Разница между кислотой и основанием
Такие вещества, которые отдают свои ионы водорода (Н +) (доноры протонов) и переносят электроны к другим, называют кислотой . Они имеют рН менее 7, 0 . Но такие вещества, которые принимают протон и жертвуют электроном, называют основой . Они имеют рН более 7, 0 . Кислоты кислые, а основания горькие.
Кислоты и основания являются одной из важнейших частей химии, но они также играют важную роль в другой области науки. Есть много определений, которые различают вещества как кислоту и основание, но наиболее приемлемыми являются теория Аррениуса, теория Бренстеда-Лоури и теория кислоты / основания Льюиса. Вместе кислоты и основания реагируют с образованием солей.
Кислоты и основы присутствуют повсюду — от мыла, используемого во время душа, до лимонной кислоты или уксуса, присутствующих на кухне. Хотя иногда бывает трудно провести различие между ними и проверить их, были предложены определенные теории, которые обсуждаются ниже вместе с кратким описанием.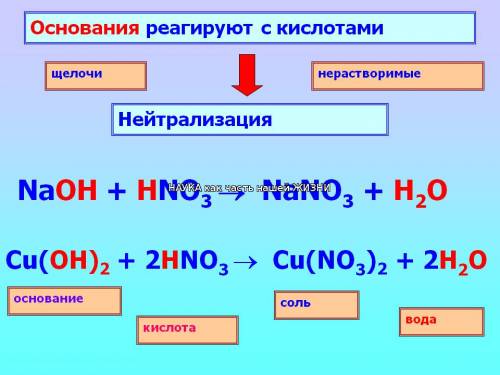
Сравнительная таблица
| Основа для сравнения | Кислоты | Основы |
|---|---|---|
| Концепция Аррениуса | Кислота является веществом, когда растворяется в воде, увеличивает концентрацию ионов H +. | Основание является веществом, когда растворяется в воде, увеличивается концентрация ионов ОН-. |
| Концепция Бренстеда-Лоури | Кислоты являются донорами протонов. | Основы являются акцептором протонов. |
| Концепция Льюиса | Такие разновидности, которые принимают пару электронов (электрофил) и будут иметь свободные орбитали, известны как кислота Льюиса. | Такие разновидности, которые жертвуют пару электронов (нуклеофил) и будут иметь неподеленную пару электронов, известны как основание Льюиса. |
| Химическая формула | Такое соединение, химическая формула которого начинается с H, например, HCl (соляная кислота), h4BO3 (борная кислота), Ch3O3 (углекислый газ).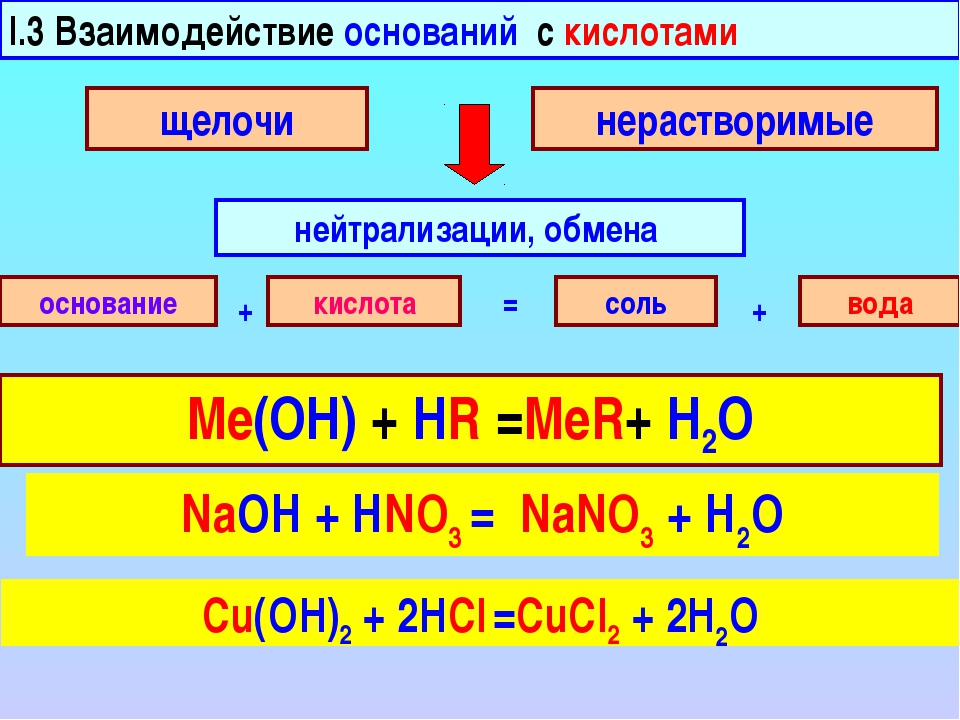 кислота). Хотя Ch4COOH (уксусная кислота) является исключением. | Такие соединения, химическая формула которых заканчивается ОН, например КОН (гидроксид калия), NaOH (гидроксид натрия). |
| Шкала рН (концентрация ионов водорода в растворе) | Менее 7 | Больше 7. |
| Физические характеристики | Кислый на вкус. | Горький на вкус. |
| Дает жжение. | Без запаха (кроме аммиака). | |
| Кислоты обычно липкие. | Основы скользкие. | |
| Реагирует с металлами с образованием газообразного водорода. | Реагирует с жирами и маслами. | |
| Индикатор фенолфталеина | Это остается бесцветным. | Это дает розовый цвет. |
| Лакмусовая бумажка | Превращает синюю лакмусовую бумагу в красную. | Превращает красную лакмусовую бумагу в синюю. |
| Сила | Зависит от концентрации ионов гидрония. | Зависит от концентрации гидроксид-ионов. |
| Диссоциация при смешивании с водой | Кислоты диссоциируют, давая свободные ионы водорода (H +) после смешивания в воде. | Основания диссоциируют, давая свободные гидроксид-ионы (ОН-) после смешивания в воде. |
| Примеры | Соляная кислота (HCl), серная кислота (h3SO4), азотная кислота (HNO3), угольная кислота (h3CO3). | Гидроксид аммония (Nh5OH), гидроксид кальция (Ca (OH) 2), гидроксид натрия (NaOH). |
| Пользы | Используются в качестве консервантов, удобрений, в качестве консервантов, используются в качестве газированных напитков, для обработки кожи, для бытовой чистки, приготовления газированных напитков, ароматизаторов для пищевых продуктов и т. Д. | Используется в медицине желудка (антацид), мыла, моющих средств, моющих средств, дезодорантов-антиперспирантов подмышками, неопасных щелочей для нейтрализации кислотных сточных вод, нейтрализации кислотности почвы. |
Определение кислоты
Слово «кислота» происходит от латинского слова «acid» или «acere», что означает «кислый». Кислота — это химические вещества, которые принимают электроны и отдают ионы водорода или протоны. Большинство кислот, содержащих атомы водорода, диссоциируют с образованием катионов и анионов в воде.
Кислота — это химические вещества, которые принимают электроны и отдают ионы водорода или протоны. Большинство кислот, содержащих атомы водорода, диссоциируют с образованием катионов и анионов в воде.
Кислотность измеряется присутствием некоторых ионов водорода, поэтому чем выше концентрация ионов водорода, тем выше кислотность и ниже pH растворов. Измеряется по шкале от 1 до 7 (7 — нейтрально) по шкале рН-метра .
Некоторые кислоты сильные, а некоторые слабые. К сильным кислотам относятся те, которые полностью диссоциируют в воде, например соляная кислота, которая полностью растворяется в ионы при растворении в воде. Такие кислоты, которые частично диссоциируют в воде и, следовательно, раствор содержит воду, кислоту и ионы, называются слабыми кислотами, например, уксусной кислотой.
В основном кислоты определяются многими способами, но приемлема кислота Аррениуса или Бренстеда-Лоури. Хотя кислоту Льюиса называют «кислотой Льюиса», эти определения не включают в себя один и тот же набор молекул.
Концепция Аррениуса — Его можно определить как вещество, которое при добавлении в воду повышает концентрацию иона водорода (Н +) и называется кислотой.
Концепция Бренстеда-Лоури. В этом случае кислота считается донором протонов. Эта теория определяет вещества, не растворяясь в воде и поэтому широко используется и принята.
Кислота Льюиса. Существуют определенные соединения, которые не содержат атома водорода, но квалифицируются как кислота, такая как трифторид бора, трихлорид алюминия. Таким образом, такое соединение, которое принимает электронную пару для образования ковалентной связи, называется кислотой Льюиса.
Свойства кислот
- Разъедает («сжигает» вашу кожу).
- Имеет pH менее 7.
- Превращает синюю лакмусовую бумагу в красный цвет.
- Реагирует с металлами с образованием газообразного водорода.
- Реагирует с основаниями для производства соли и воды.
- Реагирует с карбонатами с образованием углекислого газа, воды и соли.

- Кислый вкус.
- Диссоциируют ионы водорода (Н +) при растворении в воде.
значение
Биологически нуклеиновые кислоты, такие как ДНК (дезоксирибонуклеиновые кислоты) и РНК (рибонуклеиновые кислоты), содержат генетическую информацию, а другие являются наследственным материалом, который передается из поколения в поколение. Даже аминокислоты имеют большое значение, поскольку они помогают в создании белков. Жирные кислоты и их производные группы карбоновых кислот также играют значительную роль.
Даже соляная кислота, которая является частью желудочной кислоты, выделяемой в желудке животных, помогает в гидролизе белков и полисахаридов. Кислоты также полезны, действуя в защитном механизме, как у муравьев, которые производят муравьиную кислоту, в то время как осьминоги производят черную кислоту, называемую меланином.
Другие кислоты, такие как молочная кислота, уксус, серная кислота, лимонная кислота, встречаются в природе и известны своим различным и важным применением.
Определение базы
Основания жертвуют электроны и принимают ионы водорода или протоны. Основания могут быть названы химическим веществом, прямо противоположным химическому веществу, так как в воде роль основания заключается в уменьшении концентрации иона гидрония (H 3 O +), в то время как кислота действует на увеличение концентрации. Хотя видно, что некоторые сильные кислоты также служат основаниями. Основы измеряются в диапазоне 7-14 в шкале рН-метра.
Тем не менее, существует много путаницы между основаниями и щелочами. Многие основания не растворяются в воде, но если основание растворяется в воде, это называется щелочью . Когда в водном растворе основание реагирует с кислотой и раствор становится нейтральным, это называется реакцией нейтрализации .
Например, гидроксид натрия является основанием, а также щелочью, поскольку он нейтрализует кислоты в любой кислотно-основной реакции; во-вторых, он растворим в воде. С другой стороны, оксид меди представляет собой основание, а не щелочь, поскольку он нейтрализует кислоту в водном растворе, но не растворяется в воде.
С другой стороны, оксид меди представляет собой основание, а не щелочь, поскольку он нейтрализует кислоту в водном растворе, но не растворяется в воде.
Сильное основание — это химическое соединение, которое депротонируется или удаляет протон (Н +) из молекулы очень слабой кислоты в кислотно-щелочной реакции. Гидроксиды щелочных металлов и щелочноземельных металлов, такие как гидроксид натрия и гидроксид кальция соответственно, являются примерами сильного основания. Слабое основание — это вещество, которое не полностью ионизируется в водном растворе или его протонирование неполное.
Концепция Аррениуса — Вещество, которое вырабатывает гидроксид-ионы (ОН–) в водном растворе, называется основанием. Например, гидроксид натрия (NaOH) диссоциирует в воде и дает ионы Na + и OH–. Такие вещества, как LiOH, Ba (OH) 2, NaOH, можно назвать основанием Аррениуса. Но эта теория была ограничена веществами, которые содержат гидроксид в их формуле и была применима только в водных растворах. Благодаря этому возникла другая концепция, называемая теорией Бренстеда-Лоури.
Благодаря этому возникла другая концепция, называемая теорией Бренстеда-Лоури.
Концепция Бренстеда-Лоури. Согласно этой теории вещество, способное принимать ионы водорода (H +) или протоны, называется основанием.
База Льюиса — одна из наиболее широко принятых концепций после концепции Бренстеда-Лоури кислот и оснований. Атом, молекула или ион с неподеленной парой электронов могут быть названы основанием Льюиса, поскольку эти основания являются нуклеофильными. Это означает, что с помощью одинокой пары они атакуют положительный заряд молекулы. Nh4 является базой Льюиса. Другими словами, мы можем сказать, что вещество, подобное иону ОН–, которое может пожертвовать пару несвязывающихся электронов, называется донором основания Льюиса или донора электронной пары.
Свойства базы
- Разъедает («сжигает» вашу кожу).
- Имеет рН более 7.
- Превращает красную лакмусовую бумагу в синий цвет.
- Мыльное ощущение или скользкое прикосновение.

- Реагирует с кислотами с образованием соли и воды.
- Многие растворимые основания содержат гидроксильные ионы (ОН–).
значение
Основы (гидроксид натрия) используются в производстве бумаги, мыла и волокон, называемых вискоза. Гидроксид кальция используется в качестве отбеливающего порошка. Гидроксид магния используется в качестве «антацида», который применяется во время расстройства желудка и для уменьшения эффекта доступа к желудку. Такие основы, как карбонат натрия, используются в качестве промывочной соды и для смягчения жесткой воды. Водород натрия также используется в приготовлениях разрыхлителей, в качестве пищевой соды, а также в огнетушителе.
Амфотерные вещества — это те, которые имеют характеристики кислоты и основания; даже они способны принимать и жертвовать протон, как вода.
Основные различия между кислотой и основанием
Ниже приведены важные моменты, которые отличают кислоты от кислоты основания:
- Согласно концепции Аррениуса : кислота — это вещество, когда растворяется в воде, увеличивает концентрацию ионов H +, тогда как основа — это вещество, когда растворяется в воде, увеличивает концентрацию ионов OH–.

- С другой стороны, концепция Бронстеда-Лоури гласит, что кислоты являются донорами протонов, а основа — акцепторами протонов.
- Теория Льюиса объясняет их как такие разновидности, которые принимают пару электронов (электрофил) и будут иметь свободные орбитали, известные как кислота Льюиса, в то время как такие разновидности, которые жертвуют пару электронов (нуклеофил) и будут иметь одиночную пару электронов, являются известный как база Льюиса.
- Химическая формула кислоты начинается с Н, например, HCl (соляная кислота), h4BO3 (борная кислота), Ch3O3 (угольная кислота). Хотя
Ch4COOH (уксусная кислота) является исключением, тогда как такие соединения, химическая формула которых заканчивается на OH, например, KOH (калий)
гидроксид), NaOH (гидроксид натрия) известен как основание. Шкала рН (концентрация ионов водорода в растворе) составляет менее семи, тогда как в основании она превышает 7. - Кислоты кислые, дают ощущение жжения, обычно липкие, реагируют с металлами с образованием газообразного водорода.
 Хотя основания противоположны, поскольку они горькие, как правило, без запаха (кроме аммиака), они скользкие; основы реагируют с жирами и маслами.
Хотя основания противоположны, поскольку они горькие, как правило, без запаха (кроме аммиака), они скользкие; основы реагируют с жирами и маслами. - В фенолфталеине индикаторные кислоты остаются бесцветными, а основа дает розовый цвет . Хотя в лакмусовой бумаге тестовые кислоты превращают синюю лакмусовую бумагу в красную, а красная лакмусовая бумажка в синий.
- Сила кислот зависит от концентрации ионов гидроксония, в то время как сила зависит от концентрации ионов гидроксида.
- Кислоты диссоциируют, давая свободные ионы водорода (Н + ) при смешивании в воде, тогда как основания диссоциируют, давая свободные ионы гидроксида (ОН– ) при смешивании в воде.
- Несколько примеров кислот: соляная кислота (HCl), серная кислота (h3SO4), азотная кислота (HNO3), угольная кислота (h3CO3). Примерами оснований являются гидроксид аммония (Nh5OH), гидроксид кальция (Ca (OH) 2), гидроксид натрия (NaOH).

Вывод
Стоит иметь краткое представление о некоторых основных физических и химических принципах, которые прямо или косвенно связаны с жизнью. Кислоты и основания являются одними из них. В приведенном выше содержании мы обсудили их вместе с их свойствами. Мы обсудим три важные теории с некоторыми примерами. Мы заключаем, что это важная часть жизни, и мы часто используем их не только в химической лаборатории, но и в повседневной работе.
кислоты, оксиды, основания, соли. Типы химических реакций
Цели урока: повторить состав, названия и номенклатуру оксидов, кислот, оснований и солей; повторить типы химических реакций.
Ход урока
1. Организационный момент
2. Вещества
простые:
· Металлы
· Неметаллы
(Двухатомные молекулы: h3, N2, O2, F2, Cl2, Br2, I2 и O3).
сложные:
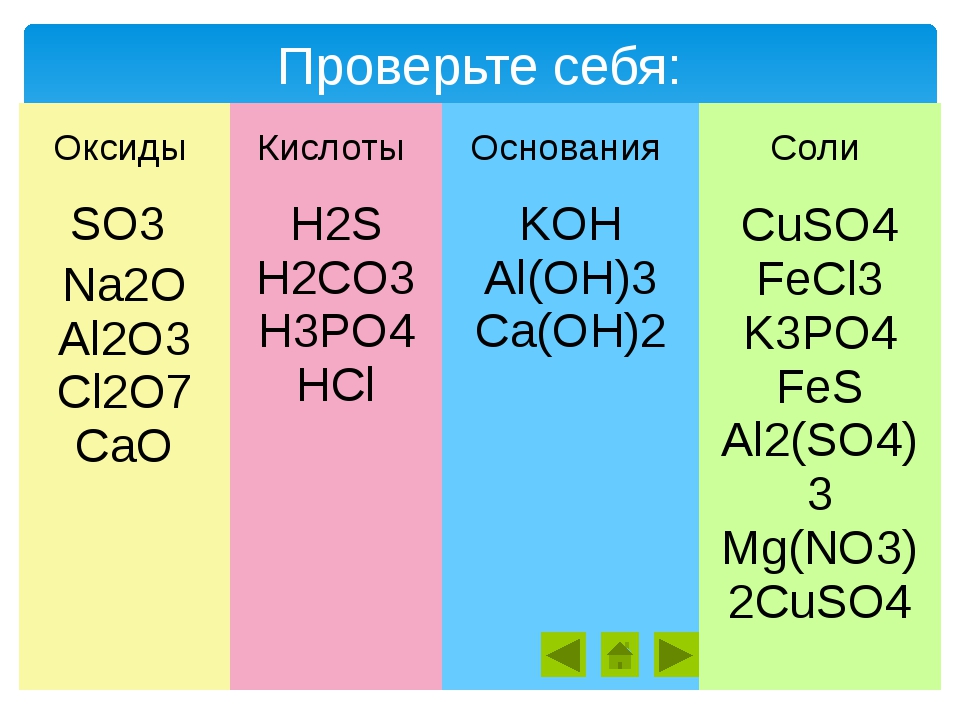
· Оксиды – ЭхОу
· Кислоты – Hn A или НхКО
· Основания – Ме(ОН)m
· Соли – Мех Ау или МХ(КО)У
3. Кислоты НхКО
Кислоты НхКО
х = 1 одноосновная
х = 2 двухосновная
х= 3 трехосновная
бескислородные |
кислородсодержащие |
HCl, HBr, HI, HF, h3S |
HNO3, h3SO4 и другие |
ПОЛУЧЕНИЕ |
|
1. Прямое взаимодействие неметаллов h3 + Cl2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO3 + h3O = h3SO4 |
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + h3SO4(конц.) = Na2SO4 + 2HCl |
|
ХИМИЧЕСКИЕ СВОЙСТВА
1. Изменяют окраску индикаторов.
Название индикатора |
Нейтральная среда |
Кислая среда |
Лакмус |
Фиолетовый |
Красный |
Фенолфталеин |
Бесцветный |
Бесцветный |
Метилоранж |
Оранжевый |
Красный |
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2. Реагируют с металлами в ряду активности до h3
Реагируют с металлами в ряду активности до h3
(искл. HNO3 – азотная кислота)
Ме + КИСЛОТА =СОЛЬ + h3↑ (р. замещения)
Zn + 2 HCl = ZnCl2 + h3
3. С основными (амфотерными) оксидами – оксидами металлов
МехОу+ КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + h3SO4 = Cu SO4 + h3O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ = СОЛЬ+ h3O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот — если образуется соль, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + h3SO4(конц.) = Na2SO4 + 2HCl (р. обмена)
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > h3SO4 > HNO3 > HMnO4 > h3SO3 > h4PO4 > HF > HNO2 > h3CO3 > h3S > h3SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
6. Разложение кислородсодержащих кислот при нагревании
(искл. h3SO4; h4PO4 )
h3SO4; h4PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения)
4. Оксиды ЭхОу
СОЛЕОБРАЗУЮЩИЕ |
БЕЗРАЗЛИЧНЫЕ (НЕСОЛЕОБРАЗУЮЩИЕ) |
||
ОСНОВНЫЕ |
АМФОТЕРНЫЕ |
КИСЛОТНЫЕ |
|
МЕТАЛЛЫ с В(или=) II |
МЕТАЛЛЫ с В II-IV |
МЕТАЛЛЫ с В (или=) IV НЕМЕТАЛЛЫ с В II |
НЕМЕТАЛЛЫ с В(или=) II |
Na2O, CaO, FeO, CrO, MnO |
BeO, ZnO, Fe2O3, Cr2O3 |
Mn2O7, CrO3, CO2, P2O5 |
CO, NO, N2O |
Оксидам соответствуют основания |
Оксидам соответствуют и кислоты и основания |
Оксидам соответствуют кислоты |
Не взаимодействуют с кислотами и основаниями |
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
2. Основной оксид + Кислота = Соль + Н2О (р. обмена)
3K2O + 2h4PO4 = 2K3PO4 + 3h3O
3. Основной оксид + Вода = Щёлочь (р. соединения)
Na2O + h3O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
1. Кислотный оксид + Вода = Кислота (р. соединения)
СO2 + h3O = h3CO3, SiO2 – не реагирует
2. Кислотный оксид + Основание = Соль + Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3h3O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
4. Менее летучие вытесняют более летучие из их солей
CaCO3 + SiO2 = CaSiO3 + CO2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2HCl = ZnCl2 + h3O
ZnO + 2NaOH + h3O = Na2Zn(OH)4 (в растворе)
ZnO + 2NaOH = Na2ZnO2 + h3O (при сплавлении)
5. Основания Ме(ОН)m
х=1 однокислотное
х=2 двухкислотное
х=3 трехкислотное
РАСТВОРИМЫЕ (ЩЁЛОЧИ) |
НЕРАСТВОРИМЫЕ |
|||||||||||||||
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ |
||||||||||||||||
ЩЁЛОЧЕЙ 1. 2. ОКСИД МеА + h3O = ЩЁЛОЧЬ (Na2O + h3O = 2 NaOH) НЕРАСТВОРИМЫХ ОСНОВАНИЙ СОЛЬ + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ* (CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4) |
||||||||||||||||
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ |
||||||||||||||||
1). Изменяют окраску индикаторов
|
||||||||||||||||
2) Взаимодействие с кислотными оксидами
— реакция обмена 2KOH + CO2 = K2CO3 + h3O 3) Взаимодействие с кислотами
— реакция обмена (нейтрализация) Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2h3O 4) С растворами солей, если в результате образуется осадок
— реакция обмена FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl |
||||||||||||||||
ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ 1) С кислотами — реакция обмена
2) Разлагаются при нагревании
— реакция разложения Cu(OH)2 = CuO + h3O или 2Fe(OH)3 = Fe2O3 +3h3O |
||||||||||||||||
АМФОТЕРНЫЕ ГИДРОКСИДЫ (нерастворимы в воде)
1. Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2h3O
Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2h3O
2. Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]
6. Соли МХ(КО)У
СРЕДНИЕ |
КИСЛЫЕ |
ОСНОВНЫЕ |
ДВОЙНЫЕ |
СМЕШАННЫЕ |
КОМПЛЕКСНЫЕ |
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl │ Cl |
Na[Al(OH)4] |
ПОЛУЧЕНИЕ
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + h3 Металл1 + соль = металл2 + соль* (металл2 стоит в ряду активности правее) Fe + CuCl2 = FeCl2 + Cu |
2. Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + h3O основный оксид + кислота = соль + вода CuO + h3SO4 = CuSO4 + h3O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
3. кислота + основание = соль + вода HCl + NaOH = NaCl + h3O |
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 + AgCl соль + щелочь = основание↓ + соль* CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 соль + кислота = кислота* + соль* 2NaCl + h3SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
ХИМИЧЕСКИЕ СВОЙСТВА
1. Взаимодействие с металлами, солями, щелочами, кислотами (см. выше)
2. Разложение при прокаливании: CaSO4 = CaO + SO3
(Исключение. Соли щелочных металлов: 2KClO3 = 2 KCl + 3O2)
7. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ.
Химические реакции по количеству исходных веществ и продуктов реакции можно разделить на группы:
Тип химической реакции |
Определение |
Пример |
Соединения А + В = АВ АВ + СД = АВСД |
Реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество. |
CaO+h3O=Ca(OH)2 PbO+SiO2=PbSiO3 2Na+Cl2=2NaCl |
Разложения АВСД = АВ + СД Реакция разложения малахита при нагревании |
Реакции, при которых из одного вещества образуется несколько простых или сложных веществ. |
Cu(OH)2=CuO+h3O CaCO3=CaO+CO2 Nh5Cl=Nh4+HCl (CuOH)2CO3 = 2CuO+CO2+h3O (разложение малахита) |
Замещения АВ + С = СВ + А АВ + С = АС + В |
Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного |
CuSO4+Fe=FeSO4+Cu 2KBr+Cl2=2KCl+Br2 |
Обмена АВ + СД = АД + СВ |
Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями |
AgNO3+KBr=AgBr+KNO3 NaOH+HCl=NaCl+h3O |
8. Домашнее задание
Домашнее задание
Ответьте на вопросы и решите задания
№ 1. Из перечня формул выберите те, которые относятся к классу солей:
А) KCl
Б) SiO2
В) HNO3
Г) Na2SO4
Д) Fe(OH)2
Е) HCl
№ 2. Установите соответствие между схемой реакции и её типом
1. 2HgO = 2Hg + O2 |
а) соединение |
2. 2Fe + 3Cl2 = 2FeCl3 |
б) разложение |
3. 2NaOH + h3SO4 = Na2SO4 + 2h3O |
в) замещение |
4. Al2O3 + 3Mg = 3MgO + 2Al |
г) обмен |
№ 3. Осуществите превращения по схеме, укажите типы реакций, назовите вещества
P→P2O5→h4PO4→Na3PO4→Ca3(PO4)2
Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
Al→Al2O3→AlCl3→Al(OH)3→Al2O3
№ 4. Классифицируйтевеществапоклассам
CaO, NaOH, CO2, h3SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, N2O, FeO, SO3, Na2SO4, ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3, Na2O, Ba(OH)2, SiO2, HCl, Al(OH)3, NO, MnO,Cr2O3, CrO3
Оксид основной |
Оксид ксилотный |
Оксид амфотерный |
Оксид безразлич |
Соль |
Кислота |
Щёлочь |
Основание нерастворим |
Acids and Bases: Arrhenius and Bronsted-Lowry Concepts | Chemistry
15.
 1: Кислоты и основания Бренстеда-Лоури
1: Кислоты и основания Бренстеда-ЛоуриКласс реакции кислотно-основная был изучен в течение довольно длительного времени. В 1680 году Роберт Бойл сообщил о чертах кислотных растворов, которые включали в себя их способность растворять много веществ, менять цвета некоторых природных красителей, и терять эти черты после попадания в контакт с растворами щелочей (основание). В восемнадцатом веке было признано, что кислоты имеют кислый вкус, реагируют с известняком, чтобы освободить газообразное вещество (сейчас известно, что CO2), и взаимодействуют с щелочами, образуя нейтральные вещества. В 1815 году Хамфри Дэви внес значительный вклад в развитие современной концепции кислотно-основная, продемонстрировав, что водород является основной составляющей кислот. Примерно в то же время Джозеф Луи Гэй-Лузсак пришел к выводу, что кислоты являются веществами, которые могут нейтрализовать основы и что эти два класса веществ могут быть определены только по понятию друг друга. Значение водорода было вновь подчеркнуто в 1884 году, когда Свант Аррениус определил кислоту как соединение, растворяющееся в воде для получения катионов водорода (в настоящее время признано ионами гидрония), и основание как соединение, растворяющееся в воде для получения анионов гидроксида.
Значение водорода было вновь подчеркнуто в 1884 году, когда Свант Аррениус определил кислоту как соединение, растворяющееся в воде для получения катионов водорода (в настоящее время признано ионами гидрония), и основание как соединение, растворяющееся в воде для получения анионов гидроксида.
Бёрнстед-Лоури кислоты и основания
Йоханнес Брёнстед и Томас Лоури предложили более общее описание в 1923 году, в котором кислоты и основания были определены с точки зрения переноса ионов водорода, H+. (Обратите внимание, что эти ионы водорода часто называют просто протонами, поскольку субатомная частица является единственным компонентом катионов, полученных из наиболее обильного изотопа водорода, 1H.) Соединение, которое передает протон другому соединению, называется кислотой Брёнстед-Лоури, а соединение, принимающая протон, называется основание Брёнстед-Лоури. Таким образом, реакция кислотно-основная является передачей протона от донора (кислоты) к акцептору (основание).
Понятие сопряженных пар полезно при описании реакций Брёнстед-Лоури кислотно-основная (и других реакций обратимая, также). Когда кислота жертвует H+, вид, который остается, называется конъюгатом основание кислоты, потому что он реагирует как акцептор протонов в обратной реакции. Аналогично, когда основание принимает H+, он превращается в свою конъюгатную кислоту. Реакция между водой и аммиаком иллюстрирует эту идею, как показано ниже.
В прямом направлении вода выступает в качестве кислоты, передавая протон аммиаку и впоследствии становясь ионом гидроксида, OH—, конъюгированным основание воды. Аммиак действует как основание при принятии этого протона, превращаясь в ион аммония, NH4+, конъюгатную кислоту аммиака. В обратном направлении гидроксид-ион действует как основание при принятии протона из иона аммония, которая действует как кислота.
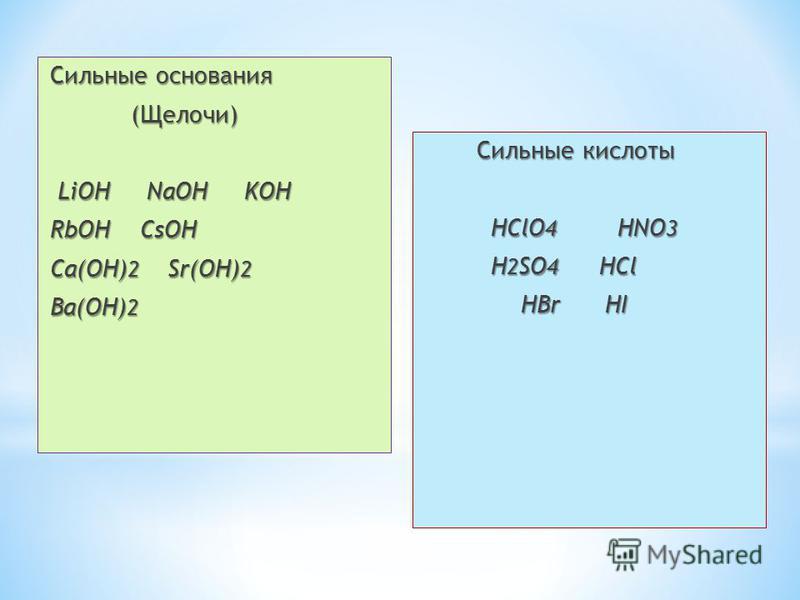
Сильные кислоты и основания полностью диссоциируют в раствор. Их конъюгатные кислоты и основания крайне слабы и не могут жертвовать или принимать протоны соответственно для осуществления обратной реакции; поэтому реакции, связанные с сильными кислотами и основами, по существу идут к завершению, когда в водном раствор. С другой стороны, слабые кислоты и основания частично диссоциируются в растворах и производят слабые конъюгатные основания и кислоты соответственно. Эти слабые конъюгатные кислоты или основания могут осуществлять обратную реакцию, и таким образом реакции слабой кислоты и основание достигают равновесия в зависимости от относительной силы слабых кислот и оснований. Подводя итог, более сильная кислота приведет к столь же слабой конъюгате основание, в то время как более сильная основание будет производить не менее слабую конъюгатную кислоту и наоборот. В таблице 1 показано соотношение между различными сопряжёнными парами кислотно-основная.
Их конъюгатные кислоты и основания крайне слабы и не могут жертвовать или принимать протоны соответственно для осуществления обратной реакции; поэтому реакции, связанные с сильными кислотами и основами, по существу идут к завершению, когда в водном раствор. С другой стороны, слабые кислоты и основания частично диссоциируются в растворах и производят слабые конъюгатные основания и кислоты соответственно. Эти слабые конъюгатные кислоты или основания могут осуществлять обратную реакцию, и таким образом реакции слабой кислоты и основание достигают равновесия в зависимости от относительной силы слабых кислот и оснований. Подводя итог, более сильная кислота приведет к столь же слабой конъюгате основание, в то время как более сильная основание будет производить не менее слабую конъюгатную кислоту и наоборот. В таблице 1 показано соотношение между различными сопряжёнными парами кислотно-основная.
| Сильная кислота | Очень слабая конъюгатная основание |
| HCl | Cl− |
| HNО3 | NО3− |
| Слабая кислота | Слабая конъюгатная основание |
| HF | F— |
| NH4+ | Nh4 |
| Очень слабая кислота | Сильный конъюгатный основание |
| OH- | O2— |
| Ch5 | CH3— |
Таблица 1: Относительная прочность нескольких сопряженных пар кислотно-основная.
Этот текст адаптирован к Openstax, Химия 2е изд., раздел 14.4 Брёнстед-Лоури кислота и основания.
Литература для дополнительного чтения
- Story, David A. «Bench-to-bedside review: A brief history of clinical acid–base.» Critical Care 8, no. 4 (2004): 253.
Обучение детей кислотам и основаниям
Вы когда-нибудь пытались научить детей основам кислот и оснований, но встречали только стоны и другие скучные реакции? Мы понимаем, что это не весело. Может быть, вы в восторге от этой концепции и хотите сделать ее интересной для детей, но изо всех сил пытаетесь найти способ оживить такую потенциально сухую тему.
Ключ к успеху в том, чтобы показать своим ученикам, насколько на самом деле эта тема далека от сухой.Причина, по которой они могут быть незаинтересованы, заключается в том, что они могут думать об этом как о непонятном химическом понятии, которое не оказывает на них никакого влияния.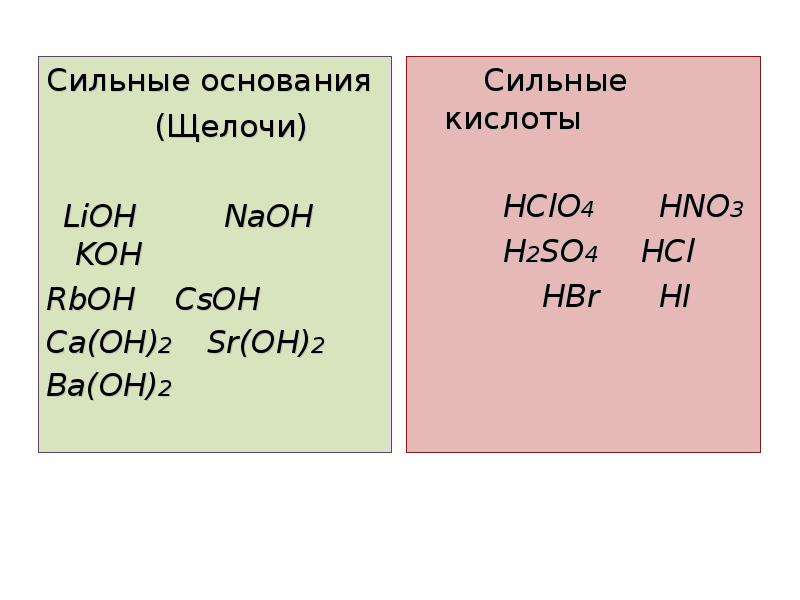 Но что, если бы вы могли доказать, что противоположное то же самое? Показывая своим детям все способы, которыми эта концепция активна в их повседневной жизни, вы можете помочь пробудить интерес, исследование и волнение.
Но что, если бы вы могли доказать, что противоположное то же самое? Показывая своим детям все способы, которыми эта концепция активна в их повседневной жизни, вы можете помочь пробудить интерес, исследование и волнение.
Чтобы помочь вам в этом, мы собрали несколько простых советов и идей по обучению детей кислотам и основаниям. Мы рассмотрим основные концепции простым языком, подходящим для детей, а также рассмотрим несколько забавных экспериментов, которые вы можете провести, чтобы поиграть с этими идеями.
Что такое кислоты?
Возможно, вы уже слышали термин «кислота» и, вероятно, слышали о чем-то, что называется кислотой. И хотя у вас может быть общее представление о том, что означают эти термины, полезно понять, что эти термины означают на научном уровне.
Подумайте о таких напитках, как лимонад или апельсиновый сок. Подумайте о восхитительном остром вкусе, который вы получаете, потягивая любой из этих напитков. Этот резкий запах является прямым результатом кислой природы этих напитков. Причина того, что эти напитки и многие другие вещества имеют естественную кислотность, заключается в том, что они содержат много ионов водорода. Ион — это особый тип атома или молекулы, обладающий электрическим зарядом. Таким образом, ион водорода — это ион с крошечным электрическим зарядом.
Причина того, что эти напитки и многие другие вещества имеют естественную кислотность, заключается в том, что они содержат много ионов водорода. Ион — это особый тип атома или молекулы, обладающий электрическим зарядом. Таким образом, ион водорода — это ион с крошечным электрическим зарядом.
Каждое вещество во Вселенной состоит из сотен и тысяч мельчайших атомов, молекул и ионов. Когда большое количество из них представляют собой ионы водорода, вещество является кислым. В еде это означает, что он будет иметь кислый или острый вкус.Однако многие вещи, кроме еды, также могут быть кислыми.
Что такое базы? Base — это термин, который мы редко используем в повседневной жизни, по крайней мере, в этом контексте, и это означает, что это может быть немного менее знакомое понятие. Одним из повседневных примеров основного вещества является пищевая сода, обычно используемая для выпечки тортов, печенья и других сладостей. Если вы попробуете его на вкус, то увидите, что он очень горький. Если вы потрете его между пальцами, вы обнаружите странное мыльное ощущение.Это все потому, что пищевая сода имеет базовую природу.
Если вы потрете его между пальцами, вы обнаружите странное мыльное ощущение.Это все потому, что пищевая сода имеет базовую природу.
Основные вещества содержат много гидроксид-ионов. Это другой тип молекулы с небольшим электрическим зарядом. В продуктах это означает, что они будут более горькими на вкус. Однако многие вещи, помимо еды, могут быть основными.
Что такое шкала рН?Шкала pH — это еще одна концепция, о которой вы, возможно, слышали, не имея особого представления о том, что это такое и как она работает. Но хотя название может показаться пугающим, на самом деле идея довольно проста.
Думайте о шкале pH как о линейке, которую мы можем использовать для измерения кислотности или щелочности чего-либо. На шкале есть 14 различных возможных значений баллов, и каждое из них представляет собой возможный уровень кислотности или щелочности. Вещество является кислым, если его уровень pH находится в диапазоне от 0 до 7, где 0 — самая кислая среда.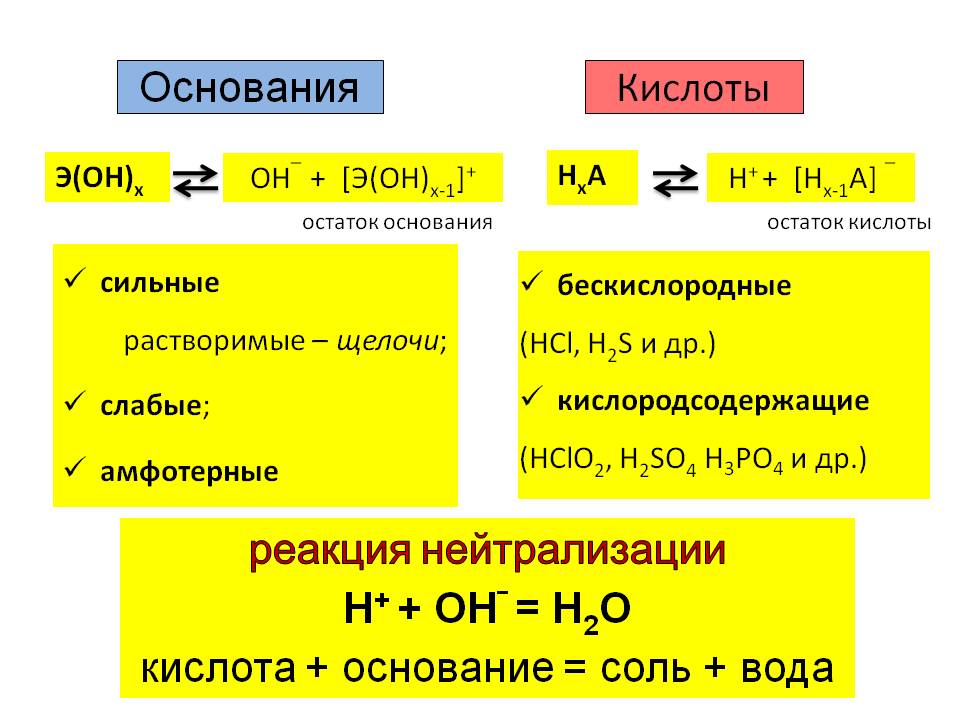 Вещество является основным, если оно имеет уровень pH от 7 до 14, где 14 является самым основным. Если вещество имеет pH ровно 7, оно нейтрально. Это означает, что он имеет равное количество ионов водорода и гидроксида.Чистая вода является нейтральным веществом.
Вещество является основным, если оно имеет уровень pH от 7 до 14, где 14 является самым основным. Если вещество имеет pH ровно 7, оно нейтрально. Это означает, что он имеет равное количество ионов водорода и гидроксида.Чистая вода является нейтральным веществом.
Если предмет имеет 3 балла по шкале pH, то мы можем видеть, что это вещество будет довольно кислым, хотя и не таким кислым, как другие вещества. Что-то, что измеряет 8, было бы немного простым.
Что такое индикатор?Ранее мы упоминали, что некоторые продукты являются более щелочными или кислыми, и вы можете сказать это, попробовав их. Лимонад, например, явно кислый и острый, помогая нам понять, что он должен быть кислым.Пищевая сода, с другой стороны, горькая, и мы можем легко понять, что она более основная.
А как насчет того, что не является едой? В конце концов, множество различных веществ в природе имеют либо кислотную, либо основную природу. По логике вещей, мы не можем попробовать все эти разные вещества, чтобы определить, какое место они занимают на шкале рН. Итак, как мы их протестируем?
Итак, как мы их протестируем?
Мы используем индикатор для сравнения кислот и оснований. Индикатор — это особый тип вещества, который говорит нам, является ли рассматриваемый элемент более кислым или щелочным.Хотите верьте, хотите нет, но есть несколько естественных индикаторов, которые мы можем использовать для определения рН вещества. Лакмус и куркума — прекрасные примеры природных индикаторов.
Из всех этих естественных индикаторов мы чаще всего используем лакмус. Это тип материала, получаемого из лишайников — растений, растущих вдоль стен, деревьев или скал. Лакмус имеет естественный фиолетовый цвет, но он может менять свой цвет. При контакте с кислым веществом краснеет.Когда основной раствор коснется его, он станет синим. Благодаря этому уникальному свойству лакмус является удобным индикатором. Когда мы используем его сегодня, мы чаще всего используем его в виде небольших листов, известных как лакмусовые бумажки.
Где в природе встречаются кислоты и основания? Хотя кислоты и основания могут звучать как малопонятные химические термины, с которыми мы никогда не встретимся, кроме как в лаборатории, это не так. Кислоты и щелочи окружают нас повсюду в повседневной жизни. Многие растения имеют листья, стебли, корни и цветы, которые либо кислые, либо щелочные.Многие фрукты являются кислыми или щелочными, и даже обычные продукты, такие как газированные напитки и молоко, находятся где-то на шкале pH.
Кислоты и щелочи окружают нас повсюду в повседневной жизни. Многие растения имеют листья, стебли, корни и цветы, которые либо кислые, либо щелочные.Многие фрукты являются кислыми или щелочными, и даже обычные продукты, такие как газированные напитки и молоко, находятся где-то на шкале pH.
Даже внутри нашего тела есть много кислых и щелочных веществ. В нашем желудке есть кислоты, которые помогают пищеварению, а наши мышцы производят кислоту, когда мы тренируемся. Наша поджелудочная железа является основной и также помогает в процессе пищеварения. Все эти различные кислоты и основания работают вместе в нашем организме, чтобы все работало гладко.
Кислоты и щелочи Эксперименты для детей Поскольку кислоты и щелочи встречаются повсюду в природе, а также во многих искусственных условиях, какие есть забавные и интересные способы поиграть с этими идеями? Как оказалось, их предостаточно.Проведите несколько таких экспериментов, чтобы заинтересовать всех идеями кислот и оснований.
Краснокочанная капуста является отличным естественным индикатором и идеально подходит для экспериментов в классе. Чтобы начать этот тест, нарежьте немного краснокочанной капусты, положите ее в кастрюлю с небольшим количеством воды и дайте ей вариться в течение 30 минут или около того. Процедите жидкость, отложите в сторону, и тогда вы готовы начать.
Возьмите пару маленьких прямоугольников из белой бумаги.Каталожные карточки — отличный выбор, но вы также можете вырезать обычные кусочки бумаги. Замочите их в краснокочанной воде и дайте им высохнуть.
Возьмите белую бумажную тарелку или плотный лист белой бумаги и капните на эту поверхность несколько капель капустной воды. Возьмите кислоту, такую как лимонный сок, и основание, такое как пищевая сода, и добавьте небольшое количество в разные части образцов капустной воды. В результате вода изменит цвет и в процессе будет выглядеть как по волшебству. С подробным объяснением оснований и кислот за поясом детям понравится наблюдать за изменением цвета в зависимости от различных жидкостей.
С подробным объяснением оснований и кислот за поясом детям понравится наблюдать за изменением цвета в зависимости от различных жидкостей.
Еще один способ использования капустной воды — налить ее на несколько дюймов в два отдельных стакана. Добавьте воду и в эти стаканы, пока они не будут заполнены примерно на две трети. Наконец, добавьте основу в один стакан и кислоту в другой и наблюдайте, как весь стакан жидкости меняет цвет.
Когда самодельные лакмусовые бумажки высохнут, нарежьте их на более мелкие полоски.Теперь дети могут выполнять свои собственные лакмусовые бумажки со всевозможными материалами и веществами. Доставайте разные предметы из холодильника и давайте детям тестировать их на бумаге. Некоторые хорошие вещи, которые можно попробовать, включают рассол, яблочный сок и содовую. Прежде чем окунать бумажки в вещества, попросите детей угадать, будет ли предмет кислотным или щелочным, и устройте из этого игру. Покажите им, как записывать свои прогнозы, а также то, были ли они правильными.
Конечно, если краснокочанная капуста недоступна или вы не хотите создавать свои собственные лакмусовые бумажки, вы можете просто купить готовые лакмусовые бумажки в разных магазинах.Эти готовые бумаги будут работать точно так же и могут использоваться для выполнения тех же тестов.
2. Эксперимент с медной монетойУ вас завалялись потускневшие медные монеты? Если это так, они могут провести отличный эксперимент.
Чтобы это сработало, вам нужно взять несколько разных чашек и налить в каждую из них небольшое количество жидкого раствора. Попробуйте несколько различных растворов, которые, как вы знаете, являются кислыми, и несколько других, которые, как вы знаете, являются щелочными.Затем все, что вам нужно сделать, это бросить медные монеты в раствор. Вы можете положить их ровно на дно чашки, хотя результаты будут более поразительными, если вы сможете поставить монету дыбом так, чтобы только половина пропиталась жидкостью.
Кислоты растворяют тусклый налет на медных монетах, восстанавливая их первоначальный блеск.
3. Эксперимент с сырым яйцомЕще один отличный эксперимент, который стоит попробовать, связан с сырым яйцом. Хотя это весело делать и интересно смотреть, детям также может понравиться делать прогнозы с этим и пытаться угадать, что произойдет.
В этом эксперименте все должно быть просто. Возьмите сырое яйцо и погрузите его в ванну с уксусом. Спросите детей, что, по их мнению, произойдет. Как вы могли догадаться, очень кислый уксус разрушает скорлупу и превращает ее в яйцо, сваренное всмятку. Он даже подпрыгнет, если вы осторожно уроните его.
4. Лодка с реактивным двигателем Этот эксперимент лучше всего работает в ванне, большой раковине или даже в надувном бассейне на заднем дворе. Для начала возьмите обычную пластиковую бутылку из-под воды и просверлите отверстие прямо в крышке.Проденьте тонкую соломинку через это отверстие и используйте немного пластилина, чтобы удерживать соломинку на месте и затыкать щели вокруг нее. Когда вы в конце концов погрузите бутылку в бассейн, эта глина также поможет утяжелить конец бутылки и удержать ее под водой.
Когда вы в конце концов погрузите бутылку в бассейн, эта глина также поможет утяжелить конец бутылки и удержать ее под водой.
Наполните бутылку с водой раствором из половины воды и половины уксуса. Будьте осторожны, чтобы не заполнить бутылку полностью, а вместо этого оставьте пустое пространство возле верха. Когда ваша ванна или бассейн наполнятся, запустите эксперимент, добавив в бутылку около половины чайной ложки пищевой соды.Немедленно закройте бутылку крышкой и прикройте кончик соломинки пальцем, прежде чем поместить бутылку в бассейн и отпустить.
Кислота уксуса и основа пищевой соды будут бурно реагировать друг с другом, шипя и создавая «реактивное топливо», которое выстрелит из соломинки и понесет лодку по бассейну.
Заинтересуйте детей наукой Понравилось ли вашим детям узнавать об этих увлекательных идеях? Загорелись ли их глаза, когда они увидели, как эти концепции воплощаются в жизнь перед ними в форме захватывающих экспериментов? Если это так, важно развивать и поощрять эти интересы.
Если какое-либо из ваших научных приключений пробудило интерес ребенка к науке, подумайте о том, чтобы записать его в летний научный лагерь или кружок после школы. И то, и другое — отличный способ позволить детям продолжать изучать эти интересы и изучать новые и захватывающие концепции в компании своих сверстников.
Если вы живете в Пенсильвании, Нью-Джерси, Делавэре или Мэриленде, наши лагеря научных исследователей — это недельные летние мероприятия, которые проводятся в школах, музеях, библиотеках и других образовательных учреждениях рядом с вами.Однако, если лето уже закончилось, не о чем беспокоиться. Мы также предлагаем внеклассные программы для детей с первого по пятый класс, хотя это может варьироваться от школы к школе.
Посетите наши информационные страницы, чтобы узнать больше о наших летних программах и кружках после школы. Если у вас есть какие-либо вопросы, не стесняйтесь обращаться к нам. Мы поможем вам найти программу, которая лучше всего подойдет вашему юному исследователю науки!
Разница между щелочью и основанием
Введение
Представления о кислотах и основаниях сложились столетия назад. Первоначально они были классифицированы на основе их вкуса, то есть кислоты имеют кислый вкус, и поэтому их имя (латинское слово acidus означает кислый), тогда как основания имеют горький вкус. Научную классификацию кислот и оснований впервые дал Аррениус. Однако со временем определение изменилось, чтобы обобщить и включить все кислоты и основания в одно определение соответственно. Щелочи являются только основаниями, но могут растворяться в воде. В этой статье мы сосредоточимся на основаниях и щелочах.
Первоначально они были классифицированы на основе их вкуса, то есть кислоты имеют кислый вкус, и поэтому их имя (латинское слово acidus означает кислый), тогда как основания имеют горький вкус. Научную классификацию кислот и оснований впервые дал Аррениус. Однако со временем определение изменилось, чтобы обобщить и включить все кислоты и основания в одно определение соответственно. Щелочи являются только основаниями, но могут растворяться в воде. В этой статье мы сосредоточимся на основаниях и щелочах.
Что такое база?
Существует 3 разных определения базы, и каждое из них определяет базу по-своему. Эти 3 определения основания следующие:
Концепция Аррениуса: Любое соединение, которое содержит ионы ОН- в своем водном растворе, называется основанием. Это определение охватывает все гидроксиды щелочных и щелочноземельных металлов, такие как NaOH, Ca(OH)2 и т. д. Это простейшее определение основания.
 В общем случае основания — это соединения, которые реагируют с кислотами с образованием соли.Это определение охватывает некоторые из основ, но упускает из виду многие. Так вот, разные ученые давали и другие определения оснований.
В общем случае основания — это соединения, которые реагируют с кислотами с образованием соли.Это определение охватывает некоторые из основ, но упускает из виду многие. Так вот, разные ученые давали и другие определения оснований.Bronsted Lowry Концепция: Любое соединение, которое способно принимать протон, т. е. ион H+, называется основанием. Согласно этому определению, даже h3O может выступать в качестве основания, поскольку он может приобретать протон с образованием иона гидроксония, т. е. иона h4O+. Это определение охватывает большинство оснований, но все же оставляет несколько оснований, потому что не все основания извлекают H+. AlCl3 действует как кислота Льюиса, но не содержит H+.Таким образом, основания, которые реагируют с такими кислотами, не могут быть объяснены этим определением. Так, другое определение базы дал Льюис.
Концепция Льюиса: любое соединение, которое может отдавать неподеленную пару или может отдавать пару электронов, называется основанием.
 Например: Nh4 является базой Льюиса. У него есть одинокая пара, которую он может подарить. Основание Льюиса обычно извлекает протоны и становится стабильным, например, Nh4, которое приобретает протон с образованием Nh5+.
Например: Nh4 является базой Льюиса. У него есть одинокая пара, которую он может подарить. Основание Льюиса обычно извлекает протоны и становится стабильным, например, Nh4, которое приобретает протон с образованием Nh5+.
Таким образом, в соответствии с этим определением любое соединение, ион или элемент, которые могут передать пару электронов другим видам, могут выступать в качестве основания.Это может быть CuO, ZnO. Это более общее определение. NaOH и KOH дают OH-, который может отдавать пару электронов. Таким образом, концепция Льюиса охватывает большинство аспектов базы.
Все эти определения оснований полезны в зависимости от ситуации. Любое соединение, соответствующее любому из 3 определений, может действовать как основание; Итак, эти 3 определения включают в себя все необходимые критерии для определения базы.
Основания реагируют с кислотами с образованием соли и/или воды. Пример NaOH реагирует с HCl с образованием NaCl и воды. Nh4 реагирует с HCl с образованием Nh5Cl.
Nh4 реагирует с HCl с образованием Nh5Cl.
Базы Бренстеда-Лоури и базы Льюиса не обеспечивают непосредственно ОН-; вместо этого при растворении в воде (протонный растворитель) они поглощают H+ из воды, тем самым косвенно высвобождая или давая OH-.
Что такое щелочь?
Щелочи являются водорастворимыми основаниями. Другими словами, основания, которые могут растворяться в воде с образованием ионов ОН-, называются щелочами.
Щелочи подобны подмножеству оснований. Таким образом, мы можем сказать, что «Все щелочи являются основаниями, но не все основания являются щелочами».Термин щелочь в основном используется для обозначения гидроксидов щелочных или щелочноземельных металлов, поскольку они легко растворяются в воде с образованием ионов ОН-.
Щелочи окрашивают красную лакмусовую бумагу в синий цвет и имеют горький вкус. И pH раствора щелочи больше 7.
Некоторые примеры щелочей:
NaOH, KOH, Be (OH)2, Ca (OH)2
Гидроксид натрия (NaOH) – едкий натр
Калий гидроксид (KOH) – едкий кали
Гидроксид кальция, {Ca (OH)2 } – известковая вода
Разница между щелочами и основаниями
Обычно люди используют эти два термина как синонимы, но между ними есть основное различие .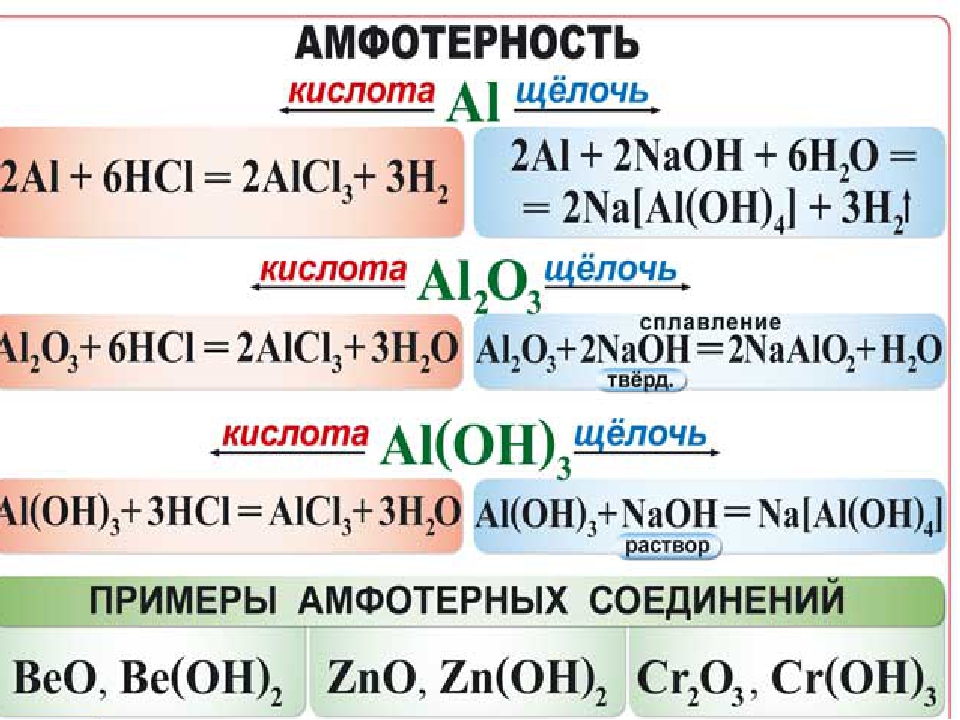 Щелочи – это гидроксиды щелочных и щелочноземельных металлов. Они не включают Nh4. Таким образом, согласно этому определению, Nh4 не является щелочью, хотя и является основанием. Точно так же есть другое определение, которое звучит так: основания, которые растворяются в воде с образованием ОН-, являются щелочами. Это определение также исключает Nh4.
Щелочи – это гидроксиды щелочных и щелочноземельных металлов. Они не включают Nh4. Таким образом, согласно этому определению, Nh4 не является щелочью, хотя и является основанием. Точно так же есть другое определение, которое звучит так: основания, которые растворяются в воде с образованием ОН-, являются щелочами. Это определение также исключает Nh4.
Таким образом, разница заключается в том, что щелочь является подмножеством оснований. Вот почему мы можем сказать, что все щелочи являются основаниями, но не все основания являются щелочами.
Основание и щелочь
На приведенном выше рисунке указано то же самое.CuO и ZnO оба являются основаниями, но не щелочью, поскольку они сами по себе не дают OH- в воде, в отличие от NaOH, KOH, которые дают OH- при растворении в воде.
Во многих органических реакциях используются особенно щелочи, поскольку ОН-, образованный щелочью, также действует как сильный нуклеофил. Таким образом, щелочи предпочтительнее, когда нам нужны нуклеофил и основание одновременно. Однако для некоторых реакций требуются специальные основания, которые не действуют как нуклеофилы, и в таких случаях используются основания Льюиса, такие как Nh4.
Таким образом, щелочи предпочтительнее, когда нам нужны нуклеофил и основание одновременно. Однако для некоторых реакций требуются специальные основания, которые не действуют как нуклеофилы, и в таких случаях используются основания Льюиса, такие как Nh4.
Правильное различие между щелочью и основанием наблюдается в органических реакциях, потому что большинство реакций проводится в среде растворителя, и в зависимости от необходимости реакции мы используем основание или щелочь.
Одно важное различие между основанием и щелочью заключается в том, что щелочи в основном представляют собой ионные соединения, которые могут диссоциировать при растворении в полярном протонном растворителе, но основания могут быть ионными соединениями, а могут и не быть. CuO, ZnO, Nh4 — все они являются ковалентными соединениями и действуют как основание.NaOH и KOH являются важными щелочами и имеют ионную природу.
Баз | Ингредиенты для выпечки | BAKERpedia
Происхождение
В природе много оснований. Они также могут быть получены путем химического синтеза. Залежи бикарбоната натрия (пищевая сода, NaHCO 3 ) естественным образом встречаются в бассейнах озера Сирлс в Калифорнии и Грин-Ривер в Колорадо, а также в Турции, Мексике и Африке, где они добываются с использованием методов добычи угля. Синтетически гидрокарбонат натрия можно получить различными способами.Самый известный из них включает двухстадийную реакцию гидроксида натрия с углекислым газом:
Они также могут быть получены путем химического синтеза. Залежи бикарбоната натрия (пищевая сода, NaHCO 3 ) естественным образом встречаются в бассейнах озера Сирлс в Калифорнии и Грин-Ривер в Колорадо, а также в Турции, Мексике и Африке, где они добываются с использованием методов добычи угля. Синтетически гидрокарбонат натрия можно получить различными способами.Самый известный из них включает двухстадийную реакцию гидроксида натрия с углекислым газом:
NaOH + CO 2 → Na 2 CO 3 + H 2 O
Na 2 CO 3 + CO 2 + H 2 O → 2 NaHCO 3
Гидроксид натрия (щелок, NaOH) может быть получен в основном путем растворения оксида натрия (Na 2 O) в воде.
Na 2 O (твердый) + H 2 O (жидкий) → 2 NaOH (водный)
Другим методом получения NaOH является электролиз хлорида натрия.
Функция
Слабое основание, такое как бикарбонат натрия, диссоциирует в воде с выделением нескольких гидроксильных ионов (-ОН), в то время как сильное основание и щелочь, например NaOH, выделяют почти все ионы -ОН. Это отражено в рН 9,5 для бикарбоната натрия по сравнению с 14,0 для гидроксида натрия.
Основыявляются жизненно важными компонентами систем химического разрыхления в хлебопечении. Их нейтрализующее значение, NV, указывает количество (г) основания, необходимое для нейтрализации 100 г разрыхлительных кислот, таких как MCP, SAPP, SALP и т. д., для получения достаточного количества диоксида углерода для надлежащего разрыхления. 1
Точно так же бикарбонат натрия реагирует с пахтой, сметаной, винной и другими кислотами с образованием углекислого газа. Роль оснований (в частности, щелочей) в реакции Майяра также была продемонстрирована при получении неферментативных продуктов подрумянивания, которые придают хлебу и другим термически обработанным продуктам уникальный цвет и вкус корочки. 2,3
2,3
Заявка
Основышироко используются в пищевой и хлебопекарной промышленности (хлеб, торты, хлебцы быстрого приготовления, кексы, пирожные, печенье и другая хлебобулочная продукция на дрожжах).Другие области применения включают никстамализацию кукурузы, нейтрализацию какао-порошка для улучшения его цвета и вкуса (голландский процесс), консервирование оливок и скандинавского лютефиска, а также китайские «вековые яйца» среди других применений.
Широкий выбор оснований, включая щелочи, доступен для пищевой промышленности и производства напитков. В выпечке чаще всего используются бикарбонат натрия, бикарбонат калия и бикарбонат аммония.
В следующей таблице приведен список оснований, используемых в пищевой промышленности, с указанием их pH и функций:
| Основание | рН | Функция |
| Бикарбонат натрия | 8.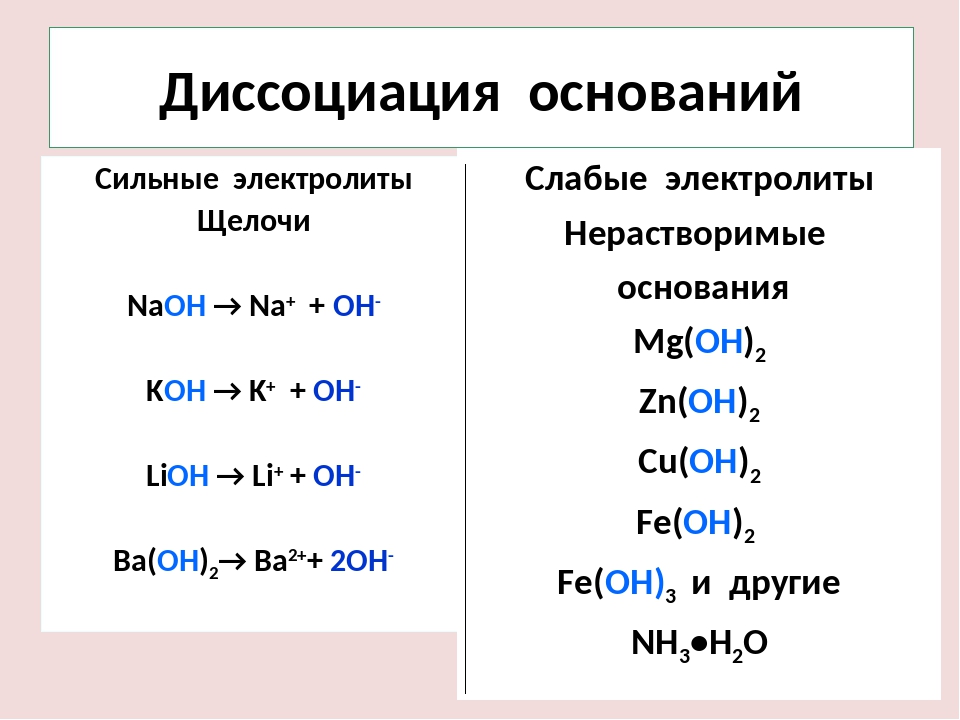 4 4 | Разрыхлитель для выпечки, контроль pH |
| Бикарбонат аммония | 7,8 | В плоской выпечке (печенье, крекеры) |
| Бикарбонат калия | 11,5 | Разрыхлитель при выпечке |
| Гидроксид натрия | 14,0 | Вяление оливок, никстамализация |
| Аммиак | 11,1 | Источник азота для ферментации, регулировка pH |
| Гидроксид кальция | 12.4 | Модификатор рН, рассол, осветлитель (сок сахарного тростника) |
| Карбонат кальция (насыщенный) | 9,4 | Кондиционер для теста, подкормка для дрожжей |
| Тринатрийфосфат | 12,0 | Регулятор кислотности в морсе, сыре, мясе и т. д. |
| Бензоат натрия | 8,0 | Консервант в газированных напитках, заправках для салатов и т.д. |
Регламент FDA
В соответствии с 21 CFR 184 «Прямые пищевые вещества, признанные в целом безопасными — GRAS», основания в их обычной кристаллической или порошкообразной форме, такие как бикарбонат аммония, бикарбонат натрия и калия, могут использоваться в качестве непосредственных пищевых ингредиентов для человека в качестве разрыхлителя. и агенты, регулирующие pH, без каких-либо ограничений, кроме действующих правил надлежащей производственной практики (GMP). 4
и агенты, регулирующие pH, без каких-либо ограничений, кроме действующих правил надлежащей производственной практики (GMP). 4
Ссылки
- Миллер, Р. Энциклопедия продуктов питания и здоровья «Разрыхлители», Elsevier Ltd., 2016, стр. 523–528.
- Веттер, Дж. Л. Энциклопедия пищевых наук и питания «Разрыхлители», Academic Press, Elsevier Ltd., 2016, стр. 3485–3490.
- Делкур, Дж.А., и Хосени, Р.К. Принципы науки и технологии зерновых «Химически заквашенные продукты», AACC International, Inc., 2010, стр. 177–181.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.«21 CFR 184 — Прямые пищевые вещества, признанные в целом безопасными». 1 апреля 2017 г., https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=184. По состоянию на 28 июля 2018 г.
Кислоты, основания и наука о воде Урок
При растворении в воде кислоты отдают ионов водорода (H+) . Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что придает им положительный электрический заряд. С другой стороны, основания, смешанные с водой, дают ионов гидроксида (ОН-) .Если раствор имеет высокую концентрацию ионов Н+, то он кислый. Если раствор имеет высокую концентрацию ионов ОН-, то он является основным.
Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что придает им положительный электрический заряд. С другой стороны, основания, смешанные с водой, дают ионов гидроксида (ОН-) .Если раствор имеет высокую концентрацию ионов Н+, то он кислый. Если раствор имеет высокую концентрацию ионов ОН-, то он является основным.
Во многих кислотно-основных реакциях конечным продуктом является вода и соль. Если соединить соляную кислоту (HCL) и гидроксид натрия (NaOH), получится H 2 O (вода) и NaCl (хлорид натрия, поваренная соль). Ионы Н+ в кислоте соединяются с ионами ОН- основания и нейтрализуются с образованием Н 2 О.
Одно из самых простых действий, позволяющих показать, как кислоты и основания реагируют друг с другом (и продемонстрировать их различные свойства), — это сделать из пищевой соды и уксуса «вулкан» . Чтобы вызвать сильное извержение, используйте маленькую пластиковую бутылку (размером 20 унций безалкогольных напитков будет хорошо работать). Наполните бутылку наполовину (от 1 до 1,5 стакана) уксусом. Чтобы вызвать извержение, бросьте в бутылку «бомбу» из пищевой соды — заверните одну столовую ложку пищевой соды в небольшой кусочек папиросной бумаги, завязав концы ниткой.Вы должны увидеть мгновенное извержение! Пищевая сода, основа, нейтрализует кислоту в уксусе. Это высвобождает углекислый газ, который вызывает шипение в вашем вулкане. (Кислый раствор нейтрализуется добавлением к нему основания, а щелочной раствор нейтрализуется добавлением кислоты.)
Наполните бутылку наполовину (от 1 до 1,5 стакана) уксусом. Чтобы вызвать извержение, бросьте в бутылку «бомбу» из пищевой соды — заверните одну столовую ложку пищевой соды в небольшой кусочек папиросной бумаги, завязав концы ниткой.Вы должны увидеть мгновенное извержение! Пищевая сода, основа, нейтрализует кислоту в уксусе. Это высвобождает углекислый газ, который вызывает шипение в вашем вулкане. (Кислый раствор нейтрализуется добавлением к нему основания, а щелочной раствор нейтрализуется добавлением кислоты.)
Для другого реакционного эксперимента поместите таблетку Alka-Seltzer на дно канистры из прозрачной пластиковой пленки (такой, в которой крышка входит внутрь, а не закрывается снаружи).Заполните канистру теплой водой, а затем быстро наденьте крышку и наблюдайте за кислотно-щелочной реакцией!
Шкала pH используется для измерения количества ионов H+ в растворе. Кислоты имеют рН ниже 7; основания имеют рН выше . Сильные кислоты имеют самый низкий уровень pH (0-4), а сильные основания имеют самый высокий уровень pH (10-14). Нейтральные растворы имеют pH 7 и не являются ни кислотными, ни щелочными. Дистиллированная вода нейтральна, так как ионы Н+ и ОН- уравновешены.
Сильные кислоты имеют самый низкий уровень pH (0-4), а сильные основания имеют самый высокий уровень pH (10-14). Нейтральные растворы имеют pH 7 и не являются ни кислотными, ни щелочными. Дистиллированная вода нейтральна, так как ионы Н+ и ОН- уравновешены.
Лакмус – это природный кислотно-щелочной индикатор, извлекаемый из лишайника.Если у вас есть красная и синяя лакмусовая бумажка, вы можете проверить разные растворы на кислотность или щелочность. Синяя лакмусовая бумажка становится красной , когда раствор кислый; красная лакмусовая бумажка превращает в синюю в основных растворах. Попробуйте протестировать средство для мытья окон, средство для чистки унитаза, апельсиновый и яблочный сок — налейте немного каждого в отдельные пробирки, маленькие стаканы или баночки. С помощью лакмусовой бумажки определите, какие вещества являются кислотами, а какие основаниями. Вот уровни pH некоторых других веществ, которые вы можете проверить: лимонный сок (2), уксус (3), молоко (6), яичные белки (8), пищевая сода (9) и аммиак (10). Человеческая кровь имеет идеальный рН 7,4; даже небольшие колебания могут серьезно повлиять на наш организм.
Человеческая кровь имеет идеальный рН 7,4; даже небольшие колебания могут серьезно повлиять на наш организм.
Вы также можете сделать свой собственный индикатор pH — используйте блендер, чтобы смешать одну часть нарезанной краснокочанной капусты с двумя частями кипящей воды и использовать сок для тестирования различных растворов. Кислоты окрашивают пигменты индикатора в красноватый цвет; основы сделают пигменты голубоватыми или желто-зелеными.
Урок науки: хорошая вода
Иногда вода может показаться простой и скучной, но у нее есть интересные физические свойства! Вода весит около 62 фунтов на кубический фут при температуре замерзания; замерзает при 0°С и кипит при 100°; и он составляет около 60% состава нашего тела и 83% нашей крови! Что касается того, на что она способна, воду называют «универсальным растворителем », потому что она может растворять больше веществ, чем любая другая жидкость, даже самая сильная кислота.
Химический состав воды H 2 O — два атома водорода и один кислород. То, как эти атомы соединяются вместе, образуя молекулу воды, определяет особые свойства воды. Два атома H образуют слабые водородные связи с кислородом; они прикрепляются к вершине молекулы, как уши Микки Мауса.
Эта молекулярная структура придает молекуле воды полярность или неравномерный электрический заряд, который притягивает другие атомы.Конец молекулы с двумя атомами Н заряжен положительно. Другой конец, с кислородом, заряжен отрицательно. Как и в магните, где северные полюса притягиваются к южным (противоположности притягиваются), положительный конец молекулы воды соединится с отрицательным концом других молекул.
Вода — единственное природное вещество, которое может существовать во всех трех агрегатных состояниях — твердом, жидком и газообразном — при температурах, обычно встречающихся на Земле. Многие другие вещества должны быть перегреты или охлаждены, чтобы изменить состояние.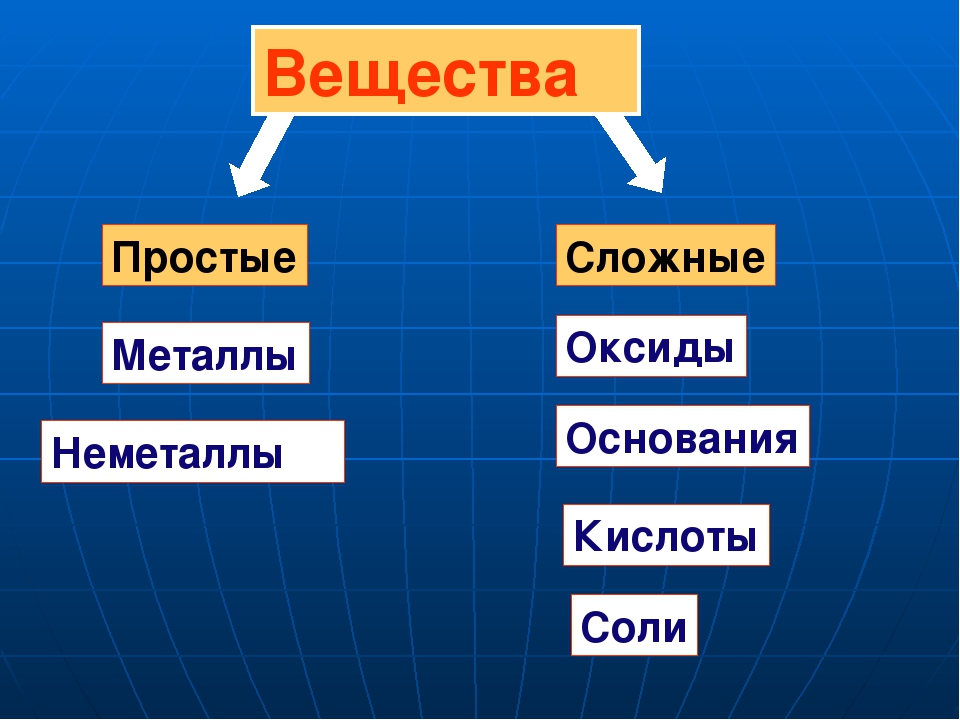 Твердое состояние воды (то есть лед) менее плотно, чем жидкое состояние, поэтому лед плавает.
Твердое состояние воды (то есть лед) менее плотно, чем жидкое состояние, поэтому лед плавает.
Вещества Polar легко растворяются в воде, «универсальном растворителе». Это связано с тем, что один конец полярной молекулы заряжен более положительно, а другой — более отрицательно. Положительно заряженный конец полярной молекулы будет притягиваться к отрицательно заряженному концу молекулы воды, и наоборот. Точно так же положительные ионы притягиваются к отрицательному концу молекулы воды и наоборот.Это молекулярное притяжение позволяет столь многим веществам легко растворяться в воде — молекулы окружены молекулами воды. Масло и другие неполярные растворы не имеют положительно или отрицательно заряженных концов, поэтому молекулы воды будут притягиваться друг к другу, а не к маслу. Вот почему масло не смешивается с водой.
Известный ученый: сэр Хамфри Дэви (1778-1829)
Дэви родился в графстве Корнуолл, Англия, 17 декабря 1778 года. Там он получил образование, став учеником хирурга-аптекаря, когда умер его отец. Через несколько лет он переехал в Бристоль и стал заведующим лечебным учреждением. В возрасте 22 лет он написал Researches, Chemical and Philosophical о своей работе о воздействии закиси азота (позже известной как веселящий газ). Он экспериментировал с газом, даже сам его вдыхал — одна из предполагаемых причин болезни, от которой он страдал в конце жизни.
Там он получил образование, став учеником хирурга-аптекаря, когда умер его отец. Через несколько лет он переехал в Бристоль и стал заведующим лечебным учреждением. В возрасте 22 лет он написал Researches, Chemical and Philosophical о своей работе о воздействии закиси азота (позже известной как веселящий газ). Он экспериментировал с газом, даже сам его вдыхал — одна из предполагаемых причин болезни, от которой он страдал в конце жизни.
Следующей его работой была электрохимия.Его использование электролиза (пропускание электрического тока через вещество для его разделения на части) привело его к правильному предположению, что элементы в соединении удерживаются вместе электрическими силами.
Дэви выделил элементы натрий, магний, калий, кальций, бор (вместе с Гей-Люссаком) и барий. Он также определил, что хлор является элементом, а не соединением кислорода, и дал ему название (от греческого слова «желто-зеленый»). Он экспериментировал с йодом, доказал, что алмазы образуются из углерода, и справедливо предположил, что кислоты содержат водород. В целом Дэви выделил больше элементов, чем любой другой химик до 20 века.
В целом Дэви выделил больше элементов, чем любой другой химик до 20 века.
Хотя Дэви был известен своими работами в области химии, он был более известен своим изобретением безопасной шахтерской лампы. Газообразный метан в угольных шахтах взрывался при контакте с пламенем свечей, которые шахтеры использовали для освещения, что приводило к гибели и повреждениям. Дэви попросили найти решение. Он придумал конструкцию лампы, в которой пламя окружалось тонкой проволочной сеткой. Некоторый свет все еще мог излучаться, но пламя, вызванное только взрывами в камере, где газ попадал в лампу; марля не позволяла теплу пламени распространяться на внешние газы.Метод Дэви был использован в более поздних усовершенствованиях шахтного освещения.
При жизни Дэви был удостоен множества наград. Он был избран членом Королевского общества в 1803 году; два года спустя он получил свою престижную медаль Копли; а в 1820 году он был избран его президентом. Кроме того, он получил награду от Наполеона Бонапарта, на которого произвели впечатление его работы в области электрохимии. Он был посвящен в рыцари в 1812 году при принце-регенте (когда Георг III страдал от приступов безумия) и получил титул баронета.
Он был посвящен в рыцари в 1812 году при принце-регенте (когда Георг III страдал от приступов безумия) и получил титул баронета.
Как объяснить детям кислоты и щелочи: 10 шагов (с иллюстрациями)
Об этой статье
В соавторстве:
Ученый-эколог
Эта статья была написана в соавторстве с Бесс Рафф, Массачусетс. Бесс Рафф — аспирант по географии в Университете штата Флорида. В 2016 году она получила степень магистра наук об окружающей среде и менеджмента в Калифорнийском университете в Санта-Барбаре.Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала исследовательскую поддержку в качестве аспиранта в Группе устойчивого рыболовства. Эта статья была просмотрена 172 719 раз.Соавторы: 13
Обновлено: 25 января 2022 г.
Просмотров: 172 719
Краткое содержание статьиX Объяснение кислот и оснований для детей может быть интересным способом познакомить их с химией и индикаторами pH.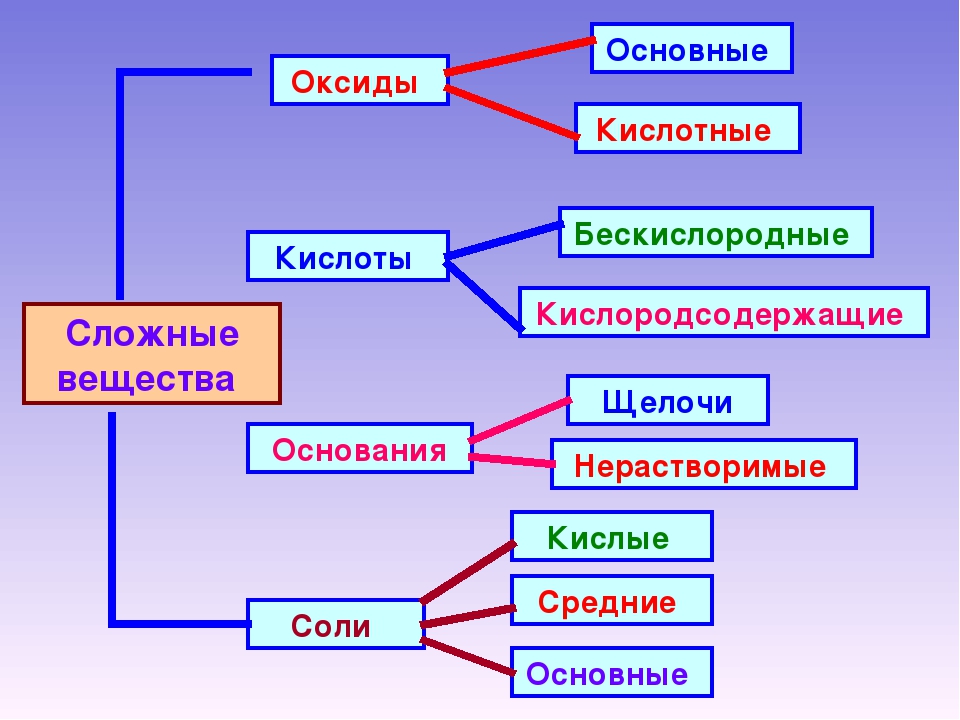 Прежде чем экспериментировать, нарисуйте шкалу pH из 14 разделов, и пусть ваши дети помогут вам раскрасить ее и подписать различные разделы. После того, как вы закончите диаграмму, полезно указать на некоторые распространенные вещества, которые являются кислотами или основаниями. Например, отбеливатель — это основание номер 13, а лимонный сок — кислота номер 2. Как только ваши дети поймут основную концепцию, попробуйте сделать жидкий индикатор, чтобы вы могли поэкспериментировать. Все, что вам нужно сделать, это варить нарезанную краснокочанную капусту в течение 30 минут, а затем процедить капустный сок в чашку.Теперь вы можете добавлять вещества в чашку, чтобы определить, являются ли они кислотными, нейтральными или щелочными. Например, когда вы добавляете пищевую соду к индикатору, он становится фиолетовым, указывая на то, что пищевая сода является основой. Затем, если вы добавите уксус, капустный сок снова станет красным, что означает, что уксус — это кислота, и он нейтрализовал основание.
Прежде чем экспериментировать, нарисуйте шкалу pH из 14 разделов, и пусть ваши дети помогут вам раскрасить ее и подписать различные разделы. После того, как вы закончите диаграмму, полезно указать на некоторые распространенные вещества, которые являются кислотами или основаниями. Например, отбеливатель — это основание номер 13, а лимонный сок — кислота номер 2. Как только ваши дети поймут основную концепцию, попробуйте сделать жидкий индикатор, чтобы вы могли поэкспериментировать. Все, что вам нужно сделать, это варить нарезанную краснокочанную капусту в течение 30 минут, а затем процедить капустный сок в чашку.Теперь вы можете добавлять вещества в чашку, чтобы определить, являются ли они кислотными, нейтральными или щелочными. Например, когда вы добавляете пищевую соду к индикатору, он становится фиолетовым, указывая на то, что пищевая сода является основой. Затем, если вы добавите уксус, капустный сок снова станет красным, что означает, что уксус — это кислота, и он нейтрализовал основание. Чтобы узнать больше о способах экспериментирования с кислотами и щелочами, читайте дальше!
Чтобы узнать больше о способах экспериментирования с кислотами и щелочами, читайте дальше!
- Печать
- Отправить фанатскую почту авторам
Щелочи — обзор | ScienceDirect Topics
Devin Gattey MD, in Clinical Ocular Toxicology, 2008
Основное применение
Щелочь относится как к гидроксиду натрия, так и к гидроксиду калия. Мыловарение путем омыления является наиболее традиционным химическим процессом с использованием гидроксида натрия. Он также используется в производстве биодизеля и в производстве продуктов питания. Гидроксид натрия чаще всего используется в домашних условиях в продуктах, которые разблокируют канализацию, а также содержится во многих сильных бытовых чистящих средствах.В исследовательских и промышленных целях гидроксид натрия и калия используется для контроля pH различных продуктов.
Побочные эффекты для глаз
Прямое попадание в глаза
Определенные
- 1.

Раздражение глаз
- a.
Глазная боль
- 2.
10524
LACRIMATION
- 23 3.
неспецифический блефароспазн
- 4.
CONCUNCTIVA
- A.
Гиперемия
- б.
Отек
- c.
Побледнение сосудистого русла
- d.
Симблефарон
- 5.
Роговица
- а.
Отек
- б.
Рубцы
- c.
Изъязвление
- d.
Васкуляризация
- e.
Перфорация
- f.
Фиброваскулярный паннус
- 6.
Катаракта
- 7.
3
03
03
03 Повышение или понижение внутриглазного давления
Глаукома
- б.
Гипотония
- c.

Туберкулез луковичный
Энтропион
Ирит
Клиническое значение
Каждый год в результате воздействия щелочей возникает множество серьезных глазных повреждений. Сбор данных за 2002–2005 годы из базы данных Системы наблюдения за воздействием токсикологических веществ Американской ассоциации центров по борьбе с отравлениями выявил 34 повреждения глаз щелочами, которые были оценены как «серьезные» (указывающие на некоторый тип значительной остаточной инвалидности). В это число не входят травмы, вызванные аммиаком, моющими средствами или другими продуктами с щелочным pH.Общее количество обращений за неотложной помощью из-за воздействия щелочей на глаза превысило 3000, и это число может соперничать только с воздействием бензина и хлорной извести. Некоторые автомобильные подушки безопасности выделяют незначительное количество гидроксида натрия, что может осложнить травмы глаз, полученные в результате прямой травмы во время дорожно-транспортных происшествий.
Щелочи обязаны своей токсичностью способности проникать через поверхность глаза легче, чем другие химические вещества, включая кислоты. Эпителий роговицы и ее мукоидное покрытие являются эффективными барьерами для многих веществ, но быстро деформируются в присутствии сильных щелочей.Концентрация гидроксильного иона и природа связанного с ним катиона играют роль в картине повреждения глаз, вызванного различными щелочами, но pH вещества, по-видимому, наиболее тесно коррелирует со степенью повреждения. Когда рН вещества поднимается выше 11, значительно увеличивается его потенциал для повреждения глаз. Из трех наиболее распространенных щелочей гидроксид аммония (см. раздел об аммиаке) быстрее всего проникает в глаза, за ним следует гидроксид натрия и затем гидроксид кальция (см. раздел об извести).Гидроксид магния — еще одна щелочь, которая, как известно, вызывает повреждение глаз, и является распространенным ингредиентом фейерверков, поэтому химическое повреждение этим соединением часто сопровождается термическим повреждением.
При попадании в глаза концентрированного щелока первой реакцией являются боль, слезотечение и блефароспазм. Последнее затрудняет немедленное промывание глаза. Повреждения конъюнктивы могут включать ишемический некроз лимбальной ткани и утрату сосудистого русла. Позже может развиться сильная сухость глаз, развитие симблефарона и энтропиона.Тяжелые ожоги глаз щелочами могут повредить чувствительные нервы и привести к анестезии глаз, что является плохим прогностическим признаком. Поскольку щелочь вызывает некроз эпителия роговицы и нарушение поверхностных барьеров, она немедленно начинает проникать в более глубокие слои роговицы, потенциально достигая передней камеры в течение минуты. Присутствие щелочи в строме может привести к необратимому помутнению роговицы, васкуляризации роговицы, истончению стромы и перфорации. Щелок в передней камере повышает рН, вызывая повреждение трабекулярной сети и повышение внутриглазного давления.Хотя у некоторых пациентов со временем развивается хроническое повышение внутриглазного давления, может произойти повреждение цилиарного тела, что приведет к гипотонии и туберкулезу луковиц. Хрусталик может быть необратимо поврежден повышенным внутриглазным pH, что приводит к катаракте. Имеются также сообщения о случаях отравления сетчатки глаза щелочью.
Хрусталик может быть необратимо поврежден повышенным внутриглазным pH, что приводит к катаракте. Имеются также сообщения о случаях отравления сетчатки глаза щелочью.
Истинная тяжесть повреждения глаз щелочью может быть неизвестна в течение нескольких дней. Заживление может быть замедлено хроническим воспалением, дисбалансом синтеза/деградации коллагена и гибелью лимбальных стволовых клеток.Могут образоваться стерильные язвы, и в конечном итоге фиброваскулярный паннус может покрыть роговицу.
Рекомендации
Наиболее важным вмешательством при попадании в глаза щелочи или других щелочей является немедленное промывание. Было проведено множество исследований для определения оптимального ирригационного раствора для различных типов химического воздействия, но малозаметные преимущества одного раствора над другим гораздо менее важны, чем быстрота ирригации. В промышленных условиях часто используются станции для промывания глаз.Если попадание в глаза сильной щелочи произошло вдали от таких ресурсов, спасатели должны немедленно применить любой нетоксичный водный раствор, который есть под рукой.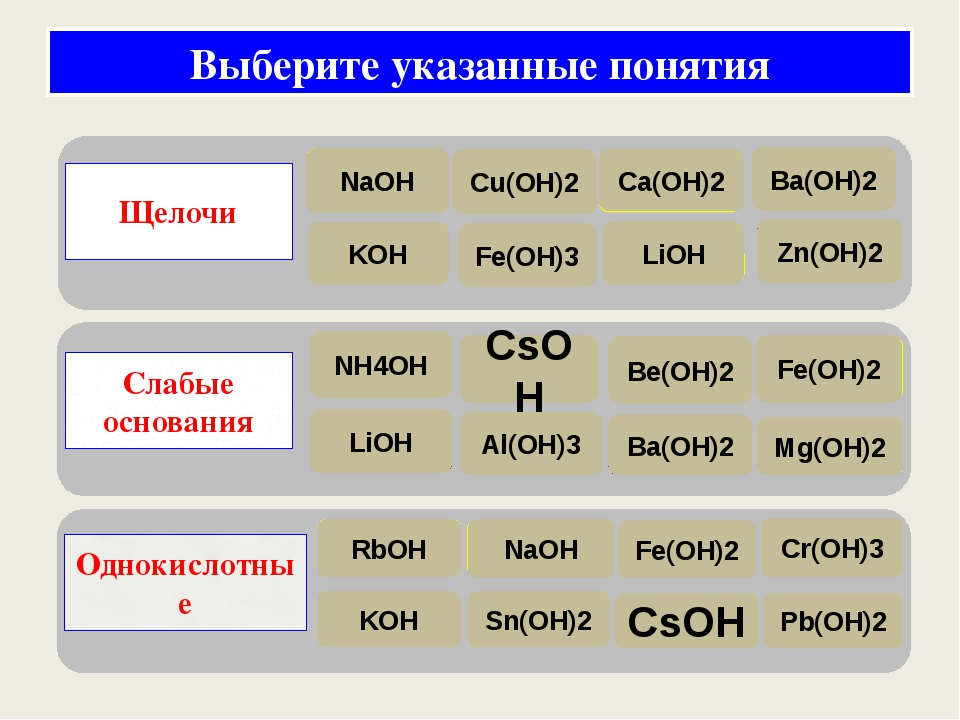
Как только пострадавший оказывается в медицинском центре, необходимо немедленно начать интенсивное орошение с использованием обычного физиологического раствора или стерильной воды. Этому способствует использование местного анестетика и расширителя. Один литр жидкости следует использовать для промывания поверхности глаза в течение 10 минут. После этого первого литра должно пройти несколько минут для точного определения pH конъюнктивального мешка с помощью лакмусовой бумаги с точностью до нейтрального диапазона.Если рН не падает ниже 8, следует продолжать циклы орошения в течение 15 минут с последующей проверкой рН. Некоторые эксперты выступают за ирригацию в течение не менее 2 часов, чтобы помочь нейтрализовать рН передней камеры, в то время как другие выступают за парацентез передней камеры и промывание. После начального цикла промывания следует провести краткий осмотр глаз, проверяя зрение и внутриглазное давление, а также исследуя конъюнктивальные своды на наличие инородных тел, которые могут служить резервуаром для щелочи. В этот момент следует удалить некротический эпителий роговицы.
В этот момент следует удалить некротический эпителий роговицы.
После ирригации и нейтрального pH следует проводить медикаментозное лечение. Местные циклоплегические глазные капли, мази с антибиотиками и глазные капли с кортикостероидами следует применять в течение первой недели. По истечении этого времени кортикостероиды могут тормозить заживление ран. При необходимости следует начать антиглаукоматозную терапию. Высокие дозы перорального аскорбата, возможно, полезны и малотоксичны. Было рекомендовано использовать многие другие вещества как для перорального, так и для местного применения, чтобы помочь в заживлении этих травм, но ни одно из них не стало стандартом лечения.Хирургическое лечение поздних последствий тяжелых ожогов глаз щелочами является сложной темой и выходит за рамки данной книги.
Что делает вещи кислотными: Шкала pH
Я помню, как довольно рано узнал о кислотах и основаниях (или кислотах и щелочах) в школе. Кислоты представляли собой острые уксусные вещества, такие как лимонный сок, а щелочи были мыльными веществами, такими как известковая вода или каустическая сода. Мы также узнали о шкале pH, которая измеряет кислотность или щелочность вещества.Шкала pH варьируется от 1 до 14, при этом pH 7 означает полностью нейтральную среду, то есть воду. Все, что имеет очень низкий pH, является кислотным, а вещества с высоким pH — щелочными.
Мы также узнали о шкале pH, которая измеряет кислотность или щелочность вещества.Шкала pH варьируется от 1 до 14, при этом pH 7 означает полностью нейтральную среду, то есть воду. Все, что имеет очень низкий pH, является кислотным, а вещества с высоким pH — щелочными.
Только позже я узнал, что на самом деле означает шкала pH, и когда я это сделал, это взорвало мне мозг. Я всегда предполагал, что оно либо состоит из двух слов, либо названо в честь кого-то. Я иногда задавался вопросом, почему это было написано именно так (с маленькой буквы «п», с большой буквы), но никогда не настолько, чтобы всерьез спрашивать об этом.
Для начала, это H не H.Причина, по которой он пишется с большой буквы, заключается в том, что это символ водорода.
Р тоже не р, это буква, используемая в качестве сокращения для математической операции. Если быть точным, операция «-log10». Я предполагал, что буквы pH на самом деле были научной формулой, -log10 концентрации ионов водорода:
pH = — log 10 [H+]
Имея это в виду, шкала pH сделала многое. больше смысла в качестве меры кислотности. Кислоты имеют несколько различных определений, но в целом это вещества, которые могут генерировать ионы водорода в растворе.pH — это способ показать, сколько ионов водорода они выделяют, без необходимости подсчитывать все ионы. pH также не имеет единиц измерения, что очень удобно для таких людей, как я, которые находят единицы измерения запутанными.
больше смысла в качестве меры кислотности. Кислоты имеют несколько различных определений, но в целом это вещества, которые могут генерировать ионы водорода в растворе.pH — это способ показать, сколько ионов водорода они выделяют, без необходимости подсчитывать все ионы. pH также не имеет единиц измерения, что очень удобно для таких людей, как я, которые находят единицы измерения запутанными.
Чтобы быть кислой, вещество должно содержать водород в форме, которая может выделяться в воду. Такие вещества, как Ch5 (метан), не являются кислотными, так как все четыре атома водорода очень прочно связаны с углеродом и никуда не денутся. Ch5 имеет нейтральный pH, около 7. С другой стороны, такие вещества, как соляная кислота, HCl, удерживаются вместе полярными ионными связями, и при попадании в воду водород отделяется с образованием ионов водорода, что делает жидкость кислой.Поэтому HCl имеет очень низкий pH и является очень сильной кислотой.
Слабые кислоты с pH 5 или 6 немного сложнее. Они образуются, когда соединение может выделять ионы водорода, но очень слабо. Примерами часто являются органические соединения, которые, несмотря на то, что в их химической структуре много атомов водорода, очень немногие из них могут отделяться в растворе. Уксусная кислота (HC 2 H 3 O 2 ) является слабой кислотой, так как только водород в начале уравнения может диссоциировать, и это не очень выгодно для него с энергетической точки зрения.
Они образуются, когда соединение может выделять ионы водорода, но очень слабо. Примерами часто являются органические соединения, которые, несмотря на то, что в их химической структуре много атомов водорода, очень немногие из них могут отделяться в растворе. Уксусная кислота (HC 2 H 3 O 2 ) является слабой кислотой, так как только водород в начале уравнения может диссоциировать, и это не очень выгодно для него с энергетической точки зрения.
Шкала рН со списком веществ при каждом рН. Кислоты вверху, основания внизу. Кредит изображения ниже.
Мне нравится тот факт, что «рН» имеет реальное химическое и математическое значение, а не просто случайный набор букв. Хотя математика кислотности может стать немного сложной по мере того, как вы углубляетесь в химию, -log10[H+] по-прежнему является основным определением как кислотности, так и щелочности.
—
Кредитная ссылка для изображения 2
HC 2 H 3 O 2
.
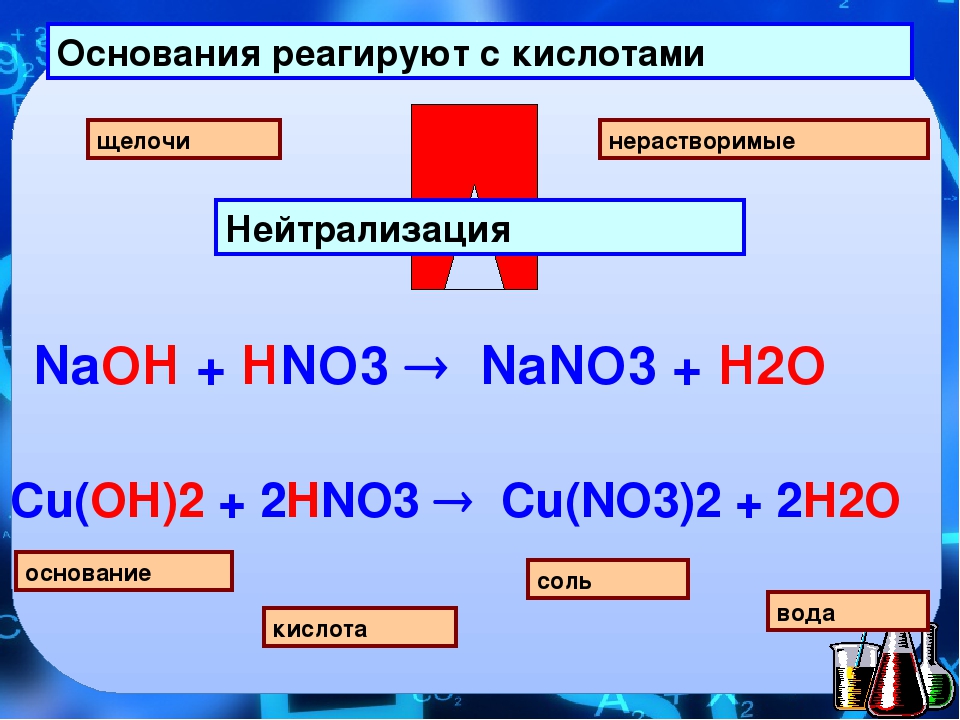


 Хотя основания противоположны, поскольку они горькие, как правило, без запаха (кроме аммиака), они скользкие; основы реагируют с жирами и маслами.
Хотя основания противоположны, поскольку они горькие, как правило, без запаха (кроме аммиака), они скользкие; основы реагируют с жирами и маслами.
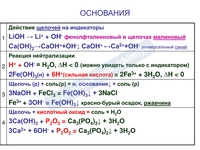 МеА + h3O = ЩЁЛОЧЬ + Н2↑ (2Na + 2h3O = 2NaOH + h3)
МеА + h3O = ЩЁЛОЧЬ + Н2↑ (2Na + 2h3O = 2NaOH + h3)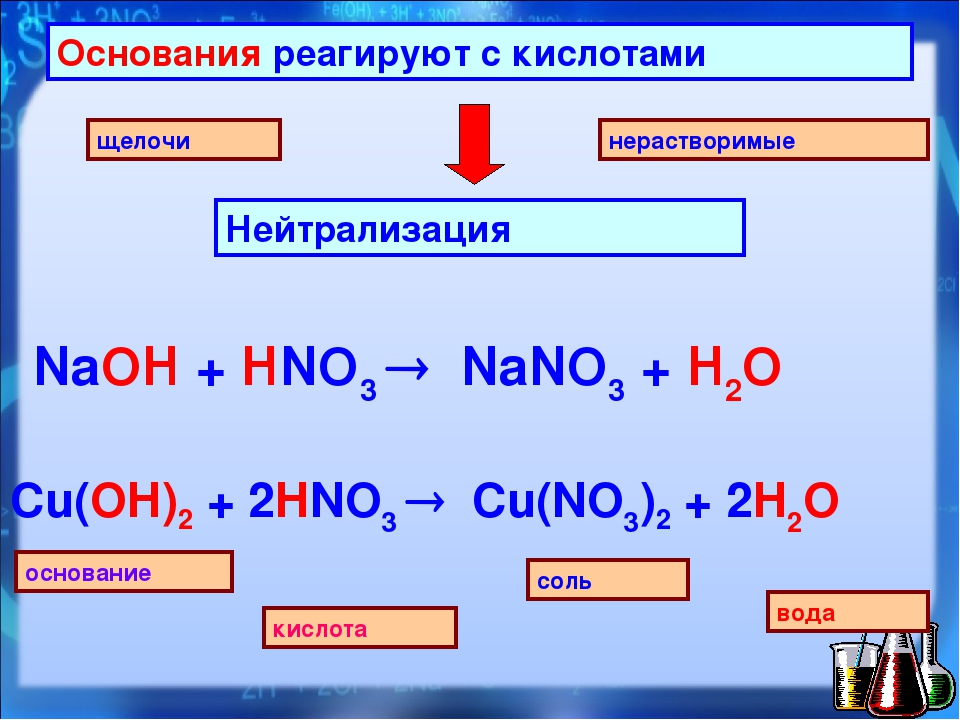 Реакция нейтрализации:
Реакция нейтрализации:
 В общем случае основания — это соединения, которые реагируют с кислотами с образованием соли.Это определение охватывает некоторые из основ, но упускает из виду многие. Так вот, разные ученые давали и другие определения оснований.
В общем случае основания — это соединения, которые реагируют с кислотами с образованием соли.Это определение охватывает некоторые из основ, но упускает из виду многие. Так вот, разные ученые давали и другие определения оснований. Например: Nh4 является базой Льюиса. У него есть одинокая пара, которую он может подарить. Основание Льюиса обычно извлекает протоны и становится стабильным, например, Nh4, которое приобретает протон с образованием Nh5+.
Например: Nh4 является базой Льюиса. У него есть одинокая пара, которую он может подарить. Основание Льюиса обычно извлекает протоны и становится стабильным, например, Nh4, которое приобретает протон с образованием Nh5+.
