ЕГЭ. Химические свойства оснований
Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.
Условие: один из реагентов должен быть растворимым.
H2SO4 + 2KOH → K2SO4 + 2H2O (соотношение реагентов 1:2)
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1)
HCl + Cu(OH)2 → CuOHCl + H2O или
2HCl + Cu(OH)2 → CuCl2 + 2H2
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.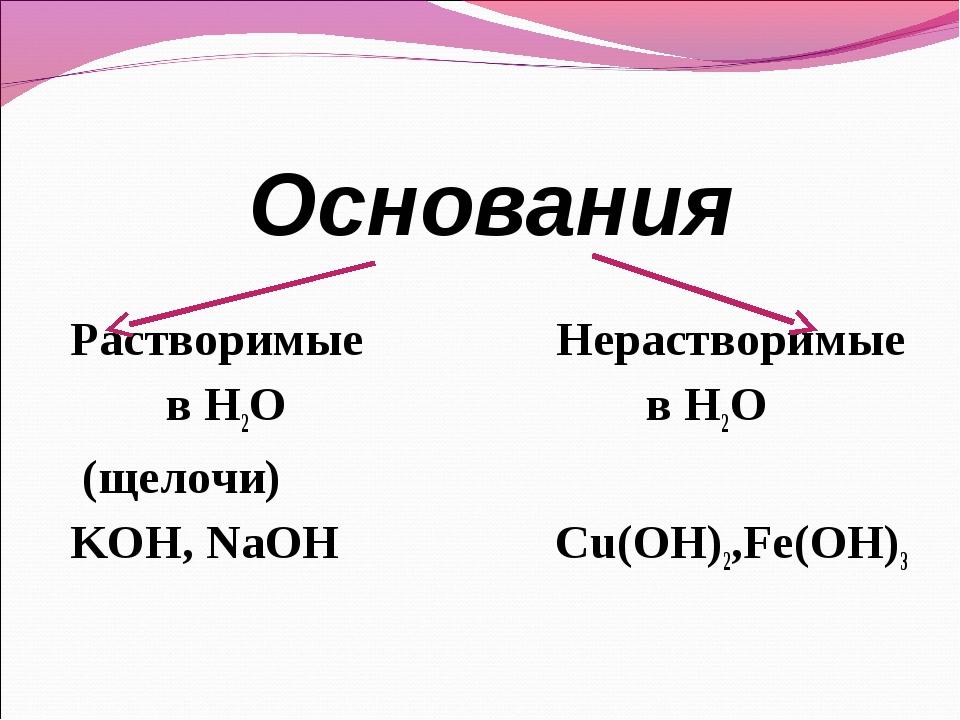
4. Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 + 2NaCl
NaOH + NH4NO3 → NH3 + NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + 2CO2 → Ca(HCO3)2
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
Zn(OH)2 + NaOH → Na2[Zn(OH)4]
Be(OH)2 + NaOH → Na2[Be(OH) 4]
Al(OH)3 + NaOH → Na[Al(OH)4]
2) реакции при сплавлении:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O (кислота: H2ZnO2)
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O (кислота: H2BeO2)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (кислота: HAlO2)
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O.
Урок 37. Основания – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 37 «Основания» из курса «Химия для чайников» узнаем о составе оснований, выясним на какие виды они подразделяются, а также рассмотрим с чем эти сложные веществ взаимодействуют.
Существует целый класс сложных неорганических веществ, в состав которых входят атомы металлов и группы ОН. Все вещества этого класса реагируют с кислотами с образованием солей, т. е. являются как бы «основой» солей. Поэтому класс таких веществ получил название основания.
Состав оснований
Вы уже знаете, что общая формула оснований — Me(OH)x, где Me — символ какого-либо металла, а индекс х — число групп OH, соединенных с одним его атомом. Обычно это число изменяется от 1 до 3.
Напомним, что основания NaOH, KOH, Mg(OH)2, Ca(OH)2, Fe(OH)2, Cu(OH)2 относятся к основным гидроксидам.
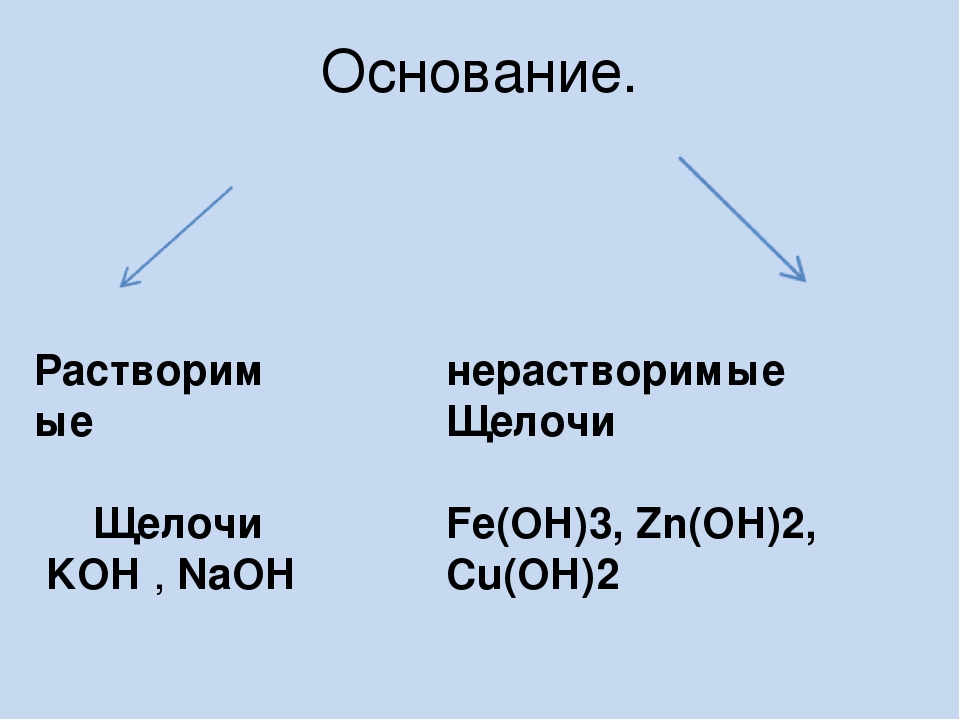
Классификация оснований
По растворимости в воде основания делятся на растворимые и нерастворимые. К растворимым основаниям относятся NaOH, KOH, Ba(OH)2, Ca(OH)2. Они имеют общее название — щёлочи. При обычных условиях это твердые вещества белого цвета. Нерастворимыми являются основания Mg(OH)2, Al(OH)3, Zn(OH)2, Fe(OH)2, Fe(OH)3 и некоторые другие. Они также представляют собой твердые вещества, многие из которых окрашены в разные цвета (рис. 120).
На заметку: Термин «щёлочь» происходит от старорусского слова «щёлок», обозначавшего отвар чего-либо в воде. Этим словом называли, например, жидкость, которая получается при кипячении смеси воды с золой растений. Вещество, содержащееся в золе, реагирует с водой и превращается в гидроксид калия KOH. Это соединение, содержащееся в щёлоке, назвали «щёлочь». Впоследствии данный термин стали использовать для всех растворимых оснований.
Этим словом называли, например, жидкость, которая получается при кипячении смеси воды с золой растений. Вещество, содержащееся в золе, реагирует с водой и превращается в гидроксид калия KOH. Это соединение, содержащееся в щёлоке, назвали «щёлочь». Впоследствии данный термин стали использовать для всех растворимых оснований.
Химические свойства оснований
Для оснований характерны реакции обмена с кислотами и солями, реакции соединения с кислотными оксидами и реакции термического разложения.
Изменение окраски индикаторов
Вы уже знаете, что такое индикаторы и для чего они используются. Вспомните, в какие цвета окрашиваются лакмус, метилоранж и фенолфталеин в растворах щелочей.
Взаимодействие с кислотами
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
Пример реакции, протекающей в соответствии с указанной схемой:
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Напомним, что реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
Взаимодействие с кислотными оксидами
Все щелочи реагируют с кислотными оксидами по общей схеме:
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в квадратных cкобках), то в составе образующейся соли будет остаток этой кислоты — PO4 с валентностью, равной III:
Взаимодействие с солями
Все щелочи реагируют с солями по общей схеме:
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями.
Термическое разложение
Все нерастворимые основания при нагревании разлагаются по общей схеме:
Краткие выводы урока:
- Основания делятся на растворимые в воде (щелочи) и нерастворимые.
- Все основания реагируют с кислотами. Растворимые основания реагируют с кислотными оксидами и солями. Нерастворимые основания подвергаются термическому разложению.
Надеюсь урок 37 «Основания» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
ХиМиК.ru — ЩЁЛОЧИ — Химическая энциклопедия
ЩЁЛОЧИ, растворимые в воде сильные
основания, создающие в водном р-ре большую концентрацию ионов ОН—.
Обычно к щёлочам относят. гидроксиды щелочных и щел.-зем. металлов. Бесцв. кристаллы.
Гидроксиды щелочных металлов — едкие щелочи -хорошо раств. в воде (хуже
— LiOH), гидроксиды щел.-зем. металлов — плохо. Сила оснований и р-римость
в воде в каждой группе периодич. системы возрастают сверху вниз с увеличением
радиуса катиона. Едкие щёлочи раств. также в этаноле и метаноле. Едкие щёлочи (за
исключением LiOH) термически устойчивы до т-ры выше 1000 °С, гидроксиды
щел.-зем. металлов и LiOH разлагаются при более низких т-рах.
 Водные р-ры едких щёлочей разрушают
стекло, расплавы — фарфор и платину. Плавят едкие щёлочи в сосудах из серебра,
никеля или железа, хранят в полиэтиленовых сосудах. Р-ры едких щёлочей нельзя
долго хранить в стеклянных сосудах с пришлифованными стеклянными пробками
и кранами, к-рые прилипают к шлифу вследствие взаимод. щёлочей со стеклом.
Водные р-ры едких щёлочей разрушают
стекло, расплавы — фарфор и платину. Плавят едкие щёлочи в сосудах из серебра,
никеля или железа, хранят в полиэтиленовых сосудах. Р-ры едких щёлочей нельзя
долго хранить в стеклянных сосудах с пришлифованными стеклянными пробками
и кранами, к-рые прилипают к шлифу вследствие взаимод. щёлочей со стеклом. Получают: едкие щёлочи- электролизом хлоридов щелочных металлов, обменными р-циями между солями щелочных металлов и гидроксидами щел.-зем. металлов; действием воды на оксиды щел.-зем. металлов. Определяют щёлочи с помощью кислотно-основных индикаторов.
Твердые щёлочи и их конц. р-ры разрушают живые ткани, особенно опасно попадание частиц твердой щёлочи в глаза.
К щёлочам иногда относят соли сильных оснований и слабых к-т, водные р-ры к-рых имеют щелочную р-цию, напр. гидросульфиды NaSH и KSH, карбонаты Na2СО3, а также ТlОН, аммиачную воду.
См. также Бария гидроксид, Калия гидроксид, Кальция оксид, Натрия гидроксид и др.
Лит.: Степин Б. Д., Цветков А. А., Неорганическая химия, М., 1994.
С. И. Дракин.
Персональный сайт — Основания
Основания (гидроксиды).
Основания — это сложные вещества, которые состоят из атомов металла и одной или нескольких групп OH, называемой гидроксогруппой.
Способы получения оснований
- Получение щелочи при реакции сильноосновного оксида с водой
Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей.
CaO(т) + H2O(ж) → Ca(OH)2(p)
Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Косвенное получение основания (гидроксида) при реакции соли со щелочью
Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p)
- Получение щелочи при реакции замещения типичного металла с водой.
Ca+2H2O=Ca(OH)2+H2
Классификация оснований
- По растворимости в воде
- Растворимые в воде основания (щёлочи): LiOH, NaOH, KOH, Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , Ra(OH)2, CsOH, RbOH, FrOH
- Практически нерастворимые в воде: Mg(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3 , Be(OH)2
- Другие основания: NH3 × H2O
- Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По количеству гидроксильных групп в молекуле
- Однокислотные (NaOH),
- Двукислотные (Cu(OH)2)
- Трехкислотные (Fe(OH)3)
- По летучести
- Летучие: NH3, CH3-NH2
- Нелетучие: Щелочи, нерастворимые основания
- Стабильность
- Стабильные: NaOH, Ba(OH)2
- Нестабильные: NH3
·H2O
- По степени диссоциации
- Сильные (α > 30%): Щелочи
- Слабые (α < 3%): Нерастворимые основания
- По наличию кислорода
- Кислородсодержащие: KOH, Sr(OH)2
- Бескислородные: Аммиак, амины
- Растворимость в H2O
- Растворимые: Na(OH), KOH, Ba(OH)2, CH3-NH2
- Нерастворимые: Cr(OH)2, Mn(OH)2, C6H5MH2
Химические свойства
1. Действие на индикаторы:
Действие на индикаторы:
- лакмус — синий,
- метилоранж — жёлтый,
- фенолфталеин — малиновый,
2. Основание + кислота = Соли + вода. Примечание: реакция не идёт, если и кислота и щёлочь слабые.
- NaOH + HCl = NaCl + H2O
3. Щёлочь + кислотный или амфотерный оксид = соли + вода
- 2NaOH + SiO2 = Na2SiO3 + H2O
4. Щёлочь + соли = (новое) основание + (новая) соль. Примечание: исходные вещества должны быть в растворе, а хотя бы один из продуктов реакции выпасть в осадок или мало растворяться.
- Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
5. Слабые основания при нагреве разлагаются:
- Cu(OH)2 + Q = CuO + H2O
6. При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид:
- 2AgNO3 + 2NaOH(разб.) → 2NaNO3 + Ag2O + H2O
Задание № 6 классификация оснований (по растворимости в воде)
Задание № 6
Классификация оснований (по растворимости в воде)
Растворимые (щелочи) | Малорастворимые | Нерастворимые |
Правильность ваших рассуждений можно проверить по таблице (учитель просит открыть таблицу растворимости в учебнике и рассказывает учащимся, как ей пользоваться).
Учитель. Существует еще две классификации
оснований, в основе одной лежит основность
(количество гидроксогрупп), а другой
отношение к электрическому току (сильные
и слабые).
Как же отличить щелочи от воды или кислоты, если эти вещества бесцветны и не имеют запаха?
Учитель просит учащихся открыть учебник, рассмотреть таблицу «Изменение окраски индикаторов» объясняет, как можно применять её для определения веществ.
Далее предлагает выполнить задание №7. Лабораторный опыт №2 «Проверьте утверждение». Проверить верно, ли указаны номера пробирок, в которых содержатся кислота, щелочь и вода используя только один реактив.
Учитель после обсуждения ответов учащихся помогает сформулировать вывод.
Учитель рассказывает, что для определения щелочей, есть еще одна качественная реакция и приглашает 2 учеников, помочь провести опыт. (Взаимодействие оксида углерода (IV) с гидроксидом кальция в двух вариантах). Учитель записывает схему уравнения реакции на доске, а учащиеся в «Рабочих листах».
Са(ОН)2 + СО2 = СаСО3 + Н2О
известковая вода соль
Вывод: Растворимые в воде основания изменяют окраску индикаторов. Под действием углекислого газа известковая вода (гидроксид кальция) мутнеет – это качественная реакция на CO2 и Ca(OH)2.
Учитель. Мы познакомились еще с одним классом сложных веществ — основаниями. Как вы думаете, имеют ли основания практическое значение? Конечно же, да Внимательно послушайте сообщение о применение щелочей и выполните задание №8 «Установите соответствие», исправив ошибки.
Сообщение
ученицы (слайд
3). Гидроксид натрия применяют в
производстве мыла, в кожевенной
промышленности, в фармацевтике и в
производстве бумаги. Гидроксид калия
используется при «варке» тугоплавкого
стекла, производстве бумаги и жидкого
мыла.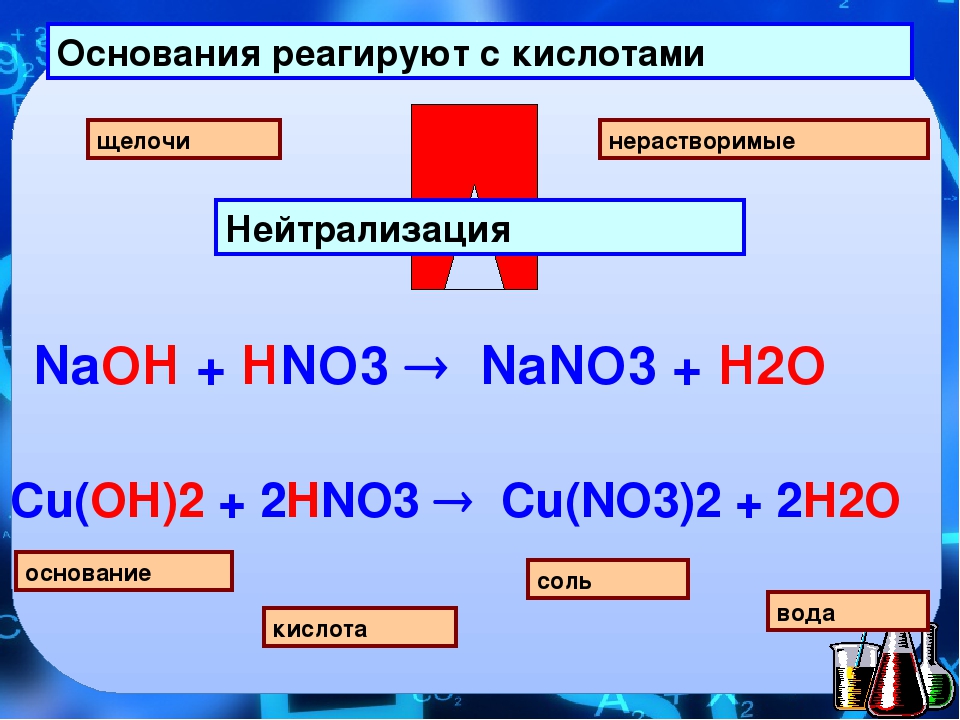 Гидроксид кальция в смеси с медным
купоросом для борьбы с возбудителями
грибковых заболеваний плодовых, овощных
и декоративных культур. Он применяется
для распознавания углекислого газа.
Гидроксид кальция в смеси с медным
купоросом для борьбы с возбудителями
грибковых заболеваний плодовых, овощных
и декоративных культур. Он применяется
для распознавания углекислого газа.
Заполненную схему, учитель проверяет после сдачи «Рабочего листа».
Учитель. Сейчас вам предстоит провести небольшое исследование и объяснить наблюдаемое явление. Это эвристическое задание, оно поможет определить, как вы можете применять полученные знания не в стандартной ситуации.
Задание №9. На каком свойстве основано применение щелочей в качестве жидкого мыла?
Тема. Рисуем на молоке.
Учитель. Откройте слайд в презентации
(после обсуждения ответов учитель объясняет суть опыта) при добавлении краски в молоко и жидкого мыла на поверхности образуются неожиданные рисунки, мыло, содержащее щелочь, растворяет жир, содержащийся в молоке. Т.к. капельки жира плавают в молоке хаотично, то и растворение его происходит неравномерно.
IV Закрепление.
Учитель. В начале урока мы сформулировали цель «Изучение свойств оснований и выявление основой для чего они служат», с какими свойствами оснований мы сегодня познакомились? (физическими и химическими)
Чтобы ответить на вторую часть вопроса обратите внимание на схемы уравнений реакций в задании №5 и №7, какие вещества образуются в реакциях со щелочами? (соли)
Вывод: основания являются основой для получения солей. Их мы будем изучать на следующем уроке.
Что
бы проверить как вы усвоили материал
урока, выполните задание
№10 — тест. В
тесте отмечены ответы, если ты не согласен
исправь их.
В
тесте отмечены ответы, если ты не согласен
исправь их.
Тест. «Исправьте ошибки»
1.При обычных условиях основания это
твердые вещества
жидкости
газообразные вещества
могут быть твердыми, жидкими и газообразными
2.В растворах щелочей лакмус меняет свой цвет соответственно на…
фиолетовый на красный
фиолетовый на синий
фиолетовый на желтый
3.Хорошо растворимы в воде все основания группы:
KOH, Ca(OH)2, NaOH
LiOH, KOH, Al(OH)3
NaOH, KOH, Ba(OH)2
4.Формула щелочи — это:
Zn(OH)2 b) KOH c) Cu(OH)2 d) Mg(OH)2
Ответ: 1 а 2 а 3 с 4 b
V Итог урока
В ходе сегодняшнего урока изучая новую тему, вы выполняли задания, находили и исправляли ошибки. Прочитайте цитату Хань Сян-цзы в «Рабочих листах», выскажите своё мнение: можно ли исправляя ошибки других, научится самому. После высказываний учеников учитель подводит итог урока, выставляет оценки за работу.
VI Рефлексия
Задание №11. Выберите предложение, которое отражает ваше настроение, и подчеркните его.
Урок полезен, все понятно.
Лишь кое-что чуть-чуть не ясно.
Еще придется потрудиться.
Да, трудно все-таки учится!
Рабочий лист.
«Тот, кто правильно указывает на мои ошибки
– мой учитель.
Тот, кто помогает мне увидеть мои ошибки
– мой друг.
Тот, кто мне
льстит – мой враг».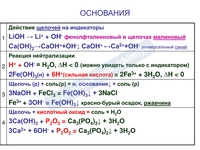
ХаньСян-цзы – китайский философ 760г.
Тема.________________________________
Цель.________________________________________________________________________
_____________________________________________________________________________Д.З. §_____№
Задание №1«Найди ошибку».
В схеме «Классификация оксидов» найдите ошибки и исправьте их. Дайте названия оксидам по международной номенклатуре.
Классификация оксидов
Оксиды металлов Оксиды неметаллов
1.Na2O _____________ А. SО2 ____________
2.H2О ______________ Б. ВаО ____________
3.CuO ______________ В. СаО ____________
Подчеркните оксиды: KOH N2O5 Fe(OH)2 Fe2O3 Al(OH)3 CO2
Основания – это______________________________________________________________
_____________________________________________________________________________
Общая формула оснований______________
Название оснований
слово «гидроксид» | + | название металла в родительном падеже | + | (римская цифра, обозначающая числовое значение степени окисления металла) для металлов с переменной степень окисления |
Задание
№2 «Лови ошибку». Найди
ошибки и исправь их в названиях, которые
будет давать приведенным ниже соединениям
учитель.
Найди
ошибки и исправь их в названиях, которые
будет давать приведенным ниже соединениям
учитель.
Fe(OH)2-гидроксид железа____________________________
LiOH- гидроксид лития (I)____________________________
KOH — основание калия_____________________________
NiOH — гидроксид натрия _____________________________
Задание №3. Составьте формулы оснований.
Гидроксид меди_______________
гидроксид бария_______________
гидроксид алюминия___________
Задание №4 «Найдите ошибки в тексте»
Правила Т.Б. со щелочами.
Несоблюдение правил работы со щелочами не приводит к сильным химическим ожогам. При воздействии на кожу концентрированных растворов едких щелочей образуются светло-желтые пятна.
Твердые едкие щелочи, притягивая влагу, содержащуюся в воздухе, легко переходят в раствор, поэтому действие их не расценивается как действие щелочей.
Твердые щелочи можно брать незащищенными руками, для этого используются фарфоровые ложечки или шпатели. Большие куски едких щелочей раскалывать на мелкие кусочки могут ученики с применением защитных очков и перчаток.
Растворять щелочи следует в фарфоровой посуде путем медленного прибавления к воде небольших порций при постоянном помешивании.
Насыпать или наливать щелочи следует как обычные вещества.
Для нейтрализации пролитых на стол щелочей используйте заранее приготовленный 50% раствор уксусной кислоты.
При нагревании жидких щелочей можно заглянуть в пробирку, т.к. это не может привести к несчастному случаю.
Остатки
щелочей и веществ после опытов сливают
в раковину.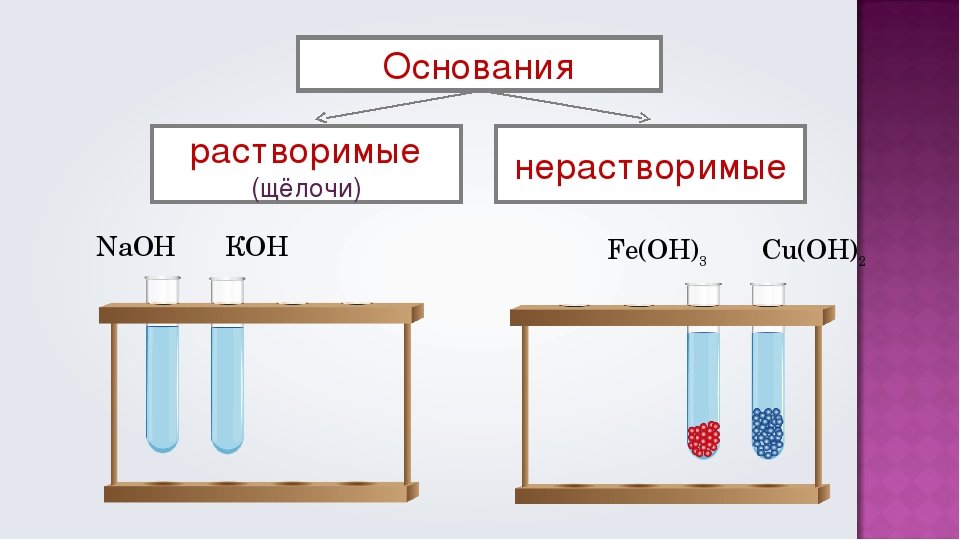
Задание
№5. Лабораторный опыт №1
Тема. Получение
гидроксидов меди (II)
и железа (III)
Техника безопасности при работе со щелочами
На лабораторное стекло с помощью стеклянной трубочки нанесите 1-2 мл сульфата меди (CuSO4) из бутылочки.
С помощью стеклянной трубочки к сульфату меди добавьте 1-2 мл гидроксид натрия (NaOH) из бутылочки.
Что вы наблюдаете? По каким признакам можно судить, что произошла реакция? К полученному веществу добавьте 3мл воды.Что вы наблюдаете? Сделайте вывод о растворимости гидроксида меди.
На лабораторное стекло с помощью стеклянной трубочки нанесите 1-2 мл хлорида железа (FeCl3) добавьте 1-2 мл гидроксид натрия (NaOH) из бутылочки.
Что вы наблюдаете? По каким признакам можно судить, что произошла реакция?К полученному веществу добавьте 3мл воды.Что вы наблюдаете? Сделайте вывод о растворимости гидроксида железа.
CuSO4 + __NaOH =____________ + Na2SO4 _________________________________
соль + щелочь = основание + новая соль
FeCl3 _+ NaOH =____________ + 2NaCl
Задание №5. Составьте схему классификации оснований. На лепестках напишите примеры оснований.
Классификация оснований (по растворимости в воде)
_______________ ___________________ ______________
Задание № 7. «Проверьте утверждение»
Лабораторный опыт №2
Тема. Определение
реакции среды растворов
Определение
реакции среды растворов
В трех пронумерованных пробирках находятся вещества №1 вода, №2 щелочь, №3 кислота. Проверьте это утверждение, используя только один реактив. Что наблюдаете?
Объясните полученные результаты.
Вывод: пробирка №1 -_________, пробирка №2 -_________ пробирка №3 -_____________
Качественная реакция на гидроксид кальция с углекислым газом.
Реакции, с помощью которых распознают определенные вещества, называют качественными.
Са(ОН)2 + СО2 = СаСО3 + Н2О
известковая вода соль
Задание №8. «Установите соответствие», исправив ошибки.
Применение оснований
Вещества | Применение | |
А. Гидроксид натрия В. Гидроксид калия С. Гидроксид кальция |
| |
| ||
| ||
| ||
|
Ответ: А-_____________ В -__________ С — __________
Задание №9. Лабораторный опыт №3
Тема. Рисуем на молоке
1. В чашку Петри налейте молоко из пробирки №4.
2. Капните по
несколько капель разноцветных красок
в молоко по центру чашки Петри.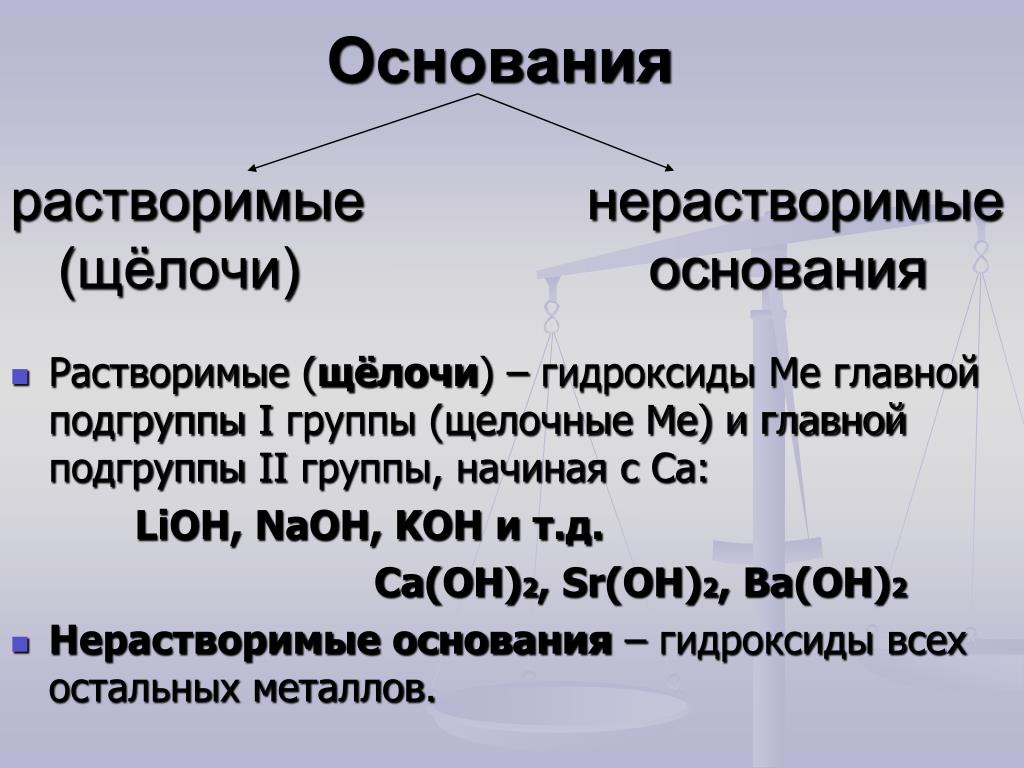
3. Обмакните две ватные палочки в жидкое мыло (фарфоровая чашечка) и погрузите их в молоко.
4. Что наблюдаете? На каком свойстве основано применение щелочей в качестве жидкого мыла?
Задание №10. Тест «Исправь ошибки». В тесте отмечены ответы, если ты не согласен исправь их и укажи свой ответ.
1.При обычных условиях основания
твердые вещества
жидкости
газообразные вещества
могут быть твердыми, жидкими и газообразными
2.В растворах щелочей лакмус меняет свой цвет соответственно на
фиолетовый на красный
фиолетовый на синий
фиолетовый на желтый
3.Хорошо растворимы в воде все основания группы:
KOH, Ca(OH)2, NaOH
LiOH, KOH, Al(OH)3
NaOH, KOH, Ba(OH)2
4.Формула щелочи — это:
Zn(OH)2 b)KOH c)Cu(OH)2 d)Mg(OH)2
Рефлексия.
Задание №11.Выбери предложение, которое отражает твое настроение.
Урок полезен, все понятно.
Лишь кое-что чуть-чуть не ясно.
Еще придется потрудиться.
Да, трудно все-таки учится!
Основания их химические свойства и способы получения (Таблица)
Основания — это сложные вещества, в состав которых входят атомы металла и гидроксогруппы OH— (за исключением гидроксид аммония NH4OH — не содержит атомов металла).
Me+n(OH)n-1 — общая формула оснований
Me — металл
n — степень окисления металла
Схема классификации оснований
Все основания делятся на растворимые в воде — щёлочи, амфотерные гидроксиды, и нерастворимые основания (нерастворимые в воде).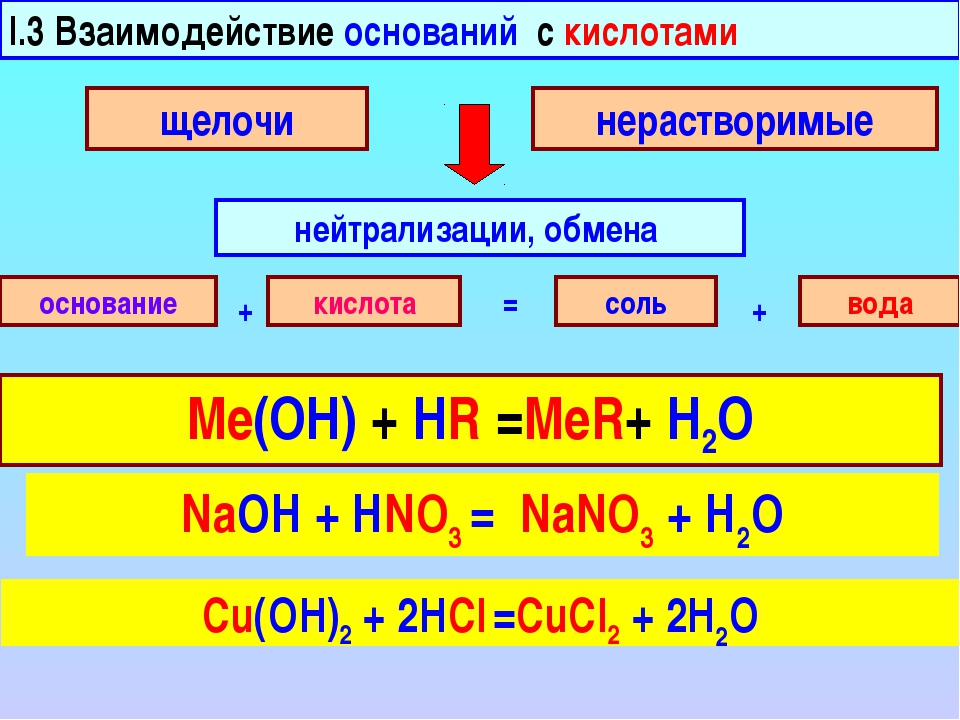
Химические свойства оснований
|
Основания |
Химические свойства |
|
Щелочи (во всех реакциях участвуют ионы ОН-, (что видно из кратких ионных уравнений), следовательно, они обуславливают общие химические свойства щелочей) |
1. Действие на индикаторы: фенолфталеин — малиновый цвет, метилоранж — желтый цвет, лакмус — синий цвет |
|
2. диссоциация: NaOH → Na+ +ОН— При диссоциации образуются ионы ОН—, которые изменяют окраску индикаторов и придают мылкость растворам щелочей. |
|
|
3. Основание + кислота → соль + вода 2КОН + 2НСl → 2КС1 + Н20 |
|
|
4. Щелочь + кислотный оксид → соль + вода Ва(ОН)2 + СO2 → ВаСО3 + Н2O |
|
|
5. Щелочь + соль 1 → соль 2 + основание 2KOH + CuSO4 → K2SO4 + Cu(OH)2↓ |
|
|
Нерастворимые основания |
1. Основание + кислота → соль + вода 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6Н2O |
|
2. Основание → t°→ оксид + вода 2Fe(OH)3 → t°→ Fe2O3 + ЗН2O, Си(ОН)2 → t°→ СuО + Н2O |
|
|
Амфотерные гидроксиды (у амфотерных гидроксидов в кислой среде равновесие смещается в сторону образования солей, а в щелочной — в сторону образования гидрокомплексов) |
1. Zn(OH)2 + 2НСl → ZnCl2 + 2Н2O |
|
2. Амфотерный гидроксид + щелочь → соль + вода Zn(OH)2 + 2NaOH → Na2ZnO2 + 2Н2O |
Способы получения оснований
|
Способ получения |
Примеры |
Примечание |
|
Взаимодействие металлов или их оксидов с водой |
2Na + 2Н2O → 2NaOH + Н2↑ К2O + Н2O → 2КOН |
Так можно получить только щелочи |
|
Действие щелочей на водные растворы солей |
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO |
Так можно получить нерастворимые основания |
|
Электролиз растворов солей |
2KCl + 2H2O → I, графит, электроды → 2KOH + + H2↑ + Cl2↑ |
Промышленный способ получения КОН и NaOH |
_______________
Источник информации:Насонова А.Е. Химия в таблицах. 8-11 класс. Справочное пособие, 2000
Кислоты, основания и соли | CPD
Хлорид натрия — это источник натрия в нашем рационе, необходимый для передачи нервных импульсов и поддержания надлежащего баланса жидкости в организме. На протяжении всей истории люди использовали эту соль для консервирования мяса, очистки ран и изготовления мыла.
Натрия хлорид является одним из примеров соли. В химии термин «соль» относится к группе ионных соединений, образованных в результате реакции нейтрализации между кислотой и основанием.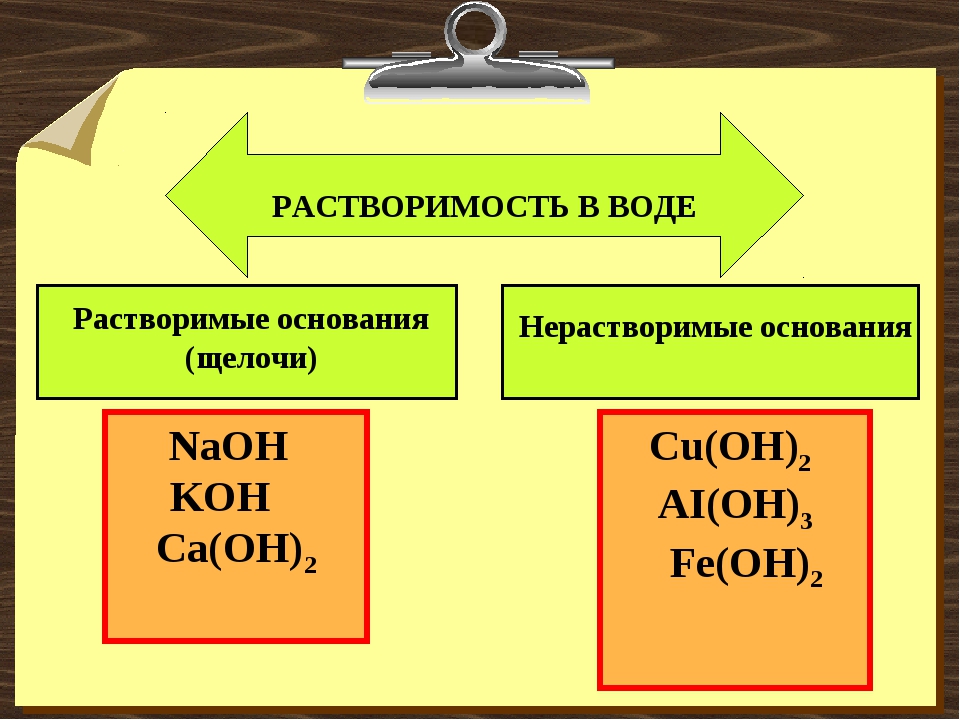
Понятия кислот, оснований и солей вводятся в начале обучения в средней школе, развиваются и уточняются по мере успеваемости учащихся и лежат в основе многих будущих тем.Вот несколько идей, которые помогут заинтересовать студентов, избежать неправильных представлений и связать практическую работу с основными концепциями.
Что нужно знать студентам
- Кислоты — водородсодержащие вещества с кислым вкусом, которые образуют растворы со значением pH менее 7. Обычные примеры включают соляную кислоту, серную кислоту, лимонную кислоту и этановую кислоту (уксус / уксусная кислота).
- Основания — это группа веществ, нейтрализующих кислоты.
- Растворимые основания называются щелочами.Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак.
- Нейтрализация — это реакция между кислотой и щелочью, при которой образуется соль и вода.
- Соли не имеют запаха и имеют соленый вкус, многие из них растворимы в воде. Общие примеры включают хлорид натрия, йодид калия, карбонат кальция и сульфат меди.
- Шкала pH используется для измерения кислотности и щелочности.
- Индикаторы — это вещества, меняющие цвет при изменении кислотности / щелочности. Лакмус — общий индикатор; щелочные растворы окрашиваются в красный лакмусовый синий цвет, а кислые растворы — в синий лакмусовый красный цвет.
- Кислоты могут реагировать с некоторыми металлами с образованием соли и газообразного водорода.
Идеи для занятий
Учащиеся имеют богатый опыт работы с кислотами, основаниями и солями, накопленный как в школе, так и в повседневной жизни.Стоит начать тему с выявления их существующих идей путем совместного построения карты разума. Будьте внимательны к недопониманиям и постарайтесь устранить их, прежде чем двигаться дальше.
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи. Загрузите подборку анекдотов о кислотах, основаниях и солях (MS Word или pdf).
Загрузите подборку анекдотов о кислотах, основаниях и солях (MS Word или pdf).
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи. Загрузите подборку анекдотов о кислотах, основаниях и солях с веб-сайта Education in Chemistry : rsc.li / 2Oj0lQk.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба выглядят как вода. Учащимся сложно использовать химические свойства для характеристики этих растворов. Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учениках (MS PowerPoint или pdf) и заметки учителя (MS Word или pdf) для этого упражнения.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба выглядят как вода. Учащимся сложно использовать химические свойства для характеристики этих растворов. Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учениках и заметки для учителей для этого упражнения: rsc.li/2Oj0lQk.
В этом упражнении мудрец должен описать простое изображение двум писцам.Один писец записывает описание мудреца, а другой пытается нарисовать по нему рисунок. Могут ли переписчики идентифицировать изображение? Описания субъективны и могут быть неверно истолкованы, тогда как идентификация требует объективного подхода.
Свяжите эту идею с тем, как мы можем четко различать два раствора, которые выглядят как вода, особенно с использованием индикаторов с кислотами и щелочами.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах.В качестве домашнего задания попросите учащихся определить бытовые вещества, которые являются кислотами и щелочами.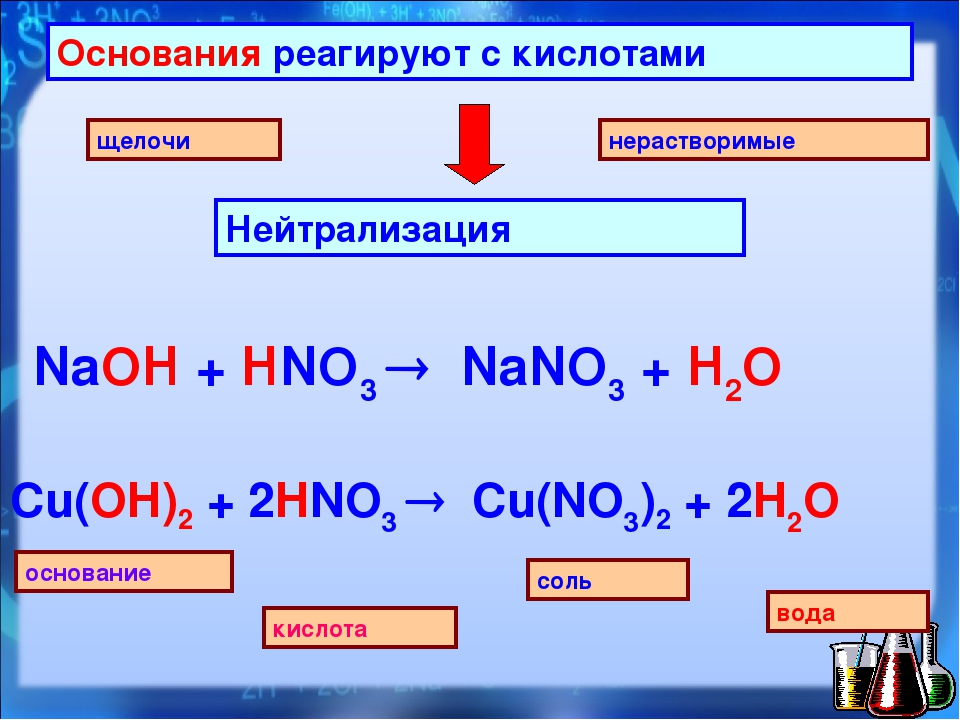 Их обычно можно найти на кухне и в ванной комнате. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами. Студент может принести образцы и протестировать их с помощью кислоты или щелочи? Кислый или щелочной? Мероприятия. Затем активность Color creactions может быть использована для введения универсального индикатора и шкалы pH перед переходом к нейтрализации.
Их обычно можно найти на кухне и в ванной комнате. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами. Студент может принести образцы и протестировать их с помощью кислоты или щелочи? Кислый или щелочной? Мероприятия. Затем активность Color creactions может быть использована для введения универсального индикатора и шкалы pH перед переходом к нейтрализации.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах.В качестве домашнего задания попросите учащихся определить бытовые вещества, которые являются кислотами и щелочами. Их обычно можно найти на кухне и в ванной комнате. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами. Студент может принести образцы и протестировать их с помощью «Кислота или щелочь? Кислая или щелочная активность? ’(Rsc.li/2PueBT7). Затем активность «Цветные реакции» можно использовать для введения универсального индикатора и шкалы pH перед переходом к нейтрализации (rsc.li / 2CaCriy).
Важно продумать, чему вы хотите, чтобы учащиеся извлекли уроки из этих заданий, и как этого можно достичь. Время должно быть поровну разделено между практическими занятиями (включая просмотр демонстраций и видео) и последующей умственной деятельностью по обсуждению основных концепций и идей. Учащиеся могут совместно работать над развитием своего понимания, используя структурированные беседы, которые позволяют установить связи между практической работой и лежащими в основе концепциями.
Связь практических задач с основополагающими концепциями
Помните, что время, выделяемое на практическую работу, должно быть поровну разделено между практическими занятиями и установлением связей между явлениями и лежащими в их основе концепциями.
Призывайте студентов наблюдать и интерпретировать, задавая вопросы. Попробуйте повторить их ответы на правильном языке. Например, замените «проделал дыру» или «прожжил» на «корродировал».
С практикой студенты могут вести свои практические беседы в своей группе.У структурированных разговоров должны быть строгие ограничения по времени. Строительные леса, такие как основы предложений, побуждают как слушать, так и отвечать друг другу.
Вопросы
- Что вы наблюдали?
- Что вы можете сделать из этого?
- Почему…?
- Что вы думаете о…?
- Каковы последствия для…?
- Как может…?
Основы приговора
- Я видел…
- Я думаю, это показывает…
- Это говорит о том, что…
- Думаю, это говорит нам…
- А как насчет…?
- Я с вами не согласен, потому что…
- Не понимаю…
Распространенные заблуждения
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы.Однако щелочи также могут быть очень агрессивными, как показано на видео о банках из-под кока-колы.
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы. Однако щелочи также могут вызывать сильную коррозию, как показано в видеоролике «Коксовые банки в кислоте и щелоче» (bit.ly/2C5YyXv).
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой».Деградация — это изменение объемных свойств материала, который будет по-другому выглядеть, станет слабее или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частицы) уровне. Например, раствор гидроксида натрия добавляют в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические).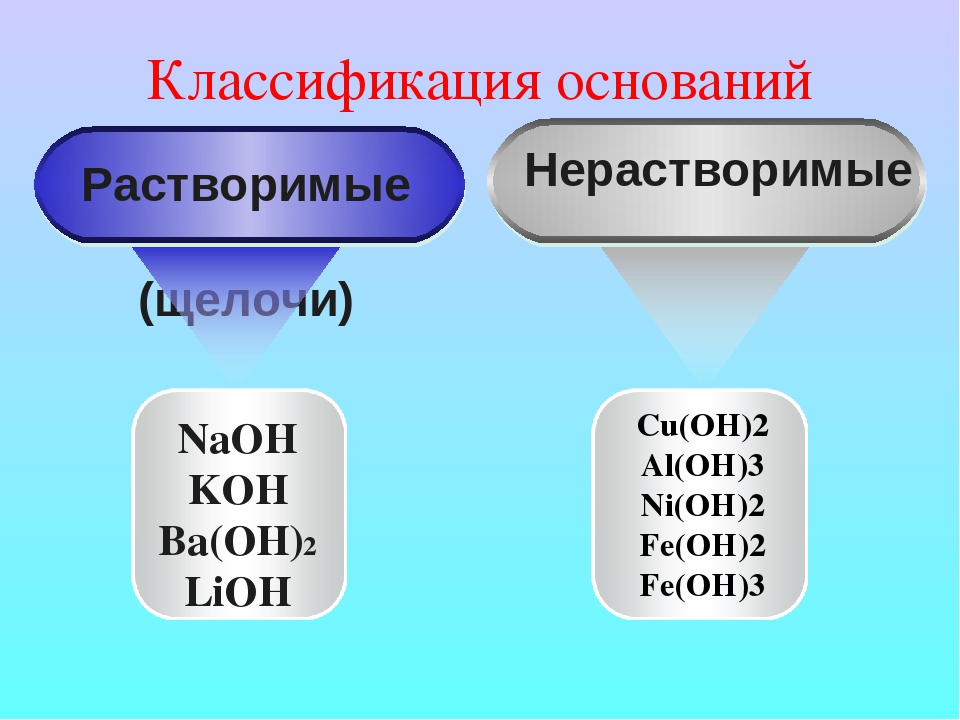 .
.
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой». Деградация — это изменение объемных свойств материала, который будет по-другому выглядеть, станет слабее или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частичном) уровне (узнайте больше о том, как заставить ваших учеников задуматься о том, как они учатся: rsc.li / 2C596X0). Например, раствор гидроксида натрия добавляют в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические). .
Старайтесь избегать использования антропоморфных описаний, таких как «атаковать» или «съесть». Эти термины, как правило, приводят к представлениям о химических веществах, которые «хотят» или «нуждаются» в реакции. Это усложнит учащимся четкое понимание того, как и почему протекают химические реакции.
Формирующее оценивание
Сопоставление концепций — полезный инструмент для усиления связи этой темы с учебной программой. Упражнение «Пересмотр кислот» (rsc.li/2OTINtu) было адаптировано как оценивание для учебной деятельности (rsc.li/2A365VQ).
Предоставьте студентам возможность практиковаться как в более длинных ответах (четыре и шесть баллов), так и в вопросах с несколькими вариантами ответов (одна оценка) при подготовке к экзаменам. Покажите вопрос и дайте студентам две минуты, чтобы написать свой ответ на мини-доске.Важно, попросите их написать, почему они выбрали свой ответ. Это дает возможность выявить недопонимание и незамедлительно дать обратную связь.
Переход на 14–16
В уроках 14–16 используется более сложная модель кислотности, основанная на ионах водорода и гидроксида.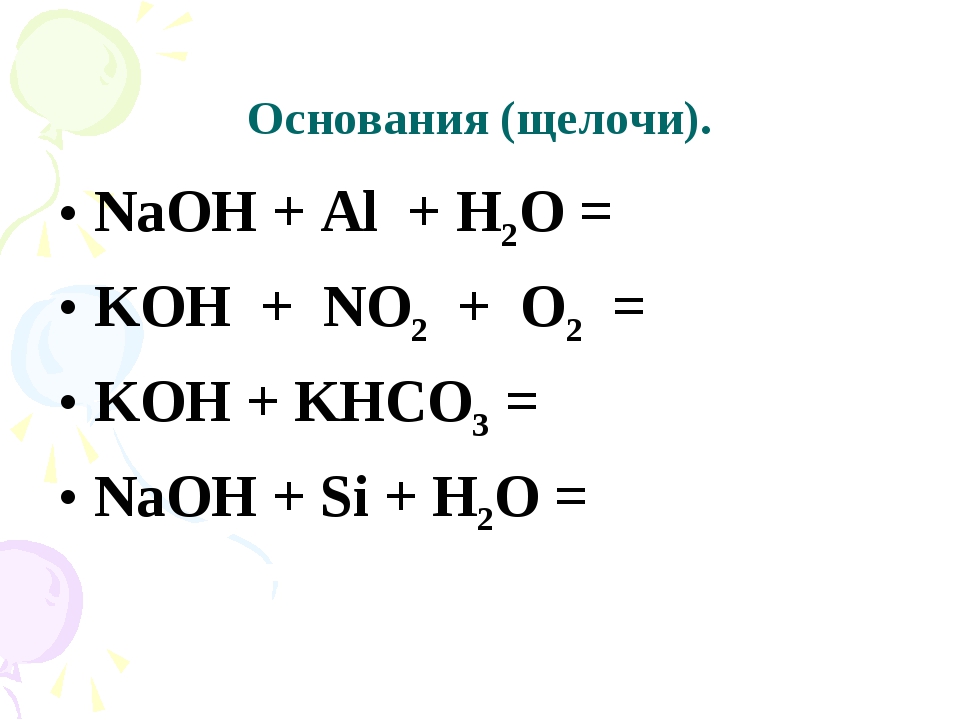 Кислоты выделяют ионы водорода (H + ) в растворе и щелочные ионы гидроксида (OH — ).
Кислоты выделяют ионы водорода (H + ) в растворе и щелочные ионы гидроксида (OH — ).
pH формально определяется как логарифмическая мера концентрации ионов водорода.Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды. Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, есть специальные устройства и методы, которые необходимо использовать и понимать, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE).
pH формально определяется как логарифмическая мера концентрации ионов водорода. Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды.Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, есть специальные устройства и методы, которые необходимо использовать и понимать, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE: rsc.li/2pIPwbD).
Итого
- Кислые и щелочные растворы можно определить по химическим свойствам.
- Усилить твердую природу кислот, оснований и солей, чтобы учащиеся отошли от простого упоминания об объемных свойствах и антропоморфных описаниях, таких как «съел дыры».
- Сделайте явным связь между практической работой и основополагающими концепциями, используя макроскопические и субмикроскопические представления.
- Эта тема лежит в основе многих будущих тем, включая синтез и анализ химических веществ.
Щелочные Vs. Базовый | Sciencing
Обновлено 13 апреля 2018 г.
Автор: Suzanne Fyhrie Parrott
Люди обычно используют термин «щелочной» для обозначения основных растворов, но их значения не совпадают.Все щелочные растворы являются щелочными, но не все щелочные. Обычно говорят о щелочности вещества, например почвы, когда pH — это свойство, которое вы действительно обсуждаете.
TL; DR (слишком долго; не читал)
Основа — это раствор, который содержит более низкую концентрацию ионов водорода, чем чистая вода. Щелочное соединение при растворении образует щелочной раствор.
Определение основного
В химии основа — это водный раствор любого химического соединения, который дает раствор с концентрацией ионов водорода ниже, чем в чистой воде.Гидроксид натрия и аммиак — два примера. Основания — это химические противоположности кислот. Основания уменьшают концентрацию ионов водорода в воде, тогда как кислоты увеличивают их. При объединении кислоты и основания нейтрализуют друг друга.
Определение щелочного металла
В химии термин «щелочь» относится к солям (ионным соединениям), содержащим элементы щелочных и щелочноземельных металлов, которые принимают ион водорода в растворе. Щелочные основы известны как основы, растворяющиеся в воде.Щелочные металлы бурно реагируют с водой, образуя гидроксиды и выделяя водород. Реакция с воздухом покрывает поверхность раствора оксидами. В природе ионные соединения (соли) содержат щелочные металлы, но никогда в чистом виде.
Свойства щелочей
Щелочные основы вызывают ощущение слизи или мыла на ощупь из-за омыления жирных кислот в коже человека. Щелочи образуют ионы гидроксида (ОН-) при растворении в воде, и все они являются основаниями Аррениуса. Обычно водорастворимые, некоторые щелочи, такие как карбонат бария, становятся растворимыми только при реакции с кислотным раствором, содержащим воду.Умеренно концентрированные растворы (pH 7,1 или выше) превращают лакмусовую бумажку в голубой, а фенолфталеин — от бесцветного до розового. Концентрированные растворы вызывают химические ожоги (едкий натр).
Две кислотно-основные теории
Основание Бростеда-Лоури, названное в честь Йоханнеса Бронстеда и Томаса Лоури, представляет собой любое вещество, которое принимает водородный значок (протон).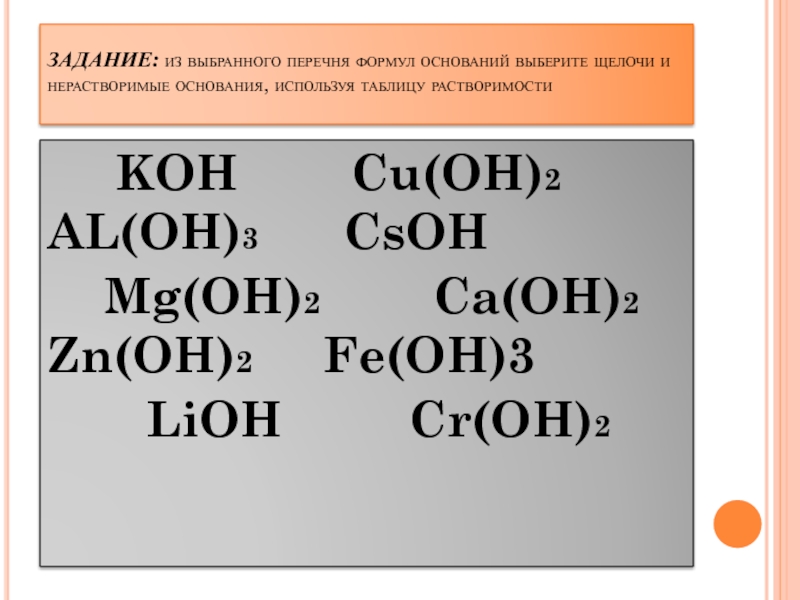 Кислота BL — это любое вещество, которое отвергает ион водорода, как указано на веб-сайте Нью-Йоркского университета. С другой стороны, определение Аррениуса классифицирует основание как любое вещество, которое увеличивает концентрацию гидроксид-ионов в воде (ОН-).
Кислота BL — это любое вещество, которое отвергает ион водорода, как указано на веб-сайте Нью-Йоркского университета. С другой стороны, определение Аррениуса классифицирует основание как любое вещество, которое увеличивает концентрацию гидроксид-ионов в воде (ОН-).
терминология — Щелочи и основы Терминология
— Щелочи и основания — Chemistry Stack ExchangeСеть обмена стеком
Сеть Stack Exchange состоит из 176 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange- 0
- +0
- Авторизоваться Зарегистрироваться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов, изучающих химию.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществуКто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено 12к раз
$ \ begingroup $ Я только что узнал о кислотах и щелочах на уроке. Я заметил, что в моем учебнике упоминается термин «щелочь / щелочь», а иногда упоминается «основной / основной». Насколько мне известно, щелочи и основания — это гидроксиды оксидов металлов. Но почему в моем учебнике используется двух слов, которые означают одно и то же, вместо одного из них? Означают ли эти термины (щелочь и основание) что-то другое?
Я заметил, что в моем учебнике упоминается термин «щелочь / щелочь», а иногда упоминается «основной / основной». Насколько мне известно, щелочи и основания — это гидроксиды оксидов металлов. Но почему в моем учебнике используется двух слов, которые означают одно и то же, вместо одного из них? Означают ли эти термины (щелочь и основание) что-то другое?
57.5k99 золотых знаков185185 серебряных знаков334334 бронзовых знака
Создан 20 ноя.
Simon-Nail-ItSimon-Nail-It4,4761515 золотых знаков4343 серебряных знака7070 бронзовых знаков
$ \ endgroup $ $ \ begingroup $Эти слова во многих случаях взаимозаменяемы: щелочной раствор / соединение — это то же самое, что и основной раствор / соединение .
Но вы можете указать «щелочь» для обозначения тех оснований, которые растворимы в воде, а также являются солями щелочных или щелочноземельных металлов.
Щелочь подобна подмножеству оснований, которое удовлетворяет этим условиям.
Например:
- Гидроксид натрия является основанием, а также солью щелочного металла, а также растворим в воде, поэтому он также является щелочью.
- Аммиак — это основание, растворимое в воде, но не соль, поэтому он не является щелочью.
- Гидроксид магния является основанием, представляет собой соль щелочноземельного металла, но он не растворяется в воде, поэтому он не является щелочью.
2,86211 золотых знаков1919 серебряных знаков6060 бронзовых знаков
Создан 20 ноя.
1,92499 серебряных знаков2020 бронзовых знаков
$ \ endgroup $ $ \ begingroup $Я думаю, что щелочь — это вещество, которое растворяется в воде с образованием ионов $ \ ce {OH- (aq)} $.Поскольку ионы $ \ ce {OH- (aq)} $ могут реагировать с кислотами, это также приводит к образованию щелочных оснований. Следовательно, щелочи — это растворимых оснований. Аммиак также может растворяться в воде с образованием аммония, ионов $ \ ce {Nh5 + (aq)} $ и $ \ ce {OH- (aq)} $, то есть он подвергается гидролизу, и в этом случае гидроксил, $ \ ce { Производятся ионы OH- (aq)} $. Поэтому в этом отношении аммиак квалифицируется как щелочь, и мы должны помнить об очень высокой растворимости аммиака в воде, что продемонстрировано в эксперименте с фонтаном .Карбонат натрия является щелочью, потому что он также растворяется в воде с образованием гидроксильных ионов. Следовательно, из этого резюме есть два очень важных критерия, по которым соединения должны считаться щелочью:
- Должно растворяться в воде
- Он должен производить ионы $ \ ce {OH- (aq)} $ в водной среде.
Создан 30 янв.
$ \ endgroup $ 1 Очень активный вопрос .Заработайте 10 репутации, чтобы ответить на этот вопрос. Требование репутации помогает защитить этот вопрос от спама и отсутствия ответов. Chemistry Stack Exchange лучше всего работает с включенным JavaScript
Chemistry Stack Exchange лучше всего работает с включенным JavaScriptВаша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie Настроить параметры
База (химия) — Энциклопедия Нового Света
В химии основание рассматривается как вещество, которое может принимать протоны или любое химическое соединение, которое дает гидроксид-ионы (OH — ) в растворе.Его также обычно называют любым веществом, которое может реагировать с кислотой для снижения или нейтрализации ее кислотных свойств, изменения цвета индикаторов (например, превращение красной лакмусовой бумажки в синий), ощущение скользкости на ощупь в растворе, горький вкус, реакция с кислотами с образованием солей и способствуют определенным химическим реакциям (например, щелочной катализ). Примеры простых оснований — гидроксид натрия и аммиак. Гидроксид натрия (NaOH), также известный как каустическая сода или щелок, диссоциирует в воде с образованием ионов гидроксида (OH — ) и ионов натрия (Na + ).
В основном растворе фенолфталеин имеет розовый или красный цвет. Базы имеют множество практических применений, и некоторые из них обычно используются в домашних условиях. Бытовой аммиак — привычное чистящее средство. Щелок используется для чистки засоров и сточных вод в раковинах. Гидроксид калия, также называемый едким калием, используется для изготовления мягкого мыла, которое легко растворяется в воде. Гидроксид магния в воде (также называемый молоком магнезии) используется как антацидное или слабительное средство.
Бытовой аммиак — привычное чистящее средство. Щелок используется для чистки засоров и сточных вод в раковинах. Гидроксид калия, также называемый едким калием, используется для изготовления мягкого мыла, которое легко растворяется в воде. Гидроксид магния в воде (также называемый молоком магнезии) используется как антацидное или слабительное средство.
Щелочь и основа
Истоки концепции
Термин «щелочь» происходит от арабского слова al qalīy , что означает «кальцинированная зола.«Эта растительная зола рассматривалась как обладающая такими свойствами, как способность обращать действие кислот и обладающая моющими свойствами. Таким образом, щелочь изначально считалась антитезой кислоты. Образование солей в результате реакции кислоты и щелочи привело к к мнению, что соли могут быть получены из двух компонентов противоположной природы.
Однако не все некислотные компоненты обладают щелочными свойствами. Примерами являются оксиды и гидроксиды тяжелых металлов. Так родилось понятие «база».Эта концепция была впервые введена французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, которые в то время были в основном летучими жидкостями, такими как уксусная кислота, превращались в твердые соли только в сочетании с определенными веществами. Эти вещества сформировали бетонную основу , для соли, [1], и отсюда и название.
Путаница между основанием и щелочью
Термины «основание» и «щелочь» часто используются взаимозаменяемо, поскольку наиболее распространенными основаниями являются щелочи.Обычно говорят об «измерении щелочности почвы», когда на самом деле имеется в виду измерение pH (основного свойства). Точно так же основания, не являющиеся щелочами, такие как аммиак, иногда ошибочно называют щелочными.
Обратите внимание, что не все или даже большинство солей, образованных щелочными металлами, являются щелочными; это обозначение применяется только к тем солям, которые являются основными.
В то время как большинство электроположительных оксидов металлов являются основными, только растворимые оксиды щелочных и щелочноземельных металлов можно правильно назвать щелочами.
Это определение щелочи как основной соли щелочного или щелочноземельного металла действительно является наиболее распространенным, исходя из словарных определений, [2] , однако, существуют противоречивые определения термина щелочь. Это включает:
- Любая водорастворимая основа. [3] Alkali, Farlex, 2008. Получено 8 апреля 2008 г. Это более точно называется основанием Аррениуса.
- Раствор основы в воде. [4]
Определения кислот и оснований
Кислоты и основания образуют дополнительные пары, поэтому их определения следует рассматривать вместе.Есть три общие группы определений: определения Аррениуса , Бронстеда-Лоури и Льюиса , в порядке возрастания общности.
- Аррениус : Согласно этому определению, кислота — это вещество, которое увеличивает концентрацию иона гидроксония (H 3 O + ) при растворении в воде, а основания — это вещества, увеличивающие концентрацию гидроксид-ионов ( ОН —). Это определение ограничивает кислоты и основания веществами, которые могут растворяться в воде.Около 1800 года многие французские химики, в том числе Антуан Лавуазье, ошибочно полагали, что все кислоты содержат кислород. Действительно, современное немецкое слово для обозначения кислорода — Sauerstoff (букв. Кислое вещество). Английские химики, в том числе сэр Хэмфри Дэви, в то же время считали, что все кислоты содержат водород. Шведский химик Сванте Аррениус использовал это убеждение, чтобы разработать определение кислоты.
- Brønsted-Lowry : Согласно этому определению, кислота является донором протона (ядро водорода), а основание — акцептором протона (ядро водорода).Говорят, что кислота диссоциирует после передачи протона.
 Кислота и соответствующее основание называются сопряженными парами кислота-основание. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, которых нет в определении Аррениуса.
Кислота и соответствующее основание называются сопряженными парами кислота-основание. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, которых нет в определении Аррениуса. - Льюис : Согласно этому определению, кислота является акцептором электронной пары, а основание — донором электронной пары. (Их часто называют «кислоты Льюиса [5] » и «основания Льюиса [6] », и в органической химии они являются электрофилами [7] и нуклеофилами [8] , соответственно; Lewis основания также являются лигандами в координационной химии.) Кислоты Льюиса включают вещества без переносимых протонов (например, H + ионы водорода), такие как хлорид железа (III), и, следовательно, определение кислоты Льюиса имеет более широкое применение, чем определение Бренстеда-Лоури. Определение Льюиса также можно объяснить с помощью теории молекулярных орбиталей. В общем, кислота может получить пару электронов на своей самой низкой незанятой орбитали (НСМО) с самой высокой занятой орбитали (ВЗМО) основания. То есть HOMO из основания и LUMO из кислоты объединяются в связывающую молекулярную орбиталь.Это определение разработал Гилберт Н. Льюис.
Общая недвижимость
Некоторые общие свойства баз включают:
- Вкус : Горький вкус (в отличие от кислого вкуса кислот и сладости альдегидов и кетонов)
- Touch : Склизкие или мыльные ощущения на пальцах
- Реакционная способность : Каустик [9] на органических веществах, бурно реагирует с кислотными или восстанавливаемыми веществами
- Электропроводность : Водные растворы или расплавленные основания диссоциируют на ионы и проводят электричество
- Лакмусовая бумажка : Основа становится красной лакмусовой бумажкой синей.{-}] \ over [BH]}}
Константа равновесия Kb также называется базовой константой ионизации. Это относится к реакции, в которой основание образует сопряженную кислоту путем удаления иона H + из воды.
Это относится к реакции, в которой основание образует сопряженную кислоту путем удаления иона H + из воды.pH (нечистой) воды является мерой ее кислотности. В чистой воде примерно одна из десяти миллионов молекул диссоциирует на ионы гидроксония (H 3 O + ) и ионы гидроксида (OH —) в соответствии со следующим уравнением:
- 2H 2 O (l) ⇌ H 3 O + (водн.) + OH — (водн.)
Основание принимает (удаляет) ионы гидроксония [10] (H 3 O + ) из раствора или отдает в раствор гидроксид-ионы [11] (OH — ).Оба действия снизят концентрацию ионов гидроксония и, таким образом, увеличат pH. Напротив, кислота отдает ионы H 3 O + раствору или принимает OH —, тем самым понижая pH.
Например, если 1 моль гидроксида натрия (40 г) растворяется в 1 литре воды, концентрация гидроксид-ионов становится [OH — ] = 1 моль / л. Следовательно, [H + ] = 10 -14 моль / л, а pH = -log 10 -14 = 14.
Константа основности или pK b является мерой основности и связана с pKa простым соотношением pK a + pK b = 14.
Базовая прочность
A «Сильное основание» — это соединение, которое полностью гидролизует, депротонируя кислоты в кислотно-основной реакции, следовательно, повышая pH раствора до 14. Соединения с pH более чем примерно 13 называются сильными основаниями. Сильные основания, такие как сильные кислоты, атакуют живые ткани и вызывают серьезные ожоги. Они по-другому реагируют на кожу, чем кислоты, в то время как сильные кислоты вызывают коррозию, мы говорим, что сильные основания являются едкими. Обычными примерами сильных оснований являются гидроксиды щелочных и щелочноземельных металлов, таких как NaOH и Ca (OH) 2 .
 Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — особый класс сильных оснований с плохой нуклеофильностью.
Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — особый класс сильных оснований с плохой нуклеофильностью.Примеры сильных оснований (гидроксидных соединений) по нисходящей силе:
- Гидроксид калия (КОН)
- Гидроксид бария (Ba (OH) 2 )
- Гидроксид цезия (CsOH)
- Гидроксид натрия (NaOH)
- Гидроксид стронция (Sr (OH) 2 )
- Гидроксид кальция (Ca (OH) 2 )
- Гидроксид лития (LiOH)
- Гидроксид рубидия (RbOH)
Катионы этих сильных оснований входят в группы 1 и 2 периодической таблицы (щелочные и щелочноземельные металлы).
Еще более сильными основаниями являются:
- Натрия гидрид (NaH)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Амид натрия (NaNH 2 )
A «Слабое основание» — это вещество, которое не полностью ионизируется в растворе. Когда основание ионизируется, оно забирает ион водорода из окружающей воды, оставляя после себя ион ОН-. Слабые основания имеют более высокую концентрацию H + , чем сильные основания. Слабые основания существуют в химическом равновесии так же, как и слабые кислоты.Константа ионизации основания K b указывает на прочность основания. Большие K b s относятся к более прочным основаниям. PH основания больше 7 (где 7 — нейтральное число; ниже 7 — кислота), обычно до 14. Типичным примером слабого основания является аммиак, который используется для очистки.Примеры слабых оснований:
- Аланин (C 3 H 5 O 2 NH 2 )
- Аммиак (вода) (NH 3 (NH 4 OH))
- Диметиламин ((CH 3 ) 2 NH)
- Этиламин (C 2 H 5 NH 2 )
- Глицин (C 2 H 3 O 2 NH 2 )
- Гидразин (N 2 H 4 )
- Метиламин (CH 3 NH 2 )
- Триметиламин ((CH 3 ) 3 N)
Кислотно-щелочная нейтрализация
Основания можно рассматривать как химическую противоположность кислот.
 Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания снижают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания снижают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.Положительный ион соли происходит от основания, а отрицательный ион — от кислоты. Если рассматривать гидроксид металла в качестве основания, то общая реакция выглядит так:
- HX (водн.) + MOH (водн.) → MX (водн.) + HOH (л)
- кислотно-основная соленая вода
Соли сильных оснований и сильных кислотСильная кислота HCl (соляная кислота) реагирует с сильным основанием NaOH (гидроксид натрия) с образованием NaCl (соль = хлорид натрия) и воды.Если количества кислоты и основания находятся в правильном стехиометрическом соотношении, тогда реакция подвергнется полной нейтрализации, при которой кислота и основание потеряют свои соответствующие свойства.
- HCL (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
- сильная сильная соленая вода
- кислотное основание
соли сильных оснований и слабых кислотыСильное основание NaOH (гидроксид натрия) добавляют к слабой кислоте CH 3 COOH (уксусная кислота) в 1 л раствора, образуя NaCH 3 COO (ацетат натрия) и воду.
- CH 3 COOH (водн.) + NaOH (водн.) → NaCH 3 COO (водн.) + H 2 O (л)
- слабая соленая вода
- кислотное основание
Соли слабых оснований и сильных кислотСлабые основания реагируют с сильными кислотами с образованием кислых солевых растворов. Конъюгированная кислота слабого основания определяет его pH. Например, NH 3 (аммиак) добавляют к HCl (соляной кислоте) с образованием NH 4 Cl (хлорид аммония).

- NH 3 (водн.) + HCl (водн.) → NH 4 Cl (водн.)
- слабая сильная соль
- основная кислота
Как только соль образуется, она вступает в реакцию с водой , в результате чего получается слабокислый раствор.
Соли слабых оснований и слабых кислотСолевые растворы, содержащие кислотные катионы и основные анионы, такие как NH 4 F (фторид аммония), имеют две возможные реакции:
- NH 4 + (водн.) + H 2 O (л) ↔ H 3 O + (водн.) + NH 3 (водн.) K a (NH 4 + ) = 5.6 x 10-10
- F — (водн.) + H 2 O (л) ↔ HF (водн.) + OH — (водн.) K b (F —) = 1,4 x 10-11
Поскольку K a (NH 4 + )> K b (F — ), реакция аммиака с водой более благоприятна. Следовательно, полученный раствор слабокислый.
Щелочи
Щелочные соли
Большинство основных солей являются щелочными солями, распространенными примерами которых являются:
- гидроксид натрия (часто называемый «едкий натр»)
- гидроксид калия (обычно называемый «поташ»)
- щелок (общий термин для любого из двух предыдущих или даже для смеси)
- Карбонат кальция (иногда называемый «свободная известь») Гидроксид магния
- является примером атипичной щелочи: это слабое основание (не может быть обнаружено фенолфталеином) и имеет низкую растворимость в воде.
Щелочная почва
Почва со значением pH выше 7,4 обычно называется щелочной. Это свойство почвы может возникнуть естественным образом из-за присутствия солей щелочных металлов. Хотя некоторые растения предпочитают слегка щелочную почву (включая овощи, такие как капуста, и корм, например, буйволовая трава), большинство растений предпочитают умеренно кислую почву (pH от 6,0 до 6,8), и щелочные почвы могут вызывать проблемы.

Щелочные озера
В щелочных озерах (разновидность соленых озер) испарение концентрирует встречающиеся в природе щелочные соли, часто образуя корку слабощелочной соли на большой площади.
Примеры щелочных озер:
Щелочность негидроксидов
Как карбонат натрия, так и аммиак являются основаниями, хотя ни одно из этих веществ не содержит групп ОН — . Это потому, что оба соединения принимают H + при растворении в воде:
- Na 2 CO 3 + H 2 O → 2 Na + + HCO 3 — + OH —
- NH 3 + H 2 O → NH 4 + + OH —
Основания как гетерогенные катализаторы
Основные вещества могут использоваться как нерастворимые гетерогенные катализаторы химических реакций.Примерами являются оксиды металлов, такие как оксид магния, оксид кальция и оксид бария, а также фторид калия на оксиде алюминия и некоторые цеолиты. Многие переходные металлы являются хорошими катализаторами, многие из которых образуют основные вещества. Основные катализаторы использовались для гидрирования, миграции двойных связей, восстановления Меервейна-Понндорфа-Верли, реакции Михаэля и многих других реакций.
Практические основы химии
Базы могут использоваться не только в промышленности, но и дома.Антациды используются для нейтрализации кислотности желудка; садовники используют основы, такие как лайм (CaO), чтобы сделать почву более простой. Мягкие основы используются для очистки всего: от посуды и одежды до транспортных средств и домашних собак.
Нейтрализует кислотность желудка
Антацид — это основа, которая используется для нейтрализации избытка желудочной кислоты. Рекомендуемая доза — это количество основания, необходимое для нейтрализации , , но не всей желудочной кислоты.
Кислотно-основной химический состав некоторых антацидов:
Соединение Химическая формула Химическая реакция Гидроксид алюминия Al (OH) 3 Al (OH) 3 (т.  ) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)
) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)Карбонат кальция CaCO 3 CaCO 3 (т.) + 2 HCl (водн.) ——> CaCl 2 (водн.) + H 2 O (л) + CO 2 (г) Карбонат магния MgCO 3 MgCO 3 (т.) + 2 HCl (водн.) ——> MgCl 2 (водн.) + H 2 O (л) + CO 2 (г) Гидроксид магния Мг (OH) 2 Mg (OH) 2 (т.) + 2 HCl (водн.) ——> MgCl 2 (водн.) + 2 H 2 O (л) Бикарбонат натрия NaHCO 3 NaHCO 3 (водн.) + HCl (водн.) ——> NaCl (водн.) + H 2 O (l) + CO 2 (g) Бытовые чистящие средства
Большинство чистящих средств, таких как средства для мытья посуды, чистящие порошки, средства для стирки и чистящие средства для духовки, являются простыми.Много десятилетий назад домашнее щелочное мыло использовалось для чистки одежды и кожи людей. Самое близкое к щелочному мылу, которое мы видим сегодня, — это средство для мытья посуды. Для действительно сложных работ по уборке дома требуются химически агрессивные чистящие средства. Для избавления от грязи, жира или пятен используются чистящие средства высокой степени очистки. Очистители слива и духовки находятся на другом конце спектра pH, имея pH 12 или выше. Обычно они содержат сильное основание, такое как NaOH, которое реагирует с жирами и жиром с образованием растворимого мыла.Все базовые растворы, как в лаборатории, так и дома, опасны, и с ними всегда следует обращаться с осторожностью. [12]
См. Также
- Теории кислотно-основных реакций
- Кислота
Банкноты
- ↑ Уильям Б. Дженсен, «Происхождение терминологической базы», , Журнал химического образования, , 1130 83 (8) (август 2006 г.
 ).
). - ↑ Щелочь, Лексико Паблишинг Груп, ООО. Проверено 8 апреля 2008 года.
- ↑ Щелочь, Тискали, 2008.Проверено 8 апреля 2008 года.
- ↑ Кислоты, основания и соли, КрыссТал, 2005. Проверено 8 апреля 2008 г.
- ↑ Вещество, которое может принимать пару электронов для образования новой связи.
- ↑ Вещество, которое может отдавать пару электронов для образования новой связи.
- ↑ Химическое соединение или группа, которые притягиваются к электронам и склонны принимать электроны.
- ↑ Химическое соединение или группа, которая притягивается к ядрам и имеет тенденцию отдавать или делиться электронами.
- ↑ Способен гореть, разъедать, растворять или разъедать химическим действием.
- ↑ Ион гидратированного водорода, h4O + . Также называется ион гидроксония.
- ↑ Ион ОН — , характерный для основных гидроксидов. Также называется гидроксил-ион.
- ↑ Дж. У. Мур, К. Л. Станицки и П. К. Юрс, 2002, Chemistry The Molecular Science , New York: Harcourt College.
Список литературы
- Браун, Теодор Э., Х. Юджин Лемей и Брюс Э. Бурстен. Химия: Центральная наука (10-е издание).Река Аппер Сэдл, Нью-Джерси: Prentice Hall, 2005. ISBN 0131096869
- Корвин, К. Х. Введение в химические концепции и связи (3-е изд.). Река Аппер Сэдл, Нью-Джерси: Прентис-Холл, 2001. ISBN 0130874701
- McMurry, J., and R.C. Fay. Химия (4-е изд.). Река Аппер Сэдл, Нью-Джерси: Прентис-Холл, 2004. ISBN 0131402080
- Moore, J. W., C. L. Stanitski, and P. C. Jurs. Химия Молекулярная наука . Нью-Йорк: Harcourt College, 2002.ISBN 0030320119
- Oxlade, Крис. Кислоты и основания (Химические вещества в действии). Библиотека Heinemann, 2002. ISBN 1588101940
Внешние ссылки
Все ссылки получены 13 мая 2016 г.
- CurTiPot — диаграммы кислотно-основного равновесия, расчет pH, моделирование и анализ кривых титрования — бесплатное ПО
Кредиты
New World Encyclopedia Писатели и редакторы переписали и завершили статью Wikipedia в соответствии со стандартами New World Encyclopedia .
 Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Разница между щелочью и щелочью
Введение
Концепция кислот и оснований возникла много веков назад. Первоначально они были классифицированы на основе их вкуса, то есть кислотный вкус кислый, и поэтому их название (латинское слово acidus, что означало кислый), тогда как основания горькие. Научная классификация кислот и оснований впервые была дана Аррениусом. Однако со временем определение изменилось, чтобы обобщить и включить все кислоты и основания в одно определение соответственно.Щелочи — это только основания, но их можно растворить в воде. В этой статье мы сосредоточимся на основаниях и щелочах.
Что такое база?
Существует 3 разных определения базы, и каждое из них определяет базу по-своему. Эти 3 определения основания следующие:
Концепция Аррениуса: Любое соединение, которое выделяет ионы ОН- в своем водном растворе, называется основанием. Это определение охватывает все гидроксиды щелочных металлов и основания щелочноземельных металлов, такие как NaOH, Ca (OH) 2 и т. Д.Это простейшее определение базы.
 Обычно основания — это соединения, которые реагируют с кислотами с образованием соли. Это определение охватывает некоторые основы, но не учитывает многие. Итак, другие определения оснований были даны разными учеными.
Обычно основания — это соединения, которые реагируют с кислотами с образованием соли. Это определение охватывает некоторые основы, но не учитывает многие. Итак, другие определения оснований были даны разными учеными.Концепция Бренстеда Лоури: любое соединение, способное принимать протон, то есть ион H +, называется основанием. Согласно этому определению, даже h3O может действовать как основание, поскольку он может приобретать протон с образованием иона гидроксония, то есть иона h4O +. Это определение охватывает большинство баз, но все же оставляет некоторые из них, потому что не все базы извлекают H +.AlCl3 действует как кислота Льюиса, но не содержит H +. Итак, основания, которые реагируют с такими кислотами, не могут быть объяснены этим определением. Итак, другое определение базы было дано Льюисом.
Концепция Льюиса: любое соединение, которое может отдавать неподеленную пару или может отдавать пару электронов, называется основанием. Например: Nh4 — база Льюиса. У него есть одинокая пара, которую он может пожертвовать. Основание Льюиса обычно извлекает протоны и становится стабильным, например, Nh4, который приобретает протон с образованием Nh5 +.
Итак, согласно этому определению любое соединение, ион или элемент, которые могут отдавать пару электронов другим частицам, могут действовать как основание. Это может быть CuO, ZnO. Это более общее определение. NaOH и КОН дают ОН-, который может отдавать пару электронов. Таким образом, концепция Льюиса охватывает большинство аспектов базы.
Все эти определения баз полезны в зависимости от ситуации. Любое соединение, которое следует любому из 3 определений, может действовать как основание; Итак, эти 3 определения включают все необходимые критерии для определения базы.
Основания реагируют с кислотами с образованием соли и / или h3O. Пример NaOH реагирует с HCl с образованием NaCl и воды.
 Nh4 реагирует с HCl с образованием Nh5Cl.
Nh4 реагирует с HCl с образованием Nh5Cl.Базы Bronsted Lowry и Lewis не содержат ОН- напрямую; вместо этого, будучи растворенными в воде (протонном растворителе), они поглощают H + из воды, тем самым косвенно высвобождая или поставляя OH.
Что такое щелочь?
Щелочи — водорастворимые основания. Другими словами, основания, которые могут растворяться в воде с образованием ионов ОН-, называются щелочью.
Щелочи похожи на подмножество оснований. Итак, мы можем сказать, что «Все щелочи — это основания, но не все основания — щелочи». Термин «щелочь» в основном используется для гидроксидов щелочных металлов или щелочноземельных металлов, поскольку они легко растворяются в воде с образованием ионов ОН-.
Щелочь становится красной лакмусовой бумажкой и становится горькой на вкус. И pH раствора щелочи больше 7.
Некоторые примеры щелочи:
NaOH, KOH, Be (OH) 2, Ca (OH) 2
Гидроксид натрия (NaOH) — каустическая сода
Калий гидроксид (KOH) — едкий калий
Гидроксид кальция, {Ca (OH) 2} — известковая вода
Разница между щелочами и основаниями
В целом, люди используют эти два термина как синонимы, но между ними есть основное различие .Щелочи — это гидроксиды щелочных и щелочноземельных металлов. Они не включают Nh4. Итак, согласно этому определению, Nh4 не является щелочью, хотя и является основанием. Точно так же есть другое определение, которое звучит так: основания, которые растворяются в воде с образованием ОН-, являются щелочами. Это определение также исключает Nh4.
Итак, разница заключается в том, что щелочь похожа на подмножество оснований. Вот почему мы можем сказать, что все щелочи являются основаниями, но не все основания являются щелочами.
Основа и щелочь
На рисунке выше показано то же самое.
 CuO и ZnO, оба являются основаниями, но не являются щелочами, поскольку сами по себе не выделяют ОН- в воде, в отличие от NaOH, КОН, которые выделяют ОН- при растворении в воде.
CuO и ZnO, оба являются основаниями, но не являются щелочами, поскольку сами по себе не выделяют ОН- в воде, в отличие от NaOH, КОН, которые выделяют ОН- при растворении в воде.Во многих органических реакциях используются особенно щелочи, потому что ОН-, поставляемый щелочью, также действует как сильный нуклеофил. Итак, щелочи предпочтительнее, когда нам нужны нуклеофил и основание одновременно. Однако для некоторых реакций требуются специальные основания, которые не действуют как нуклеофилы, и в таких случаях используются основания Льюиса, такие как Nh4.
Правильная разница между щелочью и основанием наблюдается в органических реакциях, потому что большинство реакций проводится в среде растворителя, и в зависимости от необходимости реакции мы используем основание или щелочь.
Одно важное различие между основанием и щелочью состоит в том, что щелочи — это в основном ионные соединения, которые могут диссоциировать при растворении в полярном протонном растворителе, но основания могут быть или не быть ионными соединениями. CuO, ZnO, Nh4 — все это ковалентные соединения, которые действуют как основание.NaOH и KOH являются важными щелочами и имеют ионную природу.
Базы | Компоненты для выпечки | BAKERpedia
Происхождение
Основания многочисленны в природе. Их также можно получить химическим синтезом. Отложения бикарбоната натрия (пищевая сода, NaHCO 3 ) естественным образом встречаются в бассейнах озера Сирлс, Калифорния и Колорадо, в бассейнах реки Грин-Ривер, а также в Турции, Мексике и Африке, где они добываются с использованием технологий добычи угля. Синтетически бикарбонат натрия можно производить различными способами.Самый известный из них включает двухстадийную реакцию гидроксида натрия с диоксидом углерода:
NaOH + CO 2 → Na 2 CO 3 + H 2 O
Na 2 CO 3 + CO 2 + H 2 O → 2 NaHCO 3
Гидроксид натрия (щелок, NaOH) можно получить, главным образом, растворением оксида натрия (Na 2 O) в воде.

Na 2 O (твердый) + H 2 O (жидкий) → 2 NaOH (водный)
Другой метод получения NaOH — электролиз хлорида натрия.
Функция
Слабое основание, такое как бикарбонат натрия, диссоциирует в воде с высвобождением нескольких гидроксильных ионов (-OH), в то время как сильное основание и щелочь, такие как NaOH, высвобождают почти все свои ионы -OH. Это отражается в pH 9,5 для бикарбоната натрия по сравнению с 14,0 для гидроксида натрия.
Основы являются жизненно важными компонентами систем химического разрыхления при выпечке. Их нейтрализующее значение, NV, указывает количество (г) основания, необходимое для нейтрализации 100 г заквашивающих кислот, таких как MCP, SAPP, SALP и т. Д., Для получения достаточного количества диоксида углерода для правильной закваски. 1
Аналогичным образом бикарбонат натрия реагирует с пахтой, сметаной, винной и другими кислотами с образованием диоксида углерода. Роль оснований (в частности, щелочей) в реакции Майяра также была продемонстрирована в создании неферментативных продуктов подрумянивания, которые придают уникальный цвет и вкус корочке хлеба и других термически обработанных пищевых продуктов. 2,3
Приложение
Основы широко используются в пищевой и хлебопекарной промышленности (хлеб, торты, быстрые хлебцы, кексы, выпечка, печенье и другие хлебобулочные изделия с химической закваской).Другие применения включают никстамализацию кукурузы, нейтрализацию какао-порошка для улучшения его цвета и вкуса (голландский процесс), консервирование оливок и нордических лютефисков, а также в китайских «веках яиц», среди других применений.
Для пищевой промышленности и производства напитков доступен широкий спектр основ, включая щелочи. В выпечке чаще всего используются бикарбонат натрия, бикарбонат калия и бикарбонат аммония.
В следующей таблице приведен список оснований, используемых в пищевых продуктах, с указанием их pH и функции:
База pH Функция Бикарбонат натрия 8.  4
4Разрыхлитель в выпечке, контроль pH Бикарбонат аммония 7,8 В плоской выпечке (печенье, крекеры) Бикарбонат калия 11,5 Закваска при выпечке Гидроксид натрия 14,0 Консервы оливки, никстамализация Аммиак 11,1 Источник азота для ферментации, регулировка pH Гидроксид кальция 12.4 Модификатор pH, рассол, осветлитель (сок сахарного тростника) Карбонат кальция (насыщенный) 9,4 Кондиционер для теста, питательные вещества для дрожжей Тринатрийфосфат 12,0 Регулятор кислотности морсов, сыра, мяса и т. Д. Бензоат натрия 8,0 Консервант в газированных напитках, заправках для салатов и т. Д. Постановление FDA
В соответствии с 21 CFR 184 «Прямые пищевые вещества, признанные в целом безопасными — GRAS», основы в их обычной кристаллической или порошковой форме, такие как бикарбонат аммония, бикарбонат натрия и калия, могут использоваться в качестве непосредственного пищевого ингредиента для человека в качестве закваски. и агенты, регулирующие pH, без каких-либо ограничений, кроме действующей надлежащей производственной практики (GMP). 4
Список литературы
- Миллер Р. Энциклопедия продуктов питания и здоровья «Leavening Agents», Elsevier Ltd., 2016, стр. 523–528.
- Веттер, Дж. Л. Энциклопедия «Leavening Agents» по пищевым наукам и питанию, Academic Press, Elsevier Ltd., 2016 г., стр. 3485–3490.
- Delcour, J.A., и Hoseney, R.C. «Химически дрожжевые продукты» Принципы науки и технологии зерновых, AACC International, Inc., 2010, стр. 177–181.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
 «21 CFR 184 — Пищевые вещества прямого действия признаны в целом безопасными». 1 апреля 2017 г., https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=184. По состоянию на 28 июля 2018 г.
«21 CFR 184 — Пищевые вещества прямого действия признаны в целом безопасными». 1 апреля 2017 г., https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=184. По состоянию на 28 июля 2018 г.
Значение и свойства оснований (щелочей)
Основания (щелочи)Кислоты и основания
Основания — это вещества, которые диссоциируют в воде с образованием отрицательных гидроксид-ионов (OH —). Примеры некоторых оснований, таких как гидроксид натрия (каустическая сода), NaOH, гидроксид кальция (известковая вода) и гидроксид калия ( КОН).
Свойства оснований (щелочей)Основания меняют цвет лакмусовой бумаги на синий из-за присутствия отрицательных гидроксид-ионов (OH — ). Водные растворы основ имеют горький вкус, а основания разрушают химические свойства кислот.
Основы кажутся скользкими и мыльными, поскольку они растворяют жирные кислоты и масла с вашей кожи, основы участвуют в производстве мыла. Растворимые в воде основы называются щелочами, а химическая формула всех щелочей заканчивается на (OH — ).
Основания проводят электрический ток. Это общее свойство, присущее солям, кислотам и основаниям. Соли сгруппированы вместе в категорию, называемую электролитами. Основания реагируют с маслами и жирами с образованием молекул мыла, и они имеют тенденцию к коррозии металлических поверхностей.
Сильные основания могут обжечь кожу, поэтому не следует прикасаться к основаниям и кислотам голыми руками, так как они оказывают разъедающее действие на кожу. Основания являются хорошими проводниками электричества и имеют более высокий уровень pH. чем 7.
Реакция между основанием и металлом образует соль и выделяет газообразный водород, и эта реакция может происходить только тогда, когда металл достаточно силен, чтобы вытеснить другой металл из его родительского компонента.

 Амфотерный гидроксид + кислота → соль + вода
Амфотерный гидроксид + кислота → соль + вода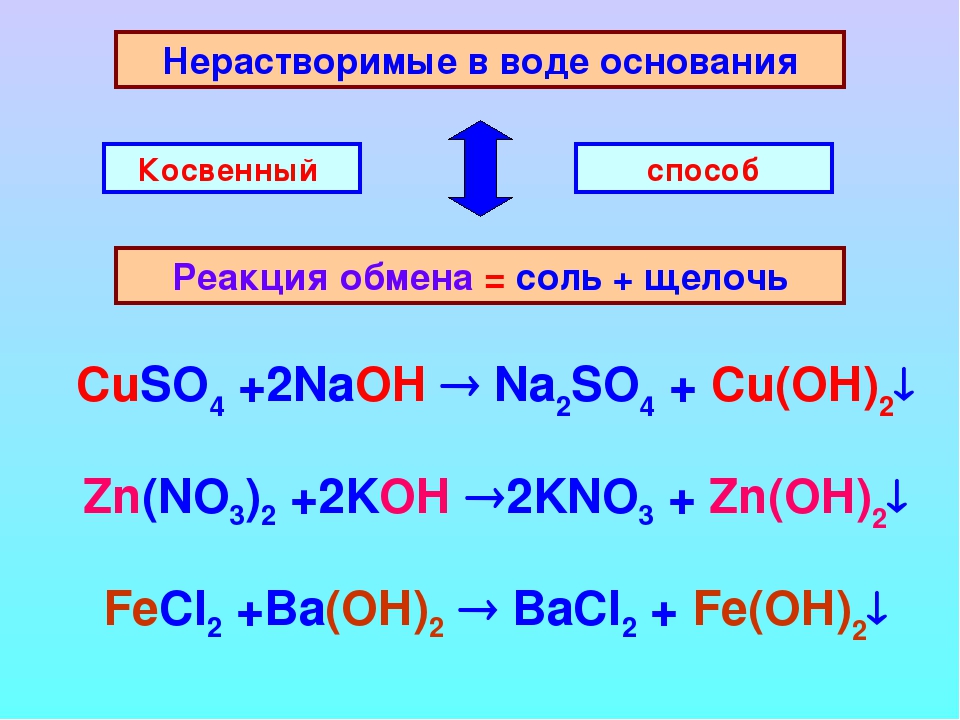 Кислота и соответствующее основание называются сопряженными парами кислота-основание. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, которых нет в определении Аррениуса.
Кислота и соответствующее основание называются сопряженными парами кислота-основание. Бренстед и Лоури сформулировали это определение, которое включает нерастворимые в воде вещества, которых нет в определении Аррениуса.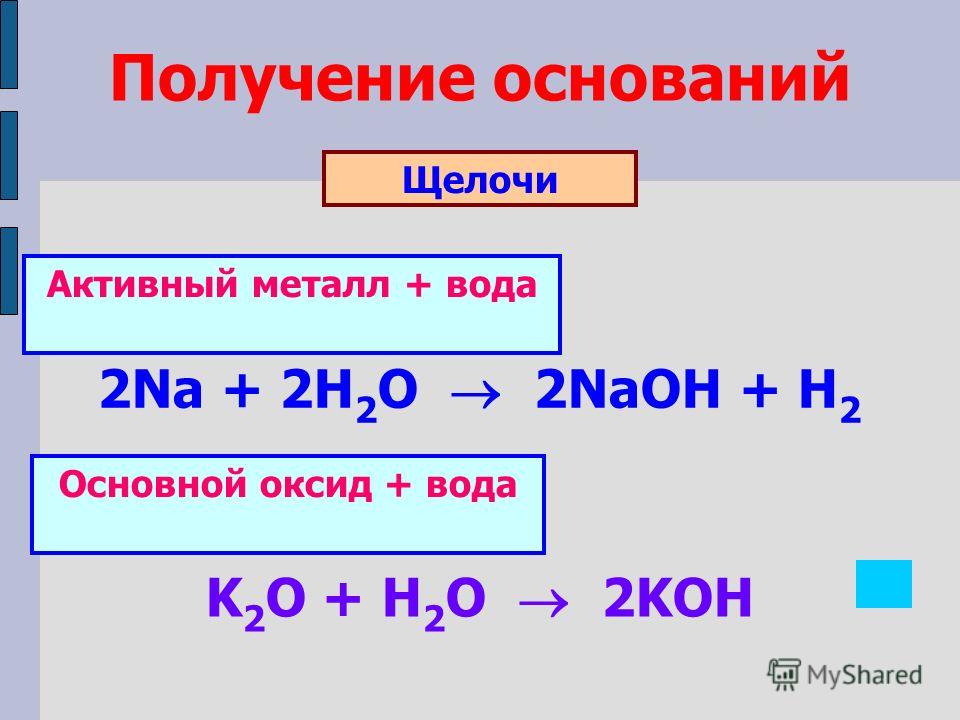 Это относится к реакции, в которой основание образует сопряженную кислоту путем удаления иона H + из воды.
Это относится к реакции, в которой основание образует сопряженную кислоту путем удаления иона H + из воды. Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — особый класс сильных оснований с плохой нуклеофильностью.
Очень сильные основания способны даже депротонировать очень слабокислые C-H-группы в отсутствие воды.
Супероснования — это класс особо основных соединений, а гарпунные основания — особый класс сильных оснований с плохой нуклеофильностью. Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания снижают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
Реакция между кислотой и основанием называется нейтрализацией. Основания и кислоты рассматриваются как противоположности, потому что действие кислоты заключается в увеличении концентрации иона гидроксония (H 3 O + ) в воде, тогда как основания снижают эту концентрацию. Основания реагируют с кислотами с образованием солей и воды.
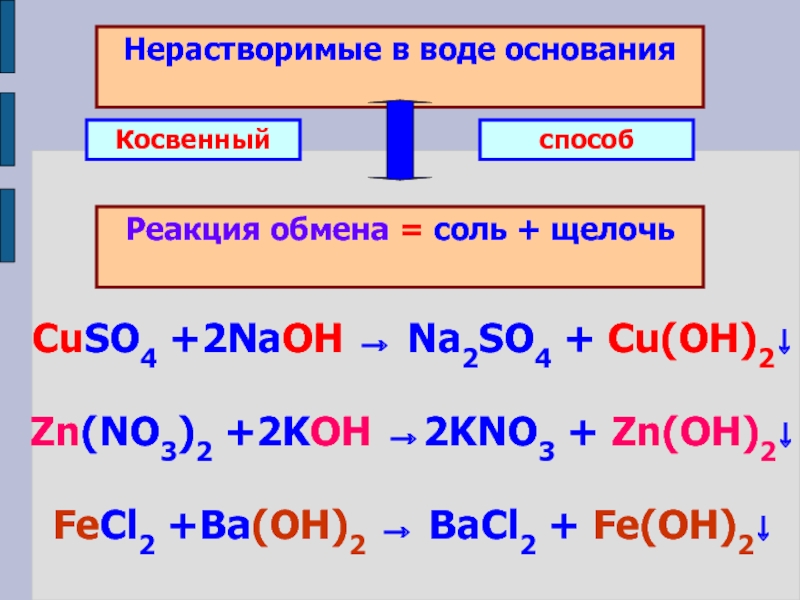
 ) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)
) + 3 HCl (водн.) ——> AlCl 3 (водн.) + 3 H 2 O (л)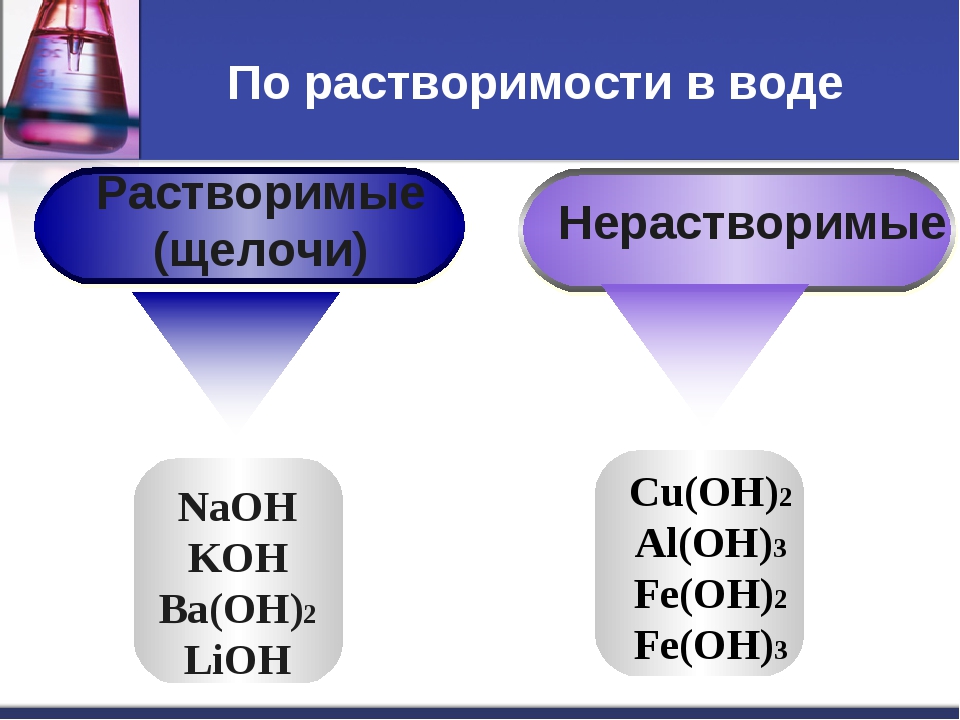 ).
). Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь: Обычно основания — это соединения, которые реагируют с кислотами с образованием соли. Это определение охватывает некоторые основы, но не учитывает многие. Итак, другие определения оснований были даны разными учеными.
Обычно основания — это соединения, которые реагируют с кислотами с образованием соли. Это определение охватывает некоторые основы, но не учитывает многие. Итак, другие определения оснований были даны разными учеными. Nh4 реагирует с HCl с образованием Nh5Cl.
Nh4 реагирует с HCl с образованием Nh5Cl. CuO и ZnO, оба являются основаниями, но не являются щелочами, поскольку сами по себе не выделяют ОН- в воде, в отличие от NaOH, КОН, которые выделяют ОН- при растворении в воде.
CuO и ZnO, оба являются основаниями, но не являются щелочами, поскольку сами по себе не выделяют ОН- в воде, в отличие от NaOH, КОН, которые выделяют ОН- при растворении в воде.
 4
4 «21 CFR 184 — Пищевые вещества прямого действия признаны в целом безопасными». 1 апреля 2017 г., https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=184. По состоянию на 28 июля 2018 г.
«21 CFR 184 — Пищевые вещества прямого действия признаны в целом безопасными». 1 апреля 2017 г., https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=184. По состоянию на 28 июля 2018 г.