Общая характеристика оксидов — урок. Химия, 8–9 класс.
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления \(–2\).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
h3O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
Рис. \(1\). Вода | Рис. \(2\). Пар | Рис. \(3\). Лёд |
CO2 — оксид углерода(\(IV\)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза.
Рис. \(4\). Фотосинтез
Оксид углерода(\(IV\)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
Рис. \(5\). Сухой лёд |
CO — оксид углерода(\(II\)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
Рис. \(6\). Горение газа | Рис. \(7\). Выхлопные газы |
Fe2O3 — оксид железа(\(III\)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
Рис. \(8\). Красный железняк |
SiO2 — оксид кремния(\(IV\)).
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
Рис. \(9\). Песок | Рис. \(10\). Кварц | Рис. \(11\). Горный хрусталь |
Классификация оксидов
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
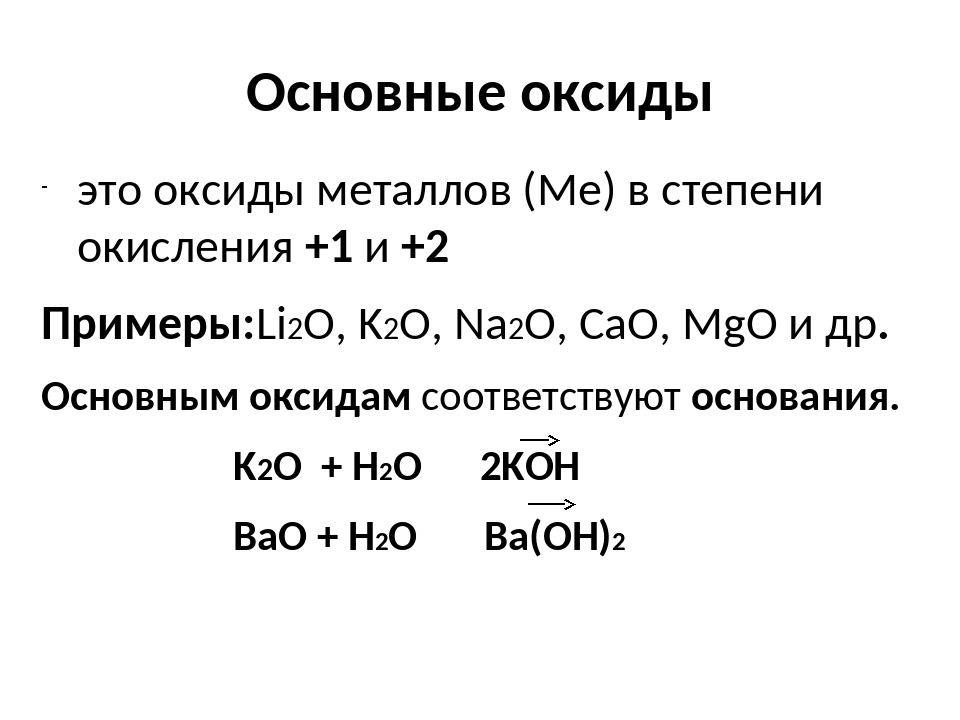
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: \(+1\) или \(+2\).оксид натрия Na2O, оксид меди(\(II\)) CuO.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO3, оксид азота(\(IV\)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+8\). Например, оксид хрома(\(VI\)) CrO3 и оксид марганца(\(VII\)) Mn2O7.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может проявлять валентность равную двум, трём, шести.
Амфотерными свойствами обладает именно оксид хрома(\(III\)) Cr2O3.
- Несолеобразующие оксиды.
Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях.
К ним относятся: оксид углерода(\(II\)) CO, оксид кремния(\(II\)) SiO ,оксид азота(\(I\)) N2O, оксид азота(\(II\)) NO.
Они не имеют кислотных гидроксидов, не вступают в реакции с образованием солей.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например: Na2O — оксид натрия, Al2O3 — оксид алюминия.Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu2O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe2O3 — оксид железа(\(III\)), Cl2O7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т. д.
Разница между кислотными и основными оксидами — Разница Между
Оксид — это любое химическое соединение, которое содержит один или несколько атомов кислорода. Оксиды могут быть кислотными или основными в зависимости от их химического состава, реакций и рН. Кислот
Кислот
Основное отличие — кислотные и основные оксиды
Оксид — это любое химическое соединение, которое содержит один или несколько атомов кислорода. Оксиды могут быть кислотными или основными в зависимости от их химического состава, реакций и рН. Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образуя основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий рН, тогда как основные оксиды имеют высокий рН. Однако основное различие между кислотными оксидами и основными оксидами состоит в том, что
Ключевые области покрыты
1. Что такое кислый оксид
— определение, химические свойства, неметаллические оксиды, примеры
2. Что такое основной оксид
— определение, химические свойства, оксиды металлов, примеры
3. В чем разница между кислотными и основными оксидами
В чем разница между кислотными и основными оксидами
— Сравнение основных различий
Основные термины: кислота, ангидриды кислот, оксид кислоты, основание, основные ангидриды, основной оксид, оксид неметалла, оксид металла, оксид, pH, соль
Что такое кислый оксид
Кислотные оксиды представляют собой соединения, которые могут образовывать кислотный раствор при растворении в воде. Кислотные оксиды образуются, когда неметалл реагирует с кислородом. Иногда кислые оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом. Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды подразделяются на ангидриды кислот, Это потому, что они производят кислотное соединение этого оксида при растворении в воде. Например, диоксид серы называют сернистым ангидридом, а триоксид серы называют серным ангидридом. Кислотные оксиды могут реагировать с основанием с образованием его соли.
Обычно кислые оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением оксидов, таких как диоксид кремния, которые имеют тенденцию образовывать гигантские молекулы. Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислый оксид растворяется в воде, он снижает рН пробы воды из-за образования Н+ ионов. Некоторыми распространенными примерами кислых оксидов являются СО2, П2О5НЕТ2, ТАК3, так далее.
Рисунок 1: SO3 представляет собой неметаллический оксид (кислый оксид)
Неметаллические оксиды
Неметаллические оксиды представляют собой оксидные соединения, образованные неметаллическими элементами. Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Неметаллические оксиды являются ковалентными соединениями, поскольку они разделяют электроны с атомами кислорода, образуя молекулы оксида.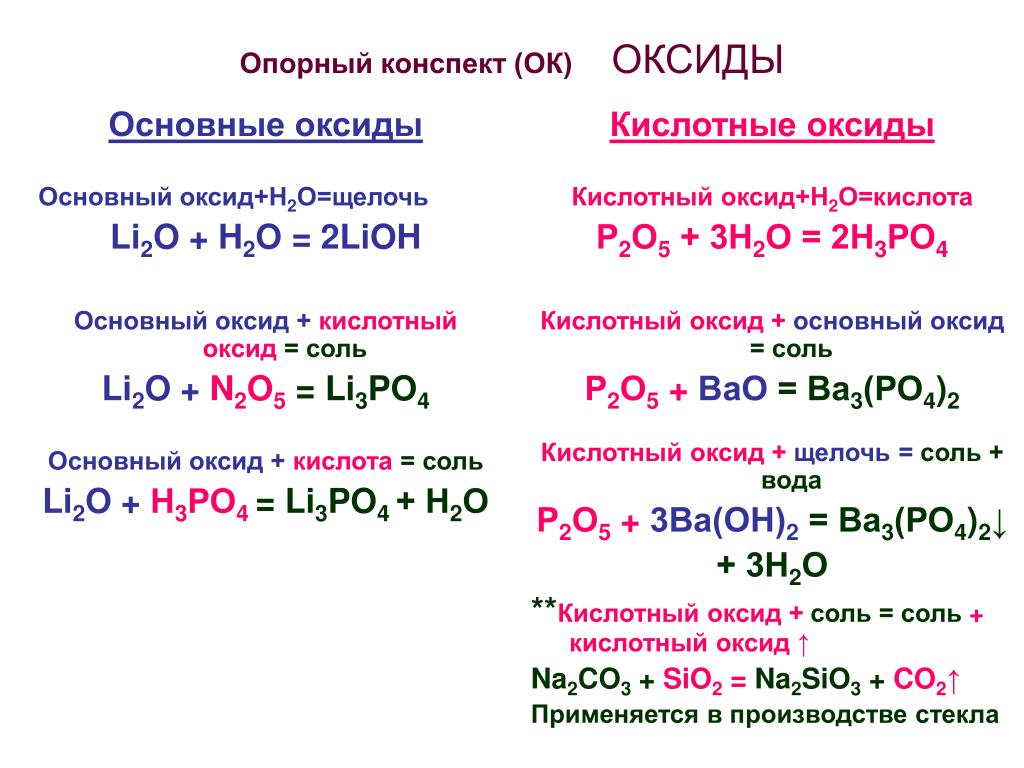 Большинство неметаллических оксидов дают кислоты после реакции с водой. Следовательно, неметаллические оксиды являются кислотными соединениями. Например, когда ТАК3 растворяется в воде, дает H2ТАК4 раствор, который очень кислый. Неметаллические оксиды реагируют с основаниями с образованием солей.
Большинство неметаллических оксидов дают кислоты после реакции с водой. Следовательно, неметаллические оксиды являются кислотными соединениями. Например, когда ТАК3 растворяется в воде, дает H2ТАК4 раствор, который очень кислый. Неметаллические оксиды реагируют с основаниями с образованием солей.
Что такое основной оксид
Основные оксиды, также называемые основные ангидридыявляются соединениями, которые могут образовывать основной раствор при растворении в воде. Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности между кислородом и металлами большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды активно реагируют с водой, образуя основные соединения. Эти оксиды реагируют с кислотами и образуют соль и воду. Когда основной оксид добавляют в воду, pH воды увеличивается из-за образования гидроксильных ионов (OH–). Некоторые примеры основных основных оксидов, Na2O, CaO, MgO и т. Д. Поэтому оксиды металлов в основном являются основными оксидами.
Некоторые примеры основных основных оксидов, Na2O, CaO, MgO и т. Д. Поэтому оксиды металлов в основном являются основными оксидами.
Рисунок 2: MgO является основным оксидом. Это оксид металла.
Оксиды металлов
Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода. Здесь степень окисления кислорода составляет -2, и это по существу анион, тогда как металл является катионом. Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют основные оксиды. Но металлы с высокими степенями окисления могут образовывать оксиды с ковалентной природой. Они более кислые, чем основные.
Количество атомов кислорода, которые связываются с ионом металла, зависит от степени окисления иона металла. Щелочные металлы образуют только одновалентные катионы. Следовательно, они образуют только М2Оксиды типа O (где М — ион металла, а О — анион оксида). Щелочноземельные металлы образуют двухвалентные катионы. Следовательно, они образуют оксиды типа МО. Эти соединения являются основными.
Щелочноземельные металлы образуют двухвалентные катионы. Следовательно, они образуют оксиды типа МО. Эти соединения являются основными.
Разница между кислотными и основными оксидами
Определение
Кислотные оксиды: Кислотные оксиды представляют собой соединения, которые могут образовывать кислотный раствор при растворении в воде.
Основные оксиды: Основные оксиды представляют собой соединения, которые могут образовывать основной раствор при растворении в воде.
формирование
Кислотные оксиды: Кислотные оксиды образуются, когда кислород реагирует с неметаллами.
Основные оксиды: Основные оксиды образуются, когда кислород реагирует с металлами.
Реакция с водой
Кислотные оксиды: Кислотные оксиды реагируют с водой, образуя кислотные соединения.
Основные оксиды: Основные оксиды реагируют с водой, образуя основные соединения.
Реакция с кислотами
Кислотные оксиды: Кислотные оксиды не вступают в реакцию с кислотами.
Основные оксиды: Основные оксиды реагируют с кислотами, образуя соль.
Реакция с основами
Кислотные оксиды: Кислотные оксиды реагируют с основаниями, образуя соль.
Основные оксиды: Основные оксиды не вступают в реакцию с основаниями.
облигации
Кислотные оксиды: Кислые оксиды имеют ковалентные связи.
Основные оксиды: Основные оксиды имеют ионные связи.
Влияние на рН
Кислотные оксиды: Когда кислые оксиды растворяются в воде, это снижает рН.
Основные оксиды: Растворение основных оксидов в воде вызывает повышение рН.
Другие имена
Кислотные оксиды: Кислотные оксиды также известны как ангидриды кислот.
Основные оксиды: Основные оксиды также называют основными ангидридами.
Заключение
Оксиды представляют собой соединения, имеющие по меньшей мере один атом кислорода, связанный с другим элементом. Этот элемент может быть металлическим или неметаллическим. Оксиды могут быть кислотными или основными в зависимости от их свойств. Если конкретный оксид может реагировать с кислотой, но не с основанием, его называют основным оксидом. Если оксид реагирует с основанием, но не с кислотами, это кислый оксид. Основное различие между кислотными и основными оксидами состоит в том, что кислые оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Ссылка:
1. «Кислотный оксид». Википедия, Фонд Викимедиа, 29 декабря 2017 г.,
Основные оксиды
1
H
1,008
1s
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Внеклассный урок — Основные оксиды
Основные оксиды
Основные оксиды – это оксиды, которым в качестве гидроксида соответствуют основания.
Основные оксиды образуют только металлы и, как правило, в степени окисления +1 и +2 (исключение: BeO, ZnO, SnO, PbO).
Na2O ⇒ NaOH
гидроксид натрия-
основный гидроксид
(основание)
CaO ⇒ Ca(OH)2
гидроксид кальция-
основный гидроксид
(основание)
Основные оксиды взаимодействуют:
1. С кислотами, образуя соль и воду:
С кислотами, образуя соль и воду:
Основный оксид + Кислота = Соль + Вода
Например:
MgO + 2HCl = MgCl2 + H2O.
В ионно-молекулярных уравнениях формулы оксидов записывают в молекулярном виде:
MgO + 2H+ + 2Cl– = Mg2+ + 2Cl– + H2O
MgO + 2H+ = Mg2+ + H2O
2. С кислотными оксидами, образуя соли:
Основный оксид + Кислотный оксид = Соль
Например:
CaO + N2O5 = Ca(NO3)2
В подобных уравнениях трудно составить формулу продукта реакции. Чтобы узнать, какая кислота соответствует данному оксиду, надо мысленно прибавить к кислотному оксиду воду и затем уже вывести формулу искомой кислоты:
N2O5 + (H2O) → H2N2O6
Если в полученной формуле все индексы четные, то их надо сократить на 2. В нашем случае выходит: HNO3. Соль этой кислоты и является продуктом реакции. Итак:
В нашем случае выходит: HNO3. Соль этой кислоты и является продуктом реакции. Итак:
2+ 2+ 2+ 2+ 2+
CaO + N2O5 = CaO + N2O5 + (H2O) = CaO + H2N2O6 = CaO + HNO3 = Ca(NO3)2–
3. С водой. Но с водой реагируют только оксиды, образованные щелочными (Li2O, Na2O, K2O и т.д) и щелочно-земельными металлами (CaO, SrO, BaO), так как продуктами этих реакций являются растворимые основания (щелочи).
Например:
CaO + H2O = Ca(OH)2.
Чтобы из формулы оксида вывести формулу соответствующего ему основания, воду можно записать в виде: H+ — OH – и показать, как один ион водорода H+ из молекулы воды соединяется с ионом кислорода из оксида CaO и образует гидроксид-ион OH –. Итак:
CaO + H2O = CaO + H+ — OH – = Ca(OH)2.
отношение к воде, кислотам и щелочам.
ПЛАН ОТВЕТА:
- Определение
- Классификация
- несолеобразующие
- солеобразующие
- основные
- кислотные
- амфотерные
- Химические свойства
- взаимодействие с водой
- взаимодействие с кислотами
- взаимодействие со щелочами
Оксиды – это сложные вещества, молекулы которых состоят из двух элементов, один из которых кислород, причём атомы кислорода не связаны друг с другом.
Все оксиды разделяют на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды не образуют солей в химических реакциях. К ним относятся: оксид азота(I), оксид азота(II), оксид кремния(IV).
Солеобразующие оксиды могут взаимодействовать с кислотами или щелочами с образованием солей. В зависимости от состава, а следовательно, и свойств они подразделяются на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которые при взаимодействии с кислотами образуют соль и воду. Они образованы элементами-металлами с валентностью 1 и 2. в качестве гидроксидов им соответствуют основания. К основным оксидам относятся оксид натрия, оксид кальция, оксид меди(), оксид железа().
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Они образованы элементами-неметаллами, например, оксид серы(IV),оксид серы(VI), оксид фосфора(V) и переходными элементами, проявляющими валентность V, VI, VII, например, оксид хрома(VI), оксид марганца(VII). В качестве гидроксида кислотным оксидам соответствуют кислоты.
В качестве гидроксида кислотным оксидам соответствуют кислоты.
Амфотерными оксидами называют оксиды, которые реагируют и с кислотами и со щелочами с образованием соли и воды. Они образованы переходными элементами. Например, оксид алюминия, оксид цинка.
Химические свойства:
Оксиды взаимодействуют с водой, если соответствующий им гидроксид растворим в воде.
При взаимодействии основного оксида с водой образуется щёлочь, например, при взаимодействии оксида натрия с водой образуется гидроксид натрия (щёлочь), а оксид меди(II) с водой не реагирует, т.к. ему соответствует нерастворимое основание.
При взаимодействии кислотного оксида с водой образуется кислота, например, при взаимодействии оксида серы(VI) с водой образуется серная кислота, а оксид кремния(IV) с водой не реагирует, т.к. кремниевая кислота нерастворима в воде.
Амфотерные оксиды с водой не реагируют, т. к. им соответствуют нерастворимые гидроксиды.
к. им соответствуют нерастворимые гидроксиды.
Основные оксиды взаимодействуют с растворимыми кислотами с образованием соли и воды, например, при взаимодействии оксида меди(II) с соляной кислотой образуются хлорид меди(II) и вода.
Все кислотные оксиды взаимодействуют со щелочами с образованием соли и воды, причём образуется соль той кислоты, которая соответствует данному оксиду. Например, при взаимодействии оксида углерода(IV) с гидроксидом кальция образуются карбонат кальция и вода.
Амфотерные оксиды могут реагировать и с кислотами и со щелочами. Например, оксид цинка при взаимодействии с соляной кислотой образует хлорид цинка и воду, а при взаимодействии с гидроксидом натрия – цинкат натрия и воду.
Na2O + H2O = 2NaOH
CuO + H2O ?
SO3 + H2O = H2SO4
SiO2 + H2O ?
CuO + 2HCl = CuCl2 + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Дополнительно знать:
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
P2O5 + 3H2O = 2H3РО4
3NO2 + H2O = 2HNO3 + NO
Формула основного оксида в химии
Определение и формула основного оксида
К числу оксидов относятся соединения элементов с кислородом, в которых степень окисления кислорода равна (-2). Существуют также пероксиды, содержащие ионы О22- (Na2O2, BaO2) и О2— (KO2).
Существуют также пероксиды, содержащие ионы О22- (Na2O2, BaO2) и О2— (KO2).
Различают основные, кислотные и амфотерные оксиды. Основные (или солеобразные/солеобразующие) оксиды характеризуются ионной или сильно полярной химической связью (Na2O, CaO и др.). При взаимодействии с водой образуют гидроксиды – основания, а при взаимодействии с с кислотами (или кислотными оксидами) — соли:
Na2O + H2O = 2NaOH;
Na2O + CO2 = Na2CO3;
Na2O + 2HCl = 2NaCl + H2O.
Основные оксиды – это оксиды металлов IA (Li, Na, K ит.д.), IIA (Mg, Ca, Ba идр.) групп Периодической таблицы Д.И. Менделеева, а также оксиды переходных металлов в низших степенях окисления (MnO, SrO).
Для того, чтобы составить формулу основного оксида необходимо соблюдать следующую последовательность действий (рассмотрим подробно на примере оксида железа (III)):
- Изображаем химические знаки элементов, входящих в состав оксида
FeO
- Проставляем над знаком каждого элемента валентность римской цифрой:
FeIIIOII
- Находим наименьшее общее кратное чисел единиц валентностей (II × III) = 6
- Делим наименьшее общее кратное на число единиц валентности каждого элемента в отдельности (полученные частные и будут индексами в формуле)
6 : 2 = 3;
6 : 3 = 2;
Fe2O3.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Оксиды — получение и свойства
Хотелось бы дать возможно более
простое определение оксида — это
соединение элемента с кислородом. Но
существуют кислоты и соли. Рассмотрим
соединения h3O2 и BaO2. Перекись
водорода является слабой кислотой
(она диссоциирует в воде давая ионы
водорода и анионы HO2- и O2-2).
Пероксид бария — это бариевая соль
перекиси водорода. У молекул h3O2 и
BaO2 есть кислородный мостик -O-O-,
поэтому степень окисления кислорода в
этих соединениях -1.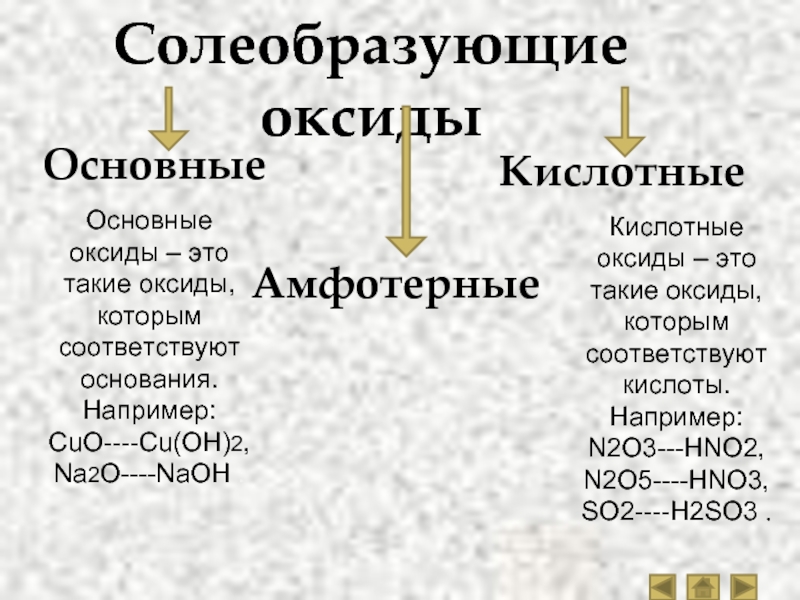 В неорганической
химии обычно пероксиды к классу
оксидов не относят и поэтому
необходимо уточнить определение
оксида таким образом, чтобы
пероксиды в этот класс не попадали.
Фтор самый активный неметалл и вслед
за ним идет кислород. Формальная
степень окисления атома кислорода в
оксиде фтора +2, а во всех других
оксидах -2. Следовательно, оксидами
называют соединения элементов с
кислородом, в которых кислород
проявляет формальную степень
окисления равную -2 (за исключением
оксида фтора, где она равна +2).
В неорганической
химии обычно пероксиды к классу
оксидов не относят и поэтому
необходимо уточнить определение
оксида таким образом, чтобы
пероксиды в этот класс не попадали.
Фтор самый активный неметалл и вслед
за ним идет кислород. Формальная
степень окисления атома кислорода в
оксиде фтора +2, а во всех других
оксидах -2. Следовательно, оксидами
называют соединения элементов с
кислородом, в которых кислород
проявляет формальную степень
окисления равную -2 (за исключением
оксида фтора, где она равна +2).
Один и тот же химический элемент
может образовывать с кислородом не
один оксид, а несколько, например, у
азота известны оксиды N2O, NO, N2O3,
NO2, N2O4, N2O5. Во всех этих оксидах
степень окисления у кислорода -2, а у
азота, соответственно, +1, +2, +3, +4,
+4 и +5. У двух оксидов: NO2 и N2O4
степен окисления азота и кислорода
совпадают. В названии веществ
отражается история развития химии
как науки. В период накопления
экспериментальных данных в химии
названия веществ отражали либо
способ их получения (жженая
магнезия: MgCO3 ® MgO + CO2), либо
характер воздействия на человека
(N2O — веселящий газ), либо сферу
применения (пурпурно-красная краска
«сурик» — Pb3O4) и т.д. По мере того как
все большее число людей изучало
химию, по мере того как все большее
число веществ надо было
охарактеризовать и запомнить
возникла необходимость просто
словами называть формулу вещества.
Введение понятий валентность,
степень окисления и т.д. влияло на
названия веществ. Мы приведем
таблицу, в которой даны названия
оксидов азота при использовании
различных стилей и номенклатур.
В период накопления
экспериментальных данных в химии
названия веществ отражали либо
способ их получения (жженая
магнезия: MgCO3 ® MgO + CO2), либо
характер воздействия на человека
(N2O — веселящий газ), либо сферу
применения (пурпурно-красная краска
«сурик» — Pb3O4) и т.д. По мере того как
все большее число людей изучало
химию, по мере того как все большее
число веществ надо было
охарактеризовать и запомнить
возникла необходимость просто
словами называть формулу вещества.
Введение понятий валентность,
степень окисления и т.д. влияло на
названия веществ. Мы приведем
таблицу, в которой даны названия
оксидов азота при использовании
различных стилей и номенклатур.
Получение оксидов
При изучении данной главы особое внимание будет уделено взаимосвязи «родственных» веществ из разных классов.
Как получить оксиды из простых веществ? Их окислением:
2Mg + O2 = 2MgO,
2C + O2 = 2CO,
C + O2 = CO2.
Рассмотрим лишь принципиальную возможность получения оксида из простых веществ. Получение CO и CO2 будет рассмотрено в разделе «Углерод».
Можно ли получить оксиды из оксидов? Да:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2.
Можно ли получить оксиды из гидроксидов ? Да:
Ca(OH)2 CaO + h3O, h3CO3 = CO2 + h3O.
Можно ли получить оксиды из солей ? Да:
CaCO3 CaO + CO2, 2Cu(NO3)2 = 2CuO + 4NO2 + O2.
Свойства оксидов
Если посмотреть внимательно реакции, написанные выше, то те из них, в которых оксиды встречались в левой части уравнения, будут говорить нам о свойствах оксидов. Эти общие для всех оксидов свойства относятся к окислительно-восстановительным процессам:
2SO2 + O2 = 2SO3,
2SO3 = 2SO2 + O2,
Fe2O3 + CO = 2FeO + CO2,
Al + Fe2O3 = Al2O3 + Fe,
C + Fe2O3 = CO + 2FeO.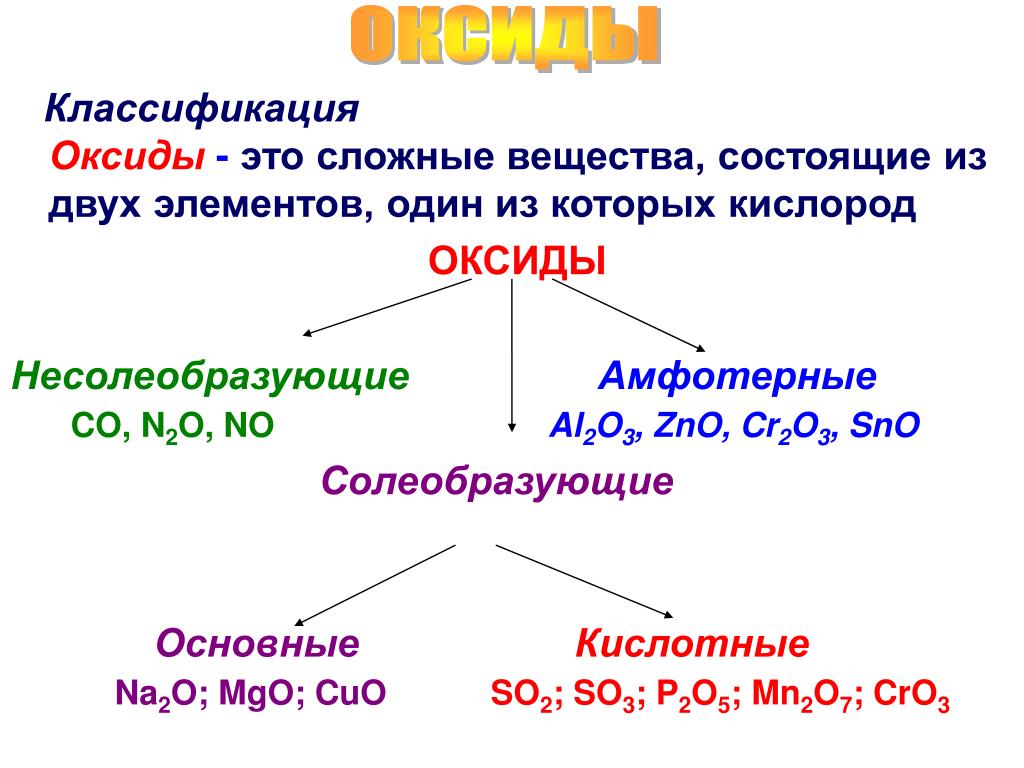
Но тем не менее, свойства оксидов обычно рассматриваются с учетом их классификации.
Свойства основных оксидов
Прежде всего надо показать, что отвечающие им гидроксиды являются основаниями:
CaO + h3O = Ca(OH)2, Ca(OH)2 = Ca2+ + 2OH-,
т.е. оксиды щелочных и щелочно-земельных металлов при взаимодействии с водой дают растворимые в воде основания, которые называются щелочами.
Основные оксиды, реагируя с кислотными или амфотерными оксидами, дают соли:
CaO + SO3 = CaSO4, BaO + Al2O3 = Ba(AlO2)2.
Основные оксиды, реагируя с кислотными или амфотерными гидроксидами, дают соли:
CaO + h3SO4 = CaSO4 + h3O, K2O + Zn(OH)2 = K2ZnO2 + h3O.
Основные оксиды, реагируя с кислыми солями, дают средние соли:
CaO + Ca(HCO3)2 = 2CaCO3 + h3O.
Основные оксиды, реагируя с нормальными солями, дают основные соли:
MgO + MgCl2 + h3O = 2Mg(OH)Cl.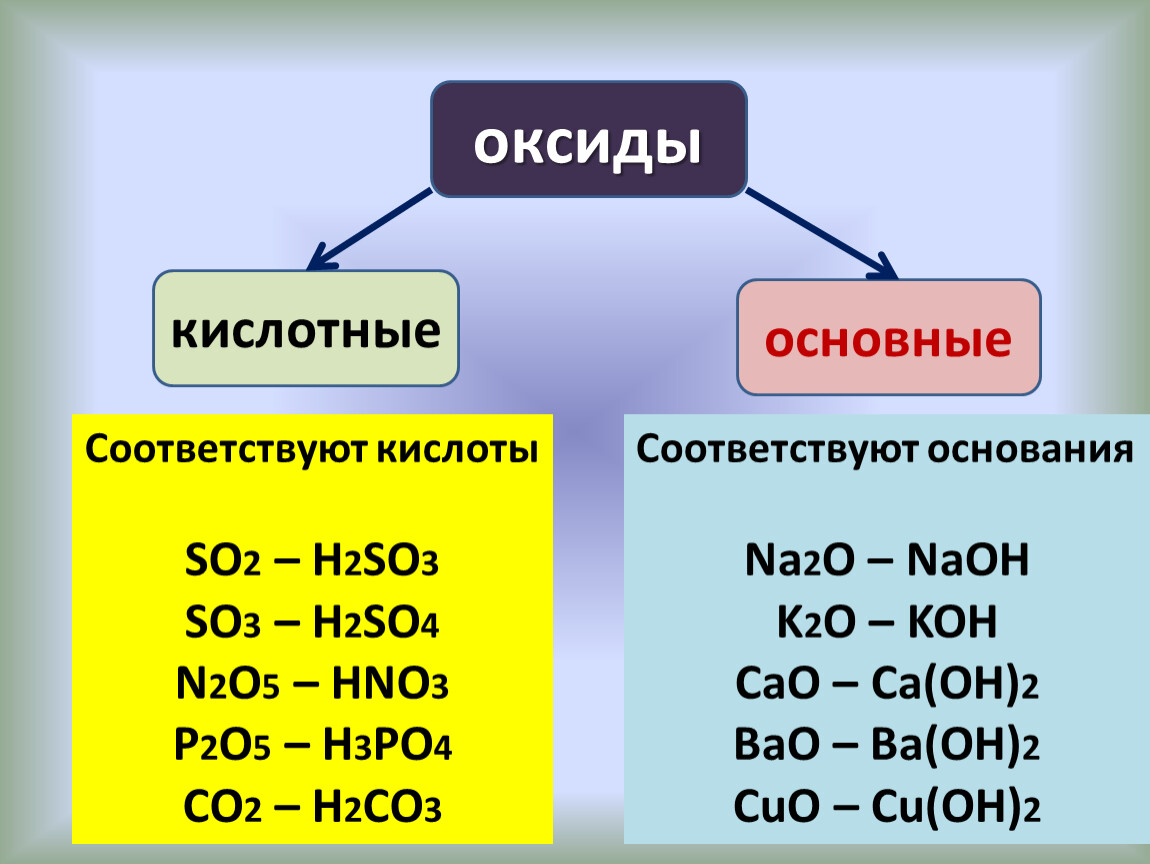
Свойства кислотных оксидов
Отвечающие кислотным оксидам гидроксиды являются кислотами:
SO3 + h3O = h3SO4, h3SO4 = 2H+ + SO42- .
Многие кислотные оксиды, растворяясь в воде, дают кислоты. Но есть и такие кислотные оксиды, которые не растворяются в воде и с ней не взаимодействуют: SiO2.
Кислотные оксиды, реагируя с основными или амфотерными оксидами, дают соли:
SiO2 + CaO = CaSiO3, 3SO3 + Al2O3 = Al2(SO4)3.
Кислотные оксиды, реагируя с основными или амфотерными гидроксидами, дают соли:
SO3 + Ca(OH)2 = CaSO4 + h3O, SO3 + Zn(OH)2 = ZnSO4 + h3O.
Кислотные оксиды, реагируя с основными солями, дают средние соли.
Кислотные оксиды, реагируя с нормальными солями, дают кислые соли:
CO2 + CaCO3 + h3O = Ca(HCO3)2.
Свойства амфотерных оксидов
Отвечающие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH)2 = Zn2+ + 2OH-,
h3ZnO2 = 2H+ + ZnO22-.
Амфотерные оксиды не растворяются в вводе.
Амфотерные оксиды, реагируя с основными или с кислотными оксидами, дают соли:
Al2O3 + K2O = 2KAlO2, Al2O3 + 3SO3 = Al2(SO4)3.
Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH = K2ZnO2 + h3O, ZnO + h3SO4 = ZnSO4 + h3O.
видов оксидов, основных оксидов, кислых оксидов. Получение оксидов. Оксиды азота
Свойства оксидов
Оксиды — сложные химические вещества, представляющие собой простые химические соединения элементов с кислородом. Они солеобразующие и солей не образуют .
Существует 3 типа солеобразующих оксидов: Основные оксиды (от слова «Основа»), кислые оксиды и Амфотерные оксиды .Примером оксидов, не образующих соли, могут быть: NO (оксид азота) — бесцветный газ без запаха. Его образуют электрические бури в атмосфере. Газ CO (окись углерода) не имеет запаха, образуется при сгорании угля. Обычно его называют оксидом углерода.
Газ CO (окись углерода) не имеет запаха, образуется при сгорании угля. Обычно его называют оксидом углерода.
Есть и другие оксиды, не образующие солей.
Теперь рассмотрим каждый тип солеобразующих оксидов.
Основные оксиды
Основные оксиды — это оксиды сложного химического вещества, которые образуют соли при химической реакции с кислотами или кислыми оксидами и не вступают в реакцию с основаниями или основными оксидами.Например, к основным оксидам относятся следующие:
K 2 O (оксид калия), CaO (оксид кальция), FeO (двухвалентный оксид железа).
Рассмотрим химических свойств оксидов примеров.
1. Реакция с водой:
— реагирует с водой и образует основание (или щелочь)
CaO + H 2 O → Ca (OH) 2 (реакция, известная как известкование, выделяет большое количество тепла!)
2.реагирует с кислотами:
реакция с кислотой и форма соли и воды (раствор соли в воде)
CaO + H 2 SO 4 → CaSO 4 + H 2 O (Кристаллы этого вещества CaSO 4 повсеместно известны как «гипс Парижа»).
3. реагирует с кислыми оксидами: образует соли
CaO + CO 2 → CaCO 3 (Это вещество, известное как мел!)
Кислые оксиды
Кислотные оксиды — это сложные химические оксиды, которые образуют соли при химических реакциях с основаниями или основными оксидами и не вступают в реакцию с кислотными оксидами.
Примеры кислых оксидов могут быть:
CO 2 (всем известный диоксид углерода), P 2 O 5 — оксид фосфора (образуется в воздухе при сгорании белого фосфора), SO 3 — оксид серы (VI) — вещество, используемое для серной кислота
— химическая реакция с водой
CO 2 + H 2 O → H 2 CO 3 — это вещество — углекислота — одна из слабых кислот, ее добавляют в газированную воду для «пузырьков» газа.С повышением температуры растворимость газа в воде уменьшается, а избыток выходит в виде пузырьков.
— реакция со щелочами (основаниями):
CO 2 + 2NaOH → Na 2 CO 3 + H 2 О — образующееся вещество (соль) широко используется в сельском хозяйстве. Это называется кальцинированной сода или стиральная сода, это отличное очищающее средство от пригоревших кастрюль, жира, ожогов. Голыми руками работать не рекомендую!
— реакция с основными оксидами:
CO 2 + MgO → MgCO 3 получается соль — карбонат магния, также называемый «горькой солью».
Амфотерные оксиды
Амфотерные оксиды — это сложное химическое вещество, также оксиды, которые образуют соли при химических реакциях с кислотами (или кислотных оксидов ) и с основаниями (или основных оксидов ). Наиболее часто употребляется слово «амфотерный» для оксидов металлов .
Пример Амфотерные оксиды могут быть:
ZnO — оксид цинка (белый порошок, часто используемый в медицине для изготовления масок и кремов), Al 2 O 3 — оксид алюминия (также называемый «глиноземом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химическую реакцию, подходящую для оснований и кислот. Например:
— реакция с кислым оксидом:
ZnO + H 2 CO 3 → ZnCO 3 + H 2 O — Образующееся вещество, состав соли карбоната цинка в воде.
— основание реакции:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O — полученное вещество представляет собой двойную соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическими и химическими методами. Самый простой способ — химическая реакция простых элементов с кислородом. Например, в результате процесса горения одним из продуктов этой химической реакции являются оксидов .
Например, если раскаленные железные стержни (вы можете взять цинк Zn, олово Sn, свинец Pb, медь Cu, это на самом деле то, что у вас есть) поместить в колбу с кислородом, произойдет химическая реакция окисления, которая сопровождается яркой вспышкой и искрами. Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
Продукт реакции — черный порошок оксида железа FeO (Например, если бы это было железо):
2Fe + O 2 → 2FeO
Совершенно аналогичные химические реакции окисления для других металлов и неметаллов, такие как:
Цинк горит в кислороде с образованием оксида цинка
2Zn + O 2 → 2ZnO
При сжигании угля образуются два оксида: оксид углерода и диоксид углерода
2C + O 2 → 2CO — образование окиси углерода.
C + O 2 → CO 2 — образование диоксида углерода.Этот газ образуется, когда кислород доступен в более чем достаточных количествах, то есть в любом случае сначала происходит реакция с образованием монооксида углерода, а затем монооксид углерода окисляется до диоксида углерода.
Получение оксидов можно осуществить другим способом — реакцией химического разложения.
Например, для получения оксида железа или оксида алюминия необходимо поджечь соответствующую основу этих металлов в огне.
Fe (OH) 2 → FeO + H 2 O
Оксид алюминия — оксид корунда-железа (III).Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в почве оксида железа (III). Оксид алюминия — корунд Растворы оксидов 2Al (OH) 3 → Al 2 O 3 + 3H 2 O,
а также разложение отдельных кислот:
H 2 CO 3 → H 2 O + CO 2 — разложение угольной кислоты
H 2 SO 3 → H 2 O + SO 2 — разложение серной кислоты
Производство оксидов может осуществляться из солей металлов при сильном нагревании:
CaCO 3 → CaO + CO 2 — при воспламенении мела получают оксид кальция (или известь) и диоксид углерода.
2Cu (NO 3 ) 2 → 2CuO + 4NO 2 + O 2 — в этой реакции разложения получается два оксида: CuO (черный цвет) и азот NO 2 (его еще называют коричневый газ, потому что он действительно коричневый).
Другой способ получения оксидов с помощью окислительно-восстановительной реакции, например
Cu + 4HNO 3 (конц.) → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (конц.) → 3SO 2 + 2H 2 O
Оксиды хлора
Молекула ClO 2 Молекула Cl 2 O 7 Закись азота N 2 ON Диоксид азота N 2 O 3 Ангидрид азота N 2 O 5 Коричневый газ NO 2Известно оксидов хлора : Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 . Все они, кроме Cl 2 O 7 , имеют желтый или оранжевый цвет и не являются устойчивыми, особенно ClO 2 Cl 2 O 6 .Все оксидов хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорные кислоты:
Итак, Cl 2 O — оксид хлора хлорноватистой кислоты.
Cl 2 O + H 2 O → 2HClO — Хлорноватистая кислота
ClO 2 — кислотный оксид хлора хлорноватистой и чарнаватовой кислоты, поскольку химическая реакция с водой приводит к образованию двух кислот:
ClO 2 + H 2 O → HClO 2 + HClO 3
Cl 2 O 6 также является кислым оксидом хлора чарнавати и хлорной кислотой:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
Наконец, Cl 2 O 7 представляет собой бесцветную жидкость кислотный оксид хлора хлорноватой кислоты:
Cl 2 O 6 + H 2 O → HClO 3 + HClO 4
а, Cl 2 O 7 — жидкость бесцветная — оксид хлора кислый хлорная кислота:
Cl 2 O 7 + H 2 O → 2HClO 4
Оксиды азота
Азот — это газ, который образует с кислородом 5 различных соединений — 5 оксидов . Например:
Например:
— N 2 O — азот смешанный . Имеет другое название, в медицине известен как веселящий газ или закись азота Газ бесцветен, сладок и приятен на вкус. NO окись азота представляет собой бесцветный газ без запаха и вкуса.
— N 2 O 3 — азотистый ангидрид — бесцветное кристаллическое вещество
— НЕТ 2 — диоксид азота .Другое его название — коричневый газ — газ действительно имеет ржаво-коричневый цвет
.— N 2 O 5 — ангидрид азота голубая жидкость, кипящая при температуре 3,5 0 C
Из всех перечисленных соединений азота наибольший интерес для промышленности представляют NO — монооксид азота, а NO 2 — диоксид азота. Окись азота (NO) Закись азота N 2 O не реагирует с водой и щелочами. Азотистый ангидрид (N 2 O 3 ) при реакции с водой образует слабую и нестабильную азотистую кислоту HNO 2 , которая на воздухе постепенно превращается в более стабильное химическое вещество азотную кислоту
Рассмотрим некоторые из химических свойств оксидов азота : Реакция с водой:
2NO 2 + H 2 O → HNO 3 + HNO 2 образуются 2 кислоты: азотная кислота HNO 3 и азотистая кислота.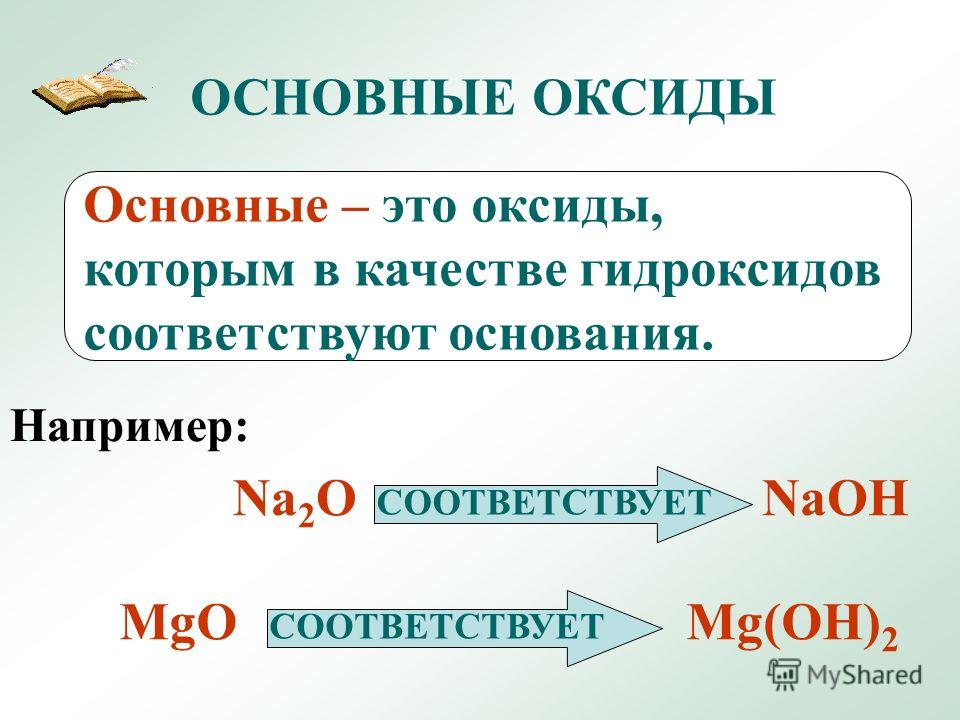
Реакция с щелочью:
2NO 2 + 2NaOH → NaNO 3 + NaNO 2 + H 2 O — образование двух солей: нитрата натрия NaNO 3 и нитрита натрия
Реакция с солями:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 — образовались две соли: нитрат натрия и нитрит натрия, а также диоксид углерода.
Получите диоксид азота (NO 2 ) из оксида азота (NO) химической реакцией соединения c кислород:
2НО + O 2 → 2НО 2
Оксиды железа
Железо образует два оксида : FeO — оксид железа (2-валентный) — черный порошок, который получают путем восстановления оксида железа (3-валентного) монооксида углерода в соответствии со следующей химической реакцией:
Fe 2 O 3 + CO → 2FeO + CO 2
Это основной оксид, легко вступающий в реакцию с кислотами.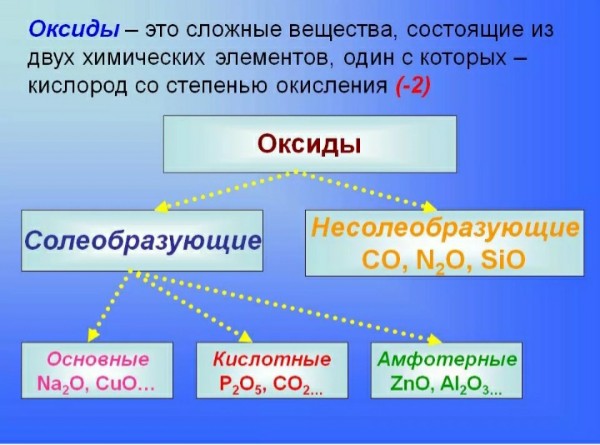 Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
Обладает восстанавливающими свойствами и быстро окисляется до оксида железа (3-валентный).
4FeO + O 2 → 2Fe 2 O 3
Оксиды железа (3-валентные) — красно-коричневый порошок (гематит), обладающий амфотерными свойствами (вступает в реакцию с кислотами и щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что чаще всего его используют в качестве основного оксида .
Также существует смешанных оксидов железа Fe 3 O 4 .Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным гематитом или магнетитом).
Если железо сжигается, в реакции образуются два оксида: оксид железа , (III) и (II) валентность.
Диоксид серы
Диоксид серы SO 2 Диоксид серы SO 2 — или сернистый газ — это кислых оксидов , но он не образует кислоту, хотя прекрасно растворяется в воде — 40 л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называется серной кислотой).
В норме это бесцветный газ с резким удушающим запахом горящей серы. При температуре -10 0 C он может быть переведен в жидкое состояние.
В присутствии катализатора оксида ванадия (V 2 O 5 ) диоксид серы присоединяет кислород и превращается в триоксид серы
2SO 2 + O 2 → 2SO 3
Растворенный в воде диоксид серы — SO 2 очень медленно окисляется, в результате чего превращается в серную кислоту
Если диоксида серы проходит через раствор щелочи, например гидроксид натрия, то сульфит натрия (или гидросульфит, это зависит от того, сколько вы берете щелочи и диоксида серы)
NaOH + SO 2 → 2NaHSO 3 — диоксид серы взято больше, чем необходимо
2NaOH + SO 2 → Na 2 SO 3 + H 2 O
Если диоксид серы не реагирует с водой, то почему его водный раствор дает кислую реакцию ?! Да не реагирует, но он сам окисляется в воде и добавляет кислород. И оказывается, в воде накапливаются атомы водорода, которые дают кислотную реакцию (это можно проверить по какому-нибудь индикатору!)
И оказывается, в воде накапливаются атомы водорода, которые дают кислотную реакцию (это можно проверить по какому-нибудь индикатору!)
Тенденции в химии оксидов Учебник
Сноски
1 Мы будем рассматривать только «нормальные» оксиды. Помимо нормального оксида Na 2 O, натрий также образует ионный пероксид Na 2 O 2 .
Однако следует отметить, что при сгорании натрия Na 2 O также будет реагировать с O 2 с образованием Na 2 O 2 , поэтому основным продуктом сгорания натрия является Na 2 О 2 .
2 Ограничение подачи кислорода во время горения дает низший оксид, P 4 O 6 вместо P 5 O 10
3 При сгорании фосфора в избытке кислорода образуется оксид фосфора P 4 O 10 .
4 При сгорании серы образуется диоксид серы SO 2 (г) .
Окисление SO 2 до SO 3 кислородом происходит самопроизвольно, но очень медленно:
SO 2 (г) + ½O 2 (г) → SO 3 (л)
5 Некоторые оксиды хлора склонны к взрыву: ClO 2 , Cl 2 O, Cl 2 O 3 и Cl 2 O 7 .
По всей видимости, они более чувствительны к удару, чем термически.
Тем не менее, ClO 2 и Cl 2 O используются в коммерческих целях в качестве отбеливающих агентов, в частности, для отбеливания бумаги и муки.
В промышленных масштабах ClO 2 получают экзотермической реакцией хлората натрия примерно в 4 моль л. -1 H 2 SO 4 , содержащем 0,05-0,25 моль л. -1 хлорид-иона с диоксидом серы:
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4
Cl 2 O можно получить обработкой свежеприготовленного желтого оксида ртути газообразным хлором или раствор хлора в четыреххлористом углероде:
2Cl 2 + 2HgO → HgCl 2 . HgO + Cl 2 O
HgO + Cl 2 O
6 Существует только одна формула оксида алюминия, Al 2 O 3 , известного как оксид алюминия, однако существует ряд полиморфов и гидратированных разновидностей.
Существует 2 формы безводного Al 2 O 3 , известные как α -Al 2 O 3 и γ -Al 2 O 3 .
α -Al 2 O 3 очень твердый и устойчивый к гидратации и воздействию кислот.
γ -Al 2 O 3 более мягкий, легко впитывает воду и растворяется в кислотах.
Существует несколько гидратированных форм оксида алюминия, включая AlO.OH и Al (OH) 3 , но их получают в щелочных растворах, а не в реакции оксида алюминия с водой.
7 Реакция протекает в холодной воде. Если используется горячая вода, образуется ряд продуктов, таких как PH 3 , фосфорная кислота и элемент P.
8 Эта реакция протекает легко, что делает P 4 O 10 хорошим осушающим агентом, но при этом образуется смесь кислот, в зависимости от количества воды и других условий.
9 Нет сомнений в том, что газообразный SO 2 растворяется в воде, но кислота H 2 SO 3 не выделяется. Тем не менее, это уравнение обычно используется для описания реакции.
10 Двуокись углерода, CO 2 , является кислым оксидом, но монооксид углерода, CO, является нейтральным оксидом.
11 Диоксид азота, NO 2 , является кислым оксидом, но оксид азота, NO, и закись азота, N 2 O, являются нейтральными оксидами.
Видео с вопросом: Определение оксида, который считается основным оксидом
Стенограмма видео
Какой из следующих оксидов считается основным оксидом? (A) SO2, (B) SO3, (C) CO2, (D) Na2O или (E) P2O5.
В этом вопросе мы хотим определить, какое из перечисленных соединений считается основной оксид.
Оксид — это химическое соединение, которое химически содержит по крайней мере один атом кислорода. связаны с атомом другого элемента.Есть много разных оксидных соединений. Несколько распространенных примеров включают двуокись углерода, воду и закись азота, также называемые веселящий газ. Эти три примера представляют собой оксиды с неметаллами. Однако оксиды также могут образовываться с металлами. Одним из примеров является оксид кальция, который находит множество применений, включая промышленное производство. фарфора и стекла.
Многие оксиды можно классифицировать как основания или кислоты, в то время как некоторые оксиды считаются
нейтральные и другие амфотерные.Мы сосредоточимся на идентификации основного оксида, что означает, что он может давать раствор.
с pH выше семи, в то время как кислотный раствор оксида имеет pH ниже семи. Это можно определить, зная электроотрицательность других элементов.
Это можно определить, зная электроотрицательность других элементов.
Электроотрицательность увеличивается по таблице Менделеева слева направо. Кислотность оксидов увеличивается с увеличением электроотрицательности элементов, связанных с кислород. Таким образом, кислотность оксидов увеличивается слева направо по периодической таблице.Металлические элементы составляют левую часть таблицы Менделеева. Металлы склонны к образованию основных оксидов. В качестве альтернативы, поскольку неметаллы находятся в правой части таблицы Менделеева, они будут склонны к образованию кислых оксидов.
Давайте посмотрим, где элементы, связанные с кислородом, в вариантах ответа
расположен на периодической таблице. Варианты ответов (A), (B), (C) и (E) — это оксиды, которые дополнительно содержат неметаллы.
к кислороду. Эти оксиды могут образовывать кислые оксиды и, следовательно, не являются ответом на этот вопрос.
вопрос. Вариант ответа (D), Na2O или оксид натрия, является оксидом металла и будет рассматриваться
базовый. Следовательно, оксид, который считается основным оксидом, является выбором ответа (D),
Na2O.
Вариант ответа (D), Na2O или оксид натрия, является оксидом металла и будет рассматриваться
базовый. Следовательно, оксид, который считается основным оксидом, является выбором ответа (D),
Na2O.
Oxides — Mini Chemistry — Learn Chemistry Online
Элементы реагируют с кислородом (иначе горят в кислороде ) в атмосфере с образованием оксидов .
Оксиды классифицируются как:
- Кислый
- Базовый
- Амфотерный
- нейтральный
Кислые оксиды
Кислые оксиды реагируют с водой с образованием кислот .
- Напомним: Растворы этих кислот в воде имеют значение pH менее 7.
Кислотные оксиды — это оксиды неметаллов , которые также известны как неметаллические оксиды . Примеры:
- $ \ text {Углерод} + \ text {кислород} \ rightarrow \ text {углекислый газ} $ $$ \ text {C} (\ text {s}) + \ text {O} _ {2} (\ text {g}) \ rightarrow \ text {CO} _ {2} (\ text {g}) $$
- $ \ text {Сера} + \ text {кислород} \ rightarrow \ text {диоксид серы} $ $$ \ text {S} (\ text {s}) + \ text {O} _ {2} (\ text { g}) \ rightarrow \ text {SO} _ {2} (\ text {g}) $$
Примеры кислотных оксидов показаны в таблице ниже:
| Кислотные оксиды | Формула | Кислота, получаемая с водой |
|---|---|---|
| Диоксид серы | $ \ text {SO} _ {2} | $ сернистая кислота $ \ text {H} _ {2} \ text {SO} _ {3} $ |
| Трехокись серы | $ \ text {SO} _ {3} | $ серная кислота $ \ text {H} _ {2} \ text {SO} _ {4} $ |
| Двуокись углерода | $ \ text {CO} _ {2} | $ Угольная кислота $ \ text {H} _ {2} \ text {CO} _ {3} $ |
| Оксид фосфора (V) | $ \ text {P} _ {4} \ text {O} _ {10} $ | фосфорная кислота $ \ text {H} _ {3} \ text {PO} _ {4} $ |
Основные оксиды
Основные оксиды взаимодействуют с кислотой с образованием только соли и воды.
- Обратите внимание, что это реакция нейтрализации .
- Следовательно, основные оксиды нейтрализуют кислоты.
Основные оксиды, растворимые в воде, называются щелочами .
- Напомним: Растворы этих щелочей в воде имеют значение pH более 7.
Основные оксиды — это оксиды металлов , которые также известны как оксидов металлов . Примеры:
- $ \ text {Натрий} + \ text {кислород} \ rightarrow \ text {оксид натрия} $ $$ \ text {Na} (\ text {s}) + \ text {O} _ {2} (\ text {g}) \ rightarrow 2 \ text {Na} _ {2} \ text {O} (\ text {s}) $$
- $ \ text {Медь} + \ text {кислород} \ rightarrow \ text {оксид меди (II)} $ $$ \ text {Cu} (\ text {s}) + \ text {O} _ {2} ( \ text {g}) \ rightarrow 2 \ text {CuO} (\ text {s}) $$
Примеры основных оксидов показаны в таблице ниже:
| Основные оксиды | Формула |
|---|---|
| Оксид натрия | $ \ text {Na} _ {2} \ text {O} $ |
| Оксид магния | $ \ text {MgO} | $
| Оксид кальция | $ \ text {CaO} | $
| Оксид меди | $ \ text {CuO} | $
| Оксид железа (III) | $ \ text {Fe} _ {2} \ text {O} _ {3} $ |
Амфотерные оксиды
Амфотерные оксиды ведут себя как кислый оксид или как основной оксид.
- Амфотерные оксиды обладают как кислотными, так и основными свойствами .
- Амфотерные оксиды могут реагировать как с кислотами, так и с щелочами с образованием солей и воды. (Напомним: реакция нейтрализации)
Примеры амфотерных оксидов показаны в таблице ниже:
| Амфотерные оксиды | Формула |
|---|---|
| Оксид алюминия | $ \ text {Al} _ {2} \ text {O} _ {3} $ |
| Оксид цинка | $ \ text {ZnO} | $
| Оксид свинца (II) | $ \ text {PbO} | $
Реакции амфотерных оксидов с кислотами :
- Оксид алюминия с соляной кислотой $$ \ text {Al} _ {2} \ text {O} _ {3} + 6 \ text {HCl} \ rightarrow 2 \ text {AlCl} _ {3} + 3 \ text {H} _ {2} \ text {O} $$
- Оксид цинка с серной кислотой $$ \ text {ZnO} + \ text {H} _ {2} \ text {SO} _ {4} \ rightarrow \ text {ZnSO} _ {4} + \ text {H} _ {2} \ text {O} $$
- Оксид свинца (II) с азотной кислотой $$ \ text {PbO} + 2 \ text {HNO} _ {3} \ rightarrow \ text {Pb} \ left (\ text {NO} _ {3} \ right) _ {2} + \ text {H} _ {2} \ text {O} $$
Реакции амфотерных оксидов с основаниями :
- Оксид алюминия с гидроксидом натрия с образованием алюмината натрия $$ \ text {Al} _ {2} \ text {O} _ {3} + 2 \ text {NaOH} \ rightarrow 2 \ text {NaAlO} _ {2} + 3 \ text {H} _ {2} \ text {O} $$
- Оксид цинка с гидроксидом натрия с образованием цинката натрия $$ \ text {ZnO} + 2 \ text {NaOH} \ rightarrow \ text {Na} _ {2} \ text {ZnO} _ {2} + \ text {H} _ {2} \ text {O} $$
- Оксид свинца (II) с гидроксидом натрия с образованием плюмбата натрия (II) $$ \ text {PbO} + 2 \ text {NaOH} \ rightarrow \ text {Na} _ {2} \ text {PbO} _ {2} + \ text {H} _ {2} \ text {O} $$
нейтральный оксид
Нейтральный оксид не имеет кислотных или основных свойств. Примеры:
Примеры:
O Level Chemistry — Типы оксидов — O Level Chemistry & IP Chemistry Notes by 10 Year Series Author
Это еще один раздел в O Level Chemistry , где учащимся трудно понять. Давайте раскроем здесь секреты.
Оксид — это соединение кислорода и другого элемента (например, в процессе сгорания)
? Металлы образуют Оксиды металлов и Неметаллы образуют Оксиды неметаллов
? Оксиды могут быть классифицированы как Кислые, Основные, Амфотерные или Нейтральные
? Природа оксидов элементов в периодической таблице слева направо изменяется от? Основной -> Амфотерный -> Кислый
КИСЛОТЫ ОКСИДЫ
Примеры:
SO2, SO3, CO2, NO2
Недвижимость:
1.Не вступайте в реакцию с кислотами.
2. Реагировать с основаниями и щелочами с образованием соли и воды.
3. Растворить в воде с образованием кислых растворов.
4. Обычно газы при комнатной температуре.
ОСНОВНЫЕ ОКСИДЫ
Примеры:
Na2O, CaO, MgO, FeO, CuO
Свойства:
1. Не вступать в реакцию с основаниями.
2. Реагировать с кислотами с образованием соли и воды.
3. Основные оксиды обычно не растворяются в воде. Те, что растворяются в воде, образуют щелочные растворы.
НЕЙТРАЛЬНЫЕ ОКСИДЫ
Примеры:
CO, NO, h3O
Свойства:
1. Нейтральный pH
АМФОТЕРИЧЕСКИЕ ОКСИДЫ
Примеры:
Оксиды, образованные с металлами вблизи? STEPS ? , например ZnO, Al2O3, PbO,
Свойства:
1. Реагировать с кислотами и основаниями с образованием соли и воды
Тем, кто изучает программу уровня GCE «O», в этом разделе, посвященном типам оксидов, возникает множество вопросов.
Давайте взглянем на некоторые экзаменационные вопросы.
Quick Check 1:
Что из следующего реагирует с разбавленной серной кислотой с образованием газа и воды в качестве двух продуктов?
A. цинк
B. карбонат цинка
C. гидроксид цинка
D. оксид цинка
Quick Check 2:
Какой элемент образует оксид, который реагирует с водой с образованием кислого раствора?
A. алюминий
B. натрий
C. сера
D.цинк
Quick Check 3:
Какой элемент горит на воздухе с образованием оксида, который при встряхивании с водой дает раствор с pH более 7?
A. углерод
B. водород
C. магний
D. сера
PS: Оставляйте предлагаемые ответы в «Разделе комментариев» непосредственно под этим сообщением.
PPS: Этот пост принадлежит к серии постов, связанных с Секретами «Кислоты, основания, соли и качественный анализ раскрыты»
Статьи по теме:
оксидов
оксидовДва самых важных свойства оксидов и гидроксидов
- их структура и связь
- их кислотно-основные свойства.
Рассмотрим оксиды Группа 1, Группа 2, B и Al из группы 3, C, Si и Pb из группы 4, P, S, Cl и первый блок d .
Некоторые определения.
Ионные оксиды и гидроксиды являются ионными, если они имеют высокие температуры плавления и кипения и кристаллическую структуру, которая состоит из отдельных ионов.
Ковалентные оксиды и оксокислоты являются молекулярными, если они имеют низкие температуры плавления и кипения и состоят из дискретные молекулы.Гигантское ковалентное соединение имеет высокую температуру плавления и кипения. с непрерывной структурой.
Слоистая решетка. Многие гидроксиды имеют структуру решетки слоев с ионами металлов, зажатыми между слоями гидроксид-ионы. Они имеют ионный / ковалентный характер. При нагревании до высокой температуры, они дают ионные оксиды.
Базовый. Металлы с
электроотрицательность менее 1,3 образуют основные оксиды и гидроксиды. Эти оксиды и
гидроксиды легко растворяются в разбавленных кислотах.Если они растворимы в воде, они вызывают
щелочные растворы.
Эти оксиды и
гидроксиды легко растворяются в разбавленных кислотах.Если они растворимы в воде, они вызывают
щелочные растворы.
Кислый. Неметаллы с электроотрицательность более 2,0 образуют кислые оксиды. Если они растворимы в воде, они дают кислые оксикислоты. Гигантские ковалентные оксиды B 2 O 3 и SiO 2 не растворяются в воде, но классифицируются как кислые, поскольку реагируют с конденсированный NaOH; кроме того, их оксокислоты, полученные гидролизом хлоридов, растворяются в водном NaOH.
Амфотерный. Металлы с электроотрицательность между 1,3 и 2,0 должен образовывать амфотерные оксиды, но многие из них имеют очень нерастворимые гидроксиды, которые лишь незначительно растворяются в водном NaOH. Эти оксиды будут считаться амфотерными, только если их гидроксиды легко растворяются в водном NaOH; в противном случае они будут считаться базовыми.
Формула. Если гидрокси
соединение является основным или амфотерным, оно будет записано в виде M (OH) x ,
хотя многие триположительные металлы образуют гидроксиды с формулой MO. ОЙ. x H 2 O ..
Если гидроксисоединение является кислым, это будет записано в виде H x XO y .
ОЙ. x H 2 O ..
Если гидроксисоединение является кислым, это будет записано в виде H x XO y .
Группа 1 и Группа 2.
Все оксиды группы 1 ионные. и щелочные:
M 2 O (т) + H 2 O (л) 2MOH (водн.)
То же самое и для группы 2. оксиды:
MO (s) + H 2 O (л) M (OH) 2 (водн.)
хотя бериллий и магний гидроксиды почти нерастворимы (растворимость гидроксидов увеличивается вниз по группе).
Оксид бериллия растворяется в обоих разбавленная кислота и щелочь и поэтому амфотерный (сравните с алюминием):
BeO (s) + 2H + (водн.) Be 2+ (водн.) + H 2 O (л)
BeO (s) + 2OH — + H 2 O (л) Be (OH) 4 2- (водн.)
Группа 3.
Оксид бора является гигантским ковалентным и
кислая. Он не растворяется в воде, но растворяется в расплавленном NaOH. Слабая кислота, H 3 BO 3, , полученный гидролизом BCl 3 , растворяется в водном растворе NaOH (сравните с кремнием).
Он не растворяется в воде, но растворяется в расплавленном NaOH. Слабая кислота, H 3 BO 3, , полученный гидролизом BCl 3 , растворяется в водном растворе NaOH (сравните с кремнием).
B 2 O 3 (т) + NaOH (л) 2NaBO 2 (л) + H 2 O (г)
H 3 BO 3 (т) + OH — (водн.) B (OH) 4 — (водн.)
Оксид алюминия ионный и гидроксид образует слоистую решетку. Его оксид показывает поведение, аналогичное поведению бора. (замените B на Al в приведенных выше уравнениях), и, поскольку он также растворяется в кислотах, он амфотерный.
Al 2 O 3 (т) + 6H + (водн.) 2Al 3+ (водн.) + 3H 2 O (л)
Al (OH) 3 (т) + 3H + (водн.) Al 3+ (водн.) + 3H 2 O (л)
Образовавшийся ион алюминия, Al (H 2 O) 6 3+ (водн. ),
имеет высокую плотность заряда и действует как слабая кислота с p K a 4.8, то же
как этановая кислота.
),
имеет высокую плотность заряда и действует как слабая кислота с p K a 4.8, то же
как этановая кислота.
[Al (H 2 O) 6 ] 3+ (водн.) + H 2 O (л) [Al (H 2 O) 5 OH] 2+ + H 3 O + (водн.)
При добавлении водного NaOH, равновесие смещается вправо до тех пор, пока не выпадет в осадок Al (OH) 3 (s); это легко реагирует с избытком NaOH с образованием алюминатного иона Al (OH) 4 — (водн.).
Группа 4.
Окись углерода молекулярная и считается нейтральным. Формально это ангидрид метановой кислоты HCOOH, но он не реагирует с водой, хотя обратный процесс, дегидратация метановой кислоты кислота с концентрированной серной кислотой, является стандартным методом получения окиси углерода.
Углекислый газ является молекулярным и
растворяется в воде с образованием угольной кислоты, которая является слабой кислотой с p K 1 6. 4:
4:
CO 2 (г) + H 2 O (л) H 2 CO 3 (водн.)
Только около 1 молекулы из 600 CO 2 (г) превращается в кислоту, и большая его часть остается в форме CO 2 (водн.).
Диоксид кремния гигантский ковалентный, содержащий одинарные связи Si-O. Молекулярная структура будет содержать связи Si = O; они были бы намного слабее двух одинарных связей Si-O, обнаруженных в решетке кремнезема. SiO 2 не растворяется в воде, но реагирует с конденсированным NaOH:
SiO 2 (т) + 2NaOH (л) Na 2 SiO 3 (л) + H 2 O (г)
Очень слабая кислота, H 4 SiO 4 (s), полученный гидролизом хлорида, также растворяется в водном NaOH.
H 4 SiO 4 (т)
+ 2OH — (водн.) SiO 3 2- (водн.) + 3H 2 O (l).
Окись свинца ионная твердое вещество, цвет которого варьируется от желтого до оранжевого. Когда жарко, он красный и снова становится желтый при охлаждении. Он растворяется в разбавленной азотной кислоте (сульфат и хлорид являются не растворим в холодной воде) и в концентрированном водном гидроксиде натрия ..
PbO (s) + 2H + (водн.) Pb 2+ (водн.) + H 2 O (л)
PbO (тв.) + H 2 O (л) + OH — (водн.) Pb (OH) 3 — (водн.)
Добавление водного NaOH к раствор соли свинца дает белый осадок, обычно записываемый как Pb (OH) 2 (s) (но возможно 2Пбо.H 2 O), который реагирует с избытком NaOH с образованием Pb (OH) 3 — (водн.), отвес (II).
Диоксид свинца, PbO 2 (т)
представляет собой ионное твердое вещество коричневого цвета. При нагревании разлагается на PbO и кислород. при температуре он растворяется в концентрированной HCl с образованием PbCl 4 и комплексного иона
PbCl 6 2-. При нагревании эти вещества выделяют газообразный хлор. PbO 2 (т)
также растворяется в концентрированном NaOH.
при температуре он растворяется в концентрированной HCl с образованием PbCl 4 и комплексного иона
PbCl 6 2-. При нагревании эти вещества выделяют газообразный хлор. PbO 2 (т)
также растворяется в концентрированном NaOH.
PbO 2 (т) + 2OH — (водн.) + 2H 2 O (л) Pb (OH) 6 2- (водн.).
Гидроксид свинца (IV) неизвестен; Вместо этого осаждается PbO 2 (т).
Фосфор, сера и хлор.
Все образуют молекулярные оксиды, которые кислые.
Оксид фосфора (III) и
оксид фосфора (V) имеет молекулярные формулы P 4 O 6 (s) и P 4 O 10 (s)
но часто встречается как P 2 O 3 (s) и P 2 O 5 (s).Они реагируют с водой с образованием слабой кислоты H 3 PO 3 с p K 1 2. 0, и немного более сильная кислота, H 3 PO 4 с p K 1 1.49. Это иллюстрирует общую тенденцию к тому, что оксид с более высокой степенью окисления
более кислый.
0, и немного более сильная кислота, H 3 PO 4 с p K 1 1.49. Это иллюстрирует общую тенденцию к тому, что оксид с более высокой степенью окисления
более кислый.
P 2 O 3 (т) + 2H 2 O (л) 2H 3 PO 3 (водн.)
P 2 O 5 (т) + 2H 2 O (л) 2H 3 PO 4 (водн.)
Сернистый газ и сера триоксид растворяется в воде с образованием слабой кислоты, H 2 SO 3 с p K 1 1.81) и очень сильной кислоты H 2 SO 4 . Обратите внимание, что даже в в этом случае вторая ионизация достаточно мала, чтобы оказать очень небольшое влияние на pH; см. страницу «pH серной кислоты».
Хлор образует несколько оксидов
из которых наиболее важными являются Cl 2 O и Cl 2 O 7 . Они
реагируют с водой с образованием слабокислой HClO с p K a 7,53), и очень
сильная кислота, HClO 4 .
Они
реагируют с водой с образованием слабокислой HClO с p K a 7,53), и очень
сильная кислота, HClO 4 .
Cl 2 O (г) + 2H 2 O (л) 2HClO (водн.)
Класс 2 O 7 (л) + 2H 2 O (л) 2HClO 4 (водн.)
3 d металлические блоки
Оксид скандия очень аналогичен оксиду алюминия
Важнейший оксид титана представляет собой TiO 2 , который является кислым.
Ванадий имеет четыре основных
степени окисления. VO и V 2 O 3 являются ионными и основными и растворяются
в кислотах, чтобы получить ион сирени [V (H 2 O) 6 ] 2+ и
сине-зеленый [V (H 2 O) 6 ] 3+ ион.Оба эти иона
легко окисляется до V (IV) или V (V). ВО 2 бывает ионным и амфотерным. Он растворяется в
кислоты с образованием синего иона VO 2+ (вероятно [VO (H 2 O) 5 ] 2+ )
и в концентрированной щелочи с получением коричневого иона VO 4 4-. В 2 О 5 имеет пограничную ионно-ковалентную структуру. Он обратимо теряет кислород при нагревании, и это
может быть, поэтому это такой эффективный катализатор в контактном процессе для превращения
диоксид серы в триоксид серы.Он амфотерный.
В 2 О 5 имеет пограничную ионно-ковалентную структуру. Он обратимо теряет кислород при нагревании, и это
может быть, поэтому это такой эффективный катализатор в контактном процессе для превращения
диоксид серы в триоксид серы.Он амфотерный.
В 2 O 5 (т) + 2H + (водн.) 2VO 2 + (водн.) + H 2 O (l) желтый раствор
В 2 O 5 (т) + 6OH — (водн.) 2VO 4 3- ( водн.) + 3H 2 O (л) бесцветный раствор
Два основных оксида хрома это зеленый Cr 2 O 3 , который является ионным, и красный CrO 3 который ковалентен.Первый является амфотерным в виде зелено-серого осадка Cr (OH) 3 растворяется в кислотах с образованием пурпурного иона [Cr (OH) 6 ] 3+ , а в щелочи
чтобы получить зеленый раствор, который, возможно, может содержать Cr (OH) 4 — ион. В растворе аммиака зелено-серый осадок растворяется с образованием розово-пурпурного цвета.
[Cr (NH 3 ) 6 ] 3+ комплексный ион.
В растворе аммиака зелено-серый осадок растворяется с образованием розово-пурпурного цвета.
[Cr (NH 3 ) 6 ] 3+ комплексный ион.
[Cr (H 2 O) 6 ] 3+ (водн.) + 3OH — (водн.) Cr (OH) 3 (т.) + 6H 2 O (л)
Это депротонирование или кислотно-основная реакция.
Cr (OH) 3 (т) + 6NH 3 (водн.) [Cr (NH 3 ) 6 ] 3+ (водн.) + 3OH — (водн.)
Это обмен лиганда реакция.
Триоксид хрома является кислым и растворяется в воде с образованием довольно сильной кислоты, H 2 CrO 4 с p K a 0,74. При нагревании он теряет кислород с образованием Cr 2 O 3 . При лечении с щелочь раствор содержит желтый ион CrO 4 2- (водн.).Это реагирует с сильными кислотами, чтобы получить оранжевый раствор, содержащий ион дихромата (VI):
| CrO 3 (т) | + H 2 O (л) | H 2 CrO 4 (водн. ) ) | ||||
| 2CrO 4 2- (водн.) | + 2H + (водн.) | Cr 2 O 7 2- (водн.) | + H 2 O (л) | |||
| желтый | оранжевый |
Соединения марганца (II) содержат
очень бледно-розовый ион d 5 , устойчивый к окислению.Если добавлена щелочь
к раствору, содержащему ион Mn 2+ (водн.), не совсем белый осадок Mn (OH) 2 легко окисляется воздухом до коричневого гидратированного Mn 2 O 3 и затем, возможно,
до 2MnO 2 .H 2 O. Уменьшение пурпурного MnO 4 — ион в щелочном растворе (например, алкенами) дает коричневый гидратированный MnO 2.
Оксид железа (II) FeO трудно приготовить, так как он быстро окисляется на воздухе с образованием Fe 2 O 3 , который содержит ион d 5 .Оба эти оксида являются основными. Свежее осажденный Fe (OH) 2 имеет зеленый цвет, но быстро темнеет на воздухе и окончательно образует коричневый Fe (OH) 3 .
Розовый кобальт соединений содержат ион [Co (H 2 O ) 6 ] 2+ . При добавлении NaOH a образуется осадок Co (OH) 2 , который сначала становится синим, но затем становится розовым потепление. Синяя форма может иметь четыре, а не шесть групп OH — вокруг каждой. ион кобальта в твердом состоянии.С аммиаком Co (OH) 2 растворяется с образованием комплекса который подвергается окислению на воздухе, давая коричневый цвет [Co (NH 3 ) 6 ] 3+ (водн.) ион.
Растворы никеля (II)
содержащий зеленый [Ni (H 2 O) 6 ] 2+ (водн. ) ион дает, с
NaOH, бледно-зеленый осадок Ni (OH) 2 , который растворяется в аммиаке с образованием
фиолетовый [Ni (NH 3 ) 6 ] 2+ (водн.) ион.
) ион дает, с
NaOH, бледно-зеленый осадок Ni (OH) 2 , который растворяется в аммиаке с образованием
фиолетовый [Ni (NH 3 ) 6 ] 2+ (водн.) ион.
При оксид меди (I) Cu 2 O (т) обрабатывается водной серной кислотой, первоначально образуется ион Cu + (водн.) диспропорционирует с образованием коричневого осадка Cu (s) и синего иона Cu 2+ (водн.), Гидратированный ион [Cu (H 2 O) 6 ] 2+ (водн.) Содержит четыре воды молекулы более прочно связаны, чем две другие, и именно эти молекулы воды являются замещается, когда бледно-голубой Cu (OH) 2 (s) растворяется в водном аммиаке с образованием темно-синий [Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ (водн.) ион.
Оксид цинка становится желтым
при нагревании и снова становится белым при охлаждении. Это результат движения ионов внутри
кристаллическая решетка обратимая. Он амфотерный, что дает [Zn (H 2 O) 4 ] 2+ (водн.)
ион с кислотами и Zn (OH) 3 — (водн.) и Zn (OH) 4 2- (водн.)
ионы при обработке NaOH. Он также реагирует с аммиаком (контраст Al (OH) 3 (s),
что не дает) с образованием иона [Zn (NH 3 ) 4 ] 2+ (водн.).
Он амфотерный, что дает [Zn (H 2 O) 4 ] 2+ (водн.)
ион с кислотами и Zn (OH) 3 — (водн.) и Zn (OH) 4 2- (водн.)
ионы при обработке NaOH. Он также реагирует с аммиаком (контраст Al (OH) 3 (s),
что не дает) с образованием иона [Zn (NH 3 ) 4 ] 2+ (водн.).
Питер Хьюз работал на химическом факультете в г. Вестминстерская школа, где он ранее был главой науки.
Индекс проблем Домашняя страница
Амфотерный оксид Facts for Kids
Амфотерный оксид — это оксиды, которые ведут себя как кислотные, так и основные оксиды. например оксид алюминия и оксид цинка
Амфотерный оксид — это оксид, который может действовать как кислота или основание.Обычно неметаллические оксиды являются кислотными, а оксиды металлов — основными. Некоторые неметаллические оксиды нейтральны, а некоторые металлические или полуметаллические оксиды являются амфотерными. Из этих обобщений есть ряд исключений.
Из этих обобщений есть ряд исключений.
Что такое амфотерные оксиды?
“ Амфотерные оксиды — это оксиды, которые ведут себя как кислотные, так и основные оксиды. Амфотерные оксиды обладают свойствами как кислотных, так и основных оксидов, которые нейтрализуют как кислоты, так и основания ».
Амфотерные оксиды растворяются в воде с образованием щелочных растворов.Щелочные растворы содержат ионы гидроксида. Таким образом, оксид алюминия (Al2O3) реагирует с соляной кислотой с образованием хлорида алюминия и воды. С раствором гидроксида натрия образует алюминат натрия (NaAlO2) и воду. Другие распространенные примеры амфотерных оксидов включают ZnO, SnO и PbO.
Как определить амфотерные оксиды?
Оксиды — это соединения металлов или неметаллов с кислородом. Есть четыре типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями с образованием солей и воды.Амфотерные оксиды, среди многих других, включают оксид свинца и оксид цинка. Примеры включают аминокислоты и белки, которые имеют классы аминов и карбоновых кислот и молекул, которые могут быть самоионизированными, такие как вода.
Примеры включают аминокислоты и белки, которые имеют классы аминов и карбоновых кислот и молекул, которые могут быть самоионизированными, такие как вода.
Амфотерные оксиды — это кислородные соединения, которые обладают как кислотными, так и основными характеристиками. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой. Это демонстрирует основные свойства соединений. Точно так же щелочь реагирует с образованием соли и воды, демонстрируя кислотные свойства. Пример: оксид алюминия.
Все оксиды могут быть получены путем нагревания элемента в кислороде. Реакция водных растворов тригалогенидов металлов с гидроксидом дает оксиды в гидратированной форме. Спускаясь вниз по группе, происходит переход от кислых оксидов через амфотерные к основным из-за усиления металлического характера соответствующих элементов.
Примеры амфотерных оксидов
Слово амфотерный означает и кислоту, и основание. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды алюминия и цинка являются примерами. Они образуют соли, когда вступают в реакцию с кислотами. Они также реагируют со щелочами с образованием сложных солей.
Оксиды алюминия и цинка являются примерами. Они образуют соли, когда вступают в реакцию с кислотами. Они также реагируют со щелочами с образованием сложных солей.
Примеры:
ZnO (т) + 2HNO3 (водн.) → Zn (NO3) 2 (водн.) + H3O (ж)
ZnO (т) + 2NaOH (водн.) → Na2ZnO2 (водн.) + H3O (ж)
Al2O3 (т.) + 6HCl (водн.) → 2AlCl3 (водн.) + 3h3O (ж)
Al2O3 (т.) + 2NaOH (водн.) → 2NaAlO2 (водн.) + H3O (л)
Цинкаты и алюминаты имеют окончание -ат, чтобы показать, что их ионы являются составными ионами, содержащими кислород — скорее, как сульфаты, карбонаты и нитраты, что указывает на то, что ионы — это ZnO22-, а алюминатные ионы — это AlO2–.Ионы записываются как Zn (OH) 42- и Al (OH) 4–. Обратите внимание, что цинкат и алюминат натрия растворимы в воде.
Список литературы
.
