Таблица растворимости солей, кислот и оснований
Содержание:
Таблица растворимости вместе с таблицей Менделеева являются основным теоретическим материалом при изучении химии! Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Если при изучении материала на данной странице у Вас возникнут вопросы, Вы всегда можете задать их на нашем форуме. Также на Вам помогут решить задачи по химии, теории вероятности, математике, геометрии и многим другим предметам!
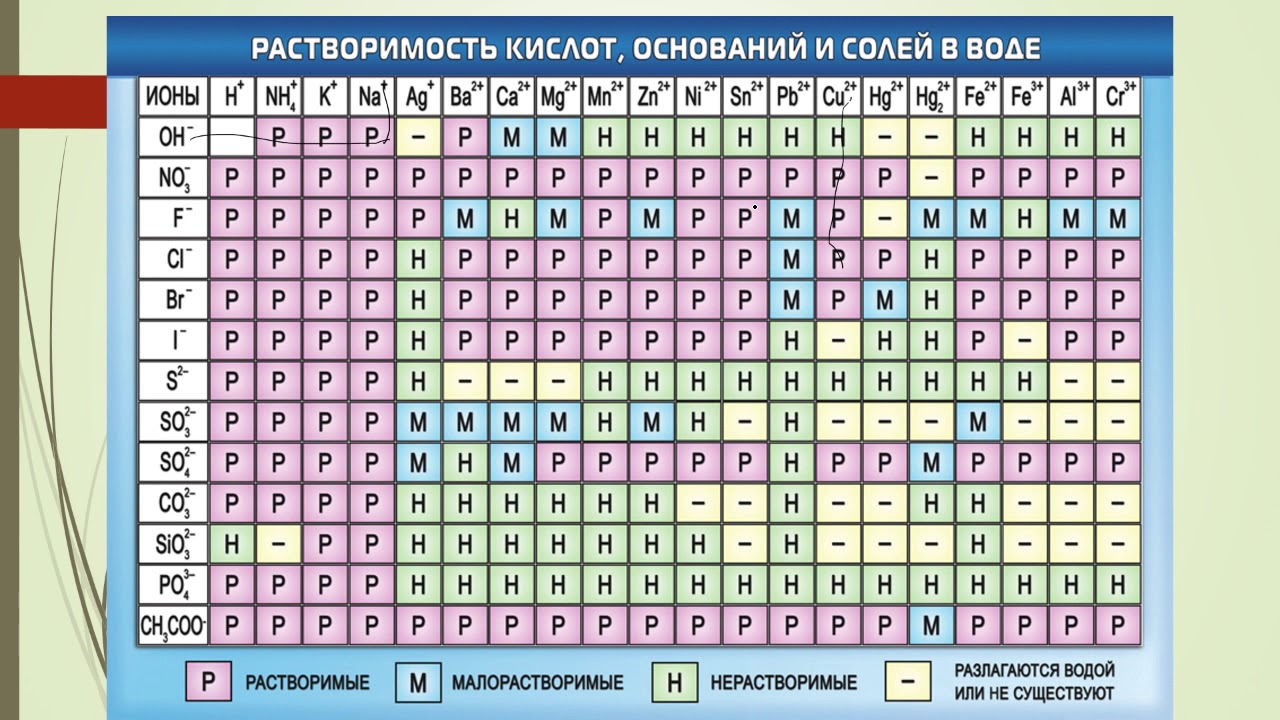
Полная таблица растворимости солей, кислот и оснований
Условные обозначения таблицы растворимости:
Р — вещество хорошо растворимо в воде;
М — вещество малорастворимо в воде;
Н — вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах;
РК — вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах;
Г — вещество полностью гидролизуется при растворении и не существует в контакте с водой;
— — вещество не существует.
Стандартная (школьная) таблица растворимости
Таблица растворимости используют для проверки условий протекания реакции, так как одним из условий протекания реакции является образование осадка (необратимость протекания реакции), то по таблице расворимости можно проверить образование осадка и тем самым определить, протекает реакиция или нет.
Помимо таблицы растворимости на сайте Вы можете посмотреть тригонометрические формулы, таблицу производных и таблицу интегралов. Пользуйтесь на здоровье!
Слишком сложно?
Таблица растворимости солей, кислот и оснований не по зубам? Тебе ответит эксперт через 10 минут!
Соли, растворимость и устойчивость Реакции солей в воде.
Соль можно определить как соединение, которое образуется в результате реакции между кислотой и основанием, но не является водой. В данном разделе будут рассмотрены те свойства солей, которые связаны с ионными равновесиями.
реакции солей в воде
Несколько позже будет показано, что растворимость—это относительное понятие. Однако для целей предстоящего обсуждения мы можем грубо подразделить все соли на растворимые и нерастворимые в воде.
Некоторые соли при растворении в воде образуют нейтральные растворы. Другие соли образуют кислые либо щелочные растворы. Это обусловлено протеканием обратимой реакции между ионами соли и водой, в результате которой образуются сопряженные кислоты либо основания. Окажется ли раствор соли нейтральным, кислым или щелочным-зависит от типа соли. В этом смысле существуют четыре типа солей.
Соли, образуемые сильными кислотами и слабыми основаниями. Соли этого типа при растворении в воде образуют кислый раствор. В качестве примера приведем хлорид аммония Nh5Cl. При растворении этой соли в воде ион аммония действует как
Избыточное количество ионов h4O+, образуемое в этом процессе, обусловливает кислые свойства раствора.
Соли, образуемые слабой кислотой и сильным основанием. Соли этого типа при растворении в воде образуют щелочный раствор. В качестве примера приведем ацетат натрия Ch4COONa1 Ацетат-ион действует как основание, акцептируя протон у воды, которая выступает в этом случае в роли кислоты:
Избыточное количество ионов ОН-, образующихся в этом процессе, обусловливает щелочные свойства раствора.
Соли, образуемые сильными кислотами и сильными основаниями. При растворении в воде солей этого типа образуется нейтральный раствор. В качестве примера приведем хлорид натрия NaCl. При растворении в воде эта соль полностью ионизируется, и, следовательно, концентрация ионов Na+ оказывается равной концентрации ионов Cl-. Поскольку ни тот, ни другой ион не вступает в кислотно-основные реакции с водой, в растворе не происходит образования избыточного количества ионов h4O+ либо ОН . Поэтому раствор оказывается нейтральным.
Соли, образуемые слабыми кислотами и слабыми основаниями.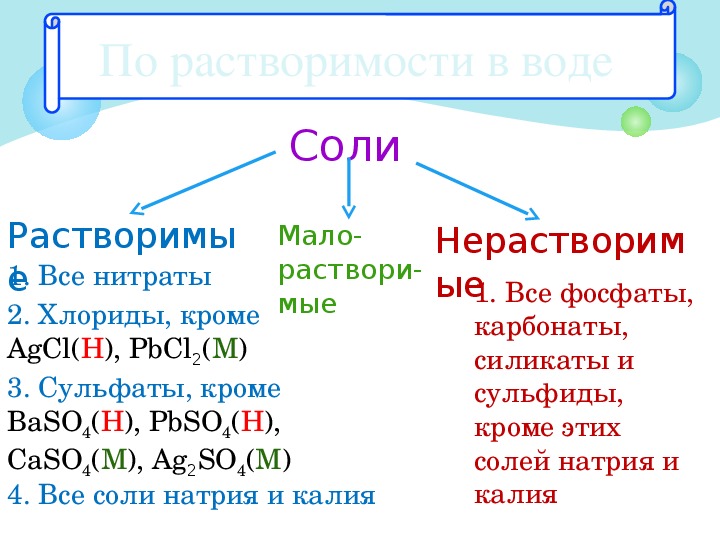 Примером солей такого типа является ацетат аммония. При растворении в воде ион аммония реагирует с водой как кислота, а ацетат-ион реагирует с водой как основание. Обе эти реакции описаны выше. Водный раствор соли, образованной слабой кислотой и слабым основанием, может быть слабокислым, слабощелочным либо нейтральным в зависимости от относительных концентраций ионов h4O+ и ОН-, образуемых в результате реакций катионов и анионов соли с водой. Это зависит от соотношения между значениями констант диссоциации катиона и аниона.
Примером солей такого типа является ацетат аммония. При растворении в воде ион аммония реагирует с водой как кислота, а ацетат-ион реагирует с водой как основание. Обе эти реакции описаны выше. Водный раствор соли, образованной слабой кислотой и слабым основанием, может быть слабокислым, слабощелочным либо нейтральным в зависимости от относительных концентраций ионов h4O+ и ОН-, образуемых в результате реакций катионов и анионов соли с водой. Это зависит от соотношения между значениями констант диссоциации катиона и аниона.
Оглавление:
Химические свойства солей — урок. Химия, 8–9 класс.
1. Соли являются электролитами.
В водных растворах соли диссоциируют на положительно заряженные ионы (катионы) металлов и отрицательно заряженные ионы (анионы) кислотных остатков.
Например, при растворении кристаллов хлорида натрия в воде положительно заряженные ионы натрия и отрицательно заряженные ионы хлора, из которых образована кристаллическая решётка этого вещества, переходят в раствор:
NaCl→Na++Cl−.
При электролитической диссоциации сульфата алюминия образуются положительно заряженные ионы алюминия и отрицательно заряженные сульфат-ионы:
Al2SO43→2Al3++3SO42−.2. Соли могут взаимодействовать с металлами.
В ходе реакции замещения, протекающей в водном растворе, химически более активный металл вытесняет менее активный.
Например, если кусочек железа поместить в раствор сульфата меди, он покрывается красно-бурым осадком меди. Раствор постепенно меняет цвет с синего на бледно-зелёный, поскольку образуется соль железа(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Видеофрагмент:
взаимодействие сульфата меди(\(II\)) с железом |
При взаимодействии хлорида меди(\(II\)) с алюминием образуются хлорид алюминия и медь:
2Al+3CuCl2→2AlCl3+3Cu↓.
3. Соли могут взаимодействовать с кислотами.
Протекает реакция обмена, в ходе которой химически более активная кислота вытесняет менее активную.
Например, при взаимодействии раствора хлорида бария с серной кислотой образуется осадок сульфата бария, а в растворе остаётся соляная кислота:
BaCl2+h3SO4→BaSO4↓+2HCl.
При взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция и угольная кислота, которая тут же разлагается на углекислый газ и воду:
CaCO3+2HCl→CaCl2+h3O+CO2↑⏟h3CO3.
Видеофрагмент:
Взаимодействие кислот с солями |
4. Растворимые в воде соли могут взаимодействовать со щелочами.
Реакция обмена возможна в том случае, если в результате хотя бы один из продуктов является практически нерастворимым (выпадает в осадок).
Например, при взаимодействии нитрата никеля(\(II\)) с гидроксидом натрия образуются нитрат натрия и практически нерастворимый гидроксид никеля(\(II\)):
NiNO32+2NaOH→NiOh3↓+2NaNO3.
Видеофрагмент:
Взаимодействие нитрата никеля(\(II\)) с гидроксидом натрия |
При взаимодействии карбоната натрия (соды) с гидроксидом кальция (гашёной известью) образуются гидроксид натрия и практически нерастворимый карбонат кальция:
Na2CO3+CaOh3→2NaOH+CaCO3↓.
5. Растворимые в воде соли могут вступать в реакцию обмена с другими растворимыми в воде солями, если в результате образуется хотя бы одно практически нерастворимое вещество.
Например, при взаимодействии сульфида натрия с нитратом серебра образуются нитрат натрия и практически нерастворимый сульфид серебра:
Na2S+2AgNO3→2NaNO3+Ag2S↓.
Видеофрагмент:
Взаимодействие сульфида натрия с нитратом серебра |
При взаимодействии нитрата бария с сульфатом калия образуются нитрат калия и практически нерастворимый сульфат бария:
BaNO32+K2SO4→2KNO3+BaSO4↓.
6. Некоторые соли при нагревании разлагаются.
Разложение солей может происходить:
- без изменения степени окисления элементов;
- с изменением степени окисления элементов (то есть, протекают окислительно-восстановительные реакции).
A. Реакции разложения солей, в которых степени окисления элементов не изменяются.
При сильном нагревании карбонат кальция (мел, известняк, мрамор) разлагается, образуя оксид кальция (жжёную известь) и углекислый газ:
CaCO3⇄t°CaO+CO2↑.
Видеофрагмент:
| Разложение мела при нагревании |
Гидрокарбонат натрия (пищевая сода) при небольшом нагревании разлагается на карбонат натрия (соду), воду и углекислый газ:
2NaHCO3⇄t°Na2CO3+h3O+CO2↑.
Видеофрагмент:
| Разложение гидрокарбоната натрия |
Кристаллогидраты солей при нагревании теряют воду. Например, пентагидрат сульфата меди(\(II\)) (медный купорос), постепенно теряя воду, превращается в безводный сульфат меди(\(II\)):
CuSO4⋅5h3O→t°CuSO4+5h3O.
При обычных условиях образовавшийся безводный сульфат меди можно превратить в кристаллогидрат:
CuSO4+5h3O→CuSO4⋅5h3O
Видеофрагмент:
| Разрушение и образование медного купороса |
Аналогичная химическая реакция протекает, когда к гемигидрату сульфата кальция (жжёному гипсу) при помешивании добавляют воду. Получившаяся кашица быстро застывает в результате образования дигидрата сульфата кальция (гипса):
CaSO4⋅0,5h3O+1,5h3O→CaSO4⋅2h3O
Видеофрагмент:
| Застывание гипса |
Б. Окислительно-восстановительные реакции разложения солей.
Окислительно-восстановительные процессы протекают при разложении нитратов.
Например, при термическом разложении нитрата калия образуются нитрит этого металла и кислород:
2KN+5O−23⟶t°2KN+3O2+O2↑0
Видеофрагмент:
Разложение нитрата калия |
Разложение перманганата калия в лабораторных условиях можно использовать для получения кислорода. При разложении этой соли, кроме кислорода, образуются манганат калия и оксид марганца(\(IV\)):
2KMn+7O−24⟶t°K2Mn+6O4+Mn+4O2+O2↑0
Свойства солей
Соли — это сложные вещества,
состоящие из одного (нескольких) атомов металла (или более сложных
катионных групп, например, аммонийных
групп NН4+,
гидроксилированных групп Ме(ОН)nm+) и одного
(нескольких) кислотных
остатков. Общая формула солей МеnАm,
где А — кислотный остаток. Соли (с точки зрения электролитической диссоциации)
представляют собой электролиты, диссоциирующие в водных растворах на
катионы металла (или аммония NН4+) и анионы кислотного остатка.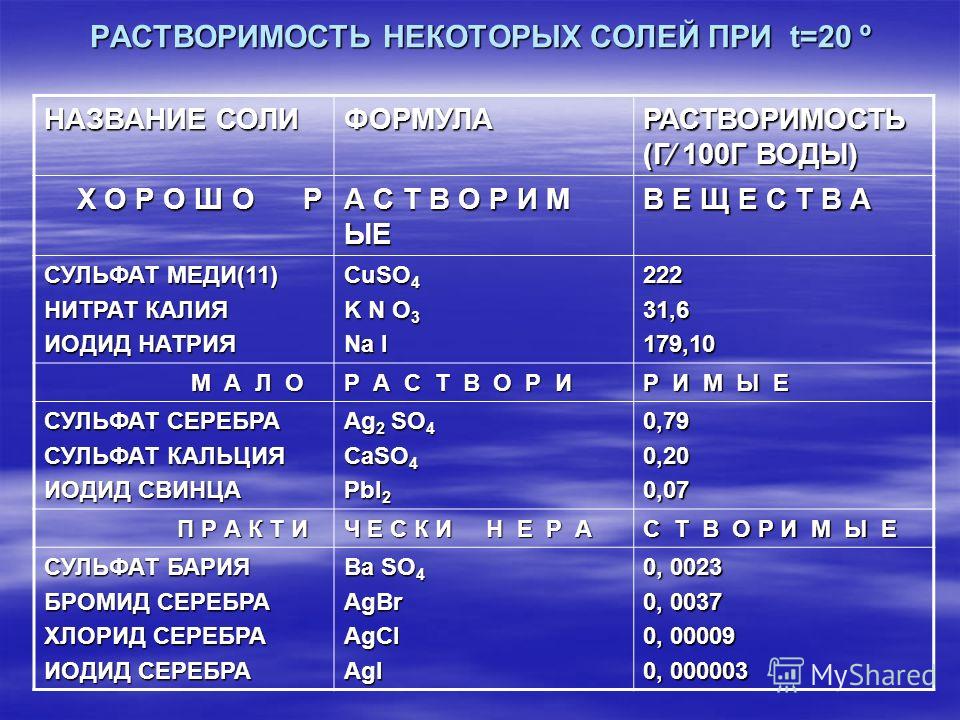
Классификация. По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные (см. таблицу).
Таблица — Классификация солей по составу
| СОЛИ | |||||
|
Средние (нормальные) — продукт полного замещения атомов водорода в кислоте на металл AlCl3 |
Кислые(гидросоли) - продукт неполного замещения атомов водорода в кислоте на металл КHSO4 |
Основные (гидроксосоли) —продукт неполного замещения ОН-групп основания на кислотный остаток FeOHCl |
Двойные — содержат два разных металла и один кислотный остаток КNaSO4 |
Смешанные — содержат один металл и несколько кислотных остатков CaClBr |
Комплексные [Cu(NH3)4]SO4 |
Физические свойства. Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Соли — это
кристаллические вещества разных цветов и разной растворимости в
воде.
Химические свойства
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
NaCl Na+ + Cl–.
КNaSO4 К+ + Na+ + SO42– .
CaClBr Ca2+
КHSO4 К+ + НSO4– HSO4– H+ + SO42–.
FeOHClFeOH+
+ Cl–
FeOH+Fe2+
+ OH–.
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42– [Cu(NH3)4]2+ Cu2+ + 4NH3.
2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н
+ (кислая среда) или ионы ОН– (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н+ (ОН–) окрашенное соединение.
AlCl3 + H2O AlOHCl2 + HCl Al3+ + H2O AlOH2+ + H+
3) Разложение при нагревании. При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
При
нагревании некоторых солей они разлагаются на оксид металла и
кислотный оксид:
СаСO3 СаO + СО
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl Ag + Cl2.
Соли, образованные кислотами-окислителями, разлагаются сложнее:
2КNO3 2КNO2 + O2.
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 ®
2NaCl + CO2
+ H2O
2H+ + CO32–®
CO2
+ H2O.
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl ® FeCl2 + H2O.
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 ® 2NaHSO4.
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
CuSO4 +
2NaOH
®
Cu(OH)2¯
+ Na2SO4 Cu2+
+ 2OH–
®
Cu(OH)2¯.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag+ + Cl– ® AgCl¯.
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 ® Cu¯ + FeSO4 Fe + Cu2+ ® Cu¯ + Fe2+.
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
8) Электролиз (разложение под действием постоянного
электрического тока). Соли подвергаются электролизу в растворах
и расплавах:
Соли подвергаются электролизу в растворах
и расплавах:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
2NaClрасплав 2Na + Cl2.
9) Взаимодействие с кислотными оксидами.
СО2 + Na2SiO3 ® Na2CO3 + SiO2
Na2CO3 + SiO2 СО2 + Na2SiO3
Получение. 1) Взаимодействием металлов с неметаллами:
2Na + Cl2
®
2NaCl.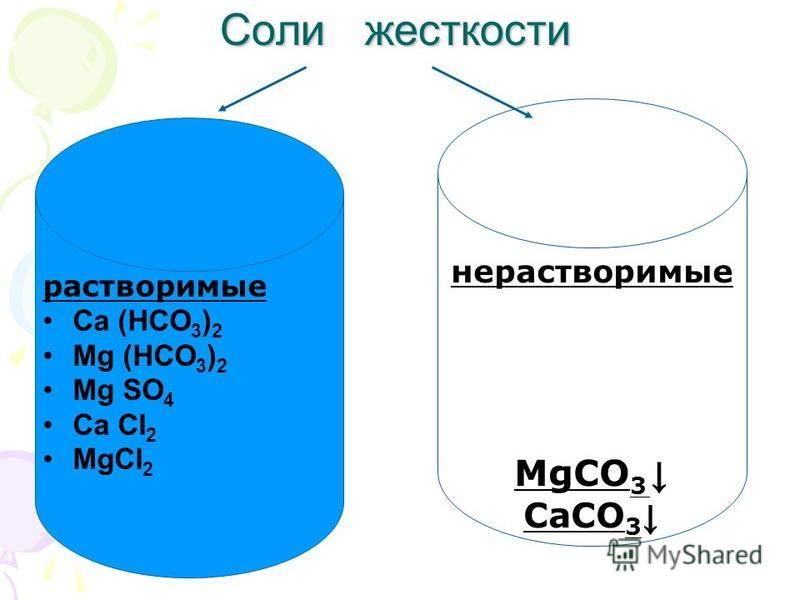
2) Взаимодействием основных и амфотерных оксидов с кислотными оксидами:
CaO + SiO2 CaSiO3 ZnO + SO3 ZnSO4.
3) Взаимодействием основных оксидов с амфотерными оксидами:
Na2O + ZnO Na2ZnO2.
4) Взаимодействием металлов с кислотами:
2HCl + Fe ® FeCl2 + H2.
5) Взаимодействием основных и амфотерных оксидов с кислотами:
Na2O
+ 2HNO3
® 2NaNO3
+ H2O
ZnO +
H2SO4 ®
ZnSO4
+ H2O.
6) Взаимодействием амфотерных оксидов и гидроксидов со щелочами:
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
7) Взаимодействием гидроксидов металлов с кислотами:
Ca(OH)2+ H2SO4
®
CaSO4¯
+ 2H2O Zn(OH)2+ H2SO4
®
ZnSO4 + 2H2O.
8) Взаимодействием кислот с солями:
2HCl + Na2S ® 2NaCl + Н2S.
9) Взаимодействием солей со щелочами:
ZnSО4 + 2NaOH ® Na2SO4 + Zn(OH)2¯.
10) Взаимодействием солей друг с другом:
AgNO3 + KCl ® AgCl¯ + KNO3.
Л.А. Яковишин
Калия соли, растворимость — Справочник химика 21
Как видно из табл. 6 и 7, хлористые соли металлов хуже растворимы, чем бромистые и иодистые. Соли натрия лучше растворимы, чем соли калия, но растворимость едкого кали больше, чем растворимость едкого натра. Таким образом, соотношение растворимостей этих неорганических соединений в метиловом и в этиловом спиртах остается примерно таким же, как и в воде. [c.17]
Таким образом, соотношение растворимостей этих неорганических соединений в метиловом и в этиловом спиртах остается примерно таким же, как и в воде. [c.17]
Из растворов органических веществ осаждением органическими растворителями часто удается выделить неорганические соли, так как большинство неорганических солей практически нерастворимо в неполярных растворителях. Однако при этом необходимо учитывать, что существует большое число неорганических солей, растворимых в спирте, как, например, сулема, азотнокислое серебро, иодистый калий и т. д. Более подробные сведения о растворимости солей в органических растворителях приведены в табл. 31 на стр. 393. [c.209]
Вследствие такого комплексообразования иона калия его гидроксид, а также различные соли (например, перманганат калия) приобретают растворимость в неполярных органических растворителях, в том числе и в бензоле. В чистом бензоле как гидроксид калия, так и неорганические соли калия нерастворимы. [c.106]
[c.106]
Сколько потребуется взять воды и нитрата калия, чтобы приготовить раствор, из которого при охлаждении от 80 до 18°С выпадет в осадок 35 г этой соли Растворимость нитрата калия пр 1 18 и 80 С равиа соответственно 30 и 170 г на 100 г воды. [c.106]
Насыщенные при 20°С водные растворы нитратов натрия, калия и аммония содержат соответственно 46,8%, 24,1% и 66,1% соли растворимость при 20°С сульфата аммония — 37,2 г и хлорида калия — 34 г. Расположите эти соли по возрастающей растворимости укажите, можно ли из нитрата натрия получить нитрат калия. [c.92]
Наконец, рассмотрим растворение в воде какой-либо соли, растворимость которой растет с температурой, например, хлорида калия. Пусть это будет система, которая в начальном состоянии представляет собой насыщенный раствор хлорида калия над его кристаллами. Если повысить температуру системы, то в силу увеличения растворимости раствор перестанет быть насыщенным и начнется растворение дополнительного количества хлорида калия. Очевидно, что растворение будет происходить на поверхности кристаллов, Т. е. в данной области возникнет более высокая концентрация соли, чем в остальной части раствора. В результате диффузии (см. 18.1) постепенно будет происходить выравнивание концентраций (этот процесс можно ускорить механическими воздействиями — перемешиванием, встряхиванием) и в конечном итоге во всем объеме образуется раствор с концентрацией, соответствующей растворимости при новой температуре. Однако процесс будет развиваться через промежуточные неравновесные состояния с неравномерным распределением концентраций по фазе переменного состава — раствору. [c.206]
Очевидно, что растворение будет происходить на поверхности кристаллов, Т. е. в данной области возникнет более высокая концентрация соли, чем в остальной части раствора. В результате диффузии (см. 18.1) постепенно будет происходить выравнивание концентраций (этот процесс можно ускорить механическими воздействиями — перемешиванием, встряхиванием) и в конечном итоге во всем объеме образуется раствор с концентрацией, соответствующей растворимости при новой температуре. Однако процесс будет развиваться через промежуточные неравновесные состояния с неравномерным распределением концентраций по фазе переменного состава — раствору. [c.206]
Определение препарата методом нейтрализации проводится косвенно через взаимодействие о йодидом калия. При действии на ртути окись желтую раствором йодида калия образуется растворимая комплексная соль и щелочь, которая оттитровывается кислотой по метиловому оранжевому. [c.129]
Карбоновые кислоты образуют с ионами натрия и калия соли, растворимые в воде.
 Натриевые соли высших жирных кисло плохо растворимы, хотя и проявляют поверхностно-активные свойства. [c.41]
Натриевые соли высших жирных кисло плохо растворимы, хотя и проявляют поверхностно-активные свойства. [c.41]Чистота осадка. Сернокислый свинец захватывает при осаждении некоторые посторонние соли, особенно сернокислые соли щелочных металлов, а также сурьму (если она не была отделена предварительно). Соли щелочных металлов с сернокислым свинцом образуют двойные соли, растворимость которых иногда меньше, чем растворимость чистого сернокислого свинца. Наиболее характерно осаждение сернокислого калия, что связано с образованием двойной соли состава РЬЗО -КгЗО . [c.175]
Соли щелочных металлов, за редким исключением, являются солями растворимыми, относящимися к группе сильных электролитов. Соли слабых кислот подвергаются в водном растворе гидролизу растворы их имеют щелочную реакцию. Летучие соли щелочных металлов окрашивают бесцветное пламя горелки в характерные цвета соединения натрия—в желтый цвет, лития — в карминовый, калия — в фиолетовый, рубидия — в краснофиолетовый и цезия — в фиолетовый. [c.183]
[c.183]
Почти все соли калия хорошо растворимы в воде, но в отличие от солей натрия не содержат кристаллизационной воды. Вместе с азотом и фосфором калий — один из основных элементов питания растений при отсутствии его они погибают. [c.292]
Двойная калиево-кальциевая железистосинеродистая соль еще более важна. Эта соль получается как промежуточный продукт в большинстве способов получения или очистки железистосинеродистого калия. При прибавлении хлористого калия к раствору железиетосинеродистого кальция или хлористого кальция к раствору железистосйнеоодистого калия получается двойная соль в виде мелких безводных кристаллов, которые только слегка растворимы в воде. Прч 15° 100 см3 воды оастворя-ют 0,35 г двойной аммонийной соли и 0,72 г двойной калиевой соли. Растворимость этих соединений в гооячей воде заметно не увеличивается, Ферроцианиды тяжелых металлов.—Хотя немногие из этих соединений имеют значение для промышленной химии, некоторые из них представляют интерес для аналитической химии вследствие того факта, что растворимые ферроцианиды часто употребляются для открытия и определения металлов. Такие растворы ферроцианидов обычно применяются для открытия небольших количеств меди, так как этот реактив является одним из наиболее чувствительных к этому металлу. При этой реакции железистосинеродистая медь выделяется в виде красного илч красно-коричневого коллоидного осадка цвет и внешний вид несколько изменяются в зависимости от условий осаждения. [c.54]
Такие растворы ферроцианидов обычно применяются для открытия небольших количеств меди, так как этот реактив является одним из наиболее чувствительных к этому металлу. При этой реакции железистосинеродистая медь выделяется в виде красного илч красно-коричневого коллоидного осадка цвет и внешний вид несколько изменяются в зависимости от условий осаждения. [c.54]
Цианиды и роданиды. Цианиды. Цианид калия осаждает из растворов солей индия белый осадок основной соли, растворимый в избытке осадителя. При нагревании раствора из него выделяется гидроокись индия [3]. Цианид 1п(СЫ)з, образующий бесцветные моноклинные кристаллы, можно получить, нагревая индий при 350° в атмосфере НСЫ. Это вещество летучее [55]. [c.291]
По кристаллической форме, мольному объему, цвету и другим свойствам соли аммония подобны солям калия и рубидия. Такое сходство объясняется тем, что размер иона аммония (радиус 148 пм) весьма близок к размерам ионов упомянутых щелочных металлов (радиус К+=133 пм, радиус КЬ+=148 пм). Все аммонийные соли растворимы в воде и полностью диссоциируют в водном растворе. [c.197]
Все аммонийные соли растворимы в воде и полностью диссоциируют в водном растворе. [c.197]
В присутствии этанола Са2[Ге(СК)б] осаждает калий соль натрия хорошо растворима [763]. [c.36]
Аммонийные соли и соли щелочных металлов карбоновых кислот (калия, натрия) растворимы в воде, но не растворимы в неполярных растворителях большинство солей тяжелых металлов (железа, серебра, меди и т. д.) в воде не растворимы. [c.555]
Большинство солей алюминия растворимо в воде. Практически нерастворимы фосфат алюминия и основные соли уксусной кислоты. Из солей, растворимых в воде, наибольшее применение имеют хлорид и сульфат алюминия, а также двойная соль — сульфат калия-алюминия (алюмо-калиевые квасцы) КАЦЗО ). -12НаО. Все соли [c.176]
Определить концентрацию раствора и количество воды, в которой можно растворить при 40 С 200 г соли, содержащей 80 % сульфата калия, если растворимость сульфата калия при этой температуре равна 64 г.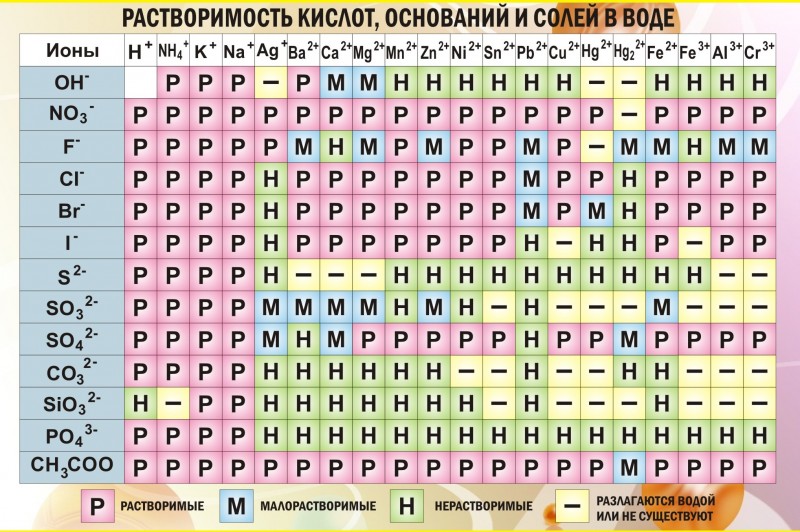 [c.147]
[c.147]
Калий играет существенную роль в превращениях углеводов. Лучший источник калия — соли ортофосфорной кислоты. Магний необходим для зеленых и пурпурных серобактерий, у которых входит в состав хлорофилла. У других бактерий магний является активатором ферментов и находится в ионном состоянии. Источником магния могут служить сернокислые и другие его соли. Кальций усваивается из растворимых солей. Роль его в клетке, как и роль натрия, не выяснена. Железо входит в состав простетических групп цитохромных ферментов. Без железа резко падает окислительная активность аэробных организмов. Микроэлементы 2п, Мп, Со, Сс1, Л, Вг, В участвуют в синтезе ферментных белков. Поэтому микроэлементы резко стимулируют жизнедеятельность микроорганизмов [c.92]
Пикриновая кислота представляет собой сильную кислоту, значительно ионизированную в водном растворе. Дпссоциа-ция ее сопровр-ждается частичной перегруппировкой в нитроновую кислоту, и это, по-видимому, является причиной углубления цвета при растворении пикриновой кислоты в воде.
 Соли пикриновой кислоты хорошо кристаллизуются многие из них, например пикрат аммония и пикрат калия, трудно растворимы в воде. В сухом виде соли пикриновой кислоты взрывают при ударе. Многие органические основания также образуют красивые труднорастворимые пикраты поэтому пикриновая кислота широко применяется для выделения и очистки таких оснований. За счет остаточных валентностей пикриновая кислота способна также соединяться со многими ароматическими (особенно многоядерными) углеводородами с образованием труднорастворимых молекулярных соединений. Так, например, нафталин образует настолько трудно растворимый пикрат СюНз СбН2(Н02)зОН, что его можно использовать для количественного определения этого углеводорода. [c.562]
Соли пикриновой кислоты хорошо кристаллизуются многие из них, например пикрат аммония и пикрат калия, трудно растворимы в воде. В сухом виде соли пикриновой кислоты взрывают при ударе. Многие органические основания также образуют красивые труднорастворимые пикраты поэтому пикриновая кислота широко применяется для выделения и очистки таких оснований. За счет остаточных валентностей пикриновая кислота способна также соединяться со многими ароматическими (особенно многоядерными) углеводородами с образованием труднорастворимых молекулярных соединений. Так, например, нафталин образует настолько трудно растворимый пикрат СюНз СбН2(Н02)зОН, что его можно использовать для количественного определения этого углеводорода. [c.562] Кз[КЬ(СМ5)б] образуется при нагревании хлорородиата калия и роданистого калия. Соль растворима в воде и спирте, экстрагируется т 3 N НС1 гексаном [42]. Концентрированные растворы роданида родия (П1) очень устойчивы, разбавленные устойчивы при pH ниже 10.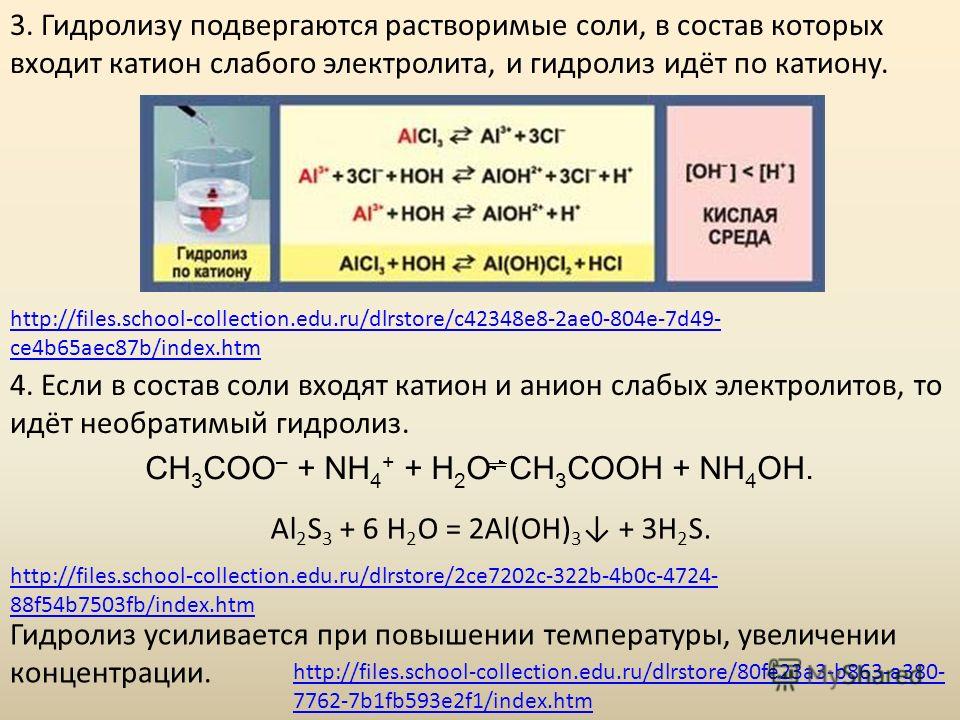 При более высоком значении pH выпадает гидроокись родия. В зависимости от концентрации NS -иона в растворе возможно образование соединений с различным количеством родано-групп во внутренней сфере [45]. [Rh( NS) - [c.55]
При более высоком значении pH выпадает гидроокись родия. В зависимости от концентрации NS -иона в растворе возможно образование соединений с различным количеством родано-групп во внутренней сфере [45]. [Rh( NS) - [c.55]
Алкалоиды Гексароданохромиат калия Соли, растворимые в ацетоне Амины IX.6 [c.330]
Обычные неорганические соли натрия и калия не растворимы в неполярных органических растворителях. Это верно и для солей неорганических анионов с небольщими органическими катионами, например для тетраметиламмония. Подобные аммонийные соли часто способны, однако, растворяться в ди-хлорметане и хлороформе. Более того, использование относительно больщих органических анионов может обеспечивать растворимость солей щелочных металлов в таких растворителях, как бензол. Например, диэтил-н-бутилмалонат натрия дает 0,14 М раствор в бензоле, для которого понижение точки замерзания неизмеримо мало, что говорит о высокой степени ассоциации. Подобным образом большие ониевые катионы (например, тетра-м-гексиламмония) делают растворимыми соли даже небольших органофобных анионов (например, гидроксид-ионов) в углеводородах. Ионофоры, т. е. молекулы, состоящие из ионов в кристаллической решетке, диссоциируют (полностью или частично) на сольватированные катионы и анионы в растворителях с высокими диэлектрическими проницаемостями. Подобные растворы в воде являются хорошими проводниками. В менее полярных растворителях даже сильные электролиты могут растворяться с образованием растворов с низкой электропроводностью это означает, что только часть растворенной соли диссоциирована на свободные ионы. Чтобы объяснить такое поведение растворов, Бьеррум выдвинул в 1926 г. гипотезу ионных пар. Впоследствии его гипотеза была усовершенствована Фуоссом [38] и рядом других исследователей. Ионные пары представляют собой ассоциаты противоположно заряженных ионов и являются нейтральными частицами. Стабильность ионных пар обеспечивается в основном кулоновскими силами, но иногда этому способствует и сильное взаимодействие с ок- [c.16]
Ионофоры, т. е. молекулы, состоящие из ионов в кристаллической решетке, диссоциируют (полностью или частично) на сольватированные катионы и анионы в растворителях с высокими диэлектрическими проницаемостями. Подобные растворы в воде являются хорошими проводниками. В менее полярных растворителях даже сильные электролиты могут растворяться с образованием растворов с низкой электропроводностью это означает, что только часть растворенной соли диссоциирована на свободные ионы. Чтобы объяснить такое поведение растворов, Бьеррум выдвинул в 1926 г. гипотезу ионных пар. Впоследствии его гипотеза была усовершенствована Фуоссом [38] и рядом других исследователей. Ионные пары представляют собой ассоциаты противоположно заряженных ионов и являются нейтральными частицами. Стабильность ионных пар обеспечивается в основном кулоновскими силами, но иногда этому способствует и сильное взаимодействие с ок- [c.16]
Окисление парафинов. Для окисления жидких и твердых парафиновых углеводородов с числом атомов углерода 10 и более наряду с перманганатом калия в качестве катализаторов могут применяться марганцевые соли растворимых в углеводородах органических кислот (такие, как нафтенаты или стеараты марганца) или просто смеси солей неопределенного состава, получающиеся нагреванием карбоната марганца с кислыми оксидатами окисления парафинов. Нафгге-наты и стеараты марганца получают аналогичным образом из карбонатов марганца и соответствующих кислот. [c.420]
Нафгге-наты и стеараты марганца получают аналогичным образом из карбонатов марганца и соответствующих кислот. [c.420]
Влияние растворителя. Растворимость большинства соединений катионов с анионами неорганических кислот резко понижается при введении органических растворителей. Так, например, сернокислый свинец или кремнефтористый калий заметно растворимы в воде, но практически нерастворимы в 50%-ном спирте. При определении калия в виде хлоропла-тината или перхлората и натрия в виде тройной соли (натрий-цинк-уранилацетат) также применяют спирт, потому что соответствующие соли заметно растворимы в воде. [c.47]
Наконец, рассмотрим растворение в воде какой-либо соли, растворимость которой растет с температурой, например хлористого калия. Здесь удобно рассмотреть систему, которая в начальном состоянии представляет собой насыщенный раствор хлористого калия, залитый над кристаллами хлористого калия. Если повысить температуру системы, то в силу увеличения растворимости раствор перестанет быть насыщенным и начнется растворение дополнительного количества хлористого калия. Очевидно, что растворение будет происходить на поверхности кристаллов хлористого калия, т. е. в данной области возникнет более высокая концентрация соли, чем в остальной части раствора. В результате диффузии постепенно будет происходить выравнивание концентраций (этот процесс можно ускорить йеханическими воздей- [c.179]
Очевидно, что растворение будет происходить на поверхности кристаллов хлористого калия, т. е. в данной области возникнет более высокая концентрация соли, чем в остальной части раствора. В результате диффузии постепенно будет происходить выравнивание концентраций (этот процесс можно ускорить йеханическими воздей- [c.179]
Краун-эфиры и другие криптанды [349]. В гл. 3 указывалось, что определенные криптанды могут окружать определенные катионы. Такая соль, как цианид калия, при взаимодействии с дицикл>огексано-18-краун-6 превращается в новую соль с тем же анионом, но катионом в которой будет намного большая частица с положительным зарядом, равномерно делокализованным по большому объему и, следовательно, менее концентрированным. Такой катион в значительно меньшей степени, чем катион калия, сольватирован водой и в большей степени склонен растворяться в органических растворителях. И хотя цианид калия обычно нерастворим в органических растворителях,-крии-татная соль растворима в большинстве из них. В этих случаях нет необходимости в водной фазе, соль просто добавляют к ор- [c.93]
В этих случаях нет необходимости в водной фазе, соль просто добавляют к ор- [c.93]
Сульфат калия образует двойную соль, растворимую в растворе KjSOi (отличие от Zt. Th, e, La., Nd и Pr). [c.610]
Как растворитель двуокись серы обладает интересными особенностями. Например, галондоводороды в ней практически нерастворимы, а свободный азот растворим довольно хорошо (причем с повышением температуры растворимость его возрастает). Элементарная сера в жидкой ЗОг нерастворима. Растворимость в ней воды довольно велика (около 1 5 по массе при обычных температурах), причем раствор содержит в основном индивидуальные молекулы НгО, а не их ассоциаты друг с другом или молекулами растворителя. По ряду С1—Вг—I растворимость галогенидов фосфора быстро уменьшается, а галогенидов натрия быстро возрастает. Фториды лития и натрия (но не калия) растворимы лучше их хлоридов и даже бромидов. Хорошо растворим Хер4, причем образующийся бесцветный раствор не проводит электрический ток. Напротив, растворы солей обычно имеют хорошую электропроводность (например, для ЫаВг при 0°С имеем К = Ъ- 10 ). Для некоторых из них были получены кристаллосольваты [например, желтый КЬ (302)4]. Подавляющее большинство солей растворимо в жидкой ЗО2 крайне мало (менее 0,1%). То же относится, по-видимому, и к свободным кислотам. [c.329]
Напротив, растворы солей обычно имеют хорошую электропроводность (например, для ЫаВг при 0°С имеем К = Ъ- 10 ). Для некоторых из них были получены кристаллосольваты [например, желтый КЬ (302)4]. Подавляющее большинство солей растворимо в жидкой ЗО2 крайне мало (менее 0,1%). То же относится, по-видимому, и к свободным кислотам. [c.329]
Вначале рассчитывают количество исходных реактивов. В обоих случаях берут 3 г дихлорида олова в расчете на безводную соль. Растворимость кристаллогидрата дихлорида олова, а также иодида калия составляет 130 г на 100 г воды. На основании этого определяют, сколько воды необходимо для приготовления концентрированных растворов дихяорида олова и иодида калия. После этого взвешивают нужные количества 5пС12-2Н20 и К1, навески помещают в конические колбы и приливают расчетное количество дистиллированной воды до полного растворения солей. К полученным растворам приливают еще 6—8 мл воды для проведения реакции (1) и в два раза больше для реакции (2).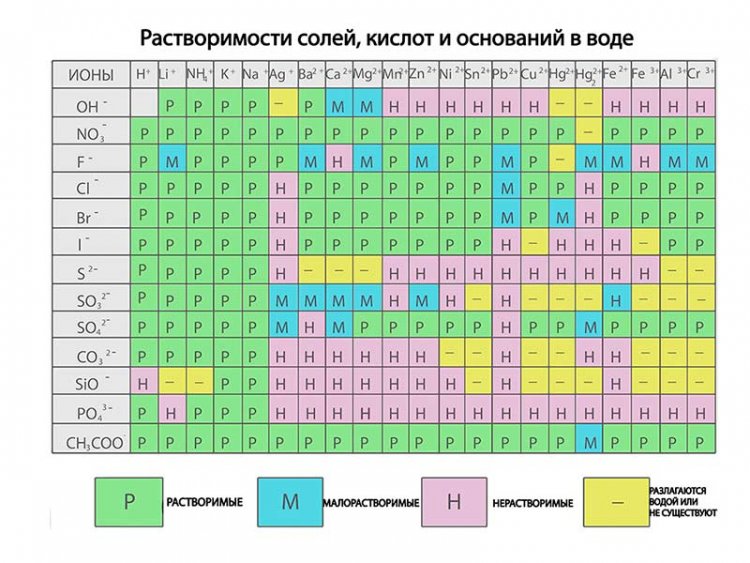 Раствор дихлорида олова подкисляют 2 н. раствором соляной кислоты. [c.124]
Раствор дихлорида олова подкисляют 2 н. раствором соляной кислоты. [c.124]
Общее положение о том, что растворимость большинства простых солей увеличивается с повышением атомного номера щелочного элемента, соблюдается только для Мер и МеС1. Среди галогенидов рубидия (как и галогенидов калия) наименьшая растворимость в воде у Rb l среди галогенидов цезия растворимость увеличивается от sl К sF. При кристаллизации из водных растворов выделяются безводные MeHal. Только Мер известны в виде кристаллогидратов [89]. [c.100]
К I аналитической группе относится также Н -ион. Его радиус (1,43 А) приблизительно равен радиусу иона калия, а растворимость его солей напоминает растворимость солей щелочных металлов. При определении растворимости солей щелочных металлов и аммония можно пользоваться следующим правилом все соли щелочных металлов и аммония практически растворимы в воде. Это правило имеет лишь редкие исключения. Нерастворимы в воде только те соли щелочных металлов, в состав которых входят крупные анионы. Например, (Nh5)зf o(NO,)J, Кз(Со(Ы02)с], КНС Н.О и др. [c.99]
Например, (Nh5)зf o(NO,)J, Кз(Со(Ы02)с], КНС Н.О и др. [c.99]
Тетрафтороборат калия и тетрафтороборат патрия — белые негигроскош1чные порошки в сухом виде па стекло пе действуют. Натриевая соль растворима в воде лучше калиевой. [c.338]
Ортованадаты Ызз О , K3VO4 и др. можно получить, сплавляя V2O5 с карбонатом или гидроокисью металла. Из них только соли натрия и калия хорошо растворимы в воде. [c.12]
Ри(ЛОз)4. При добавлении йодноватой кислоты или ее солей к азотнокислым растворам четырехвалентного плутония образуется объемистый аморфный осадок Ри(ЛОз)4 розового цвета [48, 367]. Количественное осаждение тетраиодата плутония наблюдается даже из сильнокислых сред (6 М НМОз). Влияние концентрации азотной кислоты и иодида калия на растворимость Ри(ЛОз)4 представлено на рис. 27. При обработке осадка Pu(JOз)4 аммиаком получается гидроокись плутония (IV). [c.90]
Метасиликат лития практически не растворяется в воде (соответствующие соли натрия и калия хорошо растворимы), но постепенно разлагается ею. В органических- растворителях LijSiOa не растворяется сильные кислоты разлагают его с выделением SiOa [12]. [c.61]
В органических- растворителях LijSiOa не растворяется сильные кислоты разлагают его с выделением SiOa [12]. [c.61]
Свойства соединений VIII и X в сравнении со свойствами метокси-.чированных основных веществ заслуживают особенного внимания. Соли формулы VIII в в(1де, содержащей очень небольшое количество свободной кислоты, растворяются, не гидролизуясь и образуя растворы горького вкуса соли X водой вообще заметно не расщепляются. Они нейтрального характера, наподобие солей акридиния. При смешении водного раствора соединения X с концентрированным холодным раствором бикарбо ната калия выкристаллизовывается растворимый в воде бикарбонат (XI). При встряхивании раствора хлорида со свежеоса>кденной окисью серебра [c.182]
Щелочные и щелочноземельные. соли цианистоводородной кислоты легко растворимы в воде, дают щелочную реакцию и разлагаются уже при действии угольной кислоты. Щелочные соли синильной кислоты устойчивы при прокаливании. Цианистый калий, соль, наиболее важная для органика, легко растворим в разбавленном и трудно рагуоорим в абсолютном спирте.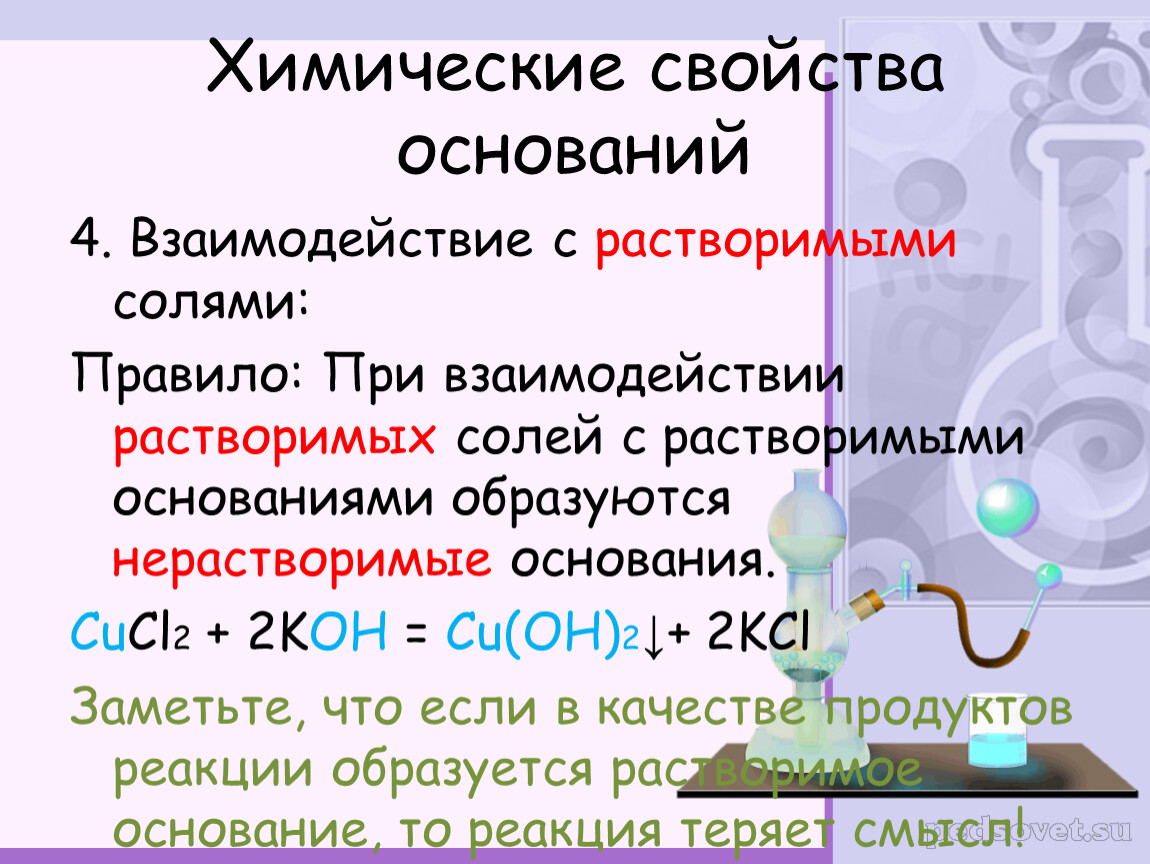 [Приготовление чистого цианистого кальция описано Франком и Фрейтагом Кислая кальциевая соль синильной кислоты a( N)a-2H N устойчива до 60 и при действии воды отщепляет цианистый водород, вследствие чего эту соль называют твердой синильной кислотой Доп. ред.] [c.22]
[Приготовление чистого цианистого кальция описано Франком и Фрейтагом Кислая кальциевая соль синильной кислоты a( N)a-2H N устойчива до 60 и при действии воды отщепляет цианистый водород, вследствие чего эту соль называют твердой синильной кислотой Доп. ред.] [c.22]
В Страссфурте встречается минерал карналлит Mg l2-K l 6Н2О, образовавшийся путем выкристаллизовывания из раствора хлоридов магния и калия. Эта двойная соль растворима р воде менее, чем чистый хлорид магния, и более, чем чистый хлорид калия. При растворении карналлита в воде двойная [c.13]
Сернокислый калий. Концентрированный раствор K2SO4 постепенно осаждает на холоду весь цирконий в виде двойной сернокислой соли циркония и калия, не растворимой в избытке реагента (отличие от А1 и Ве). Сернокислая соль циркония-калия, полученная на холоду, легко растворяется в избытке разбавленной НС1. Если же О садок образован при нагревании, то получаются вследствие гидролиза основные сернокислые соли циркония, едва растворяющиеся в НС1 (отличие от Th и Се). [c.600]
[c.600]
В то же время многие фторпроизводные ароматического ряда представляют большой интерес как инсектициды, реактивы для идентификации, лекарственные и технически полезные вещества Одним из удобных методов введения фтора в ароматическое ядро является замена диазогруппы на фтор (по Шиману) При добавлении к растворам солей диазония растворов тетра-фтороборатов натрия и аммония (аналогичная соль калия плохо растворима в воде) выпадает устойчивое соединение — тетрафтороборат диазония, которое легко выделить в твердом виде При нагревании этих тщательно высушенных солей происходит их пиролиз, приводящий к соответствующим арилфторидам Реакция протекает по механизму мономолекулярного нуклеофильного замещения, при этом арил-катион отрывает анион фтора от комплексного аниона [c.255]
Увеличить степень извлечения катализатора можно добавкой к золе 03(01 2 на стадии регенерации [42]. Гидроокись кальция реагирует с нерастворимыми соединениями калия, образуя растворимые соли калия и нерастворимые алшосиликаты кальодя. Эта реакция проводится в течение 2-4 ч в водном растворе П1м 150-200°С. Степень извлечения калия возрастает пр1 увеличении мдльнс го соотношения Са К и Са К=1 превышает 90 , а без добавки кальция она не более 70 . [c.37]
Эта реакция проводится в течение 2-4 ч в водном растворе П1м 150-200°С. Степень извлечения калия возрастает пр1 увеличении мдльнс го соотношения Са К и Са К=1 превышает 90 , а без добавки кальция она не более 70 . [c.37]
На рис. 18 приведен сравнительно простой случай таких си-стем 23, Насыщенный раствор карбоната калия в воде (точ ка Щ находится в равновесии с гидратированной солью. Растворимость К2СО3 в спирте (точка Р) очень мала. Если к смеси воды и этанола, обозначенной точкой М, добавлять безводный карбонат, в точке В система будет состоять из двух жидких фаз, в точке Е — из растворов Р и (3 и твердого гидрата, а в точке Я в равновесии будут находиться безводный карбонат калия, твердый гидрат его и насыщенный раствор /. Перегонка раствора / дает дистиллят состава К. Так как в действительности точка ] лежит гораздо ближе к точке Р, чем это показано на диаграмме, К будет представлять собой почти чистый этиловый спирт. Описанный процесс является одним из видов высаливания и часто используется для дегидратации органических веществ.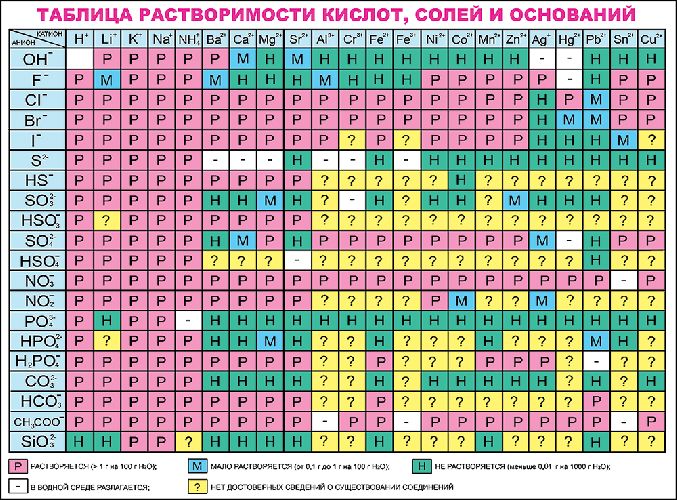 [c.39]
[c.39]
Растворимые соли помогли образовать пептиды при смене дня и ночи древней Земли
Исследователи обнаружили, что минералы, которые растворяются в воде и поглощают ее из влажного воздуха, могут «строить» пептиды из более простых строительных блоков во время циклов, призванных имитировать день и ночь на ранней Земле. Статья об этом опубликована в журнале Nature Communications.
Аминокислоты — это своего рода строительные блоки, которые связываются между собой пептидными связями и образуют белки. Химикам давно известно, что простой нагрев смесей аминокислот и их высушивание приведет к образованию пептидных связей. Выход пептидов увеличится, если добавить воду и снова просушить образец после перемешивания. Подвергать аминокислоты циклам последовательной сушки и растворения — хороший рецепт для приготовления пептидов и белков на ранней Земле, поскольку чередование жарких солнечных дней с ливнями — обычное дело для нашей планеты. Но ученые до сих пор не уверены в том, что этот процесс мог идти так просто — ведь нередко случались штормы, которые могли серьезно повлиять на концентрацию исходных аминокислот: уменьшить ее настолько, что реакция бы не пошла.
Но исследователи из Сент-Луисского университета и Чарлстонского колледжа провели ряд экспериментов и показали, что растворимые соли могли помочь создать пептиды из простейшей аминокислоты — глицина — во время саморегулируемого повторяющегося цикла сухости и влажности. В течение «дня» ученые наблюдали образование пептидов в реакционных смесях при их высушивании. В «ночное» время эти вещества впитывали воду из воздуха с образованием водных растворов при низких температурах, тем самым растворяя пептиды в воде и избегая разрушительного для таких соединений избыточного разбавления.
Кажущиеся незначительными различия, такие как изменение влажности окружающей среды от 50% до 70%, могут привести к глубоким различиям в склонности образцов поглощать воду и, следовательно, к большим различиям в выходах реакций. И хотя калий и натрий являются соседями по периодической таблице с почти одинаковой реакционной способностью, многие соли калия расплавляются раньше аналогичных солей натрия. Команда считает, что этот факт может дать ключ к разгадке тайны, почему вся жизнь на Земле тратит так много энергии, обогащая калий внутри клеток и избавляясь от натрия.
Код ТН ВЭД 3824993000. Кислоты нафтеновые, их соли, не растворимые в воде, и их сложные эфиры. Товарная номенклатура внешнеэкономической деятельности ЕАЭС
Позиция ТН ВЭД
|
Позиция ОКПД 2
|
| Базовая ставка таможенной пошлины | 5% реш.54 |
| Акциз | Не облагается |
| НДС | Жизненно необходимая медтехника Готовые связующие вещества.
10% — Медизделия (Регистрационное удостоверение) 20% — Прочие |
| Базовая ставка таможенной пошлины | Беспошлинно |
| Акциз | Не облагается |
Рассчитать контракт
Особенности товараЗагрузить особенности ИМ Загрузить особенности ЭК
Растворимая соль — обзор
Влияние растворимых солей на ESDD
Фактически измеренное на месте ESDD не является эффективным SDD, которое приводит к загрязнению изоляторов.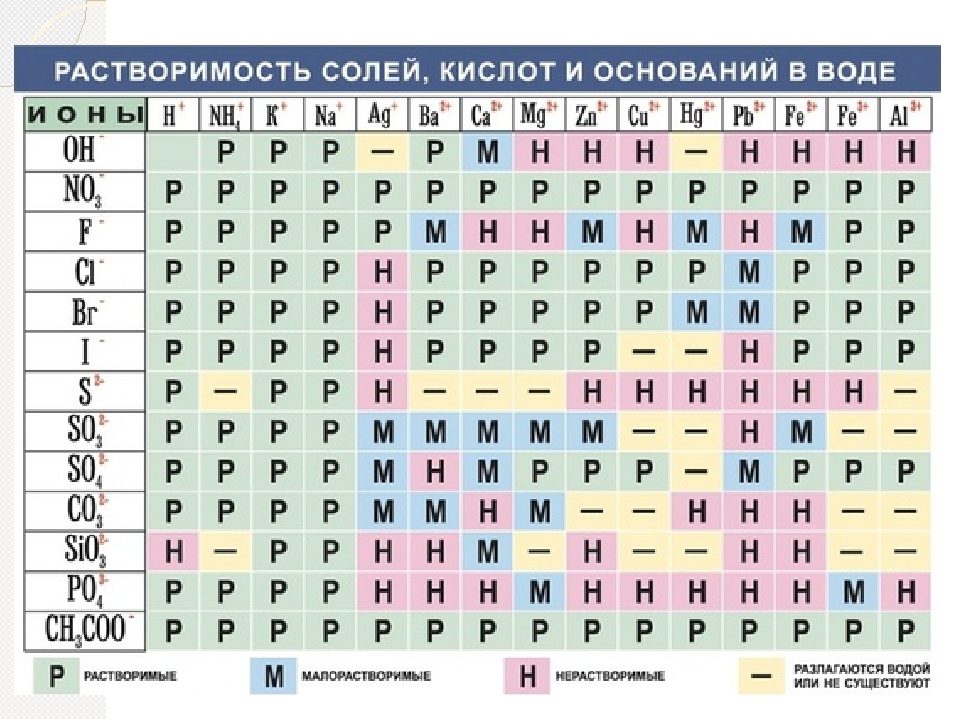 Эффективное ESDD должно определяться с учетом двойного воздействия CaSO 4 · 2H 2 O и растворимых органических веществ, содержащихся в естественных загрязнениях, и должно быть таким же, как SDD, используемое в испытаниях на искусственное загрязнение, проводимых в лабораториях с чистый хлорид натрия.
Эффективное ESDD должно определяться с учетом двойного воздействия CaSO 4 · 2H 2 O и растворимых органических веществ, содержащихся в естественных загрязнениях, и должно быть таким же, как SDD, используемое в испытаниях на искусственное загрязнение, проводимых в лабораториях с чистый хлорид натрия.
Испытания как в стране, так и за рубежом показали, что при одном и том же SDD напряжение пробоя изоляторов в значительной степени зависит от типа соли. Путем сравнения отношений напряжений пробоя загрязняющих веществ под KNO 3 , Zn (NO 3 ) 2 , MgSO 4 , CaSO 4 и CaCO 3 с напряжением под NaCl на разных SDD, можно Можно сделать вывод, что, за исключением нитратов, отношения напряжений пробоя загрязняющих веществ под MgSO 4 , CaSO 4 и CaCO 3 к напряжению под NaCl возрастают с SDD, особенно для CaSO 4 , который имеет низкую растворимость.
Обильный CaSO 4 · 2H 2 O, содержащийся в естественных загрязнителях на поверхности изолятора, резко увеличивает напряжение пробоя от загрязнения.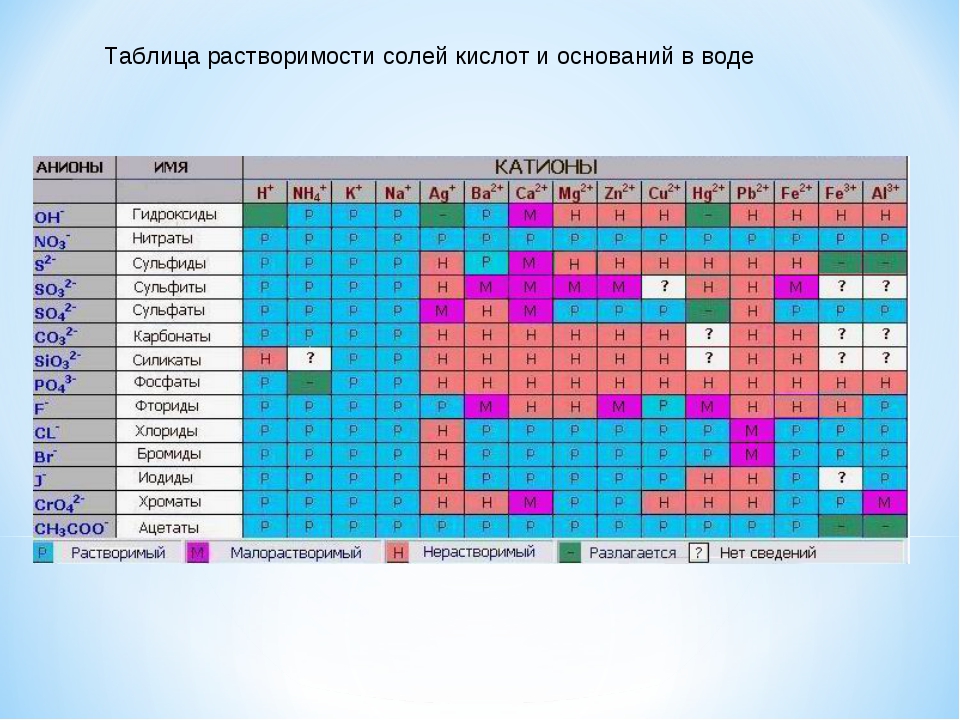 При проектировании линий сверхвысокого вакуума в Японии источники загрязнения по всей длине делятся на два типа: загрязнение морской среды, моделируемое с помощью NaCl; загрязнение пылью, моделируемое CaSO 4 • 2H 2 O или CaSO 4 • 1/2 (H 2 O).
При проектировании линий сверхвысокого вакуума в Японии источники загрязнения по всей длине делятся на два типа: загрязнение морской среды, моделируемое с помощью NaCl; загрязнение пылью, моделируемое CaSO 4 • 2H 2 O или CaSO 4 • 1/2 (H 2 O).
Исходя из местных условий эксплуатации, Япония провела испытания влияния комбинированных солей и вывела поправочную формулу.Основываясь на этих результатах, когда ESDD CaSO 4 выше 0,01 мг / см 2 , CaSO 4 не может полностью раствориться, поэтому его можно рассматривать как полностью растворимое вещество. Формула коррекции, рекомендованная Японией для ESDD изолятора, подверженного комбинированному солевому загрязнению, выглядит следующим образом:
(4,28) Wc = W − Wca + α
, где W c — скорректированное ESDD, мг / см 2 ; Вт — ESDD, мг / см 2 ; W ca — плотность CaSO 4 по отношению к ESDD, мг / см 2 ; и α — поправочный коэффициент, который принимается равным 0. 01 мг / см 2 .
01 мг / см 2 .
Учитывая разницу в регионах и условиях эксплуатации, результаты, полученные в Японии, не могут широко применяться в Китае. Поскольку CaSO 4 обычно и широко существует в форме CaSO 4 • 2H 2 O в естественных загрязнителях, напряжение пробоя изолятора при загрязнении значительно выше, чем полученное в испытаниях на искусственное загрязнение с чистым NaCl.
Чтобы количественно описать влияние различных растворимых солей, CEPRI провел испытания характеристик пробоя изоляторов, подвергшихся естественному загрязнению, путем полного моделирования и упрощенного моделирования естественного загрязнения, а также сравнил результаты с результатами испытаний на искусственное загрязнение.Он также получил кривую выдерживаемого напряжения концентрации Ca 2+ в зависимости от ESDD путем моделирования нерастворимых солей с Ca 2+ , содержащихся в CaSO 4 · 2H 2 O, и моделирования нескольких высокорастворимых солей с Na + содержится в NaCl, как показано на рис. 4.51. На рисунке также представлены результаты загрязнения сельскохозяйственных угодий (состоящих из NaCl, KNO 3 , MgSO 4 , CaSO 4 · 2H 2 O и CaCO 3 и с концентрацией Ca ++ из 90%), результаты моделирования загрязнения, уносимого летучей строительной пылью (состоящей из NaCl, KNO 3 , MgSO 4 , Zn (NO 3 ) 2 и CaSO 4 • 2H 2 O и с концентрацией Ca ++ , равной 80%), а также результаты двух испытаний на пробой от загрязнения естественным образом загрязненных изоляторов (с концентрацией Ca 2+ 81%, и ESDD 0.032 мг / см 2 и 0,043 мг / см 2 соответственно). Эти результаты испытаний хорошо согласуются друг с другом, и, в частности, разница результатов испытаний между полным моделированием составной соли и упрощенным моделированием составной соли составляет всего от –2,0% до 7,1%, что свидетельствует о довольно высоком уровне достоверности.
4.51. На рисунке также представлены результаты загрязнения сельскохозяйственных угодий (состоящих из NaCl, KNO 3 , MgSO 4 , CaSO 4 · 2H 2 O и CaCO 3 и с концентрацией Ca ++ из 90%), результаты моделирования загрязнения, уносимого летучей строительной пылью (состоящей из NaCl, KNO 3 , MgSO 4 , Zn (NO 3 ) 2 и CaSO 4 • 2H 2 O и с концентрацией Ca ++ , равной 80%), а также результаты двух испытаний на пробой от загрязнения естественным образом загрязненных изоляторов (с концентрацией Ca 2+ 81%, и ESDD 0.032 мг / см 2 и 0,043 мг / см 2 соответственно). Эти результаты испытаний хорошо согласуются друг с другом, и, в частности, разница результатов испытаний между полным моделированием составной соли и упрощенным моделированием составной соли составляет всего от –2,0% до 7,1%, что свидетельствует о довольно высоком уровне достоверности. Это объясняет, что влияние множества растворимых солей, содержащихся в природных загрязнителях, на напряжение пробоя изолятора при загрязнении может быть установлено с помощью упрощенных имитационных испытаний комбинированных солей с различными концентрациями Ca 2+ .
Это объясняет, что влияние множества растворимых солей, содержащихся в природных загрязнителях, на напряжение пробоя изолятора при загрязнении может быть установлено с помощью упрощенных имитационных испытаний комбинированных солей с различными концентрациями Ca 2+ .
Рисунок 4.51. Вольтамперные характеристики изоляторов при упрощенном моделировании испытаний комбинированных солей с различными концентрациями Ca 2+ .
Рис. 4.51 демонстрирует, что при заданном напряжении и диапазоне ESDD от 0,02 мг / см 2 до 0,2 мг / см 2 отношение K 1 ESDD, соответствующего одиночному NaCl, к этому соответствующие комбинированным солям с разной концентрацией Ca 2+ можно выразить следующим образом:
(4.29) K1 = 1−1,13D2,57
, где D — концентрация Ca 2+ в комбинированных солях.
Правила растворимости — Chemistry LibreTexts
Problems
1. Растворим ли FeCO 3 ?
Согласно Правилу № 5, карбонаты обычно нерастворимы. Следовательно, FeCO 3 , вероятно, образует осадок .
Следовательно, FeCO 3 , вероятно, образует осадок .
2. Имеет ли ClO 4 – тенденцию к образованию осадка?
Это перхлорат, который в соответствии с Правилом № 2 может быть растворимым.Следовательно, не будет образовывать осадка.
3. Какое из этих веществ может образовывать осадок?
а) CaSO 4 б) поваренная соль в) AgBr
Обе буквы a и c могут образовывать осадок .
Что касается а) CaSO 4 , хотя сульфаты обычно растворимы, правило № 5 указывает, что сульфат кальция является важным исключением из этого правила.
Для b) Правило № 1 указывает, что поваренная соль (NaCl) растворима, потому что это соль щелочного металла.
c) представляет собой пример двух противоречащих друг другу правил. Правило № 4 гласит, что бромиды обычно растворимы, но Правило № 3 утверждает, что соли серебра нерастворимы. Поскольку Правило № 3 предшествует Правилу № 4, соединение нерастворимо и образует осадок.
4. Предскажите, образуется ли в результате этой реакции осадок:
\ [2AgNO_3 + Na_2S \ стрелка вправо Ag_2S + 2NaNO_3 \]
Продукты реакции необходимо исследовать; если какое-либо из веществ, образующихся в реакции, нерастворимо, образуется осадок.
Принимая во внимание NaNO 3 , Правило № 3 гласит, что нитраты обычно растворимы. Осадок этого соединения не образуется.
Затем рассмотрим Ag 2 S. Согласно Правилу № 5 сульфиды обычно нерастворимы. Следовательно, из-за этого соединения в ходе этой реакции образуется осадок .
5. Предскажите, образуется ли в результате этой реакции осадок:
\ [2NaOH + K_2CrO_4 \ стрелка вправо KOH + Na_2CrO_4 \]
Рассмотрим еще раз продукты реакции: если какой-либо из них нерастворим, образуется осадок.
Первый продукт, KOH, является примером двух противоречащих друг другу правил. Хотя Правило № 5 гласит, что гидроксиды имеют тенденцию быть нерастворимыми, Правило № 1 утверждает, что соли катионов щелочных металлов имеют тенденцию быть растворимыми, а Правило № 1 предшествует Правилу № 5. Следовательно, это соединение не будет способствовать образованию каких-либо осадков.
Следовательно, это соединение не будет способствовать образованию каких-либо осадков.
Второй продукт, Na 2 CrO 4 , также соответствует Правилу № 1, согласно которому соли щелочных металлов обычно растворимы.
Поскольку оба продукта растворимы, в результате этой реакции не образуется осадок.
Растворимые соли и их влияние на контроль коррозии
Растворимые соли и их влияние на контроль коррозии
M. N. Rogan
Target Products Ltd.
9503 — 87 Ave.
Morinville, Alta., Canada T8R 1K6
J. R. Johnson CHLOR RID
P.O. Box 908
Chandler, AZ. США 85244
Аннотация
За последние несколько лет лакокрасочная промышленность стала
гораздо лучше осведомлены о степени преждевременного разрушения покрытия, вызванного
растворимые соли, оставшиеся на субстрате до нанесения покрытия.Растворимые соли, загрязняющие поверхность, обычно невидимы, поэтому
какой-либо метод тестирования должен быть выполнен, чтобы определить, есть ли такое загрязнение
существуют. Если загрязнения не удалить, это может привести к потере
адгезия, образование пузырей и коррозия, продолжающиеся под покрытием. Этот
в документе объясняется, как это повлияло на отрасль в изменении спецификаций.
и требования. Также будет рассмотрено, что такое растворимые соли, где
откуда они берутся, почему они вредны и как проверить их наличие
на подложку.
Если загрязнения не удалить, это может привести к потере
адгезия, образование пузырей и коррозия, продолжающиеся под покрытием. Этот
в документе объясняется, как это повлияло на отрасль в изменении спецификаций.
и требования. Также будет рассмотрено, что такое растворимые соли, где
откуда они берутся, почему они вредны и как проверить их наличие
на подложку.
Введение
Коррозия — дорогостоящая проблема, с которой сталкиваются многие люди.
и организаций на ежедневной основе. Исследования, проведенные за последние
десятилетие или около того подтверждает тот факт, что присутствие растворимых солей
на поверхности вызывает сильное ускорение коррозии и снижает
срок службы защитных покрытий. Поскольку защитные покрытия
являются основной защитой от коррозии, обязательно
им будет разрешено работать так, как задумано, если мы будем иметь возможность
защиту от коррозии, за которую мы платим. Слишком часто возникают затраты
чтобы защитить основу в течение 10 лет, только чтобы это покрытие вышло из строя
через 5 лет или меньше. Увеличилась не только ежегодная стоимость защиты.
резко, но в большинстве случаев происходит разрушение субстрата,
именно то, что мы пытались предотвратить. Многие, если не
большинство из этих преждевременных отказов были приписаны растворимым солям
остаются на поверхности перед нанесением покрытия.
Слишком часто возникают затраты
чтобы защитить основу в течение 10 лет, только чтобы это покрытие вышло из строя
через 5 лет или меньше. Увеличилась не только ежегодная стоимость защиты.
резко, но в большинстве случаев происходит разрушение субстрата,
именно то, что мы пытались предотвратить. Многие, если не
большинство из этих преждевременных отказов были приписаны растворимым солям
остаются на поверхности перед нанесением покрытия.
Промышленное развитие привело к увеличению загрязнения
противообледенительными солями, химическим загрязнением и кислотными дождями, что делает контроль
коррозионностимулирующих анионов необходимо. Промышленность переживает переходный период
период. Многие производители покрытий теперь требуют тестирования на растворимость
соли и ограничить их до определенного уровня. Большинство остальных производителей
потребует этого в течение ближайшего года или двух, так как многие предыдущие
В настоящее время установлено, что преждевременные отказы являются результатом воздействия солей.
Подготовка поверхности
Спецификации подготовки поверхности изменились незначительно и обычно включали следующее.
- Проверить сварные швы и подготовку поверхности на соответствие NACE RPO 178 для ямок, острых краев и остатков сварочных брызг.
- Степень чистоты: устранение загрязняющих веществ, таких как углеводороды, соли и другие химические вещества до и после окончательной абразивной очистки.Сварные швы, в частности, являются лучшим местом для преждевременной ржавчины. из-за присутствия древесного волокна в качестве флюса в сварочных стержнях (рис. 1). Древесное волокно обычно отбеливается хлором (производится из соль — хлорид натрия) при производстве.
- Стандарты взрывных работ: спецификации NACE и SSPC для удаления мельницы
окалина, ржавчина, краска, меление и другие загрязнения.

- Профиль поверхности: разные покрытия лучше работают с определенными профилями.
- Подача воздуха: давление, объем и чистота воздуха — вода и масло ловушки на месте и промокательная проба перед соплом.
- Температура / влажность: «Точка росы»
- Защитное покрытие / маскировка для изоляции работы в определенных областях и предотвратить повреждение соседнего имущества чрезмерной струей или распылением.
Новые технические характеристики теперь включают критерии чистоты, включая испытания для растворимых солей и удаления или ограничения растворимых солей.
Что такое растворимые соли?
Это соли, в частности хлориды и сульфаты.
кальция, магния и натрия, которые невидимы и требуют
испытания подлежат определению. Хотя их называют «растворимыми», на самом деле они
совсем не очень растворимы. Если бы они были, простая стирка удалила бы
их. Правила растворимости, принятые в промышленности, обычно следуют этим критериям:
Хотя их называют «растворимыми», на самом деле они
совсем не очень растворимы. Если бы они были, простая стирка удалила бы
их. Правила растворимости, принятые в промышленности, обычно следуют этим критериям:
- Все нитраты растворимы
- Все хлориды растворимы, кроме серебра, ртути и хлорида свинца, которые трудно солюбилизировать.
- Большинство сульфатов растворимы, за исключением сульфатов стронция, бария и свинца. которые очень трудно растворить.
- Все карбонаты, гидроксиды и сульфиды нерастворимы, за некоторыми исключениями.
Наибольшее беспокойство вызывают водорастворимые соли, такие как хлориды, сульфаты.
и нитраты, которые осаждаются на поверхности стали из-за кислотных дождей,
морские брызги, химические процессы, брызги, проливание и погружение.Они
все являются солью или сложным эфиром, полученным из кислоты, и различаются
по их происхождению. Хлориды происходят из соляной кислоты, сульфатов.
из серной кислоты и нитратов из азотной кислоты.
Хлориды происходят из соляной кислоты, сульфатов.
из серной кислоты и нитратов из азотной кислоты.
Растворимые соли обладают осмотическим действием, в результате чего вода проходит через покрытие. Свинцовые пигменты, включенные в грунтовки, уменьшают коррозию переводя в нерастворимую форму сульфаты и хлориды, преобладающие загрязняющие ионов, таким образом уменьшая осмотические силы и ограничивая, в некоторой степени, вредные коррозионная активность этих анионов.Растворимость хлорида свинца и сульфат свинца намного ниже растворимости железа или соли железа хлорида или сульфата. По осмосу хлорид железа пропускает через покрытие в 200 раз больше воды, чем хлорид свинца будет; Сульфат железа потребляет в 150 000 раз больше воды через покрытие, как сульфат свинца. Таким образом, сульфат свинца обычно не производит осмотическое образование пузырей.
Однако соединения свинца, которые широко использовались до тех пор, пока не стали здоровыми. опасности стали общепризнанными, строго ограничены.Без
включение свинцовых пигментов в грунтовки, хлориды и сульфаты
теперь должны быть сведены к минимуму другими средствами, такими как нейтрализующие агенты или
растворимые очистители солей.
опасности стали общепризнанными, строго ограничены.Без
включение свинцовых пигментов в грунтовки, хлориды и сульфаты
теперь должны быть сведены к минимуму другими средствами, такими как нейтрализующие агенты или
растворимые очистители солей.
Что делают соли?
Хорошо известно, что растворимые соли, особенно
хлориды и сульфаты, инициируют и ускоряют коррозию стали,
и глубоко внедряются в продукты коррозии железа2.
способны вызвать разрушение покрытия по механизму
осмотическое образование пузырей и отслоение между слоями.Соли
стимулируют коррозию за счет осмотического действия, втягивая влагу через
покрытие. Они продолжают рисовать, образуя волдыри, которые на самом деле образуют
вверх внутреннее давление. Плюс в том, что влага в сочетании с
хлориды, на самом деле часто образует слабую соляную кислоту. Это вызывает
коррозия, подрез покрытия и, наконец, разрушение покрытия. Часто причиной
крупного разъединения.Они также создают потенциал клетки и снижают
pH. Самым вредным действием соли является снижение pH, в результате чего
в цикле регенерации, который потребляет кислород и поглощает воду
через осмос или понижение давления пара.
Часто причиной
крупного разъединения.Они также создают потенциал клетки и снижают
pH. Самым вредным действием соли является снижение pH, в результате чего
в цикле регенерации, который потребляет кислород и поглощает воду
через осмос или понижение давления пара.
Повреждающее действие солей было рассмотрено Джонсоном. Он утверждает наличие солей на стальной поверхности приводит к следующим последствиям.
- Они поглощают и удерживают влагу из воздуха.
- Соли отводят влагу через покрытие посредством осмоса.
- Они снижают сопротивление коррозионных ячеек (т. Е. Увеличивают проводимость электролита в коррозионной ячейке.)
- Они устанавливают концентрационные потенциалы клеток. Разница в соли
концентрация между сильно загрязненными территориями и прилегающими, менее загрязненными
области создают напряжение, которое вызывает протекание тока коррозии.

- Соли понижают pH. Путем введения кислорода через пленку краски соли железа могут в конечном итоге окисляться с выделением соляной кислота с pH всего 1,5, разрушающая сталь.
Он указывает, что любое из вышеперечисленного, по отдельности или в совокупности, является вредным. к защите, обеспечиваемой покрытиями. Следовательно, эти коррозионные воздействия разрушающие силы под пленкой покрытия.
Национальная ассоциация инженеров-коррозионистов Int.,
Inc. (NACE) и Общество защитных покрытий (SSPC) признали
это факт, и мы предпринимаем шаги, чтобы противостоять этой проблеме. Уже много лет
промышленность признала, что растворимые соли вредны, но
только в последние годы мы осознали масштабы
ущерб, который они причиняют. Это признание происходит через творение
формируются новые комитеты для выпуска отраслевых руководств для пользователей
и выпустить инструкции по измерению растворимых солей.
Ржавчина
Ржавчина определяется как «продукт коррозии, состоящий из
гидратированных оксидов железа. Это пористый красно-коричневый оксид, производимый
под действием кислорода, влаги и электролиза металла. «Мгновенная ржавчина.
быстрое наступление этого состояния и при намокании от дождя, росы,
или конденсация будет происходить, когда присутствуют соли. Это проявление
состояния, которое может привести к ускоренной коррозии и порче краски.Ржавчина считается загрязнителем стальной поверхности и должна быть распознана.
как таковой. Участки стали, ранее имевшие ржавчину, тщательно очищенные
пескоструйная очистка будет иметь тенденцию снова ржаветь в тех же местах, где образовалась ржавчина
первый раз. Это говорит о коррозионной реакции с другой поверхностью.
загрязняющих веществ. По-настоящему чистая сталь не ржавеет сотни лет.
часов при воздействии нормальных атмосферных условий.
В типичном наборе для анализа растворимой соли компонент части состоят из следующего: линейка, маркер или лента, градуированный цилиндр, пластиковый или стеклянный тест-контейнер, pH-полоски, химические тест-полоски или Трубки Китагава, резиновые или латексные перчатки, ватные палочки, пинцет, деионизированные вода, инструкция и футляр для переноски.
Существует несколько методов тестирования и измерения уровня соли и
описаны в Приложении A: Руководство по полевым испытаниям растворимых солей. Все
тесты основаны на солюбилизации солей и переносе их из
субстрат к исследуемому раствору. Ни один из них не работает. Измерения
взятые в раствор титратором, например, полосками Quantab,
или химическими реагентами. SSPC провела тестирование, чтобы оценить относительную производительность
различных тестовых процедур.Патч Bresle, кажется, дает лучшее
чтения.
Уровни коррозионной соли
Уровни загрязнения хлоридом или сульфатом на
исследованы стальные поверхности, влияющие на характеристики покрытия.
несколькими людьми и обобщены Trimber. Панели для испытаний, очищенные струйной очисткой
были загрязнены известными количествами солей, отдельные слои эпоксидной смолы
и виниловая краска, нанесенная и экспонированная в шкафу с конденсирующейся влажностью
на 4 недели.Результаты показали, что 10 мкг / см2 хлорида
или 20 мкг / см2 сульфата было достаточно, чтобы вызвать образование пузырей.
в то время как 5 мкг / см2 хлорида и 10 мкг / см2 сульфата
не были. Другие исследования в Европе показывают, что для тонкопленочных систем
(<10 мил), 7 мкг / см2 хлорида и 16 мкг / см2 сульфата
вызвало образование пузырей. Для покрытия толщиной> 10 мил, без пузырей
в любом случае наблюдалась на уровне до 50 мкг / см2. Тест
данные свидетельствуют о том, что уровни хлоридов находятся в диапазоне от 2 до 10 мкг / см2.
или выше может повлиять на характеристики покрытия, если покрытия более устойчивы
сульфатного загрязнения с уровнями 10-20 мкг / см2 и более
требуется, чтобы отрицательно повлиять на характеристики покрытия. Руководящие принципы, принятые
на усмотрение производителя покрытия для поля рекомендовать
5-10 частей на миллион хлоридов как максимальный уровень для внутреннего или погружного применения
обслуживание (внутренние сосуды) и 10-20 ppm хлоридов как максимум
для наружных или атмосферных работ (трубопроводы, внешние сосуды).
Тест
данные свидетельствуют о том, что уровни хлоридов находятся в диапазоне от 2 до 10 мкг / см2.
или выше может повлиять на характеристики покрытия, если покрытия более устойчивы
сульфатного загрязнения с уровнями 10-20 мкг / см2 и более
требуется, чтобы отрицательно повлиять на характеристики покрытия. Руководящие принципы, принятые
на усмотрение производителя покрытия для поля рекомендовать
5-10 частей на миллион хлоридов как максимальный уровень для внутреннего или погружного применения
обслуживание (внутренние сосуды) и 10-20 ppm хлоридов как максимум
для наружных или атмосферных работ (трубопроводы, внешние сосуды).
Результаты показали, что абразивоструйная очистка даже белого металла,
не обязательно удалит эти загрязнения с поверхности.1 Даже
очевидно, что чистые панели могут иметь «заблокированное» загрязнение. Эти панели,
абразивоструйная очистка до стандарта белого металла визуально мало или совсем не видна
загрязнение. Те же панели через 24 часа показывают высокую степень
мгновенная ржавчина. Глядя на поперечное сечение профиля, обратите внимание на
перевернутые или зазубренные выступы в профиле (Рисунок 2).Соли блокируются
в заусенец по краю и чрезвычайно трудны, если не невозможны,
удалять. Это один из примеров того, почему часто невозможно добиться
НЕТ мгновенной ржавчины.
Те же панели через 24 часа показывают высокую степень
мгновенная ржавчина. Глядя на поперечное сечение профиля, обратите внимание на
перевернутые или зазубренные выступы в профиле (Рисунок 2).Соли блокируются
в заусенец по краю и чрезвычайно трудны, если не невозможны,
удалять. Это один из примеров того, почему часто невозможно добиться
НЕТ мгновенной ржавчины.
ВМС США приняли приемлемый уровень <3 мкг / см2 для корпуса ниже ватерлинии, и многие производители покрытий переписывают спецификации подготовки поверхности, требующие проверки растворимых солей для и ограничено определенными уровнями.
Очиститель с растворимой солью для удаления
Когда встречаются поверхности, которые содержат невидимые
удалители загрязнений, растворимых солей — одни из самых простых и наименее дорогих
и самые быстрые средства удаления, доступные на рынке. Обычно они
жидкие, органические, неопасные и биоразлагаемые и предназначены
для солюбилизации как хлоридов, так и сульфатов. Такие изделия чрезвычайно
концентрированные и обычно разбавляются 1: 100 в водопроводном растворе.Вода используется как средство доставки, поэтому ее можно использовать на любой поверхности.
метод приготовления, который включает воду или в который может быть добавлена вода.
Средство для удаления растворимых солей должно контактировать с ионами соли в
чтобы солюбилизировать их, поэтому любой барьер, например пузырчатый
краску или побочные продукты коррозии, такие как окалина ржавчины, необходимо удалить. В
барьерные материалы могут быть удалены как часть процесса дезактивации
или удаляются до дезактивации.Приложение очень простое.
Просто нанесите с помощью мойки высокого давления, водоструйной установки или аналогичного оборудования.
означает. Ручная стирка предназначена для небольших непористых участков.
Обычно они
жидкие, органические, неопасные и биоразлагаемые и предназначены
для солюбилизации как хлоридов, так и сульфатов. Такие изделия чрезвычайно
концентрированные и обычно разбавляются 1: 100 в водопроводном растворе.Вода используется как средство доставки, поэтому ее можно использовать на любой поверхности.
метод приготовления, который включает воду или в который может быть добавлена вода.
Средство для удаления растворимых солей должно контактировать с ионами соли в
чтобы солюбилизировать их, поэтому любой барьер, например пузырчатый
краску или побочные продукты коррозии, такие как окалина ржавчины, необходимо удалить. В
барьерные материалы могут быть удалены как часть процесса дезактивации
или удаляются до дезактивации.Приложение очень простое.
Просто нанесите с помощью мойки высокого давления, водоструйной установки или аналогичного оборудования.
означает. Ручная стирка предназначена для небольших непористых участков. Другие методы
исследуются.
Другие методы
исследуются.
Заключение
Промышленное загрязнение и атмосферное загрязнение являются серьезными
источники растворимых солей. Все водорастворимые соли, не удаленные со стали
во время подготовки поверхности может образоваться осмотическое образование пузырей на покрытии.
Хлориды и сульфаты вступают в химическую реакцию со сталью и вызывают коррозию
ячеек, которые могут вызвать ускоренную деградацию стали.
Очень низкий уровень хлоридов и сульфатов достаточен для разрушения
в покрытиях.
Обычные методы очистки, включая абразивно-струйную очистку удалить все внедренные загрязнения.
Существует несколько подходящих методов определения уровней наиболее важные загрязнители.
Мытье растворимыми солевыми очистителями в качестве стандартной процедуры обслуживания.
эффективен при удалении хлоридов с поверхности.
Список литературы
1. Американское общество по испытанию материалов, Стандарт Метод испытаний для определения наличия масла или воды в сжатом воздухе », обозначение ASTM Д 4285-88.
2. Эпплман, Б.Р., Журнал «Рисование над растворимыми солями: взгляд в будущее». защитных покрытий и подкладок, октябрь 1987 г., стр.68-82.
3. Флорес, С., Симанкас, Дж., И Морсилло, М., «Методы отбора проб и анализ растворимых солей на стальных поверхностях: сравнительное исследование », Журнал защитных покрытий и подкладок, март 1994 г., стр. 76-83.
4. Джонсон, W.C., «Вредные материалы на границе раздела сталь / краска», Новые концепции защиты стальных конструкций покрытиями, ASTM STP 841, D.M. Бергер и Р.Ф. Wint, Eds., 1984, стр.28-43, ГОСТ 83-01 (1983).
5. Джонсон, W.C., «Коррозионное нарушение из-за водорастворимых загрязняющих веществ. по абразивным материалам, «Журнал защитных покрытий и подкладок», сентябрь 1990 г.,
С. 54-59.
по абразивным материалам, «Журнал защитных покрытий и подкладок», сентябрь 1990 г.,
С. 54-59.
6. Мунгер К.Г., «Защита от коррозии с помощью защитных покрытий», глава 8, Национальная ассоциация инженеров-коррозионистов, 1984.
7. Национальная ассоциация инженеров-коррозионистов, «Рекомендованный стандартом» Практика — Детали изготовления, требования к отделке поверхности и надлежащая Рекомендации по проектированию резервуаров и сосудов с футеровкой для погружения Сервис », Стандарт КДЕС РПО 178-91.
8. Совет по окраске стальных конструкций, «Проверка покрытия и футеровки» Руководство », Публикация SSPC № 91-12.
9. Тримбер К.А. «Обнаружение и удаление химических загрязнителей в Целлюлозно-бумажные комбинаты, «Журнал защитных покрытий и футеровок», ноябрь. 1988, с. 30–37.
Приготовление растворимых солей — Приготовление солей — Редакция GCSE Chemistry (Single Science) — Другое
11tu5dcumwu.0.0.0.1:0.1.0.$0.$1.$0″> Растворимые соли могут быть получены путем взаимодействия кислот с растворимыми или нерастворимыми основаниями.
Изготовление соли из щелочи
Если вы используете щелочь, которая является растворимой основой, вам нужно добавить ровно столько кислоты, чтобы получился нейтральный раствор (проверьте небольшой образец с помощью универсальной индикаторной бумаги).
Нагрейте солевой раствор, чтобы вода испарилась. Вы получите более крупные кристаллы, если будете медленно испарять воду.
Получение соли из щелочи
1. Раствор помещают в испарительный бассейн и нагревают горелкой Бунзена
2″> 2. Количество раствора уменьшилось за счет испарения
3.Раствор испарился, оставив кристаллизованное растворенное вещество.
Получение соли из нерастворимого оксида или карбоната металла
Оксид меди и оксиды или гидроксиды других переходных металлов не растворяются в воде. Если основание нерастворимо, требуется дополнительная стадия для образования соли.
Вы добавляете основание в теплую кислоту до тех пор, пока не перестанет растворяться и у вас не останется немного основания — это называется «избытком». Вы фильтруете смесь, чтобы удалить излишки основания, а затем выпариваете воду в фильтрате, чтобы оставить соль.
Получение соли из нерастворимого оксида или карбоната металла
11tu5dcumwu.0.0.0.1:0.1.0.$0.$3.$3.1:$1.1.2″> Твердая и жидкая смесь наливается в фильтровальную воронку
Жидкость может капать через фильтровальную бумагу в стакан ниже, оставляя твердые частицы позади
Разница между растворимым и Нерастворимые соли
Автор: Мадху
Основное различие между растворимыми и нерастворимыми солями состоит в том, что растворимых солей могут растворяться в воде при комнатной температуре, тогда как нерастворимые соли не могут растворяться в воде при комнатной температуре .
Соль — это любое соединение, образованное в результате реакции между кислотой и основанием. Следовательно, соль по существу содержит анион (происходит от кислоты) и катион (происходит от основания). Мы можем разделить солевые соединения на два типа в зависимости от их растворимости в воде при комнатной температуре. Это растворимые и нерастворимые соли. Растворимость солей зависит от типов взаимодействий, которые они могут иметь с молекулами воды.
Это растворимые и нерастворимые соли. Растворимость солей зависит от типов взаимодействий, которые они могут иметь с молекулами воды.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2.Что такое растворимые соли
3. Что такое нерастворимые соли
4. Сравнение бок о бок — растворимые и нерастворимые соли в табличной форме
5. Резюме
Что такое растворимые соли?
Растворимые соли — это солевые соединения, растворимые в воде при комнатной температуре. Эти солевые соединения растворяются в воде, потому что они могут образовывать межмолекулярные связи с молекулами воды. Молекулы воды полярны. Следовательно, вода является полярным растворителем, и полярные соли могут растворяться в воде.
Рис. 01: Хлорид натрия представляет собой растворимую соль
Поскольку соли являются ионными соединениями, они растворяются в воде, потому что молекулы воды имеют тенденцию притягивать ионы в соединении, в результате чего они отделяются друг от друга, что приводит к растворению соли.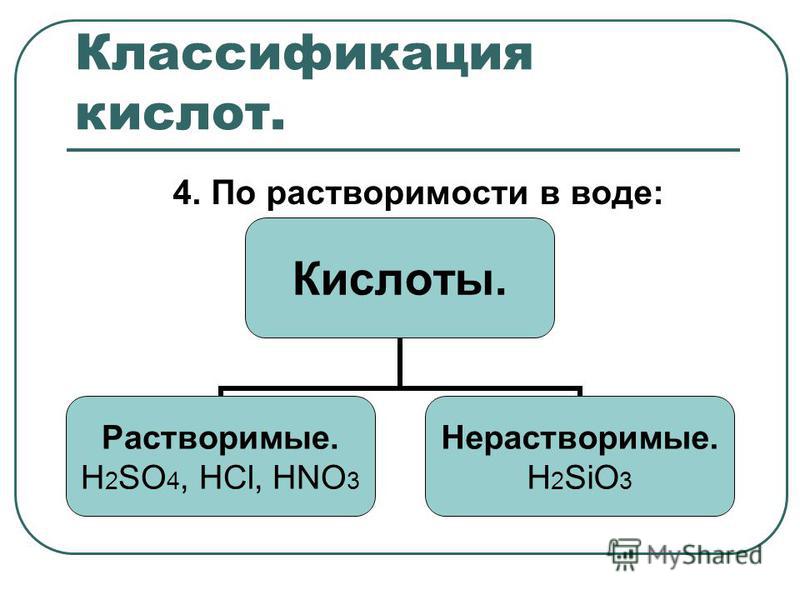 Здесь растворение соли приводит к образованию ионных частиц в воде, что делает вновь образованный водный раствор очень проводящим. Ионы, растворенные в воде, могут проводить через нее электричество. Примером растворимой соли является поваренная соль или хлорид натрия. Водный раствор поваренной соли содержит ионы натрия и ионы хлорида.
Здесь растворение соли приводит к образованию ионных частиц в воде, что делает вновь образованный водный раствор очень проводящим. Ионы, растворенные в воде, могут проводить через нее электричество. Примером растворимой соли является поваренная соль или хлорид натрия. Водный раствор поваренной соли содержит ионы натрия и ионы хлорида.
Что такое нерастворимые соли?
Нерастворимые соли — это солевые соединения, не растворимые в воде при комнатной температуре. Они нерастворимы в воде, потому что молекулы воды не могут притягивать ионы в солевом соединении.Следовательно, межмолекулярные взаимодействия между молекулами воды и нерастворимыми солевыми соединениями отсутствуют.
Рис. 02: Осадок хлорида серебра в воде
Кроме того, нерастворимые соли являются неполярными соединениями. В отличие от растворимых солей, смешивание нерастворимых солей с водой не делает раствор проводящим, поскольку соль не разделяется на ионы. Хорошим примером нерастворимой соли является хлорид серебра (AgCl).
В чем разница между растворимой и нерастворимой солью?
Мы можем разделить солевые соединения на два типа в зависимости от их растворимости в воде.Это растворимые и нерастворимые соли. Ключевое различие между растворимыми и нерастворимыми солями заключается в том, что растворимые соли могут растворяться в воде при комнатной температуре, тогда как нерастворимые соли не могут растворяться в воде при комнатной температуре. Более того, растворимые соли полярны; поэтому они могут растворяться в воде, которая является полярным растворителем. Напротив, нерастворимые соли неполярны. Итак, это еще одно существенное различие между растворимыми и нерастворимыми солями.
В дополнение к вышесказанному, молекулы воды могут образовывать межмолекулярные связи с ионами растворимых солей, но межмолекулярные взаимодействия между нерастворимыми солями и водой отсутствуют.Кроме того, растворение растворимых солей в воде дает водный раствор с высокой проводимостью, потому что ионы, растворенные в воде, могут проводить через него электричество. В отличие от растворимых солей, смешивание нерастворимых солей с водой не делает воду проводящей. Хлорид натрия является примером растворимых солей, а хлорид серебра — примером нерастворимой соли.
В отличие от растворимых солей, смешивание нерастворимых солей с водой не делает воду проводящей. Хлорид натрия является примером растворимых солей, а хлорид серебра — примером нерастворимой соли.
Заключение — Растворимые и нерастворимые соли
Мы можем разделить солевые соединения на два типа в зависимости от их растворимости в воде.Это растворимые и нерастворимые соли. Ключевое различие между растворимыми и нерастворимыми солями заключается в том, что растворимые соли могут растворяться в воде при комнатной температуре, тогда как нерастворимые соли не могут растворяться в воде при комнатной температуре. Более того, растворимые соли полярны; поэтому они могут растворяться в воде, которая является полярным растворителем. Напротив, нерастворимые соли неполярны.
Ссылка:
1. «Нерастворимые соли». Chemistry LibreTexts, Libretexts, 5 июня 2019 г., доступно здесь.
2.«Определение нерастворимых солей (осадков)». Словарь Cehmicool, доступный здесь.
3. «Нерастворимые соли». Соль-тренога, доступная здесь.
Изображение предоставлено:
1. «Хлорид натрия» от Chemicalinterest — собственная работа (общественное достояние) через Commons Wikimedia
2. «Хлорид серебра (AgCl)» Луисбрудна — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
Управление растворимыми солями — декоративное производство Декоративное производство
Наличие чрезмерного количества растворимых солей, возможно, является самым ограничивающим фактором при выращивании тепличных культур.Обычно накопление соли происходит в результате использования некачественной поливной воды, чрезмерного внесения удобрений или среды для выращивания с изначально высоким содержанием соли. Хотя растворимые соли могут подавлять рост растений, при правильном обращении их эффекты могут быть уменьшены.
Повреждение растений солью
Повреждение растений из-за чрезмерного количества растворимых солей может сначала проявиться в виде легкого хлороза листвы, позже прогрессирующего до некроза кончиков и краев листьев. Этот тип травм в значительной степени объясняется подвижностью растворимых солей в растении.Поскольку эти соли быстро перемещаются по всему растению, они накапливаются на концах и краях листьев. Когда соли достигают токсичного уровня, они вызывают характерный «ожог», связанный с чрезмерным содержанием солей.
Этот тип травм в значительной степени объясняется подвижностью растворимых солей в растении.Поскольку эти соли быстро перемещаются по всему растению, они накапливаются на концах и краях листьев. Когда соли достигают токсичного уровня, они вызывают характерный «ожог», связанный с чрезмерным содержанием солей.
Корни также могут быть повреждены присутствием растворимых солей. Это часто предрасполагает растение к широкому спектру корневых заболеваний (например, фитию, фузариозу и т. Д.). Сильная травма может также помешать поглощению воды и привести к чрезмерному увяданию растения. Чрезвычайно важно регулярно проверять корневую систему растений, чтобы следить за действием растворимых солей.
Вода для орошения
Поливная вода является основным источником растворимых солей в питательной среде. Они встречаются в основном в виде солей Na, Ca и Mg, хотя могут присутствовать и другие.
Растворимые соли в воде для орошения измеряются по электропроводности (ЕС). Чем выше содержание соли, тем выше ЕС. В целом, значения ЕС, превышающие 2,0 миллимош / куб.см, считаются вредными для роста растений. Качество воды следует регулярно контролировать, чтобы избежать потенциальных проблем, связанных с растворимыми солями.
Чем выше содержание соли, тем выше ЕС. В целом, значения ЕС, превышающие 2,0 миллимош / куб.см, считаются вредными для роста растений. Качество воды следует регулярно контролировать, чтобы избежать потенциальных проблем, связанных с растворимыми солями.
Удобрения
Удобрения представляют собой формы солей и поэтому способствуют общему содержанию растворимых солей в питательной среде. В зависимости от собственного содержания солей в используемой поливной воде уровни плодородия необходимо регулировать, чтобы избежать накопления солей.
Удобрения часто классифицируются по общему количеству содержащихся в них солей. Этот «солевой индекс» можно использовать для определения количества солей, внесенных в питательную среду. В таблице 1 представлен солевой индекс ряда обычно используемых удобрений.
| Удобрение | Солевой индекс |
|---|---|
| Нитрат натрия | 100 |
| Хлорид калия | 116 |
| Аммиачная селитра | 105 |
| Мочевина | 75 |
| Нитрат калия | 74 |
| Сульфат аммония | 69 |
| Нитрат кальция | 53 |
| Сульфат магния | 44 |
| Диаммонийфосфат | 34 |
| Суперфосфат концентрированный | 10 |
| Гипс | 5 |
Нитрат натрия был произвольно установлен на уровне 100. Чем ниже значение индекса, тем меньше вклад удобрения в уровень растворимых солей.
Чем ниже значение индекса, тем меньше вклад удобрения в уровень растворимых солей.
Среда для выращивания
Среда для выращивания может состоять из множества компонентов. К ним относятся торф, перлит, вермикулит, сосновая кора и другие. Вообще говоря, эти материалы не содержат чрезмерных количеств растворимых солей. Однако важно внимательно следить за качеством компонентов мультимедиа.
В некоторых случаях необходимо тщательно выщелачивать среду перед ее использованием.Это особенно важно для прорастания семян и других форм размножения. Выщелачивание может осуществляться путем пропускания воды через отдельные горшки или поддоны перед посадкой или путем выщелачивания всего объема сыпучей среды.
Для количественной оценки этого процесса может быть определена электрическая проводимость фильтрата. Когда ЕС меньше 2,0 миллимош, среда не содержит избыточных солей.
Управление растворимыми солями
Управление растворимыми солями предполагает комплексный подход к производству. Сюда входят тип используемой питательной среды, частота полива, качество воды, режим плодородия и устойчивость растений.
Сюда входят тип используемой питательной среды, частота полива, качество воды, режим плодородия и устойчивость растений.
Среда для выращивания должна содержать значительное количество крупных пор для обеспечения хорошего дренажа. Среды с такими характеристиками легко выщелачиваются и снижают вероятность накопления растворимых солей. При орошении этой среды важно применять достаточно воды, чтобы позволить достаточному количеству выщелачиваться через емкость. При каждом поливе следует применять примерно на 15-20% больше воды, чем может вместить контейнер, если опасность солей высока.Давление воды необходимо отрегулировать, чтобы избежать перелива.
Поскольку концентрация растворимых солей в тканях растений увеличивается по мере снижения уровня влажности, важно контролировать содержание воды в питательной среде. При наличии чрезмерного количества растворимых солей нельзя допускать высыхания питательной среды. Поддержание необходимого уровня влажности может быть затруднено в пористой среде для выращивания и требует особого внимания.
Обеспечение адекватного плодородия важно для поддержания оптимального роста растений.Однако, если уровень фертильности слишком высок, может произойти травма от растворимых солей. Определение количества используемых питательных веществ должно основываться на качестве поливной воды, а также на солевом индексе удобрения. Обычно большинство режимов плодородия, используемых для выращивания горшечных тепличных культур, составляют от 150 до 350 частей на миллион (N). Более высокий уровень фертильности создает гораздо больший риск травм от растворимых солей.
Возможно, наиболее эффективным средством борьбы с растворимыми солями является отказ от получения растений, чувствительных к соли.Каждый вид растений по-своему реагирует на скопление соли, и производители часто могут выбрать растения с устойчивостью. К растениям с известной восприимчивостью к растворимым солям относятся хлорофитум, африканские фиалки, кальцеолярии, хризантемы, герань и петунии.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.
 ..
..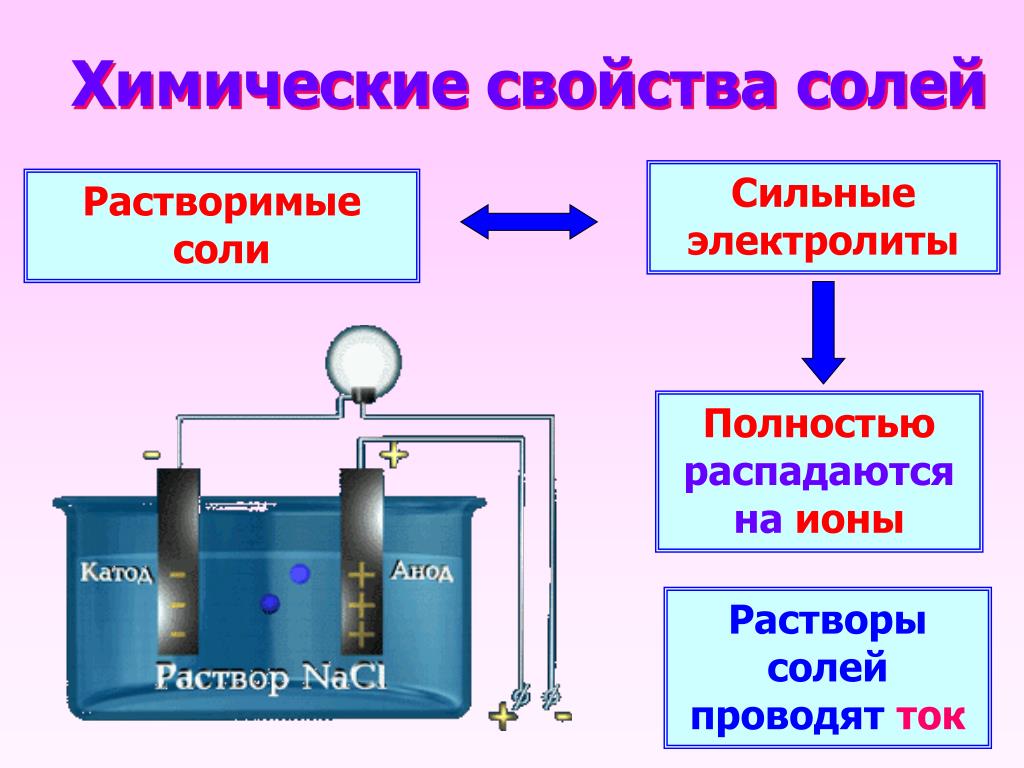 ..
..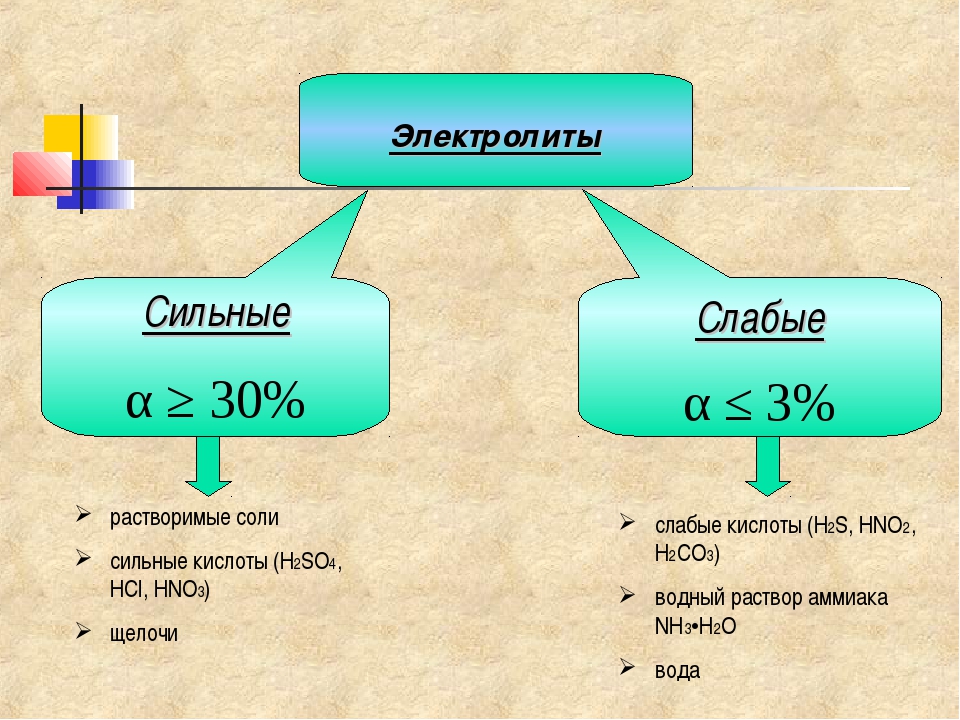 59.57
59.57 20.10
20.10 . (НДС Медизделия):
. (НДС Медизделия):