Ломоносов, атомно-молекулярное учение — Справочник химика 21
Основы атомно-молекулярного учения (Ломоносов, Дальтон), утвердившиеся на базе этих законов, позволили связать воедино состав, свойства и строение вещества. Тем не менее основоположники атомно-молекулярной теории (Гей-Люссак, Авогадро, Берцелиус, Либих, Бутлеров, Менделеев), считая, что дискретность в химии играет определяющую роль, тем не менее стремились устранить противоречия в точках зрения Пруста и Бертолле, интуитивно понимая прогрессивность взглядов последнего. Подход Бертолле к изучению химических явлений позволил рассматривать химическое взаимодействие в развитии, изменение свойств в процессе превращения, а не только конечный результат этого превращения, т. е. свойства образовавшегося объекта. [c.322]Творческая деятельность Ломоносова отличается исключительной широтой интересов и глубиной проникновения в тайны природы.

Создание атомно-молекулярного учения относится к концу ХУИ — началу XIX в., т. е. к тому времени, когда в химию были введены количественные методы исследования. Огромный вклад в создание этой теории внес русский ученый М. В. Ломоносов. [c.8]
Во времена Лавуазье этот принцип считался само собой разумеющейся истиной и молчаливо, без деклараций, принимался большинством естествоиспытателей и философов.
Атомно-молекулярное учение создали русский ученый М. В. Ломоносов (1741 г.) и английский ученый Дж. Дальтон (1808 г.). [c.8]
Атомно-молекулярное учение развил и впервые применил в химии М. В. Ломоносов. Основные положения его учения изложены в работе Элементы математической химии (1741) и ряде других . [c.4]
Основные положения его учения изложены в работе Элементы математической химии (1741) и ряде других . [c.4]
Ломоносов Михаил Васильевич (1711—1765)—первый русский ученый-естествоиспытатель мирового значения, человек энциклопедических знаний, разносторонних способностей. Один из основоположников физической химии, атомно-молекулярного учения. [c.8]
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе Элементы математической химии (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям. [c.10]
Большой вклад в развитие атомно-молекулярного учения внесли крупнейшие русские и зарубежные ученые М. В. Ломоносов, Лавуазье, Пруст, Дальтон, Авогадро, Канниццаро, Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Окончательно атомно-молекулярное учение утвердилось как научная теория в середине XIX в.
 Рассмотрим его основные положения. [c.13]
Рассмотрим его основные положения. [c.13] В 1741 г. Ломоносов в своем труде Элементы математической химии изложил мысли, которые, по существу, являются основой современного атомно-молекулярного учения. Он писал, что все изменения тел происходят посредством движения. В основе этого движения лежат элементы (под этим термином следует понимать атомы), которые, соединяясь между собой, образуют корпускулы (молекулы). Элемент (атом) есть часть тела, не состоящая из каких-либо меньших и отличных между собой тел. В основе учения Ломоносова также лежали умозрительные заключения.
Атомно-молекулярное учение помогает составить правильное представление о веществах и их превращениях. Во тьме должны находиться физики и особливо химики, не зная внутреннего частиц строения ,— писал М. В. Ломоносов. [c.11]
Ломоносов создал стройное атомно-молекулярное учение и впервые применил его в химии. [c.11]
Объяснение газовых законов базируется на атомно-молекулярном учении и кинетической теории. Основателями кинетической теории следует считать Д. Бернулли и М. В. Ломоносова. Д. Бернулли дал математическое выражение, связывающее давление газа с движением молекул. М. В. Ломоносов применил молекулярно-кинетические представления для объяснения различных явлений, в частности развил молекулярно-кинетическую теорию теплоты. Окончательную разработку кинетическая теория получила в исследованиях Дж. П. Джоуля , вычислившего в 1851 г. среднюю скорость движения частиц газа, Р. Клаузиуса (1822—1888), Дж. К. Максвелла (1831—1879). [c.160]
Основателями кинетической теории следует считать Д. Бернулли и М. В. Ломоносова. Д. Бернулли дал математическое выражение, связывающее давление газа с движением молекул. М. В. Ломоносов применил молекулярно-кинетические представления для объяснения различных явлений, в частности развил молекулярно-кинетическую теорию теплоты. Окончательную разработку кинетическая теория получила в исследованиях Дж. П. Джоуля , вычислившего в 1851 г. среднюю скорость движения частиц газа, Р. Клаузиуса (1822—1888), Дж. К. Максвелла (1831—1879). [c.160]
В другом месте Меншуткин, говоря о влиянии Ломоносова на формирование современного атомно-молекулярного учения, писал Но в выработке этих представлений труды Ломоносова не играли никакой роли, так как все названные диссертации остались при его жизни неопубликованными и были затем изданы в. моем переводе в 1904 году [И, стр. 76]. Такое утверждение нельзя считать вполне обоснованным. Действительно, часть диссертаций Ломоносова не была опубликована при его жизни. Однако основные физические диссертации были напечатаны, причем на латинском языке, в Новых Комментариях Петербургской Академии Наук в 1750 г. В этом же томе была опубликована и его химическая диссертация О действиях растворителей вообще . Кроме того, Слово о пользе химии , в котором Ломоносов развивает некоторые основные положения своих неопубликованных химических диссертаций, было напечатано не только на русском языке, но также и на латинском в 1758 г. Его физические диссертации, как известно, вызвали споры и возражения в иностранной научной литературе, а немецкий ученый Арнольд даже защитил диссертацию, в которой пытался опровергнуть молекулярно-кинетическую теорию Ломоносова.
Однако основные физические диссертации были напечатаны, причем на латинском языке, в Новых Комментариях Петербургской Академии Наук в 1750 г. В этом же томе была опубликована и его химическая диссертация О действиях растворителей вообще . Кроме того, Слово о пользе химии , в котором Ломоносов развивает некоторые основные положения своих неопубликованных химических диссертаций, было напечатано не только на русском языке, но также и на латинском в 1758 г. Его физические диссертации, как известно, вызвали споры и возражения в иностранной научной литературе, а немецкий ученый Арнольд даже защитил диссертацию, в которой пытался опровергнуть молекулярно-кинетическую теорию Ломоносова.
Творческая деятельность Ломоносова отличается как исключительной широтой интересов, так и глубиной проникновения в тайны природы. Его исследования относятся к математике, физике, химии, наукам о Земле, астрономии. Результаты этих исследований заложили основы современного естествознания. Ломоносов обратил внимание (1756) на основополагающее значение закона сохранения массы вещества в химических реакциях изложил (1741—1750) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие выдвинул (1744—1748) кинетическую теорию теплоты обосновал (1747—1752) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название физическая химия , а для практической части — техническая химия . Его [c.307]
Ломоносов обратил внимание (1756) на основополагающее значение закона сохранения массы вещества в химических реакциях изложил (1741—1750) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие выдвинул (1744—1748) кинетическую теорию теплоты обосновал (1747—1752) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название физическая химия , а для практической части — техническая химия . Его [c.307]
Основное содержание атомно-молекулярного учения. Основы атомно-молекулярного учения впервые были изложены Ломоносовым. В 1741 Г4 в одной из своих первых работ — Элементы математической химии — Ломоносов сформулировал важнейшие положения созданной им так называемой корпускулярной теории строения вещества. [c.19]
М. В. Ломоносов изложил основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие. [c.633]
[c.633]
Действительным основоположником атомно-молекулярного учения является VI. В. Ломоносов. В своем труде Элементы математической химии , изданном в 1741 г., он писал, что элемент есть часть тела, не состоящая из каких-либо других, меньших тел, и что элементы различны между собой. Совершенно ясно, что термин Ломоносова элемент совпадает с современным понятием атома. Ломоносов отметил, что корпускулы—это собрание элементов в одну незначительную массу. Нод корпускулой следует подразумевать молекулу. Далее Ломоносов пишет, что корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе, и что от этого зависит бесконечное разнообразие тел. Таким образом, Ломоносов задолго до зарубежных ученых ясно сформулировал основные положения атомно-молекулярной теории. [c.29]
Ломоносов впервые определил химию как науку об изменениях, происходящих в смешанном теле . Эту науку Ломоносов представлял себе как химические факты, объединенные математическим способом изложения и приведенные в систему на основе представлений о строении вещества.
За 200 с лишним лет, протекшие с того времени, когда жил и работал Ломоносов, его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена. В настоящее время на атомно-молекулярном учении базируются все наши представления о строении материи, о свойствах веществ и о природе физических и химических явлений. [c.19]
Основоположником атомно-молекулярного учения явился М. В. Ломоносов, изложивший свои взгляды в работе Элементы математической химии (1741 г.). Он объяснял разнообразие веществ не только различным химическим составом молекул, но и различным расположением атомов в молекуле.
Атомно-молекулярная теория. Создатель атомно-молекулярного учения и первооткрыватель закона сохранения массы веществ М.В.Ломоно-сов по праву считается основателем научной химии. Ломоносов четко различал две ступени в строении вещества элементы (в нашем понимании — атомы) и корпускулы (молекулы). Согласно Ломоносову, молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ — из разных атомов. Всеобщее признание атомно-молекулярная теория получила в начале XIX в. после утверждения в химии атомистики Дальтона. С тех пор главным объектом иссле- [c.7]
М. В. Ломоносов положил начало объединению учения о молекулах и атомах в атомно-молекулярное учение, получившее свое развитие в XIX в. [c.7]
В XVII—XVIII вв. атомизм приобрел механический характер. По сравнению с. предыдущим он был несколько более конкретным, но все же в большой мере оставался абстрактным н мало связанным с экспериментом. Выдающимися представителями здесь были Р. Бойль, который положил атомистику в основу своих химических представлений и объяснял асе химические превращения соединением и разъединением атомов М. В. Ломоносов, он сформулировал основные положения атомно-молекулярного учения. И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
Выдающимися представителями здесь были Р. Бойль, который положил атомистику в основу своих химических представлений и объяснял асе химические превращения соединением и разъединением атомов М. В. Ломоносов, он сформулировал основные положения атомно-молекулярного учения. И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
Закон сохранения массы. Химические уравнения. и расчеты по ним. Закон сохранения массы веи еств масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции (М. В. Ломоносов, 1848). С точки зрения атомно-молекулярного учения при химич еских реакциях атомы не образуются из ничего и не исчезают, поэтому число атомов всех видов в ходе химической реакции остается неизменным. А так. hMi маестгданного атома постоянна, [c.17]
Основные положения атомно-молекулярного учения. М. В. Ломоносов как основоположник атомно-молекулярного учения. Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге Химик-скептик он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. Л. Ируст (закон постоянства состава) и многие другие. [c.3]
В XVIII в. лишь отдельные передовые ученые выступали с критикой этой господствующей теории. В середине столетия М. В. Ломоносов, на основе своих теоретических представлений, выступил против распространенных в науке представлений о теплороде, или огненной материи . Опираясь на развитое им самим атомно-молекулярное учение, он разработал механическую теорию тепла, отчасти использовав идеи своих предшественников, и нашел пов[.ге аргументы в пользу принципа сохранения веса вещества и сохранения движения. На базе всего этого он сформулировал новые задачи химии как науки в противовес определениям своих современников, рассматривавших химию лишь как искус-с тво. [c.252]
В середине столетия М. В. Ломоносов, на основе своих теоретических представлений, выступил против распространенных в науке представлений о теплороде, или огненной материи . Опираясь на развитое им самим атомно-молекулярное учение, он разработал механическую теорию тепла, отчасти использовав идеи своих предшественников, и нашел пов[.ге аргументы в пользу принципа сохранения веса вещества и сохранения движения. На базе всего этого он сформулировал новые задачи химии как науки в противовес определениям своих современников, рассматривавших химию лишь как искус-с тво. [c.252]
Формулируя основные положения своей корпускулярной теории , Ломоносов не следует слепо за своими предшественниками и не исходит из каких-либо предвзятых идей. В простых и отчетливо сформулированных положениях он излагает атомно-молекулярное учение, получившее развитие спустя лишь 100 лет. В этом отношении корпускулярная теория Ломоносова, как и вся его корпускулярная философия , выгодно отличается от соответствующих построений авторов XVII в. [c.263]
[c.263]
Ломоносов создал стройное атомно-молекулярное учение и впервые применил его в химии. Основные положения атомно-молекулярного учения Ломоносова изложены в работе Элементы математической химии (1Т41) этим учением пронизаны и многие другие его работы. [c.10]
Химическая атомистика. Дальнейший исторический ход развития физики и химии в середине ХУП1 в. поставил перед учеными задачу внедрить в химию количественные методы и превратить корпускулярные воззрения в подлинно научную гипотезу. М.. В. Ломоносов кладет начало атомно-молекулярному учению и закладывает основу под химическую атомистику. [c.30]
Атомно-молекулярное учение М.В. Ломоносова
Цели урока:
- Образовательная:
Сформироватьпредставление и углубить знания
об “Атомно-молекулярном учении” М.В.
Ломоносова” как учении, лежащим в основе химии и
физики, применении учения на практике, в жизни,
показать историю становления учения, тесной
взаимосвязи химии и физики; значение атома в
мирной жизни, опасности выхода атома из под
контроля человека, ведущим к атомным катастрофам
и ядерным войнам, раскрыть последствия взрывов
атомных бомб.
Продолжать развивать креативные, коммуникативные качества, способность к продуцированию идей, мобилизовать свои скрытые знания, развитие речи, развивать интерес к предметам физике и химии проведение рефлексии, самооценки своей деятельности.
- Воспитательная:
Продолжать воспитывать чувство гордости за русскую науку, чувство патриотизма, развивать представление о М.В. Ломоносове как гениальном сыне Великой России, великом патриоте.
План.
- Организационный момент.
- Михаил Васильевич Ломоносов (сценка)
- “Моя химия – физическая”.
- Природа атомных ядер.
- Исследование М.В. Ломоносовым грозовых явлений.
- Электрический заряд в грозовом облаке.
- Занимательный опыт: “Наблюдение электрического заряда”.
- Нейтрон – нестабильная частица.

- Физические и химические свойства водорода и его изотопов.
- Разработка водородной бомбы.
- Защита организма от излучения.
- Рефлексия.
Оборудование и наглядные пособия:
- Компьютер, мультимедийный проектор.
- Презентация (тема, эпиграф, цель, задачи).
- Магнитофон – музыкальное сопровождение.
- Занимательный опыт (Электрофорная машина).
- Рефлексия (карточки).
- Портрет М.В. Ломоносова.
- Памятка по радиационной безопасности.
- Высказывания М.В. Ломоносова: “Химия и физика так соединились, что одна без другой в совершенстве быть не могут”. “Моя химия – физическая”.
Девиз:
“Химия и физика так соединились, что одна без другой в совершенстве быть не могут”.
М. В.Ломоносов
В.Ломоносов
Ход урока
1. Организационный момент.
Преподаватель физики (Слайд №1). Сегодняшнее учебное занятие мы посвящаем великому русскому ученому, гениальному человеку – Михаилу Васильевичу Ломоносову – создателю атомно-молекулярного учения.
Цель нашей сегодняшней работы рассмотреть атомно-молекулярное учение с современной точки зрения, обобщить знания об атоме. Что же такое атом? Что это за частицы Вселенной? Друг или враг человечества? Как мы, созданное свыше двухсот лет учение, применяем в современной жизни.
2. Сценка.
Написание М.В.Ломоносовым “Атомно-молекулярного учения”.
Под звуки “Студенческого гимна” выходит учащийся (Ломоносов), садится за стол, берет ручку из пера и рассуждает:
Учащийся (Ломоносов)
Да, прав был Демокрит, когда сказал о том, что все тела состоят из частиц.

Чтоб к положеньям моим не питали недоверия
Лишь по тому, что глаз этих телец первичных видит,
Я докажу, что бывают они несомненно в предметах
Даже тогда, когда глаз никакой их не может увидеть.
Должен быть в природе порядок. А учение должно быть такого:
- Все вещества состоят из молекул.
- Молекулы состоят из атомов.
- Молекулы и атомы находятся в непрерывном движении.
- При химических явлениях молекулы претерпевают изменения и из одних молекул образуются другие, при физических явлениях состав молекул остается неизменным.
3. Моя химия – физическая.
Преподаватель химии. (Слайд №2)
Наверно так, было создано великое учение М.В. Ломоносова об атомном строении мира.
1-й ведущий. Доказано, что любая материя
состоит из частиц. И это доказательство было
приведено греческим ученым – философом
Демокритом еще 2500 лет тому назад. Он то и ввел
слово “ атом”, что значит неделимый – крошечная
неделимая частица материи, принимающая участие в
химических реакциях.
Доказано, что любая материя
состоит из частиц. И это доказательство было
приведено греческим ученым – философом
Демокритом еще 2500 лет тому назад. Он то и ввел
слово “ атом”, что значит неделимый – крошечная
неделимая частица материи, принимающая участие в
химических реакциях.
Долго ученые не могли узнать строение атома. В 1911 году английский ученый Эрнст Резерфорд предложил планетарную модель строения атома, основанную на результатах собственных экспериментов и экспериментов Ханса Гейгера.
Согласно модели Резерфорда, атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, вся масса атома сосредоточена в ядре, а по орбиталям, как спутники вокруг Земли движутся электроны.
2-й ведущий. (Слайд №3)
А мне хотелось бы рядом с именем Ломоносова
поставить имя Дмитрия Ивановича Менделеева.
Создав свою периодическую систему, Дмитрий
Иванович говорил, что периодическому закону
принадлежит будущее. Он тогда просто не знал
ничего о строении атома, оказалось – каждая
цифра в его периодической системе имеет
определенный физический смысл.
Он тогда просто не знал
ничего о строении атома, оказалось – каждая
цифра в его периодической системе имеет
определенный физический смысл.
Номер периода равен числу энергетических уровней в атоме.
Номер группы равен числу валентных электронов.
Порядковый номер – заряду ядра атома и числу электронов.
Связал строение атома с периодической системой ученик Э.Резерфорда – Генри Мозли.
4. Природа атомных ядер.
Преподаватель физики. Мы знаем, что все тела состоят из молекул, а молекулы из атомов. В центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра движутся электроны. Протоны заряжены положительно, а электроны – отрицательно. Накопление большого количества зарядов разного знака вызывает вспышку. Примером гигантского искрового разряда – молния.
5. Исследование М.В. Ломоносовым грозовых явлений.

Учащийся. В давние времена на человека сильное впечатление производила гроза, испытывали страх перед ней, считали ее орудием своих богов, а молнию – это “небесной карой”.
Благодаря упорному труду исследователей удалось показать, что в явлении молнии нет ничего сверхъестественного и нет причин для суеверных страхов.
Среди первых ученых, доказавших электрическую природу грозы, был великий русский ученый Михаил Васильевич Ломоносов.
Летом 1752 г. Ломоносов со своим другом Рихманом построили “громовую машину”, с помощью которой они изучили грозовой разряд.
Большой опасности подвергался Ломоносов, проводя опыты во время грозы у себя дома. В 1753 г. его друг Рихман был убит шаровой молнией. Позже, вспоминая об этом, Ломоносов писал:
“Внезапно гром чрезвычайно грянул
в самое то время, как я руку держал у железа
и искры трещали.
Все от меня прочь бежали…”
Тяжело переживая смерть друга, Михаил Васильевич продолжил исследования и доказал что собой представляет молния.
Преподаватель физики. Как же создается электрический заряд в грозовом облаке?
6. Электрический заряд в грозовом облаке.
Учащийся. В верхней части облака (где температура ниже 0оС) ледяные кристаллы сталкиваются друг с другом, разламываются и электризуются. Более крупные осколки заряжаются отрицательно, осаждаются в нижнюю часть облака и там тают. Мелкая ледяная пыль, заряжается положительно ,относится потоками воздуха вверх. В этом случае вершина облака будет заряжена положительно, а нижняя часть – отрицательно. Проскакивает искра – это и есть молния.
Преподаватель физики. Сегодня продолжаются
эксперименты по изучению атмосферного
электричества, которые проводят с помощью
современного оборудования.
7. Занимательный опыт:
“Наблюдение электрического разряда”.Преподаватель физики. Нейтральной частицей – является нейтрон. Что собой представляет эта частица и какова ее роль?
8. Нейтрон – нестабильная частица.
Учащийся. Нейтрон входит в состав ядра, не имеет электрического заряда, обладает большой проникающей способностью. Его масса больше массы протона приблизительно на 2,5 электронных масс.
Нейтрон – нестабильная частица: свободный нейтрон живет 15 минут и распадается на протон, электрон и нейтрино.
Так как нейтроны лишены заряда, то они беспрепятственно проникают в атомные ядра и вызывают их изменения. После этого ядро разрывается на осколки неравной массы. Осколки эти сильно, радиоактивны, так как содержат избыточное количество нейтронов.
В результате наблюдения огромного числа
ядерных превращений постепенно выяснилось, что
существуют элементы с одинаковыми химическими
свойствами, но различались атомной массой, то
есть различным числом нейтронов. Эти элементы
помещены в одну клетку периодической системы
Менделеева. В 1911 году Содди назвал их изотопами.
Эти элементы
помещены в одну клетку периодической системы
Менделеева. В 1911 году Содди назвал их изотопами.
Преподаватель физики. Особенно интересен атом водорода и его изотопы.
9. Химические и физические свойства водорода и его изотопов. (Слайд №4)
Учащаяся Водород известен с XVI века. Алхимики заметили, что при взаимодействии железных опилок с соляной или серной кислотой выделяется «горючий все-дух», или «искусственный воздух». Это был водород.
Вслед за М.В.Ломоносовым, Г. Кавендиш выделил
водород изсерной и соляной кислот железом,
цинком, оловом. Он и указал, что при сжигании
«горючего воздуха» образуется вода. А.
Лавуазье повторил опыт Кавендиша и доказал, что
«горючий воздух» – простое вещество, а
вода – химическое соединение водорода и
кислорода. Лавуазье дал имя «горючему
воздуху» – гидрогениум (“рождающий воду”). Первые русские наименования водорода –
«водотворный газ», “водотвор”.
Первые русские наименования водорода –
«водотворный газ», “водотвор”.
За флогистон его признали,
Когда получен газ тот был.
Его горючесть доказали
Восстановлением простым.
Из отношенья к кислороду
Лавуазье названье дал.
Он флогистон тот развенчал.
Учащийся (стихотворение “Водород” )
Я – водород, я – водород, родитель всех и всяких вод.
Поверь, я самый легкий газ, и легче я в 16 раз,
Чем ваш любимый кислород.
Со мною вместе он даёт ту воду, что вы пьёте, которой вы живете.
В любой из клеток, что живет, в состав вхожу я – водород.
А в технике вам без меня не обойтись и даже дня.
Сказал ведь вам, что легче всех. И в том великий мой успех.
И эти вот воздушные шары – их наполняют мной – лети, лети, лети.
(бросают воздушные шары)
Преподаватель физики. В недрах Солнца содержится гигантское количество водорода, находящегося в состоянии сверхвысокого сжатия при температуре 15 000000 К, поэтому Солнце, обладая гигантской массой, в процессе термоядерного синтеза ежедневно теряет около 100 млр. т вещества и выделяет энергию, благодаря которой стала возможной жизнь на Земле.
Физика – по физическим свойствам – это газ, который не сохраняет свой объем, меняет форму и занимает всю предоставленную им емкость. Молекулы движутся беспорядочно.
Дейтерий – я дейтерий, я также стаю под номером №1 в таблице Менделеева, я сильнее водорода, так как моя атомная масса равна двум.
Химия – изотоп водорода, он стабилен, то
есть нерадиоактивен. При соединении дейтерия с
кислородом образуется тяжелая вода.
Физика – ее физические свойства заметно отличаются от свойств обычной воды. При нормальном атмосферном давлении она кипит при 101,2 оС и замерзает при 3,8 оС.
Тритий – я тритий, я также занимаю место в таблице Менделеева под №1, но я намного сильнее. Я самый сильный, потому что моя атомная масса равна трем.
Химия – изотоп водорода, бета-радиоактивен с периодом полураспада около 12 лет. Трития в природе нет, он вырабатывается в самом термоядерном реакторе из лития.
Физика – При слиянии дейтерия с тритием выделяется 176 000 000 эВ энергии. Это сулит человечеству, новый практически неисчерпаемый источник энергии.
Удалось осуществить неуправляемую реакцию взрывного типа в водородной бомбе.
10. Разработка водородной бомбы. (Слайд №5)
Учащийся. Термоядерный синтез легче всего
осуществить в смеси дейтерия и трития. Приняв это
за основу, ученые США в начале 1950 приступили к
реализации проекта по созданию водородной бомбы
(HB). Первые испытания модельного ядерного
устройства были проведены на полигоне Эниветок
весной 1951; термоядерный синтез был лишь
частичным. Значительный успех был достигнут 1
ноября 1951 при испытании массивного ядерного
устройства, мощность взрыва которого составила
4-8 Мт в тротиловом эквиваленте. Первая водородная
авиабомба была взорвана в СССР 12 августа 1953, а 1
марта 1954 на атолле Бикини американцы взорвали
более мощную (примерно 15 Мт) авиабомбу. С тех пор
обе державы проводили взрывы
усовершенствованных образцов мегатонного
оружия.
Термоядерный синтез легче всего
осуществить в смеси дейтерия и трития. Приняв это
за основу, ученые США в начале 1950 приступили к
реализации проекта по созданию водородной бомбы
(HB). Первые испытания модельного ядерного
устройства были проведены на полигоне Эниветок
весной 1951; термоядерный синтез был лишь
частичным. Значительный успех был достигнут 1
ноября 1951 при испытании массивного ядерного
устройства, мощность взрыва которого составила
4-8 Мт в тротиловом эквиваленте. Первая водородная
авиабомба была взорвана в СССР 12 августа 1953, а 1
марта 1954 на атолле Бикини американцы взорвали
более мощную (примерно 15 Мт) авиабомбу. С тех пор
обе державы проводили взрывы
усовершенствованных образцов мегатонного
оружия.
Демонстрация фильма “Атомная бомба”. Взрыв на
атолле Бикини сопровождался выбросом большого
количества радиоактивных веществ. Часть из них
выпала в сотнях километров от места взрыва на
японское рыболовецкое судно “Счастливый
дракон”, а другая покрыла остров Ронгелап. Поскольку в результате термоядерного синтеза
образуется стабильный гелий, радиоактивность
при взрыве чисто водородной бомбы должна быть не
больше, чем у атомного детонатора термоядерной
реакции. Однако в рассматриваемом случае
прогнозируемые и реальные радиоактивные осадки
значительно различались по количеству и составу.
Поскольку в результате термоядерного синтеза
образуется стабильный гелий, радиоактивность
при взрыве чисто водородной бомбы должна быть не
больше, чем у атомного детонатора термоядерной
реакции. Однако в рассматриваемом случае
прогнозируемые и реальные радиоактивные осадки
значительно различались по количеству и составу.
11. Защита организмов от излучения.
Учащийся. (Слайд №6)
Излучения радиоактивных веществ оказывают очень сильное воздействие на все живые организмы. Опасность излучений усугубляется тем, что они не вызывают никаких болевых ощущений даже при смертельных дозах.
Наиболее чувствительны к излучениям ядра
клеток, особенно клеток, которые быстро делятся.
Поэтому в первую очередь излучения поражают
костный мозг, из-за чего нарушается процесс
образования крови. Далее наступает поражение
клеток пищеварительного тракта и других органов.
При утечке радиации, необходимо принимать меры при радиационной защите всех людей. Самый простой метод защиты – это удаление всех от источника излучения на достаточно большое расстояние. Так же можно использовать для защиты преграды из поглощающих материалов. После аварии на Чернобыльской АЭС Международным агентством по атомной энергетике по предложению нашей страны приняты рекомендации по дополнительным мерам безопасности энергетических реакторов. Установлены более строгие регламенты работ персонала АЭС.
Преподаватель физики. (Слайд №7)
Хиросима, Нагасаки, Чернобыль, Фукусима показали, какую страшную опасность несет атом, когда он становится неуправляемым!
Все люди должны иметь представление об этой опасности и мерах защиты от нее.
У Вас на столе лежит ПАМЯТКА ПО РАДИАЦИОННОЙ БЕЗОПАСНОСТИ.
Изучим ее все вместе, а вместе скажем: “Мы, за мирный атом”! (Слайд№8)
Рефлексия.

Блеф-игра по теме: “Атомно-молекулярное учение”.
Верите ли вы…:
- Что впервые о строении веществ заговорили еще 2500 лет назад?
- Что атомно-молекулярное учение создал М.В. Ломоносов?
- Что строение атома открыл Д.И. Менделеев?
- Что любая материя состоит из частиц?
- Что атом согласно современной теории неделим?
- Что атом водорода образует изотопы?
- Что без энергии Солнца на Земле зародилась бы жизнь?
- Что водородная бомба безопасна?
- Что радиоактивное излучение не влияет на здоровье человека?
- Что не нужно знать ничего о защите человека от радиации?
- Что атом является единицей строения материи?
- атом, вышедший из под контроля человека – очень опасен.
Таблица. (Каждый учащийся заполняет таблицу). Слайд№9
Слайд№9
Атомно-молекулярное учение
| Это я уже знал | Этого я не знал | Думал иначе | Не понял, есть вопросы |
Слайд №10.
Презентация
Иллюстрирование положений атомно молекулярного учения. Химические реакции
§ 1 М.В. Ломоносов, как основоположник атомно-молекулярного учения
Начиная с XVII века, в науке существовало молекулярное учение, которое использовалось для объяснения физических явлений. Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из одних веществ в ходе химического процесса образуются новые.
Решение этого вопроса оказалось возможным на основе атомно-молекулярного учения. В 1741 г. в книге «Элементы математической химии» Михаил Васильевич Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский учёный-энциклопедист рассматривал строение вещества не как определенную комбинацию атомов, но как сочетание более крупных частиц — корпускул, которые, в свою очередь, состоят из более мелких частиц — элементов.
Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а на смену термину элемент пришёл термин атом. Однако суть высказанных им идей и определений блестяще выдержала испытание временем.
§ 2 История развития атомно-молекулярного учения
История развития и утверждения в науке атомно-молекулярного учения оказалась очень непростой. Работа с объектами микромира вызывала огромные трудности: атомы и молекулы было невозможно увидеть и, таким образом, убедиться в их существовании, а попытки измерения атомных масс нередко заканчивались получением ошибочных результатов. Через 67 лет после открытия Ломоносова, в 1808 году, известный английский учёный Джон Дальтон выдвинул атомную гипотезу. Согласно ей, атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов. Соединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон обеспечил прочный фундамент для дальнейших теоретических исследований в химии. К сожалению, Дальтон отрицал существование молекул у простых веществ. Он считал, что из молекул состоят только сложные вещества. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Через 67 лет после открытия Ломоносова, в 1808 году, известный английский учёный Джон Дальтон выдвинул атомную гипотезу. Согласно ей, атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов. Соединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон обеспечил прочный фундамент для дальнейших теоретических исследований в химии. К сожалению, Дальтон отрицал существование молекул у простых веществ. Он считал, что из молекул состоят только сложные вещества. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Условия для распространения идей атомно-молекулярного учения в естествознании сложились лишь во второй половине XIX века. В 1860 году на Международном съезде естествоиспытателей в немецком городе Карлсруэ были приняты научные определения атома и молекулы. Учения о строении веществ тогда ещё не было, поэтому было принято положение о том, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое сплошное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
Учения о строении веществ тогда ещё не было, поэтому было принято положение о том, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое сплошное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
§ 3 Основные положения атомно-молекулярного учения
1.Молекула — наименьшая часть вещества, сохраняющая его состав и важнейшие свойства.
2.Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Первый определил химию как науку М. В. Ломоносов. Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории. Оно сводится к следующим положениям:
1. Каждое вещество состоит из мельчайших, далее физически неделимых частиц (Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
2. Молекулы находятся в постоянном, самопроизвольном движении.
3. Молекулы состоят из атомов (Ломоносов назвал их элементами).
4. Атомы характеризуются определенным размером и массой.
5. Молекулы могут состоять как из одинаковых, так и различных атомов.
Молекула — это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы в газах притягиваются друг к другу очень слабо, тогда как между молекулами жидких и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении. Этим явлением объясняется, например, изменение объема веществ при нагревании.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом — это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами. При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разновидности атомов одного и того же элемента с различной массой, называются изотопами. Поэтому, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия «химический элемент» и «простое вещество».
Вещество — это определенная совокупность атомных и молекулярных частиц в любом из трех агрегатных состояний.
Агрегатные состояния вещества — состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем).
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Химический элемент — это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами.
Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества — это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических — разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Исключительное значение для развития химии имело атомно-молекулярное учение, колыбелью которого является Древняя Греция. Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом, однако, логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями. Как же зародилась атомистика? Основным научным методом древнегреческих философов являлись дискуссия, спор. Для поиска “первопричин” в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет, если начать его дробить?
Атомистика древнегреческих материалистов отделена от нас 25-ве-ковым периодом, однако, логика греков поражает настолько, что философское учение о дискретном строении материи, развитое ими, невольно сливается в сознании с нашими сегодняшними представлениями. Как же зародилась атомистика? Основным научным методом древнегреческих философов являлись дискуссия, спор. Для поиска “первопричин” в спорах обсуждались многие логические задачи, одной из которых являлась задача о камне: что произойдет, если начать его дробить?
Большинство философов считало, что этот процесс можно продолжать бесконечно. И только Левкип (500—440 до н.э.) и его школа утверждали, что этот процесс не бесконечен: при дроблении, в конце концов, получится такая частица, дальнейшее деление которой будет просто невозможно. Основываясь на этой концепции, Левкипп утверждал: материальный мир дискретен, он состоит из мельчайших частиц и пустоты. Ученик Левкиппа Демокрит (460—370 до н. э.) назвал мельчайшие частицы “неделимые”, что по-гречески значит “атом”. Это название мы используем и сегодня. Демокрит, развил новое учение — “атомистику”, приписал атомам такие “современные” свойства, как размер и форму, способность к движению.
Это название мы используем и сегодня. Демокрит, развил новое учение — “атомистику”, приписал атомам такие “современные” свойства, как размер и форму, способность к движению.
Последователь Демокрита Эпикур (342—270 до н. э.) придал древнегреческой атомистике завершенность, предположив, что у атомов существует внутренний источник движения, и они сами способны взаимодействовать друг с другом. Все положения древнегреческой атомистики выглядят удивительно современно, и нам они, естественно, понятны. Ведь любой из нас, ссылаясь на опыт науки, может описать множество интересных экспериментов, подтверждающих справедливость любой из выдвинутых концепций. Но совершенно непонятны они были 20—25 веков назад, поскольку никаких экспериментальных доказательств, подтверждающих справедливость своих идей, древнегреческие атомисты представить не могли. Итак, хотя атомистика древних греков и выглядит удивительно современно, ни одно из ее положений в то время не было доказано. Следовательно ”атомистика, развитая Левкиппом, Демокритом и Эпикуром, была и остается просто догадкой, смелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.
Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.
Были и другие причины, из-за которых учение атомистов было надолго забыто. К сожалению, атомисты не оставили после себя систематических трудов, а отдельные записи споров и дискуссий, которые были сделаны, лишь с трудом позволяли составить правильное представление об учении в целом. Главное же заключается е том, что многие концепции атомистики были еретичны и официальная церковь не могла их поддерживать.
Об учении атомистов не вспоминали почти 20 веков. И лишь в XVII в. Идеи древнегреческих атомистов были возрождены благодаря работам французского философа Пьера Гассенди (1592—1655 гг.). Почти 20 лет он потратил; чтобы восстановить и собрать воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах “С) жизни, нравах и учении Эпикура” и “Свод философии Эпикура”. Эти две книги, в которых воззрения древнегреческих материалистов впервые были изложены систематически, стали “учебником” для европейских ученых и философов. До этого единственным источником, дававшим информацию о воззрениях Демокрита — Эпикура, была поэма римского поэта Лукреция “О природе вещей”. История науки знает немало удивительных совпадений. Вот одно из них: возрождение древнегреческой атомистики совпадает по времени с установлением Р. Бойлем (1627—1691 гг.) фундаментальной закономерности, описывающей изменения объема газа от его давления. Качественное объяснение фактом, наблюдаемых Бойлем, может дать только атомистика: если газ имеет дискретное строение, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними. Первая робкая попытка применения атомистики для объяснения количественно наблюдаемых явлений природы позволяет сделать два очень важных вывода:
До этого единственным источником, дававшим информацию о воззрениях Демокрита — Эпикура, была поэма римского поэта Лукреция “О природе вещей”. История науки знает немало удивительных совпадений. Вот одно из них: возрождение древнегреческой атомистики совпадает по времени с установлением Р. Бойлем (1627—1691 гг.) фундаментальной закономерности, описывающей изменения объема газа от его давления. Качественное объяснение фактом, наблюдаемых Бойлем, может дать только атомистика: если газ имеет дискретное строение, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов в результате уменьшения свободного пространства между ними. Первая робкая попытка применения атомистики для объяснения количественно наблюдаемых явлений природы позволяет сделать два очень важных вывода:
- 1. Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно правильную трактовку самым разнообразным явлениям природы.

- 2. Для скорейшего превращения атомистики из философской гипотезы в научную концепцию доказательство существования атомов необходимо, прежде всего, искать при изучении газов, а не жидких и твердых веществ, которыми до этого занимались химики. Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ: водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения.
1. Существуют вещества молекулярного и немолекулярного строения.
2. У веществ молекулярного строения в твердом состоянии в узлах кристаллических решеток находятся молекулы.
3. У веществ немолекулярного строения в узлах кристаллических решеток находятся ионы или атомы.
4. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и его температуры. Наибольшие расстояния существуют между молекулами газов, поэтому газы легко сжимаются. В твердых веществах промежутки между частицами наименьшие, и соответственно эти вещества почти не подвержены сжатию.
Наибольшие расстояния существуют между молекулами газов, поэтому газы легко сжимаются. В твердых веществах промежутки между частицами наименьшие, и соответственно эти вещества почти не подвержены сжатию.
5. Молекулы находятся в непрерывном движении. Скорость их движения зависит от температуры. С повышением температуры скорость движения возрастает.
6. При физических явлениях молекулы сохраняются, при химических — разрушаются.
7. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении. Одной из форм движения атомов является химическая реакция.
8. Атомы одного элемента отличаются от атомов другого элемента размером, массой и свойствами.
9. Атомы при химических реакциях сохраняются.
10. Химическая реакция – это образование новых веществ из тех же атомов, из которых состояли исходные вещества.
Мы уже знаем,что
многие вещества состоят из молекул, а молекулы — из атомов. Сведения об атомах
и молекулах объединяются в атомно-молекулярное учение. Вам известно, что
основные положения этого учения были разработаны великим русским ученым М. В.
Ломоносовым. С тех пор прошло более двухсот лет, учение об атомах и молекулах
получило дальнейшее развитие. Так, например, теперь известно, что не все
вещества состоят из молекул. Большинство твердых веществ, с которыми мы
встретимся в неорганической химии, имеют немолекулярное строение.
Вам известно, что
основные положения этого учения были разработаны великим русским ученым М. В.
Ломоносовым. С тех пор прошло более двухсот лет, учение об атомах и молекулах
получило дальнейшее развитие. Так, например, теперь известно, что не все
вещества состоят из молекул. Большинство твердых веществ, с которыми мы
встретимся в неорганической химии, имеют немолекулярное строение.
Однако относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между
молекулами имеются промежутки, размеры которых зависят от агрегатного состояния
вещества и температуры. Наибольшие расстояния имеются между молекулами газов.
Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где
промежутки между молекулами значительно меньше. В твердых веществах промежутки
между молекулами еще меньше, поэтому они почти не сжимаются.
В твердых веществах промежутки
между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
4. Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движений.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
8. У веществ с
молекулярным строением в твердом состоянии в узлах кристаллических решеток
находятся молекулы. Связи между молекулами, расположенными в узлах
кристаллической решетки, слабые при нагревании разрываются. Поэтому вещества с
молекулярным строением, как правило, имеют низкие температуры плавления.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии.
Задание
1. Выберите слайд с одним из положений Атомно-молекулярного учения. Подберите иллюстрации и примеры из жизни, доказывающие это положение.
Сроки выполнения: 25.01- 30.01.162. Оцените следующий после вашего слайд по следующим критериям:
1. Наличие иллюстрации, соответствующей данному положению. 0-1б
2. Подобранные факты доказывают данное положение. 0-1б
3. Материал изложен доступным языком. 0-1б
4. Эстетическое оформление (иллюстрация хорошего качества, текст читаем). 0-1б
Презентация к бинарному уроку «Атомно-молекулярное учение М.В.Ломоносова»
библиотека
материалов
Содержание слайдов
Номер слайда 1
Презентация к бинарному уроку «АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ М. В. ЛОМОНОСОВА» (учебные дисциплины «Химия», «Физика») Шлыкова Алёна Васильевна, преподаватель химии Петенко Лариса Мироновна, преподаватель физики Государственное автономное профессиональное образовательное учреждение Свердловской области «НОВОУРАЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
В. ЛОМОНОСОВА» (учебные дисциплины «Химия», «Физика») Шлыкова Алёна Васильевна, преподаватель химии Петенко Лариса Мироновна, преподаватель физики Государственное автономное профессиональное образовательное учреждение Свердловской области «НОВОУРАЛЬСКИЙ ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ»
Номер слайда 2
Атомно-молекулярное учение М.В. Ломоносова. Закон сохранения массы веществ.
Номер слайда 3
Номер слайда 4
«Химия и физика так соединились, что одна без другой в совершенстве быть не могут» М. В.Ломоносов
В.Ломоносов
Номер слайда 5
«Многие звезды украшали русское небо восемнадцатого столетия. Звездою первой величины явилась слава Михаила Ломоносова» Б. Шергин Михаил Васильевич Ломоносов
Номер слайда 6
305 лет назад, 19 ноября 1711 года, на севере России в деревушке Мишанинская близ села Холмогоры Архангельской губернии в семье рыбака – помора родился здоровый и крепкий мальчик. Звали его Михайло Ломоносовым.
Звали его Михайло Ломоносовым.
Номер слайда 7
Первые учебники В 11-12 лет Михайло начал учиться грамоте. Обучившись чтению и письму, перечитал все книги в деревне. Он читал книги с таким усердием, что выучил их наизусть.
Номер слайда 8
Славянская «Грамматика» Мелетия Смотрицкого и «Арифметика» Леонтия Магницкого
Номер слайда 9
Путь Ломоносова в Москву Холмогоры Москва Страстная тяга к знаниям побудили Михайло Ломоносова в 19 лет отправиться пешком в Москву.
Номер слайда 10
Славяно – греко – латинская академия в Москве В 1730 году поступил в Славяно-греко-латинскую академию в Москве, где он не только приобрёл вкус к научным занятиям, но изучил латинский язык, ознакомился с науками и учебными дисциплинами.
Номер слайда 11
На уроке в академии… « Малые ребята кричат и перстами указывают: смотри-де, какой болван лет в двадцать пришел латыни учиться».
Номер слайда 12
В ноябре 1735 года в числе 12-ти лучших учеников отправили в Петербургскую Академию наук
Номер слайда 13
Марбург, Германия 1736 год Осенью 1736 года трое лучших студентов, в том числе Ломоносов, были отправлены Академией наук в Германию, для обучения математике, физике, химии, философии и металлургии. Студент немецкого университета
Студент немецкого университета
Номер слайда 14
В 1741 году после возвращения на Родину М.В.Ломоносов был назначен адъюнктом (помощником) Академии по физическому классу, что открыло ему путь к самостоятельному творчеству и представило определённые права – участие в заседаниях Академического собрания.
Номер слайда 15
В 1745 году М. В.Ломоносов был избран членом Академии наук и стал первым русским профессором химии в университете.
В.Ломоносов был избран членом Академии наук и стал первым русским профессором химии в университете.
Номер слайда 16
Диплом профессора химии
Номер слайда 17
Ломоносов занимался исследованиями по математике, физике, астрономии, химии, географии, геологии, биологии, языкознанию, философии, истории.
Номер слайда 18
Ломоносов по-новому осознал роль и значение химии, её место среди наук, изучающих природу. Он называл химию наукой. «Слово о пользе Химии» Ломоносова Любимая наука — химия
Номер слайда 19
В 1748 году он создаёт первую русскую химическую лабораторию, помогает Ломоносову в этом его близкий друг Георг Вильгельм Рихман — русский физик, занимавшийся работами по электричеству.
Номер слайда 20
В химической лаборатории он проводил научные исследования, в том числе разрабатывал состав стекла, фарфора и смальты, которую использовал для своих мозаик, созданных в 1751 году. Ломоносов в своей химической лаборатории
Номер слайда 21
«Мозаичное художество» М. В. Ломоносова Открыл секрет изготовления смальты Изготовил 40 мозаичных картин Избран почетным членом Петербургской Академии художеств
В. Ломоносова Открыл секрет изготовления смальты Изготовил 40 мозаичных картин Избран почетным членом Петербургской Академии художеств
Номер слайда 22
«Мозаичное художество» М.В. Ломоносова
Номер слайда 23
Для изготовления изделий из цветного стекла в 1753 году Ломоносов начал строительство фабрики. Усть-Рудицкая фабрика была передовым художественно-промышленным предприятием России XVIII века. На фабрике применялись станки, созданные по проекту учёного. Бисерное панно с видом фабрики
Усть-Рудицкая фабрика была передовым художественно-промышленным предприятием России XVIII века. На фабрике применялись станки, созданные по проекту учёного. Бисерное панно с видом фабрики
Номер слайда 24
Открытия М.В. Ломоносова в области физики
Номер слайда 25
Астрономия Открытие атмосферы на Венере
Номер слайда 26
Механика Закон сохранения энергии движения Закон сохранения силы Теория упругости среды
Номер слайда 27
Термодинамика Опроверг существование теплорода Высказал, что теплота — это внутренне движение частиц Предположил существование абсолютного нуля температуры
Номер слайда 28
Электродинамика Атмосферное электричество обусловлено движением воздушных слоев Электричество — особый вид движения эфира
Номер слайда 29
Оптика Корпускулярная (молекулярная) теория Развивая свои представления о корпускулах (молекулах) и элементах (атомах), Ломоносов приписывал им следующие свойства: протяженность, тяжесть, определенную форму (шарообразную). Он принимал также, что корпускулы (молекулы) находятся в непрерывном движении.
Он принимал также, что корпускулы (молекулы) находятся в непрерывном движении.
Номер слайда 30
Сын простого рыбака, простолюдин и мужик, стал членом Российской и Шведской Академий наук, дворянином, учёным, признанным в России и всей Европе. За всю историю России ни один крестьянин не прошёл такой путь. «Историк, ритор, механик, химик, минералог, художник и стихотворец — он всё испытал и всё прошёл». А.С.Пушкин
Номер слайда 31
Основные положения атомно-молекулярного учения
Номер слайда 32
Михаил Васильевич Ломоносов (1711 – 1765)
Номер слайда 33
1. Все вещества состоят из молекул. 2. Молекулы состоят из атомов. 3. Молекулы и атомы находятся в непрерывном движении. 4. При физических явлениях состав молекул остается неизменным, а при химических явлениях молекулы претерпевают изменения и из одних молекул образуются другие. 5. «Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому».
Все вещества состоят из молекул. 2. Молекулы состоят из атомов. 3. Молекулы и атомы находятся в непрерывном движении. 4. При физических явлениях состав молекул остается неизменным, а при химических явлениях молекулы претерпевают изменения и из одних молекул образуются другие. 5. «Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому».
Номер слайда 34
Физические явления
Номер слайда 35
Роль диффузии и броуновского движения в природе и технике Диффузия — явление проникновения частиц одного вещества в промежутки между частицами другого. Питание растений из почвы Работа органов обаяния В организмах человека и животных всасывание питательных веществ, происходит через стенки органов пищеварения Цементация Сварка, диффузная сварка и пайка металлов Окрашивание тканей Броуновское движение – беспорядочное движение мелких частиц, взвешенных в жидкостях или в газе, происходящие под влияние теплового движения.
Питание растений из почвы Работа органов обаяния В организмах человека и животных всасывание питательных веществ, происходит через стенки органов пищеварения Цементация Сварка, диффузная сварка и пайка металлов Окрашивание тканей Броуновское движение – беспорядочное движение мелких частиц, взвешенных в жидкостях или в газе, происходящие под влияние теплового движения.
Номер слайда 36
Диффузная сварка металлов
Номер слайда 37
Применение диффузии На явлении диффузии основана диффузная сварка металлов. Детали помещают в закрытую сварочную камеру с сильными разряженными газами, сдавливают и нагревают до 800 градусов. На явлении диффузии основан процесс металлизации – покрытия поверхности изделия слоем металла или сплава. Он применяется для защиты изделий от коррозии, износа.
Детали помещают в закрытую сварочную камеру с сильными разряженными газами, сдавливают и нагревают до 800 градусов. На явлении диффузии основан процесс металлизации – покрытия поверхности изделия слоем металла или сплава. Он применяется для защиты изделий от коррозии, износа.
Номер слайда 38
Химические явления
Номер слайда 39
Закон сохранения массы веществ
Номер слайда 40
История открытия «Закона сохранения массы веществ»
Номер слайда 41
«Всё изменяется, но ничто не исчезает» Публий Овидий Назон -древнеримский поэт и философ (20 марта 43 года до н. э. -17 или 18 год н. э)
э. -17 или 18 год н. э)
Номер слайда 42
Аристотель — древнегреческий философ «Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям».
Номер слайда 43
Знаменитый английский химик Роберт Бойль, прокаливая в открытой реторте различные металлы, и взвешивая их до и после нагревания, обнаружил, что масса металлов становится больше. Он говорил, что есть «какая-то огненная материя, которая при нагревании металла соединяет с ним, и за счёт этого увеличивается масса».
Он говорил, что есть «какая-то огненная материя, которая при нагревании металла соединяет с ним, и за счёт этого увеличивается масса».
Номер слайда 44
Михаил Васильевич Ломоносов в отличие от Роберта Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому». 1748 год
Номер слайда 45
Французский химик Антуан Лоран Лавуазье (1743-1794) В 1789 году закон сохранения массы веществ был установлен французским химиком Антуаном Лораном Лавуазье
Номер слайда 46
Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции
Номер слайда 47
«Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому». Масса веществ, вступивших в реак- цию, равна массе образовавшихся ве- ществ в результате реакции.
Масса веществ, вступивших в реак- цию, равна массе образовавшихся ве- ществ в результате реакции.
Номер слайда 48
Экспериментальная часть
Номер слайда 49
Лабораторный эксперимент 1. Что делали? 2. Какие признаки реакции наблюдали? 3. Изменилась ли масса получившихся веществ? 4. Записать уравнения реакции. 5. Сформулировать вывод на основе проделанного эксперимента.
Что делали? 2. Какие признаки реакции наблюдали? 3. Изменилась ли масса получившихся веществ? 4. Записать уравнения реакции. 5. Сформулировать вывод на основе проделанного эксперимента.
Номер слайда 50
3. Атомы при химических реакциях сохраняются. 4. Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции. 5. На основе закона сохранения массы веществ составляют уравнения химических реакций. Значение закона 1. Открытие закона способствовало дальнейшему развитию химии, как науки. 2. При химических реакциях разрушаются химические связи между атомами одних веществ и происходит перегруппировка атомов с образованиями других веществ.
Значение закона 1. Открытие закона способствовало дальнейшему развитию химии, как науки. 2. При химических реакциях разрушаются химические связи между атомами одних веществ и происходит перегруппировка атомов с образованиями других веществ.
Номер слайда 51
Закрепление
Номер слайда 52
Кроссворд «Атомно-молекулярная теория» Критерии оценивания кроссворда: 6 — 7 слов – «3» 8 — 9 слов – «4» 10 – 11 слов – «5»
Номер слайда 53
9 ф и 10 л а в у а з ь е и 4 ч 5 Б о й л ь е о с 8 х и м и ч е с к и е о и 3 н 2 е р о м 1 в е щ е с т в о а о л к в е ц к 11 7 д и ф ф у з и я у а я л т 6 а р и с т о т е л ь м Кроссворд «Атомно-молекулярная теория»
Номер слайда 54
«Химия и физика так соединились, что одна без другой в совершенстве быть не могут» М. В.Ломоносов
В.Ломоносов
Номер слайда 55
Номер слайда 56
Успехов в изучении химии!
Понятия и теории химии.
 Атомно-молекулярное учение
Атомно-молекулярное учениеИзвестно, что химия изучает вещества и их свойства. Для того чтобы объяснить почему то или иное вещество вступает или не вступает в химические процессы, нужно заглянуть внутрь его. Но атомы и молекулы, из которых состоят вещества, нельзя увидеть даже с помощью мощного микроскопа. Из материалов урока вы узнаете, как ученые-химики познавали и познают микромир.
1. Роль и место метода моделирования в химии
Основной метод познания в химии — моделирование.
Моделирование – это один из способов познания реального мира, при котором представления об изучаемом объекте строятся не путем непосредственного наблюдения, а по косвенным данным.
Модель может быть выполнена из какого-либо материала (т.е. быть реальной), а может существовать только в нашем воображении. Первоначально созданная модель может перестраиваться или вовсе заменяться другой моделью при встрече с противоречащими данной модели фактами.
Запомните, что природа гораздо разнообразнее, чем любая, даже самая хорошая, теоретическая модель. Поэтому все разрабатываемые теоретические модели постоянно приходится совершенствовать.
- Моделирование – основано на изучении моделированного объекта. Модель строится по подобию оригинала, на ней воспроизводят, свойственные оригиналу процессы и полученные сведения переносятся на моделируемый объект – оригинал.
Различают несколько видов моделирования:
- Мысленное. К нему относятся самые различные мыслительные представления в форме тех или иных воображаемых моделей.
- Физическое. Оно характеризуется физическим подобием между моделью и оригиналом.
- Символическое – связано с построением графиков, схем.
Моделирование как метод познания бывает единственно необходимым для исследования некоторых явлений.
Таким образом, все названные методы научного познания являются важными и необходимыми для познания окружающего мира.
2. Сущность теоретического моделирования
Так как же зарождались первые модели веществ и химических реакций? Еще во времена Античности ученых интересовал вопрос: «Можно ли из одного вещества получить какое угодно другое вещество?».
Древнегреческий философ Аристотель предположил, что основу всего составляют 4 стихии: огонь, вода, воздух и земля. Эти стихии находятся во взаимосвязи и взаимодействии.
Рис. 1. Теория «4 стихий» Аристотеля
Аристотель считал огонь, воду, воздух и землю неделимыми элементами, которые могут превращаться друг в друга, а также соединяться друг с другом, образуя новые тела. Соединение элементов с противоположными свойствами считалось невозможным: огонь не может соединиться с водой, а воздух с землей.
Предположение Аристотеля было очевидным, поэтому его представления владели умами более тысячи лет. Например, мы знаем, что вода не горит. В соответствие с данной моделью Аристотель считал, что из одного вещества можно получить любое другое вещество. Главное – подобрать условия его превращения.
Например, мы знаем, что вода не горит. В соответствие с данной моделью Аристотель считал, что из одного вещества можно получить любое другое вещество. Главное – подобрать условия его превращения.
3. Модельные представления Аристотеля и Демокрита
Другая модель строения вещества была предложена еще одним древнегреческим ученым Демокритом.
Рис. 2. Древнегреческий философ Демокрит
Он считал, что вещества состоят из неделимых частиц – атомов. Атомы отличаются формой и размером. Благодаря особенностям своей формы и размера атомы могут соединяться, образуя вещества.
В соответствии с моделью Демокрита, из одного вещества нельзя получить какое угодно другое вещество. Но учение об атомах было неочевидным, поэтому модель Демокрита была забыта вплоть до 17 в.
4. Основные положения атомно-молекулярной теории
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям.
Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества — из «сложных атомов» (в современном понимании — молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом — это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют вещества с молекулярным и немолекулярным строением.

- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.

- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Атомно-молекулярное учение — Курсовая работа
Содержание
Введение 3
1. Значение темы «Атомно-молекулярное учение» в курсе химии средней школы 5
1. Краткая историческая справка возникновения учения об атомах и молекулах 6
2. Атомно-молекулярное учение – научная основа вводного курса химии 8
3. Методика изучения темы «Атомно-молекулярная теория» в VIII классе 11
4. Современное состояние атомно-молекулярного учения 17
Заключение 27
Список использованной литературы 28
Введение
Атомно-молекулярное учение – это фундаментальная основа химии и физики. Представление о том, что вещество состоит из отдельных очень малых неделимых частиц-атомов, возникло еще в Древней Греции (атомная гипотеза). Особенностью окружающего нас мира является материальность его объектов том смысле, что они существуют вне и независимо от нашего сознания.
Особенностью окружающего нас мира является материальность его объектов том смысле, что они существуют вне и независимо от нашего сознания.
Атомно-молекулярное учение — это совокупность теоретических представлений естествознания о дискретном строении веществ.
Представление о том, что вещество состоит из отдельных очень малых неделимых частиц-атомов, возникло еще в Древней Греции (атомная гипотеза). Но научное обоснование этой гипотезы стало возможным лишь в конце XVIII — начале XIX вв., когда при изучении химических и физических процессов стали использовать все более точные количественные методы исследования.
Основные положения атомно-молекулярного учения были сформулированы М.В. Ломоносовым (1741) в разработанной им корпускулярной теории строения вещества. Работы Ломоносова на многие десятилетия опередили свою эпоху, его корпускулярная теория не была понята и не была воспринята современниками.
В развитие атомно-молекулярного учения также большой вклад внесли Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров и многие другие.
Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров и многие другие.
Актуальность данной работы обусловлена тем, что тема «Атомно-молекулярное учение» является обязательной частью программы изучения химии в школе и присутствует во всех учебниках и программах систематических курсов химии, помогая подготовить учащихся к пониманию всего остального курса.
Целью данной работы является изучение методики обучения теме «Атомно-молекулярное учение» в курсе химии средней школы.
Основные задачи:
– раскрыть значение темы «Атомно-молекулярное учение» в курсе химии средней школы;
– изучить историю возникновения и развития учения об атомах и молекулах;
– определить научную основу вводного курса химии;
– рассмотреть методику изучения темы «Атомно-молекулярное учение» в 8 класса средней школы;
– рассмотреть современное состояние атомно-молекулярного учения.
Предметом исследования является методика изучения темы «Атомно-молекулярное учение» в школе.
Объектом изучения является атомно-молекулярное учение в химии.
Структурно работа состоит из введения, 4 глав, заключения и списка использованной литературы.
- Значение темы «Атомно-молекулярное учение» в курсе химии средней школы
Учащиеся впервые знакомятся с атомно-молекулярным учением в рамках школьного курса химии в теме «Первоначальные химические понятия». Именно здесь формируются с привлечением материала физики важнейшие положения этого учения, на базе которых изучается весь последующий вводный курс химии.
Атомно-молекулярное учение является обязательной частью любого учебника и курса химии, так как она готовит учащихся к пониманию всего остального курса. В ней закладываются самые первые понятия о веществах, химических реакциях, химических элементах, методологии химической науки. В связи с тем, что предъявляемые учащимся факты должны получить теоретическое объяснение, предлагается их трактовка с позиции атомно-молекулярного учения. Это учение имеет опору в курсе физики, которая несколько опережает химию и одновременно открывает перспективу развития теории строения вещества.
Атомно-молекулярная теория. Атомно молекулярное учение
Атомно-молекулярное учение – совокупность положений, аксиом и законов, которые описывают все вещества как набор молекул, состоящих из атомов.
Древнегреческие философы задолго до начала нашей эры в своих трудах уже выдвигали теорию существования атомов. Отвергая существование богов и потусторонних сил, они пытались объяснить все непонятные и загадочные явления природы естественными причинами – соединением и разъединением, взаимодействием и смешиванием невидимых человеческому глазу частичек – атомов. Но служители церкви на протяжении многих веков преследовали приверженцев и последователей учения об атомах, подвергали их гонениям. Но из-за отсутствия необходимых технических приспособлений философы древности не могли скрупулезно изучить природные явления, и под понятием «атом» у них скрывалось современное понятие «молекула».
Лишь в середине ХVIII века великий русский учёный М. В. Ломоносов обосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
В. Ломоносов обосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
М.В. Ломоносов четко разграничивал две ступени в строении вещества: элементы (в современном понимании – атомы) и корпускулы (молекулы). В основе его корпускулярно-кинетической теории (современного атомно-молекулярного учения) лежит принцип прерывности строения (дискретности) вещества: любое вещество состоит из отдельных частиц.
В 1745 году М.В. Ломоносов писал: «Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел… Корпускулы есть собрание элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
Молекула является наименьшей частицей вещества, обладающей всеми его химическими свойствами. Вещества, имеющие молекулярную структуру, состоят из молекул (большинство неметаллов, органические вещества). Значительная часть неорганических веществ состоит из атомов (атомная решётка кристалла) или ионов (ионная структура). К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является комбинация элементарных частиц (ионы или атомы), то есть кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом – мельчайшая, далее химически неделимая составная часть молекулы.
Получается, молекулярная теория объясняет физические явления, которые происходят с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно-молекулярное учение. Сущность этого учения можно сформулировать в виде нескольких законов и положений:
- вещества состоят из атомов;
- при взаимодействии атомов образуются простые и сложные молекулы;
- при физических явлениях молекулы сохраняются, их состав не изменяется; при химических – разрушаются, их состав изменяется;
- молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются;
- атомы одного элемента сходны друг с другом, но отличаются от атомов любого другого элемента;
- химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.

Благодаря своей атомно-молекулярной теории М.В. Ломоносов по праву считается родоначальником научной химии.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
1.Химия как предмет естествознания Химия изучает ту форму движения материи, в которой происходит взаимодействие атомов с образованием новых определенных веществ.Химия -наука о оставе,строении и свойствах веществ, их превращении или явлениях, кот.эти превращения сопровождают.Современная химия включает :общую, органическую,коллоидную,аналитическую,физическую,геологическую,биохимию,химию строительных материалов.Предмет химии — химические элементы и их соединения, а также закономерности, которым подчиняются различные химические реакции. соединяет физико-математические и биолого-социальные науки.
2.Класс
неорганических соединений. Основные
химические свойства кислот, оснований,
солей. По
свойствам неорганических соединений разделяеют
на след. Классы :
оксиды, основания, кислоты,
соли.Оксиды -соединение
элементов с кислородом, в которых
последний является более электроотрицательным
элементом, а именно проявляет
степень окисления -2.
и имеет место связь только элемент
О2.Общ.формула СхОу. Бывают :кислотны е-способны
к солеобразованию с основными оксидами
и основаниями (SO3+Na2O=Na2SO4;
So3+2NaOH=Na2SO4=h3O),основные- способны
к солеобразовнию с кислотными оксидами
и кислотами(СаО+СО2=СаСО3; СаО+2НСl=CaCl2+h3O ),амфотерные (к-ты
и основ.)и с тем и с тем(ZnO,BeO,Cr2O3,SnO,PbO,MnO2).и
несолеобразующие (CO,NO,N2O)Основания
— вещества, при электролтической
диссоциации которых анион м.б. только
гидроксильная группа ОН. Кислотность
основания-число ионов ОН образующихся
при диссоциации гидроксида.
Гидроксиды-вещества, содержащие группу
ОН, получаются соединением оксидов с
водой.Бывают 3видов : основные (основания) , кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты-проявляют
основные и кислотные свойства Cr(OH)3,Zn(OH)2,Be(OH)2,Al(OH)3) Кислоты -вещества,
при электролитической диссоциации
кот.
По
свойствам неорганических соединений разделяеют
на след. Классы :
оксиды, основания, кислоты,
соли.Оксиды -соединение
элементов с кислородом, в которых
последний является более электроотрицательным
элементом, а именно проявляет
степень окисления -2.
и имеет место связь только элемент
О2.Общ.формула СхОу. Бывают :кислотны е-способны
к солеобразованию с основными оксидами
и основаниями (SO3+Na2O=Na2SO4;
So3+2NaOH=Na2SO4=h3O),основные- способны
к солеобразовнию с кислотными оксидами
и кислотами(СаО+СО2=СаСО3; СаО+2НСl=CaCl2+h3O ),амфотерные (к-ты
и основ.)и с тем и с тем(ZnO,BeO,Cr2O3,SnO,PbO,MnO2).и
несолеобразующие (CO,NO,N2O)Основания
— вещества, при электролтической
диссоциации которых анион м.б. только
гидроксильная группа ОН. Кислотность
основания-число ионов ОН образующихся
при диссоциации гидроксида.
Гидроксиды-вещества, содержащие группу
ОН, получаются соединением оксидов с
водой.Бывают 3видов : основные (основания) , кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты-проявляют
основные и кислотные свойства Cr(OH)3,Zn(OH)2,Be(OH)2,Al(OH)3) Кислоты -вещества,
при электролитической диссоциации
кот. Катионом м.б. только + заряженный
ион Н. Бывают:
бескислородные,кислородсодержащие .Число
Н-основность кислоты. мета и орто
формы-молекулы воды. Соли -вещества,
при электоролитической диссоциации
которых катионом может быть ион
аммония(Nh5)
или ион металла, а анионом любой кислотный
остаток Бывают:средние (полное
замещение.состоят из кисотного остатка
и иона метала), кислы е(неполное
замещение.наличие в составе незамещенных
Н), основные
(неполное замещение.наличие незамещенных
ОН) По составу неорганические вещества
делятся на бинарные – состоящие только из двух элементов, и
многоэлементные – состоящие из нескольких элементов.
Катионом м.б. только + заряженный
ион Н. Бывают:
бескислородные,кислородсодержащие .Число
Н-основность кислоты. мета и орто
формы-молекулы воды. Соли -вещества,
при электоролитической диссоциации
которых катионом может быть ион
аммония(Nh5)
или ион металла, а анионом любой кислотный
остаток Бывают:средние (полное
замещение.состоят из кисотного остатка
и иона метала), кислы е(неполное
замещение.наличие в составе незамещенных
Н), основные
(неполное замещение.наличие незамещенных
ОН) По составу неорганические вещества
делятся на бинарные – состоящие только из двух элементов, и
многоэлементные – состоящие из нескольких элементов.
1.Все вещества состоят из молекул(корпускулы), при физических явлениях, молекулы сохраняются, при химических разрушаются.
2.Молекулы состоят из атомов(элементы), при химических реакциях атомы сохраняются.
3.Атомы
каждого
вида (элемента)
одинаковы между собой, но отличаются
от атомов любого другого
вида.
4. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
5.Химичские реакции заключаются в образовании новых веществ, из тех же самых атомов, из которых состоят первоначальные вещества.+6.молек. и атомы находятся в непрерывном движении, а теплота состоит во внутреннем движении этих частиц
. Атом — наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами
Химический
элемент — вид атомов с одинаково полож. Зарядом
ядра. Физических свойств, характерных
для простого вещества,
химическому
элементу приписать нельзя. Простые
вещества — это вещества, состоящие из атомов
одного и того же химического элемента. 4.Основные
законы химии(закон сохранения, постоянства
состава,кратных отношений, закон
Авагадро) Закон
сохранения: Масса
веществ, вступающих в реакцию, равна
массе веществ, образующихся в результате
реакции. Закон
постоянства состава : (любое хим. Соединение имеет один и тот
же количественный состав независимо
от способа его получения)Соотношения
между
массами
элементов,
входящих в сотав данного
соединения,постоянны
и не зависят от способа получения этого
соединения.
Закон
постоянства состава : (любое хим. Соединение имеет один и тот
же количественный состав независимо
от способа его получения)Соотношения
между
массами
элементов,
входящих в сотав данного
соединения,постоянны
и не зависят от способа получения этого
соединения.
Закон кратных отношений : Если два элемента образут друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре при одинаковом давлении, содержится одно и то же число молекул.
5.
Закон Эквивалентов . Эквивалент
вещества —
это такое количество вещества,какое
взаимодействует с 1 молем атома водорода
или вытесняет такое же количество
атомов Н в хим. Реакций. Vэ(Л/Моль)-
эквивалентный объем вещества, тоесть
то объем одного эквивалента вещества
в газообразном состояние.ЗАКОН.Все
вещества реагируют в химических реакциях
и образуются в эквивалентных количествах. Отношение
эквивалентных масс, объемов, реагирующих
или образующих вещества,прямо
пропорционально отнощению их
масс(объемов)илиилиЭ(простые)=А(атомная
масса)/В(валентность элемента)
Э(кислоты)=М(молярная
масса)/осн(основание кислоты) Э(Гидроксида)=М/Кисл)Кислотность
гидроксида) Э(аксиды
соли)=M/а(количество
атомов элемента образ. Оксид(соли)*в
(валентность этого элемента или металла)
Vэ(Л/Моль)-
эквивалентный объем вещества, тоесть
то объем одного эквивалента вещества
в газообразном состояние.ЗАКОН.Все
вещества реагируют в химических реакциях
и образуются в эквивалентных количествах. Отношение
эквивалентных масс, объемов, реагирующих
или образующих вещества,прямо
пропорционально отнощению их
масс(объемов)илиилиЭ(простые)=А(атомная
масса)/В(валентность элемента)
Э(кислоты)=М(молярная
масса)/осн(основание кислоты) Э(Гидроксида)=М/Кисл)Кислотность
гидроксида) Э(аксиды
соли)=M/а(количество
атомов элемента образ. Оксид(соли)*в
(валентность этого элемента или металла)
6.
Строение атомов. Ядро. Ядерные реакции.
Виды излучения. Модель
по резерфорду:1.практически вся масса
сосредоточена в ядре 2.+ компенисруются
– 3.заряд равен номеру группы. Простейшим
–Н водород Современное
понятие хим. Элемента-вид
атомов с одинаково полож. Зарядом ядря
атом
состоит из положительно заряженного
ядра и электронной оболочки. Электронная
оболочка образована электронами. Число
электронов равно числу протонов, поэтому
заряд атома в целом равен 0
Число протонов, заряд ядра и число
электронов численно равны порядковому
номеру химического элемента. практически
вся масса атома сосредоточена в ядре.
Электроны
двигаются вокруг ядра атома,
не беспорядочно, а в зависимости от
энергии, которой они обладают, образуя
так называемый электронный слой. На
каждом электронном слое может
располагаться определенное число
электронов:
на первом — не больше 2, на втором — не
больше 8, на третьем — не больше 18. Число
электронных слоев определяется по
номеру периода Число электронов на
последнем (внешнем) слое определяется
по номеру группы в периоде происходит
постепенное ослабление металлических
свойств и возрастание свойств неметаллов Я́дерная
реа́кция — процесс образования новых
ядер или частиц при столкновениях ядер
или частиц. Радиоактивностью называют
самопроизвольное превращение
неустойчивого изотопа одного химического
элемента в изотоп другого элемента,
сопроваждающееся испусканием элементарных
частиц или ядер.
Электронная
оболочка образована электронами. Число
электронов равно числу протонов, поэтому
заряд атома в целом равен 0
Число протонов, заряд ядра и число
электронов численно равны порядковому
номеру химического элемента. практически
вся масса атома сосредоточена в ядре.
Электроны
двигаются вокруг ядра атома,
не беспорядочно, а в зависимости от
энергии, которой они обладают, образуя
так называемый электронный слой. На
каждом электронном слое может
располагаться определенное число
электронов:
на первом — не больше 2, на втором — не
больше 8, на третьем — не больше 18. Число
электронных слоев определяется по
номеру периода Число электронов на
последнем (внешнем) слое определяется
по номеру группы в периоде происходит
постепенное ослабление металлических
свойств и возрастание свойств неметаллов Я́дерная
реа́кция — процесс образования новых
ядер или частиц при столкновениях ядер
или частиц. Радиоактивностью называют
самопроизвольное превращение
неустойчивого изотопа одного химического
элемента в изотоп другого элемента,
сопроваждающееся испусканием элементарных
частиц или ядер. Виды излучений:альфа,бета(отриц и полож) и гамма.
Алфа
частица – ядро атома гелия 4/2He.
При испускании альфа-частиц ядро теряет
два протона и два нейтрона,следовательно
заряд уменьшается на 2, а массовое число
на 4.отрицательная бэта частица –
электрон. при испускании электрона
заряд ядра увеличивается на единицу,
а массовое число не изменяется.
нестабильный изотоп оказывается
настолько возбужденным, что испускание
частицы не приводит к
полному
снятию возбуждения, тогда он выбрасывает
порцию чистой энергии, называемой
гамма-излучением. Атомы
обладающие одинаковы зарядом ядра, но
разными массовыми числами, называются
изотопами(например 35/17 Cl
и 37/17Cl) Атомы
имеющие одинаковые массовые числа,но
разное число протонов в ядре,называются
изобарами(например 40/19K
и 40/20Ca) Периодом
полураспада (Т ½)называется время,за
которое распадается половина исходного
количества радиоактивного изотопа.
Виды излучений:альфа,бета(отриц и полож) и гамма.
Алфа
частица – ядро атома гелия 4/2He.
При испускании альфа-частиц ядро теряет
два протона и два нейтрона,следовательно
заряд уменьшается на 2, а массовое число
на 4.отрицательная бэта частица –
электрон. при испускании электрона
заряд ядра увеличивается на единицу,
а массовое число не изменяется.
нестабильный изотоп оказывается
настолько возбужденным, что испускание
частицы не приводит к
полному
снятию возбуждения, тогда он выбрасывает
порцию чистой энергии, называемой
гамма-излучением. Атомы
обладающие одинаковы зарядом ядра, но
разными массовыми числами, называются
изотопами(например 35/17 Cl
и 37/17Cl) Атомы
имеющие одинаковые массовые числа,но
разное число протонов в ядре,называются
изобарами(например 40/19K
и 40/20Ca) Периодом
полураспада (Т ½)называется время,за
которое распадается половина исходного
количества радиоактивного изотопа.
§ 1 М.В. Ломоносов, как основоположник атомно-молекулярного учения
Начиная с XVII века, в науке существовало молекулярное учение, которое использовалось для объяснения физических явлений. Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из одних веществ в ходе химического процесса образуются новые.
Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из одних веществ в ходе химического процесса образуются новые.
Решение этого вопроса оказалось возможным на основе атомно-молекулярного учения. В 1741 г. в книге «Элементы математической химии» Михаил Васильевич Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский учёный-энциклопедист рассматривал строение вещества не как определенную комбинацию атомов, но как сочетание более крупных частиц — корпускул, которые, в свою очередь, состоят из более мелких частиц — элементов.
Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а на смену термину элемент пришёл термин атом. Однако суть высказанных им идей и определений блестяще выдержала испытание временем.
§ 2 История развития атомно-молекулярного учения
История развития и утверждения в науке атомно-молекулярного учения оказалась очень непростой. Работа с объектами микромира вызывала огромные трудности: атомы и молекулы было невозможно увидеть и, таким образом, убедиться в их существовании, а попытки измерения атомных масс нередко заканчивались получением ошибочных результатов. Через 67 лет после открытия Ломоносова, в 1808 году, известный английский учёный Джон Дальтон выдвинул атомную гипотезу. Согласно ей, атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов. Соединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон обеспечил прочный фундамент для дальнейших теоретических исследований в химии. К сожалению, Дальтон отрицал существование молекул у простых веществ. Он считал, что из молекул состоят только сложные вещества. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Работа с объектами микромира вызывала огромные трудности: атомы и молекулы было невозможно увидеть и, таким образом, убедиться в их существовании, а попытки измерения атомных масс нередко заканчивались получением ошибочных результатов. Через 67 лет после открытия Ломоносова, в 1808 году, известный английский учёный Джон Дальтон выдвинул атомную гипотезу. Согласно ей, атомы представляют собой мельчайшие частицы вещества, которые невозможно разделить на составные части или превратить друг в друга. По Дальтону, все атомы одного элемента имеют совершенно одинаковый вес и отличаются от атомов других элементов. Соединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон обеспечил прочный фундамент для дальнейших теоретических исследований в химии. К сожалению, Дальтон отрицал существование молекул у простых веществ. Он считал, что из молекул состоят только сложные вещества. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Условия для распространения идей атомно-молекулярного учения в естествознании сложились лишь во второй половине XIX века. В 1860 году на Международном съезде естествоиспытателей в немецком городе Карлсруэ были приняты научные определения атома и молекулы. Учения о строении веществ тогда ещё не было, поэтому было принято положение о том, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое сплошное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
§ 3 Основные положения атомно-молекулярного учения
1.Молекула — наименьшая часть вещества, сохраняющая его состав и важнейшие свойства.
2.Молекулы состоят из атомов. Атомы одного элемента сходны друг с другом, но отличаются от атомов других химических элементов.
Понятие о материи и движении
Современная химия является одной из естественных наук, предметом изучения которых является материя и представляет собой систему отдельных химических дисциплин – неорганической, аналитической, физической, органической, коллоидной и др.
Весь окружающий нас многообразный мир, вся совокупность предметов и явлений объединяются общим понятием – материя, для которой известны две формы существования – вещество и поле.
Вещество представляет собой материальное образование состоящее из частиц, имеющих собственную массу или массу покоя. Современной науке известны различные типы материальных систем и соответствующие им структурные уровни материи. К ним относятся как элементарные частицы (электроны, протоны, нейтроны и т.д.), так и макроскопические тела различных размеров (геологические системы, планеты, звезды, звездные скопления, Галактика, системы галактик и др.) современные познания структуры материи простираются от 10 -14 см до 10 28 см (примерно 13 млрд. световых лет).
В отличие от вещества — поле – материальная среда, в которой осуществляется взаимодействие частиц. Например, в электронном поле происходит взаимодействие между заряженными частицами, а в ядерном — между протонами и нейтронами.
Всеобщими формами бытия материи являются пространство и время, которые не существуют вне материи, как не может быть и материальных объектов, которые не обладали бы пространственно – временными свойствами.
Коренным и неотъемлемым свойством материи является движение — способ её существования. Формы движения материи очень разнообразны, они взаимно связаны и могут переходить из одной в другую. Например, механическая форма движения материи может переходить в электрическую форму, электрическая — в тепловую и т.д. Мерой движения материи, количественной его характеристикой является энергия.
Определение химии
Различные формы движения материи изучаются различными науками – физикой, химией, биологией и др. Химия изучает химическую форму движения материи, под которой понимается качественное изменение веществ, превращение одних веществ в другие. При этом разрываются, вновь возникают или перераспределяются химические связи между атомами, входящими в состав вещества. В результате химических процессов возникают новые вещества с новыми физико-химическими свойствами.
В результате химических процессов возникают новые вещества с новыми физико-химическими свойствами.
Таким образом, химия это наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава, структуры и свойств, а также взаимные переходы между этими процессами и другими формами движения материи.
Объектом изучения в химии являются химические элементы и их соединения. Изучая свойства веществ и их превращения химия раскрывает законы природы, познает материю и её движение. Изучение химии как одной из важнейших фундаментальных естественных наук необходимо для формирования научного мировоззрения.
Атомно-молекулярное учение
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М.В. Ломоносов. Основные положения его учения изложены в работе «Элементы математической химии». Сущность учения М.В. Ломоносова сводится к следующему.
1. Все вещества состоят из «корпускул» (так М.В. Ломоносов назвал молекулы). 2. Молекулы состоят из элементов (атомов). 3. Частицы — молекулы и атомы находятся в непрерывном движении. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
2. Молекулы состоят из элементов (атомов). 3. Частицы — молекулы и атомы находятся в непрерывном движении. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из различных атомов.
В дальнейшем это учение получило развитие в работах Д. Дальтона и Я. Берцелиуса. Окончательно атомно-молекулярное учение в химии утвердилось в середине ХIХ века. На Международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий химического элемента, атома и молекулы.
Атом — наименьшая частица химического элемента, обладающая его химическими свойствами и неделимая при химических реакциях.
Молекула — наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Все вещества делятся на простые и сложные.
Простое вещество – состоит из атомов одного и того же элемента.
Сложное вещество – состоит из атомов разных элементов. Так, например, оксид меди (II) образован атомами элементов меди и кислорода.
Всего 100 лет назад атом рассматривался как неделимый объект. Однако в соответствии с современными представлениями атом имеет сложную структуру и состоит из трех субатомных частиц: протонов, нейтронов и электронов. Протоны имеют положительный заряд; нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Заряды на протоне и электроне одинаковы по величине. Протоны и нейтроны занимают вместе очень небольшой объем атома, называемый ядром. Большую часть остального объема атома составляет пространство, в котором движутся электроны. Поскольку атомы не имеют результирующего электрического заряда, в каждом атоме содержится равное число электронов и протонов. Заряд ядра определяется числом протонов.
Химический элемент — вид атомов, характеризующихся одинаковым зарядом ядра и, соответственно, характеризующихся определенной совокупностью свойств. Атомы одного и того же элемента, отличающиеся числом нейтронов, и, следовательно, массой, называются изотопами. Символ 12 6 С или просто 12 С означает атом углерода с шестью протонами и шестью нейтронами. Число протонов в ядре атома называется атомным номером. Верхний индекс (12) называется массовым числом и указывает суммарное число протонов и нейтронов в ядре атома.
Число протонов в ядре атома называется атомным номером. Верхний индекс (12) называется массовым числом и указывает суммарное число протонов и нейтронов в ядре атома.
Понятие «химический элемент» нельзя отождествлять с понятием «простое вещество». Простое вещество характеризуется определенной плотностью, растворимостью, температурами плавления и кипения и др. Эти свойства относятся к совокупности атомов и для разных простых веществ они различны.
Химический элемент характеризуется определенным зарядом ядра, изотопным составом и др. Свойства элемента относятся к его отдельным атомам.
Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода.
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образовавшиеся вещества — аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации: кислород О 2 и озон О 3 ; элемент углерод — три: алмаз, графит и карбин.
Так, элемент кислород образует две аллотропные модификации: кислород О 2 и озон О 3 ; элемент углерод — три: алмаз, графит и карбин.
Химическая форма движения материи исследуется и познается измерением физических свойств и физических величин, присущих каждому веществу. Физической величиной является, например, масса вещества, его плотность, температура плавления. В химии широко используются понятия относительной атомной и молекулярной массы вещества.
Относительная атомная масса. Массы атомов чрезвычайно малы. Так, масса атома водорода составляет 1,674×10 -27 кг , кислорода — 2,667×10 -26 кг . В химии традиционно применяют не абсолютные значения масс, а относительные. За единицу относительных масс принята атомная единица массы (сокращенно а.е.м. ), представляющая собой 1/12 массы атома углерода — 12 , т.е. изотопа углерода 6 С — 1,66×10 -27 кг . Поскольку большинство элементов имеют атомы с различной массой, поэтому относительная атомная масса химического элемента есть безразмерная величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода.
Относительную атомную массу элемента обозначают А r . Например,
где 1,993·10 -26 кг – масса атома углерода.
Относительная молекулярная масса. Относительные молекулярные массы, так же как и атомные, выражаются в атомных единицах массы. Относительная молекулярная масса вещества есть безразмерная величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12 6 С .
Относительную молекулярную массу обозначают М r . Она численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества, и подсчитывается по формуле вещества. Например, M r (H 2 О) будет слагаться из 2 А r (Н)» 2 ; А r (O)= 1 × 16 = 16 ; M r (H 2 О) = 2 + 16 = 18 .
Моль. В международной системе единиц (СИ) за единицу количества вещества принят моль. Моль — это количество вещества, содержащее столько структурных или формульных (ФЕ) единиц (молекул, атомов, ионов, электронов или других), сколько содержится атомов в 0,012 кг изотопа углерода 12 6 C .
Зная массу одного атома углерода 12 C (1,993×10 -26 кг) , вычисляют число атомов N A в 0,012 кг углерода.
Число частиц в 1 моль любого вещества одно и то же. Оно равно 6,02×10 23 и называется постоянной Авогадро (обозначается N A , размерность 1/моль или моль -1 ). Очевидно, в 2 моль углерода будет содержаться 2 × 6,02×10 23 атомов, в 3 моль — 3 × 6,02×10 23 атомов.
Молярная масса. Обычно ее обозначают M . Молярная масса — величина, равная отношению массы вещества к количеству вещества. Она имеет размерность кг/моль или г/моль . Например, M = m /n или M = m /n , где m — масса в граммах; n (ню) или n — количество вещества в молях, M — молярная масса в г/моль — постоянная величина для каждого данного вещества. Так, если масса молекулы воды равна 2,99×10 -26 кг , то молярная масса M (H 2 O) = 2,99×10 -26 кг × 6,02×10 23 моль -1 = 0,018 кг/моль или 18 г/моль .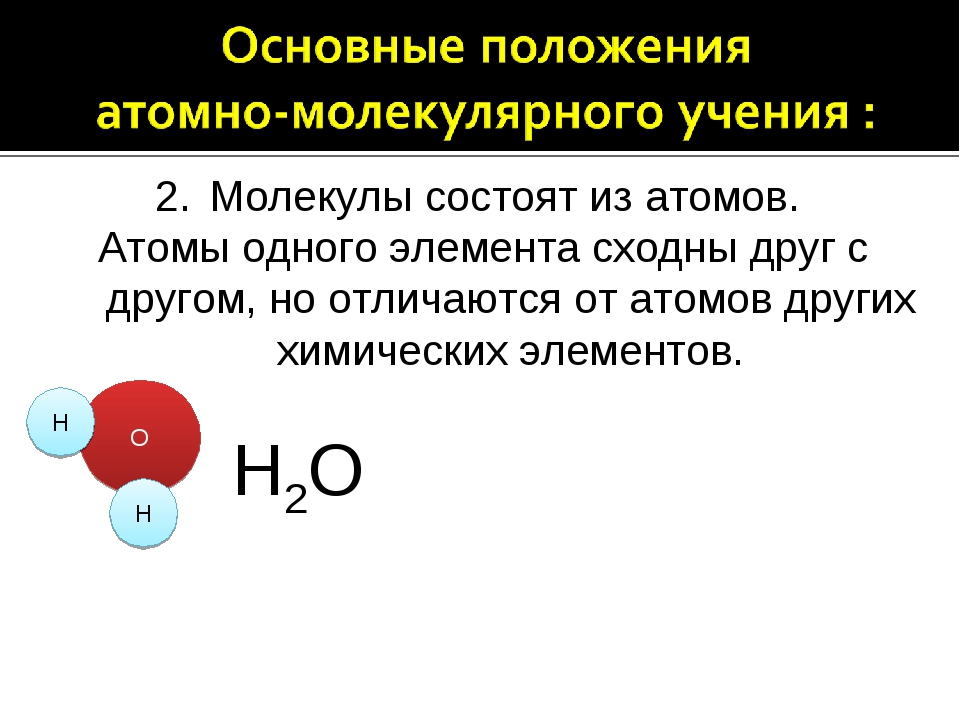 В общем случае молярная масса вещества, выраженная в г/моль , численно равна относительной атомной или относительной молекулярной массе этого вещества.
В общем случае молярная масса вещества, выраженная в г/моль , численно равна относительной атомной или относительной молекулярной массе этого вещества.
Например, относительные атомные и молекулярные массы C , O 2 , H 2 S соответственно равны 12, 32, 34, а их молярные массы составляют соответственно 12, 32, 34 г/моль.
Введение количественного метода исследования и установление закона сохранения массы имели огромное значение для дальнейшего развития химии. Но прочный научный фундамент химия получила лишь после утверждения в ней атомно-молекулярного учения.
Возникновение атомно-молекулярного ученияОсновы атомно-молекулярного учения впервые были изложены М. В. Ломоносовым в 1741 году в одной из его первых работ — «Элементы математической химии», в которой он сформулировал важнейшие положения корпускулярной теории строения .
Согласно представлениям Ломоносова, все состоят из мельчайших «нечувствительных» частичек, физически неделимых и обладающих способностью взаимного сцепления. Свойства веществ и прежде всего их агрегатное состояние обусловлены свойствами этих частичек; различие в свойствах веществ зависит только от различия самих частичек или способа их взаимной связи.
Свойства веществ и прежде всего их агрегатное состояние обусловлены свойствами этих частичек; различие в свойствах веществ зависит только от различия самих частичек или способа их взаимной связи.
Различал два вида таких частиц: более мелкие — «элементы», соответствующие атомам в современном понимании этого термина и более крупные «корпускулы», которые мы называем теперь молекулами. По его определению, «Элемент есть часть тела, не состоящая из каких-либо других меньших и отличающихся от него тел. Корпускула есть собрание элементов, образующее одну малую массу».
Каждая корпускула имеет тот же состав, что и все вещество. Химически различные вещества имеют и различные по составу корпускулы. «Корпускулы однородны, если состоят из одинакового числа одних и тех же элементов, соединенных одинаковым образом», и «корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе».
Из приведенных определений видно, что причиной различия веществ считал не только различие в составе корпускул, но и различное расположение элементов в корпускуле.
Излагая свои взгляды на из «нечувствительных» частиц, особенно подчеркивал, что каждая корпускула имеет некоторые конечные, хотя и очень малые размеры, вследствие чего ее нельзя видеть, и обладает определенной массой. Подобно всем физическим телам, корпускулы могут двигаться по законам механики; без движения корпускулы не могут сталкиваться друг с другом, отталкиваться или как-либо иначе действовать друг на друга и изменяться. Движением корпускул, в частности, объясняются такие явления, как нагревание и охлаждение тел.
Так как все изменения веществ обусловливаются движением корпускул, химические превращения должны изучаться не только методами химии, но и методами физики и математики.
Предположения Ломоносова в те времена не могли быть проверены опытным путем из-за отсутствия точных данных о количественном составе различных сложных веществ. Поэтому основные положения корпускулярной теории смогли найти подтверждение лишь после того, как химия прошла длительный путь развития, накопила большой опытный материал и овладела новыми методами исследования.
Иллюстрируя положения атомно-молекулярного учения. Химические реакции
§ 1 М.В. Ломоносов как основоположник атомно-молекулярного учения
С XVII века в науке существует молекулярная теория, которая используется для объяснения физических явлений. Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из некоторых веществ в ходе химического процесса образуются новые вещества.
Решение этого вопроса оказалось возможным на основе атомно-молекулярного учения. В 1741 году в книге «Начала математической химии» Михаил Васильевич Ломоносов фактически сформулировал основы атомно-молекулярного учения. Русский ученый-энциклопедист рассматривал строение материи не как конкретное сочетание атомов, а как сочетание более крупных частиц — корпускул, которые, в свою очередь, состоят из более мелких частиц — элементов.
Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а термин атом заменил термин элемент. Однако суть его идей и определений блестяще выдержала испытание временем.
Однако суть его идей и определений блестяще выдержала испытание временем.
§ 2 История развития атомно-молекулярного учения
История развития и утверждения атомно-молекулярного учения в науке оказалась очень непростой. Работа с объектами микромира вызывала огромные трудности: атомы и молекулы нельзя было увидеть и, следовательно, невозможно было убедиться в их существовании, а попытки измерения атомных масс часто заканчивались ошибочными результатами.Через 67 лет после открытия Ломоносова, в 1808 году, известный английский ученый Джон Дальтон выдвинул атомную гипотезу. По ее словам, атомы — это мельчайшие частицы материи, которые не могут быть разделены на составляющие или превращены друг в друга. Согласно Дальтону, все атомы одного элемента имеют одинаковый вес и отличаются от атомов других элементов. Объединив учение об атомах с учением о химических элементах, разработанным Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон заложил прочную основу для дальнейших теоретических исследований в области химии. К сожалению, Дальтон отрицал существование молекул в простых веществах. Он считал, что только сложные вещества состоят из молекул. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
К сожалению, Дальтон отрицал существование молекул в простых веществах. Он считал, что только сложные вещества состоят из молекул. Это не способствовало дальнейшему развитию и применению атомно-молекулярного учения.
Условия для распространения идей атомно-молекулярного учения в естествознании сложились только во второй половине XIX века. В 1860 г. на Международном конгрессе естествоиспытателей в немецком городе Карлсруэ были приняты научные определения атома и молекулы.В то время не существовало учения о строении веществ, поэтому было принято положение, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое непрерывное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
§ 3 Основные положения атомно-молекулярного учения
1. Молекула — мельчайшая часть вещества, сохраняющая его состав и важнейшие свойства.
2. Молекулы состоят из атомов. Атомы одного элемента похожи друг на друга, но отличаются от атомов других химических элементов.
Атомы одного элемента похожи друг на друга, но отличаются от атомов других химических элементов.
М.В. Большой вклад в развитие атомно-молекулярных исследований внесли Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Дж. Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Первым, кто определил химию как науку, был М. В. Ломоносов. Ломоносов создал учение о строении материи, заложил основы атомно-молекулярной теории.Он сводится к следующим положениям:
1. Каждое вещество состоит из мельчайших, тогда физически неделимых частиц (Ломоносов называл их корпускулами, позже их стали называть молекулами).
2. Молекулы находятся в постоянном самопроизвольном движении.
3. Молекулы состоят из атомов (Ломоносов называл их элементами).
4. Атомы характеризуются определенным размером и массой.
5. Молекулы могут состоять из одинаковых или разных атомов.
Молекула – мельчайшая частица вещества, сохраняющая свой состав и химические свойства. Молекула не может разрушаться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, которое у разных веществ различно. Молекулы в газах очень слабо притягиваются друг к другу, тогда как между молекулами жидкости и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении.Это явление объясняет, например, изменение объема веществ при нагревании.
Молекула не может разрушаться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, которое у разных веществ различно. Молекулы в газах очень слабо притягиваются друг к другу, тогда как между молекулами жидкости и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении.Это явление объясняет, например, изменение объема веществ при нагревании.
Атомы – это мельчайшие химически неделимые частицы, из которых состоят молекулы. Атом – это мельчайшая частица элемента, сохраняющая свои химические свойства. Атомы различаются зарядами ядер, массами и размерами. В ходе химических реакций атомы не появляются и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как разновидность атомов с одинаковым ядерным зарядом.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разнообразие атомов одного и того же элемента с разными массами называют изотопами. Следовательно, разновидностей атомов больше, чем химических элементов.
Следовательно, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия «химический элемент» и «простое вещество».
Вещество представляет собой определенный набор атомарных и молекулярных частиц в любом из трех агрегатных состояний.
Агрегатные состояния вещества — состояние вещества, характеризующееся определенными свойствами (способностью сохранять форму, объем).
Существует три основных агрегатных состояния: твердое, жидкое и газообразное. Иногда не совсем корректно классифицировать плазму как агрегатное состояние. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Химический элемент – это общее понятие атомов с одинаковым ядерным зарядом и химическими свойствами.
Физические свойства, характерные для простого вещества, не могут быть отнесены к химическому элементу.
Простые вещества – это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
Один и тот же элемент может образовывать несколько простых веществ.
1. Все вещества состоят из атомов.
2. Атомы каждого типа (элемента) одинаковы между собой, но отличаются от атомов любого другого типа (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. В физических явлениях молекулы сохраняются, в химических — разрушаются; в химических реакциях атомы, в отличие от молекул, сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же атомов, из которых состоят исходные вещества.
Атомно-молекулярное учение, колыбелью которого является Древняя Греция, имело исключительное значение для развития химии. Атомизм древнегреческих материалистов отделяет от нас 25-вековой период, однако логика греков настолько поразительна, что развиваемое ими философское учение о дискретном строении материи невольно сливается в сознании с нашим нынешним идеи. Как возникла атомистика? Основным научным методом древнегреческих философов была дискуссия, спор. Для поиска «первопричин» в спорах обсуждалось множество логических задач, одной из которых была проблема камня: что будет, если его начать дробить?
Как возникла атомистика? Основным научным методом древнегреческих философов была дискуссия, спор. Для поиска «первопричин» в спорах обсуждалось множество логических задач, одной из которых была проблема камня: что будет, если его начать дробить?
Большинство философов считали, что этот процесс можно продолжать бесконечно. И только Левкипе (500-440 гг. до н.э.) и его школа утверждали, что этот процесс не бесконечен: при дроблении, в конце концов, будет получена частица, дальнейшее деление которой будет просто невозможно.Основываясь на этой концепции, Левкипп утверждал: материальный мир дискретен, он состоит из мельчайших частиц и пустоты. Ученик Левкиппа Демокрит (460-370 гг. до н. э.) называл мельчайшие частицы «неделимыми», что в переводе с греческого означает «атом». Мы до сих пор используем это имя. Демокрит, разработавший новое учение — «атомистику», приписывал атомам такие «современные» свойства, как размер и форма, способность двигаться.
Последователь Демокрита Эпикур (342-270 гг. до н.э.) завершил древнегреческий атомизм, предполагая, что атомы имеют внутренний источник движения, а сами они способны взаимодействовать друг с другом.Все положения древнегреческой атомистики выглядят удивительно современно, и они, конечно, нам понятны. Ведь любой из нас, обращаясь к опыту науки, может описать множество интересных экспериментов, подтверждающих справедливость любой из выдвинутых концепций. Но они были совершенно непонятны 20-25 веков назад, так как древнегреческие атомщики не могли предоставить никаких экспериментальных данных, подтверждающих справедливость их представлений. Итак, хотя атомизм древних греков выглядит удивительно современно, ни одно из его положений в то время не было доказано.Поэтому «атомизм, развиваемый Левкиппом, Демокритом и Эпикуром, был и остается лишь догадкой, смелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума была постепенно предана забвению.
до н.э.) завершил древнегреческий атомизм, предполагая, что атомы имеют внутренний источник движения, а сами они способны взаимодействовать друг с другом.Все положения древнегреческой атомистики выглядят удивительно современно, и они, конечно, нам понятны. Ведь любой из нас, обращаясь к опыту науки, может описать множество интересных экспериментов, подтверждающих справедливость любой из выдвинутых концепций. Но они были совершенно непонятны 20-25 веков назад, так как древнегреческие атомщики не могли предоставить никаких экспериментальных данных, подтверждающих справедливость их представлений. Итак, хотя атомизм древних греков выглядит удивительно современно, ни одно из его положений в то время не было доказано.Поэтому «атомизм, развиваемый Левкиппом, Демокритом и Эпикуром, был и остается лишь догадкой, смелым предположением, философской концепцией, но подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума была постепенно предана забвению.
Были и другие причины, по которым учение атомистов было надолго забыто. К сожалению, атомисты не оставили после себя систематических работ, и отдельные записи споров и дискуссий, которые велись, лишь с трудом позволяли составить правильное представление об учении в целом.Главное, что многие концепции атомизма были еретическими и официальная церковь не могла их поддержать.
К сожалению, атомисты не оставили после себя систематических работ, и отдельные записи споров и дискуссий, которые велись, лишь с трудом позволяли составить правильное представление об учении в целом.Главное, что многие концепции атомизма были еретическими и официальная церковь не могла их поддержать.
Об учении атомистов не вспоминали почти 20 веков. И только в 17 в. Идеи древнегреческих атомистов были возрождены благодаря трудам французского философа Пьера Гассенди (1592-1655). Он провел почти 20 лет; восстановить и свести воедино забытые концепции древнегреческих философов, которые он подробно изложил в своих трудах «В) жизнь, нравы и учения Эпикура» и «Свод философии Эпикура».Эти две книги, в которых впервые были систематически изложены взгляды древнегреческих материалистов, стали «учебником» для европейских ученых и философов. До этого единственным источником, дававшим сведения о взглядах Демокрита — Эпикура, была поэма римского поэта Лукреция «О природе вещей». История науки знает много удивительных совпадений. Вот одно из них: возрождение древнегреческой атомистики совпадает по времени с установлением Р.Бойля (1627-1691) фундаментальной закономерности, описывающей изменение объема газа в зависимости от его давления. Качественное объяснение наблюдаемому Бойлем факту может дать только атомистика: если газ имеет дискретную структуру, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов как результате уменьшения свободного пространства между ними. Первая робкая попытка использовать атомистику для количественного объяснения наблюдаемых явлений природы приводит к двум очень важным выводам:
Вот одно из них: возрождение древнегреческой атомистики совпадает по времени с установлением Р.Бойля (1627-1691) фундаментальной закономерности, описывающей изменение объема газа в зависимости от его давления. Качественное объяснение наблюдаемому Бойлем факту может дать только атомистика: если газ имеет дискретную структуру, т. е. состоит из атомов и пустоты, то легкость его сжатия обусловлена сближением атомов как результате уменьшения свободного пространства между ними. Первая робкая попытка использовать атомистику для количественного объяснения наблюдаемых явлений природы приводит к двум очень важным выводам:
- 1.Превратившись из философской гипотезы в научную концепцию, атомистика может стать мощным инструментом, позволяющим давать единственно верное толкование самым разнообразным явлениям природы.
- 2. Для скорейшего превращения атомизма из философской гипотезы в научную концепцию доказательство существования атомов надо, прежде всего, искать в изучении газов, а не жидких и твердых веществ, которые раньше химики иметь дело с.
 Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся изучением газов.Затем последует каскад открытий простых веществ: водород, кислород, азот, хлор. А чуть позже газы помогут установить те законы, которые принято называть основными законами химии. Они позволят сформулировать основные положения атомно-молекулярного учения.
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся изучением газов.Затем последует каскад открытий простых веществ: водород, кислород, азот, хлор. А чуть позже газы помогут установить те законы, которые принято называть основными законами химии. Они позволят сформулировать основные положения атомно-молекулярного учения.
1. Различают вещества молекулярного и немолекулярного строения.
2. В веществах молекулярного строения молекулы располагаются в узлах кристаллических решеток в твердом состоянии.
3. В веществах немолекулярного строения узлы кристаллической решетки содержат ионы или атомы.
4. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и его температуры. Наибольшие расстояния существуют между молекулами газа, поэтому газы легко сжимаются. В твердых телах зазоры между частицами наименьшие, и, соответственно, эти вещества почти не подвержены сжатию.
5. Молекулы находятся в непрерывном движении. Скорость их движения зависит от температуры. С повышением температуры скорость движения увеличивается.
Скорость их движения зависит от температуры. С повышением температуры скорость движения увеличивается.
6. В физических явлениях молекулы сохраняются, в химических разрушаются.
7. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении. Одной из форм движения атомов является химическая реакция.
8. Атомы одного элемента отличаются от атомов другого элемента размерами, массой и свойствами.
9. Атомы сохраняются при химических реакциях.
10. Химическая реакция – образование новых веществ из тех же атомов, из которых состояли исходные вещества.
Мы уже знаем, что многие вещества состоят из молекул, а молекулы состоят из атомов. Информация об атомах и молекулах объединена в атомно-молекулярное учение. Вы знаете, что основные положения этого учения были развиты великим русским ученым М.В. Ломоносов. С тех пор прошло более двухсот лет, и теория атомов и молекул получила дальнейшее развитие.Например, теперь известно, что не все вещества состоят из молекул. Большинство твердых тел, которые мы встречаем в неорганической химии, являются немолекулярными.
Большинство твердых тел, которые мы встречаем в неорганической химии, являются немолекулярными.
Однако относительная молекулярная масса рассчитывается как для молекулярных, так и для немолекулярных веществ. Для последних условно используются понятия «молекула» и «относительная молекулярная масса».
Основные положения атомно-молекулярного учения можно сформулировать следующим образом:
1. Различают вещества с молекулярной и немолекулярной структурой.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния между молекулами газа. Это объясняет их легкую сжимаемость. Сложнее сжимать жидкости, где промежутки между молекулами намного меньше. В твердых телах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры.С повышением температуры скорость движения молекул увеличивается.
4. Между молекулами существуют силы взаимного притяжения и отталкивания. Эти силы в наибольшей степени выражены в твердых телах, в наименьшей — в газах.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. В физических явлениях молекулы сохраняются, в химических, как правило, разрушаются.
8. Для веществ с молекулярной структурой в твердом состоянии имеются молекулы в узлах кристаллических решеток. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые при нагревании, разрываются. Поэтому вещества с молекулярной структурой, как правило, имеют низкие температуры плавления.
9. В веществах с немолекулярным строением узлами кристаллической решетки являются атомы или другие частицы. Между этими частицами существуют прочные химические связи, для разрушения которых требуется много энергии.
Упражнение
1. Выберите слайд с одной из позиций Атомно-молекулярного учения. Найдите иллюстрации и примеры из жизни, подтверждающие это.
Выберите слайд с одной из позиций Атомно-молекулярного учения. Найдите иллюстрации и примеры из жизни, подтверждающие это.
2. Оцените следующий за вашим слайд по следующим критериям:
1. Наличие иллюстрации, соответствующей данному положению. 0-1б
2. Отдельные факты подтверждают это положение. 0-1б
3. Материал изложен доступным языком. 0-1б
4.Эстетичный дизайн (хорошее качество иллюстраций, читаемый текст). 0-1б
История геологии — Ломоносов
Основные работы
Его основная научная работа была связана с физической химией. Он поддерживал «атомно-молекулярную» теория вещества и «молекулярно-кинетическая» теория тепла. Последний был предшественником термодинамики, развившейся в следующем столетии. Ломоносов был лидером развитие количественной химии и физики. Он интересовался оптикой и астрономия.Во время прохождения Венеры по Солнцу 26 мая 1761 года он обнаружил, что Венера обладает атмосферой. Обе его самые важные геологические публикации были
написано на латыни.
Обе его самые важные геологические публикации были
написано на латыни.- Слово об образовании металлов от подземных толчков (1757).
- О слоях Земли (1763), приложение к трактату по металлургии.

Ломоносов проявлял особый интерес к минералогии еще со времен своего немецкого образования. Он заметил естественные группы или проявления некоторых рудных минералов и отметил, что определенные минералы обычно указывают на присутствие других минералов. Сейчас это явление называют парагенезис общий генезис родственных минералов. Его статья о 90 143 рассуждениях о твердость и текучесть тел описывает геометрические устройства для упаковки сферы (атомы) в кристаллической решетке.Он отметил постоянство межфазной границы кристалла. углы. Ломоносов также применил химический анализ для определения генезиса различных горных пород. и доказали органическое происхождение почвы, торфа, угля, нефти и янтаря.
Российское образование
Ломоносов стремился обновить качество российской науки и образования. Он пытался, но безуспешно, основать университет. В Санкт-Петербурге. В конце концов ему удалось основать то, что сейчас называется Московским государственным университетом. 1755 г. Этот университет, официально названный именем Ломоносова, находится на вершине российской
система высшего образования.В 1765 году Ломоносов простудился и умер в возрасте 54 лет. Похоронен на кладбище с.
Александро-Невский монастырь в Санкт-Петербурге, Россия.
1755 г. Этот университет, официально названный именем Ломоносова, находится на вершине российской
система высшего образования.В 1765 году Ломоносов простудился и умер в возрасте 54 лет. Похоронен на кладбище с.
Александро-Невский монастырь в Санкт-Петербурге, Россия.| Слева: парадный вход в главный корпус Московского государственного университета, Россия. Массивное сооружение было возведено в сталинские годы как памятник советской достижение. Справа: задняя сторона главного корпуса Московского государственного университета, Россия. Фотографии © Дж.С. Абер. |
Историческая оценка
Ломоносов был хорошо оценен современными ему европейскими учеными.Его сделали почетным член Шведской академии наук в 1760 году и стал почетным членом Болонской академии наук в 1764 году. Он занимает центральное место в истории русской наука. Ломоносов увековечен во многих топонимахАрктический подводный хребет, Атлантический тока и др. Российская академия наук награждает Ломоносова почетными медалями в области научных достижение одного российского и одного иностранного ученого. При этом он даже не упоминается
в нашем учебнике (Faul and Faul 1983) оплошность.
При этом он даже не упоминается
в нашем учебнике (Faul and Faul 1983) оплошность. Вернуться к программе или расписанию по истории геологии.
© Дж.С. Абер (2017).
Атомно-молекулярная теория. Атомно-молекулярная наука
Атомно-молекулярное учение — совокупность положений, аксиом и законов, описывающих все вещества как совокупность молекул, состоящих из атомов.
Древнегреческие философы задолго до начала нашей эры в своих трудах уже выдвинули теорию существования атомов.Отвергая существование богов и потусторонних сил, они пытались объяснить все непостижимые и загадочные явления природы естественными причинами — соединением и разделением, взаимодействием и смешением невидимых человеческому глазу частиц — атомов. Но служители церкви на протяжении многих веков преследовали приверженцев и последователей учения об атомах, подвергали их гонениям. Но из-за отсутствия необходимых технических приспособлений философы древности не могли скрупулезно изучать явления природы, и под понятием «атом» они скрывали современное понятие «молекула».
Только в середине восемнадцатого века великий русский ученый М.В. Ломоносов обосновал атомные и молекулярные понятия в химии. Основные положения его учения изложены в труде «Начала математической химии» (1741) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
М.В. Ломоносов четко различал две стадии в строении материи: элементы (в современном понимании — атомы) и корпускулы (молекулы).В основе его корпускулярно-кинетической теории (современной атомно-молекулярной теории) лежит принцип прерывности строения (дискретности) вещества: всякое вещество состоит из отдельных частиц.
В 1745 году М.В. Ломоносов писал: «Элемент — это часть тела, не состоящая из каких-либо меньших и различных тел… Корпускулы — это совокупность элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одинаковых элементов, соединенных одинаковым образом.Корпускулы неоднородны, когда их элементы различны и связаны по-разному или в разном количестве; от этого зависит бесконечное разнообразие тел.
Молекула — мельчайшая частица вещества, обладающая всеми его химическими свойствами. Вещества, имеющие молекулярное строение, состоящие из молекул (большинство неметаллов, органические вещества). Значительная часть неорганических веществ состоит из атомов (атомная решетка кристалла) или ионов (ионная структура).К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является совокупность элементарных частиц (ионов или атомов), т. е. кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом — мельчайший, далее химически неделимый компонент молекулы.
Оказывается, молекулярная теория объясняет физические явления, происходящие с веществами. Учение об атомах приходит на помощь молекулярной теории в объяснении химических явлений.Обе эти теории — молекулярная и атомарная — объединяются в атомно-молекулярное учение. Суть этой доктрины можно сформулировать в виде нескольких законов и постановлений:
- вещества состоят из атомов;
- при взаимодействии атомов образуются простые и сложные молекулы;
- при физических явлениях молекулы сохраняются, их состав не изменяется; при химических разрушаются, изменяется их состав;
- молекулы веществ состоят из атомов; в химических реакциях атомы, в отличие от молекул, сохраняются;
- атомы одного элемента подобны друг другу, но отличаются от атомов любого другого элемента;
- химических реакции состоят в образовании новых веществ из тех же атомов, из которых состояли исходные вещества.

Через свою атомно-молекулярную теорию М.В. Ломоносова по праву считают основоположником научной химии.
сайта, при полном или частичном копировании материала ссылка на первоисточник обязательна.
1.Химия как предмет естествознания Химия изучает ту форму движения материи, при которой происходит взаимодействие атомов с образованием новых определенных веществ. Химия — наука об остатках, строении и свойствах веществ, их превращениях или явлениях, сопровождающих эти превращения. Современная химия включает Ключевые слова: общая, органическая, коллоидная, аналитическая, физическая, геологическая, биохимия, химия строительных материалов. предмет химии — химические элементы и их соединения, а также законы, управляющие различными химическими реакциями. сочетает в себе физико-математические и биологические и социальные науки.
2. Класс неорганических соединений. Основные химические свойства кислот, оснований, солей. По свойствам неорганические соединения делятся на следующие.Классы : оксиды, основания, кислоты, соли. оксиды — соединение элементов с кислородом, при котором последний является более электроотрицательным элементом, а именно проявляет степень окисления -2. и только элемент O2 связан. Общая формула СхОу. Есть : кислые е-способные образовывать соли с основными оксидами и основаниями (SO3+Na2O=Na2SO4; So3+2NaOH=Na2SO4=h3O), основные- способные к солеобразованию с кислыми оксидами и кислотами (CaO + CO2 = CaCO3; CaO + 2HCl = CaCl2 + h3O ), амфотерный (к-ты и осн.) И с тем и с тем (ZnO, BeO, Cr2O3, SnO, PbO, MnO2). и несолеобразующие (CO,NO,N2O) Основания — вещества, при электролитической диссоциации которых анионом может быть только гидроксильная группа ОН. Кислотность основания – это количество ионов ОН, образующихся при диссоциации гидроксида. Гидроксиды-вещества, содержащие группу ОН, получают соединением оксидов с водой.
По свойствам неорганические соединения делятся на следующие.Классы : оксиды, основания, кислоты, соли. оксиды — соединение элементов с кислородом, при котором последний является более электроотрицательным элементом, а именно проявляет степень окисления -2. и только элемент O2 связан. Общая формула СхОу. Есть : кислые е-способные образовывать соли с основными оксидами и основаниями (SO3+Na2O=Na2SO4; So3+2NaOH=Na2SO4=h3O), основные- способные к солеобразованию с кислыми оксидами и кислотами (CaO + CO2 = CaCO3; CaO + 2HCl = CaCl2 + h3O ), амфотерный (к-ты и осн.) И с тем и с тем (ZnO, BeO, Cr2O3, SnO, PbO, MnO2). и несолеобразующие (CO,NO,N2O) Основания — вещества, при электролитической диссоциации которых анионом может быть только гидроксильная группа ОН. Кислотность основания – это количество ионов ОН, образующихся при диссоциации гидроксида. Гидроксиды-вещества, содержащие группу ОН, получают соединением оксидов с водой. Есть 3 вида : основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты-проявляют основные и кислотные свойства Cr(OH)3,Zn(OH)2,Be(OH) 2,Al(OH)3) кислоты -вещества с электролитической диссоциацией кат.Катион может быть. только + заряженный ион Н. Бывают: бескислородные, кислородсодержащие .Ч число основность кислоты. мета- и орто-формы молекул воды. соль — вещества, при электролитической диссоциации которых катионом может быть ион аммония (Nh5) или ион металла, а анионом может быть любой кислотный остаток Различают: средние (полное замещение. состоят из кислотного остатка и ион металла), кислый д (неполное замещение. наличие незамещенного Н в составе), основной (неполное замещение.наличие незамещенных ОН) По составу неорганические вещества делятся на бинарные — состоящие только из двух элементов, и многоэлементные — состоящие из нескольких элементов.
Есть 3 вида : основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты-проявляют основные и кислотные свойства Cr(OH)3,Zn(OH)2,Be(OH) 2,Al(OH)3) кислоты -вещества с электролитической диссоциацией кат.Катион может быть. только + заряженный ион Н. Бывают: бескислородные, кислородсодержащие .Ч число основность кислоты. мета- и орто-формы молекул воды. соль — вещества, при электролитической диссоциации которых катионом может быть ион аммония (Nh5) или ион металла, а анионом может быть любой кислотный остаток Различают: средние (полное замещение. состоят из кислотного остатка и ион металла), кислый д (неполное замещение. наличие незамещенного Н в составе), основной (неполное замещение.наличие незамещенных ОН) По составу неорганические вещества делятся на бинарные — состоящие только из двух элементов, и многоэлементные — состоящие из нескольких элементов.
1. Все вещества состоят из молекул (корпускул), при физических явлениях молекулы сохраняются, при химических явлениях разрушаются.
2. Молекулы состоят из атомов (элементов), атомы сохраняются при химических реакциях.
3. Атомы каждого типа (элемента) одинаковы между собой, но отличаются от атомов любого другого типа.
4. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
5. Химические реакции заключаются в образовании новых веществ из тех же атомов, из которых состоят исходные вещества. + 6. молекулы. и атомы находятся в непрерывном движении, и теплота состоит во внутреннем движении этих частиц
. Атом — мельчайшая частица элемента, сохраняющая свои химические свойства. Атомы различаются зарядами ядер, массой и размером
Химический элемент — тип атомов с одинаковым положением. Заряд ядра. Физические свойства, свойственные простому веществу, нельзя отнести к химическому элементу. Простые вещества — Это вещества, состоящие из атомов одного и того же химического элемента. 4.Основные законы химии (закон сохранения, постоянство состава, кратные отношения, закон Авагадро) Закон сохранения: Масса веществ, вступающих в реакцию, равна массе веществ, образовавшихся в результате реакции. Закон постоянства состава : (любое химическое соединение имеет одинаковый количественный состав независимо от способа его получения) Соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения.
Физические свойства, свойственные простому веществу, нельзя отнести к химическому элементу. Простые вещества — Это вещества, состоящие из атомов одного и того же химического элемента. 4.Основные законы химии (закон сохранения, постоянство состава, кратные отношения, закон Авагадро) Закон сохранения: Масса веществ, вступающих в реакцию, равна массе веществ, образовавшихся в результате реакции. Закон постоянства состава : (любое химическое соединение имеет одинаковый количественный состав независимо от способа его получения) Соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения.
Закон кратных отношений : Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого в этих соединениях, относятся друг к другу как малые целые числа.
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одинаковое число молекул.
5. Закон эквивалентов . Эквивалент вещества — это количество вещества, которое взаимодействует с 1 молем атома водорода или замещает такое же количество атомов Н в химическом веществе. реакции. Ve (L/Mole) — эквивалентный объем вещества, то есть объем одного эквивалента вещества в газообразном состоянии.ЗАКОН. Все вещества вступают в химические реакции и образуются в эквивалентных количествах. Отношение эквивалентных масс, объемов, реагирующих или образующихся веществ прямо пропорционально отношению их масс (объемов) или или Е (простая) = А (атомная масса) / В (валентность элемента) Е (кислоты) = M (молярная масса) / основание (кислотное основание) Е (Гидроксид) = М/Кислота) Кислотность Гидроксида) Е (оксиды солей) = М/а (число атомов элемента изображения. Оксид (соли) * в (валентность этого элемента или металла)
Оксид (соли) * в (валентность этого элемента или металла)
6. Строение атомов. Основной. Ядерные реакции. Виды излучения. Модель Резерфорда: 1.практически вся масса сосредоточена в ядре 2.+компенсированы — 3.заряд равен номеру группы. Простейший -H водород Современная концепция хим. Элемент — это вид атомов с одинаковым положением. Ядерный заряд атома состоит из положительно заряженного ядра и электронной оболочки.Электронная оболочка состоит из электронов. Количество электронов равно количеству протонов, поэтому заряд атома в целом равен 0. Количество протонов, заряд ядра и количество электронов численно равны порядковому номеру химического элемента. Почти вся масса атома сосредоточена в ядре. Электроны движутся вокруг ядра атома не хаотично, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.На каждом электронном слое может располагаться определенное количество электронов: на первом — не более 2, на втором — не более 8, на третьем — не более 18. Количество электронных слоев определяется периодом число Количество электронов на последнем (внешнем) слое определяется номером группы, в период происходит постепенное ослабление металлических свойств и повышение свойств неметаллов Ядерная реакция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Радиоактивностью называется самопроизвольное превращение нестабильного изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер. Виды излучения: альфа, бета (отрицательное и положительное) и гамма. Альфа-частица представляет собой ядро атома гелия 4/2He. При испускании альфа-частиц ядро теряет два протона и два нейтрона, поэтому заряд уменьшается на 2, а массовое число на 4. Отрицательная бета-частица – это электрон.при испускании электрона заряд ядра увеличивается на единицу, но массовое число не меняется. нестабильный изотоп возбуждается настолько, что испускание частицы не приводит к полному снятию возбуждения, тогда он выбрасывает часть чистой энергии, называемой гамма-излучением.
Количество электронных слоев определяется периодом число Количество электронов на последнем (внешнем) слое определяется номером группы, в период происходит постепенное ослабление металлических свойств и повышение свойств неметаллов Ядерная реакция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Радиоактивностью называется самопроизвольное превращение нестабильного изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер. Виды излучения: альфа, бета (отрицательное и положительное) и гамма. Альфа-частица представляет собой ядро атома гелия 4/2He. При испускании альфа-частиц ядро теряет два протона и два нейтрона, поэтому заряд уменьшается на 2, а массовое число на 4. Отрицательная бета-частица – это электрон.при испускании электрона заряд ядра увеличивается на единицу, но массовое число не меняется. нестабильный изотоп возбуждается настолько, что испускание частицы не приводит к полному снятию возбуждения, тогда он выбрасывает часть чистой энергии, называемой гамма-излучением. Атомы, имеющие одинаковый ядерный заряд, но разные массовые числа, называются изотопами (например, 35/17 Cl и 37/17 Cl) Атомы, имеющие одинаковые массовые числа, но разное число протонов в ядре, называются изобарами (например, 40/19К и 40/20Са) Период полураспада (T ½) – это время, за которое распадается половина первоначального количества радиоактивного изотопа.
Атомы, имеющие одинаковый ядерный заряд, но разные массовые числа, называются изотопами (например, 35/17 Cl и 37/17 Cl) Атомы, имеющие одинаковые массовые числа, но разное число протонов в ядре, называются изобарами (например, 40/19К и 40/20Са) Период полураспада (T ½) – это время, за которое распадается половина первоначального количества радиоактивного изотопа.
§ 1 М.В. Ломоносов как основоположник атомно-молекулярной теории
С XVII века в науке существует молекулярная теория, которая используется для объяснения физических явлений. Практическое применение молекулярной теории в химии было ограничено тем, что ее положения не могли объяснить сущность протекания химических реакций, ответить на вопрос, как из некоторых веществ в ходе химического процесса образуются новые вещества.
Решение этой проблемы оказалось возможным на основе атомно-молекулярной теории.В 1741 году в книге «Начала математической химии» Михаил Васильевич Ломоносов фактически сформулировал основы атомной и молекулярной теории. Русский ученый-энциклопедист рассматривал строение материи не как определенное сочетание атомов, а как сочетание более крупных частиц — корпускул, которые, в свою очередь, состоят из более мелких частиц — элементов.
Русский ученый-энциклопедист рассматривал строение материи не как определенное сочетание атомов, а как сочетание более крупных частиц — корпускул, которые, в свою очередь, состоят из более мелких частиц — элементов.
Терминология Ломоносова со временем претерпела изменения: то, что он называл корпускулами, стали называть молекулами, а термин элемент заменился термином атом.Однако суть высказанных им идей и определений блестяще выдержала испытание временем.
§ 2 История развития атомной и молекулярной науки
История развития и становления атомной и молекулярной теории в науке оказалась очень непростой. Работа с объектами микромира вызывала большие трудности: нельзя было увидеть атомы и молекулы и, таким образом, убедиться в их существовании, а попытки измерить атомные массы часто заканчивались ошибочными результатами.Через 67 лет после открытия Ломоносова, в 1808 году, известный английский ученый Джон Дальтон выдвинул атомную гипотезу. Согласно ему, атомы — это мельчайшие частицы материи, которые не могут быть разделены на составные части или превращены друг в друга. Согласно Дальтону, все атомы одного элемента имеют одинаковый вес и отличаются от атомов других элементов. Объединив теорию атомов с теорией химических элементов, разработанной Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон заложил прочную основу для дальнейших теоретических исследований в области химии.К сожалению, Дальтон отрицал существование молекул в простых веществах. Он считал, что только сложные вещества состоят из молекул. Это не способствовало дальнейшему развитию и применению атомно-молекулярной теории.
Согласно Дальтону, все атомы одного элемента имеют одинаковый вес и отличаются от атомов других элементов. Объединив теорию атомов с теорией химических элементов, разработанной Робертом Бойлем и Михаилом Васильевичем Ломоносовым, Дальтон заложил прочную основу для дальнейших теоретических исследований в области химии.К сожалению, Дальтон отрицал существование молекул в простых веществах. Он считал, что только сложные вещества состоят из молекул. Это не способствовало дальнейшему развитию и применению атомно-молекулярной теории.
Условия для распространения идей атомной и молекулярной теории в естествознании сложились только во второй половине XIX века. В 1860 году на Международном конгрессе естествоиспытателей в немецком городе Карлсруэ были приняты научные определения атома и молекулы.Учения о строении веществ в то время не существовало, поэтому было принято положение, что все вещества состоят из молекул. Считалось, что простые вещества, например металлы, состоят из одноатомных молекул. Впоследствии такое непрерывное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
Впоследствии такое непрерывное распространение принципа молекулярного строения на все вещества оказалось ошибочным.
§ 3 Основные положения атомно-молекулярной теории
1. Молекула — мельчайшая часть вещества, сохраняющая его состав и существенные свойства.
2. Молекулы состоят из атомов. Атомы одного элемента похожи друг на друга, но отличаются от атомов других химических элементов.
Понятие материи и движения
Современная химия — одна из естественных наук, предметом которой является вещество и представляет собой систему отдельных химических дисциплин — неорганической, аналитической, физической, органической, коллоидной и др.
Весь многообразный окружающий нас мир, вся совокупность предметов и явлений объединены общим понятием — материя, для которой известны две формы существования — материя и поле.
Вещество – материальное образование, состоящее из частиц, имеющих собственную массу или массу покоя. Современной науке известны различные типы материальных систем и соответствующие им структурные уровни материи. К ним относятся как элементарные частицы (электроны, протоны, нейтроны и т. д.), так и макроскопические тела различных размеров (геологические системы, планеты, звезды, звездные скопления, Галактики, системы галактик и т. д.). Современные знания о строении материи простираются от 90 143 10 -14 см 90 144 до 90 143 10 28 см 90 144 (около 90 143 13 миллиардов 90 144 световых лет).
К ним относятся как элементарные частицы (электроны, протоны, нейтроны и т. д.), так и макроскопические тела различных размеров (геологические системы, планеты, звезды, звездные скопления, Галактики, системы галактик и т. д.). Современные знания о строении материи простираются от 90 143 10 -14 см 90 144 до 90 143 10 28 см 90 144 (около 90 143 13 миллиардов 90 144 световых лет).
В отличие от материи поле является материальной средой, в которой взаимодействуют частицы. Например, в электронном поле происходит взаимодействие между заряженными частицами, а в ядерном поле — между протонами и нейтронами.
Всеобщими формами существования материи являются пространство и время, которые не существуют вне материи, как не может быть и материальных объектов, которые не обладали бы пространственно-временными свойствами.
Основным и неотъемлемым свойством материи является движение — способ ее существования.Формы движения материи очень разнообразны, они взаимно связаны и могут переходить из одной в другую. Например, механическая форма движения материи может переходить в электрическую, электрическая — в тепловую и т. д. Мерой движения материи, ее количественной характеристикой является энергия.
Например, механическая форма движения материи может переходить в электрическую, электрическая — в тепловую и т. д. Мерой движения материи, ее количественной характеристикой является энергия.
Определение химии
Различные формы движения материи изучаются различными науками — физикой, химией, биологией и др.Химия изучает химическую форму движения материи, под которой понимается качественное изменение веществ, превращение одного вещества в другое. При этом химические связи между атомами, входящими в состав вещества, рвутся, вновь возникают или перераспределяются. В результате химических процессов возникают новые вещества с новыми физическими и химическими свойствами.
Таким образом, химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением состава, строения и свойств, а также взаимные переходы между этими процессами и другими формами движения материи.
Объектом изучения в химии являются химические элементы и их соединения. Изучая свойства веществ и их превращения, химия раскрывает законы природы, познает материю и ее движение. Изучение химии как одной из важнейших фундаментальных естественных наук необходимо для формирования научного мировоззрения.
Изучая свойства веществ и их превращения, химия раскрывает законы природы, познает материю и ее движение. Изучение химии как одной из важнейших фундаментальных естественных наук необходимо для формирования научного мировоззрения.
Атомно-молекулярная доктрина
Атомно-молекулярное учение было разработано и впервые применено в химии великим русским ученым М.В. Ломоносов. Основные положения его учения изложены в работе «Элементы математической химии». Суть учения М.В. Ломоносова сводится к следующему.
1. Все вещества состоят из «корпускул» (как называл молекулы М. В. Ломоносов). 2. Молекулы состоят из элементов (атомов). 3. Частицы – молекулы и атомы находятся в непрерывном движении. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ — из разных атомов.
Позднее это учение получило развитие в работах Д. Дальтона и Дж. Берцелиуса. Атомно-молекулярное учение в химии окончательно утвердилось в середине 19 в. На Международном конгрессе химиков в Карлсруэ в 1860 г. были приняты определения понятий химического элемента, атома и молекулы.
были приняты определения понятий химического элемента, атома и молекулы.
Атом – мельчайшая частица химического элемента, обладающая его химическими свойствами и неделимая в химических реакциях.
Молекула – это мельчайшая частица вещества, обладающая его химическими свойствами.Химические свойства молекулы определяются ее составом и химической структурой.
Все вещества делятся на простые и сложные.
Простое вещество состоит из атомов одного и того же элемента.
Соединение состоит из атомов различных элементов. Например, оксид меди (II) образован атомами элементов меди и кислорода.
Всего 100 лет назад атом считался неделимым объектом. Однако в соответствии с современными представлениями атом имеет сложное строение и состоит из трех субатомных частиц: протонов, нейтронов и электронов.Протоны имеют положительный заряд; Нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Заряды протона и электрона одинаковы по величине. Протоны и нейтроны вместе занимают очень небольшой объем атома, называемого ядром. Большую часть остального объема атома занимает пространство, в котором движутся электроны. Поскольку атомы не имеют суммарного электрического заряда, каждый атом содержит равное количество электронов и протонов. Заряд ядра определяется количеством протонов.
Протоны и нейтроны вместе занимают очень небольшой объем атома, называемого ядром. Большую часть остального объема атома занимает пространство, в котором движутся электроны. Поскольку атомы не имеют суммарного электрического заряда, каждый атом содержит равное количество электронов и протонов. Заряд ядра определяется количеством протонов.
Химический элемент – это разновидность атомов, характеризующаяся одинаковым зарядом ядра и, соответственно, характеризующаяся определенным набором свойств. Атомы одного и того же элемента, различающиеся числом нейтронов, а значит, и массой, называются изотопами. Символ 12 6 C или просто 12 C означает атом углерода с шестью протонами и шестью нейтронами. Число протонов в ядре атома называется атомным номером. Верхний индекс (12) называется массовым числом и указывает на общее количество протонов и нейтронов в ядре атома.
Понятие «химический элемент» нельзя отождествлять с понятием «простое вещество». Простое вещество характеризуется определенной плотностью, растворимостью, температурами плавления и кипения и т. д. Эти свойства относятся к совокупности атомов и различны для разных простых веществ.
д. Эти свойства относятся к совокупности атомов и различны для разных простых веществ.
Химический элемент характеризуется определенным зарядом ядра, изотопным составом и т. д. Свойства элемента относятся к его отдельным атомам.
Сложные вещества состоят не из простых веществ, а из элементов.Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода.
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества называются аллотропными модификациями или модификациями. Так, элемент кислород образует две аллотропные модификации: кислород О 2 и озон О 3 ; элемент углерода — три: алмаз, графит и карбин.
Химическая форма движения материи исследуется и познается путем измерения физических свойств и физических величин, присущих каждому веществу. Физической величиной является, например, масса вещества, его плотность, температура плавления. В химии широко используются понятия относительной атомной и молекулярной массы вещества.
В химии широко используются понятия относительной атомной и молекулярной массы вещества.
Относительная атомная масса. Массы атомов чрезвычайно малы. Таким образом, масса атома водорода равна 1.674×10-27 кг , кислород- 2,667×10-26 кг . В химии традиционно используются не абсолютные значения масс, а относительные. Единицей относительных масс является атомная единица массы (сокращенно а.е.м. ), которая равна 1/12. массы атома углерода — 12 , то есть изотоп углерода 6 C — 1,66×10 -27 кг . Поскольку большинство элементов имеют атомы с различной массой, следовательно, относительная атомная масса химического элемента является безразмерной величиной, равной отношению средней массы атома природного изотопного состава элемента к 1/12 масса атома углерода.
Относительная атомная масса элемента обозначается A r . Например,
, где 1,993 10 -26 кг — это масса атома углерода.
Относительная молекулярная масса. Относительные молекулярные массы, как и атомные массы, выражаются в атомных единицах массы. Относительная молекулярная масса вещества – безразмерная величина, равная отношению средней массы молекулы природного изотопного состава вещества к 1/12 массы атома углерода 12 6 C .
Относительные молекулярные массы, как и атомные массы, выражаются в атомных единицах массы. Относительная молекулярная масса вещества – безразмерная величина, равная отношению средней массы молекулы природного изотопного состава вещества к 1/12 массы атома углерода 12 6 C .
Относительная молекулярная масса обозначается M r . Он численно равен сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества, и рассчитывается по формуле вещества. Например, M r (H 2 O) будет составлено из 2 A r (H)»2 ; A r (O) = 1 × 16 = 16 ; M r (H 2 О) = 2 + 16 = 18 .
Мотылек. В международной системе единиц (СИ) За единицу количества вещества принят моль.Моль – это количество вещества, которое содержит столько же структурных или формульных (ФЭ) единиц (молекул, атомов, ионов, электронов или др.), сколько атомов содержится в 0,012 кг изотопа углерода 126С .
Зная массу одного атома углерода 12 C (1,993×10 -26 кг) , вычислить количество атомов N A v 0,012 кг углерода.
Количество частиц в 1 моль любого вещества одинаково. Она равна 6,02×10 23 и называется постоянной Авогадро (обозначается N A , размерность 1/моль или моль -1 ). Очевидно, что в 2 моль углерода будет содержаться 2 × 6,02 × 10 23 атомов, в 3 моль — 3 × 6,02 × 10 23 атомов.
Молярная масса. Обычно обозначается M . Молярная масса – это величина, равная отношению массы вещества к количеству вещества.Он имеет размерность кг/моль или г/моль . Например, M = m/n или M = m/n , где m — масса в граммах; n (nu) или n — количество вещества в молях, M — молярная масса в г/моль — постоянная величина для каждого данного вещества. Так, если масса молекулы воды 2,99×10 -26 кг , то молярная масса М(h3O) = 2,99×10 -26 кг×6,02×10 23 моль -1 = 0.018 кг/моль или 18 г/моль . В общем случае молярная масса вещества, выраженная в г/моль , численно равна относительной атомной или относительной молекулярной массе этого вещества.
Так, если масса молекулы воды 2,99×10 -26 кг , то молярная масса М(h3O) = 2,99×10 -26 кг×6,02×10 23 моль -1 = 0.018 кг/моль или 18 г/моль . В общем случае молярная масса вещества, выраженная в г/моль , численно равна относительной атомной или относительной молекулярной массе этого вещества.
Например, относительные атомные и молекулярные массы C , O2 , H 2 S соответственно равны 12, 32, 34, и их молярные массы соответственно 12, 32, 34 г/моль.
Внедрение количественного метода исследования и установление закона сохранения массы имели большое значение для дальнейшего развития химии.Но прочную научную основу химия получила только после того, как в ней утвердилась атомно-молекулярная теория.
Возникновение атомной и молекулярной науки Основы атомной и молекулярной науки были впервые изложены М. В. Ломоносовым в 1741 году в одном из первых его трудов — «Началах математической химии», в котором он сформулировал важнейшие положения корпускулярной теории строения.
По представлениям Ломоносова, все состоит из мельчайших «нечувствительных» частиц, физически неделимых и обладающих способностью взаимного сцепления.Свойства веществ и прежде всего их агрегатное состояние определяются свойствами этих частиц; различие свойств веществ зависит только от различия самих частиц или способа их соединения между собой.
Он различал два типа таких частиц: более мелкие — «элементы», соответствующие атомам в современном понимании этого термина, и более крупные. «корпускул», которые мы сейчас называем молекулами. По его словам, «Элемент — это часть тела, не состоящая из каких-либо других меньших и отличных тел.Корпускула – это совокупность элементов, образующих одну маленькую массу.
Каждая корпускула имеет тот же состав, что и вся материя. Химически разные вещества также имеют корпускулы разного состава. «Корпускулы однородны, если они состоят из одинакового числа одних и тех же элементов, соединенных одинаковым образом», и «корпускулы неоднородны, когда их элементы различны и связаны по-разному или в разном количестве».
Из приведенных определений видно, что причиной различия веществ считали не только различие в составе корпускул, но и различное расположение элементов в корпускуле.
Излагая свои взгляды на «нечувствительные» частицы, он особо подчеркивал, что каждая корпускула имеет некоторые конечные, хотя и очень малые размеры, вследствие чего ее нельзя увидеть, и имеет определенную массу. Как и все физические тела, корпускулы могут двигаться по законам механики; без движения корпускулы не могут сталкиваться друг с другом, отталкиваться друг от друга или каким-либо иным образом воздействовать друг на друга и изменяться. Движением корпускул, в частности, объясняются такие явления, как нагрев и охлаждение тел.
Так как все изменения в веществах происходят благодаря движению корпускул, химические превращения необходимо изучать не только методами химии, но и методами физики и математики.
Предположения Ломоносова в то время не могли быть проверены эмпирически из-за отсутствия точных данных о количественном составе различных сложных веществ. Поэтому основные положения корпускулярной теории могли быть подтверждены только после того, как химия прошла долгий путь развития, накопила большой экспериментальный материал и освоила новые методы исследования.
Поэтому основные положения корпускулярной теории могли быть подтверждены только после того, как химия прошла долгий путь развития, накопила большой экспериментальный материал и освоила новые методы исследования.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Атомная, молекулярная и оптическая физика
Добро пожаловать в Группу атомной, молекулярной и оптической физики, исследования которой охватывают многие области, актуальные для сообщества AMO. Их можно разделить на:
Атомная и молекулярная спектроскопия (Н. Берра, Р. Кот, Г. Гибсон, П. Гулд, В. Харченко, Д. Маккаррон, В. Смит, К. Траллеро):
Харченко, Д. Маккаррон, В. Смит, К. Траллеро):
- Теория: Мы рассчитываем спектры фотоассоциации, анализируем экспериментальные спектры и сравниваем их, чтобы настроить потенциалы взаимодействия, точно воспроизводящие измеренные характеристики.Мы вычисляем время жизни молекулярных состояний и то, как спектральные характеристики зависят от окружающей среды (например, сдвиг и уширение линий, штарковский сдвиг ридберговских состояний, возбуждение E2 до высоких ридберговских уровней и т. д.).
- Эксперимент:
- Мы проводим сверхбыстрые эксперименты с фемтосекундными и аттосекундными импульсами с использованием либо настольных лазеров в UConn (в трех разных лабораториях; Berrah, Gibson, Trallero), либо с использованием XUV, VUV и рентгеновских лазеров на свободных электронах (FEL) в США, Японии. и Европа.Мы детально исследуем и измеряем молекулярную динамику, происходящую в сверхбыстрых временных масштабах. Наша цель — снять «Молекулярный фильм», измеряя в зависимости от времени все физические и химические процессы, происходящие после фотоиндуцированного возбуждения и ионизации различных систем.
 Различные лазеры, которые мы используем, позволяют нам исследовать валентные и внутренние электроны в материи (атомах, молекулах, наносистемах, жидкостях, твердых телах). Аттосекундные лазеры позволяют нам исследовать и стремиться понять электронную динамику, в то время как фемтосекундные лазеры позволяют нам исследовать и стремиться понять ядерную динамику в изучаемых нами системах.Наши исследования имеют решающее значение для других областей науки, таких как нанофизика, химия и биология.
Различные лазеры, которые мы используем, позволяют нам исследовать валентные и внутренние электроны в материи (атомах, молекулах, наносистемах, жидкостях, твердых телах). Аттосекундные лазеры позволяют нам исследовать и стремиться понять электронную динамику, в то время как фемтосекундные лазеры позволяют нам исследовать и стремиться понять ядерную динамику в изучаемых нами системах.Наши исследования имеют решающее значение для других областей науки, таких как нанофизика, химия и биология. - Мы производим ультрахолодные ридберговские атомные образцы и ультрахолодные молекулярные газы и исследуем их свойства по их спектрам. Например, мы обнаружили механизм ван-де-ваальсовой блокады в ультрахолодных ридберговских газах, изучая сильное насыщение возбуждения определенных атомных линий. Сильное взаимодействие Ридберга-Ридберга также привело к молекулярным резонансам между состояниями Ридберга, которые были обнаружены и проанализированы; они могут способствовать образованию макродимеров, т.
 е.е. молекулы микронного размера, состоящие из двух ридберговских атомов. Мы также подробно исследуем спектры Rb 2 и KRb как в основном, так и в возбужденном электронном состоянии, чтобы построить точные молекулярные потенциалы, из которых мы можем найти наилучший путь для производства ультрахолодных молекул в их основном колебательном состоянии.
е.е. молекулы микронного размера, состоящие из двух ридберговских атомов. Мы также подробно исследуем спектры Rb 2 и KRb как в основном, так и в возбужденном электронном состоянии, чтобы построить точные молекулярные потенциалы, из которых мы можем найти наилучший путь для производства ультрахолодных молекул в их основном колебательном состоянии.
Квантовая оптика (Р. Кот, Н. Датта, П. Гулд, Дж. Яванайнен, К. Ройчудхури, В. Смит, С. Елин):
- Теория : Интерференционные эффекты в ультрахолодных атомно-молекулярных образцах, электромагнитно-индуцированная прозрачность (EIT), многочастичные эффекты в холодных образцах (например,например, сверхизлучение в ридберговских газах, конденсаты Бозе-Эйнштейна в оптических решетках и т. д.) и метаматериалы (например, с отрицательным показателем преломления).
Ultracold Atoms and Molecules (R. Cote, P. Gould, J. Javanainen, D. McCarron, S. Yelin):
McCarron, S. Yelin):
- Теория: Мы изучаем взаимодействие атомов с атомами или молекулами и их рассеивающие свойства (например, их длины рассеяния или их неупругие столкновения), ультрахолодные атомы в оптических решетках (например,например, переход сверхтекучий изолятор Мотта в бозонных образцах), нелинейные эффекты (например, в процессах медленного света и ЭИП), образование ультрахолодных молекул (например, с помощью фотоассоциации вблизи резонансов Фешбаха).
- Эксперимент: Мы исследовали образцы ультрахолодных атомов Rb, чтобы контролировать их рассеивающие свойства, а также для ультрахолодных молекул (Rb 2 и KRb). Мы исследуем ультрахолодные молекулы, получая точные спектры, раскрывающие их внутреннюю структуру.Мы также изучаем их взаимодействие с внешним полем и между собой. Это приведет к исследованию вырожденных молекулярных газов.
Наука о сверхбыстрых лазерах (Н. Берра, Г. Гибсон, К. Траллеро):
Гибсон, К. Траллеро):
- Квантовая динамика: Мы используем фемтосекундные (10 -15 с) лазерные и аттосекундные импульсы для изучения структуры и динамики молекул, атомов и твердых тел с помощью настольных лазеров или лазеров на основе ускорителей, таких как Free Electron Лазеры (ЛСЭ) в США и за рубежом.Эти исследования проводятся путем отслеживания образования атомарных или молекулярных ионов и электронов с использованием сложных детекторов, таких как спектрометр импульса ионов отдачи с холодной мишенью (COLTRIMS) и картографирование скорости (VMI). Эти методы позволяют нам измерять совпадения электронов и ионов друг с другом, что позволяет получить подробную информацию. Мы также проводим аналогичные исследования, изучая крайне нелинейный отклик атомов, молекул и сред. Используя короткие импульсы света, мы можем отслеживать в «реальном времени» эволюцию квантовых систем после внезапного взаимодействия .
- Разработка оптики: Мы заинтересованы в разработке новых оптических подходов и методов в сверхбыстрой оптике в диапазоне от экстремального ультрафиолета (XUV) до инфракрасного.
 В частности, нас интересует генерация и управление импульсами с несколькими циклами в инфракрасном диапазоне от 800 до 8000 нм, а также генерация и управление импульсами XUV. Эти импульсы XUV имеют продолжительность в аттосекундах (10 -18 с) и представляют собой самые короткие временные события, измеренные на сегодняшний день. В настоящее время мы работаем над преодолением даже аттосекундного барьера.
В частности, нас интересует генерация и управление импульсами с несколькими циклами в инфракрасном диапазоне от 800 до 8000 нм, а также генерация и управление импульсами XUV. Эти импульсы XUV имеют продолжительность в аттосекундах (10 -18 с) и представляют собой самые короткие временные события, измеренные на сегодняшний день. В настоящее время мы работаем над преодолением даже аттосекундного барьера.
Столкновения ионов с атомами (Р. Кот, В. Смит):
- Эксперимент: Группа Уинтропа Смита использует гибридную ловушку для изучения ионно-атомных взаимодействий при низких и сверхнизких температурах.Гибридная ловушка, устройство, впервые предложенное профессором Смитом, сочетает в себе магнитооптическую ловушку (МОЛ) для нейтралов и ВЧ-ловушку. Ловушка Пауля для ионов в том же объеме. Мы измеряем скорость столкновений и реакций между холодными атомами и ионами, нелинейную динамику загрузки ионов и распада из линейной ионной ловушки Пауля, а также симпатическое охлаждение атомарных и молекулярных ионов ультрахолодными атомами.
 Мы сотрудничаем с Робином Коте, Джоном Монтгомери и Харви Михелсом (Коннектикут), Райнхольдом Блюмелем (Уэслианский университет), Дугласом Гудманом (Технологический институт Вентворта) и Фрэнком Нардуччи (Военно-морские авиационные системы).
Мы сотрудничаем с Робином Коте, Джоном Монтгомери и Харви Михелсом (Коннектикут), Райнхольдом Блюмелем (Уэслианский университет), Дугласом Гудманом (Технологический институт Вентворта) и Фрэнком Нардуччи (Военно-морские авиационные системы). - Теория: Группа Робина Котэ рассчитывает кривые потенциала молекулярных ионов в основном и возбужденном состояниях и методы создания молекулярных ионов в основном состоянии в гибридных ловушках. Исходя из этих расчетов, можно получить упругое рассеяние и скорость реакции для холодных и ультрахолодных ионно-атомных столкновений. Некоторые из них важны для физики Солнечной системы и межзвездной среды. Мы сотрудничаем с группой доктора Смита в Калифорнийском университете в Коннектикуте и другими группами по всему миру.
Надежность данных взаимодействующих квантовых атомов (IQA), рассчитанных на основе плотностей после HF: влияние используемого приближения
Эффективность аппроксимаций BBC1, BBC2 и Мюллера с точки зрения надежности данных IQA была исследована на уровнях CCSD, CCSD(T) и MP2 с использованием гликоля в качестве примера при интерпретации относительной стабильности его конформеров, одного с внутримолекулярным взаимодействием типа Н-связи и со стерическим столкновением двух атомов О. Уровень CCSD/BBC1 оказался идеально подходящим в качестве эталона, необходимого для оценки всех возможных комбинаций уровней теории/аппроксимации (LoT/LoA). Мы обнаружили тренд надежности LoT/BBC1 > LoT/BBC2 > LoT/Мюллер (а также его происхождение) и пришли к выводу, что приближение Мюллера не следует использовать, когда рассматривается точность энергетических терминов, определенных IQA. Кроме того, мы установили, что требование воспроизведения с помощью расчетов IQA электронной энергии является желательным, но не обязательным требованием, когда используется сравнительный подход, например, в анализе на основе FAMSEC (FAMSEC = изменение энергии молекулярной системы, приписываемое фрагменту).Предложен новый критерий оценки качества данных ВОК для сравнительного анализа, Δ E (IQA) ≈ Δ E , где Δ E (IQA) и Δ E — разности IQA и электронной энергии, соответственно, между fin-состоянием и ref-состоянием молекулярной системы. Чем ближе Δ E (IQA) приближается к Δ E , тем ближе значения данных FAMSEC, полученные на исключительно эффективном уровне CCSD/BBC1, независимо от используемой комбинации LoT/LoA.
Уровень CCSD/BBC1 оказался идеально подходящим в качестве эталона, необходимого для оценки всех возможных комбинаций уровней теории/аппроксимации (LoT/LoA). Мы обнаружили тренд надежности LoT/BBC1 > LoT/BBC2 > LoT/Мюллер (а также его происхождение) и пришли к выводу, что приближение Мюллера не следует использовать, когда рассматривается точность энергетических терминов, определенных IQA. Кроме того, мы установили, что требование воспроизведения с помощью расчетов IQA электронной энергии является желательным, но не обязательным требованием, когда используется сравнительный подход, например, в анализе на основе FAMSEC (FAMSEC = изменение энергии молекулярной системы, приписываемое фрагменту).Предложен новый критерий оценки качества данных ВОК для сравнительного анализа, Δ E (IQA) ≈ Δ E , где Δ E (IQA) и Δ E — разности IQA и электронной энергии, соответственно, между fin-состоянием и ref-состоянием молекулярной системы. Чем ближе Δ E (IQA) приближается к Δ E , тем ближе значения данных FAMSEC, полученные на исключительно эффективном уровне CCSD/BBC1, независимо от используемой комбинации LoT/LoA. Важно отметить, что в сравнительных исследованиях уровень MP2/BBC1 показал почти такие же результаты, как и уровень CCSD/BBC1. Было раскрыто и подробно обсуждено происхождение исключительной эффективности приближения MP2 / BBC1 и приемлемой эффективности приближения MP2 / Мюллера в объяснении относительной стабильности конформеров гликоля.
Важно отметить, что в сравнительных исследованиях уровень MP2/BBC1 показал почти такие же результаты, как и уровень CCSD/BBC1. Было раскрыто и подробно обсуждено происхождение исключительной эффективности приближения MP2 / BBC1 и приемлемой эффективности приближения MP2 / Мюллера в объяснении относительной стабильности конформеров гликоля.
Атомная энергия в теории «Атомы в молекулах» и ее использование для решения химических задач и ClO- были исследованы с использованием теории связанного кластера CCSD(T)/aug-cc-pVTZ//CCSD/6-311++G(d,p) и уровня M06L/6-311++G(d,p) теория функционала плотности наряду с двухточечной экстраполяцией до полного предела базисного набора и эталонным исследованием на уровнях CCSD(T) и MP2.Методы сопряженных кластеров, MP2 и DFT дают сравнимые результаты и показывают, что анионы обладают очень высокой способностью хранить водород, как весовой процент h3 в самом высоком h3-координированном состоянии F-, Cl-, Br-, OH-, Nh3- , NO2-, CN- и ClO- составляет 56,0, 47,6, 33,5, 64,0, 65,4, 41,2, 55,4, 40,0 мас.
 % соответственно. Результаты CCSD(T)/aug-cc-pVTZ//CCSD/6-311++G(d,p) представлены для анионов, координированных до девяти или десяти h3, в то время как до всей первой координационной оболочки вычисляется с использованием M06L, который выявил координационные числа h3 12, 16, 20, 15, 15, 16, 16 и 17 соответственно для F-, Cl-, Br-, OH-, Nh3-, NO2-, CN- и ClO-.Наблюдается увеличение полной энергии взаимодействия (Eint) и уменьшение энергии взаимодействия на h3 (Eint/h3) с увеличением числа координированных h3. Однако снижение Eint/h3 очень меньше, и даже у наиболее координированных анионов наблюдаются достаточно хорошие значения Eint/h3, т.е. 4,24, 2,59, 2,09, 3,32, 3,07, 2,36, 2,31 и 2,63 ккал/моль соответственно для F-, Cl-, Br-, OH-, Nh3-, NO2-, CN- и ClO-, что сопоставимо с значения, полученные для комплексов с меньшей координацией h3.Стабильность комплекса объясняется образованием большого количества нековалентных связей X-…H, что было выявлено при идентификации критических точек связи в анализе квантовой теории атомов в молекулах (QTAIM).
% соответственно. Результаты CCSD(T)/aug-cc-pVTZ//CCSD/6-311++G(d,p) представлены для анионов, координированных до девяти или десяти h3, в то время как до всей первой координационной оболочки вычисляется с использованием M06L, который выявил координационные числа h3 12, 16, 20, 15, 15, 16, 16 и 17 соответственно для F-, Cl-, Br-, OH-, Nh3-, NO2-, CN- и ClO-.Наблюдается увеличение полной энергии взаимодействия (Eint) и уменьшение энергии взаимодействия на h3 (Eint/h3) с увеличением числа координированных h3. Однако снижение Eint/h3 очень меньше, и даже у наиболее координированных анионов наблюдаются достаточно хорошие значения Eint/h3, т.е. 4,24, 2,59, 2,09, 3,32, 3,07, 2,36, 2,31 и 2,63 ккал/моль соответственно для F-, Cl-, Br-, OH-, Nh3-, NO2-, CN- и ClO-, что сопоставимо с значения, полученные для комплексов с меньшей координацией h3.Стабильность комплекса объясняется образованием большого количества нековалентных связей X-…H, что было выявлено при идентификации критических точек связи в анализе квантовой теории атомов в молекулах (QTAIM).








 Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся изучением газов.Затем последует каскад открытий простых веществ: водород, кислород, азот, хлор. А чуть позже газы помогут установить те законы, которые принято называть основными законами химии. Они позволят сформулировать основные положения атомно-молекулярного учения.
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся изучением газов.Затем последует каскад открытий простых веществ: водород, кислород, азот, хлор. А чуть позже газы помогут установить те законы, которые принято называть основными законами химии. Они позволят сформулировать основные положения атомно-молекулярного учения.

 Различные лазеры, которые мы используем, позволяют нам исследовать валентные и внутренние электроны в материи (атомах, молекулах, наносистемах, жидкостях, твердых телах). Аттосекундные лазеры позволяют нам исследовать и стремиться понять электронную динамику, в то время как фемтосекундные лазеры позволяют нам исследовать и стремиться понять ядерную динамику в изучаемых нами системах.Наши исследования имеют решающее значение для других областей науки, таких как нанофизика, химия и биология.
Различные лазеры, которые мы используем, позволяют нам исследовать валентные и внутренние электроны в материи (атомах, молекулах, наносистемах, жидкостях, твердых телах). Аттосекундные лазеры позволяют нам исследовать и стремиться понять электронную динамику, в то время как фемтосекундные лазеры позволяют нам исследовать и стремиться понять ядерную динамику в изучаемых нами системах.Наши исследования имеют решающее значение для других областей науки, таких как нанофизика, химия и биология. е.е. молекулы микронного размера, состоящие из двух ридберговских атомов. Мы также подробно исследуем спектры Rb 2 и KRb как в основном, так и в возбужденном электронном состоянии, чтобы построить точные молекулярные потенциалы, из которых мы можем найти наилучший путь для производства ультрахолодных молекул в их основном колебательном состоянии.
е.е. молекулы микронного размера, состоящие из двух ридберговских атомов. Мы также подробно исследуем спектры Rb 2 и KRb как в основном, так и в возбужденном электронном состоянии, чтобы построить точные молекулярные потенциалы, из которых мы можем найти наилучший путь для производства ультрахолодных молекул в их основном колебательном состоянии. В частности, нас интересует генерация и управление импульсами с несколькими циклами в инфракрасном диапазоне от 800 до 8000 нм, а также генерация и управление импульсами XUV. Эти импульсы XUV имеют продолжительность в аттосекундах (10 -18 с) и представляют собой самые короткие временные события, измеренные на сегодняшний день. В настоящее время мы работаем над преодолением даже аттосекундного барьера.
В частности, нас интересует генерация и управление импульсами с несколькими циклами в инфракрасном диапазоне от 800 до 8000 нм, а также генерация и управление импульсами XUV. Эти импульсы XUV имеют продолжительность в аттосекундах (10 -18 с) и представляют собой самые короткие временные события, измеренные на сегодняшний день. В настоящее время мы работаем над преодолением даже аттосекундного барьера..jpg) Мы сотрудничаем с Робином Коте, Джоном Монтгомери и Харви Михелсом (Коннектикут), Райнхольдом Блюмелем (Уэслианский университет), Дугласом Гудманом (Технологический институт Вентворта) и Фрэнком Нардуччи (Военно-морские авиационные системы).
Мы сотрудничаем с Робином Коте, Джоном Монтгомери и Харви Михелсом (Коннектикут), Райнхольдом Блюмелем (Уэслианский университет), Дугласом Гудманом (Технологический институт Вентворта) и Фрэнком Нардуччи (Военно-морские авиационные системы).