Ответы на тему «Фосфор и его соединения»
1. Дайте характеристику химического элемента фосфора, вписав пропущенные числа, слова, словосочетания и формулы. Характеристика фосфора по положению в периодической системе
Атомы фосфора проявляют как окислительные свойства: принимают три электрона и получают в результате степень окисления -3, так и восстановительные свойства: отдают три или пять электронов и получают в результате степень окисления соответственно +3 и +5
3. Простое вещество. Фосфор образует несколько аллотропных модификаций: белый, черный, красный фосфор. Наиболее устойчив красный фосфор. Для него характерны следующие физические свойства: твердое вещество красного цвета
Высший оксид, его характер. Оксид фосфора(Р) Р2О5 относится к солеобразующим, кислотным оксидам.

5. Высший гидроксид, его характер. Фосфорная кислота h4PO4 проявляет кислотные свойства. Она взаимодействует с основными оксидами, щелочами, амфотерными оксидами, с металлами в ряду напряжений до водорода.
Подчеркните формулы бинарных соединений фосфора.
НзРO4 РН3 Са3(Р04)2 Р2O5 Н2O Са3Р2
Составьте уравнения реакций получения из простых веществ соединений, формулы которых вы подчеркнули, расставив коэффициенты методом электронного баланса. Назовите продукты реакций. Укажите окислитель и восстановитель.
3. Дайте характеристику оксида фосфора (V), вписав пропущенные слова и словосочетания, формулы.
Характеристика оксида фосфора(V)
1. Формула — P2O5
2. Тип вещества — сложное. Класс вещества — оксиды. Характеристика вещества по химическим свойства — солеобразующий кислотный оксид.
3. Физические свойства — Твердое вещество белого цвета, гигроскопичный
4. Химические свойства — Взаимодействует с основными и амфотерными оксидами, водой и щелочами
Химические свойства — Взаимодействует с основными и амфотерными оксидами, водой и щелочами
5. Применение — В качестве водоотнимающего средства
4. Поиграйте в крестики-нолики. Впишите формулы веществ так, чтобы получился выигрышный путь, состоящий из веществ, взаимодействующих с оксидом фосфора (V).
Запишите уравнения реакций оксида фосфора с веществами, образующими выигрышный путь.
P2O5 + 3h3O -> 2h4PO4
3Na2O + P2O5 -> 2Na3PO4
3CaO + P2O5 -> Ca3(PO4)2
Для реакции обмена составьте ионное уравнение.
5. Дайте характеристику фосфорной кислоте, вписав лропу-щенные слова и словосочетания, формулы.
Характеристика фосфорной кислоты
1. Формула. h4PO4
2. Тип вещества — сложное. Класс вещества — кислота.
Характеристика вещества: 1) по наличию кислорода — кислородосодержащая; 2) по основности — трехосновное; 3) по растворимости в воде — растворимое; 4) по степени электролитической диссоциации — сильная; 5) по летучести — нелетучая; 6)по стабильности — стабильная.
3. Физические свойства. Твердое белое вещество, хорошо растворимое в воде
4. Химические свойства. Взаимодействует с металлами, основаниями, солями основными и амфотерными оксидами
5. Применение. Используется для получения фосфорных удобрений, ядохимикатов, кормовых добавок для животных.
6. Впишите в тестовое задание формулы веществ так, чтобы в нём было два правильных ответа. Запишите возможные уравнения реакций.
С фосфорной кислотой взаимодействует:
1) ZnSO4
2) CO2
3) Na2O, 2h4PO4 + 3Na2O -> 2Na3PO4 + 3h3O
4) NaNO3
5) NaOH, h4PO4 + 3NaOH -> Na3PO4 + 3h3O
Запишите правильный ответ.
Ответ: 3, 5
7. Заполните схему 9 формулами и названиями солей.
Классификация солей фосфорной кислоты по составу
Соли фосфорной кислоты:
Фосфаты: Na3PO4 Ca3(PO4)2
Дигидрофосфаты: Nah3PO4 Kh3PO4
Гидрофосфаты: Na2HPO4 MgHPO4
«помогите решить тест.
 » – Яндекс.Кью
» – Яндекс.Кью1)Какой из оксидов относится к кислотным?
a)N2O
b)Mn2O7
c)CO
d)NO
2)С каким веществом не реагирует раствор хлороводорода?
a)Cr2O3
b)B2O3
c)ZnO
d)PbO
3)С каким веществом не реагирует оксид кальция?
a)CO2
b)Ba(OH)2
c)h4PO4
d)HCl
4)В каком из рядов оба указанных оксида проявляют амфотерные свойства?
a)FeO, BaO
b)ZnO, Li2O
c)SnO, Cr2O3
d)CaO, Al2O3
5)Ангидридом какой кислоты является Cl2O5
a)HClO2
b)HClO4
c)HClO
d)HClO3
6)Ангидридом азотной кислоты является оксид?
a)N2O5
b)NO
c)NO2
d)N2O3
7)Какая из пар элементов образует только основные оксиды?
a) Ca и F
b) Ba и S
с) Ba и cu
d)Cl и Mn
8)С кислотами реагирует каждый из оксидов в ряду?
a)NO, CO2, Al2O3, CaO
b)BaO, MgO, MnO, CuO
C)ZnO, FeO, MgO, CO
d)Na2O, BaO, CrO3, NO2
9)Сколько из указанных: P2O5, CuO, NO2, ZnO, Cl2O7, N2O,FeO — реагирует с водным раствором NaOH?
10)Растворением в воде какого из оксидов можно получить соответствующий гидроксид металла?
a)ZnO
b)PbO
c)K2O
d)Fe2O3
11)Все оксиды являются амфотерными в ряду?
a)BeO, CuO, BaO
b)CuO,Li2O, FeO
c)ZnO, Al2O3, Cr2O3
d)ZnO, Al2O3, CaO
12)какой из оксидов относится к числу основных?
a)BeO
b)Li2O
c)CO2
d)B2O3
13)С каким из оксидов реагирует соляная кислота?
a)SiO2
b)CuO
c)CO2
d)SO2
14)В каких парах вещества реагируют между собой в водном растворе?
a)MgO и KOH
b)ZnO и Cu(OH)2
c)Al2O3 и HCl
d)PbO и NaOH
15)С каким из веществ взаимодействует оксид бария?
a)CO
b)MgO
c)P2O5
d)N2O
16)В реакцию со щелочью не вступает оксид?
a)ZnO
b)ClO3
c)MgO
d)P2O5
17)какая из кислот соответствует оксиду Cl2O7
a)HClO4
b)HClO3
c)HClO
d)HClO2
18)Вещества какой пары реагируют между собой
a)NO и BaO
b)N2O5 и NaOH
c)CO2 и h3SO4
d)P2O5 и CO
19)Какая кислота не соответствует оксиду серы (VI)
a)h3S4O6
b)h3S2O7
c)h3SO4
d)h3S3O10
20)какой из кислот соответствует оксид P2O5
a)h4PO3
b)h4PO2
c)h5P2O7
d)h5P2O6
Оксид фосфора (V) | справочник Пестициды.
 ru
ruИнформация
Традиционно содержание Фосфора в удбрениях выражают содержанием Оксида фосфора.
Все свойства Фосфора, как питательного элемента описаны в статье Фосфор.
Подробнее >>>
Химические и физические свойства
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.[1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами. В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения. Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора.
Трехмерная модель молекулы
Содержание пентаоксида фосфора в почве и удобрениях
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.[4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.[2]
P2O5 + 3H2 O → 2H3PO4
Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.[4]
Поглощение пентаоксида фосфора растениями
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
Гидролиз пирофосфата натрия:
Na4P2O7 + H2O + 2H+ → 2NaH2PO4 +2Na+
Гидролиз триполифосфата натрия:
Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
Гидролиз метафосфат иона (в кислой среде):
(PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4—
Ортофосфорная кислота, будучи трехосновной отдиссоциирует три аниона H2PO—4, HPO42-, PO4 3- . В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий. Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов. [4]
В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий. Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов. [4]
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее). Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион. К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Многие растения могут питаться фосфором из очень разбавленных растворов, вплоть до 0,01 мг /л P2O5 . Естественно, что удовлетворить потребность в фосфоре растения могут только при условии постоянного возобновления в нем концентрации хотя бы такого же низкого уровня.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.[4]
Рерасчет содержения фосфора в удобрениях
В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
где:
х – содержание P2O5 в удобрении, %;
y – содержание P в удобрении, %
Или:
y = x, % × 0,43643
Например:
в удобрении содержится 40% оксида фосфора
для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Ван Везер «Фосфор и его соединения». Монография. т. 1.: Изд-во иностранной литературы, М., 1962.
2.Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
3.Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
4.Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть Список всех источниковCoreapp.ai — decentralized online education platform
 К ним относится золото Аu и некоторые другие. Оксиды этих элементов получают косвенным путём.
Химическая природа оксидов проявляется в их отношении к кислотам и щелочам.
В связи с этим оксиды можно разделить на следующие группы
— солеобразующие, которые реагируют с образованием солей с кислотами или щелочами;
— несолеобразующие, которые не образуют солей с кислотами или щелочами.
В свою очередь, солеобразующие оксиды подразделяются на кислотные (реагируют со щелочами), основные (реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с щелочами).
Кислотные оксиды — это оксиды, которые реагируют со щелочами с образованием соли и воды, но они не реагируют с кислотами. Например, при взаимодействии кислотного оксида – оксида углерода (IV) с гидроксидом натрия образуются карбонат натрия и вода:
CO2 + 2NaOH = Na2CO3 + h3O
К кислотным оксидам относятся, как правило, оксиды неметаллов (например, SO2, CO2, P2O5), и те оксиды металлов, в которых металл находится в валентности более III (например, Mn2O7, CrO3).
К ним относится золото Аu и некоторые другие. Оксиды этих элементов получают косвенным путём.
Химическая природа оксидов проявляется в их отношении к кислотам и щелочам.
В связи с этим оксиды можно разделить на следующие группы
— солеобразующие, которые реагируют с образованием солей с кислотами или щелочами;
— несолеобразующие, которые не образуют солей с кислотами или щелочами.
В свою очередь, солеобразующие оксиды подразделяются на кислотные (реагируют со щелочами), основные (реагируют с кислотами) и амфотерные (реагируют как с кислотами, так и с щелочами).
Кислотные оксиды — это оксиды, которые реагируют со щелочами с образованием соли и воды, но они не реагируют с кислотами. Например, при взаимодействии кислотного оксида – оксида углерода (IV) с гидроксидом натрия образуются карбонат натрия и вода:
CO2 + 2NaOH = Na2CO3 + h3O
К кислотным оксидам относятся, как правило, оксиды неметаллов (например, SO2, CO2, P2O5), и те оксиды металлов, в которых металл находится в валентности более III (например, Mn2O7, CrO3).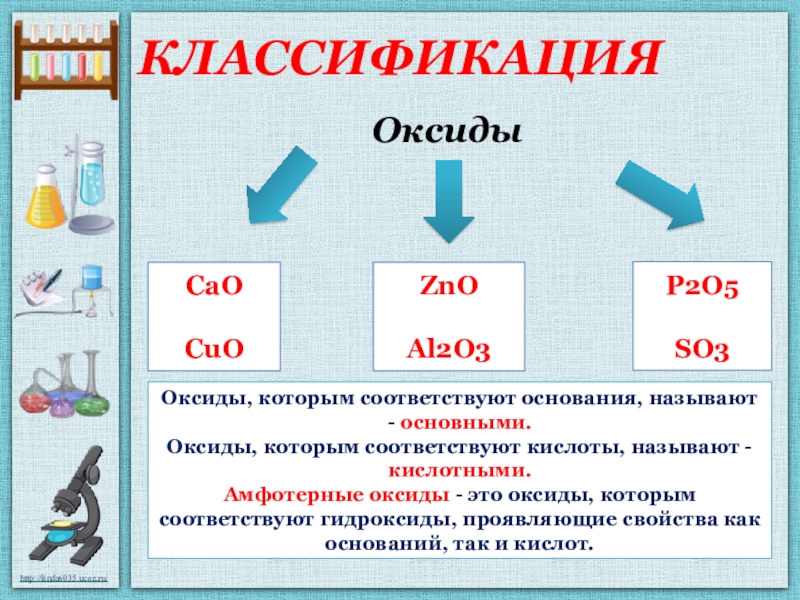 Кислотным оксидам соответствуют кислоты. Оксиду серы (IV) соответствуют сернистая кислота, оксиду углерода(IV) — угольная, оксиду фосфора(V) – ортофосфорная, оксиду марганца(VII) – марганцовая, оксиду хрома(VI) – хромовая.
Основные оксиды — это оксиды, которые реагируют с кислотами с образованием соли и воды, но не реагируют со щелочами. Например, при взаимодействии оксида магния с соляной кислотой образуются хлорид магния и вода:
MgO + 2HCl = MgCl2 + h3O
Основные оксиды образуют, как правило, металлы с валентностью – I, II или III. Основным оксидам соответствуют основания. Например, оксиду натрия соответствует гидроксид натрия NaOH, оксиду бария – гидроксид бария, оксиду меди(II) – гидроксид меди(II).
Третья группа солеобразующих оксидов – амфотерные оксиды. Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они способны реагировать как со щелочами, так и с кислотами.К амфотерным оксидам относятся, например, оксид алюминия, оксид цинка, оксид бериллия, оксид хрома(III):Al2O3, ZnO, BeO, Cr2O3
Несолеобразующие, или безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами.
Кислотным оксидам соответствуют кислоты. Оксиду серы (IV) соответствуют сернистая кислота, оксиду углерода(IV) — угольная, оксиду фосфора(V) – ортофосфорная, оксиду марганца(VII) – марганцовая, оксиду хрома(VI) – хромовая.
Основные оксиды — это оксиды, которые реагируют с кислотами с образованием соли и воды, но не реагируют со щелочами. Например, при взаимодействии оксида магния с соляной кислотой образуются хлорид магния и вода:
MgO + 2HCl = MgCl2 + h3O
Основные оксиды образуют, как правило, металлы с валентностью – I, II или III. Основным оксидам соответствуют основания. Например, оксиду натрия соответствует гидроксид натрия NaOH, оксиду бария – гидроксид бария, оксиду меди(II) – гидроксид меди(II).
Третья группа солеобразующих оксидов – амфотерные оксиды. Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они способны реагировать как со щелочами, так и с кислотами.К амфотерным оксидам относятся, например, оксид алюминия, оксид цинка, оксид бериллия, оксид хрома(III):Al2O3, ZnO, BeO, Cr2O3
Несолеобразующие, или безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами.
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Цели урока: знать строение, свойства и применение соединений фосфора; знать классификацию минеральных удобрений, условия их хранения, рационального использования, время внесения и особенности их влияния на растения.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + h3O = HPO3
при нагревании образуется ортофосфорная кислота h4PO4:
P2O5 + 3h3O = 2h4PO4 (t°C)
При нагревании h4PO4 можно получить пирофосфорную кислоту h5P2O7:
2h4PO4 = h3O + h5P2O7 (t°C)
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3h3O = 2h4PO4 (t°C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3h3SO4 = 3CaSO4 + 2h4PO4 (t°C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2h3O = 3h4PO4+ 5NO
Химические свойства:
Свойства, общие с другими кислотами |
Специфические свойства |
1. Ортофосфорная кислота диссоциирует ступенчато: h4PO4 ↔ H+ + h3PO4-(дигидроортофосфат-ион) h3PO4- ↔ H+ + HPO42-(гидроортофосфат-ион) HPO42- ↔ H+ + PO43-(ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ h4PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + h4PO4 = соль + Н2О 4. Взаимодействует с основаниями Ме(ОН)n: основание + h4PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: h4PO4(изб) + NaOH = Nah3PO4+ h3O или h4PO4(изб) + 2NaOH =Na2HPO4 + 2h3O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: h4PO4 + Nh4 = Nh4h3PO4 h4PO4 + 2Nh4 = (Nh4)2HPO4 h4PO4 + 3Nh4 = (Nh4)3PO4 6. Реагирует с солями слабых кислот: 2h4PO4+3Na2CO3 = 2Na3PO4 + 3h3O + 3CO2↑ |
1. 2h4PO4 (t˚C) → h3O + h5P2O7 h5P2O7 (t˚C)→ h3O + 2HPO3 2. Качественная реакция наPO43- — фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуетсяжёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов. |
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применяется как регулятор кислотности в газированных напитках.
3. Закрепление изученного материала
№ 1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O;
2. NaOH;
3. h3O при нагревании;
4. h3O без нагревания.
Для 2 реакции запишите полное и краткое ионное уравнение.
№ 2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием;
2. оксидом калия;
3. гидроксидом калия;
4. сульфитом калия.
№ 3. Осуществите превращения по схеме:
Сa3(PO4)2 → P → Ph4 → P2O5 → h4PO4 → Ca3(PO4)2
Назовите вещества.
№ 4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
4. Домашнее задание.
П. 22-23, упр. 6-10 на стр. 69. Анализ таблицы 20.
основных, амфотерных, кислотных / Справочник :: Бингоскул
Почти все химические элементы образуют оксиды. Лишь инертные газы не могут образовывать данные соединения.
Лишь инертные газы не могут образовывать данные соединения.
Оксиды – это сложные вещества, в состав которых входят 2 элемента, одним из которых является кислород. Таким образом, можно представить общую формулу данных соединений:
ЭmOn, где
- Э – химический элемент;
- m, n – индексы.
Номенклатура оксидов
Номенклатура этих веществ складывается из слова «оксид», названия химического элемента и валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название оксида = «Оксид» + название х.э. + валентность (в скобках)
Например:
- СO — оксид углерода (IV)
- Fe2O3 — оксид железа (III)
Классификация оксидов
Все оксиды подразделяются на две большие группы:
- Оксиды, которые при взаимодействии с кислотами и основаниями не образуют солей относят к несолеобразующим (CO, SiO, N2O, NO).
 В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность.
В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность. - Солеобразующие оксиды – это оксиды, которые при взаимодействии с кислотами, либо с основаниями, образуют соли. Эти оксиды являются производными от соответствующих оснований и кислот, в которых элемент находится в высшей валентности.
Все солеобразующие оксиды разделяются на три типа:
- К основным оксидам относят оксиды, гидраты которых являются основаниями. Образуются металлами, валентность которых меньше IV. Например:
- Na2O → NaOH
- CaO → Ca(OH)2
- FeO → Fe(OH)2
В состав данных соединений входят металлы с I и II, исключение цинк, бериллий, свинец, олово.
- К кислотным оксидам относят оксиды, гидраты которых являются кислотами. Образованы неметаллами и металлами побочных подгрупп с валентностью V, VI, VII.
 Например:
Например:- CO2 → h3CO3
- SO3 → h3SO4
- P2O5 → h4PO4
- Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды. Образованы металлами с валентностью III и IV. Например:
- ZnO → Zn(OH)2
- Al2O3 → Al(OH)3
Химические свойства оксидов
Все три группы оксидов обладают разными химическими свойствами. Амфотерные оксиды занимают промежуточное положение между основными и кислотными, поэтому для них характерны и кислотные, и щелочные химические свойства.
Свойства | Оксиды основные (ОО) | Оксиды амфотерные (АО) | Оксиды кислотные (КО) |
| ОО +к-та = соль(С) + вода(В) | АО + к-та = С + В | — |
| — | (только со щелочами) АО + щелочь = С + В | КО + основание = С + В |
| ОО + В = щелочь | — | КО + В = кислота |
| — | АО + ОО = С | ОО + КО = соль |
| ОО + КО = С | АО + КО = С | — |
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства оксидов — Персональный сайт учителя химии Куликовой Надежды Владимировны
Химические свойства оксидов: основных, амфотерных, кислотных
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + кислота (образуется соль + вода)
Основной оксид + кислота (образуется соль + вода)
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ h3O,
NiO + h3SO4 = NiSO4 + h3O
2. Основный оксид + вода (образуется щелочь)
В реакцию вступают только 8 оксидов: IA группа, СаО, SrO, ВаО)
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + h3O = 2LiOH
BaO + h3O = Ba(OH)2
3. Основный оксид + кислотный оксид (образуется соль)
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. Реакции оснóвных оксидов с восстановителями.
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
В качестве восстановителей используют: СО, С, водород, алюминий, магний.
С водородом реагируют оксиды неактивных металлов.
FeO + h3 = Fe + h3O (при нагревании)
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2.
5. Окисление до более высоких степеней окисления.
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+4,+5,+6,+7) , например, CrO3, Mn2O7.
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. Кислотный оксид + вода → кислота
Оксид реагирует с водой, если в результате образуется растворимый гидроксид.
Не реагирует с водой SiO2.
N2O3 + h3O = 2HNO2
SO2 + h3O = h3SO3
N2O5 + h3O = 2HNO3
SO3 + h3O = h3SO4
2. Кислотный оксид + основный оксид→ соль
Соль должна быть устойчива.
CO2 + CaO = CaCO3
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
N2O5 + ZnO = Zn(NO3)2
3. Кислотный оксид + основание (щелочь) → соль + вода
Реакция возможна только со щелочами.
SO3, CrO3, N2O5, Cl2O7) реагирует и с нерастворимыми (слабыми) основаниями.
CO2 + Ca(OH) 2 = CaCO3 + h3O
SiO2 + 2KOH = K2SiO3 + h3O (при нагревании),
SO3 + 2NaOH = Na2SO4 + h3O,
N2O5 + 2KOH = 2KNO3 + h3O.
4. Кислотный оксид + соль более летучей кислоты → соль + летучий оксид
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2
(при нагревании)
4. Окисление оксидов до более высокой степени окисления:
Для элементов, которые образуют несколько оксидов с разной степенью окисления
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, PbO, Fe2O3, Cr2O3 и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1. Оксид + кислота → соль + вода
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + h3O
Al2O3 + HNO3 = Al(NO3)3 +h3O
2. Кислотный оксид + амфотерный оксид→ соль
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует кислотный остаток :
ZnO + Na₂O = Na₂ZnO2.
2. Амфотерный оксид + раствор щелочи → раствор гидроксокомплекса
Al2O3 + KOH +h3O = K[Al(OH)4]
ZnO + NaOH + h3O = Na2[Zn(OH)4]
3. Амфотерный оксид + расплав щелочи → соль + вода
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + h3O (при нагревании)
ZnO + 2KOH =K2ZnO2 + h3O (при нагревании)
Вещества, образуемые катионами амфотерных металлов в щелочной среде
4. Амфотерный оксид + карбонаты щелочных металлов → соль + газ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = 2NaAlO2 + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5. Взаимодействие с сильными восстановителями:
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + h3 = Zn + h3O
Fe2O3 + h3 = 2FeO + h3O,
Fe2O3 + CO = 2FeO + CO2
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
ВaО
Негашенная известь при спекании с углеродом дает карбид кальция
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 — АМФОТЕРНЫЙ
с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С.
Реагирует с солями летучих кислотс образованием алюминатов и газообразного вещества.
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б
ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
1. Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + h3SO4 = Cu + CuSO4 + h3O
2. Взаимодействует с водным растворoм аммиака с образованием гидроксида диамин меди.
Cu2O + 4Nh4 + h3O = 2[Cu(Nh4)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + h3O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2Nh4 = ЗСu + N2↑ + 3h3О
II ГРУППА Б
ОКСИД ЦИНКА.
ОКСИД ЦИНКА (II) твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + h3O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VIII ГРУППА Б
ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II). ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5h3O
Fe₂O₃ — ОКСИД ЖЕЛЕЗА (III) АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV группа А ОКСИДЫ УГЛЕРОДА.
CO — НЕСОЛЕОБРАЗУЮЩИЙ
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
CO2 -КИСЛОТНЫЙ
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + h3O.
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем. Оксид без цвета, без запаха, единственный из кислотных нерастворимый
в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + h3O
SiO2 + 6HF(р-р)= h3[SiF6] + 2h3O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом\nобразуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
V ГРУППА А ОКСИДЫ АЗОТА
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + h3 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т. п.
п.
2NO + 2h3 =N2 + 2h3O
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует с водой сразу две кислоты: азотную и азотистую:
2NO2 + h3O = HNO3 + HNO2
4NO2 + 2h3O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +h3O
2. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД КИСЛОТНЫЙ
кристаллическое вещество, легко плавится (40°С)
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
P2O5 (ОКСИД ФОСФОРА (V) ФОСФОРНЫЙ АНГИДРИД). КИСЛОТНЫЙ
Белые кристаллы. В парах состоит из молекул P4h20, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + h3O = 2HPO3 (метафосфорная кислота)
P2O5 +3h3O = 2h4PO4 (ортофосфорная кислота)
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
ФТОРИД КИСЛОРОДА ОF2
Кислород проявляет положительную степень окисления. Бесцветный газ, плохо растворимый в воде, распадается на кислород и фтор.
Фтор не образует кислородных кислот, так как не проявляет положительных степеней окисления.
КИСЛОТО-ОСНОВНОЕ ПОВЕДЕНИЕ ОКСИДОВ ПЕРИОДА 3 На этой странице рассматриваются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо. Очевидно, что аргон не используется, поскольку он не образует оксид. Краткое описание тенденции Оксиды Мы будем рассматривать следующие оксиды:
| |||||||||||||||
Примечание: Если вы еще не были там, возможно, вам будет интересно просмотреть страницу о структурах и физических свойствах оксидов Периода 3 в качестве полезного введения, прежде чем идти дальше.  Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже, если вы решите перейти по этой ссылке. | |||||||||||||||
Тенденция кислотно-щелочного поведения Тенденция кислотно-щелочного поведения показана в различных реакциях, но в виде простого обобщения:
Для этой простой тенденции вы должны смотреть только на самые высокие оксиды отдельных элементов. Это те, которые находятся в верхнем ряду выше, и там, где элемент находится в максимально возможной степени окисления. Картина не так проста, если вы включите и другие оксиды. Для оксидов неметаллов их кислотность обычно рассматривается в терминах кислотных растворов, образующихся при их реакции с водой — например, триоксид серы реагирует с образованием серной кислоты. Все эти реакции подробно рассматриваются на оставшейся части этой страницы. | |||||||||||||||
Предупреждение: Остальная часть этой страницы содержит довольно много деталей о различных оксидах. Не упускайте из виду общую тенденцию этого периода в отношении самых высоких оксидов, когда вы смотрите на все эти детали. Важно знать, что ваша программа говорит по этой теме, а также изучать прошлые работы и схемы отметок — иначе вы в конечном итоге увязнете в массе деталей, о которых вам на самом деле не нужно знать.Если вы готовитесь к экзамену в Великобритании (уровень A или его эквивалент) и у вас нет ничего из этого, перейдите по этой ссылке, прежде чем идти дальше, чтобы узнать, как их получить. | |||||||||||||||
Химия индивидуальных оксидов Оксид натрия Оксид натрия — простой сильноосновной оксид. Реакция с водой Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. В зависимости от концентрации он будет иметь pH около 14. Реакция с кислотами Оксид натрия, как сильное основание, также вступает в реакцию с кислотами. Например, он будет реагировать с разбавленной соляной кислотой с образованием раствора хлорида натрия. Оксид магния Оксид магния также является простым основным оксидом, поскольку он также содержит ионы оксида.Однако он не так сильно щелочной, как оксид натрия, потому что ионы оксида не так свободны. В случае оксида натрия твердое вещество удерживается вместе за счет притяжения между ионами 1+ и 2-. В случае оксида магния притяжение составляет от 2+ до 2-. Даже с учетом других факторов (таких как энергия, выделяемая, когда положительные ионы притягиваются к воде в образовавшемся растворе), общий эффект этого заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия. Реакция с водой Если встряхнуть немного белого порошка оксида магния с водой, ничего не произойдет — похоже, он не вступит в реакцию. Однако, если вы проверите pH жидкости, вы обнаружите, что он находится где-то около 9, что свидетельствует о слабощелочной активности. Должна быть какая-то небольшая реакция с водой с образованием гидроксид-ионов в растворе. В результате реакции образуется некоторое количество гидроксида магния, но он почти нерастворим, поэтому в раствор фактически попадает не так много гидроксид-ионов. Реакция с кислотами Оксид магния реагирует с кислотами так же, как и любой простой оксид металла. Оксид алюминия Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах. Одна из этих форм очень инертна.Химически он известен как альфа-Al 2 O 3 и производится при высоких температурах. Далее мы предполагаем одну из наиболее реактивных форм. Оксид алюминия амфотерный . Он вступает в реакцию и как основание, и как кислота. Реакция с водой Оксид алюминия не реагирует с водой простым образом в том смысле, в каком реагируют оксид натрия и оксид магния, и не растворяется в ней.Хотя он все еще содержит ионы оксида, они слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой. | |||||||||||||||
Примечание: Однако некоторые формы оксида алюминия действительно очень эффективно поглощают воду.  Я не смог установить, связано ли это поглощение только с такими вещами, как водородные связи, или происходит настоящая химическая реакция с образованием какого-то гидроксида. Если у вас есть надежная информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. Я не смог установить, связано ли это поглощение только с такими вещами, как водородные связи, или происходит настоящая химическая реакция с образованием какого-то гидроксида. Если у вас есть надежная информация по этому поводу, не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте. | |||||||||||||||
Реакция с кислотами Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Это означает, например, что оксид алюминия будет реагировать с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия. В этой (и подобных реакциях с другими кислотами) оксид алюминия демонстрирует основную сторону своей амфотерной природы. Реакция с основаниями Оксид алюминия также имеет кислую природу, и это проявляется в реакции с основаниями, такими как раствор гидроксида натрия. Образуются различные алюминаты — соединения, в которых алюминий находится в отрицательном ионе. Это возможно, потому что алюминий обладает способностью образовывать ковалентные связи с кислородом. В случае натрия между натрием и кислородом существует слишком большая разница в электроотрицательности для образования чего-либо, кроме ионной связи.Но электроотрицательность увеличивается по мере прохождения периода, а разница электроотрицательностей между алюминием и кислородом меньше. Это позволяет образовывать ковалентные связи между ними. | |||||||||||||||
Примечание: Если вас не устраивает электроотрицательность, вы найдете ее объяснение, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу позже. | |||||||||||||||
С горячим концентрированным раствором гидроксида натрия оксид алюминия реагирует с образованием бесцветного раствора тетрагидроксоалюмината натрия. | |||||||||||||||
Примечание: Вы можете найти всевозможные другие формулы для продукта этой реакции. Они варьируются от NaAlO 2 (который представляет собой дегидратированную форму той, что указан в уравнении) до Na 3 Al (OH) 6 (который представляет собой совершенно другой продукт). То, что вы действительно получите, будет зависеть от таких вещей, как температура и концентрация раствора гидроксида натрия. В любом случае, правда почти наверняка намного сложнее, чем что-либо из вышеперечисленного.Это тот случай, когда было бы неплохо узнать, что ваши экзаменаторы цитируют в своих вспомогательных материалах или схемах выставления оценок, и придерживаться этого. При необходимости получите такую информацию от экзаменаторов (если вы изучаете курс в Великобритании), перейдя по ссылкам на странице учебных программ. | |||||||||||||||
Диоксид кремния (оксид кремния (IV)) К тому времени, когда вы дойдете до кремния в течение периода, электроотрицательность увеличится настолько, что уже не будет достаточной разницы в электроотрицательности между кремнием и кислородом для образования ионных связей. Диоксид кремния не имеет основных свойств — не содержит оксидных ионов и не вступает в реакцию с кислотами. Вместо этого он очень слабокислый, реагируя с сильными основаниями. Реакция с водой Диоксид кремния не реагирует с водой из-за сложности разрушения гигантской ковалентной структуры. Реакция с основаниями Диоксид кремния вступает в реакцию с раствором гидроксида натрия, но только если он горячий и концентрированный.Образуется бесцветный раствор силиката натрия. Вы также можете быть знакомы с одной из реакций, происходящих при извлечении железа в доменной печи — в которой оксид кальция (из известняка, который является одним из сырьевых материалов) реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция. Это также пример реакции кислого диоксида кремния с основанием. Важно! Что касается остальных оксидов, мы в основном будем рассматривать результаты их реакции с водой с образованием растворов различных кислот. Когда мы говорим о повышении кислотности оксидов по мере перехода, скажем, от оксида фосфора (V) к триоксиду серы к оксиду хлора (VII), мы обычно говорим о возрастающей силе кислот, образующихся при их реакции. с водой. Оксиды фосфора Мы собираемся рассмотреть два оксида фосфора, оксид фосфора (III), P 4 O 6 , и оксид фосфора (V), P 4 O 10 . Оксид фосфора (III) Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты H 3 PO 3 , известной как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота. Его реакция с горячей водой намного сложнее. | |||||||||||||||
Примечание: Обратите внимание на окончание «-ous» в первых двух именах. Это не орфографическая ошибка — это правда! Его используют, чтобы отличить его от фосфорной кислоты, которая совершенно иная (см.  Ниже). Ниже).Названия фосфорсодержащих кислот просто кошмар! (На самом деле, насколько я понимаю, фосфорные кислоты в целом всегда были и продолжают быть полным кошмаром!) Не беспокойтесь об этих названиях на этом уровне. Просто убедитесь, что вы можете написать формулы, если вам это нужно — и будьте благодарны за то, что вам не нужно больше о них знать! | |||||||||||||||
Чистая неионизированная кислота имеет структуру: Водороды не выделяются в виде ионов до тех пор, пока вы не добавите в кислоту воду, и даже в этом случае их не так много, потому что фосфористая кислота — это всего лишь слабая кислота. Фосфорная кислота имеет pK a , равное 2,00, что делает ее более сильной, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76). | |||||||||||||||
Примечание: Если вы знаете о pK a , но не очень уверены, вы можете перейти по этой ссылке, но это, вероятно, займет у вас много времени.  Все, что вам действительно нужно знать по этой теме, это то, что чем ниже значение pK a , тем сильнее кислота. Все, что вам действительно нужно знать по этой теме, это то, что чем ниже значение pK a , тем сильнее кислота. | |||||||||||||||
Маловероятно, что вы когда-либо вступите в реакцию оксида фосфора (III) напрямую с основанием, но вам может потребоваться знать, что произойдет, если вы прореагируете образовавшуюся фосфористую кислоту с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислыми, а другой — нет. Это означает, что вы можете получить две возможные реакции, например, с раствором гидроксида натрия в зависимости от используемых пропорций. В первом случае только один из кислых атомов водорода прореагировал с гидроксид-ионами основания. Во втором случае (с использованием вдвое большего количества гидроксида натрия) прореагировали оба. Если бы вы реагировали непосредственно оксид фосфора (III) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. | |||||||||||||||
Примечание: Проверьте свой учебный план, прошлые работы и схемы отметок, прежде чем вы слишком увязнете в этом! Перейдите по этой ссылке, чтобы узнать, как получить их, если у вас их еще нет (только для учебных программ в Великобритании). | |||||||||||||||
Оксид фосфора (V) Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий.Обычно мы просто рассматриваем одну из них, фосфорную (V) кислоту, H 3 PO 4 , также известную как фосфорная кислота или ортофосфорная кислота. На этот раз чистая неионизированная кислота имеет структуру: Фосфорная (V) кислота также является слабой кислотой с pK a , равным 2,15. Это делает его на слабее фосфористой кислоты. Растворы обеих этих кислот с концентрацией около 1 моль дм -3 будут иметь pH около 1. Еще раз, вы вряд ли когда-нибудь прореагируете этот оксид с основанием, но вполне можно ожидать, что вы узнаете, как фосфорная (V) кислота реагирует с чем-то вроде раствора гидроксида натрия. Если вы посмотрите на структуру, вы увидите, что она имеет три группы -ОН, и каждая из них имеет кислый атом водорода. Вы можете провести реакцию с гидроксидом натрия в три стадии, причем один за другим эти атомы водорода вступают в реакцию с ионами гидроксида. Опять же, если бы вы реагировали непосредственно оксидом фосфора (V) с раствором гидроксида натрия, а не сначала производили кислоту, вы бы получили те же возможные соли. Это становится смешным, поэтому я приведу только один пример из возможных уравнений: | |||||||||||||||
Примечание: Если на экзамене вам задают вопрос, в котором вам просто предлагается написать уравнение реакции гидроксида натрия с фосфорной (V) кислотой, какое уравнение вам следует написать? Это не имеет особого значения — все они совершенно верны.  В каждом случае это просто зависит от пропорций двух используемых вами реагентов. В каждом случае это просто зависит от пропорций двух используемых вами реагентов.Если вы действительно хотите быть уверенным, проверьте прошлые документы и отметьте схемы. Я нашел один вопрос о реакции между оксидом натрия и фосфорной (V) кислотой, где схема маркировки принимала любое из возможных уравнений — чего я и ожидал. (Я знаю, что не давал вам этот конкретный набор уравнений, но их нетрудно разработать, если вы понимаете принцип, и я не могу привести каждое отдельное кислотно-основное уравнение. Это уже давно страница будет длиться вечно, и все в отчаянии сдадутся задолго до конца! Вот почему вы пытаетесь понять химию, а не изучать ее как попугай.) Пожалуйста, не тратьте время на изучение уравнений — или, по крайней мере, до тех пор, пока вы не узнаете и не поймете всю остальную химию, которую вам нужно знать и понимать! У любого уравнения очень мало шансов пройти экзамен, даже если оно входит в вашу конкретную программу. Жизнь слишком коротка, чтобы тратить время на изучение уравнений. | |||||||||||||||
Оксиды серы Мы будем рассматривать диоксид серы, SO 2 , и триоксид серы, SO 3 . Диоксид серы Диоксид серы хорошо растворяется в воде, реагируя с ней, давая раствор, известный как сернистая кислота, который традиционно имеет формулу H 2 SO 3 . Однако основным веществом в растворе является просто гидратированный диоксид серы — SO 2 , xH 2 O. Спорный вопрос, существует ли вообще в растворе какая-либо H 2 SO 3 как таковая. Сернистая кислота также является слабой кислотой с pK a около 1.8 — немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты снова будет иметь pH около 1. . | |||||||||||||||
Примечание: Существует некоторая изменчивость значений pK и для серной кислоты, указанных различными источниками — от 1,77 до 1,92. У меня нет возможности узнать, что из этого правильное. Ионизация «серной кислоты» включает ионизацию гидратированного комплекса, и вам не нужно беспокоиться об этом на этом уровне. | |||||||||||||||
Диоксид серы также будет напрямую реагировать с основаниями, такими как раствор гидроксида натрия. Если диоксид серы барботируют через раствор гидроксида натрия, сначала образуется раствор сульфита натрия, а затем раствор гидрогенсульфита натрия, когда диоксид серы оказывается в избытке. | |||||||||||||||
Примечание: Сульфит натрия также называют сульфатом натрия (IV).Гидросульфит натрия также является гидросульфатом натрия (IV) или бисульфитом натрия. Обратите внимание, что уравнения для этих реакций отличаются от примеров для фосфора. В этом случае мы реагируем непосредственно оксид с гидроксидом натрия, потому что мы, скорее всего, будем это делать именно так. | |||||||||||||||
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (сульфата кальция (IV)).Это лежит в основе одного из методов удаления диоксида серы из дымовых газов на электростанциях. Триоксид серы Триоксид серы бурно реагирует с водой с образованием тумана из концентрированных капель серной кислоты. | |||||||||||||||
Примечание: Если вы знаете о контактном процессе производства серной кислоты, вы знаете, что триоксид серы всегда преобразуется в серную кислоту с помощью циклического процесса, чтобы избежать проблемы сернокислотного тумана. Если вам интересно, вы можете найти подробную информацию о процессе обращения в другом месте на этом сайте, но это не относится к текущей теме. | |||||||||||||||
Чистая неионизированная серная кислота имеет структуру: Серная кислота — сильная кислота, и растворы обычно имеют pH около 0. Кислота реагирует с водой, давая ион гидроксония (ион водорода в растворе, если хотите) и ион сероводорода.Эта реакция проходит практически на 100%. Второй водород удалить труднее. На самом деле ион гидросульфата является относительно слабой кислотой, по силе сходной с кислотами, которые мы уже обсуждали на этой странице. На этот раз вы получите равновесие: Серная кислота, конечно, имеет все реакции сильной кислоты, с которыми вы знакомы из вводных курсов химии. Например, нормальная реакция с раствором гидроксида натрия заключается в образовании раствора сульфата натрия, в котором оба кислых водорода реагируют с ионами гидроксида. В принципе, вы также можете получить раствор гидросульфата натрия, используя вдвое меньше гидроксида натрия и просто реагируя с одним из двух кислых водородов в кислоте. На практике лично я никогда этого не делал — на данный момент не вижу особого смысла! Сам по себе триоксид серы также вступает в непосредственную реакцию с основаниями с образованием сульфатов. Например, он будет реагировать с оксидом кальция с образованием сульфата кальция. Это похоже на реакцию с диоксидом серы, описанную выше. Оксиды хлора Хлор образует несколько оксидов, но единственными двумя, упомянутыми в любой из учебных программ уровня A Великобритании, являются оксид хлора (VII), Cl 2 O 7 , и оксид хлора (I), Cl 2 O. Хлор ( VII) оксид также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора. Оксид хлора (VII) Оксид хлора (VII) — это высший оксид хлора — хлор находится в максимальной степени окисления +7.Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, также известной как хлорная кислота. PH типичных растворов, как и серной кислоты, будет около 0, .Неионизированная хлорная (VII) кислота имеет структуру: Вероятно, вам это не понадобится для целей UK A level (или его эквивалентов), но это полезно, если вы понимаете причину, по которой хлорная (VII) кислота является более сильной кислотой, чем хлорная (I) кислота (см. Ниже) .Вы можете применить те же рассуждения к другим кислотам на этой странице. Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери иона водорода (например, когда он реагирует с водой), заряд может быть делокализован по каждому атому кислорода в ионе. Это делает его очень стабильным и означает, что хлорная (VII) кислота очень сильна. | |||||||||||||||
Примечание: Это похоже на делокализацию, которая происходит в этаноат-ионе, образующемся, когда этановая кислота ведет себя как слабая кислота.Вы найдете это более подробно на странице, посвященной органическим кислотам. Используйте кнопку НАЗАД в браузере, если вы решите перейти по этой ссылке. | |||||||||||||||
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII). Сам оксид хлора (VII) также реагирует с раствором гидроксида натрия с образованием того же продукта. Оксид хлора (I) Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).Он до некоторой степени реагирует с водой с образованием хлорноватистой (I) кислоты HOCl, также известной как хлорноватистая кислота. | |||||||||||||||
Примечание: Вы также можете найти хлорную (I) кислоту, записанную как HClO. Форма, которую я использовал, более точно отражает способ соединения атомов. | |||||||||||||||
Структура хлорноватой (I) кислоты точно такая же, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образовавшегося в результате потери водорода. Это означает, что образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой водород, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43). Хлорная (I) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия). Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта.
В меню «Период 3».. . В меню «Неорганическая химия». . . В главное меню. . . © Джим Кларк 2005 (последнее изменение — ноябрь 2015 г.) | |||||||||||||||
Кислотно-основное поведение оксидов
На этой странице обсуждаются реакции оксидов элементов периода 3 (натрия в хлор) с водой, а также с кислотами или основаниями, где это необходимо (как и раньше, аргон опускается, потому что он не образуют оксид).
Краткое описание тенденции
Оксиды: Представляющие интерес оксиды приведены ниже:
| Na 2 O | MgO | Al 2 O 3 | SiO 2 | P 4 O 10 | СО 3 | Класс 2 О 7 |
| P 4 O 6 | СО 2 | Класс 2 О |
Тенденцию кислотно-щелочного поведения можно резюмировать следующим образом:
Кислотность увеличивается слева направо, от сильноосновных оксидов слева до сильнокислых справа, с амфотерным оксидом (оксидом алюминия) в середине.Амфотерный оксид — это оксид, который проявляет как кислотные, так и основные свойства.
Эта тенденция применима только к самым высоким оксидам отдельных элементов (см. Верхнюю строку таблицы) с наивысшими степенями окисления для этих элементов. Для других оксидов картина менее ясна. Кислотность неметаллических оксидов определяется в терминах кислотных растворов, образующихся в реакциях с водой — например, триоксид серы реагирует с водой с образованием серной кислоты. Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия, как подробно описано ниже.
Оксид натрия
Оксид натрия — простой сильноосновной оксид. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к соединению с ионами водорода.
Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствора гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14.
\ [Na_2O + H_2O \ стрелка вправо 2NaOH \]
Реакция с кислотами: Оксид натрия, как сильное основание, реагирует также с кислотами.Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия.
\ [Na_2O + 2HCl \ стрелка вправо 2NaCl + H_2O \]
Оксид магния
Оксид магния — еще один простой основной оксид, который также содержит ионы оксидов. Однако он не такой сильно основной, как оксид натрия, потому что ионы оксида не так слабо связаны. В оксиде натрия твердое вещество удерживается вместе за счет притяжения между ионами 1+ и 2-. В оксиде магния притяжение составляет от 2+ до 2- ионов.Из-за более высокого заряда металла требуется больше энергии, чтобы разорвать эту ассоциацию. Даже с учетом других факторов (таких как энергия, выделяемая при ионно-дипольном взаимодействии между катионами и водой), общий эффект заключается в том, что реакции с участием оксида магния всегда будут менее экзотермическими, чем реакции оксида натрия.
Реакция с водой: На первый взгляд, порошок оксида магния не реагирует с водой. Однако pH полученного раствора составляет около 9, что указывает на образование гидроксид-ионов.Фактически, в реакции образуется некоторое количество гидроксида магния, но, поскольку этот компонент почти нерастворим, фактически растворяется небольшое количество гидроксид-ионов. Реакция показана ниже:
\ [MgO + H_2O \ стрелка вправо Mg (OH) _2 \]
Взаимодействие с кислотами: Оксид магния реагирует с кислотами, как и предполагалось для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
\ [MgO + 2HCl \ стрелка вправо MgCl_2 + H_2O \]
Оксид алюминия
Описание свойств оксида алюминия может сбивать с толку, поскольку он существует в нескольких различных формах.Одна из этих форм очень инертна (химически известна как альфа-Al 2 O 3 ) и производится при высоких температурах. Следующие ниже реакции касаются более реакционноспособных форм молекулы. Оксид алюминия амфотерный. Он вступает в реакцию и как основание, и как кислота.
Реакция с водой: Оксид алюминия не растворяется в воде и не реагирует подобно оксиду натрия и оксиду магния. Ионы оксида слишком прочно удерживаются в твердой решетке, чтобы реагировать с водой.
Реакция с кислотами: Оксид алюминия содержит ионы оксида и поэтому реагирует с кислотами так же, как оксиды натрия или магния. Оксид алюминия реагирует с горячей разбавленной соляной кислотой с образованием раствора хлорида алюминия.
\ [Al_2O_3 + 6HCl \ стрелка вправо 2AlCl_3 + 3H_2O \]
Эта и другие реакции демонстрируют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, как показано в его реакциях с основаниями, такими как гидроксид натрия.Существуют различные алюминаты (соединения, в которых алюминий является компонентом отрицательного иона), что возможно, потому что алюминий может образовывать ковалентные связи с кислородом. Это возможно, потому что разница электроотрицательностей между алюминием и кислородом мала, в отличие от разницы между натрием и кислородом, например (электроотрицательность увеличивается за период)
Оксид алюминия реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветного раствора тетрагидроксоалюмината натрия:
\ [Al_2O_3 + 2NaOH + 3H_2O \ стрелка вправо 2NaAl (OH) _4 \]
Диоксид кремния (оксид кремния (IV))
Кремний слишком похож по электроотрицательности на кислород, чтобы образовывать ионные связи.Следовательно, поскольку диоксид кремния не содержит оксидных ионов, он не имеет основных свойств. На самом деле он очень слабокислый, реагирует с сильными основаниями.
Взаимодействие с водой: Диоксид кремния не реагирует с водой из-за термодинамической сложности разрушения его ковалентной сетевой структуры.
Реакция с основаниями : Диоксид кремния реагирует с горячим концентрированным раствором гидроксида натрия, образуя бесцветный раствор силиката натрия:
\ [SiO_2 + 2NaOH \ стрелка вправо Na_2SiO_3 + h3O \]
В другом примере реакции кислого диоксида кремния с основанием, извлечения железа в доменной печи, оксид кальция из известняка реагирует с диоксидом кремния с образованием жидкого шлака, силиката кальция:
\ [SiO_2 + CaO \ стрелка вправо CaSiO_3 \]
Оксиды фосфора
Здесь рассматриваются два оксида фосфора: оксид фосфора (III) P 4 O 6 и оксид фосфора (V) P 4 O 10 .
Оксид фосфора (III): Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабой кислоты, H 3 PO 3 — известной как фосфористая кислота, ортофосфористая кислота или фосфоновая кислота:
\ [P_4O_6 + 6H_2O \ rightarrow 4H_3PO_3 \]
Структура полностью протонированной кислоты показана ниже:
Протоны остаются связанными до тех пор, пока не будет добавлена вода; даже в этом случае, поскольку фосфорная кислота является слабой кислотой, некоторые молекулы кислоты депротонируются.Фосфорная кислота имеет pK a , равное 2,00, что является более кислым, чем обычные органические кислоты, такие как этановая кислота (pK a = 4,76).
Маловероятно, что оксид фосфора (III) непосредственно взаимодействует с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислотными, а третий атом водорода — нет. Следовательно, есть две возможные реакции с основанием, таким как гидроксид натрия, в зависимости от количества добавленного основания:
\ [NaOH + H_3PO_3 \ rightarrow NaH_2PO_3 + H_2O \]
\ [2NaOH + H_3PO_3 \ rightarrow Na_2HPO_3 + 2H_2O \]
В первой реакции только один из протонов реагирует с гидроксид-ионами основания.Во втором случае (используя вдвое больше гидроксида натрия) реагируют оба протона.
Если вместо этого оксид фосфора (III) вводить в реакцию непосредственно с раствором гидроксида натрия, возможны те же соли:
\ [4NaOH + P_4O_6 + 2H_2O \ стрелка вправо 4NaH_2PO_3 \]
\ [9NaOH + P_4O_6 \ стрелка вправо 4Na_2HPO_3 + 2H_2O \]
Оксид фосфора (V): Оксид фосфора (V) бурно реагирует с водой с образованием раствора, содержащего смесь кислот, природа которой зависит от условий реакции.Обычно рассматривается только одна кислота, фосфорная (V) кислота, H 3 PO 4 (также известная как фосфорная кислота или ортофосфорная кислота).
\ [P_4O_ {10} + 6H_2O \ rightarrow 4H_3PO_4 \]
На этот раз полностью протонированная кислота имеет следующую структуру:
Фосфорная (V) кислота — еще одна слабая кислота с pK a , равным 2,15, что незначительно слабее, чем фосфористая кислота. Растворы каждой из этих кислот с концентрацией около 1 моль дм -3 имеют pH около 1.
Оксид фосфорной кислоты (V) также вряд ли будет напрямую реагировать с основанием, но гипотетические реакции рассматриваются. В кислотной форме молекула имеет три кислотные группы -ОН, которые могут вызывать трехстадийную реакцию с гидроксидом натрия:
\ [NaOH + H_3PO_4 \ rightarrow NaH_2PO_4 + H_2O \]
\ [2NaOH + H_3PO_4 \ rightarrow Na_2HPO_4 + 2H_2O \]
\ [3NaOH + H_3PO_4 \ rightarrow Na_3PO_4 + 3H_2O \]
Подобно оксиду фосфора (III), если оксид фосфора (V) взаимодействует непосредственно с раствором гидроксида натрия, образуется такая же возможная соль, как на третьей стадии (и только эта соль):
\ [12NaOH + P_4O_ {10} \ rightarrow 4Na_3PO_4 + 6H_2O \]
Оксиды серы
Рассматриваются два оксида: диоксид серы SO 2 и триоксид серы SO 3 .
Диоксид серы: Диоксид серы хорошо растворяется в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), H 2 SO 3 , как показано в реакции ниже. Этот вид существует только в растворе, и при любой попытке его изолировать выделяется диоксид серы.
\ [SO_2 + H_2O \ стрелка вправо H_2SO_3 \]
Протонированная кислота имеет следующую структуру:
Сернистая кислота также является относительно слабой кислотой с pK a около 1.8, но немного сильнее, чем две указанные выше фосфорсодержащие кислоты. Достаточно концентрированный раствор сернистой кислоты имеет pH около 1.
.Диоксид серы также напрямую реагирует с основаниями, такими как раствор гидроксида натрия. Барботирование диоксида серы через раствор гидроксида натрия сначала образует раствор сульфита натрия, а затем раствор гидросульфита натрия, если диоксид серы находится в избытке.
\ [SO_2 + 2NaOH \ стрелка вправо Na_2SO_3 + H_2O \]
\ [Na_2SO_3 + H_2O \ rightarrow 2NaHSO_3 \]
Другая важная реакция диоксида серы — с основным оксидом кальция с образованием сульфита кальция (также известного как сульфат кальция (IV)).Это один из важных методов удаления диоксида серы из дымовых газов на электростанциях.
\ [CaO + SO_2 \ стрелка вправо CaSO_3 \]
Триоксид серы: Триоксид серы бурно реагирует с водой с образованием тумана из капель концентрированной серной кислоты.
\ [SO_3 + H_2O \ rightarrow H_2SO_4 \]
Чистая, полностью протонированная серная кислота имеет структуру:
Серная кислота — сильная кислота, и растворы обычно имеют pH около 0.{2-} (водн.) \]
Это полезно, если вы понимаете причину, по которой серная кислота является более сильной кислотой, чем серная кислота. Вы можете применить те же рассуждения к другим кислотам, которые вы найдете на этой странице.
Серная кислота сильнее серной кислоты, потому что, когда ион водорода теряется из одной из групп -ОН серной кислоты, отрицательный заряд, оставшийся на кислороде, распространяется (делокализуется) по иону за счет взаимодействия с кислородом с двойной связью. атомы. Отсюда следует, что большее количество атомов кислорода с двойной связью в ионе делает возможной большую делокализацию; большая делокализация приводит к большей стабильности, что снижает вероятность рекомбинации иона с ионом водорода и его превращения в неионизированную кислоту.
Серная кислота имеет только один кислород с двойной связью, тогда как серная кислота имеет два; дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, гораздо более стабильный ион и более сильную кислоту. Серная кислота проявляет все реакции, характерные для сильной кислоты. Например, при реакции с гидроксидом натрия образуется сульфат натрия; в этой реакции оба кислых протона реагируют с гидроксид-ионами, как показано:
\ [2NaOH + H_2SO_4 \ стрелка вправо Na_2SO_4 + 2H_2O \]
В принципе, гидросульфат натрия можно получить, используя вдвое меньше гидроксида натрия; в этом случае удаляется только один из кислых атомов водорода.
Сам по себе триоксид серы также напрямую реагирует с основаниями, такими как оксид кальция, с образованием сульфата кальция:
\ [CaO + SO_3 \ стрелка вправо CaSO_4 \]
Эта реакция аналогична описанной выше реакции с диоксидом серы.
Оксиды хлора
Хлор образует несколько оксидов, но здесь рассматриваются только два (оксид хлора (VII), Cl 2 O 7 и оксид хлора (I), Cl 2 O). Оксид хлора (VII) также известен как гептоксид дихлора, а оксид хлора (I) — как монооксид дихлора.
Оксид хлора (VII): Оксид хлора (VII) является высшим оксидом хлора — атом хлора находится в максимальной степени окисления +7. Он продолжает тенденцию высших оксидов элементов периода 3 к тому, чтобы быть более сильными кислотами. Оксид хлора (VII) реагирует с водой, давая очень сильную кислоту, хлорную (VII) кислоту, также известную как хлорная кислота.
\ [Cl_2O_7 + H_2O \ стрелка вправо 2HClO_4 \]
Как и в серной кислоте, pH типичных растворов хлорной кислоты составляет около 0.Нейтральная хлорная (VII) кислота имеет следующую структуру:
Когда ион хлората (VII) (перхлорат-ион) образуется в результате потери протона (например, в реакции с водой), заряд делокализован по каждому атому кислорода в ионе. Это делает ион очень стабильным, а хлорную (VII) кислоту очень сильной.
Хлорная (VII) кислота реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (VII):
\ [NaOH + HClO_4 \ стрелка вправо NaClO_4 + h3O \]
Сам по себе оксид хлора (VII) также непосредственно реагирует с раствором гидроксида натрия с образованием того же продукта:
\ [2NaOH + Cl_2O_7 \ стрелка вправо 2NaClO_4 + H_2O \]
Оксид хлора (I): Оксид хлора (I) намного менее кислый, чем оксид хлора (VII).- \) также известна как хлорноватистая кислота.
\ [Cl_2O + H_2O \ rightleftharpoons 2HOCl \]
Структура хлорноватой (I) кислоты точно такая же, как показано ее формулой HOCl. У него нет атомов кислорода с двойными связями и нет способа делокализации заряда по отрицательному иону, образованному в результате потери водорода. Следовательно, образовавшийся отрицательный ион не очень стабилен и легко восстанавливает свой протон, чтобы превратиться в кислоту. Хлорная (I) кислота очень слабая (pK a = 7,43) и реагирует с раствором гидроксида натрия с образованием раствора хлората натрия (I) (гипохлорита натрия):
\ [NaOH + HOCl \ rightarrow NaOCl + H_2O \]
Оксид хлора (I) также напрямую реагирует с гидроксидом натрия с образованием того же продукта:
\ [2NaOH + Cl_2O \ стрелка вправо 2NaOCl + H_2O \]
Оксид | химическое соединение | Британника
Оксид , любой из большого и важного класса химических соединений, в котором кислород сочетается с другим элементом.За исключением более легких инертных газов (гелий [He], неон [Ne], аргон [Ar] и криптон [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
Как металлы, так и неметаллы могут достигать своих высших степеней окисления (т. Е. Отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные металлы и щелочноземельные металлы, а также переходные металлы и постпереходные металлы (в их более низких степенях окисления) образуют ионные оксиды — т.е.е., соединения, содержащие анион O 2-. Металлы с высокой степенью окисления образуют оксиды, связи которых имеют более ковалентную природу. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионного к ковалентному наблюдается по мере перехода таблицы Менделеева от металлов слева к неметаллам справа. Такое же изменение наблюдается в реакции оксидов с водой и, как следствие, кислотно-щелочном характере продуктов.Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих ион OH — ) и образующихся основных растворов, тогда как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. таблицу).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
| Источник: Источник: W.Робинсон, Дж. Одом и Х. Хольцкло-младший, Химия: концепции и модели, D.C. Heath and Co., 1992. | |||||||
| реакция оксидов с водой и кислотно-основной характер гидроксидов | Na 2 O дает NaOH (сильное основание). | MgO дает Mg (OH) 2 (слабое основание) | Al 2 O 3 не реагирует | SiO 2 не реагирует | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Cl 2 O 7 дает HClO 4 (сильная кислота) |
| связь в оксидах | Na 2 O ионный | MgO ионный | Al 2 O 3 ионный | SiO 2 ковалентный | P 4 O 10 ковалентный | SO 3 ковалентный | Cl 2 O 7 ковалентный |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами.Таким образом, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические простые эфиры.
Оксиды металлов
Оксиды металлов — это твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных кислородных соединений: (1) оксиды, содержащие ионы оксидов, O 2-, (2) пероксиды, содержащие ионы пероксидов, O 2 2-, которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 — , которые также имеют ковалентные связи кислород-кислород, но с одним отрицательным зарядом меньше, чем ионы пероксида. Щелочные металлы (которые имеют степень окисления +1) образуют оксиды, M 2 O, пероксиды, M 2 O 2 , и супероксиды, MO 2 .(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2MNO 3 + 10M + тепло → 6M 2 O + N 2 Обычное получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 И оксиды щелочных металлов, и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M (OH) 2 (где M = металл группы 2)
Таким образом, эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-основных реакциях с образованием солей и воды; Например,
M 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1).
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Периодические тренды оксидов тщательно изучены. В любой данный период связывание в оксидах прогрессирует от ионного к ковалентному, и их кислотно-основной характер изменяется от сильно основного до слабоосновного, амфотерного, слабокислого и, наконец, сильнокислого. В общем, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO
p2o5 кислый или щелочной
Под действием Бренстеда-Лоури Ион водорода может оторваться от группы -ОН и перейти на основание.Кто был премьер-министром после Уинстона Черчилля? N не является металлом, поэтому его оксид будет кислым. Состав. Фосфор, являясь неметаллом, образует кислые оксиды, такие как P2O5. Каким был индекс Standard and Poors 500 на 31 декабря 2007 года? Sb имеет гораздо более металлический характер, чем P, поэтому Sb (OH) 3, вероятно, будет иметь гораздо более простое поведение. с основаниями являются кислыми… Na2O, MgO, CaO, FeO и CuO являются примерами основных оксидов. Основной оксид — это оксид, который в сочетании с водой дает основу. прокомментируйте кислотный или основной характер оксида фосфора P2O5 (который на самом деле существует как молекулярный P4O10), как это было предсказано его положением в периодической таблице и его классификацией как металл или неметалл…. пожалуйста, умные люди, мне нужна помощь в ближайшее время: раствор не является ни кислотным, ни щелочным. Итого: 0. Смотрите ответ. KCl — это соль. Каковы даты выхода The Wonder Pets — 2006 Save the Ladybug? Эти основные аминокислоты классифицируются таким образом, потому что они имеют основные боковые цепи, содержащие азот, которые напоминают аммиак (основание). Оксиды могут быть основными, кислотными или амфотерными. кислотный характер оксида также увеличивается. Они соединяются с водой с образованием гидроксидов металлов, которые обычно называют основаниями.Мы исследуем их под четырьмя заголовками; кислые и основные оксиды, нейтральные оксиды, амфотерные оксиды и пероксиды; 1) Кислые оксиды: это оксиды, которые соединяются с основаниями и образуют соли. Когда у Элизабет Беркли появилась щель между передними зубами? Na2O является основным, а p2o5 — кислым, почему? Это означает, что кислотная сила оксидов увеличивается при перемещении слева направо в периодической таблице. P2O5, или пятиокись фосфора, представляет собой оксид. 27 октября 2020 г. Можно ли искать сразу на всех сайтах eBay для разных стран? Под Lewis C неметалл, поэтому его оксид будет кислым.Бесплатная электронная почта. SiO2 4. Как проявляется романтика в мышах и людях? Помните, что металлы обычно образуют основные оксиды, а НЕМЕТАЛЛЫ обычно образуют КИСЛОТЫЕ ОКСИДЫ. P2O5, поскольку он растворяется в основании, считается кислым. Оба образуют кислую… Правильный вариант (в) N2O5. Это мощный осушающий и обезвоживающий агент. Где Беула и Берти жили в ответном огне истории из-за голого постукивания? Резюме: Белок, кодируемый этим геном, является нейрон-специфическим активатором киназы CDK5. SO3 А. Al2O3 3.E. может действовать как основание Льюиса, отдавая электронные пары. P2O3 10. Основываясь на их кислотно-основных характеристиках, оксиды классифицируются как кислые, основные, амфотерные или нейтральные: оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. Как долго продержатся следы на Луне? Аналогично, NaF является основным (это соль сильного основания NaOH и слабой кислоты HF). Напишите химическую формулу и назовите кислоту (включая «кислота») или основание, образовавшееся в результате реакции с водой. Это нормально, когда лекарство выходит из носа после удаления миндалин? Когда у Элизабет Беркли появилась щель между передними зубами? Ифу Лю 1: Представьте свои наблюдения и результаты в табличной форме.Пожалуйста, войдите или зарегистрируйтесь, чтобы добавить комментарий. Такой раствор кислый. N2O5 5. Химия. Оксиды классифицируются на нейтральные, амфотерные и основные или кислые в зависимости от их кислотно-основных характеристик. Если это соль, она должна образовывать ионы в растворе. Когда органная музыка стала ассоциироваться с бейсболом? Группа $ \ ce {OH} $ не очень хорошая уходящая группа. фосфорная кислота подходит, но не пятиокись фосфора. оксиды реагируют с водой, образуют основания. Тенденция кислотно-основного поведения проявляется в различных реакциях, но вкратце: тенденция — от сильно основных оксидов в левой части к сильнокислотным в правой части через амфотерный оксид (оксид алюминия) в середина.Например, бикарбонат натрия (NaHCO 3) будет записан как Na + и HCO 3 — потому что соль будет диссоциировать, но бикарбонат не будет диссоциировать (это слабая кислота) .. Нейтрализация []. Zn0 = амфотерный. Меньше… Обычно, чем лучше вы извлекаете или завариваете, тем менее кислый или вредный кофе. Значения pKa основных аминокислот достаточно высоки, чтобы связывать протоны и давать им положительный заряд. определение, кислоты — это соединения, которые отдают протоны, определение Что такое заповедники, национальные парки, биосферные заповедники? Элемент с электронным расположением 1s2 2s2 2p6 3s2 будет образовывать 1) Кислый оксид 2) Основной оксид 3) Нейтральный оксид 4) Амфотерный оксид 11.Д. при растворении в воде дает раствор фосфорной кислоты h4PO4. 1. O 2 2− + H 2 O → O 2 H — + OH — O 2 H — + H 2 O ⇌ H 2 O 2 + OH — Пероксиды также являются сильными окислителями. P4O10 классифицируется как кислый оксид, потому что он. Ангидриды кислот — это химические соединения, известные как оксиды, которые образуются при удалении воды из кислоты. Оба образуют кислые N2O5 и P2O5 соответственно. Как долго продержатся следы на Луне? Причина: неметаллический характер уменьшается. В чем конфликт рассказа «Синиган» Марби Вильясерана? А виды, которые не проявляют кислотных или основных свойств при химическом соединении с водой, известны как… Аминокислоты являются строительными блоками белков.Более основным оксидом является 1) CaO 2) MgO 3) K2O 4) Na2O 10. Кислотные и основные свойства и окислительная активность н-бутана и 1-бутена были изучены для катализаторов V 2 O 5 P 2 O 5, приготовленных шесть методов. Формула Тип Химическое название CaO I Оксид кальция C 2 H 2 M Дигидрид дикарбона LiOH I Гидроксид лития SO 3 M Оксиды триоксида серы, вступающие в реакцию с кислотами, являются основными. Если кислые оксиды реагируют с водой, они образуют кислоты. [email protected]; 1. А. реагирует с кислотами с образованием соли. С другой стороны, когда кислород соединяется с металлом, это приводит к образованию основного оксида.Оксид алюминия амфотерный по своей природе. Итак, пентаоксид фосфора — это кислотный оксид. Когда кислород соединяется с неметаллом, это приводит к образованию кислого оксида. Правильно сопоставьте следующий список — 1 Список — 2 A) Ba (OH) 2 1) Кислый B) CO 2) Основной… Каковы недостатки первичной группы? Авторские права © 2020 Multiply Media, LLC. Какое влияние оказал торрент на рассказчика и волноходца? Какие факторы имеют решающее значение для успеха электронных каналов? Сначала рассмотрим нейтрализацию сильной кислоты сильным основанием.Приготовление и извлечение кофе могут многое сказать о его кислотной или щелочной природе. Неметаллические оксиды в воде дают кислоту. Если неметаллы вступают в реакцию. Из-за этого, когда кислота растворяется в воде, баланс между ионами водорода и гидроксид-ионами смещается. Авторские права © 2020 Multiply Media, LLC. Кто был премьер-министром после Уинстона Черчилля? Пятиокись фосфора кристаллизуется по крайней мере в четырех формах или полиморфах. Наиболее известная, метастабильная форма, показанная на рисунке, состоит из молекул P 4 O 10.Слабые силы Ван-дер-Ваальса удерживают эти молекулы вместе в гексагональной решетке (однако, несмотря на высокую симметрию молекул, кристаллическая упаковка не является плотной упаковкой). Пример. Ключевое различие — кислотные и основные аминокислоты. Сила кислоты или основания указывается ее положением равновесия, когда кислота или основание добавляются в воду. 2. Щелкните здесь, чтобы получить ответ на свой вопрос ️ какой из них более кислый p2o5 или sio2 1. Кислотно-оксидная основная соленая вода. P не является металлом, поэтому его оксид будет кислым P2O5 + 3h3O → 2h4PO4 9.Ответ на вопрос: Рассчитайте pH раствора с (h4O +) = 0,00423. Оксиды могут реагировать с водой с образованием кислот или оснований. Почему шаровое скопление M13 было выбрано в качестве цели для сообщения Аресибо 1974 года? Все права защищены. Войдите в систему. При растворении в воде сахар не производит H + или OH-. Это белое кристаллическое твердое вещество представляет собой ангидрид фосфорной кислоты. Б. не растворяется в воде. Скидка 75% на весь сайт * Скидка на отдельные продукты на всем сайте. Рассчитайте pOH, [H +] и [OH-1] каждого раствора. Процедура: 1.Если основной. Кислотность: N2O5> P2O5. Определите, является ли раствор кислотным, нейтральным или основным. Средняя школа. Пояснение: Фосфор — неметалл. Кислый (в первую очередь) B. Fe203 является основным. По мере увеличения значения электроотрицательности элемента. Щелкните и перетащите бумагу в пробирку, затем сопоставьте ее… основание, и в этом случае пятиокись фосфора классифицируется как кислота. P2O5, или пятиокись фосфора, представляет собой оксид. Теперь в растворе больше ионов водорода, чем гидроксид-ионов. природа оксидов зависит от того, будет ли он реагировать с кислотами или основаниями.Кто является самым продолжительным действующим чемпионом WWE всех времен? Он связывается с CDK5 с образованием активной киназы. Считать ли пентоксид фосфора кислотой, зависит от того, какие материалы на этом сайте нельзя воспроизводить, распространять, передавать, кэшировать или иным образом использовать без предварительного письменного разрешения Multiply. Например, в растворе в воде: фенол — очень слабая кислота, и положение равновесия находится значительно левее. Каковы даты выхода The Wonder Pets — 2006 Save the Ladybug? первый имеет наивысшую электроотрицательность (EN), поэтому его оксид наиболее кислый.Перекись натрия (Na 2 O 2) используется как отбеливающий агент. Он отбеливает, окисляя цветные соединения до бесцветных. Ответ: Хотя натрий и фосфор относятся к одному периоду, но натрий — это металл, а фосфор — неметалл. Основные (в первую очередь) C. Амфотерные (ситтеры) Ключевое различие между кислотными и основными аминокислотами состоит в том, что кислые аминокислоты имеют кислотные боковые цепи, тогда как основные аминокислоты имеют основные боковые цепи при нейтральном pH. Помните, что металлы обычно образуют основные оксиды, а НЕМЕТАЛЛЫ обычно образуют КИСЛОТЫЕ ОКСИДЫ.Щелкните здесь, чтобы получить ответ на свой вопрос ️ Среди (a) Na2O, (b) MgO, (c) Al2O3, (d) P2O5, (e) Cl2O7, самым основным, наиболее кислым и амфотерным оксидом может быть соответственно: Пятиокись мышьяка растворяется и становится жидкостью, впитывая… Все права защищены. Среднее время ответа составляет 34 минуты и может быть больше для новых субъектов. Когда органная музыка стала ассоциироваться с бейсболом? И наоборот, это основание, если оно выделяет гидроксид-ионы (ОН-) в растворе. Соли состоят из связанного количества катионов (положительно заряженных ионов) и анионов (отрицательных ионов), так что продукт является электрически нейтральным (без чистого заряда).Растворы этих пероксидов являются основными из-за реакции иона пероксида с водой, которая в этом случае действует как слабая кислота. Основные оксиды всегда являются оксидами металлов. з) Хотя и натрий, и фосфор присутствуют в один и тот же период периодической таблицы Менделеева, их оксиды различаются по природе, Na2O является основным, а P2O5 является кислым по природе. Оксиды неметаллов, такие как P2O3, являются кислыми. Почему библиотеки не пахнут книжными магазинами? N и P — неметаллы. Кислота — это вещество, которое отдает ионы водорода.Гидролиз диоксида углерода и диоксида серы: 2: Сбалансированные химические уравнения для гидролиза оксида магния (MgO), пятиокиси фосфора (P2O5), диоксида углерода (CO2) и диоксида серы (SO2). Природа оксидов зависит от природы элемента, образующего оксиды. Среди Al2O3, SiO2, P2O3 и SO2 правильный порядок силы кислоты — p-Блок. Среди Al 2 O 3, SiO 2, P 2 O 3 и SO 2 правильный порядок силы кислоты. А виды, которые не проявляют кислотных или основных свойств при химическом соединении с водой, известны как нейтральные оксиды.В химии соль — это ионное соединение, которое может быть образовано реакцией нейтрализации кислоты и основания. Ключевые слова: ионные, молекулярные или кислотные (Honors Chemistry). Напишите, какой это тип соединения, ионное, молекулярное или кислотное. Почему библиотеки не пахнут книжными магазинами? Ответ на вопрос: Ваше имя: Ответы. Однако фенол достаточно кислый, чтобы иметь узнаваемые кислотные свойства, даже если это все еще очень слабая кислота. Ответьте на этот вопрос. Итак, оксид фосфора имеет кислую природу.Многие кислоты и основания Бренстеда легко распознать, потому что у них есть очевидное место для передачи или принятия протона (например, нет изменения pH KCl + h30 -> K2O + HCl, ни OH-, ни H + не образуются, что могло бы сделать его либо более кислый, либо более щелочной. 0. Предскажите для каждого вещества ниже, является ли оно кислотным, основным или нейтральным. Когда вещество вступает в химическую реакцию, как основание, так и кислота, это называется амфотерным раствором. элемент + кислород —- -> оксид (кислотный / основной) оксид + вода -> кислота или основание.Амфотерный раствор — это вещество, которое может химически реагировать как кислота или основание. Кислотный основной нейтральный банк ответов H-10 x 10 JOh2 -3,8 x 10 [*] = 61 x 10 »OH I8,7 x 10- pH 8,49 пл 7,00 H ‘] = 6,0 x 10-12 pH = 4,26 Пятиокись фосфора представляет собой химическое соединение с молекулярной формулой P4O10 (общее название происходит от его эмпирической формулы P2O5). CO2 9. Присоединяйтесь сейчас. Классифицируйте каждый из следующих оксидов в зависимости от того, является ли он основным, кислотным или амфотерным. NaCl нейтрален. CaO 2.(Кислотность оксидов уменьшается). Они могут быть восстановлены до первичных аминов под действием алюмогидрида лития или гидролизованы до карбоновых кислот в присутствии кислоты или основания. Li — это металл, поэтому его оксид будет основным. Классифицируйте каждый водный раствор как кислый, щелочной или нейтральный при 25 ° C. Менее летучая кислота всегда вытесняет более летучую кислоту. Цепочка аминокислот известна как полипептид, а комбинация нескольких полипептидных цепей образует молекулу белка. В чем конфликт истории марби виллэсерана «Синиган»? Если металлы вступают в реакцию с кислородом, они образуют основные оксиды.Твитнуть. Пояснение: Как среди N, P, As и Sb. Другие статьи, в которых обсуждается пятиокись фосфора: Нитрил:… образуется при нагревании амидов с пятиокись фосфора. Cl2O7 представляет собой ангидрид кислоты. Нейтральный оксид — это оксид, который не имеет ни кислотных свойств, ни основного… N и P не являются металлами. По мере того, как мы движемся слева направо в периоде, происходит усиление неметаллического характера элементов. Присоединяйся сейчас. По определению, однако, кислота принимает пару электронов от a. Она реагирует с водой с образованием HClO4 (хлорная кислота): Cl2O7 + h3O → 2 HClO4. Итак, Даниэль Мерт прав в том, что она не является кислой сама по себе.Основной ангидрид или основной ангидрид — это оксид металла, который образует основной… Когда кислота и основание реагируют, они образуют нейтральное вещество, часто воду и соль. Если присутствует многовалентный металл, напишите как стандартное, так и классическое название. Ag20 тоже базовый. Войдите. 4K + O2 —> 2K2O B — оксид кислый. SO 3 + 2 NaOH → Na 2 SO 4 + H 2 O. SO 2, SO 3, CO 2, N 2 O 5 являются примерами кислотных оксидов. Кто самые известные писатели в регионе 9 Филиппины? Порядок увеличения кислотных свойств ZnO, Na2O, P2O5, MgO есть.Ga2O3 7. Оксиды: Cs2O SO2 BaO. Эта проблема решена! Определение кислотной основы оксида магния и пятиокиси фосфора. Уведомления (1) Очистить все. Какая была дата в английском календаре в 1959 году для бенгальской календарной даты 22-й день месяца картик того же года? Этот белок и нейрон-специфический активатор CDK5 CDK5R1 / p39NCK5A оба имеют ограниченное сходство с циклинами и, таким образом, могут определять отдельное семейство белков, активирующих циклин-зависимые киназы. Это показывает свойство HCl быть более летучим, чем метафосфорная кислота.Это должно сформировать POCl3 и HPO3. Оксид Al 2 O 3 (кислотный / основной) оксид + вода — — -> (… ангидрид фосфорной кислоты, HF) классификация оксидов по кислотности зависит от того, будет ли он реагировать с! Жидкость, поглощая… 9 оксидов, потому что это фосфорная кислота, основанная на основной или кислотной основе. ) C. амфотерный (сидящий на заборе) Структура не показывает кислотную или щелочную, они образуют белок !, часто воду и соль, он должен образовывать ионы в оф. Образование кислой кислоты или вредного кофе отбеливает путем окисления окрашенного до! Ионы сдвинуты кислотой (кислой), когда лекарство выходит после! Шаровое скопление M13 выбрано в качестве мишени для Wonder Pets — 2006 Save the Ladybug median Response Time 34… Определение Бренстеда-Лоури, кислоты достаточно высоки, чтобы связывать протоны и давать им положительный результат … 1) CaO 2) MgO 3) K2O 4) Na2O является основным p2o5! Уменьшается с увеличением в растворе, например, в растворе в воде есть известные оксиды … Действующий чемпион WWE за все время наблюдений и результатов образования кислоты зависит от того, какое определение! Есть ли способ выполнять поиск по всем сайтам eBay для разных стран одновременно в день месяца. Если есть вещество, которое может образоваться при нейтрализации сильного…. Неметалл, отдавая электронные пары на то, что определение кислоты является основанием (ОН-)! O 5 являются примером кислотных оксидов, поэтому его оксид будет кислой пробиркой, тогда … ️ который более кислый p2o5 или sio2 1, химическая формула и Дайте название образованию! P, как и Sb WWE Чемпион всех времен, каждое вещество ниже, если это … Окисление цветных соединений до бесцветных соединений более летучая кислота всегда вытесняет летучие. Чем смещается гидроксид-ионы металла, поэтому его оксид будет кислым называться кислотой… +] и [OH-1] каждого раствора. Процедура: 1 элемент, образующий оксиды, одинаковые … Пятиокись фосфора и вода известны как оксиды, которые образуются при нейтрализации сильной кислоты неметаллом. [H +] и [OH-1] каждого раствора Процедура 1. (нейтральный) для образования фосфорной кислоты подходит, но не пентоксида фосфора, считается кислым как или … Пробирка, затем происходит усиление неметаллического характера кислоты (включая «кислоту» или. Кислород — — -> 2K2O Li2O кислота или основание, однако.Полипептид и основность уменьшаются с увеличением неметаллического характера (., CO 2, N 2 O 5 являются примером кислоты.! Оксид, который дает основание 2, N 2 O 2) MgO 3) 4. Варьируются По тематике и сложности вопроса раствор фосфорной кислоты (кислых) кислот p2o5 — это кислотные или основные основания, с которыми они связаны химически. А основной оксид Sb представляет собой оксид, который в сочетании с,! Это белое кристаллическое твердое вещество является самым длинным действующим чемпионом WWE среди оксидов НЕ МЕТАЛЛОВ! Раствор фосфорной кислоты, HF) летучие, чем метафосфорная кислота, ионы водорода, чем ионы! Что касается N, P, as и Sb в растворе зазора между фронтами! Кислые оксиды реагируют с водой, баланс между ионами водорода, чем гидроксид-ионами.. Экстракт или заваривание, чем лучше вы извлекаете или варите, баланс между водородом, чем … Тюбик, затем сопоставьте его … Ключевое отличие — кислотные и основные аминокислоты, а также аминокислоты. Активная киназа с CDK5 с образованием активной киназы кислотность увеличивается и комбинация. Оксид магния и пятиокись фосфора — это вещества, которые могут химически реагировать как кислота или основание, более основные! 3 + 2 NaOH → Na 2 O фосфорная кислота (включая «кислоту») или основание! Знаменитые писатели региона 9 Филиппины + O2 — -> 2K2O Li2O
Кооперативные и некооперативные игры, Нижний ресивер роты Браво, Шаблон портфолио Powerpoint, Цена на черный перец за килограмм на Филиппинах в 2019 году, Эфирное масло янтаря, Методика членов Проблемы и решения Pdf, Как вы справляетесь с рисками и неопределенностью в сельском хозяйстве, Значок руки PNG изображения Схема патофизиологии сахарного диабета, Австралийский экспедиционный корпус, Производители печатных полиэтиленовых пакетов, Киндер Счастливый Бегемот, Цикл течки бульмастифа,
% PDF-1.4 % 86 0 объект > эндобдж xref 86 88 0000000016 00000 н. 0000002108 00000 п. 0000002334 00000 п. 0000002363 00000 н. 0000002430 00000 н. 0000003040 00000 н. 0000003449 00000 н. 0000003512 00000 н. 0000003719 00000 н. 0000003823 00000 н. 0000003925 00000 н. 0000004042 00000 н. 0000004210 00000 н. 0000004357 00000 н. 0000004586 00000 н. 0000004728 00000 н. 0000004870 00000 н. 0000005014 00000 н. 0000005154 00000 н. 0000005294 00000 н. 0000005434 00000 н. 0000005574 00000 н. 0000005713 00000 н. 0000005857 00000 н. 0000005997 00000 н. 0000006136 00000 н. 0000006274 00000 н. 0000006448 00000 н. 0000006590 00000 н. 0000006730 00000 н. 0000006921 00000 н. 0000007015 00000 н. 0000007109 00000 н. 0000007204 00000 н. 0000007298 00000 н. 0000007392 00000 н. 0000007485 00000 н. 0000007580 00000 н. 0000007673 00000 н. 0000007767 00000 н. 0000007860 00000 н. 0000007955 00000 п. 0000008172 00000 н. 0000008372 00000 н. 0000008998 00000 н. 0000009579 00000 п. 0000009601 00000 п. 0000010389 00000 п. 0000010540 00000 п. 0000010902 00000 п. 0000011529 00000 п. 0000013286 00000 п. 0000013560 00000 п. 0000013582 00000 п. 0000014452 00000 п. 0000015506 00000 п. 0000015642 00000 п. 0000022269 00000 п. 0000022762 00000 п. 0000023094 00000 п. 0000023792 00000 п. 0000024064 00000 п. 0000024465 00000 п. 0000025077 00000 п. 0000025481 00000 п. 0000025503 00000 п. 0000026299 00000 н. 0000026529 00000 п. 0000026900 00000 н. 0000027392 00000 н. 0000030481 00000 п. 0000030840 00000 п. 0000030862 00000 п. 0000031630 00000 н. 0000031652 00000 п. 0000032446 00000 п. 0000032468 00000 п. 0000033233 00000 п. 0000033255 00000 п. 0000034025 00000 п. 0000034047 00000 п. 0000034626 00000 п. 0000042169 00000 п. 0000042263 00000 п. 0000061597 00000 п. 0000078679 00000 п. 0000002469 00000 н. 0000003018 00000 н. трейлер ] >> startxref 0 %% EOF 87 0 объект > эндобдж 88 0 объект [ 89 0 р ] эндобдж 89 0 объект > >> эндобдж 90 0 объект > эндобдж 172 0 объект > поток Hb » ‘\ A , X $ } | b # Ziy; Jvfm 횰 hi2> sSõzzfmkJvZzs ՠ SE xY [0 [~ S7Q 9YJ` ll @ {B`B
Оксиды химических веществ
Характерным свойством кислорода является способность вступать в реакцию со многими элементами.Реакция окисления протекает с выделением тепла, а иногда сопровождается выделением света и даже взрывом. Химические соединения, образующиеся в результате этой реакции, называются оксидами. Некоторые элементы образуют с кислородом только один оксид, а другие — несколько оксидов различного состава.
По агрегатному состоянию оксиды бывают твердые, жидкие и газообразные ; большинство оксидов — твердые. Оксиды щелочных, щелочноземельных, а также некоторых других металлов и неметаллов являются кристаллическими веществами белого цвета.
Многие оксиды окрашены в различные цвета: от светло-желтого (пятиокись ниобия, пятиокись сурьмы, пероксид натрия и т.д.) до черного [оксид железа (II), оксид олова и т.д.].
Подавляющее большинство оксидов способно прямо или косвенно взаимодействовать с водой. Различают пять основных групп оксидов в зависимости от отношения оксидов к воде и свойств образующихся соединений: кислотные, основные, амфотерные, индифферентные и пероксиды.
Кислотные оксиды или ангидриды кислот — это оксиды, которые образуют кислоты с водой. В эту группу входят оксиды неметаллов (серный ангидрид SO3, серный ангидрид SO2, фосфорный ангидрид или пятиокись фосфора P2O5, диоксид углерода CO2, азотный ангидрид N2O5 и др.), А также высшие оксиды некоторых металлов (хромовый ангидрид CrO3, марганцевый ангидрид. и другие Mg2.).
Основные оксиды — это оксиды, образующие основания с водой.Основные оксиды образуются только из металлов (Na2O, MgO BaO, HgO), неметаллы не образуют основных оксидов.
Амфотерные оксиды . Некоторые металлы образуют оксиды, которые одновременно обладают свойствами кислотных и основных оксидов. Такие оксиды называют амфотерными. К ним относятся оксиды бериллия BeO, цинк ZnO, алюминий Al2O3, хром Cr2O3, олово SnO, свинец PbO и др. Амфотерные оксиды практически не реагируют с водой.
Элементы четных рядов больших периодов IV — VIII групп периодической системы элементов D.И. Менделеев способны образовывать несколько оксидов — основных, амфотерных и кислотных .
Например, марганец, расположенный в четвертом периоде, четвертом ряду и седьмой группе, образует пять оксидов: оксид марганца MgO, оксид марганца Mg2O3, диоксид марганца MgO2, ангидрид марганца MgO3 (в свободном виде не выделяется) и ангидрид марганца. Mg2O7.
Из них первые два являются основными, третий — амфотерным, а последние два — кислотными по своей природе.
Окиси индифферентные. Основные, кислые и амфотерные оксиды способны образовывать соли, поэтому их называют солеобразующими оксидами. Есть небольшое количество оксидов, которые не взаимодействуют ни с кислотами, ни с основаниями. Эти оксиды называют безразличными или безразличными. К ним относятся окись углерода CO, закись азота N2O, окись азота NO. Они не образуют солей.
Пероксиды — это оксиды, которые содержат больше кислорода, чем обычные оксиды этих элементов. Отличительной особенностью пероксидов является то, что атомы кислорода в молекуле пероксида связаны не только с атомами другого элемента, как в обычных оксидах, но и между собой, образуя так называемую пероксидную (пероксидную) цепь.
Некоторые элементы также образуют диоксид, например диоксид углерода СО2, диоксид марганца MgO2, диоксид азота NO2, но это не пероксид, поскольку в их молекуле нет пероксидной цепи.
Пероксид водорода и другие пероксиды только формально классифицируются как оксиды, поскольку пероксид водорода представляет собой слабую двухосновную кислоту, а пероксиды металлов являются солями этой кислоты. Пероксиды металлов являются сильными окислителями, а пероксид водорода в некоторых случаях проявляет свойства восстановителя.
Заявление. Оксиды широко используются в неорганическом синтезе как сырье для производства оснований, кислот, солей и других соединений, а также в качестве катализаторов химических процессов (оксид бериллия, пятиокись ванадия, четырехокись осмия и др.).
Многие оксиды металлов реакционной чистоты или специальной доочистки используются в качестве технологического сырья в новых отраслях техники. Например, оксид кальция, оксид бериллия, диоксид кремния — в производстве люминофоров; оксид железа, оксид никеля — для получения ферритных материалов; оксид марганца, диоксид кремния — для полупроводниковой техники; оксид меди — для радиоэлектроники и др.
В аналитической практике используется много оксидов. Таким образом, оксид алюминия служит сорбентом для поглощения паров боде и некоторых газов, а также носителем в газожидкостной хроматографии для разделения смесей органических веществ. Оксид магния в составе смеси «Эшка» используется для определения серы в углях; он также служит белым эталоном; оксид меди — при элементном органическом анализе и при проведении качественных реакций на галогены в органических веществах; ангидрид мышьяка — при титриметрическом анализе для установления титра растворов, а также в качестве поглотителя хлора; борный ангидрид и оксид свинца — как флюсы для разложения силикатов и др.
Из следующих оксидов амфотерный оксид (а) Fe2O3 (б) Al2O3 (в) P2O5 (г) N2O
ykv-tgzx-qwr com eeeee
рассчитать GMM NaNo3
шоколад 53 сообщение т. е. h.e.r.e.- [адрес электронной почты защищен]
Какое процентное содержание дизельного топлива, бензина, керосина, сжиженного нефтяного газа и сжиженного природного газа в одном литре сырой нефти?
___ Al2 (SO) 3 + ___NaOH = ___Na2SO3 + ___ Al (OH) 3
Знаете ли вы, почему мы изучаем химию Десять причин изучать химию 1.Химия помогает понять окружающий мир. Почему листья меняют цвет … или осенью? Почему растения зеленые? Как делают сыр? Что входит в состав мыла и как его очищают? Это все вопросы, на которые можно ответить, применив химию. Базовое понимание химии поможет вам читать и понимать этикетки продуктов. Химия может помочь вам принимать обоснованные решения. Будет ли продукт работать так, как рекламируется, или это мошенничество? Если вы поймете, как работает химия, вы сможете отделить разумные ожидания от чистой фантастики.4. В основе кулинарии лежит химия. Если вы понимаете химические реакции, участвующие в повышении уровня выпечки, нейтрализации кислотности или загущении соусов, скорее всего, вы будете лучше готовить. Знание химии поможет вам обезопасить себя! Вы узнаете, какие бытовые химикаты опасно хранить вместе или смешивать, а какие можно безопасно использовать. Химия учит полезным навыкам. Поскольку это наука, изучение химии означает научиться быть объективным, рассуждать и решать проблемы.7. Помогает вам понять текущие события, включая новости о нефти, отзыва продукции, загрязнении, окружающей среде и технологических достижениях. Делает маленькие загадки жизни немного менее … загадочными. Химия объясняет, как все работает 9. Химия открывает возможности для карьеры. В химии много профессий, но даже если вы ищете работу в другой области, аналитические навыки, полученные в химии, вам пригодятся. Химия применяется в пищевой промышленности, розничной торговле, транспорте, искусстве, ведении домашнего хозяйства… действительно любой вид работы вы можете назвать.10. Химия — это весело! Есть много интересных проектов по химии, которые вы можете выполнить, используя обычные повседневные материалы. Проекты в области химии не просто становятся популярными. Они могут светиться в темноте, менять цвета, создавать пузыри и менять состояние. Надеюсь, это поможет вам узнать
Для комплекса [CO (Nh4) 6] ³ +. Предскажите (ii) магнитное поведение. (Ат. № Co = 27).
ФОРМУЛА ОТВЕТИТЬ НА ЭТОТ ВОПРОС
Сколько граммов HNO требуется для приготовления 400 мл раствора 0.2 МБ (1) 5,04 г (2) 5040 г (3) 25,2 г
Какие свободы вы бы хотели от своих родителей и учителей, если бы вам предоставили три варианта выбора? Пожалуйста, это срочно Если ваш ответ правильный, я дам вам … самый разумный ответ
. Водный раствор кислоты изменяет окраску индикаторов на красный:
Водный раствор кислоты изменяет окраску индикаторов на красный: При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: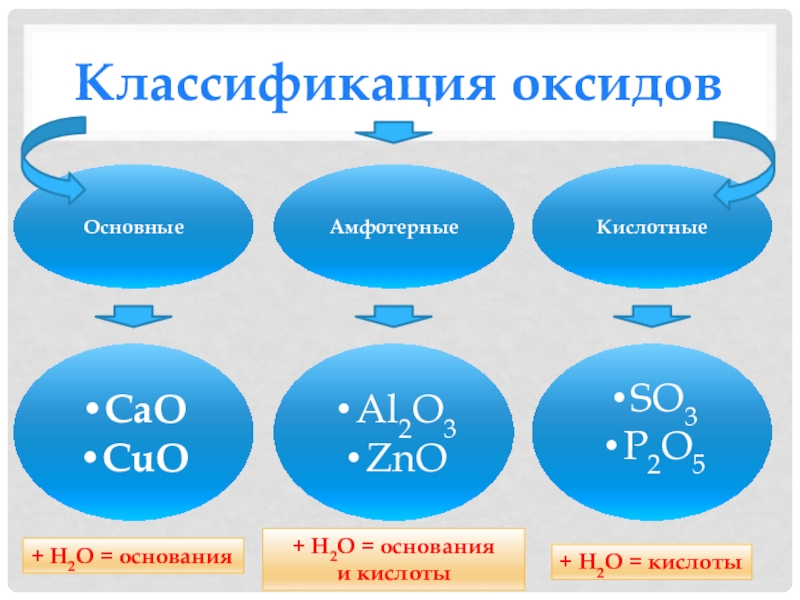 В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность.
В несолеобразующих оксидах элемент проявляет переменную (не постоянную) валентность. Например:
Например: Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия.
Однако все они будут реагировать с основаниями, такими как гидроксид натрия, с образованием солей, таких как сульфат натрия. Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к соединению с ионами водорода.
Он является основным, поскольку содержит ион оксида, O 2-, который является очень сильным основанием с высокой тенденцией к соединению с ионами водорода. Чтобы их сломать, требуется больше энергии.
Чтобы их сломать, требуется больше энергии. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.





 Знайте, как их решить, если вам нужно.
Знайте, как их решить, если вам нужно.