Дописать схемы реакций получения солей и составить уравнения:а)MgO+h4PO4=… б)Cr2O3+HNO3=… в)CO2+NaOh4=… г)h3SO4+…=KHSO4+…
Реакция протекает между оксидом магния и фосфорной кислотой. Образуются такие продукты как соль фосфат магния и вода. Уравнение химической реакции записываем так:
3 MgO + 2 H3PO4 = Mg3(PO4)2 + 3 H2O
Реакция протекает между такими веществами как оксид хрома и азотная кислота. Получается соль нитрат хрома трехвалентный и вода. Уравнение записываем так:
Cr2O3 + 6 HNO3 = 2 Cr(NO3)3 + 3 H2O
Реакция диоксида углерода и гидроксида натрия. Образуется соль карбонат натрия и вода. Уравнение записываем так.
CO2 + 2 NaOH = Na2CO3 + H2O
Серная кислота взаимодействует с гидроксидом калия, с образованием воды и гидросульфат калия. Молекулярное уравнение реакции можно записать так:
H2SO4 + KOH = KHSO4 + H2O
Соль сульфат железа трехвалентный взаимодействует с гидроксидом калия.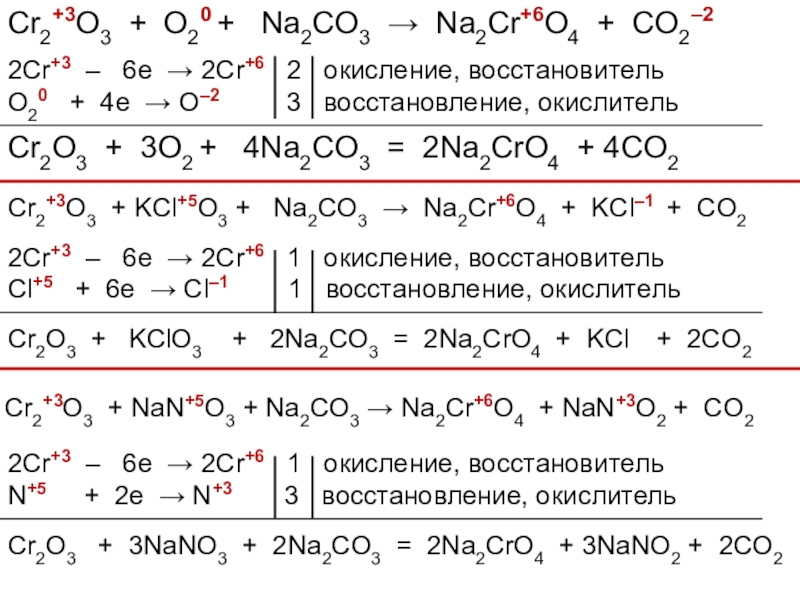
Fe2(SO4)3 + 6 KOH = 2 Fe(OH)3 + 3 K2SO4
Реакция между солью нитратом меди и магнием. Образуется соль нитрат магния и чистая медь. Молекулярное уравнение реакции можно записать так:
Cu(NO3)2 + Mg = Mg(NO3)2 + Cu
Реакция протекает между такими веществами как соль сульфат железа и соль нитрат бария. В результате прохождения реакции образуется вещества: соль нитрат железа трехвалентный и соль сульфат бария. Молекулярное уравнение реакции можно записать так:
Fe2(SO4)3 + 3 Ba(NO3)2 = 2 Fe(NO3)3 + 3 BaSO4
.| Author | Абдулвалиев, Р. А. А. | ru_RU |
| Author | Гладышев, С.В. | ru_RU |
| Author | Ахмадиева, Н.К. | ru_RU |
| Author | Бейсембекова, К.О. | ru_RU |
| Author | Омарова, С.А. | ru_RU |
| Author | Манапова, А.И. | ru_RU |
| Author | Рузахунова, Г.С. | ru_RU |
| Author | Квятковская, М.Н. | ru_RU |
| Author | Abdulvaliyev, Rinat A. | en |
| Author | Gladyshev, Sergey S. | en |
| Author | Akhmadiyeva, Nazym K. | en |
| Author | Beisembekova, Kulzhaiyk O. | en |
| Author | Omarova, Saltanat A. | en |
| Author | Manapova, Alfiyam I. | en |
| Author | Ruzakhunova, Galiyaт S. | en |
| Author | Kvyatkovskaya, Marina N. | en |
| Accessioned Date | 2017-03-28T05:01:06Z | |
| Available Date | 2017-03-28T05:01:06Z | |
| Issued Date | 2016-12 | |
| URI (for links/citations) | http://elib.sfu-kras.ru/handle/2311/32118 | |
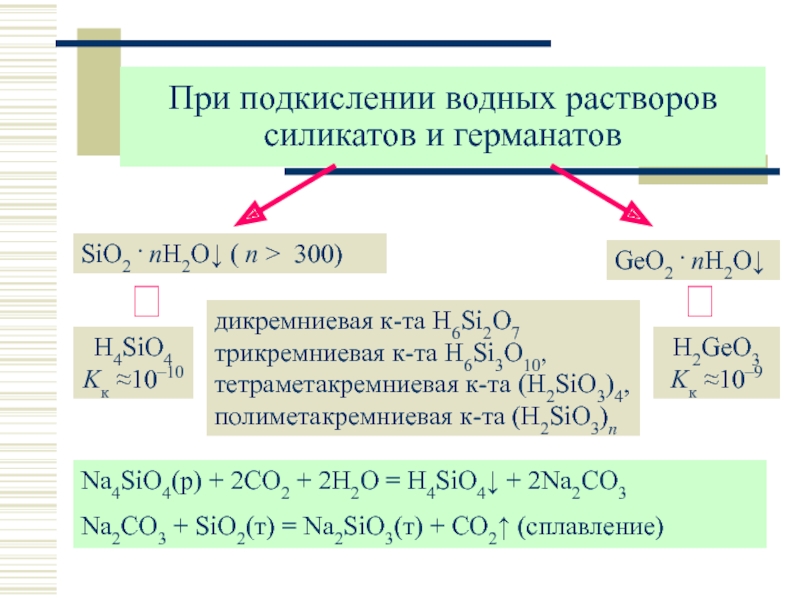
| Abstract | Проведены исследования обогащения шламовых хвостов переработки хромитовой руды
Донского горно-обогатительного комбината Республики Казахстан. Представлен физико-
химический анализ шламовых хвостов и промпродуктов переработки. Разработана
технологическая схема переработки, включающая операции предварительной активации
шламовых хвостов в растворе кальцинированной соды, концентрацией 120 г/дм3 при
температуре 120 °C, Т:Ж=1,0:10,0 и продолжительности 90 мин, сернокислотное
выщелачивание в 30%-м растворе гидросульфата аммония и гравитационное обогащение на
центробежном сепараторе. В результате переработки получен хромитовый концентрат с
содержанием Cr2O3 59,2 % при извлечении Cr2O3 в концентрат 86,8 % Представлен физико-
химический анализ шламовых хвостов и промпродуктов переработки. Разработана
технологическая схема переработки, включающая операции предварительной активации
шламовых хвостов в растворе кальцинированной соды, концентрацией 120 г/дм3 при
температуре 120 °C, Т:Ж=1,0:10,0 и продолжительности 90 мин, сернокислотное
выщелачивание в 30%-м растворе гидросульфата аммония и гравитационное обогащение на
центробежном сепараторе. В результате переработки получен хромитовый концентрат с
содержанием Cr2O3 59,2 % при извлечении Cr2O3 в концентрат 86,8 % | ru_RU |
| Abstract | Research on the technology for beneficiation of sludge tails of the processing of chromite containing ore
Donskoi ore mining and processing enterprise of the Republic of Kazakhstan was provided. Physical and
chemical analysis of sludge tails and processing by-products was shown. The technological scheme for
processing of sludge tails includes: preactivationof tails in 120 g / dm3slurry soda solution,at a liquid
to solid ratio of 10 at 120 °C for 90 minutes; sulfuric acid leaching with40 %ammonium hydrosulfate
solution and gravity concentration on centrifugal separator. The final chromite concentrate contained
59.2 % Cr2O3, with a recovery of 86.8 % The final chromite concentrate contained
59.2 % Cr2O3, with a recovery of 86.8 % | en |
| Language | ru | ru_RU |
| Publisher | Сибирский федеральный университет. Siberian Federal University | en |
| Subject | обогащение | ru_RU |
| Subject | шламовые хвосты | ru_RU |
| Subject | хромит | ru_RU |
| Subject | концентрат | ru_RU |
| Subject | центробежный сепаратор | ru_RU |
| Subject | автоклав | ru_RU |
| Subject | beneficiationof sludge tails | en |
| Subject | chromite | en |
| Subject | concentrate | en |
| subject»>Subject | centrifugal separator | en |
| Subject | autoclave | en |
| Title | Сернокислотная переработка шламовых хвостов Донского ГОКа с получением хромитового концентрата | ru_RU |
| Alternative Title | Sulfuric Acid Processing for the Production of Chromite Concentrates from Donskoy Ore-Mining and Processing Plant Slurry Tails | en |
| Type | Journal Article | |
| Type | Published Journal Article | |
| Contacts | Абдулвалиев, Р.А.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Гладышев, С.В.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| x-contacts»>Contacts | Ахмадиева, Н.К.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Бейсембекова, К.О.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Омарова, С.А.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Манапова, А.И.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Рузахунова, Г.С.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| Contacts | Квятковская, М.Н.: Институт металлургии и обогащения Казахстан, 050010, Алматы, ул. Шевченко, 29/133 | ru_RU |
| x-contacts»>Contacts | Abdulvaliyev, Rinat A.: Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Gladyshev, Sergey S.: Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Akhmadiyeva, Nazym K.: Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan; [email protected] | en |
| Contacts | Beisembekova, Kulzhaiyk O.: Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Omarova, Saltanat A.:Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Manapova, Alfiyam I. : Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan : Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Ruzakhunova, Galiyaт S.:Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Contacts | Kvyatkovskaya, Marina N.:Institute of Metallurgy and Ore beneficiation 29/133, Shevchenko Str., Almaty, 050010, Kazakhstan | en |
| Pages | 515-524 | ru_RU |
| Journal Name | Журнал Сибирского федерального университета. Химия. Journal of Siberian Federal University. Chemistry;2016 9 (4) | en |
Хром и его соединения — презентация онлайн
ХРОМ и его соединенияI. Исторические сведения
II. Хром – химический элемент:
1.Положение хрома в периодической системе
химических элементов Д.И.Менделеева
2.
 Строение атома.
Строение атома.3. Нахождение в природе
III.Хром – простое вещество
1. Состав. Физические свойства.
2. Получение.
3. Химические свойства
4. Биологическая роль и физиологическое
действие.
5. Применение
IV. Соединения хрома
В 1766 году в окрестностях
Екатеринбурга был
обнаружен минерал,
который получил название
«сибирский красный
свинец», PbCrO4.
Современное название —
крокоит.
В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска —
из-за разнообразия окраски своих соединений.
Французский химик Луи Николя
Воклен родился в Сент-Андред’Эберто (Нормандия).
Совместно с А. Ф. Фуркруа
выяснил (1799) химическую
природу мочевины. Совместно с
П. Ж. Робике открыл (1806)
первую аминокислоту аспарагин.

Открыл также пектин и яблочную
кислоту, выделил камфорную и
хинную кислоты.
Внёс существенный вклад в
развитие анализа минералов.
Создал школу химиков.
Опубликовал одно из первых в
мире руководств по химическому
анализу – «Введение в
аналитическую химию» (1799).
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер период
Cr
металл
+24
24
4
группа
VIB
1s2 2s22p6 3s23p6 3d 5 4s1
2 8
13 1
валентные электроны
Cr0 ─ 2e → Cr+2
Cr0 ─ 3e → Cr+3
Cr0 ─ 6e → Cr+6
Нахождение хрома в природе
Хром является довольно распространённым элементом
(0,02 масс. долей, %). Основные соединения хрома —
хромистый железняк (хромит) FeO·Cr2O3. Вторым по
значимости минералом является крокоит PbCrO4.
хромит
крокоит
Физические свойства
В свободном виде — голубовато- белый
металл.
Хром (с примесями) является одним из
самых твердых металлов.

Очень чистый хром достаточно хорошо
поддаётся механической обработке,
пластичен.
Устойчив на воздухе. При 2000 °C сгорает с
образованием зелёного оксида хрома (III)
Cr2O3.
Плотность 7,19 г/см3;
t плавления 1890°С;
t кипения
2480°С.
Получение
Из хромистого железняка Fe(CrO2)2
(хромита железа) получают
феррохром восстановлением в
электропечах коксом (углеродом):
FeO· Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром — сплав железа и хрома
(около 60% ),
основные примеси – углерод (до5%)
кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для
производства легированных
сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия
(кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
2) растворяют хромат натрия и отделяют его от оксида
железа;
3) переводят хромат в дихромат, подкисляя раствор и
выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата
углём:
Na2Cr2O7
+ 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130 ккал
С помощью электролиза получают электролитический хром
из раствора хромового ангидрида в воде, содержащего
добавку серной кислоты.
 При этом на катодах совершаются
При этом на катодах совершаютсяв основном 3 процесса:
1) восстановление шестивалентного хрома до
трехвалентного с переходом его в раствор;
2) разряд ионов водорода с выделением газообразного
водорода;
3) разряд ионов, содержащих шестивалентный хром с
осаждением металлического хрома;
Cr2O72− + 14Н+ + 12е− = 2Cr + 7h3O
Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
+
Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
О2 + неметаллы
+
+
+
Cr
Cr
h3O
растворы HCl, h3SO4
h3SO4 (конц.), HNO3
растворы солей
+
щелочные расплавы окислителей
+
При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он
реагирует практически со всеми неметаллами, например:
кислородом, галогенами, азотом, серой.
Составьте уравнения реакций
хрома с перечисленными неметаллами.

Рассмотрите данные реакции как
окислительно-восстановительные.
4 Cr0 + 3 O20 = 2 Cr2+3O3–2
Cr0 – 3e → Cr+3
4
O20 + 4e → 2O–2 3
Cr0 – восстановитель, процесс окисления
O20 – окислитель, процесс восстановления
2 Cr0 + 3 Br20 = 2 Cr+3Br3–1
Cr0 – 3e → Cr+3
2
Br20 + 2e → 2Br–1 3
Cr0 – восстановитель, процесс окисления
Br20 – окислитель, процесс восстановления
2 Cr0 + N20 = 2Cr+3N–3
Cr0 – 3e → Cr+3 2
N20 + 6e → 2N–3 1
Cr0 – восстановитель, процесс окисления
N20 – окислитель, процесс восстановления
2 Cr0 + 3 S0 = Cr2+3S3–2
Cr0 – 3e → Cr+3 2
S0 + 2e → S–2
3
Cr0 – восстановитель, процесс окисления
S0 – окислитель, процесс восстановления
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3h3O = Cr2O3 + 3h3
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,
Cr
Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).

Составьте уравнения реакций хрома c растворами соляной
и серной кислот.
Рассмотрите данные реакции как окислительновосстановительные.
Cr0 + 2 H+1Cl = Cr+2Cl2 + h30
Cr0 – 2e → Cr+2
1
2H+ + 2e → h30
1
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 +
h3+1SO4 = Cr+2SO4 + h30
Cr0 – 2e → Cr+2
2H+ + 2e → h30
1
1
Cr0 – восстановитель, процесс окисления
h3SO4(за счет Н+1) – окислитель,
процесс восстановления
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + h3SO4 → Cr2(SO4)3 + SO2 + h3O
Cr + HNO3 → Cr(NO3)3 + NO2 + h3O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.

Назовите окислитель и восстановитель.
Cr0 + h3S+6O4 → Cr2+3(SO4)3 + S+4O2 + h3O
Cr0 – 3e → Cr+3
S+6 + 2e → S+4
2
3
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O
Cr0 – восстановитель, процесс окисления
h3SO4 (за счет S+6) – окислитель, процесс восстановления
Cr0 + HN+5O3 → Cr+3(NO3)3 + N+4O2 + h3O
Cr0 – 3e → Cr+3
N+5 + 1e → N+4
1
3
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O
Cr0 – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, процесс восстановления
Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Составьте уравнение реакции хрома c раствором сульфата
меди (II). Рассмотрите данную реакцию как окислительновосстановительную.
Cr0 + Cu+2SO4 → Cr+2SO4 + Cu0
Cr0 – 2e → Cr+2 1
Cu+2+ 2e → Cu0 1
Cr + CuSO4 = CrSO4 + Cu
Cr0 – восстановитель, процесс окисления
CuSO4 (за счет Cu+2) – окислитель, процесс
восстановления
Растворы щелочей на хром практически не действуют.

Хром реагирует с щелочными расплавами окислителей.
В качестве окислителей используют нитраты натрия, калия,
хлорат калия и другие окислители.
При взаимодействии с щелочными расплавами окислителей
хром образует соли анионного типа, в которых проявляет
высшую степень окисления.
Cr + KClO3 + KOH
сплавление
K2CrO4 + KCl + h3O
Рассмотрите эту реакцию как окислительно-восстановительную
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
Cr0 + KCl+5O3 + KOH → K2Cr+6O4 + KCl–1 + h3O
Cr0 – 3e → Cr+3
Cl+5 + 6e → Cl–
1
2
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O
Cr0 – восстановитель, процесс окисление
KClO3 (за счет Cl+5) – окислитель, процесс восстановление
Хром — постоянная составная часть
растительных и животных организмов. В
крови содержится от 0,012 до 0,0035 %
хрома. Хром имеет большое значение в
метаболизме углеводов и жиров, а
также участвует в процессе синтеза
инсулина.
 Важнейшая его
Важнейшая егобиологическая роль состоит в регуляции
углеводного обмена и уровня глюкозы в
крови Элемент способствует
нормальному формированию и росту
детского организма. Снижение
содержания хрома в пище и крови
приводит к уменьшению скорости роста,
увеличению холестерина в крови.
Хром важный компонент во многих легированных сталях.
Используется в качестве износоустойчивых и красивых
гальванических покрытий (хромирование)
Хром применяется для производства сплавов:
хром-30 и хром-90, незаменимых для производства сопел
мощных плазмотронов и в авиакосмической промышленности.
Соединения хрома
Соединения хрома (II)
оксид
гидроксид
соли
Соединения хрома (III)
оксид
гидроксид
соли
Соединения хрома (VI)
оксид
гидроксид
соли
Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет
основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии
кислорода получают оксид хрома (II).
Составьте уравнение реакции.
Cr(OH)2 = CrO + h3O
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
3CrO = Cr + Cr2O3
Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
CrO + 2HCl = CrCl2 + h3O
CrO + 2H+ + Cl– = Cr2+ + 2Cl– + h3O
CrO + 2H+ = Cr2+ + h3O
CrO + h3SO4 = CrSO4 + h3O
CrO + 2H+ + SO42– = Cr2+ + SO42– + h3O
CrO + 2H+ = Cr2+ + h3O
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2O + O20 → Cr2+3O3–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrO + O2 = 2Cr2O3
CrO (за счет Cr+2) – восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
Гидроксид хрома (II)
Cr(OH)2
Гидроксид хрома (II) получают в виде желтого осадка
действием растворов щелочей на соли хрома (II) без доступа
воздуха.

Составьте уравнение реакции получения гидроксида
хрома (II) действием гидроксида натрия на хлорид хрома (II).
Рассмотрите реакцию с точки зрения ТЕД.
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
Гидроксид хрома (II) обладает основными
свойствами.
Составьте уравнение реакции гидроксида хрома (II) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД
Cr(OН)2 + 2HCl = CrCl2 + 2h3O
Cr(OН)2 + 2H+ + 2Cl– = Cr2+ + 2Cl– + 2h3O
Cr(OН)2 + 2H+ = Cr2+ + 2h3O
Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
Составьте уравнение реакции. Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr+2(ОН)2+ O20 + Н2О → Cr+3(O –2Н)3
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Cr(OН)2 (за счет Cr+2) –восстановитель, процесс окисления
O2 – окислитель, процесс восстановления
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.

Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета.
Соединения хрома (II) – сильные восстановители. Легко
окисляются. Именно поэтому очень трудно получать и хранить
соединения двухвалентного хрома.
Реагируют с концентрированными серной и азотной
кислотами:
CrCl2 + O2 + HCl → CrCl3 + h3O
CrCl2 + h3SO4 → Cr2(SO4)3 + SO2↑ + HCl↑ + h3O
CrCl2 + HNO3 → Cr(NO3)3 + NO2↑ + HCl↑ + h3O
Рассмотрите эти реакции как окислительновосстановительные. Расставьте коэффициенты..
Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + h3O–2
Cr+2 – 1e → Cr+3
O20 + 4e → 2O–2
4
1
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2h3O
Cr+2Cl2 + HN+5O3 (к) →Cr+3(NO3)3 + N+4O2↑ + HCl↑ + h3O
Cr+2 – 1e → Cr+3
N+5 + 1e → N+4
1
1
CrCl2 + 4HNO3(конц) = Cr(NO3)3 + NO2↑ + 2HCl↑ + h3O
Cr+2Cl2 + h3S+6O4(к.) →Cr2+3(SO4)3 + S+4O2↑ + HCl↑ + h3O
Cr+2 – 1e → Cr+3
S+6 + 2e → S+4
2
1
2CrCl2 + 4h3SO4(конц) = Cr2(SO4)3 + SO2↑ + 4HCl↑ +2h3O
Соединения хрома (III)
Cr2O3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.

Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
t°
(Nh5)2Cr2O7 = Cr2O3 + N2 + 2h3O
В промышленности восстановлением дихромата калия
коксом или серой:
t°
K2Cr2O7 + 3C = 2Cr2O3 + 2K2CO3 + CO2
t°
K2Cr2O7 + S = 2Cr2O3 + K2SO4
Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr2O3 + 6HCl = 2CrCl3 + 3h3O
Cr2O3 + 6H+ + 6Cl– = 2Cr3+ + 6Cl– + 3h3O
Cr2O3 + 6H+ = 2Cr3+ + 3h3O
При сплавлении оксида хрома (III) с оксидами,
гидроксидами и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
t°
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + h3O
t°
Сr2O3 + Na2CO3 = 2NaCrO2 + CO2
Оксид хрома (III) нерастворим в воде.
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2 + h3O
Cr2O3 + KOH + Сa(ClO)2 → K2CrO4 + CaCl2 + h3O
Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 → Na2CrO4 + NaNO2 + CO2
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.

Cr2+3O3 + KOH + KMn+7O4 → K2Cr+6O4 + Mn+4O2 + h3O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Mn+7 + 3e → Mn+4
2 восстановление, окислитель
Cr2O3 + 2KOH + 2KMnO4 = 2K2CrO4 + 2MnO2 + h3O
Cr2+3O3 + KOH + Сa(Cl+1O)2 → K2Cr+6O4 + CaCl2–1 + h3O
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+1 + 2e → Cl–1
3 восстановление, окислитель
Cr2O3 + 4KOH + 3Сa(ClO)2 = 2K2CrO4 + 3CaCl2 + 2h3O
Cr2+3O3 + O20 + Na2CO3 → Na2Cr+6O4 + CO2–2
2Cr+3 – 6e → 2Cr+6 2 окисление, восстановитель
O20 + 4e → O–2
3 восстановление, окислитель
Cr2O3 + 3O2 + 4Na2CO3 = 2Na2CrO4 + 4CO2
Cr2+3O3 + KCl+5O3 + Na2CO3 → Na2Cr+6O4 + KCl–1 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
Cl+5 + 6e → Cl–1
1 восстановление, окислитель
Cr2O3 + KClO3
+ 2Na2CO3 = 2Na2CrO4 + KCl
+ 2CO2
Cr2+3O3 + NaN+5O3 + Na2CO3 → Na2Cr+6O4 + NaN+3O2 + CO2
2Cr+3 – 6e → 2Cr+6 1 окисление, восстановитель
N+5 + 2e → N+3
3 восстановление, окислитель
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
Оксид хрома (III) – катализатор
В присутствии оксида хрома (III)
аммиак окисляется кислородом воздуха до
монооксида азота, который в избытке
кислорода окисляется до бурого диоксида
азота.

Каталитическое окисление этанола
Окисление этилового спирта
кислородом воздуха происходит
очень легко в присутствии оксида
хрома (III)
Реакция окисления спирта протекает
с выделением энергии. Продукт
реакции окисления спирта уксусный альдегид.
2СН3–СН2–ОН + О2
Cr2O3, t°
2СН3 – С ═ О + 2h3O
H
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете?
Составьте уравнение реакции получения
Cr(OH)3 действием раствора аммиака на
хлорид хрома (III):
CrCl3 + 3(Nh4·h3O) = Cr(OH)3 + 3Nh5Cl
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
HCl
CrCl3
NaOH
Cr(OH)3
Na3[Cr(OH)6]
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.

Что происходит?
+h3SO4
+NaOH
Гидроксид хрома (III) обладает амфотерными свойствами.
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции гидроксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr(OH)3 + 3HCl = CrCl3 + 3h3O
Cr(OH)3 + 3H+ + 3Cl– = Cr3+ + 3Cl– + 3h3O
Cr(OH)3 + 3H+ = Cr3+ + 3h3O
Гидроксид хрома (III) растворяется в щелочах
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
гексагидроксохромат (III) натрия
(изумрудно-зеленый)
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
При нагревании гидроксид хрома (III) разлагается:
t°
2Cr(OH)3 = Cr2O3 + 3h3O
Соли хрома (III)
Хроматы (III) устойчивы в щелочной среде. Они легко
реагируют с кислотами:
недостаток кислоты:
NaCrO2 + HCl + h3O = Cr(OH)3 + NaCl
избыток кислоты:
NaCrO2 + 4HCl = CrCl3 + NaCl + 2h3O
с угольной кислотой
Na3[Cr(OH)6] + 3CO2 = Cr(OH)3 + 3NaHCO3
В растворе подвергаются полному гидролизу:
Cr2S3 + 6h3O = 2Cr(OH)3 + 3h3S
В водных растворах катион Cr3+ встречается только
в виде гидратированного иона [Cr(h3O)6] 3+, который
придает раствору сине-фиолетовый цвет.

Сульфат хрома (III) образует двойные соли – хромовые квасцы.
Из смешанного раствора сульфата хрома (III) и сульфата калия
кристаллизуется двойная соль
сине-фиолетового цвета.
–
KCr(SO4)2·12h3O
Применяются в качестве дубящего вещества при
изготовлении эмульсий, а также в дубящих растворах
и дубящих фиксажах.
Соединения хрома (III) могут проявлять как окислительные
так и восстановительные свойства.
K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + KBr + h3O
CrCl3 + Zn → CrCl2 + ZnCl2
KCrO2 + PbO2 + KOH → K2CrO4 + K2PbO2 + h3O
CrCl3 + h3O2 + KOH → K2CrO4 + KCl + h3O
Cr2(SO4)3 + Cl2 + NaOH → Na2CrO4 + NaCl + h3O + Na2SO4
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + h3O
Cr+3 – 3e → Cr+6 2 окисление, восстановитель
Br20 + 2e → 2Br–1 3 восстановление, окислитель
2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8h3O
Cr+3Cl3 + Zn0 → Cr+2Cl2 + Zn+2Cl2
Cr+3 + 1e → Cr+2
Zn0 – 2e → Zn+2
2
1
восстановление, окислитель
окисление, восстановитель
2CrCl3 + Zn = 2CrCl2 + ZnCl2
KCr+3O2 + Pb+4O2 + KOH → K2Cr+6O4 + K2Pb+2O2 + h3O
Cr+3 – 3e → Cr+6
Pb+4 + 2e → Pb–2
2
3
окисление, восстановитель
восстановление, окислитель
2KCrO2 + 3PbO2 + 8KOH = 2K2CrO4 + 3K2PbO2 + 4h3O
Cr+3Cl3 + h3O2–1 + KOH → K2Cr+6O4 + KCl + h3O–2
Cr+3 – 3e → Cr+6 2
2O–1 + 2e → 2O–2 3
окисление, восстановитель
восстановление, окислитель
2CrCl3 + 3h3O2 + 10KOH = 2K2CrO4 + 6KCl + 8h3O
Cr2+3(SO4)3 + Cl20 + NaOH → Na2Cr+6O4 + NaCl– + h3O + Na2SO4
Cr+3 – 3e → Cr+6
Cl20 + 2e → 2Cl–1
2
3
окисление, восстановитель
восстановление, окислитель
Cr2(SO4)3 +3Cl2 +16NaOH = 2Na2CrO4 + 6NaCl + 8h3O +3Na2SO4
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.

Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2h3SO4 = 2CrO3 + 2NaHSO4 + h3O
При нагревании выше 250 °C разлагается:
4CrO3 → 2Cr2O3 + 3O2↑.
Оксид хрома (VI) очень ядовит.
CrO3 — кислотный оксид.
При растворении в воде образует кислоты.
С избытком воды образуется хромовая
кислота h3CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая
кислота
Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ↔ Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH → K2CrO4 + h3O.
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие органические
вещества самовоспламеняются или даже взрываются при
контакте с ним.

CrO3 + C2H5OH → CO2 + Cr2O3 + h3O
C2H5OH + 3h3O – 12e → 2CO2 + 12H+
2CrO3 + 6H+ + 6e → Cr2O3 + 3h3O
1
2
C2H5OH + 3h3O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6h3O
4CrO3 + C2H5OH → 2CO2 + 2Cr2O3 + 3h3O
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑.
Окисление ацетона хромовым ангидридом.
Если поместить оксид хрома на
фарфоровую пластинку и
капнуть на него несколько
капель ацетона,то через
несколько секунд ацетон
загорается. При этом оксид
хрома (VI) восстанавливается
до оксида хрома (III), а ацетон
окисляется до углекислого газа
и воды.
16CrO3 + 3Ch4– С – Ch4 → 9CO2 + 8Cr2O3 + 9h3O
О
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7
Хромовая кислота —
кристаллическое вещество
красного цвета; выделена
в свободном состоянии
при охлаждении
насыщенных водных
растворов CrO3; хромовая
кислота — электролит
средней силы.

Изополихромовые кислоты
существуют в водных
растворах, окрашенных в
красный цвет
соли
хроматы – соли хромовой кислоты
устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы, соли двухромовой
кислоты. Реакция обратима, поэтому
при добавлении щелочи желтая
окраска хромата восстанавливается.
2CrO42– + 2H+ ↔ Cr2O72– + h3O
хроматы
Н+
ОН–
дихроматы
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций.
2K2CrO4 + h3SO4(разб.) = K2Cr2O7 + K2SO4 + h3O
2K2CrO4 + 2HCl(разб.) = K2Cr2O7 + 2KCl + h3O
2K2CrO4 + h3O + CO2 = K2Cr2O7 + KHCO3
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия
K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот.

Хроматы – желтого цвета, дихроматы – оранжевого. В
кислой среде хромат-ион превращается в дихромат-ион. В
присутствии щелочи дихроматы снова становятся
хроматами. Хромат калия превращаем в дихромат,
добавляя кислоту. Желтый раствор становится оранжевым.
2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O
В стакан с дихроматом калия добавляем щелочь, оранжевый
раствор становится желтым – дихроматы превращаются в
хроматы.
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Соединения хрома (VI) –
сильные окислители
H+
Cr3+
Cr2O72– + 14H+ + 6e → 2Cr3+ + 7h3O
2–
Cr2O7
h3O
OH–
Cr(OH)3
[Cr(OH)6
3–
]
Cr2O72– + 7Н2О + 6e → 2[Cr(OH)6]3– + 2ОН–
Окислительные свойства дихроматов
Дихроматы, например дихромат калия K2Cr2O7 – сильные
окислители. Под действием восстановителей дихроматы в
кислой среде переходят в соли хрома (III). Примером такой
реакции может служить окисление сульфита натрия
раствором дихромата калия в кислой среде.
 К раствору
К растворудихромата калия добавляем серную кислоту и раствор
сульфита натрия.
K2Cr2O7 +3Na2SO3+4h3SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4h3O
Оранжевая окраска, характерная для дихроматов, переходит в
зеленую. Образовался раствор сульфата хрома (III) зеленого
цвета. Соли хрома — ярко окрашены, именно поэтому элемент
получил такое название: «хром», что в переводе с греческого
означает «цвет, краска».
опыт
Zn + K2Cr2O7 + h3SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3S + h3SO4 → S + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O2 + h3SO4 → O2 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O + h3S → S + Cr(OH)3 + KOH
K2Cr2O7 + h3O + K2S → S + K3[Cr(OH)6] + KOH
K2Cr2O7 + KOH + (Nh5)2S → S + K3[Cr(OH)6] + Nh4
Дихроматы проявляют окислительные свойства не только в
растворах, но и в твердом виде:
K2Cr2O7 + S → K2SO4 + Cr2O3
K2Cr2O7 + С → K2СO3 + СО + Cr2O3
K2Cr2O7 + Al → Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.

Zn0 + K2Cr2+6O7 + h3SO4 → Zn+2SO4 + Cr2+3(SO4)3 + K2SO4 +h3O
Cr+6 + 3e → Cr+3
Zn0 – 2e → Zn+2
2
3
восстановление, окислитель
окисление, восстановитель
3Zn + K2Cr2O7 + 7h3SO4 = 3ZnSO4 + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3S–2 + h3SO4 → S0 + Cr2+3(SO4)3 + K2SO4 + h3O
Cr+6 + 3e → Cr+3
S–2 – 2e → S0
2
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 3h3S + 4h3SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3O2–1 + h3SO4 → O20 + Cr2+3(SO4)3 + K2SO4 +h3O
Cr+6 + 3e → Cr+3
2O–1 – 2e → O20
2 восстановление, окислитель
3 окисление, восстановитель
K2Cr2O7 + 3h3O2 + 4h3SO4 = 3O2 + Cr2(SO4)3 + K2SO4 + 7h3O
K2Cr2+6O7 + h3O + h3S–2 → S0 + Cr+3(OH)3 + KOH
2Cr+6 + 6e → 2Cr+3 1
S–2 – 2e → S0
3
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + h3O + 3h3S = 3S + 2Cr(OH)3 + 2KOH
K2Cr2+6O7 + h3O + K2S–2 → S0 + K3[Cr+3 (OH)6] + KOH
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 7h3O + 3K2S = 3S + 2K3[Cr(OH)6] + 2KOH
K2Cr2+6O7 + KOH +h3O + (Nh5)2S–2 → S0 + K3[Cr+3(OH)6] + Nh4
2Cr+6 + 6e → 2Cr+ 1 восстановление, окислитель
S–2 – 2e → S0
3 окисление, восстановитель
K2Cr2O7 + 4KOH + h3O + 3(Nh5)2S = 3S + 2K3[Cr(OH)6] + 6Nh4
K2Cr2+6O7 + S0 → K2S+6O4 + Cr2+3O3
Cr+6 + 3e → Cr+3 2
S0 – 6e → S+6
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + S = K2SO4 + Cr2O3
K2Cr2+6O7 + С0 → K2С+4O3 + С+2О + Cr2+3O3
Cr+6 + 3e → Cr+3
С0 – 4e → С+4
С0 – 2e → С+2
3
4
2
2
1
1
восстановление, окислитель
окисление, восстановитель
K2Cr2O7 + 2С = K2СO3 + СО + Cr2O3
K2Cr2+6O7 + Al0 → Cr0 + KAlO2 + Al2+3O3
2Cr+6 + 6e → 2Cr+3 1 восстановление, окислитель
Al0 – 3e → Al+3
2 окисление, восстановитель
K2Cr2O7 + 4Al = 2Cr + 2KAlO2 + Al2O3
Дихромат калия (хромпик) широко применяется как окислитель
органических соединений:
3С2H5OH + K2Cr2O7 + 4h3SO4
Ch4– CHO + Cr2(SO4)3 + K2SO4 + 7h3O
3С3H7OH + K2Cr2O7 + 4h3SO4
3Ch4– C–Ch4 + Cr2(SO4)3 + K2SO4 + 7h3O
║
O
Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы
Дихромат аммония разлагается при нагревании:
(Nh5)2Cr2O7
180°C
Cr2O3 + N2 + 4h3O
В ряду гидроксидов хрома различных степеней окисления
Cr(ОН)2 — Cr(ОН)3 — Н2CrО4
закономерно происходит ослабление основных свойств и
усиление кислотных.
 Такое изменение свойств обусловлено
Такое изменение свойств обусловленоувеличением степени окисления и уменьшением ионных
радиусов хрома. В этом же ряду последовательно
усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко
окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко
восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с
сильными восстановителями проявлять окислительные
свойства, переходя в соединения хрома (II), а при
взаимодействии с сильными окислителями проявлять
восстановительные свойства, превращаясь в соединения
хрома (VI).
Соединения хрома
Степень окисления хромa
Оксид
Гидроксид
+2
CrO
+3
+6
Cr2O3
CrO3
Cr(OH)2 Cr(OH)3 h3CrO4
h3Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
Начала химии. Современный курс для поступающих в
ВУЗы.
 – М.: 1Федеративная Книготорговая Компания.
– М.: 1Федеративная Книготорговая Компания.Химия. Подготовка к ЕГЭ: учебно-методическое пособие /
Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион
Химия. Пособие для поступающих в вузы /О.О.
Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо
Интернет-ресурсы (картинки, видеофрагменты: 1) Единая
образовательная коллекция цифровых ресурсов. Химия.
Неорганическая химия. Металлы побочных подгрупп. Хром.
Видеопыты. http://school-collection.edu.ru/
2) Образовательная коллекция
Химия для всех XXI
Химические опыты со взрывами и без
http://ppt4web.ru/khimija/khrom1.html
75. Техника безопасности при работе с соединениями хрома
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ ССОЕДИНЕНИЯМИ ХРОМА
При работе с препаратами хрома не
допускать их попадания на кожу и внутрь
организма.
Соединения хрома высших степеней
окисления оказывают раздражающее и
сжигающее действие на слизистые оболочки
и кожу. В трещинах кожного покрова или
порезах оксид хрома (VI) СгО3 и дихроматы
способны вызывать долго не заживающие
язвы.

Дихроматы более опасны, чем хроматы.
Менее опасны соединения хрома со
степенью окисления +3, однако
установлено, что пыль оксида хрома (III)
Cr2O3, которая образуется при разложении
дихромата аммония (Nh5)2Cr2О7 и
алюмотермии оксидов хрома, взывает
раздражение и способна в конечном счете
привести к тяжелейшим заболеваниям
легких.
77. Лабораторный практикум
ЛАБОРАТОРНЫЙ ПРАКТИКУМОпыт 1. Получение и свойства хроматов и дихроматов
Смещение равновесия между хромат(VI)- и дихромат(VI)- ионами.
К раствору
прилейте 2 моль/л раствор серной кислоты, а к раствору
K2Cr2O7 – 2 моль/л раствор КOH.
Запишите наблюдения. Напишите в ионном виде уравнение реакции,
объясняющее изменение окраски растворов.
2K2CrO4 + h3SO4 ……….
K2Cr2O7 + 2KOH ………..
Окислительные свойства соединений хрома (VI). К раствору дихромата
калия, подкисленному 2 моль/л раствором серной кислоты, прилейте раздельно в
2-х пробирках растворы NaNO2 и Na2S.
 Запишите наблюдения.
Запишите наблюдения.Напишите и уравняйте уравнения реакций ионно электронным методом:
K2Cr2O7+ NaNO2 +h3SO4
K2Cr2O7+h3SO4+Na2S
K2Cr2O7+h3SO4+С2Н5ОН
Влияние температуры и точечных дефектов
Моделирование роста и разрушения пассивных оксидных пленок, образующихся на нержавеющих сталях, представляет общий интерес для использования нержавеющей стали в качестве конструкционного материала и представляет особый интерес в контексте продления срока службы легководных реакторов. на атомных электростанциях. С использованием подхода проведено теоретическое исследование сопротивления разрушению богатого хромом внутреннего оксидного слоя, образующегося на поверхности хромсодержащих аустенитных сплавов (нержавеющей стали и сплавов на основе никеля).Исследования проводились для периодических объемных моделей. Данные в атомном масштабе были экстраполированы с использованием модели универсальных отношений энергии связи (UBERs) для оценки механического поведения оксидной шкалы толщиной 10 мкм и толщиной мкм. Рассчитанные значения напряжений хорошо согласуются с экспериментом. Наблюдали растягивающее напряжение для объемного хрома. Исследовано влияние температуры и структурных дефектов на растрескивание. Возможность растрескивания усиливается при высокой температуре по сравнению с исследованиями при 0 K.Более высокая склонность к растрескиванию наблюдалась при наличии дефектов по сравнению с недефектным оксидом, что согласуется с экспериментальными наблюдениями.
Рассчитанные значения напряжений хорошо согласуются с экспериментом. Наблюдали растягивающее напряжение для объемного хрома. Исследовано влияние температуры и структурных дефектов на растрескивание. Возможность растрескивания усиливается при высокой температуре по сравнению с исследованиями при 0 K.Более высокая склонность к растрескиванию наблюдалась при наличии дефектов по сравнению с недефектным оксидом, что согласуется с экспериментальными наблюдениями.
1. Введение
Хромсодержащие сплавы на основе железа или никеля, такие как нержавеющая сталь, химически защищены поверхностной оксидной пленкой (пассивной пленкой). Эти пассивные пленки, как правило, богаты оксидом хрома [1, 2]. Рост и свойства поверхностного оксида играют важную роль в механизмах коррозионного растрескивания под напряжением аустенитных сплавов (аустенитных нержавеющих сталей и сплавов на основе никеля), подвергающихся воздействию первичной воды реактора с водой под давлением (PWR).В условиях эксплуатации (водная среда, высокая температура, остаточное напряжение и, в конечном счете, нейтронное облучение) сложный синергизм между микроструктурой, окислением и механической нагрузкой может привести к локальному растрескиванию [3, 4]. Исследование кинетики роста пассивных слоев на нержавеющих сталях и их коррозионной стойкости при различных физико-химических и механических нагрузках является задачей повышения ресурса элементов PWR [5].
Исследование кинетики роста пассивных слоев на нержавеющих сталях и их коррозионной стойкости при различных физико-химических и механических нагрузках является задачей повышения ресурса элементов PWR [5].
Bulk Cr 2 O 3 представляет собой антиферромагнитный изолятор, который кристаллизуется в гексагональной структуре корунда (пространственная группа R3c ) [6].Элементарная ячейка содержит шесть формульных единиц, в которых две трети октаэдрических позиций заняты Cr, а одна треть остается вакантной, как показано на рис. 1. Как экспериментальные [7–12], так и теоретические [13, 14] исследования проводились исследование механических свойств Cr 2 O 3 . Экспериментальные исследования [7, 8] показывают, что растягивающие напряжения возникают при росте оксидной окалины, контролируемом преимущественно катионной диффузией, тогда как сжимающие напряжения ожидаются за счет диффузии кислорода по границам зерен.Экспериментальные оценки показывают предел прочности при растяжении в диапазоне от 178 до 400 МПа [9–11] и предел прочности при сжатии в диапазоне от –1,6 ГПа до –2,6 ГПа [7, 8, 12] в зависимости от толщины подложки и оксидного слоя. В совсем недавних исследованиях [13, 14] также была оценена прочность на растяжение объемного хрома в диапазоне от 67,0 до 94,6 ГПа вдоль направления. Очевидно, что такие расчетные значения кажутся сильно завышенными по сравнению с экспериментальными. Одна из основных причин заключается в том, что квантово-химические расчеты DFT проводились в атомном или наноскопическом масштабе, тогда как механические свойства экспериментально измерялись в микрометровом масштабе.С помощью модели UBER авторы [13, 14] показали, что предел прочности при растяжении для образца хрома толщиной 10 мкм и толщиной м находится в диапазоне 380–500 МПа. Однако в этих исследованиях не учитывались другие факторы, влияющие на механические свойства, такие как температура и наличие дефектов.
В совсем недавних исследованиях [13, 14] также была оценена прочность на растяжение объемного хрома в диапазоне от 67,0 до 94,6 ГПа вдоль направления. Очевидно, что такие расчетные значения кажутся сильно завышенными по сравнению с экспериментальными. Одна из основных причин заключается в том, что квантово-химические расчеты DFT проводились в атомном или наноскопическом масштабе, тогда как механические свойства экспериментально измерялись в микрометровом масштабе.С помощью модели UBER авторы [13, 14] показали, что предел прочности при растяжении для образца хрома толщиной 10 мкм и толщиной м находится в диапазоне 380–500 МПа. Однако в этих исследованиях не учитывались другие факторы, влияющие на механические свойства, такие как температура и наличие дефектов.
Целью настоящего исследования является расчет сопротивления разрушению слоя оксида с высоким содержанием хрома, предположительно состоящего из хрома (Cr 2 O 3 ).Мы провели теоретическое исследование механических свойств, связанных с разрушением оксида хрома, приняв методы, описанные в предыдущем исследовании [13]. Настоящее исследование сосредоточено на расчетах DFT напряжений в объеме Cr 2 O 3 с учетом влияния точечных дефектов и температуры. Методы будут использоваться для локализации напряжения/деформации в границах зерен (ГЗ) Cr 2 O 3 в будущих исследованиях.
Настоящее исследование сосредоточено на расчетах DFT напряжений в объеме Cr 2 O 3 с учетом влияния точечных дефектов и температуры. Методы будут использоваться для локализации напряжения/деформации в границах зерен (ГЗ) Cr 2 O 3 в будущих исследованиях.
2. Методика
2.1. Свойства при растяжении
Максимальное напряжение при растяжении, которое материал может выдержать до разрушения, называется пределом прочности при растяжении. В экспериментальных исследованиях [9–11] измерения свойств оксидных слоев при растяжении проводятся на макроскопических образцах с помощью испытаний на изгиб, где значения предела прочности при растяжении оцениваются по пределу прочности при изгибе. Как правило, это приводит к широкому диапазону значений из-за различной микроструктуры и наличия дефектов в материале.Разрушение материалов обычно инициируется процессами на атомном уровне, такими как разрыв связей и зарождение дислокаций.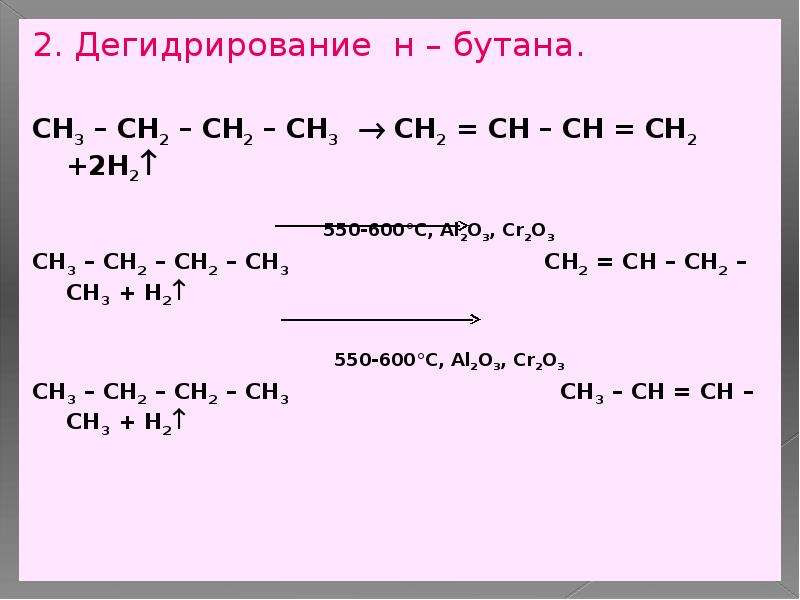 Расчеты DFT дают представление об этих основных процессах, ответственных за разрушение материалов, на атомном уровне.
Расчеты DFT дают представление об этих основных процессах, ответственных за разрушение материалов, на атомном уровне.
Расчеты полной энергии проводились в рамках теории функционала плотности (DFT + U ) на основе обобщенного градиентного приближения (GGA) Пердью и Ванга [15]. Уравнения Кона-Шама решались с помощью пакета моделирования Vienna ab initio (VASP) [16, 17].Код VASP выполняет итеративную диагонализацию гамильтониана Кона-Шэма посредством неограниченной поэтапной минимизации нормы остаточного вектора для каждого собственного состояния и с помощью оптимизированных процедур смешивания плотности заряда. (GGA + U ) использовали, как и в [18], для описания сильных корреляционных эффектов оксида. Для Cr в Cr 2 O 3 использовался эффективный параметр кулоновского взаимодействия на месте = 5 эВ, определенный в наших предыдущих исследованиях [19, 20].Собственные состояния волновых функций электрона разлагаются на базисный набор плоских волн с использованием псевдопотенциалов для описания электронно-ионных взаимодействий в рамках подхода с привлечением проекторных волн (PAW) [21].
Оптимизация атомной геометрии при 0 K осуществляется путем определения точных сил Хеллмана-Фейнмана, действующих на ионы для каждого шага оптимизации, и с использованием алгоритма сопряженных градиентов до достижения геометрического критерия сходимости по энергии (0,1 мэВ/ячейка или меньше) достигается.Оптимизированные векторы объемной решетки были рассчитаны как Å и Å, что очень близко к экспериментальным значениям, Å и Å [22]. Молекулярно-динамические расчеты на уровне DFT + U выполнены при температуре 300 K. Создание модели Universal Binding Energy Relationships (UBERs) [23–26] предоставляет альтернативные средства экстраполяции результатов расчетов в атомном масштабе на более длинные масштабы.Поэтому модель UBERs применяется для оценки механического поведения оксидной окалины толщиной 10 мкм и толщиной мкм.
2.2. Расчет напряжения
Механические свойства хрома оцениваются двумя способами. Первый подход — это «идеальное испытание на растяжение», которое учитывает равномерное удлинение модели (рис. 2(а)) до разрушения, обеспечивающее теоретическую прочность материала на растяжение. Этот подход проиллюстрирован на рисунке 2(b), где деформация растяжения действует через одноосное и равномерное расширение системы с расстоянием удлинения (Å).Второй подход рассматривает образование одиночной трещины в определенной межатомной плоскости за счет приложения растягивающей нагрузки, как показано на рисунке 2 (с). Комбинируя два подхода, можно рассчитать сопротивление разрушению модели толщиной 10 мкм и толщиной м с использованием модели UBERs, представленной в недавних теоретических исследованиях [13, 14].
2(а)) до разрушения, обеспечивающее теоретическую прочность материала на растяжение. Этот подход проиллюстрирован на рисунке 2(b), где деформация растяжения действует через одноосное и равномерное расширение системы с расстоянием удлинения (Å).Второй подход рассматривает образование одиночной трещины в определенной межатомной плоскости за счет приложения растягивающей нагрузки, как показано на рисунке 2 (с). Комбинируя два подхода, можно рассчитать сопротивление разрушению модели толщиной 10 мкм и толщиной м с использованием модели UBERs, представленной в недавних теоретических исследованиях [13, 14].
3. Результаты и обсуждение
3.1. Идеальное испытание на растяжение объемного материала Cr
2 O 3 В моделированном испытании на растяжение растягивающая деформация применяется путем удлинения системы вдоль направления приложенной нагрузки, как показано на рисунке 2(b).Приложенная нагрузка направлена вдоль кристаллографической оси (направление). Таким образом, осевое напряжение оценивается для последовательных удлинений. Полученная кривая напряжения-деформации (рис. 3(а)) обеспечивает максимум, указывающий на предел сопротивления разрушению материала. Значение напряжения до разрушения соответствует максимальному растягивающему напряжению (), которое может испытать моделируемая система. На рис. 3(а) показано, что рассчитанное методом DFT + U значение составляет 57,0 ГПа. Максимальная деформация () до разрушения равна 3.3 Å. Разрушение всегда происходит перпендикулярно направлению приложенной нагрузки (как показано на рис. 3(б)). Разлом возникает в середине системы, в верхней части октаэдра Cr–O, разрывая три самые длинные связи (2,048 Å в объеме), а три более короткие связи (1,935 Å в объеме) остаются. Он разделяет бислой Cr посередине, как показано на рисунке 3(c).
Таким образом, осевое напряжение оценивается для последовательных удлинений. Полученная кривая напряжения-деформации (рис. 3(а)) обеспечивает максимум, указывающий на предел сопротивления разрушению материала. Значение напряжения до разрушения соответствует максимальному растягивающему напряжению (), которое может испытать моделируемая система. На рис. 3(а) показано, что рассчитанное методом DFT + U значение составляет 57,0 ГПа. Максимальная деформация () до разрушения равна 3.3 Å. Разрушение всегда происходит перпендикулярно направлению приложенной нагрузки (как показано на рис. 3(б)). Разлом возникает в середине системы, в верхней части октаэдра Cr–O, разрывая три самые длинные связи (2,048 Å в объеме), а три более короткие связи (1,935 Å в объеме) остаются. Он разделяет бислой Cr посередине, как показано на рисунке 3(c).
Очевидно, что расчетное значение сильно завышено по сравнению с экспериментальным значением (0.18–0,40 ГПа [9–11], см. табл. 1). Хотя идеальное испытание на растяжение концептуально похоже на экспериментальное испытание на растяжение, существует большое расхождение между рассчитанными и экспериментально измеренными значениями . Мы предполагаем, что из-за отсутствия тепловых флуктуаций и структурных дефектов расчет завышен.
Мы предполагаем, что из-за отсутствия тепловых флуктуаций и структурных дефектов расчет завышен.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Влияние размера элементарной ячейки на расчетные свойства было исследовано путем удвоения размера элементарной ячейки вдоль направления (направления приложенной нагрузки). Кривая напряжение-деформация показана на рисунке 4 (а).Разрушение происходит в двух плоскостях, перпендикулярных направлению приложенной нагрузки (рис. 4(б)). Расчетное значение составляет 54,40 ГПа, что меньше, чем у суперячейки (1 × 1 × 1) (57,00 ГПа, таблица 1). Это указывает на то, что моделирование очень большой суперячейки, представляющей реальную систему, понизится до значения, близкого к экспериментальному. Однако из-за ограниченных компьютерных ресурсов исследование с более крупной суперячейкой выходит за рамки настоящего исследования. Мы также исследовали влияние температуры и дефектов на расчетное значение , что будет обсуждаться позже.
Кривая напряжение-деформация показана на рисунке 4 (а).Разрушение происходит в двух плоскостях, перпендикулярных направлению приложенной нагрузки (рис. 4(б)). Расчетное значение составляет 54,40 ГПа, что меньше, чем у суперячейки (1 × 1 × 1) (57,00 ГПа, таблица 1). Это указывает на то, что моделирование очень большой суперячейки, представляющей реальную систему, понизится до значения, близкого к экспериментальному. Однако из-за ограниченных компьютерных ресурсов исследование с более крупной суперячейкой выходит за рамки настоящего исследования. Мы также исследовали влияние температуры и дефектов на расчетное значение , что будет обсуждаться позже.
3.2. Локализация деформации в объеме Cr
2 O 3 Структура Локализация деформации в структуре Cr 2 O 3 исследована путем анализа структур, полученных при равномерном удлинении системы вдоль направления приложенной нагрузки. Изменение длин связей Cr–O вокруг одного атома Cr определяли в зависимости от приложенной деформации растяжения. Как показано на рисунке 5 (а), существуют три эквивалентные связи Cr-O (зеленые) над атомом Cr и еще три эквивалентные связи Cr-O (синие) ниже этого атома, что обозначено как .Для сравнения приняты те же обозначения, что и в [13]. Кривые изменения длины связи в зависимости от прочности на растяжение для связей Cr–O представлены на рисунке 5 (b), где зеленая кривая соответствует верхним связям Cr–O, а синяя кривая соответствует нижним связям Cr–O.
Как показано на рисунке 5 (а), существуют три эквивалентные связи Cr-O (зеленые) над атомом Cr и еще три эквивалентные связи Cr-O (синие) ниже этого атома, что обозначено как .Для сравнения приняты те же обозначения, что и в [13]. Кривые изменения длины связи в зависимости от прочности на растяжение для связей Cr–O представлены на рисунке 5 (b), где зеленая кривая соответствует верхним связям Cr–O, а синяя кривая соответствует нижним связям Cr–O.
Наблюдается, что длина связи Cr–O увеличивается примерно линейно с приложенным удлинением. Скорость изменения длины связи для связей Cr–O выше и ниже обозначенного атома Cr почти одинакова до тех пор, пока система не расколется.Отметим, что все атомы Cr в Cr 2 O 3 структурно эквивалентны. Наши результаты показывают, что все связи Cr–O в системе одинаково воспринимают растягивающую нагрузку, приложенную вдоль направления кристалла. После разрушения нижняя связь Cr–O сильно увеличивается (как показано на синей кривой на рисунке 5(b)), тогда как верхняя связь Cr–O уменьшается (как показано на зеленой кривой на рисунке 5(b)). ). Они хорошо согласуются с предыдущим теоретическим исследованием [13].
). Они хорошо согласуются с предыдущим теоретическим исследованием [13].
3.3. Модели UBER
Два разных предела, в которых материал может выдерживать приложенную нагрузку, можно рассматривать как уже изображенные на рисунке 2. Во-первых, система может выдерживать приложенную деформацию () за счет равномерного расширения на расстоянии (Å) вдоль направление приложенной нагрузки. Во-вторых, система может выдерживать приложенную деформацию (), образуя одиночную трещину шириной (Å).
В обоих случаях было выполнено несколько расчетов полной оптимизации для различных значений, после чего для каждого расчета оценивалась энергия системы.Кривые сравнения построены для обоих видов ограничений, как показано на рисунке 6(а).
Для расширенной системы разрушение произошло при Å (розовая кривая на рис. 6(а)), тогда как для системы с внедренной трещиной разрушение началось при более низком значении (ниже 1,5 Å, синяя кривая на рис. 6(а) ( а)). При промежуточном значении Å энергия равномерно расширенной системы была равна энергии системы с внедренной трещиной. Это удлинение () соответствует максимальному значению δ , которое может испытать система до отказа.Комбинация розовой и синей кривых приводит к рисунку 6(b), где можно оценить как 1,8 Å. Оценка напряжения в этой точке дает оценку .
Это удлинение () соответствует максимальному значению δ , которое может испытать система до отказа.Комбинация розовой и синей кривых приводит к рисунку 6(b), где можно оценить как 1,8 Å. Оценка напряжения в этой точке дает оценку .
Перенормировка и в безразмерные величины может быть выполнена в соответствии со следующими уравнениями: где — поверхностная энергия. где — число стехиометрических единиц и — одноосная упругая постоянная, определяемая наклоном графика зависимости.
Кривая (рис. 6(с)), полученная путем построения зависимости, называется UBER; его универсальность подразумевает, что все материалы должны подчиняться этому соотношению.Более подробную информацию можно получить из аналогичного исследования по Cr 2 O 3 [13].
Для модели толщиной 10 мкм и толщиной м = 0,531 ГПа. рассчитывается по (2), где 1 (максимум кривой зависимости, рис. 6(в)). Расчетное значение для образца толщиной 10 мкм и толщиной м составляет 166 Å.
Расчетные значения (Å) и (ГПа) сравниваются с экспериментальными значениями в таблице 1. Диапазон экспериментальных значений составляет от 0,18 до 0,40 ГПа. Как обсуждалось ранее, рассчитанные значения DFT + U сильно завышены по сравнению с экспериментальным значением 57.00 ГПа для равномерно расширенной системы и 39,90 ГПа для системы с внедренной трещиной (значения в скобках). Как показывают значения , переход между равномерно расширенным и растрескавшимся режимами происходит при 1,80 (Å) при приложении нагрузки вдоль направления. Это можно визуализировать на кривой сравнения (рис. 6(b)). Переход между равномерно расширенным и растрескавшимся режимами плавный, а кривая имеет ожидаемую форму: показывает примерно гармоническую зависимость от при малых значениях и асимптотически приближается к постоянному значению при стремлении к бесконечности.Значение 0,53 ГПа, полученное для образца толщиной 10 мкм м по модели UBERs (см. табл. 1), хорошо согласуется с экспериментом. Это показывает способность UBER преобразовывать результаты расчетов в атомном масштабе в реалистичные значения механических свойств в гораздо более длинных масштабах.
Это показывает способность UBER преобразовывать результаты расчетов в атомном масштабе в реалистичные значения механических свойств в гораздо более длинных масштабах.
3.4. Влияние температуры
В действительности экспериментальные измерения свойств при растяжении проводятся при комнатной температуре. Чтобы смоделировать реальную ситуацию, дальнейшее исследование было проведено при 300 K с моделированием МД.Растягивающее напряжение применяется путем удлинения системы в направлении приложенной нагрузки, как показано на рисунке 2 (б). Для каждой приложенной нагрузки было выполнено несколько МД-расчетов при 300 К. Максимальная деформация () до разрушения составляет 1,4 Å для Cr 2 O 3 при 300 К, что значительно меньше, чем при 0 К (3,3 Å). Структуры до и после разрушения показаны на рисунке 7. Как и при 0 K, разрушение происходит в средней точке двойного слоя Cr, и образующиеся полуслои Cr перемещаются к соседним слоям O.Значение напряжения в этой точке на кривой напряжение-деформация (максимальное растягивающее напряжение) составляет 21,50 ГПа. По сравнению с экспериментальным значением наблюдается меньшее завышение максимальной прочности при растяжении при 300 К, чем при 0 К (табл. 1).
По сравнению с экспериментальным значением наблюдается меньшее завышение максимальной прочности при растяжении при 300 К, чем при 0 К (табл. 1).
3.5. Cr-дефектный Cr
2 O 3Для Cr-дефектного Cr 2 O 3 деформация растяжения создается за счет удлинения системы вдоль направления приложенной нагрузки, как описано выше (см. рис. 2). (б)).Это делается для серии деформаций, а затем для каждой деформации оценивается напряжение вдоль направления приложенной нагрузки. Наблюдается, что разрушение происходит перпендикулярно оси приложенной нагрузки, а материал разрушается вблизи дефекта, как показано на рисунках 8 (а) и 8 (б).
Полученная кривая зависимости напряжения от деформации (рис. 8(c)) дает максимум, указывающий на механическое разрушение материала. Значение напряжения в этой точке на кривой напряжение-деформация соответствует максимальному растягивающему напряжению (), которое может выдержать моделируемая система. На рисунке 8(c) видно, что рассчитанное методом DFT + U значение составляет 22,70 ГПа. Максимальная деформация () перед разрушением составляет 2,5 Å. По сравнению с экспериментальным значением наблюдается меньшее завышение максимального предела прочности при растяжении в Cr-дефектной системе, чем в недефектной (табл. 1). Это разумно, так как наличие дефекта снижает напряжение, необходимое для образования трещины или механического разрушения в системе. Поскольку все атомы Cr в Cr 2 O 3 структурно эквивалентны, изменение местоположения дефекта не будет изменять максимальное растягивающее напряжение и деформацию системы.Расчетные значения и будут уменьшаться с уменьшением концентрации дефектов Cr в структуре и сходиться к экспериментальным значениям для очень малой концентрации вакансий. Следует отметить, что из-за ограниченного размера модели одна вакансия на элементарную ячейку соответствует очень высокой концентрации вакансий (3,33%).
На рисунке 8(c) видно, что рассчитанное методом DFT + U значение составляет 22,70 ГПа. Максимальная деформация () перед разрушением составляет 2,5 Å. По сравнению с экспериментальным значением наблюдается меньшее завышение максимального предела прочности при растяжении в Cr-дефектной системе, чем в недефектной (табл. 1). Это разумно, так как наличие дефекта снижает напряжение, необходимое для образования трещины или механического разрушения в системе. Поскольку все атомы Cr в Cr 2 O 3 структурно эквивалентны, изменение местоположения дефекта не будет изменять максимальное растягивающее напряжение и деформацию системы.Расчетные значения и будут уменьшаться с уменьшением концентрации дефектов Cr в структуре и сходиться к экспериментальным значениям для очень малой концентрации вакансий. Следует отметить, что из-за ограниченного размера модели одна вакансия на элементарную ячейку соответствует очень высокой концентрации вакансий (3,33%).
4. Выводы
Механические свойства, связанные с разрушением хрома (Cr 2 O 3 ), были оценены теоретически. Оценка стресса проводилась двумя способами.Первый подход учитывает эффект воздействия на материал увеличивающихся растягивающих нагрузок до тех пор, пока не произойдет разрушение, и обеспечивает теоретическую прочность материала на растяжение. Второй подход рассматривает образование одиночной трещины поперек определенной межатомной плоскости за счет приложения растягивающей нагрузки.
Оценка стресса проводилась двумя способами.Первый подход учитывает эффект воздействия на материал увеличивающихся растягивающих нагрузок до тех пор, пока не произойдет разрушение, и обеспечивает теоретическую прочность материала на растяжение. Второй подход рассматривает образование одиночной трещины поперек определенной межатомной плоскости за счет приложения растягивающей нагрузки.
Расчеты свойств, связанных с напряжением, были выполнены с использованием подхода DFT + U с применением периодических моделей. Затем результаты на атомном уровне были экстраполированы с использованием модели UBERs, чтобы получить реалистичную оценку для образца толщиной 10 мкм мкм.Наше исследование также показывает, что температура и наличие точечных дефектов играют важную роль в механических свойствах, связанных с разрушением. Было замечено, что напряжение для объемного хрома является растягивающим. Они хорошо согласуются с экспериментальными наблюдениями. Продолжаются исследования, чтобы понять локализацию напряжения/деформации в границах зерен оксидов хрома с применением вышеупомянутых методов и методов.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Благодарности
Получение докторской стипендии от Electricite de France (EDF) для поддержки Мажарула М. Ислама.
mp-19399: Cr2O3 (тригональный, R-3c, 167)
@статья{Jain2013,
автор = {Джайн, Анубхав и Онг, Шью Пинг и Отье, Жоффруа и Чен, Вей и Ричардс, Уильям Дэвидсон и Дачек, Стивен и Чолия, Шреяс и Гюнтер, Дэн и Скиннер, Дэвид и Седер, Гербранд и Перссон, Кристин а. },
дои = {10.1063/1.4812323},
иссн = {2166532X},
журнал = {Материалы APL},
число = {1},
страницы = {011002},
title = {{Commentary: The Materials Project: генетический подход к ускорению инноваций в области материалов}},
URL = {https://doi.org/10.1063/1.4812323},
громкость = {1},
год = {2013}
} @статья{Hill2010,
автор = «Хилл, А. Х. и Харрисон, А., и Дикинсон, К., и Вузонг, Чжоу, и Кокельманн, В.»,
title = «Кристаллографические и магнитные исследования мезопористого эсколаита, Cr2O3»,
журнал = «Микропористые и мезопористые материалы»,
год = «2010»,
громкость = «130»,
страницы = «280-286»,
ASTM_id = «MIMMFJ»
} @статья{Рехи2000,
автор = «Рехи, С. Дубровинский Л.С. и Ахуджа, Р. и Саксена, С.К. и Йоханссон, Б.»,
title = «Экспериментальные и теоретические исследования эсколаита (Cr O3) при высоких давлениях»,
журнал = «Журнал сплавов и соединений»,
год = «2000»,
объем = «302»,
страницы = «16-20»,
ASTM_id = «ДЖАЛСЕУ»
} @статья{Кантор2012,
автор = «Кантор А. и Кантор И. и Мерлини М. и Глазырин К. и Прешер К. и Ханфланд М. и Дубровинский Л.»,
title = «Структурные исследования эсколаита под высоким давлением методом рентгеновской дифракции монокристаллов»,
журнал = «Американский минералог»,
год = «2012»,
громкость = «97»,
страницы = «1764-1770»,
ASTM_id = «АММИАЙ»
} @статья{Ян2008,
автор = «Янг, Дж.»,
title = «Структурный анализ перовскита La Cr(1-x) Ni(x) O3 с помощью уточнения по методу Ритвельда данных порошковой рентгеновской дифракции»,
журнал = «Acta Crystallographica, Section B: Structural Science»,
год = «2008»,
громкость = «64»,
страницы = «281-286»,
ASTM_id = «ASBSDK»
} @статья{Грэм1960,
автор = «Грэм, Дж.
Дубровинский Л.С. и Ахуджа, Р. и Саксена, С.К. и Йоханссон, Б.»,
title = «Экспериментальные и теоретические исследования эсколаита (Cr O3) при высоких давлениях»,
журнал = «Журнал сплавов и соединений»,
год = «2000»,
объем = «302»,
страницы = «16-20»,
ASTM_id = «ДЖАЛСЕУ»
} @статья{Кантор2012,
автор = «Кантор А. и Кантор И. и Мерлини М. и Глазырин К. и Прешер К. и Ханфланд М. и Дубровинский Л.»,
title = «Структурные исследования эсколаита под высоким давлением методом рентгеновской дифракции монокристаллов»,
журнал = «Американский минералог»,
год = «2012»,
громкость = «97»,
страницы = «1764-1770»,
ASTM_id = «АММИАЙ»
} @статья{Ян2008,
автор = «Янг, Дж.»,
title = «Структурный анализ перовскита La Cr(1-x) Ni(x) O3 с помощью уточнения по методу Ритвельда данных порошковой рентгеновской дифракции»,
журнал = «Acta Crystallographica, Section B: Structural Science»,
год = «2008»,
громкость = «64»,
страницы = «281-286»,
ASTM_id = «ASBSDK»
} @статья{Грэм1960,
автор = «Грэм, Дж.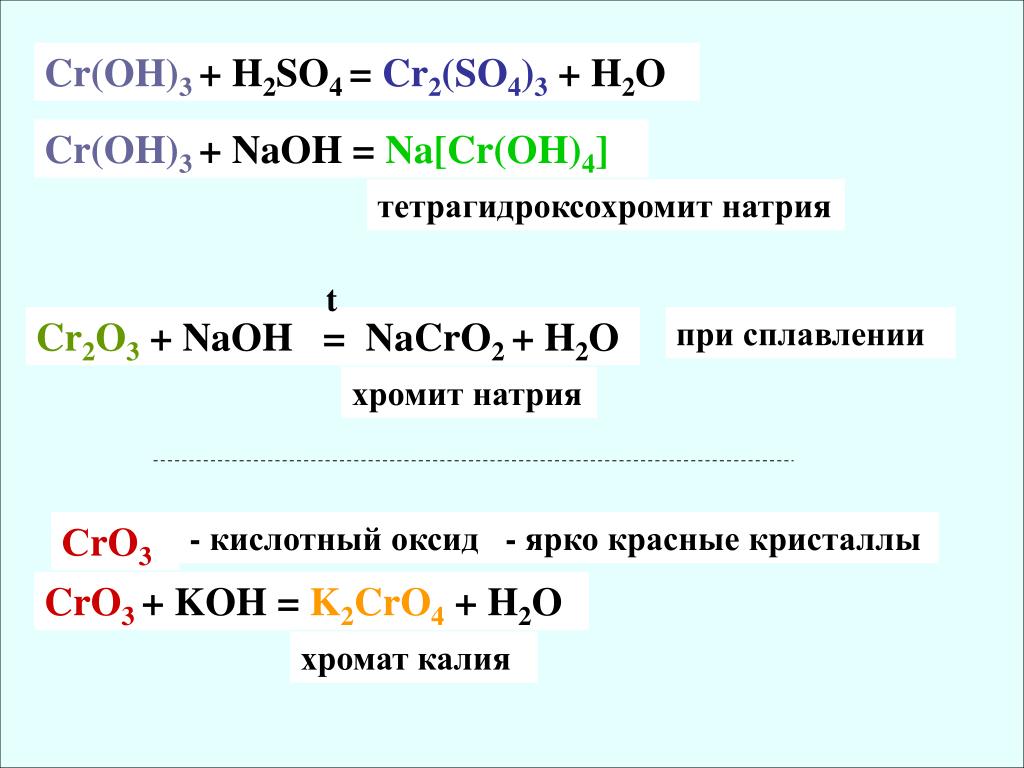 «,
title = «Шаг решетки и цвет в системе оксид алюминия — оксид хрома»,
journal = «Журнал физики и химии твердого тела»,
год = «1960»,
громкость = «17»,
страницы = «18-25»,
ASTM_id = «JPCSAW»
} @статья{Ньюнхэм1962,
автор = «Ньюнхэм, Р.Э. и де Хаан, Ю.М.»,
title = «Уточнение альфа-структур Al2 O3, Ti2 O3, V2 O3 и Cr2 O3»,
журнал = «Zeitschrift fuer Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie (-144,1977)»,
год = «1962»,
громкость = «117»,
страницы = «235-237»,
ASTM_id = «ЗЕКГАКС»
} @article{Белоконева2003,
автор = «Белоконева Е.Л. и Щербакова Ю.К.»,
title = «Электронная плотность в синтетическом эсколаите Cr2O3 со структурой корунда и ее связь с антиферромагнитными свойствами»,
журнал = «Журнал Неорганической Химии»,
год = «2003»,
громкость = «48»,
страницы = «960-968»,
ASTM_id = «ЗНОКАК»
} @статья{Finger1980,
автор = «Палец, Л.В. и Хазен, Р.М.»,
title = «Кристаллическая структура и изотермическое сжатие Fe2O3, Cr2O3 и V2O3 до 50 кбар»,
журнал = «Журнал прикладной физики»,
год = «1980»,
громкость = «51»,
страницы = «5362-5367»,
ASTM_id = «ЯПИАУ»
} @статья{Baster2000,
автор = «Бастер, М.
«,
title = «Шаг решетки и цвет в системе оксид алюминия — оксид хрома»,
journal = «Журнал физики и химии твердого тела»,
год = «1960»,
громкость = «17»,
страницы = «18-25»,
ASTM_id = «JPCSAW»
} @статья{Ньюнхэм1962,
автор = «Ньюнхэм, Р.Э. и де Хаан, Ю.М.»,
title = «Уточнение альфа-структур Al2 O3, Ti2 O3, V2 O3 и Cr2 O3»,
журнал = «Zeitschrift fuer Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie (-144,1977)»,
год = «1962»,
громкость = «117»,
страницы = «235-237»,
ASTM_id = «ЗЕКГАКС»
} @article{Белоконева2003,
автор = «Белоконева Е.Л. и Щербакова Ю.К.»,
title = «Электронная плотность в синтетическом эсколаите Cr2O3 со структурой корунда и ее связь с антиферромагнитными свойствами»,
журнал = «Журнал Неорганической Химии»,
год = «2003»,
громкость = «48»,
страницы = «960-968»,
ASTM_id = «ЗНОКАК»
} @статья{Finger1980,
автор = «Палец, Л.В. и Хазен, Р.М.»,
title = «Кристаллическая структура и изотермическое сжатие Fe2O3, Cr2O3 и V2O3 до 50 кбар»,
журнал = «Журнал прикладной физики»,
год = «1980»,
громкость = «51»,
страницы = «5362-5367»,
ASTM_id = «ЯПИАУ»
} @статья{Baster2000,
автор = «Бастер, М. и Бури, Ф. и Ковальска, А. и Латач, З.»,
title = «Изменение кристаллических и обменных параметров вблизи TN в Cr2 O3»,
журнал = «Журнал сплавов и соединений»,
год = «2000»,
объем = «296»,
страницы = «1-5»,
ASTM_id = «ДЖАЛСЕУ»
} @статья{Бруксбанк1968,
автор = «Бруксбэнк, Д.и Эндрюс, К.В.»,
title = «Температурное расширение некоторых включений, обнаруженных в сплавах, и отношение к мозаичным напряжениям»,
Journal = «Журнал Института железа и стали (Лондон)»,
год = «1968»,
громкость = «206»,
страницы = «595-599»,
ASTM_id = «ДЖИСИАКС»
} @статья{Гольдшмидт1928,
автор = «Гольдшмидт, В.М. и Барт, Т. и Лунде, Г.В.В.»,
title = «Untersuchungen ueber die Kristallstruktur von Sesquioxyden und Verbindungen A B O3»,
журнал = «Skrifter utgitt av det Norske Videnskaps-Akademi i Oslo 1: Matematisk-Naturvidenskapelig Klasse»,
год = «1928»,
объем = «1928»,
страницы = «1-165»,
ASTM_id = «САНВАК»
} @article{Saalfeld1964,
автор = «Заальфельд, Х.
и Бури, Ф. и Ковальска, А. и Латач, З.»,
title = «Изменение кристаллических и обменных параметров вблизи TN в Cr2 O3»,
журнал = «Журнал сплавов и соединений»,
год = «2000»,
объем = «296»,
страницы = «1-5»,
ASTM_id = «ДЖАЛСЕУ»
} @статья{Бруксбанк1968,
автор = «Бруксбэнк, Д.и Эндрюс, К.В.»,
title = «Температурное расширение некоторых включений, обнаруженных в сплавах, и отношение к мозаичным напряжениям»,
Journal = «Журнал Института железа и стали (Лондон)»,
год = «1968»,
громкость = «206»,
страницы = «595-599»,
ASTM_id = «ДЖИСИАКС»
} @статья{Гольдшмидт1928,
автор = «Гольдшмидт, В.М. и Барт, Т. и Лунде, Г.В.В.»,
title = «Untersuchungen ueber die Kristallstruktur von Sesquioxyden und Verbindungen A B O3»,
журнал = «Skrifter utgitt av det Norske Videnskaps-Akademi i Oslo 1: Matematisk-Naturvidenskapelig Klasse»,
год = «1928»,
объем = «1928»,
страницы = «1-165»,
ASTM_id = «САНВАК»
} @article{Saalfeld1964,
автор = «Заальфельд, Х.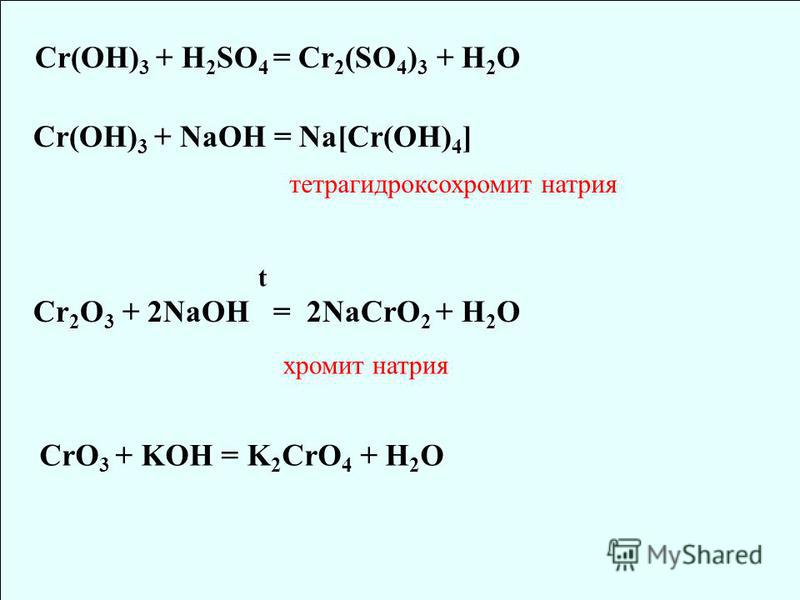 «,
title = «Strukturuntersuchungen im System Al2 O3 — Cr2 O3»,
журнал = «Zeitschrift fuer Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie (-144,1977)»,
год = «1964»,
громкость = «120»,
страницы = «342-348»,
ASTM_id = «ЗЕКГАКС»
} @статья{Wessel2013,
автор = «Вессель, К. и Дронсковски, Р.»,
title = «Первопринципное исследование полутораоксида хрома, Cr2 O3»,
журнал = «Журнал химии твердого тела»,
год = «2013»,
громкость = «199»,
страницы = «149-153»,
ASTM_id = «JSSCBI»
} @статья{Battle1988,
автор = «Битва, П.Д. и Гибб, Т.С. и Никсон, С. и Харрисон, WTA»,
title = «Магнитные свойства синтетического лангбейнита K Ba Cr2 (PO4)3»,
журнал = «Журнал химии твердого тела»,
год = «1988»,
громкость = «75»,
страницы = «21-29»,
ASTM_id = «JSSCBI»
} @article{Zachariasen1928,
автор = «Захариасен, WH»,
title = «Untersuchungen ueber die Kristallstruktur von Sesquioxyden und Verbindungen A B O3»,
журнал = «Skrifter utgitt av det Norske Videnskaps-Akademi i Oslo 1: Matematisk-Naturvidenskapelig Klasse»,
год = «1928»,
объем = «1928»,
страницы = «6-166»,
ASTM_id = «САНВАК»
} @статья{Sawada1994,
автор = «Савада, Х.
«,
title = «Strukturuntersuchungen im System Al2 O3 — Cr2 O3»,
журнал = «Zeitschrift fuer Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie (-144,1977)»,
год = «1964»,
громкость = «120»,
страницы = «342-348»,
ASTM_id = «ЗЕКГАКС»
} @статья{Wessel2013,
автор = «Вессель, К. и Дронсковски, Р.»,
title = «Первопринципное исследование полутораоксида хрома, Cr2 O3»,
журнал = «Журнал химии твердого тела»,
год = «2013»,
громкость = «199»,
страницы = «149-153»,
ASTM_id = «JSSCBI»
} @статья{Battle1988,
автор = «Битва, П.Д. и Гибб, Т.С. и Никсон, С. и Харрисон, WTA»,
title = «Магнитные свойства синтетического лангбейнита K Ba Cr2 (PO4)3»,
журнал = «Журнал химии твердого тела»,
год = «1988»,
громкость = «75»,
страницы = «21-29»,
ASTM_id = «JSSCBI»
} @article{Zachariasen1928,
автор = «Захариасен, WH»,
title = «Untersuchungen ueber die Kristallstruktur von Sesquioxyden und Verbindungen A B O3»,
журнал = «Skrifter utgitt av det Norske Videnskaps-Akademi i Oslo 1: Matematisk-Naturvidenskapelig Klasse»,
год = «1928»,
объем = «1928»,
страницы = «6-166»,
ASTM_id = «САНВАК»
} @статья{Sawada1994,
автор = «Савада, Х. «,
title = «Исследование остаточной электронной плотности полуторного оксида хрома по кристаллической структуре и уточнению коэффициента рассеяния»,
журнал = «Бюллетень материаловедения»,
год = «1994»,
громкость = «29»,
страницы = «239-245»,
ASTM_id = «MRBUAC»
}
«,
title = «Исследование остаточной электронной плотности полуторного оксида хрома по кристаллической структуре и уточнению коэффициента рассеяния»,
журнал = «Бюллетень материаловедения»,
год = «1994»,
громкость = «29»,
страницы = «239-245»,
ASTM_id = «MRBUAC»
}
Неблагородный, эффективный катализатор из наночастиц α-Cr2O3 без носителя для низкотемпературного окисления СО продукты при 400–800 °С представлены на рис.. В ИК спектре образца Cr
2 O 3 наблюдается сильное поглощение на 523 см −1 , широкое плечо на 839 см −1 , резкая полоса на 1384 см −1 , слабое плечо на 1468 см -1 и слабая полоса 1628 см -1 . В спектре также присутствует сильная и широкая полоса с центром около 3416 см -1 . Широкая полоса, показанная при 3416 см -1 , обусловлена υO-H гидроксильных групп, связанных Н-связями. Пик при 1628 см -1 можно отнести к деформационным колебаниям δH-O-H физически адсорбированной молекулы воды. Полоса 1467 см −1 относится к υCOO карбонатных примесей. Поглощение при 1384 см -1 обусловлено колебаниями υNO 3 — , которые исходят от предшественника металла. Полосы ниже 1000 см -1 связаны с полосами υCr-O. ИК-спектры продуктов прокаливания (при 400–800 °С) существенно отличаются от свежеприготовленного Cr 2 O 3 . ИК-спектр Cr 2 O 3 -4 показывает только две резкие сильные полосы при 640 и 581 см -1 , в дополнение к гораздо более слабому поглощению при 3453 см -1 .При дальнейшем повышении температуры прокаливания до 800 °С появляются две дополнительные низкочастотные полосы при 445 и 414 см -1 . Четыре поглощения при 661, 574, 445 и 414 см -1 приписываются колебанию решетки υCr-O кристаллитов α-Cr 2 O 3 22 .
Полоса 1467 см −1 относится к υCOO карбонатных примесей. Поглощение при 1384 см -1 обусловлено колебаниями υNO 3 — , которые исходят от предшественника металла. Полосы ниже 1000 см -1 связаны с полосами υCr-O. ИК-спектры продуктов прокаливания (при 400–800 °С) существенно отличаются от свежеприготовленного Cr 2 O 3 . ИК-спектр Cr 2 O 3 -4 показывает только две резкие сильные полосы при 640 и 581 см -1 , в дополнение к гораздо более слабому поглощению при 3453 см -1 .При дальнейшем повышении температуры прокаливания до 800 °С появляются две дополнительные низкочастотные полосы при 445 и 414 см -1 . Четыре поглощения при 661, 574, 445 и 414 см -1 приписываются колебанию решетки υCr-O кристаллитов α-Cr 2 O 3 22 . FT-IR-спектры полученного Cr 2 O 3 и продуктов его прокаливания при 400°, 600° и 800°C. На рис.. Из результатов очевидно, что полученный Cr 2 O 3 в значительной степени некристаллит, что отражается в его гелеобразной природе. Показано, что продукты прокаливания являются кристаллическими. Показано, что кристалличность увеличивается с температурой прокаливания. Несмотря на это, показано, что продукты прокаливания демонстрируют одинаковую дифракционную картину, аналогичную картине, представленной в карточке JCPDS №. 01-1294 23 для α-Cr 2 O 3 .Размер кристалла можно рассчитать по формуле Дебая-Шеррера:
На рис.. Из результатов очевидно, что полученный Cr 2 O 3 в значительной степени некристаллит, что отражается в его гелеобразной природе. Показано, что продукты прокаливания являются кристаллическими. Показано, что кристалличность увеличивается с температурой прокаливания. Несмотря на это, показано, что продукты прокаливания демонстрируют одинаковую дифракционную картину, аналогичную картине, представленной в карточке JCPDS №. 01-1294 23 для α-Cr 2 O 3 .Размер кристалла можно рассчитать по формуле Дебая-Шеррера:
, где K — коэффициент формы, k = 0,89, λ — длина волны излучения Cu-Kα, β — полная ширина на половине максимума, а θ — угол получено из значений 2θ, соответствующих пику максимальной интенсивности на рентгенограмме. Установлено, что средние значения размеров кристаллитов зависят от температуры и равны 36 нм, 40 нм и 56 нм для Cr 2 O 3 -4, Cr 2 O 3 -6 и Cr 2 О 3 -8 соответственно.
Порошковые рентгеновские дифрактограммы исходного Cr 2 O 3 и продуктов его прокаливания (400°–800 °C). пики, отмеченные *, относятся к держателю образца Pt/Rh.
Результаты XPS, полученные для хрома, Cr 2 O 3 -4, показаны на рис. Энергии связи всех деконволютивных пиков исследованных образцов приведены в табл. Было обнаружено, что значения энергии связи электрона Cr(2p) находятся на уровне 586 и 587 эВ для Cr 2p 1/2 и 576 и 579 эВ для Cr 2p 3/2 соответственно.Нижний пик энергии связи, расположенный при 576 эВ, соответствует состоянию Cr 3+ 24 . В то время как пик, расположенный при 579 эВ, относится к более высокой степени окисления Cr 6+ 24 . Результаты показывают, что, несмотря на то, что продукты прокаливания по существу представляют собой α-Cr 2 O 3 , поверхность частично окисляется, обнажая ионы Cr ≥3+ . Аналогичные результаты были получены Fahim, и др. . 25 . Поверхностные атомные отношения Cr ≥3+ /Cr 3+ , рассчитанные по сигналу 2p XPS Cr, составляют 0,18, 0,32, 0,42, 0,31 для Cr 2 O 3 -RT, Cr 2 2 O 3 -4, Cr 2 O 3 -6 и Cr 2 O 3 -8 соответственно. Небольшое количество поверхностных OH -1 связано с неизбежной физической адсорбцией воды на поверхности 26 . Спектр XPS O1s показал три компонента с энергиями связи O1s на уровне 529.7, и 531,1 эВ отнесены к кислороду решетки, а пик при 533,2 эВ отнесен к поверхностным дефектам и/или адсорбированным поверхностным гидроксилам 27 . Поверхностное атомное отношение O/Cr составило 4,6, 2,8, 2,1 и 2,1 для Cr 2 O 3 -RT, Cr 2 O 3 -4, Cr 2 O1 3 -6 и Cr 2 O 3 -8 соответственно.
Аналогичные результаты были получены Fahim, и др. . 25 . Поверхностные атомные отношения Cr ≥3+ /Cr 3+ , рассчитанные по сигналу 2p XPS Cr, составляют 0,18, 0,32, 0,42, 0,31 для Cr 2 O 3 -RT, Cr 2 2 O 3 -4, Cr 2 O 3 -6 и Cr 2 O 3 -8 соответственно. Небольшое количество поверхностных OH -1 связано с неизбежной физической адсорбцией воды на поверхности 26 . Спектр XPS O1s показал три компонента с энергиями связи O1s на уровне 529.7, и 531,1 эВ отнесены к кислороду решетки, а пик при 533,2 эВ отнесен к поверхностным дефектам и/или адсорбированным поверхностным гидроксилам 27 . Поверхностное атомное отношение O/Cr составило 4,6, 2,8, 2,1 и 2,1 для Cr 2 O 3 -RT, Cr 2 O 3 -4, Cr 2 O1 3 -6 и Cr 2 O 3 -8 соответственно. Ожидается более высокое отношение при низкой температуре прокаливания, и оно связано с образованием Cr 2 O 3 .Структура nH 2 O (структура оксид-гидроксид). Это также видно из присутствия двух типов сигналов O 2– , показанных в таблице: считается, что более низкая энергия связи относится к поверхностному решеточному кислороду из негидратированной формулы Cr 2 O 3 , в то время как более высокий изгиб энергию получают из воды, связанной с формулой хрома (т.е. гидратированный Cr 2 O 3 ). Третий пик около 533 эВ соответствует частицам OH − /H 2 O, физико-сорбированным на поверхности.Другими словами, кроме сигнала XPS кислорода решетки, есть два других сигнала, обусловленных двумя типами воды, взаимодействующими с поверхностями катализатора. Один из них возникает из-за хемосорбированной воды, чему способствует наличие дефектов / вакансий в решетке, а другой — из-за физисорбированных молекул воды, испытывающих диполь-дипольные взаимодействия с кислородом решетки.
Ожидается более высокое отношение при низкой температуре прокаливания, и оно связано с образованием Cr 2 O 3 .Структура nH 2 O (структура оксид-гидроксид). Это также видно из присутствия двух типов сигналов O 2– , показанных в таблице: считается, что более низкая энергия связи относится к поверхностному решеточному кислороду из негидратированной формулы Cr 2 O 3 , в то время как более высокий изгиб энергию получают из воды, связанной с формулой хрома (т.е. гидратированный Cr 2 O 3 ). Третий пик около 533 эВ соответствует частицам OH − /H 2 O, физико-сорбированным на поверхности.Другими словами, кроме сигнала XPS кислорода решетки, есть два других сигнала, обусловленных двумя типами воды, взаимодействующими с поверхностями катализатора. Один из них возникает из-за хемосорбированной воды, чему способствует наличие дефектов / вакансий в решетке, а другой — из-за физисорбированных молекул воды, испытывающих диполь-дипольные взаимодействия с кислородом решетки.
XPS-пики после деконволюции ( A ) O (1s) и ( B ) Cr (2p) и для Cr 2 O 3 -4.
Таблица 1
Данные РФЭС для полученного Cr 2 O 3 и продуктов его прокаливания (400°–800 °C).
| Test Catalyst | Состав поверхности | ||||
|---|---|---|---|---|---|
| вид # | 4 BE (EV)|||||
| O (1S) | О 2- | 529,6 | |||
| О(1с) | О 2- | 531.2 | |||
| CR 3+ | 576.8|||||
| CR 6+ | 578.9 | ||||
| CR 3+ | 2 5865|||||
| CR 6+ | 588.3 | ||||
| Cr 2 O 3 -4 | O(1s) | O 2− | 529.9 | ||
| CR 3+ | 2 576.|||||
| CR 6+ | CR 3+ | 585.7 | |||
| Кр(2п1/2) | Кр 6+ | 587.9 | |||
| O 2- | 2 529.8|||||
| O 2- | 531.4 | ||||
| OH | OH — | 532.9 | |||
| CR 6+ | 578,3 | ||||
| Cr(2p1/2) | Cr 3+ | 585. 9 9 | |||
| O (1S) | O 2- | 529.6 | |||
| O (1S) | O 2- 1 | 2 5315||||
| CR 3+ | 576.0 | ||||
| Кр(2р3/2) | Кр 6+ | 578.2 | |||
| CR | 585.7 | ||||
| CR 6+ | 2 587.|||||
| Материал | В P /(см 3 /г) | р p /nm | S B /(m 2 /g) | S C /(m 2 /g) | L / NM|
|---|---|---|---|---|---|
| 4 | 4 | 2 127130 | 2 0|||
0. 094 094 | 11 | 11 | 29 | 29 | 2 36|
| 14 | 2 142 252 232 36|||||
| 0.039 | 23 | 2 2317 | 133 | 133 | 52 |
SEM Изображения, полученные для как полученного CR 2 O 3 и его кальцинированные продукты при 400 ° -800 °С показаны на рис.. СЭМ показывает, что полученные продукты Cr 2 O 3 и Cr 2 O 3 -4 имеют неправильные скопления частиц с нечеткими контурами, тогда как прокаленные образцы при ≥600°C дают другую морфология характеризуется однородным размером частиц, показывающим квазисферические частицы.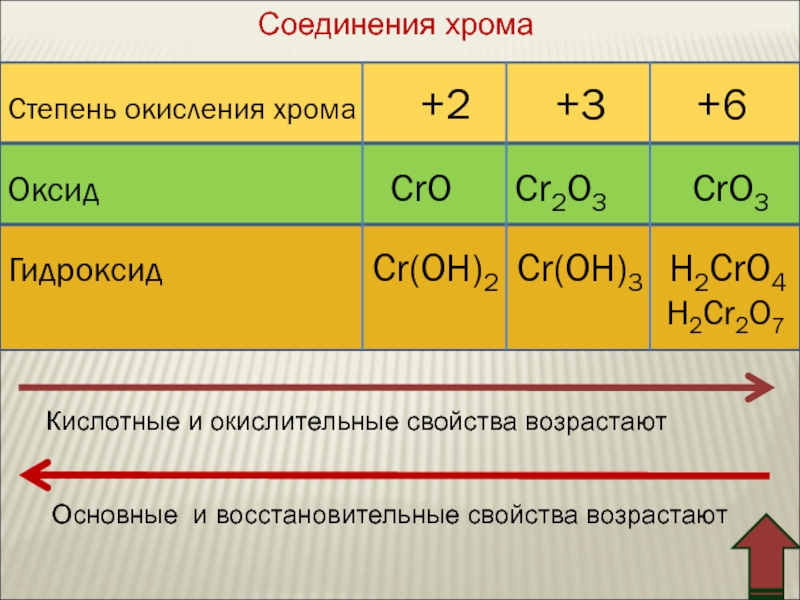 Также видно, что размер этих частиц увеличивается с температурой прокаливания от 600° до 800 °С.
Также видно, что размер этих частиц увеличивается с температурой прокаливания от 600° до 800 °С.
СЭМ-микрофотографии полученного Cr 2 O 3 и продуктов его прокаливания при 400°, 600° и 800 °C.
Активность окисления CO
На поверхностях хрома окислительно-восстановительные пары Cr 3+ /Cr >+3 являются важными центрами каталитического окисления 29 . На рисунке сравниваются графики конверсии CO в зависимости от температуры реакции для хромистых катализаторов, полученных из Cr 2 O 3 , при различных температурах прокаливания.
( A ) Графики превращения CO в зависимости от температуры реакции для наночастиц Cr 2 O 3 при различных температурах прокаливания.( B ) Число оборотов трех исследуемых катализаторов при 100 °C.
Полученные результаты показывают, что окисление СО на хромовых катализаторах активно происходит при низких температурах, как показано на рис. . T 100 представляет собой температуру, при которой 100% CO окислялось, а T 50 представляет собой температуру зажигания, и их соответствующие значения представлены в таблице, в которой настоящие результаты сравнивались с соответствующими неблагородными катализаторами, указанными в литература.Наши результаты также показывают, что хром, полученный при низкой температуре прокаливания (400°С), более активен, чем полученный при высоких температурах прокаливания (600° или 800°С). По данным РФЭС мы обнаружили, что чем выше температура прокаливания, тем ниже поверхностное содержание центров Cr >+3 . Поскольку известно, что на поверхностях хрома тесно связанные центры Cr 3+ -Cr >+3 облегчают подвижность электронов, необходимую для окисления СО, и, таким образом, считаются активными центрами 29 .Следовательно, падение активности при повышении температуры прокаливания может быть связано с сопутствующими потерями или избыточными изменениями на поверхности хрома.
. T 100 представляет собой температуру, при которой 100% CO окислялось, а T 50 представляет собой температуру зажигания, и их соответствующие значения представлены в таблице, в которой настоящие результаты сравнивались с соответствующими неблагородными катализаторами, указанными в литература.Наши результаты также показывают, что хром, полученный при низкой температуре прокаливания (400°С), более активен, чем полученный при высоких температурах прокаливания (600° или 800°С). По данным РФЭС мы обнаружили, что чем выше температура прокаливания, тем ниже поверхностное содержание центров Cr >+3 . Поскольку известно, что на поверхностях хрома тесно связанные центры Cr 3+ -Cr >+3 облегчают подвижность электронов, необходимую для окисления СО, и, таким образом, считаются активными центрами 29 .Следовательно, падение активности при повышении температуры прокаливания может быть связано с сопутствующими потерями или избыточными изменениями на поверхности хрома. Стоит отметить, что три испытуемых образца хрома имеют сопоставимую площадь поверхности, поэтому площадь поверхности может не быть ключевым параметром при формировании активности окисления СО на данных испытуемых образцах. Кроме того, хром является кислым оксидом, и, следовательно, основные центры поверхности также имеют меньшее значение для каталитической активности поверхности в данном случае.
Стоит отметить, что три испытуемых образца хрома имеют сопоставимую площадь поверхности, поэтому площадь поверхности может не быть ключевым параметром при формировании активности окисления СО на данных испытуемых образцах. Кроме того, хром является кислым оксидом, и, следовательно, основные центры поверхности также имеют меньшее значение для каталитической активности поверхности в данном случае.
Таблица 3
T 100 температура и T 50 (температура зажигания) для Cr 2 O 3 при различных температурах прокаливания (400°–800 °C) и пример ранее опубликованных данных на различных простых и многокомпонентных оксидах. Ссылки указаны для получения дополнительной информации о составе катализаторов, поверхностных свойствах, фазах кристаллитов и экспериментальных/рабочих условиях.
| Материал | Экспериментальные условия | Т 100 , °C | T50, °C | [Ссылка. |
|---|---|---|---|---|
| CR 2 O 3 -4 | 2 Доза катализатора: 250-300 мг200 | 2 9850091 | ||
| CO + O 2 с 1: 3 массовым соотношением | 248 | 115 | 115 | |
| 132 | 2 reat||||
| 45–46 г (80 см 3 ) катализатора, газовый состав, CO~л.2%, O 2 ~1.2′ %, остальное He; расход газа-1400 см 3 /мин. | 340 | 265 | 19 | |
| CuO/Cr 2 O 3 на кремнеземе | Исходный состав: 2% CO, 2% O 2 в гелии. 0,1 г катализатора при расходе 100 мл мин −1 0,1 г катализатора при расходе 100 мл мин −1 | ≈500 | 213 | 32 |
| CuO/Cr 2 O 3 на глиноземе | ≈320 | 233 | 32 | |
| Co 3 O 4 шестигранные пластины | 50 мг катализатора.Сырьевой газ (1,6% CO, 21,0% O 2 и сбалансированный N 2 ) при общем расходе 25 мл мин 33 | |||
| Co 3 O 4 кубики | ≈130 | 112 | 33 | |
| Co 3 O 4 тетракадекаэдры | ≈120 | 110 | 33 | |
| CuxCeO 2 -X | 0.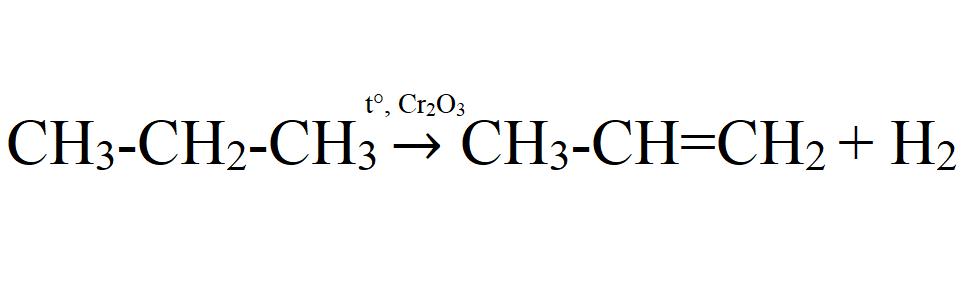 10 г катализатора. Реакционный газ, содержащий CO (2400 частей на миллион) и O 2 (15 об.%), а также остаток Ar подавали через слой катализатора со скоростью 100 мл/мин. 10 г катализатора. Реакционный газ, содержащий CO (2400 частей на миллион) и O 2 (15 об.%), а также остаток Ar подавали через слой катализатора со скоростью 100 мл/мин. | 253 | 186 | 34 |
| CoxCeO 2 -X | 300 | 216 | 34 | |
| CuMnOx | 200 мг катализатора (40–60 меш). Стандартный состав сырьевого газа: 1% CO, 20% O 2 и 79% N 2 с объемной скоростью (SV) 20000 мл/(ч·г кат. ). | 140 | 35 | 35 |
| CuO–CeO 2 | 50 мг катализатора. Реакционная смесь состояла из 1 об. % CO, 1,25 об. % O 2 и 50 об. % H 2 в He % CO, 1,25 об. % O 2 и 50 об. % H 2 в He | 200 | 94 | 36 |
| Co 0,9 Fe 2,1 O 4 | 20 мг катализатора. Реакционная газовая смесь состояла из 1% CO и 10% O 2 в аргоне с общей скоростью потока 15 мл/мин | 235 | 205 | 37 |
| α-Fe 2 O 3 | 20 мг катализатора.Общий расход составлял 15 мл мин −1 с 1% CO и 10% O 2 | 385 | 325 | 38 |
| 200 | 150 | 39 |
Результаты, представленные на рис. , относятся к собственной (т.е. без учета удельной площади поверхности) активности прокаленного катализатора.Другими словами, графики показывают число оборотов, ТОН, на молекулы CO в минуту на м 2 . Соответственно, ранжирование исследуемых оксидов на основе TON показывает, что при 100 °C образцы Cr 2 O 3 -4 проявляют лучшую характеристическую активность, чем Cr 2 O 3 -6 и Cr 2 . О 3 -8. Это означает, что среди исследованных катализаторов наилучшей активностью и собственной активностью при 100°С обладает Cr 2 O 3 -4. Следует отметить, что по результатам РФЭС поверхностные атомные отношения Cr ≥3+ /Cr 3+ Cr 2 O 3 -4 равны 0.32, что равно найденному для Cr 2 O 3 -8 (0,31), но меньше, чем у Cr 2 O 3 -6 (0,42). Это означает, что для исследованных образцов поверхностное отношение Cr ≥3+ /Cr 3+ не является единственным фактором, контролирующим собственную активность, роль играют и другие факторы.
, относятся к собственной (т.е. без учета удельной площади поверхности) активности прокаленного катализатора.Другими словами, графики показывают число оборотов, ТОН, на молекулы CO в минуту на м 2 . Соответственно, ранжирование исследуемых оксидов на основе TON показывает, что при 100 °C образцы Cr 2 O 3 -4 проявляют лучшую характеристическую активность, чем Cr 2 O 3 -6 и Cr 2 . О 3 -8. Это означает, что среди исследованных катализаторов наилучшей активностью и собственной активностью при 100°С обладает Cr 2 O 3 -4. Следует отметить, что по результатам РФЭС поверхностные атомные отношения Cr ≥3+ /Cr 3+ Cr 2 O 3 -4 равны 0.32, что равно найденному для Cr 2 O 3 -8 (0,31), но меньше, чем у Cr 2 O 3 -6 (0,42). Это означает, что для исследованных образцов поверхностное отношение Cr ≥3+ /Cr 3+ не является единственным фактором, контролирующим собственную активность, роль играют и другие факторы. Это также подтверждает наш вывод о том, что появление Cr 2 O 3 -4 на переходе между Cr 2 O 3 .nH 2 O ⇔ Cr 2 O 3 является здесь определяющим фактором. Различная морфологическая структура катализатора Cr 2 O 3 -4 (см. рис.) также может играть роль в таком превосходстве 30 .
Это также подтверждает наш вывод о том, что появление Cr 2 O 3 -4 на переходе между Cr 2 O 3 .nH 2 O ⇔ Cr 2 O 3 является здесь определяющим фактором. Различная морфологическая структура катализатора Cr 2 O 3 -4 (см. рис.) также может играть роль в таком превосходстве 30 .
Исследования кинетического катализа показали, что путь окисления СО на оксидах металлов зависит от применяемого температурного режима реакции 31 : (i) при ≤150 °C, механизм Элея-Ридеяла (CO (g) + O 2 (адс) или O 2(г) + CO(адс), ∆E ≤ 10 ккал/моль (ii) при 150–250 °C, механизм Ленгмюра-Хиншельвуда (CO(адс) + O 2 (объявления)), ∆E ок.10–20 ккал/моль; и (iii) при ≥250 °C, механизм Марса-ван-Кревелена (CO (g) + O(решетка)), ∆E ≥ 20 ккал/моль. Исходя из исследованной температуры, ожидается механизм Ленгмюра-Хиншельвуда (оба реагента (СО и О 2 ) адсорбируются на поверхности катализатора, а О 2 активируются и реагируют с СО. Участие кислорода решетки развертывается, поскольку 100% конверсия СО достигается при относительно низкой температуре (200–300 °С).Четыре элементарные стадии механизма Ленгмюра-Хиншельвуда окисления СО.С помощью эквров следующих элементарных реакций ( 2 — 5 ):
Участие кислорода решетки развертывается, поскольку 100% конверсия СО достигается при относительно низкой температуре (200–300 °С).Четыре элементарные стадии механизма Ленгмюра-Хиншельвуда окисления СО.С помощью эквров следующих элементарных реакций ( 2 — 5 ):
1/2o 2 + X ↔ O ⋅ X
2
CO + x ↔ Co ⋅ x
3
o ⋅ x + CO ⋅ X → CO 2 ⋅ X + X
4
CO 2 ⋅ X ↔ CO 2 + X
5 9002
Эффект межфазной связи Cr2O3 на магнитные свойства тонких пленок Fe72Ga28
В измерениях XRD мы наблюдали только дифракционные пики, относящиеся либо к Cr 2 O 3 , FeGa или Mo (рис.1а). Мы проанализировали возможность окисления Fe 72 Ga 28 из-за его роста поверх Cr 2 O 3 , но измерения XRD не показывают признаков окисления в методе разрешения. Дифракционные пики, относящиеся к FeGa, аналогичны тем, о которых мы сообщали ранее о напыленных тонких пленках Fe 72 Ga 28 , представляющих собой (110) основной дифракционный пик 16,17,18,19 . Для Fe 72 Ga 28 мы можем определить параметр решетки ( a ) благодаря закону Брэгга:
Для Fe 72 Ga 28 мы можем определить параметр решетки ( a ) благодаря закону Брэгга:
$$n = 2d_{{hkl}} sin\theta$$
(1)
, где \({d}_{hkl}\) — семейство плоскостей, \(\theta\) угол дифракции и \(\lambda\) длина волны излучения (Cu K α в данном случае) .{2} } \справа)$$
(2)
где h , k , l — индексы Миллера семейства плоскостей. Из экспериментальных результатов для пика (110) мы определили параметр решетки 2,90 Å в соответствии с предыдущими работами 17,18 .
Рис. 1 ( a ) Рентгенограммы образцов, исследованных в данной работе. Измерение для слоя Cr 2 O 3 толщиной 30 нм на стекле было включено для дальнейшего сравнения.Кривые смещены для ясности. ( b ) Магнитный момент в зависимости от температуры для образца Cr 2 O 3 / Fe 72 Ga 28 (20 нм). Вставка: деталь измерения.
Вставка: деталь измерения.
С другой стороны, дифракционные пики Cr 2 O 3 не изменяются при нанесении на него Fe 72 Ga 28 , что можно сделать из сравнения с одним слоем Cr 2 O 3 , осажденных в тех же условиях роста (рис.1а). Экспериментальные дифракционные пики для Cr 2 O 3 проявляются при тех же углах дифракции, что и для файла, использованного для идентификации (01-084-0312), поэтому он имеет ромбоэдрическую структуру с параметрами решетки a = b = 4,95 Å и c = 13,56 Å. Слои Cr 2 O 3 не полностью ориентированы по c , поскольку дифракционные пики (012), (104) и (116) для Cr 2 O 3 были обнаружены с помощью XRD.Однако ожидается магнитный вклад вдоль перпендикулярного направления из-за этого семейства плоскостей. Температура Нееля ( T N ) Cr 2 O 3 была получена из измерения намагниченности как функции температуры (рис. 1b). Экспериментальное значение T N = 297 k — всего 10 ° С ниже, что из насыпных CR 2 O 3 , T N = 307 K.Наконец, мы также проанализировали морфологию образцов с помощью АСМ (рис. 2), получив среднеквадратичную (среднеквадратичную) шероховатость около 2 нм для окончательного набора.
1b). Экспериментальное значение T N = 297 k — всего 10 ° С ниже, что из насыпных CR 2 O 3 , T N = 307 K.Наконец, мы также проанализировали морфологию образцов с помощью АСМ (рис. 2), получив среднеквадратичную (среднеквадратичную) шероховатость около 2 нм для окончательного набора.
Распыленное Fe 72 Ga 28 слои, осажденные в баллистическом режиме, развивают плоскостную магнитную анизотропию выше 100 нм 16,18 .Тем не менее, соединение с Cr 2 O 3 полностью устраняет эту плоскостную анизотропию даже для толщин, значительно превышающих 100 нм (рис. 3а). Это можно понять, если учесть, что образец покажет PMA, если выполняются два условия: i) он магнитно изотропен в плоскости образца и ii) направление OOP является легкой осью по сравнению с любым направлением в плоскости образца. Поэтому отсутствие внутриплоскостной магнитной анизотропии является необходимым условием развития ПМА. Мы исключили влияние магнитострикции и деформации на эту модификацию магнитной анизотропии, поскольку не наблюдали различий параметра решетки Fe 72 Ga 28 по отношению к несвязанным одиночным слоям. Фактически, когда деформация использовалась для управления магнитной анизотропией в тонких пленках FeGa с высоким содержанием галлия, изменялось только направление в плоскости образца 20 .
Мы исключили влияние магнитострикции и деформации на эту модификацию магнитной анизотропии, поскольку не наблюдали различий параметра решетки Fe 72 Ga 28 по отношению к несвязанным одиночным слоям. Фактически, когда деформация использовалась для управления магнитной анизотропией в тонких пленках FeGa с высоким содержанием галлия, изменялось только направление в плоскости образца 20 .
( a ) Петли гистерезиса при комнатной температуре в плоскости, записанные для разных углов между опорным направлением, принятым в качестве направления опорного луча, и приложенным магнитным полем (закрашенный квадрат) 0°, (закрашенный кружок) 30° , и (закрашенный треугольник) 60° для образца Cr 2 O 3 /Fe 72 Ga 28 (240 нм).( b ) Петли гистерезиса ООП, зарегистрированные при комнатной температуре для образцов с различной толщиной FeGa (закрашенный квадрат) 20 нм, (закрашенный кружок) 40 нм, (закрашенный треугольник) 80 нм, (закрашенный треугольник вниз) 160 нм и (закрашенный треугольник) алмаз) 240 нм. ( c ) Петли гистерезиса в плоскости и перпендикулярно при комнатной температуре для несвязанной тонкой пленки Fe 72 Ga 28 толщиной 20 нм. ( d ) Сравнение плоскостных (открытый квадрат) и перпендикулярных (закрашенный квадрат) петель гистерезиса при комнатной температуре для образца Cr 2 O 3 / Fe 72 Ga 28 (20 нм).
( c ) Петли гистерезиса в плоскости и перпендикулярно при комнатной температуре для несвязанной тонкой пленки Fe 72 Ga 28 толщиной 20 нм. ( d ) Сравнение плоскостных (открытый квадрат) и перпендикулярных (закрашенный квадрат) петель гистерезиса при комнатной температуре для образца Cr 2 O 3 / Fe 72 Ga 28 (20 нм).
Петли гистерезиса VSM показывают изменение направления намагниченности с плоскостного на ООП по мере уменьшения толщины Fe 72 Ga 28 (рис. 3b). Мы можем количественно контролировать эту эволюцию с помощью квадраты ООП ( м м / м MAX ) Определено как соотношение между Remanence ( м R ) и максимальная намагниченность ( M max ) получена в перпендикулярных петлях гистерезиса.В Таблице 1 мы можем наблюдать, как прямоугольность увеличивается по мере уменьшения толщины Fe 72 Ga 28 , в основном для толщины менее 80 нм. Прямоугольность ООП и петли гистерезиса связанных слоев можно сравнить с тонкой пленкой Fe 72 Ga 28 , выращенной в аналогичных условиях (табл. 1; рис. 3c). Прямоугольность ООП одиночного слоя намного ниже, чем у Fe 72 Ga 28 той же толщины, но в сочетании с Cr 2 O 3 .Наконец, на рис. 3d представлено сравнение петель гистерезиса в плоскости и ООП для образца Cr 2 O 3 / Fe 72 Ga 28 (20 нм), чтобы показать направление намагниченности. превратился в перпендикулярное направление, став легкой осью направления ООП.
Прямоугольность ООП и петли гистерезиса связанных слоев можно сравнить с тонкой пленкой Fe 72 Ga 28 , выращенной в аналогичных условиях (табл. 1; рис. 3c). Прямоугольность ООП одиночного слоя намного ниже, чем у Fe 72 Ga 28 той же толщины, но в сочетании с Cr 2 O 3 .Наконец, на рис. 3d представлено сравнение петель гистерезиса в плоскости и ООП для образца Cr 2 O 3 / Fe 72 Ga 28 (20 нм), чтобы показать направление намагниченности. превратился в перпендикулярное направление, став легкой осью направления ООП.
 Перпендикулярная магнитная анизотропия (K FM ) для системы Cr 2 O 3 /Fe 72 Ga 28 в тех образцах, в которых направление ООП является четкой легкой осью.
Перпендикулярная магнитная анизотропия (K FM ) для системы Cr 2 O 3 /Fe 72 Ga 28 в тех образцах, в которых направление ООП является четкой легкой осью. Перпендикулярная магнитная анизотропия, K FM , может быть определена экспериментально с учетом того, что:
$$K_{{FM}} = \frac{{M_{{FM}} \cdot H_{ К} }}{2}$$
(3)
будучи M FM намагниченность насыщения Fe 72 Ga 28 , и H K Для образцов с Fe 72 Ga 28 толщиной 20 нм и 40 нм в плоскости проходит жесткая ось, и мы получили среднее значение K FM из 3·10 6 эрг см −3 (табл. 1) для M FM = 1100 emu см −3 26 . Для более высокой толщины Fe 72 Ga 28 направление OOP не является четкой легкой осью из-за постепенного поворота намагниченности в перпендикулярном направлении по мере уменьшения толщины FeGa.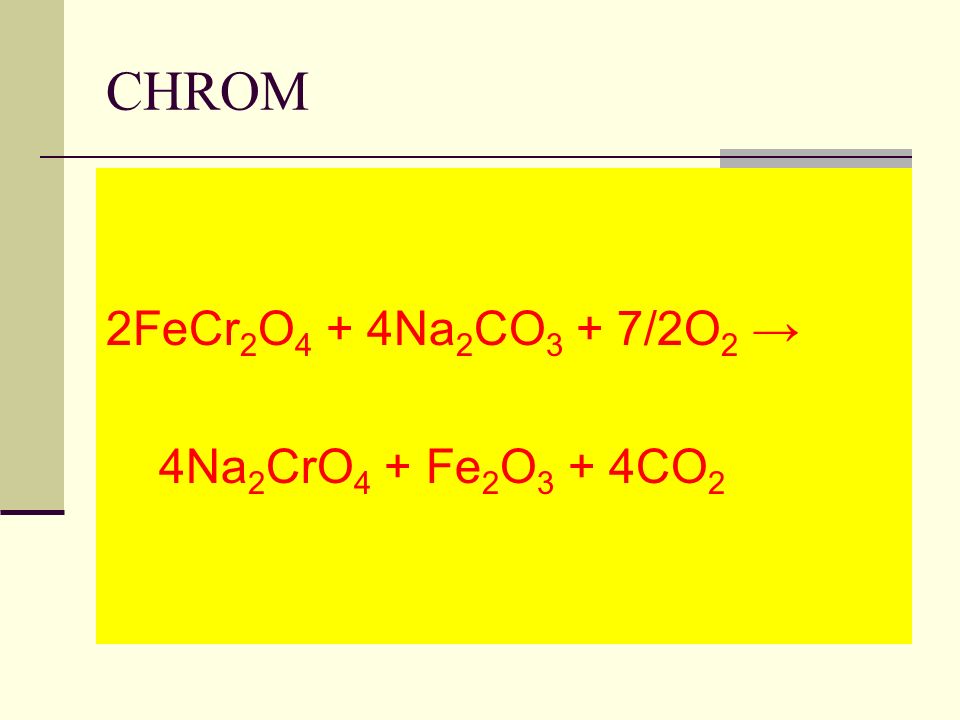 Изображения МСМ
Изображения МСМ
также можно использовать для мониторинга влияния Cr 2 O 3 на магнитное поведение Fe 72 Ga 28 (рис. 4). Когда Fe 72 Ga 28 не связан (рис. 4а), наблюдается магнитный контраст, известный как магнитная пульсация, в соответствии с предыдущими работами 24,25,26 . Однако из-за межфазной связи с Cr 2 O 3 ООП-компонента намагниченности Fe 72 Ga 28 усиливается, и на МСМ-изображениях начинают проявляться полосовые домены (рис.4б-г).
Рис. 4 МСМ-изображения, полученные в остаточной намагниченности после приложения магнитного поля напряженностью 10 кЭ в перпендикулярном направлении. ( a ) Несвязанный слой Fe 72 Ga 28 толщиной 150 нм. Синей линией показан пример магнитного контраста, известного как рябь. ( B ) CR 2 O 3 / FE 72 GA 28 (160 нм), ( C 9164) CR 2 O 3 / FE 72 GA 28 ( 80 нм) и ( d ) Cr 2 O 3 /Fe 72 Ga 28 (40 нм). {2}$$
{2}$$
(4)
Для материалов с умеренным или низким ПМА, Q < 1, выше критической толщины появляются полосчатые домены ( t cr ):
$$t_{{cr}} = 2\pi \sqrt {A_{{ex}} /K_{{FM}} }$$
(5)
где A ex — обменная энергия на единицу длины. При Q > 0,1 полосовые домены шире толщины слоя, тогда как при Q < 0 они демонстрируют периодичность, равную толщине слоя.1.
с учетом экспериментальной стоимости выведены для перпендикулярной магнитной анизотропии, K FM = 3 · 10 6 ERG / см 3 , и м FM = 1100 FM = 1100 emu cm −3 26 , в наших образцах предполагается, что Q составляет 0,3, и поэтому ожидается, что полосы превышают критическую толщину. Принимая во внимание A ex = 1,7·10 −6 эрг·см −1 из литературы 22,23,40 и используя уравнение(5), получается экспериментальный t cr 44 нм. Это согласуется с нашими экспериментальными данными, в которых полосы наблюдались только для Fe 72 Ga 28 толщиной ≥ 40 нм. Фактически, если мы примем это экспериментальное значение как t cr , a K FM of 4·10 6 эрг см −3 из экспериментальных петель гистерезиса, 3·10 6 эрг см -3 .Наконец, из изображений МСМ мы получили период полосы от 110 до 125 нм с помощью спектральной плотности мощности (дополнительная информация). Эта периодичность полос, превышающая толщину слоя, согласуется с добротностью Q выше 0,1, рассчитанной для наших образцов.
Это согласуется с нашими экспериментальными данными, в которых полосы наблюдались только для Fe 72 Ga 28 толщиной ≥ 40 нм. Фактически, если мы примем это экспериментальное значение как t cr , a K FM of 4·10 6 эрг см −3 из экспериментальных петель гистерезиса, 3·10 6 эрг см -3 .Наконец, из изображений МСМ мы получили период полосы от 110 до 125 нм с помощью спектральной плотности мощности (дополнительная информация). Эта периодичность полос, превышающая толщину слоя, согласуется с добротностью Q выше 0,1, рассчитанной для наших образцов.
В дополнение к повороту намагниченности направления Fe 72 Ga 28 в перпендикулярном направлении мы наблюдали эффект обменного смещения, связанный с 28 межфазная связь, на которую указывает сдвиг петли гистерезиса ООП по горизонтальной оси ( H E ) при 5 К после FC-процесса при 1 кЭ (рис. 5). Это явление обменного смещения в перпендикулярном направлении связано с обменной связью между антиферромагнитным Cr 2 O 3 и ферромагнитным Fe 72 Ga 28 41 . Для Fe 72 Ga 28 толщиной 20 нм, H E составляет − 21 Э и − 11 Э для толщины 40 нм. Для наименьшей толщины FeGa эффект обменного смещения наблюдался по крайней мере до 200 K.
5). Это явление обменного смещения в перпендикулярном направлении связано с обменной связью между антиферромагнитным Cr 2 O 3 и ферромагнитным Fe 72 Ga 28 41 . Для Fe 72 Ga 28 толщиной 20 нм, H E составляет − 21 Э и − 11 Э для толщины 40 нм. Для наименьшей толщины FeGa эффект обменного смещения наблюдался по крайней мере до 200 K.
Петли гистерезиса ООП, зарегистрированные при 5 K после FC при 1 кЭ (закрашенный треугольник) и ZFC (незаштрихованный кружок) от 360 K для образцов с толщиной FeGa ( a ) 20 нм и ( b ) 40 нм.
Со времени перпендикулярной магнитной анизотропии выведены в этой работе для Fe 72 GA 28 ( K FM = 3 · 10 6 ERG · CM -3 ) выше теоретической ценности CR 2 O 3 ( K k = 2 · 10 5 ERG · CM -3 ) 42 и некоторые химические шероховатости ожидается на Fe 72 GA 28 /Cr 2 O 3 , мы использовали модель случайного поля, предложенную Малоземовым 35,36,37 , для расчета теоретических значений H E . {2} M_{{FM}} t_{{FM}} }}~$$
{2} M_{{FM}} t_{{FM}} }}~$$
(6)
, где z обычно принимают за единицу, а A AF — это обменная жесткость антиферромагнетика, которая принимает значение 4·10 −7 эрг·см − 1 90 . Из этого выражения (6) получаем H E равные − 26 Э и − 13 Э для Fe 72 Ga 28 толщиной 20 и 40 нм соответственно, что довольно близко к экспериментальным − 21 Э и − 11 Э соответственно.Это соглашение по скважинам подтверждает возможность использования этой модели в системах с обменным смещением на основе Cr 2 O 3 , как ранее сообщалось 42 .
Наконец, по экспериментальным значениям H E можно рассчитать энергию межфазного обмена Δ E :
$$\Delta E = H_{E} M_{{FM}} t_{{FM} }$$
(7)
Для Fe 72 Ga 28 20 нм и 40 нм получается Δ E , равный 0. 046 и 0,048 эрг см -2 , что аналогично тому, что сообщалось в предыдущих работах, в которых Cr 2 O 3 был связан с другими ферромагнетиками со значениями 0,05 эрг см -2 при 5 К 30,41 . Однако важно отметить, что мы получили эту межфазную энергию, используя поликристаллический Cr 2 O 3 , а не полностью ориентированный c Cr 2 O 3 со всеми магнитными моментами, выровненными перпендикулярно направление.Тем не менее, наши экспериментальные результаты указывают на то, что даже в этой ситуации возможен постепенный поворот намагниченности Fe 72 Ga 28 во внеплоскостное направление за счет комбинации Cr 2 O 3 с Fe 72 Ga 28 с магнитными флуктуациями, вызывающими магнитные пульсации в несвязанных слоях 25 . Таким образом, эти результаты показывают возможность использования поликристаллических слоев для дальнейших приложений, таких как адаптация направления намагниченности.
046 и 0,048 эрг см -2 , что аналогично тому, что сообщалось в предыдущих работах, в которых Cr 2 O 3 был связан с другими ферромагнетиками со значениями 0,05 эрг см -2 при 5 К 30,41 . Однако важно отметить, что мы получили эту межфазную энергию, используя поликристаллический Cr 2 O 3 , а не полностью ориентированный c Cr 2 O 3 со всеми магнитными моментами, выровненными перпендикулярно направление.Тем не менее, наши экспериментальные результаты указывают на то, что даже в этой ситуации возможен постепенный поворот намагниченности Fe 72 Ga 28 во внеплоскостное направление за счет комбинации Cr 2 O 3 с Fe 72 Ga 28 с магнитными флуктуациями, вызывающими магнитные пульсации в несвязанных слоях 25 . Таким образом, эти результаты показывают возможность использования поликристаллических слоев для дальнейших приложений, таких как адаптация направления намагниченности.
%PDF-1.7
%
153 0 объект
>
эндообъект
внешняя ссылка
153 89
0000000016 00000 н
0000002698 00000 н
0000002911 00000 н
0000002955 00000 н
0000003086 00000 н
0000003121 00000 н
0000003614 00000 н
0000003748 00000 н
0000003881 00000 н
0000004015 00000 н
0000004179 00000 н
0000004343 00000 н
0000004505 00000 н
0000004661 00000 н
0000004816 00000 н
0000004872 00000 н
0000030714 00000 н
0000030759 00000 н
0000030805 00000 н
0000031247 00000 н
0000031948 00000 н
0000032185 00000 н
0000042649 00000 н
0000042936 00000 н
0000043247 00000 н
0000043370 00000 н
0000043457 00000 н
0000043540 00000 н
0000044100 00000 н
0000044772 00000 н
0000044935 00000 н
0000045513 00000 н
0000045669 00000 н
0000045996 00000 н
0000061956 00000 н
0000062111 00000 н
0000062556 00000 н
0000063235 00000 н
0000063883 00000 н
0000064846 00000 н
0000065170 00000 н
0000065340 00000 н
0000065497 00000 н
0000065885 00000 н
00000 00000 н
00000
00000 н
0000115263 00000 н
0000115561 00000 н
0000115880 00000 н
0000116614 00000 н
0000117344 00000 н
0000118050 00000 н
0000118640 00000 н
0000118833 00000 н
0000118864 00000 н
0000132349 00000 н
0000132681 00000 н
0000133050 00000 н
0000152808 00000 н
0000153137 00000 н
0000153469 00000 н
0000153644 00000 н
0000153793 00000 н
0000153942 00000 н
0000154091 00000 н
0000154201 00000 н
0000164237 00000 н
0000164276 00000 н
0000165963 00000 н
0000166273 00000 н
0000166344 00000 н
0000166418 00000 н
0000166492 00000 н
0000166535 00000 н
0000166622 00000 н
0000166652 00000 н
0000166695 00000 н
0000166782 00000 н
0000166818 00000 н
0000166861 00000 н
0000166948 00000 н
0000166979 00000 н
0000167022 00000 н
0000167109 00000 н
0000167151 00000 н
0000167194 00000 н
0000167226 00000 н
0000167269 00000 н
0000002076 00000 н
трейлер
]/предыдущая 480954>>
startxref
0
%%EOF
241 0 объект
>поток
hb«`b`e`g`fb@
Частицы оксида хрома | AMERICAN ELEMENTS®
РАЗДЕЛ 1.
 ИДЕНТИФИКАЦИЯ
ИДЕНТИФИКАЦИЯНаименование продукта: Частицы оксида хрома
Номер продукта: Все применимые коды продуктов American Elements, например. CR-OX-02-PTCS , CR-OX-03-PTCS , CR-OX-04-PTCS , CR-OX-05-PTCS
Номер CAS: 1308-38-9
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2.ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS07
Acute Tox. 4 h402 Вреден при проглатывании.
Острый токсикоз. 4 h432 Вреден при вдыхании.
Skin Sens. 1 ч417 Может вызывать кожную аллергическую реакцию.
Классификация согласно Директиве 67/548/ЕЭС или Директиве 1999/45/ЕС
Xn; Вреден для здоровья
R20/22: Вреден при вдыхании и проглатывании.
Си; Сенсибилизация
R43: Может вызвать сенсибилизацию при контакте с кожей.
Информация об особых опасностях для человека и окружающей среды:
Н/Д
Опасности, не классифицированные иначе
Нет доступных данных
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с регламентом CLP .
Пиктограммы, обозначающие опасности
GHS07
Сигнальное слово: Осторожно
Краткая характеристика опасности
h402+h432 Вреден при проглатывании или при вдыхании.
h417 Может вызывать кожную аллергическую реакцию.
Меры предосторожности
P261 Избегать вдыхания пыли/дыма/газа/тумана/паров/аэрозолей.
P280 Пользоваться защитными перчатками/защитной одеждой/средствами защиты глаз/лица.
P304+P340 ПРИ ВДЫХАНИИ: Вынести пострадавшего на свежий воздух и обеспечить комфорт для дыхания.
P301+P312 ПРИ ПРОГЛАТЫВАНИИ: Позвоните в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу/…/, если вы плохо себя чувствуете.
P312 Обратитесь в ТОКСИКОЛОГИЧЕСКИЙ ЦЕНТР/к врачу/…/, если вы плохо себя чувствуете.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
D2B — Токсичный материал, вызывающий другие токсические эффекты
Система классификации
Оценки HMIS (шкала 0–4)
(Система идентификации опасных материалов) 2
Воспламеняемость = 0
Физическая опасность = 1
Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
/ Название вещества:
1308-38-9 Оксид хрома(III)
Идентификационный номер(а):
Номер ЕС: 215-160-9
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
Описание мер первой помощи
При вдыхании :
Обеспечить пациента свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратиться за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт негорючий.Используйте меры пожаротушения, подходящие для окружающего огня.
Особые опасности, исходящие от вещества или смеси
Если этот продукт вовлечен в пожар, могут быть выделены следующие вещества:
Пар оксида металла
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и порядок действий в чрезвычайных ситуациях
Использовать средства индивидуальной защиты.Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания продукта в канализацию, канализационные системы или другие водотоки.
Не допускайте проникновения материала в землю или почву.
Методы и материалы для локализации и очистки:
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Обеспечить достаточную вентиляцию.
Предотвращение вторичных опасностей:
Никаких специальных мер не требуется.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Продукт не воспламеняется
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить контейнер плотно закрытым.
Хранить в прохладном сухом месте в хорошо закрытых контейнерах.
Конкретное конечное применение
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем: не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующими контроля на рабочем месте:
1308-38-9 Оксид хрома(III) (100,0%)
PEL (США) Длительное значение: 0,5 мг/м 3 как Cr
REL (США) Долговременное значение: 0,5 мг/м 3 в виде Cr; См. приложение «Карманный справочник». C
TLV (США) Долговременное значение: 0,5 мг/м 3 как Cr
EL (Канада) Долгосрочное значение: 0,5 мг/м 3 как Cr
Дополнительная информация: Нет данных
Средства контроля воздействия
Персональные защитное оборудование
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и зараженную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
Используйте подходящий респиратор при наличии высоких концентраций.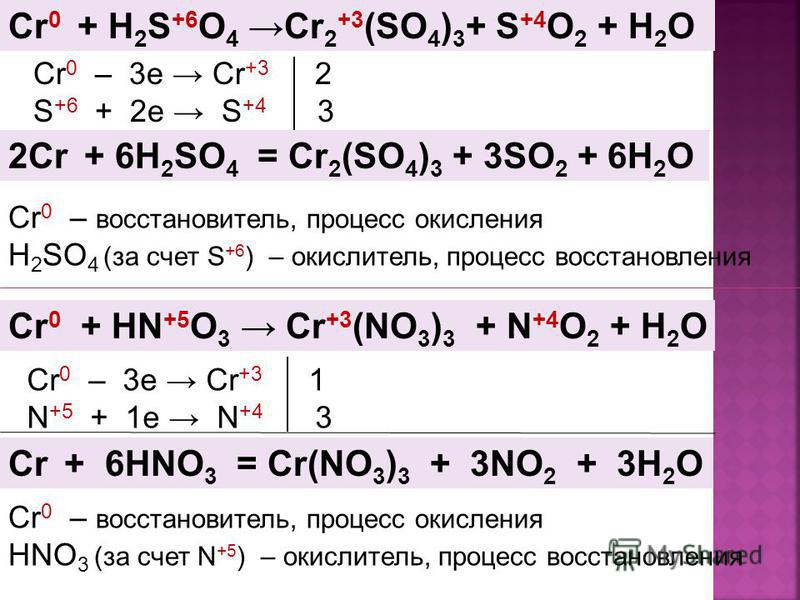
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха.Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук:
Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Время проникновения материала перчаток (в минутах): Данные отсутствуют
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид:
Форма: Различные формы (порошок/чешуйки/кристаллы/гранулы и т. д.)
д.)
Цвет: от светло-зеленого до темно-зеленого
Запах: без запаха
Порог восприятия запаха: данные отсутствуют.
pH: неприменимо
Точка плавления/диапазон плавления: 2435 °C (4415 °F)
Точка/диапазон кипения: 3000 °C (5432 °F) газ): нет данных.
Температура воспламенения: Данные отсутствуют.
Температура разложения: Данные отсутствуют.
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров при 20 °C (68 °F): 0 гПа
Плотность при 20 °C (68 °F): 5,22 г/см 3 (43,561 фунта/гал)
Относительная плотность: Данные отсутствуют.
Плотность паров: N/A
Скорость испарения: N/A
Растворимость в воде (H 2 O): нерастворим
Коэффициент распределения (н-октанол/вода): Данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Данные отсутствуют
РАЗДЕЛ 10.
 СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ Реакционная способность
Данные отсутствуют
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций.
Реагирует с сильными окислителями.ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Вреден при вдыхании.
Вреден при проглатывании.
Реестр токсического воздействия химических веществ (RTECS) содержит данные об острой токсичности этого вещества.
Значения LD/LC50, важные для классификации: Нет данных
Раздражение или коррозия кожи: Может вызывать раздражение
Раздражение или коррозия глаз: Может вызывать раздражение
Сенсибилизация: Может вызывать аллергическую кожную реакцию.
Мутагенность зародышевых клеток:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о мутациях для этого вещества.
Канцерогенность:
EPA-D: Канцерогенность для человека не классифицируется: неадекватные доказательства канцерогенности для людей и животных или данные отсутствуют.
EPA-CBD: канцерогенный потенциал не может быть определен.
IARC-3: Канцерогенность для человека не классифицируется.
ACGIH A4: Не классифицируется как канцероген для человека: Недостаточно данных для классификации агента с точки зрения его канцерогенности для людей и/или животных.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об онкогенности, и/или канцерогенности, и/или новообразованиях для этого вещества.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность на орган-мишень — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности:
Реестр токсических эффектов химических веществ (RTECS) содержит данные о токсичности при многократном приеме этого вещества.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Раздел 12. Экологическая информация
Токсичность
Водная токсичность:
Нет данных Доступны
Устойчивость и деградалимость
Нет данных Доступны
Биоаккумулятивный потенциал
Нет данных Доступны
Мобильность в почве
Нет доступных данных
Дополнительная экологическая информация:
Избегайте передачи в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные эффекты
Данные отсутствуют
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
.
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, ADN, IMDG, IATA
N/A
Надлежащее отгрузочное наименование ООН
DOT, ADN, IMDG, IATA
N/A
DOT, ADR, ADN, IMDG, IATA
Class
N/A
Группа упаковки
DOT, IMDG, IATA
N/A
Опасности для окружающей среды:
N/A
Особые меры предосторожности для пользователя
N/A
к Приложению II к MARPOL73/78 и IBC Code
N/A
Транспорт/Дополнительная информация:
DOT
Морской загрязнитель (DOT):
№
РАЗДЕЛ 15.
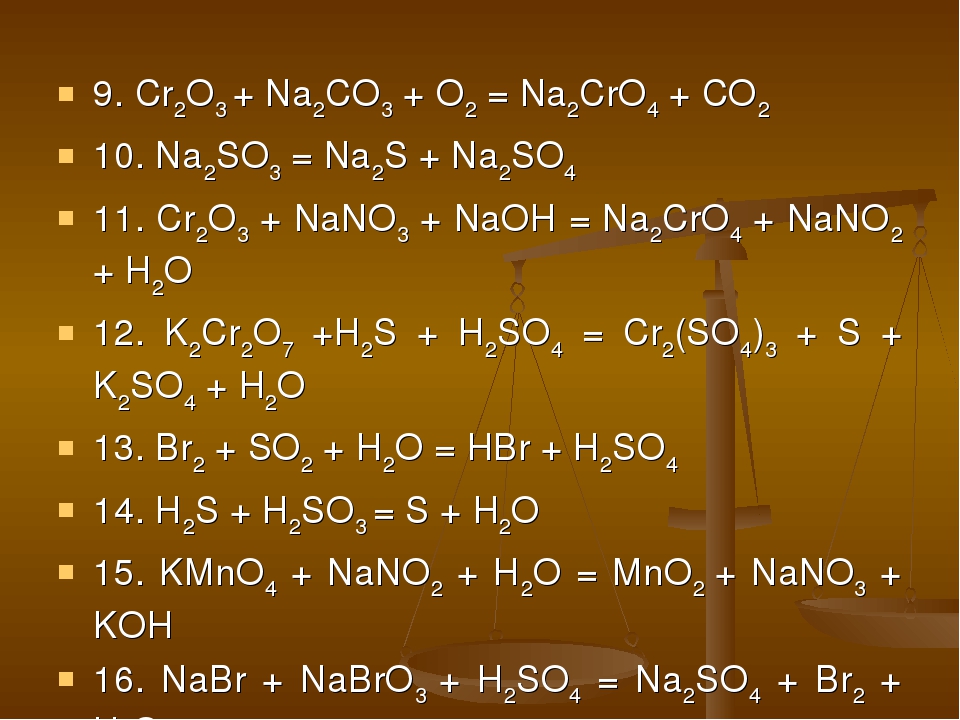 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ Агентства по охране окружающей среды США.
Все компоненты этого продукта перечислены в Канадском перечне веществ для внутреннего потребления (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
1308-38-9 Оксид хрома (III)
Предложение 65 штата Калифорния
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития, женщины
Вещество не указано.
Prop 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Прочие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
REACH — Предварительно зарегистрированные вещества
Вещество указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16.ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Влияние легирования Cr2O3 и Fe2O3 на термическую активацию неполяризованных носителей заряда PZT электронной промышленности из-за его полезных пьезоэлектрических свойств.Различные устройства, такие как преобразователи и интегральные схемы для микроэлектронных приложений, используют этот тип керамики [3,4]. Материал интенсивно исследовался с тех пор, как в 1950-х годах была обнаружена смешиваемость титаната свинца и цирконата свинца [5]. Добавление различных легирующих примесей в базовую матрицу (PZT) позволяет варьировать различные свойства, чтобы синтезировать новые керамические материалы для различных применений. С этой целью многие исследователи изучали состав PZT, модифицированный соответствующим замещением в местах А и В [6–8], с использованием легирующих примесей для улучшения электрических и механических свойств пьезоэлектрических материалов.
 Свойства образцов ЦТС высокочувствительны к добавкам, составу и методам синтеза [9].
Свойства образцов ЦТС высокочувствительны к добавкам, составу и методам синтеза [9]. Электропроводность, которая напрямую связана с потерями мощности или утечкой заряда пьезоэлектрических устройств, является ключевым физическим параметром и существенно ограничивает использование некоторых свойств сегнетоэлектриков [10]. Увеличение проводимости затрудняет определение точки Кюри известных сегнетоэлектриков с помощью диэлектрических измерений. Электропроводность сегнетоэлектрической керамики также важна для эффективности поляризации и, в свою очередь, для конфигурации доменов [11], которые влияют на диэлектрические и пьезоэлектрические свойства.Для исходных сегнетоэлектрических поликристаллов пьезоэлектрический эффект не может наблюдаться в макроскопическом масштабе из-за отсутствия общей поляризации. Чистая поляризация, которая вызывает пьезоэлектричество, может быть развита в поликристаллах в процессе поляризации. Процесс поляризации зависит от локальной спонтанной поляризации в элементарных ячейках, а также может быть переориентирован при наличии достаточно сильного электрического поля, т. е. сегнетоэлектрического эффекта [12]. В микроструктуре возникает переориентация спонтанной поляризации, обусловленная либо движением доменных стенок, либо границами, разделяющими соседние домены [13].Многие факторы, такие как поле поля, температура и время поля, могут влиять на степень поля и, следовательно, на пьезоэлектрические свойства [14].
е. сегнетоэлектрического эффекта [12]. В микроструктуре возникает переориентация спонтанной поляризации, обусловленная либо движением доменных стенок, либо границами, разделяющими соседние домены [13].Многие факторы, такие как поле поля, температура и время поля, могут влиять на степень поля и, следовательно, на пьезоэлектрические свойства [14].
Обзор литературы показал, что несколько групп сообщили об электрических свойствах PZT, зависящих от температуры [15]. Басу и др. изучали влияние температурно-зависимых электрических свойств (диэлектрическая проницаемость, вызванное полем смещение, коэффициент электромеханической связи) пластин PZT, изготовленных ленточным литьем. Майва и др.[16] исследовали зависящие от температуры электрические и электромеханические свойства тонких пленок PZT и пришли к выводу, что более тонкие пленки обладают более высокой температурой Кюри. Йимнирун и др. [17] обнаружили, что площадь гистерезиса и остаточная поляризация объемного PZT следуют степенному закону, зависящему от температуры, в то время как поле коэрцитивной силы линейно зависит от температуры. Губини и др. [18] сообщили о влиянии температуры на электрические свойства объема PZT. Глаум и др. [19] изучали свойства деградации объемного PZT в зависимости от температуры и поля в однополярном электрическом поле.Чен и др. [20] изучали влияние избытка свинца на поляризационную усталость, а также сообщали об ухудшении усталости при повышении температуры.
Губини и др. [18] сообщили о влиянии температуры на электрические свойства объема PZT. Глаум и др. [19] изучали свойства деградации объемного PZT в зависимости от температуры и поля в однополярном электрическом поле.Чен и др. [20] изучали влияние избытка свинца на поляризационную усталость, а также сообщали об ухудшении усталости при повышении температуры.
Настоящая работа направлена на определение структурных и электрических свойств неполяризованного ЦТС, легированного Cr2O3 и Fe2O3. Свойства микроструктуры, удельное сопротивление и проводимость были исследованы в зависимости от природы легирующей примеси, состава и температуры.
Experimental В настоящем исследовании из порошков оксидов высокой чистоты, а именно PbO (99.90 %), ZrO2 (99,90 %), TiO2 (99,80 %), Cr2O3 (99,90 %) и Fe2O3 (99,90 %), образцы были приготовлены традиционным керамическим способом по формулам (1−x) Pb (Zr0,48 , Ti0,52) O3-x Cr2O3 и (1-x)Pb(Zr0,48,Ti0,52)O3-x Fe2O3 соответственно (x=2%, 4%, 6%, 8%). Стехиометрическое количество металла в указанном составе (1-x) PZT-x Cr2O3 и (1-x) PZT-x Fe2O3 смешивали в течение 2 ч в качестве мелющих тел и этанола в качестве растворителя. После измельчения в течение 6 ч полученную суспензию сушили в печи, а порошок прокаливали в печи при 900°С в течение 120 мин.Затем прокаленный порошок измельчали в шаровой мельнице в течение 6 часов, чтобы убедиться, что получен мелкий размер частиц. После сушки порошок прессовали в дискообразную форму и спекали при 1200 °С в закрытом тигле из глинозема в атмосфере, обогащенной парами PbO, с использованием порошка PbZrO3. Для выявления фаз спеченных образцов использовали рентгеновский дифрактометр с CuK-излучением. Электрические свойства (удельное сопротивление и проводимость) измеряли с помощью LCR-метра и программируемой печи.
Стехиометрическое количество металла в указанном составе (1-x) PZT-x Cr2O3 и (1-x) PZT-x Fe2O3 смешивали в течение 2 ч в качестве мелющих тел и этанола в качестве растворителя. После измельчения в течение 6 ч полученную суспензию сушили в печи, а порошок прокаливали в печи при 900°С в течение 120 мин.Затем прокаленный порошок измельчали в шаровой мельнице в течение 6 часов, чтобы убедиться, что получен мелкий размер частиц. После сушки порошок прессовали в дискообразную форму и спекали при 1200 °С в закрытом тигле из глинозема в атмосфере, обогащенной парами PbO, с использованием порошка PbZrO3. Для выявления фаз спеченных образцов использовали рентгеновский дифрактометр с CuK-излучением. Электрические свойства (удельное сопротивление и проводимость) измеряли с помощью LCR-метра и программируемой печи.
Рис.1 и 2 показаны рентгенограммы (1-x) Pb (Zr0,48, Ti0,52) O3-x Cr2O3 и (1-x) Pb (Zr0,48, Ti0,52) O3-x Fe2O3 соответственно для различного содержания (2, 4, 6 и 8%). Тетрагональную, тетрагонально-ромбоэдрическую фазы идентифицировали путем анализа пиков 002 (тетрагональный), 200 (тетрагональный) и 200 (ромбоэдрический) в диапазоне 2θ 43–47°.
Тетрагональную, тетрагонально-ромбоэдрическую фазы идентифицировали путем анализа пиков 002 (тетрагональный), 200 (тетрагональный) и 200 (ромбоэдрический) в диапазоне 2θ 43–47°.
Влияние содержания Cr2O3 и Fe2O3 на микроструктуру видно на рис. 3(а, б), 4(а, б) и 5(а, б). Увеличение содержания Cr2O3 и Fe2O3 вызывает изменение параметров решетки для тетрагональной и ромбоэдрической фаз.Как правило, увеличение содержания хрома и оксида железа способствует тетрагональности (до x=0,06) и препятствует ромбоэдрической форме в сторону кубической структуры.
Увеличение содержания Fe2O3 привело к постепенному увеличению размера кристаллов тетрагональной и ромбоэдрической фаз, что может быть связано с внедрением атомов хрома. Однако увеличение количества Cr2O3 вызвало увеличение размера кристаллов тетрагональной фазы и уменьшение размера ромбоэдрической фазы. Это можно расценить как замещение ионов хрома с меньшим атомным радиусом ионами циркония или титана. с большим атомным радиусом. Фазовая структура и параметры решетки образцов (1-x) Pb (Zr0,48, Ti0,52) O3-x Cr2O3 и (1-x) Pb (Zr0,48, Ti0,52) O3-x Fe2O3, полученных с использованием различных содержание указано в Таблице 1.
Фазовая структура и параметры решетки образцов (1-x) Pb (Zr0,48, Ti0,52) O3-x Cr2O3 и (1-x) Pb (Zr0,48, Ti0,52) O3-x Fe2O3, полученных с использованием различных содержание указано в Таблице 1.
Электрические свойства (1-x) PZT-x Fe2O3 и (1-x) PZT-x Cr2O3 свидетельствуют о фазовом превращении. Рис. 6(a, b) и 7(a, b) представлены зависимости удельного сопротивления и проводимости от температуры для различных количеств легирующих добавок Cr2O3 и Fe2O3. Как видно из этих рисунков, легирование Cr2O3 приводит к прогрессивному уменьшению удельного сопротивления и увеличению проводимости образцов.Это можно оценить по подвижности носителей заряда из-за присутствия хрома, что делает образец более электропроводящим. С другой стороны, добавление оксида железа приводит к уменьшению удельного электрического сопротивления неполяризованных образцов переменным и непрогрессивным образом по сравнению с оксидом хрома. Это может быть связано с разницей в теплопроводности хрома (0,937 Вт/см⋅К) и железа (0,802 Вт/см⋅К) [21]. Следовательно, хром, будучи более теплопроводным, обеспечивает быструю передачу тепла к носителям заряда, так что они термически возбуждаются и мобилизуются.Это делает неполяризованный материал менее устойчивым к электричеству и более проводящим, и это обратная ситуация с железом.
Следовательно, хром, будучи более теплопроводным, обеспечивает быструю передачу тепла к носителям заряда, так что они термически возбуждаются и мобилизуются.Это делает неполяризованный материал менее устойчивым к электричеству и более проводящим, и это обратная ситуация с железом.
В этой статье рентгеноструктурный анализ и измерение электрических свойств неполяризованной керамики PZT были реализованы для исследования влияния оксида хрома и оксида железа на сосуществование ромбоэдрических тетрагональных фаз, микроструктуру и электрические свойства. Результаты показывают, что:
- 1.
Увеличение состава Cr2O3 и Fe2O3 привело к изменению параметров решетки для тетрагональной и ромбоэдрической фаз.В общем, увеличение состава оксидов хрома и железа благоприятствует тетрагональным фрагментам (до x=0,06), в то время как ромбоэдрическая форма становится неблагоприятной в сторону кубической структуры.
- 2.
Увеличение состава Fe2O3 приводит к постепенному увеличению размера кристаллов тетрагональной и ромбоэдрической фаз.

 0
0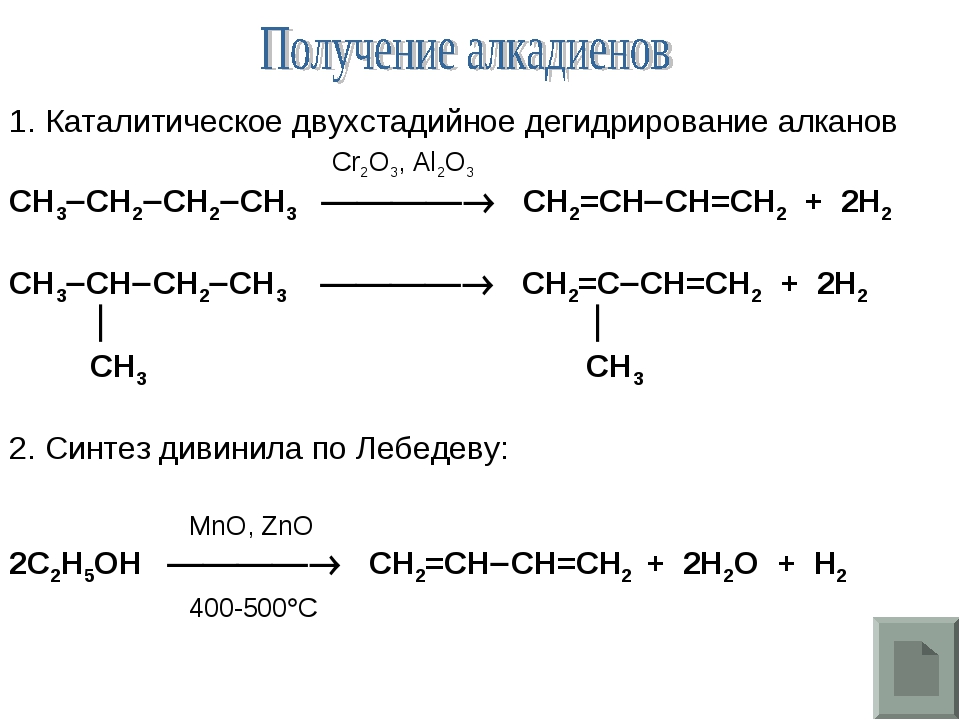 9
9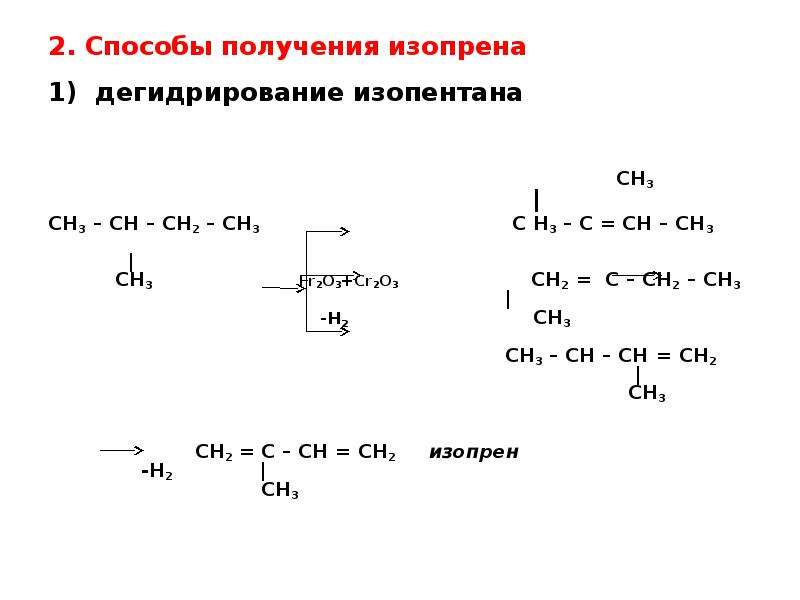 В то время как α-Cr 2 O 3 -8 отображает петлю типа h4. Считается, что петля типа h3 связана с порами, похожими на чернильницы, различного радиуса, часто образованными агломератами или компактами сфероидальных частиц неоднородного размера и расположения.Петля типа h4 связана с конденсацией адсорбата в капиллярных пространствах между параллельными пластинами или открытыми щелевидными капиллярами.
В то время как α-Cr 2 O 3 -8 отображает петлю типа h4. Считается, что петля типа h3 связана с порами, похожими на чернильницы, различного радиуса, часто образованными агломератами или компактами сфероидальных частиц неоднородного размера и расположения.Петля типа h4 связана с конденсацией адсорбата в капиллярных пространствах между параллельными пластинами или открытыми щелевидными капиллярами. Cr 2 O 3 показал самое низкое значение объема пор (0,0385 см 3 /г) при 800 °C (таблица), что является прямым результатом высокотемпературного прокаливания и последующего спекания частиц. Сам полученный Cr 2 O 3 имеет самый высокий объем пор (0.235 см 3 /г). При прокаливании (400–800 °C) образуются частицы α-Cr 2 O 3 , которые проявляют более высокую V c p по сравнению с V p , что подразумевает наличие нецилиндрических мезопор (см. Таблицу). Полученный α-Cr 2 O 3 имеет более узкий размер пор, чем прокаленный. При повышении температуры прокаливания от 400° до 800 °С наблюдается расширение пор ( r p / нм = 11 → 23 нм).Одновременно наблюдается уменьшение объема пор (0,0937 → 0,0385 см 3 /г). Это поддерживает механизм расширения пор (таблица ).
Cr 2 O 3 показал самое низкое значение объема пор (0,0385 см 3 /г) при 800 °C (таблица), что является прямым результатом высокотемпературного прокаливания и последующего спекания частиц. Сам полученный Cr 2 O 3 имеет самый высокий объем пор (0.235 см 3 /г). При прокаливании (400–800 °C) образуются частицы α-Cr 2 O 3 , которые проявляют более высокую V c p по сравнению с V p , что подразумевает наличие нецилиндрических мезопор (см. Таблицу). Полученный α-Cr 2 O 3 имеет более узкий размер пор, чем прокаленный. При повышении температуры прокаливания от 400° до 800 °С наблюдается расширение пор ( r p / нм = 11 → 23 нм).Одновременно наблюдается уменьшение объема пор (0,0937 → 0,0385 см 3 /г). Это поддерживает механизм расширения пор (таблица ).