Общие способы получения средних солей — урок. Химия, 8–9 класс.
Соли образуются в результате целого ряда химических превращений. Выбор способа получения каждой конкретной соли зависит от целого ряда факторов, в частности от доступности исходных веществ, а в промышленности определяется в первую очередь экономической целесообразностью.
Разберём некоторые общие подходы к выбору способов получения средних солей.
1. Соли образуются при взаимодействии металлов с неметаллами.
Например, при взаимодействии железа с хлором образуется хлорид железа(\(III\)):
2Fe+3Cl2⟶t°2FeCl3.
При нагревании смеси железа с серой образуется сульфид железа(\(II\)):
Fe+S⟶t°FeS.
2. Соли образуются при взаимодействии металлов с кислотами.
Например, при взаимодействии железа с соляной кислотой образуется хлорид железа(\(II\)):
Fe+2HCl→FeCl2+h3↑.
При взаимодействии магния с серной кислотой образуется сульфат магния:
Mg+h3SO4→MgSO4+h3↑.
3. Соли можно получить, используя реакции замещения, протекающие при взаимодействии металлов с другими солями.
Например, сульфат железа(\(II\)) образуется при взаимодействии железа с сульфатом меди(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Нитрат магния образуется при взаимодействии магния с нитратом серебра:
Mg+2AgNO3→MgNO32+2Ag↓.
4. Соли образуются при взаимодействии основных, кислотных или амфотерных оксидов с оксидами, принадлежащими к другой группе оксидов.
Например, при взаимодействии основного оксида кальция с кислотным оксидом углерода(\(IV\)) образуется карбонат кальция:
CaO+CO2→CaCO3.
При нагревании смеси основного оксида магния с амфотерным оксидом алюминия образуется алюминат магния:
MgO+Al2O3⟶t°MgAlO22.
5. Соли образуются при взаимодействии основных и амфотерных оксидов с кислотами.
Например, сульфат меди(\(II\)) можно получить, используя оксид меди(\(II\)) и серную кислоту:
CuO+h3SO4→CuSO4+h3O.
Хлорид цинка можно получить, используя оксид цинка и соляную кислоту:
ZnO+2HCl→ZnCl2+h3O.
6. Соли образуются при взаимодействии кислотных и амфотерных оксидов с основаниями.
Например, при пропускании углекислого газа через известковую воду (водный раствор гидроксида кальция) выпадает осадок карбоната кальция:
CaOh3+CO2→CaCO3↓+h3O.
При взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуется сульфит натрия:
2NaOH+SO2→Na2SO3+h3O.
7. Соли образуются при взаимодействии кислот с основаниями или с амфотерными гидроксидами.
Например, сульфат меди(\(II\)) можно получить, используя гидроксид меди(\(II\)) и серную кислоту:
CuOh3+h3SO4→CuSO4+2h3O.
Нитрат алюминия образуется в результате взаимодействия гидроксида алюминия с азотной кислотой:
AlOh4+3HNO3→AlNO33+3h3O.
8. Соли можно получить, используя химическую реакцию обмена, протекающую между кислотой и другой солью.
Например, при взаимодействии сульфида железа(\(II\)) с серной кислотой образуется сульфат железа(\(II\)):
FeS+h3SO4→FeSO4+h3S↑.
Хлорид кальция образуется при взаимодействии соляной кислоты (водного раствора хлороводорода) с карбонатом кальция:
CaCO3+2HCl→CaCl2+h3O+CO2↑.
9. Соли образуются при взаимодействии щелочей с растворимыми в воде солями.
Например, нитрат натрия образуется в результате химической реакции, протекающей между гидроксидом натрия и нитратом меди(\(II\)):
2NaOH+CuNO32→2NaNO3+CuOh3↓.
Сульфат калия образуется в реакции обмена, протекающей между гидроксидом калия и сульфатом железа(\(III\)):
2KOH+FeSO4→K2SO4+FeOh3↓.
10. Соли образуются в реакциях обмена, протекающих между другими солями.
Например, чтобы получить бромид серебра, можно в качестве исходных веществ использовать нитрат серебра и бромид калия:
AgNO3+KBr→AgBr↓+KNO3.
Сульфат бария образуется в реакции обмена, протекающей между сульфатом натрия и хлоридом бария:
Na2SO4+BaCl2→BaSO4↓+2NaCl.
11. Соли можно получить, разлагая некоторые другие соли.
2KClO3⟶катализаторt°2KCl+3O2.
Осадок карбоната кальция образуется при разложении гидрокарбоната кальция:
CaHCO32⇄t°CaCO3↓+h3O+CO2↑.
www.yaklass.ru
Способы получения основных солей
Основные соли образуются:
1) при добавлении недостатка раствора щелочи к растворам средних солей металлов, образованных труднорастворимыми основаниями или амфотерными гидроксидами, например:
AlCl3 + NaOH → AlOHCl2 +NaCl.
2) при действии растворов солей слабых кислородных кислот на средние соли, например:
2MgCl2 + 2K2CO3 + H2O → (MgOH)2CO3 + CO2 + 4KCl.
3) при действии недостатка кислоты на многокислотные основания или амфотерные гидроксиды, например:
Fе(OH)3 + 2HNO3 → FеOH(NO3)2 + 2H2O.
Химические свойства основных солей
1. Диссоциация основных солей.
Нужно помнить: основные соли диссоциируют по ступеням:
по первой ступени необратимо (по типу
сильного электролита) с образованием
гидроксокатиона и кислотных остатков;
по всем остальным ступеням обратимо с
постепенным отщеплением ионов  от гидроксокатиона. Примеры диссоциации
основных солей:
от гидроксокатиона. Примеры диссоциации
основных солей:
1ступень:  ,
,
гидроксокатион
2 ступень: 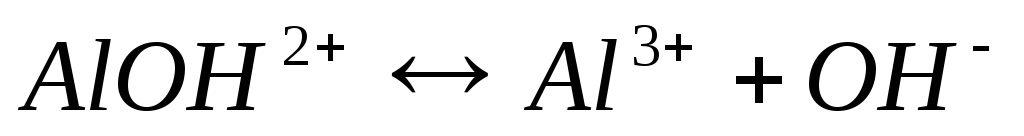 .
.
1 ступень:  ,
,
гидроксокатион
2 ступень: 
1 ступень:  ,
,
гидроксокатион
2 ступень:  ,
,
гидроксокатион
3 ступень: .
2. Основные соли летучих кислородных кислот при нагревании легко разлагаются, например:
(CuOH)2CO3 2CuО
+ CO2↑
+ H2O.
2CuО
+ CO2↑
+ H2O.
3. Реагируют с кислотами, например:
(MgOH)2CO3 + 2H2SO4 → 2MgSO4 + CO2 + 3H2O,
CuOHCl
+ HCl → CuCl
FeOH(NO3)2 + HNO3 → Fe(NO3)3 + H2O.
4. Реагируют со щелочами, например:
Fe(OH)NO3 + КOH
→ Fe(OH)2 + КNO3 .
2.3.4 Двойные соли
Двойными солями называют такие соли, в состав которых входят катионы двух различных металлов (или катион аммония) и анионы одного кислотного остатка, например:
KAl(SO4)2 – сульфат алюминия калия;
(NH4)2Fe(SO4)2 – сульфат железа (ΙΙ) аммония;
KCuCl3 – хлорид меди (ΙΙ) калия.
Двойные соли образуются при соединении солей двух различных металлов одной и той же кислоты:
K 2SO4 + Al2(SO4)3 → K2SO4 × Al2(SO4)3 → 2KAl(SO4)2,
сульфат алюминия калия
(NH4)2SO4 + Fe2(SO4)3 → (NH4)2SO4 × Fe2(SO4)3 → 2NH4Fe(SO4)2,
сульфат железа (ΙIΙ) аммония
Двойные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) на ионы, из которых они состоят, например:
 ,
,

 ,
, 


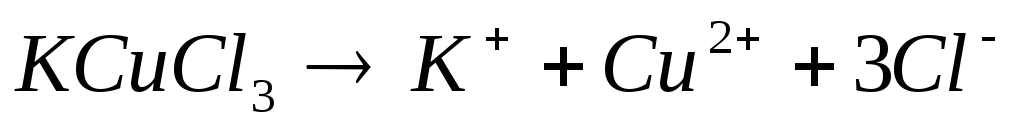 .
.
2.3.5 Смешанные соли
Смешанными солями называют такие соли, в состав которых входят катионы одного металла и анионы двух различных кислотных остатков и могут быть образованы при взаимодействии солей двух различных кислот одного и того же металла. Такие соли встречаются довольно редко, например:

 CaCl2
CaCl2 C
 a(OCl)Cl
+ 2Ca(OCl)Cl,
a(OCl)Cl
+ 2Ca(OCl)Cl,
хлоридгипохлорит кальция Ca(ClO)2 хлоридгипохлорит кальция
 CuBr2
CuBr2
C
 uBrCl
+ 2CuBrCl.
uBrCl
+ 2CuBrCl.
хлоридбромид меди (II) хлоридбромид меди (II)
CuCl2
Смешанные соли
диссоциируют в одну ступень необратимо
(по типу сильного электролита) с
образованием всех ионов, входящих в
состав соли, например:  ,
,
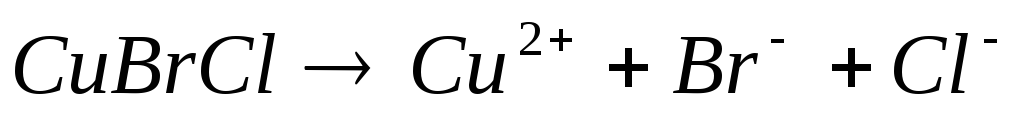 .
.
studfile.net
1.4.6. Способы получения солей.
Известно большое число реакций, приводящих к образованию солей. Приведем наиболее важные из них.
1. Взаимодействие кислот с основаниями (реакция нейтрализации):
NаОН + НNO3 = NаNO3 + Н2О
Al(OH)3 + 3НС1 = AlCl3 + 3Н2О
2. Взаимодействие металлов с кислотами:
Fе + 2HCl = FeCl2 + Н2
Zn + Н2SО4 разб.= ZnSO4 + Н2
3. Взаимодействие кислот с основными и амфотерными оксидами:
СuO + Н2
ZnO + 2HCl = ZnСl2 + Н2О
4. Взаимодействие кислот с солями:
FeCl2 + H2S = FeS + 2HCl
AgNO3 + HCI = AgCl + HNO3
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
5. Взаимодействие растворов двух различных солей:
BaCl2 + Na2SO4 = ВаSO4 + 2NаСl
Pb(NO3)2 + 2NaCl = РbС12 + 2NaNO3
6. Взаимодействие оснований с кислотными оксидами (щелочей с амфотерными оксидами):
Са(ОН)2 + СО2 = СаСО3 + Н2О,
2NаОН(тв.) + ZnO  Na2ZnO2 + Н2О
Na2ZnO2 + Н2О
7. Взаимодействие основных оксидов с кислотными:
СаO
+ SiO СаSiO3
СаSiO3
Na2O + SO3 = Na2SO4
8. Взаимодействие металлов с неметаллами:
2К + С12 = 2КС1
Fе
+ S  FеS
FеS
9. Взаимодействие металлов с солями.
Cu + Hg(NO3)2 = Hg + Cu(NO3)2
Pb(NO3)2 + Zn = Рb + Zn(NO3)2
10. Взаимодействие растворов щелочей с растворами солей
CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl
NaHCO3 + NaOH = Na2CO3+ H2O
Применение солей.
Ряд солей являются соединениями необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов (соли натрия, калия, кальция, а также соли, содержащие элементы азот и фосфор). Ниже, на примерах отдельных солей, показаны области применения представителей данного класса неорганических соединений, в том числе, в нефтяной промышленности.
NаС1 — хлорид натрия (соль пищевая, поваренная соль). О широте использования этой соли говорит тот факт, что мировая добыча этого вещества составляет более 200 млн. т.
Эта соль находит широкое применение в пищевой промышленности, служит сырьем для получения хлора, соляной кислоты, гидроксида натрия, кальцинированной соды (Na2CO3). Хлорид натрия находит разнообразное применение в нефтяной промышленности, например, как добавка в буровые растворы для повышения плотности, предупреждения образования каверн при бурении скважин, как регулятор сроков схватывания цементных тампонажных составов, для понижения температуры замерзания (антифриз) буровых и цементных растворов.
КС1 — хлорид калия. Входит в состав буровых растворов, способствующих сохранению устойчивости стенок скважин в глинистых породах. В значительных количествах хлорид калия используется в сельском хозяйстве в качестве макроудобрения.
Na2CO3 — карбонат натрия (сода). Входит в состав смесей для производства стекла, моющих средств. Реагент для увеличения щелочности среды, улучшения качества глин для глинистых буровых растворов. Используется для устранения жесткости воды при ее подготовке к использованию (например, в котлах), широко используется для очистки природного газа от сероводорода и для производства реагентов для буровых и тампонажных растворов.
Al2(SO4)3 — сульфат алюминия. Компонент буровых растворов, коагулянт для очистки воды от тонкодисперсных взвешенных частиц, компонент вязкоупругих смесей для изоляции зон поглощения в нефтяных и газовых скважинах.
Nа2В4О7 — тетраборат натрия (бура). Является эффективным реагентом — замедлителем схватывания цементных растворов, ингибитором термоокислительной деструкции защитных реагентов на основе эфиров целлюлозы.
BаSО4 — сульфат бария (барит, тяжелый шпат). Используется в качестве утяжелителя ( 4,5 г/см3) буровых и тампонажных растворов.
Fе2SO4 — сульфат железа (П) (железный купорос). Используется для приготовления феррохромлигносульфоната — реагента-стабилизатора буровых растворов, компонент высокоэффективных эмульсионных буровых растворов на углеводородной основе.
FеС13 — хлорид железа (Ш). В сочетании со щелочью используется для очистки воды от сероводорода при бурении скважин водой, для закачки в сероводородсодержащие пласты с целью снижения их проницаемости, как добавка к цементам с целью повышения их стойкости к действию сероводорода, для очистки воды от взвешенных частиц.
CaCO3 — карбонат кальция в виде мела, известняка. Является сырьем для производства негашеной извести СаО и гашеной извести Ca(OH)2. Используется в металлургии в качестве флюса. Применяется при бурении нефтяных и газовых скважин в качестве утяжелителя и наполнителя буровых растворов. Карбонат кальция в виде мрамора с определенным размером частиц применяется в качестве расклинивающего агента при гидравлическом разрыве продуктивных пластов с целью повышения нефтеотдачи.
CaSO4 — сульфат кальция. В виде алебастра (2СаSО4 · Н2О) широко используется в строительстве, входит в состав быстротвердеющих вяжущих смесей для изоляции зон поглощений. При добавке к буровым растворам в виде ангидрита (СаSО4) или гипса (СаSО4 · 2Н2О) придает устойчивость разбуриваемым глинистым породам.
CaCl2 — хлорид кальция. Используется для приготовления буровых и тампонажных растворов для разбуривания неустойчивых пород, сильно снижает температуру замерзания растворов (антифриз). Применяется для создания растворов высокой плотности, не содержащих твердой фазы, эффективных для вскрытия продуктивных пластов.
Nа2SiО3 — силикат натрия (растворимое стекло). Используется для закрепления неустойчивых грунтов, для приготовления быстросхватывающихся смесей для изоляции зон поглощений. Применяется в качестве ингибитора коррозии металлов, компонента некоторых буровых тампонажных и буферных растворов.
AgNO3 — нитрат серебра. Используется для химического анализа, в том числе пластовых вод и фильтратов буровых растворов на содержание ионов хлора.
Na2SO3 — сульфит натрия. Используется для химического удаления кислорода (деаэрация) из воды в целях борьбы с коррозией при закачке сточных вод. Для ингибирования термоокислительной деструкции защитных реагентов.
Na2Cr2О7 — бихромат натрия. Используется в нефтяной промышленности в качестве высокотемпературного понизителя вязкости буровых растворов, ингибитора коррозии алюминия, для приготовления ряда реагентов.
studfile.net
определение, классификация, номенклатура. Диссоциация. Важнейшие свойства. Методы получения кислых, средних (нормальных) и основных солей.
Соли – это электролиты, диссоцирующие в водном растворе с образованием катионов основных остатков и анионов кислотных остатков.
Формулы и названия солей
Состав соли описывается формулой, в которой на первое место ставится формула катиона, а на второе – формула аниона. Названия солей образуются от названия кислотного остатка (в именительном падеже) и названия основного остатка (в родительном падеже), входящих в состав соли. Степень окисления металла, образующего катион, указывается римскими цифрами в скобках, если это необходимо. Например, K2S – сульфид калия.
Анион бескислородной кислоты имеет окончание «ид». Например, FeCl3 – хлорид железа (III).
Названия кислых солей образуются также, как и средних, но при этом к названию аниона добавляют приставку «гидро», указывающую на наличие атомов водорода, число которых обозначается греческими числительными: ди, три и.т.д. Например: Fe(HSO4)3 – гидросульфат железа (III).
Названия основных солей образуются также, как и средних, но при этом к названию катиона добавляют приставку «гидроксо», указывающую на наличие гидроксогрупп, число которых обозначается греческими числительными: ди, три и.т.д. Например: (CuOH)2CO3 – карбонат гидроксомеди (II).
Соли подразделяются на средние, кислые и основные.
Средние (нормальные) соли не содержат в молекуле ни атомов водорода, ни гидроксогрупп. Они диссоциируют практически полностью (не ступенчато), образуя катионы металла и анионы кислотного остатка:
K2S 2 K+ + S2–
AlCl3 Al3+ + 3 Cl–
Средние соли модно получить при полном замещении атомов водорода в молекулах кислот атомами металлов или при полном замещении гидроксогрупп в основаниях на кислотные остатки. Например:
Zn(OH)2 + H2SO4 → ZnSO4 + 2 H2O
Кислые соли – это соли, кислотный остаток которых содержит в своем составе водород, например, KHS, Fe(HSO4)3. Такие соли диссоциируют ступенчато. Вначале (по I ступени) происходит полная диссоциация соли на катионы металла и анионы кислотного остатка:
KHS K+ + HS– (полная диссоциация)
Затем кислотный остаток диссоциирует в меньшей степени (частично), ступенчато отщепляя катионы водорода:
HS– H+ + S2– (частичная диссоциация)
По своим свойствам кислые соли являются промежуточными соединениями межу средними солями и кислотами. Так же, как кислоты, они обычно хорошо растворимы в воде и способны к реакции нейтрализации.
Кислые соли образуются только многоосновными кислотами в случае неполного замещения атомов водорода в кислоте на атомы металла (избыток кислоты). Например:
NaOH + H2SO4 → NaHSO4 + H2O
гидросульфат натрия
Одноосновные кислоты (HCl, HNO3) кислых солей не образуют.
Основные соли – это соли, катионы которых содержат одну или несколько гидроксогрупп, например, (CuOH)2CO3, (FeOH)Cl2.
Основные соли так же, как и кислые, диссоциируют ступенчато. По I ступени идет полная диссоциация на катионы основного остатка и анионы кислотного, а затем идет частичная диссоциация основного остатка. Например, карбонат гидроксомеди (II) полностью диссоциирует по первой ступени:
(CuOH)2CO3 2 CuOH+ + CO32–, (полная диссоциация)
затем основной остаток частично диссоциирует как слабый электролит на ионы:
CuOH+ Cu2+ + OH– (частичная диссоциация)
Как правило, основные соли малорастворимы и при нагревании разлагаются с выделением воды.
Основные соли образуются только многокислотными основаниями в случае неполного замещения гидроксогрупп основания на кислотные остатки (избыток основания). Например:
Mg(OH)2 + HCl → MgOHCl + H2O
хлорид гидроксомагния
Получение солей
Средние соли могут быть получены при взаимодействии
металла с неметаллом. Например:
Fe + S → FeS
металла с кислотой. Например:
Zn + 2 HCl → ZnCl2 + H2
3 Zn + 4 H2SO4(конц.) → 3 ZnSO4 + S + 4 H2O
основного оксида с кислотой. Например:
CuO + H2SO4 → CuSO4 + H2O
кислотного оксида с основаниями. Например:
CO2 + Ca(OH)2 → CaCO3 + H2O
основания с кислотой (реакция нейтрализации). Например:
Ca(OH)2 + 2 HCl → CaCl2 + 2 H2O
двух различных солей. Например:
Na2SO4 + BaCl2 → BaSO4 + 2 NaCl
щелочей с солями. Например:
3 KOH + FeCl3 → 3 KCl + Fe(OH)3
вытеснение пассивного металла из раствора его соли более активным металлом (в соответствии с рядом напряжений металлов). Например:
Fe + CuSO4 → FeSO4 + Cu
взаимодействием кислотного оксида с основным. Например:
CaO + SiO2 → CaSiO3
Кислые соли могут быть получены:
1. при взаимодействии снования с избытком кислоты или кислотного оксида. Например:
Pb(OH)2 + 2 H2SO4 → Pb(HSO4)2 + 2 H2O
Ca(OH)2 + 2 CO2 → Ca(HCO3)2
2. при взаимодействии средней соли с кислотой, кислотный остаток которой входит в состав этой соли. Например:
PbSO4 + H2SO4 → Pb(HSO4)2
Основные соли получаются:
при взаимодействии кислоты с избытком основания. Например:
HCl + Mg(OH)2 → MgOHCl + H2O
при взаимодействии средней соли со щелочью:
Bi(NO3)3 + 2 NaOH → Bi(OH)2NO3 + 2 NaNO3
Кислые и основные соли образуются при гидролизе средних солей:
Na2CO3 + H2O → NaHCO3 + NaOH
Al2(SO4)3 + H2O → 2 AlOHSO4 + H2SO4
Химические свойства солей
1. В ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей. Например:
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Соли взаимодействуют со щелочами. Например:
CuSO4 + 2 NaOH → Cu(OH)2 + Na2SO4
Соли взаимодействуют с кислотами:
CuSO4 + H2S → CuS + H2SO4
Многие соли взаимодействуют между собой:
CaCl2 + Na2CO3 → CaCO3 + 2 NaCl
При составлении химический уравнений реакций нужно помнить, что реакция протекает, если один из образующихся продуктов выпадает в виде осадка, выделяется виде газа или представляет собой малодиссоциированное соединение.
Превращение кислых и основных солей в средние
Взаимодействие кислой соли с гидроксидом того же металла:
KHSO4 + KOH → K2SO4 + H2O
Взаимодействие кислой соли с солью того же металла, но другой кислоты:
KHSO4 + KСl → K2SO4 + HCl
Термическое разложение кислых солей:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Взаимодействие основной соли с соответствующей кислотой:
2 FeOHSO4 + H2SO4 → Fe2(SO4)3 + 2 H2O
studfile.net
Ответы@Mail.Ru: Как получить ОСНОВНУЮ СОЛЬ???
Получение основных солей: 1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + h3O = [Zn(OH)]Cl + HCl 2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl 3. Взаимодействие солей слабых кислот со средними солями 2MgCl2 + 2Na2CO3 + h3O = [Mg(OH)]2CO3 + CO2 + 4NaCl
молча))) Ca(OH)2=CaOH+(в степени) +OH-(в степени) CaOH+NO3 -(в степени) =CaOHNO3(гидроксонитрат кальция))))) через дисациацию тама))
Есть 10 способов получения основных солей. 1. Реакция нейтрализации (взаимодействие кислоты с основанием) Ca(OH)2+2HCl=CaCl2+2h3O 2. Взаимодействие металла с неметаллом 2Fe+3Cl2=2FeCl3 3. Взаимодействие металла с кислотой. Это взаимодействие идет по разному в зависимости от характера металла и характера кислоты. Металлы, стоящие в ряду напряжений до водорода, реагируют с кислотами с образованием соли и выделением водорода: Ca+2HCl= CaCl2 +h3 . Металлы, стоящие после водорода, не вытесняют водород из кислот: Однако при взаимодействии металлов, независимо от их положения в ряду напряжений, с концентрированной серной кислотой и азотной кислотой любой концентрации водород не выделяется: 4Zn+10HNO3=4Zn(NO3)2+Nh5NO3+3h3O 4Zn+5h3SO4 (конц.) =4ZnSO4+h3S+4h3O, но Zn+h3SO4 (разбавл.) =ZnSO4+h3. 4. Взаимодействие металла с солью. Реакция протекает в том случае, если реагирующий металл стоит в ряду напряжений левее металла, входящего в состав соли Fe+CuSO4=FeSO4+Cu 5. Взаимодействие основного оксида с кислотным CaO+SO3=CaSO4 6. Взаимодействие основного оксида с кислотой CuO+2HCl=CuCl2+h3O 7. Взаимодействие кислотного оксида с основанием CO2+2NaOH=Na2CO3+h3O 8. Взаимодействие соли с кислотой Na2CO3+2HCl = 2NaCl+h3CO3 9. Взаимодействие соли со щелочью CrCl3+3NaOH=Cr(OH)3+3NaCl 10. Взаимодействие между собой двух солей в растворе. Эта реакция происходит реально в том случае, если одна из образующих солей выпадает в осадок AgNO3+NaCl=AgCl+NaNO3
touch.otvet.mail.ru
Химические свойства средних солей
1. Диссоциация средних солей.
Нужно помнить, что средние соли диссоциируют необратимо по типу сильного электролита, в одну ступень с образованием всех ионов, входящих в состав соли, например:
Al2(SO4)3 2Al3+ + 3SO
2Al3+ + 3SO ,
,
K3PO4 3K+ + PO
3K+ + PO ,
,
Cu(NO3)2 Cu2+ + 2NO
Cu2+ + 2NO ,
,
CH3COONH4 CH3COO— + NH
CH3COO— + NH .
.
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из раствора соли только те металлы, которые находятся правее его в электрохимическом ряду напряжений, где М(1) более активный металл, чем М(2). Например: реакция взаимодействия раствора сульфата меди (II) с металлическим железом идет с выделением металлической меди: CuSO4 + Fe → FeSO4 + Cu.
Железо вытесняет медь из раствора соли меди, потому что железо – более активный металл, чем медь (смотри ряд напряжений (активности) металлов).
3. Растворы солей взаимодействуют со щелочами с образованием новой соли и нового труднорастворимого основания или труднорастворимой соли, например:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl,
CuSO4 +NaOH → Cu(OH)2↓ + NaSO4,
K2CO3 + Ba(OH)2 → BaCO3↓ + 2KOH.
Реакции могут протекать с образованием основных солей, например:
FeCl3 + KOH → Fe(OH)Cl2 + KCl,
FeCl3 + 2KOH → Fe(OH)2Cl + 2KCl.
4. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты (смотрите ряд активности кислот) или новой труднорастворимой соли, например: BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
 CO2
CO2
N a2CO3 + 2HCl → 2NaCl + H2CO3
a2CO3 + 2HCl → 2NaCl + H2CO3
H2O.
5. Соли взаимодействуют между собой с образованием новых солей, если одна из солей выпадает в осадок, например:
AgNO3 + KCl → AgCl↓ + KNO3.
6. Некоторые соли разлагаются при нагревании, например:
MgCO3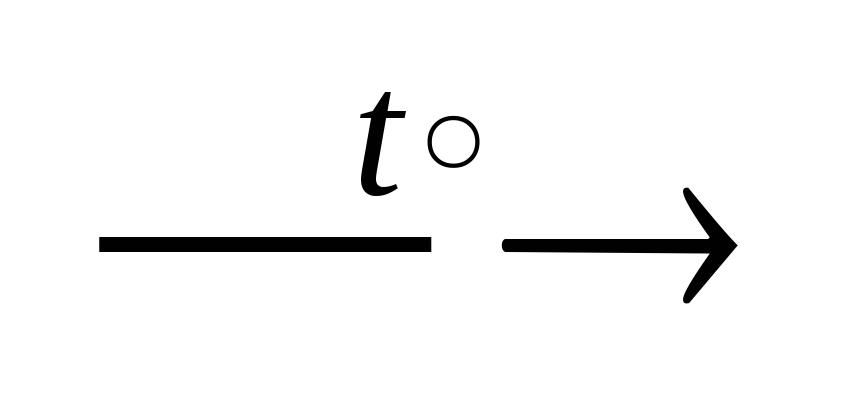 MgO + CO2↑,
MgO + CO2↑,
(NH4)2Cr2O7 N2↑
+ Cr2O3 + 4H2O,
N2↑
+ Cr2O3 + 4H2O,
KNO3 KNO2 + O2↑.
KNO2 + O2↑.
2.3.2 Кислые соли
Кислые соли – это продукты неполного замещения катионов водорода в молекулах многоосновных кислот на катионы металла.
Например: KHCO3 – гидрокарбонат калия, NaHSO4 – гидросульфат натрия и т.д. В кислых солях, кроме ионов металла и кислотного остатка содержаться ионы водорода (H+).
Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль.
H2SO4 + NaOH → NaHSO4 + H2O
Трёхосновная кислота с любым металлом образует одну нормальную и две кислые соли:
Номенклатура (название) кислых солей

Название кислых солей складывается из названия аниона кислоты с добавлением приставки – гидро (с латинского названия «гидрогениум») и названия металла в родительном падеже, например: Ca(HCO3)2 – гидрокарбонат кальция, NaHS – гидросульфид натрия, FeHPO4 – гидроортофосфат железа (II).
Нужно помнить! Приставка ди- используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода, например: NaH2PO4 – дигидроортофосфат натрия, Ca(H2PO4)2 – дигидроортофосфат кальция.
 –O
–O

 2 иона
H
– O
– P
= O
или –
2 иона
H
– O
– P
= O
или – 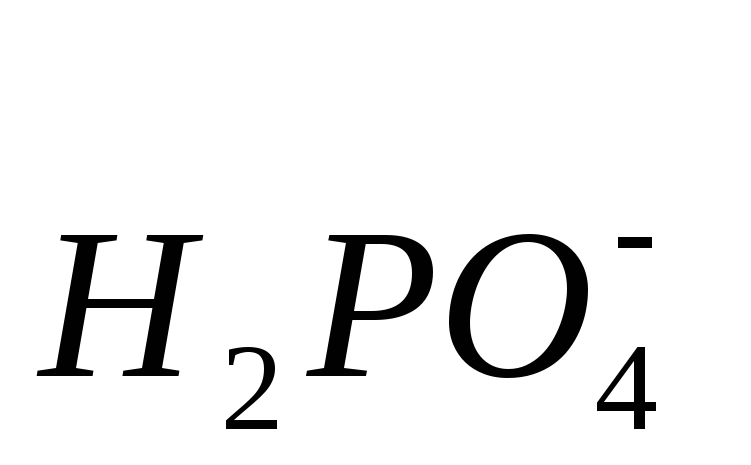
 водорода
Н – О
водорода
Н – О
дигидроортофосфат – анион
Н – О
– О
Н – О – Р = О –
– О – Р = О –
Н – О
ортофосфорная
к ислота
1 ион–
О
ислота
1 ион–
О

 водорода
– О – Р = О или =
водорода
– О – Р = О или = 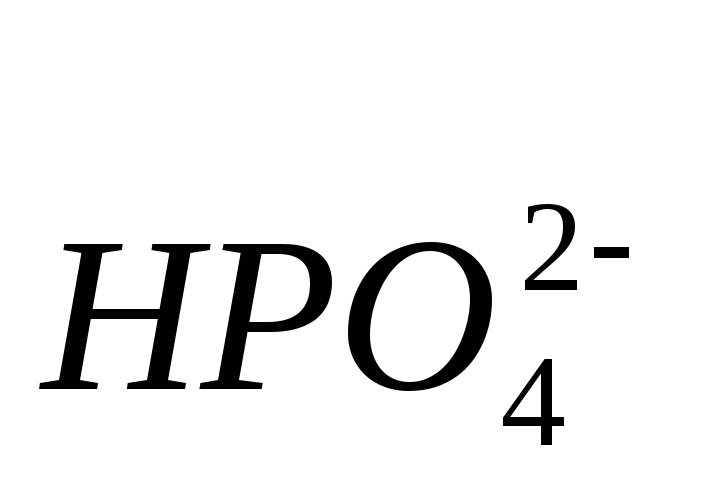 .
.
Н – О
гидроортофосфат – анион
studfile.net
средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
Видеоурок 1: Классификация неорганических солей и их номенклатура
Видеоурок 2: Способы получения неорганических солей. Химические свойства солей
Лекция: Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
 Характеристика солей
Характеристика солейСоли – это такие химические соединения, состоящие из катионов металлов (или аммония) и кислотных остатков.
Соли так же следует рассматривать в виде продукта взаимодействия кислоты и основания. В итоге данного взаимодействия, могут образовываться:
нормальные (средние),
кислые,
основные соли.
Нормальные соли образуются при достаточном для полного взаимодействия количестве кислоты и основания. К примеру:
Названия нормальных солей состоят из двух частей. В начале называется анион (кислотный остаток), затем катион. Например: хлорид натрия — NaCl, сульфат железа(III) — Fe2(SО4)3, карбонат калия — K2CO3, фосфат калия — K3PO4 и др.
Кислые соли образуются при избытке кислоты и недостаточном количестве щелочи, потому как при этом катионов металла становится недостаточно для замещения всех катионов водорода, имеющихся в молекуле кислоты. К примеру:
В составе кислотных остатков данного вида солей вы всегда увидите водород. Кислые соли всегда возможны для многоосновных кислот, а для одноосновных нет.
В названиях кислых солей ставится приставка гидро- к аниону. Например: гидросульфат железа(III)- Fe(HSO4)3, гидрокарбонат калия — KHCO3, гидрофосфат калия — K2HPO4 и др.
Основные соли образуются при избытке основания и недостаточном количестве кислоты, потому как в данном случае анионов кислотных остатков недостаточно для полного замещения гидроксогрупп, имеющихся в основании. К примеру:
Таким образом основные соли в составе катионов содержат гидроксогруппы. Основные соли возможны для многокислотных оснований, а для однокислотных нет. Некоторые основные соли способны самостоятельно разлагаться, при этом выделяя воду, образуя оксосоли, обладающие свойствами основных солей. К примеру:
Название основных солей строится следующим образом: к аниону добавляется приставка гидроксо-. Например: гидроксосульфат железа(III) — FeOHSO4, гидроксосульфат алюминия — AlOHSO4, дигидроксохлорид железа (III) — Fe(OH)2Cl и др.
Многие соли, находясь в твердом агрегатном состоянии, являются кристаллогидратами: CuSO4.5h3O; Na2CO3.10h3O и т.д.
 Химические свойства солей
Химические свойства солей
Соли – это достаточно твердые кристаллические вещества, имеющие ионную связь между катионами и анионами. Свойства солей обусловлены их взаимодействием с металлами, кислотами, основаниями и солями.
Типичные реакции нормальных солей
С металлами реагируют хорошо. При этом, более активные металлы вытесняют менее активные из растворов их солей. К примеру:
С кислотами, щелочами и другими солями реакции проходят до конца, при условии образования осадка, газа или малодиссоциируемых соединений. Например, в реакциях солей с кислотами образуются такие вещества, как сероводород H2S – газ; сульфат бария BaSO4 – осадок; уксусная кислота CH3COOH – слабый электролит, малодиссоциируемое соединение. Вот уравнения данных реакций:
K2S + H2SO4 → K2SO4 + H2S;
BaCl2 + H2SO4 → BaSO4 + 2HCl;
CH3COONa + HCl → NaCl + CH3COOH.
В реакциях солей со щелочами образуются такие вещества, как гидроксид никеля (II) Ni(OH)2 – осадок; аммиак NH3 – газ; вода H2О – слабый электролит, малодиссоциируемое соединение:
Соли реагируют между собой, если образуется осадок:
Или в случае образования более устойчивого соединения:
В этой реакции из кирпично-красного хромата серебра образуется черный сульфид серебра, ввиду того, что он является более нерастворимым осадком, чем хромат.
Многие нормальные соли разлагаются при нагревании с образованием двух оксидов – кислотного и основного:
Нитраты разлагаются другим, отличным от остальных нормальных солей образом. При нагревании нитраты щелочных и щелочноземельных металлов выделяют кислород и превращаются в нитриты:
Нитраты почти всех других металлов разлагаются до оксидов:
Нитраты некоторых тяжелых металлов (серебра, ртути и др) разлагаются при нагревании до металлов:
Особое положение занимает нитрат аммония, который до температуры плавления (170оС) частично разлагается по уравнению:
При температурах 170 — 230 оС, по уравнению:
При температурах выше 230 оС — со взрывом, по уравнению:
Хлорид аммония NH4Cl разлагается с образованием аммиака и хлороводорода:
Типичные реакции кислых солей
Они вступают во все те реакции, в которые вступают кислоты. Со щелочами реагируют следующим образом, если в составе кислой соли и щелочи имеется один и тот же металл, то в результате образуется нормальная соль. К примеру:
Если же щелочь содержит другой металл, то образуются двойные соли. Пример образования карбоната лития — натрия:
Типичные реакции основных солей
Данные соли вступают в те же реакции, что и основания. С кислотами реагируют следующим образом, если в составе основной соли и кислоты имеется один и тот же кислотный остаток, то в результате образуется нормальная соль. К примеру:
Если же кислота содержит другой кислотный остаток, то образуются двойные соли. Пример образования хлорида меди — брома:
 Комплексные соли
Комплексные соли
Комплексное соединение — соединение, в узлах кристаллической решетки которого содержатся комплексные ионы.
Рассмотрим комплексные соединения алюминия — тетрагидроксоалюминаты и цинка — тетрагидроксоцинкаты. В квадратных скобках формул данных веществ указываются комплексные ионы.
Химические свойства тетрагидроксоалюмината натрия Na[Al(OH)4] и тетрагидроксоцинката натрия Na2[Zn(OH)4]:
1. Как и все комплексные соединения выше названные вещества диссоциируются:
- Na[Al(OH)4] → Na+ + [Al(OH)4]—;
- Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]—.
Имейте ввиду, что дальнейшая диссоциация комплексных ионов невозможна.
2. В реакциях с избытком сильных кислот образуют две соли. Рассмотрим реакцию тетрагидроксоалюмината натрия с разбавленным раствором хлороводорода:
- Na[Al(OH)4] + 4HCl → AlCl3 + NaCl + H2O.
Мы видим образование двух солей: хлорида алюминия, хлорида натрия и воды. Подобная реакция произойдет и в случае с тетрагидроксоцинкатом натрия.
3. Если же сильной кислоты будет недостаточно, допустим вместо 4HCl мы взяли 2HCl, то соль образует наиболее активный металл, в данном случае натрий активнее, значит образуется хлорид натрия, а образовавшиеся гидроксиды алюминия и цинка выпадут в осадок. Этот случай рассмотрим на уравнении реакции с тетрагидроксоцинкатом натрия:
cknow.ru