Стандартные окислительные восстановительные потенциалы (Таблица)
Справочная таблица стандартные окислительно -восстановительные потенциалы по общей и неорганической химии содержит: элемент, уравнение реакции и стандартный потенциал. Таблица содержит справочный материал, необходимый для решения задач по общей и неорганической химии. Предназначено для школьников и студентов.
Смотрите также таблицу «Стандартные электродные потенциалы металлов».
Элемент | Уравнение реакции | Стандартный потенциал Ео, В |
Азот | HNO2+ H+ + e = NO + H2O | +1,00 |
NO3—+ 2H+ + 2e = NO2—+ H2O | +0,835 | |
NO3—+ 4H+ + 3e = NO + 2H2O | +0,96 | |
-3,1 | ||
| ||
Алюминий | AlO2—+ 2H2O + 3e = Al + 4OH— | -2,35 |
Al(OH)3+ 3H+ + 3e = Al + 3H2O | -1,471 | |
| ||
Бериллий | Be(OH)2+ 2H+ + 2e = Be + 2H2O | -1,820 |
BeO22-+ 4H+ + 2e = Be + 2H2O | -0,909 | |
Be2+ + 2e = Be | -1,847 | |
| ||
Бром | Br2+ 2e = 2Br— | +1,065 |
HBrO + H+ + 2e = Br— + h3O | +1,33 | |
HBrO + 2H+ + 2e = Br2 + h3O | +1,59 | |
BrO— + h3O + 2e = Br— + 2OH— | +0,76 | |
BrO3—+ 2h3O + 4e = BrO— + 4OH— | +0,54 | |
BrO3—+ 6H+ + 6e = Br— + 3h3O | +1,44 | |
2BrO3—+ 12H+ + 10e = Br2+ 6H2O | +1,52 | |
| ||
Водород | H2+ 2e = 2H— | -2,251 |
2H2O + 2e—= H2+ 2OH— | -0,828 | |
| ||
Железо | Fe3+ + e = Fe2+ | +0,771 |
Fe3+ + 3e = Fe | -0,037 | |
Fe(OH)3 + e = Fe(OH)2 + OH— | -0,56 | |
Fe(OH)3+ H+ + e = Fe(OH)2+ H2O | +0,271 | |
| ||
Иод | I2+ 2e = 2I— | +0,536 |
HIO + H+ + 2e = I—+ H2O | +0,99 | |
2HIO + 2H+ + 2e = I2 + 2h3O | +1,45 | |
IO— + h3O + 2e = I— + 2OH— | +0,49 | |
IO3—+ 5H+ + 4e = HIO + 2H2O | +1,14 | |
| ||
Иод | IO3 —+ 3H2O + 6e = I—+ 6OH— | +0,26 |
IO3—+ 6H+ + 6e = I— + 3h3O | +1,085 | |
2IO3—+ 12H+ + 10e = I2+ 6H2O | +1,19 | |
| ||
Кислород | O2+ 2H2O + 2e = H2O2+ 2OH— | -0,076 |
O2 + 2h3O + 4e = 4OH— | +0,401 | |
O2 + 2H+ + 2e = h3O2 | +0,682 | |
O2 + 4H+ + 4e = 2h3O | +1,23 | |
h3O2 + 2H+ + 2e = 2h3O | +1,77 | |
О3 + H2O + 2e = O2+ 2OH— | +1,24 | |
O3 + 6H+ + 6e = 3h3O | +1,511 | |
O3+ 2H+ + 2e = O2+ H2O | +2,076 | |
Марганец | MnO4—+ e = MnO42- | +0,56 |
MnO4—+ 2H2O + 3e = MnO2+ 4OH— | +0,6 | |
MnO2 + 4H+ + 2e = Mn2+ + 2h3O | +1,228 | |
MnO4—+ 8H+ + 5e = Mn2+ + 4H2O | +1,51 | |
| ||
Медь | Cu2+ + e = Cu+ | +0,15 |
Cu+ + e = Cu | +0,52 | |
Cu2+ + Br— + e = CuBr | +0,64 | |
Cu2+ + I—+ e = CuI | +0,86 | |
| ||
Свинец | PbO + H2O + 2e = Pb + 2OH— | -0,580 |
PbO + 2H+ + 2e = Pb + H2O | +0,248 | |
Pb(OH)2 + 2H+ + 2e = Pb + h3O | +0,277 | |
PbO2 + SO42-+ 4H+ + 2e = PbSO4 + 2h3O | +1,685 | |
Pb4+ + 2e = Pb2+ | +1,69 | |
| ||
Селен | Se + 2e = Se2- | -0,92 |
Se + 2H+ + 2e = H2Se | -0,36 | |
+1,15 | ||
h3SeO3 + 4H+ + 4e = Se + 3h3O | +0,74 | |
SeO32-+ 3h3O + 4e = Se + 6OH— | -0,366 | |
| ||
Сера | S + 2e = S2- | -0,48 |
S + 2H+ + 2e = H2S | +0,17 | |
SO42-+ 8H+ + 6e = S + 4H2O | +0,357 | |
SO42-+ 10H+ + 8e = H2S + 4H2O | +0,311 | |
SO42-+ 8H+ + 8e = S2-+ 4H2O | +0,149 | |
SO42-+ 4H+ + 2e = h3SO3 + h3O | +0,17 | |
SO42-+ h3O + 2e = SO32- + 2OH— | -0,93 | |
SO42-+ 2H+ + 2e = SO32-+ H2O | +0,20 | |
h3SO3 + 4H+ + 4e = S + 3h3O | +0,449 | |
SO32-+ 6H+ + 6e = S2-+ 3h3O | +0,231 | |
| ||
Фосфор | H3PO4+ 2H+ + 2e = H3PO3+ H2O | -0,276 |
| ||
Фтор | F2+ 2e = 2F— | +2,87 |
F2+ 2H+ + 2e = 2HF | +3,06 | |
| ||
Хлор | Cl2+ 2e = 2Cl— | +1,36 |
+1,49 | ||
2HClO + 2H+ + 2e = Cl2 + 2h3O | +1,63 | |
ClO—+ H2O + 2e = Cl—+ 2OH— | +0,88 | |
ClO3—+ 6H+ + 6e = Cl— + 3h3O | +1,45 | |
2ClO3—+ 12H+ + 10e = Cl2+ 3H2O | +1,47 | |
ClO3—+ 3h3O + 6e = Cl— + 6OH— | +0,63 | |
ClO4—+ 2H+ + 2e = ClO3—+ h3O | +1,189 | |
ClO4—+ 16H+ + 14e = Cl2(водн) + 8H2O | +1,385 | |
2HCl(r) + 2H+ + 2e = Cl2(водн) + 2H2O | +1,594 | |
| ||
Хром | Cr2O72-+ 14H+ + 6e = 2Cr3+ + 7H2O | +1,36 |
Cr3+ + 3e = Cr | -0,744 | |
Cr2+ + 2e = Cr | -0,913 | |
Cr3+ + e = Cr2+ | -0,407 | |
| ||
Цинк | ZnO22-+ 4H+ + 2e = Zn + 2H2O | +0,44 |
ZnO22-+ 2H2O + 2e—= Zn + 4OH— | -1,216 | |
infotables.ru
2.2. Метод ионно-электронного баланса (метод полуреакций)
В отличие от метода электронного баланса он дает более правильное представление о процессах окисления и восстановления в растворах, так как рассматривает не гипотетические степени окисления элементов, а ионы молекул в том виде, в котором они существуют в растворе. Слабые электролиты или малорастворимые вещества записывают в виде молекул, а сильные – в виде ионов; при этом учитывают, что в водной среде в реакции могут участвовать ионы Н+, ОН– и молекулы Н2О.
Порядок и правила нахождения коэффициентов в уравнениях ОВР, протекающих в различных средах, неодинаковы, поэтому рассмотрим их на отдельных примерах.
Овр, протекающие в кислой среде
Каждая освобождающаяся частица кислорода связывается с двумя ионами водорода с образованием одной молекулы воды: [О–2] + 2 Н+ = Н2О. Каждая недостающая частица кислорода берется из молекулы воды, при этом освобождается два иона водорода: Н2О — [О–2] = 2 H+
Последовательность действий при составлении уравнений реакции следующая:
Записывают схему реакции в молекулярной форме, например:
KMnO4 + H2C2O4 + H2SO4 → MnSO4 + CO2 + K2SO4 + H2O
2. Записывают схему реакции в ионной форме:
K+ + MnO4‾ + 2H+ + C2O42- + 2H+ + SO42- → Mn2+ + SO42- + CO2 +2K+ + SO42- + H2O
Сокращаем те ионы, которые не претерпели изменения в результате реакции.
3. Составляют краткое ионное уравнение ОВР и подчеркивают ионы, которые изменились по зарядности или составу:
MnO4‾ + 2H+ + C2О42- → Mn2+ + CО2+ H2O
4. Записывают схему процессов окисления и восстановления в виде так называемых полуреакций а) MnO4– → Mn2+ восстановление;
б) C2O42– → CO2 окисление.
5. Составляют качественный и количественный баланс для атомов элементов, а также баланс по зарядам ионов, молекул для полуреакций «а» и «б».
Качественный баланс предусматривает, чтобы в правой и левой частях уравнений «а» и «б» присутствовали одни и те же элементы. Количественный баланс требует равенства числа атомов каждого элемента в правой и левой частях.
Качественный и количественный баланс обеспечивается разными способами в различных средах.
В процессе восстановления в левой части полуреакции «а» — четыре атома кислорода, для их связывания нужно написать в левую часть 8 H+ и получить 4 молекулы воды в правой части уравнения «а» (т. е. на каждый избыточный атом кислорода вводится в левую часть удвоенное число катионов водорода, а в правую вводится соответствующее число молекул воды (в два раза меньше, чем число ионов водорода):
а) MnO4‾ + 8 H+ → Mn2+ + 4H2O;
б) C2O42‾ → 2CO2;
для полуреакции «б» качественный и количественный баланс обеспечивают коэффициентом в правой части уравнения. Если окислительно-восстановительные реакции протекают в присутствии молекулы кислоты и при составлении материального баланса наблюдается недостаток атомов кислорода в одной из частей баланса, то в эту часть записывают столько молекул воды, сколько не хватает атомов кислорода, а в противоположную часть записывают удвоенное число катионов водорода на каждый избыточный атом кислорода.
6. Далее осуществляют баланс по зарядам ионов и молекулам складывая все заряды левой части и правой части уравнения. В нашем примере заряд левой части равен +7, а правой части двум. Далее, чтобы уравнять заряды прибавляют в левую часть 5ē электронов, и стрелку заменяем на знак равенства.
В полуреакции «б» заряд левой части обусловливается зарядом иона и равен –2, а правой части – 0, т.к. нейтральные молекулы электронейтральны, и чтобы заряд левой части был равен нулю, отнимают 2 электрона
MnO4— + 8H+ + 5ē = Mn2+ + 4H2O | 5 | 10 | 2 | ||
суммарный заряд до превращения | суммарный заряд после превращения | число переданных электронов | |||
[-1+8(+1)]=+7 | [+2+4•0]=+2 | n1 =+7-2=+5 | |||
C2O42- — 2ē = 2CO2 | 2 | 5 | |||
заряд до превращения равен -2 | заряд после число переданных превращения электронов 2•0=0 n2 =–2 – 0 =–2 | ||||
Так как число принятых окислителем электронов и отданных восстановителем должно быть одинаковым, то для чисел 2 и 5 находим наименьшее общее кратное, оно равно 10, затем находим коэффициенты для полуреакций «а» и «б». Для молекул и ионов уравнения «а» множитель равен 2, в уравнении «б» множитель равен 5.
7. Каждую частицу полуреакции окисления-восстановления умножаем на найденные коэффициенты электронного баланса и складываем левые и правые части баланса; если нужно, то приводим подобные члены и составляем краткое ионное уравнение ОВР.
2MnO4¯ + 16H+ + 5C2O42– = 2Mn2+ + 8H2O + 10CO2 (краткое ионное уравнение)
Множители перед ионами и молекулами в суммарном уравнении есть коэффициенты перед соответствующими молекулами в молекулярном уравнении и составляют молекулярное уравнение.
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 4H2O
8. Определяют коэффициенты перед атомами элементов не участвующими в ОВР (например К+) и проверяют суммарное число атомов водорода и кислорода в левой и правой частях молекулярного уравнения.
Пример:
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
1) 2K+ + (Cr2O7)2 + H+ + Cl— → Cr3+ + 3Cl— + Cl2 + K+ + Cl + H2O
2) Cr2O72- + H+ + Cl— → Cr3+ + Cl2 + H2O
3

 )Cr2O72- + 14H+ + 6ē →
2Cr3+ + 7H2O 6 3 1 восстановление
)Cr2O72- + 14H+ + 6ē →
2Cr3+ + 7H2O 6 3 1 восстановление
2Cl— -2ē = Cl2 2 1 3 окисление
Так как в ионе Cr2O72- 2 атома хрома, то и в правой части перед ионом ставится коэффициент 2:
4) Cr2O72- + 6Cl— = 2Cr3+ + 7H2O + 3Cl2
При
написании молекулярного уравнения
нужно учесть что молекулы HCl
выполняют роль восстановителя и среды.
Ионы K+ в молекуле K2Cr2O7 нужно связать с хлорид ионом с образованием
соли KCl,
а атом 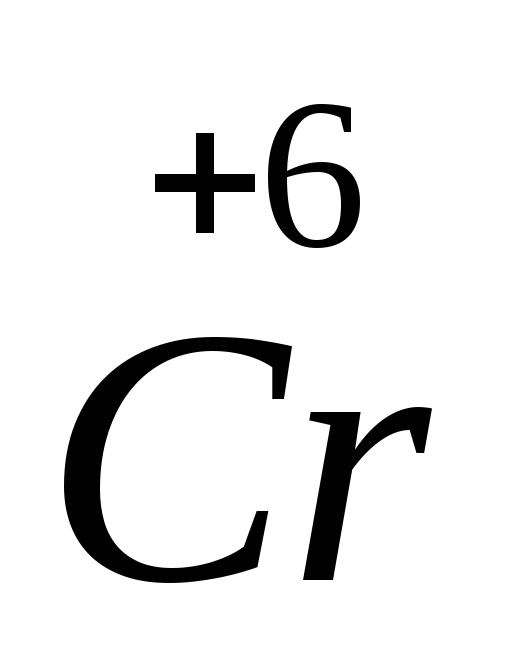 ,
который входит в состав иона(Cr2O7)2—,
выполняющего роль окислителя и
восстанавливающийся до ионов Cr3+,
связать тоже c
ионом Cl¯ в соль CrCl3.
Таким образом 8 молекул кислоты HCl в правой части идет на солеобразование
и 6 молекул на окисление, поэтому
коэффициент перед кислотой ставится
по числу катионов водорода.
,
который входит в состав иона(Cr2O7)2—,
выполняющего роль окислителя и
восстанавливающийся до ионов Cr3+,
связать тоже c
ионом Cl¯ в соль CrCl3.
Таким образом 8 молекул кислоты HCl в правой части идет на солеобразование
и 6 молекул на окисление, поэтому
коэффициент перед кислотой ставится
по числу катионов водорода.
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O
studfile.net
Направление окислительно-восстановительной реакции » HimEge.ru
По величинам стандартных окислительно-восстановительных потенциалов (Е0) можно судить о направлении окислительно-восстановительной реакции.
Например. Для уравнения реакции
MnO4— + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
самопроизвольно прямая реакция будет протекать, если стандартный потенциал окислительно-восстановительной пары окислителя больше, чем стандартный потенциал окислительно-восстановительной пары восстановителя, а ΔЕ > 0. Табличные значения стандартных электродных потенциалов для следующих окислительно-восстановительных пар:
Е0(MnO4—/Mn2+) = 1,51 B; Е0(Fe3+/Fe2+) = 0,77 B.
Величина 1,51 В > 0,77 В, следовательно, при контакте перманганат ион MnO4— выступает в роли окислителя, а катион железа Fe2+ — восстановителя, протекает прямая реакция. Вычисляем ΔЕ этой реакции:
ΔЕ = Е0ок – Е0восст = 1,51 – 0,77 = 0,74 В.
Величина ΔЕ положительная, реакция протекает самопроизвольно в прямом направлении. Если ΔЕ окажется отрицательной величиной, то реакция протекает в обратном направлении в стандартных условиях.
Например. Может ли хлор Cl2 окислить бромид-ион Br— до брома Br2?
Выпишем из справочной таблицы значения стандартных потенциалов окислительно-восстановительных пар:
Е0(Cl2/2Cl—) = 1,36 B; Е0(Br2/2Br—) = 1,07 В.
Из значений стандартных потенциалов видно, что величина 1,36 В > 1,07 В, следовательно, хлор будет окислять бромид–ион до брома по уравнению реакции:
Cl2 + 2Br— = 2Cl— + Br2
Стандартные окислительно-восстановительные потенциалы (Е0)
по отношению к потенциалу стандартного водородного электрода при 25 °С
| Элемент | Высшая степень окисления | +ne— | Низшая степень окисления | E0, В |
| As | As↓ + 3H+ As↓ + 3H2OH AsO2 + 3H+H3 AsO4 + 2H+ AsO43- + 2H2O | +3e +3e +3e +2e +2e | AsH3↑ AsH3↑ + 3OH— As↓ + 2H2OH AsO2 +2H2O AsO2— + 4OH— | -0,60 -1,43 +0,234 +0,56 -0,71 |
| Br | Br2 BrO3— + 5H+ BrO3— + 2H2O | +2e +4e +4e | 2Br— HBrO + 2H2O BrO— + 4OH— | +1,087 +1,45 +0,54 |
| 2BrO3— + 12H+ 2 BrO3— + 6H2O BrO3— + 6H+ BrO3— + 3H2O | +10e +10e +6e +6e | Br2 + 6H2O Br2 + 12OH— Br— + 3H2O Br— + 6OH— | +1,52 +0,50 +1,45 +0,61 | |
| C | C6H4O2 +2H+ Хинон HCHO + 2H+ HCOOH + 2H+ CO2↑+ 2H+ 2CO2↑ + 2H+ | +2e +2e +2e +2e +2e | C6H4(OH)2 Гдрохинон CH3OH HCHO + H2O HCOOH H2C2O4 | +0,699 +0,19 -0,01 -0,20 -0,49 |
| Cl | Cl2↓ 2ClO3— + 12H+ ClO4— + 2H+ 2ClO4— + 16H+ ClO4— + 8H+ | +2e +10e +2e +14e +8e | 2Cl—Cl 2↓ + 6H2O ClO3— + H2O Cl2↓ + 8H2O Cl— + 4H2O | +1,359 +1,47 +1,19 +1,39 +1,38 |
| Cr | Cr3+ Cr3+ Cr2+ Cr(OH)3↓ Cr2O72- + 14H+ CrO42- + 4H2O | +e +3e +2e +3e +6e +3e | Cr2+ Cr↓ Cr↓ Cr↓ + 3OH— 2Cr3+ + 7H2O Cr(OH)3↓ | -0,41 -0,74 -0,91 -1,3 +1,33 -0,13 |
| Cu | Cu2+ Cu+ Cu2+ CuI↓ Cu(NH3)42+ | +2e +e +e +e +2e | Cu↓ Cu↓ Cu+ Cu↓ + I— Cu↓ + 4NH3 | +0,345 +0,531 +0,159 -0,185 -0,07 |
| F | F2 | +2e | 2F— | +2,77 |
| Fe | Fe3+ Fe3+ Fe2+ Fe(CN)63- | +e +3e +2e +e | Fe2+ Fe↓ Fe↓ Fe(CN)64- | +0,771 -0,058 -0,473 +0,364 |
| H | 2H+ 2H+ (10-7 M) H2↑ 2H2O H2O2 + 2H+ | +2e +2e +2e +2e +2e | H2↑ H2↑ 2H— H2↑ + 2OH— 2H2O | 0,0000 -0,414 -2,25 -0,828 +1,77 |
| I | I2↓ I2 I3— 2IO3— + 12H+ 2IO3— + 6H2O IO3— + 6H+ IO3— + 3H2O | +2e +2e +2e +10e +10e +6e +6e | 2I— 2I— 3I— I2↓ + 6H2O I2↓ + 12OH— I— + 3H2O I— + 6OH— | +0,536 +0,621 +0,545 +1,19 +0,21 +1,08 +0,26 |
| K | K+ | +e | K↓ | -2,923 |
| Li | Li+ | +e | Li↓ | -3,04 |
| Mg | Mg2+ | +2e | Mg↓ | -2,37 |
| Mn | Mn3+ Mn2+ | +e +2e | Mn2+ Mn↓ | +1,51 -1,17 |
| MnO2↓ + 4H+ MnO42- + 2H2O MnO4— MnO4— + 4H+ MnO4— + 2H2O MnO4— + 8H+ | +2e +2e +e +3e +3e +5e | Mn2+ + 2H2O MnO2↓ + 4OH— MnO42- MnO2↓ + 2H2O MnO2↓ + 4OH— Mn2+ + 4H2O | +1,23 +0,58 +0,558 +1,69 +0,60 +1,51 | |
| Mo | Mo3+ H2MoO4 + 6H+ MoO42- + 4H2O | +3e +6e +6e | Mo↓ Mo↓ + 4H2O Mo↓ + 8OH— | -0,20,0 -1,05 |
| Na | Na+ | +e | Na↓ | -2,713 |
himege.ru
Стандартные потенциалы окислительно- восстановительных пар (Таблица)
Справочная таблица по общей и неорганической химии содержит информацию по стандартным потенциалам окислительно -востановительных пар. Таблица содержит справочный материал, необходимый для решения задач по общей и неорганической химии для школьников и студентов, а также для сдачи экзаменов и ЕГЭ.
Смотрите также таблицу «Стандартные электродные потенциалы металлов»
φ° — стандартный потенциал Тип среды: “к” – кислотная среда; “н” – нейтральная среда; “щ” – щелочная среда; “Оф” — окисленная форма; “Вф” — восстановленная форма |
Оф / Вф | Стандартный потенциал φ°, среда |
Ag+/ Ag | +0,80 к |
[Ag(CN)2]—/ Ag, CN— | -0,43 щ |
Al3+/ Al | -1,70 к |
Al(OH)3 / Al | -1,49 н (pH=6) |
[Al(OH)4]—/ Al | -2,34 щ |
At2 / At— | +0,20 к, щ |
Au3+/ Au | +1,50 к |
[Au(CN)2]—/ Au, CN— | -0,76 щ |
Be2+ / Be | -1,85 к |
[Be(OH)4]2—/ Be | -2,52 щ |
Bi3+ / Bi | +0,32 к |
Bi(OH)3 / Bi | -0,38 щ |
Br2 / Br— | +1,09 к, щ |
BrO—/ Br2 | +0,43 щ |
BrO3—/ Br2 | +1,51 к |
BrO3—/ Br2 | +0,52 щ |
CH3CHO/ C2H5OH | +0,19 к |
CO2 / H2C2O4 | -0,47 к |
Ca2+/ Ca | -2,86 к |
Cd2+/ Cd | -0,40 к |
Cl2 / Cl— | +1,40 к, щ |
ClO—/ Cl2 | +0,48 щ |
ClO—/ Cl2 | +2,14 к |
ClO3—/ ClO— | +0,48 щ |
ClO3—/ Cl2 | +0,48 щ |
ClO3—/ Cl2 | +1,47 к |
ClO4—/ ClO3— | +1,19 к |
Co3+/ Co2+ | +1,38 к |
CoO(OH)/Co(OH)2 | +0,19 щ |
Cr3+/ Cr2+ | -0,41 к |
Cr(OH)3 / Cr(OH)2 | -1,18 щ |
CrO42—/ [Cr(OH)6]3— | -0,17 щ |
Cr2O72—/ Cr3+ | +1,33 к |
Cu2+/ Cu | +0,34 к |
Cu2+/ Cu2O | +0,21 к |
Cu2+, Br—/ CuBr | +0,66 к |
Cu2+,CN—/[Cu(CN)2]— | +1,11 щ |
Cu2+, Cl—/ CuCl | +0,55 к |
Cu2+, Cl—/ [CuCl2]— | +0,49 к |
Cu2+, I—/ CuI | +0,86 к |
Cu2+, I—/ [CuI2]— | +0,69 к |
[Cu(NH3)2]+/ Cu, NH3 | -0,12 щ |
[Cu(NH3)4]2+/Cu, NH3 | -0,07 щ |
Cu2O / Cu | +0,47 к |
Cu2O / Cu | -0,37 щ |
Fe2+/ Fe | -0,44 к |
Fe3+/ Fe2+ | +0,77 к |
FeO(OH) / Fe(OH)2 | -0,67 щ |
F2 / F— | +2,87 щ |
F2 / HF | +3,09 к |
H+ / H2 | ±0,00 к |
H+ / H2 | -0,42 н (pH=7) |
H2O / H2 | -0,83 щ |
H2, Ca2+/ CaH2 | -2,16 к |
HBrO / Br2 | +1,57 к |
HClO / Cl2 | +1,63 к |
HO2—/ OH— | +0,88 щ |
H2O2 / H2O | +1,76 к |
H2O2 / OH— | +0,94 щ |
H3PO4 / H(PH2O2) | -0,39 к |
H3PO4 / H2(PHO3) | -0,28 к |
H3PO4 / P | -0,38 к |
HSO3—/ S | +0,48 к |
Hg2+/ Hg | +0,85 к |
HgCl2 / Hg2Cl2, Cl— | +0,66 к |
Hg2Cl2 / Hg, Cl— | +0,27 к |
[HgI4]2—/Hg, I— | -0,04 к |
[I(I)2]— / I— | +0,54 к, щ |
I2 / I— | +0,54 к, щ |
IO3—/ I— | +1,08 к |
IO3—/ I— | +0,25 щ |
IO3—/ I2 | +1,19 к |
IO3—/ I2 | +0,20 щ |
Mg2+/ Mg | -2,37 к |
Mg(OH)2 / Mg | -2,69 щ |
MnO(OH)/Mn(OH)2 | +0,17 щ |
MnO2 / Mn2+ | +1,24 к |
MnO4—/ MnO2 | +0,62 н (pH=8) |
MnO4—/ MnO2 | +1,73 н (pH=6) |
MnO4—/ MnO42— | +0,56 щ |
MnO4—/ Mn2+ | +1,53 к |
N2 / NH4+ | +0,27 к |
N2 / N2H5+ | -0,23 к |
N2 / NH3 . H2O | -0,74 щ |
N2 / N2H4 . H2O | -1,12 щ |
N2 / NH3OH+ | -1,87 к |
N2 / NH2OH . H2O | -3,04 щ |
NO3—/ NO2 | +0,77 к |
NO2—/ NO | +1,20 к |
NO2—/ NO | -0,45 щ |
NO2—/ N2O | +0,16 щ |
NO3—/ HNO2 | +0,93 к |
NO3—/ NO2— | +0,01 щ |
NO3—/ NH3 . H2O | -0,12 щ |
NO3—/ NH4+ | +0,88 к |
NO3—/ NO | +0,96 к |
Na+/ Na | -2,71 к, щ |
Na2O2 / H2O, Na+ | +2,86 к |
Na2O2 / OH—, Na+ | +1,20 щ |
NaBiO3 /Bi(OH)3,Na+ | +0,37 щ |
NaBiO3 / Bi3+, Na+ | +1,81 к |
Ni2+ / Ni | -0,23 к |
NiO(OH)/Ni2+ | +2,25 к |
NiO(OH)/ Ni(OH)2 | +0,78 щ |
O2 / HO2— | -0,08 щ |
O2 / H2O | +1,23 к |
O2 / H2O2 | +0,69 к |
O2 / H2O2 | -0,13 щ |
Pb2+ / Pb | -0,13 к |
PbO2 / Pb2+ | +1,46 к |
PbO2 / [Pb(OH)3]— | +0,19 щ |
(Pb2IIPbIV)O4/Pb2+ | +2,16 к |
S / H2S | +0,14 к |
S / S2— | -0,44 щ |
SO2 / S | +0,45 к |
SO2 / SO3S2— | +0,39 к |
SO32—/ S | -0,66 щ |
SO32—/ S | +0,58 к |
SO32—/ SO3S2— | -0,59 щ |
SO42—/ H2S | +0,31 к |
SO42—/ S | +0,35 к |
SO42—/ S | -0,75 щ |
SO42—/ S2— | +0,15 к |
SO42—/ S2— | -0,67 щ |
SO42—/ SO2 | +0,16 к |
SO42— / SO32— | -0,932 щ |
SO42—/ SO32—, H2O | -0,10 к |
SO42—/ SO3S2— | +0,275 |
SO42—, Cu2+/ CuS | +0,42 |
SO42—, Fe3+/ FeS | +0,33 |
S4O62—/ SO3S2— | +0,015 |
S2O6(O2)2—/ SO42— | +1,961 |
SO3S2—/ S | +0,512 к |
Sn2+/ Sn | -0,141 к |
[SnCl3]—/ Sn, Cl— | -0,201 к |
[SnCl6]2—/ [SnCl3]— | +0,139 к |
SnO2/ Sn | -0,118 щ |
[Sn(OH)3]—/ Sn | -0,790 щ |
[Sn(OH)6]2—/[Sn(OH)3]— | -0,960 щ |
Tl3+ / Tl+ | +1,280 |
Zn2+ / Zn | -0,763 к |
[Zn(OH)4]2—/ Zn | -1,26 щ |
_______________
Источник информации: Справочные таблицы по неорганической химии./ — М., МИТХТ им. М.В. Ломоносова, 2005.
infotables.ru