Сера Порядковый номер 16 Период 3
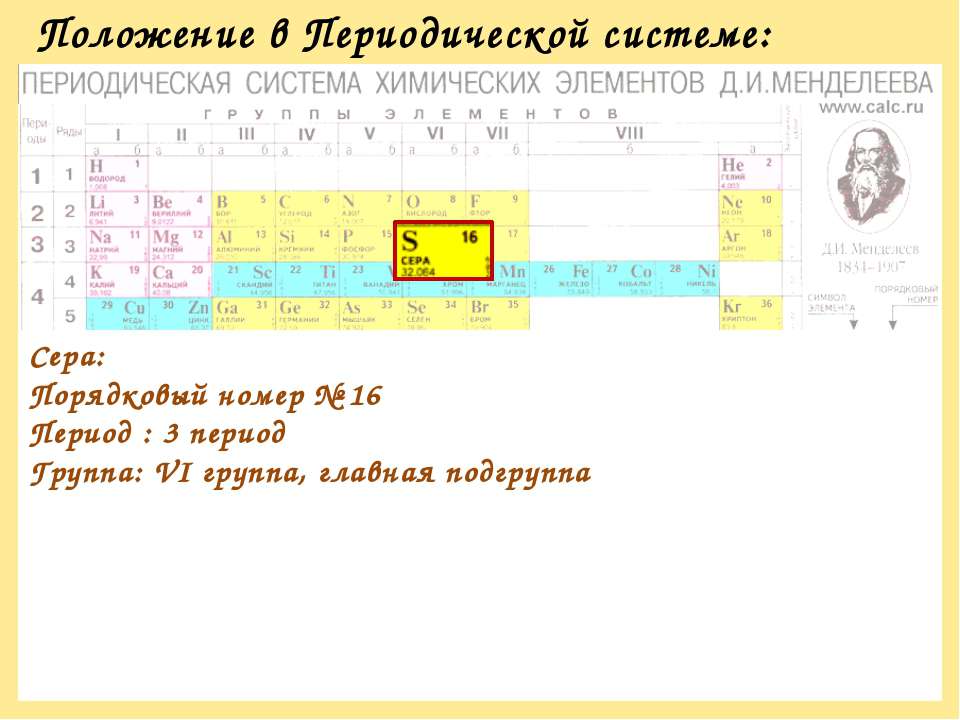
Сера: Порядковый номер № 16 Период : 3 период Группа: VI группа, главная подгруппа
32 +16 S 1 s 2 2 8 6 2 p 6 3 s 2 3 p 4 3 d 0 Валентные возможности- II; IV; VI. Краткая электронная запись- 1 s 2 2 s 22 p 6 3 s 23 p 4
Серу получают путём выплавки самородной в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о её возможности самовозгорания.
Серный колчедан (пирит Fе. S 2) Сера самородная (S) S Свинцовый блеск (галенит Pb. S) Киноварь (Hg. S) Цинковая обманка (сфалерит Zn. S)
Модификации серы Ромбическая Моноклинная Пластическая
Самородная сера Сульфидная сера Сульфатная сера
— твердое агрегатное состояние — желтого цвета — не растворима в воде — не смачивается водой ( ация) — растворяется в органических растворителях
Окислительные свойства Восстановительные свойства
Окислительные свойства 1. Сера взаимодействует практически со всеми металлами. Al + S = Восстановительные свойства
Сера взаимодействует практически со всеми металлами. Al + S = Восстановительные свойства
Окислительные свойства 1. Сера взаимодействует практически со всеми металлами. Al + S = 2. Со щелочными металлами сера взаимодействует без нагревания. Na + S = Восстановительные свойства
Окислительные свойства 1. Сера взаимодействует практически со всеми металлами. Al + S = 2. Со щелочными металлами сера взаимодействует без нагревания. Na + S = 3. При повышенной температуре сера взаимодействует с водородом. H 2 + S = Восстановительные свойства
Окислительные свойства 1. Сера взаимодействует практически со всеми металлами. Al + S = 2. Со щелочными металлами сера взаимодействует без нагревания. Na + S = 3. При повышенной температуре сера взаимодействует с водородом. H 2 + S = Восстановительные свойства 1. Сера взаимодействует с кислородом (горит) S + O 2 =
Окислительные свойства Восстановительные свойства 1. Сера взаимодействует практически со всеми металлами. 1. Сера взаимодействует с кислородом (горит) 2. Со щелочными металлами сера взаимодействует без нагревания. 2. Сера взаимодействует со фтором. Al + S = Na + S = 3. При повышенной температуре сера взаимодействует с водородом. H 2 + S = S + O 2 = S + F 2 =
Сера взаимодействует практически со всеми металлами. 1. Сера взаимодействует с кислородом (горит) 2. Со щелочными металлами сера взаимодействует без нагревания. 2. Сера взаимодействует со фтором. Al + S = Na + S = 3. При повышенной температуре сера взаимодействует с водородом. H 2 + S = S + O 2 = S + F 2 =
Окислительные свойства Восстановительные свойства 1. Сера взаимодействует практически со всеми металлами. 1. Сера взаимодействует с кислородом (горит) 2. Со щелочными металлами сера взаимодействует без нагревания. 2. Сера взаимодействует со фтором. Al + S = Al 2 S 3 Na + S = Na 2 S 3. При повышенной температуре сера взаимодействует с водородом. H 2 + S = H 2 S S + O 2 = SO 2 S + F 2 = SF 6
Окислительные свойства Восстановительные свойства 1. Сера взаимодействует практически со всеми металлами. 1. Сера взаимодействует с кислородом (горит) 2. Со щелочными металлами сера взаимодействует без нагревания. 2. Сера взаимодействует со фтором. -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов. -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
«Помогите пожалуйста.» – Яндекс.Кью
1 В атоме магния содержатся 12 протонов и 12 электронов. Укажите число электронов и протонов в ионе Mg2+:
Выберите один ответ:
12 протонов и 10 электронов
10 протонов и 12 электронов
12 протонов и 14 электронов
10 протонов и 10 электронов
2 Какова максимальная емкость р-подуровня?
Выберите один ответ:
4 электрона
2 электрона
3 электрона
6 электронов
3 Какая из электронных формул соответствует хлорид-иону?
Выберите один ответ:
ls22s22р6
ls22s22р53s23р5
ls22s22р5
ls22s22р63s23р6
4 Определите состав ядра атома углерода-12
Выберите один ответ:
6 протонов и 7 электронов
3 протона и 2 нейтрона
4 протона и 12 нейтронов
6 протонов и 6 нейтронов
5 В каком ряду основные свойства соединений усиливаются?
Выберите один ответ:
CО2,MgO,N2О5
MgO, Na2О, C02
SiО2, SО3, Cl2O7
Li2О, K2О, Rb2О
6 Номер периода в Периодической системе элементов Д. И. Менделеева указывает на:
И. Менделеева указывает на:
Выберите один ответ:
число электронов на внешнем энергетическом уровне
число валентных электронов
число энергетических уровней в атоме
общее число электронов в атоме
7 Что является основной причиной, обусловливающей периодическое изменение химических свойств элементов?
Выберите один ответ:
относительная атомная масса
строение внешних электронных уровней атомов элементов
число электронов в атоме
заряд атома
8 Какое число р-электронов находится в атоме аргона?
Выберите один ответ:
12
6
8
4
9 Укажите максимальную емкость энергетического уровня с заданным главным квантовым числом n:
Выберите один ответ:
n2
2n2
n-1
2n+1
10 В каком из рядов возрастают металлические свойства элементов?
Выберите один ответ:
Ca, Sr, Ba
В, О, F
Р, S, Cl
Al, Si, P
11 Внешний энергетический уровень атома элемента представлен формулой 3s2р6. Определите порядковый номер и название элемента.
Определите порядковый номер и название элемента.
Выберите один ответ:
10, неон
18, аргон
12, магний
15, фосфор
12 Какую из приведенных электронных формул может иметь ион Na+?
Выберите один ответ:
ls22sl
ls22s22p3
ls22s22p6
ls22s22p63sl
13 В каком из рядов орбитали представлены в порядке увеличения их энергии?
Выберите один ответ:
1s, 2s, 2p
1s, 2р, 2s
3s, 2р, 2s
2р, 1s, 2s
14 В каком из рядов находятся изоэлектронные (т. е. содержащие одинаковое число электронов) частицы?
Выберите один ответ:
Si4+, Na+, F
Mn2+, Fe2+, K+
Fe2+, Co3+, F-
Са2+, Аг, С1-
15 У какого из указанных ионов электронная формула совпадает с электронной формулой неона?
Выберите один ответ:
Be2+
F-
CI-
Li+
16 В каком из рядов приведенных элементов возрастает число электронов на внешнем слое?
Выберите один ответ:
Na,Al,Cl
Mg,Li,S
Be,N,C
Li,F,Be
17 Какая из электронных формул соответствует атому неона?
Выберите один ответ:
ls22s22p1
1s22s1
1s22s2
1s22s22p6
18 Атом какого из перечисленных элементов в основном состоянии содержит на внешнем уровне два неспаренных электрона?
Выберите один ответ:
алюминий
гелий
сера
магний
19 Что показывает порядковый номер химического элемента?
Выберите один ответ:
валентность атома в соединении
число протонов в ядре атома элемента
степень окисления элемента в соединении
заряд атома
20 Укажите пару атомов элементов четвертого периода периодической системы, которые образуют оксиды состава Э205, соответствующие их высшей степени окисления:
Выберите один ответ:
фтор и азот
германий и мышьяк
ванадий и мышьяк
мышьяк и фосфор
|
|
Ответы к упражнениям § 1. Химия 9 класс.
| |||
Презентация по химии «Химические свойства серы»
Сера и её свойства
Презентация составлена к уроку химии в
9 классе
Цели урока
- Охарактеризовать положение серы в Периодической системе, строение атома, физические и химические свойства серы.
- Охарактеризовать природные соединения серы, а также области ее применения .

- Рассмотреть сероводород и оксид серы (IV) как загрязнители окружающей среды.
Визитка химического элемента.
- Химический знак — S
- Порядковый номер – 16
- Аr — 32.066
- Период — III
- Группа – V I
- Подгруппа – главная
- Электронная формула атома – 1s 2 2s 2 2p 6 3s 2 3p 4
- Радиус атома – 0.104 нм.
- Электроотрицательность – 2.58
S 16
Sulfur 2
32.066 8
3s 2 3p 4 6
Радиус атома
Электроотрицательность
Окислительные свойства
Неметаллические свойства
Кислород
Сера
О
Селен
s
Se
Телур
2 s 2 2р 4
Te
Поло
ний
3 s 2 3 p 4
Po
4 s 2 4 p 4
5 s 2 5 p 4
6 s 2 6 p 4
) )
+8
2 6
)) )
+16
2 8 6
))) )
+34
2 8 18 6
)))) )
+52
2 8 18 18 6
))))) )
+84
2 8 18 32 18 6
4
32
+16
8
6
2
3d 0
3p 4
3s 2
2p 6
2s 2
1s 2
Валентные возможности- II (примеры соединений : SCl 2 H 2 S )
IV ( SO 2 )
VI (SO 3 )
Распространенность серы
По распространённости в земной коре сера занимает
пятнадцатое место.
Содержание серы в организме среднего человека (массой тела 70 кг.) составляет 140 г.
Содержание в окружающей среде и в организме человека ( в % по массе )
Нахождение серы в природе .
Сульфаты
Гипс-СаSO 4 *2H 2 O
Мирабилит –Na 2 SO 4 *10H 2 O
Горькая соль-MgSO 4 *7H 2 O
- Сера в природе
Самородная сера -S
Сульфиды
Пирит –FeS 2
Киноварь HgS
Халькопирит
CuFeS 2
Аллотропные модификации серы.
1. Ромбическая сера —
устойчива
при комнатной температуре
2. Моноклинная сера – образуется при
медленном охлаждении расплава
ромбической серы .
3 . Пластическая сера –
резиноподобная масса,
состоящая из полимерных
цепочек, образуется при быстром охлаждении
расплава ромбической серы .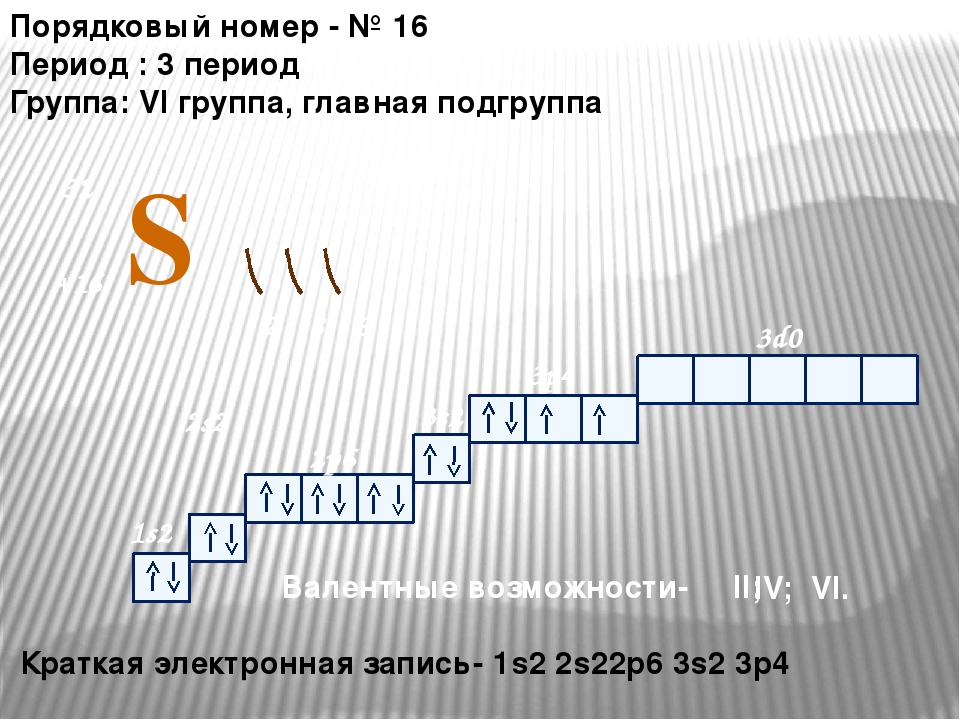
Химические свойства серы
S – окислитель
S + 2е — = S -2
1.Взаимодействие с металлами
Сu + S = CuS
2Al + 3S = Al 2 S 3
2.Взаимодействие с водородом
H 2 + S = H 2 S
Химические свойства серы .
S – восстановитель
S – 2e — = S +2 S — 4e — = S +4 S — 6e — = S +6
- S – 2e — = S +2 S — 4e — = S +4 S — 6e — = S +6
3.Взаимодействие с кислотами – окислителями
S+ 2Н 2 SО 4 =3SO 2 +2H 2 O
Концентрированная.
1.Взаимодействие с кислородом
S + O 2 = SO 2
- 1.
 Взаимодействие с кислородом S + O 2 = SO 2
Взаимодействие с кислородом S + O 2 = SO 2
2.Взаимодействие с галогенами
S+ Cl 2 = SCl 2
S + 3F 2 = SF 6
- Сероводород – высокотоксичное, крайне ядовитое вещество. Вдыхание H 2 S вызывает головокружение и головную боль, происходит разрушение гемоглобина в крови.
- Сернистый газ тоже ядовит, но он широко используется в качестве дезинфицирующего средства и отбеливателя.
Кто есть кто на данном
семейном портрете?
А
Нет, я не понимаю
В
Я не полностью уверен
Да, я понимаю
С
Использованные материалы и Интернет-ресурсы
- Учебник «Химия – 9» , О.С. Габриелян
- Единая коллекция Цифровых Образовательных Ресурсов
http :// school-collection. edu.ru
edu.ru
- Виртуальный учебник по химии
http://www.chemistry.ssu.samara.ru/
- Каталог образовательных ресурсов по химии
http://www.mec.tgl.ru/index.php?module=subjects&func=viewpage&pageid=149
- Я иду на урок химии
http://him.1september.ru/urok/
Презентация на тему: «Сера и её свойства.»
Выполнила
Федорова Нина Георгиевна,
учитель химии
МБОУ «СОШ №1 г.Тосно с углубленным изучением отдельных предметов»
г. Тосно Ленинградской области
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
КИСЛОРОД И СЕРАТема урока:
Положение кислорода и серы в
Периодической системе химических
элементов, строение их атомов. Строение
простых веществ. Аллотропия.
Изучение элементов в неорганической химии
проводится по определенному плану:
1.
 Характеристика положения элементов в
Характеристика положения элементов вПериодической системе химических элементов
Д.И.Менделеева
2. Электронное строение атома и его валентные
возможности. Возможные с.о. элемента.
3. Характеристика простого вещества. Строение
простых веществ.
4. Физические свойства. Нахождение в природе.
Важнейшие природные соединения.
5. Химические свойства.
6. Химия важнейших соединений.
7. Применение.
План характеристики химического элемента по его
положению в Периодической системе химических
элементов Д.И. Менделеева:
1. Название элемента. Его химический знак.
2. Положение элемента в Периодической системе
химических элементов Д.И. Менделеева:
порядковый номер, номер периода (большой,
малый), номер группы (с указанием подгруппы главная или побочная).
3. Химическая природа элемента (металл, неметалл).
4. С.о. элемента и формула его высшего оксида,
гидроксида. Характер их свойств (основный,
кислотный, амфотерный).

5. Низшая с.о. для неметаллов и формула его летучего
водородного соединения.
Характеристика элемента серы S на основании его
положения в Периодической системе химических
элементов Д.И. Менделеева:
1. Порядковый номер – 16, который указывает на заряд
ядра этого атома (+16) и на количество его электронов.
2. Расположена в 3-м (малом) периоде, в VI группе
главной подгруппы.
3. Типичный неметалл
4. Высший оксид – SO3 – кислотный.
5. Летучее водородное соединение – h3S.
6. Высшая с.о. равна +6, низшая –2.
7. SO3 + h3O = h3SO4 – характер гидроксида кислотный.
Характеристика элемента кислорода О на основании
его положения в Периодической системе химических
элементов Д.И. Менделеева:
1. Порядковый номер – 8, который указывает на заряд ядра
этого атома (+8) и на количество его электронов.
2. Расположена в 2-м периоде, в VI группе главной
подгруппы.
3. Типичный неметалл
4. Соединение кислорода с высшей с.
 о. – OF2.
о. – OF2.5. Водородное соединение с низшей с.о. – h3О.
6. Высшая с.о. равна +2, низшая –2.
С увеличением порядкового номера элемента VI
группы главной подгруппы происходит:
1) Ослабление неметаллических (окислительных)
свойств;
2) Уменьшение электроотрицательности элементов;
3) Ослабление кислотных свойств оксидов и
гидроксидов.
Аллотро́пия — существование двух и более простых
веществ одного и того же химического элемента,
различных по строению и свойствам — так называемых
аллотропных (или аллотропических) модификаций или
форм.
Домашнее задание:
Параграф 17, ? – 1 – письменно. Тестовые задания –
письменно. Рабочая тетрадь: стр. 15-16 и №№ 39-45.
+ доклад на тему: Применение серы.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Вариант 1
1. Число протонов в ядре атома химического элемента, порядковый номер которого в периодической системе 15, равно:
1) 31;
2) 15;
3) 16;
4) 30.
2. Число электронов в атоме химического элемента, находящегося в периодической системе в 3-м периоде IIIА-группе, соответственно равно:
1) 13;
2) 27;
3) 14;
4) 23.
3. В атоме фтора число электронных слоёв равно:
1) одному;
2) двум;
3) трём;
4) четырём.
4. Два электрона во внешнем электронном слое находятся в атомах каждого из двух химических элементов:
1) кислорода и углерода;
2) бериллия и магния;
3) азота и фосфора;
4) кремния и углерода.
5. В порядке увеличения заряда ядра атомов химические элементы расположены в ряду:
1) фтор → кислород → азот;
2) сера → фосфор → кремний;
3) натрий → магний → алюминий;
4) железо → марганец → хром.
6. Одинаковое число электронных слоёв имеют атомы каждого из химических элементов в группе:
1) фосфор, азот, мышьяк;
2) кремний, свинец, углерод;
3) фосфор, сера, хлор;
4) бром, хлор, фтор.
7. Одинаковое число электронов во внешнем электронном слое имеют атомы каждого из химических элементов в группе:
1) бор, углерод, азот;
2) фосфор, сера, кремний;
3) фосфор, сера, хлор;
4) бром, хлор, фтор.
8. В порядке увеличения радиуса атомов элементы расположены в ряду:
1) литий → натрий → калий;
2) свинец → олово → кремний;
3) иод → бром → хлор;
4) селен → сера → кислород.
9. В порядке усиления неметаллических свойств элементы расположены в ряду:
1) углерод → кремний → германий;
2) азот → фосфор → мышьяк;
3) селен → сера → кислород;
4) фтор → хлор → бром.
10. В порядке усиления основных свойств их высших оксидов элементы расположены в ряду:
1) калий → натрий → литий;
2) бериллий → магний → кальций;
3) натрий → магний → алюминий;
4) литий → бериллий → бор.
Вариант 2
1. Заряд ядра атома химического элемента, порядковый номер которого в периодической системе 26, равен:
1) +26;
2) +56;
3) +30;
4) +55.
2. Число электронов в атоме химического элемента, порядковый номер которого в периодической системе 19, равно:
1) 20;
2) 39;
3) 19;
4) 40.
3. Один электронный слой имеется в атоме:
1) натрия;
2) лития;
3) неона;
4) гелия.
4. В перечне: гелий, барий, кислород, магний, углерод — число химических элементов, в атомах которых два электрона во внешнем электронном слое, равно:
1) одному;
2) двум;
3) трём;
4) четырём.
5. В порядке уменьшения заряда ядра атомов химические элементы расположены в ряду:
1) азот → кислород → фтор;
2) литий → бериллий → бор;
3) фосфор → сера → хлор;
4) углерод → бор → бериллий.
6. Не изменяется число электронных слоёв, заполняемых электронами, в атомах химических элементов в ряду:
1) азот → кислород → фтор;
2) бериллий → магний → кальций;
3) селен → сера → кислород;
4) азот → фосфор → мышьяк.
7. Не изменяется число электронов во внешнем электронном слое в атомах химических элементов в ряду:
Не изменяется число электронов во внешнем электронном слое в атомах химических элементов в ряду:
1) сера → фосфор → кремний;
2) углерод → кремний → германий;
3) фосфор → сера → хлор;
4) хлор → сера → фосфор.
8. В порядке уменьшения радиуса ядра атомов элементы расположены в ряду:
1) сера → фосфор → кремний;
2) азот → кислород → фтор;
3) алюминий → магний → натрий;
4) углерод → бор → бериллий.
9. В порядке ослабления металлических свойств элементы расположены в ряду:
1) магний → кальций → барий;
2) кремний → олово → свинец;
3) натрий → магний → алюминий;
4) бор → бериллий → натрий.
10. В порядке ослабления основных свойств их высших гидроксидов элементы расположены в ряду:
1) германий → олово → свинец;
2) алюминий → магний → натрий;
3) литий → натрий → калий;
4) барий → кальций → магний.
Вариант 3
1. Составьте тестовое задание, в котором в качестве правильного ответа необходимо выбрать число протонов в электронной оболочке атома химического элемента по его порядковому номеру в Периодической системе Д. И. Менделеева.
И. Менделеева.
2. Составьте тестовое задание, в котором в качестве правильного ответа необходимо выбрать заряд ядра атома химического элемента по его порядковому номеру в Периодической системе Д.И. Менделеева.
3. Сравните число электронных слоёв в электронных оболочках атомов:
1) лития и азота;
2) кремния и углерода.
4. Сравните число электронов во внешнем электронном слое атомов:
1) лития и азота;
2) кремния и углерода.
5. Укажите “лишнюю” последовательность химических элементов по признаку “заряд атомного ядра” в каждой группе;
1) углерод → кремний → германий;
водород → литий → натрий;
селен → сера → кислород;
гелий → неон → аргон.
2) калий → натрий → литий;
кремний → фосфор → сера;
галлий → алюминий → бор;
кислород → азот → углерод.
6. Укажите “лишнюю” последовательность химических элементов по признаку “число электронных слоёв в атоме” в каждой группе:
1) селен → сера → кислород;
германий → кремний → углерод;
бор → алюминий → галлий;
барий → кальций → магний.
2) калий → натрий → литий;
фтор → хлор → бром;
германий → олово → свинец;
хлор → бром → иод.
7. Укажите “лишнюю” последовательность химических элементов по признаку “число электронов во внешнем электронном слое в атоме” в каждой группе:
1) фтор → кислород → азот;
натрий → магний → алюминий;
сера → фосфор → кремний;
бор → бериллий → литий.
2) азот → кислород → фтор;
бериллий → бор → углерод;
кислород → азот → углерод;
алюминий → кремний → фосфор.
8. Укажите “лишнюю” последовательность химических элементов по признаку “радиус атома” в каждой группе:
1) кремний → олово → свинец;
бром → хлор → фтор;
кислород → сера → теллур;
кислород → сера → селен.
2) магний → кальций → барий;
калий → натрий → литий;
кремний → фосфор → сера;
азот → кислород → фтор.
9. Укажите “лишнюю” последовательность химических элементов по признаку “изменение металлических свойств атомов”:
1) калий → натрий → литий;
2) бериллий → магний → кальций;
3) свинец → олово → германий;
4) барий → кальций → магний.
10. Укажите “лишнюю” последовательность химических элементов по признаку “изменение кислотноосновных свойств оксидов”:
1) углерод → кремний → германий;
2) мышьяк → фосфор → азот;
3) сера → селен → теллур;
4) хлор → бром → иод.
чисел окисления
чисел окисленияЧисло окисления
Часто бывает полезно следить за химическими реакциями, наблюдая за изменениями в окислении. количество атомов в каждом соединении во время реакции. Показатели окисления также играют важную роль. важную роль в систематической номенклатуре химических соединений. По определению, окисление число атома — это заряд, который атом имел бы, если бы соединение состояло из ионы.
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы.
всего одного элемента. Таким образом, атомы в O 2 , O 3 , P 4 , S 8 ,
и металлический алюминий имеют степень окисления 0.
2. Степень окисления простых ионов равна заряду иона. Окисление количество натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода равна +1, когда он сочетается с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он сочетается с металлом как дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы в группе IA образуют соединения (такие как Li 3 N и Na 2 S). в котором атом металла имеет степень окисления +1.
6. Элементы Группы IIA образуют соединения (такие как Mg 3 N 2 и CaCO 3 ), в котором атом металла имеет степень окисления +2.
7. Кислород обычно имеет степень окисления -2. Исключения включают молекулы и
многоатомные ионы, которые содержат связи O-O, такие как O 2 , O 3 , H 2 O 2 ,
и ион O 2 2-.
8.Элементы в группе VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
H 2 O: 2 (+1) + (-2) = 0
10. Сумма степеней окисления многоатомного иона равна заряду на ион. Степень окисления атома серы в ионе SO 4 2- должна быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна равно -2.
СО 4 2- : (+6) + 4 (-2) = -2
11. Элементы в нижнем левом углу таблицы Менделеева. с большей вероятностью будут иметь положительную степень окисления, чем те, которые расположены в правом верхнем углу угол стола. Сера имеет положительную степень окисления в SO 2 , для Например, потому что он ниже кислорода в периодической таблице.
СО 2 : (+4) + 2 (-2) = 0
Торговая марка SULFUR-RITE — регистрационный номер 3812419
SULFUR-RITE — Сведения о товарном знакеСтатус: 710 — Аннулировано — Раздел 8
Регистрационный номер
3812419
Статус
710 — Аннулирован — Раздел 8
000
3812419
Дата регистрации
2010-07-06
Маркировка
4000 — Стандартный знак символа Набор
Дата публикации возражения
2010-04-20
Код местоположения, присвоенный адвокатской конторе
M50
Имя сотрудника
FIRST, VIVIAN M
ЗаявленияХимическое технологическое оборудование для удаления сероводорода из углеводородного сырья
Классификационная информацияМеждународный класс
011 — Аппараты для освещения, отопления, производства пара, приготовления пищи, охлаждения, сушки, вентиляции, водоснабжения и санитарных целей . — Аппараты для освещения, отопления, паропроизводства, приготовления пищи, охлаждения, сушки, вентиляции, водоснабжения и санитарных целей.
— Аппараты для освещения, отопления, паропроизводства, приготовления пищи, охлаждения, сушки, вентиляции, водоснабжения и санитарных целей.Коды классов США
013, 021, 023, 031, 034
Код состояния класса
2 — Разд. 8 — Полная регистрация
Дата статуса класса
2017-02-10
Дата первого использования в любом месте
1999-01-00
Дата первого использования в продаже
1999-01-00
КорреспонденцияАдрес
Пожалуйста, войдите в свою учетную запись Justia, чтобы увидеть этот адрес. События товарного знака| Дата события | Описание события | |
| 2009-11-24 | НОВОЕ ПРИЛОЖЕНИЕ ОФИС ПРЕДОСТАВЛЕННЫЕ ДАННЫЕ, ВХОДЯЩИЕ В ТРАМВАЙ | -11 | ПЕРЕДАВАЕМЫЕ ЭКСПЕРТУ |
| 2010-02-24 | НАПИСАНО ЭКСПЕРТАТУ | |
15. 03.2010 03.2010 | ЗАВЕРШЕН ОБЗОР ПУБЛИКАЦИИ АДВОКАТСКОГО ОТДЕЛЕНИЯ | |
| 31.03.2010 | УВЕДОМЛЕНИЕ О ПУБЛИКАЦИИ | |
| 2010-04-20 | ОПУБЛИКОВАНО | 7 ДЛЯ ОППОЗИЦИИ |
| ЗАРЕГИСТРИРОВАННЫЙ ГЛАВНЫЙ РЕЕСТР | ||
| 2017-02-10 | ОТМЕНЕН СЕК.8 (6 лет) |
pg% 20perry Торговая марка Perry / Goar Sulfur Systems Серийный номер: 73357902 :: Торговые марки Legalhoop
PG PERRY / GOAR SULFUR SYSTEMS — Информация о торговой марке
Торговому знаку PG PERRY / GOAR SULFUR SYSTEMS был присвоен серийный номер № 73357902 Ведомством США по патентам и товарным знакам (USPTO). Серийный номер товарного знака — это уникальный идентификатор для идентификации знака PG PERRY / GOAR SULFUR SYSTEMS в ВПТЗ США.Знак PG PERRY / GOAR SULFUR SYSTEMS зарегистрирован в категории Строительство, Ремонт, Монтаж. Юридическим корреспондентом торговой марки PG PERRY / GOAR SULFUR SYSTEMS является RONALD J NELSON, STE A P O BOX 9890, 811 CENTRAL,
ОДЕССА,
ТЕХАС
СОЕДИНЕННЫЕ ШТАТЫ
79762 Внутренний представитель — не найден История обвинения Дата
Описание
Исходящий номер 6 февраля 1990 г. ОТМЕНЕН СЕК. 8 (6 лет) 20 сен. Текущий статус регистрации PG PERRY / GOAR SULFUR SYSTEMS — Регистрация отменена, поскольку регистрант не подал приемлемую декларацию в соответствии с Разделом 8..
Юридическим корреспондентом торговой марки PG PERRY / GOAR SULFUR SYSTEMS является RONALD J NELSON, STE A P O BOX 9890, 811 CENTRAL,
ОДЕССА,
ТЕХАС
СОЕДИНЕННЫЕ ШТАТЫ
79762 Внутренний представитель — не найден История обвинения Дата
Описание
Исходящий номер 6 февраля 1990 г. ОТМЕНЕН СЕК. 8 (6 лет) 20 сен. Текущий статус регистрации PG PERRY / GOAR SULFUR SYSTEMS — Регистрация отменена, поскольку регистрант не подал приемлемую декларацию в соответствии с Разделом 8..
Торговая марка PG PERRY / GOAR SULFUR SYSTEMS, основанная на Perry / Goar Sulfur Systems, используется в следующих сферах деятельности: изготовление и установка оборудования для извлечения серы и сжигания сероводорода на заказ.
Legalhoop — крупнейшая бесплатная онлайн-платформа для поиска товарных знаков, мониторинга товарных знаков и отслеживания. Мы предоставляем онлайн-программное обеспечение для оптимизации процесса, помогая клиентам выполнять поиск по товарным знакам и патентам, подавать заявки и осуществлять мониторинг более автоматическим и эффективным способом. Вы можете создать бесплатную учетную запись на Legalhoop.com и отслеживать все свои товарные знаки с одной удобной панели управления, а также получать бесплатные обновления статуса в любое время при изменении статуса.
Вы можете создать бесплатную учетную запись на Legalhoop.com и отслеживать все свои товарные знаки с одной удобной панели управления, а также получать бесплатные обновления статуса в любое время при изменении статуса.
Есть имя, слоган или логотип, которые нужно защитить? Legalhoop, опытный агент по интеллектуальной собственности, упростил регистрацию товарных знаков в 180 странах.
Настройте свои бренды на успех! Соединенные Штаты — самая сложная страна в мире для регистрации товарного знака. Процесс регистрации товарного знака в Соединенных Штатах занимает примерно один год и полон подводных камней.Примерно 60% всех заявок получают отказ. Многие из этих отказов можно преодолеть стратегической работой опытного консультанта по интеллектуальной собственности, но самодельные приложения, как правило, НЕ приносят успеха.
Мы обладаем обширным опытом в области права интеллектуальной собственности, включая, помимо прочего, вопросы товарных знаков, авторского права и патентов во многих странах. Вы можете положиться на наш обширный опыт в подаче заявок на регистрацию товарных знаков и обслуживании товарных знаков, чтобы помочь вам защитить свой товарный знак должным образом, с минимальными затратами и результативно.
Вы можете положиться на наш обширный опыт в подаче заявок на регистрацию товарных знаков и обслуживании товарных знаков, чтобы помочь вам защитить свой товарный знак должным образом, с минимальными затратами и результативно.
Выберите страну подачи:
Америка — СШАРегистрация торговой марки в США
199 долларов США
$ 199 + правительственный сбор * (1 класс)
СТАНДАРТНАЯ УПАКОВКА
Базовый поиск с прямым попаданием, чтобы избежать очевидного дублирования уже существующих меток.
Профессиональное оформление заявки на регистрацию товарного знака.
Электронная доставка заявки на товарный знак без необходимости ждать почты или работать с бумажными файлами. Это даст вам право на снижение государственной пошлины за подачу заявления.
Бесплатный поиск и оценка альтернативного знака, если ваш поверенный считает, что есть проблема с вашим первым выбором.
* Государственная пошлина за товарный знак взимается, когда мы отправляем ваш товарный знак в Государственное ведомство по товарным знакам, что обычно происходит в ближайшие несколько рабочих дней.
ЗНАК СЛОВА
PG СИСТЕМЫ ПЕРРИ / GOAR SULFUR SYSTEMS
ТЕКУЩЕЕ СОСТОЯНИЕ
Регистрация отменена, поскольку регистрант не подал приемлемую декларацию в соответствии с разделом 8.
СТАТУС ДАТА
6 февраля 1990 г., вторник
ДАТА ПОДАЧИ
2 апреля 1982 г., пятница
СРОК ПОДАЧИ ПРИОРИТЕТНОЙ ПРЕТЕНЗИИ:2 октября 1982 г.
(ПРИОРИТЕТНАЯ ПРЕТЕНЗИЯ ДОЛЖНА БЫТЬ ПОДАНА В ТЕЧЕНИЕ ШЕСТИ МЕСЯЦЕВ ПОДАЧИ ЗАРУБЕЖНОЙ ПОДАЧИ)Товарные знаки территориальные.Регистрация товарного знака в США не защитит ваш товарный знак в другой стране. Если вы планируете защитить свой товарный знак на международном уровне, см. Дополнительные варианты ниже:
РЕГИСТРАЦИОННЫЙ НОМЕР
1251854
ВЛАДЕЛЕЦ ТОВАРНОГО ЗНАКА
Perry / Goar Sulphur Systems
2501 E. Жемчужная ул.,
Одесса,
ТЕХАС
СОЕДИНЕННЫЕ ШТАТЫ
79763
Жемчужная ул.,
Одесса,
ТЕХАС
СОЕДИНЕННЫЕ ШТАТЫ
79763
Тип собственника: ОГРАНИЧЕННОЕ ПАРТНЕРСТВО
КОРРЕСПОНДЕНТ ТОВАРНОГО ЗНАКА
РОНАЛЬД ДЖ. НЕЛЬСОН
STE A P O BOX 9890, 811 ЦЕНТРАЛЬНЫЙ, ОДЕССА, ТЕХАС СОЕДИНЕННЫЕ ШТАТЫ 79762 Внутренний представитель — не найден История обвинения Дата Описание Исходящий номер Февраль06, 1990 ОТМЕНЕН СЕК. 8 (6 лет) 20 сентября
Информация о классификации товарных знаков
ИНФОРМАЦИЯ О КЛАССЕ
Класс 037 — Строительство, Ремонт, Монтаж
Первое использование в любом месте:
Первое использование в торговле:
Товарный знак Описание товаров и услуг
ОПИСАНИЕ
Класс 037 — Изготовление на заказ и установка оборудования для извлечения серы и сжигания сероводорода
SULFUR-OX3 Торговая марка компании Culligan International.
 Серийный номер: 88641968 :: Торговая марка Elite Trademarks
Серийный номер: 88641968 :: Торговая марка Elite TrademarksУ вас есть имя, слоган или логотип? Юридическая фирма США по высокотехнологичным товарным знакам упростила задачу — регистрация товарных знаков в 180 странах. Профилируется на NYTimes, IEEE, TechCrunch.
Почему TrademarkElite? Нужен ли вам поверенный при регистрации товарного знака? Настройте свои бренды на успех! Соединенные Штаты — самая сложная страна в мире для регистрации товарного знака .Процесс регистрации товарного знака в Соединенных Штатах занимает примерно один год и полон подводных камней.
Примерно 60% всех заявок получают отказ. Многие из этих отказов можно преодолеть стратегической работой лицензированного поверенного по товарным знакам,
но DIY-приложения обычно НЕ успешны.
Многие из этих отказов можно преодолеть стратегической работой лицензированного поверенного по товарным знакам,
но DIY-приложения обычно НЕ успешны.
Мы юридическая фирма — Каждая заявка через TrademarkElite подается лицензированными юристами по товарным знакам.Лицензированные юристы представляют вас в USPTO. Непревзойденные адвокатские услуги как по профессионализму, так и по цене.
Выберите страну подачи:
| Загрузка… |
Регистрация товарного знака
в США 249 долл. США
США
$ 249 + Комиссия правительства * (1 класс)
Элитный пакет
Профилировано на NYTimes, IEEE, TechCrunch. Непревзойденный профессионализм и цена адвокатских услуг.
Регистрация товарного знака: 249 долларов США X 1 ( 249 $ / класс ) По вашему делу работает лицензированный юрист; проводит поиск и оценку нокаута по вашей марке;
рекомендует вам соответствующий класс (а)
и описание товара / услуги, чтобы наилучшим образом защитить ваши законные права.
Общий экран товарных знаков; Обновления статуса товарных знаков; Мониторинг оппозиции; и Напоминание о международной подаче.
Бесплатный поиск и оценка альтернативного знака, если ваш поверенный считает, что есть проблема с вашим первым выбором.
* Комиссия правительства: 350 долларов США X 1 ( 350 $ / класс ) СправкаЧто такое государственная пошлина?
Государственная пошлина за товарный знак уплачивается государственному ведомству по товарным знакам. Государственная пошлина взимается отдельно при подаче заявки.
когда поверенные завершат вашу юридическую работу по товарным знакам,
согласовать с вами детали подачи документов
и готовы представить ваш товарный знак в бюро по товарным знакам.
Государственная пошлина взимается отдельно при подаче заявки.
когда поверенные завершат вашу юридическую работу по товарным знакам,
согласовать с вами детали подачи документов
и готовы представить ваш товарный знак в бюро по товарным знакам.
* У.S. Государственная пошлина за товарный знак — для классов товаров (1-34) вы можете иметь право на пониженную государственную пошлину. Не все приложения подходят; Чтобы иметь право на сниженные сборы, идентификация товаров должна соответствовать идентификатору, предварительно утвержденному ВПТЗ США.
Государственная пошлина за товарный знак взимается, когда мы отправляем ваш товарный знак в Государственное ведомство по товарным знакам, что обычно происходит в ближайшие несколько рабочих дней.
Не все приложения подходят; Чтобы иметь право на сниженные сборы, идентификация товаров должна соответствовать идентификатору, предварительно утвержденному ВПТЗ США.
Государственная пошлина за товарный знак взимается, когда мы отправляем ваш товарный знак в Государственное ведомство по товарным знакам, что обычно происходит в ближайшие несколько рабочих дней.
INTERIOR INSPIRATION Торговая марка Sulphur Specialists, Inc.- Серийный номер 75943822
ИНТЕРЬЕР ВДОХНОВЕНИЕ Товарный знак
Обзор торговой марки
Во вторник, 14 марта 2000 г., заявка на регистрацию товарного знака была подана на INTERIOR INSPIRATION в Ведомство США по патентам и товарным знакам. ВПТЗ США присвоило товарному знаку INTERIOR INSPIRATION серийный номер 75943822. Федеральный статус регистрации этого товарного знака ОТМЕНЕН — РАЗДЕЛ 8 по состоянию на субботу, 22 декабря 2007 г.
 Эта торговая марка принадлежит Sulphur Specialists, Inc. Торговая марка INTERIOR INSPIRATION зарегистрирована в категории «Образовательные и развлекательные услуги» со следующим описанием:
Эта торговая марка принадлежит Sulphur Specialists, Inc. Торговая марка INTERIOR INSPIRATION зарегистрирована в категории «Образовательные и развлекательные услуги» со следующим описанием:образовательных услуг, а именно проведение семинаров в области дизайна интерьеров
Общая информация
| Серийный номер | 75943822 | |
| Word Mark | ИНТЕРЬЕР ВДОХНОВЕНИЕ | |
| Дата подачи | Вторник, 14 марта 2000 г. | |
| Статус CANCEL | —||
| — статус CANCEL | —Дата статуса | Суббота, 22 декабря 2007 г. |
| Регистрационный номер | 2436980 | |
| Дата регистрации | Вторник, 20 марта 2001 г. | |
| Рисунок отметки | 1000 — Тип с) / буква (а) / номер (а) | |
| Дата публикации для возражения | Вторник, 26 декабря 2000 г. | |
| Имя поверенного | Кент Р.Erickson | |
| Код местоположения юридического бюро | L10 | |
| Имя сотрудника | MCCAULEY, BRENDAN D | |
| Корреспондент | KENT R. |
Заявления о товарных знаках
| Заявление об ограничении ответственности с заранее заданным текстом | «ИНТЕРЬЕР» |
| Товары и услуги | Образовательные услуги, а именно проведение семинаров в области дизайна интерьера |
Классификационная информация
| Международный класс | 041 — Образование; обеспечение обучения; развлечение; спортивные и культурные мероприятия. |
| Коды классов США | 100, 101, 107 |
| Код состояния класса | 2 — Разд. 8 — Полная регистрация 8 — Полная регистрация |
| Дата статуса класса | Суббота, 22 декабря 2007 г. |
| Основной код | 041 |
| Дата первого использования в любом месте | Понедельник, 10 января 2000 г. |
| Первое использование Дата поступления в продажу | Среда, 16 февраля 2000 г. |
История владельцев товарных знаков
| Название стороны | Sulfur Specialists, Inc. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип стороны | 30 — Первоначальный регистрант | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип юридического лица | 03 — Корпорация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Адрес | Overland Park, KS 66221 | СторонаSulphur Specialists, Inc. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип партии | 20 — Владелец публикации | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип юридического лица | 03 — Корпорация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Адрес | Overland Park
Соединения серы — обзор Восстановленные соединения серы, такие как сульфид (H 2 S), тиосульфат (S 2 O 3 2−), тетратионат (S 4 O 6 2 — ), и элементарная сера (S 0 ) используются в качестве доноров электронов окислителями серы ( Таблица 2 ). Таблица 3. Примеры скоростей хемосинтеза in situ в различных водных системах
Источники 1. 2. Баствикен Д., Эйлертссон Дж., Сунд И. и Транвик Л. (2003) Метан как источник углерода и энергии для пелагических пищевых сетей озер. Экология 84: 969–981. 3. Камачо А., Эрез Дж., Чикоте А., и др. . (2001) Микробиологическая микростратификация, фотоассимиляция неорганического углерода и фиксация темного углерода в хемоклине меромиктического озера Каданьо (Швейцария) и его значение для пищевой сети. Водные науки 63: 91–106. 4. Казамайор Е.О., Гарсия-Кантизано Дж., Мас Дж. И Педрос-Алио С. (2001) Первичная продукция на границе раздела кислород / бескислородный газ в эстуарии: вклад микробного темного CO. 2 фиксация в устье соляного клина реки Эбро. Серия «Прогресс морской экологии» 215: 49–56. 5. Клоерн Дж. 6. Фелиатра Ф. и Бьянки М. (1993) Скорость нитрификации и поглощения углерода в шлейфе реки Роны (северо-запад Средиземного моря Microbial Ecology 26: 21–28. 7. Гарсия-Кантизано Дж., Касамайор Е.О., Газоль Дж. М., Герреро Р. и Педрос-Алио С. (2005) Распределение включения СО2 между гильдиями планктонных микробов и оценка темпов роста in situ. Microbial Ecology 50: 230–241. 8. Хадас О., Пинкас Р., и Эрез Дж. (2001) Высокая первичная хемоавтотрофная продукция в озере Кинерет, Израиль: пренебрегаемое звено в углеродном цикле озера. Лимнология и океанография 46: 1968–1976. 9. Йоргенсен Б.Б., Фоссинг Х., Вирсен С. и Яннаш Х. (1991) Окисление сульфидов в бескислородном хемоклине Черного моря. Deep-Sea Research 38: (Дополнение 2), S1083 – S1103. 10. Йоргенсен Б. 11. Можжевельник С.К. и Бринкхерст Р.О. (1986) Водяной столб темный CO 2 фиксация и рост бактериального мата в периодически бескислородном заливе Саанич, Британская Колумбия. Marine Ecology Progress Series 33: 41–50. 12. Kuuppo-Leinikki P и Salonen K (1992) Бактериопланктон в небольшом полигумическом озере с бескислородным гиполимнионом. Hydrobiologia 229: 159–168. 13. Маерки М., Мюллер Б. и Верли Б. (2006) Пути микромасштабной минерализации в поверхностных отложениях: химическое сенсорное исследование в озере Байкал. Лимнология и океанография 51: 1342–1354. 14. Пракаш А., Шелдон Р. и Сатклифф WHJ (1991). Океаническая вариация поглощения 14 C в темноте. Лимнология и океанография 36: 30–39. 15. Секи Х. (1968) Связь между производством и минерализацией органического вещества в заливе Абурацубо в Японии. 16. Сорокин Ю.И. (1964) О трофической роли хемосинтеза в водоемах. Internationale Revue der gesamten Hydrobiologie 49: 307–324. 17. Сорокин Ю.И. (1970) Взаимосвязь круговорота серы и углерода в меромиктических озерах. Архив мех. Hydrobiologie 66: 391–446. 18. Тейлор Г.Т., Ябичелла М., Хо Т.Й., и др. . (2001) Хемоавтотрофия в окислительно-восстановительной переходной зоне бассейна Кариако: значительный средний источник образования органического углерода. Лимнология и океанография 46: 148–163. 19. Tuttle JH и Jannasch HW (1979) Микробная темновая ассимиляция CO 2 в желобе Кариако. Лимнология и океанография 24: 746–753. Произошла ошибка при настройке пользовательского файла cookie Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера для приема файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. |
 Химия 9 класс.
Химия 9 класс. Летучее водородное соединение PH3 — фосфин
Летучее водородное соединение PH3 — фосфин
 Уравнения реакций с участием электролитов запишите также в ионной форме.
Уравнения реакций с участием электролитов запишите также в ионной форме.
 Рассмотрите их с позиций процессов окисления-восстановления.
Рассмотрите их с позиций процессов окисления-восстановления.





 Взаимодействие с кислородом S + O 2 = SO 2
Взаимодействие с кислородом S + O 2 = SO 2
 Такие организмы способны выполнять обширный хемосинтез во внутренних водах с высокими концентрациями, например, сероводорода, сульфита (HS — ) и серы (, таблица 3, ). Восстановленные соединения серы обычно образуются в результате анаэробного гетеротрофного дыхания с сульфатом, но некоторые воды получают большие поступления сульфида через грунтовые воды. Кислород является наиболее распространенным акцептором электронов, но были предложены другие потенциальные акцепторы электронов, такие как нитрат. Восстановители серы и окислители могут проявлять активность в экстремальных условиях pH, температуры и солевого раствора.
Такие организмы способны выполнять обширный хемосинтез во внутренних водах с высокими концентрациями, например, сероводорода, сульфита (HS — ) и серы (, таблица 3, ). Восстановленные соединения серы обычно образуются в результате анаэробного гетеротрофного дыхания с сульфатом, но некоторые воды получают большие поступления сульфида через грунтовые воды. Кислород является наиболее распространенным акцептором электронов, но были предложены другие потенциальные акцепторы электронов, такие как нитрат. Восстановители серы и окислители могут проявлять активность в экстремальных условиях pH, температуры и солевого раствора. 8–80
8–80 0
0 8–141
8–141 01–3,6
01–3,6 32
32 Andersson MGI, Brion N и Middelburg JJ (2006) Сравнение активности нитрификаторов с ростом в устье Шельды — мутном, приливном эстуарии в северной Европе. Экология водных микробов 42: 149–158.
Andersson MGI, Brion N и Middelburg JJ (2006) Сравнение активности нитрификаторов с ростом в устье Шельды — мутном, приливном эстуарии в северной Европе. Экология водных микробов 42: 149–158. Э., Коул Б. Е., Оремланд Р. С. (1983) Автотрофные процессы в меромиктическом озере Биг-Сода, Невада. Лимнология и океанография 28: 1049–1061.
Э., Коул Б. Е., Оремланд Р. С. (1983) Автотрофные процессы в меромиктическом озере Биг-Сода, Невада. Лимнология и океанография 28: 1049–1061.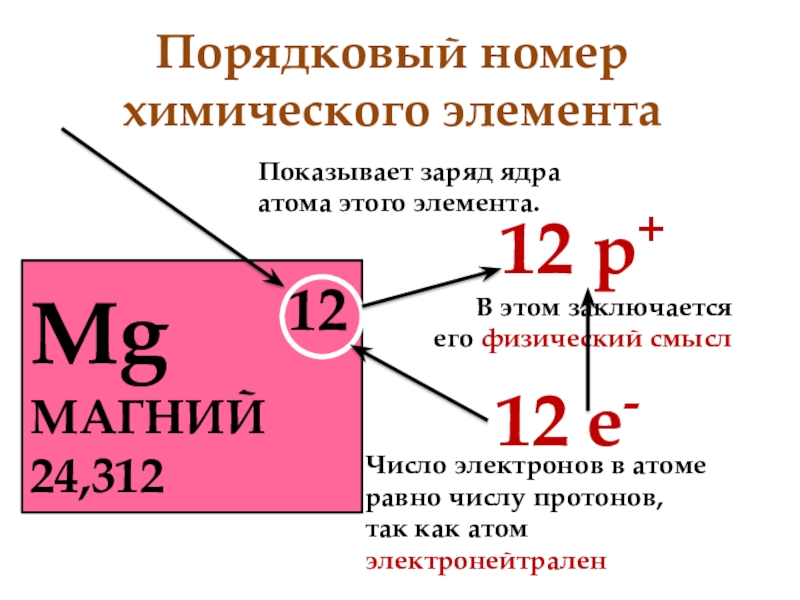 Б., Куэнен Дж. Г. и Коэн Ю. (1979) Микробные превращения соединений серы в стратифицированном озере (Солнечное озеро, Синай). Лимнология и океанография 24: 799–822.
Б., Куэнен Дж. Г. и Коэн Ю. (1979) Микробные превращения соединений серы в стратифицированном озере (Солнечное озеро, Синай). Лимнология и океанография 24: 799–822. Журнал Исследовательского совета рыболовства Канады 25: 625–687.
Журнал Исследовательского совета рыболовства Канады 25: 625–687.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.