Методическая разработка (химия, 9 класс) по теме: Урок в 9 классе по теме «Окислительно-восстановительные реакции»
Урок в 9 классе по теме:
«ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)»
ТДЦ
Воспитывающая: создать условия для воспитания активности и самостоятельности при изучении данной темы, а также умения работать в группе, умения слушать своих одноклассников.
Развивающая: продолжить развитие логического мышления, умений наблюдать, анализировать и сравнивать, находить причинно-следственные связи, делать выводы, работать с алгоритмами, формировать интерес к предмету.
Обучающая:
- закрепить понятия “степень окисления”, процессы “окисления”, “восстановления”;
- закрепить навыки в составлении уравнений окислительно-восстановительных реакций методом электронного баланса;
- научить прогнозировать продукты окислительно-восстановительных реакций.
ХОД УРОКА:
- Организационный момент.
- Актуализация знаний.
- Какие правила определения степени атомов химических элементов вы знаете? (слайд 1)
- Выполните задание (слайд 2)
- Выполните самопроверку (слайд 3)
- Изучение нового материала.
- Выполните задание (слайд 4)
Определите, что происходит со степенью окисления серы при следующих переходах:
А) h3S → SO2 → SO3
Б) SO2→ h3SO3 → Na2SO3
Какой можно сделать вывод после выполнения второй генетической цепочки?
На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
- Проверяем (слайд 5).
- Делаем вывод: По изменению степени окисления атомов химических элементов, участвующих в химической реакции различают реакций – с изменением СО и без изменения СО.
- Итак, обозначим тему урока ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР).
- Записываем определение
ОВР – реакции, которые протекают с изменением степени окисления атомов,
входящих в состав реагирующих веществ
- Попробуем разобраться – в чём особенность процессов окисления и восстановления элементов при образовании ионной связи, на примере молекулы фторида натрия?
Внимательно рассмотрите схему и ответьте на вопросы:
- Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
- Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
- Как можно сформулировать определение окисления и восстановления?
Атому натрия до завершения своего внешнего уровня легче отдать один электрон (чем принимать 7 ē до восьми, т.е. до завершения), поэтому он отдаёт свой валентный электрон атому фтора и помогает ему завершить его внешний уровень, при этом, он – восстановитель, окисляется и повышает свою СО. Атому фтора, как более электроотрицательному элементу легче принять 1 электрон для завершения своего внешнего уровня, он забирает электрон натрия, при этом восстанавливается, понижает свою СО и является окислителем.
«Окислитель как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Отнимает электроны — и ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…»
- Записываем определения
Процесс отдачи электронов атомом, называется окислением.
Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем.
Процесс принятия электронов атомом, называется восстановлением.
Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем.
- РАССТАНОВКА КОЭФФИЦИЕНТОВ В ОВР МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА
Многие химические реакции уравниваются простым подбором коэффициентов.
Но в уравнениях окислительно-восстановительных реакций иногда возникают сложности. Для расстановки коэффициентов используют метод электронного баланса.
Предлагаю вам просмотреть АНИМАЦИЮ
Изучите алгоритм составления уравнений ОВР методом электронного баланса (приложение 1).
- Закрепление
Расставьте коэффициенты в УХР
Al2O3+h3=h3O+Al методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель), выполните самопроверку.
- Рефлексия
Ответьте на вопросы в таблице «Вопросы к ученику» (приложение 2).
- Подведение итогов урока. ДЗ
- Комментированное выставление оценок.
- Домашнее задание: выполните тест с самопроверкой (приложение 3)
nsportal.ru
Урок «Окислительно-восстановительные реакции» (9 класс)
Тема: «Окислительно-восстановительные реакции»
Цели:
Образовательные: закрепить знания учащихся об основных положениях теории окисления-восстановления, важнейших окислителях и восстановителях; совершенствовать умения определять степень окисления элемента в сложном веществе; использовать метод электронного баланса для составления окислительно-восстановительных реакций
Развивающие: продолжить развивать у учащихся мыслительные операции: умение анализировать, выделять главное, связывать уже имеющиеся знания с вновь приобретенными, обобщать изученный материал.
Воспитательные: воспитание стремления к творческой познавательной деятельности через выполнение экспериментальных заданий. Продолжить воспитание качеств, необходимых в профессиональной деятельности: аккуратность, точность выполнения задания, самостоятельность, ответственность за выполнение порученного задания.
Методы: словесный, проблемно-поисковый, выполнение упражнений, практическая работа с элементами исследовательского характера
Наглядные пособия:
Таблицы: периодическая система химических элементов Д.И. Менделеева, таблица растворимости.
Раздаточный материал: дидактические карточки, набор реактивов для практической работы.
Реактивы: р-р CuSO4, Fe (металл.), Cu (металл.), р-ры KMnO4, H2SO4, FeSO4, KNO2 (или NaNO2), K2CrO4, КI.
1 занятие
Тема : «Окислительно-восстановительные реакции»
Структура занятия:
1.
Организационный момент – 2 мин.2. Мотивация занятия – 5 мин.
3. Изучение нового материала — 55 мин.
4.Контроль знаний – 20 мин.
5.Подведение итогов – 5 мин.
6.Домашняя работа – 3 мин.
1.Организационный момент
Мобилизовать внимание учащихся. Определить тему и цели занятия.
2.Мотивация занятия
Какова роль окислительно-восстановительных реакций в природе, технике и жизнедеятельности человека?
Окислительно-восстановительные реакции чрезвычайно распространены. С ними связаны, например, процессы дыхания и обмена веществ, протекающие в живом организме, гниение и брожение, фотосинтез. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов, при электролизе и выплавке металлов. С их помощью получают щелочи и кислоты, а так же многие другие ценные продукты. Окислительно-восстановительные реакции лежат в основе преобразования химической энергии в электрическую энергию в гальванических и топливных элементах. Окислительно-восстановительные реакции широко применяются в качественном и количественном анализе. Так, в их используют для открытия катионов и анионов, дающих характерные реакции с окислителями и восстановителями, они лежат в основе ряда титриметрических методов анализа: перманганатометрия, иодометрия.
3. Изучение нового материала.
Проводится в виде объяснения с активным привлечением учащихся к обсуждению темы и выполнение упражнений.
При изучении строения атома, описании свойств некоторых элементов, химической связи неоднократно упоминалось о том, что атомы принимают или отдают электроны. Очевидно, существуют химические реакции, в ходе которых одни атомы отдают электроны, а другие их принимают.
Процесс отдачи электронов называется окислением, а процесс приема электронов – восстановлением. Оба процесса происходят одновременно.
Процессы окисления и восстановления, протекающие одновременно, называются окислительно-восстановительными реакциями.
При этом атом, отдающий электроны, называется восстановителем, а атом, принимающий электроны – окислителем. (Такие атомы могут быть нейтральными, в виде радикалов или ионов.) В таких случаях изменение состояния обозначают при помощи степени окисления.
Что такое степень окисления?
Как обозначается степень окисления?
Перечислите правила расчета степени окисления.
Как определить степень окисления в сложном веществе?
Задание1. Расставьте степени окисления химических элементов в соединениях:
N2O, HNO3, N2, Cu(NO3)2, NH3, NH4OH.
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой – восстановителем:
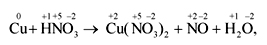
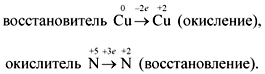
Задание 2. Определите окислитель и восстановитель в схеме реакций:
Al + H2SO4 —> Al2(SO4)3 + S + H2O,
NH3 + O2 —> NO + H2O.
Важнейшие окислители и восстановители
ОкислителиВосстановители
Простые вещества: все галогены, кислород, сера
Щелочные и щелочноземельные металлы, алюминий, цинк, водород.
Сложные вещества: HNO3, H2SO4, KMnO4, KClO3, MnO2, K2Cr2O7
KI ,H2S, FeSO4, HCl, CO, NH3
Вещества, проявляющие как окислительные, так и восстановительные свойства
H2O2, KNO2, SO2, Na2SO3
Это зависит от величины степени окисления элементов, которые входят в состав вещества.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя. Например KMnO
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя. Например NH3.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем и восстановителем. Например Na2SO3.
Типы окислительно-восстановительных реакций
межмолекулярные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ.
N
2+2H2=2NH3внутримолекулярные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества.
NH4NO2=N2+2H2O
реакции диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается.
2NO2+H2O=HNO2+HNO3
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечетный, а в молекуле четное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение к тем атомам, которые с данной степенью окисления встречаются в уравнении один раз.
6. Уравнивают атомы металлов; неметаллов; водорода.
7. Проверяют по кислороду.
Рассмотрим эти правила на примере. Требуется расставить коэффициенты в схеме реакции:
KMnO4 + HCl —> Cl2 + MnCl2 + KCl + H2O.
Выполняем пп. 1–3 правил:
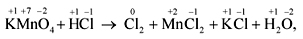
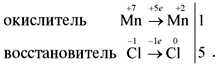
Поскольку число атомов хлора в молекуле четное (2), а коэффициент к хлору нечетный (5), удвоим оба дополнительных коэффициента (в соответствии с п. 4):
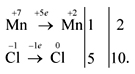
Согласно п. 5, переносим коэффициенты к атомам марганца и хлора (кроме  , которые встречаются в уравнении реакции три раза):
, которые встречаются в уравнении реакции три раза):
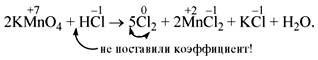
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, т.к. нужно считать атомы хлора: 5•2 = 10 атомов.
Уравняем остальные атомы:
2KMnО4 + 16НСl = 5Сl2 + 2MnСl2 + 2KСl + 8Н2O.
Атомы кислорода до и после реакции пересчитайте самостоятельно.
Задание 3. Уравнять методом электронного баланса:
Zn + HNO3 —> Zn(NO3)2 + N2O + H2O,
Al + H2SO4 —> Al2(SO4)3 + H2S + H2O,
KMnO4 + H2SO3 —> K2SO4 + H2SO4 + MnSO4 + H2O
4. Контроль знаний
Самостоятельная работа по вариантам.
Вариант 1
1.Определите степень окисления всех атомов:
K2SO3, H2SO4, KClO3, K2Cr2O7, Ca3(PO4)2, KOH.
2. Расставьте коэффициенты в следующих схемах реакций и укажите окислитель и восстановитель:
KNO2+KMnO4+H2SO4→ KNO3+MnSO4+K2SO4+H2O
K2Cr2O7+KNO2+H2SO4→ KNO3+Cr2(SO4)3+ K2SO4 +H2O
3.К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
KMnO4→ K2MnO4+MnO2+O2
HClO3+H2S→ HCl+H2SO4
Вариант 2
1.Определите степень окисления всех атомов:
KClO4, Na2S, K2CrO4, KNO2, H3PO4, Na2SO3
2. Расставьте коэффициенты в следующих схемах реакций, и укажите окислитель и восстановитель:
NaCrO2+Br2+NaOH → Na2CrO4+NaBr+H2O
KMnO4+H2S+H2SO4 →S + MnSO4+K2SO4+H2O
3.К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
K2MnO4+H2O → KMnO4+MnO2+KOH
Na2SO3 → Na2SO4+Na2S
Вариант 3
1.Определите степень окисления всех атомов:
NH4NO3, FeSO4, KNO2, CaH2, KMnO4, Br2
2. Расставьте коэффициенты в следующих уравнениях реакций:
Na2SO3+KMnO4+H2O→Na2SO4+MnO2+KOH
K2Cr2O7+H2S+H2SO4→S + Cr2(SO4)3+ K2SO4 +H2O
3. К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
HNO2→HNO3+NO+H2O
Cu(NO3)2→CuO+NO2+O2
Вариант 4
1.Определите степень окисления всех атомов:
HClO, NaNO3, KCrO2, N2O5, FeSO4, F2
2. Расставьте коэффициенты в следующих уравнениях реакций:
KMnO4+KI+H2SO4→K2SO4+MnSO4+I2+H2O
K2Cr2O7+SO2+H2SO4→K2SO4+ Cr2(SO4)3+H2O
3.К какому типу окислительно-восстановительных реакций относятся данные реакции, расставьте коэффициенты методом электронного баланса:
CuO+NH3 → N2 + Cu + H2O
Na2SO3 → Na2SO4 + Na2S
5. Подведение итогов
Итог подводится по результатам устных ответов, работы у доски и индивидуальной работы по карточкам.
6. Домашняя работа
1.Работа с конспектом.
2.расставить коэффициенты методом электронного баланса.
а) Cl2 + KOH → KCl + KClO + H2O
б) KClO3 + S→ KCl + SO2
в) Cu + H2SO4→ CuSO4 + SO2 + H2O
г) HCl + MnO2 → Cl2 + MnCl2 + H2O
infourok.ru
Материал для подготовки к ЕГЭ (ГИА) по химии (9 класс) на тему: Тест 9 класс ОВР
Окислительно-восстановительные реакции
Вариант 1
А 1. Реакции, протекающие с изменением степени окисления, хотя бы одного элемента называются:
- Каталитическими
- Окислительно-восстановительными
- Некаталитическими
- Неокислительно-восстановительными
А 2. Элемент, повышающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс отдачи электронов атомами, молекулами или ионами, называется:
- Электролиз
- Восстановление
- Коррозия
- Окисление
А 4. Высшая степень окисления элемента совпадает с:
- Номером периода
- Порядковым номером элемента
- Номером группы
- Нет правильного ответa
А5. Простые вещества неметаллы в окислительно-восстановительных реакциях проявляют:
- Окислительные свойства
- Восстановительные свойства
- Окислительно-восстановительную двойственность
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в высшей степени окисления, выполняет роль:
- окислителя и восстановителя
- только окислителя
- только восстановителя
- нет правильного ответа
А 7. Схема процесса окисления:
1) Na+1 ⟶ Na0 2) S-2 ⟶ S+4 3) Fe+3 ⟶ Fe+0 4) S+6 ⟶ S+4
А 8. Только восстановительные свойства за счёт атома азота проявляет
1) Nh4 2) N2 3) N2O3 4) N2O5
А 9. Соединение железа играет роль окислителя в реакции, схема которой:
1) Fe(OH)2 + O2 + h3O ⟶ Fe(OH)3
2) FeCl2 + Cl2 ⟶ FeCl3
3) Fe(OH)2 + h3SO4 ⟶ FeSO4 + h3O
4) FeSO4 + Zn ⟶ ZnSO4 + Fe
С 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
SO2 + Cl2 + h3O ⟶ h3SO4 + HCl
Окислительно-восстановительные реакции
Вариант 2
А 1. Реакции, протекающие без изменением степени окисления элементов называются:
- Каталитическими
- Окислительно-восстановительными
- Некаталитическими
- Неокислительно-восстановительными
А 2. Элемент, понижающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс присоединения электронов атомами, молекулами или ионами, называется:
- Электролиз
- Восстановление
- Коррозия
- Окисление
А 4. Минимальная степень окисления элемента совпадает с:
- Номером периода
- Порядковым номером элемента
- Номером группы
- Нет правильного ответа
А5. Простые вещества металлы в окислительно-восстановительных реакциях проявляют:
- Окислительные свойства
- Восстановительные свойства
- Окислительно-восстановительную двойственность
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в промежуточной степени окисления, выполняет роль:
- окислителя и восстановителя
- только окислителя
- только восстановителя
- нет правильного ответа
А 7. Схема процесса восстановления:
1) N+5 ⟶ N+2 2) Fe+2 ⟶ Fe+3 3) 2N-3 ⟶ N20 4) S+4⟶ S+6
А 8. Окислительно-восстановительную двойственность за счёт атома азота проявляет
1) КNO3 2) Nh4 3) HNO3 4) N2O
А 9. Соединение железа играет роль восстановителя в реакции, схема которой:
1) FeCl3 + KI ⟶ FeI2 + I2 + KCl
2) Fe(OH)2 + O2 + h3O ⟶ Fe(OH)3
3) FeO + HCl ⟶ FeCl2 + h3O
4) FeO + h3 ⟶ Fe + h3O
С 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
NO2 + CO ⟶ N2 + CO2
Окислительно-восстановительные реакции
Вариант 3
А 1. Реакции, протекающие с изменением степени окисления, хотя бы одного элемента называются:
- Окислительно-восстановительными
- Некаталитическими
- Каталитическими
- Неокислительно-восстановительными
А 2. Элемент, повышающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс отдачи электронов атомами, молекулами или ионами, называется:
- Окисление
- Электролиз
- Восстановление
- Коррозия
А 4. Максимальная я степень окисления элемента совпадает с:
- Номером группы
- Номером периода
- Порядковым номером элемента
- Нет правильного ответа
А5. Простые вещества неметаллы в окислительно-восстановительных реакциях проявляют:
- Окислительные свойства
- Окислительно-восстановительную двойственность
- Восстановительные свойства
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в низшей степени окисления, выполняет роль:
- окислителя и восстановителя
- только окислителя
- только восстановителя
- нет правильного ответа
А 7. Схема процесса окисления:
1) O20 ⟶ 2O-2 2) N20 ⟶ 2N-3 3) S+4 ⟶ S+6 4) P0 ⟶ P-3
А 8. Только окислительные свойства за счёт атома хлора проявляет:
1) Cl2O 2) KClO4 3) Cl2 4) HCl
А 9. Хлороводород проявляет окислительные свойства в реакции, схема которой:
1)HCl + Zn ⟶ ZnCl2 + h3
2) HCl + CaO ⟶ CaCl2 + h3O
3) HCl + NaOH ⟶ NaCl + h3O
4) HCl + Na2CO3 ⟶ NaCl + h3O + CO2
С 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
CrO3 + HCl ⟶ CrCl3 + Cl2 + h3O
Окислительно-восстановительные реакции
Вариант 4
А 1. Реакции, протекающие без изменением степени окисления, хотя бы одного элемента называются:
- Каталитическими
- Окислительно-восстановительными
- Некаталитическими
- Неокислительно-восстановительными
А 2. Элемент, понижающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс присоединения электронов атомами, молекулами или ионами, называется:
- Коррозия
- Окисление
- Электролиз
- Восстановление
А 4. Низшая степень окисления элемента совпадает с:
- Номером группы
- Номером периода
- Порядковым номером элемента
- Нет правильного ответа
А5. Простые вещества металлы в окислительно-восстановительных реакциях проявляют:
- Окислительно-восстановительную двойственность
- Окислительные свойства
- Восстановительные свойства
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в высшей степени окисления, выполняет роль:
- окислителя и восстановителя
- только окислителя
- только восстановителя
- нет правильного ответа
А 7. Схема процесса восстановления:
1) P-3 ⟶ P0 2) N+3 ⟶ N+5 3) Mg0 ⟶ Mg+2 4) S0 ⟶ S-2
А 8. Только восстановительные свойства за счёт атома брома проявляет
1) Br2 2) HBr 3) HBrO4 4) KBrO
А 9. Хлороводород проявляет восстановительные свойства в реакции, схема которой:
- HCl + CaCO3⟶ CaCl2 + h3O + CO2
- HCl + Al2O3 ⟶ AlCl3 + h3O
- HCl + Mg ⟶ MgCl2 + h3
- HCl + MnO2 ⟶ MnCl2 + Cl2 + h3O
С 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
S + HNO3 ⟶ h3SO4 + NO2 + h3O
Окислительно-восстановительные реакции
Вариант 5
А 1. Реакции, протекающие с изменением степени окисления, хотя бы одного элемента называются:
- Каталитическими
- Окислительно-восстановительными
- Некаталитическими
- Неокислительно-восстановительными
А 2. Элемент, повышающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс отдачи электронов атомами, молекулами или ионами, называется:
- Коррозия
- Электролиз
- Восстановление
- Окисление
А 4. Высшая степень окисления элемента совпадает с:
- Номером периода
- Порядковым номером элемента
- Номером группы
- Нет правильного ответа
А5. Простые вещества неметаллы в окислительно-восстановительных реакциях проявляют:
- Окислительные свойства
- Восстановительные свойства
- Окислительно-восстановительную двойственность
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в минимальной степени окисления, выполняет роль:
- окислителя и восстановителя
- только окислителя
- только восстановителя
- нет правильного ответа
А. 7. Схема процесса окисления:
1) O20 ⟶ 2O-2 2) N20 ⟶ 2N-3 3) S+4 ⟶ S0 4) P0 ⟶ P+5
А. 8. Окислительно- восстановительную двойственность за счёт атома хлора проявляет:
1) Cl2O 2) KClO4 3) Cl2О7 4) HCl
А.9. Соединение железа играет роль восстановителя в реакции, схема которой:
1) FeCl3 + KI ⟶ FeI2 + I2 + KCl
2) Fe(OH)2 + O2 + h3O ⟶ Fe(OH)3
3) FeO + HCl ⟶ FeCl2 + h3O
4) FeO + h3 ⟶ Fe + h3O
С. 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
P + HNO3 + h3O ⟶ h4PO4 + NO
Окислительно-восстановительные реакции
Вариант 6
А 1. Реакции, протекающие без изменением степени окисления, хотя бы одного элемента называются:
- Неокислительно-восстановительными
- Каталитическими
- Окислительно-восстановительными
- Некаталитическими
А 2. Элемент, понижающий степень окисления в ходе окислительно-восстановительной реакции, называют:
- Окислитель
- Восстановитель
А3. Процесс присоединения электронов атомами, молекулами или ионами, называется:
- Электролиз
- Восстановление
- Коррозия
- Окисление
А 4. Минимальная степень окисления элемента совпадает с:
- Номером периода
- Порядковым номером элемента
- Номером группы
- Нет правильного ответа
А5. Простые вещества металлы в окислительно-восстановительных реакциях проявляют:
- Восстановительные свойства
- Окислительные свойства
- Окислительно-восстановительную двойственность
- Все ответы верны
А 6. Сложное веществ, содержащее элемент в промежуточной степени окисления, проявляет свойства:
- Окислительно-восстановительные
- только окислительные
- только восстановительные
- нет правильного ответа
А 7. Схема процесса восстановления:
1) Na+1 ⟶ Na0 2) S-2 ⟶ S+4 3) Fe+2 ⟶ Fe+3 4) S+4 ⟶ S+6
А 8. Только окислительные свойства за счёт атома азота проявляет:
1) NO 2) N2 3) N2O3 4) N2O5
А 9. Соединение железа играет роль окислителя в реакции схема которой:
1) Fe(OH)2 + O2 + h3O ⟶ Fe(OH)3
2) FeCl2 + Cl2 ⟶ FeCl3
3) Fe(OH)2 + h3SO4 ⟶ FeSO4 + h3O
4) FeSO4 + Zn ⟶ ZnSO4 + Fe
С 1. Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель, процессы окисления, восстановления:
NO + h3 ⟶ N2 + h3O
nsportal.ru
Дидактический материал по теме «Окислительно-восстановительные реакции»
1)
Al + S → Al2S3
Zn S +O2→ZnO + SO2
HCl + PbO2→Cl2+ PbCl2+ H2O
SO2 + O2→ SO3
НNO3 → NO2 +O2 +H2O
2)
СO + O2 → СO2
Н2 + I2 → HI
KClO3 + P → P2O5 + KCl
KClO3 → KCl + O2
H2S + HMnO4→ S + MnO2 + H2O
3)
С + СO2 → СO
Ba + S → Ba S
Н2SO4 + HBr → Br2 + SO2 + H2O
Zn(NO3)2 → ZnO + NO2 + O2
HNO3 + I2→ HIO3+ NO+ H2O
4)
H2 + I2 → HI
H2S + HClO3 → S + HCl + H2O
H2S + SO2 → S + H2O
Fe(OH)2 + О2 + H2O → Fe(OH)3
C + НNO3 → CO2 + NО + H2O
5)
S + HNO3 → H2SO4 + NO2+ H2O
Mg + H2SO4 → MgSO4 + H2S + H2O
SO2 + O2 → SO3
Ag + HNO3 → AgNO3 + NO + H2O
H2S + SO2 → S + H2O
6)
Pb + HNO3 → Pb(NO3)2+ NO2 + H2O
KClO3 → KCl + O2
Li + H2O → LiOH + H2
H2 + Br2 → HBr
Р + N2O → N2 + P2O5
7)
S + O2 → SO2
P +HNO3 + H2O → H3PO4 + NO
C + H2SO4 → CO2 + SO2 + H2O
CuO + NH3 → Cu + N2 + H2O
Mg + H2SO4 → MgSO4 + H2S + H2O
8)
KI + H2SO4 → H2S + I2 + H2O + K2SO4
NaNO3 → NaNО2 + О2
HCl + MnO2 → Cl2 + MnCl2 + H2O
NaNO3→ NaNО2 + О2
Mg + HNO3 → Mg(NO3)2 + N2O + H2O
9)
H2S + SO2 → S + H2O
Ca +H2SO4 → CaSO4 + H2S + H2O
Cu2O + HNO3 → Cu(NO3)2 + NO + H2O
NaClO3 → NaCl + O2
Zn + HNO3 → Zn (NO3)2+ NO2 + H2O
10)
P + N2O → N2 + P2O5
KClO3 → KCl + O2
H2 + O2 → H2O
CuO + NH3 → Cu + N2 + H2O
Pb + HNO3 → Pb(NO3)2+ NO2 + H2O
videouroki.net
1)
Al + S → Al2S3
Zn S +O2→ZnO + SO2
HCl + PbO2→Cl2+ PbCl2+ H2O
SO2 + O2→ SO3
НNO3 → NO2 +O2 +H2O
2)
СO + O2 → СO2
Н2 + I2 → HI
KClO3 + P → P2O5 + KCl
KClO3 → KCl + O2
H2S + HMnO4→ S + MnO2 + H2O
3)
С + СO2 → СO
Ba + S → Ba S
Н2SO4 + HBr → Br2 + SO2 + H2O
Zn(NO3)2 → ZnO + NO2 + O2
HNO3 + I2→ HIO3+ NO+ H2O
4)
H2 + I2 → HI
H2S + HClO3 → S + HCl + H2O
H2S + SO2 → S + H2O
Fe(OH)2 + О2 + H2O → Fe(OH)3
C + НNO3 → CO2 + NО + H2O
5)
S + HNO3 → H2SO4 + NO2+ H2O
Mg + H2SO4 → MgSO4 + H2S + H2O
SO2 + O2 → SO3
Ag + HNO3 → AgNO3 + NO + H2O
H2S + SO2 → S + H2O
6)
Pb + HNO3 → Pb(NO3)2+ NO2 + H2O
KClO3 → KCl + O2
Li + H2O → LiOH + H2
H2 + Br2 → HBr
Р + N2O → N2 + P2O5
7)
S + O2 → SO2
P +HNO3 + H2O → H3PO4 + NO
C + H2SO4 → CO2 + SO2 + H2O
CuO + NH3 → Cu + N2 + H2O
Mg + H2SO4 → MgSO4 + H2S + H2O
8)
KI + H2SO4 → H2S + I2 + H2O + K2SO4
NaNO3 → NaNО2 + О2
HCl + MnO2 → Cl2 + MnCl2 + H2O
NaNO3→ NaNО2 + О2
Mg + HNO3 → Mg(NO3)2 + N2O + H2O
9)
H2S + SO2 → S + H2O
Ca +H2SO4 → CaSO4 + H2S + H2O
Cu2O + HNO3 → Cu(NO3)2 + NO + H2O
NaClO3 → NaCl + O2
Zn + HNO3 → Zn (NO3)2+ NO2 + H2O
10)
P + N2O → N2 + P2O5
KClO3 → KCl + O2
H2 + O2 → H2O
CuO + NH3 → Cu + N2 + H2O
Pb + HNO3 → Pb(NO3)2+ NO2 + H2O