Приведи пример вещества, которое может находиться в нескольких состояниях
Одно и тоже вещество в зависимости от условий, в которых оно находится, может пребывать в различных состояниях, отличающихся по своим свойствам.
Состояния вещества
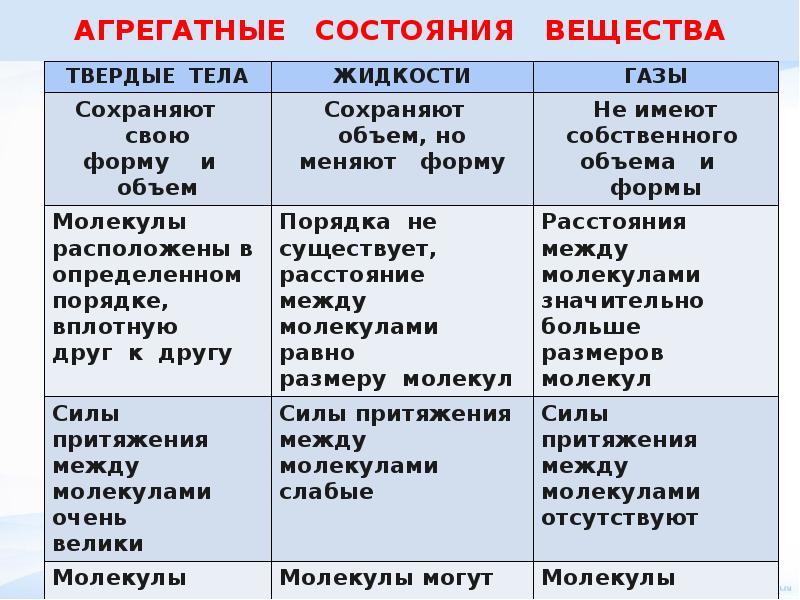
Существует 3 основные агрегатные состояния вещества, обладающие следующими особенностями:
- Твердое. Характерным признаком твердого состояния вещества является стабильность формы и объема.
- Газообразное. Оно характеризуется расположением частиц на больших расстояниях друг от друга и очень слабым взаимодействием между ними. Благодаря этому, газ не имеет определенной формы и стремится заполнить весь предоставленный ему объем.
- Жидкое. В этом состоянии силы взаимодействия между частицами, которые расположены более плотно, чем в газе, достаточно сильны, чтобы обеспечивать неизменность объема, но не достаточны для сохранения формы.
Практически все вещества могут пребывать в 3 агрегатных состояниях.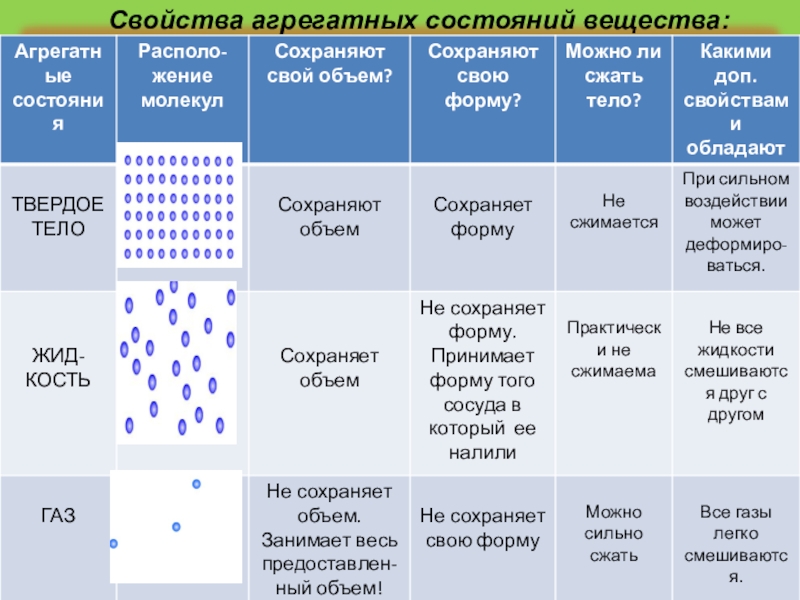
Агрегатные состояния воды
Различные состояния воды — это те явления, которые мы имеем возможность наблюдать в природе: дождь, роса, туман, снег, лед, пар.
Твердое состояние воды имеет место при пониженной температуре, когда она замерзает. При высоком давлении температура затвердевания оказывается выше. В твердом виде вода сохраняет форму и объем. В природных условиях в этом состоянии вода встречается в виде льда, снега, града.
Вода в жидком состоянии сохраняет объем, но не имеет постоянной формы. В природе дождь, туман, роса соответствуют ее жидкому состоянию.
Вода в газообразном состоянии представляет собой водяной пар. В этом состоянии не сохраняются ни ее форма, ни объем.
При изменении температуры происходит трансформация агрегатных состояний воды: при нагреве воды, находящейся в твердом состоянии происходит ее плавление — она из льда превращается в жидкость, при нагреве жидкости вода испаряется и переходит в газообразное состояние.
Агрегатные состояния вещества. Физические свойства тел в различных агрегатных состояниях. Зависимость линейных размеров тел от температуры
Цели урока:
- Учащимся необходимо научиться применять знания о взаимодействии молекул к объяснению и анализу явлений окружающего мира. Называть три агрегатных состояния вещества, уметь приводить примеры из учебника, объяснять поведение жидких, твердых и газообразных тел с позиций молекулярного строения. Знать основные положения МКТ.
- Учащимся необходимо систематизировать
имеющиеся знания о силах взаимодействия молекул
и расширить их.

- Ученик должен учиться применять знания о взаимодействии молекул к объяснению агрегатных состояний вещества. Ученики должны усвоить характерные особенности межмолекулярного взаимодействия в веществах находящихся в различных агрегатных состояниях.
Задачи урока:
ОБРАЗОВАТЕЛЬНЫЕ:
- Назвать физическую величину, определяющую агрегатное состояние вещества. Проиллюстрировать это.
- Сформировать у учащихся понятие об агрегатных состояниях вещества, сравнить физические свойства тел в различных агрегатных состояниях, познакомить учащихся с кристаллическими и аморфными телами, показать зависимость линейных размеров тел от температуры;
- Показать, что взаимодействие является
неотъемлемым свойством материальных объектов.
Продолжить работу по выделению основного
содержания материала при работе с
научно-популярной литературой по нескольким
источникам.

- Расширить и уточнить знания о взаимодействии молекул при объяснении перехода веществ из одного агрегатного состояния в другое. Сформировать умения применять основные положения теории строения вещества к обоснованию свойств данного агрегатного состояния вещества. Формировать навыки самоконтроля.
ВОСПИТАТЕЛЬНЫЕ:
- Подчеркнуть значение моделирования строения вещества в познаваемости явлений окружающего мира, противодействующие стороны в явлении взаимодействия молекул и подвести к пониманию закона единства и борьбы противоположностей. Показать, что моделирование и описание выступают как методы изучения фактов при обобщении явлений на разных уровнях.
- Показать значение опытных фактов и
эксперимента в создании модели строения
вещества. Развить интеллект и речь учащихся,
навыки аналитической работы, навыки применения
знаний на практике.

РАЗВИТИЯ МЫШЛЕНИЯ:
- Проверить уровень самостоятельности мышления школьника по применению учащимися знаний в различных ситуациях. Продолжить работу по формированию умений обобщать опытные данные на основе имеющихся знаний о строении вещества.
- Работать над формированием умений, анализировать свойства и явления на основе знаний, выделять главную причину, влияющую на результат, выделять признаки сходства в описании явлений при их обобщении.
- Сформировать элементы творческого поиска на основе приемов обобщения. Высказать свое суждение о роли теоретических знаний в познании человеком природы.
- Воспитать интерес к изучению предмета и чтению литературы
Тип урока: комбинированный урок.
Оборудование урока: классная доска,
заранее подготовленная к уроку; карточки-задания
для самостоятельной работы.
Физика – это наука понимать природу.
Э.Роджерс
Ход урока
1. Организационный момент.
2. Проверка домашнего задания.
Примерный перечень вопросов:
- Что вам известно о строении вещества?
- Какие явления доказывают, что молекулы вещества движутся?
- Приведите примеры подтверждающие, что между молекулами существуют силы взаимодействия.
- Что доказывает явление смачивания?
- Положите в воду кусочек мела. Что наблюдается? Объясните.
Почему трудно оторвать друг от друга две смоченные пластины полированного стекла?
3. Самостоятельная работа по карточкам.
Вариант 1.
1. Вещество – это …
а) воздух; б) то, из чего состоят тела; в) вода.
2. Атом:
а) состоит из молекул; б) это наименьшая частица; в) состоит из воздуха.
3. Чего больше – тел или веществ?
а) тел; б) веществ; в) одинаково.
4. Из каких атомов состоит молекула воды:
а) 1 атом оксигена и 1 атом гидрогена; б) 2 атомов оксигена и 1 атома гидрогена; в) 1 атома оксигена и 2 атомов гидрогена.
5. Вещества называются простыми, если они состоят из:
а) двух атомов; б) одного химического элемента; в) двух и более атомов.
6. Как называется мир молекул и атомов?
а) Микромир; б) Мегамир; в) Макромир.
Вариант 2.
1. Примером физического тела может быть:
а) сталь; б) температура; в) планета.
2. Все вещества состоят из …
а) воды; б) воздуха; в) молекул и атомов.
3. Молекулы:
а) состоят из атомов; б) наименьшая частица; в) состоят из воздуха.
4. Сколько веществ может входить в состав тела?
а) одного; б) двух; в) множества.
5. При увеличении температуры скорость движения молекул:
а) увеличивается; б) уменьшается; в) не изменяется.
6. Вирус, атом, молекула относятся к:
а) микромиру; б) виртуальному миру; в) макромиру.
4. Актуализация опорных знаний.
Вопрос: какие агрегатные состояния вещества вы знаете из курса природоведения?
Рассмотрим три агрегатных состояния вещества: твердое, жидкое и газ. Мы привыкли, что железо твердое, ртуть жидкая, а кислород газообразный. Но есть хорошо известное нам вещество, которое при обычных условиях можно наблюдать сразу в трех состояниях. Что это за вещество? Это вода. И ее состояния имеют свои специфические названия: лед, вода и водяной пар.
Как вы считаете. Какая из известных вам
физических величин больше всего влияет на
агрегатное состояние вещества? Это температура.
Вследствие нагревания вещество может переходить
из твердого состояния в жидкое, а потом в
газообразное.
5. Изучение нового материала.
Оглашение темы урока.
Сравним основные свойства тел в различных агрегатных состояниях и заполним сравнительную таблицу. Заполнения таблицы сопровождается демонстрациями (сжатие железного бруска, переливание воды в сосуды разной формы, сжатие надутого шара).
| Агрегатное состояние | Свойства | ||
| форма | объем | Сжатие | |
| Твердое | Сохраняет | Сохраняет | |
| Жидкое | Не сохраняет | Сохраняет | Практически невозможно |
| газообразное | Не сохраняет | Занимает весь объем | Легко сжимается |
Газ легко сжимается и расширяется. А заметного
сжатия твердых тел и жидкостей не наблюдается. Но
это совсем не означает, что их нельзя сжать.
Просто это требует значительных усилий.
А заметного
сжатия твердых тел и жидкостей не наблюдается. Но
это совсем не означает, что их нельзя сжать.
Просто это требует значительных усилий.
Так почему же существует такое отличие в свойствах твердых тел, жидкостей и газов? Лед, вода и водяной пар состоят из одних и тех же молекул воды, но они по разному расположены и по разному двигаются.
Заполнение сравнительной таблицы.
| Агрегатное состояние | Молекулы | ||
| Расположение | Движение | Взаимодействие | |
| Твердое | Расстояние сравнимо с молекулой, образуют кристаллическую решетку | Колебание | Сильное |
| Жидкое | Расстояние сравнимо с молекулой, порядок отсутствует | Колебание и прыжок | Сильное |
| Газообразное | Расстояние намного больше размеров молекул | Свободное, иногда сталкиваются | Слабое притяжение, отталкивание во время столкновений |
Физкульминутка.
Для того, чтобы учащиеся лучше запомнили в каких агрегатных состояниях находятся вещества и на каком расстоянии располагаются молекулы делаем упражнение:
— газообразное – руки вверх и в стороны;
— жидкое – руки вверх;
— твердое – руки вверх кулачки касаются друг друга.
Перечень: дерево, морская вода, кислород, яблоко, сок, азот, железо, молоко. чай, золото.
Объяснение свойств веществ в различных агрегатных состояниях на основе их строения
Есть тела, которые по признакам относятся к твердым телам, а по расположению молекул больше напоминают жидкости. Такие тела называют аморфными.
Твердые тела бывают кристаллические и аморфные (демонстрация решеток).
Твердые тела при нагревании расширяются (демонстрация с шариком и кольцом).
6. Закрепление изученного материала.
Ответьте на вопросы:
1. Наименьшая частица вещества?
2. Алмаз представляет собой…?
Алмаз представляет собой…?
3. Состояние вещества, которое легко сохраняет объем, но не сохраняет форму?
4. Состояние вещества, у которого тяжело изменить форму?
5. Что необходимо сделать, чтобы расплавить олово?
6. Что необходимо сделать, чтобы пар стал водой?
7. Самое распространенное вещество на Земле?
8. Газообразное состояние воды?
9. При замерзании вода превращается в …?
10. Сколько есть состояний вещества?
7. Итоги урока и оценивание.
8. Домашнее задание: проработать соответствующие параграфы учебника, ответить на вопросы, составить список веществ, относящихся к твердому, жидкому и газообразному состоянию, нарисовать модели строения этих веществ, подготовиться к лабораторной работе.
Урок по окружающему миру в 3-м классе по теме «Строение веществ, находящихся в разных агрегатных состояниях»
Цели и задачи:
- Начать формировать представление о частицах – молекулах, о движении и
расположении их в твердых, жидких и газообразных веществах, познакомить с
увеличительным прибором – микроскопом.

- Продолжить развитие наглядно-образного, логического мышления, воображения.
- Продолжить формирование элементов абстрагирования, как мыслительной операции.
- Продолжить формирование умения делать выводы по результатам наблюдений и простых опытов.
- Развивать способность к опытно-экспериментальной учебной деятельности.
- Воспитывать познавательный интерес к опытно-экспериментальной работе.
- Воспитывать гордость за великих ученых России.
- Воспитывать чувство товарищества и взаимопомощи.
Оборудование:
- Медиопроектор, Презентация.
- Кроссворд.
- У каждого ребенка по 2 стакана с водой, пипетка, ложка, сахар, чернила, шприц без игл, брусок.
- У учителя большой шприц с подкрашенной жидкостью, зерна кофе, два сосуда для жидкости.
Ход урока
Организационный момент:
Долгожданный дан звонок –
Начинается урок.
На занятиях, в игре,
Смело, четко говорим и тихонечко сидим.
Проверка домашнего задания, повторение:
На прошлом уроке мы познакомились с вами с новыми понятиями. Разгадав кроссворд, мы проверим, хорошо ли вы их запомнили, и узнаем тему нашего сегодняшнего урока.
(Кроссворд на доске)
Слово по вертикали под № 1.– Как по научному называется любой предмет? (Тело)
– Это многозначное слово.
– Какие еще значения может иметь это слово? (Организм человека, часть организма – туловище, часть чего-либо, корпус чего-нибудь – тело орудия, поршня.)
Слово тело произошло от слова тесто и буквально означает “масса” (на костях, которую можно мять). (Показ теста.)
Сегодня мы исследуем тела, составленные из разных веществ, и узнаем: все ли
они одинаково легко поддаются сжатию и давлению, как тесто. Наши выводы помогут
нам в дальнейшей работе.
Наши выводы помогут
нам в дальнейшей работе.
Слово по вертикали под № 2: То из чего состоит любое тело. (Вещество.)
– Как вы думаете, от какого слова образовалось слово “вещество”? (От слова “вещь”.) Подберите однокоренные слова. (Вещественный.)
Многие из вас слышали словосочетание: вещественные доказательства.
То есть то, что реально существует. Вещества – это основа нашего материального мира. И сегодня именно о них пойдет речь.
Слово по вертикали под № 3: Вид вещества, название которого произошло от слова “твердь”? (Твердое.)
– Может быть, кто-то знает, что такое твердь? (Земля, суша.)
– Почему от этого слова произошло слово “твердое”? (Земля неизменна, устойчива.)
– Приведите примеры твердых веществ. (Мел, металл, лед.)
– Ребята, а в каких случаях еще употребляется слово “твердый”? (Твердый
картон – жесткий, крепкий, твердое решение – неизменное, прочное, непоколебимое,
твердая рука, сердце – сильный, решительный. )
)
– Как вы думаете, почему во всех этих случаях употребляется слово “твердый”? (Похоже на свойство твердых тел, указывается на сохранение состояния, его неизменность.)
– У нас на партах лежит тело – брусок.
(Учитель демонстрирует брусок.)
– Из какого вещества он изготовлен?
– Исследуем его, чтобы узнать, легко ли он поддается сжатию.
Я предполагаю, что нет. Попытайтесь его сжать, покрутите.
– Что вы заметили?
– Легко ли его сжать или сломать? (Трудно.)
– Да, для этого надо приложить большие усилия.
– Изменяется ли его форма? А объем? (Нет.)
– Сделайте вывод, какими же свойствами обладают твердые тела? (Они сохраняют форму и объем.)
Слайд 1:
На Слайде таблица:
| Состояние вещества | Свойства вещества |
| Твердое | Сохраняет форму и объем, трудно сжать. |
Слово по вертикали под № 4: Вещество, обладающее текучестью. (Жидкое.)
(Учитель переливает чай из одного сосуда в другой.)
– Приведите примеры жидких тел или веществ.
– Исследуем свойство жидкости сжиматься. Я предполагаю, что жидкость сжать трудно.
В моем шприце подкрашенная вода. Я закрываю отверстие для иглы и пробую надавить на поршень. Ничего не получается.
В русском языке есть даже такое выражение “Толочь воду в ступе”. Что оно означает? (Бесполезное занятие.)
– Сделайте вывод, какими свойствами обладает жидкое вещество? (Текучесть, принимает форму сосуда, в котором находится, не сохраняет объем, трудно сжать.)
Слайд 2:
На Слайде таблица:
| Состояние вещества | Свойства вещества |
| Жидкое | Обладает текучестью, принимает форму сосуда, в котором
находится. |
Слово по вертикали под № 5: Ребята, на прошлом уроке мы познакомились с происхождением слова, заимствованного из французского языка. Оно произошло от слова “хаос” – бесформенное, беспредельное пространство.
– Что это за слово? (Газ.)
– Как называется вещество, название которого связано с этим слово? (Газообразное.)
– Приведите примеры.
– У меня в руках шприц, наполненный смесью газообразных веществ – воздухом. У вас на партах тоже. Исследуем, легко ли сжимается газообразное вещество – воздух.
– Как вы думаете? (Легко.)
– Закройте отверстие для иглы пальцем, а другой рукой попробуйте надавить на поршень.
– Что вы видите? (Воздух внутри шприца сжимается.)
– Отпустите поршень. Что заметили? (Поршень возвращается на место.)
– Как вы думаете, почему? (Сжатый воздух выталкивает его.)
– Сделайте вывод о свойствах газообразных веществ. (Занимает весь
предоставленный объем, легко сжать.)
(Занимает весь
предоставленный объем, легко сжать.)
1 кубический метр воздуха можно сжать до размера наперстка.
Слайд 3:
На Слайде таблица:
| Состояние вещества | Свойства вещества |
| Газообразное | Занимает весь предоставлены объем, легко сжать. |
– Мы с вами сейчас исследовали разные вещества в разных состояниях. Но и одно и то же вещество при разных условиях может быть или в жидком, или в твердом, или в газообразном состоянии. Приведите пример. (Вода – лед – пар.)
– В чем же сходство и различие веществ, находящихся в разном состоянии?
– Посмотрите на наш кроссворд. Какое слово получилось по горизонтали?
В кроссворде на доске по горизонтали получилось слово: строение.
– С чем ассоциируется у вас это слово, подберите однокоренные слова. (Устройство.)
Тема урока:
Тема нашего сегодняшнего урока – “Строение веществ”. Сегодня нам предстоит ответить на вопрос: “В чем сходство и различие в строении твердых, жидких и газообразных веществ? Почему одни вещества твердые, другие – жидкие, а третьи – газообразные?”
Для работы по этой теме учебник приглашает нас в гости к невидимкам (Слайд 4), но кое-что мы все-таки увидим.
Перед этим отправимся на прогулку:
Физминутка:
Мы немножко отдохнем,
Встанем, глубоко вздохнем.
Дети по лесу гуляли,
За природой наблюдали.
Вверх на солнце посмотрели,
И их лучики согрели.
Чудеса у нас на свете:
Стали карликами дети.
А потом все дружно встали,
Великанами мы стали.
– Готовы к работе?
– Итак, мы должны разобраться, из чего же состоят вещества.
– Ученых с древних времен интересовал этот вопрос. Они предполагали, что если вещество, например, камень разделить до точки, то можно обнаружить мельчайшую неделимую частицу – атом (Слайд 5). Атомы могут быть нескольких сортов и образовывать молекулы (Слайд 6). Это слово означает “маленькая массочка”. Условно молекулы изображаются в виде шариков. Древние ученые предполагали, что сходство всех веществ на свете в том, что они состоят из движущихся молекул, между которыми есть промежутки.
– Проведем исследование, которое подтвердит или опровергнет мнение ученых о том, что все вещества состоят из мельчайших частиц – молекул.
– Предположим, что ученые правы и каждое вещество состоит из движущихся молекул, между которыми есть промежутки.
Тогда возможно проникновение частиц одного вещества между частицами другого.
– Чтобы проверить это проделаем опыт.
Опыт с сахаром:
Перед вами стоят стаканчики с водой и лежит кусочек сахара.
Соедините эти два вещества, помешайте сахар ложкой.
– Что вы видите? (Сахар постепенно стал невидимым, растворился.)
– Как убедиться, что сахар все еще находится в стакане? (Попробовать.)
– Попробуйте воду на вкус. Какая она? (Сладкая.)
– Какой вывод мы можем сделать? (Сахар не исчез, он остался в стакане).
– Почему же мы не видим сахар? (Потому что сахар распался на мельчайшие частицы, из которых он состоял. И это частицы перемешались с частицами воды.)
– Этот опыт подтвердил нам мнение ученых о том, что вещества состоят из частиц.
– Всегда ли можно пробовать, когда проводишь исследование?
Опыт с чернилами:
– А теперь проведем опыт, который поможет нам кое-что увидеть. Проверим, подтвердит ли он наши выводы о взаимопроникновении веществ.
Соединим две жидкости. Предположим, что, если они состоят из частиц, между
которыми есть промежутки, то они перемешаются. А может, этого и не произойдет.
А может, этого и не произойдет.
– Капните в пластмассовый стакан каплю чернил.
– Что вы наблюдаете? (Вода окрашивается.)
– Попробуйте объяснить почему?
– Возможно ли было бы окрашивание, если бы жидкость была сплошной, без промежутков? (нет)
– Сделайте вывод. (Окрашивание возможно потому, что вещество не сплошное и состоит из отдельных частиц, между которыми есть промежутки.)
– О чем говорит распространение окрашивания в разные стороны? (частицы двигаются в разных направлениях)
– Почему такой маленькой капельки чернил хватило, чтобы окрасить всю воду? (Значит в маленькой капле очень много частиц, перемешавшихся с частицами воды.)
– Сделайте общий вывод. (Вещества состоят из отдельных, невидимых глазу, движущихся частиц, между ними есть промежутки.)
– Посмотрите: молекулы разных веществ различны!
Слайд 7, Слайд 8, Слайд 9 , Слайд 10, Слайд 11
– К выводу, который вы сейчас сделали, в России первым пришел величайший
русский ученый, поэт, художник, основатель Московского университета Михаил
Васильевич Ломоносов. Слайд 12
Слайд 12
Именно благодаря ему, мы сегодня познакомились с понятием “молекула”. И словарь науки обогатился такими словами, как формула, термометр, барометр, атмосфера и другими.
Доказать его гипотезу люди смогли только с изобретением электронного микроскопа. Слайд 13. И, возможно, в будущем вы тоже станете учеными и сделаете свои открытия в этой области.
– А пока перед нами стоит все та же задача: определить, чем похожи между собой вещества, находящиеся в одинаковом состоянии. Как их состояние зависит от их строения.
Посмотрите на нашу таблицу.
Слайд 14
| Состояние вещества | Свойства вещества |
| Твердое | |
| Жидкое | |
| Газообразное |
– Повторим свойства твердого вещества.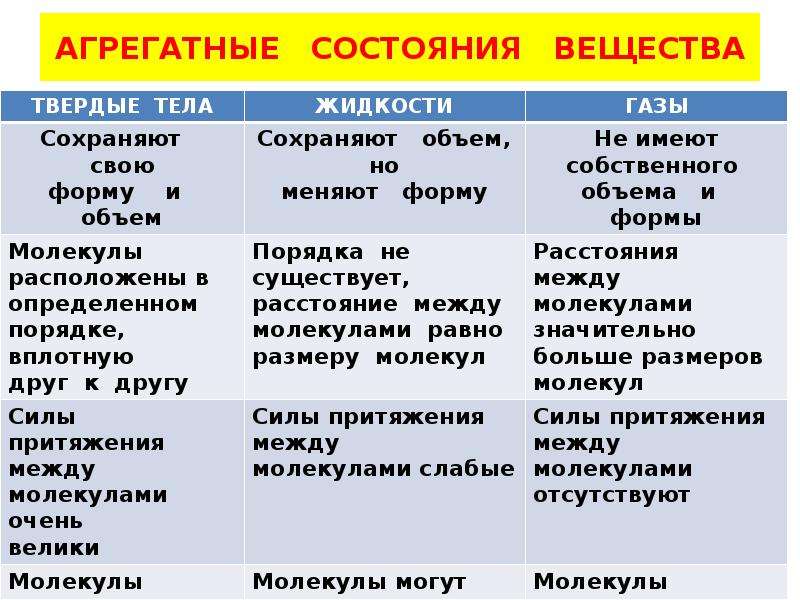 (Сохраняют форму и объем, очень
трудно сжать.) Слайд 15.
(Сохраняют форму и объем, очень
трудно сжать.) Слайд 15.
Сейчас 4 человека с первых парт попробуют изобразить молекулы твердого вещества.
– Как вам надо встать, чтобы вас было трудно разъединить? (Обнявшись крепко.)
– Попробуем вас разъединить (Очень сложно.)
– Почему твердое тело трудно сломать и разъединить? Как должны располагаться молекулы? (Молекулы находятся очень близко друг к другу.)
– Вспомните рассказ Л.Н. Толстого “Отец и сыновья”.
– Чему учил сыновей отец? (Держаться вместе.)
– Какой пример он им привел? (Веник, который не сломать.)
– Так и мы, если будем держаться друг за друга, дружить – никто нас не разобьет.
Древние ученые думали, что у молекул твердых веществ есть крючки, которыми они цепляются друг за друга.
Теперь мы знаем, что никаких крючков между молекулами твердого тела нет,
просто молекулы в твердом теле очень сильно притягиваются друг к другу, но между
ними все равно есть небольшие промежутки, и молекулы колеблются. Поэтому твердое
тело очень тяжело сжать.
Поэтому твердое
тело очень тяжело сжать.
Посмотрим опять в таблицу. Слайд 16
Вспомните опыт с водой, чаем.
– Какими свойствами обладают жидкие вещества? (Текучестью, трудно сжимаются.)
Следующие 4 человека попробуют изобразить молекулы жидкого вещества. Покажите, как вы легко перетекаете. (Хоровод, ручеек.)
– Благодаря чему жидким веществам это удается делать? (Молекулы расположены свободнее, хотя тоже притягиваются друг к другу. Помимо колебаний, они перескакивают с места на место)
Опыт с кофе:
А теперь закройте глаза и попробуйте догадаться, какое вещество я принесла в класс. (Кофе.)
– Как догадались? (По запаху.)
– Чтобы вы почувствовали запах, что должно было произойти с молекулами кофе? (Они должны были попасть к нам в нос, они вылетели с поверхности зерен и находились в газообразном состоянии.)
– Что позволило молекулам так быстро достичь вашего носа? (Слабые связи
между молекулами.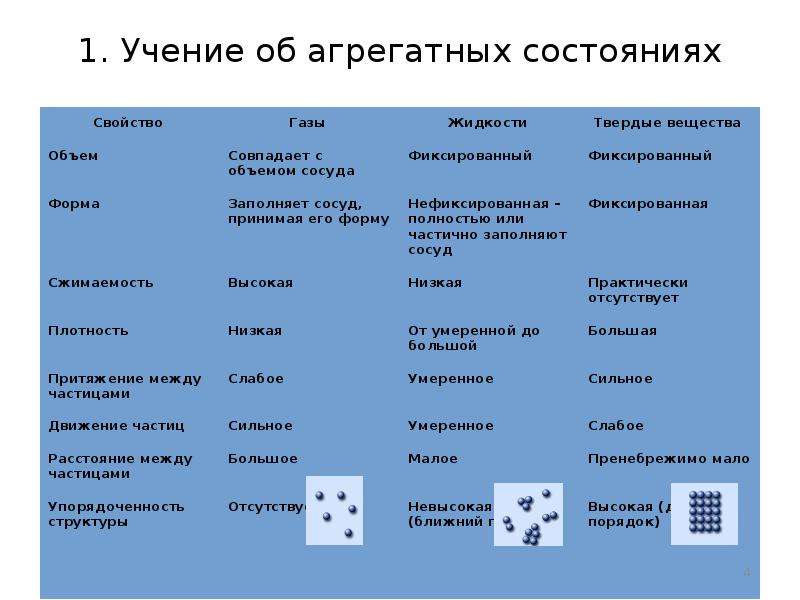 Молекулы носятся с огромной скорость на большом расстоянии.)
Молекулы носятся с огромной скорость на большом расстоянии.)
– Какое свойство газа этим обусловлено? (Занимать весь предоставленный объем, легко сжиматься, так как между молекулами большие промежутки.) Слайд 17.
– Подумайте, где и при каких обстоятельствах вы ежедневно сталкиваетесь с моделью взаимодействия молекул газа между собой? (На перемене, когда многие бегают.)
Давайте, постараемся, во избежание травм, на переменах быть похожими не на молекулы газообразного вещества, а на молекулы жидкости, играя в ручеек и другие игры.
– С какими понятиями познакомились на уроке? (Молекулы, атом.)
– Удалось ли нам ответить на главный вопрос, поставленный в начале урока?
– В чем сходство всех веществ? (Состоят из молекул.)
– Как зависит состояние вещества от его строения?
Домашнее задание:
Открыть учебник на странице 49 № 2. Дома определите, в каких состояниях
находятся вещества, модели строения которых изображены на рисунках и подготовьте
ответ на вопрос № 3.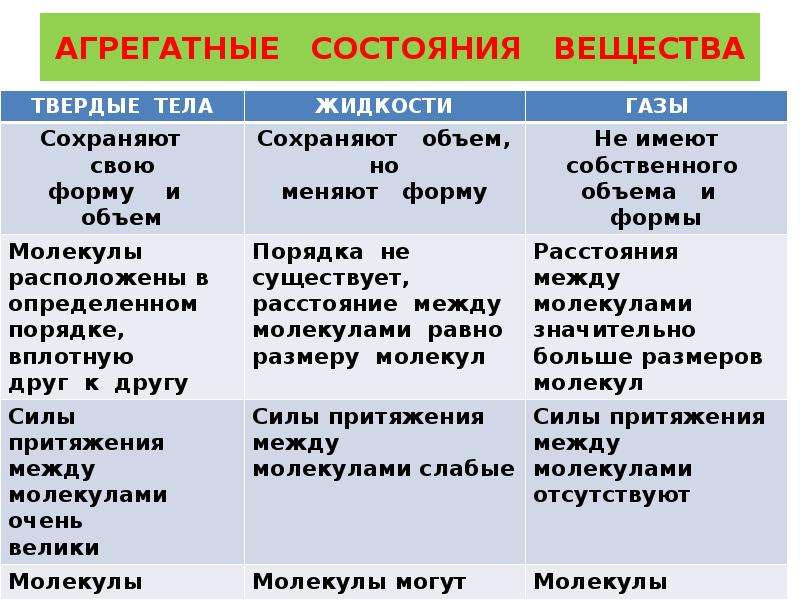
Вещества в газообразном состоянии: примеры и свойства
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ — это природные обитатели, формирующиеся естественным путем. Другая половина — искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.
Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы — это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород — О2, озон — О3, водород — Н2, хлор — CL2, фтор — F2, азот — N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород — H2S;
- хлороводород — HCL;
- метан — CH4;
- сернистый газ — SO2;
- бурый газ — NO2;
- фреон — CF2CL2;
- аммиак — NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен — С2Н4;
- ацетилен или этин — С2Н2;
- метиламин — CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.

- Диффузия — одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение — жидкость превращается в пар, сублимация — твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.
Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких — сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов — процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул.
 Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа. - Ферми — создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт — фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.
А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.
Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон — О3). Тип связи — ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях — темно-фиолетовые кристаллы с металлическим блеском.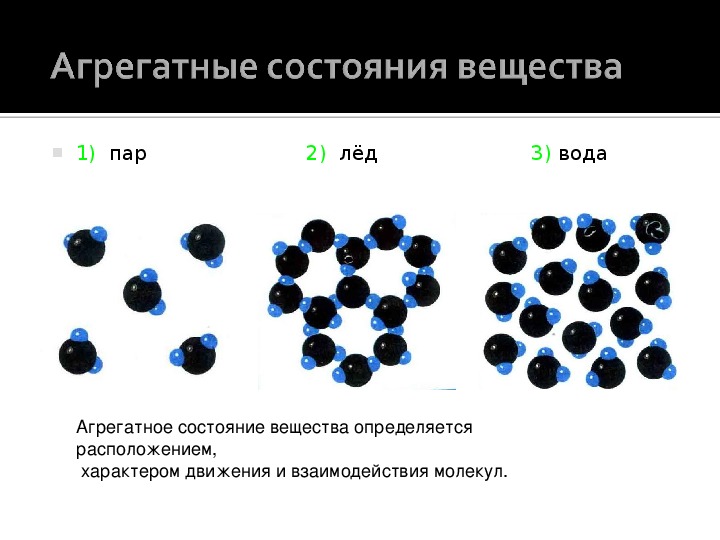 Однако при нагревании сублимируются в клубы ярко-фиолетового газа — I2.
Однако при нагревании сублимируются в клубы ярко-фиолетового газа — I2.
К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений — важная часть химических синтезов, осуществляемых в промышленности.
Большая часть подобных соединений — важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием «газ» обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь — это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.
Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден — кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ — необходимый продукт «питания» для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ — важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы — это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены — газы. Бром — это жидкость при обычных условиях, а йод — легко возгоняющееся твердое вещество. Фтор и хлор — ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Вещества газообразные — Справочник химика 21
Различают три агрегатных состояния вещества газообразное, жидкое и твердое . Агрегатное состояние, в котором находится данное вещество, зависит от его природы, температуры и давления. [c.125]Этот раздел физической химии, пожалуй, менее других разделов насыщен демонстрационными опытами. Цель предлагаемых демонстраций— дать наглядное представление об основных агрегатных состояниях вещества газообразном, жидком и твердом. [c.18]
Приведите примеры веществ, газообразных при обычных условиях, которые, взаимодействуя попарно, дают а) твердое вещество б) газообразное окрашенное или неокрашенное вещество. [c.153]
Вещество (газообраз- ное) дн 3 Ср Вещество (газообразное . АН 8 [c.359]
Напр мер, для снятия спектров из растворов газ-носитель, содержащий исследуемое вещество, пропускают через растворитель, поглощающий данное вещество. В случае снятия спектров твердых веществ вещество из газа-носителя осаждают на порошок бромида калия и из полученной смеси приготовляют таблетки. Если исследуемое вещество газообразно, то измерения проводят в специальной газовой кювете, в которую вещество поступает в смеси с газом-носителем. Эти методы позволяют работать с меньшими потерями вещества по сравнению с методом улавливания веществ в ловушках. [c.195]
В случае снятия спектров твердых веществ вещество из газа-носителя осаждают на порошок бромида калия и из полученной смеси приготовляют таблетки. Если исследуемое вещество газообразно, то измерения проводят в специальной газовой кювете, в которую вещество поступает в смеси с газом-носителем. Эти методы позволяют работать с меньшими потерями вещества по сравнению с методом улавливания веществ в ловушках. [c.195]
Другие многочисленные реакции, к которым способны соли в водных растворах, также сводятся в основном к ионным реакциям обмена, вызывающим образование малодиссоциированных соединений воды, малорастворимых веществ, газообразных веществ, слабых кисло г и оснований. [c.116]
Если реагирующие вещества газообразные, то =/д Ка = Кг (где равновесные концентрации участников реакции выражены через парциальные летучести). Для систем, описываемых уравнением состояния идеального газа, т. е. таких систем, в которых силами взаимодействия между молекулами можно пренебречь, /а1 = Ра (парциальное давление) иKf = Kp. [c.139]
[c.139]
Перечислите известные вам неорганические и органические вещества — газообразные, жидкие и твердые, обладающие специфическим, легко отличимым запахом. [c.166]
Мы будем стараться записывать все реакции сокращенным молекулярно-ионным способом, вводя в уравнение только формулы простых веществ, газообразных, кристаллических и жид- [c.123]
Чтобы сравнить AGj- различных реакций, надо иметь одинаковые исходные состояния системы. Условились за исходное состояние, называемое стандартным, выбирать такое, при котором активность каждого исходного и конечного участника реакции соответствует одномоляльной концентрации. Если реагирующие вещества газообразные, то в исходном состоянии парциальные летучести всех участников реакции должны равняться единице (/а,=/а,. .. =/д == =/д =1 атм), а для идеальных газообразных систем парциальные давления всех участников реакции равны 1 атм. [c.140]
Как известно, вещества могут находиться в трех фазовых состояниях — газообразном, жидком и кристаллическом. Критерием того, что данное вещество находится в том или ином фазовом состоянии, служат не внешние признаки, а степень упорядоченности ионов или молекул, из которых состоит вещество. Газообразное состояние является наиболее беспорядочным фазовым состоянием. В кристаллическом состоянии, наоборот, вещество имеет наиболее упорядоченную структуру в этом случае наблюдается дальний порядок, т. е. в кристалле на всем его протяжении повторяется в определенном порядке один и тот же структурный элемент. Жидкое состояние занимает среднее положение, в нем отсутствует дальний порядок, но наблюдается ближний порядок, т. е. упорядочение структурных элементов в отдельных участках жидкости, [c.431]
Критерием того, что данное вещество находится в том или ином фазовом состоянии, служат не внешние признаки, а степень упорядоченности ионов или молекул, из которых состоит вещество. Газообразное состояние является наиболее беспорядочным фазовым состоянием. В кристаллическом состоянии, наоборот, вещество имеет наиболее упорядоченную структуру в этом случае наблюдается дальний порядок, т. е. в кристалле на всем его протяжении повторяется в определенном порядке один и тот же структурный элемент. Жидкое состояние занимает среднее положение, в нем отсутствует дальний порядок, но наблюдается ближний порядок, т. е. упорядочение структурных элементов в отдельных участках жидкости, [c.431]
Гетерогенные системы. Для реакций, в которых лишь часть веществ газообразна, выражение константы равновесия упрощается при данной температуре парциальные давления реагентов, находящихся в конденсированном состоянии, постоянны и не зависят от количества реагентов при условии, что реагенты не образуют растворов.
 Это позволяет объединить парциальные давления с величиной Кс (Кр) в общую константу. Так, например, для реакции [c.121]
Это позволяет объединить парциальные давления с величиной Кс (Кр) в общую константу. Так, например, для реакции [c.121]Общие представления о химических соединениях постоянного и переменного состава. Различают химические соединения постоянного и переменного состава. Постоянный состав имеют вещества (газообразные, жидкие, твердые), состоящие из молекул, так как в состав молекул входит лишь целое и притом постоянное число атомов. Молекулы могут быть и одноатомны (молекулы благородных газов). Число атомов в молекуле выражается целочисленными индексами в хи- [c.235]
Из таблицы видно, что при обычных условиях температуры и давления все инертные элементы в виде простых веществ газообразны. Самая низкая температура кипения у гелия. Это вообще наиболее трудно сжижаемое вещество. При испарении жидкого гелия достигается температура, близкая к абсолютному нулю. В связи с этим гелием пользуются в криогенной технике для получения очень низких температур. Гелий—единственное рабочее тело в газовых термометрах, пригодное для измерения температур ниже Г К- Температуры плавления и кипения других инертных веществ закономерно повышаются от гелия к радону. [c.538]
Гелий—единственное рабочее тело в газовых термометрах, пригодное для измерения температур ниже Г К- Температуры плавления и кипения других инертных веществ закономерно повышаются от гелия к радону. [c.538]
Поскольку понятие насыщения раствора связано с равновесием процесса растворения, его можно относить только к определенным условиям раствор, насыщенный при одной температуре, может стать ненасыщенным (или пересыщенным) при другой. Таким образом, растворимость вещества является функцией температуры, а если растворяемое вещество газообразно, то и функцией давления газа над раствором. Чаще всего растворимость [c.148]
До XIX века считали, что газы являются таковыми по самой своей природе, и вопрос о их сжижении даже не возникал. Лишь в 20-х годах XIX века, применяя значительные давления, удалось получить в жидком состоянии хлор, аммиак, двуокись углерода и ряд других веществ газообразной природы . Однако оставались еще [c.38]
В центре нарождавшейся новой науки оказался химический процесс как таковой — его скорость, явления, его сопровождающие, прежде всего тепловые. В связи с этим развивается изучение состояния вещества (газообразного, жидкого, твердого и растворенного), поскольку именно этим определяется механизм реакций. На основе решения данных проблем сформировалась физическая химия. [c.301]
В связи с этим развивается изучение состояния вещества (газообразного, жидкого, твердого и растворенного), поскольку именно этим определяется механизм реакций. На основе решения данных проблем сформировалась физическая химия. [c.301]
Отравление катализатора в большинстве случаев происходит в результате адсорбции яда на иоверхности. Таким образом, механизм отравления- аадинег, чается в блокировке, активных участков катализатора. Посколь-, ку адсорбция может быть как обратимой, так и необратимой,-различают обратимое и необратимое отравление. Так, платиновый катализатор Отравляется СО и СЗг, однако при внесении его в чистую смесь исходных веществ (газообразных) происходит десорбция яда, и активность восстанавливается. При отравлении же НгЗ и РНз платина полностью дезактивируется. На рис. ХП, 6 показана кинетика обратимого отравления парами воды железного катализатора нри синтезе аммиака. При про-нускагши влажного газа активность катализатора снижается примерно в 6 раз, а нри пропускании сухой смеси азота с водородом активность в течение часа восстанавливается до исходной величииы. [c.300]
[c.300]
Если вещества газообразны и их можно считать идеальными тазами, то [c.178]
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Например, катализатор твердый, а реагирующее вещество газообразное или жидкое. [c.334]
Решение, а) При протекании реакции общее количество вещества газообразных веществ уменьшается (с 2 моль до 1 моль). В соответствии с принципом Ле Шателье повышение давления приведет к смещению равновесия в сторону реакции, приводящей к меньшему количеству вещества газов, т. е. в сторону вещества С. Следовательно, п(С) увеличивается. [c.38]
Вещество газообразном состоянии Д Н , КН71Л/Л10.М иа. /моль. грае/ О na.i/моль грае) 1 [c.286]
Для величин Ягэз — Яо веществ, находящихся при 298,15 К в кристаллическом или жидком состояниях, в качестве базисного принято кристаллическое состояние их при О К, а для веществ газообразных при 298,15 К эти величины отнесены к газообразному состоянию их и при О К.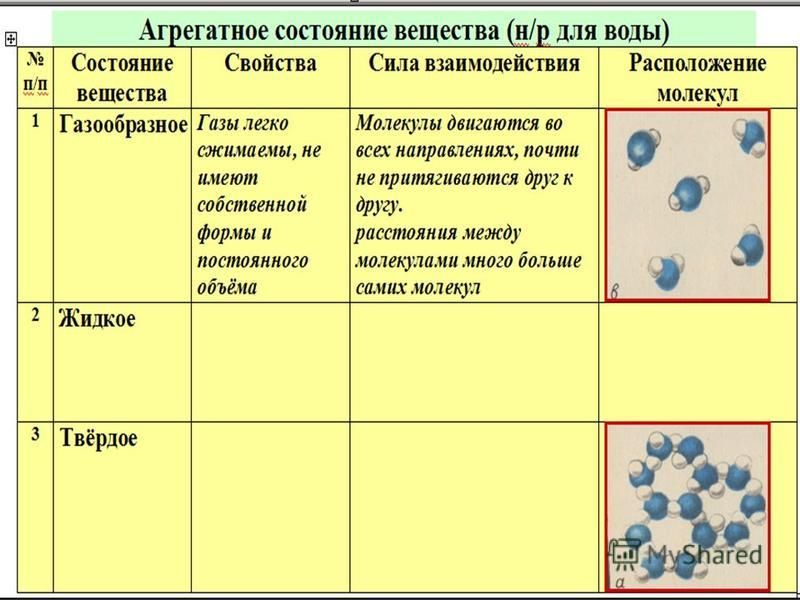 [c.316]
[c.316]
Алканы (метановые углеводороды) представляют собой газо-о(1/эазные, жидкие или твердые вещества. Газообразные соедине-пия содержат в цепи от 1 до 4 атомов углерода ( i—С4) и входят в состав попутных и природных газов (мэтап, этан, пропан, бутан, пзобутан). Соединения, содержащие от 5 до 15 атомов углерода (С,5— ia), представляют собой жидкие вещества. Начиная с гексадекана ( ie), нормальные алканы являются твердыми веществами, которые при обычной температуре могут находиться в растворенном или кристаллическом состоянии в нефти и в высококипящих фракциях. [c.99]
Более высококипящие фракции нефтей содержат значительно меньше этих углеводородов, и в масляных фракциях некоторых нефтей парафины практически отсутствуют. Парафиновые углеводороды нефтей представляют собой газообразные, жидкие и твердые при обыкновенной температуре вещества. Газообразные — метан, этан, пропан, изобутан и н-бутан — содержатся в газах, выделяющихся из нефтяных месторождений, Пентаны, гексаны и т. д., кончая пентадеканом (С1нНз2), представляют собой жидкие вещества, входящие в состав отдельных фракций. Начиная с гексадекана нормальные парафиновые углеводороды тверды при обыкновенной температуре и могут находиться частично в растворенном, частично в кристаллическом состоянии в нефтях и в их высококипящих фракциях. [c.8]
д., кончая пентадеканом (С1нНз2), представляют собой жидкие вещества, входящие в состав отдельных фракций. Начиная с гексадекана нормальные парафиновые углеводороды тверды при обыкновенной температуре и могут находиться частично в растворенном, частично в кристаллическом состоянии в нефтях и в их высококипящих фракциях. [c.8]
Агрегатное состояние вещества зависит от взаимодействия между молекулами. При слабом взаимодействии молекулы находятся далеко друг от друга и вещество газообразно. Сильное взаимодействие обусловливает ирочгюе сцепление молекул — вещество твердое. [c.219]
Чем объяснить тот факт, что а) метиловый спирт, обладающий меньшим молекулярным весом, чем бромистый метил, является жидкостью, растворим в воде, тогда как СНдЕк — вещество газообразное и не растворимое в воде [c.112]
Для реакции Н2-]-С12 = 2НС1 (все вещества газообразные) изменение энергии Гиббса при 298 К АО равно —190,5 кДж. Рассчитайте величину АС для этой реакции при 348 К, пользуясь справочными данными и считая, что изменение энтропии в ходе этой реакции не зависит от температуры. [c.22]
Рассчитайте величину АС для этой реакции при 348 К, пользуясь справочными данными и считая, что изменение энтропии в ходе этой реакции не зависит от температуры. [c.22]
Этат метод применим, однако, только при достаточно высоких Т и Та. Его часто используют в той области температур, в которой вещество газообразно. [c.192]
ФОСФИНЫ — органические производные фосфороводорода РН3 (фосфина), аналогичны аминам (СНз)зР, (СаН5)зР. Ф.— бесцветные вещества (газообразные, жидкие, твердые), с характерным неприятным запахом, хорошо растворяются в органических растворителях, плохо в воде. Низшие члены Ф. жирного ряда — ядовиты, по характеру действия напоминают РН,. [c.264]
Определенный интерес представляет вопрос о соотношении скоростей процессов каталитического гидрирования и электрогидрирования. Каталитическое гидрирование проводится при пропускании в раствор, в котором находятся электрод-катализатор и гидрируемое органическое вещество, газообразного водорода. Иногда можно встретить утверждение о том, что каталитическое гидрирование и электровосстановлеыие протекают с разными скоростями, так как при каталитическом гидрировании адсорбированный водород образуется при диссоциации молекулярного водорода и в момент образования энергетически отличается от атомарного водорода, возникающего за счет разряда ионов гидроксония. Однако убедительные доводы в пользу этого предположения не были получены. [c.283]
Иногда можно встретить утверждение о том, что каталитическое гидрирование и электровосстановлеыие протекают с разными скоростями, так как при каталитическом гидрировании адсорбированный водород образуется при диссоциации молекулярного водорода и в момент образования энергетически отличается от атомарного водорода, возникающего за счет разряда ионов гидроксония. Однако убедительные доводы в пользу этого предположения не были получены. [c.283]
Метод термодистилляции оказался весьма эффективным методом глубокой очистки ряда веществ от содержащихся в них примесей в виде мельчайших взвешенных частиц субмикронного размера ( 10 —10 мкм). Такие частицы могут иметь различную природу, обусловленную их происхождением (химические реакции термораспада или гидролиза, диспергирование конструкционных материалов, окружающая среда и т. д.) они практически присутствуют во всех веществах — газообразных, жидких и твердых. Установлено, например, что взвешенные частицы, находящиеся в летучих неорганических гидридах и хлоридах, на основе которых получают некоторые материалы для полупроводниковой техники и волоконной оптики, состоят в основном из оксидов различных элементов. Внося существенный вклад в суммарное содержание примесей, взвешенные частицы оказывают отрицательное влияние на электрофизические и оптические свойства этих материалов. [c.183]
Внося существенный вклад в суммарное содержание примесей, взвешенные частицы оказывают отрицательное влияние на электрофизические и оптические свойства этих материалов. [c.183]
Порядок съемки спектра поглощения. Порядок съемки спектра поглощения исследуемого вещества совершенно аналогичен порядку съемки спектра полистирола. Вместо пленки из полистирола установить кювету с исследуемым веществом. Если исследуемое вещество газообразное, то в комплекте прибора имеются специальные кюветы. В один из световых потоков ставится кювета сравнения. Если нет кюветы с соверщенно одинаковыми оптическими свойствами, то можно кювету не ставить. Если вещество жидкое, то его следует поместить между окнами, прозрачными для исследуемого участка спектра. Если исследуется раствор, то в луч сравнения И для учета поглощения излучения молекулами растворителя поместить кювету с растворителем, причем толщина поглощающего слоя должна быть аналогична толщине поглощающего слоя раствора. Твердые вещества снимаются в виде суспензии в.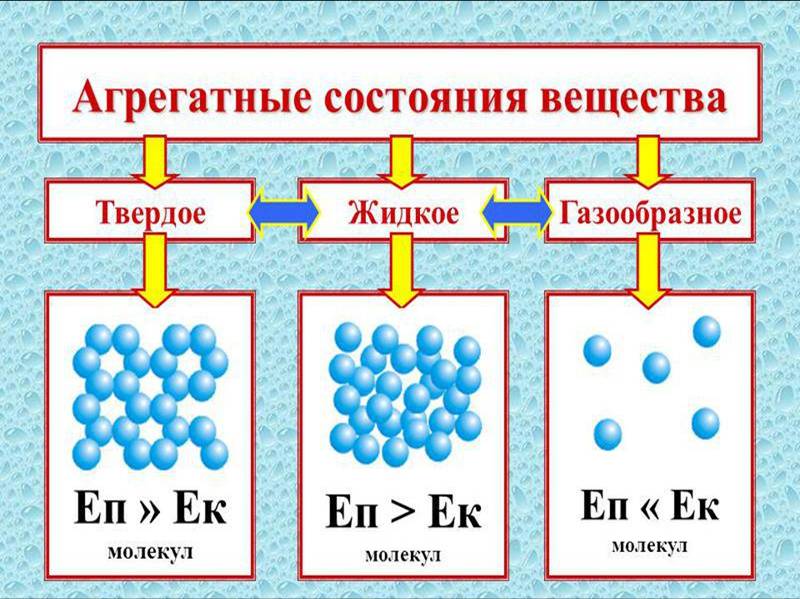 вазелиновом масле или в виде таблетки, сп1рессованной с бромидом калия. [c.58]
вазелиновом масле или в виде таблетки, сп1рессованной с бромидом калия. [c.58]
Молекулярное поле частицы а полностью насыщается (компен сируется) в результате взаимодействия с аналогичными полями окру жающих молекул. Иное следует отметить в отношении молекулы Ь Силовое поле последней насыщается лишь односторонне. Ненасыщен ная часть молекулярного поля позволяет молекуле Ь взаимодейство вать с молекулами других веществ (газообразных или растворенных) Этими последними в опыте с углем были молекулы аммиака, но могли бы быть и молекулы ЗОз, Нз, красителей и т. д. В результате сило вое поле поверхностно расположенных молекул насыщается. [c.107]
От химических свойств следует отличать фишческие свойства веществ температуры плавления и кипения, плот ность, цвет, вязкость, летучесть и др., а также агрегатные состояния веществ газообразное, жидкое и твердое [обозначения (г), (ж) и (т)]. [c.7]
Приведенные законы являются следствием того, что атомы могут входить в состав молекул соединений только целыми числами и поэтому они, безусловно, справедливы, когда индивйдуальные вещества (газообразные, жидкие или твердые) состоят из молекул. Газообразные вещества всегда молекулярные. Молекулы могут быть и одноатомными (Не, Ne, Аг). Молекулярные веса этих веществ легко определяются, и химические формулы их истинные с целочисленными индексами (SO 2, СО 2, Н2О). [c.7]
Газообразные вещества всегда молекулярные. Молекулы могут быть и одноатомными (Не, Ne, Аг). Молекулярные веса этих веществ легко определяются, и химические формулы их истинные с целочисленными индексами (SO 2, СО 2, Н2О). [c.7]
Энергетическое образование
2. Фазовые переходы
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств. В современной физике выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма (ранее им соответствовали 4 стихии (первоэлементы): Земля, Вода, Воздух, Огонь. Изменение агрегатного состояния — термодинамические процессы, являющиеся фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Понятие агрегатного состояния достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, представляющие нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие.
Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Понятие агрегатного состояния достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, представляющие нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие.
Твёрдое тело — cостояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Переход твердое вещество — жидкость.
Можно заставить жидкость перейти в твердое состояние, забрав у нее тепло. Для этого достаточно поместить ее в более холодную среду. При потере тепла молекулы жидкости замедляют свое движение и, в конце концов, уже не могут перемещаться, а просто колеблются вокруг фиксированных точек. С наступлением этой фазы жидкость отвердевает, т. е. превращается в твердое вещество. Например, вода замерзает при температуре 0°С. Большинство веществ кристаллизуются при переходе из жидкого состояния в твердое. Так, NaCl (поваренная соль) образует кристаллы кубической формы. Нагреваясь, твердые вещества могут снова перейти в жидкое состояние, так как при этом увеличивается скорость движения их молекул. При нагревании твердого вещества с целью превращения в жидкость его температура растет за счет поглощения тепла. Но, достигнув точки плавления, температура вещества остается постоянной, хотя процесс поглощения тепла продолжается. Тепло, используемое для превращения твердого вещества в жидкость, не увеличивается после достижения точки плавления и называется скрытой теплотой плавления.
Для этого достаточно поместить ее в более холодную среду. При потере тепла молекулы жидкости замедляют свое движение и, в конце концов, уже не могут перемещаться, а просто колеблются вокруг фиксированных точек. С наступлением этой фазы жидкость отвердевает, т. е. превращается в твердое вещество. Например, вода замерзает при температуре 0°С. Большинство веществ кристаллизуются при переходе из жидкого состояния в твердое. Так, NaCl (поваренная соль) образует кристаллы кубической формы. Нагреваясь, твердые вещества могут снова перейти в жидкое состояние, так как при этом увеличивается скорость движения их молекул. При нагревании твердого вещества с целью превращения в жидкость его температура растет за счет поглощения тепла. Но, достигнув точки плавления, температура вещества остается постоянной, хотя процесс поглощения тепла продолжается. Тепло, используемое для превращения твердого вещества в жидкость, не увеличивается после достижения точки плавления и называется скрытой теплотой плавления. Лишь после того, как все твердое вещество перейдет в жидкое состояние, его температура вновь начинает расти.
Лишь после того, как все твердое вещество перейдет в жидкое состояние, его температура вновь начинает расти.
Жидкость. Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Переход жидкость — газ.
Если продолжать нагревать жидкость, ее температура будет расти до достижения точки кипения, после чего остается неизменной, так как превращение жидкости в газ требует большого количества тепла. Тепло, используемое для перехода жидкости в газообразное состояние, называется теплотой парообразования. Как только все вещество превратится в пар, его температура будет опять расти.
При охлаждении газа его температура вначале падает. Затем, после достижения точки кипения вещества, газ отдает свою теплоту парообразования и переходит в жидкое состояние при той же температуре. Только когда весь газ превратится в жидкость, температура вещества начинает падать.
Затем, после достижения точки кипения вещества, газ отдает свою теплоту парообразования и переходит в жидкое состояние при той же температуре. Только когда весь газ превратится в жидкость, температура вещества начинает падать.
Пар снова превращается в воду при определенной потере тепла. Это явление можно наблюдать при продолжительном кипении воды в чайнике. Холодные поверхности в помещении покрываются влагой, так как часть образовавшегося пара отдает им тепло при контакте. В результате молекулы пара замедляют движение, и он превращается в воду. Говорят, что пар конденсировался в жидкое состояние, а явление называют «конденсацией». Мы ошибочно считаем паром белые клубы у носика чайника, но настоящий пар нельзя увидеть. Видимые клубы состоят из крошечных капелек воды, образующихся при конденсации пара, когда на выходе из чайника он сталкивается с относительно холодным окружающим воздухом.
Газ. Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Прибор для демонстрации газовых законов представляет собой стеклянную колбу, соединенную вакуумными шлангами с гофрированным цилиндром, вакуумметром и вакуумным насосом. Для изменения объема гофрированного цилиндра последний соединен с рычагом. Все элементы смонтированы на несущей раме. У стеклянной колбы имеется еще один отросток — шлюзовая камера с двумя вакуумными кранами. Для показа опытов с насыщенными парами используем легко испаряющуюся жидкость — ацетон. Из системы откачиваем воздух и пережимаем шланг, ведущий к насосу, зажимом. Через шлюзовую камеру, чтобы в колбу не попал воздух, заливаем ацетон в таком количестве, чтобы на дне колбы образовалось немного жидкого ацетона. Вакуумметр показывает давление насыщенных паров ацетона. Медленно изменяем с помощью рычага объем гофрированного цилиндра. Стрелка вакуумметра стоит на одном месте. Это подтверждает тот факт, что давление насыщенных паров не зависит от объема. Закрепляем рычаг (фиксируем постоянный объем цилиндра) и спиртовым факелом подогреваем колбу. Давление насыщенных паров увеличивается.
Это подтверждает тот факт, что давление насыщенных паров не зависит от объема. Закрепляем рычаг (фиксируем постоянный объем цилиндра) и спиртовым факелом подогреваем колбу. Давление насыщенных паров увеличивается.
Сублимация
Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое.Хорошо поддается возгонке вода, что определило широкое применение данного процесса как одного из способов сушки. При промышленной возгонке сначала производят заморозку исходного тела, а затем помещают его в вакуумную или заполненную инертными газами камеру. Физически процесс возгонки продолжается до тех пор, пока концентрация водяных паров в камере не достигнет нормального для данной температуры уровня, в связи с чем избыточные водяные пары постоянно откачивают. Возгонка применяется в химической промышленности, в частности, на производствах взрывоопасных или взрывчатых веществ, получаемых осаждением из водных растворов.
Возгонка применяется в химической промышленности, в частности, на производствах взрывоопасных или взрывчатых веществ, получаемых осаждением из водных растворов.
Возгонка также используется в пищевой промышленности: так, например, фрукты после сублимирования весят в несколько раз меньше, а восстанавливаются в воде. Сублимированные продукты значительно превосходят сушеные по пищевой ценности, так как возгонке поддаётся только вода, а при термическом испарении теряются многие полезные вещества. Перед сублимацией пищевых продуктов используется быстрое замораживание (-100 до -190 град. Цельсия), что приводит к образованию мелких кристаллов, не разрушающих клеточные мембраны.
Кривая насыщения — линия, где происходит переход из одного агрегатного состояния в другое.
У разных веществ может одновременно происходить несколько изменений агрегатного состояния, например кипение одного с образованием кристаллической решетки у другого.
Урок 4. Движение молекул. Диффузия. Твердое, жидкое, газообразное состояние веществ — Природоведение 5 класс — конспекты уроков — План урока — Конспект урока — Планы уроков
Урок 4. Движение молекул. Диффузия. Твердое, жидкое, газообразное состояние веществ
Цель: расширить представление о строении физических тел и свойства веществ, ознакомить с понятием «диффузия»; формировать умение определять агрегатное состояние веществ, развивать навыки самостоятельной практической работы; воспитывать интерес к исследовательской работе
Оборудование: шарики из пластилина, образцы веществ (ацетон, бензин, сахар, алюминиевую проволоку, масло, полиэтилен, кусок меди, графит (или угля), железный гвоздь, вода, нашатырь, каменная соль, цинковая пластинка, деревянная линейка).
Тип урока: формирование новых знаний и умений.
Ход урока
I. Организационный момент
II. Актуализация опорных знаний, проверка домашнего задания
Работа в группах
1. Игра «Природоведческий марафон»
Разделить класс на несколько (4-5) команд. Задачи. Составить по представленным схемам молекулы веществ.
Командам выдать инструкцию, какого цвета атомы того или иного элемента.
2. Заполнить кроссворд с названиями химических элементов (использовать кроссворды, которые ученики сделали дома). Каждая группа получает кроссворд своих соперников.
3. Представители команд выходят к доске и по команде учителя на своей части доски пишут по очереди названия простых и сложных веществ. Выигрывает та команда, которая напишет на доске длиннее список при условии, что все примеры будут правильными.
III. Изучение нового материала
1. Агрегатные состояния веществ
Агрегатные состояния веществ
— В каких агрегатных состояниях может находиться вещество?
Каждому ученику на ладонь положить кусок льда, а под ладонь поставить стакан, чтобы вода, растаяв, была собрана в стакан.
— У вас на ладони вода находится в твердом состоянии. Что с ней происходит?
Учитель демонстрирует процесс испарения воды с помощью собственного кубика льда и ее конденсацию на стекле, объясняет различия между фазами — агрегатными состояниями.
— Таким образом, запишем:
Задачи. Все предметы, которые есть на демонстрационном столе (см. оборудование), нужно разделить на группы в соответствии с агрегатного состояния.
Молекулы вещества находятся на определенном расстоянии друг от друга. Это расстояние и поведение молекул определяются агрегатным состоянием вещества. Между атомами и молекулами действуют силы притяжения. Каждая частица притягивает к себе соседние частицы, и сама притягивается к ним. В твердом агрегатном состоянии молекулы находятся близко и двигаются на короткие расстояния (колеблются). В жидком состоянии молекулы находятся на большем расстоянии друг от друга, их колебания сильнее. В газообразном состоянии молекулы находятся на значительных расстояниях друг от друга, они хаотично двигаются, сталкиваются и меняют направление движения. Поэтому газ можно сжимать так, что его объем уменьшится в несколько раз, ведь в газах расстояние между молекулами намного больше по размерам самих молекул, поэтому газы не сохраняют форму как твердые тела, и объем, как жидкость.
В твердом агрегатном состоянии молекулы находятся близко и двигаются на короткие расстояния (колеблются). В жидком состоянии молекулы находятся на большем расстоянии друг от друга, их колебания сильнее. В газообразном состоянии молекулы находятся на значительных расстояниях друг от друга, они хаотично двигаются, сталкиваются и меняют направление движения. Поэтому газ можно сжимать так, что его объем уменьшится в несколько раз, ведь в газах расстояние между молекулами намного больше по размерам самих молекул, поэтому газы не сохраняют форму как твердые тела, и объем, как жидкость.
2. Движение молекул. Диффузия
Практикум
— Представим, что все мы — молекулы воды. По команде мы начнем передвигаться, а скажу «Стоп!» — останавливаемся и остаемся на месте. Взгляните: все мы занимаем определенный объем (классную комнату, холл) и более-менее равномерно размещены в нем. Это беспорядочное движение молекул называется броуновским движением. Если снизить температуру или увеличить давление, взаимное притяжение становится сильнее, и молекулы скапливаются до определенного объема.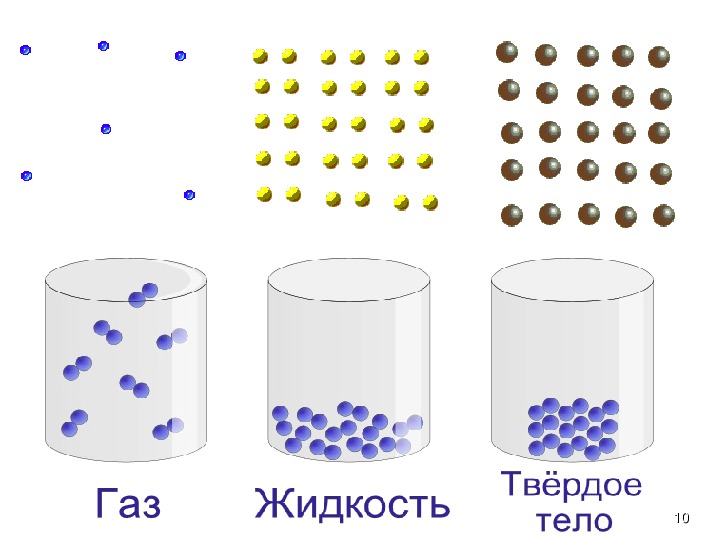 Возьмите, пожалуйста, друг друга за руки. Если потянуть одного из вас (молекулу), то вместе с ним начнут двигаться другие (молекулы),- это свойство называется текучестью. Однако, как вас не «сворачивать», вы будете иметь разную форму, но одинаковый объем.
Возьмите, пожалуйста, друг друга за руки. Если потянуть одного из вас (молекулу), то вместе с ним начнут двигаться другие (молекулы),- это свойство называется текучестью. Однако, как вас не «сворачивать», вы будете иметь разную форму, но одинаковый объем.
В твердой форме связи между молекулами более прочные. Нескольким ученикам учитель предлагает положить одну руку на плечи соседа спереди, другую — соседу справа.
— Крепко держитесь и не сгибайте руки. Вместе с вами мы построили кристаллическую решетку твердого вещества. Обратите внимание: вы имеете определенную форму и занимаете определенный объем. Если даже я потяну определенный край, вы продвигаетесь вместе, не меняя формы.
Молекулы жидкости могут взаимно проникать. Это напоминает игру «Разорви цепь». Явление взаимного проникновения (смешивания) веществ называется диффузией.
IV. Закрепление новых знаний
1. Практикум
В два стакана воды осторожно налить две-три капли чернил. Первый стакан должен быть с холодной водой, вторая — с горячей. Результаты наблюдений за скоростью процессов записать и зарисовать в тетрадях. Объяснить результаты опыта, сделать вывод о влиянии температуры на диффузию.
Первый стакан должен быть с холодной водой, вторая — с горячей. Результаты наблюдений за скоростью процессов записать и зарисовать в тетрадях. Объяснить результаты опыта, сделать вывод о влиянии температуры на диффузию.
2. Беседа
♦ В каких агрегатных состояниях может находиться вещество?
♦ Приведите примеры веществ в разных агрегатных состояниях.
♦ Что называют диффузией?
♦ Объясните явление диффузии в веществах, находящихся в различных агрегатных состояниях.
V. Итог урока
VИ. Домашнє задачи
Проработайте текст учебника.
Провести дома эксперимент. Взять лист бумаги из альбома для рисования. Намочить его водой. Далее с помощью пипетки или шприца капнемо немного чернил на мокрый лист. Наблюдайте, как пятно увеличивается. О чем свидетельствует этот эксперимент? Благодаря какому явлению происходит увеличение пятна?
Такой же эксперимент можно провести, используя акварельные краски. Нарисуйте фантастический пейзаж, не используя традиционные инструменты для рисования, а только метод «плямування».
Нарисуйте фантастический пейзаж, не используя традиционные инструменты для рисования, а только метод «плямування».
Теория химических расчетов | Агрегатные состояния вещества | Химические упражнения
Вещество присутствует в природе в трех различных агрегатных состояниях вещества: твердом, жидком и газообразном. Твердые тела имеют фиксированную форму и объем. Жидкости имеют фиксированный объем, но их форма соответствует форме сосуда. Газы не имеют пути или определенного объема, регулируя в обоих случаях их емкость. Эти два свойства, форма и объем, которые служат для различения трех агрегатных состояний, зависят от сил притяжения между составляющими частицами вещества и относительного упорядочения указанных частиц.
ЗАКОНЫ ГАЗОВ
Объем V любого вещества (твердого, жидкого или газообразного) является функцией количества вещества, которое может быть выражено через количество молей n, давления p и температуры T.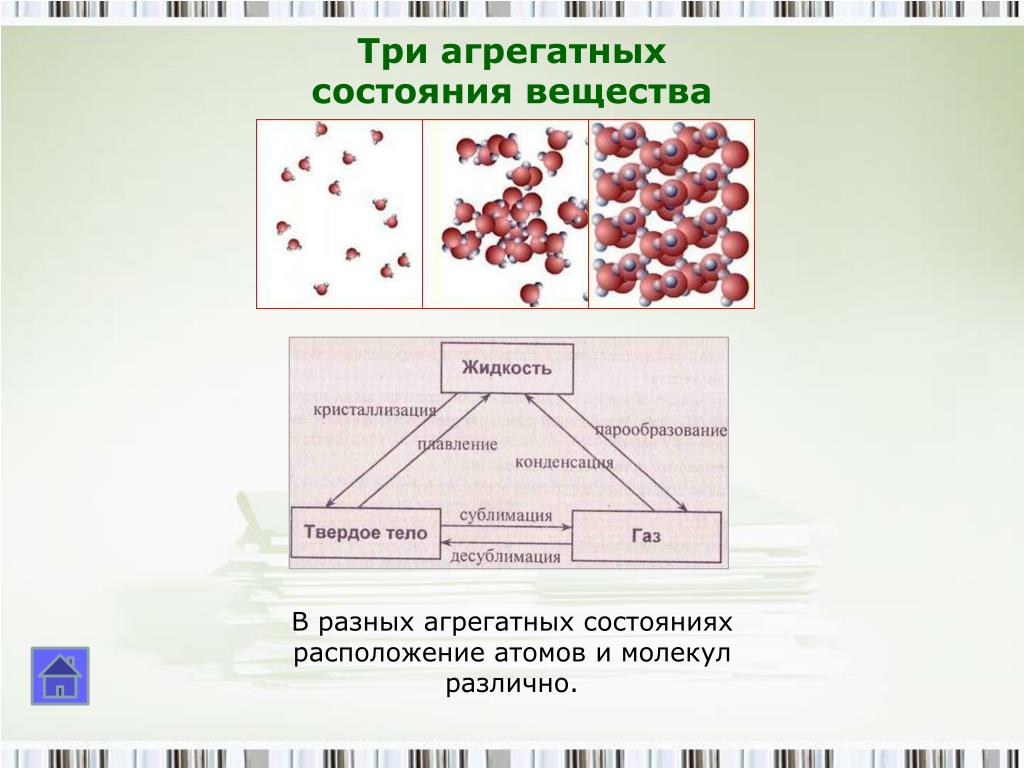
Закон Бойля-Мариотта
«Постоянная температура и фиксированная масса газа, занимаемый объем обратно пропорционален давлению».
Bioprofe |Агрегатные состояния материи в теории| 01
Более известен по выражению:
Bioprofe |Агрегатные состояния материи в теории| 02
Где V — объем, занимаемый при давлении P, а V´ — объем, занимаемый при давлении P’.
Закон Шарля-Гея Люссака
«При постоянном давлении и фиксированной массе газа занимаемый объем прямо пропорционален температуре».
Bioprofe |Агрегатные состояния материи в теории| 03
«При постоянном объеме и фиксированной массе газа давление прямо пропорционально температуре».
Bioprofe |Агрегатные состояния материи в теории| 04
Состояние Уравнение идеальных газов.
Законы Бойля-Мариотта и Шарля-Гея-Люссака можно объединить в одно выражение, получив таким образом связь между объемом данной массы газа, давлением и температурой.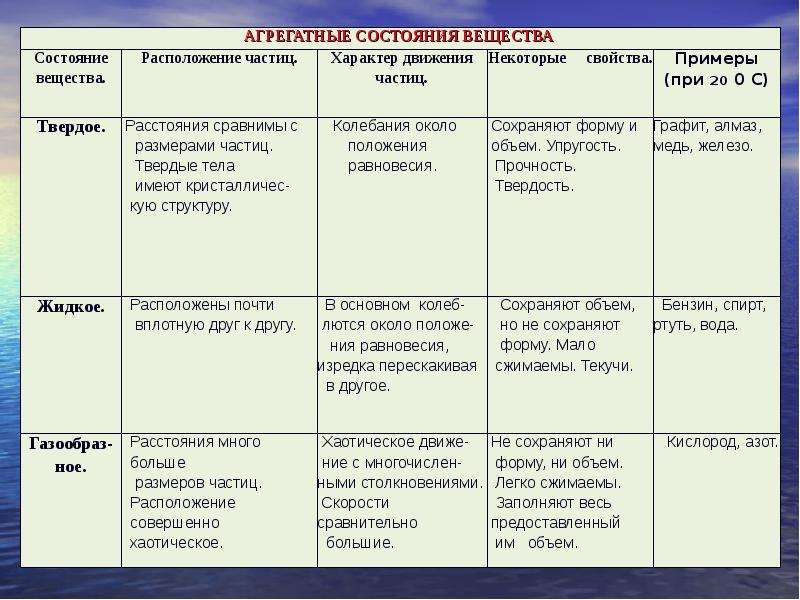
Bioprofe |Агрегатные состояния материи в теории| 05
Применение закона Авогадро:
Bioprofe |Агрегатные состояния материи в теории| 06
Bioprofe |Агрегатные состояния материи в теории| 07
Закон Дальтона.
«Полное давление, p, оказываемое смесью газов, равно сумме парциальных давлений, p I , которое оказал бы каждый газ, если бы он был только компонентом в том же самом сосуде».
Bioprofe |Агрегатные состояния материи в теории| 08
(p = общее давление смеси; p i = парциальное давление каждого газа x i = мольная доля каждого газа).
Кажущаяся молекулярная масса газовой смеси, М:
Bioprofe |Агрегатные состояния материи в теории| 09
(M i = молекулярная масса каждого газа; n i = количество молей каждого газа; V i = объем каждого газа; V = объем смеси).
Кинетическая энергия 1 моля идеального газа:
Bioprofe |Агрегатные состояния материи в теории| 10
МОЛЕКУЛЫ СКОРОСТИ
Среднеквадратичная скорость газа:
Bioprofe |Агрегатные состояния материи в теории| 11
Средняя скорость газа:
Bioprofe |Агрегатные состояния материи в теории| 12
Наиболее вероятная скорость газа:
Bioprofe |Агрегатные состояния материи в теории| 13
Связь между различными скоростями:
Bioprofe |Агрегатные состояния материи в теории| 14
ПЕРЕДАЧА В ГАЗЫ
Закон Грэма:
«Скорость диффузии или истечения газов v обратно пропорциональна квадратному корню из их плотности или молекулярной массы».
Bioprofe |Агрегатные состояния материи в теории| 15
РЕАЛЬНЫЕ ГАЗЫ
Уравнение Ван-дер-Ваальса для 1 моля газа:
Bioprofe |Агрегатные состояния материи в теории| 17
(a/V 2 = внутреннее давление газа; b = кообъем).
Связь между a, b и R и постоянная критика:
Bioprofe |Агрегатные состояния материи в теории| 16
ПРАВИЛО ФАЗ ГИББСА:
Ж + Л = С + 2
(F = количество фаз; L = количество степеней свободы; C = количество компонентов).
Какие состояния материи – x-engineer.org
Все окружающие нас предметы состоят из материи . Вселенная также содержит материю, но в другом масштабе. Материя может существовать в нескольких состояниях (называемых также фазами). Наиболее распространенными фундаментальными состояниями материи являются:
Наиболее распространенными фундаментальными состояниями материи являются:
Существует также четвертое состояние, также весьма распространенное, но менее интуитивное:
Состояние, в котором находится объект, зависит от двух физических атрибутов: давление и температура .Возьмем в качестве примера воду. На Земле наиболее распространенным состоянием воды является жидкое. Это связано с тем, что глобальная среднегодовая температура составляет 15 °C , а атмосферное давление составляет 1 бар . В этих условиях вода будет находиться в жидком состоянии.
Чем выше температура (теплота, энтальпия) вещества, тем выше кинетическая энергия молекул. Это заставит молекулы вибрировать с более высокими амплитудами и частотами, что нарушит межмолекулярные силы и отделит молекулы друг от друга.Вот почему, как правило, чем выше температура, тем ниже плотность.
В зависимости от температуры (при постоянном давлении) вещество может находиться в твердом, жидком или газообразном состоянии.
Изображение: Наиболее распространенные фазы вещества
ТВЕРДЫЕ ВЕЩЕСТВА
Вещество в твердом состоянии имеет самую высокую плотность, при этом молекулы плотно упакованы вместе. По сравнению с другими состояниями кинетическая энергия в твердом теле мала. Твердые тела имеют определенную форму и объем, если их поместить в контейнер, они не соответствуют геометрии контейнера.Имея определенный объем, даже сжатие под высоким давлением не сожмет их в меньший объем, твердые тела не сжимаемы.
Твердое тело может стать жидкостью, этот процесс называется плавлением или сплавлением. Например, лед (твердый) при температуре выше 0 °С тает и превращается в жидкую воду. Тот же процесс относится и к железу, которое становится жидким при температуре выше 1500 ºC.
Твердые вещества могут также переходить непосредственно в газы, этот процесс называется сублимацией .Нафталин, основной ингредиент традиционных шариков от нафталина, представляет собой органическое соединение с формулой C 10 H 8 . Это твердое вещество, которое возгоняется при стандартной атмосферной температуре и низких температурах.
Это твердое вещество, которое возгоняется при стандартной атмосферной температуре и низких температурах.
ЖИДКОСТИ
Жидкости имеют меньшую плотность, чем твердые тела (кроме воды), но более высокую кинетическую энергию. У них также есть определенный объем, поэтому они не могут быть сжаты. Молекулы воды более рыхлые, по сравнению с твердыми телами, и могут двигаться относительно друг друга.Жидкость не имеет определенной формы и, если ее поместить в емкость, принимает ее форму.
Жидкость может переходить в твердое тело в результате процесса, называемого затвердеванием (или кристаллизацией). Вода при охлаждении ниже 0°С становится твердой (льдом).
Процесс превращения жидкости в газ называется испарением . В случае воды, если ее нагреть до 100°С, она начинает кипеть и превращается в пар.
Изображение: Фазы функции воды от температуры (теплоты)
ГАЗЫ
По сравнению с другими состояниями вещества газы имеют наименьшую плотность и наибольшую кинетическую энергию. Молекулы внутри газа имеют большое пространство между собой и, если их не сдержать, будут распространяться бесконечно. Если его поместить в сосуд, газ займет весь объем. Под давлением промежутки между молекулами уменьшатся, и объем газа уменьшится. Газ сжимаем.
Молекулы внутри газа имеют большое пространство между собой и, если их не сдержать, будут распространяться бесконечно. Если его поместить в сосуд, газ займет весь объем. Под давлением промежутки между молекулами уменьшатся, и объем газа уменьшится. Газ сжимаем.
Газ может быть преобразован в жидкость посредством процесса, называемого конденсацией . Если газ достаточно охладить, кинетическая энергия молекулы уже не будет способна преодолевать межмолекулярные силы.Это приведет к накоплению молекул, которые образуют жидкость. Например, водяной пар (пар) при охлаждении ниже 100 °C начнет конденсироваться в жидкую воду.
Превращение газа непосредственно в твердое тело называется осаждением . Если газ поместить непосредственно в очень холодную среду, он превратится в мельчайшие твердые частицы. Например, водяной пар превращается в кристаллы льда при температуре ниже 0 °C.
Изображение: Физическое изменение состояния материи
ПЛАЗМА
Плазма является наиболее распространенным состоянием материи во Вселенной, но не очень распространенным на Земле. При очень большом количестве тепла газ может превратиться в плазму. В плазменном состоянии атомы ионизированы , что отделяет электроны (отрицательный заряд) от ионов (положительный заряд).
При очень большом количестве тепла газ может превратиться в плазму. В плазменном состоянии атомы ионизированы , что отделяет электроны (отрицательный заряд) от ионов (положительный заряд).
Примеры плазмы в природе: молния, неоновый свет и электрические искры. Плазму также можно получить искусственно, наиболее распространенной технологией является применение электрического тока через диэлектрический газ или жидкость.
Изображение: Плазменная струя
Плазма может быть получена только из газов, а обратный процесс только из плазмы в газ посредством деионизации .
ФАЗОВЫЕ ДИАГРАММЫ
Преобразование материи лучше всего описывается на фазовых диаграммах . На этих диаграммах показаны равновесные фазы в зависимости вещества от температуры и давления или состава.
Простые фазовые диаграммы (2-D), которые легко понять, представляют собой диаграммы давление-температура одного простого вещества, например воды . Вертикальная ось соответствует давлению, а горизонтальная – температуре.Фазовая диаграмма показывает в пространстве давление-температура линии равновесия или фазовые границы между тремя фазами твердого тела, жидкости и газа.
Вертикальная ось соответствует давлению, а горизонтальная – температуре.Фазовая диаграмма показывает в пространстве давление-температура линии равновесия или фазовые границы между тремя фазами твердого тела, жидкости и газа.
Изображение: Диаграмма фазовой границы вещества (2-D) (газ, жидкость и твердое тело) этого вещества сосуществуют в термодинамическом равновесии. Для воды координаты тройной точки: 0.01 °C и 0,0061166 бар. В этот момент при небольших изменениях давления и температуры можно превратить все вещество в лед, воду или пар.
Изображение: Фазовая диаграмма воды
Критическая точка определяет конец границы жидкость-пар. Он определяется критической температурой ( T cr ) и критическим давлением ( p cr ). В критической точке граница раздела фаз исчезает, жидкость и ее пар могут сосуществовать в одном и том же состоянии.Критическая точка для воды наступает при 374 °C и 220,888 бар. Вблизи критической точки вода становится сжимаемой, расширяемой, плохим диэлектриком и плохим растворителем для электролитов. Выше критической точки вода становится сверхкритической жидкостью . Вещество в этом состоянии сочетает в себе свойства как жидкости, так и газа, и путем точной настройки температуры и давления можно управлять поведением, чтобы оно было более похожим на жидкость или газ.
Выше критической точки вода становится сверхкритической жидкостью . Вещество в этом состоянии сочетает в себе свойства как жидкости, так и газа, и путем точной настройки температуры и давления можно управлять поведением, чтобы оно было более похожим на жидкость или газ.
Вода (H 2 O) и диоксид углерода (CO 2 ) являются наиболее часто используемыми сверхкритическими жидкостями.
Изображение: фазовая диаграмма давление-температура диоксида углерода
Особое состояние вещества — это конденсаты Бозе-Эйнштейна (БЭК) . При охлаждении вещества при экстремально низких температурах (близких к абсолютному нулю, 0 K = -273,15 °C) молекулярные колебания приближаются к полной остановке. Все атомы вещества собираются вместе, потому что нет кинетической энергии, чтобы разделить их, создавая «суператом». Вещества БЭК в основном используются для моделирования условий, которые могут иметь место в черных дырах.
Если у вас есть какие-либо вопросы или замечания относительно этого урока, пожалуйста, используйте форму комментариев ниже.
Не забудьте поставить лайк, поделиться и подписаться!
7.1: Состояние вещества — Химия LibreTexts
Результаты обучения
- Перечислите три состояния материи и приведите примеры каждого из них.
- Опишите свойства каждого состояния вещества.
- Определите и опишите каждый тип изменения состояния.
- Знайте, что точки кипения и плавления различны для каждого вещества.
- Знать, что точка кипения вещества зависит от давления.
Состояние вещества
Другим способом, которым мы можем описать свойства материи, является состояние (также называемое фазой). Количество энергии в молекулах материи определяет состояние материи . Материя может существовать в одном из нескольких различных состояний, включая газообразное, жидкое или твердое состояние. Эти разные состояния вещества обладают разными свойствами, которые показаны на рисунке ниже.
- Газ — это состояние вещества, в котором атомы или молекулы обладают достаточной энергией для свободного движения.
 Молекулы вступают в контакт друг с другом только тогда, когда они случайным образом сталкиваются. Силы между атомами или молекулами недостаточно сильны, чтобы удерживать их вместе.
Молекулы вступают в контакт друг с другом только тогда, когда они случайным образом сталкиваются. Силы между атомами или молекулами недостаточно сильны, чтобы удерживать их вместе. - Жидкость — это состояние вещества, в котором атомы или молекулы постоянно находятся в контакте, но обладают достаточной энергией, чтобы постоянно менять положение относительно друг друга. Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы относительно близко друг к другу, но недостаточно сильны, чтобы предотвратить их движение мимо друг друга.
- Твердое тело — это состояние вещества, в котором атомы или молекулы не имеют достаточно энергии для движения. Они постоянно соприкасаются и находятся в фиксированных положениях друг относительно друга. Силы между атомами или молекулами достаточно сильны, чтобы удерживать молекулы вместе и препятствовать их перемещению друг относительно друга.
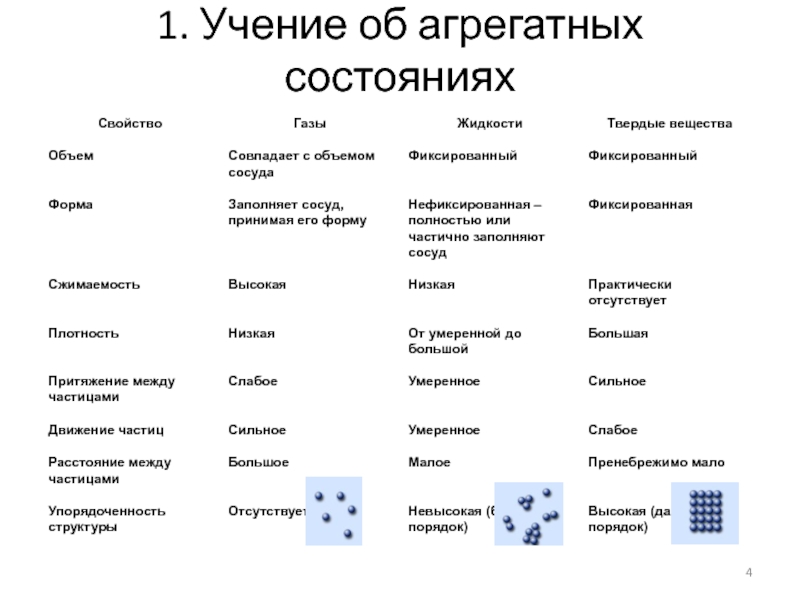 \text{o} \text{C }\).\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств.
\text{o} \text{C }\).\text{o} \text{C}\), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств.| Газ | Жидкость | Твердый | |
|---|---|---|---|
Форма | не имеет определенной формы (принимает форму контейнера) | не имеет определенной формы (принимает форму контейнера) | определенная форма (жесткая) |
Том | частицы движутся случайным образом практически без притяжения друг к другу | имеет определенный объем | определенный объем |
Мобильность | частицы движутся случайным образом практически без притяжения друг к другу | частицы могут свободно перемещаться друг над другом, но все равно притягиваются друг к другу | частицы колеблются вокруг фиксированных осей |
Сжимаемость | сильно сжимаемый | слабо сжимаемый | слабо сжимаемый |
Технически говоря, существует четвертое состояние материи, называемое плазмой, но оно не встречается в природе на Земле, поэтому мы не будем его здесь изучать.
Изменение состояний
Материя постоянно проходит циклы, включающие изменение состояний (также называемые фазами изменения). Вода и все важные для организмов элементы, включая углерод и азот, постоянно перерабатываются на Земле. По мере того, как материя движется по своим циклам, она неоднократно меняет свое состояние. Например, в круговороте воды вода неоднократно превращается из газа в жидкость или твердое тело и снова в газ. Как это произошло?
Добавление энергии к материи дает ее атомам или молекулам способность сопротивляться некоторым силам, удерживающим их вместе.Например, нагрев льда до точки плавления дает его молекулам достаточно энергии для движения. Лед тает и становится жидкой водой. Точно так же нагревание жидкой воды до ее точки кипения дает ее молекулам достаточно энергии, чтобы отделиться друг от друга, чтобы они больше не соприкасались. Жидкая вода испаряется и становится водяным паром. \text{o} \text{C} \right)\)»> 93
\text{o} \text{C} \right)\)»> 93
Авторы и авторство
Фонд CK-12, созданный Шэрон Бьюик, Ричардом Парсонсом, Терезой Форсайт, Шонной Робинсон и Джин Дюпон.
Эллисон Сульт, доктор философии. (Кафедра химии, Университет Кентукки)
Агрегация частиц – обзор
15.5 Моделирование коллоидов при сдвиге
Реологическое поведение коллоидных суспензий в значительной степени зависит от концентрации частиц и степени агрегации частиц при сдвиге. Компьютерное моделирование является полезным инструментом для связи макроскопического реологического поведения с микроструктурой коллоидных суспензий, как видно из следующих примеров.
Мелроуз и Хейс (1993) сообщили о результатах BD-моделирования двух моделей агрегированных дисперсий, а именно, электрореологических жидкостей (с анизотропными дипольными взаимодействиями) и флокулированных систем с истощением (с изотропными взаимодействиями). В отсутствие сдвига обе системы образуют бесконечную гелеобразную агрегатную сеть. При сдвиге они становятся тонкими и подвергаются агломерации, вызванной сдвигом, с образованием более компактных структур. Имитационная модель не включает гидродинамические взаимодействия многих тел из-за вычислительных ограничений, поскольку необходимо использовать относительно большое количество частиц.(Моделирование, включающее гидродинамику многих тел, обсуждается в разделе 15.6.) Это означает, что предполагается, что структура сдвиговой суспензии умеренно или сильно взаимодействующих частиц определяется исключительно неравновесной статистической механикой прямых взаимодействий частиц, -объемная доля и броуновское движение. Следовательно, смоделированные подвески представляют собой идеализированные модельные системы. Поскольку все включенные взаимодействия можно рассматривать как термодинамические взаимодействия (в том смысле, что они определяют равновесную структуру), моделирование может отразить основную физику формирования структуры в модельных системах.
В отсутствие сдвига обе системы образуют бесконечную гелеобразную агрегатную сеть. При сдвиге они становятся тонкими и подвергаются агломерации, вызванной сдвигом, с образованием более компактных структур. Имитационная модель не включает гидродинамические взаимодействия многих тел из-за вычислительных ограничений, поскольку необходимо использовать относительно большое количество частиц.(Моделирование, включающее гидродинамику многих тел, обсуждается в разделе 15.6.) Это означает, что предполагается, что структура сдвиговой суспензии умеренно или сильно взаимодействующих частиц определяется исключительно неравновесной статистической механикой прямых взаимодействий частиц, -объемная доля и броуновское движение. Следовательно, смоделированные подвески представляют собой идеализированные модельные системы. Поскольку все включенные взаимодействия можно рассматривать как термодинамические взаимодействия (в том смысле, что они определяют равновесную структуру), моделирование может отразить основную физику формирования структуры в модельных системах.
Здесь мы только иллюстрируем несколько примеров результатов, полученных для первой модельной системы (электрореологические жидкости) с использованием модели моделирования. В присутствии сильного электрического поля кажущаяся вязкость электрореологической суспензии заметно выше, чем при нулевом поле, и суспензия сильно утончается при сдвиге. Это связано с тем, что при достаточно сильном приложенном электрическом поле и сдвиге исходная гелеобразная сетка переходит в фазу текучих слоев.На рис. 15.8 такой переход показан графически. Он был получен с использованием 500 частиц при 30% объемной концентрации. Рисунок 15.8(а) представляет собой снимок структуры подвески в состоянии покоя без сдвига, полученный после 12 × 10 4 шагов по времени; Рисунок 8(b) представляет собой аналог, полученный после 10 × 10 90 171 4 90 172 временных шагов со сдвигом, применяемым со скоростью 2 × 10 90 171 -5 90 172 на временной шаг. По результатам моделирования, полученным в широком диапазоне числа Пекле, Pe, и силы взаимодействия частиц, Q , при 30% объемной концентрации твердого вещества можно построить неравновесную фазовую диаграмму, как показано на рисунке 15. 9. Существуют четыре различных этапа. Упорядоченные фазы включают слоистую фазу (LY) и фазу сдвиговой струны (SS). Жидкая фаза (L2) находится между секущей колонной и пластовой фазой. Броуновская линия отмечает другую жидкую фазу (L1) и является продолжением равновесного перехода. Линия стоксовских переходов возникает из-за конкуренции поляризационных и сдвиговых сил, а линия броуновских переходов — из конкуренции броуновских и поляризационных сил. Пересечение (обозначено пунктирным кружком на рисунке 15.9) переходы от броуновского к стоксову можно интерпретировать как эффект размера частиц.
9. Существуют четыре различных этапа. Упорядоченные фазы включают слоистую фазу (LY) и фазу сдвиговой струны (SS). Жидкая фаза (L2) находится между секущей колонной и пластовой фазой. Броуновская линия отмечает другую жидкую фазу (L1) и является продолжением равновесного перехода. Линия стоксовских переходов возникает из-за конкуренции поляризационных и сдвиговых сил, а линия броуновских переходов — из конкуренции броуновских и поляризационных сил. Пересечение (обозначено пунктирным кружком на рисунке 15.9) переходы от броуновского к стоксову можно интерпретировать как эффект размера частиц.
Рисунок 15.8. Переход электрореологической суспензии объемной долей 0,30 гелеобразной сетки ( a ) в слоистую структуру ( b )
Рисунок 15.9. Неравновесная фазовая диаграмма электрореологической модельной суспензии при объемной концентрации 30%
Поведение электрореологических жидкостей может быть описано степенным законом относительно относительной вязкости η r по отношению к числу Мейсона, M n (определяется как безразмерное отношение силы сдвига к дипольной силе): ηr∝Mn−α Если α = 1, это соответствует модели Бингама с четко определенным динамическим пределом текучести τ y . Для α < 1 модель является псевдопластичной без истинного предела текучести. Когда α > 1, это сдвиговое утолщение. На рис. 15.10(а) показана зависимость относительной вязкости от числа Мейсона, полученная в условиях с минимальным перекрытием частиц и без броуновского движения (т. е. в стоксовом пределе, когда сила сдвига намного превышает броуновскую силу). Данные показывают, что в исследованном диапазоне M n реология представляет собой разжижение при сдвиге по степенному закону. Вставка к рисунку 15.10(a) представляет собой график приведенного напряжения τ* в зависимости от Pe для низких точек, который предполагает наличие динамического предела текучести.Как видно из рис. 15.10(b), данные можно довольно хорошо аппроксимировать уравнением Кэссона. Поскольку имитационная модель использует выровненные точечные диполи, которые недооценивают взаимодействие, вызванное полем, вязкость и напряжение, предсказанные моделированием, по понятным причинам намного ниже, чем у реальных суспензий.
Для α < 1 модель является псевдопластичной без истинного предела текучести. Когда α > 1, это сдвиговое утолщение. На рис. 15.10(а) показана зависимость относительной вязкости от числа Мейсона, полученная в условиях с минимальным перекрытием частиц и без броуновского движения (т. е. в стоксовом пределе, когда сила сдвига намного превышает броуновскую силу). Данные показывают, что в исследованном диапазоне M n реология представляет собой разжижение при сдвиге по степенному закону. Вставка к рисунку 15.10(a) представляет собой график приведенного напряжения τ* в зависимости от Pe для низких точек, который предполагает наличие динамического предела текучести.Как видно из рис. 15.10(b), данные можно довольно хорошо аппроксимировать уравнением Кэссона. Поскольку имитационная модель использует выровненные точечные диполи, которые недооценивают взаимодействие, вызванное полем, вязкость и напряжение, предсказанные моделированием, по понятным причинам намного ниже, чем у реальных суспензий.
Рисунок 15.10. Имитационное прогнозирование реологии модельной суспензии. ( a ) Относительная вязкость в зависимости от числа Мейсона в пределе Стокса. Вставка представляет собой график приведенного напряжения в зависимости от скорости сдвига для точек с низким M n , ( b ) График Кассона квадратного корня приведенного напряжения в зависимости от квадратного корня из скорости сдвига
Интересный аспект Следующий пример состоит в том, что смоделированные частицы имеют форму не сферической, а пластинчатой формы.Моделирование было проведено Шервудом (1992) с использованием упрощенной версии алгоритма BD, предложенного Эрмарком и Маккаммоном (1978). Пластинчатые частицы имеют размеры 2 a × 2 a и нулевую толщину и помещены в монослой внутри элементарной ячейки с периодическими граничными условиями. Силы, учитываемые при моделировании, включают поперечную силу, двойной электрический слой и взаимодействия Борна, сопротивление Стокса и пары на изолированной пластине, а также броуновское движение (как поступательное, так и вращательное). Гидродинамическими взаимодействиями между частицами и инерцией пренебрегают. Заряды на пластинах представлены серией точечных зарядов, каждый из которых окружен двойным электрическим слоем. Это упрощает расчет двойной электрической силы между пластинами. Если все заряды одинаковы, небольшие жидкокристаллические упорядоченные домены образуются в отсутствие сдвига (рис. 15.11 (а)), а дальний порядок может быть вызван сдвигом (рис. 15.11 (б)). Если знак заряда на краю пластины отличается от заряда на поверхности пластины, частицы могут флоккулировать, образуя гель, охватывающий всю элементарную ячейку в отсутствие сдвига (рис. 15.12(а)). При низких скоростях сдвига в геле появляется одна полоса сдвига (рис. 15.12(b)), а по мере увеличения скорости сдвига типичный размер хлопьев уменьшается. Хотя результаты моделирования в целом согласуются с интуицией, некоторые прогнозы (например, длинная структура, показанная на рис. 15.11, и сильная уязвимость геля к приложенному сдвигу) характерны для двумерной природы моделируемой системы и могут не наблюдаться в трехмерной реальности флокулированных суспензий.
Гидродинамическими взаимодействиями между частицами и инерцией пренебрегают. Заряды на пластинах представлены серией точечных зарядов, каждый из которых окружен двойным электрическим слоем. Это упрощает расчет двойной электрической силы между пластинами. Если все заряды одинаковы, небольшие жидкокристаллические упорядоченные домены образуются в отсутствие сдвига (рис. 15.11 (а)), а дальний порядок может быть вызван сдвигом (рис. 15.11 (б)). Если знак заряда на краю пластины отличается от заряда на поверхности пластины, частицы могут флоккулировать, образуя гель, охватывающий всю элементарную ячейку в отсутствие сдвига (рис. 15.12(а)). При низких скоростях сдвига в геле появляется одна полоса сдвига (рис. 15.12(b)), а по мере увеличения скорости сдвига типичный размер хлопьев уменьшается. Хотя результаты моделирования в целом согласуются с интуицией, некоторые прогнозы (например, длинная структура, показанная на рис. 15.11, и сильная уязвимость геля к приложенному сдвигу) характерны для двумерной природы моделируемой системы и могут не наблюдаться в трехмерной реальности флокулированных суспензий.
Рисунок 15.11. Конфигурации пластин равнозарядных ( a ) без сдвига и ( b ) со сдвигом
Рисунок 15.12. Конфигурации пластины противоположных зарядов ( a ) без сдвига и ( b ) при сдвиге
Строго говоря, приведенный ниже пример не попадает в категорию моделирования BD, поскольку броуновское движение полностью игнорируется. Он также не относится к МД-моделированию, описанному в главе 7, поскольку, во-первых, он не рассматривает взаимодействия между всеми видами составляющих частиц, как это обычно делает типичное МД-моделирование, и, во-вторых, уравнения движения не решаются с использованием алгоритмы, обычно используемые при моделировании МД.Он был выбран в качестве примера здесь, потому что такой вид моделирования не является необычным при работе со сложными системами, такими как коллоидные дисперсии. Методы моделирования, описанные в главе 7, были разработаны и усовершенствованы в ходе изучения простых жидкостей за последние три-четыре десятилетия, и в настоящее время они хорошо зарекомендовали себя. Сценарий в области коллоидов совершенно иной. Компьютерное моделирование коллоидов приобрело популярность сравнительно недавно. Не существует такого понятия, как «стандартный» или хорошо зарекомендовавший себя метод моделирования для коллоидных систем в целом; многие имитационные модели представляют собой специальные модели , основанные на некоторых основных идеях, которые возникли из алгоритмов моделирования, разработанных для простых жидкостей и впоследствии адаптированных для моделирования коллоидов.
Сценарий в области коллоидов совершенно иной. Компьютерное моделирование коллоидов приобрело популярность сравнительно недавно. Не существует такого понятия, как «стандартный» или хорошо зарекомендовавший себя метод моделирования для коллоидных систем в целом; многие имитационные модели представляют собой специальные модели , основанные на некоторых основных идеях, которые возникли из алгоритмов моделирования, разработанных для простых жидкостей и впоследствии адаптированных для моделирования коллоидов.
Приведенный здесь пример называется моделью липких сфер (Doi and Chen, 1989; Chen and Doi, 1989) и представляет собой попытку моделирования кинетики и реологических свойств агрегирующихся коллоидов в сдвиговом потоке. Предполагается, что коллоидные частицы образуют кластер при соприкосновении. Кластер может деформироваться, разрываться и объединяться с другими кластерами. По-видимому, модель получила свое название от одного из своих основных предположений, что при столкновении коллоидные частицы будут просто слипаться; застрявшие сферы могут катиться друг по другу, но не могут скользить в точке контакта. Для того, чтобы это произошло, допуская разрушение кластеров, принимается максимальное (или критическое) значение силы притяжения, f c . Таким образом, модель может охарактеризовать все взаимодействия между частицами (коллоидные и гидродинамические) с использованием одного параметра, f c , предполагается, что он имеет бесконечно малый эффективный диапазон, что означает, что частицы будут взаимодействовать друг с другом только при контакте. Это значительно упрощает задачу, а поскольку броуновским движением также пренебрегают, динамика системы детерминирована и определяется только гидродинамикой каждой отдельной частицы.Дальнейшие детали и математические обработки можно найти в оригинальной статье и здесь не приводятся. Достаточно сказать, что даже с таким количеством сокращений вычислительные требования по-прежнему превышают возможности большинства обычных компьютеров, и масштаб системы моделирования должен быть небольшим (до 1000 частиц), чтобы выполнить один запуск моделирования.
Для того, чтобы это произошло, допуская разрушение кластеров, принимается максимальное (или критическое) значение силы притяжения, f c . Таким образом, модель может охарактеризовать все взаимодействия между частицами (коллоидные и гидродинамические) с использованием одного параметра, f c , предполагается, что он имеет бесконечно малый эффективный диапазон, что означает, что частицы будут взаимодействовать друг с другом только при контакте. Это значительно упрощает задачу, а поскольку броуновским движением также пренебрегают, динамика системы детерминирована и определяется только гидродинамикой каждой отдельной частицы.Дальнейшие детали и математические обработки можно найти в оригинальной статье и здесь не приводятся. Достаточно сказать, что даже с таким количеством сокращений вычислительные требования по-прежнему превышают возможности большинства обычных компьютеров, и масштаб системы моделирования должен быть небольшим (до 1000 частиц), чтобы выполнить один запуск моделирования. на суперкомпьютере мейнфрейма в течение разумного периода времени (несколько часов процессорного времени).
на суперкомпьютере мейнфрейма в течение разумного периода времени (несколько часов процессорного времени).
Несмотря на упрощения, модель по-прежнему поддерживает основную физику агрегации, вызванной сдвигом, и, таким образом, способна дать некоторое качественное представление о структуре агрегатов и взаимосвязи между структурой и реологическими свойствами; однако прямого и количественного сравнения с экспериментами ожидать не приходится.Используя модель липких сфер, авторы (Doi and Chen, 1989; Chen and Doi, 1989) изучили эволюцию во времени структуры агрегатов и макроскопической вязкости дисперсии в сдвиговом течении. На рис. 15.13 показано смоделированное изменение структуры агрегатов при различных скоростях сдвига γ. Сравнивая два разных случая, показанных на этом рисунке, можно увидеть, что агрегаты, вызванные сдвигом, изначально имеют цепочечную форму, но по мере увеличения напряжения сдвига они скручиваются, становясь более компактными.В стационарном состоянии средний размер кластера больше при низких скоростях сдвига, чем при высоких скоростях сдвига.
Рисунок 15.13. Эволюция кластерной структуры при различных скоростях сдвига
В переходном состоянии вязкость дисперсии увеличивается по сигмоидальному закону. Это можно увидеть на рис. 15.14. Результаты качественно согласуются с экспериментальными наблюдениями. Стационарная вязкость зависит от скорости сдвига и подчиняется одному и тому же степенному закону для всех концентраций частиц, что позволяет предположить, что критическим структурным параметром, определяющим макроскопическую вязкость дисперсии, является не общий размер кластера, а размер более жесткие субкластеры, причина в том, что связи между этими субкластерами гибкие, что делает весь кластер деформируемым при сдвиге.
Рисунок 15.14. Вязкость в зависимости от деформации сдвига
Агрегатные состояния вещества: виды и примеры
Когда говорят о степени взаимодействия, это относится к тому, насколько сильно частицы соединяются друг с другом, образуя наборы, которые, в свою очередь, определяют фазу или состояние материала. Таким образом, мы имеем три основных агрегатных состояния материи: твердое, жидкое и газообразное, все они присутствуют здесь, на Земле, в больших масштабах.
Таким образом, мы имеем три основных агрегатных состояния материи: твердое, жидкое и газообразное, все они присутствуют здесь, на Земле, в больших масштабах.
Океаны и моря являются примерами жидкостей. Атмосфера и воздух, которым мы дышим, соответствуют газообразному состоянию.Между тем, айсберги и земная кора представляют твердые тела планеты Земля. Кроме этих трех состояний можно упомянуть коллоидное, наблюдаемое в облаках неба и в бесчисленных природных объектах.
Существуют и другие агрегатные состояния материи, считающиеся экзотическими, поскольку они развиваются только в лабораториях или на космических территориях при невообразимых условиях температур и давлений. Некоторые из них представляют собой плазму, нейтронную материю, фотонную материю или конденсаты Бозе-Эйнштейна.
Жидкое агрегатное состояние Вода является примером жидкого состояния . Источник: Pxhere. В жидкости взаимодействия между частицами сильны, но недостаточно сильны, чтобы лишить их свободного движения. Таким образом, наборы частиц определяют вещество, способное занимать весь объем сосуда, но при этом испытывающее силу притяжения.
Таким образом, наборы частиц определяют вещество, способное занимать весь объем сосуда, но при этом испытывающее силу притяжения.
Следовательно, поверхность жидкости охватывает всю ширину сосуда.Это наблюдается в любой бутылке, ванне, баке, колодце, тигле и т. д. При встряхивании емкости жидкость имеет тенденцию выливаться через ее края или выплескиваться прямо на землю.
Особенностью жидкостей является то, что они могут течь по каналам или трубам.
Некоторые примеры жидкостей:
-Вода
-Масло
-Нефть
-Стирка
-Мед
— Сиропы
-Бром
— Меркурий
— Четыреххлористый углерод
— Титана тетрахлорид
— Соли расплавленные
— Плавленые металлы
— Жидкий азот
-Бензин
— Пиво
-Вина
— Ледяная уксусная кислота
Есть жидкости, которые текут больше других, а это значит, что они имеют разную вязкость.Это свойство жидкостей служит для их характеристики; то есть отличать их друг от друга.
Газы визуализируются как пузырьки в жидкости или как туман или пар. Взаимодействия между его частицами слабые, что приводит к большому расстоянию между ними. Следовательно, они образуют вещество, которое почти не испытывает действия гравитации и которое диффундирует по всему объему содержащего его сосуда.
В газах частицы, будь то атомы, ионы или молекулы, обладают максимальной свободой движения. В зависимости от массы одни газы могут быть плотнее других, что напрямую влияет на скорость их распространения в пространстве.
Это агрегатное состояние материи считается неуловимым, мимолетным, неуловимым (неприкасаемым) и рассеянным.
Некоторые примеры газов:
-Водяной пар
— Углекислый газ
-Воздух
— Метеоризм
— Аммиак
-Кислород
— Водород
-Гелий
-Хлор
-Фтор
-Метан
— Природный газ
-Этан
-Ацетилен
-Фосфин
-Фосген
-силан
— Оксиды азота (NO x )
— Диоксид и триоксид серы
-Озон
— Гексафторид серы
— Диметиловый эфир
Газы вообще нежелательны, потому что в случае утечек они быстро распространяются по пространству, а также обычно представляют серьезную опасность возгорания или отравления.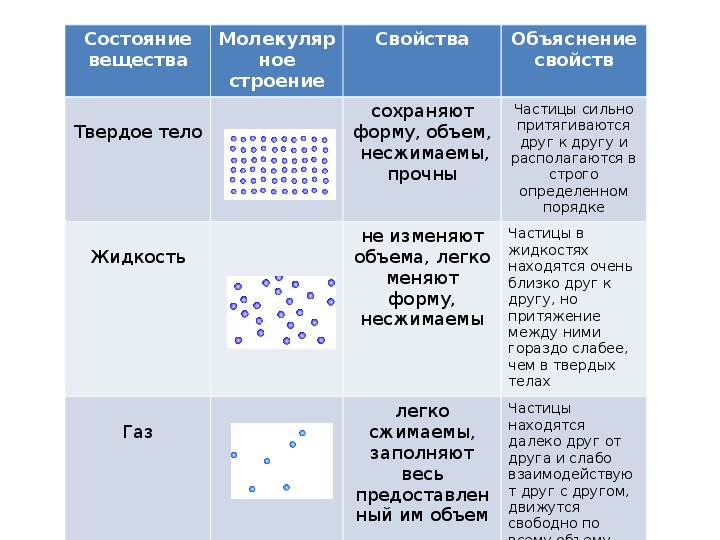 Точно так же газы создают опасное давление во время многих промышленных процессов и являются загрязняющими веществами или отходами, которые больше всего воздействуют на атмосферу.
Точно так же газы создают опасное давление во время многих промышленных процессов и являются загрязняющими веществами или отходами, которые больше всего воздействуют на атмосферу.
. Твердое агрегатное состояние характеризуется тем, что его частицы имеют сильные взаимодействия. Следовательно, они испытывают на себе всю гравитационную силу планеты, поэтому они определяют свои собственные объемы независимо от того, в каких контейнерах они находятся, оставляя различные полые или пустые пространства.
Твердые тела характеризуются существованием в виде кристаллических или аморфных тел в зависимости от степени расположения их частиц. Они также обладают другими свойствами, такими как твердость, непроницаемость и плотность.
Некоторые примеры твердых тел:
-Лед
-Кости
— Сухой лед
— Уголь
-Графит
-Алмаз
— Минералы
-Выходите
— Скалы
— Дерево
— Мясо
— Растительные волокна
— Пластмассы
— Текстильные волокна
— Металлы
— Твердые жиры
— Сплавы
-Очки
-Йод
— Металлокомплексы
Твердые вещества в целом являются наиболее желательными веществами, поскольку их легче всего хранить и с ними легче всего обращаться. Точно так же они соответствуют телам, с которыми мы можем больше всего взаимодействовать с нашими органами чувств. Именно по этой причине разработка новых материалов почти всегда вызывает больший интерес, чем открытие новых жидкостей или газов.
Точно так же они соответствуют телам, с которыми мы можем больше всего взаимодействовать с нашими органами чувств. Именно по этой причине разработка новых материалов почти всегда вызывает больший интерес, чем открытие новых жидкостей или газов.
. Хотя он не считается одним из основных состояний вещества вместе с твердым, жидким или газообразным, правда в том, что коллоидное состояние довольно распространено в природе и в промышленность, охватывающая огромное количество смесей.Именно коллоидное состояние бывает не в чистых веществах, а в смесях, где один из компонентов диспергирован в более крупной фазе.
Будучи смесью, две фазы представляют свои собственные агрегатные состояния. Например, дисперсная фаза может быть твердой, тогда как основная или дисперсионная фаза также может быть твердой, газообразной или жидкой. Есть несколько вариантов и комбинаций. Поэтому в природе встречается много коллоидных тел.
Есть несколько вариантов и комбинаций. Поэтому в природе встречается много коллоидных тел.
Некоторые примеры коллоидных веществ:
-Облака
-Дым
— Туман и туман
-Кровь
-Мороженое
-Молоко
-Майонез
-Томатный соус
-Сливочное масло
— Желе
-Арахисовое масло
-Бумаги
-Окрашенное стекло
-Картины
— Косметика
-Сыр
-Фарфор
— Пена
— Зефир
Однако суспензии как таковые находятся вне агрегатных состояний вещества, так как взаимодействия между их компонентами не такие «интимные», как в случае с коллоидами.
Это просто смеси, свойства которых не слишком отличаются от того, что известно для жидкостей или твердых тел. Например, грязь, навозная жижа, просто считается «водой с большим количеством почвы».
Агрегатное состояние плазмы Плазменная лампа В агрегатном состоянии плазмы проход экзотической материи. Мы больше не говорим об атомах, молекулах или ионах, а говорим о протонах, нейтронах и электронах. Он возникает, когда газ подвергается сильному электрическому удару или подвергается сильному нагреву.Когда это происходит, он ионизируется, то есть теряет электроны, чтобы получить положительный заряд.
Мы больше не говорим об атомах, молекулах или ионах, а говорим о протонах, нейтронах и электронах. Он возникает, когда газ подвергается сильному электрическому удару или подвергается сильному нагреву.Когда это происходит, он ионизируется, то есть теряет электроны, чтобы получить положительный заряд.
По мере потери электронов образуются газообразные ионы, пока, наконец, их атомные ядра не станут голыми. Тогда получится «золотой суп» из протонов, нейтронов и электронов. В этом супе частицы имеют коллективное поведение, что означает, что их движения напрямую влияют на движения их соседей. Они не проявляют такого свободного поведения, как газы.
Плазма характеризуется яркими и горячими веществами, из которых состоит звездная «ткань».Следовательно, они находятся в звездах и на нашем Солнце , возможно, являясь самым распространенным состоянием материи во Вселенной. Однако они могут возникнуть и здесь, на Земле.
Некоторые примеры плазмы:
— Пожар
— Электрические лучи
-Неоновые огни
— Лазеры
— Люминесцентные лампы
-Солнечные ветры
— Туманности
— Плазменные телевизоры
— Хвост кометы
Степень ионизации плазмы и, следовательно, ее энергия могут варьироваться в зависимости от плазмы, которую можно использовать в приложениях и инструментах повседневной жизни.
Предсказанный учеными Альбертом Эйнштейном и Сатьендрой Нат Бозе, конденсат Бозе-Эйнштейна представляет собой состояние, в котором бозоны, в данном случае атомы рубидия или натрия, агломерируются в самом низком энергетическом состоянии при очень низких температурах, касаясь абсолютного нуля.
При этих температурах атомы агломерируются или конденсируются таким образом, что ведут себя так, как если бы они были единым целым: суператомом.
Агрегатное состояние нейтроновНейтронная материя на несколько шагов опережает плазму.Теперь условия, в которых находятся частицы, настолько интенсивны, что протоны и электроны сливаются, образуя нейтроны. Поэтому у вас будет невообразимое количество сильно сжатых нейтронов.
Состояние агрегации нейтронов обнаружено у знаменитых нейтронных звезд, входящих в состав интереснейших небесных тел и изучаемых астрономией. Некоторые придумали термин «нейтроний» для вещества, состоящего исключительно из нейтронов, и он послужил источником вдохновения для многих произведений научной фантастики.
До сих пор говорили о взаимодействиях, которые существуют между атомами, протонами, нейтронами, электронами, молекулами и т. д., образуя различные агрегатные состояния материи. Идя еще дальше, граничащее с фантазией, взаимодействия между фотонами света возможны. Однако не просто любой свет, а очень низкоэнергетический.
Чтобы заставить фотоны очень низкой энергии взаимодействовать и, таким образом, сформировать «фотонные молекулы» из двух или трех фотонов, необходимо заставить их пройти через облако замороженных атомов рубидия.При этих температурах и условиях фотоны входят в облако по отдельности и покидают его парами или тройками.
Предполагается, что однажды такие взаимодействия можно будет использовать для хранения информации в квантовых компьютерах, что сделает их гораздо более мощными и быстрыми.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Агрегатные состояния: типы, изменения и характеристики
Мы объясним, что такое агрегатные состояния и как они классифицируются. Кроме того, каковы их характеристики и изменения, которые они представляют?
Что такое агрегатные состояния?
Агрегатные состояния материи (или просто состояния материи ) называются фазами или моментами, которые представляют различные известные вещества , в соответствии с существующими силами соединения между составляющими их частицами.Традиционно известны четыре фазы вещества: жидкая, твердая, газообразная и плазменная.
Каждая из этих фаз или моментов, называемых «состояниями», имеет свои физические характеристики , отличные от тех, которые одно и то же вещество представляет в других различных состояниях, несмотря на то, что его химическое строение (атомный состав частиц) не вообще не измениться. которые их составляют).
которые их составляют).
Таким образом, понятно, что все вещество находится в одном типе фазы в данный момент , но может быть переведено в другой тип путем изменения температуры и/или давления, которым оно подвергается, что приводит к серии физические процессы, называемые «методами фазового перехода»: затвердевание, плавление, сублимация, осаждение, конденсация, испарение, ионизация и деионизация.
Типы состояний вещества
Можно довести вещество до агрегатных состояний, не встречающихся в природе.Известны четыре типа состояний вещества: твердое, жидкое, газообразное и плазменное , каждое из которых отличается такими переменными, как твердость, сопротивление, пластичность, текучесть, объем и сцепление, а также отношениями между определяемыми им частицами.
Однако можно привести материю к агрегатным состояниям, которые обычно не встречаются в природе, а скорее в очень специфических и контролируемых лабораторных условиях: конденсат Бозе-Эйнштейна, конденсат Ферми, сверхтвердая или кварк-глюонная плазма, последнее все еще гипотетично в природа.
Твердотельный
Твердые тела обладают малой или нулевой текучестью.Твердое состояние распознается, потому что материя имеет определенное тело, с собственным объемом и постоянной формой , в зависимости от рассматриваемого вещества. Его атомы формируют узкие и жесткие структуры, которые оказывают сопротивление внешним силам.
В общем, они устойчивы к фрагментации , обладают малой или нулевой текучестью, высокой связностью и памятью формы, которая придает им эластичность, то есть способность восстанавливать свою форму, если они удалены из исходной конфигурации.
Примерами материи в твердом состоянии являются лед, камень, керамика, дерево, кость .
Жидкое состояние
Жидкости не имеют определенной формы и мало связаны. Вещество в жидком состоянии имеет гораздо более слабое соединение между своими атомами , чем в случае твердых тел, что придает ему текучесть, его основную характеристику.
Это означает, что материя не имеет определенной формы, но принимает форму сосуда, в котором она содержится.
В общем, жидкая материя имеет меньшую когезию , кинетическую энергию движения, текучесть, диффузию, небольшую сжимаемость и сжатие в присутствии холода (кроме воды).
Примерами веществ в жидком состоянии являются вода, ртуть, кровь, молоко .
Газообразное состояние
Газы имеют очень низкую плотность.Вещество в газообразном состоянии называется «газом» и больше всего состоит из слабо связанных частиц , расширенных и обладающих очень небольшой силой притяжения, что не позволяет им иметь определенную форму и объем.
Высвобождение газа фактически заставляет его свободно расширяться, пока он не заполнит контейнер, в котором он содержится.
Газы имеют очень низкую плотность , так как их частицы имеют относительный беспорядок: они движутся очень быстро.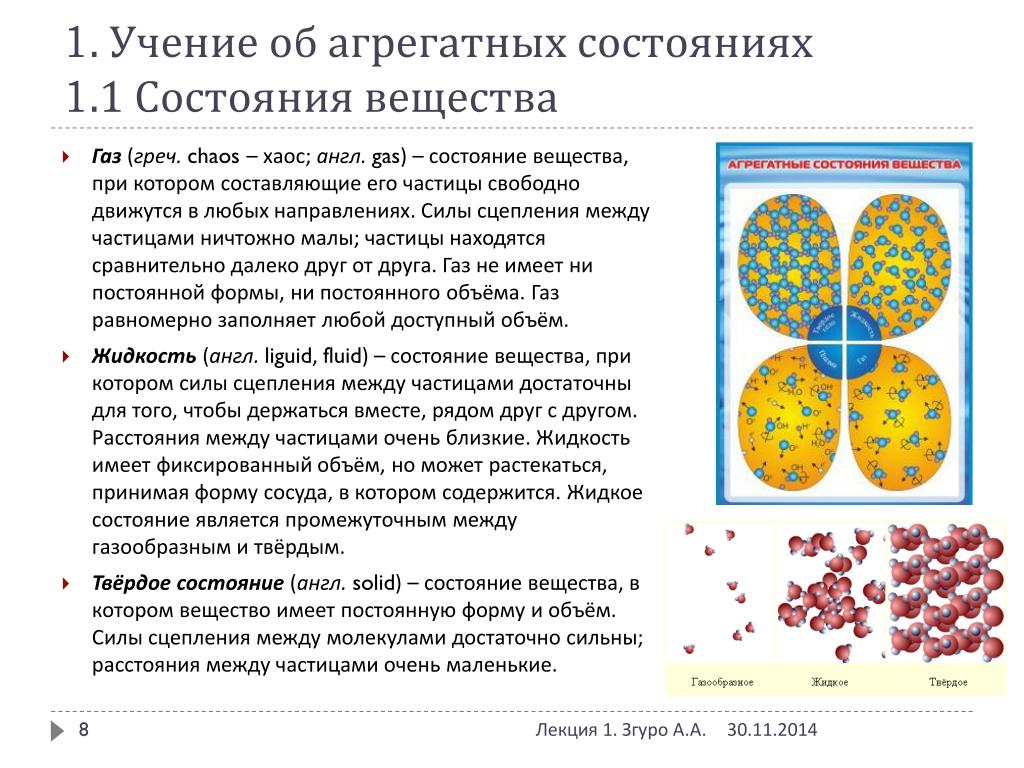
Они также имеют низкую реакцию на действие гравитации, почти нулевое сцепление и переменный объем , но очень высокую компрессионную способность.
Примерами газов являются озон , природный газ от приготовления пищи, гелий , а также газы, составляющие атмосферу .
Статус плазмы
Плазменное состояние может проводить электричество.Когда мы говорим о плазме или веществе в плазменном состоянии, мы говорим о ионизированном газе , то есть о том, атомы которого утратили свою электронейтральность и образуют анионы (-) или катионы (+).
Это означает, что плазменное состояние похоже на газ, но со свойствами, совершенно отличными от свойств «холодного газа» , такими как его склонность проводить электричество или его сильный отклик на магнитные поля.
Существует два типа плазмы:
- Холодная плазма .Что он не вызывает ожогов, потому что его частицы движутся не так быстро, как его электроны.

- Горячая плазма . В котором атомы сталкиваются друг с другом при движении (и теряют электроны) и при этом генерируют свет и тепло.
Примером плазменной материи является огонь или даже солнце, или содержимое плазменных ламп.
Изменения в твердотельном состоянии
Сухой лед является примером сублимации.Твердое агрегатное состояние может стать жидким или газообразным в результате процессов, известных как:
- Fusion .Переход из твердого состояния в жидкое. В общем случае требуется повышение температуры, которое заставляет почти покоящиеся частицы двигаться и расширять расстояние между ними, ослабляя связь, а, следовательно, и структуру соединения. Примером этого процесса является нагрев металлов на сталелитейных заводах, чтобы им можно было придать форму, а затем дать им вернуться к твердости (при охлаждении).
- Сублимация . Переход из твердого состояния в газообразное (без прохождения через жидкость).
 Как правило, для этого требуются определенные условия давления, такие как те, которых достигают снег или лед на горных вершинах, где они никогда не достигают температуры плавления, а сразу переходят в пар.Мы можем видеть этот эффект в сухом льду (замороженный CO 2 ).
Как правило, для этого требуются определенные условия давления, такие как те, которых достигают снег или лед на горных вершинах, где они никогда не достигают температуры плавления, а сразу переходят в пар.Мы можем видеть этот эффект в сухом льду (замороженный CO 2 ).
Изменения жидкого состояния
Жидкое агрегатное состояние может стать твердым или газообразным в результате процессов, известных как:
- Затвердевание . Переход из жидкого состояния в твердое при приложении давления к жидкости. Как следствие, происходит потеря кинетической энергии (тепла), в результате чего частицы начинают двигаться гораздо медленнее, пока не составят неподвижную (геометрическую в случае кристаллизации) и постоянную структуру.Примером этого является затвердевание воды.
- Замораживание . Переход из жидкого состояния в твердое при снижении температуры ниже точки замерзания жидкости.
- Испарение .
 Переход из жидкости в газ, как правило, обусловлен повышением температуры жидкости, что вызывает разрыв ее и без того непрочных связей между частицами и, следовательно, потерю ее сцепления. Вот что происходит, когда мы кипятим воду.
Переход из жидкости в газ, как правило, обусловлен повышением температуры жидкости, что вызывает разрыв ее и без того непрочных связей между частицами и, следовательно, потерю ее сцепления. Вот что происходит, когда мы кипятим воду.
Изменения газообразного состояния
При кристаллизации происходит переход из газообразного состояния в твердое.Газообразное состояние может стать твердым, жидким или плазменным в соответствии со следующими процессами:
- Конденсация и сжижение . Эти два процесса связаны с переходом из газообразного состояния в жидкое. Конденсация происходит за счет потери кинетической энергии (охлаждения), как это происходит в облаках высоко в атмосфере во время водооборота . Разжижение происходит из-за увеличения давления, которое заставляет частицы сближаться и снова соединяться.
- Обратное осаждение или сублимация .Это название, данное переходу из газообразного состояния в твердое, которое также можно назвать кристаллизацией.
 Это происходит, например, в замороженном воздухе, водяной пар которого переходит непосредственно в кристаллы льда.
Это происходит, например, в замороженном воздухе, водяной пар которого переходит непосредственно в кристаллы льда. - Ионизация . Возникает за счет потери электронов атомами газа, за счет увеличения движения его частиц, что приводит к состоянию плазматической агрегации.
Изменения в статусе плазмы
Вещество в плазменном состоянии может вернуться в газообразное состояние посредством процесса, называемого деионизацией, при котором тепло удаляется, а его частицы восстанавливают потерянные электроны , снова становясь газом.
Другие агрегатные состояния
В настоящее время проводятся эксперименты с многочисленными различными агрегатными состояниями, в результате которых появляются конкретных веществ, таких как феррожидкости , аэрографены и целый ряд новых материалов.
Вышеупомянутый контент, опубликованный в Collaborative Research Group, предназначен только для информационных и образовательных целей и был разработан со ссылкой на надежные источники и рекомендации экспертов в области технологий.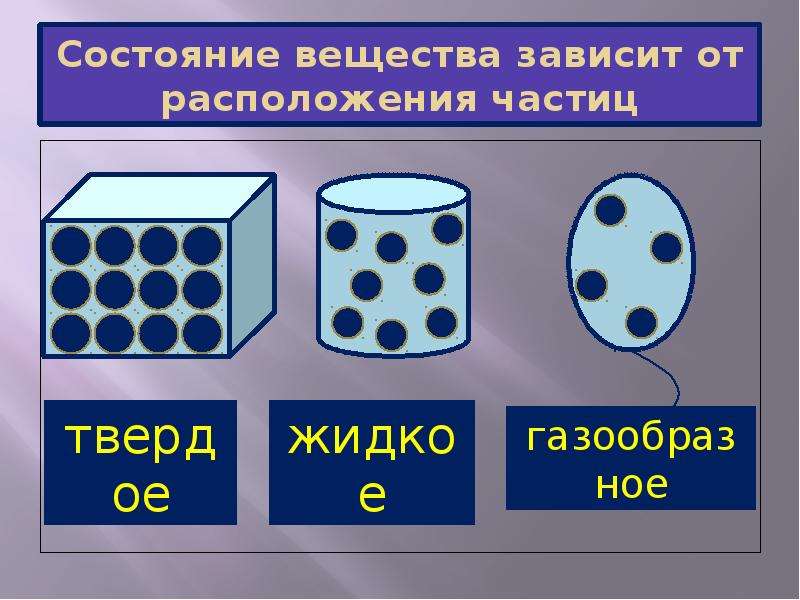



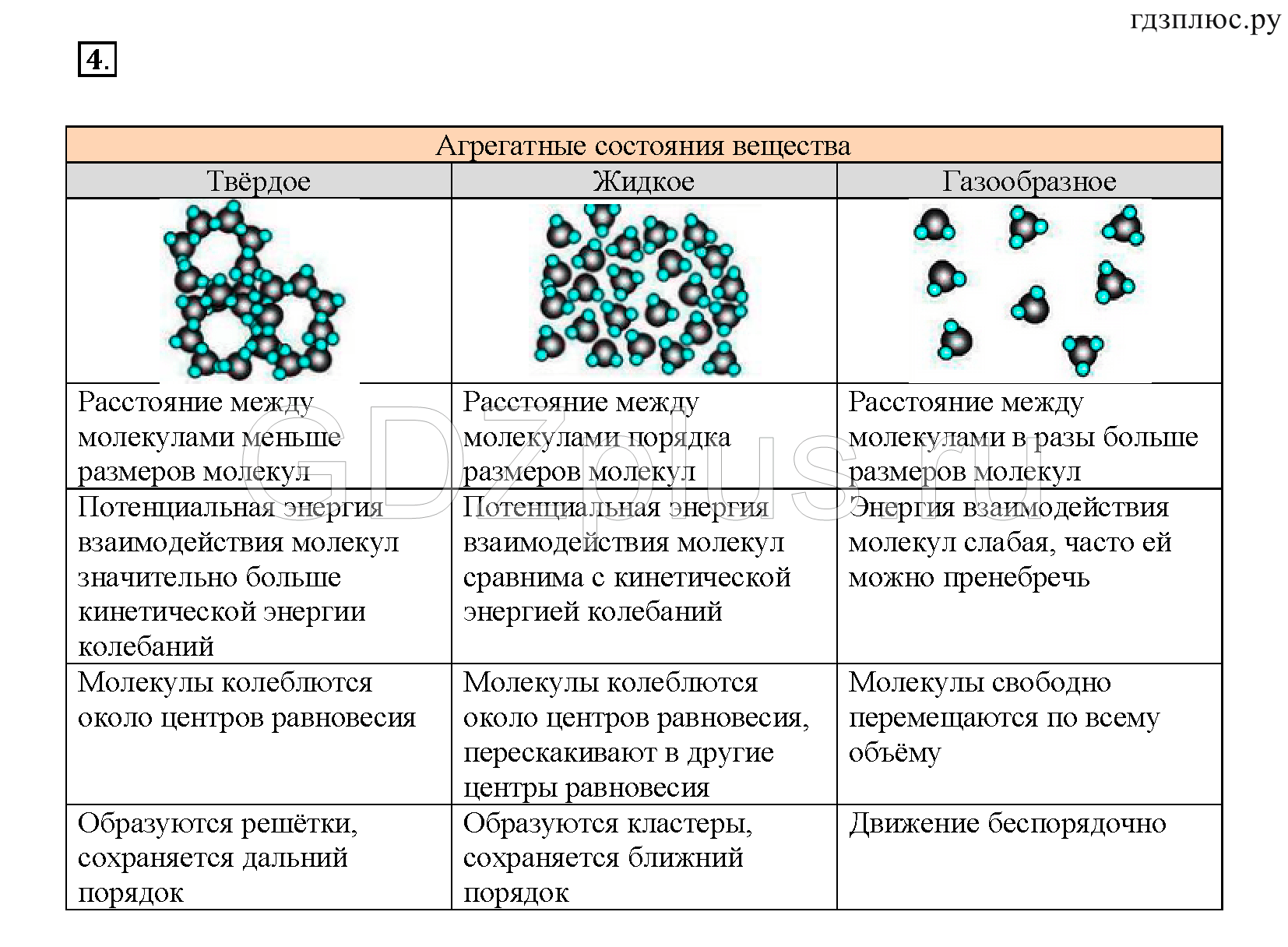

 Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа. Молекулы вступают в контакт друг с другом только тогда, когда они случайным образом сталкиваются. Силы между атомами или молекулами недостаточно сильны, чтобы удерживать их вместе.
Молекулы вступают в контакт друг с другом только тогда, когда они случайным образом сталкиваются. Силы между атомами или молекулами недостаточно сильны, чтобы удерживать их вместе.
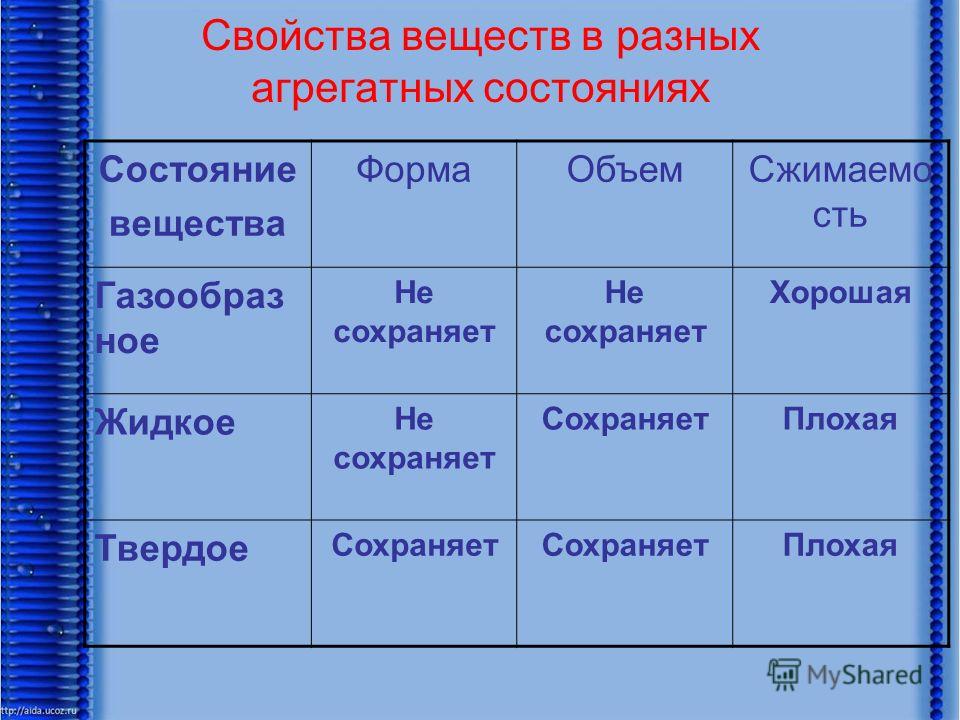

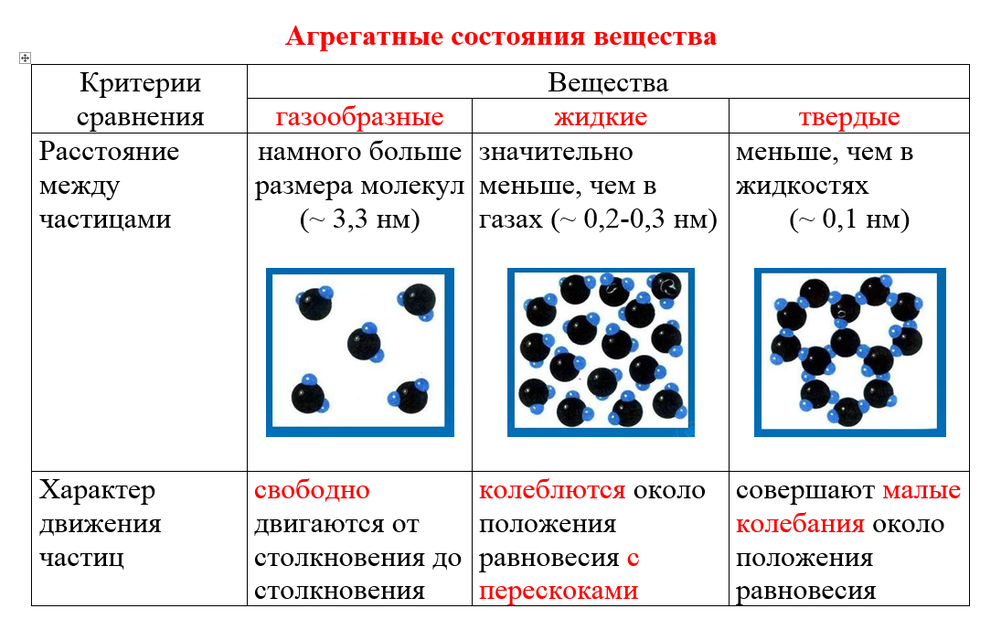 Как правило, для этого требуются определенные условия давления, такие как те, которых достигают снег или лед на горных вершинах, где они никогда не достигают температуры плавления, а сразу переходят в пар.Мы можем видеть этот эффект в сухом льду (замороженный CO 2 ).
Как правило, для этого требуются определенные условия давления, такие как те, которых достигают снег или лед на горных вершинах, где они никогда не достигают температуры плавления, а сразу переходят в пар.Мы можем видеть этот эффект в сухом льду (замороженный CO 2 ). Переход из жидкости в газ, как правило, обусловлен повышением температуры жидкости, что вызывает разрыв ее и без того непрочных связей между частицами и, следовательно, потерю ее сцепления. Вот что происходит, когда мы кипятим воду.
Переход из жидкости в газ, как правило, обусловлен повышением температуры жидкости, что вызывает разрыв ее и без того непрочных связей между частицами и, следовательно, потерю ее сцепления. Вот что происходит, когда мы кипятим воду. Это происходит, например, в замороженном воздухе, водяной пар которого переходит непосредственно в кристаллы льда.
Это происходит, например, в замороженном воздухе, водяной пар которого переходит непосредственно в кристаллы льда.