Химия X10 — задачи и реакции
“Химия X10” решает дз и контрольные.
• Подходит для 7, 8, 9, 10 и 11 классов
• Работает без интернета
• 800 000 скачавших
▶ РЕШЕНИЕ ЗАДАЧ
Вводим: “дано” и “найти”
Получаем: решенную задачу с ходом решения и ответом
Типы решаемых задач:
• по формулам
• на растворы
• на смеси
• по уравнению реакции
• на избыток и недостаток
Не решает задачи на вывод формулы вещества
▶ ХИМИЧЕСКИЕ РЕАКЦИИ
Находит уравнения реакций по введенной части
8000 реакций доступны без интернета
▶ ЦЕПОЧКИ ПРЕВРАЩЕНИЙ
Решает открытые цепочки.
Вводим:
Cu = CuO = CuCl2 = Cu(OH)2
Получаем:
1) Cu + h3SO4 = CuO + SO2 + h3O
2) 4CuO + 2Nh5Cl = 3Cu + CuCl2 + N2 + 4h3O
3) 2NaOH + CuCl2 = 2NaCl + Cu(OH)2
▶ РАССТАНОВКА КОЭФФИЦИЕНТОВ
Расставляет коэффициенты подбором и методом электронного баланса.
Вводим:
h3 + O2 = h3O
Получаем:
2h3 + O2 = 2h3O
▶ МОЛЯРНЫЕ МАССЫ
Считает молярные массы сложных веществ.
Вводим: Cu(OH)2
Получаем:
98 г/моль. Найдем в таблице Менделеева все элементы, из которых состоит Cu(OH)2. Это: Cu, O и H…
▶ ФОРМУЛЫ ДЛЯ ЗАДАЧ
Формулы разбиты на разделы с величинами: масса, молярная масса и т.д.
Для каждой записаны готовые формулы: масса: m = nM, m = ρV и другие.
▶ ШПАРГАЛКИ
Школьный курс химии доступен оффлайн. В нем 70 тем по неорганической и 90 по органической химии.
▶ ТАБЛИЦА МЕНДЕЛЕЕВА
Можно посмотреть: период, группу, атомную массу, класс, валентности, тип кристаллической решетки, цвет, температуры плавления и кипения, электронную конфигурацию, энергетические уровни, электроотрицательность
▶ ЗАЩИТА ОТ УЧИТЕЛЯ: звонок от мамы и часы
Игорь списывает на итоговой контрольной. Учительница это заметила и идет забирать телефон.
“Извините, мама звонит”, — говорит Игорь и показывает телефон.
“Выйди на коридор и ответь”, — предлагает она.
Игорь выходит из класса.
 За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс.
За дверью жмет в левый верхний угол экрана — и вместо звонка снова решенная задача. Он в спокойной обстановке смотрит решение и возвращается в класс.Мама не звонила. Игорь включил защиту от учителя.
В “Химии X10” 2 вида защиты: звонок мамы и часы. Часы работают работают по умолчанию, звонок есть в Pro-версии
——
“Pro-версия” — это услуга по месячной подписке. Она дает бесконечные кристаллы и открывает функции, которые доступны только в “Pro-версии”: защиту от учителя «Звонок мамы» и подробное решение задач. “Pro-версия” стоит 1.99 USD (эквивалент в местной валюте) в неделю.
Подписка будет обновляться автоматически, если не отключить автоматическое продление не позже чем за 24 часа до истечения срока текущей подписки. Оплата будет взиматься со счета iTunes в течение 24 часов до окончания текущего срока подписки.
Политика конфиденциальности:
http://appcrab. net/privacy-policy
net/privacy-policy
Условия пользования:
http://appcrab.net/terms-of-use
Как решать (составлять) молекулярные уравнения
В ходе изучения химии часто возникают вопросы, связанные с составлением молекулярных уравнений реакций. Какие вещества реагируют друг с другом и как узнать, идет ли реакция? Нужно ли расставлять коэффициенты в уравнении реакции?
Молекулярные уравнения – это запись, которая позволяет понимать какие молекулы, и в каком количестве вступали в реакцию и в какие новые молекулы они превратились в ходе химической реакции.
4Mg + 5H2SO4 (конц.) = 4MgSO 4 + H2S ↑ + 4H2O
Перед нами химическая реакция, где Mg + H2SO4 (конц.) – исходные (израсходованные) вещества, то есть вещества, вступившие в химическую реакцию, а MgSO4 + H2S ↑ + H2O – это вещества, которые образовались в ходе химической реакции. Они называются продуктами реакции. Часто составления химических реакций достаточно знать к каким классам относятся исходные вещества, что бы понимать будет ли между ними реакция, если вещество проявляет кислотные свойства, то оно будет реагировать с веществом с основными свойствами. Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Часто составления химических реакций достаточно знать к каким классам относятся исходные вещества, что бы понимать будет ли между ними реакция, если вещество проявляет кислотные свойства, то оно будет реагировать с веществом с основными свойствами. Амфотерные соединения проявляют химическую двойственность, что позволяет им реагировать как с веществами с кислотными свойствами, так и с основными. Кроме общих химических свойств для различных классов веществ (металлы, неметаллы, оксиды кислотные, амфотерные и основные, кислоты, основания, амфотерные гидроксиды) существуют и специфические свойства,характерные для определенных веществ.
Разберем общие правила, которые позволят составлять молекулярные уравнения.
1. Реакции замещения идут лишь, когда более активный металл замещает, то есть встает на место менее активного металла в сложном веществе. Для определения активности следует использовать «электрохимический ряд напряжения металлов», в котором металл, находящийся левее активнее, то есть сильнее металла, стоящего правее, а значит, кто левее сможет вытеснять из сложных веществ, например солей, те металлы, которые правее.
2Al + 3Zn = Al2O3 + 3Zn
Электрохимический ряд напряжения металлов в порядке ослабления активности металлов, ослаблении восстановительных свойств
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
2. Реакции ионного обмена идут до конца, когда в ходе химической реакции образуется в продуктах реакции газ, осадок или вода. Важно отметить, что может быть одновременное образование воды и осадка, или двух осадков. Выделение газа, образование осадка это видимые признаки химической реакции. В таблице растворимости можно посмотреть является ли основание, соль или кислота нерастворимым соединением.
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
3. Важным правилом при составлении молекулярных уравнений является расстановка стехиометрических коэффициентов. Количество атомов одного и того же элемента в левой части от знака равно должно быть равным количеству атомов в правой части уравнения.
Ca(OH)2 + 2CO2= Ca(HCO3)2
В данном случае, количество атомов кальция в левой и правой части = 1, количество углерода равно 2, водород тоже уравнен, в исходных веществах и в продуктах реакции по 2 водорода, а кислорода по 6 атомов.
4. В ходе некоторых реакций образуются неустойчивые вещества, которые сразу же разлагаются, а значит нужно написать в продуктах реакции сразу выделяющийся газ и воду.
H2CO3 = CO2 ↑ +H2O
H2SO3 = SO2 ↑ +H2O
NH4OH = NH3 ↑ + H2O
Пример:
H2SO4 + K2CO3 = K2SO4 + H2CO3 – неверная запись молекулярного уравнения
H2SO4 + K2CO3 = K2SO4 + CO2 ↑ + H2O – верное уравнение.
5. Если в ходе химической реакции образуется газ, то стоит поставить знак «↑», что символизирует, что образующийся газ улетел. Если образуется осадок, то «↓», что будет означать, что в ходе реакции образовалось нерастворимое в воде соединение.
ТЕСТ ПО ТЕМЕ ХИМИЧЕСКИЕ УРАВНЕНИЯ
Вариант 1.
ТЕСТ
ХИМИЧЕСКИЕ УРАВНЕНИЯ
Дополните.
1. Фамилия ученого, открывшего закон сохранения массы вещества в 1756 году, — … .
Установите правильную последовательность.
2. Закон сохранения массы веществ:
1) массе веществ
2) масса веществ
3) в результате ее
4) вступивших в реакцию
5) получившихся
6) равна
Установите соответствие.
3. Понятие:
1) реакция разложения
2) химические уравнения
3) реакция обмена
Определение:
а) реакция образования одного более сложного вещества из нескольких простых или сложных веществ;
б) реакция, при которой два сложных вещества обмениваются своими составными частями;
в) масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате ее;
г) условная запись химической реакции с помощью химических формул и математических знаков;
д) реакция, при которой из одного сложного вещества образуется два или более новых простых или сложных веществ, но более простого состава;
е) реакция, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
4. Уравнение реакции: 1) CuCl2 + Fe = FeCl2 + Cu 2) 4Fl + 3O2 = 2Al2O3
Тип химической реакции:
А) соединение
Б) обмена
В) разложение
Г) замещение
Установите правильную последовательность.
5. Алгоритм составления уравнения химической реакции между фосфором и кислородом:
1) найти коэффициенты к формулам в левой и правой частях уравнения
2) записать в правой части уравнения формулы продукта реакции
3) заменить стрелки на знак равенства
4) написать в левой части уравнения формулы фосфора и кислорода
5) проверить числа атомов фосфора и кислорода в левой и правой частях уравнения
6) написать стрелки между левой и правой частями уравнения
Установите соответствие
6. Тип химической реакции:
А) обмен
Б) разложение
Уравнение реакции:
1) CaO + CO2 = CaCO3
2) 2h3O = 2h3 + O2
3) Zn + 2HCl = ZnCl2 + h3
4) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Установите правильную последовательность.
7. Реакция замещения —
1) простого вещества
2) атомов элемента
3) атомами элементов
4) замещение
5) одного из
6) в сложном веществе
Дополните.
8. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции X + 2HCl = MgCl2 + h3: … и … .
9. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции Fe2O3 + h3 = X + h3O: … и … .
10. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции NaOH + h3SO4 = Na2SO4 + X: … и … .
Химия 8 класс. Урок 48. Вариант 2.
ТЕСТ
ХИМИЧЕСКИЕ УРАВНЕНИЯ
Дополните.
1. Фамилия ученого, подтвердившего закон сохранения массы веществ, — … .
Установите правильную последовательность.
2. Химическое уравнение:
1) химической реакции
2) и математических знаков
3) с помощью
4) условная запись
5) химических формул
Установите соответствие.
3. Понятие:
1) реакция замещения
2) реакция соединения
3) закон сохранения массы
Определение:
а) реакция образования одного более сложного вещества из нескольких простых или сложных веществ;
б) реакция, при которой два сложных вещества обмениваются своими составными частями;
в) масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате ее;
г) условная запись химической реакции с помощью химических формул и математических знаков;
д) реакция, при которой из одного сложного вещества образуется два или более новых простых или сложных веществ, но более простого состава;
е) реакция, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
4. Уравнение реакции: 1) Cu(ОН)2 = СuО + Н2О 2) Cu Cl2 + NaOH = Cu(OH)2 + 2NaCl
Тип химической реакции:
А) соединение
Б) обмена
В) разложение
Г) замещение
Установите правильную последовательность.
5. Алгоритм составления уравнения химической реакции между алюминием и оксидом железа (3):
1) найти коэффициенты к формулам в левой и правой частях уравнения
2) записать в правой части уравнения формулы продуктов реакции через знак «плюс»
3) заменить стрелки на знак равенства
4) написать в левой части уравнения формулы алюминия и оксида железа через знак «плюс»
5) проверить числа атомов алюминия, железа и кислорода в левой и правой частях уравнения
6) написать стрелки между левой и правой частями уравнения
Установите соответствие
6. Тип химической реакции:
А) соединение
Б) замещение
Уравнение реакции:
1) CaO + CO2 = CaCO3
2) 2h3O = 2h3 + O2
3) Zn + 2HCl = ZnCl2 + h3
4) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Установите правильную последовательность.
7. Реакция разложения —
1) двух или более
2) образованного из одного
3) новых простых
4) более простого состава
5) сложного вещества
6) или сложных веществ
Дополните.
8. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции CuO + X = h3O + Cu: … и … .
9. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции Au2O3 = X + O2: … и … .
10. Формула исходного веществ Х и сумма коэффициентов в уравнении реакции Al + CuCl2 = AlCl3 + X: … и … .
Химия 8 класс. Урок 48.
1. Закончите уравнения и расставьте коэффициенты:
1) Fl + ? = Al2O3
2) CuO + C = ? + CO2
3) Pb3O4 + h3 = Pb + ?
4) AgBr = ? + Br2
5) ? + ? = Na2S
6) CaO + CO2 = ?
7) Cu + HgCl2 = ? + Hg
8) ? = C + h3
2. Закончите уравнения реакций, расставьте коэффициенты и укажите тип реакций.
1) N2 + h3 =
2) CO + O2 =
3) MgO + h3 =
4) Al + Cl2 =
5) KOH + h3SO4 =
6) Fe3O4 + h3 =
7) MnO2 + Al =
8) Ca + HCl =
9) NO + O2 =
10) h3S + O2 =
11) Ch5 + O2 =
12) CaO + P2O5 =
13) Fe2O3 + HCl =
14) Cu(OH)2 + h3SO4 =
3.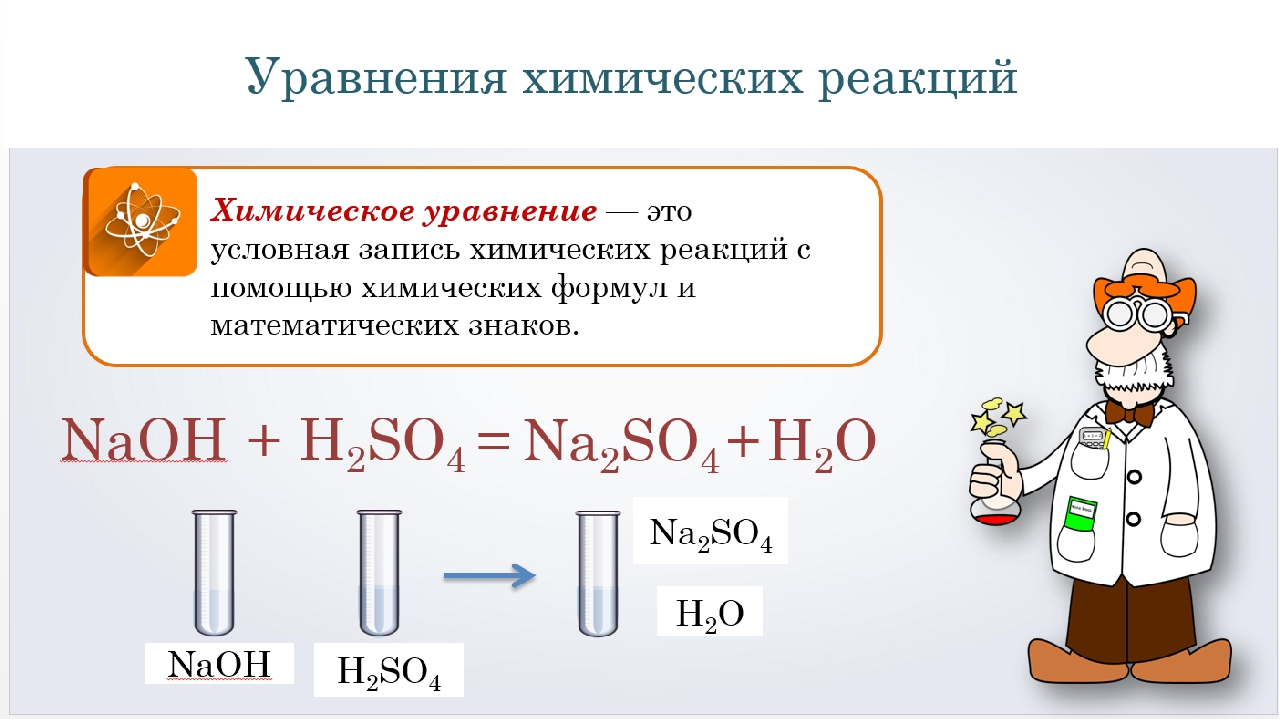 Напишите уравнения реакций по схеме:
Напишите уравнения реакций по схеме:
1) Ca CaO Ca (OH)2
2) C CO2 h3CO3 ?
Химия 8 класс. Урок 48.
1. Закончите уравнения и расставьте коэффициенты:
1) Fl + ? = Al2O3
2) CuO + C = ? + CO2
3) Pb3O4 + h3 = Pb + ?
4) AgBr = ? + Br2
5) ? + ? = Na2S
6) CaO + CO2 = ?
7) Cu + HgCl2 = ? + Hg
8) ? = C + h3
2. Закончите уравнения реакций, расставьте коэффициенты и укажите тип реакций.
1) N2 + h3 =
2) CO + O2 =
3) MgO + h3 =
4) Al + Cl2 =
5) KOH + h3SO4 =
6) Fe3O4 + h3 =
7) MnO2 + Al =
8) Ca + HCl =
9) NO + O2 =
10) h3S + O2 =
11) Ch5 + O2 =
12) CaO + P2O5 =
13) Fe2O3 + HCl =
14) Cu(OH)2 + h3SO4 =
3. Напишите уравнения реакций по схеме:
1) Ca CaO Ca (OH)2
2) C CO2 h3CO3 ?
Химия 8 класс. Урок 48.
1. Закончите уравнения и расставьте коэффициенты:
1) Fl + ? = Al2O3
2) CuO + C = ? + CO2
3) Pb3O4 + h3 = Pb + ?
4) AgBr = ? + Br2
5) ? + ? = Na2S
6) CaO + CO2 = ?
7) Cu + HgCl2 = ? + Hg
8) ? = C + h3
2. Закончите уравнения реакций, расставьте коэффициенты и укажите тип реакций.
Закончите уравнения реакций, расставьте коэффициенты и укажите тип реакций.
1) N2 + h3 =
2) CO + O2 =
3) MgO + h3 =
4) Al + Cl2 =
5) KOH + h3SO4 =
6) Fe3O4 + h3 =
7) MnO2 + Al =
8) Ca + HCl =
9) NO + O2 =
10) h3S + O2 =
11) Ch5 + O2 =
12) CaO + P2O5 =
13) Fe2O3 + HCl =
14) Cu(OH)2 + h3SO4 =
3. Напишите уравнения реакций по схеме:
1) Ca CaO Ca (OH)2
2) C CO2 h3CO3 ?
Химия 8 класс. Урок 48.
1. Закончите уравнения и расставьте коэффициенты:
1) Fl + ? = Al2O3
2) CuO + C = ? + CO2
3) Pb3O4 + h3 = Pb + ?
4) AgBr = ? + Br2
5) ? + ? = Na2S
6) CaO + CO2 = ?
7) Cu + HgCl2 = ? + Hg
8) ? = C + h3
2. Закончите уравнения реакций, расставьте коэффициенты и укажите тип реакций.
1) N2 + h3 =
2) CO + O2 =
3) MgO + h3 =
4) Al + Cl2 =
5) KOH + h3SO4 =
6) Fe3O4 + h3 =
7) MnO2 + Al =
8) Ca + HCl =
9) NO + O2 =
10) h3S + O2 =
11) Ch5 + O2 =
12) CaO + P2O5 =
13) Fe2O3 + HCl =
14) Cu(OH)2 + h3SO4 =
Член Европейской ассоциации русских репетиторов, преподаватель по химии высшей категории с 15 летним стажем, стаж репетиторской деятельности — 9 лет.
Программа обучения
Введение в химию, 7 классВведение в химию – 7 класс Данный курс не ставит задачу, опередить школьное изучение химии, снабдить запасом знаний, чтобы в 8 классе школьнику было проще. Задача курса — доступно и понятно объяснить сложные законы природы, научить устанавливать причинно-следственные связи между свойствами веществ, их составом, и строением, чтобы изучение такой интересной науки химии не превратилось в заучивание без понимания. Курс поможет подготовиться к участию в олимпиадах по химии и различных интеллектуальных соревнованиях. Каждое занятие строится на рассмотрении и изучении теории, и решении различных задач для закрепления изученного, от базовых, до задач из олимпиад различного уровня. Предусмотрены упражнения для самостоятельного выполнения, чтобы ученик мог убедиться, что он усвоил теорию. Занятия проводятся один раз в неделю, продолжительность каждого занятия 2 часа (астрономических) с перерывами. Программа курса
Олимпиадная химия , 8-9 классОлимпиадная химия – 8-9 класс Целью данной программы является развитие интереса школьников к химии, углубления знаний по химии, полученных при изучении химии в школе для успешного участия в олимпиадах и интеллектуальных соревнованиях различного уровня. Содержание разбито на тематические блоки, охватывающие все основные разделы химии, встречающиеся на олимпиадах. Слушатели научатся применять различные подходы к решению задач, видеть их структуру, освоят порядок действий и способы оформления. Каждое занятие строится на рассмотрении и изучении теории, и решении различных задач для закрепления изученного, рассмотрении олимпиадных задач прошлых лет. Разноуровневые задания для закрепления позволят каждому выбрать посильную трудность. Занятия проводятся один раз в неделю, продолжительность каждого занятия 2 часа (астрономических) с перерывами.
Программа курса
Подготовка к ОГЭ по химии, 9 классПодготовка к ОГЭ по химии – 9 класс Курс будет актуален для тех, кто решил сдавать ОГЭ по химии. На занятиях будет подробно рассмотрена теория, соответствующая спецификации контрольно-измерительных материалов ОГЭ по химии. Задания по каждой теме, от базового до сложного уровня, позволят качественно проработать материал. Курс подходит для слушателей с разным уровнем знаний. Большое внимание уделяется взаимосвязи строения и свойств веществ, поэтому содержание построено таким образом, что сначала рассматриваются вопросы общей химии, затем полученные знания закрепляются при рассмотрении конкретных классов веществ и химии элементов. Расчетные задачи и особенности протекания реакций, несмотря на то, что заявлены как отдельные темы, находят место при изучении практически каждой темы, что позволяет лучше усвоить эти элементы знаний, традиционно вызывающие сложности у учеников. На каждом занятии подробно рассматривается теория, разбираются задания по теме разного уровня сложности, предусмотрены упражнения для самостоятельного выполнения, чтобы ученик мог убедиться, что он усвоил теорию. Занятия проходят один раз в неделю, продолжительность 2 часа (астрономических) с перерывами. Программа курса
Занятия проходят на платформе zoom
Продолжиельность курса: 1 октября 2021 г. Расписание занятий
Зарегистрироваться
Остались вопросы? Звоните!
8 (800) 302-77-42 8 (495) 542-65-62 8 (495) 743-29-02
|
Онлайн тесты по химии
Многие известные нам химические элементы имеют порой удивительные свойства. Проверьте свои знания о металлах и неметаллах в этом тесте по химии.
Проверьте свои знания о металлах и неметаллах в этом тесте по химии.
Некоторые химические элементы были открыты совершенно случайно, а для открытия других ученые проделывали огромную целенаправленную работу.
Рейтинг теста: Сложность теста: нормальный Вопросов: 20Химия знакомит нас с множеством разнообразных веществ и элементов, которые обладают интересными и, порой, неожиданными свойствами.
Как по-научному называется тефлон? Из какого метала изготавливали медаль «За пьянство»? Каким газом наполняют аэростаты? Интересные факты о металлах и неметаллах в этом тесте!
Рейтинг теста: Сложность теста: нормальный Вопросов: 27Разнообразие химических элементов в природе удивляет. Еще более удивительными могут оказаться их свойства. Узнайте больше в этом тесте по химии!
Еще более удивительными могут оказаться их свойства. Узнайте больше в этом тесте по химии!
В этом тесте вам предлагается потренироваться в знании обозначений химических элементов и их соединений, а также в знании их свойств.
Рейтинг теста: Сложность теста: простой Вопросов: 20Какие-то химические вещества знакомы человечеству с древних времен, какие-то открыты совсем недавно. Но все они находят применение в той или иной области деятельности людей.
Но все они находят применение в той или иной области деятельности людей.
Знаете ли вы, какой химический элемент используется в освещении улиц города? А какое вещество сыграло роковую роль в жизни Наполеона Бонапарта?
Рейтинг теста: Сложность теста: простой Вопросов: 20Каждый день мы так или иначе имеем дело с металлами. А многое ли вы знаете об их свойствах и об истории их открытия?
А многое ли вы знаете об их свойствах и об истории их открытия?
В науке химии очень много сложных формул, правил и законов. Однако от этого она не перестает быть интересной. Узнайте несколько занимательных фактов о металлах в этом тесте.
Рейтинг теста: Сложность теста: нормальный Вопросов: 20Химические элементы бывают очень полезными и очень опасными, но все они для чего-то необходимы. История открытия химических элементов также очень разнообразны и интересны.
История открытия химических элементов также очень разнообразны и интересны.
Каждый день, часто даже не задумываясь об этом, мы сталкиваемся с различными химическими веществами. Узнайте больше о химии в быту в этом тесте.
Рейтинг теста: Вопросов: 20Химические уравнения — презентация онлайн
1.
 Химические уравнения
Химические уравнения3. Атомно-молекулярная теория
Молекулы состоят из атомов.Атомы при химических реакциях не
изменяются и не исчезают,
происходит лишь их
перегруппировка, т.е. образуются
новые вещества.
Следовательно, их общая масса
также не изменяется
4. Основные правила составления химических уравнений:
1. В левой части уравнения пишутся формулы веществ,вступающих в реакцию – исходные вещества.
2. В правой части – формулы получившихся веществ –
продукты реакции.
3. Между исходными веществами и продуктами
реакции ставится стрелка.
4. На основании закона сохранения веществ
уравниваются атомы.
5.Число атомов каждого элемента в правой части равно
числу атомов этого же элемента в левой части.
6. Уравнивание атомов производится с помощью
подбора коэффициентов перед формулами веществ.
5. Химическим уравнением называют условную запись химической реакции с помощью химических формул и математических знаков.

6. При разложении воды образуются два газообразных вещества — Н2 и О2.
h3Oh3 + O2
2h3O == 2h3 + O2
Уравнение химической реакции
7. Алгоритм составления уравнения химической реакции
1. Записать формулы исходныхвеществ.
2. Справа от формул исходных
веществ (после стрелки)
записать формулы продуктов
реакции.
3. Расставить коэффициенты.
8. Горение магния
Mg + O2MgO
2Mg + O2 = 2MgO
9. Работа у доски
1. Получение углекислого газа:С + О2
2. Разложение ртути:
HgO
3. Окисление натрия:
Na + O2
10. Соотношение количеств веществ, участвующих в реакции.
Коэффициенты показывают не толькочисло молекул каждого вещества, но и
соотношение количеств веществ,
которые участвуют в реакции.
Например: 2Н2 + О2 = 2Н2О
Для образования воды(2 моль)
необходимо столько же моль водорода(2
моль) и в 2 раза меньше кислорода (1
моль)
11.
 Задача: Определить количество вещества кислорода, образующегося в результате разложения 4 моль воды. Алгоритм решения задачи:
Задача: Определить количество вещества кислорода, образующегося в результате разложения 4 моль воды. Алгоритм решения задачи:1. Составить уравнение реакции.
2. Составить пропорцию, определив
количества веществ по уравнению реакции и
по условию, неизвестное берем за Х.
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти Х.
12. Задача: Какое количество кислорода потребуется для полного сгорания 3 моль меди?
Ответ: n (О2) = 1,5 мольОнлайн-консультация по подготовке к ЕГЭ по химии
Урок провёл руководитель комиссии по разработке контрольных измерительных материалов ЕГЭ по химии, кандидат педагогических наук Дмитрий Юрьевич Добротин.Расписание консультаций по другим предметам.
Что изменится в заданиях ЕГЭ по химии в 2021 г.?
Раньше в заданиях 19 и 20 было точно известно количество правильных ответов, теперь оно известно не будет.
В заданиях в развёрнутым ответом при выборе веществ, между которыми нужно составить уравнение реакции, нужно учесть дополнительные фильтры: классификационные признаки, признаки протекания реакций,. .
.
Какие задания в ЕГЭ по химии были самыми трудными?
Задание 34 – расчетная задача. Всего может быть 5 видов расчетов:
→ Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
→ Расчёты массы (объема, количества вещества), продукта реакции, если одно из веществ дано в виде раствора с определенной массовой доле растворенного вещества.
→ Расчёты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в виде избытка (имеет примеси)
→ Расчёты массовой или объемной доли выхода продукта реакции от теоретически возможного
→ Расчёты массовой доли (массы) химического соединения в смеси
Как лучше выполнять работу, чтоб уложиться в отведенное время?
Должен быть хорошо сформированный и отработанный уровень системных знаний, нужно уметь работать с информацией, представленной в тексте условия задания, нужно уметь правильно распределять свое время на экзамене.
Как будет оценено оригинальное решение задачи, которое не совпадает с приведенным в критериях решением от разработчиков?
Не бойтесь решать так, как вы научились вместе со своим учителем или репетитором. Важно, чтобы решение четко соответствовало условию задания.
Важно, чтобы решение четко соответствовало условию задания.
Что самое важное при подготовке к экзамену?
→ Понимать суть заданных физических величин и основных формул, отражающих взаимосвязь этих величин
→ Понимать химическую сущность процессов, описанных в условии задания
→ Уметь составлять уравнения химических реакций
→ Уметь выстроить логическую последовательность использования величин
→ Уметь составить и решить алгебраические уравнения.
| Онлайн-балансировщик
Введение в химический балансир
Калькулятор химических уравнений балансировки работает разумно, так как есть искусственный интеллект. Это онлайн-инструмент, который работает в цифровом формате и дает быстрые результаты. Калькулятор уравнений балансировки выполняет функцию балансировки данного уравнения, а также рассчитывает коэффициенты.
Используется алгоритм исключения Гаусса-Жордана, но с небольшими изменениями. Калькулятор химических уравнений балансировки бесплатный и простой в использовании.
Калькулятор химических уравнений балансировки бесплатный и простой в использовании.
Вы можете использовать калькулятор уравнений балансировки для онлайн-расчетов или найти полное руководство по балансировке химических уравнений с примерами.
Связанный: Узнайте, что подразумевается под химическим выходом и сколько типов выхода у нас есть в химии.
Что такое химическое уравнение?
Химическое уравнение показывает общее химическое превращение реагентов в продукты. Реагенты — это то, с чего вы начинаете, а продукты — это то, что образуется.Есть два способа написания химических уравнений: словесное уравнение и символьное уравнение. Точно так же вы можете рассчитать его вручную или с помощью калькулятора химического уравнения.
$$ \ text {NaOH} \; \; + \; \; \ text {HCl} \; \ rightarrow \; $$
$$ \ text {NaCl} \; \; + \; \; H_2O $$
Гидроксид натрия (NaOH)
Соляная кислота (HCl)
Хлорид натрия (NaCl)
Вода (H 2 O)
Онлайн-калькулятор химических уравнений баланса позволяет мгновенно сбалансировать химические уравнения.
Как записывается химическое уравнение?
При написании химического уравнения реагенты находятся слева перед стрелкой, а продукты — справа. Это остается неизменным при использовании калькулятора сбалансированных уравнений. Стрелка —> показывает, что реакция необратима. Он показывает направление реакции. Знак плюс указывает на то, что на каждой стороне уравнения присутствует более одного реагента или продукта.
Словесное уравнение дает хорошее резюме, а символьное уравнение дает более подробную информацию.Он показывает больше информации и позволяет нам увидеть, сколько атомов и молекул участвует в каждой реакции. Те, кто все еще борется с этой концепцией, должны использовать преобразование словесных уравнений в химические уравнения и выучить их полностью.
Чтобы узнать больше о молекулах, воспользуйтесь нашим калькулятором граммов в молекулы. Или, если вы хотите узнать о доле молей, у нас также есть калькулятор мольных соотношений для вашего обучения и практики.
Как сбалансировать химическое уравнение?
Если мы смешаем железо (Fe) с двумя молекулами кислорода (O 2 ) вместе, вы получите соединение (Fe 2 O 3 ) и то, что обычно называют ржавчиной.Итак, это хороший пример, показывающий, что происходит, когда вы оставляете свой велосипед под дождем.
Велосипед в основном состоит из стали. Сталь чиста на 95%, но железо смешивается с дождем, который представляет собой просто воду, а вода содержит кислород. Итак, железо и кислород соединяются вместе, и тогда на вашем велосипеде появляется раздражающее коричневое вещество Fe 2 O 3 , которое вы знаете как ржавчину.
$$ \ text {Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Чтобы сбалансировать это уравнение вручную без использования балансировщика уравнений, нам нужно иметь такое же количество железа в левой части, что и в правой части.Итак, с левой стороны у него один атом железа, а с правой стороны — два атома железа. Чтобы сделать их равными, добавьте количество двух молекул в левой части.
Чтобы сделать их равными, добавьте количество двух молекул в левой части.
$$ \ text {2Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Итак, сделаем то же самое с кислородом. Слева у нас есть два атома кислорода, но с правой стороны у нас есть три атома кислорода. Нам нужно сделать это равным, но калькулятор произведения химического уравнения автоматически делает это.Итак, с левой стороны нанесены два атома кислорода с полуторными молекулами.
$$ \ text {2Fe} \; \; + \; \; 1.5O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Теперь у нас есть то же точное количество железа и кислорода в левой части, что и в правой части. Но мы возвращаемся с проблемой, потому что никогда не бывает половины молекулы.
Но мы заметили, что здесь у нас есть полторы молекулы кислорода. Мы также можем найти молекулярную массу онлайн с помощью калькулятора молекулярной массы.Так как же нам избавиться от этой половины молекулы? Ответ на этот вопрос — умножить обе части на два.
Теперь у нас есть сбалансированное химическое уравнение. Калькулятор химического уравнения продукта работает с той же формулой и процедурой. Чтобы узнать о периоде полураспада элемента или вещества, попробуйте калькулятор периода полураспада, чтобы вы могли практиковаться во время выполнения.
Связано: Узнайте, как уравновесить окислительно-восстановительную реакцию в основной среде?
Как пользоваться калькулятором балансировки химических уравнений?
Calculatored предлагает множество онлайн-инструментов и калькуляторов, а наш калькулятор уравнений баланса бесплатный и простой в использовании.С помощью нашего калькулятора химической реакции вы легко сможете сбалансировать уравнение. Просто введите свое несбалансированное уравнение в полосе ввода и нажмите «БАЛАНС». Избегайте ненужных пробелов.
Есть еще один способ сбалансировать ваше уравнение, используя наш калькулятор балансирующих химических уравнений. У нас есть периодическая таблица, помещенная в наш калькулятор химических уравнений, просто нажмите на значения и нажмите кнопку «БАЛАНС» на нашем калькуляторе химического балансира, чтобы получить необходимые результаты.
У нас есть периодическая таблица, помещенная в наш калькулятор химических уравнений, просто нажмите на значения и нажмите кнопку «БАЛАНС» на нашем калькуляторе химического балансира, чтобы получить необходимые результаты.
Мы надеемся, что вам понравился наш калькулятор балансировки химических уравнений.Помимо нашего балансировщика химических уравнений, у нас также есть другие онлайн-калькуляторы, связанные с химией.
Если вы хотите рассчитать теоретическую доходность по ее формуле, просто воспользуйтесь нашим калькулятором теоретической доходности. Или, если вы хотите узнать, что такое процентная доходность и как ее рассчитать, попробуйте воспользоваться бесплатным онлайн-калькулятором процентной доходности.
Пожалуйста, поделитесь с нами своими ценными отзывами, чтобы мы могли постоянно улучшаться.
Net Ionic Equation Calculator | ProtonsTalk
Чистый калькулятор ионных и ионных уравнений — это бесплатный онлайн-инструмент, который показывает структуру, константу равновесия, сбалансированное уравнение, свойства вещества с химическими формулами и названиями. Калькулятор сбалансированного чистого ионного уравнения Инструмент делает прогнозирование быстрым и простым и отображает ответ за доли секунды.
Калькулятор сбалансированного чистого ионного уравнения Инструмент делает прогнозирование быстрым и простым и отображает ответ за доли секунды.
Как пользоваться калькулятором Net Ionic Equation Calculator?
Метод использования калькулятора уравнения ионной сети выглядит следующим образом:
1: Введите химическое уравнение в поле «Введите химическое уравнение».
2: Теперь нажмите кнопку «Баланс», чтобы получить уравнение выравнивания.
3: Наконец, для указанного химического уравнения появится окно с выходными данными.
Формат ввода
Входное уравнение должно быть в следующем формате
Fe + Cl2 -> FeCl3
Выход
На выходе калькулятора
- Сбалансированное уравнение
- Структура (как Льюиса, так и скелетная)
- Названия реагентов и продуктов
- Термодинамика реакции
- Энтальпия, энтропия, свободная энергия Гиббса
- Константа равновесия
- Скорость реакции
- Химические названия и Свойства вещества
Что такое химическое уравнение?
Химическое уравнение интерпретируется как символическое представление химической реакции, где реагенты указаны слева, а продукты — справа. Реагенты и продукты разделены стрелками. Каждое уникальное вещество в химической реакции разделено знаком плюс (+).
Реагенты и продукты разделены стрелками. Каждое уникальное вещество в химической реакции разделено знаком плюс (+).
Пример: Al + HCl → AlCl 3 + H 2
Вопрос: Уравновесить данное химическое уравнение: CH 4 + O 2 → CO 2 + H 2 O
Решение: Вычисленное уравнение для данного химического уравнения:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Посмотреть другие научные калькуляторы от Protonstalk
Что такое сбалансированное чистое ионное уравнение? Чистые ионные уравнения — это в основном уравнение, уравновешенное массой и зарядом.Здесь
1. Балансировка по массе означает, что по обе стороны уравнения есть равные массы каждого элемента.
2. Балансировка по заряду заключается в том, что общий заряд должен быть одинаковым с обеих сторон уравнения.
Основное различие состоит в том, что чистое ионное уравнение показывает только химические частицы, которые участвуют в реакции , тогда как полное ионное уравнение также включает в себя ионы -наблюдателя .
Химические уравнения и расчеты
Да, в этом разделе мы будем много заниматься «математикой», должен знать, что вам нужно, чтобы пройти любой достойный курс химии. Но не бойтесь, это в основном арифметика четвертого класса: простая пропорциональность и дроби. И даже если вы не планируете заниматься какой-либо серьезной химией в дальнейшем, вы найдете содержание этого урока отличным обзором этих тем, который позволит вам легко решать любое количество других числовых задач, которые возникают снова и снова в жизнь каждого.
1 Как читать и писать химические уравнения
В ходе химической реакции один или несколько реагентов превращаются в продукты :
реактивы → продукты
Цель химического уравнения состоит в том, чтобы выразить это отношение в терминах формул фактических реагентов и продуктов, которые определяют конкретное химическое изменение. Например, реакция ртути с кислородом с образованием оксида ртути может быть выражена уравнением
Например, реакция ртути с кислородом с образованием оксида ртути может быть выражена уравнением
Hg + O 2 → HgO 2
Иногда для удобства желательно указать физическое состояние (газ, жидкость или твердое вещество) одного или нескольких видов соответствующими сокращениями:
Hg (л) + O 2 (г) → HgO 2 (с)
C (графит) + O 2 (г) → CO 2 (г)
C (алмаз) + O 2 (г) → CO 2 (г)
Однако это всегда необязательно.
Химические уравнения
должны быть сбалансированы!По сути, это означает, что химические уравнения должны согласовываться с законом сохранения массы :
В контексте обычной химической реакции сохранение массы означает, что атомы не создаются и не разрушаются. Это требование легко удовлетворить, убедившись, что в обеих частях уравнения присутствует равное количество всех атомов.
Когда мы уравновешиваем уравнение, мы просто приводим его в соответствие с наблюдаемым фактом, что отдельные атомы сохраняются при химических изменениях.
Не существует установленного «рецепта» для уравновешивания обычных химических уравнений; Лучше всего начать с тщательного изучения избранных примеров, подобных приведенным ниже. Для получения дополнительной информации см. Рекомендации и примеры в главе 7 превосходного онлайн-учебника профессора Марка Бишопа Introduction to Chemistry
Полезные видеоролики по уравнениям балансировки
Руководство для начинающих по балансировке уравнений
(боземанбиол, 11 мин)
Уравнения балансировки
(MrB, 9½ мин)
Уравнения балансировки
(Хан, 14½ мин.)
Советы и приемы по уравновешиванию уравнений (IsaacsTeach, 7 мин.)
Пример задачи 1: Сгорание пропана Напишите вычисленное уравнение горения пропана C 3 H 8 в кислороде O 2 . Продуктами являются углекислый газ CO 2 и вода H 2 O.
Продуктами являются углекислый газ CO 2 и вода H 2 O.
Решение: Начните с написания несбалансированного уравнения
C 3 H 8 + O 2 → CO 2 + H 2 O
Обычно лучше всего начать с балансировки соединений, содержащих наименее распространенный элемент, поэтому сначала мы сбалансируем уравнение для углерода:
C 3 H 8 + O 2 → 3 CO 2 + H 2 O
Уравновешивая кислород, мы видим, что четное число молекул O 2 слева не может дать нечетное число атомов O, показанное справа.Не беспокойтесь об этом сейчас — просто используйте соответствующий дробный коэффициент:
C 3 H 8 + 3 ½ O 2 → 3 CO 2 + H 2 O
Наконец, мы уравновешиваем водород, добавляя больше воды справа:
C 3 H 8 + 7/2 O 2 → 3 CO 2 + 4 H 2 O
А, но теперь кислород снова отключен — исправление этого также позволяет нам избавиться от фракции в левой части:
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
Однако часто случается, что мы получаем дробный коэффициент, как в этом варианте вышеприведенного примера.
Напишите вычисленное уравнение горения этана C 2 H 6 в кислороде O 2 . Продуктами являются углекислый газ CO 2 и вода H 2 O.
.Решение: Начните с написания несбалансированного уравнения
C 2 H 6 + O 2 → CO 2 + H 2 O
…затем сбалансируйте углерод:
C 2 H 6 + O 2 → 2 CO 2 + H 2 O
Давайте уравновесим водород следующим образом:
C 2 H 6 + O 2 → 2 CO 2 + 3 H 2 O
… но теперь нам нужно слева нецелое число молекул кислорода:
C 2 H 6 + 7/2 O 2 → 2 CO 2 + 3 H 2 O
Я предпочитаю просто оставить его в этой форме; нет ничего плохого в 7/2 = 3 ½ моля O 2 , и мало что можно получить, умножая каждый член на два — если только ваш учитель не является настоящим приверженцем того, что делает это «по книге», и в этом случае Вам лучше написать
2 C 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O
2 Чистые ионные уравнения
Ионные соединения обычно диссоциируют в водном растворе; таким образом, если мы объединяем растворы нитрата серебра AgNO 3 и хлорида натрия NaCl, мы действительно объединяем четыре разных вида: катионы (положительные ионы), Ag + и Na + и анионы (отрицательные ионы) НЕТ 3 — и Cl —. Бывает, что когда ионы Ag + и Cl — объединяются, они объединяются с образованием нерастворимого осадка хлорида серебра. Чистое уравнение для этой реакции —
Бывает, что когда ионы Ag + и Cl — объединяются, они объединяются с образованием нерастворимого осадка хлорида серебра. Чистое уравнение для этой реакции —
Ag + ( водн. ) + Cl — ( водн. ) → AgCl ( водн. )
Чистые ионные уравнения на
(ChemUTAustin, 4 мин.) — ВПЕРЕД ⇒
.(CarringtonChem, 9 мин.) — GO ⇒
.(химводкасты, 8½ мин.) — GO⇒
Обратите внимание, что
- ионы NO 3 — и Cl — не принимают непосредственного участия в этой реакции; уравнение выражает только чистое изменение , которое представляет собой удаление ионов серебра и хлорида из раствора с образованием нерастворимого твердого вещества.
- символ ( водн. ) означает, что ионы находятся в водном растворе и, таким образом, гидратированы, или присоединены к молекулам воды.

- символ ( s ) указывает на то, что вещество AgCl существует в твердом состоянии. Когда в результате реакции, протекающей в растворе, образуется твердое вещество, оно известно как осадок . Об образовании осадка часто говорят подчеркиванием.
Прогнозирование результата при смешивании растворенных солей
Из приведенного выше примера с хлоридом серебра ясно, что значимое чистое ионное уравнение может быть записано только в том случае, если два иона объединяются с образованием нерастворимого соединения.Чтобы сделать это определение, полезно знать правила растворимости , которые когда-то требовалось запомнить всем студентам-химикам, но в настоящее время их обычно получают из таблиц, подобных приведенной ниже.
| Анион (отрицательный ион) | Катион (положительный ион) | Растворимый? |
|---|---|---|
| любой анион | ионов щелочных металлов (Li + , Na + , K + и т. Д.) Д.) | да |
| нитрат, NO 3 — | любой катион | да |
| ацетат, CH 3 COO — | любой катион, кроме Ag + | да |
| галогенид-ионы Cl — , Br — или I — | Ag + , Pb 2+ , Hg 2 2+ , Cu 2+ | № |
| галогенид-ионы Cl — , Br — или I — | любой другой катион | да |
| сульфат, SO 4 2– | Ca 2+ , Sr 2+ , Ba 2+ , Ag + , Pb 2+ | № |
| сульфат, SO 4 2– | любой другой катион | да |
| сульфид, S 2 — | ионов щелочных металлов или NH 4 + | да |
| сульфид, S 2 — | Be 2+ , Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ , Ra 2+ | да |
| сульфид, S 2 — | любой другой катион | № |
| гидроксид, OH — | ионов щелочных металлов или NH 4 + | да |
| гидроксид, OH — | Sr 2+ , Ba 2+ , Ra 2+ | слегка |
| гидроксид, OH — | любой другой катион | № |
| фосфат, PO 4 3–, карбонат CO 3 2– | ионов щелочных металлов или NH 4 + | да |
| фосфат, PO 4 3–, карбонат CO 3 2– | любой другой катион | № |
Напишите чистые ионные уравнения того, что происходит при объединении водных растворов следующих солей:
а) PbCl 2 + K 2 SO 4
б) K 2 CO 3 + Sr (NO 3 ) 2
в) AlCl 3 + CaSO 4
г) Na 3 PO 4 + CaCl 2
Раствор: Используйте таблицу правил растворимости (выше), чтобы найти нерастворимые комбинации:
а) Pb 2+ ( водн. ) + SO 4 2– ( водн. ) → PbSO 4 ( с )
) + SO 4 2– ( водн. ) → PbSO 4 ( с )
б) Sr 2+ ( водн. ) + CO 3 2– ( водн. ) → SrCO 3 ( с )
в) нет чистой реакции
г) 3 Ca 2+ ( водн. ) + 2 PO 4 3– ( водн. ) → 3 Ca 3 (PO 4 ) 2 ( с )
(Обратите внимание на необходимость сбалансировать электрические заряды)
3 Соотношения масс в химических уравнениях
Базовая «химическая арифметика»
Сбалансированное химическое уравнение выражает относительное количество молей каждого компонента (продукта или реагента), но поскольку каждая формула в уравнении подразумевает определенную массу вещества (его молярную массу), уравнение также подразумевает, что между компоненты.Например, уравнение, описывающее горение окиси углерода до двуокиси углерода
2 CO + O 2 → 2 CO 2
Термин стехиометрия может относиться к любому типу расчета, который связывает количества реагентов и продуктов в химической реакции. Стехиометрия по сути является выражением принципа, согласно которому атомы сохраняют химические изменения.
Стехиометрия по сути является выражением принципа, согласно которому атомы сохраняют химические изменения.
Термин происходит от греческих слов στοιχεῖον stoicheion «элемент» и μέτρον metron «мера»
подразумевает следующие отношения:
Относительные массы, указанные в нижней строке, определяют стехиометрию реакции, то есть отношения между массами различных компонентов.Поскольку эти массы изменяются прямо пропорционально друг другу, мы можем определить, что составляет коэффициент преобразования (иногда называемый химическим коэффициентом ), который связывает массу любого одного компонента с массой любого другого компонента.
Пример задачи 4a: химический коэффициент и преобразование массы Оцените химический коэффициент и коэффициент преобразования, связывающий массу диоксида углерода с массой CO, потребляемого в реакции.
Решение: Из вышеприведенного блока массовое отношение CO 2 к CO в этой реакции составляет 88/56 = 1,57 ; это химический коэффициент для преобразования CO в CO 2 .
Коэффициент преобразования составляет всего 1,57 / 1, в котором явно указаны единицы массы:
(1,57 г CO 2 /1 г CO)
Стехиометрия уравнения по
(Хан, 10 мин) GO ⇒
.(Сандра Этеридж, 10 мин.) GO ⇒
.(TheChemistrySolution, 7 мин.) GO ⇒
.(химводкасты, 8½ мин.) — GO⇒
Но то же самое соотношение применимо к любому обычному набору единиц массы или веса, поэтому мы можем просто сказать, что отношение масс CO 2 к CO, выраженное приведенным выше уравнением, равно 1.57, что также является соотношением масс этих двух компонентов в уравнении. Это, в свою очередь, позволяет нам легко решать такие проблемы, как:
Пример задачи 4b: расчет массы-массы в различных единицах / промежуток>a) Сколько тонн CO 2 можно получить при сжигании 10 тонн CO?
b) Сколько кг CO необходимо сжечь, чтобы получить 20 кг CO 2 ?
Решения:
а) (1. 57 т CO 2 /1 т CO) × (10 т CO) = 15,7 т CO 2
57 т CO 2 /1 т CO) × (10 т CO) = 15,7 т CO 2
b) Обратите внимание, что ответ на этот вопрос должен относиться к окиси углерода, а не к CO 2 , поэтому мы записываем коэффициент преобразования в обратном порядке:
(1 кг CO / 1,57 кг CO 2 ) × (20 кг CO 2 ) = (20 / 1,57) г CO = 12,7 кг CO .
Разумен ли этот ответ? Да, потому что в этой реакции масса CO всегда должна быть меньше, чем масса CO 2 .
Освоение массово-массовых задач
Не рассчитывайте сдать химию, если вы не справитесь с проблемами, подобными перечисленным ниже; они часто возникают в самых разных контекстах. Если вы чувствуете необходимость в дополнительных рекомендациях, просмотрите одно из видеоуроков, перечисленных в нижней части этой страницы.
Пример проблемы 5
Руда FeS 2 может быть преобразована в важный промышленный химикат серную кислоту H 2 SO 4 с помощью ряда процессов. Если предположить, что преобразование завершено, сколько литров серной кислоты (плотность 1,86 кг L –1 ) можно получить из 50 кг руды?
Если предположить, что преобразование завершено, сколько литров серной кислоты (плотность 1,86 кг L –1 ) можно получить из 50 кг руды?
Решение: Как и большинство проблем, здесь можно выделить несколько более простых. Мы начинаем с определения стехиометрии в предположении, что вся сера в или заканчивается как H 2 SO 4 , что позволяет нам написать
FeS 2 → 2 H 2 SO 4
Хотя это «скелетное» уравнение является неполным (и, следовательно, не сбалансированным), оно сбалансировано по двум интересующим компонентам, и это все, что нам здесь нужно.Молярные массы двух компонентов составляют 120,0 и 98 г / моль –1 соответственно, поэтому уравнение можно интерпретировать с точки зрения масс как
[120 единиц массы] FeS 2 → [2 × 98 единиц массы] H 2 SO 4
Таким образом, из 50 кг руды получится (50 кг) × (196/120) = 81,7 кг продукта.
[ Проверьте : разумен ли этот ответ? Да, потому что коэффициент (196/120) близок к (200/120) = 5/3, поэтому масса продукта должна быть немного меньше, чем удвоенная масса израсходованной руды.]
Из информации о плотности находим, что объем жидкости H 2 SO 4 составляет
(81,7 кг) ÷ (1,86 кг L –1 ) = 43,9 L
[ Проверка : разумен ли этот ответ? Да, потому что плотность говорит нам, что количество литров кислоты будет немного больше, чем половина ее веса.]
Хлорид бария образует кристаллогидрат BaCl 2 · xH 2 O, в котором x молекул воды включены в твердое кристаллическое вещество на каждую единицу BaCl 2 .Эта вода может быть унесена теплом; если нагреть 1,10 г гидратированной соли и несколько раз повторно взвесить до тех пор, пока не прекратится дальнейшая потеря веса (т. е. потеря воды), конечный вес образца составит 0,937 г. Какое значение x в формуле гидрата?
е. потеря воды), конечный вес образца составит 0,937 г. Какое значение x в формуле гидрата?
Решение:
Первый шаг — найти количество молей BaCl 2 (молекулярная масса 208,2) из массы обезвоженного образца.
(0,937 г) / (208,2 г моль –1 ) = 0,00450 моль
Теперь найдите количество молей H 2 O (молекулярная масса 18), потерянных при сушке образца:
(1,10 — 0,937) г / (18 г моль –1 ) = 0,00905 моль
С учетом разумной погрешности измерения очевидно, что мольное отношение BaCl 2 : h3O = 1: 2. Формула гидрата: BaCl 2 · 2H 2 O .
4 Понимание ограничивающих реагентов
Большинство химических реакций, которые происходят в реальном мире, начинаются с более или менее произвольных количеств различных реагентов; обычно нам приходится прилагать особые усилия, если мы хотим обеспечить объединение стехиометрических количеств реагентов. Это означает, что один или несколько реагентов обычно присутствуют в избытке; их будет больше, чем может прореагировать, и некоторые останутся после того, как реакция закончится.При этом полностью израсходуется один реагент; мы называем это ограничивающим реагентом , потому что количество этого присутствующего вещества будет контролировать или ограничивать количества других потребляемых реагентов, а также количества производимых продуктов.
Это означает, что один или несколько реагентов обычно присутствуют в избытке; их будет больше, чем может прореагировать, и некоторые останутся после того, как реакция закончится.При этом полностью израсходуется один реагент; мы называем это ограничивающим реагентом , потому что количество этого присутствующего вещества будет контролировать или ограничивать количества других потребляемых реагентов, а также количества производимых продуктов.
Проблемы ограничения реагентов решаются так же, как и обычные проблемы стехиометрии, с одним дополнительным предварительным шагом: вы должны сначала определить, какой из реагентов является ограничивающим, то есть какой из них будет полностью израсходован.Для начала рассмотрим следующий очень простой пример
. Пример проблемы 7 Для гипотетической реакции 3 A + 4 B → [продукты] , определите, какой реагент будет полностью израсходован, когда мы объединим
a) эквимолярных количеств A и B;
б) 0,57 моль A и 0,68 моль B.
Решение:
a) Простая проверка уравнения ясно показывает, что требуется больше молей B, поэтому этот компонент будет израсходован (и, таким образом, является ограничивающим реагентом), оставляя после себя столько же молей A.
b) Сколько моль B прореагирует с 0,57 моль A? Ответ будет
(4/3 × 0,57 моль). Если это значение меньше 0,68 моль, то ограничивающим реагентом будет B, и вы должны продолжить решение проблемы, исходя из количества присутствующего B. Если ограничивающим реагентом является A, тогда все 0,57 моль A будут реагировать, оставляя часть B в избытке. Проработай это!
Сера и медь при совместном нагревании реагируют с образованием сульфида меди (I), Cu 2 S.Сколько граммов Cu 2 S можно получить из 10 г серы и 15 г меди?
Раствор: Из атомных масс Cu (63,55) и S (32,06) мы можем интерпретировать реакцию 2 Cu + S → Cu 2 S как
[2 × 63,55 = 127,1 единиц массы] Cu + [32,06 единиц массы] S
→ [159,2 единицы массы] Cu 2 S
Таким образом, для 10 г S потребуется (10 г S) × (127. 1 г Cu) / (32,06 г S) = 39,6 г Cu
1 г Cu) / (32,06 г S) = 39,6 г Cu
… что намного больше, чем то, что доступно, поэтому медь здесь является ограничивающим реагентом .
[Проверьте: разумен ли этот ответ? Да, потому что химический фактор (127/32) составляет примерно 4, что указывает на то, что сера вступает в реакцию с массой меди, примерно в четыре раза превышающей ее вес.]
Масса образовавшегося сульфида меди будет определяться массой доступной меди:
(15 г Cu) × (159,2 г Cu 2 S) / (127.1 г Cu) = 18,8 г Cu 2 S
[Проверьте: разумен ли этот ответ? Да, потому что химический коэффициент (159,2 / 127,1) немного больше единицы, что означает, что масса продукта немного превышает массу потребленной меди.]
Ограничивающие реагенты в быту
Концепция ограничения реагентов затрагивает всех нас в нашей повседневной жизни — и, как мы покажем во втором примере ниже, даже в поддержании самой жизни!
Соотношение воздух-топливо при сгорании
Сгорание — экзотермический процесс, в котором топливо соединяется с кислородом; полное сгорание углеводородного топлива, такого как метан или бензин, дает диоксид углерода и воду:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O (г)
Пример задачи 9: массовое отношение топлива к кислороду при сгорании метана Рассчитайте массовое отношение CH 4 к O 2 , необходимое для полного сгорания.
Раствор: Это просто отношение молярной массы CH 4 (16 г) к молярной массе двух молей дикислорода (2 x 32 г)
Таким образом (64 г) / (16 г) = 4/1 = 4,0 .
Для полного сгорания каждого кг метана расходуется 4 кг дикислорода, который доставляется воздухом. В классической горелке Бунзена воздух поступает через регулируемое отверстие рядом с основанием.Когда он полностью открыт, пламя синего цвета и достигает максимальной температуры, что указывает на то, что горение является приблизительно стехиометрическим. Если отверстие постепенно закрывается, внешний вид пламени изменяется, как показано на рисунке. В этих условиях кислород становится ограничивающим реагентом, и сгорание продолжается.
Неполное сгорание обычно нежелательно, поскольку при этом расходуется топливо, выделяется меньше тепла и выделяются такие загрязнители, как углеродная сажа. Энергетические процессы горения всегда должны протекать в режиме с ограничением количества топлива.
Энергетические процессы горения всегда должны протекать в режиме с ограничением количества топлива.
В обычных процессах горения источником кислорода является воздух. Поскольку только около 20 процентов молекул в сухом воздухе состоит из O 2 , объем подаваемого воздуха в пять раз больше, чем требуется для чистого O 2 . Расчет массового отношения воздуха к топливу («соотношение A / F»), применяемого инженерами по сжиганию, затруднен из-за различных молярных масс кислорода и воздуха.Для сжигания метана соотношение A / F составляет около 17,2. (Подробный расчет см. Здесь). Отношения A / F, которые превышают стехиометрические значения, называются бедным , в то время как те, при которых воздух становится ограничивающим компонентом, характеризуются как богатый . Чтобы обеспечить полное сгорание, обычно используют слегка обедненную смесь. Количество так называемого избыточного воздуха , обычно допускаемого к горелкам, варьируется от 5-10% для природного газа до 100% для определенных марок угля.
Для двигателей внутреннего сгорания, работающих на бензине (примерно соответствует
C 7 H 14 ) стехиометрическое соотношение A / F составляет 15: 1. Однако практические соображения требуют различных соотношений на разных этапах работы. Типичные значения варьируются от богатого передаточного числа для трогания с места или ускорения до передаточных чисел с небольшим наклоном при обычном вождении. Эти передаточные числа устанавливаются карбюратором с дополнительным управлением компьютером двигателя и датчиком кислорода в выхлопной линии в современных автомобилях или ручной дроссельной заслонкой в более ранних.
Аэробное и анаэробное дыхание
Нашему телу требуется постоянный источник энергии для поддержания нервной активности, синтеза белков и других важных биохимических компонентов, замены клеток и обеспечения мышечной деятельности. «Топливо» — носитель химической энергии — глюкоза, простой сахар, который высвобождается по мере необходимости из крахмалоподобного полимерного гликогена — формы, в которой хранится энергия, которую мы получаем из пищи.
Артериальная кровь переносит растворенную глюкозу вместе со связанным с гемоглобином диоксидом кислорода к отдельным клеткам, которые являются местами «горения» глюкозы:
C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
Чистая реакция и количество выделяемой энергии такие же, как если бы глюкоза была сожжена на открытом воздухе, но внутри клеток реакция протекает серией крошечных шагов, которые захватывают большую часть этой энергии для использования организмом, высвобождая только небольшая его часть в виде тепловой энергии (тепла).
Поскольку в этом процессе используется кислород из воздуха, которым мы дышим, он известен как аэробное дыхание . И, как и в любом эффективном процессе сгорания, ограничивающим реагентом здесь является глюкоза.
Но бывают случаи, когда при интенсивной физической активности мышцы потребляют глюкозу со скоростью, превышающей способность крови доставлять необходимое количество кислорода. В этих условиях клеточное дыхание переключается на альтернативный анаэробный режим :
В этих условиях клеточное дыхание переключается на альтернативный анаэробный режим :
C 6 H 12 O 6 → 2 CH 3 CH (OH) COOH
Как видно из этого уравнения, глюкоза расщепляется лишь частично (на молочную кислоту и ), и, таким образом, только часть ее химической энергии улавливается организмом.
Аэробные упражнения имеют множество преимуществ для здоровья, в том числе повышают способность организма поддерживать аэробное состояние. Но если вы занимаетесь бегом на короткие дистанции (спринт) или вас преследует тигр, снижение эффективности анаэробных упражнений может оказаться небольшой платой.
Видео
Видеоуроки из и других источников предоставляют альтернативные средства представления и объяснения концепций, которые могут с пользой дополнить печатное слово.Следующее рекомендуется для пользователей данного устройства.
Стехиометрия основной реакции
Предельные реагенты
Что вы должны уметь
Убедитесь, что вы полностью понимаете следующие важные идеи, изложенные выше. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Учитывая формулы реагентов и продуктов, запишите сбалансированное химическое уравнение реакции.
- Учитывая относительную растворимость, напишите сбалансированное уравнение чистых ионов для реакции между водными растворами двух ионных соединений.
- Напишите соответствующие химические коэффициенты преобразования для расчета масс всех компонентов химической реакции, когда масса любого отдельного компонента указана в любой системе единиц.
- Если указаны массы двух или более реагентов, укажите ограничивающий реагент и найдите массы всех компонентов, присутствующих после завершения реакции.
- Опишите, каким образом концепция ограничения реагентов относится к горению и упражнениям человека.
Концептуальная карта
Калькулятор стехиометрии — ezcalc.
 me
meЭтот онлайн-калькулятор стехиометрии находит стехиометрические коэффициенты для уравновешивания данного химического уравнения и вычисляет количества реагентов и продуктов реакции, как в молях, так и в граммах. Уравнения могут включать свободные электроны и электрически заряженные молекулы (ионы).
Вы можете ввести химическое уравнение вручную или вставить уравнение, скопированное с веб-страницы или текстового документа (включая файл DOC или PDF). Индексы, обозначенные с помощью тегов и html (например, H 2 O), а также обозначенные с помощью «крошечных» чисел, таких как ₂ или ₅ (например, H₂O), поддерживаются и автоматически преобразуются в нормальную форму. Ниже приводится более подробное руководство по синтаксису нашего калькулятора.
Стехиометрия реакции рассчитывается автоматически для сбалансированного уравнения, при этом количество молей соединений совпадает со стехиометрическими коэффициентами.Вы можете ввести необходимое количество молей или вес в граммах для одного из соединений в соответствующее поле, а затем нажать клавишу «Ввод», чтобы вычислить новые значения для остальных соединений.
Расчеты стехиометрии
Стехиометрия — это область химии, изучающая относительные количества реагентов и продуктов в химических реакциях. Для любого сбалансированного химического уравнения используются целые числа (стехиометрические коэффициенты), чтобы показать количества (в молях) как реагентов, так и продуктов.Зная молекулярную массу соединений, участвующих в реакции, легко найти массу этих соединений в граммах.
Итак, первый шаг в вычислениях стехиометрии — это уравновешивание химических уравнений. Это означает поиск стехиометрических коэффициентов для реагентов и продуктов. Это важно, потому что в химической реакции количество каждого элемента не меняется (закон сохранения массы). Таким образом, каждая сторона уравнения должна представлять одно и то же количество атомов любого химического элемента.В случае ионных реакций одинаковый электрический заряд должен присутствовать с обеих сторон уравнения.
Существует несколько методов балансировки химических уравнений. Но в случае сложных реакций с участием многих соединений предпочтительнее уравновесить уравнения алгебраическими методами, основанными на решении системы линейных уравнений.
Но в случае сложных реакций с участием многих соединений предпочтительнее уравновесить уравнения алгебраическими методами, основанными на решении системы линейных уравнений.
Наш калькулятор стехиометрии использует алгоритм исключения Гаусса-Жордана для решения набора линейных уравнений. Метод модифицирован для нахождения целочисленных коэффициентов.
Руководство по синтаксису
• Реагенты и продукты химической реакции разделены знаком равенства (=). Вещества разделены знаком плюс (+).
• Формулу вещества следует вводить, используя верхний регистр для первого символа в названии элемента и нижний регистр для второго символа (сравните: Co — кобальт и CO — окись углерода). Перед формулой не должно быть числового коэффициента.
• Индексы следует вводить как обычные числа после соответствующих элементов или групп, например.г. h3O для молекулы воды или (Nh5) 2SO4 для сульфата аммония.
• В формулах можно использовать круглые скобки (), квадратные скобки [] и фигурные скобки (фигурные скобки) {}. Также разрешены вложенные скобки, например [Co (Nh4) 6] Cl3. Степень вложенности не ограничена, но все скобки должны быть сбалансированы.
Также разрешены вложенные скобки, например [Co (Nh4) 6] Cl3. Степень вложенности не ограничена, но все скобки должны быть сбалансированы.
• Для обозначения иона укажите его заряд в фигурных скобках после соединения: {+2} или {2+}. Пример: H {+} + CO3 {2 -} = h3O + CO2.
• Чтобы включить электрон в химическое уравнение, используйте {-}, e.г. Fe {+3} + {-} = Fe.
• Не входите в состояние таких соединений, как твердые вещества (я), жидкости (l) или газы (g).
Использование калькулятора стехиометрии
При вводе химического уравнения вручную или при вставке скопированного уравнения оно автоматически преобразуется в «нормальную» форму в соответствии с приведенными выше правилами. Все пробелы игнорируются, а символ → преобразуется в =. Но символы ↑ и ↓ остаются на своих местах.
Обратите внимание, что как индексы, так и сборы могут быть обозначены в исходном документе с помощью тегов и html, например.г. SO 4 -2 , или обозначается «крошечными» символами, например SO₄⁻². Они также автоматически преобразуются в «нормальную» форму.
Они также автоматически преобразуются в «нормальную» форму.
Отдельный электрон может быть обозначен как e — (e — ) или e⁻ (с «крошечным» минусом).
Формат вывода
Используя соответствующее раскрывающееся меню, можно выбрать выходной формат для сбалансированного химического уравнения:
• Html — сбалансированное уравнение представлено с помощью тегов HTML для индексов и сборов.Одиночный электрон обозначается как e — . Нажав кнопку «Копировать в буфер обмена» (), вы можете скопировать результат «как есть», включая все теги, а затем вставить его на любую html-страницу. Однако, нажав Ctrl-A и Ctrl-C, вы можете скопировать результат без тегов и вставить его в документ DOC, сохранив должным образом отформатированные индексы и сборы.
• Малые индексы — сбалансированное уравнение представлено с помощью «крошечных» символов для индексов и сборов. Например, CO₃²⁻, где используются символы Unicode: ² = (\ u2083), ² = (\ u00B2), ⁻ = (\ u207B). Одиночный электрон обозначается как e⁻.
Одиночный электрон обозначается как e⁻.
• Нормальный — Сбалансированное уравнение представлено в соответствии с приведенным выше руководством по синтаксису.
Уведомления об ошибках
Существует ряд очевидных уведомлений в случае ошибки, обнаруженной в ходе первоначальной проверки введенного уравнения, например, Неожиданный символ или Скобки не сбалансированы . Особого внимания заслуживают следующие уведомления:
Неправильное уравнение — Введенное уравнение содержит химические элементы в левой части, которые отсутствуют в правой части, или наоборот.
Невозможная реакция — Введенное уравнение представляет собой невозможную реакцию. Например, уравнение (NH 4 ) 2 SO 4 = NH 4 OH + SO 2 имеет только тривиальное решение, когда все коэффициенты равны нулю.
Несколько независимых решений — Введенное уравнение можно сбалансировать бесконечным количеством способов. Обычно это сочетание нескольких разных независимых реакций. Например, уравнение H + O = H 2 O + HO не имеет единственного решения, потому что, например, два решения: 3H + 2O = H 2 O + HO и 4H + 3O = H 2 O + 2HO, которые не являются кратными друг другу.Уравнение можно разделить как H + O = H 2 O и H + O = HO, каждое из которых имеет уникальное решение.
Обычно это сочетание нескольких разных независимых реакций. Например, уравнение H + O = H 2 O + HO не имеет единственного решения, потому что, например, два решения: 3H + 2O = H 2 O + HO и 4H + 3O = H 2 O + 2HO, которые не являются кратными друг другу.Уравнение можно разделить как H + O = H 2 O и H + O = HO, каждое из которых имеет уникальное решение.
Элемент «…» не существует — Имя элемента, введенное в соответствии с приведенным выше руководством по синтаксису, не указывает на настоящий химический элемент. Иногда неизменная группа в химических соединениях заменяется фиктивным элементом, чтобы сбалансировать уравнение, которое в противном случае не может быть однозначно сбалансировано. В этом случае наш калькулятор сбалансирует химическое уравнение, но не вычислит стехиометрию реакции.
Пример расчета стехиометрии
Рассмотрим сжигание метилмеркаптана (CH 4 S или CH 3 SH), в результате которого образуется диоксид серы:
CH 4 S + O 2 → CO 2 + H 2 O + SO 2 ,
и ответьте на следующие вопросы:
a) Сколько граммов диоксида серы (SO 2 ) образуется при полном сгорании 4 г CH 4 S?
б) Сколько граммов SO 2 образуется, когда 4 г CH 4 S реагируют с 3 г O 2 ?
С помощью нашего калькулятора стехиометрии мы можем легко получить результат в кратчайшие сроки.
Сначала скопируйте приведенное выше уравнение как есть и вставьте в поле «Equation to Balance» калькулятора. Он немедленно преобразуется в «нормальную» форму. Затем нажмите кнопку «Рассчитать». В поле «Сбалансированное уравнение» будет результат:
CH 4 S + 3 O 2 = CO 2 + 2 H 2 O + SO 2 .
Ниже представлена таблица реагентов и продуктов реакции с указанием количества каждого соединения.Количество молей соединений указано таким же, как стехиометрические коэффициенты в уравнении. Количество каждого соединения в граммах рассчитывается как произведение молекулярной массы соединения и соответствующего числа молей.
Эти поля являются интерактивными, и вы можете изменить любое значение суммы, а все остальные поля автоматически пересчитываются. Итак, приступим к решению вышеперечисленных задач.
a) Введите 4 в поле граммов для CH 4 S и нажмите клавишу «Enter» на клавиатуре. Вы получите сразу 5,326725 г за SO 2 .
Вы получите сразу 5,326725 г за SO 2 .
б) Обратите внимание, что для полного сгорания 4 г CH 4 S требуется 7,981831 г O 2 . Таким образом, если только 3 г O 2 реагирует с CH 4 S, то кислород является ограничивающим реагентом . Это означает, что мы должны ввести 3 г для O 2 и получить, что только 1,503415 г CH 4 S прореагирует с образованием 2,002069 г SO 2 .
Связанные калькуляторы
Ознакомьтесь с другими нашими химическими калькуляторами, такими как Калькулятор балансировки химических уравнений или Калькулятор молекулярной массы.
Как интерпретировать химические уравнения
Химические уравнения и периодическая таблица
Чтобы понять химические уравнения, нам нужно немного разобраться в периодической таблице.
Каждая буква периодической таблицы является сокращением для определенного элемента. Например, H — водород, C — углерод, а Ca — кальций.
Например, H — водород, C — углерод, а Ca — кальций.
Хотя не все сокращения настолько прямолинейны. Например, K означает калий, что, кажется, не имеет никакого смысла, поскольку в слове калия нет даже звука «k» (это сокращение фактически происходит от латинского названия калия. , калий). Эти сокращения используются в химических уравнениях.
Количества каждого химического вещества
Каждое химическое вещество состоит из элементов. Химическая формула может сказать нам, сколько атомов каждого элемента используется. Атом — простейший компонент элемента.В большинстве случаев элементы находятся вместе. Мы не находим ни одного элемента в одиночку. Однако, говоря только об одном элементе, мы называем его атомом.
Итак, давайте посмотрим на пример производства воды.
Сначала мы видим, что используются водород (H) и кислород (O). Вместе они образуют дигидромоноксид, который обычно называют водой. «Ди-» означает два, «водород» означает водород, «моно» означает один, а «оксид» означает кислород.Итак, одна молекула воды имеет 2 атома водорода и 1 атом кислорода. Молекула — простейший компонент химического вещества. Обычно мы не находим отдельную химическую молекулу. Но когда мы говорим об одном, мы называем его молекулой.
«Ди-» означает два, «водород» означает водород, «моно» означает один, а «оксид» означает кислород.Итак, одна молекула воды имеет 2 атома водорода и 1 атом кислорода. Молекула — простейший компонент химического вещества. Обычно мы не находим отдельную химическую молекулу. Но когда мы говорим об одном, мы называем его молекулой.
Обратите внимание на индекс «2» в уравнении. Если у нас есть банка, полная атомов водорода, атомы водорода не плавают сами по себе. Два атома водорода объединятся и образуют молекулу водорода. То же самое и с кислородом.
Есть некоторые атомы (например, натрий), которые не соединяются друг с другом, но водород и кислород всегда будут соединяться вместе, если их оставить плавать вместе. Вот почему и у водорода, и у кислорода есть маленькие 2 рядом с ними — это означает, что мы используем молекулы дигидрогена и дикислорода.
Мы не будем вдаваться в подробности того, как сбалансировать уравнение в этом уроке, но просто знаем, что мы должны получить одинаковое количество атомов по обе стороны стрелки. Вы заметите, что у нас есть две молекулы дигидрогена слева от стрелки, и в итоге мы получаем две молекулы воды (h30).Об этом свидетельствует наличие большого числа 2 перед молекулой дигидрогена и большого числа 2 перед молекулой воды. Когда перед молекулой нет числа, мы знаем, что это означает, что была использована только 1 молекула. Поскольку перед молекулой дикислорода нет номера, мы знаем, что была использована только 1 молекула дикислорода.
Вы заметите, что у нас есть две молекулы дигидрогена слева от стрелки, и в итоге мы получаем две молекулы воды (h30).Об этом свидетельствует наличие большого числа 2 перед молекулой дигидрогена и большого числа 2 перед молекулой воды. Когда перед молекулой нет числа, мы знаем, что это означает, что была использована только 1 молекула. Поскольку перед молекулой дикислорода нет номера, мы знаем, что была использована только 1 молекула дикислорода.
Собираем все вместе: 2 молекулы водорода вступают в реакцию с 1 молекулой кислорода с образованием 2 молекул воды.
Другой пример
Теперь давайте посмотрим на немного более сложный пример:
Итак, начнем с самого начала: Ag относится к серебру (да, еще одна странная аббревиатура, которая не имеет смысла на основе английского слова), N — азот, O — кислород, Ca — кальций, а Br — бромид. .Чтобы упростить наименование, мы называем азотно-кислородную часть (нитротриоксид) нитратом. Итак, в качестве реагентов у нас есть следующие молекулы: нитрат серебра и бромид кальция. В качестве продуктов образуются следующие молекулы: бромид серебра и нитрат кальция.
Итак, в качестве реагентов у нас есть следующие молекулы: нитрат серебра и бромид кальция. В качестве продуктов образуются следующие молекулы: бромид серебра и нитрат кальция.
Теперь мы видим, что в нитрате серебра есть 1 атом серебра, 1 атом азота и 3 атома кислорода. Бромид кальция имеет: 1 атом кальция и 2 атома бромида. Тогда бромид серебра имеет: 1 атом серебра и 1 атом бромида.
Нитрат кальция — это то место, где становится сложно, как скобки работают с меньшими числами? Нитрат заключен в круглые скобки, а сразу после скобок идет пара цифр. Скобки означают, что нитрат может действовать как часть молекулы, и что их два. Итак, в нитрате есть 1 атом азота и 3 атома кислорода, но поскольку нитратов 2, у нас всего 2 атома азота и 6 атомов кислорода. Все это связано с одним атомом кальция.
Это становится более понятным, если мы посмотрим на структуру нитрата кальция.
Мы видим, что кальций непосредственно присоединен к двум нитратам. Таким образом, эти скобки не только говорят нам, сколько атомов азота и кислорода в молекуле, но также немного говорят нам о структуре молекулы.
Таким образом, эти скобки не только говорят нам, сколько атомов азота и кислорода в молекуле, но также немного говорят нам о структуре молекулы.
Теперь давайте сложим все вместе: 2 молекулы нитрата серебра вступают в реакцию с 1 молекулой бромида кальция с образованием 2 молекул бромида серебра и 1 молекулы нитрата кальция.
Краткое содержание урока
В химическом уравнении справа от стрелки мы видим реагенты, которые образуют продукты, перечисленные слева. Химические уравнения говорят нам, какие химические вещества необходимы для совместной реакции с образованием другого химического вещества. Другими словами, какие атомов (простейший компонент элемента) и молекул (простейший компонент химического вещества) используются и сколько.
Это определяется на основе чисел в нижнем индексе (которые говорят нам количество этого конкретного атома) и больших чисел (которые говорят нам количество этой конкретной молекулы).Скобки в химическом уравнении также могут немного рассказать нам о структуре молекулы.
— EndMemo
| H | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | He | ||||||
| Li | Be | ( | ) | B | С | N | О | ф | Ne | ||||||||
| Na | мг | 9815386″> Al | Si | P | ю. | Cl | Ar | ||||||||||
| К | Ca | Sc | Ti | В | Кр | Мн | Fe | Co | Ni | Cu | Zn | Ga | Ge | Se | руб. | Kr | |
| руб. | Sr | Y | Zr | Nb | Пн | Tc | Ру | Rh | Pd | Ag | Кд | В | Sn | Сб | Te | я | Xe |
| CS | Ba | Лас | 49″> Hf | Ta | Вт | Re | Ос | Ir | Pt | Au | рт. | тл | Pb | Bi | Po | при | рн |
| пт. | Ra | СКУД | Rf | Дб | Sg | Bh | HS | тонн | Ds | Rg | Cn | ||||||
| Лас | 90547″> Ла | CE | пр. | Nd | вечера | см | Eu | Gd | Тб | Dy | Хо | Er | Тм | Yb | Лю | ||
| СКУД | Ac | Тыс | Па | U | Np | Pu | Am | см | Bk | Cf | Es | FM | мкр. | Нет | Lr | ||
Балансир для химических уравнений
Этот балансировщик химических уравнений может помочь вам сбалансировать несбалансированное уравнение.
Этот балансир также может помочь вам проверить, сбалансировано ли уравнение, таким образом, вы можете редактировать уравнение и проверять его баланс.
Балансировщик чувствителен к регистру.
Ниже приведены некоторые примеры формата ввода уравнения:
1. h3 + O2 = h3O
2. 2h3 + O2 = 2h3O
3. CaCl2 + 2AgNO3 = Ca (NO3) 2 + 2AgCl
ChemReaX — приложение для моделирования и моделирования химических реакций от ScienceBySimulation
______________________________________________________________________________________________
Что ChemReaX?
ChemReaX ™ — бесплатное веб-приложение для моделирования и моделирования основных химических реакций . Программа предназначена для студентов-химиков и их учителей на уровне бакалавриата и старшей школы (AP / IB). Платформа моделирования ChemReaX позволяет легко создавать сложные виртуальные лаборатории на курсах общей химии и физической химии.
Программа предназначена для студентов-химиков и их учителей на уровне бакалавриата и старшей школы (AP / IB). Платформа моделирования ChemReaX позволяет легко создавать сложные виртуальные лаборатории на курсах общей химии и физической химии.
ChemReaX можно использовать для экспериментов с химической термодинамикой , реакционным равновесием, кинетикой, кислотно-основным титрованием и . Он включает термодинамические свойства для более чем 1200 химических веществ, что позволяет пользователям создавать практически неограниченное количество химических реакций.Или пользователи могут выбирать из более чем 80 предопределенных реакций. ChemReaX моделирует данную реакцию от начальных условий до конечного состояния равновесия и точно моделирует влияние концентраций, температуры и давления. Он поставляется с подробным руководством пользователя, учебными пособиями и несколькими готовыми к использованию виртуальными лабораторными упражнениями.
Можно ответить на следующие вопросы: Возможна ли реакция? В каком направлении пойдет реакция при исходном состоянии? Реакция спонтанная? Что такое конечное состояние равновесия? Что делать, если есть ограничивающий реагент? Как реакция реагирует на изменения температуры и начальных концентраций реагентов / продуктов? Как реакция реагирует на изменение давления в состоянии равновесия? Как быстро протекает реакция и как со временем меняются концентрации реагента / продукта?
ChemReax внесен в базу данных Национальной научной цифровой библиотеки, MERLOT, EdSurge и LearnPlatform в качестве онлайн-инструмента для обучения химии, а также доступен в рамках проекта учебников с открытым доступом LibreTexts.
Как ChemReaX обычно используется?
ChemReaX можно использовать в качестве виртуальной лаборатории или испытательного стенда для моделирования и моделирования
практически неограниченное разнообразие химических реакций. Более 1200 химических веществ в
базу данных ChemReaX можно объединить как реагенты или продукты в
химическая реакция, охватывающая большинство реакций, представляющих интерес для студентов-химиков и
учителя.Реагенты и продукты выбираются с помощью раскрывающегося списка с возможностью поиска.
списки. Пользователь может сбалансировать уравнение и попросить ChemReaX проверить его
действительность, или позволить ChemReaX автоматически сбалансировать его. Затем пользователь вводит
начальные концентрации реагентов и продуктов. Температура, давление
Фактор и параметры скорости реакции являются дополнительными переменными, которые могут быть установлены
Пользователь.При нажатии кнопки «Запустить реакцию» ChemReaX выполняет
расчет равновесия, а затем моделирует реакцию до окончательного установившегося
состояние достигнуто.
Более 1200 химических веществ в
базу данных ChemReaX можно объединить как реагенты или продукты в
химическая реакция, охватывающая большинство реакций, представляющих интерес для студентов-химиков и
учителя.Реагенты и продукты выбираются с помощью раскрывающегося списка с возможностью поиска.
списки. Пользователь может сбалансировать уравнение и попросить ChemReaX проверить его
действительность, или позволить ChemReaX автоматически сбалансировать его. Затем пользователь вводит
начальные концентрации реагентов и продуктов. Температура, давление
Фактор и параметры скорости реакции являются дополнительными переменными, которые могут быть установлены
Пользователь.При нажатии кнопки «Запустить реакцию» ChemReaX выполняет
расчет равновесия, а затем моделирует реакцию до окончательного установившегося
состояние достигнуто.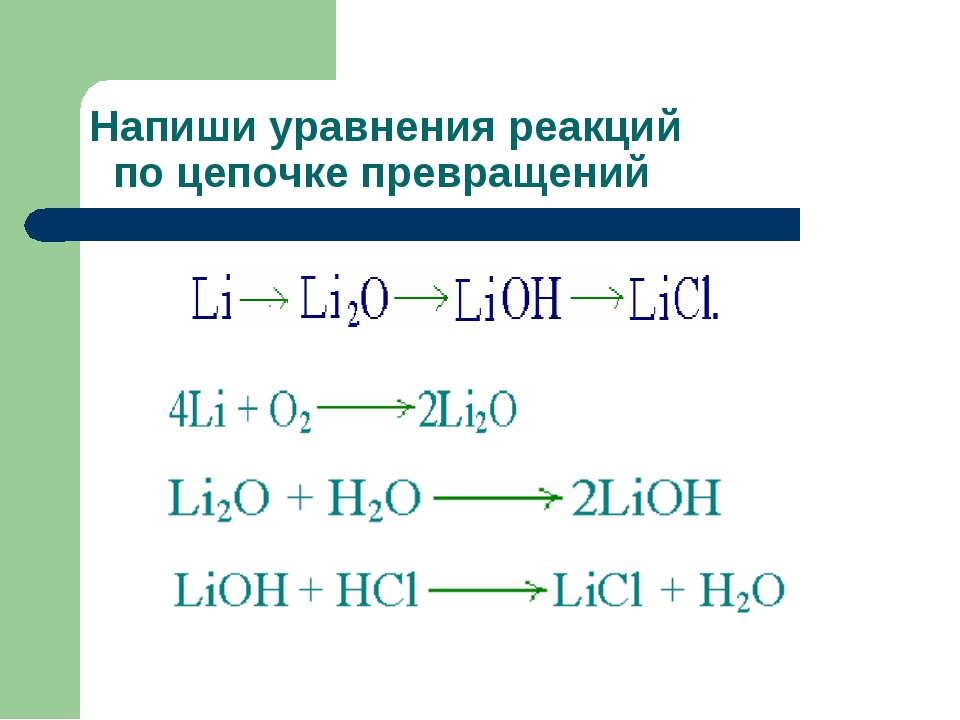 Результаты представлены в табличной и графической формах.
Результаты представлены в табличной и графической формах.
Некоторые типичные приложения:
- Запустить виртуальный
«эксперименты» и сбор данных для лабораторных занятий по любому количеству химических
реакции:
- Соберите любую интересную реакцию, используя 1200+ химических веществ в базе данных.В настоящее время до трех реагентов и можно выбрать три продукта. Это позволяет использовать практически неограниченное количество реакции, которые необходимо изучить.
- Изменяйте начальные концентрации или парциальные давления всех
реагентов / продуктов, а также температуры — и «запускать» каждую реакцию при
выбранные условия.

- Измените коэффициент давления относительно базовой линии, чтобы увидеть влияние давления. изменяется, когда реакция находится в равновесии.
- Смоделируйте реакцию скорости как дополнительная опция для изучения кинетики и термодинамики реакций в единый каркас.
- Данные, собранные в ходе виртуальных экспериментов, могут включают конечные концентрации всех веществ, общее изменение свободной энергии, общие стандартные изменения энтальпии / энтропии, кинетика реакции и другие детали.
- Запустите моделируемое титрование для изучения кислотно-основных взаимодействий.
 Выбирайте из большого
выбор сильных / слабых кислот и оснований для титрования, а также изменение титра и
объемы и концентрации титранта.
Выбирайте из большого
выбор сильных / слабых кислот и оснований для титрования, а также изменение титра и
объемы и концентрации титранта.
- Предскажите результаты любой реакции и сравните с результатами ChemReaX:
- Предсказать направление реакции по заданному исходное состояние при заданной температуре — а затем сравнить с результатами моделирования от ChemReaX.
- Рассчитайте вручную состояние равновесия и окончательный
концентрации (включая влияние любых ограничивающих реагентов) — а затем
сравните с результатами моделирования ChemReaX.

- Предсказать эффект влияния вариаций в температура, давление и начальные концентрации на конечном состоянии равновесия по принципу Ле Шателье — а затем сравните с результатами моделирования из ChemReaX.
- Предскажите результат кислотно-щелочного титрования — а затем сравните с результатами моделирования ChemReaX.
- Примените закон Гесса, чтобы разбить сложное уравнение
в систему более простых аддитивных уравнений для термодинамических расчетов.
 Получить
изменение свободной энергии (∆G) для каждого более простого уравнения из ChemReaX и
вычислить общее изменение свободной энергии, а затем сравнить с результатами ChemReaX
для одного комплексного уравнения.
Получить
изменение свободной энергии (∆G) для каждого более простого уравнения из ChemReaX и
вычислить общее изменение свободной энергии, а затем сравнить с результатами ChemReaX
для одного комплексного уравнения. - Удобно получить термодинамические свойства (стандартная молярная энтальпия образования и энтропия при указанная температура) для любого из 1200+ видов в базе данных для использования вне ChemReaX.Это самая большая бесплатная онлайн-база данных по химическим веществам. термодинамические свойства как функция температуры.
- Автоматически выполнять стехиометрический баланс химических реакций.

- Проверить справедливость химического уравнения, проверяя, что масса и заряд сохраняются.
Что уникальный в ChemReaX?
- ChemReaX позволяет пользователям создавать практически неограниченное количество химических реакций, используя более 1200 частиц во внутренней базе данных, и автоматически проверяет правильность уравнений и / или автоматически уравновешивает уравнения.Он также содержит более 80 предопределенных реакций, которые можно быстро выбрать по 10 различным категориям.
- Моделирует данную реакцию от начальных условий до достижения конечного состояния равновесия с использованием алгоритма моделирования, управляемого событиями, и точно генерирует конечные концентрации всех компонентов реакции на основе начальных концентраций (или парциальных давлений) и температуры.

- Оценивает влияние изменений давления в состоянии равновесия и производит окончательные составы продуктов и реагентов с регулируемым давлением.
- Моделирует кинетику реакции, используя модель скорости реакции (с параметрами, определяемыми пользователем), основанную на управляемом временем алгоритме моделирования, и отображает состав реагента / продукта графически как функцию времени.
- Моделирует кислотно-основное титрование с использованием той же базовой технологии моделирования, которая используется для общих реакций.
- Предоставляет мощные возможности моделирования и симуляции в руки студентов и учителей-химиков. Это не инструмент для анимации, а настоящий инструмент моделирования — аналогичный инструментам, используемым в промышленности, — который может помочь в серьезных научных исследованиях и исследованиях и обеспечить исследовательский / экспериментальный подход к изучению химии.

- Предоставляет самую большую бесплатную онлайн-базу данных химических термодинамических свойств в зависимости от температуры.
- ChemReaX находится в Интернете и размещается в облаке. На компьютер пользователя нечего устанавливать, и любой веб-браузер подойдет для доступа к инструменту.
ChemReaX бесплатно использовать?
Да, ChemReaX в настоящее время абсолютно бесплатен.Базовый набор функций и возможности всегда останутся бесплатными для всех учащихся и преподавателей. из любой точки мира.
Как пользователи могут участвовать в дальнейшем развитии и развитии ChemReaX?
Когда вы используете этот программный инструмент, сообщите нам, что вам нравится, а что нет. нравится, и какие функции следует добавить или улучшить для лучшего обучения
опыт.Нам абсолютно необходимы ваш вклад и помощь в разработке идеи
преподавание / обучение наука путем моделирования реальность. Мы особенно хотим
услышать от вас, если вы преподаватель / профессор и заинтересованы в
включение этой технологии в курс химии, который вы преподаете. В
технологии здесь, давайте работать вместе над их совершенствованием.пожалуйста, свяжитесь с нами в
[email protected].
нравится, и какие функции следует добавить или улучшить для лучшего обучения
опыт.Нам абсолютно необходимы ваш вклад и помощь в разработке идеи
преподавание / обучение наука путем моделирования реальность. Мы особенно хотим
услышать от вас, если вы преподаватель / профессор и заинтересованы в
включение этой технологии в курс химии, который вы преподаете. В
технологии здесь, давайте работать вместе над их совершенствованием.пожалуйста, свяжитесь с нами в
[email protected].
Какие источники теории и данные используются в ChemReaX?
Полинг, Л.
 1988. Общая химия . Нью-Йорк: Dover Publications.
1988. Общая химия . Нью-Йорк: Dover Publications.Аткинс, П. и Де Паула, Дж. 2014. Физическая химия: термодинамика, Структура и изменение .Нью-Йорк: W.H. Фриман и Ко.
ДеВое, Х. 2014. Термодинамика и химия . Кафедра химии и биохимии Мэрилендского университета.
Розенберг, Дж.Л., Эпштейн, Л.
 М., Кригер, П. Дж. 2013. Химический колледж . Обзорная серия Шаума. Нью-Йорк: Образование Макгроу Хилл.
М., Кригер, П. Дж. 2013. Химический колледж . Обзорная серия Шаума. Нью-Йорк: Образование Макгроу Хилл.Кокс, Дж. Д., Вагман, Д. Д., Медведев, В. А. 1989. Ключевые значения CODATA для термодинамики. Нью-Йорк: Hemisphere Publishing Corp.
Макбрайд Б.Дж., Гордон С. и Рино М.А. 1993. Коэффициенты для расчета термодинамических и транспортных свойств отдельных видов . Технический меморандум НАСА 4513.
Гольдберг, Р.
 Н., Кишор Н., Леннен Р. 2002. Термодинамические величины для реакций ионизации буферов. J. Phys. Chem. Ref. Данные, Vol. 31, № 2.
Н., Кишор Н., Леннен Р. 2002. Термодинамические величины для реакций ионизации буферов. J. Phys. Chem. Ref. Данные, Vol. 31, № 2.Дилл, Д. 2008. Заметки по общей химии. Химический факультет Бостонского университета.
Хайэм, Д.J. 2008. Моделирование и моделирование химических реакций . SIAM REVIEW, Vol. 50, №2.
CRC. 2004. Справочник CRC по химии и физике, 84-е издание.


 Опыт работы в средних учебных образовательных заведениях и в вузах, автор научных публикаций, методических пособий и учебников по химии. Эксперт и составитель заданий всероссийской олимпиады школьников по химии. Преподаватель подготовительных курсов МФТИ. ;
Опыт работы в средних учебных образовательных заведениях и в вузах, автор научных публикаций, методических пособий и учебников по химии. Эксперт и составитель заданий всероссийской олимпиады школьников по химии. Преподаватель подготовительных курсов МФТИ. ;
 Лабораторная посуда и ее назначение. Моделирование и наблюдение.
Лабораторная посуда и ее назначение. Моделирование и наблюдение.





 Номенклатура солей. Основные химические свойства солей. Знакомство с некоторыми представителями класса
Номенклатура солей. Основные химические свойства солей. Знакомство с некоторыми представителями класса
 Свойства веществ и их описание
Свойства веществ и их описание

 Часть 2
Часть 2 Установление формулы кристаллогидрата
Установление формулы кристаллогидрата Примеры комплексных соединений, химические свойства и способы получения.
Примеры комплексных соединений, химические свойства и способы получения. Примеры важнейших окислителей и восстановителей. Расстановка коэффициентов в уравнении окислительно-восстановительной реакции методом электронного баланса.
Примеры важнейших окислителей и восстановителей. Расстановка коэффициентов в уравнении окислительно-восстановительной реакции методом электронного баланса.

 И. Менделеева. Отработка заданий №2, 6
И. Менделеева. Отработка заданий №2, 6 Отработка заданий №16
Отработка заданий №16 Механизм диссоциации веществ с различным типом связи. Гидратированные ионы. Отработка заданий №13
Механизм диссоциации веществ с различным типом связи. Гидратированные ионы. Отработка заданий №13 Молярная масса. Объем. Молярный объем. Постоянная Авогадро. Решение расчетных задач
Молярная масса. Объем. Молярный объем. Постоянная Авогадро. Решение расчетных задач Отработка заданий №8-10
Отработка заданий №8-10
 Отработка заданий №17, 23
Отработка заданий №17, 23 — 31 мая 2022 г.
— 31 мая 2022 г.  00-16.00
00-16.00

 Выбирайте из большого
выбор сильных / слабых кислот и оснований для титрования, а также изменение титра и
объемы и концентрации титранта.
Выбирайте из большого
выбор сильных / слабых кислот и оснований для титрования, а также изменение титра и
объемы и концентрации титранта.
 Получить
изменение свободной энергии (∆G) для каждого более простого уравнения из ChemReaX и
вычислить общее изменение свободной энергии, а затем сравнить с результатами ChemReaX
для одного комплексного уравнения.
Получить
изменение свободной энергии (∆G) для каждого более простого уравнения из ChemReaX и
вычислить общее изменение свободной энергии, а затем сравнить с результатами ChemReaX
для одного комплексного уравнения.


 1988. Общая химия . Нью-Йорк: Dover Publications.
1988. Общая химия . Нью-Йорк: Dover Publications. М., Кригер, П. Дж. 2013. Химический колледж . Обзорная серия Шаума. Нью-Йорк: Образование Макгроу Хилл.
М., Кригер, П. Дж. 2013. Химический колледж . Обзорная серия Шаума. Нью-Йорк: Образование Макгроу Хилл. Н., Кишор Н., Леннен Р. 2002. Термодинамические величины для реакций ионизации буферов. J. Phys. Chem. Ref. Данные, Vol. 31, № 2.
Н., Кишор Н., Леннен Р. 2002. Термодинамические величины для реакций ионизации буферов. J. Phys. Chem. Ref. Данные, Vol. 31, № 2.