Сера. Описание, свойства, происхождение и применение минерала
Чистая желтая сера
Сера — минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
СТРУКТУРА
Кристаллическая структура и две сингонии серы
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS
СВОЙСТВА
Самородная сера
Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см 3, хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H2SO4 нерастворима. HNO3 и царская водка окисляют серу, превращая её в H2SO4. Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ
Самородная сера
Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ
Самородная сера
Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ
Сера входит в состав спичечной головки
Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
| Молекулярный вес | 32.06 г/моль |
| Происхождение названия | Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть» |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый |
| Цвет черты | бесцветный |
| Прозрачность | прозрачный, полупрозрачный |
| Блеск | смоляной, жирный |
| Спайность | несовершенная по {001}, {110} и {111} |
| Твердость (шкала Мооса) | 1.5 — 2.5 |
| Излом | неровный, раковистый |
| Прочность | очень хрупкая |
| Отдельность | отдельность по {111} |
| Плотность (измеренная) | 2.07 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | двухосный (+) |
| Показатели преломления | nα = 1.958 nβ = 2.038 nγ = 2.245 |
| Максимальное двулучепреломление | δ = 0.287 |
| Оптический рельеф | очень высокий |
| Плеохроизм | видимый |
| Рассеивание | относительно слабое r<v |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | |
| Пространственная группа | Fddd |
| Сингония | Ромбическая (орторомбическая) |
| Параметры ячейки | a = 10.468Å, b = 12.870Å, c = 24.49Å |
| Двойникование | Двойники по {101}, {011}, {110} довольно редки |
Интересные статьи:
mineralpro.ru 28.07.2016mineralpro.ru
Сера
Се́ра — элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
История открытия
Сера (англ. Sulfur, фр. Soufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно происхождение серы не установлено, но, как сказано выше, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён.
Происхождение названия
Русское название серы восходит к праславянскому *sěra, которое связывают с лат. sērum «сыворотка». Латинское sulphur (эллинизированное написание более старого sulpur) восходит к индоевропейскому корню *swelp — «гореть».
Получение
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания. Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу. В 1890 г. Герман Фраш, предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху. Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Физические свойства
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы: FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
СЕРА — это… Что такое СЕРА?
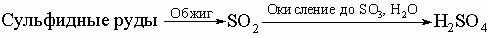
Большая часть получаемой кислоты идет на производство минеральных удобрений (суперфосфат, сульфат аммония). Серная кислота служит исходным сырьем для получения солей и других кислот, для синтеза органических веществ, искусственных волокон, для очистки керосина, нефтяных масел, бензола, толоуола, при изготовлении красок, травлении черных металлов, в гидрометаллургии урана и некоторых цветных металлов, для получения моющих и лекарственных средств, как электролит в свинцовых аккумуляторах и как осушитель. Тиосерная кислота h3S2O3 структурно аналогична серной кислоте за исключением замены одного кислорода на атом серы. Наиболее важным производным кислоты является тиосульфат натрия Na2S2O3 — бесцветные кристаллы, образующиеся при кипячении сульфита натрия Na2SO3 с серным цветом. Тиосульфат (или гипосульфит) натрия используется в фотографии как закрепитель (фиксаж). Сульфонал (Ch4)2C(SO2C2H5)2 — белое кристаллическое вещество, без запаха, слабо растворимое в воде, является наркотиком и используется как седативное и снотворное средство. Сульфид водорода h3S (сероводород) — бесцветный газ с резким неприятным запахом тухлых яиц. Он несколько тяжелее воздуха (плотность 1,189 г/дм3), легко сжижается в бесцветную жидкость и хорошо растворим в воде. Раствор в воде является слабой кислотой с рН СЕРА 4. Жидкий сероводород используют как растворитель. Раствор и газ широко применяют в качественном анализе для отделения и определения многих металлов. Вдыхание незначительного количества сероводорода вызывает головную боль и тошноту, большие количества или непрерывное вдыхание сероводорода вызывают паралич нервной системы, сердца и легких. Паралич наступает неожиданно, в результате нарушения жизненных функций организма. Монохлорид серы S2Cl2 — дымящая масляная жидкость янтарного цвета с едким запахом, слезоточивая и затрудняющая дыхание. Она дымит во влажном воздухе и разлагается водой, но растворима в сероуглероде. Монохлорид серы — хороший растворитель для серы, иода, галогенидов металлов и органических соединений. Монохлорид используется для вулканизации каучука, в производстве типографской краски и инсектицидов. При реакции с этиленом образуется летучая жидкость, известная как горчичный газ (ClC2h5)2S — токсичное соединение, используемое как боевое химическое отравляющее вещество раздражающего действия. Дисульфид углерода CS2 (сероуглерод) — бледножелтая жидкость, ядовитая и легко воспламеняющаяся. CS2 получают синтезом из элементов в электрической печи. Вещество нерастворимо в воде, имеет высокий коэффициент светопреломления, высокое давление паров, низкую температуру кипения (46° C). Сероуглерод — эффективный растворитель жиров, масел, каучука и резин — широко используют для экстракции масел, в производстве искусственного шелка, лаков, резиновых клеев и спичек, уничтожения амбарных долгоносиков и одежной моли, для дезинфекции почв. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Справочник сернокислотчика. М., 1971 Бусев А.И., Симонова Л.Н. Аналитическая химия серы. М., 1975
Энциклопедия Кольера. — Открытое общество. 2000.
dic.academic.ru
Сера, подготовка к ЕГЭ по химии
Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.

Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
H2S + O2 = S + H 2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO 4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород — сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + SO2
H2S + HClO3 = H2SO4 + HCl
H2S + O2 = H2O + S

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
Cl2 + H2SO4 = H2SO4 + HCl
SO2 + O2 = (t, кат. — Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3—
HSO3— = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота — основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr

Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O

SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Онлайн урок: Сера по предмету Химия 8 класс
Серная кислота H2SO4 – важный ресурс для химической промышленности и её продукт.

Серную кислоту активно использовали ещё алхимики как «купоросное масло».
Купоросное, потому что сульфаты тяжелых металлов издавна называют купоросами.
А масло, потому что чистая серная кислота:
- тяжелая (в 2 раза тяжелее воды) маслянистая жидкость
- без запаха
- не летучая
- гигроскопичная (быстро поглощает пары воды из воздуха)
Она смешивается с водой в любых отношениях, причем при смешении выделяется большое количество тепла.
Например, если в концентрированную серную кислоту влить немного воды, то выделяющегося тепла достаточно для её закипания, и вода может тут же разбрызгаться вместе с кислотой.

Поэтому при разбавлении серной кислоты никогда не льют воду в кислоту, а только кислоту в воду, небольшими порциями при постоянном перемешивании.
Вспомните об этом, если вам придется разбавить электролит для аккумулятора.
Серная кислота образуется при реакции оксида серы (VI) с водой.
Оксид серы (VI) SO3– бесцветная летучая жидкость, ниже 17 °С превращается в прозрачную хлопьевидную массу, кипит при 44 °С.
Это типичный кислотный оксид и проявляет все свойства кислотных оксидов, реагирует с основными и амфотерными оксидами, с основаниями, образуя сульфаты – соли серной кислоты.
Свойства разбавленной и концентрированной серной кислоты различаются.
За счет того, что сера находится в максимальной степени окисления +6, серная кислота – окислитель.
Однако её окислительные свойства проявляются только в концентрированном виде.
Разбавленная серная кислота является сильной кислотой, хорошо растворяет большинство металлов с выделением водорода, реагирует с основными и амфотерными оксидами, основаниями с образованием сульфатов.
Концентрированная серная кислота является окислителем и растворяет гораздо больше металлов, чем разбавленная, но уже с выделением оксида серы (IV) SO2, серы S или сероводорода H2S (чем активнее металл, тем меньше степень окисления серы в продукте реакции).
Но также концентрированная серная кислота реагирует и с неметаллами (серой, фосфором, углеродом), окисляя их до оксидов или кислот.
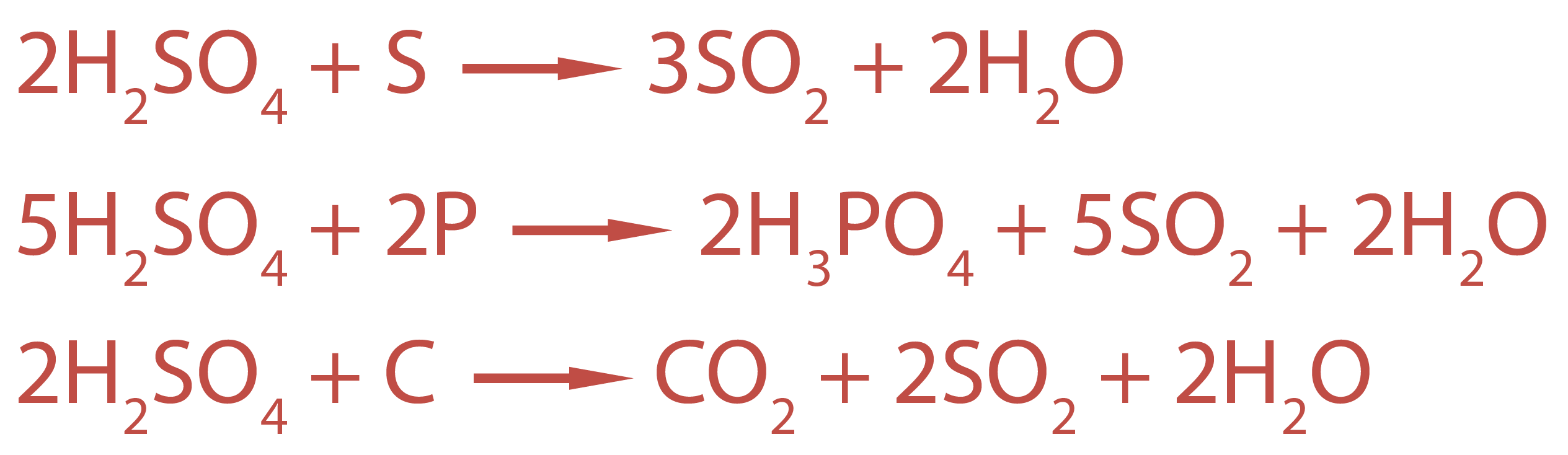
Концентрированная серная кислота гигроскопична, то есть поглощает пары воды, поэтому её используют как осушитель.
Газы, которые не вступают с ней в реакцию, сушат пропусканием через склянки с концентрированной серной кислотой.
Этот способ подходит для осушения углекислого газа CO2, хлороводорода HCl, хлора Cl2, водорода H2.
А, например, аммиак NH3 с серной кислотой немедленно образует сульфат аммония:

Гигроскопичность серной кислоты проявляется в том, что она обугливает органические вещества.
Например, если её добавить к истолчённому сахару, смесь сразу же чернеет – кислота отнимает от сахара воду, оставляя углерод.

Это свойство серной кислоты объясняет то, что при попадании на кожу она вызывает сильные ожоги.
В лабораториях, где часто работают с концентрированной серной кислотой, под рукой всегда держат раствор питьевой соды. Именно этим раствором и большим количеством воды и смывают кислоту с кожи.
Серная кислота относится к продуктам основного химического производства.
С ней вы наверняка сталкиваетесь почти каждый день: электролит в свинцово-кислотных аккумуляторах представляет собой 30 % серную кислоту.
Но, кроме этого, она также используется при производстве удобрений, при обработке руд для получения редкоземельных металлов, в химическом производстве красителей, взрывчатых веществ, в легкой промышленности для обработки тканей, восстановления наполнителей фильтров для воды.

ladle.ru
Сера — это… Что такое Сера?
| Внешний вид простого вещества | |
|---|---|
| Светло-жёлтое хрупкое твёрдое вещество | |
| Свойства атома | |
| Имя, символ, номер | Сера / Sulfur (S), 16 |
| Атомная масса (молярная масса) | 32,066 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p4 |
| Радиус атома | 127 пм |
| Химические свойства | |
| Ковалентный радиус | 102 пм |
| Радиус иона | 30 (+6e) 184 (-2e) пм |
| Электроотрицательность | 2,58 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | +6, +4, +2, 0, -1, −2 |
| Энергия ионизации (первый электрон) | 999,0 (10,35) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 2,070 г/см³ |
| Температура плавления | 386 К (112,85 °С) |
| Температура кипения | 717,824 К (444,67 °С) |
| Теплота плавления | 1,23 кДж/моль |
| Теплота испарения | 10,5 кДж/моль |
| Молярная теплоёмкость | 22,61[1] Дж/(K·моль) |
| Молярный объём | 15,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=10,437 b=12,845 c=24,369 Å |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,27 Вт/(м·К) |
Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. sulphur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы: FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
История открытия
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно происхождение серы не установлено, но, как сказано выше, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён.
 Кристаллы серы среди щёток арагонита
Кристаллы серы среди щёток арагонитаПроисхождение названия
Слово «сера», известное в древнерусском языке с XV в., заимствовано из старославянского «сѣра» – «сера, смола», вообще «горючее вещество, жир». Этимология слова не выяснена до настоящих времен, поскольку первоначальное общеславянское название вещества утрачено и слово дошло до современного русского языка в искаженном виде[2].
По предположению Фасмера[3], «сера» восходит к лат. sera – «воск» или лат. serum – «сыворотка».
Латинское sulphur (происходящее из эллинизированного написания этимологического sulpur) предположительно восходит к индоевропейскому корню *swelp — «гореть»[4].
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
От того, образовались эти вкрапления одновременно с сопутствующими породами или позже, зависит направление поисковых и разведочных работ. Существует несколько совершенно различных теорий по этому вопросу.
Теория сингенеза (то есть одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворённые в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путём или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространённый из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит всё новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-H2O и ангидрита CaSO4 в серу и кальцит СаСО3. Эта теория создана в 1935 году советскими учёными Л. М. Миропольским и Б. П. Кротовым. В её пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озёра (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Всё это означает, что разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Ещё из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Получение
Гранулированная сераВ древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш, предложил плавить серу под землёй и через скважины, подобные нефтяным, выкачивать её на поверхность. Сравнительно невысокая (113 °C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие её как побочный продукт при очистке газа.
Применение
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Свойства
Физические свойства
Природный сросток кристаллов самородной серыСера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например в сероуглероде, скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд[5].
Химические свойства
 Горение серы
Горение серыНа воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO[6].
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
Расплав серы реагирует с хлором, при этом возможно образование двух низших хлоридов[7]:
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[8], среди которых — высший сульфид P2S5:
Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
- (сероводород)
- (сероуглерод)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды:
- .
Растворы сульфидов щелочных металлов реагируют с серой с образованием полисульфидов:
Из сложных веществ следует отметить прежде всего реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует аналогично хлору:
- .
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
- (конц.)
- (конц.)
Биологическая роль
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка (формирование дисульфидных мостиков). Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе[9].
Человек содержит примерно 2 г серы на 1 кг своего веса.
Самородная сера на почтовой марке, 2009Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углём, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распылённая вода, воздушно-механическая пена[10].
По данным В. Маршалла пыль серы относится к разряду взрывоопасных, но для взрыва необходима достаточно высокая концентрация пыли — порядка 20 г/м³ (20 000 мг/м³), такая концентрация во много раз превышает предельно допустимую концентрацию для человека в воздухе рабочей зоны — 6 мг/м³[11].
Пары образуют с воздухом взрывчатую смесь[12].
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см[13]. Температура пламени при горении серы составляет 1820 °C[14].
Так как воздух по объёму состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объёма кислорода получается один объём SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха, и объёмное содержание SO2 в газовой смеси меньше теоретически возможного, составляя обычно 14…15 %[6].
Обнаружение горения серы пожарной автоматикой является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Тепловыделение при пожаре приводит к температуре ниже, чем при пожарах других распространенных пожароопасных веществ. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространёнными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы[15].
Для выполнения требований пожарной безопасности на складах серы необходимо:
- конструкции и технологическое оборудование должны регулярно очищаться от пыли;
- помещение склада должно постоянно проветриваться естественной вентиляцией при открытых дверях;
- дробление комков серы на решётке бункера должно производиться деревянными кувалдами или инструментом из неискрящего материала;
- конвейеры для подачи серы в производственные помещения должны быть снабжены металлоискателями;
- в местах хранения и применения серы необходимо предусматривать устройства (бортики, пороги с пандусом и т. п.), обеспечивающие в аварийной ситуации предотвращение растекания расплава серы за пределы помещения или открытой площадки;
- на складе серы запрещается:
- производство всех видов работ с применением открытого огня;
- складировать и хранить промасленную ветошь и тряпки;
- при ремонте применять инструмент из искродающего материала[16].
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет-Уэст Западной Капской провинции Южно-Африканской Республики произошёл крупный пожар, погибли два человека[17][18].
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет[19].
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошёл пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчёта с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал[20].
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов[21].
В апреле 2008 недалеко от посёлка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчётов и спасатели. В тот момент, когда пожарные оказались около склада, горела ещё не вся сера, а только её небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землёй и залиты водой[22].
В июле 2009 в Днепродзержинске горела сера. Пожар произошёл на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал[23].
В конце июля 2012 под Уфой в поселке Тимашево загорелся склад с серой площадью 3200 квадратных метров. На место выехало 13 единиц техники, в тушении пожара задействован 31 пожарный. Произошло загрязнение атмосферного воздуха продуктами горения. Погибших и пострадавших нет.[24].
См. также
Примечания
- ↑ Химическая энциклопедия: в 5 т. / Редкол.:Зефиров Н. С. (гл. ред.). — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 319. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑ Этимологический словарь русского языка Семенова
- ↑ Фасмер М. Этимологический словарь русского языка, том 3. — М.: Прогресс. — 1964 – 1973. — С. 603.
- ↑ Mallory J. P., Adams D.Q. The Oxford Introduction To Proto-Indo-European And Indo-European World. — Oxford:University Press. — 2006. — С. 124.
- ↑ Б. В. Некрасов. Основы общей химии. — 3-е изд., исправленное и доп. — М.: Химия, 1973. — Т. 1. — 656 с.
- ↑ 1 2 Непенин Н. Н. Технология целлюлозы. Производство сульфитной целлюлозы. — М.: «Лесная промышленность», 1976. — С. 151.
- ↑ Ключников Н. Г. Неорганчиеский синтез. М., Просвещение, 1971, С. 267—269
- ↑ Реми Г. Курс неорганической химии. — М.: «Издательство иностранной литературы», 1961. — С. 695.
- ↑ Т.Л.Богданова, Е.А.Солодова. Биология: Справочник для старшеклассников и поступающих в ВУЗы. — М.: АСТ-ПРЕСС КНИГА. — 2011. — С. 85.
- ↑ А. Я. Корольченко, Д. А. Корольченко. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. — 2-е изд., перераб и доп. — М.: Асе. «Пожнаука», 2004. — Т. 2. — 396 с.
- ↑ Е. П. Белобров, А. В. Сидоров «Эколого-гигиенические последствия взрывов пыли и пожаров комовой серы, сопровождающие её перегрузку в порту Мариуполь»
- ↑ РД 50-290-81 Методические указания. Анализаторы содержания серы в нефти. Методы и средства поверки — скачать бесплатно
- ↑ В. Аксютин, П. Щеглов, В. Жолобов, С. Алексанянц «Ликвидация пожаров при аварийных ситуациях с опасными грузами»
- ↑ Теребнев В. В. Справочник руководителя тушения пожара. Тактические возможности пожарных подразделений. — М.: Пожкнига, 2004. — С. 99.
- ↑ http://www.det-tronics.com/utcfs/ws-462/Assets/77-1022_sulfur_fire_detection.pdf
- ↑ ППБО 157-90 Правила пожарной безопасности в лесной промышленности 5.11. Склады серы и негашёной извести
- ↑ South African sulphur fire
- ↑ AECI fire puts sulphur stockpiles in spotlight-01/01/1996-ECN
- ↑ Радио «Трансмит» : Новости : Пожар на череповецком «Аммофосе»! Накануне около пяти вечера на этом предприятии загорелся склад с серой
- ↑ В Балакове сгорел склад с серой — Информационное агентство Взгляд-инфо
- ↑ ТОО «Тенгизшевройл» оштрафуют за два пожара в хранилище серы | Информационный портал ZAKON.KZ
- ↑ KP.RU // МЧСники ищут владельца сарая с серой, который горел под Самарой
- ↑ Коксохим горел в Днепродзержинске
- ↑ Под Уфой горел склад с серой
Литература
Ссылки
dic.academic.ru
Физические и химические свойства серы
Электронная конфигурация 1s22s22p63s23p4. Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67С, плавления – 112,85С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F2 = SF6;
2S + Cl2 = S2Cl2;
S + Cl2 = SCl2;
5S + 2P = P2S5;
S + H2 = H2S;
2S + C = CS2;
S + O2 = SO2;
2S + Br2 = S2Br2.
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na2S;
Ca + S = CaS
2Al + 3S = Al2S3;
Fe + S = FeS.
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K2SO3 +2K2S + 3H2O;
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
S + 2H2SO4 = 3SO2↑ + 2H2O.
При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na2S + S = Na2S2.
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
ru.solverbook.com