1.2. Основные понятия химии
Объектом изучения в химии являются химические элементы и их соединения.
Химическим элементом называют вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица элемента, обладающая его химическими свойствами.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов.
Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H2, O2, S4. Простое вещество является формой существования химического элемента в свободном состоянии. Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением)
Химические свойства вещества характеризуют его способность участвовать в химических реакциях, т. е. в процессах превращения одних веществ в другие.
Массы атомов, молекул очень малы. Например, массы отдельных атомов составляют 10-24 — 10-22 г. Массы атомов, молекул выражают или в относительных единицах ( через массу какого-либо одного определенного вида атома), или в атомных единицах массы (а.е.м.).
1а.е.м.-это
1/12 часть массы атома изотопа углерода 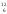 С. 1а.е.м.=1.66053*10-24 г.
С. 1а.е.м.=1.66053*10-24 г.
Значение
относительной атомной (Ar)
или молекулярной массы (Mr)
показывает, во сколько раз масса атома
или молекулы больше чем 1/12 часть массы
атома изотопа углерода 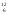 С
(углеродная шкала атомных масс).
Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе
элементов Д.И. Менделеева под символом
элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную
атомную массу, легко можно найти и массу
атома, выраженную в граммах. Так, масса
атома углерода-12 в г равна: 12* 1.66053*10-24=
1.992636*10-23 г. Масса
молекулы равна сумме масс атомов,
входящих в ее состав.
С
(углеродная шкала атомных масс).
Ar и Мr – безразмерны. Значения Аr приводятся в периодической системе
элементов Д.И. Менделеева под символом
элемента. Численно Аr и А (а.е.м.) совпадают. Зная относительную
атомную массу, легко можно найти и массу
атома, выраженную в граммах. Так, масса
атома углерода-12 в г равна: 12* 1.66053*10-24=
1.992636*10-23 г. Масса
молекулы равна сумме масс атомов,
входящих в ее состав.
Количество вещества (n;) – это число структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т.д.) в системе. Единицей измерения количества вещества является моль. Моль – количество вещества, которое содержит столько определенных структурных единиц, сколько атомов содержится в 12 г изотопа углерода
Количество вещества () равно отношению числа структурных единиц (атомов, молекул, ионов, эквивалентов, электронов и т.д.) в системе (N) к их числу в 1 моле вещества (NА):

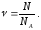
Молярная масса (М) – это масса 1 моль вещества, равная отношению массы вещества (m) к его количеству ():
М=m/.
Основной единицей измерения молярной массы является г/моль (кг/моль). Молярная масса вещества, выраженная в граммах, численно равна относительной молекулярной массе этого вещества.
Молярный
объем (Vм ) – это
объем, занимаемый 1 моль газообразного
вещества, равный отношению объема
газообразного вещества (V)
к его количеству( ):
):

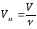 .
.
При н.у. (273,15 К и 101,325 кПа) для любого вещества в газообразном состоянии Vм = 22,4 л/моль.
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях
Для того чтобы определить формулы эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента:
А. 2NaOH+H2SO4 =2H2O+Na2SO4.
Краткое ионно-молекулярное уравнение процесса:
2OH— +2H+ =2H2O.
В данной ионообменной реакции участвуют два иона водорода. На один ион водорода приходится:
NaOH+1/2H2SO4=H2O+1/2Na2SO4,
т.е. одному иону водорода соответствует: одна молекула NaOH, 1/2 молекулы H 2SO4, одна молекула H2O, 1/2 молекулы Na2SO4, поэтому Э(NaOH)=NaOH; Э(H2SO4)=1/2H2SO4; Э(H2O)=H2O; Э(Na2SO4)=1/2Na2SO4.
Б. Zn+2HCl=ZnCl2+H2
Ионно-электронные уравнения процессов окисления, восстановления:
Zn-2e=Zn2+,
2H++2e=H2.
В данной ОВР участвуют два электрона. На один электрон приходится:
1/2Zn+HCl=1/2ZnCl2+1/2H2,
т.е.
одному электрону соответствует 1/2 атома
Zn, одна молекула HСl,1/2 молекулы ZnCl2 и 1/2 молекулы Н2,
поэтому Э(Zn) =
1/2Zn; Э(HCl) = HCl;
Э(ZnCl2) =
1/2ZnCl2;
Э(H2) =
1/2H
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, получило название фактора эквивалентности fэ. Например, в рассматриваемых реакциях fэ(Zn)=1/2, fэ(NaOH)=1.
Для окислительно-восстановительных реакций используют понятие «эквивалентное число» (Z), которое равно числу электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Моль эквивалента – количество вещества, cодержащего 6,02*1023 эквивалентов. Массу одного моля эквивалента вещества называют молярной массой эквивалента вещества (Мэ), измеряют в г/моль и рассчитывают по формулам:
Мэ=m/э; Мэ=fэ*М,
где М – молярная масса вещества, г/моль; νэ
– количество эквивалента вещества, моль.Для расчета молярной массы эквивалента вещества можно использовать следующие формулы:
1. Для простого вещества:
Мэ=МА/В, fэ = 1/В,
где МА – молярная масса атомов данного вещества; В – валентность атома, например, Мэ(Al)=27/3=9 г/моль.
2. Для сложного вещества:
Мэ=М/В*n, fэ = 1/В*n,
где В – валентность функциональной группы; n – число функциональных групп в формуле молекулы вещества.
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла, для оксидов – оксидообразующий элемент.
Мэ кислоты=Мкислоты/основность кислоты.
Основность кислоты определяется числом протонов, которое отдает молекула кислоты, реагируя с основанием
Например, Мэ(H2SO4)=98/2=49 г/моль.
Мэ основания = Моснования/кислотность основания.
Кислотность основания определяется числом протонов, присоединяемых молекулой основания при взаимодействии его с кислотой.
Например, Мэ(NaOH)=40/1=40 г/моль.
Мэ соли=Мсоли/(число атомов металла*валентность металла).
Например, Мэ(Al2(SO4)3)=342/(2*3)=57 г/моль.
Мэ оксида=Моксида/(число атомов оксидообразующего элемента * валентность элемента).
Например, М э(Al2O3)=102/(2*3)=17 г/моль.
В общем случае молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
3. Для окислителя, восстановителя:
Мэ=М/Z,
где Z – эквивалентное число (Z=1/f э).
Как
известно, моль любого газа при нормальных
условиях (Т=273,15 К, Р=101,325 кПа или 760 мм рт.
ст.) занимает объем, равный 22,4 л; этот
объем называется молярным объемом Vм.
Исходя из этой величины, можно рассчитать
объем одного моля эквивалента газа (Vэ,
л/моль) при нормальных условиях. Например,
для водорода Э(Н2)=1/2Н2,
моль эквивалента водорода в два раза
меньше его моля молекул и поэтому объем
одного моля эквивалента водорода также
в два раза меньше его молярного объема:
22,4 л/2=11,2 л. Для кислорода Э(О2)=1/4
О
В
общем случае: Vэ=fэ*Vм;
Vэ=
V/ .
.
основные понятия, определения, термины и законы
Химия, основные понятия которой мы рассмотрим, – это наука, которая изучает вещества и их превращения, происходящие с изменением строения и состава, а значит, и свойств. Прежде всего необходимо определить, что же означает такой термин, как «вещество». Если говорить о нем в широком смысле, оно представляет собой форму материи, которая имеет массу покоя. Веществом является любая элементарная частица, к примеру, нейтрон. В химии же это понятие используется в более узком значении.
Для начала кратко опишем основные термины и понятия химии, атомно-молекулярного учения. После этого мы поясним их, а также изложим некоторые важные законы данной науки.
Основные понятия химии (вещество, атом, молекула) знакомы каждому из нас еще со школы. Ниже дана краткая характеристика их, а также других, не столь очевидных терминов и явлений.
Атомы
Прежде всего все вещества, которые изучаются в химии, сложены из маленьких частиц, называемых атомами. Нейтроны же не являются объектом изучения этой науки. Также следует сказать, что атомы могут соединяться друг с другом, в результате чего формируются химические связи. Для того чтобы разорвать эту связь, необходима затрата энергии. Следовательно, атомы в обычных условиях по одиночке не существуют (за исключением «благородных газов»). Они соединяются друг с другом хотя бы попарно.
Непрерывное тепловое движение
Непрерывным тепловым движением характеризуются все частицы, которые изучает химия. Основные понятия этой науки нельзя изложить, не рассказав о нем. При непрерывном движении средняя кинетическая энергия частиц пропорциональна температуре (однако следует заметить, что энергии у отдельных частиц разные). Екин = kT / 2, где k – постоянная Больцмана. Эта формула справедлива для любого вида движения. Так как Екин = mV2 / 2, движение массивных частиц более медленное. К примеру, если температура одинакова, молекулы кислорода в среднем перемещаются в 4 раза медленнее, чем молекулы углерода. Это происходит потому, что их масса больше в 16 раз. Движение бывает колебательным, поступательным и вращательным. Колебательное наблюдается и в жидких, и в твердых, и в газообразных веществах. А вот поступательное и вращательное легче всего осуществляется в газах. В жидкостях оно труднее, а в твердых веществах – еще более трудно.
Молекулы
Продолжим описывать основные понятия и определения химии. Если атомы объединяются между собой, образуя небольшие группы (их называют молекулами), такие группы принимают участие в тепловом движении, выступая как единое целое. До 100 атомов присутствует в типичных молекулах, а их число у так называемых высокомолекулярных соединений может достигать 105.
Немолекулярные вещества
Однако атомы часто объединяются в огромные коллективы количеством от 107 до 1027. В этом виде они уже практически не принимают участие в тепловом движении. Данные объединения уже мало напоминают молекулы. Они больше похожи на куски твердого тела. Вещества эти принято называть немолекулярными. В этом случае тепловое движение осуществляется внутри куска, а сам он не летает, подобно молекуле. Есть и переходная область размеров, в которую включаются объединения, состоящие из атомов в количестве от 105 до 107. Данные частицы являются или очень большими молекулами, или же представляют собой маленькие крупицы порошка.
Ионы
Необходимо отметить, что атомы и их группы могут обладать электрическим зарядом. В этом случае они называются ионами в такой науке, как химия, основные понятия которой мы изучаем. Так как одноименные заряды всегда отталкиваются друг от друга, вещество, где присутствует значительный избыток тех или иных зарядов, не может быть устойчиво. Отрицательные и положительные заряды в пространстве всегда чередуются. А вещество в целом остается электронейтральным. Заметим, что заряды, считающиеся в электростатике большими, с точки зрения химии ничтожны (на 105-1015 атомов – 1е).
Объекты изучения в химии
Нужно уточнить, что объектами изучения в химии выступают те явления, в которых не возникают и не разрушаются атомы, а только лишь перегруппировываются, то есть по-новому соединяются. Одни связи разрываются, в результате чего формируются другие. Иными словами, новые вещества появляются из атомов, бывших в составе исходных веществ. Если же и атомы, и существующие между ними связи сохраняются (к примеру, при испарении молекулярных веществ), то эти процессы относятся к области изучения уже не химии, а молекулярной физики. В случае когда атомы образуются или разрушаются, речь идет о предметах изучения ядерной или атомной физики. Однако граница между химическими и физическими явлениями размыта. Ведь деление на отдельные науки условно, тогда как природа неделима. Поэтому химикам очень полезно знание физики.
Основные понятия химии кратко были нами изложены. Теперь предлагаем вам подробнее их рассмотреть.
Подробнее об атомах
Атомы и молекулы — это то, с чем у многих ассоциируется химия. Основные понятия эти необходимо четко определить. То, что атомы существуют, две тысячи лет назад было гениально угадано. Затем, уже в 19 веке, у ученых появились экспериментальные данные (пока еще косвенные). Речь идет о кратных отношениях Авогадро, законах постоянства состава (ниже мы рассмотрим эти основные понятия химии). Атом продолжили исследовать в 20 веке, когда возникло множество уже прямых экспериментальных подтверждений. Они были основаны на данных спектроскопии, на рассеянии рентгеновских лучей, альфа-частиц, нейтронов, электронов и др. Размер данных частиц составляет примерно 1 Е = 1о-10м. Масса их – около 10-27 – 10-25 кг. В центре этих частиц находится положительно заряженное ядро, вокруг которого движутся электроны с отрицательным зарядом. Размер ядра составляет около 10-15 м. Получается, что электронная оболочка определяет размеры атома, однако при этом его масса практически полностью сосредоточена в ядре. Еще одно определение следует ввести, рассматривая основные понятия химии. Химический элемент — это вид атомов, заряд ядра которых одинаков.
Часто встречается определение атома как мельчайшей частицы вещества, химически неделимой. Как понять «химически»? Как мы уже отмечали, деление явлений на физические и химические условно. А вот существование атомов безусловно. Поэтому химию лучше определять через них, а не наоборот, атомы через химию.
Химическая связь

Это то, благодаря чему атомы удерживаются вместе. Она не позволяет им разлететься под влиянием теплового движения. Отметим основные характеристики связей — это межъядерное расстояние и энергия. Это также основные понятия химии. Длина связи определяется экспериментально с достаточно высокой точностью. Энергия – тоже, однако не всегда. К примеру, невозможно объективно определить, какова она по отношению к отдельной связи в сложной молекуле. Однако энергия атомизации вещества, необходимая для разрыва всех имеющихся связей, определяется всегда. Зная длину связи, можно определить, какие атомы являются связанными (у них короткое расстояние), а какие – нет (длинное расстояние).
Координационное число и координация
Основные понятия аналитической химии включают в себя два этих термина. Что же они обозначают? Давайте разберемся.
Координационное число представляет собой количество ближайших соседей данного конкретного атома. Другими словами, это число тех, с кем он связан химически. Координация представляет собой взаимное расположение, вид и число соседей. Другими словами, это понятие более содержательно. К примеру, координационное число азота, свойственное молекулам аммиака и азотной кислоты, одинаково – 3. Однако координация у них разная – неплоская и плоская. Она определяется независимо от представлений о природе связи, тогда как степень окисления и валентность – понятия условные, которые созданы для того, чтобы заранее предсказывать координацию и состав.
Определение молекулы
Мы уже касались этого понятия, рассматривая основные понятия и законы химии кратко. Теперь остановимся на нем более подробно. В учебниках часто встречается определение молекулы как наименьшей нейтральной частицы вещества, которая обладает его химическими свойствами, а также способна существовать самостоятельно. Необходимо отметить, что это определение в настоящий момент уже устарело. Во-первых, то, что все физики и химики именуют молекулой, свойств вещества не сохраняет. Вода диссоциирует, однако для этого необходимы минимум 2 молекулы. Степень диссоциации воды – это 10-7. Другими словами, этому процессу может подвергаться лишь одна молекула из 10 млн. Если у вас имеется одна молекула, или есть даже сто, вы не сможете получить представления о ее диссоциации. Дело в том, что тепловые эффекты реакций в химии обычно включают энергию взаимодействия между молекулами. Поэтому их нельзя найти по одной из них. И химические, и физические свойства молекулярного вещества можно определить лишь по большому коллективу молекул. Кроме того, существуют вещества, у которых способная существовать самостоятельно «наименьшая» частица неопределенно велика и очень отличается от привычных молекул. Молекула фактически представляет собой группу атомов, электрически не заряженную. В частном случае это может быть один атом, к примеру, Ne. Эта группа должна быть способна участвовать в диффузии, а также в других типах теплового движения, выступая как единое целое.
Как вы видите, не так просты основные понятия химии. Молекула — это то, что необходимо тщательно изучить. Она обладает своими собственными свойствами, а также молекулярной массой. О последней мы сейчас и поговорим.
Молекулярная масса
Как определить молекулярную массу на опыте? Один способ – основываясь на законе Авогадро, по относительной плотности пара. Самым точным методом является масс-спектрометрический. Электрон выбивают из молекулы. Полученный в результате этого ион сначала разгоняют в электрическом поле, затем отклоняют его магнитным путем. Отношение заряда к массе определяется именно величиной отклонения. Существуют также методы, основанные на свойствах, которыми обладают растворы. Однако молекулы во всех этих случаях непременно должны быть в движении – в растворе, в вакууме, в газе. Если они не движутся, невозможно объективно рассчитать их массу. Да и само их существование в этом случае трудно обнаружить.
Особенности немолекулярных веществ
Говоря о них, отмечают, что они состоят из атомов, а не из молекул. Однако это же справедливо и по отношению к благородным газам. Данные атомы движутся свободно, следовательно, лучше считать их одноатомными молекулами. Однако не это главное. Важнее, что в немолекулярных веществах имеется очень много атомов, которые связаны воедино. Нужно заметить, что деление всех веществ на немолекулярные и молекулярные является недостаточным. Деление по связности более содержательно. Рассмотрим, к примеру, различие в свойствах графита и алмаза. Оба они являются углеродом, однако первое – мягкое, а второе – твердое. Чем же они отличаются друг от друга? Разница заключается как раз в их связности. Если рассмотреть структуру графита, мы увидим, что прочные связи имеются лишь в двух измерениях. А вот в третьем очень значительны межатомные расстояния, следовательно, нет прочной связи. Графит легко скользит и раскалывается по этим слоям.
Связность структуры
Иначе ее называют пространственной размерностью. Она представляет собой количество измерений пространства, характеризующихся тем, что в них непрерывна (почти бесконечна) система остов (прочных связей). Значения, которые она может принимать, — 0, 1, 2 и 3. Следовательно, необходимо различать трехмерно-связные, слоистые, цепочечные и островные (молекулярные) структуры.
Закон постоянства состава
Мы уже изучили основные понятия химии. Вещество было вкратце рассмотрено нами. Теперь расскажем о законе, который относится к нему. Обычно его формулируют следующим образом: любое индивидуальное вещество (то есть чистое), независимо от того, каким способом оно было получено, имеет одинаковый количественный и качественный состав. Но что же значит понятие «чистое вещество»? Давайте разберемся.
Две тысячи лет назад, когда строение веществ нельзя было еще изучить прямыми методами, когда еще даже не существовали основные химические понятия и законы химии, привычные нам, его определяли описательно. К примеру, вода – это жидкость, которая составляет основу морей и рек. У нее нет запаха, цвета, вкуса. Она имеет такие-то температуры замерзания и плавления, от нее синеет сульфат меди. Соленой морская вода является потому, что она не чистая. Однако соли можно отделить с помощью перегонки. Примерно так, описательным методом, определялись основные химические понятия и законы химии.

Для ученых того времени было неочевидно, что жидкость, которая выделена разными способами (сжиганием водорода, обезвоживанием купороса, перегонкой морской воды), обладает одинаковым составом. Большим открытием в науке стало доказательство этого факта. Стало понятно, что соотношение кислорода и водорода не может плавно меняться. Это значит, что элементы состоят из атомов – неделимых порций. Так были получены формулы веществ, а также обосновано представление ученых о молекулах.
В наше время любое вещество явно или неявно определяют прежде всего формулой, а не температурой плавления, вкусом или цветом. Вода — Н2О. Если присутствуют другие молекулы, она уже не будет являться чистой. Следовательно, чистое молекулярное вещество представляет собой то, которое сложено из молекул только одного вида.
Однако как в этом случае быть с электролитами? Ведь в их составе присутствуют ионы, а не только молекулы. Необходимо более строгое определение. Чистое молекулярное вещество представляет собой то, которое сложено из молекул одного вида, а также, возможно, продуктов их обратимого быстрого превращения (изомеризации, ассоциации, диссоциации). Слово «быстрого» в этом контексте означает, что от этих продуктов мы не можем избавиться, они сразу же появляются вновь. Слово «обратимого» указывает на то, что превращение не доводится до конца. Если доводится, тогда лучше говорить, что оно неустойчиво. В этом случае оно не является чистым веществом.
Закон сохранения массы вещества
Этот закон еще с древнейших времен был известен в метафорической форме. Он гласил, что вещество несотворимо и неуничтожимо. Затем появилась его количественная формулировка. Согласно ей, вес (а с конца 17 столетия – масса) является мерой количества вещества.
Данный закон в привычном для нас виде был открыт в 1748 году Ломоносовым. В 1789 году его дополнил А. Лавуазье, французский ученый. Современная его формулировка звучит так: масса веществ, вступающих в химическую реакцию, равняется массе веществ, которые получаются в результате нее.
Закон Авогадро, закон объемных отношений газов
Последний из них был сформулирован в 1808 году Ж. Л. Гей-Люссаком, французским ученым. В настоящее время этот закон именуется законом Гей-Люссака. Согласно ему, объемы вступающих в реакцию газов относятся друг к другу, а также к объемам полученных газообразных продуктов как целые небольшие числа.
Закономерность, которую обнаружил Гей-Люссак, объясняет закон, который был открыт немного позже, в 1811 году, Амедео Авогадро, итальянским ученым. Он гласит, что при равных условиях (давления и температуры) в газах, имеющих одинаковые объемы, присутствует одинаковое количество молекул.
Два важных следствия вытекают из закона Авогадро. Первое заключается в том, что при одинаковых условиях один моль любого газа занимает равный объем. Объем любого из них при нормальных условиях (которыми являются температура 0 °С, а также давление 101,325 кПа) составляет 22,4 л. Второе следствие данного закона следующее: при равных условиях отношение масс газов, имеющих одинаковый объем, равняется отношению их молярных масс.
Существует и еще один закон, о котором непременно нужно упомянуть. Расскажем о нем вкратце.
Периодический закон и таблица
Д. И. Менделеев, основываясь на химических свойствах элементов и атомно-молекулярном учении, открыл этот закон. Это событие произошло 1 марта 1869 г. Периодический закон является одним из важнейших в природе. Его можно сформулировать следующим образом: свойства элементов и образуемых ими сложных и простых веществ имеют периодическую зависимость от зарядов ядер их атомов.
Периодическая таблица, которую создал Менделеев, состоит из семи периодов и восьми групп. Группами называются ее вертикальные столбцы. Элементы внутри каждой из них имеют схожие физические и химические свойства. Группа, в свою очередь, делится на подгруппы (главные и побочные).
Горизонтальные ряды этой таблицы именуют периодами. Элементы, которые находятся в них, отличаются между собой, однако у них есть и общее – то, что их последние электроны расположены на одном энергетическом уровне. В первом периоде находятся только два элемента. Это водород Н и гелий Не. Восемь элементов имеются во втором периоде. В четвертом их уже 18. Менделеев обозначил этот период как первый большой. В пятом также 18 элементов, его структура схожа с четвертым. В составе шестого – 32 элемента. Седьмой не закончен. Этот период начинается с франция (Fr). Мы можем предположить, что он будет содержать 32 элемента, как и шестой. Однако пока найдено лишь 24.
Правило откета
Согласно правилу откета, все элементы стремятся к тому, чтобы приобрести электрон или потерять его для того, чтобы иметь 8-электронную конфигурацию благородного газа, ближайшего к ним. Энергия ионизации – это то количество энергии, которое необходимо для отделения электрона от атома. Правило откета гласит, что при движении слева направо по периодической таблице необходимо больше энергии для отрыва электрона. Поэтому элементы, находящиеся с левой стороны, стремятся к тому, чтобы потерять электрон. Напротив, те, которые расположены с правой стороны, жаждут его приобрести.
Законы и основные понятия химии кратко мы изложили. Безусловно, это лишь общая информация. В рамках одной статьи невозможно подробно рассказать о столь серьезной науке. Основные понятия и законы химии, кратко изложенные в нашей статье, — это лишь отправная точка для дальнейшего изучения. Ведь в этой науке есть множество разделов. Существует, к примеру, органическая и неорганическая химия. Основные понятия каждого из разделов этой науки можно изучать очень долго. Но те, которые представлены выше, относятся к общим вопросам. Поэтому можно сказать, что это основные понятия органической химии, как и неорганической.
ОСНОВНЫЕ ХИМИЧЕСКИЕ ТЕРМИНЫ (Словарь)
Страница 1 из 3
Справочник основных химических терминов.
А
Абсорбция — поглощение веществ из газовой смеси или жидкости жидкостями или твердыми телами; применяется в промышленности для разделения газовых смесей, очистки газов от примесей в специальных аппаратах — абсорберах.
Автоклав — аппарат для проведения химических реакций под давлением в замкнутой системе.
Адгезия — молекулярная связь между молекулами на поверхностях двух соприкасающихся разнородных тел; имеет большое значение при склеивании материалов и для обеспечения защитных свойств лакокрасочных покрытий.
Адсорбция — поглощение вещества на поверхности твердого тела под влиянием молекулярных сил поверхности.
Азеотропные смеси — растворы, перегоняющиеся при постоянной температуре без изменения состава; такие смеси нельзя разделить перегонкой.
Азиды — соли азотистоводородной кислоты HN3, например азид натрия Na — N = N ≡ N.
Азокрасители — органические соединения, содержащие азогруппу —N = N—, связывающую ароматические радикалы — самый многочисленный класс синтетических красителей.
Азотные удобрения — химические вещества, содержащие в своем составе азот, способный служить питательным веществом для растений.
Алкил — обобщенное название одновалентных радикалов ряда насыщенных углеводородов: СН3—, СН3СН2—, СН3СН2СН2— и т. д.
Алкоголиз — реакция со спиртами, например взаимодействие хлористого ацетила с этиловым спиртом.
Аллотропия — способность химического элемента существовать в виде двух или большего числа простых веществ, например кислород и озон, графит и алмаз.
Альдегиды — класс органических соединений, содержащих группу —С<OH. Простейший представитель альдегидов — формальдегид
Амальгамы — металлические системы, одним из компонентов которых является ртуть.
Аминокислоты — карбоновые кислоты, содержащие одну или несколько аминогрупп; являются структурными элементами молекул белков (например, глицин NH2CH2COOH, аланин CH3CH(NH2)COOH).
Амины — продукты замещения одного или нескольких атомов водорода в молекуле аммиака NH3 различными органическими радикалами, например CH3NH2 — метиламин, (C2H5)2NH—диэтила- мин; способны связывать галогенводороды с образованием четвертичных солей, например (C2H5)3N·HCl — солянокислый триэтиламин.
Аналитическая химия — наука о методах определения состава вещества.
Ангидриды — кислородные соединения, получаемые в результате отщепления воды от кислоты, например В2O3, СО2, Р2О5 и т. д.
Ангстрем — единица длины, равная одной стомиллионной доле сантиметра.
Анион — отрицательно заряженный ион.
Анод — электрод, соединенный с положительным источником тока.
Антибиотики — вещества, образуемые микроорганизмами в процессе их жизнедеятельности и обладающие способностью убивать окружающих микробов; в настоящее время выделено и описано более 400 антибиотиков, многие из которых можно получить синтетическим путем.
Антидетонаторы топлив — химические соединения, добавляемые в количествах менее 1% к моторным топливам для повышения их стойкости к детонации. В последнее время вместо токсичного тетраэтилсвинца химиками получен новый эффективный антидетонатор — метилциклопентадиенилтрикарбонилмарганец СН3С5Н4Мn(СО)3.
Антиоксиданты — вещества, предотвращающие или замедляющие окисление органических соединений молекулярным кислородом; в качестве антиоксидантов применяют ароматические соединения, содержащие гидроксильную группу или аминогруппу.
Антифризы — низкозамерзающие жидкости, применяемые в установках, работающих при низких температурах, для охлаждения двигателей; например, смесь, содержащая 66,7% этиленгликоля и 33,3% воды, замерзает при —75° С.
Арил — обобщенное название одновалентных радикалов ароматического ряда, например С6Н5 — фенил, СН3С6Н4 — толил.
Атом — мельчайшая частица элемента, сохраняющая все его химические свойства.
Атомный вес — среднее значение массы атома химического элемента, выраженной в относительных углеродных единицах.
Ацетатное волокно — искусственное волокно, получаемое из растворов ацетилцеллюлозы путем формования через тонкие отверстия — фильеры-
Ацилирование — реакция замещения водорода в органических соединениях остатком карбоновой кислоты RCO (ацильным остатком).
Аэрозоли — системы, состоящие из мелких твердых или жидких частиц, взвешенных в воздухе или другом газе.
Б
Белки — высокомолекулярные природные соединения, являющиеся продуктами поликонденсации а-аминокислот; важнейшая составная часть всех живых организмов. Основная структурная единица — полипептидная цепь
Бензины — сложные смеси легких углеводородов с температурой кипения не выше 205° С, применяемые в качестве топлива в двигателях с искровым зажиганием; получают в процессе переработки нефти.
Биохимия — наука о химическом составе организмов и химических процессах, протекающих в организме.
В
Валентность — свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Взрывоопасные вещества — соединения или смеси, которые в условиях переработки или транспортировки способны к взрыву; работа с ними требует соблюдения особых мер предосторожности.
Взрывчатые вещества — химические соединения или смеси, способные к быстрому превращению с образованием большого количества газообразных продуктов.
Вискозиметр — прибор для определения вязкости жидкостей. Наиболее простой — вискозиметр Оствальда, основанный на измерении скорости истечения определенного количества жидкости в узкой трубке постоянного сечения.
Вода тяжелая — изотопная разновидность воды, в которой обыкновенный водород замещен его тяжелым изотопом — дейтерием D. Формула HDO или D2O.
Водородный показатель pH — величина, характеризующая концентрацию ионов водорода в растворах; численно равна отрицательному логарифму концентрации, выраженной в грамм-ионах на литр.
Возгонка (сублимация) — превращение вещества при нагревании из твердого состояния непосредственно в пар без плавления.
Восстановление — химическая реакция, в результате которой к атомам или ионам присоединяются электроны. В органической химии восстановлением называют присоединение водорода к молекуле органического соединения.
Вспышки температура — минимальная температура, при которой пары жидкости образуют в закрытом сосуде смесь, способную воспламеняться.
Вулканизация — технологический процесс резинового производства, при котором сырой каучук путем образования поперечных связей между молекулами превращается в эластичную резину.
Выпаривание — процесс концентрирования растворов твердых веществ путем частичного удаления растворителя при кипении.
Высокомолекулярные соединения (полимеры) — химические соединения, молекулярный вес которых составляет величину от нескольких тысяч до нескольких миллионов.