Оксид серы (IV) | справочник Пестициды.ru
Информация
Традиционно содержание Серы в удбрениях выражают содержанием Оксида серы. Все свойства Серы, как питательного элемента описаны в статье Сера.
Подробнее »
Химические и физические свойства
Диоксид серы – бесцветный газ с резким запахом. Молекула имеет угловую форму.
- Температура плавления – -75,46 °С,
- Температура кипения – -10,6 °С,
- Плотность газа – 2,92655 г/л.
Легко сжижается в бесцветную легкоподвижную жидкость при температуре 25 °С и давлении около 0,5 МПа.
Для жидкой формы плотность равна 1,4619 г/см3 (при – 10 °С).
Твердый диоксид серы – бесцветные кристаллы, ромбической сингонии.
Диоксид серы заметно диссоциирует только около 2800 °С.
Диссоциация жидкого диоксида серы проходит по схеме:
2SO2 ↔ SO2+
Трехмерная модель молекулы
Растворимость диоксида серы в воде зависит от температуры:
- при 0 °С в 100 г воды растворяется 22,8 г диоксида серы,
- при 20 °С – 11,5 г,
- при 90 °С – 2,1 г.
Водный раствор диоксида серы – это сернистая кислота H2SO3.
Диоксид серы растворим в этаноле, H2SO4, олеуме, CH3COOH. Жидкий сернистый ангидрид смешивается в любых соотношениях с SO3. CHCl3, CS2, диэтиловым эфиром.
Жидкий сернистый ангидрид растворяет хлориды. Иодиды и роданиды металлов не растворяются.
Соли, растворенные в жидком диоксиде серы, диссоциируют.
Диоксид серы способен восстанавливаться до серы и окисляться до шестивалентных соединений серы.
Диоксид серы токсичен. При концентрации 0,03–0,05 мг/л раздражает слизистые оболочки, органы дыхания, глаза.
Основной промышленный способ получения диоксида серы – из серного колчедана FeS2 путем его сжигания и дальнейшей обработки слабой холодной H2SO4.
Кроме того, серный диоксид можно получить путем сжигания серы, а также как побочный продукт обжига медных и цинковых сульфидных руд.[2]
Содержание диоксида серы в почве и удобрениях
Неорганические соединения серы представлены сульфатами (гипс CaSO4•2H2O, ангидрит CaSO4) и сульфидами (пирит FeS2).
Сульфидная сера доступна растениям только после перехода в сульфатную форму. Большая часть серы присутствует в почве в составе органических соединений, не усваиваемых растениями. Только после минерализации органических веществ и перехода серы в сульфатную форму органическая сера становится доступной для растений.
Химическая промышленность не выпускает удобрений с основным действующим веществом диоксидом серы. Однако в качестве примесей он содержится во многих удобрениях. К ним относятся фосфогипс, простой суперфосфат, сульфат аммония, сульфат калия, калимагнезия, гипс, сланцевая зола, навоз, торф и многие другие.[1]
Поглощение диоксида серы растениями
Сера поступает в растения через корни в виде SO42- и листья в виде диоксида серы. При этом поглощение серы из атмосферы обеспечивает до 80 % потребности растений в данном элементе. В связи с этим вблизи промышленных центров, где атмосфера богата диоксидом серы, растения хорошо обеспечены серой. В удаленных районах количество сернистого ангидрида в осадках и атмосфере сильно снижается и питание растений серой зависит от ее наличия в почве.[2]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
2.Химическая энциклопедия: в 5 томах: том 4: Полимерные-Трипсин/Редколлегия: Зефиров Н.С. (гл. ред.) и др. – М.: Большая Российская энциклопедия, 1995. – 639 с.: ил
Свернуть Список всех источниковОксид серы — Знаешь как
Кислотные соединения серы. У серы несколько соединений с кислородом , но важнейшие из них ( IV ) SO2 и ( VI ) SO3 .Оксиды серы ( IV ) получают при нагревании серы на воздухе :
S + O2 = SO2
В лаборатории её получают действием соляной кислоты на сульфиты :
Na2SO3 + 2HCl = SO2↑+ 2NaCl + h3O
или взаимодействием концентрированной серной кислоты с медью :
2h3SO4 + Cu = SO2↑ + CuSO4 + 2h3O
В сернокислотном производстве оксид серы ( IV ) получают обжигом пирита :
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Также оксид серы получают как побочный продукт при коксовании углей .
SO2 — бесцветный газ с запахом горящей серы , сжижается при -10,09°C , затвердевает при — 70°C . Он ядовит , вдыхание воздуха , содержание более 0,2% оксида серы ( IV ) вызывает заболевание .
Молекулы оксида серы ( IV ) не ассоциированы и построены аналогично молекуле озона . Атомы в молекуле SO2 образуют равнобедренный треугольник , в котором расстояние S-O равны 1,43 А , а угол O — S — O составляет 119 градусов .
Поскольку сера в степени окисления + 4 может терять два электрона или присоединять шесть электронов , оксид серы ( IV ) в одной реакции ведёт себя как восстановитель , а в других — как окислитель . Оксид серы ( IV ) обесцвечивает органические пигменты и его применяют иногда для отбеливания шёлка , шерсти и соломы , так как они разрушаются под воздействием хлора . Но в отличие от хлора оксид серы ( IV ) не разрушает красители , а лишь образует с ними непрочные , бесцветные соединения , которые разлагаются под действием тепла и света и первоначальная окраска растительного пигмента восстанавливается . При 20°C в 1 объёме воды растворяется 39,4 объёма оксида серы ( IV ) , часть которой химически взаимодействует с водой и образуется двухосновная сернистая кислота средней силы :
SO2 + h3O ⇄ h3SO3 ⇄ H⁺ + HSO3 ⇄ 2H⁺ + SO3
Сернистая кислота нестойкая , существует только в водных растворах , при нагревании её раствора равновесие смещается влево и выделяется оксид серы ( IV ) .
В окислительно — восстановительных реакциях сернистая кислота обычно играет роль восстановителя и окисляется до серной кислоты :
+4 0 +6 — 1
h3SO3 + Cl2 + h3O = h3SO4 + 2HCl
Она постепенно окисляется до серной кислоты даже кислородом воздуха , но , взаимодействуя с более сильными восстановителями , например с сероводородом , сернистая кислота ведёт себя как окислитель и восстанавливается до свободной серы :
h3SO3 + 2h3S = 3S↓ + 3h3O
Средние соли сернистой кислоты называют сульфитами ( например , Na2SO3 — сульфит натрия ) , а кислые гидросульфитами ( NaHSO3 — гидросульфит натрия ) . Сульфиты — также активные восстановители .
Тиосерная кислота h3S2O3 — неустойчивая даже в водных растворах и считается производным серной кислоты , в молекуле которой один атом кислорода замещён атомом серы .
Соли тиосерной кислоты — тиосульфаты более стойки . При кипячении раствора сульфита натрия с серой получается тиосульфат натрия , который при понижении температуры выкристаллизовывается в виде Na2S2O3 · 2h3O Сильные кислоты ( соляная кислота ) вытесняют из тиосульфатов тиосерную кислоту :
Na2S2O3 + 2HCl = h3S2O3 + 2NaCl
Которая разлагается с выделением двуокиси серы и свободной серы :
h3S2O3 = S↓+ SO2↑ + h3O
Тиосульфат натрия или гипосульфит широко использовался в применении в фотографии . Действие его как закрепителя основано на свойстве растворять неразложившийся бромид серебра с образованием комплексной соли :
AgBr + 2Na2S2O3 + Na3[Ag( S2O3 )2] + NaBr
Тиосульфат натрия легко окисляется хлором и бромом , (а также другими сильными окислителями ) до серной кислоты ( или сульфатов ) :
Na2S2O3 + 4Cl2 + 5h3O = 2h3SO4 + 6HCl + 2NaCl
На этой реакции основано применение тиосульфата натрия для удаления остатков хлора , кроме того он использовался в ветеринарии и медицине .
Оксид серы (VI )
Окисление оксида серы ( IV ) SO2 до оксида серы ( VI ) SO3 при обычных условиях протекает медленно , однако эта реакция ускоряется при нагревании ( до 450°C ) в присутствии катализаторов ( мелко раздробленной платины , оксидов ванадия , хрома или железа ) .
Различают две модификации оксида серы ( VI ) .
Одна из них жидкая , плотностью 1,92 г/см³, кипит при 44,9°C , а при 16,8°C затвердевает в кристаллы , напоминающие лёд . Она состоит из ( SO3 )3 , т.е. состоит из циклических тримерных молекул и называется льдовидной модификацией , но при хранении SO3 полимеризуется :xSO3 ⇄ ( SO3 )x
и получается асбестовидная модификация оксида серы ( VI ) , представляющие собой шелковистые кристаллы и состоящих из длинных цепей , образованных тетраэдрами SO4 .
Оксид серы ( VI ) жадно соединяется с водой , образуя серную кислоту :
SO3 + h3O = h3SO4
Статья на тему Оксид серы
Оксид серы(VI) — это… Что такое Оксид серы(VI)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO
3.Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
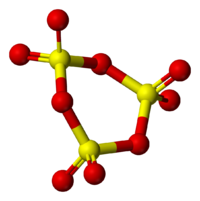 Пространственная модель молекулы γ-SO3
Пространственная модель молекулы γ-SO3Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3):
Можно получить термическим разложением сульфатов:
или взаимодействием SO2 с озоном:
Для окисления SO2 используют также NO2:
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
и оксидами:
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Оксид серы(IV) — Википедия
У этого термина существуют и другие значения, см. Оксид серы.| Оксид серы | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Хим. формула | SO2 |
| Состояние | бесцветный газ |
| Молярная масса | 64,054 г/моль |
| Плотность | 0,002927 г/см³ |
| Энергия ионизации | 12,3 ± 0,1 эВ[1] |
| Т. плав. | −75,5 °C |
| Т. кип. | −10,01 °C |
| Энтальпия образования | −296,90 кДж/моль |
| Давление пара | 3,2 ± 0,1 атм[1] |
| Растворимость в воде | 11,5 г/100 мл |
| Рег. номер CAS | [7446-09-5] |
| PubChem | 1119 |
| Рег. номер EINECS | 231-195-2 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E220 |
| RTECS | WS4550000 |
| ChEBI | 18422, 45789, 45819 и 8992 |
| ChemSpider | 1087 |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Окси́д се́ры(IV) (диокси́д се́ры, двуокись серы, серни́стый газ, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Токсичен. Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой серни́стой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле и се́рной кислоте. Один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
- 2FeS2+5O2→2FeO+4SO2.{\displaystyle {\mathsf {2FeS_{2}+5O_{2}\rightarrow 2FeO+4SO_{2}}}.}
В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
- Na2SO3+h3SO4→Na2SO4+h3SO3,{\displaystyle {\mathsf {Na_{2}SO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}SO_{3}}},}
- h3SO3→h3O+SO2↑.{\displaystyle {\mathsf {H_{2}SO_{3}\rightarrow H_{2}O+SO_{2}\uparrow }}.}
Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазоне.Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
- SO2+h3O⇄h3SO3.{\displaystyle {\mathsf {SO_{2}+H_{2}O\rightleftarrows H_{2}SO_{3}}}.}
С щелочами образует сульфиты:
- 2NaOH+SO2→Na2SO3+h3O.{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}.}
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
- SO2+Br2+2h3O→h3SO4+2HBr,{\displaystyle {\mathsf {SO_{2}+Br_{2}+2H_{2}O\rightarrow H_{2}SO_{4}+2HBr}},}
- SO2+I2+2h3O→h3SO4+2HI,{\displaystyle {\mathsf {SO_{2}+I_{2}+2H_{2}O\rightarrow H_{2}SO_{4}+2HI}},}
- 2SO2+O2→Pt450oC2SO3,{\displaystyle {\mathsf {2SO_{2}+O_{2}{\xrightarrow[{Pt}]{450^{o}C}}2SO_{3}}},}
- 5SO2+2KMnO4+2h3O→2h3SO4+2MnSO4+K2SO4,{\displaystyle {\mathsf {5SO_{2}+2KMnO_{4}+2H_{2}O\rightarrow 2H_{2}SO_{4}+2MnSO_{4}+K_{2}SO_{4}}},}
- Fe2(SO4)3+SO2+2h3O→2FeSO4+2h3SO4.{\displaystyle {\mathsf {Fe_{2}(SO_{4})_{3}+SO_{2}+2H_{2}O\rightarrow 2FeSO_{4}+2H_{2}SO_{4}}}.}
Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
- SO2+2CO→2CO2+S.{\displaystyle {\mathsf {SO_{2}+2CO\rightarrow 2CO_{2}+S}}.}
Или для получения фосфорноватистой кислоты:
- Ph4+SO2→HP(OH)2+S.{\displaystyle {\mathsf {PH_{3}+SO_{2}\rightarrow HP(OH)_{2}+S}}.}
Применение
Большая часть оксида серы(IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таком его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и, как следствие присутствия воды, H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре[2]. Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
Токсическое действие
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
- ПДК (предельно допустимая концентрация):
- в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
- в помещении (рабочая зона) — 10 мг/м³
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Биологическая роль
Роль эндогенного сернистого газа в физиологии организма млекопитающих ещё окончательно не выяснена.[3] Сернистый газ блокирует нервные импульсы от рецепторов растяжения лёгких и устраняет рефлекс, возникающий в ответ на перерастяжение лёгких, стимулируя тем самым более глубокое дыхание.
Показано, что эндогенный сернистый газ играет роль в предотвращении повреждения лёгких, уменьшает образование свободных радикалов, оксидативный стресс и воспаление в лёгочной ткани, в то время как экспериментальное повреждение лёгких, вызываемое олеиновой кислотой, сопровождается, наоборот, снижением образования сернистого газа и активности опосредуемых им внутриклеточных путей и повышением образования свободных радикалов и уровня оксидативного стресса. Что ещё более важно, блокада фермента, способствующего образованию эндогенного сернистого газа, в эксперименте способствовала усилению повреждения лёгких, оксидативного стресса и воспаления и активации апоптоза клеток лёгочной ткани. И напротив, обогащение организма подопытных животных серосодержащими соединениями, такими, как глютатион и ацетилцистеин, служащими источниками эндогенного сернистого газа, приводило не только к повышению содержания эндогенного сернистого газа, но и к уменьшению образования свободных радикалов, оксидативного стресса, воспаления и апоптоза клеток лёгочной ткани.[4]
Считают, что эндогенный сернистый газ играет важную физиологическую роль в регуляции функций сердечно-сосудистой системы, а нарушения в его метаболизме могут играть важную роль в развитии таких патологических состояний, как лёгочная гипертензия, гипертоническая болезнь, атеросклероз сосудов, ишемическая болезнь сердца, ишемия-реперфузия и др.[5]
Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина (вредного токсичного метаболита цистеина) и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии. Предложено использовать гомоцистеин как маркер степени тяжести состояния этих больных и указано, что метаболизм эндогенного сернистого газа может быть важной терапевтической мишенью у этих больных.[6]
Также показано, что эндогенный сернистый газ понижает пролиферативную активность клеток гладких мышц эндотелия сосудов, угнетая активность MAPK-сигнального пути и одновременно активируя аденилатциклазный путь и протеинкиназу A.[7] А пролиферация гладкомышечных клеток стенок сосудов считается одним из механизмов гипертензивного ремоделирования сосудов и важным звеном патогенеза артериальной гипертензии, а также играет роль в развитии стеноза (сужения просвета) сосудов, предрасполагающего к развитию в них атеросклеротических бляшек.
Эндогенный сернистый газ оказывает эндотелий-зависимое вазодилатирующее действие в низких концентрациях, а в более высоких концентрациях становится эндотелий-независимым вазодилататором, а также оказывает отрицательное инотропное действие на миокард (понижает сократительную функцию и сердечный выброс, способствуя снижению артериального давления). Этот вазодилатирующий эффект сернистого газа опосредуется через АТФ-чувствительные кальциевые каналы и кальциевые каналы L-типа («дигидропиридиновые»). В патофизиологических условиях эндогенный сернистый газ оказывает противовоспалительное действие и повышает антиоксидантный резерв крови и тканей, например при экспериментальной лёгочной гипертензии у крыс. Эндогенный сернистый газ также снижает повышенное артериальное давление и тормозит гипертензивное ремоделирование сосудов у крыс в экспериментальных моделях гипертонической болезни и лёгочной гипертензии. Последние (на 2015 год) исследования показывают также, что эндогенный сернистый газ вовлечён в регуляцию липидного метаболизма и в процессы ишемии-реперфузии.[8]
Эндогенный сернистый газ также уменьшает повреждение миокарда, вызванное экспериментальной гиперстимуляцией адренорецепторов изопротеренолом, и повышает антиоксидантный резерв миокарда.[9]
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное[10][11]. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие её в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида. Необходимо отметить также, что диоксид серы имеет максимум в спектре поглощения света в ультрафиолетовой области (190—220 нм), что совпадает с максимумом в спектре поглощения озона. Это свойство диоксида серы позволяет утверждать, что наличие этого газа в атмосфере имеет также положительный эффект, предотвращая возникновение и развитие онкологических заболеваний кожи человека. Диоксид серы в атмосфере Земли существенно ослабляет влияние парниковых газов (диоксид углерода, метан) на рост температуры атмосферы[12]. Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже[13].
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0575.html
- ↑ Гордон А., Форд Р. Спутник химика / Пер. на русск. Е. Л. Розенберга, С. И. Коппель. — М.: Мир, 1976. — 544 с.
- ↑ Liu, D.; Jin, H; Tang, C; Du, J. Sulfur dioxide: a novel gaseous signal in the regulation of cardiovascular functions (англ.) // Mini-Reviews in Medicinal Chemistry (англ.)русск. : journal. — 2010. — Vol. 10, no. 11. — P. 1039—1045. — PMID 20540708. Архивировано 26 апреля 2013 года.
- ↑ Chen S, Zheng S, Liu Z, Tang C, Zhao B, Du J, Jin H. Endogenous sulfur dioxide protects against oleic acid-induced acute lung injury in association with inhibition of oxidative stress in rats. // Lab Invest.. — Feb 2015. — Т. 95, вып. 95(2), № 2. — С. 142—156. — DOI:10.1038/labinvest.2014.147. — PMID 25581610.
- ↑ Tian H. Advances in the study on endogenous sulfur dioxide in the cardiovascular system. // Chin Med J. — Nov 2014. — Т. 127, вып. 127(21), № 21. — С. 3803—3807. — PMID 25382339.
- ↑ Yang R, Yang Y, Dong X, Wu X, Wei Y. Correlation between endogenous sulfur dioxide and homocysteine in children with pulmonary arterial hypertension associated with congenital heart disease (кит.) // Zhonghua Er Ke Za Zhi. — Aug 2014. — 第52卷, 第52(8)期, 第8数. — 第625—629 页. — PMID 25224243.
- ↑ Liu D, Huang Y, Bu D, Liu AD, Holmberg L, Jia Y, Tang C, Du J, Jin H. Sulfur dioxide inhibits vascular smooth muscle cell proliferation via suppressing the Erk/MAP kinase pathway mediated by cAMP/PKA signaling. // Cell Death Dis.. — May 2014. — Т. 5, вып. 5(5), № 5. — С. e1251. — DOI:10.1038/cddis.2014.229.. — PMID 24853429.
- ↑ Wang XB, Jin HF, Tang CS, Du JB. The biological effect of endogenous sulfur dioxide in the cardiovascular system. // Eur J Pharmacol.. — 16 Nov 2011. — Т. 670, вып. 670(1), № 1. — DOI:10.1016/j.ejphar.2011.08.031. — PMID 21925165.
- ↑ Liang Y, Liu D, Ochs T, Tang C, Chen S, Zhang S, Geng B, Jin H, Du J. Endogenous sulfur dioxide protects against isoproterenol-induced myocardial injury and increases myocardial antioxidant capacity in rats. // Lab Invest.. — Jan 2011. — Т. 91, вып. 91(1), № 1. — С. 12—23. — DOI:10.1038/labinvest.2010.156. — PMID 20733562.
- ↑ Серный ангидрид, его воздействие на окружающую среду (неопр.). Дата обращения 21 ноября 2013.
- ↑ Основы расчета нормативов пдв (неопр.). Дата обращения 21 ноября 2013.
- ↑ Проблемы загрязнения атмосферы. Парниковый эффект. (неопр.). Дата обращения 21 ноября 2013.
- ↑ Экологические кризисы (неопр.). Дата обращения 21 ноября 2013.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки
Оксид серы(VI) — это… Что такое Оксид серы(VI)?
У этого термина существуют и другие значения, см. Оксид серы.Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
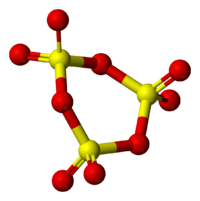 Пространственная модель молекулы γ-SO3
Пространственная модель молекулы γ-SO3Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3):
Можно получить термическим разложением сульфатов:
или взаимодействием SO2 с озоном:
Для окисления SO2 используют также NO2:
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
и оксидами:
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
Двуокись серы — это… Что такое Двуокись серы?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
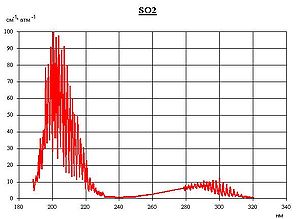
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие

SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.
Оксид серы (IV) — это… Что такое Оксид серы (IV)?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
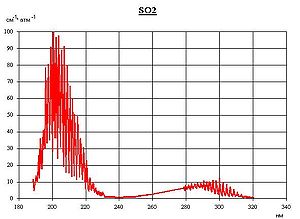
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие

SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.