Плотность жидком двуокиси серы — Справочник химика 21
Двуокись серы кипит при —10°, но она может быть сжижена при комнатной температуре под давлением. Плотность жидкой двуокиси серы при 20° равна 1,45. Вследствие весьма низкой температуры кипения двуокись серы очень легко отгоняется из смеси с нефтяными продуктами ее низкая вязкость и высокая плотность способствуют легкому разделению двух фаз при отстаивании. [c.313]Жидкая двуокись серы. Сернистый газ был сжижен в 1780 г. первым из всех газов. Жидкая двуокись серы бесцветна и очень подвижна. Температура кипения ее при нормальном давлении —10,09° температура кристаллизации —72,7°. Критическая плотность двуокиси серы, 0,516 г/сл . [c.25]
Двуокись серы принадлежит к сравнительно легко сжижаемым газам. При атмосферном давлении газообразную 100%-ную двуокись серы можно превратить в жидкое состояние при —10°. С повышением температуры необходимое давление и соответствующий расход энергии на сжатие увеличиваются, а скрытая теплота конденсации и плотность жидкости уменьшаются, что видно из табл. 1П, IV и V (см. Приложение) и из следующих данных
Процесс очистки протекает в смесителе — цилиндрическом аппарате, в который снизу поступает очищаемый продукт (смазочное масло), а сверху жидкая двуокись серы. Жидкости в смесителе вследствие разницы плотностей передвигаются противотоком. Сверху из смесителя вытекает рафинат — очищенный продукт, содержащий растворенную в нем двуокись серы. Снизу вытекает окстракт — раствор в двуокиси серы содержавшихся в масле примесей. В смесителе поддерживается температура около —10°. [c.238]
Двуокись серы применяется и в холодильном деле. Она очень легко конденсируется и имеетбольшую теплоту испарения. При температуре кипения сжиженного газа (—10,0°) теплота испарения составляет код/г. Давление паров SO2 при 0° равно 1,52 атм, при 20° — 3,3 атм- удельный вес жидкой двуокиси серы при —10° равен 1,46. Критическая температура 157,2°, критическое давление 77,7 атм, критическая плотность 0,51. Температура замерзания —72,5°. Плотность в газообразном состоянии при нормальных условиях составляет 2,2630 но отношению к плотности воздуха, принятой за 1 (вес 1 л газообразной SO2 равен 2,9256 г). Так как двуокись серы легко конденсируется, ее поведение довольно плохо подчиняется законам идеальных газов. [c.768]
Система Ы — 5 Ог. По этой системе имеется несколько патентов [54, 55]. Растворителем может быть сама двуокись серы в жидком состоянии или органический растворитель,, насыщенный 50г. На основе системы Ь1—50г был предложен элемент без разделения анодного и катодного пространств специальным сепаратором, несмотря на то, что деполяризатор в этой системе растворим в электролите. Литиевый анод при контакте с раствором 50г покрывается пассивирующей пленкой нерастворимого соединения Ыг5204, которая играет роль полупроницаемой мембраны. Элемент с литиевым анодом, катодом из керамического пористого никеля и 1 М раствором (СгН5)4МВг в диметилсульфите в качестве электролита, насыщенном 50г, имеет э. д. с. 2,6 в, разрядное напряжение при плотности тока 10 ма см 2,2 в и при 22 ма см —
Известен полимерный сульфид германия (СеЗг) п—белый порошок, осаждаемый сероводородом из сильнокислых растворов солей германия сульфид плавится при 800°. Воздействуя жидким аммиаком на четыреххлористый германий, а также аммиаком на германий (650— 700°) или на двуокись германия (700—750°) получают полимерный нитрид (ОезЫ4)п. Светло-серые ромбоэдрические кристаллы этого полимерного тела плотностью 5,35 разлагаются на элементы при нагреве выше 1000°. Полимер устойчив в кипящей воде, щелочах и разбавленных кислотах. [c.162]
Физические свойства сернистого газа: плотность, теплопроводность SO2
Рассмотрены физические свойства сернистого газа (SO2, диоксид серы) при нормальном атмосферном давлении в зависимости от температуры — в диапазоне от 0 до 1000°С. В таблице приведены следующие свойства: плотность сернистого газа ρ, массовая удельная теплоемкость при постоянном давлении Cp, коэффициент динамической вязкости μ, коэффициент теплопроводности λ.
Плотность сернистого газа при нормальных условиях равна 2,926 кг/м3. При нагревании диоксида серы его плотность снижается за счет теплового расширения этого газа. К примеру, при нагревании до 1000°С плотность сернистого газа уменьшается до величины 0,626 кг/м3, то есть более чем в 4,5 раза.
Плотность сернистого газа ρ достаточно высока. Ее величина соизмерима с плотностью таких газов, как фтористый бор, гексагидрид кремния, фторокись азота. Если сравнить плотность этого газа с плотностью воздуха можно сделать вывод, что сернистый газ более чем в 2 раза тяжелее воздуха.
Удельная теплоемкость сернистого газа Cp при температуре 0°С равна 607 Дж/(кг·град). С ростом температуры сернистого газа его удельная теплоемкость увеличивается. Следует отметить, что теплоемкость диоксида серы имеет меньшее значение, чем у воздуха.
Сернистый газ менее вязкий, чем воздух. Например, динамическая вязкость SO2 при нормальных условиях равна 1,16·10-7 Па·с, в то время как вязкость воздуха составляет величину 17,2·10-6 Па·с. Характер зависимости вязкости сернистого газа μ от температуры подобен таковой у многих других газов — сернистый газ при нагревании становится более вязким.
Коэффициент теплопроводности сернистого газа λ имеет низкое значение. Он существенно ниже теплопроводности многих неорганических и органических газов. Теплопроводность сернистого газа сравнима с теплопроводностью некоторых фреонов. Необходимо отметить, что при нагревании диоксид серы становиться более теплопроводным.
| Температура SO2, °C | ρ, кг/м3 | Cp, Дж/(кг·град) | μ·107, Па·с | λ, Вт/(м·град) |
|---|---|---|---|---|
| 0 | 2,926 | 607 | 1,16 | 0,0084 |
| 50 | 2,533 | 635 | 1,39 | 0,0104 |
| 100 | 2,14 | 662 | 1,61 | 0,0123 |
| 150 | 1,915 | 687 | 1,81 | 0,0145 |
| 200 | 1,69 | 712 | 2 | 0,0166 |
| 250 | 1,543 | 733 | 2,19 | 0,0189 |
| 300 | 1,395 | 754 | 2,38 | 0,0212 |
| 350 | 1,291 | 769 | 2,57 | 0,0235 |
| 400 | 1,187 | 783 | 2,75 | 0,0258 |
| 450 | 1,11 | 796 | 2,94 | 0,0283 |
| 500 | 1,033 | 808 | 3,13 | 0,0307 |
| 550 | 0,975 | 817 | 3,29 | 0,0333 |
| 600 | 0,916 | 825 | 3,45 | 0,0358 |
| 650 | 0,904 | 831 | 3,6 | 0,0384 |
| 700 | 0,892 | 837 | 3,75 | 0,041 |
| 750 | 0,818 | 844 | 3,89 | 0,0437 |
| 800 | 0,743 | 850 | 4,03 | 0,0463 |
| 850 | 0,712 | 854 | 4,16 | 0,0491 |
| 900 | 0,681 | 858 | 4,29 | 0,0519 |
| 950 | 0,654 | 863 | 4,41 | 0,0548 |
| 1000 | 0,626 | 867 | 4,53 | 0,0576 |
Источник:
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей.
Ответы на билеты СКП
Ответы на билеты СКПОсновные свойства серы, твердой, жидкой, газообразной, ее использование для производства серной кислотыДве модификации серы
Твердая (кристаллическая) сера устойчиво существует в виде двух модификаций :
ромбическая (Sальфа ) и
моноклинная (Sбэта ).
Существует также аморфная (пластическая) форма Sмю .
При температуре ниже 95,4 °С сера кристаллизуется в ромбической системе (почти вся природная сера), а выше 95,5 °С – в моноклинной системе. При температуре выше 119 °С (при 1 атм) твердая сера не существует, при температуре ниже 110 °С и том же давлении не существует жидкой серы.
Физические свойства серы
Разнообразие физических свойств, способность проявлять как восстановительные, так и окислительные свойства, меняя степень окисления от – 2 до + 6, это связано с тем, что при различной температуре и в зависимости от других условий молекулы серы могут состоять из разного числа атомов с различным их расположением в молекуле. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и с открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. При 120 °С расплавленная сера представляет собой желтую легкоподвижную жидкость, вязкость которой повышается с ростом температуры , отличие от всех жидкостей, достигая максимума при 192 °С , превращаясь в темно-коричневую вязкую, как смола, массу.
Причина увеличения вязкости жидкой серы
От 159 °С до 192 °С вязкость жидкой серы возрастает в 15 тыс. раз за счет полимеризации молекул (полимеризационные цепочки достигают 106 атомов). При дальнейшем повышении температуры вязкость массы вновь снижается и при 400 С расплав становится легкоподвижным. При температуре 444,6 °С сера кипит.
Горение серы – сложный процесс (из-за большой зависимости физико-химических свойств от температуры и др. факторов). Сера горит, образуя сернистый ангидрид — SO2 — бесцветный газ с резким запахом:
S + O2 = SO2
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820°C. Жидкая и твердая сера не взаимодействует с металлами, парообразная – сильно их разрушает.
Преимущества использования серы для производства серной кислоты:
2. не остается огарка, удаление которого связано с большими затратами;
3. в самородной сере присутствует лишь незначительное количество мышьяка, что позволяет направлять газ после сжигания серы в контактное производство серной кислоты без специальной очистки газов от мышьяка.
Назад
Сероуглерод — Википедия
Сероуглерод CS2 — соединение серы с углеродом.
Чистый сероуглерод представляет собой бесцветную жидкость с приятным «эфирным» запахом. Технический продукт, полученный сульфидированием угля, имеет неприятный «редечный» запах. Молекула CS2 линейна, длина связи С—S = 0,15529 нм; энергия диссоциации 1149 кДж/моль.
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости[2].
- CS2+3O2→CO2+2SO2{\displaystyle {\mathsf {CS_{2}+3O_{2}\rightarrow CO_{2}+2SO_{2}}}}
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). При реакции с щелочами образуются соли дитиоугольной кислоты и продукты их диспропорционирования.
Однако сероуглерод, в отличие от диоксида углерода, проявляет большую реакционную способность по отношению к нуклеофилам и легче восстанавливается.
Так, сероуглерод способен реагировать с C-нуклеофилами, его взаимодействие с енолятами активированных метиларилкетонов идет с образованием бис-тиолятов арилвинилкетонов, которые могут быть проалкилированы до бис-алкилтиоарилвинилкетонов; эта реакция имеет препаративное значение[3]:
- PyCOCh4+CS2+2t-BuOK→PyCOCH=C(S−K+)2+2t-BuOH{\displaystyle {\mathsf {PyCOCH_{3}+CS_{2}+2t{\text{-}}BuOK\rightarrow PyCOCH{\text{=}}C(S^{-}K^{+})_{2}+2t{\text{-}}BuOH}}}
- PyCOCH=C(S−K+)+2MeI→PyCOCH=C(SMe)2+2KI{\displaystyle {\mathsf {PyCOCH{\text{=}}C(S^{-}K^{+})+2MeI\rightarrow PyCOCH{\text{=}}C(SMe)_{2}+2KI}}}
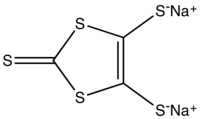
При взаимодействии с натрием в диметилформамиде сероуглерод образует 1,3-дитиол-2-тион-4,5-дитиолят натрия, использующийся в качестве предшественника в синтезе тетратиафульваленов[4]:
При взаимодействии с первичными или вторичными аминами в щелочной среде образуются соли дитиокарбаматы:
- 2R2NH+CS2→[R2Nh3+][R2NCS2−]{\displaystyle {\mathsf {2R_{2}NH+CS_{2}\rightarrow [R_{2}NH_{2}^{+}][R_{2}NCS_{2}^{-}]}}}
Для растворимых дитиокарбаматов характерно образование комплексов с металлами, что используется в аналитической химии. Они также имеют большое промышленное значение в качестве катализаторов вулканизации каучука.
Со спиртовыми растворами щелочей образует ксантогенаты:
- RONa+CS2→[Na+][ROCS2−]{\displaystyle {\mathsf {RONa+CS_{2}\rightarrow [Na^{+}][ROCS_{2}^{-}]}}}
Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
С оксидом серы (VI) сероуглерод взаимодействует с образованием сульфоксида углерода:
- CS2+3SO3→COS+4SO2{\displaystyle {\mathsf {CS_{2}+3SO_{3}\rightarrow COS+4SO_{2}}}}
С оксидом хлора(I) образует фосген:
- CS2+3Cl2O→COCl2+2SOCl2{\displaystyle {\mathsf {CS_{2}+3Cl_{2}O\rightarrow COCl_{2}+2SOCl_{2}}}}
Сероуглерод хлорируется в присутствии катализаторов до перхлорметилмеркаптана CCl3SCl[5], использующегося в синтезе тиофосгена CSCl2:
- 2CS2+5Cl2→2CCl3SCl+S2Cl2{\displaystyle {\mathsf {2CS_{2}+5Cl_{2}\rightarrow 2CCl_{3}SCl+S_{2}Cl_{2}}}}
- CCl3SCl→[H]CSCl2+2HCl{\displaystyle {\mathsf {CCl_{3}SCl{\xrightarrow[{}]{[H]}}CSCl_{2}+2HCl}}}
Избытком хлора сероуглерод хлорируется до четырёххлористого углерода:
- CSCl2+2Cl2→CCl4+S2Cl2{\displaystyle {\mathsf {CSCl_{2}+2Cl_{2}\rightarrow CCl_{4}+S_{2}Cl_{2}}}}
Фторирование сероуглерода фторидом серебра в ацетонитриле ведет к образованию трифторметилтиолята серебра, эта реакция имеет препаративное значение[6]
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
- CS2+2h3O→CO2+2h3S{\displaystyle {\mathsf {CS_{2}+2H_{2}O\rightarrow CO_{2}+2H_{2}S}}}
В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:
- 2Ch5+S8→2CS2+4h3S{\displaystyle {\mathsf {2CH_{4}+S_{8}\rightarrow 2CS_{2}+4H_{2}S}}}
Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
Хорошо растворяет жиры, масла, смолы, каучук, используют как экстрагент; растворяет серу, фосфор, иод, нитрат серебра.
Большая часть (80 %) производимого сероуглерода идёт в производство вискозы — сырья в производстве вискозного волокна («искусственного шелка»). Его применяют для получения различных химических веществ (ксантогенатов, четырёххлористого углерода, роданидов).

Сероуглерод ядовит. Полулетальная доза при поступлении внутрь составляет 3188 мг/кг. Высокотоксичная концентрация в воздухе — свыше 10 мг/л. Оказывает местное раздражающее, резорбтивное действия. Обладает психотропными, нейротоксическими свойствами, которые связаны с его наркотическим воздействием на центральную нервную систему.
При отравлении возникают головная боль, головокружение, судороги, потеря сознания. Бессознательное состояние может сменяться психическим и двигательным возбуждением. Могут наблюдаться рецидивы судорог с потерей сознания, угнетение дыхания. При приёме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.
Прежде всего необходимо удалить пострадавшего из поражённой зоны. При попадании сероуглерода внутрь необходимо выполнить промывание желудка с использованием зонда, форсированный диурез, ингаляцию кислорода. Обычно проводят симптоматическую терапию. При судорогах вводят 10 мг диазепама внутривенно.
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0104.html
- ↑ Кипер Руслан. Рекорды веществ (рус.) (недоступная ссылка). Рекорды для неорганических веществ. www.chemister.ru (Дата последнего изменения 13.10.2010). Дата обращения 17 октября 2010. Архивировано 11 января 2012 года.
- ↑ Kevin T. Potts et al. 2,2′ : 6′,2′ -Terpyridine. Org. Synth. 1986, 64, 189 DOI: 10.15227/orgsyn.064.0189
- ↑ Thomas K. Hansen et al. 4,5-Dibenzoyl-1,3-dithiole-1-thione. Org. Synth. 1996, 73, 270 DOI: 10.15227/orgsyn.073.0270
- ↑ Губен И. Методы органической химии. Том 3 — М.: Химическая литература, 1935. — 676 c.
- ↑ Jiansheng Zhu et al. Preparation of N-Trifluoromethylthiosaccharin: A Shelf-Stable Electrophilic Reagent for Trifluoromethylthiolation. Org. Synth. 2017, 94, 217—233 DOI: 10.15227/orgsyn.094.0217
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.