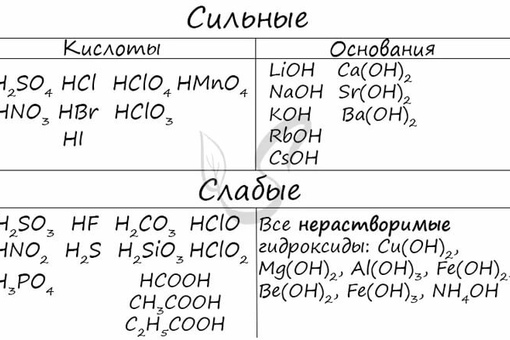
Основания сильные и слабые — Справочник химика 21
При титровании слабых кислот слабыми основаниями (или наоборот) кислотная часть кривой титрования отвечает титрованию слабой кислоты сильным основанием. Щелочная часть кривой титрования совпадает с кривой титрования слабого основания сильной кислотой. Для точки эквивалентности величину pH находят из уравнения константы гидролиза соли следующим способом. [c.270]Кислотно-основное титрование (иногда называется также методом нейтрализации). В качестве рабочих титрованных растворов (реактивов) применяют обычно кислоты и щелочи. Определять этим методом можно кислоты, щелочи, соли слабых кислот и соли слабых оснований, а иногда также вещества, которые реагируют с такими солями. Если в растворе содержится несколько компонентов, имеющих различные кислотно-основные свойства, нередко возможно раздельное определение таких компонентов в их смеси.
Титрование слабых оснований сильными кислотами (или наоборот) 267 [c.267]
Катионы сильных оснований N3+, a +, Ва + и анионы сильных кислот С1, 505 не принимают участия в этих реакциях, поскольку не могут образовать с ионами воды и ОН малодиссоциированных соединений. Таким образом, водные растворы уксуснокислых солей (ацетатов), образованных сильными основаниями, имеют щелочную реакцию, а растворы аммониевых солей сильных кис лот — кислую реакцию. В случае ацетата аммония и катион, и анион принимают участие в реакции гидролиза, однако раствор сохраняет нейтральную реакцию, так как образующиеся уксусная кислота и гидроксид аммония — электролиты равной силы (с. 127), В других случаях, например при гидролизе Nh5 N, для определе ния характера раствора необходимо сопоставить константы диссоциации слабого основания и слабой кислоты, образующихся при гидролизе соли. [c.130]
127), В других случаях, например при гидролизе Nh5 N, для определе ния характера раствора необходимо сопоставить константы диссоциации слабого основания и слабой кислоты, образующихся при гидролизе соли. [c.130] В табл. 5-3 указаны константы ионизации ряда кислот в водных растворах там же приведены оценки для сильных кислот, маскируемые растворителем в водном растворе. Диссоциация протонированного растворителя Н3О на гидратированные протоны и HjO представляет собой просто миграцию протонов от одних молекул воды к другим и должна характеризоваться константой равновесия = 1,00. Если в качестве растворителя используется аммиак, все кислоты, сопряженные основания которых слабее, чем NHj, вследствие выравнивающего действия растворителя окажутся полностью ионизованными сильными кислотами. Таким образом, как фтористоводородная, так и уксусная кислоты в жидком аммиаке являются сильными кислотами.
Являются ли следующие кислоты и основания сильными, слабыми или средней силы [c.
 105]
105]Слабая кислота и ее соль защищают следующим образом раствор от изменения pH при добавлении небольшого количества кислоты или основания. Если добавляется основание, слабая кислота буфера его нейтрализует, предотвращая сильное изменение pH если добавляется кислота, то она нейтрализуется основанием — анионом слабой кислоты, также не допуская сильного изменения pH. [c.459]
Согласно теории кислот и оснований Бренстеда — Лаури, вещество, являющееся источником протонов, представляет собой кислоту, а вещество, способное соединяться с протоном и удалять его из раствора, представляет собой основание. Когда кислота теряет свой протон, она превращается в сопряженное основание. Сильная кислота типа НС1 обладает слабым сопряженным основанием С1 , а слабая кислота, например НАс или КНГ имеет сравнительно сильное сопряженное основание. Ас или КНз. Всякая кислота, сопряженное основание которой значительно слабее Н2О (т. е. имеет меньшее сродство к протону Н , чем вода), должно полностью диссоциировать в водном растворе и поэтому представляет собой сильную кислоту.
Титровать соль, образованную сильным основанием и слабой кислотой с показателем рК, все равно что титровать той же концентрации раствор слабого основания с показателем 14 —р/С в обоих случаях кривые титрования совершенно одинаковы. [c.284]
В этом случае обобщенно можно сказать, что гидролиз по аниону происходит у солей сильных оснований и слабых кислот.
Укажите необходимые признаки веществ и растворов, для которых можно применять правило произведения растворимости (хорошая, плохая, малая, большая растворимость, сильный, слабый электролит, неэлектролит, соль, основание, кислота и т. д.). [c.107]
Слабое основание Сильное основание [c.58]
Поскольку в водных растворах вода присутствует в большом избытке, любая кислота, сопряженное основание которой слабее, чем HjO (т. е. имеет меньшее сродство к протону, чем HjO), должна быть почти полностью ионизована. По этой причине невозможно установить различие между силой таких кислот, как НС1 и H IO4 (хлорная кислота) в водных растворах. Обе эти кислоты в водном растворе полностью диссоциированы и поэтому являются сильными кислотами. Однако в растворителях, обладающих меньшим сродством к протону, чем вода, можно установить различия между НС1 и H IO4. Если в качестве растворителя используется диэтиловый эфир, хлорная кислота по-прежнему обладает свойствами сильной кислоты, но НС1 ионизуется лишь частично и, следовательно, оказывается слабой кислотой. Диэтиловый эфир не так сильно сольвати-рует протон, как вода (рис. 5-4). (Сольватация-это обобщение понятия гидратации, применяемое к любым, в том числе неводным растворителям.) Положение равновесия в реакции [c.217]
е. имеет меньшее сродство к протону, чем HjO), должна быть почти полностью ионизована. По этой причине невозможно установить различие между силой таких кислот, как НС1 и H IO4 (хлорная кислота) в водных растворах. Обе эти кислоты в водном растворе полностью диссоциированы и поэтому являются сильными кислотами. Однако в растворителях, обладающих меньшим сродством к протону, чем вода, можно установить различия между НС1 и H IO4. Если в качестве растворителя используется диэтиловый эфир, хлорная кислота по-прежнему обладает свойствами сильной кислоты, но НС1 ионизуется лишь частично и, следовательно, оказывается слабой кислотой. Диэтиловый эфир не так сильно сольвати-рует протон, как вода (рис. 5-4). (Сольватация-это обобщение понятия гидратации, применяемое к любым, в том числе неводным растворителям.) Положение равновесия в реакции [c.217]
Из рассмотрения этой кривой ясно, что она совершенно подобна кривым титрования растворов слабых оснований сильными кислотами. Действительно а) как и при титровании слабых осно- [c.283]
Действительно а) как и при титровании слабых осно- [c.283]
Соответственно константа гидролиза соли, образованной сильным основанием н слабой трехосновной кислотой, равна ионному произведению воды, деленному на третью константу диссоциации кислоты
Аналогично при нейтрализации слабого основания сильной кислотой [c.147]
Этот вывод имеет общий характер, и, следовательно, нормальной соли, образованной сильным основанием и слабой [c.133]
В одном из патентов указывается, что при окислении бутана в растворе уксусной кислоты в присутствии солей кобальта применение замедлителей, например соли сильного основания и слабой кислоты (ацетат натрия и др.), увеличивает выход альдегидов и кетонов [223]. [c.97]
Титрование слабой кислоты сильным основанием или слабого основания сильной кислотой представляет собой более сложный процесс, потому что слабый титрант диссоциирован лишь частично. В таком случае приходится рассматривать равновесие диссоциации, обсуждаемое в следующем [c.228]
В таком случае приходится рассматривать равновесие диссоциации, обсуждаемое в следующем [c.228]
Раствор хлорида натрия нейтрален и имеет pH = 7,0. Это понятно, поскольку хлорид натрия-соль сильного основания (гидроксида натрия) и сильной (хлористоводородной) кислоты, а когда такие вещества взяты в равных количествах, они должны полностью нейтрализовать друг друга. В отличие от этого ацетат натрия представляет собой соль сильного основания и слабой кислоты. Интуитивно можно ожидать, что раствор ацетата натрия окажется несколько основным, и это действительно так. Часть ацетатных ионов, образованных этой солью, соединяется с водой, образуя недиссоциированную уксусную кислоту и гидроксидные ионы [c.242]
Обобщая этот лример, можио сделать вывод, что сильные кислоты вытесняют слабые из растворов их солей (аналогично сильные основания вытесняют слабые основания). [c.262]
К сильным принадлежат сильные кислоты, сильные основания и большая часть солей.

Рассмотрим гидролиз солей, образованных сильным основанием и слабой кислотой на примере цианида калия. В системе, состоящей из молекул K N и НгО, происходят следующие процессы диссоциации [c.72]
Составляя подобным же образом результаты изменения потенциала водородного электрода при титровании сильных кислот растворами оснований и слабых кислот растворами щелочей, легко убедиться, что скачок потенциала в к.т.т, резко убывает с уменьшением степени диссоциации реагирующих кислот и оснований, Если константы диссоциации кислоты и основания малы, го в т,э. вообще не наблюдается скачка потенциала или перегиба на кривой титрования. Табл.
При титровании слабых оснований сильными кислотами наблюдаются те же закономерности, что и в примерах 2 и 3. Разница лишь в том, что pH не повышается, а понижается, как это показано на рис. XVHI, 5. Расчет pH при этом ведется совершенно так же, как н при титровании слабой кислоты сильным основанием, только в формуле, соответствующей формуле (XVIII, 88), величины Сн+ и сон меняются местами. [c.506]
Аналогично протекают реакция между сильными основаниями солями слабых оснований. Например, при действии гидроксида атр11я на су мьфат железа(II) выделяется гидроксид железа(II)
В реакции гндро.чпза вст пают солн, образованные слабой кислотой и слабым основанием, пли слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются нейтрализация в этом случае сводится к процессу [c. 258]
258]
Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, ко1 да ионы, образующиеся в результате электролитической диссоциации соли, — катион, анион или оба вместе — способны образовывать с нонами нод1>1 Н и ОН малодиссо,циированные соединения. Гидро.лизу подвергаются соли, образованные а) слабыми кислотами и сильными основаниями б) слабыми основаниями и сильными кислотами и в) слабыми кислотами и слабыми основаниями. [c.129]
Л гидр = Л и/Л кисл — 1соли сильного основания и слабой однрЗШ Й кислоты. К р = КуКас — -он ст ант а гидролиза соли сильной кислоты й слабого одн основания. Константа гидролиза ацетата аммония имеет вид [c.131]
Растворы солей, образованных сильными основаниями и слабыми многоосновиыми кислотами, имеют щелочную реакцию. Для приближенной оценки степени их гидролиза можно ограничиться только первой ступенью этого процесса, учитывая гидролиз образовавшейся гидросоли лищь при значительном разбавлении раствора. [c.134]
[c.134]
Вопрос о сильных и слабых кислотах и основаниях, по-видимому, лучще всего рассматривать на данном уровне, позаботившись о том, чтобы учащиеся запомнили несколько часто встречающихся сильных кислот и оснований — тогда они могут исходить из того, что все ирочие кислоты и основания являются слабыми, если не оговаривается противоположное. [c.572]
Рассмотрим процесс нейтрализации слабого основания сильной кислотой, например, Nh5OH и НС1. В ионном виде процесс может быть записан так [c.77]
Н. Н. Безипгер и Г. Д. Гальнерн разработали схему классификации нефтяных азотистых соединений, основанную на.лсотен-циометрическом титровании компонентов нефти до и после их восстановления литийалюмогидридом [184]. По. этой схеме азотистые соединения делятся на группы А (сильные основания), В (слабые основания) и С (нейтральные соединения). Слабые основания в соответствии с их поведением нри восстановлении разделены на типы В (восстанавливающиеся до сильноосновных), Вг (восстанавливающиеся до нейтральных) и В3 (не восстанавливающиеся вещества) [185]. Хотя этот метод рекомендован лишь для анализа группового состава, очевидно, что аналогичное восстановление можно применять и в препаративном масштабе. [c.23]
Хотя этот метод рекомендован лишь для анализа группового состава, очевидно, что аналогичное восстановление можно применять и в препаративном масштабе. [c.23]
Н. Н. Безингер п Г. Д. Гальиерн [184] предложили детализировать групповой анализ азотистых компопентов нефти, применяя потенциометрическое титрование до и аосле восстаповления нейтральных и слабоосновных веществ алюмогидридом лития. На этой основе разработана классификация, но которой нефтяные АС делят на группы А (сильные основания), В (слабые основания) и С (нетитрующиеся или нейтральные соединения). Слабые основания, в соответствии сих поведением при восстановлении, разделены на типы Bj (восстанавливающиеся до сильноосновных), Bj (восстанавливающиеся до нейтральных) и Вд (невосстанавливающиеся вещества) [185]. [c.124]
В растворах умеренных концентраций степень гидролиза пр11 комнатной температуре невелика. Для солей, образованных сильным основанием и сильной кислотой, она практически равна нулю для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой, кислотой, она составляет около 1%- Так, для ЫНдС при концентрации 0,01 моль/л г = 0,01% для 0,1 н. раствора СНзСООНН4 Ог 0,5%. [c.267]
раствора СНзСООНН4 Ог 0,5%. [c.267]
В растворах умеренных концентраций степень гидролиза при комнатной температуре невелика для солей, образованных сильным основанием и сильной кислотой, она практически равна нулю для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой кислотой, она составляет около 1%. Для солей, образованных слабым основанием и слабой кислотой, степень гидролиза может приближаться к 100%, а для галогенангидридов достигает 100%. Так, для НН4С1 при концентрации в 0,01 Л1 = 0,01% для 0,1н. раствора СНзСООЫН4- 0,5% для растворов (ЫН4)аСОз и (N 4)08 она равна соответственно 77 и 99%. [c.207]
В первом случае образуются иедиссоцинроваиные молекулы слабой кислоты и гидроксид-ионы, во втором — недиссоциированные молекулы слабого основания и ионы водорода (точнее, гидроксо-иия). Следовательно, раствор соли слабой кислоты (если, конечно, основание сильнее кислоты) имеет щелочную реакцию (рН>7), а [c. 179]
179]
Нейтрализация слабой кислоты сильным основанием (или слабого основания сильной кислотой) сопровождается одновременной диссоциацией слабого электролита с тепловым эффектом ДЯд сс. Эта теплота складывается из эндотермического эффекта диссоциации и экзотермического эффекта гидратации ионов. Сумма последних двух тепловых эффектов — в зависимости от природы электролитов — различается как знаком, так и значением. Вследствие этого теплота нейтрализации отличается от теплоты реакции образования воды из ионов (теплота нейтрализации H N едким натром равна — 10,290 кДж/моль, Н3РО4 едким кали равна — 63,850 кДж/моль). Теплоту диссоциации вычисляют по уравнению [c.49]
Разница между сильными и слабыми кислотами и основаниями | Сравните разницу между похожими терминами — Наука
Разница между сильными и слабыми кислотами и основаниями — Наука
Сильные против слабых кислот против оснований
Различные ученые определяют кислоты по-разному. Аррениус определяет кислоту как вещество, которое отдает H3О+ ионы в растворе, тогда как основание — это вещество, которое отдает ОН– ионы в раствор. Бронстед-Лоури определяет кислоту как вещество, которое может отдавать протон, и основание как вещество, которое может принимать протон. Определение кислоты Льюиса гораздо более распространено, чем два вышеупомянутых. Согласно ему, любой акцептор электронной пары — это кислота, а донатор — это основание. Согласно определению Аррениуса, соединение должно иметь гидроксид-анион и способность отдавать его в виде гидроксид-иона в качестве основания. Согласно Льюису и Бронстед-Лоури, могут быть молекулы, которые не содержат гидроксидов, но могут действовать как основание. Например, NH3 является основанием Льюиса, потому что он может отдавать электронную пару на азоте. Na2CO3 представляет собой основание Бренстеда-Лоури без гидроксидных групп, но обладает способностью принимать водороды.
Аррениус определяет кислоту как вещество, которое отдает H3О+ ионы в растворе, тогда как основание — это вещество, которое отдает ОН– ионы в раствор. Бронстед-Лоури определяет кислоту как вещество, которое может отдавать протон, и основание как вещество, которое может принимать протон. Определение кислоты Льюиса гораздо более распространено, чем два вышеупомянутых. Согласно ему, любой акцептор электронной пары — это кислота, а донатор — это основание. Согласно определению Аррениуса, соединение должно иметь гидроксид-анион и способность отдавать его в виде гидроксид-иона в качестве основания. Согласно Льюису и Бронстед-Лоури, могут быть молекулы, которые не содержат гидроксидов, но могут действовать как основание. Например, NH3 является основанием Льюиса, потому что он может отдавать электронную пару на азоте. Na2CO3 представляет собой основание Бренстеда-Лоури без гидроксидных групп, но обладает способностью принимать водороды.
Сильные и слабые кислоты
Независимо от приведенных выше определений, мы обычно идентифицируем кислоту как донор протонов. Кислоты имеют кислый вкус. Сок лайма и уксус — две кислоты, с которыми мы сталкиваемся дома. Они реагируют с основаниями с образованием воды и реагируют с металлами с образованием H2, тем самым увеличивая скорость коррозии металла. Кислоты можно разделить на две категории в зависимости от их способности диссоциировать и производить протоны. Сильные кислоты, такие как HCl, HNO3 полностью ионизируются в растворе с образованием протонов. Слабые кислоты, такие как CH3COOH частично диссоциирует и дает меньшее количество протонов.
Kа — константа диссоциации кислоты. Это указывает на способность терять протон слабой кислоты. Чтобы проверить, является ли вещество кислотой, мы можем использовать несколько индикаторов, таких как лакмусовая бумага или pH-бумага. На шкале pH представлены от 1 до 6 кислот. Кислота с pH 1 считается очень сильной, и по мере увеличения значения pH кислотность уменьшается.
Кислота с pH 1 считается очень сильной, и по мере увеличения значения pH кислотность уменьшается.
Сильное и слабое основание
Основы имеют скользкое ощущение мыла и горький вкус. Они легко реагируют с кислотами, образуя молекулы воды и соли. Каустическая сода, аммиак и пищевая сода — одни из самых распространенных оснований, с которыми мы сталкиваемся очень часто. Основания можно разделить на две категории в зависимости от их способности диссоциировать и производить ионы гидроксида. Сильные основания, такие как NaOH и KOH, полностью ионизируются в растворе с образованием ионов. Слабые базы вроде NH3 частично диссоциируют и дают меньше гидроксид-ионов.
Kб — константа диссоциации основания. Это указывает на способность терять гидроксид-ионы слабого основания. Кислоты с более высоким pKа значение (более 13) являются слабыми кислотами, но их сопряженные основания считаются сильными основаниями. Чтобы проверить, является ли вещество основой или нет, мы можем использовать несколько индикаторов, таких как лакмусовая бумага или pH-бумага. Основания показывают значение pH выше 7, и он становится красной лакмусовой бумажкой на синий.
Основания показывают значение pH выше 7, и он становится красной лакмусовой бумажкой на синий.
В чем разница между Сильные и слабые кислоты и основания? • Кислоты имеют значения pH от 1 до 7. Более сильные кислоты близки к 1, а слабые кислоты близки к 7. Основания имеют значения pH от 7 до 14. Сильные основания ближе к 14, а слабые основания ближе к 7. • Сильные кислоты и сильные основания полностью реагируют с образованием соли и воды. • Слабые кислоты и слабые основания не реагируют полностью, так как они не полностью диссоциируют. |
Сильные стороны кислот и оснований
Сильные стороны кислот и основанийСильные и слабые кислоты:
Сила кислоты связана с ионизацией кислот в воде. Некоторые из кислот
могут на 100% ионизироваться в водных растворах, мы называем их «сильными
кислотами». HCl, HNO3, HBr, HI, H2SO4 являются примерами сильных кислот. Приведенный ниже пример
показывает молярную концентрацию иона H+ в водном
растворе HCl и HNO3;
Приведенный ниже пример
показывает молярную концентрацию иона H+ в водном
растворе HCl и HNO3;
HCl(aq) → H+(aq) +C l—(aq)
0,1мол/L 0,1M 0,1M
Концентрация иона H+ составляет [H+] = 0,1 М
HNO3(aq) → H+(aq) + NO3—(aq)
0,1мол/L 0,1M 0,1M
Концентрация иона H+ составляет [H+] = 0,1 МНапротив, некоторые из кислот не могут ионизироваться как сильные кислоты. Мы называем кислоты частично ионизирующимися в растворах «слабой кислотой«. CH3COOH, HF, H2CO3 являются примерами слабых кислот. Когда слабые кислоты растворяются в воде;
CH3COOH (aq) ↔ H+(aq) + CH3COO—(aq)
HF(aq) ↔ H+(aq) + F—(aq)
В 0,1 мольном растворе CH3COOH ионизация составляет 1%. Количество CH3COOH в 1 л воды составляет;
0,1. (1/100)=0,001 мол CH3COOH
(1/100)=0,001 мол CH3COOH
Как мы уже говорили, растворы кислот проводят электрический ток. Электрический ток прямо пропорционален концентрации ионов в растворе. Таким образом, можно сказать, что растворы сильных кислот проводят электричество лучше, чем растворы слабых кислот.
Пусть X — любой элемент;
- Если электроотрицательность Х увеличивается, то сила кислоты, производимой Х и Н, также увеличивается.
- Если энергия между связями X и H увеличивается, то сила кислоты уменьшается.
- В периодической таблице сверху вниз, в той же группе, H-X сила увеличивается.
Пример:
HI>HBr>HCl>HF
- В периодической таблице слева направо сила H-X увеличивается.
Пример:
HF>H2O>NH3>CH4
Сильные и слабые основания:Основания, полностью ионизирующиеся в растворах, называются «сильными
основаниями». NaOH, KOH, Ba(OH)2 и основания,
включая ион OH—, являются сильными основаниями.
NaOH, KOH, Ba(OH)2 и основания,
включая ион OH—, являются сильными основаниями.
NaOH(aq) → Na+2(aq) + OH—(aq)
Ba(OH)2(aq) → Ba+2(aq) + 2OH—(aq)
Основания, которые частично ионизуются в растворах, называются «слабыми основаниями». NH3 является примером слабого основания.
NH3(aq) + H2O(l) ↔ NH4+(aq) OH—(aq)
Водные растворы оснований также проводят электричество, и оно прямо пропорционально концентрации ионов в растворе. Таким образом, решения сильных оснований проводят электричество лучше, чем решения слабых оснований.- В периодической таблице сверху вниз в металлических группах увеличивается базовая прочность соединений.
Пример:
LiOH<NaOH<KOH
- В периодической таблице слева направо основная прочность соединений уменьшается.
NaOH>Mg(OH)2>Al(OH)3
Пример: Найти соотношение между кислотой
следующих элементов с H, показанной в периодической таблице.
Решение: сила соединений H увеличивается по мере того, как мы идем слева направо и сверху вниз в периодической таблице. Таким образом, для заданных элементов;
HCl>H2S и HBr>HCl
HBr>HCl>H2S
Кислота и основание экзамены и решение проблем
Гидролиз солей
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Кислоты и основания в водеСамоионизация водыЖидкая вода находится в равновесии с сольватированным гидроксидом и сольватированными протонами. Обычно мы используем значение, связанное с константой равновесия, для определения концентрации этих сольватированных ионов в воде. Константа диссоциации воды , K w , равна 1 x 10 -14 .pH и pOH являются важными значениями для кислых и щелочных растворов.Это логарифмическое основание 10 концентрации ионов водорода или концентрации ионов гидроксида, соответственно.
Принцип Ле-Шателье говорит нам, что добавление одного из продуктов к системе, находящейся в равновесии, сдвинет равновесие в сторону реагентов. Для любой кислоты K a является константой равновесия реакции диссоциации кислоты в воде. На странице таблиц приведен список значений K и при комнатной температуре. Обратите внимание, что и A — , и H + окружены и стабилизированы молекулами воды. Мы могли бы также записать их как [A(H 2 O) x ] — , [H(H 2 O) x ] + или A (aq) — 2 , 12 , H (водный) + . pH и pOH часто используются для описания растворов кислот и оснований в воде. В чистой воде концентрация сольватированных протонов равна концентрации сольватированных анионов гидроксида, а pH равен 7. Кислые растворы имеют более низкий pH, а основные растворы — более высокий. Сильные кислотыСильные кислоты полностью диссоциируют в водном растворе и имеют отрицательные значения K a . Можно считать, что [Н + ] в растворе сильной кислоты равно исходной концентрации кислоты.Сильные кислоты перечислены ниже. Можно считать, что [Н + ] в растворе сильной кислоты равно исходной концентрации кислоты.Сильные кислоты перечислены ниже. Слабые кислотыСлабые кислоты лишь частично диссоциируют в водном растворе. Значения K a описывают равновесие, а pK a = -log(K a ). Некоторые из слабых кислот приведены в таблице ниже.Прочные основанияСильные гидроксидные основания полностью диссоциируют в водном растворе. Другие сильные основания полностью реагируют с водой. К сильным основаниям относятся NaOH, LiOH, Ca(OH) 2 , NaNH 2 .Слабые основанияСлабые основания находятся в равновесии с водой. Значения K b описывают равновесие, а pK b = -log(K b ).Некоторые слабые базы указаны в таблице ниже.
БуферыРаствор, содержащий слабую кислоту и сопряженное с ней основание, сопротивляется изменению pH при добавлении небольшого количества кислоты или основания. Раствор, который содержит равные концентрации как слабой кислоты, так и сопряженного основания, имеет pH, равный pK a кислоты. Например, pH раствора, который составляет 0,1 М в HSO 4 -2 и 0,1 М в SO 4 -2 , будет около 2. Назад Компас Столы Показатель Введение Следующий Назад Компас Столы Показатель Введение Следующий |
Сильные кислоты или основания, замещенные слабыми кислотами или основаниями в аэрозолях: реакции, вызванные непрерывным разделением летучих продуктов в газовой фазе
Аэрозоли присутствуют в атмосфере повсеместно и оказывают глубокое воздействие на климатические системы и здоровье человека.Чтобы получить больше информации об их широком воздействии, нам необходимо всесторонне понять фундаментальные свойства атмосферных аэрозолей. Поскольку аэрозоли являются многофазными, дисперсия конденсированного вещества (твердых частиц или капель жидкости, далее частицы) в газе, разделение летучих веществ между конденсированной и газовой фазами является одной из определяющих характеристик аэрозолей. Например, в последние десятилетия широко изучалось распределение содержания воды в условиях различной относительной влажности, известное как гигроскопичность аэрозолей. В то же время малоизученным остается разделение летучих органических или неорганических компонентов, называемое аэрозольной летучестью. Обычно объемную систему растворов рассматривают как одну фазу, летучесть которой в основном определяется природой ее компонентов, а распределение состава между раствором и газовой фазой ограничено. Однако аэрозоли содержат обширную газовую фазу, и их летучесть также может быть вызвана реакциями компонентов. Эти реакции, происходящие в аэрозолях, обусловлены образованием летучих продуктов и их непрерывным выделением в газовую фазу.Как следствие, аэрозольные системы в целом демонстрируют заметную летучесть. Примечательно, что такая летучесть, вызванная реакциями, является явлением, наблюдаемым исключительно в многофазных аэрозольных системах, и она тривиальна в объемных растворах из-за ограниченной степени разделения жидкости и газа. Возьмем, к примеру, истощение хлоридов в частицах морской соли. Недавние открытия показали, что истощение хлоридов может быть вызвано реакциями между NaCl и слабыми органическими кислотами, которые выделяют HCl в газовую фазу.
В то же время малоизученным остается разделение летучих органических или неорганических компонентов, называемое аэрозольной летучестью. Обычно объемную систему растворов рассматривают как одну фазу, летучесть которой в основном определяется природой ее компонентов, а распределение состава между раствором и газовой фазой ограничено. Однако аэрозоли содержат обширную газовую фазу, и их летучесть также может быть вызвана реакциями компонентов. Эти реакции, происходящие в аэрозолях, обусловлены образованием летучих продуктов и их непрерывным выделением в газовую фазу.Как следствие, аэрозольные системы в целом демонстрируют заметную летучесть. Примечательно, что такая летучесть, вызванная реакциями, является явлением, наблюдаемым исключительно в многофазных аэрозольных системах, и она тривиальна в объемных растворах из-за ограниченной степени разделения жидкости и газа. Возьмем, к примеру, истощение хлоридов в частицах морской соли. Недавние открытия показали, что истощение хлоридов может быть вызвано реакциями между NaCl и слабыми органическими кислотами, которые выделяют HCl в газовую фазу. Такая реакция может быть описана как вытеснение сильной кислоты слабой кислотой, что практически не наблюдается в объемной фазе. Как правило, это уникальное поведение разделения аэрозольных систем и его способность изменять состав аэрозоля, размер, реакционную способность и другие физико-химические свойства заслуживают большего внимания со стороны атмосферного сообщества. В этом отчете основное внимание уделяется последним достижениям в исследовании реакций компонентов, которые вызывают летучесть аэрозолей. Эти реакции можно разделить на четыре типа: истощение хлоридов, истощение нитратов, истощение аммония и гидролиз солей.Истощение хлоридов или нитратов можно рассматривать как реакцию замещения, при которой сильная кислота вытесняется слабой кислотой. Такая реакция высвобождает легколетучую HCl или HNO 3 в газовую фазу и приводит к потере хлорида или нитрата внутри частиц. Точно так же истощение аммиака представляет собой реакцию замещения, при которой сильное основание вытесняется слабым основанием, что приводит к выделению аммиака и существенным изменениям гигроскопичности аэрозоля.
Такая реакция может быть описана как вытеснение сильной кислоты слабой кислотой, что практически не наблюдается в объемной фазе. Как правило, это уникальное поведение разделения аэрозольных систем и его способность изменять состав аэрозоля, размер, реакционную способность и другие физико-химические свойства заслуживают большего внимания со стороны атмосферного сообщества. В этом отчете основное внимание уделяется последним достижениям в исследовании реакций компонентов, которые вызывают летучесть аэрозолей. Эти реакции можно разделить на четыре типа: истощение хлоридов, истощение нитратов, истощение аммония и гидролиз солей.Истощение хлоридов или нитратов можно рассматривать как реакцию замещения, при которой сильная кислота вытесняется слабой кислотой. Такая реакция высвобождает легколетучую HCl или HNO 3 в газовую фазу и приводит к потере хлорида или нитрата внутри частиц. Точно так же истощение аммиака представляет собой реакцию замещения, при которой сильное основание вытесняется слабым основанием, что приводит к выделению аммиака и существенным изменениям гигроскопичности аэрозоля. Кроме того, летучесть аэрозоля также может быть вызвана гидролизом соли в конкретном случае, который поддерживается сосуществованием акцептора протона и акцептора гидроксид-иона внутри частиц.Кроме того, мы количественно обсуждаем эти реакции замещения как с термодинамической, так и с кинетической точек зрения, используя расширенную неорганическую модель аэрозоля (E-AIM) и стационарное уравнение диффузионного массопереноса Максвелла соответственно. Учитывая повсеместное распространение разделения компонентов в аэрозольных системах, наше обсуждение может дать новый взгляд на основные механизмы старения аэрозолей и соответствующие климатические эффекты.
Кроме того, летучесть аэрозоля также может быть вызвана гидролизом соли в конкретном случае, который поддерживается сосуществованием акцептора протона и акцептора гидроксид-иона внутри частиц.Кроме того, мы количественно обсуждаем эти реакции замещения как с термодинамической, так и с кинетической точек зрения, используя расширенную неорганическую модель аэрозоля (E-AIM) и стационарное уравнение диффузионного массопереноса Максвелла соответственно. Учитывая повсеместное распространение разделения компонентов в аэрозольных системах, наше обсуждение может дать новый взгляд на основные механизмы старения аэрозолей и соответствующие климатические эффекты.
Прочность сопряженных кислот и оснований. Учебное пособие по химии
Сноски:
1.Термины «кислота» и «основание» относятся к кислоте Бренстеда-Лоури и основанию Бренстеда-Лоури.
(см. учебник по определениям кислот и оснований)
2. Термин «сильная» достаточно хорошо определен для разбавленного раствора моноосновной кислоты, такая кислота является сильной, если процент ее диссоциации (ионизации) составляет примерно 100%.
Термин «слабая» определен не точно, то есть слабой кислотой является кислота, которая лишь частично диссоциирует (ионизируется).
По этой причине существует континуум слабости кислоты, то есть одни слабые кислоты слабее других.
Мы решили использовать термин «слабый» для тех, которые претерпевают очень небольшую диссоциацию, и термин «умеренно слабый» для тех, которые не так «слабы».
Вы также увидите сравнительные термины, такие как слабый, очень слабый и очень, очень слабый (даже слабый), используемые для описания этого континуума слабости.
Если вам не дали список кислот для запоминания как слабых, очень слабых и т. д., эти термины весьма произвольны и должны использоваться только для сравнения силы одной кислоты с другой.
Сила слабой кислоты лучше всего описывается с использованием значения ее константы кислотной диссоциации (константа ионизации кислоты), K a (или pK a ).
Гораздо важнее, чтобы вы понимали, что сила кислоты (или основания) и сопряженного с ней основания (или кислоты) основана на положении равновесия для реакции диссоциации (ионизации).
3. ИЮПАК предпочитает термин «гидрон», а не «протон» для положительно заряженного иона водорода.
Мы используем термин протон, потому что большая часть встречающегося в природе водорода представляет собой водород-1, 1 H.
Когда этот изотоп водорода теряет свой электрон, остается только протон.
Однако существует очень небольшой процент встречающегося в природе водорода-2, 2 H.
Когда этот атом водорода теряет свой электрон, в результате получается ядро, содержащее как протон, так и нейтрон.
«Водород» относится к встречающейся в природе смеси водорода-1 и водорода-2, «гидрон» относится к встречающейся в природе смеси положительно заряженных ионов встречающегося в природе водорода и является гораздо лучшим описанием, чем «протон».
В большей части литературы используется термин «протон», а не «гидрон».
Лаборатория 6 — Смеси кислот и оснований
Назначение
Исследовать результирующие значения рН различных смесей растворов кислот и оснований.
голов
1
Рассчитать рН чистых растворов кислот и оснований.2
Для расчета рН смесей растворов кислот и оснований.3
Для измерения pH чистых растворов кислот и оснований и смесей этих растворов.4
Сравнить полученные значения рН различных смесей растворов кислот и оснований.
Введение
Кислоты Brø
nsted определяются как доноры протонов. При помещении в воду Brø
нстед-кислоты (HA) отдают протон воде с образованием сопряженного основания кислоты (A — ) и иона гидроксония (H 3 O + ) в соответствии с следующую реакцию.( 1 )
HA + H 2 O A — + H 3 O +Это определяется как реакция диссоциации кислоты , а константа равновесия для этой реакции называется константой диссоциации кислоты, K a .
 K и можно найти в таблицах физических данных и в приложении к вашему учебнику. Чем больше K a для кислоты, тем сильнее кислота. Кислоты Br
K и можно найти в таблицах физических данных и в приложении к вашему учебнику. Чем больше K a для кислоты, тем сильнее кислота. Кислоты Brø
nsted делятся на две основные группы: сильные кислоты и слабые кислоты. Сильные кислоты: K и для сильных кислот, таких как HCl и HNO 3 , просто перечислены как >> 1, что указывает на то, что они диссоциируют на 100% при помещении в воду.( 2 )
HCl + H 2 O → Cl − + H 3 O +
Поскольку сильные кислоты диссоциируют полностью, [H 3 O + ] = [концентрация сильной кислоты] и pH = -log[H 3 O + ]. Слабые кислоты: Слабые кислоты, такие как NH 4 + и HC 2 H 3 O 2 , лишь частично диссоциируют в воде в соответствии с их K a . Как и в случае любой равновесной реакции, равновесные концентрации можно рассчитать, составив таблицу реакций и подставив в выражение K выражение . Например, уксусная кислота HC 2 H 3 O 2 имеет K a 1,8 x 10 -5 .Таким образом, для 0,2 М водного раствора HC 2 H 3 O 2 равновесные концентрации можно рассчитать следующим образом.
Например, уксусная кислота HC 2 H 3 O 2 имеет K a 1,8 x 10 -5 .Таким образом, для 0,2 М водного раствора HC 2 H 3 O 2 равновесные концентрации можно рассчитать следующим образом.| HC 2 H 3 O 2 | + | H 2 O | C 2 H 3 O 2 — | + | H 3 O + | ||||
| начальный | 0,2 M | 0,20 м | 0,0 м | ||||||
| + x | + x | ||||||||
| равновесие | 0,2 — XM | x M | x M |
( 3 )
K 9002 A =
 8 x 10 −5 8 x 10 −5 | ||
| x = 1,9 x 10 −3 M |
( 4 )
[H
3 O + ] = (K A XC WA ) 1/2 = (1.8 x 10 -5 x 0.2) 1/2 = 1,9 x 10 — 3 М
pH этого раствора теперь можно рассчитать, взяв -log[H 3 O + ], чтобы получить 2,72. Точно так же основания Brø
nsted (B –) определяются как акцепторы протонов, и при помещении в воду они будут принимать протон из воды с образованием сопряженной с основанием кислоты (HB) и гидроксид-иона (OH –).
( 5 )
B — + H 2 O HB + OH —Эта реакция определяется как реакция ассоциации оснований , а константа равновесия для нее представляет собой константу ассоциации оснований, K b . K b не могут быть найдены в таблицах, как K a . K b должны рассчитываться по следующему уравнению при 25°C.
( 6 )
К а х К б = К w = 1.0 x 10 −14
Базы Brø
nsted также делятся на две основные группы: сильные базы и слабые базы. Прочные основания: Наиболее распространенными сильными основаниями, обнаруженными в лаборатории, являются соли гидроксида группы IA, которые полностью диссоциируют в воде с образованием одного эквивалента ОН –.( 7 )
NaOH(s) → Na + (водн.) + OH − (водн. )
)
| C 2 H 3 O 2 — | + | + | H | 2 O | HC 2 H 3 O 2 | + | О — | ||
| 0,0 м | Δ | -x | + x | +x | |||||
| равновесие | 0. 2 — xM 2 — xM | x M | x M | ||||||
( 9 )
K B =
x = 1,1 x 10 −5 M |  ( 10 ) [OH − ] = (K b x c wb ) 1/2 = (5.6 x 10 −10 x 0,2) 1/2 = 1,1 x 10 −5 М Теперь можно рассчитать pOH этого раствора, взяв -log[OH — ], чтобы получить 4,98. Используя уравнение 8, pH 0,2 М раствора C 2 H 3 O 2 — составляет 14 — 4,98 = 9,02. Когда кислоты и основания смешиваются вместе, все становится сложнее. Какими бы сложными они ни были, ко всем смесям кислот и оснований следует подходить одинаково.
Рисунок 1 : Комбинации кислот и оснований Смесь 1: Смесь 1, реакция сильной кислоты и сильного основания, идет до конца. Таблицу реакций можно использовать, чтобы определить, остается ли избыток кислоты или основания. Например, рассмотрим добавление 10 мл 0,10 М HCl к 15 мл 0,20 М NaOH. Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль. Таблицу реакций можно использовать, чтобы определить, остается ли избыток кислоты или основания. Например, рассмотрим добавление 10 мл 0,10 М HCl к 15 мл 0,20 М NaOH. Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль.
 [OH — ] можно рассчитать из конечного ммоль/(общий объем), чтобы получить 2,0 ммоль/(10 + 15 мл) = 0,08 M. Таблица 6-1 содержит необходимые формулы для расчета pOH и pH на основе этой информации. . рН этой смеси составляет 12,90. Смесь 2: Смесь 2, реакция сильного основания и слабой кислоты, также идет до конца. В зависимости от относительного количества вещества окончательный раствор может состоять только из сильного основания, только из слабого основания или из смеси слабой кислоты и слабого основания.Например, рассмотрим добавление 15 мл 0,20 М NaOH к 10 мл 0,30 М HC 2 H 3 O 2 . Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль. [OH — ] можно рассчитать из конечного ммоль/(общий объем), чтобы получить 2,0 ммоль/(10 + 15 мл) = 0,08 M. Таблица 6-1 содержит необходимые формулы для расчета pOH и pH на основе этой информации. . рН этой смеси составляет 12,90. Смесь 2: Смесь 2, реакция сильного основания и слабой кислоты, также идет до конца. В зависимости от относительного количества вещества окончательный раствор может состоять только из сильного основания, только из слабого основания или из смеси слабой кислоты и слабого основания.Например, рассмотрим добавление 15 мл 0,20 М NaOH к 10 мл 0,30 М HC 2 H 3 O 2 . Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль.
 Скорее [OH —], связанный с сильным основанием, имеет тенденцию подавлять образование [OH —] в результате реакции слабого основания и воды. Пожалуйста, обратитесь к учебнику для более подробной информации. В композициях, подобных этой, рН можно легко получить, ориентируясь на концентрацию сильного основания. Например, рассмотрим добавление 20 мл 0,20 М NaOH к 10 мл 0,20 М NaC 2 H 3 O 2 . Это приводит к разбавлению сильного основания.В этом примере [OH — ] = ммоль NaOH/общий объем = 20 мл x 0,20 M OH — / (20, + 10, мл) = 0,13 M. Таблица 6-1 содержит необходимые формулы для расчета pOH. и рН из этой информации. рН этой смеси составляет 13,12. Смесь 4: Смесь 4, реакция сильной кислоты и слабого основания, также идет до конца. В зависимости от относительного количества вещества окончательный раствор может состоять только из сильной кислоты, только из слабой кислоты или из смеси слабой кислоты и слабого основания. Скорее [OH —], связанный с сильным основанием, имеет тенденцию подавлять образование [OH —] в результате реакции слабого основания и воды. Пожалуйста, обратитесь к учебнику для более подробной информации. В композициях, подобных этой, рН можно легко получить, ориентируясь на концентрацию сильного основания. Например, рассмотрим добавление 20 мл 0,20 М NaOH к 10 мл 0,20 М NaC 2 H 3 O 2 . Это приводит к разбавлению сильного основания.В этом примере [OH — ] = ммоль NaOH/общий объем = 20 мл x 0,20 M OH — / (20, + 10, мл) = 0,13 M. Таблица 6-1 содержит необходимые формулы для расчета pOH. и рН из этой информации. рН этой смеси составляет 13,12. Смесь 4: Смесь 4, реакция сильной кислоты и слабого основания, также идет до конца. В зависимости от относительного количества вещества окончательный раствор может состоять только из сильной кислоты, только из слабой кислоты или из смеси слабой кислоты и слабого основания. Например, рассмотрим добавление 15 мл 0,20 М HCl к 20 мл 0,20 М NaC 2 H 3 O 2 . Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль. Например, рассмотрим добавление 15 мл 0,20 М HCl к 20 мл 0,20 М NaC 2 H 3 O 2 . Поскольку смешиваются два раствора, в таблице реакций лучше использовать моли или ммоль.
( 11 ) PH = PK A + log | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| молей базы |
| молей кислоты |
pH = -log (1.8 x 10 -5 ) + Журнал (1,0 ммоль C 2 H 3 O 2 — / 3,0 ммоль HC 2 H 3 O 2 ) = 4.26
Смесь 5: Смесь 5, сильной кислоты и слабой кислоты, также не вступает в реакцию. [H 3 O + ], связанный с сильной кислотой, имеет тенденцию подавлять образование [H 3 O + ] в результате реакции слабой кислоты и воды. В композициях, подобных этой, рН можно легко получить, ориентируясь на концентрацию сильной кислоты.Например, рассмотрим добавление 30 мл 0,20 М HCl к 20 мл 0,15 М HC 2 H 3 O 2 . Это приводит к разбавлению сильной кислоты. В этом примере [H 3 O + ] = ммоль HCl / общий объем = 30 мл x 0,20 M H 3 O + / (30, + 20, мл) = 0,12 М. pH = — log [H 3 O + ] = 0,92. Смесь 6: Смесь 6, представляющая собой комбинацию слабой кислоты и слабого основания, также является буфером.pH можно рассчитать по уравнению Хендерсона-Хассельбаха. Например, рассмотрим смесь 10 мл 0,1 М NH 4 Cl и 15 мл 0,10 М NH 3 . Для этого примера
[H 3 O + ], связанный с сильной кислотой, имеет тенденцию подавлять образование [H 3 O + ] в результате реакции слабой кислоты и воды. В композициях, подобных этой, рН можно легко получить, ориентируясь на концентрацию сильной кислоты.Например, рассмотрим добавление 30 мл 0,20 М HCl к 20 мл 0,15 М HC 2 H 3 O 2 . Это приводит к разбавлению сильной кислоты. В этом примере [H 3 O + ] = ммоль HCl / общий объем = 30 мл x 0,20 M H 3 O + / (30, + 20, мл) = 0,12 М. pH = — log [H 3 O + ] = 0,92. Смесь 6: Смесь 6, представляющая собой комбинацию слабой кислоты и слабого основания, также является буфером.pH можно рассчитать по уравнению Хендерсона-Хассельбаха. Например, рассмотрим смесь 10 мл 0,1 М NH 4 Cl и 15 мл 0,10 М NH 3 . Для этого примераpH = -log (5,6 x 10 -10 ) + log (1,5 ммоль NH 3 / 1,0 ммоль NH 4 + ) = 9,43
Это краткое описание расчета рН чистых растворов кислот и оснований, а также смесей растворов кислот и оснований. В этой лабораторной работе вы более подробно изучите эти растворы и получите более полное представление о равновесии в водных смесях кислот и оснований.
В этой лабораторной работе вы более подробно изучите эти растворы и получите более полное представление о равновесии в водных смесях кислот и оснований.Оборудование
1
Пробирка 25 х 150 мм1
Стакан на 400 мл (для хранения пробирки)1
стеклянная палочка для перемешивания1
Мерный цилиндр на 10 мл1
стакан 100 мл2
стаканы 30 мл1
Интерфейс Микролаб1
Инструкции по измерению pH MicroLab1
pH-электрод с pH 7.00 буфер1
кольцевая подставка1
зажим1
Стакан на 250 мл для промывки электродов1
бутылка с деионизированной водой1
коробка Kimwipes
Реагенты
~60 мл
0,1 М NaOH10 мл
0. 1 М HCl
1 М HCl10 мл
0,1 М NH 4 Cl10 мл
0,1 М NaC 2 H 3 O 2~15 мл
буфер pH 4,00~15 мл
буфер pH 7,00~15 мл
буфер pH 10,00
Безопасность
HCl и NaOH вызывают коррозию.Они могут атаковать кожу и вызвать необратимое повреждение глаз. Если какой-либо раствор попал вам в глаза, немедленно используйте жидкость для промывания глаз. Держите глаза открытыми и промойте их водой. При попадании на кожу или одежду промойте пораженный участок водой. Попросите партнера по лаборатории сообщить инструктору о разливе.Удаление отходов
Все растворы можно смывать в раковину большим количеством воды.До класса
Пожалуйста, выполните предварительное задание WebAssign.Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не завершившие предварительную лабораторную работу WebAssign, должны принести и сдать лист предварительной лабораторной работы. Пожалуйста, введите расчетные значения pH из предлабораторного задания WebAssign в таблицу данных A на распечатанном рабочем листе.
Пожалуйста, введите расчетные значения pH из предлабораторного задания WebAssign в таблицу данных A на распечатанном рабочем листе.Лабораторная процедура
Пожалуйста, распечатайте рабочий лист для этой лабораторной работы. Этот лист понадобится вам для записи ваших данных. В этом эксперименте вы будете использовать рН-электроды, подключенные к интерфейсу MicroLab.Электроды pH имеют тонкую стеклянную колбу на конце. Они легко ломаются, а их замена стоит дорого. Будьте осторожны, чтобы не протолкнуть электрод на дно стакана и не уронить электрод. Вокруг наконечника имеется защитный кожух, который всегда должен оставаться на месте. Гарда не защитит от небрежного обращения. Пожалуйста, будьте предельно осторожны при использовании этого оборудования. Наилучшие результаты использования электродов достигаются, если:•
Когда электроды не используются, их хранят в стандартном буферном растворе с pH 7.•
Непосредственно перед использованием электроды промывают деионизированной водой и осторожно промокают салфеткой, а затем помещают в испытуемый раствор.
•
Электроды промывают и снова промокают после измерения и возвращают в буферный раствор с pH 7.
Часть A: Калибровка pH-электрода MicroLab
TM1
Откройте программу МикроЛаб.2
Убедитесь, что pH-электрод подключен к интерфейсу.3
Откалибруйте pH-электрод, используя инструкции MicroLab, предоставленные в лаборатории. Стандартами калибровки pH-электрода будут буферный раствор с pH = 4,00 (красный), буферный раствор с pH = 7,00 (желтый) и буферный раствор с pH = 10,00 (синий). Используйте около 15 мл каждого из них в стаканах на 30 мл.4
После завершения калибровки настройте программу MicroLab для сбора данных, как описано в лаборатории.Часть B: Измерение pH кислотно-основных смесей
1
В стакан на 100 мл наберите ~70 мл 0,1 М NaOH с боковой полки.2
Отмерьте 10,0 мл деионизированной воды с помощью мерного цилиндра на 10 мл. Осторожно налейте воду в пробирку 25 х 150 мм и поместите ее в химический стакан на 400 мл для поддержки.
Осторожно налейте воду в пробирку 25 х 150 мм и поместите ее в химический стакан на 400 мл для поддержки.3
Измерьте pH деионизированной воды и запишите его в таблицу данных A.и
Извлеките электрод из буфера, промойте электрод деионизированной водой и промокните его салфеткой Kimwipe.б
Во время измерения поместите электрод так, чтобы он был погружен в раствор пробы, и осторожно покрутите химический стакан, оставив несколько секунд для уравновешивания.с
После записи измерения промойте электрод деионизированной водой и промокните его салфеткой Kimwipe. Затем верните его в предоставленный буфер pH 7.
4
Мера 5.0 мл 0,1 М NaOH с использованием мерного цилиндра. Аккуратно добавьте NaOH в воду в пробирке. Используйте стеклянную палочку для перемешивания, чтобы аккуратно перемешать раствор.5
Измерьте pH деионизированной воды с добавлением 5,0 мл NaOH и запишите его в таблицу данных A.
6
Снова отмерьте 5,0 мл 0,1 М раствора NaOH с помощью мерного цилиндра и осторожно добавьте его к раствору в пробирке. Используйте стеклянную палочку для перемешивания, чтобы аккуратно перемешать раствор.7
Измерьте pH деионизированной воды плюс 10.0 мл NaOH и запишите его в таблицу данных А.8
Еще раз отмерить мерным цилиндром 5,0 мл 0,1 М раствора NaOH и осторожно добавить его к раствору в пробирке. Используйте стеклянную палочку для перемешивания, чтобы аккуратно перемешать раствор.9
Измерьте pH деионизированной воды с добавлением 15,0 мл NaOH и запишите его в таблицу данных A.10
Вылейте раствор в раковину и промойте водой из-под крана. Промойте пробирку деионизированной водой и высушите, насколько это возможно.11
Повторите шаги 2-10, заменив 0,1 М HCl на деионизированную воду.12
Повторите шаги 2-10, заменив 0,1 М Nh5Cl на деионизированную воду.13
Повторите шаги 2–10, заменив 0,1 М NaC 2 H 3 O 2 на деионизированную воду.
14
После последнего измерения остановите и закройте программу MicroLab. Промойте всю стеклянную посуду водой, высушите ее и верните в место установки, где вы ее нашли.Убедитесь, что pH-электрод погружен в буферный раствор pH 7.15
Перед отъездом введите свои результаты в лабораторном задании. Если все результаты признаны правильными, выйдите из системы. Если не все результаты верны, попробуйте найти ошибку или проконсультируйтесь с лаборантом. Если все результаты правильные, запишите их и выйдите из WebAssign. Лабораторное задание должно быть выполнено к концу лабораторного периода. Если требуется дополнительное время, проконсультируйтесь с преподавателем лаборатории. Таблица A: Расчетные и измеренные pH смесей кислоты и Bse Вопрос 1: Для серии реакций 1, реакция воды с сильным основанием, сравните значения pH, рассчитанные в вашей предварительной лаборатории, с pH, измеренными вами в таблице данных A. Пожалуйста, объясните любые несоответствия между вашими расчетами и результатами измерений. Вопрос 2: Для серии реакций 2, реакция сильной кислоты с сильным основанием, сравните значения pH, рассчитанные в предварительной лаборатории, с значениями pH, измеренными в таблице данных A.Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 4: Для серии реакций 3 сравните значение pH, рассчитанное вами в предварительной лаборатории для 0,1 М раствора Nh5Cl в таблице данных A, с измеренным вами значением pH. Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 4a: Составьте реакционную таблицу для смеси 10,0 мл 0,1 М NH 4 Cl с 5,0 мл 0,1 М NaOH. Вопрос 4b: Рассчитайте равновесные концентрации NH 4 + , NH 3 , H 3 O + и OH — в полученном растворе.
Пожалуйста, объясните любые несоответствия между вашими расчетами и результатами измерений. Вопрос 2: Для серии реакций 2, реакция сильной кислоты с сильным основанием, сравните значения pH, рассчитанные в предварительной лаборатории, с значениями pH, измеренными в таблице данных A.Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 4: Для серии реакций 3 сравните значение pH, рассчитанное вами в предварительной лаборатории для 0,1 М раствора Nh5Cl в таблице данных A, с измеренным вами значением pH. Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 4a: Составьте реакционную таблицу для смеси 10,0 мл 0,1 М NH 4 Cl с 5,0 мл 0,1 М NaOH. Вопрос 4b: Рассчитайте равновесные концентрации NH 4 + , NH 3 , H 3 O + и OH — в полученном растворе. Вопрос 4c: Рассчитайте рН полученного раствора. вопрос 4d: Как это соотносится с измеренным вами значением pH? Пожалуйста, объясните любые несоответствия. Вопрос 5: Для серии реакций 4 сравните значение pH, рассчитанное вами в предварительном лабораторном исследовании, с 0.1 M NaC 2 H 3 O 2 раствор Таблица данных A с измеренным вами pH. Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 6a: Постройте реакционную таблицу для смеси 10,0 мл 0,1 М NaC 2 H 3 O 2 с 5,0 мл 0,1 М NaOH. Используя принцип Ле-Шателье, объясните влияние OH — на реакцию C 2 H 3 O 2 — с водой. Вопрос 6b: Рассчитать равновесные концентрации C 2 H 3 O 2 — , HC 2 H 3 O 2 , H 3 O + и OH — в полученном растворе.
Вопрос 4c: Рассчитайте рН полученного раствора. вопрос 4d: Как это соотносится с измеренным вами значением pH? Пожалуйста, объясните любые несоответствия. Вопрос 5: Для серии реакций 4 сравните значение pH, рассчитанное вами в предварительном лабораторном исследовании, с 0.1 M NaC 2 H 3 O 2 раствор Таблица данных A с измеренным вами pH. Пожалуйста, объясните любые несоответствия между вашими расчетными и измеренными результатами. Вопрос 6a: Постройте реакционную таблицу для смеси 10,0 мл 0,1 М NaC 2 H 3 O 2 с 5,0 мл 0,1 М NaOH. Используя принцип Ле-Шателье, объясните влияние OH — на реакцию C 2 H 3 O 2 — с водой. Вопрос 6b: Рассчитать равновесные концентрации C 2 H 3 O 2 — , HC 2 H 3 O 2 , H 3 O + и OH — в полученном растворе. Вопрос 6c: Рассчитайте pH полученного раствора. Вопрос 6d: Как это соотносится с измеренным вами значением pH? Пожалуйста, объясните любые несоответствия.
Вопрос 6c: Рассчитайте pH полученного раствора. Вопрос 6d: Как это соотносится с измеренным вами значением pH? Пожалуйста, объясните любые несоответствия.Copyright © 2010-2013 Advanced Instructional Systems, Inc. и Университет штата Северная Каролина | Кредиты
Как сильные кислоты или сильные основания заменяются слабыми кислотами или слабыми основаниями в аэрозолях?
Аннотация
Из-за значительного влияния на глобальный климат и здоровье человека атмосферные аэрозоли вызвали большой интерес со стороны научного сообщества, занимающегося изучением атмосферы.Чтобы получить представление об эффекте аэрозоля, необходимо всесторонне исследовать свойства аэрозоля. Поскольку атмосферные аэрозоли окружены значительной газовой фазой и имеют большую удельную поверхность, разделение состава между фазой частиц и газовой фазой должно рассматриваться как ключевой аэрозоль. свойство, которое называется летучестью для летучих органических/неорганических компонентов. Недавние исследования показывают, что летучесть аэрозоля также может быть вызвана реакцией компонентов в дополнение к летучим составам.Здесь мы суммируем четыре типа летучести, вызванной реакцией, а именно истощение хлоридов, истощение нитратов, истощение аммиака и летучесть, вызванную гидролизом соли. Для истощения хлоридов и нитратов эти процессы можно рассматривать как реакции замещения сильных кислот слабыми кислотами. Высокая летучесть образующихся HCl или HNO3 способствует непрерывному протеканию реакции. Что касается истощения аммония, мы наблюдали реакцию между (Nh5)2SO4 и солями органических кислот во время процесса дегидратации с помощью ATR-FTIR.Например, при молярном соотношении 1:1 в частицах сукцината динатрия/(Nh5)2SO4 наблюдалось значительное уменьшение содержания аммония, что указывает на испарение Nh4. Кроме того, после обезвоживания снижается гигроскопичность аэрозольных частиц, что следует связывать с образованием менее гигроскопичной янтарной кислоты и обеднением аммиаком.
свойство, которое называется летучестью для летучих органических/неорганических компонентов. Недавние исследования показывают, что летучесть аэрозоля также может быть вызвана реакцией компонентов в дополнение к летучим составам.Здесь мы суммируем четыре типа летучести, вызванной реакцией, а именно истощение хлоридов, истощение нитратов, истощение аммиака и летучесть, вызванную гидролизом соли. Для истощения хлоридов и нитратов эти процессы можно рассматривать как реакции замещения сильных кислот слабыми кислотами. Высокая летучесть образующихся HCl или HNO3 способствует непрерывному протеканию реакции. Что касается истощения аммония, мы наблюдали реакцию между (Nh5)2SO4 и солями органических кислот во время процесса дегидратации с помощью ATR-FTIR.Например, при молярном соотношении 1:1 в частицах сукцината динатрия/(Nh5)2SO4 наблюдалось значительное уменьшение содержания аммония, что указывает на испарение Nh4. Кроме того, после обезвоживания снижается гигроскопичность аэрозольных частиц, что следует связывать с образованием менее гигроскопичной янтарной кислоты и обеднением аммиаком. Рассматривая соли органических кислот как слабые основания, истощение аммония представляет собой реакцию, при которой сильное основание заменяется слабым основанием, что приводит к непрерывному высвобождению Nh4.В дополнение к летучести, вызванной реакциями в многокомпонентных аэрозолях, мы также обнаружили, что гидролиз солей также может вызывать образование летучих продуктов. Для аэрозолей ацетата магния (MgAc2) мы обнаружили значительную потерю воды аэрозольными частицами в условиях постоянной относительной влажности, при этом количество ацетата также уменьшилось. Мы делаем вывод, что испарение уксусной кислоты (HAc) вызвано гидролизом MgAc2, что приводит к летучести и снижению гигроскопичности. Два фактора способствуют летучести аэрозолей MgAc2.Одним из них является донор летучей кислоты (Ac2-), который может привести к образованию летучей HAc. Другой — акцептор остаточных ионов (Mg2+), который может объединять остаточный OH- после истощения протона в результате испарения HAc. Образование нерастворимого Mg(OH)2 эффективно поддерживает рН водного раствора в приемлемом диапазоне, способствуя протеканию реакции.
Рассматривая соли органических кислот как слабые основания, истощение аммония представляет собой реакцию, при которой сильное основание заменяется слабым основанием, что приводит к непрерывному высвобождению Nh4.В дополнение к летучести, вызванной реакциями в многокомпонентных аэрозолях, мы также обнаружили, что гидролиз солей также может вызывать образование летучих продуктов. Для аэрозолей ацетата магния (MgAc2) мы обнаружили значительную потерю воды аэрозольными частицами в условиях постоянной относительной влажности, при этом количество ацетата также уменьшилось. Мы делаем вывод, что испарение уксусной кислоты (HAc) вызвано гидролизом MgAc2, что приводит к летучести и снижению гигроскопичности. Два фактора способствуют летучести аэрозолей MgAc2.Одним из них является донор летучей кислоты (Ac2-), который может привести к образованию летучей HAc. Другой — акцептор остаточных ионов (Mg2+), который может объединять остаточный OH- после истощения протона в результате испарения HAc. Образование нерастворимого Mg(OH)2 эффективно поддерживает рН водного раствора в приемлемом диапазоне, способствуя протеканию реакции. Следует отметить, что сосуществование переносчика летучих кислот и акцептора остаточных ионов необходимо для летучести, вызванной гидролизом. Как правило, для летучих веществ, присутствующих в атмосфере, летучесть аэрозоля, вызванная реакцией компонентов, может быть важным путем. для процессов их переработки.Из-за существенного изменения состава такая реакция также влияет на гигроскопичность. Следовательно, такое распределение аэрозолей необходимо учитывать в будущих исследованиях атмосферных аэрозолей, что может предотвратить недооценку улетучивания частиц или переоценку гигроскопичности.
Следует отметить, что сосуществование переносчика летучих кислот и акцептора остаточных ионов необходимо для летучести, вызванной гидролизом. Как правило, для летучих веществ, присутствующих в атмосфере, летучесть аэрозоля, вызванная реакцией компонентов, может быть важным путем. для процессов их переработки.Из-за существенного изменения состава такая реакция также влияет на гигроскопичность. Следовательно, такое распределение аэрозолей необходимо учитывать в будущих исследованиях атмосферных аэрозолей, что может предотвратить недооценку улетучивания частиц или переоценку гигроскопичности.
Коллоиды
КоллоидыКонстанты равновесия для кислот и оснований: K a
Кислотно-щелочные проблемы можно разделить на 4 категории: сильная кислота/основа, слабая кислота/основание, буферы и гидролиз.
Помните: сила кислоты определяется тем, насколько вправо смещено равновесие. Качественно об этом можно судить по К и кислоты. Большой K a указывает на сильную кислоту; маленький K a указывает на слабую кислоту.
Большой K a указывает на сильную кислоту; маленький K a указывает на слабую кислоту.
Слабые кислоты и основания
Слабые кислоты и слабые основания не диссоциируют полностью. Существует равновесие между слабой кислотой, водой, H 3 O + и анионом слабой кислоты.Равновесие находится в левой части уравнения, указывая на то, что производится немного H 3 O + . Тот факт, что производится очень мало H 3 O + , является определением слабой кислоты. K a для слабой кислоты мал, обычно число меньше 1.
Диссоциация слабой кислоты
В задаче этого типа вас попросят найти концентрацию ионов гидроксония и/или рН слабой кислоты, начальная концентрация которой известна.Типичная проблема может быть:
Какова концентрация ионов гидроксония и pH 0,010 М раствора хлорноватистой кислоты, K a = 3,5 x 10 -8 ?
1 st напишите сбалансированное уравнение диссоциации :
HClO(водн. ) + H 2 O(л)ó H 3 O + (водн.) + ClO ¯(водн.)
) + H 2 O(л)ó H 3 O + (водн.) + ClO ¯(водн.)
2 nd напишите выражение равновесия: Примечание: H 2 O не входит в уравнение.Почему нет?
3 rd настройте таблицу ICE:
HClO(водн.) ó H 3 O + (водн.) + ClO ¯(водн.)
Исходный 0,010M 0 0
Изменить -x +x +x
Равновесие 0.010-x x x
4 th подставьте значение в выражение равновесия и найдите x:
Решение для x упрощается, поскольку x в знаменателе можно не учитывать. Этим х можно пренебречь, потому что он будет пренебрежимо мал по сравнению с концентрацией 0,10 М. Чтобы определить, пренебрежимо ли х, сравните величину последнего десятичного знака концентрации кислоты с величиной константы равновесия.Если разница в величине больше 100, х можно не учитывать. В этом случае концентрация известна с точностью до 10 -3 , а константа равновесия равна 10 -8 . Разница в величине составляет 10 5 , поэтому x можно легко пренебречь.
Этим х можно пренебречь, потому что он будет пренебрежимо мал по сравнению с концентрацией 0,10 М. Чтобы определить, пренебрежимо ли х, сравните величину последнего десятичного знака концентрации кислоты с величиной константы равновесия.Если разница в величине больше 100, х можно не учитывать. В этом случае концентрация известна с точностью до 10 -3 , а константа равновесия равна 10 -8 . Разница в величине составляет 10 5 , поэтому x можно легко пренебречь.
5 th вычислить x: x 2 = (0,010)(3,5×10 -8 ) = 3,5 x 10 -10 ; х = 1,87 х 10 -5 М
6 th Рассчитайте pH, используя вновь найденное значение H 3 O + : [H 3 O + ] = 1.87 x 10 -5 M
pH = -log(0,87 x 10 -5 M) = 4,73
Тот же самый процесс, показанный выше, работает и для диссоциации основания, вам просто нужно рассчитать [OH — ], вычислить pOH и затем преобразовать в pH.
Проблемы:
- Какова концентрация ионов гидроксида и рН 0.10 М раствор NH 3 , К b = 1,8 х 10 -5 ?
NH 3 + H 2 O ó NH 4 + + OH —
Начальный 0,10 0 0
Изменить +x +x
Равновесие 0.10 – x x x
Предположим, что x мало по сравнению с концентрацией (Ka составляет ~10 -5 , концентрация составляет 10 -1 , разница составляет 10 000).
1.8 x 10 -5 = x 2 /0. 10 x = 1.34 x 10 -3 Итак [OH] = 1.34 x 10 -3 м
10 x = 1.34 x 10 -3 Итак [OH] = 1.34 x 10 -3 м
рОН = -log(1.34 x 10 -3 M) = 2,9 SO pH = 14–2,9 = 11,1
- Предположим, у вас есть раствор объемом 1,0 л, который изначально содержит 0,20 М в уксусной кислоте (HAc) и 0,10 М в ацетате натрия (NaAc). Какой будет рН этого раствора? Каким будет рН, если в систему добавить 2 мл 1,0 М HCl? К a = 1,8 х 10 -5
Исходная реакция: HAc + H 2 O ó H 3 O + + Ac —
Исходный 0.20 0 0,10
Изменение -x +x +x
Равновесие 0,20 – x x 0,10 + x
Снова предположим, что x мало по сравнению с концентрацией кислоты и основания, упростите и вычислите x:
К и = 0,10x/0. 20 = 1,8 x 10 -5 x = 3,6 x 10 -5 [H 3 O] = 3,6 x 10 -5 M 7
20 = 1,8 x 10 -5 x = 3,6 x 10 -5 [H 3 O] = 3,6 x 10 -5 M 7
, поэтому pH = –log(3,6 x 10 -5 М) = 4,44
Добавление Добавление сильной кислоты H + : 0,002 л x 1,0 моль/л = добавлено 0,002 моля. Таким образом, равновесие смещается влево, обратно в сторону слабой кислоты. Прибавляем концентрацию кислоты к кислоте и вычитаем из основания:
После добавления кислоты новые концентрации: [Hac] = ~0.202М ; [Ас —] = ~0,098М. Это наши новые исходные концентрации. ~ здесь, потому что концентрации включают 2 мл объема кислоты.
Реакция: HAc + H 2 O ó H 3 O + + Ac 3 Исходный ~0,202 0 ~0,098 Изменение -x +x +x Равновесие 0. Предположим, что x мало, тогда 1,8 x 10 -5 = 0,098x/0,202 x = 3,64 x 10 -5 M Новый pH = 4,43 Это в основном буферная система, так что изменение должно быть небольшим! Гидролиз соли – При нейтрализации сильной кислоты и сильного основания в реакции: H + + OH — ó H 2 O Обычно образуется нейтральная соль. Соль, образованная между сильной кислотой и слабым основанием, представляет собой кислую соль . Аммиак — слабое основание, и его соль с любой сильной кислотой дает раствор с рН ниже 7. Например, рассмотрим реакцию: HCl + NH 4 OH — NH 4 + + Cl — + H 2 O В растворе ион NH 4 + реагирует с водой (называется гидролизом) по уравнению: NH 4 + + H 2 O ó NH 3 + H 3 O + . Основная соль образуется между слабой кислотой и сильным основанием. Основность обусловлена гидролизом сопряженного основания (слабой) кислоты, используемой в реакции нейтрализации. Например, ацетат натрия, образующийся между слабой уксусной кислотой и сильным основанием NaOH, является основной солью. При растворении соли происходит ионизация: NaCH 3 COO = Na + + CH 3 COO — В присутствии воды CH 3 COO — подвергается гидролизу: H 2 O + CH 3 COO — = CH 3 COOH + OH — Соль, образующаяся между слабой кислотой и слабым основанием, может быть нейтральной, кислой или основной в зависимости от относительных сил кислоты и основания. Если K a (катион) > K b (анион), раствор соли кислый. Если К а (катион) = К b (анион), то раствор соли нейтрален. Если K a (катион) < K b (анион), то раствор соли является щелочным. Как получить K b , если вы получили только K a или наоборот? K A * K B = K W = 1 x 10 -14 или PK A + PK B = PK W Проблемы: CN — + H 2 O — HCN + OH — I 0. C -x +x +x E 0,1-x x x 1.6 x 10 -5 = x 2 /0,1 при условии, что x маленькое x = 0,0013 = [OH — ] pOH = 2,9, поэтому pH = 11,1 HA + MOH à H 2 O + MA где MA — соль. Это реакция нейтрализации. Стехиометрия реакции определяет количество кислоты или основания, оставшихся непрореагировавшими в растворе, и, следовательно, рН раствора. (Помните лимитирование и избыток реагентов?) Задача: каков рН раствора, содержащего 10 мл 1.0 М HCl и 20 мл 1,0 М NaOH? После реакции остается 10 мл основания. Итак, 0,01 моль основания = pOH, равное 2, поэтому pH будет 14-2 = 12. Сильная кислота и слабое основание: Если вы соедините сильную кислоту со слабым основанием, вы все равно получите соль: HCl(водн. Но, как и большинство солей, диссоциирует в воде.NH 4 + , как вы знаете, является кислотой, поэтому он далее реагирует с водой в растворе как: NH 4 + + H 2 O ó NH 3 + H 3 O + pH раствора будет определяться K a NH 4 + . (К и = 5,6 х 10 -10 ) Задача: Каким будет pH раствора, содержащего 20 мл 1M HCl и 20 мл 1M NH 3 ? HCl(водн.) + NH 3 (водн.) → NH 4 + Cl(водн.) ; 0.02 моля NH 4 + Cl(водн.), полученного в результате реакции, так что начните с этого: NH 4 + + H 2 O ó NH 3 + H 3 O + I 0,02 0 0 C -x +x +x E 0,02 – x x x 5. Сильное основание и слабая кислота: Когда вы смешиваете сильное основание со слабой кислотой, вы все равно получаете соль: CH 3 COOH (водн.) + NaOH (водн.) — NaCH 3 COO ¯ (водн.) + H 2 O(ж) Но, как и большинство солей, диссоциирует в воде.СН 3 СОО ¯ , как известно, является сопряженным основанием слабой кислоты, поэтому далее реагирует с водой в растворе как: CH 3 COO ¯ (водн.) + H 2 O(л) — CH 3 COOH (водн.) + OH — (водн.) Таким образом, рН раствора зависит от K b аниона соли. Задача: Каким будет pH раствора, содержащего 20 мл 1M CH 3 COOH и 20 мл 1M NaOH? CH 3 COOH (водн.) + NaOH (водн.) — NaCH 3 COO ¯ (водн.) + H 2 O(ж) ; 0.02 моль NaCH 3 COO ¯ производятся таким образом, начиная с этого: 6  202 –x x 0,098 + x
202 –x x 0,098 + x 
Соли слабых кислот и слабых оснований

К a (HCN) = 6,2E-10, K b (CN-) = 1,6E-5. 1 0 0
1 0 0 ) + NH 3 (водн.) → NH 4 + Cl(водн.)
) + NH 3 (водн.) → NH 4 + Cl(водн.) 6 x 10 -10 = x 2 /0,02 при малом x. x = 3,35 x 10 -6 = [H 3 O + ] pH = 5,5
6 x 10 -10 = x 2 /0,02 при малом x. x = 3,35 x 10 -6 = [H 3 O + ] pH = 5,5  К б = 5,6х10 -10
К б = 5,6х10 -10
I 0,02 0 0
C -x +x +x
E 0.02-x x x
5,6 x 10 -10 = x 2 /0,02 при малом x. x = 3,35 x 10 -6 = [OH — ] pOH = 5,5, поэтому pH = 8,5
x = 3,35 x 10 -6 = [OH — ] pOH = 5,5, поэтому pH = 8,5
Слабое основание и слабая кислота: K Rxn = K w /K a K b ; [H 3 O] = (K w K a /K b ) 1/2
Это дает соль, состоящую из сопряженной кислоты и основания.pH зависит от K a и K b этих видов.
Таблицы сильных кислот и оснований
Таблицы сильных кислот и оснований (Вернуться к странице 5 Anion) ТАБЛИЦА СИЛЬНЫХ КИСЛОТ
Полностью ионизированный в воде
дать один ( или более ) протонов на молекулу кислоты
| Привет | H + (водн.) + I — (водн.) |
| HBr | H + (водн. ) + Br — (водн.) ) + Br — (водн.) |
| HClO 4 | H + (водн.) + ClO 4 — (водн.) |
| HCl | H + (водн.) + Cl — (водн.) |
| HClO 3 | H + (водн.) + ClO 3 — (водн.) |
| H 2 SO 4 | H + (водн.) + HSO 4 — (водн.) (HSO 4 — является слабой кислотой, которая вносит дополнительные протоны) |
| HNO 3 | H + (водн.) + NO 3 — (водн.) |
ТАБЛИЦА СИЛЬНЫХ ОСНОВАНИЙ
Полностью ионизированный в воде
дать один ( или более ) гидроксидов на основную молекулу
| NaOH | Na + (водн. ) + OH — (водн.) ) + OH — (водн.) |
| КОН | K + (водн.) + OH — (водн.) |
| LiOH | Li + (водн.) + OH — (водн.) |
| RbOH | Rb + (водн.) + OH — (водн.) |
| CsOH | Cs + (водн.) + OH — (водн.) |
| Са(ОН) 2 | Ca 2+ (водн.) + 2OH — (водн.) (но плохо растворим) |
| Ва(ОН) 2 | Ba 2+ (водн.) + 2OH — (водн.) (но плохо растворим) |
| Sr(OH) 2 | Sr 2+ (водн.) + 2OH — (водн.) (но плохо растворим) |
(Список распространенных слабых кислот и основания, см. Таблицу 8 -2 в Oxtoby)
.
 Кислоты и основания растворяются в воде и, увеличивая концентрацию одного из продуктов самоионизации воды — протонов или гидроксид-ионов, подавляют диссоциацию воды.
Кислоты и основания растворяются в воде и, увеличивая концентрацию одного из продуктов самоионизации воды — протонов или гидроксид-ионов, подавляют диссоциацию воды. 76
76 Найдите возможные реакции K a или K b . Или для реакций слабого основания с ионом гидроксония или слабой кислоты с ионом гидроксида, которые будут реагировать на 100%.Иногда не будет соответствующей химической реакции!
Найдите возможные реакции K a или K b . Или для реакций слабого основания с ионом гидроксония или слабой кислоты с ионом гидроксида, которые будут реагировать на 100%.Иногда не будет соответствующей химической реакции! ML X 0,30 м
ML X 0,30 м 0 ммоль
0 ммоль 1 М HCl
1 М HCl