Факторы, влияющие на скорость химических реакций.
1) Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди — не реагирует.
2)Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ — скорость реакции возрастает.
Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
Один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м. з. в 1864—67, назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для мономолекулярной реакции
скорость реакции определяется концентрацией молекул вещества А: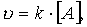
где k — коэффициент пропорциональности, который называется константой скорости реакции; [А] — молярная концентрация вещества А.
В случае бимолекулярной реакции, ее скорость определяется концентрацией молекул не только вещества А, но и вещества В:
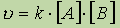
В случае тримолекулярной реакции, скорость реакции выражается уравнением:
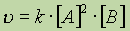
В общем случае, если в реакцию вступают одновременно т молекул вещества А и n молекул вещества В, т. е.
тА + пВ = С,
уравнение скорости реакции имеет вид:
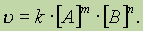
. Вид уравнения определяется тем, что необходимым условием элементарного акта реакции является столкновение молекул исходных веществ, т. е. их встреча в некотором малом объёме (порядка размера молекул). Вероятность найти в данный момент в данном малом объёме молекулу А пропорциональна [А], т. е., чем больше концентрация реагирующих веществ, тем больше скорость реакции в данный момент времени.
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, а в случае жидкого раствора — также и от давления; последняя зависимость существенна лишь при высоких давлениях, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Запишите выражение закона действия масс для следующих реакций:
a) N2(г) + 3H2(г) = 2NH3(г)
b) 2C(к) + O2(г) = 2CO(г)
studfile.net
2. Факторы, влияющие на скорость химической реакции. Физическая химия: конспект лекций
2. Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Пример:
NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода.
Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени.
Концентрация реагирующих веществ будет рассмотрена ниже.
Пример:

Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше.

Рис. 10
Чем больше концентрации Na2S2O3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Итак, основным законом кинетики является установленный опытным путем закон: скорость реакции пропорциональна концентрации реагирующих веществ, пример: (т.е. для реакции)

Для этой реакции Н2 + J2 = 2НJ – скорость можно выразить через изменение концентрации любого из веществ. Если реакция протекает слева направо, то концентрация Н2 и J2 будет уменьшаться, концентрация НJ – увеличиваться по ходу реакции. Для мгновенной скорости реакций можно записать выражение:

квадратными скобками обозначается концентрация.
Физический смысл k– молекулы находятся в непрерывном движении, сталкиваются, разлетаются, ударяются о стенки сосуда. Для того, чтобы произошла химическая реакция образования НJ, молекулам Н

У большинства же сталкивающихся молекул энергия меньше необходимой для ослабления связей в Н 2 и J2. Такие молекулы «тихо» столкнутся и также «тихо» разойдутся, оставшись тем, чем они были, Н2 и J2. Таким образом, не все, а лишь часть столкновений приводит к химической реакции. Коэффициент пропорциональности (k) показывает число результативных, приводящих к реакции соударений при концентрациях [Н2] = [J2] = 1моль. Величина k– const скорости. Как же скорость может быть постоянной? Да, скоростью равномерного прямолинейного движения называют постоянную векторную величину, равную отношению перемещения тела за любой промежуток времени к значению этого промежутка. Но молекулы движутся хаотически, тогда как же может быть скорость – const? Но постоянная скорость может быть только при постоянной температуре. С ростом температуры увеличивается доля быстрых молекул, столкновения которых приводят к реакции, т. е. увеличивается константа скорости. Но увеличение константы скорости не безгранично. При какой-то температуре энергия молекул станет столь большой, что практически все соударения реагентов будут результативными. При столкновении двух быстрых молекул будет происходить обратная реакция.

Настанет такой момент, когда скорости образования 2НJ из Н2 и J2 и разложения будут равны, но это уже химическое равновесие. Зависимость скорости реакции от концентрации реагирующих веществ можно проследить, пользуясь традиционной реакцией взаимодействия раствора тиосульфата натрия с раствором серной кислоты.
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3, (1)
H2S2O3 = S?+H2O+SO2?. (2)
Реакция (1) протекает практически мгновенно. Скорость реакции (2) зависит при постоянной температуре от концентрации реагирующего вещества H 2S2O3. Именно эту реакцию мы наблюдали – в этом случае скорость измеряется временем от начала сливания растворов до появления опалесценции. В статье Л. М. Кузнецовой описана реакция взаимодействия тиосульфата натрия с соляной кислотой. Она пишет, что при сливании растворов происходит опалесценция (помутнение). Но данное утверждение Л. М. Кузнецовой ошибочно так как опалесценция и помутнение – это разные вещи. Опалесценция (от опал и латинского escentia – суффикс, означающий слабое действие) – рассеяние света мутными средами, обусловленное их оптической неоднородностью. Рассеяние света – отклонение световых лучей, распространяющихся в среде во все стороны от первоначального направления. Коллоидные частицы способны рассеивать свет (эффект Тиндаля – Фарадея) – этим объясняется опалесценция, легкая мутноватость коллоидного раствора. При проведении этого опыта надо учитывать голубую опалесценцию, а затем коагуляцию коллоидной суспензии серы. Одинаковую плотность суспензии отмечают по видимому исчезновению какого-либо рисунка (например, сетки на дне стаканчика), наблюдаемого сверху через слой раствора. Время отсчитывают по секундомеру с момента сливания.
Растворы Na2S2O3 x 5H2O и H2SO4.
Первый готовят путем растворения 7,5 г соли в 100 мл H2O, что соответствует 0,3 М концентрации. Для приготовления раствора H2SO4 той же концентрации отмерить надо 1,8 мл H2SO4(к), ? = = 1,84 г/см3 и растворить ее в 120 мл H2O. Приготовленный раствор Na2S2O3 разлить в три стакана: в первый – 60 мл, во второй – 30 мл, в третий – 10 мл. Во второй стакан добавить 30 мл H2O дистиллированной, а в третий – 50 мл. Таким образом, во всех трех стаканах окажется по 60 мл жидкости, но в первом концентрация соли условно = 1, во втором – Ѕ, а в третьем – 1/6. После того, как будут подготовлены растворы, в первый стакан с раствором соли прилейте 60 мл раствора H2SO4 и включите секундомер, и т. д. Учитывая, что скорость реакции падает с разбавлением раствора Na2S2O3, ее можно определить как величину, обратно пропорциональную времени v = 1/? и построить график, отложив на оси абсцисс концентрацию, а на оси ординат – скорость реакции. Из этого вывод – скорость реакции зависит от концентрации веществ. Полученные данные занесены в таблицу 3. Можно этот опыт выполнить с помощью бюреток, но это требует от выполняющего большой практики, потому что график бывает неправильным.
Таблица 3
Скорость и время реакции

Подтверждается закон Гульдберга-Вааге – профессора химии Гульдерга и молодого ученого Вааге).
Рассмотрим следующий фактор – температуру.
При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза».

где ? – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °C;
v1 – скорость реакции при температуре t1;
v2 – скорость реакции при температуре t2.

Например, реакция при 50 °С протекает за две минуты, за сколько времени закончится процесс при 70 °С, если температурный коэффициент ?= 2?
Решение:

t1 = 120 с = 2 мин; t1 = 50 °С; t2 = 70 °С.
Даже небольшое повышение температуры вызывает резкое увеличение скорости реакции активных соударений молекулы. Согласно теории активации, в процессе участвуют только те молекулы, энергия которых больше средней энергии молекул на определенную величину. Эта избыточная энергия – энергия активации. Физический смысл ее – это та энергия, которая необходима для активного столкновения молекул (перестройки орбиталей). Число активных частиц, а следовательно, скорость реакции возрастает с температурой по экспоненциальному закону, согласно уравнению Аррениуса, отражающему зависимость константы скорости от температуры

где А – коэффициент пропорциональности Аррениуса;
k– постоянная Больцмана;
ЕА – энергия активации;
R – газовая постоянная;
Т– температура.
Катализатор – вещество, ускоряющее скорость реакции, которое само при этом не расходуется.
Катализ – явление изменения скорости реакции в присутствии катализатора. Различают гомогенный и гетерогенный катализ. Гомогенный – если реагенты и катализатор находятся в одном агрегатном состоянии. Гетерогенный – если реагенты и катализатор в различных агрегатных состояниях. Про катализ см. отдельно (дальше).
Ингибитор – вещество, замедляющее скорость реакции.
Следующий фактор – площадь поверхности. Чем больше поверхность реагирующего вещества, тем больше скорость. Рассмотрим на примере влияние степени дисперсности на скорость реакции.
CaCO3 – мрамор. Плиточный мрамор опустим в соляную кислоту HCl, подождем пять минут, он растворится полностью.
Порошкообразный мрамор – с ним проделаем ту же процедуру, он растворился через тридцать секунд.
Уравнение обоих процессов одинаково.
CaCO3(тв) + HCl(г) = CaCl2(тв) + H2O(ж) + CO2(г) ?.
Итак, при добавлении порошкообразного мрамора время меньше, чем при добавлении плиточного мрамора, при одинаковой массе.
С увеличением поверхности раздела фаз скорость гетерогенных реакций увеличивается.
Поделитесь на страничкеСледующая глава >
fis.wikireading.ru
20. Основные понятия химической кинетики. Скорость химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных процессах.
Химическая кинетика –изучает скорость химической реакции и зависимость ее от различных факторов, а также механизм протекания химических реакций.
Скоростью химической реакции называют число элементарных актов реакции, происходящих в единицу времени.
Скорость химической реакции зависит от:
1) концентрации реагирующих веществ;
2) температуры;
3) присутствия катализаторов;
4) природы реагирующих веществ;
5) степени измельчения твердого вещества;
6) перемешивания, если вещества находятся в растворенном состоянии.
Vист =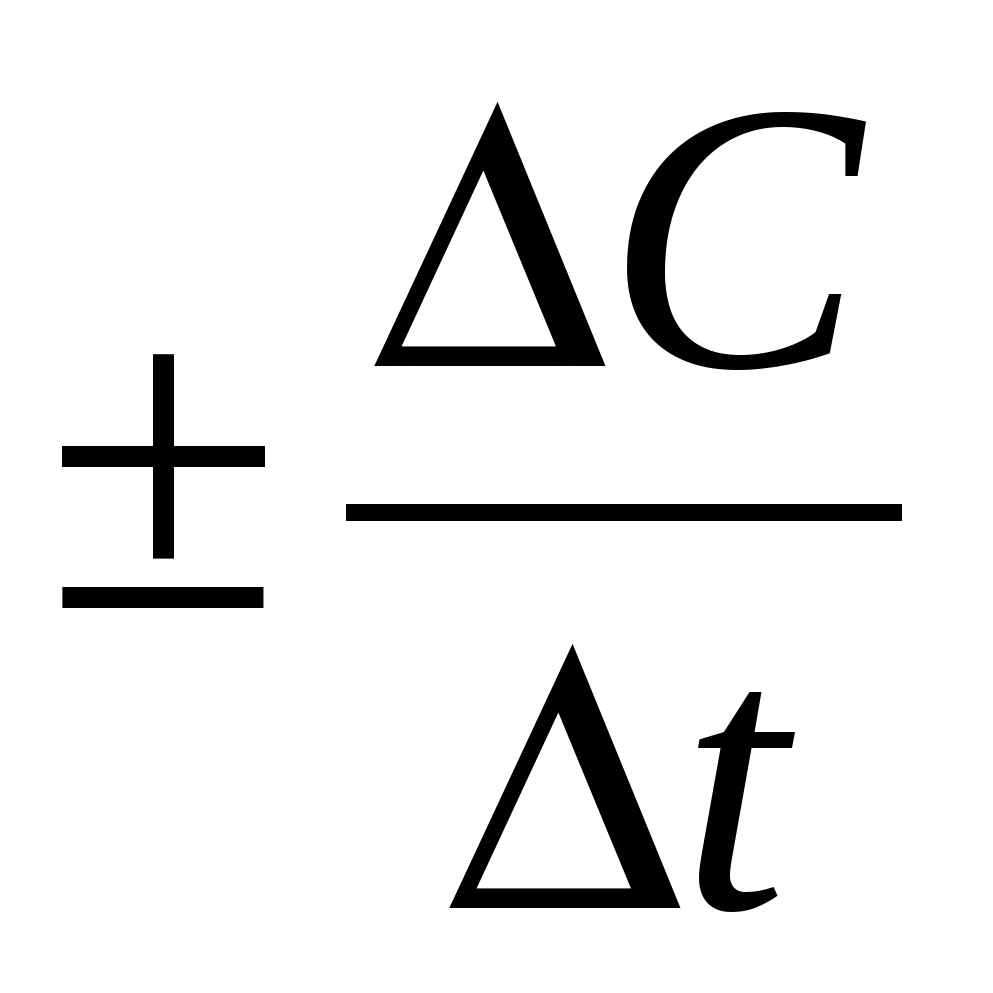
Средняя скорость каждой реакции определяется изменением молярной концентрации реагирующих в-в за промежуток времени. (моль/(литр*с))
21. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Закон действующих масс показывает зависимость скорости хим. реакц. от концентрации реагир. в-в.
Скорость хим. реакт. Прямо пропорциональна произв. конц. реагирующих в-в, взятых в степенях их стехиометрических коэф.
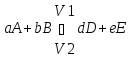
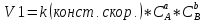
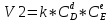
Для газовых реакций можно пользоваться
парциальным давлением.
Закон справедлив
только для ГОМОГЕННЫХсистем. Если
система гетерогенная, то скор. Реакц.
Зависит от пов-ти раздела(степени
давления) твердой фазы.
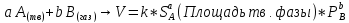
22. Влияние температуры на скорость химической реакции. Энергия активации.
При повышении температуры увеличивается запас внутренней энергии молекул. Всё большее их число становятся активными. Как следствие этого, возрастает доля эффективных соударений между молекулами за единицу времени, а значит и скорость химической реакции.
При повышении температуры концентрации исходных веществ в реакционной смеси практически не изменяются. Значит, увеличение скорости реакции в соответствии с главным кинетическим уравнением должно быть связано с возрастанием её константы скорости.
Голландский учёный Вант-Гофф опытным путём определил, что для химических реакций (имеющих нормальный тип зависимости скорости от температуры) при повышении температуры на каждые 10 градусов величина константы скорости возрастает в 2-4 раза. Причём для каждой химической реакции это число является постоянным и может принимать из указанного интервала как целочисленные (2, 3, 4) значения, так и дробные. Оно определяется экспериментально, называетсятемпературным коэффициентом скорости химической реакции или коэффициентом Вант-Гоффа и обозначается греческой буквой γ:
γ = 
где kТ – константа скорости химической реакции при температуре, равной Т; kT+10 – константа скорости химической реакции при температуре, повышенной, по сравнению с исходной, на 10 градусов.
Энергию активации химической реакции (Еа) по физическому смыслу можно определить как тот избыток энергии, по сравнению со средней энергией неактивных молекул исходных веществ в реакционной системе при данной температуре, который им нужно сообщить, чтобы столкновения между ними привели к химической реакции.
Минимальный запас энергии, которым должны обладать молекулы для вступления в ту или иную реакцию, можно рассматривать как своеобразный энергетический барьер этой реакции.
Причём, чем он выше, тем меньшее число молекул способно его преодолеть. Зная общее число молекул в системе и величину энергии активации для данной реакции, количество таких активных молекул можно рассчитать по закону Максвелла-Больцмана
Na = No∙
где Na – число активных молекул, No– общее число молекул.
studfile.net
План-конспект урока по химии по теме: «Скорость химической реакции и факторы, влияющие на скорость химической реакции»
Урок химии в 11 классе на тему:
«Скорость химической реакции и факторы, влияющие на скорость химической реакции»
Цели:
- дать понятие о скорости химической реакции;
- показать влияние на скорость химической реакции таких факторов, как природа реагирующих веществ, их концентрация, площадь поверхности соприкосновения веществ, температура и участие катализаторов;
- рассмотреть классификацию химических реакций по таким признакам, как «фазовое состояние» и «участие катализатора»;
- развивать умение анализировать, сравнивать, делать выводы, применять приобретённые знания и умения в практической деятельности и повседневной жизни.
Тип урока: урок изучения нового материала с элементами исследования.
Основные понятия: молярная концентрация, скорость химической реакции, гомогенные и гетерогенные реакции, катализ, катализаторы, ферменты.
Оборудование и реактивы: растворы HCl, h3SO4, Ch4COOH, h3O2, Zn, Mg, Fe, CuO, MnO2, пробирки, спиртовки, инструкции по выполнению лабораторных работ.
Ход урока.
Сообщение темы, цели урока, методов, формы работы. Для актуализации знаний учитель проводит с учащимися беседу по вопросам.
- Для чего нужны знания о скорости химической реакции?
- Приведите примеры химических реакций, идущих с разной скоростью.
- Предположите, чем можно измерить скорость химической реакции?
Предполагаемые ответы.
- Знания о скорости химической реакции помогут обосновать экономическую эффективность химических производств. Замедлить или ускорить процессы, которые сопровождают нас в повседневной жизни: коррозия металлов, хранение продуктов питания и т. п.
- Коррозия металлов, разложение органических веществ идут медленно. Горение спирта, взаимодействие кислот с металлами и мрамором — быстро. Реакции ионного обмена в растворах электролитов протекают мгновенно.
- Ответ на этот вопрос, как правило, вызывает затруднения. Целесообразно обратить внимание учащихся на количественные характеристики веществ (концентрацию), участвующих в химической реакции, и признаки, по которым судят о скорости химической реакции.
Учитель формулирует определение понятия «молярная концентрация». Молярная концентрация С — это отношение количества вещества к объёму:
C = n ? V
Единицей измерения является моль / л.
Скорость химической реакции υ — это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени:
υ = ± С1 — С2 / t2 — t1 = ± (знак дельта)C / (знак дельта)t,
где С1 и С2 — молярная концентрация реагирующих веществ или продуктов реакции соответственно в момент времени t2 и t1.
Единица изменения скорости химической реакции моль / л • с.
Если С2 больше С1 , то перед дробью ставят знак «минус».
Данное определение и формула справедливы лишь для гомогенных реакций. Учитель предлагает классификацию реакций по фазовому состоянию:
Химические реакции:
гомогенные: протекающие в однородной среде (нет поверхности раздела между реагирующими веществами)
гетерогенные: протекающие в неоднородной среде (есть поверхность раздела между веществами)
Учащимся предлагается классифицировать химические реакции по данному признаку.
N2(Г) +3h3(Г)→2Nh4(Г)
S(Т) +O2(Г)→SO2(Г)
CaCO3(Т) +2HCl(Р-Р)→CaCl2(Р-Р) +CO2(Г) +h3O(Ж)
N2(Г) +O2(Г)→2NO(Г)
Учитель задаёт вопрос: «Что может повлиять на изменение скорости химической реакции?» Учащиеся высказывают предположения. Для подтверждения своих гипотез учащимся предлагается выполнить ряд экспериментальных заданий. Задания выполняются в группах. Каждая группа получает свою инструкцию. Результаты работы оформляются в виде таблицы.
Исходные вещества | Признаки химической реакции | Уравнения химических реакций | Выводы о скорости протекания химической реакции |
Перед выполнением работы учитель проводит инструктаж по правилам техники безопасности.
Инструкция группе 1.
Исследование влияния природы реагирующих веществ на скорость химической реакции.
Цель: сравнить скорость протекания химической реакции взаимодействия раствора соляной кислоты с различными металлами.
Оборудование и реактивы: раствор соляной кислоты, Mg, Zn, Fe, пробирки.
Возьмите три пробирки и налейте в них по одному мл соляной кислоты, поместите в них примерно одинаковые кусочки Mg, Zn, Fe. Наблюдения и выводы запишите в таблицу.
Инструкция группе 2.
Влияние концентрации реагирующих веществ на скорость химической реакции.
Цель: изучить зависимость скорости взаимодействия растворов соляной кислоты разной концентрации с Zn.
Оборудование и реактивы: раствор HCl, Zn, h3O.
В три пробирки налейте раствор HCl: в первую — 3мл, во вторую — 2мл, в третью — 1мл. Во вторую и третью пробирки долейте воды до 3 мл. В каждую пробирку поместите одинаковые гранулы Zn. Наблюдения и выводы занесите в таблицу.
Инструкция группе 3.
Влияние температуры на скорость химической реакции.
Цель: сравнить скорость химической реакции взаимодействия CuO и h3SO4 при разной температуре.
Оборудование и реактивы: CuO, h3SO4, спиртовка, стакан с горячей водой, пробирки.
В три пробирки насыпьте немного порошка CuO, добавьте 3-5мл раствора h3SO4 . Первую пробирку поставьте в штатив, вторую — в стакан с горячей водой (пробирку предварительно подогрейте), третью нагрейте в пламени спиртовки. По изменению окраски раствора сделайте вывод о скорости протекания химической реакции.
Инструкция группе 4.
Влияние поверхности соприкосновения реагирующих веществ на скорость химической реакции.
Цель: сравнить скорость взаимодействия раствора соляной кислоты с гранулами, опилками и порошком Zn.
Оборудование и реактивы: раствор HCl, Zn, пробирки.
В три пробирки поместите гранулы, опилки и порошок Zn примерно одинакового объёма, добавьте раствор HCl. Наблюдения и выводы занесите в таблицу.
Инструкция группе 5.
Влияние катализатора на скорость химической реакции.
Цель: рассмотреть влияние катализаторов MnO2 на скорость разложения перекиси водорода.
Оборудование и реактивы: раствор h3O2, MnO2, пробирки, спиртовка, лучинка.
Вспомните, какие вещества называют катализаторами?
В пробирку налейте раствор h3O2. Что наблюдаете? Добавьте в пробирку немного порошка MnO2. Внесите в пробирку тлеющую личинку. Какой газ выделяется? Сравните скорость разложения h3O2 при разных условиях.
После окончания эксперимента происходит обсуждение. Учащиеся демонстрируют результаты опытов, делают выводы о влиянии различных факторов на скорость химических реакций. Уравнения проделанных реакций записывают на доске.
Выводы по результатам эксперимента.
- Каждое вещество оказывает влияние на скорость химической реакции.
- Чем больше концентрация реагирующих веществ, тем выше скорость химической реакции.
- При повышении температуры скорость химической реакции увеличивается. Правило Вант-Гоффа: при изменении (повышении или понижении) температуры на каждые 10 градусов скорость химической реакции изменяется (соответственно повышается или понижается) в 2-4 раза.
υ2 = υ1 • γ (t2-t1) / 10
υ2 υ1 — скорости химической реакции при температуре соответственно t2 и t1, γ — температурный коэффициент, показывающий во сколько раз изменяется скорость химической реакции.
4.Чем больше площадь поверхности соприкосновения реагирующих веществ, тем выше скорость химической реакции.
5.Катализаторы — вещества, изменяющие скорость химической реакции, но остающиеся неизменными к её окончанию.
Ферменты — биологические катализаторы белковой природы.
По участию катализатора химические реакции делят на:
каталитические:
2SO2+O2 →2SO3
4Nh4+5O2 →4NO+6h3O
некаталитические:
CuO+h3SO4 →CuSO4+h3O
2Fe(OH)3 →Fe2O3+3h3O
Вывод: знания о скорости химической реакции и факторах, влияющих на её изменение, позволяют управлять в значительной степени химическими реакциями.
Домашнее задание: подготовить сообщения по темам:
- «Применение катализаторов в промышленности»
- «Роль ферментов в жизнедеятельности живых организмов»
§ 15 упр. 1,3,6,7.
nsportal.ru
На конкретных примерах укажите основные факторы, влияющие на скорость химических реакций.
1) Скорость реакции зависит от природы реагирующих веществ.
Металлы реагируют с соляной кислотой с различной скоро- стью: магний реагирует быстрее железа, а медь не реагирует вовсе (за скоростью реакции легко следить по выделению пузырьков водорода).

Галогены реагируют с водородом с различной скоростью, например хлор быстрее йода:

2) Для веществ в растворенном состоянии и газов скорость реакции зависит от концентрации реагирующих веществ.
Оксид азота (II) реагирует с чистым кислородом быстрее, чем с воздухом, в котором кислорода около 20% (за изменением скорости реакции легко наблюдать, так как исходные вещества бесцветны, а оксид азота (IV) окрашен в коричневый цвет).

3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
Чем сильнее измельчено твердое вещество, тем больше его поверхность. Уголь в виде больших кусков сгорает в печи медленнее, чем измельченный:
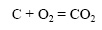
Железные опилки реагируют с раствором сульфата меди быстрее, чем железная пластинка такой же массы:
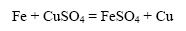
4) При повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2–4 раза.
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
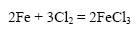
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет.
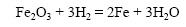
5) Скорость реакции зависит от присутствия некоторых веществ (катализаторов и ингибиторов).
Реакция синтеза аммиака из азота и водорода протекает только в присутствии катализаторов (железа со специальными добавками):
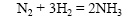
Реакция окисления аммиака также протекает только в присутствии катализатора (платины):
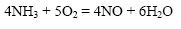
5terka.com