Соли слабых кислот и сильных оснований
Рассмотрим гидролиз соли, образованной одноосновной кисло-» той и одновалентным металлом. В качестве примера возьмем ацетат натрия — соль слабой кислоты и сильного основания. Уравнение гидролиза этой соли имеет вид [c.258]Степень гидролиза солей слабых кислот и сильных оснований [c.482]
Моющее действие мыл состоит из. ряда процессов. Главное заключается в следующем. Мыло — поверхностно-активное вещество (ПАВ) — вызывает смачивание частиц илн поверхностей, обладающих водоотталкивающими свойствами, способствует образованию устойчивой пены. Мыльный раствор проникает в капиллярные пространства. Молекулы мыла сорбируются на поверхности капелек жиров, твердых частичек, загрязняющих предметы или материалы. В результате образуются устойчивые суспензии или эмульсии. Жиры и грязь переходят с поверхности и пор тканей в раствор.

Сущность гидролиза состоит в том, что катионы или анионы солей связывают соответственно водородный 1[ли гидроксильный ионы воды с образованием малодиссоциирующих или труднорастворимых продуктов. В этом процессе происходит накапливание свободных ионов гидроксила или водорода. Например, при растворении в воде уксуснокислого натрия, соли слабой кислоты и сильного основания протекает следующая химическая реакция [c.61]
Соли слабых кислот и сильных оснований. Гидролиз. как константа гидролиза. [c.206]
Поэтому при вычислении pH здесь исходят из уравнения константы ионизации соответствующей слабой кислоты. Для расчета кривой титрования необходимо вывести три формулы а) расчет [Н+] (pH) до титрования, т. е. в растворе слабой кислоты б) расчет [Н+] (pH) в процессе титрования, когда в растворе присутствует слабая кислота и ее соль и, наконец, в) расчет [Н+] (pH) в точке эквивалентности, когда в растворе находится только соль слабой кислоты и сильного основания.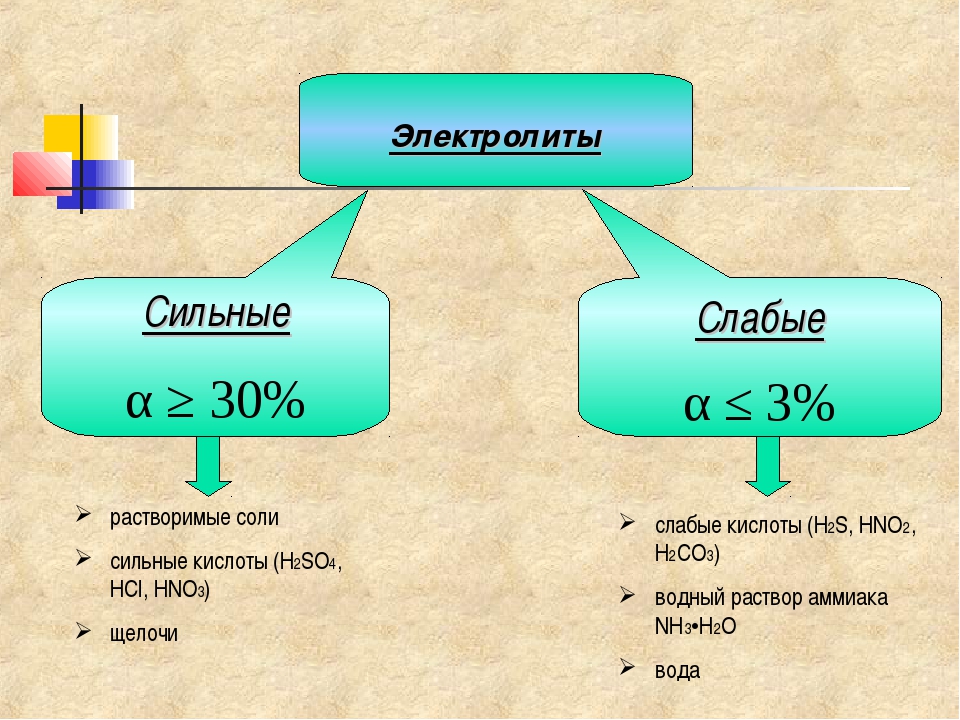
Моющее действие мыла основано на сложных физико-химических процессах. Являясь солью слабой кислоты и сильного основания, мыло в воде подвергается гидролизу [c.198]
Титрование солей слабых кислот и сильных основании. В результате реакции такой соли с сильной кислотой выделяется свободная слабая кислота, т. е. в точке эквивалентности раствор будет иметь кислую реакцию. Следовательно, необходимо взять индикатор с рТ[c.311]
Таким образом, раствор соли слабой кислоты и сильного основания в результате гидролиза оказывается щелочным. Отношение концентрации образовавшегося гидроксила к начальной концентрации соли называется степенью гидролиза и обозначается буквой р
Величину pH в третьей точке эквивалентности можно вычислить по формуле для pH солей слабых кислот и сильных оснований [c.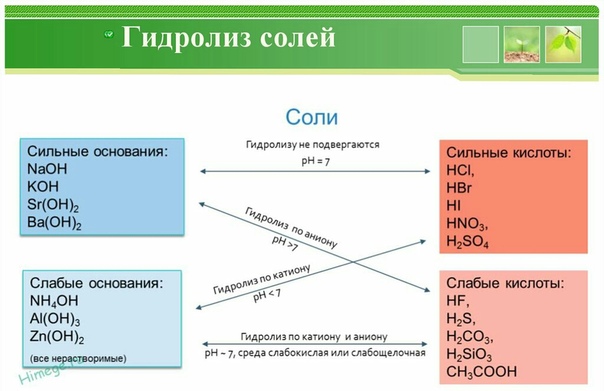 276]
276]
Следует обратить внимание на то обстоятельство, что эта формула отличается от выведенной ранее для pH растворов солей слабых кислот и сильных оснований только тем, что в формуле (8) [c.268]
В точке эквивалентности pH бензоата натрия рассчитываем ио формуле для соли слабой кислоты и сильного основания [c.159]
Уравнение (58) идентично уравнению (57). Это наглядно видно, если выразить в уравнении (58) величину рОН через pH из условия рН + рОН = рД г. Уравнение (57) позволяет рассчитывать pH растворов, содержащих соль слабой кислоты и сильного основания. Такой раствор образуется также в точке эквивалентности при титровании слабой кислоты раствором сильного основания. Значение pH, рассчитанное по уравнению (57), называют показателем титрования рТ. Уравнения (52) и (57) справедливы только при соблюдении условий рис. Д.39, т. е. для умеренно разбавленных растворов и для растворов кислот и оснований средней силы. В других случаях некоторые из неравенств, взятых из диаграммы, недействительны и формулы для расчета pH усложняются.
Соли слабых кислот и сильных оснований
Соли слабых кислот и сильных оснований. Гидролиз 242 [c.647]
Феноляты в отлич[1е от алкоголятов водой не разлагаются, но все же и они з водных растворах, подобно солям слабых кислот и сильных оснований, частично гидролизованы и их растворы имеют щелочную реакцию. Фенол вытесняется нз фенолята даже угольной кислотой. [c.480]
Альдегиды в присутствии органических солей и солей слабых кислот и сильных оснований легко окисляются в карбоновые кислоты. [c.98]
Соль слабой кислоты и сильного основания легко гидролизуется с отщеплением свободных гидроксилов. Поэтому точка эквивалентности находится [c.179]
Поэтому точка эквивалентности находится [c.179]
В качестве рабочих титрованных растворов обычно применяют сильные кислоты и основания. Путем непосредственного титрования можно определять следующие группы электролитов сильные и слабые основания, соли слабых кислот и сильных оснований и, аналогично, сильные и слабые кислоты, а также соли слабых оснований и сильных кислот.
[c.311]Щавелевая кислота является слабой кислотой (Ki= 6,5-10″ Kj=6,l-10 — ). При титровании слабых кислот берут слабый индир атор (рТ>7), например фенолфталеин. В точке эквивалентности образуется щавелевокислый натрий, который, как соль слабой кислоты и сильного основания, имеет в растворе щелочную реакцию pH этого раствора можно вычислить по уравнению [c.335]
Соли, образованные слабыми кислотами или (и) слабыми основаниями, подвергаются в водных растворах гидролизу. Для соли слабой кислоты и сильного основания реакция гидролиза протекает,ло.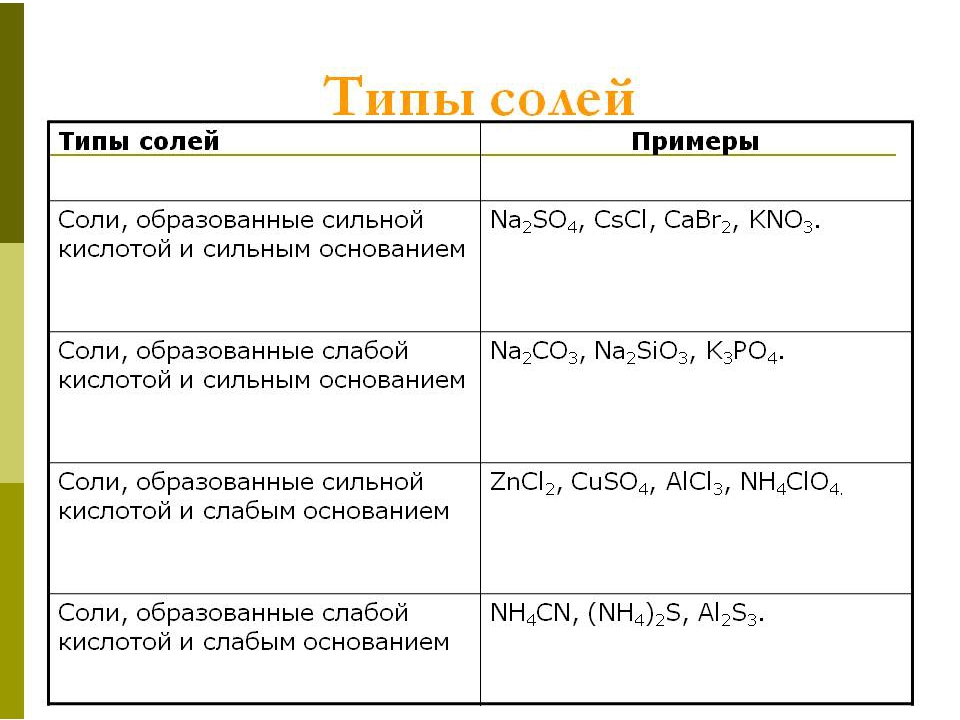 уравнению А Ч-НгО НА+ОН- и характеризуется константой гидролиза [c.12]
уравнению А Ч-НгО НА+ОН- и характеризуется константой гидролиза [c.12]
В практике приготовления лекарств часто возникает необходимость предотвращения гидролиза лекарственных веществ. С этой целью подкисляют (растворы солей сильных кислот и слабых оснований) или подщелачивают (растворы солей слабых кислот и сильных оснований). Такие операции сводятся к добавлению одного из продуктов реакции, в связи с чем реакция гидролиза смещается влево.
Бура является солью слабой кислоты и сильного основания. Поэтому ее раствор имеет основную среду за счет реакции гидролиза [c.181]
От гидролиза можно избавиться также путем подкисления или подщелачивания растворов. Если раствор содержит соль слабой кислоты и сильного основания, необходимо в этот раствор добавить щелочи. Если соль образована сильной кислотой и слабым основанием, то такой раствор надо подкислить. Например, чтобы раствор хлорида олова не подвергался гидролизу, необходимо добавить к его раствору кислоту [c.
Рассмотрим реакцию гидролиза соли слабой кислоты и сильного основания, например гидролиз ацетата натрия по уравнению [c.249]
Рассмотрим соль слабой кислоты и сильного основания. Если НЛ — слабая кислота, то [c.74]
Учитывая сказанное, реакцию гидролиза солей слабой кислоты и сильного основания можно написать [c.80]
Однако, как уже указывалось, pH гидролиза соли слабой кислоты и сильного основания определяется величиной константы кислотности Ка слабой кислоты, так как константа гидролиза равна — . [c.263]
СНзСООКа — соль слабой кислоты и сильного основания, среда щелочная [c.108]
Соль слабой кислоты и сильного основания гидролизует по следующей схеме [c.7]
Рассмотрим последовательно различные типы солей соли сильной кислоты и сильного основания соли сильной кислоты и слабого основания соли слабой кислоты и сильного основания соли слабой кислоты и слабого основания.
VI.4.4.3. Гидролиз соли слабой кислоты и сильного основания [c.246]
В качестве смеси слабой кислоты и соли слабой кислоты и сильного основания рассмотрим раствор, концентрация уксусной кислоты которого равна С кмоль/м , а концентрация ацетата натрия Сг кмоль/м. [c.210]
Основными достоинствами анионных моющих веществ, содержащих гидрофильные сульфогруппы (кислые сложиЬю эфиры серной кислоты, алкилсульфо- и алкиларилсуль-фокислоты), являются большая растворимость в воде их кальциевых и магниевых солей, чем растворимость солей карбоновых кислот этих же металлов. Это позволяет использовать их в жесткой воде, так как образующиеся соли не мешают процессу мойки. Стабильность этих соединений в кислой среде также больше, чем стабильность солей карбоновых кислот, которые представляют собою соли слабых кислот и сильных оснований. (При использовании мыл карбоновых кислот в кислых средах выделяются жирные кислоты, оставляя пятна на очищаемых волокнах.
Иные соотношения наблюдаются в водных растворах солей слабой кислоты и сильного основания, или наоборот, сильной кислоты и слабого основания. Изучая эти системы, рассмотрим лишь закономерности, справедливые для очень разбавленных растворов, для которых активности можно заменить концентра-цигми. [c.479]
Рассмотрим соль слабой кислоты и сильного основания, например Ha OONa. Если раствор этой соли достаточно разбавлен, то можно считать, что соль полностью диссоциирована. Но ион СНзСОО», именно вследствие того, что уксусная кислота является слабой, проявляет основные свойства, т. е. способен
Присутствие в любых водных растворах ионов Н3О+ и ОН» существенно влияет на протекающие в них химические процессы. В основе многих химических реакций в водных растворах лежит переход протона от одних молекул или ионов к другим. Прежде всего — это реакции протолитической диссоциации кислот. К ним относятся также реакции гидролиза, когда взаимодействие воды с солью слабой кислоты и сильного основания придает раствору щелочную реакцию, а с солью сильной кислоты и слабого основания — кислую. Другим примером, где в реакции участвуют ионы Н+ или ОН», может служить реакция нейтрализации, на которой основано ацидиметрическое и алка-лиметрическое титрования, широко применяющиеся в объемном анализе. Во многих случаях ионы Н+ оказывают каталитическое действие на химические процессы (омыление эфиров, инверсия тростникового сахара и др.). [c.594]
К ним относятся также реакции гидролиза, когда взаимодействие воды с солью слабой кислоты и сильного основания придает раствору щелочную реакцию, а с солью сильной кислоты и слабого основания — кислую. Другим примером, где в реакции участвуют ионы Н+ или ОН», может служить реакция нейтрализации, на которой основано ацидиметрическое и алка-лиметрическое титрования, широко применяющиеся в объемном анализе. Во многих случаях ионы Н+ оказывают каталитическое действие на химические процессы (омыление эфиров, инверсия тростникового сахара и др.). [c.594]
Гидролиз соли слабой кислоты и сильного основания. Рассмотрим эту реакцию на примере гидролиза ацетата натрия Hз OONa, который в водном растворе диссоциирован по схеме [c.208]
Перед началом анализа необходимо проверить реакцию среды растпора по лакмусу. Если среда нейтральная, то присутствуют соли сильных кислот н сильных основании кислая среда —присутствуют свободные кислоты, кислые соли — соли сильных кислот и слабых 01 нований щелочная среда — присутствуют щелочи, соли слабых кислот и сильных оснований, основные соли. [c.177]
[c.177]
Разница между сильными и слабыми электролитами — Разница Между
Электролиты — это вещества, которые дают ионы при растворении в воде. Три основных типа электролитов — это кислоты, основания и соли, и эти соединения при растворении в воде диссоциируют на ионы. Пол
Основное отличие — сильные и слабые электролиты
Электролиты — это вещества, которые дают ионы при растворении в воде. Три основных типа электролитов — это кислоты, основания и соли, и эти соединения при растворении в воде диссоциируют на ионы. Положительно заряженные и отрицательно заряженные ионы могут проводить электричество через водный раствор этих соединений. Некоторые электролиты являются сильными соединениями, а другие — слабыми электролитами. Основное различие между сильными электролитами и слабыми электролитами заключается в том, что сильные электролиты могут почти полностью диссоциировать на ионы, тогда как слабые электролиты частично диссоциируют на ионы.
Ключевые области покрыты
1. Что такое сильные электролиты
— определение, свойства, реакции
2. Что такое слабые электролиты
— определение, свойства, реакции
3. В чем разница между сильными и слабыми электролитами
— Сравнение основных различий
Ключевые термины: кислоты, основания, электролиты, соли, сильные электролиты, слабые электролиты.
Что такое сильные электролиты
Сильный электролит — это соединение, которое при растворении в воде может полностью диссоциировать на ионы. Следовательно, сильный электролит — это растворенное вещество, которое полностью растворяется в воде. Электролит состоит из катионов или положительно заряженных ионов и анионов или отрицательно заряженных ионов. Эти ионы могут проводить электрический ток в растворе.
Рисунок 1: Сильные кислоты и сильные основания — сильные электролиты
Обычные сильные электролиты — сильные кислоты, сильные основания и ионные соли. Однако некоторые электролиты не полностью растворяются в воде, а считаются сильными электролитами. Это связано с тем, что количество растворенного полностью ионизируется в его ионы.
Однако некоторые электролиты не полностью растворяются в воде, а считаются сильными электролитами. Это связано с тем, что количество растворенного полностью ионизируется в его ионы.
Например, сильные кислоты, такие как HCl, HNO3 сильные электролиты. Они диссоциированы в их катион H+ и анион полностью. Сильные основания, такие как NaOH, полностью диссоциируют на ионы, которые могут проводить электричество.
Что такое слабые электролиты
Слабые электролиты — это соединения, которые частично растворяются в его ионах при растворении в воде. Слабые электролиты состоят из катионов и анионов. Ионный характер этих соединений меньше по сравнению с сильными электролитами. Обычные слабые электролиты — это слабые кислоты, слабые основания и соли.
Обычно около 1-10% соединения диссоциирует на ионы. Большинство азотсодержащих соединений являются слабыми электролитами. Вода также считается слабым электролитом, поскольку молекулы воды частично диссоциируют на Н+ и ОН– ионов.
Рисунок 2: Молекулы воды частично диссоциируют на ион
Поскольку эти слабые электролиты частично растворяются в воде, раствор слабых электролитов состоит из молекул, катионов и анионов. Поскольку существует несколько электрически заряженных ионов, эти растворы могут проводить электрический ток.
Некоторые общие слабые электролиты являются слабыми кислотами, такими как H2Колорадо3и слабые основания, такие как NH3, Для слабых электролитов константы диссоциации важны при прогнозировании емкости электрического заряда, который может быть проведен через раствор, поскольку диссоциация соединения образует растворимые ионы, которые могут проводить электричество.
Разница между сильными и слабыми электролитами
Определение
Сильные Электролиты: Сильные электролиты — это соединения, которые при растворении в воде могут полностью диссоциировать на ионы.
Слабые электролиты: Слабые электролиты — это соединения, которые частично растворяются в его ионах при растворении в воде.
диссоциация
Сильные Электролиты: Сильные электролиты могут полностью диссоциировать на ионы.
Слабые электролиты: Слабые электролиты частично диссоциируют на ионы.
Примеры
Сильные Электролиты: Сильные электролиты — это сильные кислоты, сильные основания и некоторые соли.
Слабые электролиты: Слабыми электролитами являются слабые кислоты, слабые основания и некоторые соли.
Заключение
Электролиты представляют собой соединения, которые могут растворяться в воде с выделением катионов и анионов. Эти ионы могут способствовать прохождению электричества через раствор. Основное различие между сильными электролитами и слабыми электролитами заключается в том, что сильные электролиты могут почти полностью диссоциировать на ионы, тогда как слабые электролиты частично диссоциируют на ионы.
Рекомендации:
1. «Слабый электролит: определение и примеры». Study.com, Study.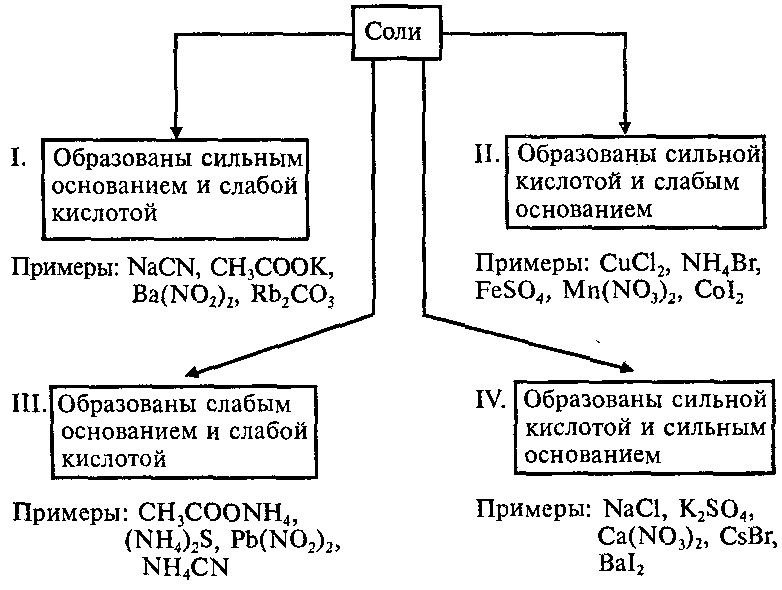 com,
com,
Растворы электролитов. Ионно–молекулярные уравнения
Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты.
 К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами. - Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.

- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α < 0,3 ).
Константа диссоциации
Более точно процесс диссоциации электролита характеризует константа диссоциации, не зависящая от концентрации раствора. Если представить процесс диссоциации электролита в общем виде:
Aa Bb ↔ aA— + bB+
K = [A—]a·[B+]b/[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α2C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α2C
Отсюда нетрудно найти степень диссоциации
α = (K/C)1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H+ + Cl— +Na+ + OH— = Na+ + Cl— + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H+ + OH— = HOH
Мы видим, что процесс нейтрализации сводится к соединению H+ и OH— и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag+ + NO3— + H+ + I— →AgI↓ + H+ + NO3— |
| Сокращенное ионное уравнение | Ag+ + I— →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag+ и I— и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na+ + SO32- + 2H+ + 2I— → 2Na+ + 2I— + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO32- + 2H+ → SO2↑ + H2O |
Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca2+ + Cl— + 2Na+ + I— = 2Na+ + Cl— + Ca2++ 2I— |
| Сокращенное ионное уравнение | отсутствует |
Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита.
 В качестве неэлектролита может выступать вода.
В качестве неэлектролита может выступать вода. - Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Больше примеров приведено в разделе Задачи к разделу растворы электролитов
Также для тренировки, рекомендуем пройти тест Задания 14. Электролиты и неэлектролиты. Катионы и анионы
Сильные и слабые электролиты. Кислотность среды. 9 класс
11.11.2020Сильные и слабые электролиты
Цель: уметь раскрывать смысл понятий «сильный
электролит», «слабый электролит».
Кто такие электролиты?
Электролиты – это вещества, растворы или расплавы которых
проводят электрический ток,
в следствие того, что диссоциируют (распадаются на ионы)
Вещества каких классов являются электролитами?
Кислоты, основания, соли
Какие из них слабые, а какие сильные электролиты?
Сильные электролиты – это вещества, которые практически
полностью распадаются на ионы.

HNO3 → H+ + NO3-
Ca(OH)2 →
Ca2+
—
+ 2OH
Сильные электролиты – это вещества, которые практически
полностью распадаются на ионы.
‼
Сильный электролит ≠ растворимое вещество
1) Почти все соли. NaCl, KNO3 , BaSO4
2) Щелочи. Гидроксиды щелочных и
щелочноземельных металлов. LiOH, NaOH, KOH,
RbOH, CsOH,Ca(OH)2, Ba(OH)2, Sr(OH)2.
3) Кислоты. НCl, НBr , НI — запоминаем
Слабые электролиты – это вещества, которые распадаются
на ионы лишь частично.
h3 S⇆
2H+
HF ⇆
H+
+S
+F
2-
—
HCN ⇆ H+ + CN-
Слабые электролиты – это вещества, которые распадаются
на ионы лишь частично.
1) Вода
2) Нерастворимые в воде основания. Сu(OH)2 , Fe(OH)2 .
Амфотерные гидроксиды Zn(OH)2 , Al(OH)3 , Fe(OH)3 .
3) Водный раствор аммиака Nh4
4) Все кислоты, что не вошли в группу сильных
Степень диссоциации
это отношение количества вещества, распавшегося на
ионы, к общему количеству растворенного вещества.

α=
ν
νобщ
α=
ν
νобщ
∙ 100%
У сильных электролитов α ≈ 50-100% (0,5 — 1)
У слабых электролитов α ≈ 10% (меньше 0,1)
Дома: В водном растворе фосфата железа (II) содержится 0,1 моль фосфатионов. Сколько граммов соли использовали для приготовления раствора?
итог
• Электролиты, которые полностью распадаются на ионы,
называют сильными.
• К ним относят все соли, гидроксиды щелочных и
щелочноземельных металлов, некоторые кислоты –
соляную, серную, азотную.
• Электролиты, которые лишь частично распадаются на
ионы, называются слабыми.
• Это вода, такие слабые кислоты, как сероводородная,
уксусная нерастворимые основания
Дома:
Изучать §11;
выучить вещества (группы веществ), которые
относятся к сильным и слабым электролитам;
упр.2,3;
*В водном растворе нитрата железа (II) содержится
0,1 моль нитрат-ионов. Сколько граммов соли
использовали для приготовления раствора?
Домашнюю работу оформляем на двойном листке.

Работу подписываем.
Указываем номер параграфа и номера заданий.
Приходим в школу на консультацию и относим листок в лаборантскую химии
(можно под дверь).
До субботы работы должны быть сданы!
«Теория электролитической диссоциации. Сильные и слабые электролиты. Диссоциация кислот солей и оснований»ссоциации. Сильные и слабые электролиты. Диссоциация кислот солей и оснований»
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №12» муниципального образования городской округ Симферополь Республики Крым
11 класс
Конспект урока по химии
«Теория электролитической диссоциации. Сильные и слабые электролиты. Диссоциация кислот солей и оснований»
Подготовила
учитель химии высшей категории
заместитель директора по УВР
Березинская А. И.
И.
Симферополь 2018
Урок № 14 Класс 11-А Дата 10.12. 2018 г
Учитель химии : Березинская А.И.
Теория электролитической диссоциации. Сильные и слабые электролиты. Диссоциация кислот солей и оснований
Тип урока: Урок сообщения и усвоения новых знаний.
Форма проведения: исследовательская работа (демонстрационные и лабораторные опыты)
Название проблемы: Почему растворы сложных веществ проводят электрический ток?
Цели урока:
Организовать деятельность учащихся по восприятию, осмыслению, первичному запоминанию таких понятий как: кислоты – электролиты, основания-электролиты, соли-электролиты.
Развивать умения выделить главное, существенное в изучаемом материале.
Обеспечить закрепление знаний и способов деятельности учащихся по составлению уравнений реакций ионного обмена, в молекулярном и ионном видах.
Педагогические технологии: проблемно – ориентированное обучение, мозговой штурм, игровая деятельность, исследовательская деятельность, элементы развития критического мышления.

Ход урока
I. Организационный момент.
Проверка готовности к уроку.
Мотивация, целеполагание.
Установки: продемонстрируйте объективность, любопытство и настойчивость во время проведения лабораторных исследований свойств веществ; при подведении итогов и при решении проблемы.
II. Подготовка учащихся к работе на основном этапе
Какая информация важна для создания гипотезы?
1.Вещества с ионной и ковалентной полярной связями в растворенном состоянии проводят электрический ток .
2.Вещества с ковалентной слабополярной и неполярной ковалентными связями не пропускают электрический ток .
3. Для прохождения электрического тока в растворах и расплавах отвечают ионы.
Какими могут быть причины проблемы?
1.Молекулы воды играют очень важную роль в растворах веществ. Диполи воды отвечают за процесс диссоциации вещества.
2.Вещества при участии молекул воды распадаются на ионы. Это процесс электролитической диссоциации.
3. Строение вещества определяет свойства вещества, т.е. в данном случае, электропроводность вещества.
4.Классификация веществ на электролиты и неэлектролиты.
Учитель .Каковы решения?
1.Доказать, что вещества при растворении в воде распадаются на ионы.
Обучающие вопросы
Что мы уже знаем?
1. Вещества с каким типом химической связи проводят электрический ток?
2.Молекулы какого вещества способствуют процессу диссоциации?
3.Что это такое электролиты и неэлектролиты, электролитическая диссоциация?
Что мы можем сделать?
1.Провести опыты и доказать, что вещества при растворении в воде диссоциируют на ионы.
Что это такое кислота-электролит?
Что это такое щелочь-электролит?
Что это такое соль- электролит?
Где пробелы в знаниях?
1. Когда еще возможна диссоциация вещества?
Когда еще возможна диссоциация вещества?
2.В какой мере происходит диссоциация веществ?
План действий
Как мы планируем искать информацию? Работа с учебником, с интернет-ресурсами, проведение исследования в лаборатории.
Как мы планируем осуществлять самообучение? Работа с учебником, с интернет-ресурсами.
Упр. №1. “Химический дождь”. (См. Приложение 1. Презентация к уроку). Между какими ионами произойдёт взаимодействие? Составьте уравнения реакций.
Пятиминутка. (Приложение 2) Отметьте в таблице знаком “+” пары веществ, между которыми возможны реакции ионного обмена, идущие до конца. 1 вариант – с образование осадка, 2 вариант – с образованием газообразного вещества и воды.
III. Усвоение новых знаний и способов действия Рассмотрим в свете теории ЭД свойства веществ, растворы которых обладают электропроводностью: кислоты, основания и соли.
– Дайте определение кислот с точки зрения теории ЭД.
– Озвучьте схему, приведите примеры.
Упр. №2. Составьте уравнения возможных реакций растворов кислот с веществами. Охарактеризуйте их с позиции теории ЭЛД.
Первая группа свойств кислот обусловлена наличием в них иона водорода.Как можно доказать наличие данного иона? (индикаторами).
Лабораторный опыт №1.
Проведение мини-исследования под руководством учителя.
Проверьте действие универсального индикатора на растворимые и нерастворимые кислоты.
Вторая группа свойств кислот обусловлена наличием кислотного остатка в составе кислот. По ним можно отличать кислоты между собой.Лабораторный опыт №2.
Проведите качественные реакции на некоторые кислоты.
Дайте определение оснований с точки зрения теории ЭД.– Озвучьте схему, приведите примеры.
Упр. №3. “Накормите лягушку”. Какие “комары” будут “съедены” каждой из “лягушек”? Составьте уравнения реакций в молекулярном и ионном виде.
№3. “Накормите лягушку”. Какие “комары” будут “съедены” каждой из “лягушек”? Составьте уравнения реакций в молекулярном и ионном виде.
— Сформулируете определение солей с точки зрения ТЭД.
— Как диссоциируют средние (кислые, основные) соли?
Составьте уравнения диссоциации солей :MgCl2 <—> Fe2(SO4)3 <—>
Основные химические свойства солей. Все три типа реакций являются обменными, поэтому идут до конца, если образуется осадок, газ или слабый электролит.
Демонстрационный эксперимент:
IV. Закрепление новых знаний и способов действия.
Упр. № 4. “Химический баскетбол”. Сколько мячей попадёт в корзину? Составьте уравнения реакций.
V. Первичный контроль новых знаний и способов действия.
Упр. №5. “Часы с кукушкой”. Кукушка начинает куковать всякий раз, когда между веществом, указанным на стрелке часов, и веществом, соответствующим цифре на циферблате, возможна реакция.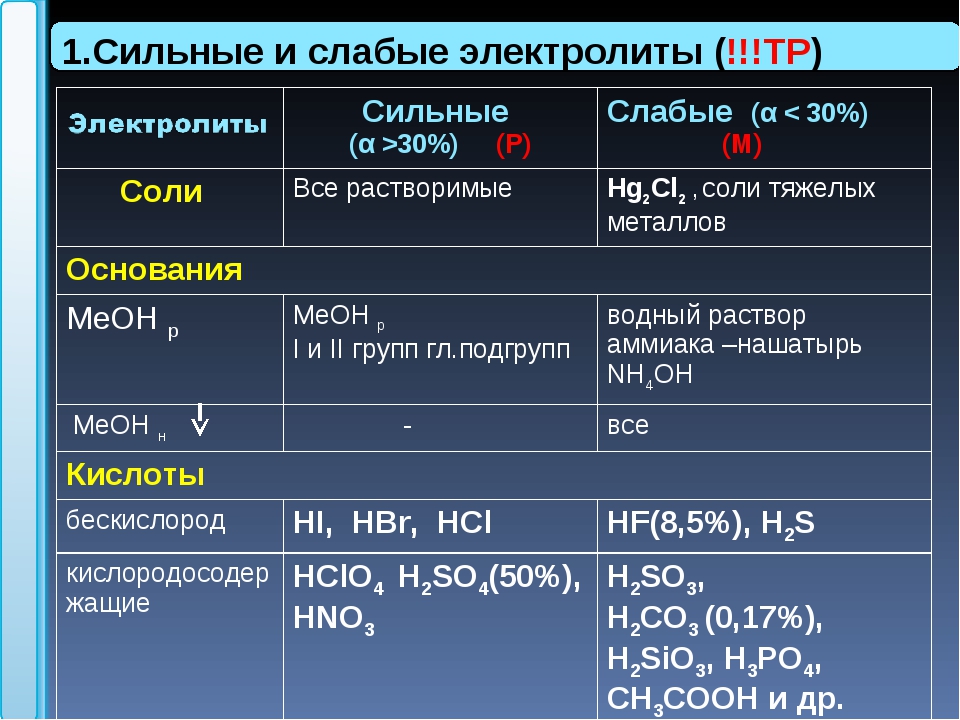 Напишите уравнения возможных реакций
Напишите уравнения возможных реакций
1 вариант – нечётные номера
2 вариант – чётные номера.
Запомнить!
Чем меньше концентрация электролита в водном растворе, тем больше степень диссоциации.
Чем выше температура раствора электролита, тем выше степень диссоциации
Репрессия ионизации под влиянием одноименных ионов α (степеньэлектролитической диссоциации) подавляется
VI. Информация о домашнем задании.
Прочитать §19 . уметь объяснять основные понятия, иллюстрировать их примерами упраж №2,3 стр 88
VII. Рефлексия.
Какие из изученных сегодня вопросов вызвали наибольшие трудности при усвоении? Как вы думаете почему?
Что на уроке вам понравилось? Почему?
Химия — 8
| Сильные электролиты | Электролиты средней силы | Слабые электролиты |
|---|---|---|
| α ≥ 30% | Получает значение между α=3 ÷ 30% (или 0,03 ÷ 0,3) | Получает значение меньше α < 3% (0,03) |
| Щелочи: LiOH, NaOH, KOH, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) | NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплаве частично диссоциируются на ионы, называют слабыми электролитами.
Задача 5. Какие вещества не электролиты?
1) PbCl2 2) BaCl2 3) C2H5OH
4) Zn(NO3)2 5) CaCO3
Решение: Нерастворимые в воде соли, основания, спирты — неэлектролиты. Правильный ответ: 1, 3, 5.
Проверка знаний и способностей
- Что называют степенью диссоциации?
- Что называют сильным электролитом? Приведите примеры.
- Что называют слабым электролитом? Приведите примеры.
- Определите соответствие.
По значению степени диссоциации:
1) сильный электролит
2) средней силы электролит
3) слабый электролитВещества:
a) HCl, HBr, HNO3 b) Mg(OH)2, H3PO4
c) NH4OH, H2CO3 d) NaOH, KOH
e) H2S, CH3COOH - Сколько молекул электролита не подверглось диссоциации?
Число растворимых в воде молекул электролита Степень диссоциации
(в %)400 20
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
СИЛЬНАЯ КИСЛОТА — СЛАБАЯ КИСЛОТА — ВИДЫ СОЛИ — КИСЛОТНАЯ СОЛЬ — ОСНОВНАЯ СОЛЬ — НЕЙТРАЛЬНАЯ СОЛЬ
| P H Из разных веществ: Apple: 2.9-3.3 Чистая вода: 7 Масла: 6.1-6.4 Молоко: 6.1-6.4 Молоко: 6.3-6.6 Мука пшеницы: 5.5-6.5 Кола: 3 Даты: 6.2-6.4 Томатный сок: 4. | |||
СИЛЬНЫЙ КИСЛОТА | |||
Ан
кислоту, которая в водном растворе в значительной степени ионизируется, называют «сильной
кислота» . Пример: HCl, H 2 SO 4 , HNO 3 | |||
СЛАБЫЙ КИСЛОТА | СИЛЬНЫЙ КИСЛОТА — СЛАБАЯ КИСЛОТА — ВИДЫ СОЛИ — КИСЛАЯ СОЛЬ — ОСНОВНАЯ СОЛЬ — НЕЙТРАЛЬНАЯ СОЛЬ — ТИТРОВАНИЕ | ||
| Ан
кислоту, которая в водном растворе ионизируется в меньшей степени, называют слабой
кислота». Пример: CH 3 COOH, щавелевая кислота (COOH-COOH), муравьиная кислота (HCOOH). | |||
ГИДРОЛИЗ | |||
Реакция
вещества с водой, в которой p H воды заменяется
называется «Гидролиз». При гидролизе связка между
Н и О в воде расщепляются. Гидролиз – это обратная реакция нейтрализации. Актуальная информация, бесплатные компьютерные курсы и важные заметки посетите: www.citycollegiate.com | |||
НХ 4 Кл + H 2 O NH 4 OH + HCl | |||
ТИПЫ СОЛИ | |||
| Есть три типа солей | |||
| (1)
Кислая соль. (2) Основная соль. (3) Нейтральная соль. | |||
КИСЛОТА СОЛЬ | СИЛЬНЫЙ КИСЛОТА — СЛАБАЯ КИСЛОТА — ВИДЫ СОЛИ — КИСЛАЯ СОЛЬ — ОСНОВНАЯ СОЛЬ — НЕЙТРАЛЬНАЯ СОЛЬ — ТИТРОВАНИЕ | ||
| Соль
образуется в результате реакции между сильной кислотой и слабым основанием, называется «кислой
соль» .  Пример: NH 4 Cl, CuSO 4 Пример: NH 4 Cl, CuSO 4 | |||
слабый
основание + сильная кислота кислая соль + вода | |||
БАЗОВЫЙ СОЛЬ | |||
| Соль
образуется при взаимодействии сильного основания со слабой кислотой, называется «основным
соль». . Пример: CH 3 COONa, Na 2 S | |||
сильный
основание + слабая кислота основное
соль + вода | |||
НЕЙТРАЛЬНЫЙ СОЛЬ | |||
Соль
образуется в результате реакции между сильной кислотой и сильным основанием, называется нейтральной
соль». Пример: NaCl, KNO 3 | |||
сильный
основание +сильная кислота нейтральный
соль + вода | |||
| Для последнюю информацию , бесплатные компьютерные курсы и важные заметки посетите : www.citycollegiate.com | |||
Общий ион и pH
Общий ион и pHОбщий ионный эффект: pH
Общий ионный эффект — это сдвиг в равновесии, происходящий из-за добавления иона, уже участвующего в равновесной реакции.
AgCl(т) <=> Ag + (водн.) + Cl — (водн.)
<-----------------Добавление NaCl Смещает это равновесие влево.
Добавление общего иона к слабой кислотно-основной системе:
HA <=> H + + A —
Теперь добавьте A — (в виде соли), и реакция будет направлена влево
и [ H + ] уменьшится
Пример:
CH 3 COOH <=> H + + CH 3 COO —
Теперь добавьте NaCH 3 COO , , где ацетат — обычный ион.
Это увеличивает концентрацию ацетат-иона, и реакция сдвигается влево, а [H + ] уменьшается. Добавление общего иона CH 3 COO — к раствору CH 3 COOH аналогично титрованию кислоты NaOH, поскольку обе операции уменьшают [H 90 +]. Однако вместо того, чтобы превращать протоны в воду, обычный ион соединяется с протонами, образуя более слабую кислоту.
Практическая задача:
Что такое [H + ] в растворе, содержащем 0,50 М HF и 0,10 М NaI?
Помните, что соли обычно сильно диссоциируют в воде, так что концентрация аниона примерно равна исходной концентрации соли:
Теперь рассмотрим в более общем виде смесь слабой кислоты (ГК) и ее соли, образованной сильным основанием (ХА) в водном растворе. Мы знаем, что слабая кислота частично диссоциирует с образованием H + и A — , а соль полностью диссоциирует с образованием X + и A — .
Мы знаем, что слабая кислота частично диссоциирует с образованием H + и A — , а соль полностью диссоциирует с образованием X + и A — .
Из кислотного равновесия можно записать следующее соотношение:
Количество чистой слабой кислоты, которая диссоциирует, невелико. Для 0,1 М раствора CH 3 COOH (pKa = 4.74). Таким образом, концентрация кислоты ГК остается примерно такой же, как и количество кислоты, первоначально добавленной к воде. Точно так же количество A — , образующееся при диссоциации кислоты, будет намного меньше, чем количество A — , образующееся при диссоциации соли, следовательно, [A — ] приблизительно равно такая же, как концентрация добавленной соли. Мы можем использовать эти факты, чтобы создать уравнение для упрощения расчета, подобное тому, которое мы только что завершили выше:
ОГРАНИЧЕНИЯ:
Предполагается, что количество кислоты, которая диссоциирует, невелико, поэтому это соотношение лучше всего применимо к более слабым кислотам. Его нельзя с уверенностью использовать для кислот с pKa < 2,0.
Его нельзя с уверенностью использовать для кислот с pKa < 2,0.
Также делается предположение, что очень мало аниона (А-) вносится при диссоциации слабой кислоты. Этого не происходит в начальной части титрования слабой кислоты сильным основанием (или слабого основания сильной кислотой) — расчет кривых титрования по уравнению Гендерсона-Хассельбаха может привести к ошибкам в начальной фазе.
Используя уравнение Хендерсона-Хассельбальха:
1) Рассчитайте концентрацию H + и pH раствора, который равен 0.15 М в уксусной кислоте и 0,25 М в ацетате натрия. (К и =1,8е-5)
Мы можем сделать это достаточно легко, используя таблицу ICE
HC 2 H 3 O 2 + | Н 2 О | <=> H + | C 2 H 3 O 2 — |
|---|---|---|---|
0. | 0,25 м | ||
-х | +х | +х | |
0,15-х | х | 0,15+х |
К a = [(х)(0.25+x)]/0,15-x = 1,8e-5
Если предположить, что x очень мало по сравнению с концентрацией, уравнение сводится к следующему: 0,025x/0,015 = 1,8e-5; и x = 1,08e-5, поэтому pH равен 4,96.
ИЛИ
Мы можем использовать уравнение Хендерсона-Хассельбальха:
pH = -log(1,8e-5) + log(0,25/0,15) = 4,74 + 0,2218 = 4,96
Соли слабых кислот и сильных оснований
Соли слабых кислот и сильных оснований
Когда мы нейтрализуем слабую кислоту сильным основанием, мы получаем соль, содержащую сопряженное основание слабой кислоты.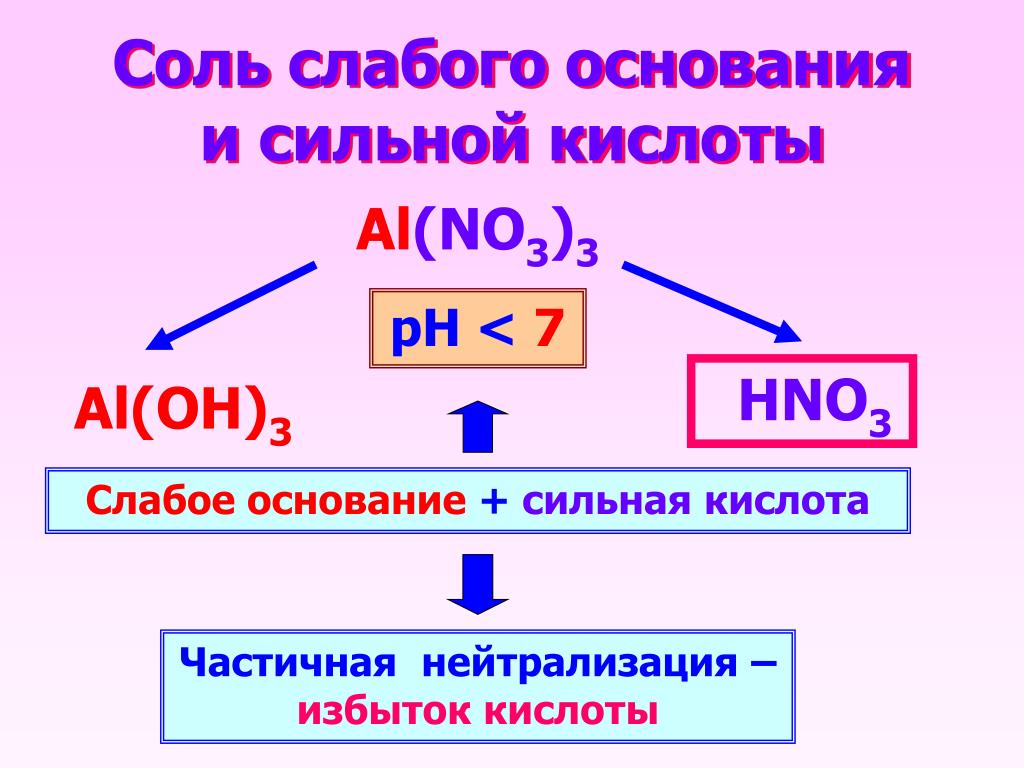 Это сопряженное основание обычно является слабым основанием. Например, ацетат натрия, NaCH 3 CO 2 , представляет собой соль, образованную реакцией слабокислой уксусной кислоты с сильным основанием гидроксида натрия:
Это сопряженное основание обычно является слабым основанием. Например, ацетат натрия, NaCH 3 CO 2 , представляет собой соль, образованную реакцией слабокислой уксусной кислоты с сильным основанием гидроксида натрия:
\({\text{CH}}_{3} {\ text{CO}}_{2}\text{H}\left(aq\right)+\text{NaOH}\left(aq\right)\phantom{\rule{0.2em}{0ex}}⟶ \phantom{\rule{0.2em}{0ex}}{\text{NaCH}}_{3}{\text{CO}}_{2}\left(aq\right)+{\text{H}} _{2}\text{O}\left(aq\right)\)
Раствор этой соли содержит ионы натрия и ацетат-ионы.{\text{−}}.\) Значение K b можно рассчитать по значению константы ионизации воды, K w и K a , константе ионизации сопряженной кислоты аниона, используя уравнение:
\({K}_{\text{w}}={K}_{\text{a}}\phantom{\rule{0.2em}{0ex} }×\phantom{\rule{0.2em}{0ex}}{K}_{\text{b}}\)
Для иона ацетата и сопряженной с ним кислоты имеем:
\({K}_{ \text{b}}\phantom{\rule{0.{-10}\)
В некоторых справочниках не указаны значения K b . {\text{-}}\right)\phantom{\rule {0.{-10}\)
{\text{-}}\right)\phantom{\rule {0.{-10}\)
Решая это уравнение, получаем [CH 3 CO 2 H] = 1,1 \(×\) 10 −5 M .
рН солей в воде | Кафедра химии
Химикаты и растворы
- хлорид аммония
- твердый хлорид натрия или KBr (поваренная соль не подходит для этой демонстрации!)
- ацетат натрия твердый
Материалы
- три высоких цилиндра ареометра
- три шпателя
- деионизированная вода
- индикаторный раствор крезолового красного или феноловый красный
Процедура
- Налейте воду в каждый из цилиндров ареометра и добавьте несколько капель индикаторного раствора крезолового красного.Вода должна стать оранжевой.
- В один цилиндр ареометра добавить ацетат натрия. Решение становится красным, показывая, что решение является основным.
- В другой цилиндр добавить хлорид натрия. Изменение цвета не наблюдается.

- В последний баллон добавить хлористый аммоний. Раствор становится желтым, показывая, что раствор кислый.
Обсуждение
Когда соль, полученная из сильного основания и слабой кислоты, растворяется в воде, раствор становится щелочным.При диссоциации ацетата натрия в воде образуются ионы натрия и ацетат-ионы. Ион натрия не имеет ни кислотных, ни основных свойств. Ион ацетата является сопряженным основанием уксусной кислоты и имеет сродство к иону H+. Реакция гидролиза представлена формулой:
\( \ce{ Ch4COO-_{(водн.)} + h3O_{(ж)} -> Ch4COOH_{(водн.)} + OH-_{(водн.)} } \)
Поскольку в этой реакции образуются ионы ОН-, раствор ацетата натрия является щелочным.
Когда соль, полученная из сильной кислоты и слабого основания, растворяется в воде, раствор становится кислым.При диссоциации хлорида аммония образуются ионы хлорида и ионы аммония. Ион хлорида не имеет сродства к ионам H+. Ион аммония является сопряженной кислотой аммиака и реагирует с водой следующим образом:
\( \ce{ Nh5+ + h3O -> Nh4 + h4O+ } \)
Поскольку эта реакция высвобождает ион гидроксония, раствор является кислым.
Соли, полученные из сильной кислоты и сильного основания, дают нейтральные растворы. Соли, полученные из слабого основания и слабой кислоты, могут быть кислыми или основными.{-}}$ в воде, тем самым снижая ее кислотность и щелочность.
Полное пошаговое решение:
Соль образуется в результате реакции кислоты и основания. Это называется реакцией нейтрализации, в результате которой образуется соль и вода. Возьмем пример сильной кислоты, такой как соляная кислота, $HCl$, и слабого основания, такого как гидроксид аммония, $N{{H}_{4}}OH$. При реакции образуется соль аммония, $N{{H}_{4}}Cl$ и вода. Реакция выглядит следующим образом:
\[HCl+N{{H}_{4}}OH\ в N{{H}_{4}}Cl+{{H}_{2}}O\]
Эта соль при растворении в воде полностью распадается с водой на составляющие его ионы.{-}} \right]$. Гидролиз соли приводит к тому, что рН раствора снижается до 7, поскольку он соответственно проявляет кислую или основную природу.
Сильные кислоты и основания. Кислотно-основные равновесия
Сила кислоты относится к тому, насколько легко кислота будет терять или отдавать протон, в то время как сила основания определяется его способностью депротонировать из других соединений.
Сила кислот и сильные кислоты
Кислоты давно признаны особым классом соединений, водные растворы которых обладают следующими свойствами:
- Характерный кислый вкус.
- Изменяет цвет лакмуса с синего на красный.
- Реагирует с некоторыми металлами с образованием газообразного H 2 .
- Реагирует с основаниями с образованием соли и воды.
Кислые растворы имеют рН менее 7, причем более низкие значения рН соответствуют повышению кислотности. Общие примеры кислот включают уксусную кислоту (в уксусе), серную кислоту (используемую в автомобильных аккумуляторах) и винную кислоту (используемую в выпечке). Кислоты реагируют с карбонатами с образованием соли, воды и углекислого газа.
Существует три общепринятых определения кислот:
- Кислота Аррениуса: любые вещества, повышающие концентрацию ионов гидроксония (H 3 O + ) в растворе.
- Кислота Бренстеда-Лоури: любое вещество, которое может действовать как донор протонов.

- Кислота Льюиса: любое вещество, способное принять пару электронов.
Сила кислоты относится к тому, насколько легко кислота будет терять или отдавать протон, часто в растворе. Более сильная кислота легче ионизируется или диссоциирует в растворе, чем более слабая.Шесть распространенных сильных кислот:
- соляная кислота (HCl)
- бромистоводородная кислота (HBr)
- йодистоводородная кислота (HI)
- серная кислота (H 2 SO 4 ; только первый протон считается сильнокислотным)
- азотная кислота (HNO 3 )
- хлорная кислота (HClO 4 )
Каждая из этих кислот ионизируется практически на 100% в растворе. По определению, сильная кислота полностью диссоциирует в воде; другими словами, один моль общей сильной кислоты HA даст один моль H + , один моль сопряженного основания A — , при этом в растворе не останется ни одной непротонированной кислоты HA. Напротив, однако, слабая кислота, менее охотно отдающая свой протон, лишь частично диссоциирует в растворе. В равновесии будут присутствовать как кислота, так и сопряженное основание, а также значительное количество недиссоциированных частиц, ГК.
Напротив, однако, слабая кислота, менее охотно отдающая свой протон, лишь частично диссоциирует в растворе. В равновесии будут присутствовать как кислота, так и сопряженное основание, а также значительное количество недиссоциированных частиц, ГК.
На общую силу кислоты влияют два ключевых фактора:
- полярность молекулы
- прочность связи H-A
Эти два фактора на самом деле связаны. Чем более полярна молекула, тем больше плотность электронов внутри молекулы будет оттягиваться от протона.Чем больше частичный положительный заряд протона, тем слабее будет связь Н-А и тем легче протон будет диссоциировать в растворе.
Сила кислот также часто обсуждается с точки зрения стабильности сопряженного основания. Более сильные кислоты имеют большее K a и более отрицательное значение pK a , чем более слабые кислоты.
Прочность основания и прочные основания
Существует три общих определения баз:
- Основание Аррениуса: любое соединение, которое отдает гидроксид-ион (ОН – ) в растворе.

- Основание Бренстеда-Лоури: любое соединение, способное принимать протон.
- Основание Льюиса: любое соединение, способное отдавать электронную пару.
В воде щелочные растворы имеют pH от 7 до 14.
Сильное основание является противоположностью сильной кислоты; в то время как кислота считается сильной, если она может легко отдавать протоны, основание считается сильным, если оно может легко депротонировать (т. е. удалять ион H + ) из других соединений. Как и в случае с кислотами, мы часто говорим об основных водных растворах в воде, а депротонируемым веществом часто является сама вода.Общая реакция выглядит так:
A-(водн.)+h3O(водн.)→AH(водн.)+OH-(водн.)
Таким образом, депротонированная вода дает гидроксид-ионы, что неудивительно. Концентрация гидроксид-ионов увеличивается с увеличением рН.
Гидроксиды большинства щелочных и некоторых щелочноземельных металлов в растворе являются сильными основаниями. К ним относятся:
К ним относятся:
- гидроксид натрия (NaOH)
- гидроксид калия (КОН)
- гидроксид лития (LiOH)
- гидроксид рубидия (RbOH)
- гидроксид цезия (CsOH)
- гидроксид кальция (Ca(OH) 2 )
- бария гидроксид (Ba(OH) 2 )
- гидроксид стронция (Sr(OH) 2 )
Гидроксиды щелочных металлов полностью диссоциируют в растворе.Гидроксиды щелочноземельных металлов менее растворимы, но все же считаются сильными основаниями.
В уравнении для кислоты HA представляет собой протонированную кислоту, H + представляет собой свободный кислотный протон, а A – представляет собой сопряженное основание.
Поскольку сильные кислоты и сильные основания полностью ионизируются в растворе, концентрация сильной кислоты будет такой же, как концентрация свободного кислотного протона, и можно просто рассчитать -log[H+] или pH. То же самое верно для сильных оснований и pOH (-log[OH-]).
эквивалентной массы (или эквивалентной массы) кислоты — это масса, которая дает один моль ионов водорода, или для основания это масса основания, которое реагирует с одним молем ионов водорода.
Практические вопросы
Академия Хана
Официальная подготовка MCAT (AAMC)
Пакет вопросов по химии, отрывок 1, вопрос 2
Пакет вопросов по химии, отрывок 3, вопрос 11
Пакет вопросов по химии, отрывок 3, вопрос 13
Пакет вопросов по химии, отрывок 5, вопрос 25
Пакет вопросов по химии, отрывок 18, вопрос 105
Пакет вопросов по химии, отрывок 19, вопрос 110
Пакет вопросов по химии Вопрос 119
Раздел Bank C/P Раздел Passage 11 Вопрос 90
Образец теста C/P Раздел 3, вопрос 10
Практический экзамен 1 C/P Раздел 7 Вопрос 37
Практический экзамен 1 Раздел C/P Вопрос 44
Ключевые точки
• Кислота – это вещество, которое отдает протоны (по определению Бренстеда-Лоури) или принимает пару валентных электронов для образования связи (по определению Льюиса).
• Основание — это вещество, которое может принимать протоны или отдавать пару валентных электронов для образования связи.
• Основания можно рассматривать как химическую противоположность кислот. Реакция между кислотой и основанием называется реакцией нейтрализации.
• Сила кислоты относится к ее способности или склонности терять протон; сильная кислота – это та, которая полностью диссоциирует в воде. Тогда молярная концентрация кислоты равна молярной концентрации протонов, которую можно использовать для расчета pH.
Основные термины
Валентный электрон : Любой из электронов в самой внешней оболочке атома; способны образовывать связи с другими атомами.
K a : Константа диссоциации кислоты – это константа равновесия реакции диссоциации кислоты.
pK a : Метод, используемый для определения силы кислоты. pKa – отрицательный логарифм константы диссоциации кислоты или значения Ka .
 К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
 В качестве неэлектролита может выступать вода.
В качестве неэлектролита может выступать вода.

 15М
15М

