Сложное вещество
Сложное вещество – это вещество, состоящее из атомов двух и более разных химических элементов. Согласно принципам систематической номенклатуры, химическая формула сложного вещества разделяется на условно электроположительную (катион) и условно электроотрицательную (анион) составляющие. Первая составляющая ставится в формуле слева, а вторая – справа. Название сложного вещества читается справа налево, то есть вначале называется его электроотрицательная составляющая в именительном падеже, а затем электроположительная – в родительном. При этом в случае одноэлементной электроотрицательной составляющей используется суффикс –ид, а в случае многоэлементарной – суффикс –ат.
Классификация сложных веществ:Бинарные соединенияВ формулах бинарных соединений, состоящих из металла и неметалла, на первом месте всегда стоит металл (как более электроположительный элемент): K2

В формулах соединений, не содержащих атомы металлов, на первом месте помещается элемент с меньшей электроотрицательностью. Порядок увеличения электроотрицательности определяется практическим рядом:
Rn, Xe, Kr, B, Si, C, As, P, H, Te, Se, S, At, I, Br, Cl, N, O, F
Например, H2O, CS2, Cl3N, C2H6, AsI3, NO2, OF2. Исключение составляют некоторые соединения азота с водородом, для которых оставлено традиционное написание формул: HN3, N2H4 (но для кислоты HN3).
Бинарные соединения:
- Галогениды;
- Оксиды;
- Халькогениды;
- Нитриды;
- Водородные соединения азота;
- Фосфиды;
- Карбиды;
- Гидриды;
- Интерметаллиды.
- Гидроксиды;
- Кислоты;
- Соли;
Автор: Тикавый В. Ф.
Ф.
Источник: Общая химия в формулах, определениях, схемах., под редакцией Тикавого В.Ф.,1987 год
Дата в источнике: 1987 год
Простые и сложные вещества — получение и свойства
Все вещества, о которых мы говорим в
школьном курсе химии, принято делить
на простые и сложные. Простые
вещества — это такие вещества, в
состав молекул которых входят атомы
одного и того же элемента. Атомарный
кислород (O), молекулярный кислород
(O2) или просто кислород, озон (O3),
графит, алмаз — это примеры простых
веществ, которые образуют
химические элементы кислород и
углерод. Сложные вещества делятся на
органические и неорганические. Среди
неорганических веществ, прежде всего
выделяют следующие четыре класса:
окислы (или оксиды), кислоты
(кислродные и безкислородные),
основания (растворимые в воде
основания называются щелочами) и
соли.
Простые вещества принято делить на
металлы, неметаллы и инертные газы. К
металлам относятся все химические
элементы, у которых идет заполнение
d- и f-подуровней, это в 4-ом периоде
элементы: Sc — Zn, в 5-ом периоде: Y —
Cd, в 6-ом периоде: La — Hg, Ce — Lu, в 7
периоде Ac — Th — Lr. Если теперь среди
оставшихся элементов провести линию
от Be к At, то слева и внизу от нее
будут расположены металлы, а справа
и вверху — неметаллы. В 8 группе
Периодической системы расположены
инертные газы. Элементы,
расположенные на диагонали: Al, Ge,
Sb, Po (и некоторые другие. Например,
Zn) в свободном состоянии обладают
свойствами металлов, а гидроксиды
обладают свойствами и оснований, и
кислот, т.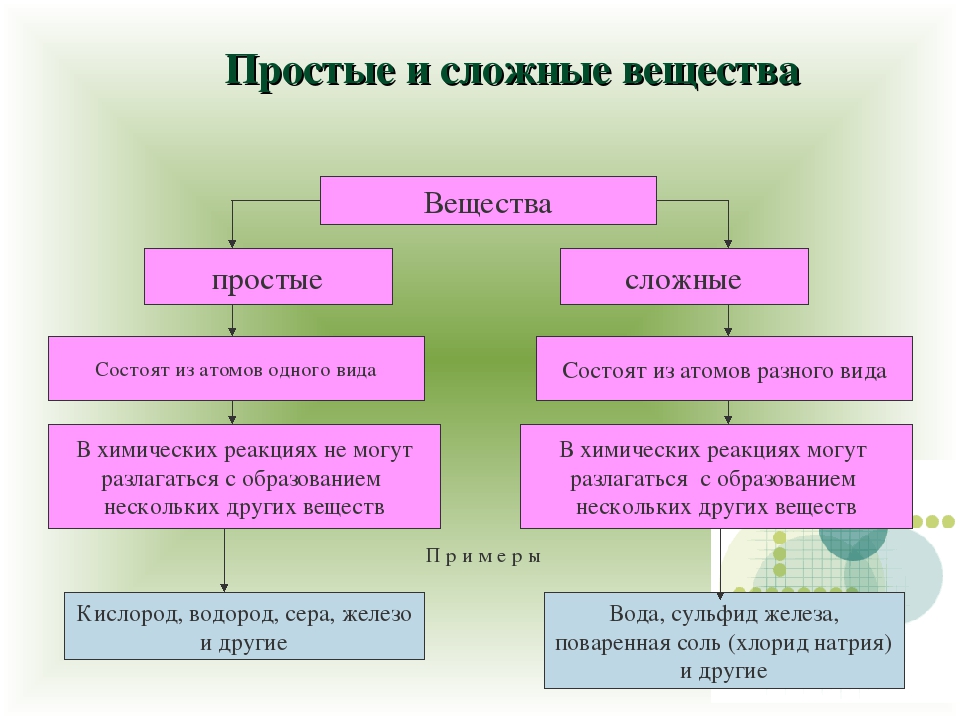
Простые и сложные вещества.
 Аллотропия. Химические соединения и смеси
Аллотропия. Химические соединения и смесиВсе вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение, т. е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами. К ним относятся: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе, радон Rn. Эти простые вещества состоят из не связанных друг с другом атомов.
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно, а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия — это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О2 и имеет такое же название, как и элемент— кислород. Другое простое вещество состоит из трехатомных молекул О3 и имеет собственное название — озон.
Кислород О 2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение кристаллов. Примером являются аллотропные модификации углерода С — алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества — это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: НCl, Н2O, NaCl, СО2, H2SO4 и т. д.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраняются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Например, хлорид натрия NaCl может образоваться из простых веществ — металлического натрия Na и газообразного хлора Сl Физические и химические свойства NaCl отличаются от свойств Na и Cl
В природе, как правило, встречаются не чистые вещества, а смеси веществ. В практической деятельности мы также обычно используем смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О2 (21 % по объему), азота N2 (78%), углекислого газа СО2 и др. Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными).
Гомогенные смеси — это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).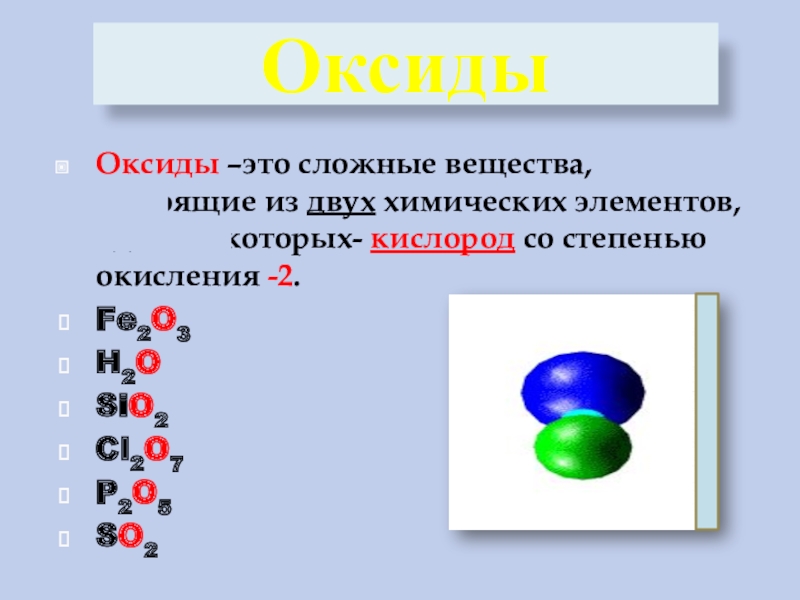
Важнейшие отличия смесей от химических соединений:
- В смесях свойства отдельных веществ (компонентов) сохраняются.
- Состав смесей не является постоянным.
Похожее
Типы химических реакций
☰
В природе существует огромное множество различных химических реакций. Для их упорядочивания и систематизации придумано несколько способов их классификации, то есть разделения на различные типы.
Чаще всего химические реакции классифицируют по числу и составу реагентов и продуктов реакции. По этой классификации выделяют четыре типа химических реакций — это реакции соединения, разложения, замещения, обмена. Однако существуют химические реакции, которые нельзя отнести ни к одному из перечисленных типов.
Реакции соединения
Реакция соединения — это реакция, реагентами которой являются два или несколько простых или сложных веществ, а продуктом — одно сложное вещество.
Примеры реакций соединения
Образование оксидов из простых веществ:
C + O2 = CO2, 2Mg + O2 = 2MgO
Взаимодействие металла с неметаллом и получение соли:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие оксида с водой:
CaO + H2O = Ca(OH)2
Реакции разложения
Реакция разложения — это реакция, реагентом которой является одно сложное вещество, а продуктом — два или несколько простых или сложных веществ. Чаще всего реакции разложения протекают при нагревании.
Примеры реакций разложения
Разложение мела при нагревании:
CaCO3 = CaO + CO2
Разложение воды под действием электрического тока:
2H2O = 2H2 + O2
Разложение оксида ртути при нагревании:
2HgO = 2Hg + O2
Реакции замещения
Реакция замещения — это реакция, реагентами которой являются простое и сложное вещества, а продуктами — также простое и сложное вещества, но атомы одного из элементов в сложном веществе заменены на атомы простого реагента.
Примеры реакций замещения
Замещение водорода в кислотах:
Zn + H2SO4 = ZnSO4 + H2
Вытеснение металла из соли:
Fe + CuSO4 = FeSO4 + Cu
Образование щелочи:
2Na + 2H2O = 2NaOH + H2
Реакции обмена
Реакция обмена — это реакция, реагентами и продуктами которой являются по два сложных вещества, в процессе реакции реагенты обмениваются между собой своими составными частями, в результате чего образуются другие сложные вещества.
Примеры реакций обмена
Взаимодействие соли с кислотой:
FeS + 2HCl = FeCl2 + H2S
Взаимодействие двух солей:
2K3PO4 + 3MgSO4 = Mg3(PO4)2 + 3K2SO4
| Класс | Название урока | Ссылка на учебные материалы |
| 8 | Предмет химии. Тела и вещества. Основные методы познания. Вводный инструктаж по технике безопасности | https://resh.edu.ru/subject/lesson/1521/main/ |
| 8 | Чистые вещества и смеси. Способы разделения смесей | https://resh.edu.ru/subject/lesson/1522/main/ |
| 8 | Физические и химические явления | https://resh.edu.ru/subject/lesson/1485/main/ |
| 8 | Атом. Молекула | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Химический элемент. Знаки химических элементов | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Простые и сложные вещества | https://resh.edu.ru/subject/lesson/1486/main/ |
| 8 | Валентность. Составление химических формул бинарных соединений Составление химических формул бинарных соединений |
https://resh.edu.ru/subject/lesson/1520/main/ |
| 8 | Химические уравнения. Коэффициенты. Закон сохранения массы веществ | https://resh.edu.ru/subject/lesson/1519/main/ |
| 8 | Вычисления по химическим уравнениям количества и массы вещества по количеству вещества, массе реагентов или продуктов реакции | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Обобщение и систематизация знаний по теме «Первоначальные химические понятия» | https://resh.edu.ru/subject/lesson/2448/main/ |
| 8 | Кислород – химический элемент и простое вещество. Озон. Состав воздуха | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Физические и химические свойства кислорода | https://resh.edu.ru/subject/lesson/2447/main/ |
| 8 | Получение и применение кислорода | https://resh. edu.ru/subject/lesson/2447/main/ edu.ru/subject/lesson/2447/main/ |
| 8 | Озон. Аллотропия кислорода. Состав воздуха. Горение | https://resh.edu.ru/subject/lesson/2446/main/ |
| 8 | Водород – химический элемент и простое вещество. Физические и химические свойства водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Получение и применение водорода | https://resh.edu.ru/subject/lesson/3119/main/ |
| 8 | Объёмные отношения газов при химических реакциях | https://resh.edu.ru/subject/lesson/2731/main/ |
| 8 | Вода в природе. Круговорот воды в природе. Физические свойства воды | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды. Взаимодействие с металлами | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Химические свойства воды.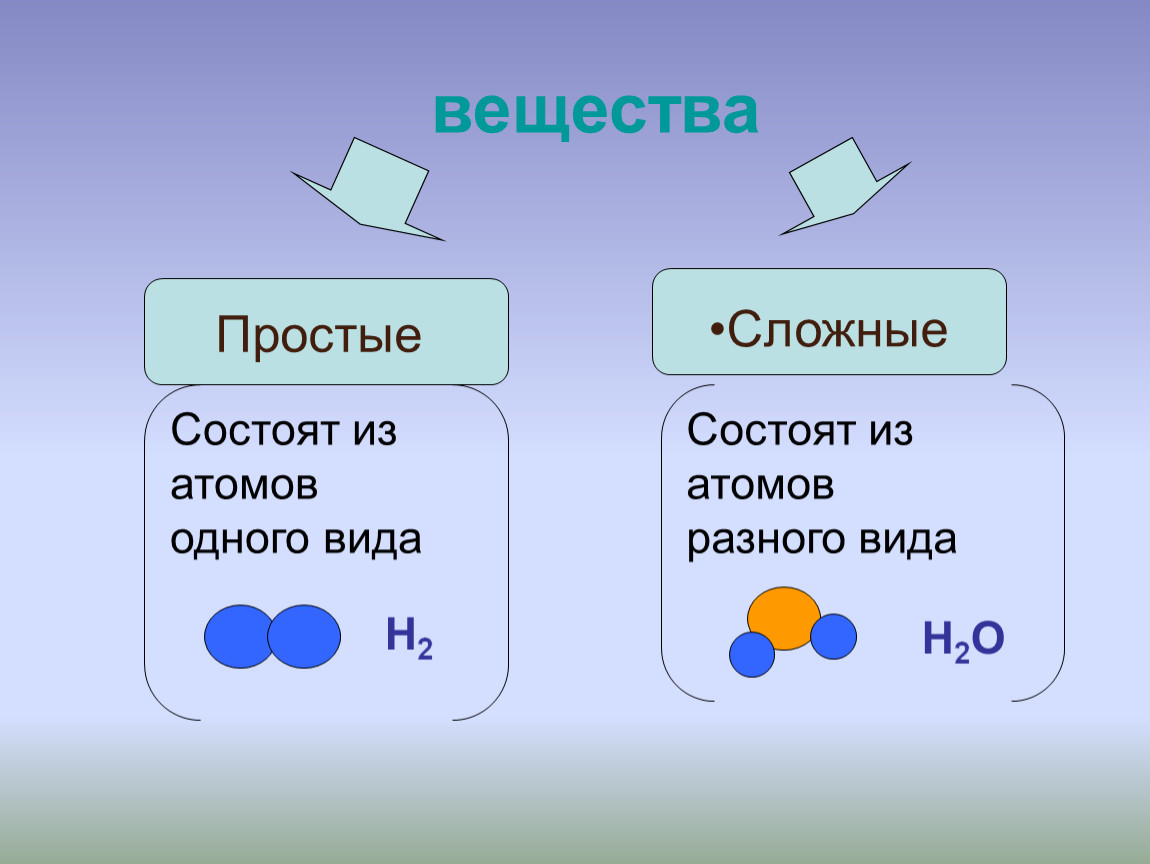 Взаимодействие воды с оксидами металлов Взаимодействие воды с оксидами металлов |
https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Растворы. Растворимость веществ в воде. Массовая доля растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Расчёт массовой доли растворённого вещества в растворе | https://resh.edu.ru/subject/lesson/2062/main/ |
| 8 | Оксиды. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2445/main/ |
| 8 | Амфотерные оксиды и гидроксиды | https://resh.edu.ru/subject/lesson/2684/main/ |
| 8 | Физические и химические свойства оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Получение и применение оксидов | https://resh.edu.ru/subject/lesson/2444/main/ |
| 8 | Основания. Классификация. Номенклатура Классификация. Номенклатура |
https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Получение и применение оснований | https://resh.edu.ru/subject/lesson/2442/main/ |
| 8 | Кислоты. Классификация. Номенклатура | https://resh.edu.ru/subject/lesson/2055/main/ |
| 8 | Физические и химические свойства кислот. Индикаторы. Изменение окраски индикаторов в различных средах | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Получение и применение кислот | https://resh.edu.ru/subject/lesson/3120/main/ |
| 8 | Соли. Классификация. Номенклатура. Получение и применение солей | https://resh.edu.ru/subject/lesson/2054/main/ |
| 8 | Физические и химические свойства солей | https://resh.edu.ru/subject/lesson/2441/main/ |
| 8 | Генетическая связь между классами неорганических соединений | https://resh. edu.ru/subject/lesson/2440/main/ edu.ru/subject/lesson/2440/main/ |
| 8 | Строение атома: ядро, энергетический уровень |
https://resh.edu.ru/subject/lesson/2051/main/ https://mosobr.tv/release/7883 |
| 8 | Состав ядра атома: протоны, нейтроны. Изотопы | https://resh.edu.ru/subject/lesson/2051/main/ |
| 8 | Периодический закон Д. И. Менделеева. Периодическая система химических элементов Д. И. Менделеева | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Физический смысл атомного (порядкового) номера химического элемента, номера группы и периода периодической системы | https://resh.edu.ru/subject/lesson/2050/main/ |
| 8 | Закономерности изменения свойств атомов химических элементов и их соединений на основе положения в периодической системе Д. И. Менделеева и строения атома |
https://resh. edu.ru/subject/lesson/2049/main/ edu.ru/subject/lesson/2049/main/ |
| 8 | Электроотрицательность атомов химических элементов | https://resh.edu.ru/subject/lesson/2439/main/ |
| 8 | Ковалентная химическая связь: неполярная и полярная. Ионная связь | https://resh.edu.ru/subject/lesson/2048/main/ |
| 8 | Металлическая связь. Понятие о водородной связи и её влиянии на физические свойства веществ на примере воды | https://resh.edu.ru/subject/lesson/2438/main/ |
| 8 | Валентность и степень окисления. Правила определения степеней окисления | https://resh.edu.ru/subject/lesson/3121/main/ |
| 8 | Окислительно-восстановительные реакции | https://resh.edu.ru/subject/lesson/3122/main/ |
| 8 | Повторение и обобщение по теме «Строение атома. Строение вещества. Химическая связь» | https://resh. edu.ru/subject/lesson/3093/main/ edu.ru/subject/lesson/3093/main/ |
| 8 | Химические формулы. Индексы. Закон постоянства состава вещества | https://interneturok.ru/lesson/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/himicheskaya-formula-veschestva?seconds=0 |
| 8 | Относительная атомная и молекулярная массы. Массовая доля химического элемента в соединении |
Относительная+атомная+и+молекулярная+массы |
| 8 | Вычисление массовой доли химического элемента по формуле соединения | Вычисление+массовой+доли+химического+элемента |
| 8 | Моль – единица количества вещества. Молярная масса | Моль+-+единица+количества+вещества.+Молярная+масса |
| 8 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | Тепловой+эффект+химических+реакций.+Понятие+об +экзо-+и+эндотермических+реакциях |
| 8 | Физические и химические свойства оснований | Физические+и+химические+свойства+оснований |
| 9 | Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления |
https://resh.edu.ru/subject/lesson/2104/main/ |
| 9 | Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакциях | https://resh.edu.ru/subject/lesson/2437/main/ |
| 9 | Скорость химических реакций. Первоначальные представления о катализе | https://resh.edu.ru/subject/lesson/2102/main/ |
| 9 | Обратимые и необратимые реакции. Понятие о химическом равновесии | https://resh.edu.ru/subject/lesson/2103/main/ |
| 9 | Сущность процесса электролитической диссоциации. Диссоциация кислот, оснований и солей. Слабые и сильные электролиты. Степень диссоциации | https://resh.edu.ru/subject/lesson/1518/main/ |
| 9 | Реакции ионного обмена и условия их протекания | https://resh. edu.ru/subject/lesson/1603/main/ edu.ru/subject/lesson/1603/main/ |
| 9 | Гидролиз солей | https://resh.edu.ru/subject/lesson/3123/main/ |
| 9 | Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях | https://resh.edu.ru/subject/lesson/1606/main/ |
| 9 | Обобщение и систематизация знаний по теме «Химические реакции» | https://resh.edu.ru/subject/lesson/2101/main/ |
| 9 | Общая характеристика элементов VIIA группы. Галогены в природе. Физические свойства галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Химические свойства и применение галогенов | https://resh.edu.ru/subject/lesson/2075/main/ |
| 9 | Хлороводород. Соляная кислота и её соли | https://resh. edu.ru/subject/lesson/2075/main/ edu.ru/subject/lesson/2075/main/ |
| 9 | Общая характеристика элементов VIA группы. Сера в природе. Физические и химические свойства серы | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Сероводород. Сульфиды | https://resh.edu.ru/subject/lesson/2434/main/ |
| 9 | Оксиды серы (IV). Сернистая кислота и её соли | https://resh.edu.ru/subject/lesson/2076/main/ |
| 9 | Оксиды серы (VI). Серная кислота и её соли | https://resh.edu.ru/subject/lesson/2077/main/ |
| 9 | Общая характеристика элементов VA группы. Азот в природе. Физические и химические свойства азота | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: строение молекулы, физические и химические свойства | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Аммиак: химические свойства, получение, применение | https://resh. edu.ru/subject/lesson/2078/main/ edu.ru/subject/lesson/2078/main/ |
| 9 | Соли аммония | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Азотная кислота и её соли | https://resh.edu.ru/subject/lesson/2078/main/ |
| 9 | Фосфор. Оксид фосфора (V) | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Фосфорная кислота и её соли | https://resh.edu.ru/subject/lesson/2073/main/ |
| 9 | Характеристика элементов IVA группы. Углерод и кремний в природе. Физические и химические свойства углерода. Аллотропия углерода | https://resh.edu.ru/subject/lesson/2072/main/ |
| 9 | Оксиды углерода | https://resh.edu.ru/subject/lesson/2071/main/ |
| 9 | Угольная кислота и её соли | https://resh.edu.ru/subject/lesson/2070/main/ |
| 9 | Кремний и его соединения | https://resh.edu.ru/subject/lesson/2069/main/ |
| 9 | Обобщение и систематизация знаний по теме «Неметаллы IV и V групп и их соединения» | https://resh.edu.ru/subject/lesson/2068/main/ |
| 9 | Положение металлов в Периодической системе химических элементов Д. И. Менделеева. Общие физические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7942 |
| 9 | Общие химические свойства металлов |
https://resh.edu.ru/subject/lesson/1607/main/ https://mosobr.tv/release/7974 |
| 9 | Получение и применение металлов | https://resh.edu.ru/subject/lesson/1607/main/ |
| 9 | Положение щелочных и щелочноземельных металлов в Периодической таблице химических элементов Д. И. Менделеева и строение их атомов. Свойства | https://resh.edu.ru/subject/lesson/1602/main/ |
| 9 | Соединения щелочных и щелочноземельных металлов | https://resh.edu.ru/subject/lesson/3124/main/ |
| 9 | Положение алюминия в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Физические и химические свойства алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Соединения алюминия | https://resh.edu.ru/subject/lesson/1604/main/ |
| 9 | Положение железа в Периодической таблице химических элементов Д. И. Менделеева и строение атома. Нахождение в природе. Физические и химические свойства железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Соединения железа и их свойства | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Получение и применение соединений железа | https://resh.edu.ru/subject/lesson/1605/main/ |
| 9 | Обобщение и систематизация знаний по теме «Металлы и их соединения» | https://resh.edu.ru/subject/lesson/2067/main/ |
| 9 | Углеводороды | https://resh.edu.ru/subject/lesson/1608/main/ |
| 9 | Спирты: метанол, этанол, глицерин | https://resh.edu.ru/subject/lesson/2066/main/ |
| 9 | Карбоновые кислоты: уксусная, стеариновая, олеиновая, аминоуксусная кислоты | https://resh.edu.ru/subject/lesson/2065/main/ |
| 9 | Биологически важные вещества: жиры, углеводы, белки | https://resh.edu.ru/subject/lesson/1609/main/ |
| 9 | Полимеры | https://resh.edu.ru/subject/lesson/2435/main/ |
| 9 | Обобщающий урок по теме «Важнейшие органические соединения» | https://resh.edu.ru/subject/lesson/2064/main/ |
| 9 | Степень окисления атомов и её определение в соединениях | Степень+окисления+атомов+и+её+определение+в+соединениях |
| 9 | Положение неметаллов в Периодической системе химических элементов Д. И. Менделеева | https://www.youtube.com/watch?v=ohFd4lJ9RcE&feature=emb_logo |
| 9 | Химические свойства металлов. Взаимодействие металлов с неметаллами | https://www.youtube.com/watch?v=qgzo40bfL1o |
| 9 | Оксиды азота | https://www.youtube.com/watch?time_continue=130&v=JmbTPhygCdk&feature=emb_logo |
| 9 | Общие химические свойства металлов | https://www.youtube.com/watch?time_continue=217&v=3O_1UupZ71E&feature=emb_logo |
| 9 | Получение и применение металлов | https://www.youtube.com/watch?time_continue=347&v=ZmgAo8Q3jFI&feature=emb_logo |
| 9 | Природные источники углеводородов: природный газ, нефть, уголь | https://www.youtube.com/watch?time_continue=206&v=O9e6ORyASjI&feature=emb_logo |
| 9 | Свойства металлов, неметаллов и их соединений. Генетическая связь между классами неорганических соединений | Свойства+металлов+неметаллов+и+их+соединений |
| 9 | Вычисления по химическим уравнениям количества, объёма, массы вещества по количеству, объёму, массе реагентов или продуктов реакции | https://www.youtube.com/watch?time_continue=8&v=nwIVA6XBq5w&feature=emb_logo |
Вещества сложные — Справочник химика 21
Молекулярная адсорбционная хроматография. Этот вид хроматографии имеет большое значение для аналитического и технологического разделения смесей органических веществ сложного состава, например растительных пигментов, витаминов, антибиотиков, аминокислот. Известны также примеры использования метода молекулярной адсорбционной хроматографии для разделения редкоземельных и радиоактивных элементов, хотя для этих целей чаще применяют методы ионообменной хроматографии. [c.69]Экстракция неорганических веществ — сложный физико-химический процесс, связанный с различными реакциями в растворах и переносом вещества через поверхность раздела фаз. Растворенное вещество распределяется между фазами в определенном закономерном соотношении. Закон распределения, открытый М. Бертло и Юнгфлейшем и обобщенный В. Нерстом, можно формулировать так растворенное вещество распределяется между двумя несмешивающнмнся фазами так, что отношение равновесных концентраций вещества в обеих фазах не зависит от общей концентрации, если в каждой фазе вещество имеет один и тот же молекулярный вес. Закон В. Нернста не является строго термодинамическим и выполняется в частных случаях для разбавленных растворов (1 Ю З—1 10 моль/л) [c.332]
Процессы ассоциации зависят не только от свойств растворенных молекул, анионов и катионов, но и от свойств той среды, в которой эти молекулы, анионы и катионы находятся, т. е. от взаимодействия между растворителем, молекулами растворенного вещества, сложными ионами, простыми ионами и агрегатами молекул. Каждый из трех процессов (диссоциация, ассоциация и комплексная диссоциация) зависит от физических и химических свойств растворителя, от его диэлектрической проницаемости, химической природы и т. д. При этом чем ниже диэлектрическая проницаемость, тем больше эти процессы сдвинуты в сторону агрегации всех частиц, находящихся в растворе. [c.107]
Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и хгшические формулы. Уравнения химических реакций. [c.122]
Другие уравнения состояния получены в большей или меньшей степени на эмпирической основе, поэтому их параметры связаны очень мало или совсем не связаны со свойствами молекул. Таким образом, экстраполяция по этим уравнениям весьма рискованна, ибо они надежно описывают только ту область параметров состояния, для которой имеются экспериментальные данные. Если экстраполяция необходима, то ее лучше осуществлять с помощью уравнения, имеющего теоретическую основу. (Это утверждение не следует рассматривать как разрешение на произвольную экстраполяцию для вириального уравнения. При любой экстраполяции необходимо соблюдать большую осторожность.) Однако основное достоинство вириального уравнения состояния заключается не в возможности более обоснованной экстраполяции, а в его теоретически аргументированной связи с межмолекулярными взаимодействиями, в частности с силами, действующими между молекулами. Как известно, многие макроскопические свойства вещества в большой степени зависят от межмолекулярных сил. Для некоторых из них, например транспортных свойств разреженных газов, вириальных коэффициентов и свойств простых кристаллов, функциональная связь между межмолекулярными силами и указанными свойствами вполне понятна. Это позволяет на основании экспериментально определенных свойств рассчитывать межмолекулярные силы, и, наоборот, зная последние, рассчитывать макроскопические свойства. Однако теория уравнения состояния и транспортных свойств сжатых газов, а также свойств жидкостей и твердых веществ сложной структуры находится на начальной стадии развития, и успех в этой области зависит от нашего знания природы межмолекулярных сил, основанного на экспериментальных данных по макроскопическим свойствам. [c.9]
Важную информацию приносит и рентгенофазовый анализ исходных кристаллических форм и продуктов, получившихся в результате прогрева. Пользуясь этим методом, можно регистрировать различия кристаллических структур как одного и того же вещества (полиморфизм), так и различных веществ сложной системы. [c.74]
Что называется эквивалентом вещества (элемента, простого вещества, сложного вещества) [c.7]
Вещества (сложные эфиры), образующиеся при взаимодействии глицерина с жирными кислотами [c.544]
Простые вещества. Зависимость строения и свойств просты.х веществ от иоложения алементов в периодической системе. Получение простых веществ. Сложные вещества. Бинарные соединения. Двухэлементные соединения. Зависимость устойчивости и свойств двухэлементных соединений от атомного номера элемента с положительной степенью окисления. Неорганические полимеры с тетраэдрическими связями. Трехэлементные соединения. Их строение, свойства. Смешанные соединепия. Твердые расгвор1л. Эвтектические смеси. Оксосоединения /i-элементов. Силикат(.1, Алюмосиликаты. [c.181]
Исследования И. Н. Назарова позволили синтезировать ряд душистых природных веществ, исходя из спиртов, получаемых при переработке ацетилена. Таким путем были получены фарнезол, линалоол, гараниол. Из органических кислот и спиртов получают душистые вещества — сложные эфиры. Бензиловый эфпр уксусной кислоты применяют в духах типа Жасмин . Гераниоловые эфиры пропионовой и масляной кислот имеют запах розы и также используются в парфюмерных изделиях. [c.356]
Со значением свободной энергии, отнесенной к отдельному компоненту (веществу) сложной материальной системы, связывают понятие химического потенциала (в большинстве случаев он определяется для одного моля вещества). Химический потенциал зависит от свойств вещества и концентрации данного компонента в системе. Каждый процесс, ведущий к изменению состава (например, диффузия, химическая реакция), протекает в направлении уменьшения химического потенциала всех компонентов системы. Следовательно, если химический потенциал некоторых компонентов системы в различных ее точках имеет различную величину, то этот компонент при отсутствии каких-либо препятствий перейдет от точки с большим химическим потенциалом к точкам с меньшим химическим потенциалом. В результате система стремится к равновесию и достигает его, когда химические потенциалы всех компонентов по всему объему станут одинаковыми. [c.18]
ПРИРОДНЫЕ красящие вещества — сложные органические соединения, вырабатываемые живыми организмами и окрашивающие различные животные и растительные ткани. Длительное время природные красители применялись для окраски текстильных изделий, кожи, бумаги, пищевых продуктов и др. С развитием промышленности органического синтеза они утратили свое значение. Однако эти красители играют важную роль в жизни организмов, которыми они вырабатываются многие из них обладают значительной физиологической активностью и применяются как лечебные препараты. [c.203]
Понятно, что дисперсные системы по сравнению с агрегатными состояниями индивидуальных веществ сложнее по структуре и имеют свои особенности. [c.158]
Препараты для декорирования стекла, металла, дерева. Сульфиды (в виде терпенсульфидов золота или платины) используют для декорирования стекла, фарфора, металла, дерева, пластмассы, ткани, бумаги и др. [29]. Терпен-сульфиды металлов — вещества сложного, непостоянного состава они представляют собой продукты взаимодействия солей золота или платины со скипидаром (живичный скипидар, лиственничный терпентин), обработанным при нагревании элементарной серой. Нанесенный в виде орнамента на поверхность стекла или фарфора терпенсульфид золота восстанавливают при 420° С до свободного золота. [c.55]
Таким образом, окислителями могут являться атомы веществ с высокой электроотрицательностью (ЭО) — элементарные окислители (Р, С1, О, 5 и т. д.) — или молекулы сложных веществ — сложные [c.254]
Моющее действие веществ — сложный коллоидно-химический процесс, включающий понижение поверхностной энергии, диспергирование, коллоидную защиту и солюбилизацию . [c.136]
Монопальмитат и моностеарат сахарозы относятся к классу неионогенных поверхностно-активных веществ. Сложные эфиры сахарозы обычно получают переэтерификацией по схеме [c.167]
Химическое превращение, т. е. образование новых веществ, обладающих по сравнению с исходными веществами иными свойствами, связано с изменением самих молекул вещества. Молекулы одних веществ сложнее, чем других, т. е. вещества отличаются друг от друга сложностью. Из различных сравнительно простых веществ посредством их соединения могут быть получены более сложные вещества. Наоборот, из сложных веществ посредством их разложения могут быть получены сравнительно более простые вещества. [c.5]
Поскольку свойства химических элементов находятся в периодической зависимости от заряда ядра их атомов (1-14), величина которого совпадает с порядковым номером элемента, в такой же зависимости от порядкового номера должны находиться и свойства элементарных веществ — как физические, так и химические. Так оно и есть на самом деле, только эта зависимость для элементарных веществ сложнее, чем для химических элементов. [c.48]
В отличие от ООС тонкий органический синтез (ТОС) объединяет производства органических веществ сложного строения, вырабатываемые в относительно небольших количествах и используемые преимущественно в качестве целевых конечных продуктов. К ним относятся красители, фото- и кинореактивы, фармацевтические препараты, взрывчатые вещества, парфюмерные средства и т.п. [c.236]
В начале 30-х годов Б. Уоррен применил этот метод для исследования структуры аморфных веществ сложного состава, ввел радиальные функции распределения электронной плотности, связанные с интенсивностью рассеяния уравнением [c.5]
Природа растворов. Растворы играют важную роль в природе и технике. В свое время алхимики считали, что вещества взаимодействуют лишь в растворенном состоянии. Многие технологические процессы, например получение соды или азотной кислоты, выделение и очистка редких металлов, отбеливание и окрашивание тканей, протекают в растворах. Вода, встречающаяся в природе, содержит растворенные вещества и поэтому всегда является раствором. Природные водные рас творы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные физико-химические процессы, происходящие в организме животных и человека, также протекают в растворах. Существует мнение, что образование белковоподобных соединений из неорганических веществ, т. е. возникновение жизни на Земле, также протекало в водных растворах. [c.180]
Как известно, изоморфные вещества образуют друг с другом твердые растворы — гомогенные твердые вещества сложного состава, в структуре которых атомы распределены статистически. В твердых растворах ионных соединений, металлов, полимеров атомы соединены межатомными связями. Поэтому подобные вещества являются твердыми атомными соединениями. Каждому непрерывному твердому раствору соответствует ряд однотипных твердых химических соединений, в том числе соединений, обладающих равноценными статистическими структурами, и в ряде случаев интерметаллических соединений. Например, медь и золото образуют непрерывный ряд твердых растворов, но при концентрациях золота от 20 до 70 ат. % в сплавах, полученных отжигом (т. е. выдерживанием сплава при высокой температуре), проявляются интерметаллические соединения СизАи и СиАи, имеющие строго закономерную структуру. Следовательно, твердые растворы не всегда имеют неупорядоченное строение. Эта неупорядоченность — во многих случаях результат закрепления атомов при [c.44]
Веществ очень много. В настоящее время ученые знают около 3 миллионов органических и около 100 тысяч неорганических (минеральных) веществ. Для облегчения изучения веществ их классифицируют по различным признакам. Так, все известные вещества можно разделить на четыре большие группы элементарные частицы, простые вещества, сложные вещества и смеси. [c.5]
Белки. Белки — это природные вещества сложного строения, важнейшая составная часть живых организмов, основа процессов их жизнедеятельности. [c.309]
Автомобильные бензины до использования прихр- дится транспортировать и хранить иногда в течение длительного времени. В этот период наиболее нестабильные соединения, входящие в их состав, под действием кислорода воздуха претерпевают химические изменения с образованием смолистых веществ сложного состава (аутоокисление). Способ ность бензинов противостоять химическим изме- нениям при хранении, транспортировке и применении назы1 к)т химической стабильностью. [c.219]
Какое-нибудь вещество (сложное или простое) может находиться или рассматриваться в разных стандартных состояниях при одной и той же температуре. Так, воду при обычных температурах, наряду со стандартным жидким состоянием, часто рассматривают в стандартном состоянии идеального газа. Хотя такое состояние воды при обычных температурах практически недостия имо, термодинамические параметры, отвечающие ему, могут быть рассчитаны и широко используются в качестве вспомогательных величин при различных термодинамических расчетах. [c.22]
Со времени Лавуазье все вещества разделяют на простые вещества, сложные вещества (соединения) и смеси. Простое вещество состоит из атомов какого-нибудь одного элемента, соединения— из химически связанных атомов двух или более элементов. Простые вещества и соединения представляют собой химические иудивиды или индивидуальные вещества. Каждое из них обладает определенным составом, строением и только ему одному присущим набором свойств, обусловленных этим составом и строением. Химические индивиды отличаются от механических смесей однородностью, т. е. в их массе нет включений иного состава н строения. [c.12]
Г 1,дрировать ароматические альдегиды, кетоны и спирты только пароматическим связям с сохранением кислородных функциональных групп не удается приходится защищать спиртовую или карбонильную группу, применяя производные этих веществ (сложные )фиры, ацетали). [c.509]
Исходное неизвестное органическое вещество — сложный эфир, так как прн кипячении его со щелочью в качестве одного из продуктов реакции образуется спирт. Грамм-моль С2Н5ОН = 46 г. Определим грамм-молекулярную массу сложного эфира, обозначив ее через х. [c.169]
Анализ сернистых соединений нефтяных дистиллятов сопряжен со значительными трудностями. Строение этих веществ сложнее строения углеводородов, в растворе которых они находятся, а содержание их в нефтепродуктах весьма мало (в среднедистиллятных фракциях высокосернистых нефтей не более 5—7 вес. %). Поэтому ни один из современных аналитических методов не позволяет с исчерпывающей полнотой определить состав нефтяных сернистых соединений. Лишь комбинируя методы определенным образом, удается решить эту задачу. Достоверность результатов во многом зависит от того, как подготовлено сырье для исследования. Насколько важна подготовка материала и насколько она может быть индивидуальна и неповторима для другого сырья, показывает следующий пример. Фракцию 111—150° С нефти месторождения Уассон (США) вначале в изотермических условиях разгоняли на узкие фракции. Из этих фракций специальными комбинированными методами были удалены меркаптаны (опи могли помешать определению соединений других классов). Однако даже такой подготовки оказалось недостаточно. Поэтому узкие фракхщ-подвергли гидрогеполизу. В результате сернистые соединения восстановились до соответствующих углеводородов, которые и были обнаружены методом газо-жидкост-ной хроматографии. Для проверки были проведены параллельные исследования методами ИК- и масс-спектрометрии, которые подтвердили правильность результата основного анализа. [c.75]
Поскольку ингибиторы представляют собой, как правило, многокомпонентные смеси веществ сложного строения, с помощью спектрометра 5РЕКОКО-М82 были получены ИК-спек-тры исследованных реагентов. При этом учитывали, что не следует надеяться на получение спектров, свободных от шумов, которые точно передавали бы контуры, частоты и интенсивности поглощения молекул и не были бы искажены самим спектрометром. В то же время с помощью ИК-спектрометрии невозможно установить различия в составе или структуре веществ, когда изменения сигналов соизмеримы с величинами случайных ошибок прибора, и констатировать, действительно ли данная проба удовлетворяет техническим условиям. Не имея атласа ИК-спектров, невозможно расшифровать состав ингибитора. Однако, рассмотрев внешнее сходство пиков ИК-спектров, ингибиторы можно подразделить на группы, в которых наблюдаются примерно одинаковые пики в определенных диапазонах [c.257]
Органический сапропелевый материал осаждается гораздо медленнее песка, но глинистый материал, как уже было показано, способен длительное время находиться во взвешенном состоянии, и поэтому понятно, почему органический материал и глинистые частицы могут осаждаться совместно, если вообще имело место поступление глинистого вещества. Так как глины, даже в неактивированном состоянии, способны превращать одни молекулы в другие, даже в пределах углеводородных классов, вообще менее способных к превращениям, чем соединения гетерогенного характера, образование углеводородов и близких к ним веществ сложной полициклической структуры кажется с химической точки зрения вероятным. С другой стороны, песок и карбонатные породы лишены ярко выраженных каталитических свойств, а потому совместное осаждение органического вещества теоретически не обеспечивает благоприятной обстановки для нефтепроизводящих процессов. Карбонатные породы, содержащие органическое вещество, являются продуктом превращений скелетных частей организмов, и, следовательно, невозможно как-то разъединять процессы отложения органического вещества и карбонатов. Вероятно, наличие карбонатов доля по препятствовать образованию нефти. Таким образом, приходится опираться главным образом на глинистые породы, ( держащие органическое вещество, как на благоприятную среду для нефтеобразовательных процессов. [c.202]
Одной из важнейших задач в комплексе проблем, связанных с развитием нефтеперерабатывающей и нефтехимической отраслей России, является обеспечение высокой эксплуатационной надежности технологического оборудования. Важность этой задачи обусловлена как специфическими особенностями указанных отраслей, так и современными тенденциями их развития. К числу факторов, выделяющих нефтепереработку и нефтехимию из сферы промышленного производства, следует отнести широкое применение в технологических процессах повышенных и криогенных температур высоких давлений и вакуума коррозионных, огне- и взрывоопасных сред сильнодействующих ядовитых веществ сложные режимы нагружения технологического оборудования, включающие различные виды и сочетания силовых, тепловых и коррозионных нагрузок [1, 2], Для большинства видов оборудования эти факторы действуют одновременно, приводя к проявлению системного эффекта эмерджентности. Стохастическая природа внешних воздействий и внутренних процессов, протекающих в конструкционных материалах, делает результаты такого проявления трудно прогнозируемыми. При неблагоприятном стечении обстоятельств это может привести к большому экономическому ущербу, нарушению нормальной экологической обстановки на значительных территориях, а в особо тяжелых случаях- к человеческим жертвам. [c.3]
Опыт 2. Влияние температуры. При взамодейст-вии иода с крахмалом образуется синее вещество сложного состава (соединение включения) [c.70]
Эпипроекцию применяют при изложении нового материала показывая рисунки или чертежи, учитель включает их описание в свой рассказ или предлагает учащимся проанализировать изображение. Умелое использование эпипроекции открывает возможность организовать творческую работу в классе. Так, по последовательному ряду веществ или химических реакций, можно предложить учащимся перечислить простые вещества, сложные, типичные восстановители, окислители, назвать предложенный тип химической реакции и пр. Творческая работа может быть организована и по фотографиям, снятым самими учащимися во время экскурсий на производство, в лаборатории и музеи. Комментируют такой эпифильм учащиеся-авторы. [c.137]
Атомы, из которых сложен остов твердого вещества, являются его структурными единицами. В общем случае структурные единицы имеют более сложный состав и строение, могут состоять из нескольких атомов, например SiOi >B кремнеземе. В твердых веществах сложного состава химические связи между атомами остова самые разнообразные, однако положение упрощается, если использовать понятие о структурных единицах. Тогда можно выявить общий принцип для твердых тел характер связей [c.9]
В избытке НС1 пентахлорид сурьмы образует комплексное соединение H(Sb l(.). Ион Sb l » образует с органическим полициклическим веществом сложной структуры — родамином Б — соединение с еще не изученной структурой. [c.225]
Помимо чисто химического, гомогенный катализ имеет громадное биологическое значение. В организмах и животных, и растений содержатся ферменты —органические вещества сложного строения, играющие роль катализаторов при разнообразных жизйенных процессах. Они обнаруживают резкую специфичность действия, так как каждый из них ускоряет только определенный процесс, не влияя на другие. В этом отношении ферменты превосходят неорганические катализаторы, которые большей частью могут ускорять ряд сходных по химизму реакций. 3 [c.346]
Такая запись отражает три основных фактора, определяющих поведение ионов в системе их молекулярное взаимодействие с окружающей средой ( lio), участие в тепловом движении (RT ln i) и взаимодействие с электрическим полем (гг-есрЫд). Вообще говоря, соотношение (VII—6) должно выполняться для всех ионов, присутствующих в системе. Однако иногда (при больших значениях lio) какие-либо ионы практически отсутствуют в одной из фаз или в обеих контактирующих фазах в последнем случае они присутствуют только на поверхности раздела фаз (поверхностная диссоциация, характерная для неорганических веществ сложного строения, например, силикатных и алюмосиликатных минералов). Кроме того, возможна такая поляризация поверхности, когда для одного из ионов из-за кинетических затруднений электрохимическое равновесие не устанавливается тогда разность потенциалов между фазами может быть изменена без изменения их состава приложением внешней разности потенциалов. [c.177]
Химия для поступающих в вузы 1985 (1985) — [ c.12 ]
Химия для поступающих в вузы 1993 (1993) — [ c.11 ]
История химии (1975) — [ c.109 ]
Учебник физической химии (0) — [ c.71 ]
История химии (1966) — [ c.110 ]
Сочинения Научно-популярные, исторические, критико-библиографические и другие работы по химии Том 3 (1958) — [ c.5 , c.15 , c.22 , c.31 , c.47 , c.49 , c.52 , c.57 , c.62 , c.174 , c.175 , c.177 , c.178 , c.182 , c.184 , c.202 , c.205 , c.206 , c.210 , c.212 , c.215 , c.218 , c.220 , c.228 , c.230 , c.240 , c.256 , c.262 , c.265 ]
Простые и сложные вещества — параграф 9 ГДЗ химия 8 Рудзитис
1. Как можно доказать, что кислород, железо и водород — простые вещества, а вода и сульфид железа — сложные вещества? Каковы условия возникновения и течения реакции образования сульфида железа?
Способов доказательства два:
- Получение из сложного вещества простых веществ.
- Синтез из простых веществ, сложного вещества.
Разложить сульфид железа крайне сложно, зато легко его получить. В параграфе это подробно описано. Для возникновения и течения этой реакции необходимо соблюсти следующие условия:
- Соприкосновение веществ.
- Измельчение веществ (кусок железа и кусок серы при обычных условиях взаимодействовать не будут).
- Нагревание.
Доказать, что кислород и водород простые вещества, можно путем электролиза воды. При котором вода разлагается на простые, составляющие ее вещества — водород и кислород. Водород можно условно определить по тому, что он горит с образованием воды. А кислород поддерживает горение (поместить в емкость с кислородом тлеющую лучинку).
2. Чем отличаются по составу и свойствам смеси от химических соединений? Приведите примеры.
По составу: смесь представляет собой два или более разных химических веществ, а химическое соединение это одно вещество.
По свойствам: химические свойства смеси — это химические свойства веществ, ее составляющих. А химическое соединение обладает уникальными свойствами, отличными от свойств веществ, из которых оно образовано. Кроме того, смесь нередко можно разделить на компоненты физическими методами (фильтрование, центрифугирование, отстаивание, воздействие магнитом и проч.), а химическое соединение так разделить нельзя.
Примеры:
Смесь железа и серы: можно разделить магнитом (железо обладает магнитными свойствами) или водой (сера не смачивается и всплывает на поверхность). Температура плавления серы 112° C, железа 1 539° C.
Сульфид железа: не обладает магнитными свойствами, нерастворим в воде (и оказывается на дне). Температура плавления 1 194° C.
Водород и кислород: оба — бесцветные газы, не обладающие запахом. Водород горюч и взрывоопасен. Кислород поддерживает горение. Сама смесь водорода и кислорода взрывоопасна, взрывается с громким хлопком, отчего получила название «гремучая смесь». Температура кипения водорода -253° C, кислорода — 183° C.
Вода — бесцветная жидкость, без вкуса и запаха. Температура плавления 0° C, кипения 100° C.
3. При помощи каких способов из смесей можно выделить вещества, входящие в их состав? Приведите примеры.
См. вопрос №1 в § 4. Чистые вещества и смеси.
Тестовые задания
1. На рисунках условно изображены простые и сложные вещества. Простое вещество изображено на рисунке:
Чтобы ответить, нужно вспомнить, что простое вещество образовано одним химическим элементом, а сложное — несколькими. Таким образом, на картинке нужно найти вещество, состоящее из одинаковых частиц.
Ответ: 4
2. На рисунках условно изображены простые и сложные вещества. Сложное вещество изображено на рисунке:
Этот вопрос с подвохом, т.к. на рисунках есть смеси простых и сложных веществ. 1- простое вещество (одинаковые частицы соединены попарно), 2 — сложное вещество (разные размеры частиц), 3 и 4 — смеси простых (одинаковые частицы соединены попарно) и сложных (частицы разного размера соединены между собой) веществ.
Ответ: 2
3. На рисунках условно изображены химические соединения и смеси. Смеси показаны на рисунках:
В этом случае наша задача — найти разные типы молекул, частиц. На рисунках 1 и 2 молекулы одинаковые. А вот на рисунках 3 и 4 видно, что молекулы образованы разными частицами.
Ответ: 3 и 4.
Сложные органические соединения в химии: типы, группы и примеры
Сложные органические соединения
Основная причина высокой ценности углерода заключается в том, что он может образовывать четыре связи одновременно, что позволяет ему образовывать сложные гибкие молекулы. Это идеальный вариант для жизни. Четыре основные группы молекул углерода жизни — это белков , углеводов , липидов и нуклеиновых кислот . Это самые сложные виды органических соединений.
Хорошо, иди взгляни в зеркало. Вы видите сложные органические соединения? Вы это сделаете, если увидите свою кожу. Кожа состоит из белков. Вы это сделаете, если увидите жир. Под кожей и жиром происходит множество процессов, для которых требуется энергия в виде углеводов. Мы не можем забыть очень важные нуклеиновые кислоты, которые сообщают клеткам вашего тела, как работать и воспроизводиться.
В простых органических соединениях углерод связан только с водородом. Сложные органические соединения, особенно те, которые участвуют в живых системах, имеют углеродные связи, по крайней мере, с водородом и кислородом.Давайте начнем с простого и снова перейдем к сложному.
Углеводы — это молекула, состоящая из углерода, водорода и кислорода . Примером углеводов является столовый сахар , известный как сахароза . Сахароза имеет молекулярную формулу C12h32O11 . Все сложные органические молекулы, такие как сахароза, известны как полимеры . Полимеры представляют собой комплекс повторяющихся структурных единиц .Структурные единицы , из которых состоят полимеры , называются мономерами . Итак, по сути, полимеры — это комплексы мономеров. Сахароза — это полимер мономера глюкозы.
Липиды , обычно называемые жирами, также являются полимерами. Липиды — это полимеры жирных кислот . Холестерин, который вы так усердно пытаетесь удержать в определенных пределах, является примером липида. Холестерин является одним из основных компонентов мембран клеток животных и позволяет клетке быть гибкой и изменять форму.Холестерин имеет сложную структуру из четырех связанных углеводородных колец и углеводородного хвоста . Молекулярная формула холестерина — C27h56O .
Если вы уже пробовали соблюдать диету, то знаете о двух основных типах липидов: насыщенных и ненасыщенных . Возможно, вы сидели на диете с высоким содержанием ненасыщенных жиров или цепочек жирных кислот с двойными связями , потому что они более здоровы. Насыщенные липиды — это цепь жирных кислот, не имеющих двойных связей .Большинство животных жиров представляют собой насыщенные липиды, тогда как большинство жиров растений и семян являются ненасыщенными липидами. За исключением некоторых жиров тропических растений, таких как кокосовое или пальмовое масло, которые являются насыщенными липидами.
Наше следующее органическое соединение, белок , даже сложнее углеводов или липидов. Белки — это полимер из аминокислот. Аминокислоты содержат азот, углерод, кислород и водород . Вы замечаете, что чем больше мы добавляем элементов, тем сложнее органическое соединение? Есть 20 аминокислот с широким спектром химических свойств, благодаря содержащемуся в них азоту.Аминокислоты охватывают всю шкалу pH, некоторые из них являются кислыми, основными или нейтральными. Некоторые аминокислоты обладают зарядом, что делает их полярными. Это важно, когда речь идет о том, как белки складываются вместе, а также как они связываются с другими соединениями.
Форма белков после сворачивания определяет их функцию. Например, фермент — это белок с активным центром, который будет объединять другие молекулы для катализирования реакции . Некоторые белки огромны из-за их окончательной формы после сворачивания.Эти белки настолько велики, что химики не обращают внимания на их молекулярную формулу; вместо этого они сосредотачиваются на своей молекулярной массе.
Белки, которые мы только что обсудили, созданы благодаря инструкциям, закодированным в нуклеиновых кислотах . Нуклеиновые кислоты — это полимер из нуклеотидов. Нуклеотиды представляют собой сахарофосфатные соединения , присоединенные к азотному основанию . ДНК , сокращенно от дезоксирибонуклеиновой кислоты , представляет собой нуклеиновую кислоту, которая кодирует инструкции для клеток . Рибонуклеиновая кислота , или РНК , представляет собой нуклеиновую кислоту , которая помогает преобразовывать ДНК в белки . Каждый аспект каждого живого организма, от бактерий до растений, вашей собаки и нас, определяется нуклеиновыми кислотами.
Краткое содержание урока
Органические соединения — это любые молекулы, состоящие из элемента углерода .Четыре основные группы углеродных молекул жизни представляют собой наиболее сложные органические соединения: белков , углеводов , липидов и нуклеиновых кислот . Все сложные органические молекулы представляют собой полимеры . Полимеры представляют собой комплекс повторяющихся структурных единиц , известных как мономеров . По сути, полимеры — это комплексы мономеров.
Углеводы — это молекула, состоящая из углерода, водорода и кислорода .Примером углеводов является столовый сахар , известный как сахароза .
Липиды , также называемые жирами , представляют собой полимер жирных кислот . Два типа липидов — это ненасыщенных жиров или цепей жирных кислот с двойными связями и насыщенных жиров или цепей жирных кислот, не имеющих двойных связей . Примером липида является холестерин , который представляет собой сложную структуру из четырех связанных углеводородных колец и углеводородного хвоста .
Белки представляют собой полимеры аминокислот . Аминокислоты — это мономеры , содержащие азот, углерод, кислород и водород . Одним из специализированных типов белка является фермент , который представляет собой белок с активным центром, который объединяет другие молекулы, чтобы катализировать реакцию .
Нуклеиновые кислоты представляют собой полимеры с нуклеотидами . Нуклеотиды представляют собой сахарофосфатные соединения , присоединенные к азотному основанию .Двумя типами нуклеиновых кислот являются дезоксирибонуклеиновая кислота , сокращенно ДНК , которая представляет собой нуклеиновая кислота, кодирующая инструкции для клеток , и рибонуклеиновая кислота , сокращенно РНК , которая является нуклеиновой кислотой . что помогает преобразовывать ДНК в белки .
Фреймворк для количественной оценки и визуализации
Реферат
Подробная характеристика химического состава сложных веществ, таких как продукты нефтепереработки и экологические смеси, очень необходима при оценке воздействия и производстве.Присущая сложность и изменчивость состава сложных веществ затрудняют выбор для их подробных аналитических характеристик. Тем не менее, вместо точного химического состава сложных веществ, оценка степени сходства является разумным путем к принятию решений в отношении правил гигиены окружающей среды. Группирование подобных сложных веществ — это проблема, которую можно решить с помощью передовых аналитических методов и оптимизированных методов анализа и визуализации данных.Здесь мы предлагаем структуру с неконтролируемым и контролируемым анализом для оптимальной группировки сложных веществ на основе их аналитических характеристик. Мы тестируем два набора данных по сложным веществам, полученным из нефти. Первый набор данных получен из анализа газовой хроматографией-масс-спектрометрией (ГХ-МС) 20 стандартных стандартных образцов, представляющих сырую нефть и продукты нефтепереработки. Второй набор данных состоит из 15 образцов различных газойлей, проанализированных с использованием трех аналитических методов: ГХ-МС, ГХ-ГХ-пламенно-ионизационное обнаружение (FID) и спектрометрия-масс-спектрометрия ионной подвижности (IM-MS).Мы используем иерархическую кластеризацию с использованием корреляции Пирсона в качестве метрики сходства для неконтролируемого анализа и строим модели классификации с использованием алгоритма случайного леса для контролируемого анализа. Мы представляем количественную сравнительную оценку результатов кластеризации с помощью индекса Фаулкса – Мэллоуса и результаты классификации с помощью модельной точности предсказания группы неизвестного сложного вещества. Мы демонстрируем влияние (i) различных методологий группирования, (ii) размера набора данных и (iii) уменьшения размерности на качество группирования, и (iv) различных аналитических методов на характеристику сложных веществ.Хотя сложность и изменчивость химического состава являются неотъемлемой чертой сложных веществ, мы демонстрируем, как выбор методов анализа и визуализации данных может повлиять на передачу их характеристик, чтобы выявить достаточное сходство.
Образец цитирования: Онель М., Бейкал Б., Фергюсон К., Чиу В.А., Макдональд Т.Дж., Чжоу Л. и др. (2019) Группировка сложных веществ с использованием данных аналитической химии: основа для количественной оценки и визуализации.PLoS ONE 14 (10): e0223517. https://doi.org/10.1371/journal.pone.0223517
Редактор: Цзе Чжан, Университет Ньюкасла, ВЕЛИКОБРИТАНИЯ
Поступила: 9 мая 2019 г .; Одобрена: 23 сентября 2019 г .; Опубликовано: 10 октября 2019 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, строить или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Доступность данных: Документация R Markdown о рабочих процессах неконтролируемого и контролируемого анализа доступна по адресу http://parametric.tamu.edu/research/Onel_etAl_2019_Rmarkdown.html Данные GC-MS, GCxGC-FID и IM-MS Concawe и данные ГХ-МС образцов SRM можно загрузить с http://paroc.tamu.edu/Software/Onel_etAl_2019_data.zip.
Финансирование: Исследование финансировалось U.Грант P42 ES027704 Национального института здравоохранения США (NIH) (лауреат: доктор Иван Русин) и Техасский энергетический институт A&M. Содержание этой публикации не обязательно отражает официальную точку зрения NIH. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
1. Введение
Продукты нефтепереработки представляют собой прототипы веществ UVCB (неизвестного или переменного состава, сложных продуктов реакции и биологических материалов) [1].UVCB являются одними из самых сложных веществ для промышленности и регулирующих органов, потому что существует несколько установленных рамок для оценки UVCB в рамках текущей политики регулирования химических веществ и обеспечения того, чтобы не было недооценки опасности ни для рабочих, ни для обычных пользователей конечной продукции [ 2]. Действительно, сложность химического состава нефтяных веществ [3, 4] и, в частности, их многокомпонентный характер и изменчивость в составе продуктов, основанная на изменчивости запасов сырой нефти, представляет собой уникальные проблемы для регулирующих органов и лиц, регистрирующих эти вещества. [5].
Как правило, отдельные вещества UVCB классифицируются в категории продукта на основе производственных процессов, физических / химических свойств (включая историю переработки и диапазоны точек кипения / углеродного числа) и ограниченной аналитической химической информации (например, классы углеводородов) [1, 2 ]. Однако регулирующие органы не всегда могут считать такие широкие параметры сходства достаточными, и необходимы новые подходы для облегчения группировки UVCB [6]. Последние разработки в области высокоразрешающих и многомерных аналитических методов улучшают характеристики сложных веществ, обеспечивая более высокое разрешение их химического состава [7, 8].Несмотря на эти достижения, полная химическая характеристика сложных веществ, таких как вещества UVCB нефти, все еще в значительной степени недостижима [6]. Это представляет проблему для определения «достаточного сходства» интересующего вещества по сравнению с теми веществами, которые, возможно, уже были протестированы на предмет их потенциального воздействия на человека и окружающую среду [9, 10].
Для быстрого профилирования химического состава проб окружающей среды и ультрафиолетовых лучей можно использовать различные аналитические методы, и все они позволяют получать сложные многомерные наборы данных [6, 11].Количественная интерпретация многомерных данных была активной областью статистики, и ряд алгоритмов был применен для классификации неизвестных выборок или для получения отличительных признаков данных [8, 12]. Например, методы интеграции данных, кластеризации и визуализации с использованием данных масс-спектрометрии ионной подвижности (IM-MS) подмножества UVCB были использованы для определения групповых сходств [13]. Также был проведен сравнительный анализ. Например, де Карвальо Роша, Шанц [14] использовали анализ основных компонентов (MPCA), анализ основных факторов (PARAFAC) и анализ самоорганизующихся карт (SOM), чтобы различать различные типы топлива посредством распознавания образов.Хотя SOM дает визуально привлекательные карты группировки (рис. 1), сравнительная оценка для определения оптимальной группировки является сложной задачей [15, 16]. Дополнительные методы анализа распознавания образов [1, 17–19] также были исследованы для интерпретации образов в сложных наборах данных; однако результаты этих методов в основном качественные по своей природе и основываются на субъективной визуальной оценке результатов группировки, а не на количественных сравнительных показателях.
Работа, представленная в этой рукописи, направлена на устранение разрыва между количественной оценкой и визуальной коммуникацией результатов группового анализа для поиска оптимальной группировки сложных веществ.В этом исследовании мы представляем основанную на данных структуру, которая включает два отдельных рабочих процесса для группировки сложных химических веществ. Во-первых, мы представляем рабочий процесс неконтролируемого анализа данных, основанный на иерархической кластеризации, где результаты демонстрируются с помощью дендрограмм, а качество группировки оценивается по существующим производственным классам с использованием индекса Фаулкса-Мальлоу (F-M). Во-вторых, мы используем контролируемый анализ. Мы применили алгоритм случайного леса для обучения моделей классификации прогнозированию информации о производственных категориях этих веществ.Общая предпосылка предлагаемой структуры состоит в том, чтобы обеспечить (i) оптимальную группировку сложных веществ, (ii) улучшенную интерпретацию результатов группировки для лиц, принимающих решения с использованием методов визуализации и идентификации наиболее информативных характеристик, и (iii) сравнительная оценка результатов группировки путем предоставления количественных показателей (например, индекса Фаулкса-Маллоуз для кластеризации и точности для анализа классификации).
2. Материалы и методы
2.1. Материалы
В этом исследовании мы использовали два различных набора эталонных данных аналитической химии: (i) 3 повтора 20 стандартных стандартных образцов (SRM) (Таблица 1), и (ii) несколько нефтесодержащих веществ UVCB, которые были предоставлены Европейской Ассоциация нефтепереработчиков AISBL, подразделение Concawe (Брюссель, Бельгия) и именуется «нефтяные образцы UVCB» (Таблица 2). В частности, SRM — это сертифицированные стандартные образцы, связанные с нефтью, которые предоставляются Национальным институтом стандартов и технологий (NIST) [14].Напротив, пробы UVCB нефти были получены в результате трех отдельных процессов очистки и классифицированы как газойли прямой перегонки (SRGO), другие газойли (OGO) и газойли вакуумной и гидроочищенной очистки (VHGO). Стандарты полициклических ароматических углеводородов (ПАУ), насыщенных углеводородов и сырой нефти были предоставлены Техасской группой геохимических и экологических исследований A&M (GERG) (Колледж-Стейшн, Техас).
2.2. Химическая дактилоскопия и обработка экспериментальных данных
Профиль аналитической химии SRM был получен с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС) [14], тогда как химический отпечаток веществ UVCB нефти был оценен с помощью 3 различных методов аналитической химии: (i) комплексная двухмерная газовая хроматография. с пламенно-ионизационным детектором (GC × GC-FID), (ii) GC-MS и (iii) масс-спектрометрии ионной подвижности (IM-MS).Подробная экспериментальная процедура представлена в Фергюсоне [20].
Данные ГХ-МС от de Carvalho Rocha, Schantz (14) представляют собой трехмерный массив, который состоит из 23 248 значений времени элюирования и 301 массы в масс-спектрах 60 стандартных стандартных образцов (трижды по 20 образцов). Чтобы уменьшить вычислительную сложность группового анализа и шума в данных ГХ-МС, мы выбрали 55 из 301 значений m / z (т.е. аналиты), которые соответствуют полициклическим ароматическим углеводородам (ПАУ) (таблица S1), и суммированы по полное измерение времени элюирования.Это дает двумерный массив (60 × 55), который затем используется для группового анализа.
2.3. Фреймворк для анализа и визуализации данных
Мы использовали два рабочих процесса анализа для группировки сложных веществ (рис. 2). В неконтролируемом анализе сложные вещества группируются на основе сходства между характеристиками (т. Е. Аналитическими химическими профилями) образцов (сложных веществ) без предварительного знания этикеток или категорий образцов. Чтобы оценить результат такой группировки, мы включили количественный показатель в рабочий процесс неконтролируемого анализа, чтобы сравнить результат с ранее сообщенной категоризацией образцов (т.е. производственные классы). Подробности предлагаемого рабочего процесса неконтролируемого анализа описаны в Разделе 2.3.2. В контролируемом анализе известные классификации / классы образцов используются для построения моделей классификации, которые затем могут использоваться для прогнозирования класса неизвестного вещества. Эта идея основана на сквозном прочтении, где похожие сложные вещества, сгруппированные вместе в соответствии с их физическими / химическими свойствами, могут иметь аналогичные эффекты [2]. Подробности предлагаемого рабочего процесса неконтролируемого анализа описаны в Разделе 2.3.3. Независимо от того, какой рабочий процесс (неконтролируемый или контролируемый анализ), начальным общим шагом является предварительная обработка данных, которая имеет решающее значение для получения устойчивых и надежных моделей группирования (раздел 2.3.1).
2.3.1. Предварительная обработка данных.
Этапы предварительной обработки данных включают (i) форматирование данных, (ii) обработку недостающих данных и (iii) очистку и масштабирование данных. Выполнение этих шагов обеспечивает качество данных для построения надежных и надежных моделей. Применение этих шагов к каждому конкретному набору данных представлено ниже.
Сначала необходимо было развернуть трехмерные данные аналитической химии (наборы данных ГХ × ГХ-ПИД, ГХ-МС и ИМ-МС) в 2-мерную матрицу. Данные ГХ-МС SRM после этапа обработки экспериментальных данных, описанного в разделе 2.2, уже являются двумерными. Разворачивание было выполнено таким образом, чтобы для окончательной матрицы строки соответствовали сложным веществам, а столбцы — аналитическим характеристикам (измерениям), которые представляют собой сцепленные значения числа атомов углерода и состава молекулярного класса.Этот процесс дал размер массива 15 × 310 для GC × GC-FID, 15 × 248 для GC-MS и 15 × 403 для наборов данных IM-MS образцов Petroleum UVCB.
Затем были исследованы двухмерные наборы данных аналитической химии для обнаружения любых недостающих точек. Хотя передовые методы обработки недостающих данных иногда используются в комплексном анализе данных [21], здесь недостающие точки данных в профилях аналитической химии указывают на необнаруженный химический состав для определенного молекулярного класса. Таким образом, мы заменили соответствующие отсутствующие поля нулями.
Наборы данных были дополнительно очищены путем удаления столбцов (количество атомов углерода — состав молекулярного класса), если они показывают незначительные изменения. Здесь мы удалили столбцы со стандартным отклонением (SD) 0 или SD <0,05 для меньшего набора данных Petroleum UVCB. Этот шаг уменьшил количество функций в GC × GC-FID с 310 до 192, GC-MS с 248 до 62 и данных IM-MS с 403 до 68. Этот шаг не исключил никаких измерений из матрицы 60 x 55 Образцы SRM.
Последний шаг перед анализом данных — это масштабирование наборов данных.Чистые двумерные массивы были масштабированы с помощью построчного масштабирования минимум-максимум, где каждая строка соответствует новому образцу, а каждый столбец представляет собой новую аналитическую функцию. Каждое значение строки масштабировалось путем вычитания минимального значения этой строки и последующего деления его на диапазон соответствующей строки. Построчное масштабирование не выполнялось для наборов данных Petroleum UVCB, потому что данные уже были предварительно обработаны в программе PetroOrg [22] и масштабированы по строкам. Перед классификационным анализом мы также выполнили построчное масштабирование от минимума до максимума массивов данных с построчным масштабированием.Этот дополнительный шаг масштабирования необходим, чтобы гарантировать, что каждое измерение имеет примерно равный вес в моделях классификации обучения.
2.3.2. Рабочий процесс неконтролируемого анализа.
Неконтролируемый анализ исследует шаблоны данных, чтобы сделать выводы о структуре группирования выборок без справочной информации о категоризации. Двумя наиболее распространенными методами неконтролируемого анализа, используемыми в литературе, являются кластерный анализ [23], используемый в нашем рабочем процессе (рис. 2, левая панель), и SOM [24].Подробные шаги этого рабочего процесса приведены ниже. Документация R Markdown по этому анализу для образцов SRM также представлена в дополнительном материале (текст S1).
В рамках неконтролируемого рабочего процесса мы выполнили кластерный анализ с использованием данных, как описано, а также после создания набора данных с пониженным рангом, чтобы оценить эффект от использования данных с пониженным рангом (т. Е. После «уменьшения шума» данных ). Исходные немасштабированные наборы данных SRM и Petroleum UVCB были линейно масштабированы и центрированы по строкам (т.е. нормализация z-показателя). Затем полученные данные были разложены с использованием разложения по сингулярным значениям (SVD) [25, 26] в R для получения набора данных с пониженным рангом, соответствующего 85% вариации исходных данных.
корреляции Пирсона как исходных, так и аналитических данных химического анализа с пониженным рангом были использованы в качестве индекса сходства для иерархического кластерного анализа образцов с использованием hclust в R со средней связью [27, 28].
Количественное сравнение кластеризации с известными категориями веществ (рассматриваемых здесь как «золотой стандарт») было выполнено с использованием индекса Фаулкса-Маллоуз (F-M) [29].Индекс F-M традиционно используется для сравнения двух дендрограмм, но также может использоваться для сравнения одной дендрограммы с фиксированной категоризацией. Мы создали два набора дендрограмм иерархической кластеризации для образцов Petroleum UVCB и SRM. Сначала была создана искусственная дендрограмма путем вычисления евклидова расстояния между индексами (0/1) эталонной категоризации. Во-вторых, корреляционные матрицы образцов Petroleum UVCB и SRM использовались для создания дендрограммы. Затем обе дендрограммы были разрезаны на известное количество производственных классов (т.е.е. 3 для образцов Petroleum UVCB и 3, 9 или 16 для образцов SRM) для оценки количества общих сложных веществ в полученных кластерах. Это число затем использовалось для расчета индекса F-M для двух групп (т. Е. Сравнения известной категоризации с группировкой на основе данных). Индекс F-M можно выразить как среднее геометрическое для точности и полноты, двух показателей машинного обучения, которые широко используются в моделировании на основе данных [23]. Выражаясь математически, мы имеем где TP — истинно положительное, FP — ложноположительное, а FN — ложноотрицательное.TP указывает количество сложных веществ, которые сгруппированы в категорию A с точки зрения производственной категории, а также сгруппированы в категорию A с точки зрения профиля аналитической химии. Напротив, FP и FN обозначают количество сложных веществ, которые сгруппированы по-разному. Индекс F-M варьируется от 0 до 1, где 0 указывает на отсутствие какого-либо сходства, а 1 указывает на 100% идентичность между эталонной категоризацией и результатами кластеризации. Более подробную информацию об индексе F-M и других показателях для сравнения кластеризации можно найти в Wagner & Wagner [30].Индекс F-M рассчитывался с помощью функции FM_index пакета dendextend в R.
.Чтобы проверить статистическую значимость результатов группировки, мы также рассчитали распределение индекса F-M при нулевой гипотезе об отсутствии связи между двумя дендрограммами кластеризации. Это нулевое распределение было создано путем перетасовки групповых меток выборок с использованием 1000 перестановок с эмпирическим значением p , определяемым долей переставленных значений индекса F-M, превышающих наблюдаемые.В качестве порога ложного срабатывания мы использовали α = 0,05. Расчет нулевого индекса F-M с 1000 перестановками групповых меток был выполнен с помощью функции Bk_permutations пакета dendextend в R.
2.3.3. Контролируемый рабочий процесс анализа.
Хотя неконтролируемый анализ может выявить ранее неизвестные структуры данных, контролируемые методы могут выявить особенности, наиболее важные для классификации. Более того, в этом контексте контролируемый анализ может выявить вещества, которые показывают сравнительно плохое сходство с другими членами производственной категории.Алгоритмы обучения с учителем широко используются в различных инженерных и научных задачах [31–40]. Здесь мы использовали алгоритм дерева решений случайного леса [41] для обучения моделей прогнозированию производственной категории по характеристикам. Модели были оценены по точности их классификации, а результаты были визуализированы через представление ToxPi [42] для расширенной интерпретации (рис. 2 справа). Шаги предлагаемого рабочего процесса контролируемого анализа представлены ниже и применяются к наборам данных Petroleum UVCB и SRM.Документация по анализу образцов SRM была создана с использованием R Markdown и представлена в дополнительном материале (текст S1).
В нашей реализации случайных лесов количество аналитических функций было настроено с помощью поиска по сетке с использованием функции trainControl пакета каретки в R, где обучение каждой модели выполнялось с использованием перекрестной проверки с исключением по одному с 500 деревьями решений. Затем окончательный классификатор случайного леса был построен на всем наборе данных с 500 деревьями решений, где каждое дерево моделировалось с использованием оптимального количества аналитических функций.Кроме того, ранжирование аналитических признаков было получено путем расчета среднего снижения точности классификации среди 500 деревьев решений. Этот анализ был выполнен с помощью функции randomForest пакета randomForest.
Чтобы оценить точность модели классификации, начальным шагом было извлечение матрицы неточностей модели, то есть количества истинных и ошибочно предсказанных выборок для каждого класса. Затем была рассчитана точность классификации, которая представляет собой процент истинного предсказанного количества выборок из всех классов по отношению к общему количеству выборок.
В дополнение к количественной оценке классификационных моделей, мы составили профили индекса токсикологической приоритетности (ToxPi) сложных веществ, используя ранжированный список аналитических характеристик из классификационного анализа [42–44]. За счет интеграции нескольких источников данных в общую оценку веса доказательств и преобразования их в четкие визуальные рейтинги, ToxPi обеспечивает эффективный способ визуальной коммуникации многомерных наборов данных. Здесь мы интегрировали 10 самых информативных хроматографических характеристик, которые были извлечены на этапе моделирования классификации, чтобы получить визуализацию ToxPi сложных веществ.
3. Результаты и обсуждение
3.1. Количественная оценка неконтролируемого анализа
Недавнее исследование [14] показало, что ГХ-МС в сочетании с неконтролируемым хемометрическим анализом можно использовать для дифференциации сложных веществ и смесей. Авторы пришли к выводу, что нелинейный метод SOM оказался эффективным при создании модели разделения. Однако модель сложнее интерпретировать, чем линейные модели, такие как MPCA и PARAFAC [45, 46]. Унифицированная матрица расстояний SOM-анализа 20 SRM (таблица 1) от de Carvalho Rocha, Schantz (14) показана на рисунке 1.Визуализация данных с помощью SOM делает очевидным, что реплики одного и того же образца были хорошо сгруппированы (15 из 20 образцов имеют все 3 реплики в непосредственной близости друг от друга) (рис. 1). Однако менее очевидно, что анализ SOM может различать более широкие категории образцов (3 класса: сырая нефть, тяжелые и легкие продукты нефтепереработки; 9 классов: сырая нефть, мазут, газойль, моторное масло, биодизели, дизели. , бензины, керосины и реактивное топливо). Только образцы реактивного топлива и бензина из легких продуктов нефтепереработки сгруппированы близко друг к другу (рис. 1).
Для изучения дополнительных методов визуализации мы использовали данные de Carvalho Rocha, Schantz (14) для выполнения неконтролируемого кластерного анализа образцов (рис. 3). Результаты показали, что все технические реплики 20 веществ были плотно сгруппированы, что указывает на высокую воспроизводимость аналитических данных ГХ-МС анализа этих сложных веществ. Однако, когда рассматривались 3 или 9 более широких производственных классов, образцы не были сгруппированы так близко, как они были в 16 производственных классах.Для группировки по 9 классам повторяющиеся образцы газойлей, биодизельного топлива и моторных масел были сгруппированы в отдельные кластеры. В результатах группировки по 3 классам только пробы сырой нефти были сгруппированы в одну из трех групп. Несмотря на то, что большинство легких продуктов нефтепереработки (один бензин, три образца дизельного топлива, два реактивного топлива и два образца керосина) были сгруппированы вместе в одну из трех групп, один образец бензина и два образца биодизеля попадают в отдельные кластеры (рис. 3). Эти анализы продемонстрировали, что аналитические характеристики, полученные с помощью ГХ-МС, сами по себе недостаточны для обоснования объединения этих сложных веществ в производственные категории.
Затем мы стремились количественно сравнить результаты SOM и кластерного анализа с категориями производственных классов этих образцов. Мы использовали индекс Фаулкса-Маллоуз (F-M), чтобы обеспечить количественный показатель для таких сравнений [29]. Хотя прямого метода оценки качества группировки с помощью анализа SOM не существует, мы извлекли координаты x и y каждого образца SRM на карте SOM, как сообщили де Карвальо Роша, Шанц (14) (рис. 1), и использовали Матрица сходства на основе евклидова расстояния для получения индекса FM для анализа группировки на основе SOM.Индекс F-M также использовался для оценки влияния уменьшения размерности на результаты кластерного анализа.
На рис. 4 показаны индексы F-M для анализа на основе SOM, а также представленный рабочий процесс неконтролируемого анализа для полного набора данных из 55 функций GC-MS и сокращенного набора из 7 функций после SVD. Также приводятся значения p- для значимости соответствия кластеризации по сравнению с известным назначением класса (рис. 4). Значения p- , полученные для 3-классной группировки, были выше 0.05 для основанного на SOM и исходного набора данных образцов SRM, подразумевая, что эти результаты не были статистически значимыми. Небольшие различия делят эти материалы на 16 категорий. Когда эти различия были сгруппированы по трем категориям, они представляли собой шум. Следовательно, случайная перестановка этих выборок случайно привела к более высоким показателям F-M. Напротив, значения p- для группировки из 3 классов с сокращенными наборами данных были ниже 0,05. Это свидетельствует о том, что уменьшение размерности устраняет избыточные аналитические функции из наборов данных (с 55 до 7), что дополнительно снижает шум, приводя к статистически значимым результатам с аналогичным (и немного улучшенным) индексом F-M.
Основываясь на группировке SRM по 9 и 16 классам, можно четко заметить, что иерархическая кластеризация превосходит анализ SOM. Индекс F-M увеличился с 0,33 до 0,44 и с 0,42 до 0,57 для групп 9 и 16 классов соответственно. Хотя уменьшение размерности не привело к дальнейшему увеличению индекса F-M для групп 9 и 16 классов, оно также не повлияло на качество группировки и обеспечило одинаково хорошие результаты с меньшими числовыми характеристиками (7 из 55).
3.2. Важность размера пробы вещества при проведении контролируемого анализа
Здесь мы получаем выгоду от сквозной гипотезы о том, что «сложные вещества, которые группируются одинаково в зависимости от производства, могут иметь схожие профили опасности», и переходим от неконтролируемого анализа к контролируемому.С этой целью мы строим классификационные модели, используя аналитические химические профили образцов. Для каждого из 20 веществ SRM ГХ-МС была проведена три раза, что сделало окончательный набор данных ГХ-МС больше с точки зрения количества образцов. Таким образом, интересный вопрос, который мы можем изучить, заключается в том, сколько реплик образцов будет достаточно для разработки моделей, управляемых данными, которые могут точно различать шаблоны классов.
На рис. 5 и 6 показаны матрицы неточностей, полученные с помощью обученных классификаторов случайного леса.Эти матрицы сообщают известные («истинные») и предсказанные (с помощью обученного классификатора случайного леса) классы для каждой выборки SRM. Результаты показали, что мы достигли 100% точности классификации, когда использовали все реплики, представленные в таблице 1 (таблица 3, рисунок 5). Точность классификации снизилась до 65%, 35% и 15% для групп из 3, 9 и 16 классов, когда мы использовали только 1 из 3 повторов (Таблица 3, Рис. 6). Основная причина этого заключается в том, что количество выборок в группе уменьшается с увеличением количества классов.В частности, 14 из 16 классов были представлены только одной выборкой во время обучения модели для прогнозов из 16 классов (рис. 6C). Точно так же 5 из 9 классов были представлены только одной выборкой во время обучения модели для прогнозов 9 классов (рис. 6B). Это уменьшение количества информации на класс значительно усложняет обучение модели (Таблица 3). Следовательно, мы можем сделать вывод, что единичная выборка для каждого класса не дает адекватной информации для отражения индивидуальных характеристик класса.Более того, многомерный характер данных ГХ-МС с 55 характеристиками еще больше затруднял точность классификации материалов SRM при использовании только одного образца на категорию. Тем не менее, точность предсказаний классификаторов для каждого анализа была выше, чем у случайных предсказаний, что указывает на их статистическую значимость (таблица 3). Это было подтверждено расчетами значений p с использованием исходных результатов и результатов группирования 1000 случайных перестановок (таблица 3). Матрицы неточности, сгенерированные из среднего значения 1000 перестановок выборок SRM, представлены на фиг. S1 и фиг. S2 для 3 и 1 повторов, соответственно.
Аналогичная тенденция наблюдалась с образцами Petroleum UVCB, где мы построили классификационные модели, используя только 1 копию каждого образца (Таблица 4, S3 Рис). Результаты показали, что точность модели классификации для образцов Petroleum UVCB была неудовлетворительной, когда единственный статистически значимый результат был получен на основе данных IM-MS с точностью классификации 60%. Следовательно, чтобы построить точную классификационную модель, нам нужно большее количество экспериментальных реплик для каждого конкретного сложного вещества, чтобы уловить и изучить нелинейные характеристики их химической сложности.Хотя кластеризация может сгруппировать выборки точно независимо от размера выборки, учитывая, что измерения существенно отличаются друг от друга, достаточный размер выборки данных имеет важное значение во время построения классификационной модели. Тем не менее, каждая экспериментальная копия требует дополнительных затрат и требует дополнительного времени и ресурсов. Таким образом, минимизация количества повторений образцов при достижении точных прогнозирующих классификаторов имеет первостепенное значение. В этой работе мы заметили, что, учитывая высокое качество данных аналитической химии, трех повторов было достаточно для создания точных и надежных классификаторов.Важно отметить, что размер выборки имеет решающее значение на этапе обучения модели, когда модели выигрывают от большего количества выборок. Однако это не относится к фазе тестирования, когда одного эксперимента достаточно, чтобы предсказать информацию о его классе неизвестного сложного вещества.
3.3. Важность соотношения количества вещества к классу при проведении контролируемого анализа
Еще один важный вопрос, на который необходимо ответить, заключается в следующем: как точно мы можем классифицировать новое, неизвестное вещество с помощью модели, управляемой данными, которая обучена с помощью базы данных аналитического химического профиля категоризированных веществ без предварительно маркированных образцов протестированных вещество? Гипотетически можно точно классифицировать неизвестное вещество, если у него есть классификатор, обученный работе с базой данных профиля аналитической химии, которая включает большое количество веществ в каждом классе.Другими словами, новое вещество может быть точно маркировано, если база данных аналитического химического профиля предоставляет точный средний профиль определенных классов. Здесь мы использовали 20 веществ SRM, чтобы понять, может ли соотношение количества веществ к классам в наборе данных обеспечить точную категоризацию каждого вещества SRM. С этой целью мы разработали одну модель классификации случайного леса для каждого из 20 веществ SRM и сообщили об общей точности классификации. В частности, мы исключили информацию о аналитическом химическом профиле из всех 3 повторов выбранного вещества SRM во время обучения модели, а затем спрогнозировали категорию с помощью обученной модели.
Для прогнозов 3 классов точность классификации была получена как 75% (таблица 5), где матрицы неточностей для исходных и средних значений 1000 перестановок меток групп веществ SRM представлены на рис. S4. Однако вычисленное значение p — Значение (Таблица 5) показало, что разработанные модели, основанные на данных, были статистически незначимыми, что мы связываем с низким соотношением количества веществ к классам. Это соотношение ухудшается по мере увеличения количества категорий для 20 веществ SRM.В качестве подтверждения наших наблюдений мы также запустили случайную модель леса, в которой рассчитали средний профиль признаков для каждого вещества, свернув реплики в один искусственный вектор признаков. Полученная точность классификации была очень похожей (в диапазоне 70% -75%, не показано).
В таблицеS2 приводится количество веществ и дубликатов образцов для каждого класса для классификации по 3, 9 и 16 классам. Как видно из таблицы S2, удаление всех 3-х повторений вещества часто соответствует удалению всех образцов класса в нескольких случаях анализа 9-го и 16-го классов, что мешает нам разработать классификационные модели для 2 (Категория 4 и 7) и 14 категорий (исключая только Категории 6 и 15) для анализа 9 и 16 классов соответственно.Следовательно, мы не можем сообщить об общей точности классификации для анализа по 9 и 16 классам. Эти результаты показывают, что высокое значение отношения вещества к классу имеет решающее значение для точной классификации неизвестного вещества с помощью моделей на основе данных, которые обучаются без каких-либо предыдущих образцов тестируемого вещества. Таким образом, мы делаем вывод, что (i) постоянное совершенствование базы данных аналитического химического профиля, используемой для обучения модели, с добавлением категоризированных веществ для каждого класса, и (ii) постоянное обновление модели, управляемой данными, является важным и необходимым для точной категоризации новое, неизвестное вещество.
3.4. Облегчение интерпретации данных через представление ToxPi
В дополнение к разработке высокоточных моделей классификаторов для прогнозирования информации о группе / классе неизвестного сложного вещества с использованием реплик образцов категоризированных веществ, мы также сообщили о 10 наиболее информативных характеристиках, которые четко идентифицируют образцы классов материалов SRM (Таблица 6) . Эти информативные функции помогают нам облегчить визуальную передачу результатов с помощью визуализации ToxPi, как показано на рис. 7.
Таблица 6. 10 самых информативных хроматографических характеристик ГХ-МС в отношении точности классификации нефтяных веществ.
См. Таблицы S3 – S5 для получения списка всех хроматографических характеристик и их соответствующих рангов в каждом анализе.
https://doi.org/10.1371/journal.pone.0223517.t006
Профили ToxPi образцов SRM успешно продемонстрировали различную природу газовых / моторных масел, биодизеля и сырой нефти (за исключением SRM 2722) с по отношению к остальным SRM.В частности, для сырой нефти все 10 основных хроматографических характеристик помогли идентифицировать сырую нефть среди SRM. Что касается газа / моторных масел, профили выявили важность C2-нафтобензотиофенов для дальнейшей идентификации между ними. Более того, профили ToxPi показали, что измерения C3-фенантрен / антрацен, C2-нафтобензотиофена и бензотиофена являются характеристиками образцов биодизеля и могут отличать их от остальных SRM. Мы также наблюдали большое сходство между подгруппой легких продуктов нефтепереработки, включающей реактивное топливо, керосины и бензины, где вес бензотиофена оставался уникальной характеристикой среди всех них.Это доказывает, что данные ГХ-МС не могли дать четкого различия между этими веществами. Наконец, мы отметили существенное различие между образцами дизельного топлива. В отличие от двух других образцов дизельного топлива, SRM 2723b и SRM 2771, большинство из 10 выбранных аналитических характеристик были важны для идентификации SRM 1624d. В частности, дибензотиофен, C1-дибензотиофены и C4-нафталины были отдельными измерениями, которые больше всего отличают SRM 1624d от остальных SRM. Кроме того, PCA извлеченных баллов ToxPi помогает нам описать различие между сложными веществами, используя наиболее информативную аналитическую информацию о характеристиках (рис. 8).
3,5. Сравнение методов ГХ × ГХ-ПИД, ГХ-МС и ИМ-МС с помощью индекса Фаулкса-Маллоуса
В дополнение к количественной оценке качества группировки и информации о классах, необходимо изучить соответствующий метод аналитической химии, который обеспечивает оптимальное группирование для веществ со сложным химическим составом. В большинстве нормативных и стандартизированных протоколов анализа химического состава ГХ-МС используется в качестве предпочтительного инструмента для определения УФХБ-веществ.Как правило, в приборе ГХ-МС используется капиллярная колонка, нагретая термостатом при заданном градиенте температуры для разделения соединений по температуре кипения и полярности. Затем элюирующие соединения ионизируются и анализируются детектором. Поскольку молекулы определенных молекулярных классов сохраняют различные модели разрушения ионов по массе, ГХ-МС может различать ионные сигналы от нескольких соединений. Однако пиковая емкость колонки ГХ-МС может быть перегружена, вызывая скачок базовой линии, называемый неразрешенной сложной смесью (UCM).В таких случаях колонка больше не имеет разрешающей способности для разделения всех соединений в образце, что обычно наблюдается при анализе нефтяных веществ, поскольку отдельное нефтяное вещество содержит более 10 000 различных химических соединений. Это может ограничить количество молекул, которые могут быть эффективно дифференцированы прибором, и затруднить получение надежных химических отпечатков пальцев.
Однако в последние годы разрешающая способность и чувствительность прибора увеличились, что позволяет более детально характеризовать сложные вещества.Включение двух колонок для газовой хроматографии с разной селективностью (GC × GC-FID) увеличивает пиковую емкость прибора и позволяет улучшить разделение молекул, которые образуют UCM при анализе GC-MS. Кроме того, масс-спектрометрия ионной подвижности (IM-MS) включает уникальные методы ионизации, электронное распыление (ESI) или атмосферную фотоионизацию (APPI), а также методы разделения на основе размера, формы и заряда ионизированной молекулы. Это дополнительно увеличивает аналитическую чувствительность и позволяет улучшить химическое снятие отпечатков пальцев.Хотя эти два метода дополнительно повышают способность характеризовать сложные вещества, такие как нефтепродукты, их применение все еще ново и не широко изучено в научных, регулирующих или промышленных сообществах [14, 47]. Несмотря на технологические достижения, представленные методами ГХ-ГХ-ПИД и ИМ-МС по сравнению с ГХ-МС, нет никаких доказательств, исследующих какие-либо потенциальные улучшения в отношении сложной группировки веществ. Поэтому мы использовали индекс Фаулкса-Мэллоуз для проведения сравнительной оценки этих трех методов аналитической химии с использованием образцов Petroleum UVCB.
Рис. 9 демонстрирует, что ГХ × ГХ-ПИД и ГХ-МС дали статистически незначимые показатели F-M из-за ограниченного размера выборки. IM-MS был единственным методом, дающим статистически значимые результаты только после уменьшения размерности, который предоставил наиболее полезную информацию для выявления различий в классах между образцами Petroleum UVCB. Соответствующие им дендрограммы кластеризации представлены на рис. 10. В частности, индекс F-M группировки образцов Petroleum UVCB с 8 признаками, созданными с помощью техники IM-MS, был равен 0.49. Хотя мы не смогли сделать конкретных выводов по ГХ × ГХ-ПИД и ГХ-МС, мы можем сообщить, что ИМ-МС показал лучшие характеристики, чем два других метода, с точки зрения определения химических характеристик сложных веществ.
4. Заключение
В этом исследовании мы создали основанную на данных основу для оптимального группирования сложных химических веществ на основе их химических характеристик и предоставили количественную и визуальную оценку, чтобы облегчить интерпретацию сложной химической природы веществ / смесей.Разработанная структура состоит из двух рабочих процессов анализа с двумя разными точками зрения. В процессе неконтролируемого анализа мы исследовали группировку сложных веществ, используя их химические отпечатки пальцев, полученные с помощью различных аналитических методов, и количественно сравнили иерархию группирования с эталонной категоризацией с помощью индекса F-M. Напротив, в рабочем процессе контролируемого анализа мы извлекли выгоду из гипотезы «сквозного чтения», то есть аналогичные сложные вещества, сгруппированные вместе на основе их химической структуры (т. Е.е. категории производства) склонны вести себя аналогичным образом с точки зрения оценки риска для здоровья, связанного с окружающей средой. Следовательно, мы можем обучать высокоточные классификационные модели, используя имеющуюся информацию о классификации известных сложных веществ. Сгенерированные модели затем можно использовать для прогнозирования воздействия неизвестных сложных веществ на окружающую среду в будущем. Общей особенностью обоих рабочих процессов были количественные показатели, которые значительно облегчили сравнительную оценку различных параметров, таких как различные аналитические методы, размеры наборов данных или разное количество категоризации образцов для выяснения оптимальной группировки сложных веществ.Кроме того, мы включили представление ToxPi сложных веществ с наиболее информативными аналитическими функциями, чтобы получить дополнительную информацию на основе разработанных моделей классификации на основе данных.
Наши результаты показали, что для оценки статистической значимости результатов группировки очень важно переставлять метки категорий сложных веществ и рассчитывать значение p- для полученных результатов независимо от выбранного рабочего процесса. Кроме того, уменьшение размерности сыграло ключевую роль в уменьшении шума в извлеченных многомерных профилях аналитической химии.Уменьшение размерности позволило получить аналогичное или более высокое качество группировки со значительно уменьшенным количеством измерений. Выбор наиболее информативных функций значительно улучшил интерпретацию данных за счет передовых методов визуализации данных, таких как представление ToxPi. Это еще больше облегчило передачу информации о сложных характеристиках веществ лицам, принимающим решения.
Благодарности
Авторы выражают признательность доктору Р.Терри Л. Уэйду за его ценный вклад.-
Ссылки
- 1. Кларк С.Р., Макки Р.Х., Фриман Дж. Дж., Свик Д., Махагаокар С., Пиграм Дж. И др. Соответствующий СГС подход к классификации нефтяных веществ, относящихся к классу веществ UVCB, по опасности для здоровья. Regul Toxicol Pharmacol. 2013. 67 (3): 409–20. pmid: 24025648.
- 2. Европейское химическое агентство. Система оценки всестороннего чтения (RAAF) — рассмотрение многокомпонентных веществ и UVCB.Хельсинки, Финляндия: Европейское химическое агентство; 2017.
- 3. Редман А.Д., Паркертон Т.Ф. Руководство по повышению сопоставимости и актуальности тестов на токсичность нефти. Mar Pollut Bull. 2015; 98 (1–2): 156–70. pmid: 26162510.
- 4. Gestel CAMv. Токсичность смеси: объединение подходов экологической и человеческой токсикологии. Бока-Ратон: CRC Press; 2011. xxxviii, 280 с. п.
- 5. Димитров С.Д., Георгиева Д.Г., Павлов Т.С., Караколев Ю.Х., Карамерцанис П.Г., Расенберг М. и др.Вещества UVCB: методология структурного описания и применения для оценки судьбы и опасности. Environ Toxicol Chem. 2015. 34 (11): 2450–62. pmid: 26053589.
- 6. КОНКАВЕ. REACH — Аналитическая характеристика веществ UVCB нефти. Брюссель, Бельгия: Номер контракта 2012: № 7/12.
- 7. Белл М., Блейс Дж. М.. Рабочий процесс «-Омикс» для палеолимнологических и геологических архивов: обзор. Sci Total Environ. 2019; 672: 438–55. Epub 2019/04/10. pmid: 30965259.
- 8. Чо Й, Ахмед А., Ислам А., Ким С. Развитие приборов FT-ICR MS, методов ионизации и методов интерпретации данных для петролеомики. Масс-спектром. Ред. 2015; 34 (2): 248–63. Epub 2014/06/20. pmid: 24942384.
- 9. Катлин Н.Р., Коллинз Б.Дж., Ауэрбах С.С., Фергюсон С.С., Харнли Дж. М., Геннингс С. и др. Насколько похоже достаточно похоже? Пример достаточного сходства с экстрактом гинкго билоба. Food Chem Toxicol. 2018; 118: 328–39. Epub 2018/05/13.pmid: 29752982.
- 10. Гримм Ф.А., Рассел В.К., Луо Ю.С., Ивата Й., Чиу В.А., Рой Т. и др. Группирование нефтяных веществ в качестве примера UVCB методом масс-спектрометрии ионной подвижности для обеспечения возможности считывания на основе химического состава. Экологическая наука и технологии. 2017; 51 (12): 7197–207. pmid: 28502166.
- 11. Маршалл А.Г., Роджерс Р.П. Петролеомика: химия преступного мира. Proc Natl Acad Sci U S. A. 2008; 105 (47): 18090–5. pmid: 18836082; PubMed Central PMCID: PMC2587575.
- 12. Розетт Р.В., Петерсен Э.М. Методы факторного анализа масс-спектров. Anal Chem. 1975. 47 (8): 1301–8.
- 13. Гримм Ф.А., Рассел В.К., Луо Ю.С., Ивата Й., Чиу В.А., Рой Т. и др. Группирование нефтяных веществ в качестве примера UVCB методом масс-спектрометрии ионной подвижности для обеспечения возможности считывания на основе химического состава. Наука об окружающей среде и технологии. 2017; 51 (12): 7197–207. WOS: 000404087400062. pmid: 28502166
- 14. де Карвалью Роча В.Ф., Шанц М.М., Шин Д.А., Чу П.М., Липпа К.А.Неконтролируемая классификация сертифицированных стандартных образцов нефти и других видов топлива путем хемометрического анализа данных газовой хроматографии-масс-спектрометрии. Топливо (лонд.). 2017; 197: 248–58. pmid: 28603295; PubMed Central PMCID: PMC5464420.
- 15. Флексер А. Ограничения самоорганизующихся карт для векторного квантования и многомерного масштабирования. Adv Neur In. 1997; 9: 445–51. WOS: A1997BH93C00063.
- 16. Инь HJ. Связь между самоорганизующимися картами и метрическим многомерным масштабированием.Ieee Ijcnn. 2007: 1025–30. WOS: 0002542179.
- 17. Ранг J. Классификация и оценка риска химических веществ: случай DEHP в свете REACH. Журнал трансдисциплинарных экологических исследований. 2005; 4 (3): 1–15.
- 18. L’Yi S, Ko B, Shin D, Cho YJ, Lee J, Kim B и др. XCluSim: инструмент визуальной аналитики для интерактивного сравнения нескольких результатов кластеризации биоинформатических данных. BMC Bioinformatics. 2015; 16 Приложение 11: S5. pmid: 26328893; PubMed Central PMCID: PMC4547151.
- 19. Филиппова Д., Гадани А., Кингсфорд К. Корал: интегрированный набор визуализаций для сравнения кластеризации. BMC Bioinformatics. 2012; 13: 276. pmid: 23102108; PubMed Central PMCID: PMC3576325.
- 20. Ferguson KC. Характеристика сложных веществ, используемых в биологическом профилировании, путем определения свободной концентрации в анализах in vitro. 2018.
- 21. До К.Т., Валь С., Раффлер Дж., Мольнос С., Лаймигхофер М., Адамски Дж. И др.Характеристика пропущенных значений в нецелевых метаболомических данных на основе MS и оценка стратегий обработки недостающих данных. Метаболомика. 2018; 14 (10): 128. pmid: 30830398; PubMed Central PMCID: PMC6153696.
- 22. PetroOrg Software Таллахасси, Флорида 2014 [13.02.2019]. Доступно по адресу: http://software.Petroorg.com.
- 23. Алпайдин Э. Введение в машинное обучение, 3-е издание. Введение в машинное обучение, 3-е издание. 2014: 1–613. WOS: 000351537500022.
- 24. Кохонен Т. Самоорганизующаяся карта. Труды ИЭЭЭ. 1990. 78 (9): 1464–80. WOS: A1990EC03500004.
- 25. Ванлоан К. Вычисление Cs и обобщенных разложений по сингулярным числам. Numer Math. 1985. 46 (4): 479–91. WOS: A1985ANR4700001.
- 26. Голуб Г.Х., Рейнш К. Разложение по сингулярным числам и решения методом наименьших квадратов. Numer Math. 1970; 14 (5): 403– &. WOS: A1970G000600001.
- 27. Чипман Х., Тибширани Р.Гибридная иерархическая кластеризация с приложениями к данным микрочипов. Биостатистика. 2006. 7 (2): 286–301. WOS: 000236436300009. pmid: 16301308
- 28. Сюй Р., Вунш Д. Обзор алгоритмов кластеризации. Ieee T Neural Networ. 2005. 16 (3): 645–78. WOS: 0002289093. pmid: 15940994
- 29. Фаулкс Э.Б., Мальвас CL. Метод сравнения двух иерархических кластеров. Журнал Американской статистической ассоциации. 1983. 78 (383): 553–69. WOS: A1983RF005.
- 30.Вагнер С. и Доротея Вагнер. Сравнение кластеризации: обзор. Карлсруэ: Universität Karlsruhe, Fakultät für Informatik. 2007.
- 31. Кисар Ч., Макгаффин Л.Дж., Валлнер Б., Чопра Дж., Адхикари Б., Бхаттачарья Д. и др. Анализ и оценка совместной работы WeFold для прогнозирования структуры белка и ее конвейеров в CASP11 и CASP12. Научный доклад 2018; 8 (1): 9939. pmid: 29967418; PubMed Central PMCID: PMC6028396.
- 32. Kieslich CA, Tamamis P, Guzman YA, Onel M, Floudas CA.Высокоточное предсказание использования корецепторов ВИЧ-1 на основе структуры предполагает межмолекулярные взаимодействия, определяющие тропизм. PLoS One. 2016; 11 (2): e0148974. pmid: 26859389; PubMed Central PMCID: PMC4747591.
- 33. Онель М., Бейкал Б., Ван М.К., Гримм Ф.А., Чжоу Л., Райт Ф.А. и др. Оптимальная химическая группировка и дизайн сорбирующего материала с помощью методов анализа данных, моделирования и уменьшения размерности. Comput-Aided Chem En. 2018; 43: 421–6. WOS: 000441374200076.
- 34. Онель М, Кислих CA, Гусман Я., Floudas CA, Pistikopoulos EN.Подход с использованием больших данных к мониторингу пакетного процесса: одновременное обнаружение и диагностика неисправностей с использованием нелинейного опорного вектора на основе машинного выбора функций. Comput Chem Eng. 2018; 115: 46–63. pmid: 30386002; PubMed Central PMCID: PMC6205516.
- 35. Онель М, Кислич К.А., Гусман Я.А., Пистикопулос ЭН. Одновременное обнаружение и идентификация неисправностей в непрерывных процессах с помощью нелинейного выбора функций на основе машины опорных векторов. Int Symp Process Syst Eng. 2018; 44: 2077–82. pmid: 30534633; PubMed Central PMCID: PMC6284809.
- 36. Онель М, Кислих CA, Пистикопулос EN. Подход на основе машинного выбора нелинейных опорных векторов для обнаружения и диагностики неисправностей: приложение к процессу Tennessee Eastman. Журнал Айше. 2019.
- 37. Beykal B, Boukouvala F, Floudas CA, Pistikopoulos EN. Оптимальное проектирование энергетических систем с использованием ограниченной многоцелевой оптимизации серого ящика. Comput Chem Eng. 2018; 116: 488–502. WOS: 000448410000032. pmid: 30546167
- 38.Бейкал Б., Букувала Ф., Флаудас К.А., Сорек Н., Залавадия Х., Гильдин Э. Глобальная оптимизация вычислительных систем «серого ящика» с использованием суррогатных функций и приложений для операций на нефтяных месторождениях с жесткими ограничениями. Comput Chem Eng. 2018; 114: 99–110. WOS: 000439701100009.
- 39. Sorek N, Gildin E, Boukouvala F, Beykal B, Floudas CA. Снижение размерности для оптимизации добычи с использованием полиномиальных приближений. Computat Geosci. 2017; 21 (2): 247–66. WOS: 0003980005.
- 40. Мукерджи Р., Онель М., Бейкал Б., Шафран А.Т., Стосси Ф., Манчини М.А. и др. Разработка вычислительной платформы Texas A&M Superfund Research Program для интеграции, визуализации и анализа данных. Компьютерная химическая инженерия. 46: Эльзевир; 2019. стр. 967–72.
- 41.
Брейман Л. Случайные леса. Mach Learn. 2001. 45 (1): 5–32. WOS: 000170489
1.
- 42. Marvel SW, To K, Гримм FA, Райт FA, Rusyn I, Reif DM. Графический интерфейс пользователя ToxPi 2.0: динамическое исследование, визуализация и совместное использование интегрированных моделей данных. BMC Bioinformatics. 2018; 19 (1): 80. pmid: 29506467; PubMed Central PMCID: PMC5838926.
- 43. Рейф Д.М., Мартин М.Т., Тан С.В., Хаук К.А., Джадсон Р.С., Ричард А.М. и др. Эндокринное профилирование и приоритезация химических веществ в окружающей среде с использованием данных ToxCast. Перспектива здоровья окружающей среды. 2010. 118 (12): 1714–20. pmid: 20826373; PubMed Central PMCID: PMC3002190.
- 44. Рейф Д.М., Сипа М., Лок Э.Ф., Райт Ф.А., Уилсон А., Кэти Т. и др.ToxPi GUI: интерактивный инструмент визуализации для прозрачной интеграции данных из различных источников доказательств. Биоинформатика. 2013. 29 (3): 402–3. pmid: 23202747; PubMed Central PMCID: PMC3988461.
- 45. Братан Р. ПАРАФАК. Учебник и приложения. Хемометр Intell Lab. 1997. 38 (2): 149–71. WOS: A1997Yh29600005.
- 46. Харшман Р.А., Ланди М.Э. Парафак — Параллельный факторный анализ. Расчет статистических данных An. 1994. 18 (1): 39–72. WOS: A1994NY54800004.
- 47.Стаут С.А., Ван З.Д. Методы химического дактилоскопирования и факторы, влияющие на следы нефти в окружающей среде. Стандартное руководство по экологической экспертизе разливов нефти: отпечатки пальцев и идентификация источника, 2-е издание. 2016: 61–129. WOS: 000404774100003.
Сложные вещества. Жесткость воды
Комплексные вещества: водаКомплексные вещества
Сложные вещества — химическое вещество, образованное сочетанием нескольких простых веществ.В нашей экономике мы используем сложные вещества в большей степени и простые вещества в меньшей степени. Соли оксидов, оснований или щелочей, кислот используются нами как комплексные вещества , а также многие органические соединения, такие как спирты, парафины, альдегиды и др.
Вода
| Ваш Waight | Суточная норма |
| 18 кг | 0,5 л |
| 27 кг | 0,75 л |
| 36 кг | 1,0 л |
| 45 кг | 1,25 л |
| 54 кг | 1,5 л |
| 63 кг | 1,75 л |
| 72 кг | 2,0 л |
| 81 кг | 2,25 л |
| 90 кг | 2,5 л |
| 99 кг | 2,75 л |
| 108 кг | 3,0 л |
| 117 кг | 3,25 л |
| 126 кг | 3,5 л |
| 135 кг | 3,75 л |
| 144 кг | 4,0 л |
Вода — сильный растворитель.Как вы думаете, при какой температуре вода больше весит? Наибольшая плотность воды наблюдается при температуре 4 0 ° C, выше и ниже этой температуры плотность постепенно уменьшается. Соответственно, наибольший вес воды составляет 4 0 C.
Вода дистиллированная по вкусу отличается от обычной воды. Это связано с тем, что в обычной воде растворены разные соли, это соли кальция (присутствие этих солей затрудняет образование мыла при стирке), магния (обычно придает воде горечь), а также соли железа, соли щелочных металлов и многие другие вещества.Вода, обогащенная ионами металлов, полезными для организма (но не из-под крана!). Например, калий и магний для работы сердечной мышцы, кальций и железо для свертывания крови, натрий для образования минеральных солей, с щелочной реакцией и способен разлагать органические вещества.
Всем известно, что человеческий организм на 81% состоит из воды и, конечно, постоянно нуждается в пополнении. Следовательно, норма потребления воды организмом человека в зависимости от веса человека:
Жесткость воды
Жесткость воды — определяется наличием в воде катионов кальция (Ca) и магния (Mg).Чем выше количество этих катионов, тем жесткость воды больше . Имеется временной жесткости и постоянной жесткости воды. Временная твердость снимается кипячением. Соли, которые растворяются (гидрокарбонаты кальция и магния Ca (HCO 3 ) 2 , Mg (HCO 3 ) 2 ) легко обесцвечиваются при нагревании до воды и углекислого газа:
Ca (HCO 3 ) 2 → CaCO 3 + H 2 O + CO 2
мг (HCO 3 ) 2 → MgCO 3 + H 2 O + CO 2
Постоянная твердость кипение удалить невозможно.Эта вода содержит соли — сульфаты, хлориды, нитраты, кальций, магний. Но можно попробовать избавиться от постоянной жесткости воды: используйте известковое молоко (гашеная известь — Ca (OH) 2 ) или соду).
Одним из наиболее эффективных способов удаления постоянной жесткости воды является использование ортофосфата натрия (Na 3 PO 4 ). При взаимодействии с водой соли выпадают в воду:
Ca (HCO 3 ) 2 + 2Na 3 PO 4 → Ca 3 (PO 4 ) 2 + 6NaHCO 3
3MgSO 4 + 2Na 3 PO 4 → Mg 3 (PO 4 ) 2 + 3Na 2 SO 4
При закипании жесткой воды на стенах посуды образуется накипь — соли кальция и магния.Они плохо переносят тепло. Если накипи образовалось много, стенки посуды могут перегреться.
При стирке в жесткой воде мыло израсходовалось намного больше. Это связано с тем, что образуются сложные вещества — стеараты кальция и магния (Ca (C 17 H 35 C00) 2 и Mg (C 17 H 35 COO) 2 )
Овощи дольше сохраняются в воде жесткости, потому что углеводы, содержащиеся в овощах, образуют нерастворимые комплексные вещества из солей кальция и магния.
Вода и лед . Почему вода тяжелее льда ?!
Фрагменты (H 2 O) 8 сохраняются в жидкой воде. Количество одинаковых молекул воды внутри таких агрегатов H 2 O, поэтому плотность воды выше плотности льда (900 кг / м 3 )
О проточной питьевой воде :
Всем известно, что очистка воды производится с помощью отбеливателя или раствора, содержащего хлор.В такой воде микроорганизмы не могут выжить и погибнуть.
Но качество воды ухудшается, потому что хлор — очень мощное окисляющее вещество, которое вступает в реакцию с растворенными примесями и образует хлорорганические соединения, вредные для здоровья. Диоксины — самые токсичные и вредные вещества. Эти вещества — настоящие яды!
Они наносят вред человеческим органам, нарушают их нормальное функционирование. Но некоторые фильтры не всегда справляются с растворенным хлором.
Из всей воды на нашей планете только 1% пригоден для питья. Несмотря на то, что существует великое множество различных очищающих фильтров, даже самый лучший фильтр (слои, содержащие ионообменную среду, активированный уголь) не способен удалить все токсичные вещества из воды. Для получения чистой воды Вы можете регулярно менять фильтр (картридж), также Вы должны знать источник, из которого берется вода и как очищается (например, на сильно загрязненных территориях фильтр следует менять чаще).
Чистую и полезную воду получают из натуральных источников, которую предварительно обрабатывают, дополнительно очищают и разливают в стеклянные бутылки!
Снежинки
Снег образуется, когда микроскопические капли воды в облаках притягиваются к частицам пыли и замерзают. Появляющиеся кристаллы льда не превышают первых 0,1 мм в диаметре, падают и растут за счет конденсации влаги из воздуха.Этот механизм образовал гексагональную кристаллическую форму. Благодаря структуре молекул воды между вершинами кристаллических углов образуются углы размером всего 60 и 120 градусов. Главный кристалл воды в горизонтальной плоскости имеет форму правильного шестиугольника. Новые маленькие кристаллы оседают на вершинах шестиугольника, новые маленькие кристаллы образуют новые и новые различные формы звезд — снежинки.
Снежинки в начале своего образования т достаточно высоких температур кристаллы многократно плавятся и снова кристаллизуются.Этот процесс нарушает правильную форму снежинок и формирует смешанные разновидности. Кристаллизация всех шести углов снежинок происходит одновременно практически в одинаковых условиях и, следовательно, формы углов снежинок получают также одинаково.
С точки зрения кристаллографии наиболее естественной формой снежинок является «гексагональная» симметрия. Но иногда в природе можно увидеть треугольные снежинки. Причины таких различий до сих пор остаются неизвестными.
Для получения треугольных снежинок необходима температура 2 градуса ниже нуля.
Американские физики изучили влияние различных факторов на рост снежинок. Согласно теории физики, есть 2 основных фактора: динамика диффузионных молекул в воздухе и динамика поведения этих молекул на поверхности кристалла.
Они определили, что эти настройки напрямую определяются потоком воздуха, которым покрыта снежинка.
Ученые проверили свои теоретические предположения с помощью специальной камеры «снежной машины», с помощью которой можно контролировать рост снежинок.В результате было определено, что треугольные снежинки являются наиболее стойкими, то есть изменение воздушного потока не меняет форму снежинок. Этим, по мнению ученых, объясняется распространение треугольных снежинок.
Недавно ученым из Великобритании удалось получить снежинку «Пентагон». На поверхность меди кладут тонкий слой льда. В этом слое молекулы воды располагались на вершинах пятиугольника
25.3: Координационные соединения — Chemistry LibreTexts
Цели обучения
- Перечислить определяющие свойства координационных соединений
- Описать строение комплексов, содержащих монодентатные и полидентатные лиганды
- Используйте стандартные правила номенклатуры для наименования координационных соединений
- Объясните и приведите примеры геометрической и оптической изомерии
- Определить несколько природных и технологических проявлений координационных соединений
Гемоглобин в крови, хлорофилл зеленых растений, витамин \ (B_ {12} \) и катализатор, используемый при производстве полиэтилена, содержат координационные соединения.Ионы металлов, особенно переходных металлов, вероятно, образуют комплексы. Многие из этих соединений сильно окрашены (Рисунок \ (\ PageIndex {1} \)). В оставшейся части этой главы мы рассмотрим структуру и связь этих замечательных соединений.
Рисунок \ (\ PageIndex {1} \): Ионы металлов, содержащие частично заполненную d подоболочку, обычно образуют окрашенные комплексные ионы; Ионы с пустой d-подоболочкой (d 0 ) или с заполненной d-подоболочкой (d 10 ) обычно образуют бесцветные комплексы.На этом рисунке слева направо показаны растворы, содержащие ионы [M (H 2 O) 6 ] n + с M = Sc 3+ (d 0 ), Cr 3+ (d 3 ), Co 2+ (d 7 ), Ni 2+ (d 8 ), Cu 2+ (d 9 ) и Zn 2+ (d 10 ). (кредит: Сахар Атва)Помните, что в большинстве соединений элементов основной группы валентные электроны изолированных атомов объединяются, образуя химические связи, удовлетворяющие правилу октетов.Например, четыре валентных электрона углерода перекрываются с электронами четырех атомов водорода с образованием CH 4 . Один валентный электрон покидает натрий и присоединяется к семи валентным электронам хлора, образуя ионную формульную единицу NaCl (рисунок \ (\ PageIndex {2} \)). Переходные металлы обычно не связываются таким образом. В первую очередь они образуют координированные ковалентные связи, форму кислотно-основного взаимодействия Льюиса, при котором оба электрона в связи вносятся донором (основанием Льюиса) в акцептор электронов (кислотой Льюиса).Кислота Льюиса в координационных комплексах, часто называемая центральным ионом (или атомом) металла, часто является переходным металлом или внутренним переходным металлом, хотя элементы основной группы также могут образовывать координационные соединения. Донорами основания Льюиса, называемыми лигандами, могут быть самые разные химические вещества — атомы, молекулы или ионы. Единственное требование — они должны иметь одну или несколько электронных пар, которые можно передать центральному металлу. Чаще всего речь идет о донорном атоме с неподеленной парой электронов, которые могут образовывать координационную связь с металлом.
Рисунок \ (\ PageIndex {2} \): (a) Ковалентные связи включают обмен электронами, а ионные связи включают перенос электронов, связанных с каждым связывающим атомом, как показано окрашенными электронами. (b) Однако координационные ковалентные связи включают в себя электроны от основания Льюиса, передаваемые металлическому центру. Неподеленные пары из шести молекул воды образуют связи с ионом скандия, образуя октаэдрический комплекс. (Показаны только пожертвованные пары.)Координационная сфера состоит из центрального иона или атома металла плюс присоединенные к нему лиганды.Скобки в формуле заключают координационную сферу; виды вне скобок не входят в координационную сферу. Координационное число центрального иона или атома металла — это количество связанных с ним донорных атомов. Координационное число для иона серебра в [Ag (NH 3 ) 2 ] + равно двум (рисунок \ (\ PageIndex {3} \)). Для иона меди (II) в [CuCl 4 ] 2- координационное число равно четырем, тогда как для иона кобальта (II) в [Co (H 2 O) 6 ] 2+ координационный номер — шесть.Каждый из этих лигандов является монодентатным, от греческого «однозубый», что означает, что они соединяются с центральным металлом только через один атом. В этом случае количество лигандов и координационное число равны.
Рисунок \ (\ PageIndex {3} \): Комплексы (а) [Ag (NH 3 ) 2 ] + , (б) [Cu (Cl) 4 ] 2- и (c) [Co (H 2 O) 6 ] 2+ имеют координационные числа два, четыре и шесть соответственно.Геометрия этих комплексов такая же, как мы видели в теории VSEPR для элементов основных групп: линейных, тетраэдрических и октаэдрических.Многие другие лиганды координируются с металлом более сложным образом. Бидентатные лиганды — это те, в которых два атома координируются с металлическим центром. 3 +} \) содержит три из этих лигандов, каждый из которых образует две связи с ионом кобальта.
Любой лиганд, который связывается с центральным ионом металла более чем одним донорным атомом, является полидентатным лигандом (или «множеством зубов»), поскольку он может врезаться в металлический центр более чем одной связью. Термин «хелат» (произносится «КЛЮЧ-поздний») от греческого «коготь» также используется для описания этого типа взаимодействия. Многие полидентатные лиганды представляют собой хелатирующие лиганды, а комплекс, состоящий из одного или нескольких из этих лигандов и центрального металла, представляет собой хелат. Хелатирующий лиганд также известен как хелатирующий агент.Хелатирующий лиганд удерживает ион металла так же, как клешня краба удерживает мрамор. На рисунке \ (\ PageIndex {4} \) показан один пример хелата, а гемовый комплекс в гемоглобине — еще один важный пример (рисунок \ (\ PageIndex {5} \)). Он содержит полидентатный лиганд с четырьмя донорными атомами, которые координируются с железом.
Рисунок \ (\ PageIndex {5} \): гем с одним лигандом содержит четыре атома азота, которые координируются с железом в гемоглобине с образованием хелата.Полидентатные лиганды иногда идентифицируют с помощью префиксов, которые указывают количество донорных атомов в лиганде.Как мы видели, лиганды с одним донорным атомом, такие как NH 3 , Cl — и H 2 O, являются монодентатными лигандами. Лиганды с двумя донорными группами являются бидентатными лигандами. Этилендиамин, H 2 NCH 2 CH 2 NH 2 , и анион кислого глицина, \ (\ ce {Nh3Ch3CO2 -} \) (рисунок \ (\ PageIndex {6} \)) являются примеры бидентатных лигандов. Тридентатные лиганды, тетрадентатные лиганды, пентадентатные лиганды и гексадентатные лиганды содержат три, четыре, пять и шесть донорных атомов соответственно.Гем-лиганд (рисунок \ (\ PageIndex {5} \)) является тетрадентатным лигандом.
Рисунок \ (\ PageIndex {6} \): Каждый из показанных анионных лигандов бидентатно присоединяется к платине (II), причем атомы азота и кислорода координируются с металлом.Наименование комплексов
Номенклатура комплексов построена по системе, предложенной Альфредом Вернером, швейцарским химиком и лауреатом Нобелевской премии, чья выдающаяся работа более 100 лет назад заложила основу для более четкого понимания этих соединений.Для наименования комплексов используются следующие пять правил:
- Если координационное соединение является ионным, сначала назовите катион, а вторым — анион в соответствии с обычной номенклатурой.
- Сначала назовите лиганды, а затем центральный металл. Назовите лиганды в алфавитном порядке. Отрицательные лиганды (анионы) имеют имена, образованные добавлением — o к основному имени группы (например, Таблица \ (\ PageIndex {1} \). Для большинства нейтральных лигандов используется название молекулы.Четыре общих исключения: аква (H 2 O), амин (NH 3 ), карбонил (CO) и нитрозил (NO). Например, назовите [Pt (NH 3 ) 2 Cl 4 ] как диаминтетрахлорплатину (IV).
- Если присутствует более одного лиганда данного типа, номер обозначается префиксами di — (для двоих), tri — (для трех), tetra — (для четырех), penta — (для пяти) и гекса, — (для шести).Иногда префиксы bis — (для двоих), tris — (для трех) и tetrakis — (для четырех) используются, когда имя лиганда уже включает di -, tri — , или tetra -, или когда имя лиганда начинается с гласной. Например, ион бис (бипиридил) осмия (II) использует бис- для обозначения того, что к Os присоединены два лиганда, и каждый бипиридильный лиганд содержит две пиридиновые группы (C 5 H 4 N).
| Анионный лиганд | Имя |
|---|---|
| Ф. — | фтор |
| Класс — | хлор |
| Br — | бром |
| Я — | йод |
| CN — | циано |
| \ (\ ce {NO3 -} \) | нитрато |
| ОН — | гидроксо |
| O 2– | оксо |
| \ (\ ce {C2O4 ^ 2 -} \) | оксалато |
| \ (\ ce {CO2 ^ 2 -} \) | карбонато |
Когда комплекс представляет собой катион или нейтральную молекулу, название центрального атома металла пишется точно так же, как и название элемента, и за ним следует римская цифра в круглых скобках, чтобы указать его степень окисления (Таблицы \ ( \ PageIndex {2} \), \ (\ PageIndex {3} \) и \ (\ PageIndex {3} \)).Когда комплекс представляет собой анион, к основанию названия металла добавляется суффикс -ат, за которым следует римское числовое обозначение его степени окисления.
| Примеры, в которых комплекс представляет собой катион | |
| [Co (NH 3 ) 6 ] Cl 3 | гексааминкобальта (III) хлорид |
| [Pt (NH 3 ) 4 Класс 2 ] 2+ | ион тетрааминдихлорплатины (IV) |
| [Ag (NH 3 ) 2 ] + | Ион диаминосеребра (I) |
| [Cr (H 2 O) 4 Класс 2 ] Класс | хлорид тетрааквадихлорхрома (III) |
| [Co (H 2 NCH 2 CH 2 NH 2 ) 3 ] 2 (SO 4 ) 3 | трис (этилендиамин) сульфат кобальта (III) |
| Примеры, в которых комплекс является нейтральным | |
| [Pt (NH 3 ) 2 Класс 4 ] | диаминтетрахлорплатина (IV) |
| [Ni (H 2 NCH 2 CH 2 NH 2 ) 2 Cl 2 ] | дихлорбис (этилендиамин) никель (II) |
| Примеры, в которых комплекс представляет собой анион | |
| [PtCl 6 ] 2- | гексахлороплатинат (IV) ион |
| Na 2 [S nCl 6 ] | гексахлоростаннат натрия (IV) |
Иногда используется латинское название металла, если английское название неуклюже.Например, феррат используется вместо ироната , свинца вместо свинца и станнат вместо тината . Степень окисления металла определяется на основе зарядов каждого лиганда и общего заряда координационного соединения. Например, в [Cr (H 2 O) 4 Cl 2 ] Br координационная сфера (в скобках) имеет заряд 1+ для уравновешивания бромид-иона. Водные лиганды нейтральны, а хлоридные лиганды анионны с зарядом 1– каждый.Чтобы определить степень окисления металла, мы устанавливаем общий заряд равным сумме лигандов и металла: +1 = −2 + x , поэтому степень окисления ( x ) равна 3+.
Пример \ (\ PageIndex {1} \): Координационные числа и состояния окисления
Определите названия следующих комплексов и укажите координационное число центрального атома металла.
- Na 2 [PtCl 6 ]
- K 3 [Fe (C 2 O 4 ) 3 ]
- [Co (NH 3 ) 5 Cl] Cl 2
Раствор
- Есть два иона Na + , поэтому координационная сфера имеет два отрицательных заряда: [PtCl 6 ] 2- .Существует шесть анионных хлоридных лигандов, поэтому -2 = -6 + x , а степень окисления платины составляет 4+. Название комплекса — гексахлороплатинат натрия (IV), координационное число — шесть.
- Координационная сфера имеет заряд 3− (в зависимости от калия), а оксалатные лиганды имеют заряд 2−, поэтому степень окисления металла определяется как −3 = −6 + x , и это комплекс железа (III). Название — трисоксалатоферрат (III) калия (обратите внимание, что трис используется вместо три, потому что название лиганда начинается с гласной).Поскольку оксалат является бидентатным лигандом, этот комплекс имеет координационное число шесть.
- В этом примере координационная сфера имеет катионный заряд 2+. Лиганд NH 3 нейтрален, но хлор-лиганд имеет заряд 1−. Степень окисления определяется как +2 = −1 + x и равна 3+, поэтому комплекс представляет собой хлорид пентааминхлорокобальта (III), а координационное число равно шести.
Упражнение \ (\ PageIndex {1} \)
Комплексный дицианоаргенат (I) калия используется для изготовления антисептических составов.Приведите формулу и координационное число.
- Ответ
К [Ag (CN) 2 ]; координационный номер два
Структуры комплексов
Наиболее распространенными структурами комплексов в координационных соединениях являются октаэдрические, тетраэдрические и квадратно-плоские (Рисунок \ (\ PageIndex {7} \)). Для комплексов переходных металлов координационное число определяет геометрию вокруг центрального иона металла. Таблица \ (\ PageIndex {3} \) сравнивает координационные числа с молекулярной геометрией:
Рисунок \ (\ PageIndex {7} \): это геометрия некоторых комплексов с координационными числами семь и восемь.| Координационный номер | Молекулярная геометрия | Пример |
|---|---|---|
| 2 | линейный | [Ag (NH 3 ) 2 ] + |
| 3 | тригонально планарная | [Cu (CN) 3 ] 2- |
| 4 | тетраэдрический ( d 0 или d 10 ), низкие степени окисления для M | [Ni (CO) 4 ] |
| 4 | квадратный плоский ( d 8 ) | [NiCl 4 ] 2- |
| 5 | тригонально-бипирамидальный | [CoCl 5 ] 2- |
| 5 | квадратно-пирамидальный | [ВО (CN) 4 ] 2- |
| 6 | восьмигранный | [CoCl 6 ] 3- |
| 7 | пятиугольная бипирамида | [ZrF 7 ] 3- |
| 8 | квадратная антипризма | [ReF 8 ] 2- |
| 8 | додекаэдр | [Mo (CN) 8 ] 4- |
| 9 и выше | конструкции более сложные | [ReH 9 ] 2- |
В отличие от атомов основной группы, в которых как связывающие, так и несвязывающие электроны определяют молекулярную форму, несвязывающие d -электроны не изменяют расположение лигандов.Октаэдрические комплексы имеют координационное число шесть, и шесть донорных атомов расположены в углах октаэдра вокруг центрального иона металла. Примеры показаны на рисунке \ (\ PageIndex {8} \). Хлоридные и нитратные анионы в [Co (H 2 O) 6 ] Cl 2 и [Cr (en) 3 ] (NO 3 ) 3 и катионы калия в K 2 [PtCl 6 ], находятся вне скобок и не связаны с ионом металла.
Рисунок \ (\ PageIndex {8} \): Многие комплексы переходных металлов принимают октаэдрическую геометрию, с шестью донорными атомами, образующими валентные углы 90 ° вокруг центрального атома с соседними лигандами.Обратите внимание, что только лиганды в координационной сфере влияют на геометрию вокруг металлического центра.Для переходных металлов с координационным числом четыре возможны две различные геометрии: тетраэдрическая или квадратно-плоская. В отличие от элементов основной группы, геометрия которых может быть предсказана на основе теории VSEPR, требуется более подробное обсуждение орбиталей переходных металлов (обсуждается в разделе Теория кристаллического поля), чтобы предсказать, какие комплексы будут тетраэдрическими, а какие — квадратными.В тетраэдрических комплексах, таких как [Zn (CN) 4 ] 2- (рисунок \ (\ PageIndex {9} \)), каждая из пар лигандов образует угол 109,5 °. В плоских квадратных комплексах, таких как [Pt (NH 3 ) 2 Cl 2 ], каждый лиганд имеет два других лиганда под углом 90 ° (так называемые цис-положения ) и один дополнительный лиганд под углом 180 ° угол, в положении транс .
Рисунок \ (\ PageIndex {9} \): переходные металлы с координационным числом четыре могут иметь тетраэдрическую геометрию (a), как в K 2 [Zn (CN) 4 ], или квадратную плоскую геометрию (b). как показано в [Pt (NH 3 ) 2 Cl 2 ].Изомерия в комплексах
Изомеры — это разные химические соединения, имеющие одинаковую химическую формулу. Переходные металлы часто образуют геометрических изомеров , в которых одни и те же атомы связаны посредством одних и тех же типов связей, но с различной ориентацией в пространстве. Координационные комплексы с двумя разными лигандами в положениях цис и транс от интересующего лиганда образуют изомеры. Например, октаэдрический ион [Co (NH 3 ) 4 Cl 2 ] + имеет два изомера.В конфигурации цис два хлоридных лиганда находятся рядом друг с другом (рисунок \ (\ PageIndex {1} \)). Другой изомер, конфигурация транс , имеет два хлоридных лиганда, расположенных прямо напротив друг друга.
Рисунок \ (\ PageIndex {10} \): цис- и транс-изомеры [Co (H 2 O) 4 Cl 2 ] + содержат одни и те же лиганды, присоединенные к тому же иону металла, но пространственное расположение приводит к тому, что эти два соединения имеют очень разные свойства.Различные геометрические изомеры вещества — это разные химические соединения. Они обладают разными свойствами, хотя имеют одинаковую формулу. Например, два изомера [Co (NH 3 ) 4 Cl 2 ] NO 3 различаются по цвету; форма цис фиолетовая, а форма транс зеленая. Кроме того, эти изомеры имеют разные дипольные моменты, растворимость и реакционную способность. В качестве примера того, как расположение в пространстве может влиять на молекулярные свойства, рассмотрим полярность двух изомеров [Co (NH 3 ) 4 Cl 2 ] NO 3 .Помните, что полярность молекулы или иона определяется диполями связей (которые возникают из-за разницы в электроотрицательности связывающих атомов) и их расположением в пространстве. В одном изомере цис- хлоридные лиганды вызывают большую электронную плотность на одной стороне молекулы, чем на другой, что делает ее полярной. Для изомера транс- каждый лиганд находится прямо напротив идентичного лиганда, поэтому диполи связи компенсируются, и молекула неполярна.
Пример \ (\ PageIndex {2} \): геометрические изомеры
Определите, какой геометрический изомер [Pt (NH 3 ) 2 Cl 2 ] показан на рисунке \ (\ PageIndex {9} \) b.Нарисуйте другой геометрический изомер и дайте его полное название.
Решение
На рисунке \ (\ PageIndex {9} \) b два лиганда хлора занимают цис- положения. Другая форма показана ниже. При названии конкретных изомеров дескриптор указывается перед названием. Следовательно, этот комплекс представляет собой транс -диаминдихлорплатину (II).
Изомер транс [Pt (NH 3 ) 2 Cl 2 ] имеет каждый лиганд прямо напротив соседнего лиганда.
Упражнение \ (\ PageIndex {2} \)
Изобразите ион транс -диаква- транс -дибром- транс -дихлорокобальт (II).
- Ответ
Другим важным типом изомеров являются оптические изомеры или энантиомеры, в которых два объекта являются точными зеркальными отображениями друг друга, но не могут быть выстроены так, чтобы все части совпадали. Это означает, что оптические изомеры представляют собой несверхналоженные зеркальные изображения.Классическим примером этого является пара рук, в которой правая и левая рука являются зеркальным отображением друг друга, но не могут быть наложены друг на друга. Оптические изомеры очень важны в органической и биохимии, потому что живые системы часто включают один конкретный оптический изомер, а не другой. В отличие от геометрических изомеров, пары оптических изомеров имеют идентичные свойства (точку кипения, полярность, растворимость и т. Д.). Оптические изомеры различаются только тем, как они влияют на поляризованный свет и как они реагируют с другими оптическими изомерами.Для координационных комплексов многие координационные соединения, такие как [M (en) 3 ] n + [в котором M n + представляет собой центральный ион металла, такой как железо (III) или кобальт (II)], образуют энантиомеры, как показано на рисунке \ (\ PageIndex {11} \). Эти два изомера будут по-разному реагировать с другими оптическими изомерами. Например, спирали ДНК являются оптическими изомерами, и форма, которая встречается в природе (правая ДНК), будет связываться только с одним изомером [M (en) 3 ] n + , а не с другим.
Рисунок \ (\ PageIndex {11} \): Комплекс [M (en) 3 ] n + (M n + = ион металла, en = этилендиамин) имеет неперекрывающееся зеркальное отображение.Ион [Co (en) 2 Cl 2 ] + демонстрирует геометрическую изомерию ( цис / транс ), а его изомер цис существует в виде пары оптических изомеров (рис. \ (\ PageIndex {12} \)).
Рисунок \ (\ PageIndex {12} \): Существуют три изомерные формы [Co (en) 2 Cl 2 ] + .Транс-изомер, образующийся, когда хлор расположены под углом 180 °, имеет свойства, сильно отличающиеся от цис-изомеров. Зеркальные изображения цис-изомера образуют пару оптических изомеров, которые имеют идентичное поведение, за исключением реакции с другими энантиомерами.Изомеры связи возникают, когда координационное соединение содержит лиганд, который может связываться с центром переходного металла через два разных атома. Например, лиганд CN может связываться через атом углерода (циано) или через атом азота (изоциано).Точно так же SCN- может связываться через атом серы или азота, давая два различных соединения ([Co (NH 3 ) 5 SCN] 2+ или [Co (NH 3 ) 5 NCS] 2+ ).
Ионизационные изомеры (или координационные изомеры) возникают, когда один анионный лиганд во внутренней координационной сфере заменяется противоионом из внешней координационной сферы. Простым примером двух ионизационных изомеров являются [CoCl 6 ] [Br] и [CoCl 5 Br] [Cl].
Координационные комплексы в природе и технике
Хлорофилл, зеленый пигмент растений, представляет собой комплекс, содержащий магний (Рисунок \ (\ PageIndex {13} \)). Это пример элемента главной группы в координационном комплексе. Растения кажутся зелеными, потому что хлорофилл поглощает красный и фиолетовый свет; отраженный свет, следовательно, становится зеленым. Энергия, возникающая в результате поглощения света, используется в фотосинтезе.
Рисунок \ (\ PageIndex {13} \): (a) Хлорофилл бывает нескольких разных форм, которые имеют одинаковую базовую структуру вокруг магниевого центра.(b) Фталоцианиновый синий медь, плоский квадратный комплекс меди, присутствует в некоторых синих красителях.Одно из наиболее важных применений переходных металлов — это промышленные катализаторы. Как вы помните из главы о кинетике, катализатор увеличивает скорость реакции за счет снижения энергии активации и регенерируется в каталитическом цикле. Более 90% всей производимой продукции производится с использованием одного или нескольких катализаторов. Способность связывать лиганды и изменять степень окисления делает катализаторы на основе переходных металлов хорошо подходящими для каталитических применений.Оксид ванадия используется для производства 230 000 000 тонн серной кислоты во всем мире каждый год, которая, в свою очередь, используется для производства всего, от удобрений до консервных банок для еды. Пластмассы производятся с помощью катализаторов из переходных металлов, а также моющих средств, удобрений, красок и т. Д. (Рисунок \ (\ PageIndex {14} \)). Очень сложные фармацевтические препараты производятся с катализаторами, которые являются избирательными, реагируя с одной конкретной связью из большого числа возможных. Катализаторы делают процессы более экономичными и экологически безопасными.Разработка новых катализаторов и лучшее понимание существующих систем — важные области текущих исследований.
Рисунок \ (\ PageIndex {14} \): (a) Моющие средства, (b) краски и (c) удобрения — все производятся с использованием катализаторов на основе переходных металлов. (кредит a: модификация работы «Mr. Brian» / Flickr; кредит b: модификация работы Ewen Roberts; кредит c: модификация работы «osseous» / Flickr)Многие другие координационные комплексы также ярко окрашены. Квадратный плоский комплекс фталоцианинового синего меди (II) (из рисунка \ (\ PageIndex {13} \)) является одним из многих комплексов, используемых в качестве пигментов или красителей.Этот комплекс используется в синих чернилах, синих джинсах и некоторых синих красках.
Структура гема (рисунок \ (\ PageIndex {15} \)), железосодержащего комплекса в гемоглобине, очень похожа на структуру хлорофилла. В гемоглобине комплекс красного гема связан с большой молекулой белка (глобином) путем присоединения белка к гем-лиганду. Молекулы кислорода переносятся гемоглобином в крови, связываясь с железным центром. Когда гемоглобин теряет кислород, цвет меняется на синевато-красный.Гемоглобин будет переносить кислород, только если железо Fe 2+ ; окисление железа до Fe 3+ предотвращает перенос кислорода.
Рисунок \ (\ PageIndex {15} \): Гемоглобин содержит четыре белковые субъединицы, каждая из которых имеет железный центр, присоединенный к гем-лиганду (показан красным), который координирован с белком глобина. Каждая субъединица показана другим цветом.Комплексообразующие агенты часто используются для смягчения воды, поскольку они связывают такие ионы, как Ca 2+ , Mg 2+ и Fe 2+ , которые делают воду жесткой.Ионы многих металлов также нежелательны в пищевых продуктах, поскольку эти ионы могут катализировать реакции, изменяющие цвет пищи. Координационные комплексы полезны как консерванты. Например, лиганд EDTA, (HO 2 CCH 2 ) 2 NCH 2 CH 2 N (CH 2 CO 2 H) 2 , координируется с ионами металлов через шесть донорные атомы и предотвращает реакцию металлов (Рисунок \ (\ PageIndex {16} \)). Этот лиганд также используется для связывания ионов металлов в производстве бумаги, текстиля и моющих средств, а также в фармацевтике.
Рисунок \ (\ PageIndex {16} \): лиганд EDTA прочно связывается с различными ионами металлов, образуя гексадентатные комплексы.Комплексообразующие агенты, связывающие ионы металлов, также используются в качестве лекарств. British Anti-Lewisite (BAL), HSCH 2 CH (SH) CH 2 OH — препарат, разработанный во время Первой мировой войны в качестве противоядия от боевого газа левизита на основе мышьяка. БАЛ теперь используется для лечения отравлений тяжелыми металлами, такими как мышьяк, ртуть, таллий и хром. Лекарство является лигандом и действует, образуя водорастворимый хелат металла; почки выводят этот хелат металла (Рисунок \ (\ PageIndex {17} \)).Другой полидентатный лиганд, энтеробактин, который выделен из определенных бактерий, используется для образования комплексов железа и, таким образом, для контроля тяжелого накопления железа, обнаруживаемого у пациентов, страдающих такими заболеваниями крови, как анемия Кули, которым требуются частые переливания крови. Когда перелитая кровь разрушается, обычные метаболические процессы, удаляющие железо, перегружаются, и избыток железа может накапливаться до фатального уровня. Энтеробактин образует водорастворимый комплекс с избытком железа, и организм может безопасно устранить этот комплекс.
Рисунок \ (\ PageIndex {17} \): Координационные комплексы используются в качестве лекарств. (а) Британский анти-люизит используется для лечения отравления тяжелыми металлами путем координирования металлов (M), а энтеробактин (b) позволяет удалить избыток железа из крови.Пример \ (\ PageIndex {3} \): хелатная терапия
Лиганды, такие как БАЛ и энтеробактин, важны для лечения отравлений тяжелыми металлами. Однако хелатирование может нарушить нормальную концентрацию ионов в организме, что приведет к серьезным побочным эффектам, поэтому исследователи ищут новые хелатирующие препараты.Одним из разработанных препаратов является димеркаптоянтарная кислота (DMSA), показанная на рисунке \ (\ PageIndex {18} \). Определите, какие атомы в этой молекуле могут действовать как донорные атомы.
Рисунок \ (\ PageIndex {18} \): Димеркаптоянтарная кислота используется для лечения отравления тяжелыми металлами.Решение
Все атомы кислорода и серы имеют неподеленные пары электронов, которые можно использовать для координации с металлическим центром, поэтому существует шесть возможных атомов-доноров. Геометрически только два из этих атомов могут быть скоординированы с металлом одновременно.Наиболее распространенный способ связывания включает координацию одного атома серы и одного атома кислорода, образуя пятичленное кольцо с металлом.
Упражнение \ (\ PageIndex {3} \)
Некоторые практикующие врачи альтернативной медицины рекомендуют хелатирующие препараты для лечения заболеваний, которые явно не связаны с тяжелыми металлами, таких как рак и аутизм, хотя эта практика не одобряется многими научными организациями. 1 Определите по крайней мере два биологически важных металла, которые могут быть разрушены хелатной терапией.
- Ответ
Ca, Fe, Zn и Cu
Лиганды также используются в гальванической промышленности. Когда ионы металлов восстанавливаются с образованием тонких металлических покрытий, металлы могут слипаться, образуя кластеры и наночастицы. Когда используются координационные комплексы металлов, лиганды удерживают атомы металлов изолированными друг от друга. Было обнаружено, что многие металлы имеют более гладкую, однородную, красивую и более прочную поверхность при нанесении покрытия из ванны, содержащей металл в виде комплексного иона.Таким образом, такие комплексы, как [Ag (CN) 2 ] — и [Au (CN) 2 ] —, широко используются в гальванической промышленности.
В 1965 году ученые из Университета штата Мичиган обнаружили, что существует комплекс платины, который ингибирует деление клеток у некоторых микроорганизмов. Более поздняя работа показала, что комплекс представлял собой цис -диаминдихлорплатину (II), [Pt (NH 3 ) 2 (Cl) 2 ] и что изомер транс не был эффективным.Ингибирование клеточного деления показало, что это квадратно-плоское соединение могло быть противораковым агентом. В 1978 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило это соединение, известное как цисплатин, для использования при лечении определенных форм рака. С того времени было разработано много подобных соединений платины для лечения рака. Во всех случаях это изомеры цис и никогда не изомеры транс . Часть диамина (NH 3 ) 2 остается с другими группами, заменяя часть дихлор [(Cl) 2 ].Новые препараты включают карбоплатин, оксалиплатин и сатраплатин.
Авторы и авторство
Сводка
Переходные элементы и элементы основной группы могут образовывать координационные соединения или комплексы, в которых центральный атом или ион металла связан с одним или несколькими лигандами координационными ковалентными связями. Лиганды с более чем одним донорным атомом называются полидентатными лигандами и образуют хелаты. Общие геометрические формы, встречающиеся в комплексах, являются тетраэдрическими и квадратными (оба с координационным числом четыре) и октаэдрическими (с координационным числом шесть).Конфигурации Cis и trans возможны в некоторых октаэдрических и квадратных плоских комплексах. В дополнение к этим геометрическим изомерам в некоторых октаэдрических комплексах возможны оптические изомеры (молекулы или ионы, которые являются зеркальными отражениями, но не накладываются друг на друга). Координационные комплексы имеют множество применений, включая транспортировку кислорода в крови, очистку воды и фармацевтическое применение.
- Национальный совет по борьбе с мошенничеством в сфере здравоохранения, Заявление NCAHF о политике в отношении хелатной терапии (Пибоди, Массачусетс, 2002).
Глоссарий
- бидентатный лиганд
- лиганд, который координируется с одним центральным металлом через координационные связи двух разных атомов
- центральный металл
- ион или атом, к которому один или несколько лигандов присоединены посредством координационных ковалентных связей
- хелат
- комплекс, образованный полидентатным лигандом, присоединенным к центральному металлу
- хелатный лиганд
- лиганд, который присоединяется к центральному иону металла связями от двух или более донорных атомов
- cis конфигурация
- конфигурация геометрического изомера, в которой две аналогичные группы находятся по одну сторону от воображаемой реперной линии на молекуле
- координационное соединение
- вещество, состоящее из атомов, молекул или ионов, прикрепленных к центральному атому посредством кислотно-основных взаимодействий Льюиса
- координационный номер
- число координационных ковалентных связей с центральным атомом металла в комплексе или число ближайших контактов с атомом в кристаллической форме
- координационная сфера
- центральный атом или ион металла плюс присоединенные лиганды комплекса
- донорный атом
- атом в лиганде с неподеленной парой электронов, которая образует координационную ковалентную связь с центральным металлом
- ионизационный изомер
- (или координационный изомер) изомер, в котором анионный лиганд заменен на противоион во внутренней координационной сфере
- лиганд
- ион или нейтральная молекула, присоединенная к центральному иону металла в координационном соединении
- изомер связи
- координационное соединение, которое обладает лигандом, который может связываться с переходным металлом двумя разными способами (CN — vs.NC —)
- однодентатный
- лиганд, который присоединяется к центральному металлу через одну координационную ковалентную связь
- оптический изомер
- (также энантиомер) молекула, которая представляет собой несимметричное зеркальное отображение с идентичными химическими и физическими свойствами, за исключением случаев, когда она реагирует с другими оптическими изомерами
- полидентатный лиганд
- лиганд, который присоединен к центральному иону металла связями от двух или более донорных атомов, назван с префиксом, указывающим, сколько доноров присутствует (например,г., гексадентат = образовано шесть координатных связей)
- транс конфигурация
- конфигурация геометрического изомера, в которой две аналогичные группы находятся на противоположных сторонах воображаемой реперной линии на молекуле
Авторы и авторство
Введение в координационную химию — химия LibreTexts
Комплексы или Координационные соединения — это молекулы, которые имеют металлический центр, связанный с лигандами (атомами, ионами или молекулами, которые отдают электроны металлу).Эти комплексы могут быть нейтральными или заряженными. Когда комплекс заряжен, он стабилизируется соседними противоионами.
Введение
Координационная химия возникла в результате работы Альфреда Вернера, швейцарского химика, который исследовал различные соединения, состоящие из хлорида кобальта (III) и аммиака. При добавлении соляной кислоты Вернер заметил, что аммиак нельзя полностью удалить. Затем он предположил, что аммиак должен быть более тесно связан с центральным ионом кобальта.Однако при добавлении водного раствора нитрата серебра одним из образовавшихся продуктов был твердый хлорид серебра. Количество образовавшегося хлорида серебра зависело от количества молекул аммиака, связанных с хлоридом кобальта (III). Например, когда нитрат серебра был добавлен к CoCl 3 · 6NH 3, все три хлорида были преобразованы в хлорид серебра. Однако, когда нитрат серебра был добавлен к CoCl 3 · 5NH 3 , только 2 из 3 хлоридов образовали хлорид серебра. Когда CoCl 3 · 4NH 3 обрабатывали нитратом серебра, один из трех хлоридов выпадал в осадок в виде хлорида серебра.
В результате наблюдений предполагается образование комплекса или координационных соединений . Во внутренней координационной сфере , которая также упоминается в некоторых текстах как первая сфера , лиганды непосредственно связаны с центральным металлом. Во внешней координационной сфере , иногда называемой второй сферой , другие ионы присоединены к комплексному иону. Вернер был удостоен Нобелевской премии в 1913 году за свою теорию координации.Следующая таблица представляет собой сводку наблюдений Вернера:
| Исходное соединение | Образовавшиеся соединения при добавлении AgNO 3 |
|---|---|
| CoCl 3 · 6NH 3 | [Co (NH 3 ) 6 ] 3+ (класс — ) 3 |
| CoCl 3 · 5NH 3 | [Co (NH 3 ) 5 Cl] 2+ (Cl —) 2 |
| CoCl 3 · 4NH 3 | [Co (NH 3 ) 4 Класс 2 ] + (Класс —) |
| CoCl 3 · 3NH 3 | [Co (NH 3 ) 3 Cl 3 ] |
Как показано в таблице выше, комплексному иону [Co (NH 3 ) 6 ] 3+ противодействуют три хлорид-иона.Многоуровневое связывание координационных комплексов играет важную роль в определении диссоциации этих комплексов в водном растворе. Например, \ (\ ce {[Co (Nh4) 5Cl] Cl2} \) диссоциирует на три иона, а \ (\ ce {[Co (Nh4) 4Cl2] Cl} \) диссоциирует на два иона. Путем подачи тока через водные растворы полученных комплексных соединений Вернер измерил электропроводность и, таким образом, свойства диссоциации комплексных соединений. Результаты подтвердили его гипотезу об образовании сложных соединений.Важно отметить, что вышеуказанные соединения имеют координационное число 6, которое является общим координационным числом для многих неорганических комплексов. Координационные числа для комплексных соединений обычно находятся в диапазоне от 1 до 16.
Свойства координационных комплексов
Некоторые методы проверки наличия сложных ионов включают изучение их химического поведения. Это может быть достигнуто путем наблюдения за цветом соединений, растворимостью, спектром поглощения, магнитными свойствами и т. Д. Свойства сложных соединений отделены от свойств отдельных атомов.При образовании координационных соединений изменяются свойства как металла, так и лиганда.
Связи металл-лиганд обычно представляют собой кислотно-основные взаимодействия Льюиса. Атом металла действует как акцептор электронной пары (кислота Льюиса), в то время как лиганды действуют как доноры электронной пары (основание Льюиса). Природа связи между металлом и лигандом сильнее, чем межмолекулярные силы, потому что они образуют направленные связи между ионом металла и лигандом, но слабее, чем ковалентные связи и ионные связи.
Общие лиганды
Монодентатные лиганды отдают одну пару электронов центральным атомам металла. Примером этих лигандов являются ионы галдида (F — , Cl — , Br — , I — ). Полидентатные лиганды, также называемые хелатами или хелатирующими агентами, отдают более одной пары электронов атому металла, образуя более прочную связь и более стабильный комплекс. Обычным хелатирующим агентом является этилендиамин (en), который, как следует из названия, содержит два аммина или: NH 2 сайтов, которые могут связываться с двумя сайтами на центральном металле.Примером тридентатного лиганда является бис-диэтилентриаммин. Примером такого координационного комплекса является бис-диэтилентриамин кобальт III.
| Комплексное соединение / ион | Координационный номер | Состояние окисления атома металла |
|---|---|---|
| [Fe (CN) 6 ] 4- | 6 | 2+ |
| [Co (NH 3 ) 4 SO 4 ] — | 5 | 1+ |
| [Pt (NH 3 ) 4 ] 2+ | 4 | 2+ |
| [Ni (NH 2 CH 2 CH 2 NH 2 ) 3 ] 2+ | 6 | 2+ |
Комплексные ионы могут образовывать множество соединений, связываясь с другими комплексными ионами в нескольких соотношениях.Это приводит к множеству комбинаций координационных соединений. В структурах некоторых координационных соединений также могут быть изомеры, которые могут изменять их взаимодействие с другими химическими агентами. Связывание металла с лигандами изучается в металлах, в тетраэдрических и октаэдрических структурах. Координационные комплексы и их изомеры имеют множество фармацевтических и биологических применений.
Список литературы
- Kleinberg, J .; Argersinger, WJ; Грисуорлд Э. Неорганическая химия.; Д. К. Хит и компания: Бостон, Массачусетс, 1960; Глава 6.
- Мартелл, Артур Э. Химия хелатных соединений металлов .; Prentice-Hall inc: Нью-Йорк, Нью-Йорк, 1952 г.
- Oxtoby, David W .; Gillis H.P .; Кэмпион, Алан. Принципы современной химии, 6-е изд .; Томсон Брукс / Коул: Бельмонт, Калифорния, 2008; Глава 8.
- Майерс, Томас Р. «Правила для координационного числа ионов металлов (CEC)». J. Chem. Educ. 1981 , 58 , 681.
- Сямал, А.«Некоторые неправильные термины в координационной химии». J. Chem. Educ. 1985 , 62 , 143.
- Toma, Henrique E .; Араки, Коити; Довидаускас, Серджио. «Циклический эксперимент вольтамперометрии, иллюстрирующий окислительно-восстановительные потенциалы, константы равновесия и реакции замещения в координационной химии». J. Chem. Educ. 2000 77 1351.
- Тоофан, Джахансооз. «Простое выражение между отношением критического радиуса и координационным числом.» J. Chem. Educ. 1994 , 71 , 147.
- Вульф, А. А. «Координация и отношение радиуса: графическое представление». J. Chem. Educ. 1989 , 66 , 509.
Авторы и авторство
Реакции и применение координационных соединений
Реакции координационных соединений
Координационные комплексы — это анионные лиганды, связанные с катионным металлом.
Цели обучения
Обсудите общие классы реакций координационных соединений.
Основные выводы
Ключевые моменты
- Координационный комплекс, или комплекс металла, состоит из атома или иона (обычно металлического) и окружающего массива молекул или анионов, называемых лигандами или комплексообразующими агентами.
- Координационное соединение — это любая молекула, содержащая координационный комплекс.
- Донорный атом — это атом внутри лиганда, который связан с центральным атомом или ионом.
- Координационные комплексы могут вступать в различные реакции, включая перенос электрона, обмен лигандами и ассоциативные процессы.
Ключевые термины
- координация : реакция одного или нескольких лигандов с ионом металла с образованием координационного соединения.
- редокс : обратимая химическая реакция, в которой одна реакция является окислением, а обратная — восстановлением.
- донорный атом : атом в лиганде, который связан с центральным атомом или ионом в координационном комплексе.
В химии координационный или металлический комплекс состоит из атома или иона (обычно металлического) и окружающего массива связанных молекул или анионов, известных как лиганды или комплексообразующие агенты. Многие металлосодержащие соединения состоят из координационных комплексов.
Цисплатин : Этот комплекс, PtCl2 (Nh4) 2, является противоопухолевым лекарственным средством и примером координационного комплекса.
Структура координационных комплексов
Донор Атом
Атом в лиганде, который связан с центральным атомом или ионом, называется донорным атомом.Типичный комплекс связан с несколькими донорными атомами, которые могут быть одинаковыми или разными элементами.
Полидентатные (многократно связанные) лиганды состоят из нескольких донорных атомов, некоторые из которых связаны с центральным атомом или ионом. Эти комплексы называются хелатными комплексами, образование которых называется хелатированием, комплексообразованием и координацией.
Хелатирование ЭДТА : Молекула ЭДТА имеет шесть различных донорных атомов, которые образуют комплекс.
Лиганды
Ионы или молекулы, окружающие центральный атом, называются лигандами.Обычно они связаны с центральным атомом координатной ковалентной связью (отдавая электроны из неподеленной электронной пары на пустую металлическую орбиталь). Существуют также органические лиганды, такие как алкены, пи (π) -связи которых могут координироваться с пустыми металлическими орбиталями. Примером является этен в комплексе, известном как соль Цейзе, K + [PtCl 3 (C 2 H 4 )] —.
Центральный атом или ион вместе со всеми лигандами составляют координационную сферу.Центральные атомы или ион и донорные атомы составляют первую координационную сферу. Координация относится к координированным ковалентным связям (диполярным связям) между лигандами и центральным атомом.
Первоначально комплекс подразумевал обратимую ассоциацию молекул, атомов или ионов через такие слабые химические связи. Применительно к координационной химии это значение претерпело эволюцию. Некоторые комплексы металлов образуются практически необратимо, а многие из них связаны довольно прочными связями.
Реакционная способность
Перенос электронов
Обычной реакцией между координационными комплексами с участием лигандов является перенос электрона. Существует два различных механизма окислительно-восстановительных реакций переноса электронов: перенос электронов во внутренней или внешней сфере. При переносе электрона электрон перемещается от одного атома к другому, изменяя заряд каждого атома, но оставляя общий заряд системы неизменным.
Обмен лигандов
Одним из важных показателей реакционной способности является скорость вырожденного обмена лигандов.Например, скорость обмена координатной воды в комплексах [M (H 2 O) 6 ] n + варьируется более чем на 20 порядков. Комплексы, в которых лиганды высвобождаются и быстро восстанавливаются, классифицируются как лабильные. Такие лабильные комплексы могут быть термодинамически достаточно стабильными. Обычно они либо имеют низкий заряд (Na + ), электроны на d-орбиталях, которые разрывают связи по отношению к лигандам (Zn 2+ ), либо не обладают ковалентностью (Ln 3+ , где Ln — любой лантаноид). .
Лабильность металлического комплекса также зависит от конфигурации высокоспинового против низкоспинового, когда это возможно. Таким образом, высокоспиновые Fe (II) и Co (III) образуют лабильные комплексы, тогда как низкоспиновые аналоги инертны.
Ассоциированные процессы
Комплексы с незаполненными или наполовину заполненными орбиталями часто проявляют способность реагировать с субстратами. Большинство субстратов имеют синглетное основное состояние; то есть у них есть неподеленные электронные пары (например, вода, амины, простые эфиры). Этим субстратам нужна пустая орбиталь, чтобы иметь возможность реагировать с металлическим центром.Некоторые субстраты (например, молекулярный кислород) имеют триплетное основное состояние. Металлы с наполовину заполненными орбиталями имеют тенденцию реагировать с такими субстратами. Если лиганды вокруг металла тщательно выбраны, металл может способствовать (стехиометрическим или каталитическим) превращениям молекул или использоваться в качестве сенсора.
Металлургия
Добывающая металлургия — это изучение процессов, используемых при разделении и обогащении сырья.
Цели обучения
Обсудите, как координационная химия может применяться в металлургических процессах.
Основные выводы
Ключевые моменты
- Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных металлов в более чистую форму.
- Область добывающей металлургии включает в себя множество специализированных дисциплин, включая переработку полезных ископаемых, гидрометаллургию, пирометаллургию и электрометаллургию.
- В частности, в гидрометаллургии, координационная химия металлов играет большую роль в их растворимости и реакционной способности, поскольку руда перерабатывается в драгоценный металл.
Ключевые термины
- растворение : растворение или переход в раствор.
- пирометаллургия : Термическая обработка минералов или руд для осуществления физических и химических превращений в материалах, позволяющих извлекать ценные металлы.
- металлургия : Металловедение; их извлечение из руд, очистка и легирование, термическая обработка и переработка.
Добывающая металлургия
Добывающая металлургия — это практика удаления ценных металлов из руды и переработки извлеченных сырых металлов в более чистую форму.Эта область является прикладной наукой, охватывающей все аспекты физических и химических процессов, используемых для производства минералосодержащих и металлических материалов. Практика добывающей металлургии почти всегда предполагает участие других научных областей, таких как аналитическая химия и минералогия. Иногда добывающая металлургия производит готовую продукцию, но чаще она производит форму, требующую дальнейшей физической обработки.
Область экстракционной металлургии включает в себя множество специализированных дисциплин, каждая из которых связана с различными физическими и химическими процессами, которые являются этапами в общем процессе производства определенного материала.Эти специальности в целом сгруппированы по категориям переработки полезных ископаемых:
- гидрометаллургия
- пирометаллургия
- электрометаллургия
Переработка полезных ископаемых
Обработка минералов позволяет управлять размером частиц твердого сырья для отделения ценных материалов от материалов, не представляющих ценности. Обычно размер частиц необходимо уменьшить, чтобы эффективно отделить ценные материалы. Физические свойства ценных материалов могут включать плотность, размер и форму частиц, электрические и магнитные свойства и свойства поверхности.
Поскольку во многих процессах измельчения и разделения используется вода, процессы разделения твердой и жидкой фаз являются частью переработки минералов. Чтобы растворить руду в водном растворе, часто необходимо разбить большие куски на более мелкие, тем самым увеличивая площадь поверхности и скорость растворения. Кроме того, можно дробить только руды, которые легко измельчаются, что позволяет им растворяться гораздо быстрее, чем руды, оставшиеся в больших кусках.
Гидрометаллургия
«Гидрометаллургия» описывает процесс извлечения металлов из руд с использованием водных растворов. Наиболее распространенным гидрометаллургическим процессом является выщелачивание, при котором ценные металлы растворяются в водном растворе. После отделения раствора от твердой руды раствор часто подвергают различным процессам очистки и концентрирования перед извлечением ценного металла.
Процессы очистки и концентрирования раствора могут включать осаждение, дистилляцию, адсорбцию и экстракцию растворителем.Заключительный этап восстановления может включать осаждение, цементацию или электрометаллургический процесс. Иногда гидрометаллургические процессы могут выполняться непосредственно на рудном материале без каких-либо этапов предварительной обработки. Часто руда должна быть подвергнута предварительной обработке с помощью различных стадий обогащения полезных ископаемых, а иногда и пирометаллургических процессов. Здесь координационная химия и растворимость соединения могут стать очень важными, когда кто-то пытается осаждать интересующий минерал (металл) над другими металлами в растворе или пытается избирательно выщелачивать один желаемый минерал над другими, присутствующими в образце.
Пирометаллургия
Пирометаллургия включает высокотемпературные процессы, при которых происходят химические реакции между газами, твердыми телами и расплавленными материалами. Твердые вещества, содержащие ценные металлы, вступают в реакцию с образованием промежуточных соединений для дальнейшей обработки или превращаются в их элементарное или металлическое состояние. Процессы производства расплавленных продуктов в совокупности называются операциями плавки. Энергия, необходимая для поддержания высокотемпературных пирометаллургических процессов, может полностью зависеть от экзотермической природы протекающих химических реакций, обычно реакций окисления.Однако часто энергия должна добавляться к процессу за счет сжигания топлива или, в случае некоторых процессов плавки, путем прямого приложения электрической энергии.
Плавильная печь : Для плавления руд и металлов, получаемых при горных работах, часто требуются высокие температуры.
Электрометаллургия
Электрометаллургия включает в себя металлургические процессы, которые происходят в какой-либо форме электролитической ячейки. Наиболее распространенными видами электрометаллургических процессов являются электролитическое извлечение и электролитическое рафинирование.Электролизное извлечение — это процесс электролиза, используемый для извлечения металлов в водном растворе, обычно в результате того, что руда подверглась одному или нескольким гидрометаллургическим процессам. Интересующий металл нанесен на катод, а анод представляет собой инертный электрический проводник. Электрорафинирование используется для растворения загрязненного металлического анода (обычно в процессе плавки) и получения катода высокой чистоты. Сфера применения электрометаллургии в значительной степени совпадает с областями гидрометаллургии и (в случае электролиза плавленых солей) пирометаллургии.
Хелатирующие агенты
Хелатирующие агенты — это лиганды для металлов, которые связываются через несколько атомов, таким образом занимая несколько координационных центров на металле.
Цели обучения
Опишите происхождение хелатного эффекта.
Основные выводы
Ключевые моменты
- Хелатирование — это образование или наличие двух или более отдельных координационных связей между полидентатным (многосвязным) лигандом и одним центральным атомом.
- Хелатный эффект описывает повышенное сродство хелатирующих лигандов к иону металла по сравнению со сродством набора аналогичных нехелатирующих (монодентатных) лигандов к тому же металлу.
- Хелатная терапия — это использование хелатирующих агентов для детоксикации ядовитых металлических агентов, таких как ртуть, мышьяк и свинец, путем преобразования их в химически инертную форму, которая может выводиться из организма без дальнейшего взаимодействия с организмом.
Ключевые термины
- хелатное соединение : циклическое соединение, в котором атом металла связан по крайней мере с двумя другими атомами.
- хелатирующий агент : любое соединение, которое реагирует с ионом металла с образованием хелата.
- лиганд : ион, молекула или функциональная группа, которая связывается с другим химическим соединением с образованием более крупного комплекса.
Хелатирование
Хелатирование — это образование или наличие двух или более отдельных координационных связей между полидентатным (многосвязным) лигандом и одним центральным атомом. Обычно эти лиганды представляют собой органические соединения и называются хелатирующими агентами, хелатирующими агентами, хелатирующими агентами или связывающими агентами; полученные комплексы называются хелатными соединениями.
Хелат металл-ЭДТА : Химическая структура хелата ЭДТА.
Хелатные комплексы контрастируют с координационными комплексами, состоящими из монодентатных лигандов, которые образуют только одну связь с центральным атомом. Хелатирующие агенты, в отличие от других лигандов в координационных соединениях, связываются через несколько атомов в молекуле лиганда, а не только через один.
Хелатный эффект
Хелатный эффект описывает повышенное сродство хелатирующих лигандов к иону металла по сравнению со сродством набора аналогичных нехелатирующих (монодентатных) лигандов к тому же металлу.{2+} [/ latex] (2)
В (1) бидентатный лиганд этилендиамин образует хелатный комплекс с ионом меди. Хелатирование приводит к образованию пятичленного кольца. В (2) два монодентатных метиламиновых лиганда примерно с одинаковой донорной способностью (энтальпия образования связей Cu — N примерно одинакова в двух реакциях) образуют комплекс. В условиях равных концентраций меди и когда концентрация метиламина в два раза превышает концентрацию этилендиамина, концентрация комплекса в (1) будет больше, чем концентрация комплекса в (2).Эффект увеличивается с увеличением количества хелатных колец, поэтому концентрация комплекса EDTA, который имеет шесть хелатных колец, намного выше, чем у соответствующего комплекса с двумя монодентатными лигандами-донорами азота и четырьмя монодентатными карбоксилатными лигандами. Таким образом, явление хелатного эффекта — твердо установленный эмпирический факт.
Хелат этилендиамина : Этилендиамин служит хелатирующим агентом, связываясь через два атома азота.
Применение хелатирующих агентов
Хелатирующая терапия — это использование хелатирующих агентов для детоксикации ядовитых металлических агентов, таких как ртуть, мышьяк и свинец, путем преобразования их в химически инертную форму, которая может выводиться из организма без дальнейшего взаимодействия с организмом.Эта терапия была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1991 году. Хотя они могут быть полезными при отравлении тяжелыми металлами, хелатирующие агенты также могут быть опасными. Использование динатриевой соли EDTA вместо кальция EDTA привело к смертельному исходу из-за гипокальциемии.
Практически все биохимические вещества обладают способностью растворять определенные катионы металлов. Таким образом, белки, полисахариды и полинуклеиновые кислоты являются отличными полидентатными лигандами для многих ионов металлов. Органические соединения, такие как аминокислоты глутаминовая кислота и гистидин, органические двухосновные кислоты, такие как малат, и полипептиды, такие как фитохелатин, также являются типичными хелаторами.В дополнение к этим дополнительным хелаторам, несколько биомолекул специально продуцируются для связывания определенных металлов. Практически все металлоферменты содержат металлы, которые хелатированы, обычно с пептидами или кофакторами и простетическими группами. Такие хелатирующие агенты включают порфириновые кольца в гемоглобине и хлорофилле. Многие виды микробов производят водорастворимые пигменты, которые служат хелатирующими агентами, называемыми сидерофорами. Например, известно, что виды Pseudomonas секретируют пиоцианин и пиовердин, связывающие железо.Энтеробактин, продуцируемый E. coli, является сильнейшим из известных хелатирующих агентов.
Химический анализ
Координационные комплексы и их химический состав могут использоваться для анализа состава раствора методом осаждения или колориметрического анализа.
Цели обучения
Опишите применение координационных соединений в анализе химического состава.
Основные выводы
Ключевые моменты
- Координационные комплексы могут использоваться для анализа химического состава с помощью анализа осадков и колориметрического анализа.
- Классический качественный неорганический анализ — это метод аналитической химии, направленный на определение элементного состава неорганических соединений.
- Катионы обычно подразделяются на шесть групп в соответствии с их категориями, а анионы подразделяются на три группы.
Ключевые термины
- осаждение : реакция, которая приводит к образованию более тяжелого твердого вещества в более легкой жидкости; осадок образовался на дне емкости.
Координационные комплексы могут использоваться для анализа химического состава различными способами. Двумя распространенными методами являются анализ осадков и колориметрический анализ. Эти методы называются классическим качественным неорганическим анализом.
Реакция осаждения : Разница во внешнем виде агрегата и осадка.
Качественный неорганический анализ
Классический качественный неорганический анализ — это метод аналитической химии, направленный на определение элементного состава неорганических соединений.Он в основном ориентирован на обнаружение ионов в водном растворе, поэтому материалы в других формах, возможно, потребуется привести в это состояние, прежде чем можно будет использовать стандартные методы. Затем раствор обрабатывают различными реагентами для проверки реакций, характерных для определенных ионов, которые могут вызывать изменение цвета, образование твердого вещества или другие видимые изменения.
Анализ осадков
Катионы обычно классифицируются в одну из шести групп в соответствии с их свойствами, а анионы классифицируются в одну из трех групп.Детали классификации немного различаются от одного источника к другому. У каждой группы есть общий реагент, который можно использовать для отделения катиона или аниона от раствора. Для получения значимых результатов разделение должно производиться в определенной последовательности, поскольку некоторые ионы более ранней группы могут также реагировать с реагентом более поздней группы, что приводит к неоднозначности относительно того, какие ионы присутствуют. Это происходит потому, что катионный анализ основан на продуктах растворимости ионов. Когда катион достигает необходимой оптимальной концентрации, он выпадает в осадок, что позволяет обнаруживать.
Анализ осаждения : Медь из проволоки вытесняет серебро в растворе нитрата серебра, в который ее окунают, и твердое серебро выпадает в осадок. Анализ осадков можно использовать для определения химического состава раствора.
В группы катионов входят:
- Те, которые образуют нерастворимые хлориды, такие как свинец, серебро и ртуть.
- Те, которые образуют нерастворимые в кислоте сульфиды, такие как кадмий, висмут, медь, сурьма и олово.
- Те, которые образуют нерастворимые гидроксидные комплексы, такие как железо, алюминий и хром.
- Цинк, никель, кобальт и марганец определяются добавлением хлорида аммония, гидроксида аммония и газообразного сероводорода. Цвет осадка укажет на металл.
- Группа нерастворимых карбонатных солей. (Хотя многие из более ранних катионов будут выпадать в осадок с карбонатом, они будут обнаружены до этого момента, если шаги были выполнены по порядку.) Барий, кальций и стронций выпадут в осадок в этот момент, но не раньше.
- Магний, литий, натрий, калий и аммоний трудно осаждать, и их обычно определяют по цвету пламени.
Есть три группы анионов, и методы их обнаружения сильно различаются. Однако часто используются методы осаждения, подобные упомянутым выше.
Колориметрический анализ
Колориметрический анализ — это метод определения концентрации химического элемента или химического соединения в растворе с помощью цветного реагента.Это применимо как к органическим соединениям, так и к неорганическим соединениям. Метод широко используется в медицинских лабораториях и в промышленных целях, например, для анализа проб воды в связи с промышленной очисткой воды.
Красящие вещества
Электронная конфигурация некоторых комплексов металлов придает им важные свойства, такие как цвет координационных соединений.
Цели обучения
Обсудите взаимосвязь между переносом заряда и цветом металлического комплекса.
Основные выводы
Ключевые моменты
- Металлические комплексы часто имеют эффектные цвета, обусловленные электронными переходами при поглощении света.
- Большинство переходов, связанных с окрашенными комплексами металлов, являются либо d – d переходами, либо полосами переноса заряда.
- Зона переноса заряда вызывает продвижение электронов с орбиталей на основе металлов и орбиталей на основе лигандов.
Ключевые термины
- неорганическая химия : химия элементов (включая углерод) и тех соединений, которые не содержат углерод.
- лиганд : ион, молекула или функциональная группа, которая связывается с другим химическим соединением с образованием более крупного комплекса.
Связывание в координационных соединениях
Многие свойства комплексов металлов продиктованы их электронным строением. Электронную структуру можно описать с помощью относительно ионной модели, которая приписывает формальные заряды металлам и лигандам. Этот подход составляет суть теории кристаллического поля (CFT), которая является ключевым понятием в неорганической химии.
Более сложные модели (по сравнению с теорией кристаллического поля) охватывают ковалентность. Этот подход описывается теорией поля лигандов (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и основанная на теории молекулярных орбиталей, может работать с более широким кругом комплексов. Это может объяснить комплексы, в которых взаимодействия ковалентны. Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя простые, основанные на симметрии решения формальных уравнений.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств. По этой причине CFT был фаворитом для обсуждений, когда это было возможно. Теории МО и НЧ сложнее, но дают более реалистичную перспективу.
Цвет в координационных соединениях
Металлические комплексы часто имеют эффектные цвета, вызванные электронными переходами из-за поглощения света. По этой причине их часто применяют в качестве пигментов. Большинство переходов, связанных с окрашенными комплексами металлов, являются либо переходами d – d, либо полосами переноса заряда.При d – d переходе электрон на d-орбитали на металле возбуждается фотоном на другую d-орбиталь с более высокой энергией. Однако электрон остается в центре металла.
Цвет различных комплексов Ni (II) в водных растворах : Слева направо, [Ni (NH 3 ) 6 ] 2+ , [Ni 3 ] 2+ , [NiCl 4 ] 2- , [Ni (H 2 O) 6 ] 2+ . Реакции, начинающиеся с NiCl2 · 6h3O, могут быть использованы для образования различных координационных комплексов никеля, поскольку лиганды h3O быстро замещаются аммиаком, аминами, тиоэфирами, тиолатами и органофосфинами.
Полоса переноса заряда влечет за собой продвижение электрона с металлической орбитали на пустую орбиталь на основе лиганда (перенос заряда от металла к лиганду или MLCT). Концептуально можно представить, что степень окисления металла увеличивается на единицу (потеря электронов), в то время как степень окисления лиганда уменьшается на единицу (становится анионной). Общий заряд системы остается прежним, но изменяется локализация электрона.
Также произойдет обратное: возбуждение электрона на орбитали на основе лиганда на пустую орбиталь на основе металла (перенос заряда лиганда на металл или LMCT).Эти явления можно наблюдать с помощью электронной спектроскопии (также известной как UV-Vis).
Именно относительная энергия этих электронных переходов позволяет им иметь поглощательную способность в видимой области. Поскольку природу лигандов и металла можно широко регулировать, можно получить множество цветов.
Цвета различных координационных комплексов : Изменение металла или лиганда может изменить цвет координационного комплекса.
Биомолекулы
Координационные комплексы обнаружены во многих биомолекулах, особенно как важные ингредиенты для активного центра ферментов.
Цели обучения
Обсудить применение координационных комплексов в биомолекулах.
Основные выводы
Ключевые моменты
- Координационные комплексы и переходные металлы являются неотъемлемым компонентом белков, особенно класса белков, которые могут выполнять химические реакции, называемых ферментами.
- Подсчитано, что примерно половина всех белков содержит металл.
- Переходные металлы, особенно цинк и железо, чаще всего находятся в активных центрах ферментов.
- В металлоферментах ион металла связан с белком одним лабильным координационным центром.
Ключевые термины
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию.
- кофактор : Вещество, особенно кофермент или металл, которое должно присутствовать для функционирования фермента.
- лабильный : свойство временных химических веществ, которое делает возможным быстрый синтез и разложение субстратов в биологических системах.
- Металлопротеин : белок, содержащий кофактор иона металла.
Координационные комплексы в биологии
Координационные комплексы (также называемые координационными соединениями) и переходные металлы широко распространены в природе. Они являются неотъемлемым компонентом белков, особенно класса белков, которые могут выполнять химические реакции, называемых ферментами. Переходные металлы, особенно цинк и железо, часто являются ключевыми компонентами активных центров ферментов. Хотя существуют другие биологически важные молекулы, которые также содержат металлы, координационные комплексы содержат центральный ион металла и играют важную роль во многих биологических процессах.
Металлопротеин — это общий термин для белка, который содержит кофактор иона металла. Большая часть всех белков — это металлоферменты, и они выполняют множество разнообразных функций, включая транспортировку, хранение и передачу сигналов.
Принципы координационной химии
В металлопротеинах ионы металлов обычно координируются азотными, кислородными или серными центрами, принадлежащими аминокислотным остаткам белка. Эти донорные группы часто представлены боковыми цепями на аминокислотных остатках.Важные донорские группы включают:
- имидазольные (донорные атомы азота) заместители в остатках гистидина
- тиолатные (атом серы) заместители в цистеиниловых остатках
- карбоксилатные группы (атом кислорода), обеспечиваемые аспартатом
Учитывая разнообразие металлопротеинов, было показано, что практически все аминокислотные остатки связывают центры металлов. Пептидный остов также обеспечивает донорные группы; они включают депротонированные амиды и амидные карбонильные кислородные центры (атомы кислорода и азота в качестве лигандов).
Помимо донорных групп, которые обеспечиваются аминокислотными остатками, большое количество органических кофакторов действует как лиганды. Возможно, наиболее известными являются тетрадентатные макроциклические лиганды N 4 , включенные в гем-белок (чаще всего рассматриваемый как часть гемоглобина). Также распространены неорганические лиганды, такие как сульфид и оксид.
Гем B : Гем B представляет собой порфирин (четыре связанных пиррольных кольца), который легко связывает железо, как показано. Это пример биомолекулы, которая содержит небелковые лиганды переходного металла.
Металлоферменты
Металлоферменты содержат ион металла, связанный с белком с одним лабильным координационным центром. Как и для всех ферментов, форма активного центра имеет решающее значение. Ион металла обычно находится в кармане, форма которого соответствует форме подложки. Ион металла катализирует реакции, которые трудно осуществить в органической химии. Рассмотрим следующую реакцию:
[латекс] \ text {CO} _2 + \ text {H} _2 \ text {O} \ rightleftharpoons \ text {H} _2 \ text {CO} _3 [/ latex]
Эта реакция протекает очень медленно в отсутствие катализатора, но довольно быстро в присутствии гидроксид-иона.- [/ латекс]
Подобная реакция с карбоангидразой протекает практически мгновенно. Структура активного центра в карбонатных ангидразах хорошо известна по ряду кристаллических структур. Он состоит из иона цинка, координированного тремя имидазольными атомами азота трех гистидиновых звеньев. Четвертый координационный узел занимает молекула воды.
Положительно заряженный ион цинка поляризует скоординированную молекулу воды, и нуклеофильная атака отрицательно заряженной части на диоксид углерода происходит быстро.+ [/ латекс]
Активный центр карбоангидразы : Активный центр карбоангидразы. Три координирующих остатка гистидина показаны зеленым, гидроксид — красным и белым, а цинк — серым.
Что такое координационное соединение?
Что такое координационное соединение? Что такое координационное соединение?Координационный комплекс является продуктом кислотно-основной реакции Льюиса, в которой нейтральные молекулы или анионы (называемые лигандами ) связываются с центральным атомом (или ионом) металла координационными ковалентными связями .
- Лиганды — это основания Льюиса — они содержат, по крайней мере, одну пару электронов, которые будут отданы атому / иону металла. Лиганды также называют комплексообразующими агентами .
- Атомы / ионы металлов являются кислотами Льюиса — они могут принимать пары электронов от оснований Льюиса.
- В лиганде атом, который непосредственно связан с атомом / ионом металла, называется донорным атомом .
- Координационная ковалентная связь — это ковалентная связь, в которой один атом (т.е.е., донорный атом) поставляет оба электрона. Этот тип связи отличается от обычной ковалентной связи, в которой каждый атом поставляет один электрон.
- Если координационный комплекс несет общий заряд, комплекс называется комплексным ионом .
- Соединения, содержащие координационный комплекс, называются координационными соединениями .
Координационные соединения и комплексы представляют собой разные химические соединения — их свойства и поведение отличаются от атома / иона металла и лигандов, из которых они состоят.
Координационная сфера координационного соединения или комплекса состоит из центрального атома / иона металла и связанных с ним лигандов. Координационная сфера обычно заключена в скобки при записи в формуле.
Координационное число — это количество донорных атомов, связанных с центральным атомом / ионом металла.
| Некоторые координационные комплексы | |||||
|---|---|---|---|---|---|
| пример | молекулярная формула | Основание / лиганд Льюиса | Кислота Льюиса | донорный атом | координационный номер |
| [Ag (NH 3 ) 2 ] + | NH 3 | Ag + | N | 2 | |
| [Zn (CN) 4 ] 2- | CN — | Zn 2+ | С | 4 | |
| [Ni (CN) 4 ] 2- | CN — | Ni 2+ | С | 4 | |
| [PtCl 6 ] 2- | Класс — | Pt 4+ | Класс | 6 | |
| [Ni (NH 3 ) 6 ] 2+ | NH 3 | Ni 2+ | N | 6 |
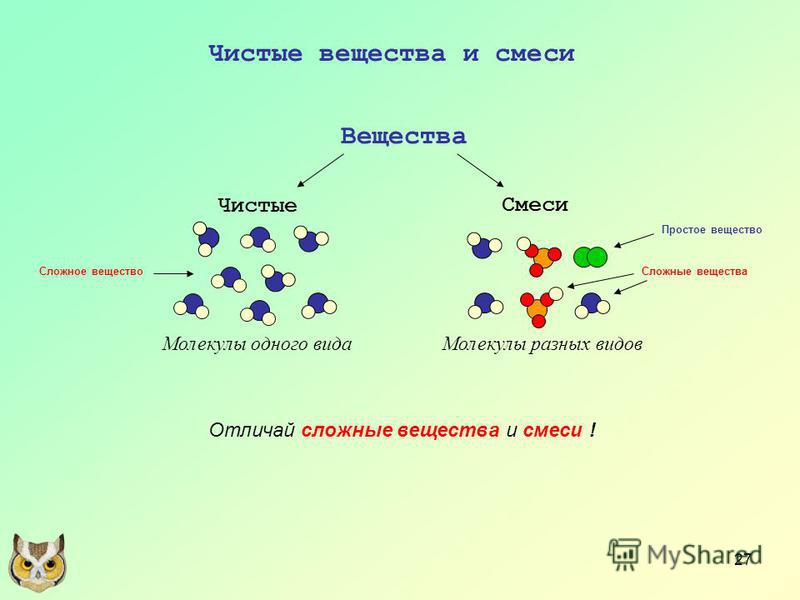 Химия (8-9 классы)
Химия (8-9 классы)