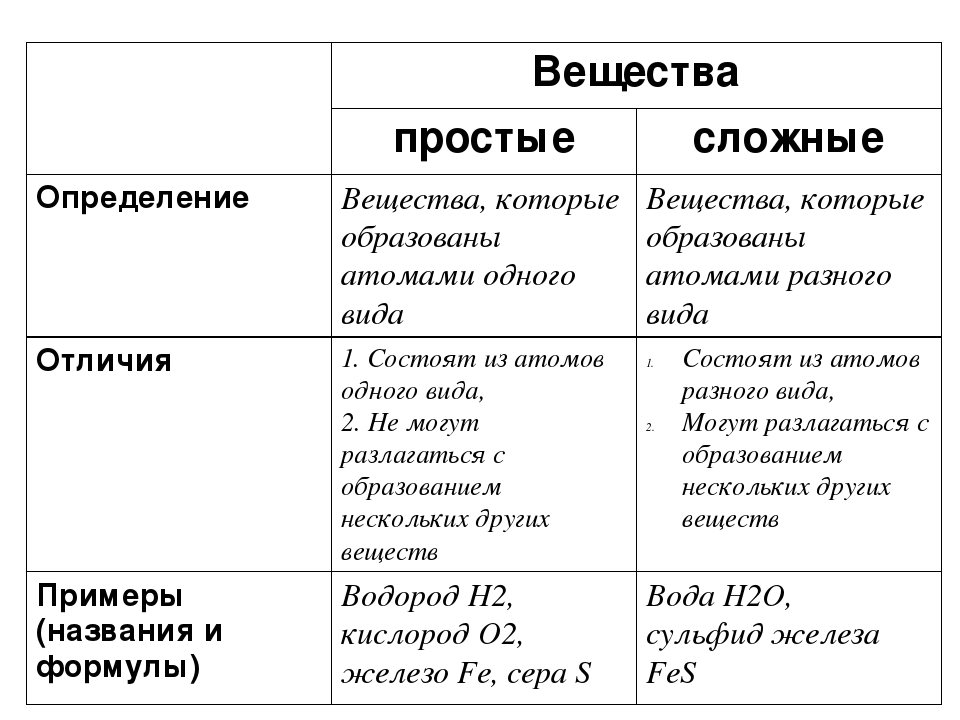
Металлы и неметаллы — урок. Химия, 8–9 класс.
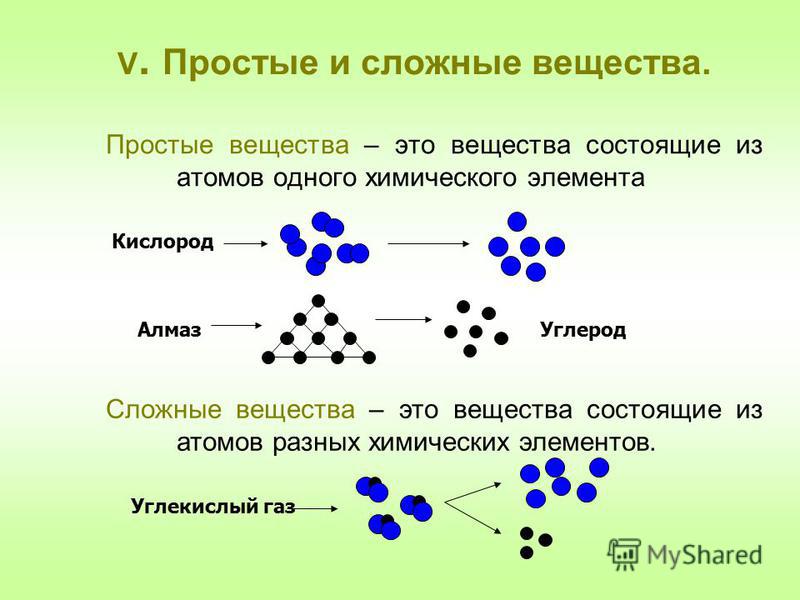
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Рис. \(1\). Ртуть
Рис. \(2\). Железо
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Рис. \(3\). Хлор
Рис. \(4\). Бром
Рис. \(5\). Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Рис. \(6\). Уголь
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Рис. \(7\). Периодическая таблица
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Источники:
Рис. 1. Ртуть https://www.shutterstock.com/ru/image-illustration/shiny-mercury-hg-metal-drops-droplets-373508821
Рис. 2. Железо https://www.shutterstock.com/ru/image-photo/99-fine-electrolytic-iron-isolated-on-1687925125
Рис. 3. Хлор https://image.shutterstock.com/image-photo/chlorine-gaz-glass-round-bottom-600w-713676862.jpg
Рис. 4. Бром https://image.shutterstock.com/image-photo/macroview-on-ampoule-element-no-600w-1739647871.jpg
Рис. 5. Сера https://www.shutterstock.com/ru/image-photo/yellow-natural-native-sulfur-crystal-isolated-729259936
Рис. 6. Уголь https://www.shutterstock.com/ru/image-photo/activated-charcoal-isolated-on-white-background-1446133922
Рис. 7. Периодическая таблица © ЯКласс
7. Периодическая таблица © ЯКласс
Сложные вещества — урок. Химия, 8–9 класс.
Химические элементы входят в состав сложных веществ (химических соединений).
Сложными называют вещества, состоящие из атомов разных химических элементов.
Большинство химических веществ являются сложными.
Многие сложные вещества имеют молекулярное строение. К молекулярным относятся метан Ch5, вода h3O, углекислый газ CO2, серная кислота h3SO4, глюкоза C6h22O6. Пластмассы, белки, жиры, крахмал тоже представляют собой сложные вещества, состоящие из молекул.
Рис. \(1\). Модель молекулы воды
Рис. \(2\). Модель молекулы этанола
Немолекулярное строение имеет песок SiO2, а также все сложные вещества, в состав которых входят металлы: поваренная соль NaCl, мел CaCO3, питьевая сода NaHCO3 и многие другие. Из сложных веществ немолекулярного строения состоят минералы и горные породы.
Из сложных веществ немолекулярного строения состоят минералы и горные породы.
Рис. \(3\). Модель кристалла поваренной соли
При определённых условиях сложные вещества можно разложить на несколько новых веществ. Так под действием электрического тока вода разлагается на водород и кислород, а сахар при нагревании превращается в уголь и воду.
Водород и кислород совсем не похожи на воду. При обычных условиях водород и кислород представляют собой газы, а вода — жидкость. Уголь и вода ничем не напоминают сахар.
Обрати внимание!
Свойства сложного вещества не являются суммой свойств веществ, образующихся при его разложении.
Источники:
Рис. 1. Модель молекулы воды https://cdn.pixabay.com/photo/2013/07/13/13/41/molecule-161361_960_720.png
Рис. 2. Модель молекулы этанола https://upload.wikimedia.org/wikipedia/commons/0/00/Ethanol-3D-vdW.png
Рис. 3. Модель кристалла поваренной соли https://upload.wikimedia. org/wikipedia/commons/thumb/7/70/Lithium-chloride-3D-ionic.png/1024px-Lithium-chloride-3D-ionic.png
org/wikipedia/commons/thumb/7/70/Lithium-chloride-3D-ionic.png/1024px-Lithium-chloride-3D-ionic.png
| 1. В каком ряду перечислены два сложных вещества и одно простое: | |
| а) кислород, азот, вода | б) хлор, аммиак, углекислый газ |
| в) водород, бром, углерод | г) алмаз, оксид кремния (IV), медь |
| 2. Аллотропные видоизменения кислорода – озон и кислород – различаются между собой: | |
| а) все ответы верны | б) физическими свойствами |
| в) химическими свойствами | г) количественным составом молекул |
| 3. В каких выражениях речь идет о простом веществе кислород, а не о химическом элементе: | |
| а) кислород входит в состав воды | б) кислород плохо растворяется в воде |
| в) в оксиде меди (II) массовая доля кислорода составляет 20 % | г) все ответы верны |
4. Какие утверждения справедливы для понятия «простое
вещество»: Какие утверждения справедливы для понятия «простое
вещество»: | |
| а) форма существования химического элемента в природе | б) все ответы верны |
| в) состоит из атомов одного вида | г) простых веществ больше, чем химических элементов |
| 5. Найдите вариант ответа, где указано простое вещество: | |
| 6. К простым веществам относится каждое из двух веществ: | |
| а) натрий и вода | б) хлор и углерод |
| в) кислород и сульфат натрия | г) серная кислота и аммиак |
7..jpg) В перечне азотная кислота, калий,
нитрат кальция, железо, оксид натрия, сульфид бария, фосфора — число формул
простых веществ равно: В перечне азотная кислота, калий,
нитрат кальция, железо, оксид натрия, сульфид бария, фосфора — число формул
простых веществ равно: | |
| 8. К сложным веществам относятся: | |
| 9. Аллотропные модификации углерода: | |
| г) все ответы верны | |
| 10. Благородные газы: | |
| г) все ответы верны | |
Простые и сложные вещества.
 Аллотропия
Простые и сложные вещества. Аллотропий [c.8]
Аллотропия
Простые и сложные вещества. Аллотропий [c.8]Атом, элемент, молекула — важнейшие понятия в химии. Многообразие химических соединений определяется взаимодействием атомов друг с другом, при этом образуются простые и сложные вещества. Атомы одного и того же элемента способны образовывать несколько простых веществ, чем и обусловлена аллотропия. Каждое соединение характеризуется своим качественным и количественным составом, который постоянен для молекул одного и того же вещества. Состав простых и сложных веществ может быть изображен с помощью символов атомов соответствующих химических элементов с указанием их количества. [c.25]
Простые и сложные вещества. Понятие о химическом элементе. Аллотропия. Металлы и неметаллы, различие их физических и химических свойств. [c.11]
Основополагающим понятием современной химии является понятие о химическом элементе , т. е. виде атомов с определенной совокупностью свойств. Под свойствами изолированных атомов подразумеваются заряд ядра и атомная масса, особенности электронного строения, потенциалы ионизации, сродство к электрону и электроотрицательность, атомные, орбитальные и ионные радиусы н т. д. Однако необходимо иметь в виду, что изолированные атомы как форма организации вещества могут существовать в природе лишь при достаточно высоких температурах в виде моноатомного пара. Единственным исключением являются благородные газы, для которых при любых условиях и в любом агрегатном состоянии структурной единицей является атом. Все остальные элементы существуют в природе в виде более сложных агрегатов молекул и кристаллов. Таким образом, следует строго различать понятия элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Следует особо подчеркнуть нетождественность этих понятий хотя бы потому, что один элемент может существовать в виде нескольких простых веществ (аллотропия) .
е. виде атомов с определенной совокупностью свойств. Под свойствами изолированных атомов подразумеваются заряд ядра и атомная масса, особенности электронного строения, потенциалы ионизации, сродство к электрону и электроотрицательность, атомные, орбитальные и ионные радиусы н т. д. Однако необходимо иметь в виду, что изолированные атомы как форма организации вещества могут существовать в природе лишь при достаточно высоких температурах в виде моноатомного пара. Единственным исключением являются благородные газы, для которых при любых условиях и в любом агрегатном состоянии структурной единицей является атом. Все остальные элементы существуют в природе в виде более сложных агрегатов молекул и кристаллов. Таким образом, следует строго различать понятия элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Следует особо подчеркнуть нетождественность этих понятий хотя бы потому, что один элемент может существовать в виде нескольких простых веществ (аллотропия) .
Употребляются два термина, отражающих способность веществ существовать в разных формах, — аллотропия и полиморфизм. Первый относится только к простым веществам независимо от их агрегатного состояния (кислород—озон, алмаз—графит и т. п.). Второй относится только к твердому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твердых веществ (кристаллическая сера, фосфор, железо и др.). [c.321]
Простые и сложные вещества. Аллотропия [c.12]
Вещества делят на простые и сложные. Простые вещества состоят из атомов одиого и того же элемента их можно рассматривать как форму существования элементов в свободном состоянии. В настоящее время известно 107 элементов, а простых веществ гораздо больше, поскольку многие нз них образуют несколько видоизменений (модификаций). Существование химического элемента в виде нескольких простых веществ получило название аллотропии (от греч.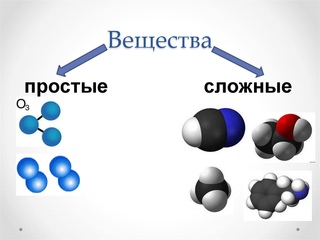
Используется также термин полиморфизм ( много форм ). Под этим термином часто понимают разные кристаллические структурные формы простого и сложного вещества говорят, например, о полиморфных модификациях металлов и сложных вещ,еств (Т 02, 8102 и др.). Необходимо эти два понятия — аллотропия и полиморфизм —разграничивать. Понятие аллотропия относят к модификациям простых веществ, которые образует один и тот же элемент, тогда как термин полиморфизм целесообразно применять при рассмотрении модификаций одного и того же сложного вещества (АиОз, ТЮг и др.) таким образом три понятия — аллотропия, полиморфизм и изоморфизм — получат свою логическую качественную дифференциацию. [c.33]
Классификация сложных соединений. Термином сложные химические соединения определяют химические индивиды, содержащие три элемента и более. Если простых веществ (с учетом аллотропии и полиморфизма) насчитывается около 200, а бинарных соединений — порядка 10 ООО, то сложных химических соединений значительно больше. Традиционно эти объекты подразделяются на три класса основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения, поскольку существуют комплексные кислоты, комплексные основания и комплексные соли. Однако уже среди комплексных соединений встречаются такие, которые невозможно отнести ни к одному из перечисленных классов. Таковы, например, карбонилы металлов, многие хелаты и внутрикомплексные соединения. Таким образом, уже применительно к комплексным соединениям приведенная классификация не является полной. Но существуют сложные соединения, которые не относятся и к комплексным, хотя их также нельзя рассматривать в рамках данной классификации. В частности, такие соединения, как Сс18пА82, 2пСеР2, СиГеЗг и т.
Термином сложные химические соединения определяют химические индивиды, содержащие три элемента и более. Если простых веществ (с учетом аллотропии и полиморфизма) насчитывается около 200, а бинарных соединений — порядка 10 ООО, то сложных химических соединений значительно больше. Традиционно эти объекты подразделяются на три класса основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения, поскольку существуют комплексные кислоты, комплексные основания и комплексные соли. Однако уже среди комплексных соединений встречаются такие, которые невозможно отнести ни к одному из перечисленных классов. Таковы, например, карбонилы металлов, многие хелаты и внутрикомплексные соединения. Таким образом, уже применительно к комплексным соединениям приведенная классификация не является полной. Но существуют сложные соединения, которые не относятся и к комплексным, хотя их также нельзя рассматривать в рамках данной классификации. В частности, такие соединения, как Сс18пА82, 2пСеР2, СиГеЗг и т.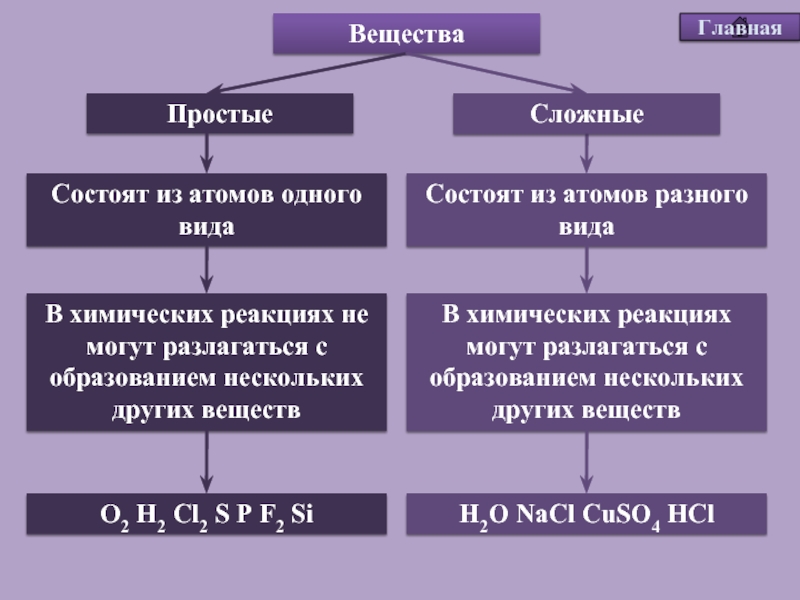
Химические элементы. Знаки химических элементов и химические формулы. Простое вещество, сложное вещество. Аллотропия. [c.500]
Химический элемент (19). — 4. Простое вещество. Аллотропия (22). — 5. Сложное вещество. Моль. (23). — 6. Закон Авогадро (24) — 7. Валентность. Степень окисления. Химические формулы (26) — Упражнения к главе 1 (28). [c.1]
Простыми называются вещества, состоящие только из одного элемента. У них, очевидно, каждая молекула (а следовательно, и все молекулы) содержит атомы только одного вида. Одному элементу может отвечать несколько различных простых веществ в зависимости от числа атомов, содержащихся в их молекулах. Это является частным случаем аллотропии. Сложными называются вещества, состоящие из двух или большего числа элементов. У них, очевидно, каждая молекула содержит соответ-. ственно атомы двух или больше видов. [c.65]
Одному элементу может отвечать несколько различных простых веществ в зависимости от числа атомов, содержащихся в их молекулах. Это является частным случаем аллотропии. Сложными называются вещества, состоящие из двух или большего числа элементов. У них, очевидно, каждая молекула содержит соответ-. ственно атомы двух или больше видов. [c.65]
Вещества простые и сложные. Аллотропия 9. Явления физические и химические. Смеси в хими ческне соединения. ….. [c.470]
При дальнейшем систематическом изучении химии простых и сложных веществ по группам периодической системы принята единая последовательность состав и строение простых веществ, аллотропия, физические и химические свойства, получение, применение. Некоторые пункты плана иногда опускаются, если, например, получение веществ требует рассмотрения сложных для понимания процессов или применение вещества ограничено. Однако в некоторых случаях авторами избирается другой подход. Вещества изучаются не по группам периодической системы, а по периодам. Изучение по подгруппам переносится в этом случае на старшую ступень обучения. [c.263]
Изучение по подгруппам переносится в этом случае на старшую ступень обучения. [c.263]
Вещества простые и сложные. Аллотропия [c.119]
Термином полиморфизм мы будем пользо ваться как для сложных, так и для простых веществ, не вводя для последних специального термина аллотропия. [c.212]
Следовательно, в виде полиморфных форм встречаются как сложные, так и простые вещества. Частным случаем полиморфизма является аллотропия ( 9) — полиморфизм простых веществ. [c.87]
Полиморфизм следует отличать от явления аллотропии. Явление полиморфизма связано с различием только в кристаллическом строении веществ одного и того же химического состава, как простых, так и сложных. [c.86]
Элемент (или соединенне) называют полиморфным, если он (оно) образует две или более кристаллические фазы, различающиеся атомным расположением. Более ранний термин аллотропия используется и сейчас для того, чтобы обозначить различные формы элементов но, за исключением особого случая Оа II Оз, аллотропы являются просто полиморфными модификациями.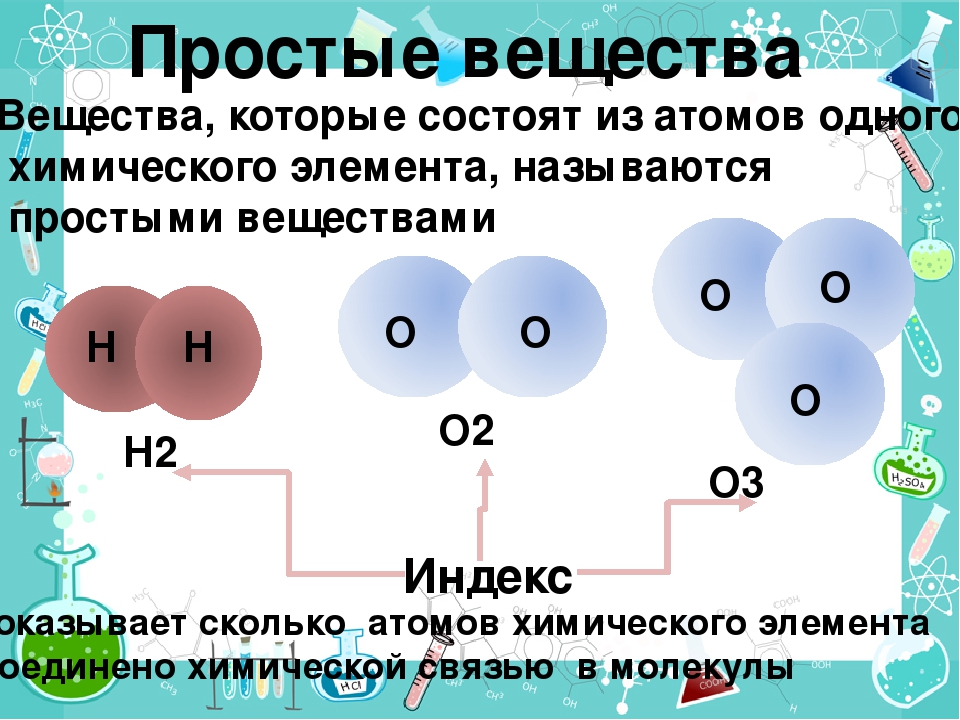 Полиморфизм элементов и соединений — скорее правило, чем исключение, и структурная химия любого элемента или соединения включает структуры всех его полиморфных модификаций, точно так же как понятие молекулы включает структуры ее изомеров. Различия между структурами полиморфных модификаций колеблются от таких очень незначительных, как изменение ориентации молекулы или иона от фиксированной до произвольной (или полного вращения) в высокотемпературной форме вещества (примерами могут служить кристаллический НС1, соли, содержащие Nh5+, NO3 , N и другие сложные ионы) или как — -изменения форм Si02, до таких больших различий, как перестройка всего кристалла (полиморфные модификации С, Р, Si02 и т. д.). [c.20]
Полиморфизм элементов и соединений — скорее правило, чем исключение, и структурная химия любого элемента или соединения включает структуры всех его полиморфных модификаций, точно так же как понятие молекулы включает структуры ее изомеров. Различия между структурами полиморфных модификаций колеблются от таких очень незначительных, как изменение ориентации молекулы или иона от фиксированной до произвольной (или полного вращения) в высокотемпературной форме вещества (примерами могут служить кристаллический НС1, соли, содержащие Nh5+, NO3 , N и другие сложные ионы) или как — -изменения форм Si02, до таких больших различий, как перестройка всего кристалла (полиморфные модификации С, Р, Si02 и т. д.). [c.20]
Простые и сложные вещества. Аллотропия простых вещестБ [c.7]
Термином сложные химические соединения определяют хи. шче-ские индивиды, содержащие три и более компонентов. Если простых веществ (с учетом аллотропии и полиморфизма) насчитывается около 200, а бинарных соединении — порядка 10 ООО, сложных многокомпонентных соединений значительно больше. Традиционно эти объекты подразделяют на 3 класса основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения, поскольку существуют, например, комплексные кислоты (HJPt lel), комплексные основания ([Ag (ЫНз)210Н) и комплексные [c.79]
Традиционно эти объекты подразделяют на 3 класса основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения, поскольку существуют, например, комплексные кислоты (HJPt lel), комплексные основания ([Ag (ЫНз)210Н) и комплексные [c.79]
Простые и сложные вещества
1. Простыми называются вещества, которые состоят из атомов одного химического элемента (О2, Н2, Na, Al)
2. Сложными называются вещества, которые состоят из нескольких химических элементов (H2O, CuSO4)
3. Оксиды — сложные вещества, которые состоят из атомов двух химических элементов, один из которых кислород со степенью окисления -2.
4. Основные оксиды — оксиды, которым соответствуют основания (CaO — Ca(OH)2)
5. Кислотные оксиды — оксиды, которым соответствуют кислоты (P2O5 — H3PO4, Mn2O7 — HMnO4)
6. Амфотерные оксиды — оксиды, проявляющие основные и кислотные свойства (Al2O3, BeO, ZnO, Cr2O3)
Амфотерные оксиды — оксиды, проявляющие основные и кислотные свойства (Al2O3, BeO, ZnO, Cr2O3)
7. Несолеобразующие оксиды — не проявляют ни основных ни кислотных свойств (N2O, NO, CO)
8. Кислоты — сложные вещества, которые состоят из атомов водорода и кислотных остатков
HCl — соляная кислота (хлороводородная) (хлориды)
HNO3 — азотная (нитраты)
H2SO4 — серная (сульфаты)
H3PO4 — фосфорная (фосфаты)
H2CO3 — угольная (карбонаты)
H2S — сероводородная (сульфиды)
H2SO3 — сернистая (сульфиты)
H2SiO3 — кремниевая (силикаты)
HF — фтороводородная (плавиковая) (фториды)
HBr — бромоводородная (бромиды)
HNO2 — азотистая (нитриты)
9.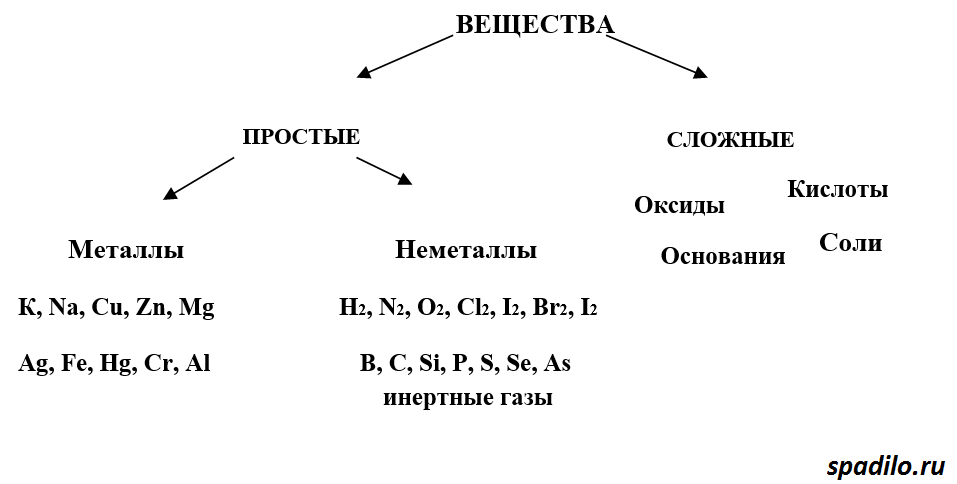 Основания — сложные вещества, которые состоят из катиона металла и гидроксид-ионов (NaOH, Fe(OH)3). Растворимые в воде основания называют щелочами.
Основания — сложные вещества, которые состоят из катиона металла и гидроксид-ионов (NaOH, Fe(OH)3). Растворимые в воде основания называют щелочами.
10. Соли — сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков (NaCl, CuSO4)
Давайте порассуждаем вместе
1. Сульфат алюминия относят к классу:
1) оксидов
2) оснований
3) солей
4) кислот
Ответ: сульфат алюминия Al2(SO4)3 относят к классу солей, т.к. это сложное вещество, которое состоит из катионов металла алюминия и кислотных остатков сульфат-анионов.
2. Кислотой и щелочью соответственно являются вещества, формулы которых:
1) HCl, Cu(OH)2
2) HNO3, Ba(OH)2
3) NaCl, NaOH
4) H2SiO3, Fe(OH)2
Ответ: правильный ответ №2, т.
к. HNO3 — это азотная кислота, а Ва(OH)2 — основание, которое хорошо растворяется в воде, значит является щелочью
3. Основному оксиду соответствует формула:
1) SO3
2) NO2
3) MgO
4) P2O5
Ответ: MgO — основный оксид, т.к. ему соответствует основание Mg(OH)2
4. Амфотерным оксидом и кислотным оксидом соответственно явлются вещества:
1) Al2O3, SO2
2) NaOH, P2O5
3) ZnO, HCl
4) Zn(OH)2, H2SO4
Ответ: правильный ответ №1, т.к. Al2O3 — амфотерный оксид, а SO2 — кислотный оксид, ему соответствует сернистая кислота H2SO3
5. Нерастворимым основанием и солью соответственно являются вещества:
Нерастворимым основанием и солью соответственно являются вещества:
1) KOH, Ca(NO3)2
2) CaO, Na2CO3
3) Mg(OH)2, H2SO4
4) Fe(OH)3, AgBr
Ответ: правильный ответ №4, т.к. Fe(OH)3 — нерастворимое основание, а AgBr — бромид серебра — соль
Простые и сложные вещества | Природоведение. Реферат, доклад, сообщение, краткое содержание, конспект, сочинение, ГДЗ, тест, книга
Тема: Тела и вещества
Простые вещества. В образовании некоторых веществ участвуют атомы лишь одного вида, то есть одного химического элемента. Используя справочную табл. 4 , рассмотрим примеры. Из атомов химического элемента алюминия образовано простое вещество алюминий. В составе этого вещества — только атомы алюминия. Как и алюминий, простое вещество железо состоит из атомов одного химического элемента — железа.
В составе этого вещества — только атомы алюминия. Как и алюминий, простое вещество железо состоит из атомов одного химического элемента — железа.
| Железо и алюминий — простые вещества |
Вещества, образованные атомами только одного химического элемента, называются простыми.
К простым веществам относится также кислород. Но от алюминия и железа это простое вещество отличается тем, что атомы кислорода, из которых вещество состоит, соединены по два в одной молекуле. В составе Солнца больше всего водорода — простого вещества, молекулы которого также двухатомные.
В составе простых веществ могут быть либо атомы, либо молекулы, образованные из двух или более атомов одного химического элемента.
Сложные вещества. Простых веществ известно несколько сотен, а сложных — миллионы. Они состоят из атомов разных элементов. Действительно, молекула сложного вещества воды содержит атомы водорода и кислорода, а сложного вещества метана — атомы водорода и углерода. Обратите внимание, что молекулы обоих веществ содержат атомы водорода. В молекуле воды имеется один атом кислорода, а в молекуле метана — один атом углерода.
Действительно, молекула сложного вещества воды содержит атомы водорода и кислорода, а сложного вещества метана — атомы водорода и углерода. Обратите внимание, что молекулы обоих веществ содержат атомы водорода. В молекуле воды имеется один атом кислорода, а в молекуле метана — один атом углерода.
| Вода и глюкоза — сложные вещества |
Насколько незначительны различия в составе молекул и насколько значительны — в их свойствах! Метан — легковоспламеняющееся огнеопасное вещество, а вода не горит и используется при тушении пожаров.
Сложными называют вещества, образованные атомами разных химических элементов.
Рассмотрите рис. 19. В каких случаях изображено образование простых веществ, а в каких — сложных? Материал с сайта //iEssay.ru
Рис. 19. Модели образования молекул простых и сложных веществ: а — йод; б — озон; в — йодоводород; г — вода 19. Модели образования молекул простых и сложных веществ: а — йод; б — озон; в — йодоводород; г — вода |
Различия между смесями веществ и сложными веществами
Купить неорганические реактивы, inorganic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены неорганические реактивы — категории: ;
Купить органические соединения, реактивы, organic chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены органические соединения, реактивы — реактивы Карла Фишера для волюметрии, реактивы HYDRANAL, органические растворители, органические кислоты, органические соли и соединения, категории: reagents for Karl Fischer volumetry, other reagents HYDRANAL, organic solvents, organic acids, organic salts and compounds, ; , , , , органические соединения, органические соли,реактивы Карла Фишера для волюметрии
Подробнее. ..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…
..
Купить реактивы карла фишера для волюметрии — reagents for Karl Fischer volumetry в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Использование реактивов Гидранал позволяет определить воду в составе химических реактивов, пищевых продуктов, фармацевтическихпрепаратов. Содержание воды влияет на множество химических и физических параметров выпускаемой продукции. Реактивы Карла Фишера произв…органические растворители
Подробнее… Купить органические растворители (organic solvents) в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический растворитель в Санкт-Петербурге по выгодной цене. Компания ХИМСНАБ-СПБ предлагает следующую фасовку растворителей: п/э или стеклянная бутылка 1 литр; п/э канистра 10 литров; п/э канистра 5 литров; стеклянный флакон 1 литр, бочка, и бочка, 250 кг. Реактивы и растворители. ..
..органические кислоты
Подробнее… Купить органические кислоты — organic acids в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Органические вещества, проявляющие кислотные свойства (кислоты их кислые соли и средние соли содержатся во многих товарах. Благодаря наличию свободных кислот и кислых солей многие продукты и их водные вытяжки обладают кислой реакцией. К ним относятся карбоновые кислоты, содержа…Купить химические реактивы, chemicals в Санкт-Петербурге
В каталоге товаров/продукции представлены химические реактивы — вода, неорганические реактивы, органические соединения, реактивы, растворы, особо чистые вещества, категории: water, inorganic chemicals, organic chemicals, solutions, highly purified substances, ; дистиллированная вода, вода (УФ-ВЭЖХ) для аналитики, бидистиллированная вода, вода для молекулярной биологии, , , , ,неорганические реактивы
Подробнее. ..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…
..
Купить неорганические реактивы — inorganic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93.
Неорганическое соединение, как правило, представляет собой химическое соединение, которое не имеет связей СН , то есть соединение, которое не является органическим соединением
Химические соединения, реагенты и реактивы находят свое применение в различных областях: научные-исследов…органические соединения, реактивы
Подробнее… Купить органические реактивы — organic chemicals в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. Купить органический реактив в Санкт-Петербурге по выгодной цене. химические реактивы химические реактивы химические реактивы хим. реактивы продукцию chemicals химические реактивы, chemicals вода, неорганические реактивы, органические реактивы, растворы, особо чистые вещества особо чистые веще. ..
..растворы
Подробнее… Купить растворы — solutions в ХИМСНАБ-СПБ, контактный телефон +7-812-337-18-93. В каталоге ХИМСНАБ-СПБ представлен большой выбор готовых специальных растворов различного назначения: буферные растворы, растворы для заполнения, очистки и хранения электродов, стандартные растворы для кондуктометров, реактивы карла фишера для кулонометрии. Купить раствор в Санкт-Петербурге по выгодной цене: …особо чистые вещества
Подробнее… Купить особо чистые вещества (ультрачистые вещества) в Санкт-Петербурге, в компании Химснаб-СПБ, телефон +7-812-337-18-93. В высокочистых веществах содержатся примесей в незначительном количестве, что они не влияют на основные специфические свойства веществ. Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени… Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Свойства особо чистых веществ используют для создания новых приборов, устройств и технологических процессов. Они находят применени… Оставьте заявку ON-LINE или позвоните. Менеджер компании ответит на ваши вопросы.
Широкий ассортимент
В каталоге компании более 4000 наименований продукции в 200 товарных категориях: химические реактивы, лаб. оборудование и посуда, аксессуары и принадлежности для лабораторий, различные виды удобрений, химическое сырьеи многе другое. Можно подобрать продукцию воспользовавшись фильтром характеристик.
Проверенные поставщики
Компания реализует товары и продукцию только от проверенных поставщиков гарантирующих качестно продукции.
Консультация по продукции
Менеджеры компании проконсультируют вас по ассортименту реализуемой продукции, звоните в рабочее время
Доставка
География потребителей выходит за пределы России, компания «Химснаб-СПБ» осуществляет доставку приобретаемых товаров и продукции по Санкт-Петербургу, Ленинрадской обл, России и странам СНГ.
Индивидуальный подход
Строим свое сотрудничество с клиентом с учетом всех пожеланий клиента.
Гибкий и индивидуальный подход к каждому клиенту, ориентированность на долгосрочные партнерские отношения, строгое соблюдение оговоренных сроков и предоставления документов заказчику являются неоспоримыми преимуществами компании «Химснаб-СПБ». Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Мы заботимся о том, чтобы каждый наш клиент остался доволен приобретаемой продукцией и полученным результатом, который является нашим общим успехом!
Малотоннажная химия
Реализация продукции малотоннажной химии: продукция химической и нефтехимической промышленности. Малотоннажная химия дает возможность на скромном оборудовании и в небольших объемах производить дорогостоящие модификаторы, пластификаторы, ингибиторы и другие микродобавки, способные наделять конечный продукт новыми свойствами
Комплексное снабжение, оснащение
Компания Химснаб-СПБ имеет многолетний опыт работы на рынке химической продукции и лабораторного оборудования. Компания тесно сотрудничает со многими промышленными и производственными организациями и имеет возможность осуществлять комплексное снабжение и оснащение предприятии различных отраслений промышленности необходимым оборудованием и расходными материалами.
Предствленная информация на страницах данного интернет-сайта и в каталоге продукции носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ. Для получения подробной информации о наличии и стоимости указанных товаров и (или) услуг,обращайтесь к менеджерам отдела продаж: форма обратной связи, e-mail, телефон.
Реализация продукции для сельского хозяйства, химической, строительной, нефтегазовой, металлургической, текстильной, кожевенной, и других отраслей промышленности.
Сложные вещества. Жесткость воды
Комплексные вещества: водаКомплексные вещества
Сложные вещества — химическое вещество, образованное сочетанием нескольких простых веществ.
В нашей экономике мы используем сложные вещества больше и простые вещества меньше. Соли оксидов, оснований или щелочей, кислот используются нами как комплексных веществ , а также многие органические соединения, такие как спирты, парафины, альдегиды и др.
Вода
| Ваш Waight | Суточная норма |
| 18 кг | 0,5 л |
| 27 кг | 0,75 л |
| 36 кг | 1,0 л |
| 45 кг | 1,25 л |
| 54 кг | 1,5 л |
| 63 кг | 1,75 л |
| 72 кг | 2,0 л |
| 81 кг | 2,25 л |
| 90 кг | 2,5 л |
| 99 кг | 2,75 л |
| 108 кг | 3,0 л |
| 117 кг | 3,25 л |
| 126 кг | 3,5 л |
| 135 кг | 3,75 л |
| 144 кг | 4,0 л |
Вода — сильный растворитель.Как вы думаете, при какой температуре вода больше весит? Наибольшая плотность воды наблюдается при температуре 4 0 ° C, выше и ниже этой температуры плотность постепенно уменьшается. Соответственно, наибольший вес воды составляет 4 0 C.
Соответственно, наибольший вес воды составляет 4 0 C.
Вода дистиллированная по вкусу отличается от обычной воды. Это связано с тем, что в обычной воде растворены разные соли, это соли кальция (присутствие этих солей затрудняет образование мыла при стирке), магния (обычно придает воде горечь), а также соли железа, соли щелочных металлов и многие другие вещества.Вода, обогащенная ионами металлов, полезными для организма (но не из-под крана!). Например, калий и магний для работы сердечной мышцы, кальций и железо для свертывания крови, натрий для образования минеральных солей, с щелочной реакцией и способен разлагать органические вещества.
Всем известно, что человеческий организм на 81% состоит из воды и, конечно же, нуждается в постоянном пополнении. Следовательно, норма потребления воды организмом человека в зависимости от веса человека:
Жесткость воды
Жесткость воды — определяется наличием в воде катионов кальция (Ca) и магния (Mg). Чем выше количество этих катионов, тем жесткость воды больше . Имеется временной жесткости и постоянной жесткости воды. Временная твердость снимается кипячением. Соли, которые растворяются (гидрокарбонаты кальция и магния Ca (HCO 3 ) 2 , Mg (HCO 3 ) 2 ) легко обесцвечиваются при нагревании до воды и углекислого газа:
Чем выше количество этих катионов, тем жесткость воды больше . Имеется временной жесткости и постоянной жесткости воды. Временная твердость снимается кипячением. Соли, которые растворяются (гидрокарбонаты кальция и магния Ca (HCO 3 ) 2 , Mg (HCO 3 ) 2 ) легко обесцвечиваются при нагревании до воды и углекислого газа:
Ca (HCO 3 ) 2 → CaCO 3 + H 2 O + CO 2
Mg (HCO 3 ) 2 → MgCO 3 + H 2 O + CO 2
Постоянная жесткость кипение удалить невозможно.Эта вода содержит соли — сульфаты, хлориды, нитраты, кальций, магний. Но можно попробовать избавиться от постоянной жесткости воды: используйте известковое молоко (гашеную известь — Ca (OH) 2 ) или соду).
Одним из наиболее эффективных способов удаления постоянной жесткости воды является использование ортофосфата натрия (Na 3 PO 4 ). При реакции с водой соли выпадают в воду:
При реакции с водой соли выпадают в воду:
Ca (HCO 3 ) 2 + 2Na 3 PO 4 → Ca 3 (PO 4 ) 2 + 6NaHCO 3
3MgSO 4 + 2Na 3 PO 4 → Mg 3 (PO 4 ) 2 + 3Na 2 SO 4
При закипании воды жесткости на стенах посуды образуется накипь — соли кальция и магния.Они плохо переносят тепло. Если накипи образовалось много, стенки посуды могут перегреться.
При стирке в жесткой воде мыло израсходовалось намного больше. Это связано с тем, что образуются сложные вещества — стеараты кальция и магния (Ca (C 17 H 35 C00) 2 и Mg (C 17 H 35 COO) 2 )
Овощи дольше сохраняются в воде жесткости, потому что углеводы, содержащиеся в овощах, образуют нерастворимые комплексные вещества из солей кальция и магния.
Вода и лед . Почему вода тяжелее льда ?!
Почему вода тяжелее льда ?!
Фрагменты (H 2 O) 8 сохраняются в жидкой воде. Количество одинаковых молекул воды внутри таких агрегатов H 2 O, поэтому плотность воды выше плотности льда (900 кг / м 3 )
О проточной питьевой воде :
Всем известно, что очистка воды производится с помощью хлорки или хлорсодержащего раствора.В такой воде микроорганизмы не могут выжить и погибнуть.
Но качество воды ухудшается, потому что хлор — очень мощное окисляющее вещество, которое вступает в реакцию с растворенными примесями и образует хлорорганические соединения, вредные для здоровья. Диоксины — самые токсичные и вредные вещества. Эти вещества — настоящие яды!
Они наносят вред человеческим органам, нарушают их нормальное функционирование. Но некоторые фильтры не всегда справляются с растворенным хлором.
Из всей воды на нашей планете только 1% пригоден для питья. Несмотря на то, что существует множество различных фильтров для очистки, даже самый лучший фильтр (слои, содержащие ионообменную среду, активированный уголь) не способен удалить все токсичные вещества из воды. Для получения чистой воды Вы можете регулярно менять фильтр (картридж), также Вы должны знать источник, из которого берется вода и как очищается (например, на сильно загрязненных территориях фильтр следует менять чаще).
Для получения чистой воды Вы можете регулярно менять фильтр (картридж), также Вы должны знать источник, из которого берется вода и как очищается (например, на сильно загрязненных территориях фильтр следует менять чаще).
Чистую и полезную воду получают из натуральных источников, которую предварительно обрабатывают, дополнительно очищают и разливают в стеклянные бутылки!
Снежинки
Снег образуется, когда микроскопические капли воды в облаках притягиваются к частицам пыли и замерзают. Появляющиеся кристаллы льда не превышают первых 0,1 мм в диаметре, падают и растут за счет конденсации влаги из воздуха.Этот механизм образовал гексагональную форму кристалла. Благодаря структуре молекул воды между вершинами кристаллических углов образуются углы размером всего 60 и 120 градусов. Главный кристалл воды в горизонтальной плоскости имеет форму правильного шестиугольника. Новые маленькие кристаллы оседают на вершинах шестиугольника, новые маленькие кристаллы образуют все новые и новые различные формы звезд — снежинки.
т достаточно высоких температур кристаллы многократно плавятся и снова кристаллизуются.Этот процесс нарушает правильную форму снежинок и формирует смешанные разновидности. Кристаллизация всех шести углов снежинок происходит одновременно почти в одинаковых условиях и, следовательно, формы углов снежинок также получаются одинаково.
С точки зрения кристаллографии наиболее естественной формой снежинок является «гексагональная» симметрия. Но иногда в природе можно увидеть треугольные снежинки. Причины таких различий до сих пор остаются неизвестными.
Для получения треугольных снежинок необходима температура 2 градуса ниже нуля.
Американские физики изучили влияние различных факторов на рост снежинок. Согласно теории физики, есть 2 основных фактора: динамика диффузионных молекул в воздухе и динамика поведения этих молекул на поверхности кристалла.
Они определили, что эти настройки напрямую определяются потоком воздуха, которым покрыта снежинка.
Ученые проверили свои теоретические предположения с помощью специальной камеры «снежной машины», с помощью которой можно контролировать рост снежинок.В результате было определено, что треугольные снежинки являются наиболее стойкими, то есть изменение воздушного потока не меняет форму снежинок. Этим, по мнению ученых, объясняется распространение треугольных снежинок.
Недавно ученым из Великобритании удалось получить снежинку «Пентагон». На поверхность меди кладут тонкий слой льда. В этом слое молекулы воды располагались на вершинах пятиугольника
| MCQ: Рибоза является примером ___________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Тот, который не является глобулярным белком __________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Выход крахмальной целлюлозы и гликогена ___________ при полном гидролизе? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: ____________% глюкозы, обычно присутствующей в нашей крови? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Какой из следующих углеводов не может быть гидролизован __________________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Фермент, который превращает дипептид в отдельные аминокислоты, является примером __________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Какой из них растворим в горячей воде _____________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Для синтеза 10 г глюкозы требуется ______________ энергии? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: С какой органеллой связано клеточное пищеварение __________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Ковалентная связь между двумя моносахаридными субъединицами называется ________________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
MCQ: одноклеточные организмы поглощают большие молекулы в свою цитоплазму из внешней среды, не переваривая их заранее. Этот процесс называется ___________? Этот процесс называется ___________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Какой из следующих полисахаридов называется животным крахмалом _________________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Какой из них дает синий цвет с йодом _______________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Микоплазмы были включены в состав бактерий, потому что: Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: В каком из них много животных ___________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Тот, который может выдержать самое высокое внешнее осмотическое давление, — это __________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: Клеточная стенка оомицетов в основном состоит из ___________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: __________ является примером чистой формы целлюлозы? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: соединение, образующееся в результате химической реакции спирта с кислотой, в которой высвобождается молекула воды, называется ________________? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| MCQ: В каком из следующего _______________ липиды растворимы? Категория: Биология Mcqs, Издатель: T-Code Scripts |
| Вопрос | Ответ |
|---|---|
| Физическое изменение | Изменение, которое изменяет форму или внешний вид материала, но не превращает материал в другое вещество. |
| Химическое изменение | Изменение, при котором одно или несколько веществ объединяются или распадаются с образованием новых веществ. |
| Реагент | Вещество, вступающее в химическую реакцию. |
| Продукт | Вещество, образовавшееся в результате химической реакции. |
| Осадок | Твердое вещество, которое образуется из раствора в ходе химической реакции. |
| Экзотермическая реакция | Реакция, при которой выделяется энергия, обычно в виде тепла. |
| Эндотермическая реакция | Реакция с поглощением энергии. |
| Химическое уравнение | Краткий и простой способ показать химическую реакцию с помощью символов. |
| Закон сохранения массы | Принцип, согласно которому общее количество материи не создается и не разрушается во время каких-либо химических или физических изменений. |
| Открытая система | Система, в которой материя может входить или выходить из окружающей среды. |
| Замкнутая система | Система, в которой любой материи разрешено входить или выходить. |
| Коэффициент | Число перед химической формулой в уравнении, которое указывает, сколько молекул или атомов каждого реагента и продукт участвуют в реакции. |
| Синтез | Химическая реакция, в которой два или более простых вещества объединяются с образованием нового, более сложного вещества. |
| Разложение | Химическая реакция, при которой соединения расщепляются на более простые продукты. |
| Замена | Реакция, в которой один элемент заменяет другой в соединении или когда два элемента в разных соединениях меняются местами. |
| Энергия активации | Минимальное количество энергии, необходимое для начала химической реакции. |
| Концентрация | Количество одного материала в определенном объеме другого материала. |
| Катализатор | Материал, повышающий скорость реакции за счет снижения энергии активации.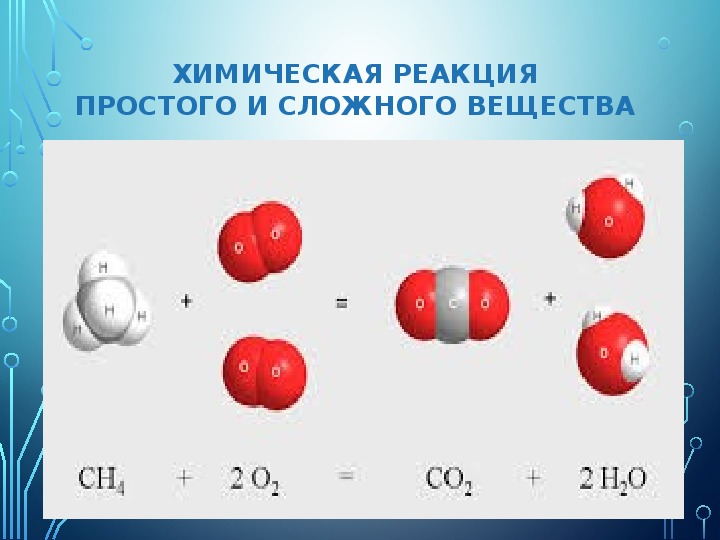 |
| Фермент | Тип белка, ускоряющий химическую реакцию в живом организме; биологический катализатор, снижающий энергию активации реакций в клетках. |
| Ингибитор | Материал, снижающий скорость реакции. |
| Закон сохранения массы впервые продемонстрировал французский химик __________. | Антуан Лавуазье |
| В вычисленном уравнении образования аммиака из азота и водорода сумма коэффициентов равна? | шесть |
| В химическом уравнении стрелка читается как ________. | дает |
| Производство диоксида углерода при сжигании топлива является примером реакции __________. | синтез |
| Реакция, в которой водород и кислород производятся при пропускании электрического тока через воду, является примером | разложения |
| реакция, которая имеет два соединения в качестве реагентов и два соединения в качестве продуктов, наиболее вероятна a | реакция двойного замещения |
В вычисленном химическом уравнении атомами являются ________. | консервативные |
| Вещество, присутствующее после реакции | продукт |
| Реакция, в которой вещества объединяются с образованием более сложного соединения? | реакция синтеза |
| Принцип, согласно которому материя не создается и не разрушается во время химической реакции. | сохранение массы |
| Реакция, в которой один элемент заменяет другой в соединении. | реакция замещения |
| Вещество, присутствующее до реакции. | Реагент |
| Число, показывающее, сколько молекул вещества участвует в химической реакции. | коэфф. |
| Реакция, при которой соединения распадаются на более простые вещества. | реакция разложения |
| Для обозначения химических реакций используются символы и формулы. | химическое уравнение |
При физическом изменении некоторые физические свойства вещества могут измениться, а химический состав ___________. | остается прежним |
| Другое название химического изменения — химическое вещество _________. | реакция |
| Способность реагировать с кислородом является примером ___________ свойства. | химический |
| Вещества, вступающие в химическую реакцию, называются _____________. | реагенты |
| Вода кипит при 100 градусах Цельсия. Это пример какого типа собственности? | физический |
| В экзотермической реакции продукты имеют больше или меньше энергии, чем реагенты? | минус |
| Что из следующего не является физическим имуществом? температура плавления, состояние вещества, плотность, горючесть | горючесть |
| Вещества, образующиеся в результате химической реакции, называются? | продукты |
| Химические реакции сопровождаются изменением ___________. | энергия |
Химические реакции образуют новые вещества с новыми ___________. | свойства |
| В эндотермической реакции энергия _________. | поглощено |
| Осадок | твердое вещество, образовавшееся из жидких реагентов во время химической реакции. |
| Эндотермическая реакция | реакция, в которой поглощается энергия. |
| Экзотермическая реакция | реакция, которая высвобождает энергию в виде тепла |
| материя | все, что имеет массу и занимает пространство |
| физическое изменение | любое изменение, которое изменяет вещество без его изменения в другое вещество |
| Какие изменения вызывают выпечка торта? | химикат |
| Какой тип изменений вызывает сжигание бревна? | химикат |
| Какое изменение вызывает замерзшая вода? | физический |
| Какие наблюдаемые изменения происходят при выпечке торта? | тесто поднимается |
| Какое наблюдаемое изменение происходит при сжигании бревна? | чернеет и осыпается |
| Какие наблюдаемые изменения происходят при замерзании воды? | становится твердым |
Кормление животных Процесс пищеварения Седьмой класс Наука
Пищеварение
После приема пищи пища переваривается, а затем поступает в различные части тела для роста, восстановления и других жизненно важных функций организма.
Пища, которую мы принимаем, в основном состоит из сложных веществ. Нашему организму нельзя употреблять пищу в сложной форме. Итак, эти сложные вещества необходимо разбить на простые вещества, чтобы они могли усваиваться клетками тела. После этого клетки могут использовать такие простые вещества для различных целей, таких как рост и получение энергии, а также для получения энергии.
Процесс расщепления сложного компонента пищи на более простые вещества называется пищеварением. Процесс пищеварения различен у человека, травоядных животных, амеб, гидры и т. Д.Пищеварительные системы разных животных развивались в соответствии с различными диетическими потребностями этих животных. В случае амебы пищеварение составляет внутриклеточно, , т.е. происходит внутри клетки. С другой стороны, пищеварение у сложных животных внеклеточное, , т.е. происходит вне клеток.
Ферменты помогают в расщеплении сложных молекул, таких как углеводы, белки, жиры и т. Д., На простые молекулы. Ферменты — это особые химические вещества, которые ускоряют химическую реакцию в процессе пищеварения.
Д., На простые молекулы. Ферменты — это особые химические вещества, которые ускоряют химическую реакцию в процессе пищеварения.
Пищеварение у одноклеточных животных, таких как амеба, внутриклеточно. Как только амеба захватывает пищевую частицу, она образует пищевую вакуоль вокруг пищевой частицы. Пищеварительные ферменты секретируются в пищевых вакуолях. Пищеварение происходит внутри пищевых вакуолей. Далее следует абсорбция и ассимиляция. После этого пищевая вакуоль прилипает к клеточной мембране с последующим выделением непереваренной пищи.
Вопрос 1. Что такое прием пищи?
Ответ: Прием пищи называется проглатыванием.
Вопросы 2: Что такое пищеварение?
Ответ: Разложение твердой и сложной пищи на простые и растворимые формы называется перевариванием.
Вопрос 3: Что такое абсорбция?
Ответ: Процесс попадания переваренной пищи в кровеносные сосуды кишечника называется абсорбцией.
Вопрос 4: Что вы понимаете под ассимиляцией?
Ответ: Преобразование поглощенной пищи в сложные вещества, такие как белки и витамины, необходимые организму, называется ассимиляцией.
Вопрос 5: Что вы понимаете под эгестией?
Ответ: Удаление шлаков из организма, время от времени, из ануса, называется эритроцитом.
Вопросы 6: Каковы этапы питания животных?
Ответ: Есть пять этапов питания животных. Это прием внутрь, пищеварение, всасывание, ассимиляция и переваривание.
Вопросы 7: Что такое псевдоподии?
Ответ: Пальцевидные выросты на амебе называются псевдоподиями.{c} \)
\ (a_ {b} \)
\ (\ sqrt {a} \)
\ (\ sqrt [b] {a} \)
\ (\ frac {a} { b} \)
\ (\ cfrac {a} {b} \)
\ (+ \)
\ (- \)
\ (\ times \)
\ (\ div \)
\ (\ pm \)
\ (\ cdot \)
\ (\ amalg \)
\ (\ ast \)
\ (\ barwedge \)
\ (\ bigcirc \)
\ ( \ bigodot \)
\ (\ bigoplus \)
\ (\ bigotimes \)
\ (\ bigsqcup \)
\ (\ bigstar \)
\ (\ bigtriangledown \)
\ (\ bigtriangleup \)
\ (\ blacklozenge \)
\ (\ blacksquare \)
\ (\ blacktriangle \)
\ (\ blacktriangledown \)
\ (\ bullet \)
\ (\ cap \)
\ (\ cup \)
\ (\ circ \)
\ (\ circledcirc \)
\ (\ dagger \)
\ (\ ddagger \)
\ (\ diamond \)
\ (\ dotplus \)
\ (\ lozenge \)
\ (\ mp \)
\ (\ ominus \)
\ (\ oplus \)
\ (\ oslash \)
\ (\ otimes \)
\ (\ setminus \)
\ ( \ sqcap \)
\ (\ sqcup \)
\ (\ square \)
\ (\ star \)
\ (\ треугольник \)
\ (\ triangledown \)
\ (\ треугольник влево \)
\ (\ Cap \)
\ (\ Cup \)
\ (\ uplus \)
\ (\ vee \)
\ (\ veebar \)
\ (\ wedge \)
\ (\ wr \)
\ (\ следовательно \)
\ (\ left (a \ right) \)
\ (\ left \ | a \ right \ | \)
\ (\ left [a \ right] \)
\ (\ left \ {a \ right \} \)
\ (\ left \ lceil a \ right \ rceil \)
\ (\ left \ lfloor a \ right \ rfloor \)
\ (\ left (a \ right) \)
\ (\ vert a \ vert \)
\ (\ leftarrow \)
\ (\ leftharpoondown \)
\ (\ leftharpoonup \)
\ (\ leftrightarrow \)
\ (\ leftrightharpoons \)
\ (\ mapsto \)
\ (\ rightarrow \)
\ (\ rightharpoondown \)
\ (\ rightharpoonup \)
\ (\ rightleftharpoons \)
\ (\ to \)
\ (\ Leftarrow \)
\ (\ Leftrightarrow \)
\ (\ Rightarrow \ )
\ (\ overset {a} {\ leftarrow} \)
\ (\ overset {a} {\ rightarrow} \)
\ (\ приблизительно \)
\ (\ asymp \)
\ (\ cong \)
\ (\ dashv \)
\ (\ doteq \)
\ (= \)
\ (\ Equiv \)
\ (\ frown \)
9000 4 \ (\ geq \)\ (\ geqslant \)
\ (\ gg \)
\ (\ gt \)
\ (| \)
\ (\ leq \)
\ (\ leqslant \)
\ (\ ll \)
\ (\ lt \)
\ (\ models \)
\ (\ neq \)
\ (\ ngeqslant \)
\ (\ ngtr \)
\ (\ nleqslant \)
\ (\ nless \)
\ (\ not \ Equiv \)
\ (\ overset {\ подмножество {\ mathrm {def}} {}} {=} \)
\ (\ parallel \)
\ (\ perp \)
\ (\ prec \)
\ (\ prevq \)
\ (\ sim \)
\ (\ simeq \)
\ (\ smile \)
\ (\ succ \)
\ (\ successq \)
\ (\ vdash \)
\ ( \ in \)
\ (\ ni \)
\ (\ notin \)
\ (\ nsubseteq \)
\ (\ nsupseteq \)
\ (\ sqsubset \)
\ (\ sqsubseteq \)
\ (\ sqsupset \)
\ (\ sqsupseteq \)
\ (\ subset \)
\ (\ substeq \)
\ (\ substeqq \)
\ (\ supset \)
\ (\ supsete q \)
\ (\ supseteqq \)
\ (\ emptyset \)
\ (\ mathbb {N} \)
\ (\ mathbb {Z} \)
\ (\ mathbb {Q} \)
\ (\ mathbb {R} \)
\ (\ mathbb {C} \)
\ (\ alpha \)
\ (\ beta \)
\ (\ gamma \)
\ (\ delta \)
\ (\ epsilon \)
\ (\ zeta \)
\ (\ eta \)
\ (\ theta \)
\ (\ iota \)
\ ( \ каппа \)
\ (\ лямбда \)
\ (\ mu \)
\ (\ nu \)
\ (\ xi \)
\ (\ pi \)
\ (\ rho \)
\ (\ sigma \)
\ (\ tau \)
\ (\ upsilon \)
\ (\ phi \)
\ (\ chi \)
\ (\ psi \)
\ (\ omega \)
\ (\ Gamma \)
\ (\ Delta \)
\ (\ Theta \)
\ (\ Lambda \)
\ (\ Xi \)
\ (\ Pi \)
\ (\ Sigma \)
\ (\ Upsilon \)
\ (\ Phi \)
\ (\ Ps i \)
\ (\ Omega \)
\ ((a) \)
\ ([a] \)
\ (\ lbrace {a} \ rbrace \)
\ (\ frac {a + b} {c + d} \)
\ (\ vec {a} \)
\ (\ binom {a} {b} \)
\ ({a \ brack b} \)
\ ({a \ brace b} \)
\ (\ sin \)
\ (\ cos \)
\ (\ tan \)
\ (\ cot \)
\ (\ sec \)
\ (\ csc \)
\ (\ sinh \)
\ (\ cosh \)
\ (\ tanh \)
\ (\ coth \)
\ (\ bigcap {a} \)
\ (\ bigcap_ {b} ^ {} a \)
\ (\ bigcup {a} \)
\ (\ bigcup_ {b} ^ {} a \)
\ (\ coprod {a} \)
\ (\ coprod_ {b} ^ {} a \)
\ (\ prod {a} \)
\ (\ prod_ {b} ^ {} a \)
\ (\ sum_ { a = 1} ^ b \)
\ (\ sum_ {b} ^ {} a \)
\ (\ sum {a} \)
\ (\ underset {a \ to b} \ lim \)
\ (\ int {a} \)
\ (\ int_ {b} ^ {} a \)
\ (\ iint {a} \)
\ (\ iint_ {b} ^ {} a \)
\ (\ int_ {a} ^ {b} {c} \)
\ (\ iint_ {a} ^ {b} {c} \)
\ (\ iiint_ {a} ^ { b} {c} \)
\ (\ oint {a} \)
\ (\ oint_ {b} ^ {} a \)
Почему пищеварение важно? | Клиника IBD
Почему пищеварение важно? Пищеварение важно для расщепления пищи на питательные вещества, которые организм использует для получения энергии, роста и восстановления клеток. Еда и напитки должны быть превращены в более мелкие молекулы питательных веществ, прежде чем кровь поглотит их и доставит к клеткам по всему телу. Организм расщепляет питательные вещества из пищи и напитков на углеводы, белки, жиры и витамины.
Еда и напитки должны быть превращены в более мелкие молекулы питательных веществ, прежде чем кровь поглотит их и доставит к клеткам по всему телу. Организм расщепляет питательные вещества из пищи и напитков на углеводы, белки, жиры и витамины.
Углеводы — это сахар, крахмал и клетчатка, содержащиеся во многих продуктах питания. Углеводы называют простыми или сложными, в зависимости от их химического строения. Простые углеводы включают сахара, которые естественным образом содержатся в таких продуктах, как фрукты, овощи, молоко и молочные продукты, а также сахара, добавленные в процессе обработки пищевых продуктов.Сложные углеводы — это крахмалы и клетчатка, содержащиеся в цельнозерновом хлебе и крупах, крахмалистых овощах и бобовых.
БЕЛК Такие продукты, как мясо, яйца и бобы, состоят из больших молекул белка, которые организм переваривает в более мелкие молекулы, называемые аминокислотами.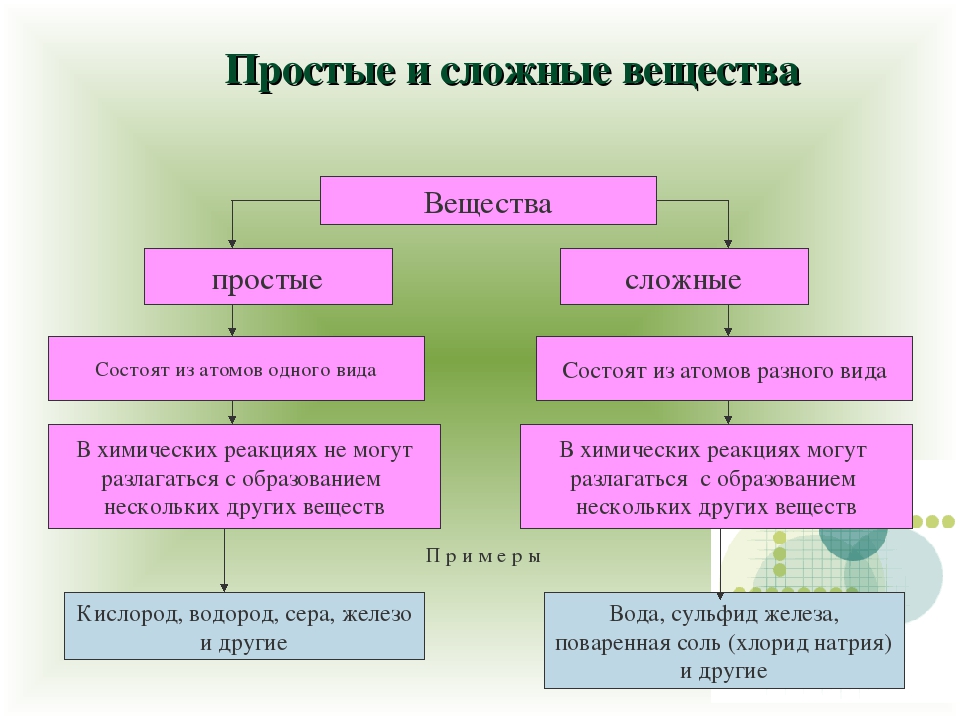 Организм поглощает аминокислоты через тонкий кишечник в кровь, которая затем разносит их по всему телу.
Организм поглощает аминокислоты через тонкий кишечник в кровь, которая затем разносит их по всему телу.
Молекулы жира являются богатым источником энергии для организма и помогают ему усваивать витамины.Масла, такие как кукурузное, рапсовое, оливковое, сафлоровое, соевое и подсолнечное, являются примерами полезных жиров. Сливочное масло, шортенинг и закуски — примеры менее полезных жиров. Во время пищеварения организм расщепляет молекулы жира на жирные кислоты и глицерин.
ВИТАМИНЫ Ученые классифицируют витамины по жидкости, в которой они растворяются. Водорастворимые витамины включают все витамины группы B и витамин C. Жирорастворимые витамины включают витамины A, D, E и K. Каждый витамин играет разную роль в росте и здоровье организма.Организм накапливает жирорастворимые витамины в печени и жировых тканях, тогда как организм не может легко накапливать водорастворимые витамины и вымывает лишние с мочой.
Список литературы
Углеводы и сахар (для родителей)
Что такое углеводы?
Углеводы — самый важный и доступный для организма источник энергии. Они являются необходимой частью здорового питания как для детей, так и для взрослых.
Две основные формы углеводов:
- простых углеводов (или простых сахаров): включая фруктозу, глюкозу и лактозу, которые также содержатся в питательных цельных фруктах
- сложные углеводы (или крахмалы): содержатся в таких продуктах, как крахмалистые овощи, цельнозерновые, рис, хлеб и крупы
Так как же организм перерабатывает углеводы и сахар? Все углеводы расщепляются на простые сахара, которые всасываются в кровоток.По мере повышения уровня сахара поджелудочная железа выделяет гормон инсулин, который необходим для перемещения сахара из крови в клетки, где сахар может использоваться в качестве энергии
Углеводы в некоторых продуктах (в основном те, которые содержат простой сахар и высокоочищенные зерна, такие как белая мука и белый рис) легко расщепляются и вызывают быстрое повышение уровня сахара в крови.
Сложные углеводы (содержащиеся в цельнозерновых), с другой стороны, расщепляются медленнее, позволяя сахару в крови постепенно повышаться.Диета с высоким содержанием продуктов, вызывающих быстрое повышение уровня сахара в крови, может увеличить риск развития у человека проблем со здоровьем, таких как диабет.
Некоторые продукты с высоким содержанием углеводов полезнее других. Хорошие варианты включают:
- цельнозерновые
- коричневый рис
- цельнозерновой хлеб
- фруктов
- овощей
- обезжиренные молочные продукты
Здоровая сбалансированная диета для детей старше 2 лет должна включать от 50% до 60% калорий, поступающих из углеводов.Главное — убедиться, что большинство этих углеводов поступает из хороших источников и что добавленный сахар ограничен.
Некоторые углеводы — плохо?
Углеводы в последние годы сильно пострадали. Медицинские эксперты считают, что употребление в пищу слишком большого количества рафинированных углеводов, таких как рафинированный сахар в конфетах и газированных напитках, а также очищенные зерна, такие как белый рис и белая мука, используемые во многих макаронных изделиях и хлебе, способствовало росту ожирения в Соединенных Штатах.
Как один вид еды может вызвать такую большую проблему? «Плохие» углеводы (сахар и рафинированные продукты) легко достать, они употребляются большими порциями, имеют приятный вкус и не слишком сытны.Поэтому люди склонны есть их больше, чем нужно. А некоторые вообще не нужны: газированные напитки и конфеты — это «пустые калории», не содержащие питательных веществ.
Но это не значит, что все простые сахара вредны. Простые углеводы также содержатся во многих питательных продуктах, таких как фрукты, овощи и молочные продукты, которые содержат ряд важных питательных веществ, поддерживающих рост и общее состояние здоровья. Например, свежие фрукты содержат простые углеводы, но также содержат витамины и клетчатку.
п.
Почему сложные углеводы полезны?
Руководящие принципы питания для американцев на 2015–2020 годы рекомендуют употреблять в пищу злаки, по крайней мере, половина из которых должны составлять сложные углеводы. Цельнозерновые , такие как коричневый рис, овсянка, цельнозерновой хлеб и крупы, — это лучший выбор. Рацион, богатый цельнозерновыми продуктами, защищает от диабета и болезней сердца. И сложные углеводы:
Рацион, богатый цельнозерновыми продуктами, защищает от диабета и болезней сердца. И сложные углеводы:
- Медленнее распадаются в организме: Цельные зерна содержат все три части зерна (отруби, зародыши и эндосперм), тогда как очищенные зерна в основном представляют собой только эндосперм. Цельнозерновые продукты способствуют большему расщеплению организма, поэтому пищеварение происходит медленнее. Когда углеводы поступают в организм медленнее, вашему организму легче их регулировать.
- с высоким содержанием клетчатки: Продукты с высоким содержанием клетчатки сытны и, следовательно, препятствуют перееданию. Кроме того, в сочетании с большим количеством жидкости они помогают перемещать пищу через пищеварительную систему, предотвращая запоры и могут защитить от рака кишечника.
- Обеспечивает витаминами и минералами: Цельнозерновые продукты содержат важные витамины и минералы, такие как витамины группы B, магний и железо.

Большинство детей школьного возраста должны съедать от четырех до шести «эквивалентов унций» из зерновой группы каждый день, по крайней мере, половина из которых должна поступать из цельного зерна.«Эквивалент унции» подобен порции — 1 ломтик хлеба; 1 стакан готовой каши; или полстакана вареного риса, вареной пасты или каши.
А как насчет сахара?
Продукты с высоким содержанием добавленного сахара (газированные напитки, печенье, пирожные, конфеты, замороженные десерты и некоторые морсы) также обычно высококалорийны и низкокалорийны. Диета с высоким содержанием сахара часто связана с ожирением, а слишком много сладких продуктов может привести к кариесу. В Рекомендациях по питанию на 2015–2020 годы рекомендуется, чтобы добавленный сахар составлял менее 10% от общего количества потребляемых калорий.
Вместо сладких блюд предложите более здоровые продукты, например фрукты — естественно сладкую закуску, содержащую углеводы, которая также содержит клетчатку и витамины, в которых нуждаются дети.
Один из способов сократить количество добавляемого сахара — запретить газировку и другие сахаросодержащие напитки. Рассмотрим эти факты:
- Каждая порция газированного подслащенного безалкогольного напитка на 12 унций (355 мл) эквивалентна 10 чайным ложкам (49 мл) сахара и 150 калориям. Сладкие напитки — самый большой источник добавленного сахара в ежедневном рационе U.С. дети.
- Употребление одного сладкого безалкогольного напитка объемом 12 унций (355 мл) в день увеличивает риск ожирения у ребенка.
- Кислотность подслащенных напитков может разрушить зубную эмаль, а высокое содержание сахара в них может вызвать кариес.
Вместо газированных напитков или сокосодержащих напитков (которые часто содержат столько же сахара, что и безалкогольные напитки) подавайте нежирное молоко, воду или 100% фруктовый сок. Примечание: Хотя в 100% фруктовый сок не добавлен сахар, калории из этих натуральных сахаров могут накапливаться.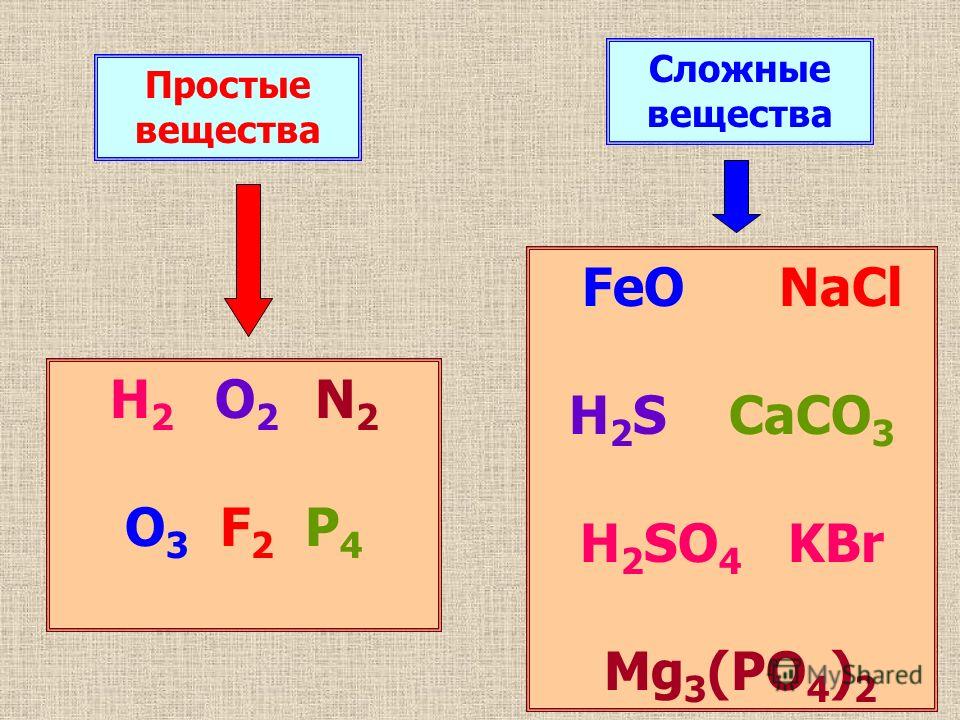 Поэтому ограничьте сок до 4–6 унций (118–177 мл) для детей младше 7 лет и не более 8–12 унций (237–355 мл) для детей старшего возраста и подростков.
Поэтому ограничьте сок до 4–6 унций (118–177 мл) для детей младше 7 лет и не более 8–12 унций (237–355 мл) для детей старшего возраста и подростков.
стр. 3
Как найти здоровый вариант?
Не всегда легко сказать, какие продукты подходят, а какие нет. Информация о пищевой ценности на этикетках пищевых продуктов может помочь.
Чтобы определить углеводы, найдите эти три числа:
- Всего углеводов: Это число, указанное в граммах, объединяет несколько типов углеводов: пищевые волокна, сахара и другие углеводы.
- Пищевая клетчатка: Пищевая клетчатка, внесенная в список «Всего углеводов», сама по себе не содержит калорий, а диета с высоким содержанием клетчатки имеет много преимуществ для здоровья.
- Сахаров: Также указано в разделе Всего углеводов. Этикетка Nutrition Facts скоро сделает различие между натуральными и добавленными сахарами. Натуральный сахар содержится в таких продуктах, как фрукты и молочные продукты.
 Закуски, конфеты и газированные напитки часто содержат много добавленного сахара. Чтобы узнать, добавлен ли в пищу сахар, проверьте список ингредиентов на наличие сахара, кукурузного сиропа или других подсластителей, таких как декстроза, фруктоза, мед или патока, и это лишь некоторые из них.Избегайте продуктов, в списке ингредиентов которых есть сахар или другие подсластители.
Закуски, конфеты и газированные напитки часто содержат много добавленного сахара. Чтобы узнать, добавлен ли в пищу сахар, проверьте список ингредиентов на наличие сахара, кукурузного сиропа или других подсластителей, таких как декстроза, фруктоза, мед или патока, и это лишь некоторые из них.Избегайте продуктов, в списке ингредиентов которых есть сахар или другие подсластители.
Хотя углеводы содержат всего 4 калории на грамм, высокое содержание сахара в закусках означает, что калории могут быстро накапливаться, и эти «пустые калории» обычно содержат мало других питательных веществ.
Как сделать углеводы частью здоровой диеты?
Делайте правильный выбор углеводов (покупайте цельнозерновые, фрукты, овощи, молоко и молочные продукты с низким содержанием жира), ограничьте употребление продуктов с добавлением сахара и поощряйте детей быть активными каждый день.
И не забывайте быть хорошим примером для подражания. Дети увидят ваши здоровые привычки и усвоят их, что приведет к более здоровому образу жизни в детстве и за его пределами.
 к. HNO3 — это азотная кислота, а Ва(OH)2 — основание, которое хорошо растворяется в воде, значит является щелочью
к. HNO3 — это азотная кислота, а Ва(OH)2 — основание, которое хорошо растворяется в воде, значит является щелочью
 Закуски, конфеты и газированные напитки часто содержат много добавленного сахара. Чтобы узнать, добавлен ли в пищу сахар, проверьте список ингредиентов на наличие сахара, кукурузного сиропа или других подсластителей, таких как декстроза, фруктоза, мед или патока, и это лишь некоторые из них.Избегайте продуктов, в списке ингредиентов которых есть сахар или другие подсластители.
Закуски, конфеты и газированные напитки часто содержат много добавленного сахара. Чтобы узнать, добавлен ли в пищу сахар, проверьте список ингредиентов на наличие сахара, кукурузного сиропа или других подсластителей, таких как декстроза, фруктоза, мед или патока, и это лишь некоторые из них.Избегайте продуктов, в списке ингредиентов которых есть сахар или другие подсластители.