Дайте сравнительную характеристику оксидов серы в степенях
Оксид серы (IV) и оксид серы (VI) проявляют кислотные свойства, но у оксида серы (VI) они более выражены.
Взаимодействуют с водой, при этом с оксидом серы (IV) образуется слабая сернистая кислота, а с оксидом серы (VI) – сильная серная кислота:
SO2 + H2O ⇄ H2SO3
SO3 + H2O ⟶ H2SO4
Взаимодействуют с основными оксидами:
SO2 + Na2O ⟶ Na2SO3
SO3 + CaO ⟶ CaSO4
Взаимодействуют с щелочами:
SO2 + 2NaOH ⟶ Na2SO3 + H2O
SO2 + 2Na+ + 2OH— ⟶ 2Na+ + SO32- + H2O
SO2 + 2OH— ⟶ SO32- + H2O
SO3 + 2NaOH ⟶ Na
SO3 + 2Na+ + 2OH— ⟶ 2Na+ + SO42- + H2O
SO3 + 2OH— ⟶ SO42- + H2O
Оксид серы (IV) и оксид серы (VI) проявляют окислительные свойства.
| SO2 + 2H2S ⟶ 3S + 2H2O | ||
| S+4 + 4ē ⟶ S0 | 1 | окислитель (восстановление) |
| S-2 — 2ē ⟶ S0 | 2 | восстановитель (окисление) |
| 2SO3 ⇄ 2SO2 + O2 | ||
| S+6 + 2ē ⟶ S+4 | 2 | окислитель (восстановление) |
| 2O-2 — 4ē ⟶ O20 | 1 | восстановитель (окисление) |
Оксид серы (IV) проявляет восстановительные свойства.
| SO2 + 2HNO3 ⟶ H2SO4 + 2NO2↑ | ||
| N+5 + 1ē ⟶ N+4 | 2 | окислитель (восстановление) |
| S+4 — 2ē ⟶ S+6 | 1 | восстановитель (окисление) |
gomolog.ru
SO2 какой это оксид
Диоксид серы – сернистый газ – синтезируют сжиганием серы на воздухе или окислением сульфидов:
а также действием 70%-ной серной кислоты на сульфиты металлов:
Диоксид серы – бесцветный тяжелый токсичный газ с удушливым запахом. При температуре он сжижается. Жидкий сернистый ангидрид – бесцветная подвижная жидкость, хорошо растворяющая серу, йод, жиры.
Угловое строение и локализация электронной пары на атоме серы объясняют полярность молекулы и её высокую реакционную активность.
Сернистый газ хорошо растворим в воде (40 объемов в 1 объеме при , т.е. около 10% по массе) с образованием гидратов . Вследствие частичной диссоциации раствор приобретает кислую реакцию (SO2 какой это оксид?).
Для диоксида серы характерна окислительно-восстановительная двойственность. Так, сернистый газ обесцвечивает воду:
и раствор перманганата калия:
ru.solverbook.com
Оксид серы в природе и жизни человека :: SYL.ru
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов — серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
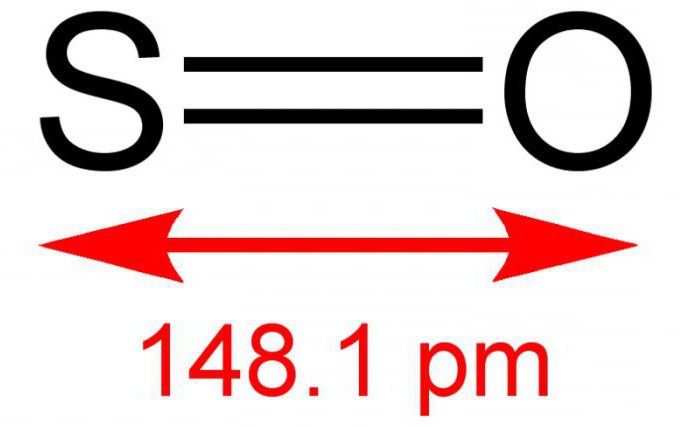
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 =2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
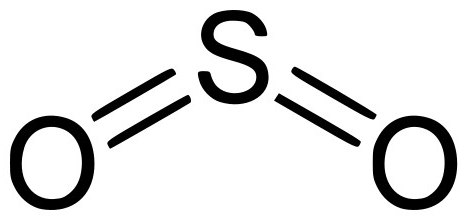
В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 — довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, — это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
www.syl.ru