Химия 11 класс
Урок-семинар на тему «Виды химической связи, типы кристаллических решеток» — СТРОЕНИЕ ВЕЩЕСТВА — ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс — поурочные разработки — разработки уроков — авторские уроки — план-конспект урока — химия
Цели урока: обобщить, закрепить знание учащимися темы и умение применять их в решении упражнений.
Оборудование: таблицы «Виды химической связи», «Типы кристаллических решеток», кристаллические решетки (модели): ионная, атомная, молекулярная; кодотранспорант с вопросами теории и практики.
Ход урока
I. Организационный момент
Постановка целей и задач урока, организация учащихся на проведение семинара. Вопросы теории обсуждаются согласно их последовательности, используются конспекты, текст учебника, наглядные пособия.
II. Обсуждение вопросов теории и практики
Теоретическая часть
1. Понятия «химическая связь», «электроотрицательность».
2.
Ионная связь. Определение.
3. Ковалентная связь. Определение. Примеры соединений. Виды ковалентной связи. Механизмы образования ковалентной связи:
а) обменный;
б) донорно-акцепторный;
Типы кристаллических решеток, физические свойства веществ.
4. Металлическая связь. Определение. Пример. Механизмы образования. Тип кристаллической решетки. Физические свойства. Сходство и различия с ковалентной и ионной связью.
5. Водородная связь. Определение. Примеры соединений. Механизмы образования водородной связи. Тип кристаллической решетки. Физические свойства веществ.
6. В чем заключается единство природы всех видов химической связи? На конкретных примерах объяснить переход одного вида связи в другой. Далее приступаем к обсуждению вопросов практики, которые непосредственно являются домашним заданием.
Практическая часть
1. Какие виды химической связи и типы кристаллических решеток характерны для соединений?
N2;
Са; CaF2; F2; OF2; К2O2;
Na2SO4.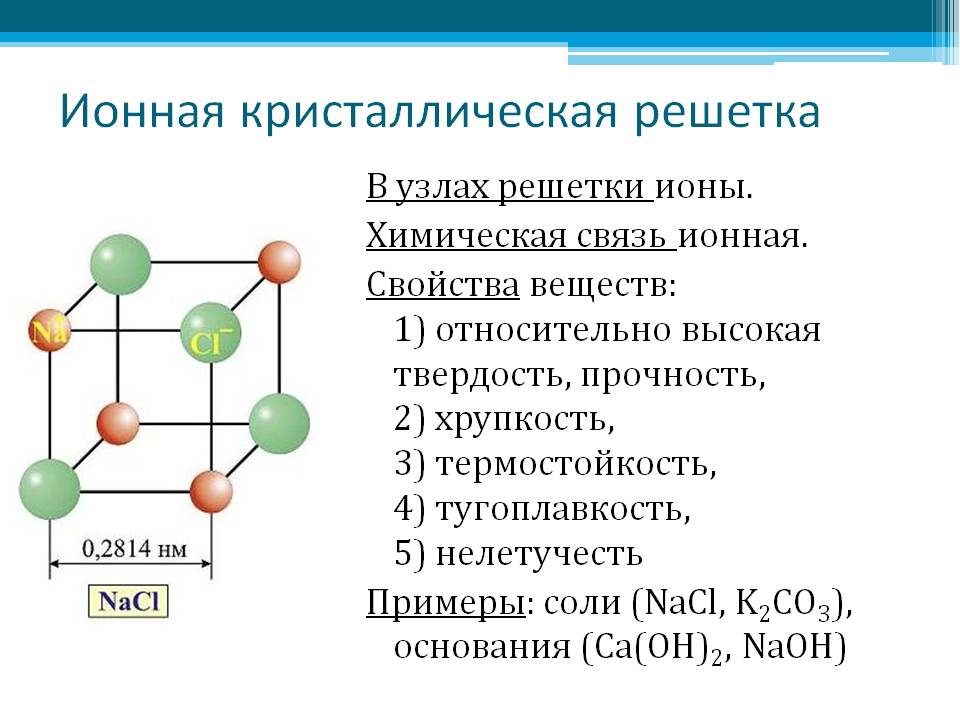
2. Объяснить механизм образования связи в соединениях.
a) N2; б) Са; в) OF2; г) CaF2.
II. Самостоятельная работа
Вариант I | Вариант II |
1. Дать характеристику соединений по плану: вид связи, определение, механизм образования связи, способ перекрывания орбиталей, тип кристаллической решетки, физические свойства. | |
а) NF3 б) MgCl2 | a) H2S б) Сl2 |
2. Возникает ли в соединении водородная связь и какая именно? | |
HF | NH3 |
Почему они растворяются в воде? | |
III. Подведение итогов урока
IV. Домашнее задание
Повторить:
валентные состояния атома углерода в органических соединениях; гибридизация –sp3;
-sp2: -sp, записи за 10 класс, учебник для 10 класса.
Ответы на вопросы теории предложены в планах-конспектах уроков № 1, 2, учебник § 6.
Ответы
Практическая часть
1. Ионная связь — CaF2; ионная кристаллическая решетка. Ковалентная неполярная связь — N2; F2; молекулярная кристаллическая решетка.
Ковалентная полярная связь — OF2; молекулярная кристаллическая решетка.
Са — металлическая связь, металлическая решетка.
К2O2 — в соединении ионная связь и ковалентная неполярная; ионная кристаллическая решетка.
Na2SO4 — в соединении ионная связь; ковалентная полярная, в анионе SO42 — ионная кристаллическая решетка.
2. Механизм образования связи в соединениях:
a) N2 — ковалентная, неполярная связь.
+7; 1s22s22p3
—
атом азота имеет пару спаренных электронов и три неспаренных по обменному
механизму с другим атомом азота идет образование трех общих электронных пар,
идет перекрывание р-орбиталей, одно осевое — σ-связь и два боковых
перекрывания 2π-связи.
Кратность связи — 3.
Кристаллическая решетка — молекулярная.
б) Са — металл, металлическая связь, в кристалле присутствуют атомы-ионы, свободные электроны; за счет их взаимопритяжения осуществляется связь.
в) OF2 — ковалентная полярная связь.
+8; 1s22s22p4
— атом кислорода имеет две пары спаренных электронов и 2p-неспаренных электрона.
-9; 1s22s22p5
— атом фтора имеет три пары спаренных электронов и 1 р-неспаренный электрон.
Между атомом кислорода и двумя атомами фтора образуются общие электронные пары по обменному механизму, т. к. ЭО фтора больше ЭО кислорода, общие электронные пары смещены в сторону атомов фтора.
г) CaF2 — ионная связь соединения образована элементами, резко отличающиеся в ЭО.
Са — металл | F — неметалл |
Са 4s2 | F +8; 2s22p5 |
отдает 2е— атомам фтора | |
приобретает заряд +2 | атом фтора
принимает один электрон, приобретает заряд -1. |
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью.
Самостоятельная работа
Вариант I
1. a) NF3 — ковалентная полярная связь. Связь посредством общих электронных пар, образованных по обменному механизму
N +7; 1s22s22р3 | F +9; 1s22s22p5 |
три неспаренных р-электрона | один неспаренный p-электрон, необходимо три атома фтора |
Перекрывание орбиталей осевое, образуются σ-связи; кратность связи между атомами — 1.
Кристаллическая решетка молекулярная, возможно, что это газ, легко переходящий в жидкость.
б)
MgCl2 — ионная связь, связь за счет электростатического
притяжения противоположно заряженных частиц. Соединение образовано металлом и
неметаллом, которые резко отличаются в ЭО.
Соединение образовано металлом и
неметаллом, которые резко отличаются в ЭО.
Взаимопритяжение противоположно заряженных частиц приводит к образованию соединения с ионной связью:
Ионная кристаллическая решетка, вещество твердое, тугоплавкое.
2. HF — соединения с полярной ковалентной связью в молекуле есть смещение общей электронной пары к ЭО атому фтора и возникает полюсность. δ+ — у атома водорода и δ- — у атома фтора, фтор также имеет неподеленные пары электронов Между молекулами возможно образование водородной связи.
Так как в молекуле воды также наблюдается смещение общих элек тронных пар к ЭО атома О — кислороду, который также имеет неподеленные пары электронов. В молекуле у атомов водорода возникает недостаток электронной плотности δ+, у атома кислорода — избыток δ-.
Между
молекулами фтороводорода и воды возможно образование водородных связей,
фтороводород растворим в воде.
Вариант II
1. a) H2S — ковалентная полярная связь, связь посредством общих электронных пар, образованных по обменному механизму.
один неспаренный s-электрон | на третьем энергетическом уровне две пары спаренных электронов и 2р-неспаренных электрона |
Идет перекрывание s-орбиталей атомов водородов и p-орбиталей атома серы, перекрывание осевое, образуется σ-связь, смешенная в сторону ЭО атома серы, кратность связи — 1; кристаллическая решетка молекулярная.
б) Сl2 — ковалентная неполярная связь, связь посредством обшей электронной пары, образованной по обменному механизму.
В атоме три пары спаренных электрона и один р-электрон, не спаренный. Происходит перекрывание p-орбиталей, осевое, возникает σ-связь.
Кратность
связи — 1. Кристаллическая решетка молекулярная.
2. NH3 — соединение с полярной ковалентной связью, в молекуле есть смещение общих электронных пар к ЭО атому азота, у которого есть неподеленная пара электрона, возникает полюсность: δ+ — у атомов водорода, δ- — у атома азота.
Между молекулами возможно возникновение водородных связей.
Так как в молекуле воды также наблюдается смешение общих электронных пар к ЭО атому — кислороду, который также имеет неподеленные пары электронов. В молекуле Н2O у атомов водорода возникает недостаток электронной плотности δ+. у атома кислорода — избыток δ+. Между молекулами NH3 и Н2O возможно образование водородных связей. NH3 растворим в воде.
Ионная кристаллическая решетка
Твердые вещества существуют в кристаллическом и аморфном состоянии и преимущественно имеют кристаллическое строение. Оно отличается правильным местоположением частиц в точно определенных точках, характеризуется периодической повторяемостью в объемном, трехмерном пространстве. Если мысленно соединить эти точки прямыми – получим пространственный каркас, который и называют кристаллической решеткой. Понятие «кристаллическая решетка» относится к геометрическому образу, который описывает трехмерную периодичность в размещении молекул (атомов, ионов) в кристаллическом пространстве.
Если мысленно соединить эти точки прямыми – получим пространственный каркас, который и называют кристаллической решеткой. Понятие «кристаллическая решетка» относится к геометрическому образу, который описывает трехмерную периодичность в размещении молекул (атомов, ионов) в кристаллическом пространстве.
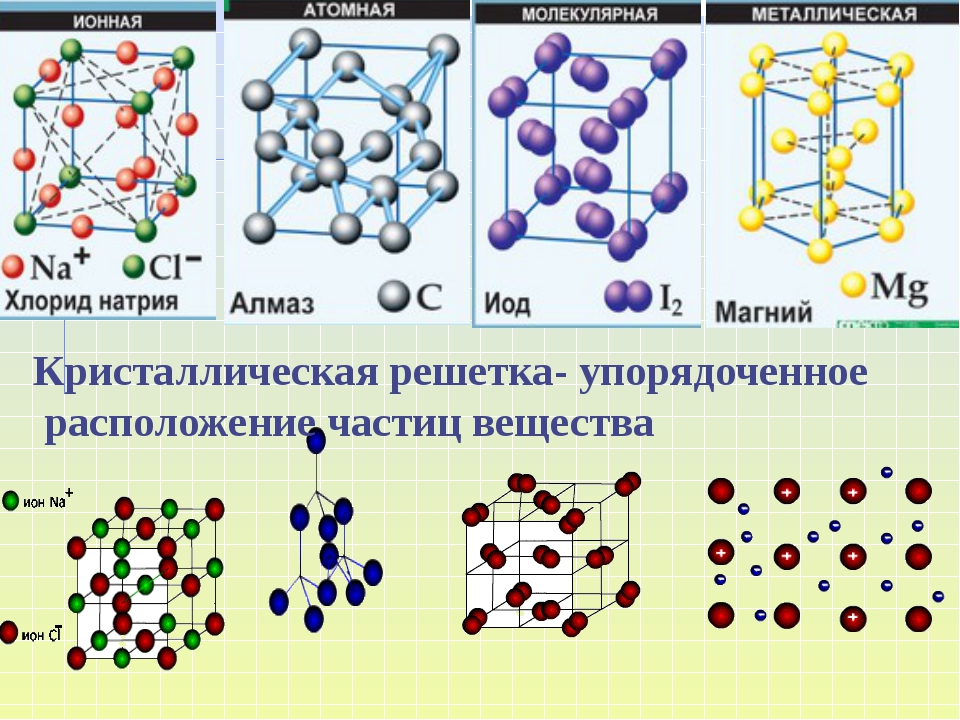
Точки расположения частиц называются узлами решетки. Внутри каркаса действуют межузловые связи. Вид частиц и характер связи между ними: молекулы, атомы, ионы – определяют тип кристаллической решетки. Всего выделяют четыре таких типа: ионные, атомные, молекулярные и металлические.
Если в узлах решетки расположены ионы (частицы с отрицательным или положительным зарядом), то это ионная кристаллическая решетка, характеризующаяся одноименными связями.
Эти связи весьма прочны и стабильны. Поэтому вещества с таким типом строения обладают достаточно высокой твердостью и плотностью, нелетучи и тугоплавки. При низких температурах они проявляют себя как диэлектрики. Однако при плавлении таких соединений нарушается геометрически правильная ионная кристаллическая решетка (расположение ионов) и уменьшаются прочностные связи.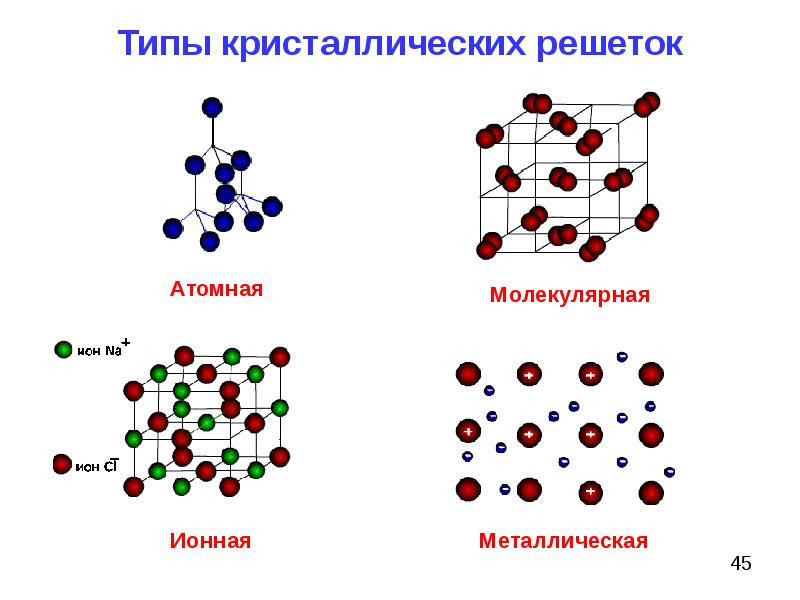
При температуре, близкой к температуре плавления, кристаллы с ионной связью уже способны проводить электрический ток. Такие соединения легко растворимы в воде и других жидкостях, которые состоят из полярных молекул.
Ионная кристаллическая решетка свойственна всем веществам с ионным типом связи — соли, гидроксиды металлов, бинарные соединения металлов с неметаллами. Ионная связь не имеет направленности в пространстве, потому что каждый ион связан сразу с несколькими противоионами, сила взаимодействия которых зависит от расстояния между ними (закон Кулона). Ионно-связанные соединения имеют немолекулярное строение, они представляют собой твердые вещества с ионными решетками, высокой полярностью, высокими температурами плавления и кипения, в водных растворах являющиеся электропроводными. Соединений с ионными связями в чистом виде практически не встречается.
Ионная кристаллическая решетка присуща некоторым гидроксидам и оксидам типичных металлов, солям, т.е. веществам с ионной химической связью.
Кроме ионной связи в кристаллах бывает металлическая, молекулярная и ковалентная связь.
Кристаллы, имеющие ковалентную связь, являются полупроводниками или диэлектриками. Типовыми примерами атомных кристаллов служат алмаз, кремний и германий.
Алмаз — это минерал, аллотропная кубическая модификация (форма) углерода. Кристаллическая решетка алмаза – атомная, весьма сложная. В узлах такой решетки находятся атомы, соединенные между собой крайне прочными ковалентными связями. Алмаз состоит из отдельных атомов углерода, расположенных по одному в центре тетраэдра, вершинами которого являются четыре ближайших атома. Такая решетка характеризуется гранецентрированной кубической элементарной ячейкой, что обусловливает максимальную твердость алмаза и довольно высокую температуру плавления. В решетке алмаза отсутствуют молекулы — и кристалл можно рассматривать как одну внушительную молекулу.
Помимо этого, атомная кристаллическая решетка свойственна кремнию, твердому бору, германию и соединениям отдельных элементов с кремнием и углеродом (кремнезем, кварц, слюда, речной песок, карборунд). Вообще же представителей кристаллических тел с атомной решеткой относительно немного.
Вообще же представителей кристаллических тел с атомной решеткой относительно немного.
Ионная связь в химии — виды, типы, формулы и определения с примерами
Содержание:
Ионная связь:
Ионы образуются в результате отдачи или присоединения электронов атомами. Атомы, отдающие свои валентные электроны, превращаются в положительно заряженные ионы, а атомы, принимающие эти электроны в отрицательно заряженные ионы. Ионы это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами. Катионы в основном образуются от металлов и ионов аммония. Неметаллы в одиночку не образуют катионов (кроме H
Химическая связь, образованная между ионами в результате действия электростатических сил притяжения, называется ионной связью. Полученное при этом соединение носит название ионного или гетерополярного соединения. Ионная связь образуется между металлами и неметаллами, т.е. между атомами элементов с резко отличающимися электроотрицательностями. Самая сильная ионная связь возникает в солях кислородсодержащих и бескислородных кислот (например, между металлами (щелочные и щелочноземельные металлы) и галогенами), в основаниях. Следовательно, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Полученное при этом соединение носит название ионного или гетерополярного соединения. Ионная связь образуется между металлами и неметаллами, т.е. между атомами элементов с резко отличающимися электроотрицательностями. Самая сильная ионная связь возникает в солях кислородсодержащих и бескислородных кислот (например, между металлами (щелочные и щелочноземельные металлы) и галогенами), в основаниях. Следовательно, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионной связи присущ целый ряд характерных свойств:
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.

В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH ) и кислотным остатком существует ионная связь.
В соединениях с ионной связью число ионных связей равно произведению числа катионов на валентность.
В солях, в составе которых содержится кислород и ион аммония, в том числе и в основаниях, имеются как ионная, так и полярная ковалентная связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению валентности центрального элемента на его индекс. В кислых же солях число полярных ковалентных связей равно произведению суммы валентности центрального элемента и количества H на индекс кислотного остатка.
В кислых же солях число полярных ковалентных связей равно произведению суммы валентности центрального элемента и количества H на индекс кислотного остатка.
| Вещества | Число ионных связей в молекуле | Число полярных ковалентных связей в молекуле |
| 3 | 3-4=12 | |
| 2- 3=6 | 3-6=18 |
| Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью. |
Химическая связь, образованная между положительно заряженными ионами металлов и относительно свободными электронами кристаллических решеток, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Огносительно свободные электроны, оторвавшись от атомов, движутся между положительными ионами металлов, образуя металлическую связь, те. электроны словно цементируют положительные ионы кристаллической решетки металлов.
Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Огносительно свободные электроны, оторвавшись от атомов, движутся между положительными ионами металлов, образуя металлическую связь, те. электроны словно цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь обладает целым рядом характерных свойств:
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
Химическая связь, образованная между атомом водорода одной молекулы и атомом более сильного электроотрицательного элемента (O,N,F) другой или же аналогичной молекулы, называется водородной связью.
Характерные свойства водородной связи:
- Водородная связь обозначается 3-мя точками.
- Водородная связь в 15 20 раз слабее ковалентной связи.
- Образуется в таких веществах, как NH3, Н2O, HF, в том числе между органическими веществами, содержащими группы ОН, NH2 COOH и др.
- Водородная связь может быть как межмолекулярной, так и внутримолекулярной.
Вода, HF, спирты, водные растворы спиртов образуют межмолекулярные водородные связи. Для белков и многих органических соединений характерна внутримолекулярная водородная связь.
Радиус атома водорода очень маленький и при перемещении или отдаче своего единственного электрона другому атому он становится положительно заряженным. За счет этого водород одной молекулы взаимодействует с находящимися в составе других молекул (HF, Н2О) атомами электроотрицательных элементов с частично отрицательным зарядом.
Образование водородной связи
За счет водородной связи действительная формула воды имеет следующий вид: (H2O)n
При переходе того или иного вещества, образующего водородную связь, из жидкого состояния в газообразное состояние, водородная связь разрывается, а в обратном процессе вновь восстанавливается.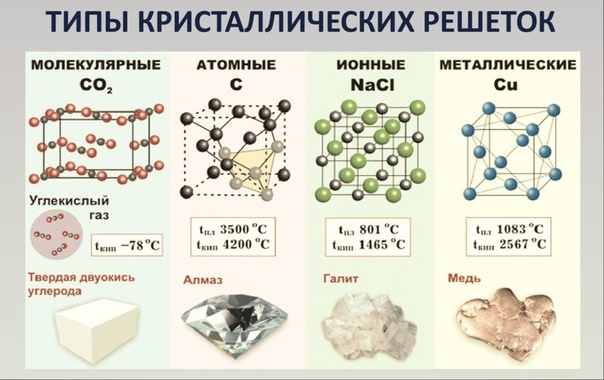
Вода, находясь в твердом (лед) и жидком состояниях, образует водородную связь. При переходе же в газообразное состояние водородная связь разрывается.
При 1 и 2 превращениях водородная связь сохраняется, при третьем состоянии -разрывается, а при четвертом — восстанавливается. Увеличение объема воды при понижении температуры (т.е. объем льда бывает больше объема жидкой воды одинаковой массы, а плотность — меньше) объясняется наличием водородной связи. Эго связано с тем, что при понижении температуры происходит образование более упорядоченной структуры молекул и в результате их «упаковочная» плотность уменьшается.
Одна из причин того, что фтористая кислота является слабой кислотой, заключается в ассоциации друг с другом молекул HF посредством водородной связи. Вот почему действительная формула фтороводородной кислоты следующая: (HF)n.
Типы кристаллических решетокКристаллические и аморфные вещества:
При механическом раздроблении кусочка хлорида натрия или другого твердого вещества образуются кристаллы определенной формы. Такие вещества называют кристаллическими веществами. Однако существуют и такие твердые вещества (стекло, куски смолы), которые при раздроблении под действием удара образуют осколки неопределенной формы. Такие вещества называют аморфными, т.е. бесформенными веществами.
Такие вещества называют кристаллическими веществами. Однако существуют и такие твердые вещества (стекло, куски смолы), которые при раздроблении под действием удара образуют осколки неопределенной формы. Такие вещества называют аморфными, т.е. бесформенными веществами.
Частицы (атомы, ионы и т.д.) твердых веществ, располагаясь в строгом порядке, образуют различного типа кристаллические решетки. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В графите атомы углерода на одной плоскости расположены близко друг к другу, а на разных плоскостях на отдаленном расстоянии друг от друга. Расположение атомов углерода, находящихся на разных плоскостях, в отдалении друг от друга приводит к расслоению графита на чешуйки. Свидетельством тому являются оставленные карандашом следы на бумаге (чешуйки графита).
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллической решетки.
В отличие от кристаллических веществ, в аморфных веществах частицы расположены не в такой закономерности, а неупорядоченно.
| Профессор Худу Мамедов (1927 1988) являлся член корреспондентом НАНА, доктором геолого минералогических наук, почетным членом Коралевской Академии Великобритании. Его основные научные труды от носятся к области ристаллохимии. Исследовал молекулярное и кристаллическое строения более 50 ти органических комплексных соединений слигандами. |
Ионная кристаллическая решетка. Кристаллические решетки, в узлах которых содержатся соединенные ионными связями положительно и отрицательно заряженные ионы, называются ионными кристаллическими решетками. Ионные кристаллические решетки характерны для оксидов металлов, оснований и солей: NaCl, KCl, NaBr, KBr, N2CO3, Na2SO4, Fe2O3, Ca(OH)2 и др.
Строение кристаллической решетки поваренной соли
Строение кристаллической решетки графита
Из-за сильного притяжения между ионами веществ с ионной кристаллической решеткой, эти вещества отличаются относительной тугоплавкостью, малой летучестью и определенной твёрдостью.
Атомные кристаллические решеткиКристаллические решетки, в узлах которых содержатся отдельные атомы, связанные друг с другом ковалентной связью, называются атомными кристаллическими решетками.
В атомных кристаллических решетках атомы, как и ионы, располагаются в пространстве в различных положениях, образуя в результате различной формы кристаллы. Например, в узлах кристаллической решетки как алмаза, так и графита содержатся атомы углерода. Однако вследствие их различного расположения, кристаллы алмаза обладают формой тетраэдра, а кристаллы графита слоистой формой.
| Аллотропические видоизменения углерода | Состояния гибридизации углерода | Xимический cocтав | Тип кристаллической решетки | Cтроение кристаллической решетки |
| Алмаз | sp3 | Одинаковый (C) | Атомный | тетраэдрическое |
| Графит | sp2 | слоистое | ||
| Карбин | sp | линейное |
Хотя тип кристаллической решетки аллотропических видоизменений углерода и одинаковый, однако у них различное строение.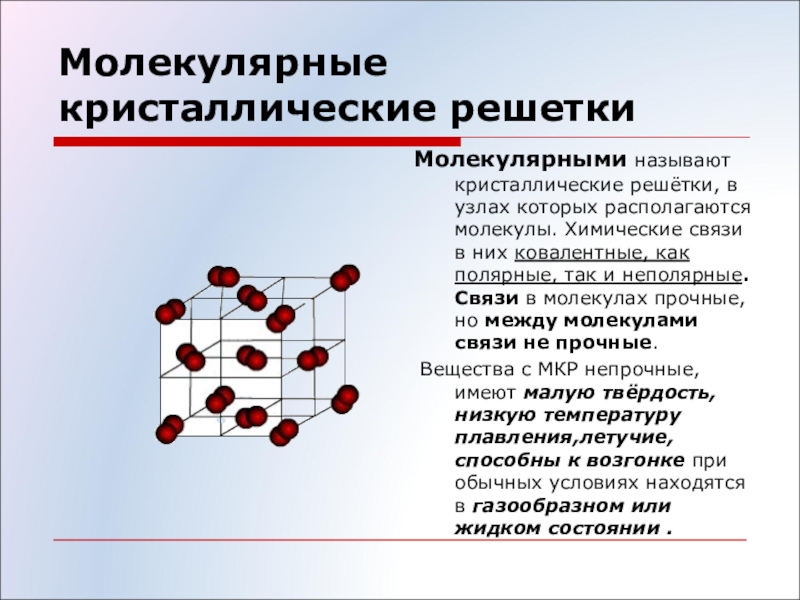 Примерами веществ, образующих атомную кристаллическую решетку, являются В, С, Si, SiC (карборунд), SiO2, красный и черный фосфор.
Примерами веществ, образующих атомную кристаллическую решетку, являются В, С, Si, SiC (карборунд), SiO2, красный и черный фосфор.
Так как в атомных кристаллических решетках этих веществ ковалентные связи между атомами обладают прочностью, для них характерны большая твердость и высокая температура плавления.
| Хотя SiC и SiOi обладают атомной кристаллической решеткой, связь между их атомами образована посредством полярной ковалентной связи. |
Кристаллические решетки, в узлах которых содержатся полярные и неполярные молекулы, связанные между собой межмолекулярными силами, называются молекулярными кристаллическими решетками. Молекулярные вещества образуют кристаллические решетки молекулярного типа.
Строение кристаллической решетки йода
Вещества, находящиеся при комнатной температуре в твердом состоянии и образованные только посредством ковалентной связи, в обычных условиях имеют молекулярную кристаллическую решетку, а газообразные, жидкие вещества образуют молекулярную кристаллическую решетку лишь в определенных условиях. В качестве примера веществ с молекулярными кристаллическими решетками в обычных условиях можно привести белый фосфор (Р4), кристаллическую серу (S8), Н3РО4, иод (I2), НРО3, Р2О5, глюкозу (C6H12O6), сахарозу (C12H22O11) и др.
В качестве примера веществ с молекулярными кристаллическими решетками в обычных условиях можно привести белый фосфор (Р4), кристаллическую серу (S8), Н3РО4, иод (I2), НРО3, Р2О5, глюкозу (C6H12O6), сахарозу (C12H22O11) и др.
В молекулярных кристаллических решетках веществ с неполярными ковалентными связями (H2, N2, О2, О3, F2, Сl2, Вr2, l2, Р4, S8) связи между молекулами создаются лишь слабыми межмолекулярными силами. В веществах с неполярной ковалентной связью межмолекулярное притяжение слабое. Вследствие этого они обладают очень низкой температурой плавления.
В кристаллических решетках веществ с полярной ковалентной связью (кроме SiC и SiO2) действуют межмолекулярные и электростатические силы притяжения. Значит, только вещества, образованные посредством полярной ковалентной и неполярной ковалентной связи, создают молекулярную кристаллическую решетку. Например, H2O, HCl, HBr, HI, CO2, HNO3, H2SO4, большинство органических веществ и др.
Значит, только вещества, образованные посредством полярной ковалентной и неполярной ковалентной связи, создают молекулярную кристаллическую решетку. Например, H2O, HCl, HBr, HI, CO2, HNO3, H2SO4, большинство органических веществ и др.
Кристаллические решетки, в узлах которых содержатся отдельные атомы или ионы металлов, связанные общими электронами, называются металлическими кристаллическими решетками. Большинство металлов (Na, Ca, Fe, Al, Cu и др.), а также расплавов, образуют металлические кристаллические решетки.
Многие свойства металлов электрическая проводимость, теплопроводность, ковкость и др. объясняются свободным движением электронов, образующих металлическую связь.
Некоторые физические свойства веществ зависят от типов кристаллических решеток. В этой связи существует такая закономерность: при известном строении веществ можно заранее предсказать их свойства, и наоборот, если известны свойства веществ, то можно определить их строение.
Вещества, обладающие молекулярной кристаллической решеткой, называются молекулярными (состоят из молекул), а обладающие ионной, атомной и металлической кристаллическими решетками немолекулярными (состоят из атомов или ионов) веществами.
ВалентностьВалентность элементов относится к основным понятиям химии.
Валентность — это свойство атомов элементов присоединять или замещать определенное число атомов других элементов. Понятие валентности было введено в науку в 1852 году Эдуардом Франклендом.
Данное определение валентности носит несколько формальный характер, так как не дает представления о природе, свойствах вещества. C развитием учения о химической связи содержание понятия «валентность» в настоящее время обычно выражается так:
Валентность это свойство атомов элементов создавать определенное число ковалентных химических связей.
Валентность определяется числам ковалентных связей, посредством которых в соединениях один атом связывается с другими атомами.
Согласно представлениям о ковалентной связи, независимо от способа образования общих электронных пар, валентность определяется числом общих электронных пар, связывающих атомы в молекуле.
Как вам известно, числовое значение валентности связано с положением элемента в периодической системе химических элементов Д.И.Менделеева. Высшая валентность элемента по числовому значению равна номеру его группы в периодической системе. Некоторые элементы не подчиняются этой закономерности (например, N, О, F). Это связано с тем, что из-за отсутствия в их атомах незаполненных орбиталей, они не могут возбуждаться. Максимальная валентность в соответствующем соединении того или иного элемента определяется числом орбиталей, участвующих в образовании связей в его атоме.
Образование связи в соответствии с валентностью элемента
В образовании иона аммония (NH ) участвуют 3 одиночных электрона (в 2p3) и одна электронная пара (в 2s2) атома азота. Т.е., поскольку в образовании связей участвуют 4 орбитали (2s и 2р), максимально азот бывает четырехвалентным. Точно так же при образовании иона гидроксония (Н3О+) из 2p4 электронов наружного слоя атома кислорода в создании ковалентной связи два одиночных электрона участвуют по механизму обмена, а парный электрон по донорно-акцепторному механизму, т.е. в создании связи задействованы 3 орбитали кислорода. Вот почему в ионе гидроксония кислород трехвалентен. Во всех органических соединениях в образовании связи участвуют все 4 орбитали внешнего электронного слоя атома углерода.
Т.е., поскольку в образовании связей участвуют 4 орбитали (2s и 2р), максимально азот бывает четырехвалентным. Точно так же при образовании иона гидроксония (Н3О+) из 2p4 электронов наружного слоя атома кислорода в создании ковалентной связи два одиночных электрона участвуют по механизму обмена, а парный электрон по донорно-акцепторному механизму, т.е. в создании связи задействованы 3 орбитали кислорода. Вот почему в ионе гидроксония кислород трехвалентен. Во всех органических соединениях в образовании связи участвуют все 4 орбитали внешнего электронного слоя атома углерода.
Степень окисления это условный заряд, который приходится на долю каждого атома в молекуле. Степень окисления может принимать отрицательные, нулевые, положительные и дробные значения. Значение степени окисления определяется числом электронов, отданных атому другого элемента или полученных от атома данного элемента.
| Элементы | Степень окисления, проявляемая в соединениях |
| Li, Na, К, Rb, Cs | + 1 |
| Be, Mg, Ca, Sr, Ba, Ra, Zn | +2 |
| Al | +3 |
| F | -1 |
Для определения степени окисления каждого элемента в соединениях используются нижеприведенные данные. В таблице даны элементы с постоянной степенью окисления в соединениях.
В таблице даны элементы с постоянной степенью окисления в соединениях.
Степень окисления у других элементов бывает переменной.
Степень окисления водорода в его соединениях с металлами и кремнием равна 1 (например: ВН3, SiH4, NaH, CaH2 и др.), а во всех других соединениях+1.
Вот почему в периодической таблице водород записан как в подгруппе 1А, так и в подгруппе VIIA.
Степень окисления кислорода в пероксидах равна 1 (H2O2, Na2O2, CaO2 и др), в супероксидах 1 /2 (КО2), фтористых соединениях () +2 и +1, во всех остальных соединениях 2.
Углерод в своих соединениях проявляет степень окисления -4 ÷ +4.
Степень окисления азота в его соединениях с металлами (например, в нитридах Na3N, AIN, Ca3N2 и др.), аммиаке (NH3) равна -3, а в кислородсодержащих соединениях от +1 ÷ +5.
Степень окисления фосфора в его соединениях с металлами, фосфидах (Na3P, K3P, Ca3P2, AlP и др. ), фосфине (PH3) равна -3, а в других соединениях +3 и +5 (P2S3, P2O3, P2O5, PCl5, HPO3, H3PO3, H3PO4 и др.).
), фосфине (PH3) равна -3, а в других соединениях +3 и +5 (P2S3, P2O3, P2O5, PCl5, HPO3, H3PO3, H3PO4 и др.).
Степень окисления серы в сульфидах равна -2 (H2S, Na2S, FeS, P2S3, P2S5, CS2, и др.), а в других соединениях -1 ÷ +6 .
Из галогенов хлор, бром и йод только в соединениях с металлами проявляют степень окисления 1, а в кислородсодержащих соединениях +l÷+-7.
Степень окисления элементов в простых веществах всегда равна нулю.
Алгебраическая сумма значений степени окисления элементов в сложных веществах всегда равна нулю. Следуя этому правилу, можно легко вычислить степень окисления любого химического элемента, если известны степень окисления других химических элементов в соединении. Неизвестная степень окисления элемента всегда принимается за х.
В сложных ионах алгебраическая сумма степеней окисления элементов равна заряду иона. Неизвестная степень окисления элемента в сложном ионе принимается за х. Записав в скобках формулу иона, за скобками (справа сверху) отмечают его заряд.
У большинства элементов самая высокая степень окисления соответствует номеру группы, в которой данный элемент размещается (кроме F, О, Fe, Си, Ag, Au). Самая низкая степень окисления любого неметалла (кроме H и В) определяется путем вычитания числа 8 от номера группы, где он расположен.
| Группа | VI | VII | V | IV |
| Элемент | S | Cl | N | C |
| Самая низкая степень окисления | 6 8=-2 | 7 8=-1 | 5 8=-3 | 4 8=-4 |
Металлы никогда не проявляют отрицательной степени окисления. Самая низкая степень окисления у них равна нулю.
В большинстве случаев степень окисления элемента по своему численному значению совпадает с его валентностью. Но такое бывает не всегда. Например: углерод трехвалентный только в угарном газе (СО), во всех остальных соединениях он четырехвалентный. Кислород трехвалентный только в ионе гидроксония (Н3О+) и угарном газе, во всех остальных соединениях он двухвалентный. В таких соединениях, как Аl4С3, CO2, CCl4, CF4, CS2, численные значения степени окисления и валентности у углерода совпадают.
При определении степени окисления посредством общего баланса отданных и полученных электронов ее среднее значение иногда может быть выражено дробным числом.
При разных степенях окисления атомов одного элемента в соединении степени окисления выражаются дробными числами. Среднее значение вычисляется способом электронного баланса.
Значение степени окисления, в отличие от заряда иона, проставляется над химическим знаком элемента (вначале ставится знак заряда, а затем число).
| Степень окисления | +2 Fe | +3 Fe | -2 S | +6 S |
| Заряд иона | Fe2+ | Fe3+ | S2- | S6+ |
Пример №1
Сколько процентов от числа валентных электронов азота (7N 2s22p3) создают связь по механизму обмена?
Решение: В атоме азота из 5-ти валентных электронов 3 одиночные.
Значит, (3/5) ∙ 100%=60% участвуют в механизме обмена.
Каждая электронная пара, образующая химическую связь, обозначается по одной валентной линии, формулы молекул изображаются графически.
Пример №2
Определите отношения между а, b, с.
| Соли | Число донорно-акцепторных связен |
| (NH4)2SO4 | а |
| NH4Cl | b |
| (NH4)3PO4 | c |
Решение: Число донорноакцепторных связей в солях аммония равно числу ионов аммония.
Тогда: a=2; b=l; с=3
Ответ: bac
Пример №3
Определите количество а) полярных ковалентных и b) неполярных ковалентных связей в молекуле соединения:
Решение: Полярная ковалентная связь образуется между атомами двух разных неметаллов. В таком случае, в данном соединении N(пол.ков.связь) N(C Н)связь N(H) 6
А неполярная ковалентная связь образуется между атомами одного вида (в представленном соединении это линии между атомами углерода). Тогда N(κeпoл.ков.связь.) = 3
Ответ: а=6; b=3
Пример №4
Определите общее число орбиталей, участвующих в образовании химических связей в соединении Н3С CH2 СН3.
Решение: Кроме угарного газа (СО), во всех соединениях углерода все 4 орбитали внешнего электронного слоя участвуют в образовании связи. Поскольку атом H имеет 1 орбиталь, его орбиталь тоже участвует в образовании связи. В таком случае, общее число орбиталей, участвующих в образовании связи: N(оpб.)o6щ. N(C) • 4 + N(H) 3•4 + 8 20
В таком случае, общее число орбиталей, участвующих в образовании связи: N(оpб.)o6щ. N(C) • 4 + N(H) 3•4 + 8 20
Пример №5
Определите в данном соединении гибридное состояние углерода.
Решение:
Ионные кристаллы.
Ионы, из которых состоят ионные кристаллы, удерживаются вместе электростатическими силами. Поэтому структура кристаллической решетки ионных кристаллов должна обеспечивать их электрическую нейтральность.
На рис. 3.24-3.27 схематически изображены важнейшие типы кристаллических решеток ионных кристаллов и приведены подробные сведения о них. Каждому типу ионов в ионной решетке соответствует свое собственное координационное число. Так, в кристаллической решетке хлорида цезия (рис. 3.24) каждый ион Cs+ окружен восемью ионами Cl» и, следовательно, имеет координационное число 8. Аналогично каждый ион Cl- окружен восемью ионами Cs+, т. е. тоже имеет координационное число 8. Поэтому считается, что кристаллическая решетка хлорида цезия имеет координацию 8:8. Кристаллическая решетка хлорида натрия имеет координацию 6:6 (рис. 3.25). Отметим, что в каждом случае обеспечивается сохранение электрической нейтральности кристалла.
е. тоже имеет координационное число 8. Поэтому считается, что кристаллическая решетка хлорида цезия имеет координацию 8:8. Кристаллическая решетка хлорида натрия имеет координацию 6:6 (рис. 3.25). Отметим, что в каждом случае обеспечивается сохранение электрической нейтральности кристалла.
Координация и тип кристаллической структуры ионных решеток определяются главным образом двумя следующими факторами: отношением числа катионов к числу анионов и отношением радиусов катионов и анионов.
Гранецентрированная кубическая или октаэдрическая
Рис. 3.25. Кристаллическая структура хлорида натрия (каменной соли).
Отношение числа катионов к числу анионов в кристаллических решетках хлорида цезия (CsCl), хлорида натрия (NaCl) и цинковой обманки (сульфид цинка ZnS) равно 1:1. Поэтому их относят к стехиометрическому типу AB. Флюорит (фторид кальция CaF2) относится к стехиометрическому типу AB2. Подробное обсуждение стехиометрии проводится в гл. 4.
Отношение ионного радиуса катиона (А) к ионному радиусу аниона (В) называется отношением ионных радиусов rJrB. В общем случае, чем больше отношение ионных радиусов, тем больше координационное число решетки (табл. 3.8).
В общем случае, чем больше отношение ионных радиусов, тем больше координационное число решетки (табл. 3.8).
Таблица 3.8. Зависимость координации от отношения ионных радиусов
Координация Отношение ионных радиусов
Рис. 3.26. Кристаллическая структура цинковой обманки.
Как правило, легче рассматривать структуру ионных кристаллов так, будто они состоят из двух частей — анионной и катионной. Например, структуру хлорида цезия можно представить себе состоящей из кубической катионной структуры и кубической анионной структуры. Вместе они образуют две взаимопроникающие (вложенные) структуры, образующие единую объемноцентрированную кубическую структуру (рис. 3.24). Структура типа хлорида натрия, или каменной соли, тоже состоит из двух кубических структур-одной катионной и другой анионной. Вместе они образуют две вложенные кубические структуры, образующие единую гранецентрированную кубическую структуру. Катионы и анионы в этой структуре имеют октаэдрическое окружение с координацией 6:6 (рис. 3.25).
3.25).
Структура типа цинковой обманки имеет гранецентрированную кубическую решетку (рис. 3.26). Можно рассматривать ее таким образом, будто катионы образуют кубическую структуру, а анионы имеют тетраэдрическую структуру внутри куба. Но если рассматривать анионы как кубическую структуру, то катионы имеют в ней тетраэдрическое расположение.
Структура флюорита (рис. 3.27) отличается от рассмотренных выше тем, что она имеет стехиометрический тип AB2, а также два разных координационных числа — 8 и 4. Каждый ион Ca2+ окружают восемь ионов F-, а каждый ион F- окружают четыре иона Ca2 + . Структуру флюорита можно представить себе как гранецентрированную кубическую катионную решетку, внутри которой имеется тетраэдрическое расположение анионов. Можно представить ее и по-иному: как объемноцентрированную кубическую решетку, в которой катионы находятся в центре кубической ячейки.
Гранецентрировенная кубическая и объемноцентрировэнная кубическая
Все рассмотренные в данном разделе соединения предполагаются чисто ионными. Ионы в них рассматриваются как твердые сферы со строго определенными радиусами. Однако, как было указано в разд. 2.1, многие соединения имеют частично ионный, а частично ковалентный характер. Вследствие этого ионные соединения с заметно выраженным ковалентным характером не могут полностью подчиняться общим правилам, изложенным в данном разделе.
Ионы в них рассматриваются как твердые сферы со строго определенными радиусами. Однако, как было указано в разд. 2.1, многие соединения имеют частично ионный, а частично ковалентный характер. Вследствие этого ионные соединения с заметно выраженным ковалентным характером не могут полностью подчиняться общим правилам, изложенным в данном разделе.
Оглавление:
Вещества с ионной кристаллической решеткой характеризуются пластичностью. Кристаллическая решетка: определение, ее основные типы
Молекулярное и немолекулярное строение веществ. Строение вещества
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения . Вещества, состоящие из молекул, называются молекулярными веществами . Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 SO 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (C, Si, Li, Na, K, Cu, Fe, W), среди них есть металлы и неметаллы. К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 SO 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Твердые вещества: аморфные и кристаллические
Твердые вещества делятся на кристаллические и аморфные .
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства.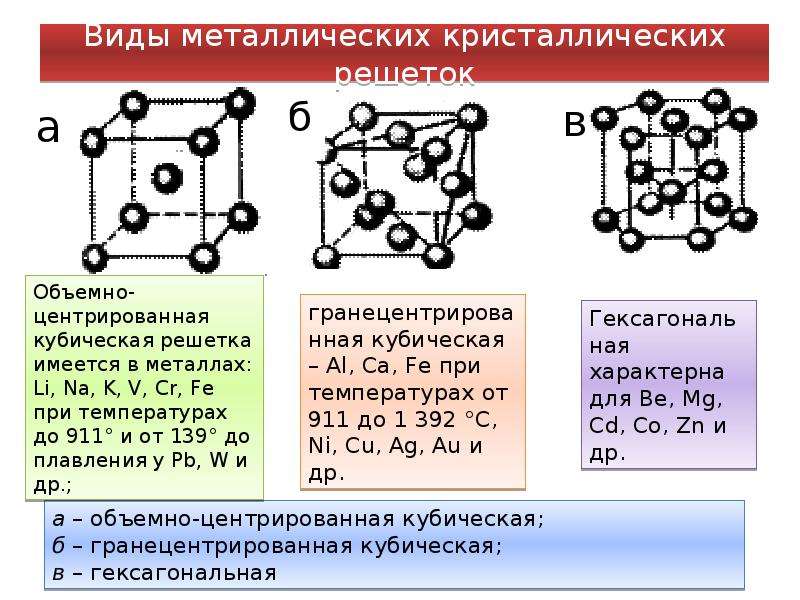 При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионными называют кристаллические решетки , в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl — , так и сложные SO 4 2- , OH — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Cl — , образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Кристаллическая решетка — а) и аморфная решетка — б).
Кристаллическая решетка — а) и аморфная решетка — б).
Атомные кристаллические решетки
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями . Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода. Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl, H 2 O), и неполярными (N 2 , O 2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения . Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Молекулярная кристаллическая решетка(углекислый газ)
Металлические кристаллические решетки
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Шпаргалки
Который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, я при температуре -218,8º С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.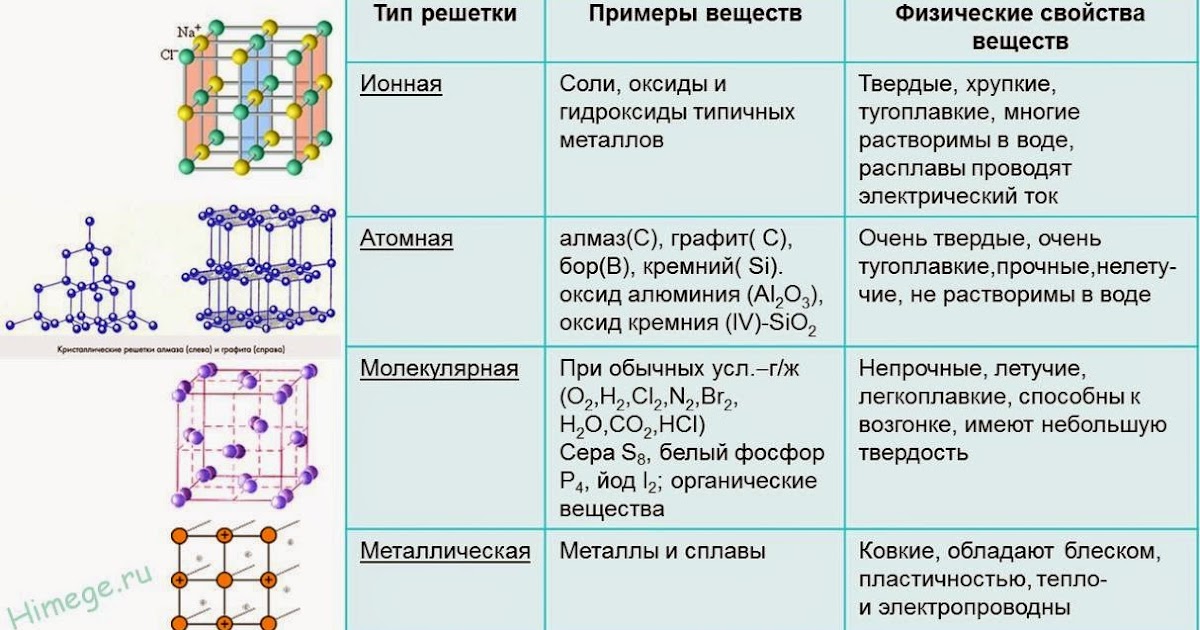
В этом параграфе мы рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Температурный интервал существования вещества в твердом состоянии определяется его температурами кипения и плавления. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находится пластилин или различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов. — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют изложи решетки.
В узлах воображаемой решетки могут находиться ионы, атомы и молекулы . Эти частицы совершают колебательные движения. С повышением температуры размах этих колебаний возрастает, что приводит, как правило, к тепловому расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические (табл. 6).
Простые вещества остальных элементов, не представленные в таблице 6, имеют металлическую решетку.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+,Сl-, так и сложные SO 2- 4, ОН-. Следовательно, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов , то есть те вещества, в которых существует ионная химическая связь. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl-, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решетной обладают сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомными наливают кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентними связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
В таких решетках атомы соединены между собой очень прочными ковалентними связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Число веществ с атомной кристаллической решеткой не очень велико. К ним относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, в состав которых входит оксид кремния (IV) — SlО2: кремнезем, кварц, песок, горный хрусталь.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 ºС), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными и неполяриыми. Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями , между самими молекулами действуют слабые силы можмолекулярно-го притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи.
Примерами веществ с молекулярными кристаллическими решетками являются твердая вода — лед, твердый оксид углерода (IV) — «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно- (благородные газы), двух- , трех- (О3), четырех- (Р4). восьмиатомными молекулами. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны в общее пользование). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Для веществ, имеющих молекулярное строение, справедлив открытый французским химиком Ж. Л. Прустом (1799-1803) закон постоянства состава. В настоящее время этот закон формулируется так: «Молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста является одним из основных законов химии. Однако для веществ с нсмолекулярным строением, например ионным, этот закон не всегда справедлив.
Закон Пруста является одним из основных законов химии. Однако для веществ с нсмолекулярным строением, например ионным, этот закон не всегда справедлив.
1. Твердое, жидкое и газообразное состояния вещества.
2. Твердые вещества: аморфные и кристаллические.
3. Кристаллические решетки: атомные, ионные, металлические и молекулярные.
4. Закон постоянства состава.
Какие свойства нафталина лежат в основе его применения для защиты шерстяных изделий от моли?
Какие качества аморфных тел применимы для опнсаиия особенностей характера отдельных людей?
Почему открытый датским ученым К. X. Эрстедом алюминий в 1825 г. еще долгое время относился к драгоценным металлам?
Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твердого кислорода, используя его описание, приведенное в книге.
Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу .
Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком — нет? Почему?
Согласно атомно-молекулярной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры). Такие структуры называются кристаллическими решётками . Места, в которых находятся сами молекулы, ионы или атомы, называют узлами . А расстояния между узлами получили название – периоды идентичности . В зависимости от положения частиц в пространстве, различают несколько типов:
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные , так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся ;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na +) и отрицательных (Cl —) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).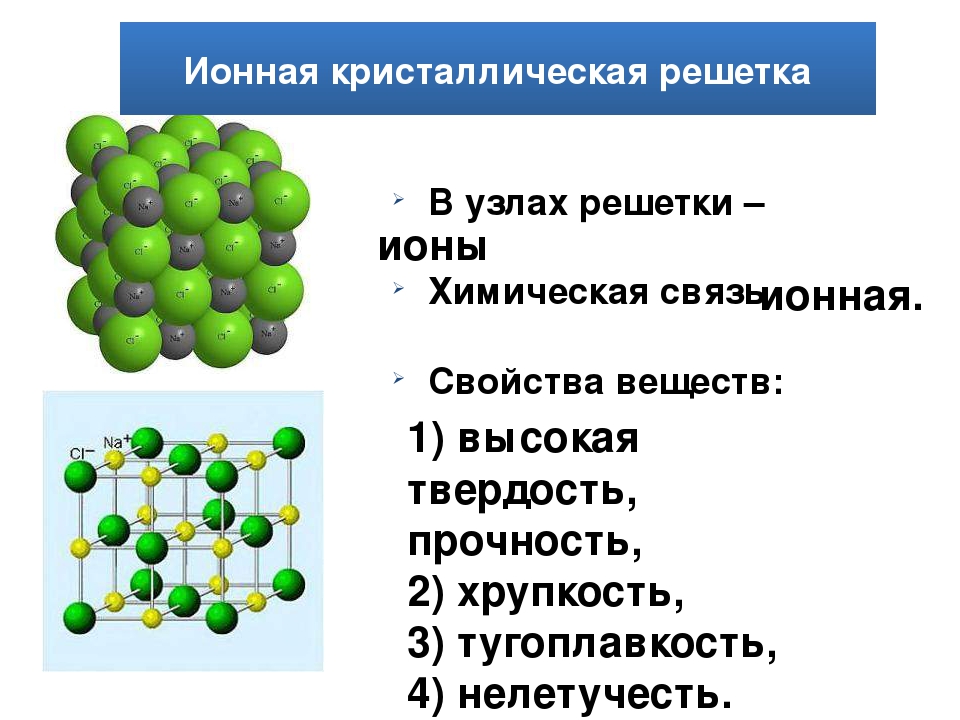
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Как мы уже знаем, вещество может существовать в трех агрегатных состояниях: газообразном , твердом и жидком . Кислород, который при обычных условиях находится в газообразном состоянии, при температуре -194° С преобразуется в жидкость голубоватого цвета, а при температуре -218,8° С превращается в снегообразную массу с кристаллами синего цвета.
Температурный интервал существования вещества в твердом состоянии определяется температурами кипения и плавления. Твердые вещества бывают кристаллическими и аморфными .
У аморфных веществ нет фиксированной температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В таком состоянии, например, находятся различные смолы, пластилин.
В таком состоянии, например, находятся различные смолы, пластилин.
Кристаллические вещества отличаются закономерным расположением частиц, из которых они состоят: атомов, молекул и ионов, – в строго определенных точках пространства. Когда эти точки соединяются прямыми линиями, создается пространственный каркас, его называют кристаллической решеткой. Точки, в которых находятся частицы кристалла, называют узлами решетки.
В узлах воображаемой нами решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. Когда температура увеличивается, размах этих колебаний тоже возрастает, что приводит к тепловому расширению тел.
В зависимости от разновидности частиц, находящихся в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные , атомные , молекулярные и металлические .
Ионными называют такие кристаллические решетки, в узлах которых расположены ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+, Cl- , так и сложные SO24-, OH-. Таким образом, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксилы металлов, т.е. те вещества, в которых существует ионная химическая связь. Рассмотрим кристалл хлорида натрия, он состоит из положительно чередующихся ионов Na+ и отрицательных CL-, вместе они образуют решетку в виде куба. Связи между ионами в таком кристалле чрезвычайно устойчивы. Из-за этого вещества с ионной решеткой обладают сравнительно высокой прочностью и твердостью, они тугоплавки и нелетучи.
Атомными кристаллическими решетками называют такие кристаллические решетки, в узлах которых находятся отдельные атомы. В подобных решетках атомы соединяются между собой очень крепкими ковалентными связями. К примеру, алмаз – одно из аллотропных видоизменений углерода.
Вещества с атомной кристаллической решеткой не сильно распространены в природе. К ним относятся кристаллический бор, кремний и германий, а также сложные вещества, например такие, в составе которых есть оксид кремния (IV) – SiO 2: кремнезем, кварц, песок, горный хрусталь.
Подавляющее большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (у алмаза она превышает 3500° С), такие вещества прочны и тверды, практически не растворимы.
Молекулярными называют такие кристаллические решетки, в узлах которых расположены молекулы. Химические связи в этих молекулах могут быть также, как полярными (HCl, H 2 0), так и неполярными (N 2 , O 3). И хотя атомы внутри молекукл связаны очень крепкими ковалентными связями, между самими молекулами действует слабые силы межмолекулярного притяжения. Именно поэтому вещества с молекулярными кристаллическими решетками характеризуются малой твердостью, низкой температурой плавления, летучестью.
Примерами таких веществ могут послужить твердая вода – лед, твердый оксид углерода (IV) – «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно – (благородные газы), двух – (H 2 , O 2 , CL 2 , N 2 , I 2), трех – (O 3), четырех – (P 4), восьмиатомными (S 8) молекулами.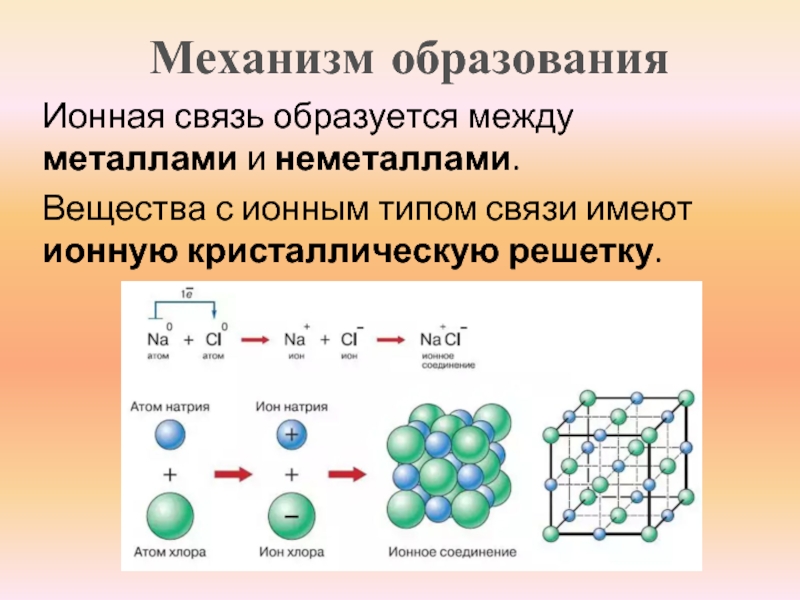 Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
Подавляющее большинство твердых органических соединений обладают молекулярными кристаллическими решетками (нафталин, глюкоза, сахар).
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Поговорим о твердых телах. Твердые тела можно разделить на две большие группы: аморфные и кристаллические . Разделять мы их будем по принципу есть порядок или нет.
В аморфных веществах молекулы располагаются хаотично. В их пространственном расположении нет никаких закономерностей. По сути, аморфные вещества – это очень вязкие жидкости, настолько вязкие, что твердые.
Отсюда и название: «а-» – отрицательная частица, «morphe» – форма. К аморфным веществам относятся: стекла, смолы, воск, парафин, мыло.
Отсутствие порядка в расположении частиц обусловливает физические свойства аморфных тел: они не имеют фиксированных температур плавления . По мере нагревания их вязкость постепенно снижается, и они также постепенно переходят в жидкое состояние.
В противоположность аморфным веществам существуют кристаллические. Частицы кристаллического вещества пространственно упорядочены. Это правильная структура пространственного расположения частиц в кристаллическом веществе называется кристаллической решеткой .
В отличии от аморфных тел, кристаллические вещества имеют фиксированные температуры плавления.
В зависимости от того какие частицы находятся в узлах решетки , и от того какие связи удерживают их различают: молекулярную , атомную , ионную и металлическую решетки.
Для чего принципиально важно знать, какая у вещества кристаллическая решетка? Что она определяет? Все. Структура определяет, как химические и физические свойства вещества .
Самый простой пример: ДНК. У всех организмов на земле она построена из одинакового набора структурных компонентов: нуклеотидов четырех видов. А какое многообразие жизни. Это все определяется структурой: порядком, в котором эти нуклеотиды расположены.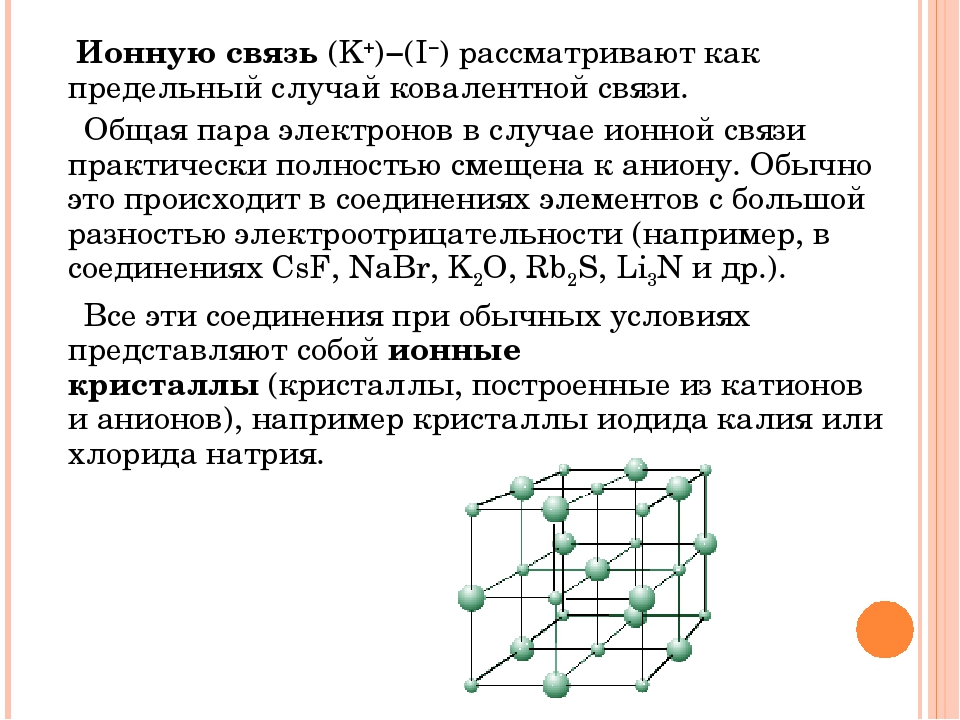
Типичный пример вода – в твердом состоянии (лед). В узлах решетки находятся целые молекулы. И удерживают их вместе межмолекулярные взаимодействия : водородные связи, силы Ван-дер-Ваальса.
Связи эти слабые, поэтому молекулярная решетка – самая непрочная , температура плавления таких веществ низкая.
Хороший диагностический признак: если вещество имеет при нормальных условиях жидкое или газообразное состояние и/или имеет запах – то скорее всего у этого вещества молекулярная кристаллическая решетка. Ведь жидкое и газообразное состояния – это следствие того, что молекулы на поверхности кристалла плохо держатся (связи то слабые). И их «сдувает». Это свойство называется летучестью. А сдутые молекулы, диффундируя в воздухе доходят до наших органов обоняния, что субъективно ощущается как запах.
Молекулярную кристаллическую решетку имеют:
- Некоторые простые вещества неметаллов: I 2 , P, S (то есть все неметаллы, у которых не атомная решетка).

- Почти все органические вещества (кроме солей ).
- И как уже говорилось ранее, вещества при нормальных условиях жидкие, либо газообразные (будучи замороженными) и/или имеющие запах (NH 3 , O 2 , H 2 O, кислоты, CO 2).
В узлах атомной кристаллической решетки, в отличие от молекулярной, располагаются отдельные атомы . Получается, что удерживают решетку ковалентные связи (ведь именно они связывают нейтральные атомы).
Классический пример – эталон прочности твердости – алмаз (по химической природе – это простое вещество углерод). Связи: ковалентные неполярные , так как решетку образуют только атомы углерода.
А вот, например, в кристалле кварца (химическая формула которого SiO 2) есть атомы Si и O. Поэтому связи ковалентные полярные .
Физические свойства веществ с атомной кристаллической решеткой:
- прочность, твердость
- высокие температуры плавления (тугоплавкость)
- нелетучие вещества
- нерастворимы (ни в воде, ни в других растворителях)
Все эти свойства обусловлены прочностью ковалентных связей.
Веществ в атомной кристаллической решеткой немного. Особой закономерности нет, поэтому их нужно просто запомнить:
- Аллотропные модификации углерода (C): алмаз, графит.
- Бор (B), кремний (Si), германий (Ge).
- Только две аллотропные модификации фосфора имеют атомную кристаллическую решетку: красный фосфор и черный фосфор. (у белого фосфора – молекулярная кристаллическая решетка).
- SiC – карборунд (карбид кремния).
- BN – нитрид бора.
- Кремнезем, горный хрусталь, кварц, речной песок – все эти вещества имеют состав SiO 2 .
- Корунд, рубин, сапфир – у этих веществ состав Al 2 O 3 .
Наверняка возникает вопрос: С – это и алмаз, и графит. Но они же совершенно разные: графит непрозрачный, пачкает, проводит электрический ток, а алмаз прозрачный, не пачкает и ток не проводит. Отличаются они структурой.
И то, и то – атомная решетка, но разная. Поэтому и свойства разные.
Ионная кристаллическая решетка.Классический пример: поваренная соль: NaCl.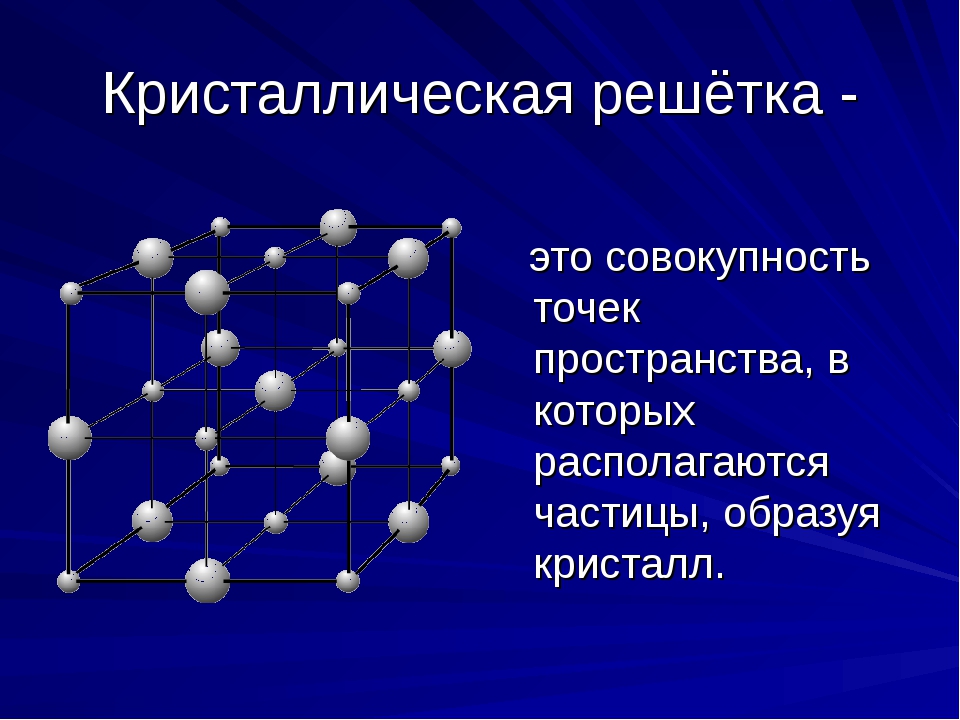 В узлах решетки располагаются отдельные ионы : Na + и Cl – . Удерживает решетку электростатические силы притяжения между ионами («плюс» притягивается к «минусу»), то есть ионная связь .
В узлах решетки располагаются отдельные ионы : Na + и Cl – . Удерживает решетку электростатические силы притяжения между ионами («плюс» притягивается к «минусу»), то есть ионная связь .
Ионные кристаллические решетки довольно прочные, но хрупкие, температуры плавления таких веществ довольно высокие (выше, чем у представителей металлической, но ниже чем у веществ с атомной решеткой). Многие растворимы в воде.
С определением ионной кристаллической решетки, как правило, проблем не возникает: там, где ионная связь – там ионная кристаллическая решетка. Это: все соли , оксиды металлов , щелочи (и другие основные гидроксиды).
Металлическая кристаллическая решетка.Металлическая решетка реализуется в простых веществах металлах . Ранее мы говорили, что все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Час настал.
Главное свойство металлов: электроны на внешнем энергетическом уровне плохо удерживаются, поэтому легко отдаются. Потеряв электрон металл превращается в положительно заряженный ион – катион:
Потеряв электрон металл превращается в положительно заряженный ион – катион:
Na 0 – 1e → Na +
В металлической кристаллической решетке постоянно протекают процессы отдачи, и присоединения электронов: от атома металла в одном узле решетки отрывается электрон. Образуется катион. Оторвавшийся электрон притягивается другим катионом (или этим же): вновь образуется нейтральный атом.
В узлах металлической кристаллической решетки находятся как нейтральные атомы, так и катионы металла. А между узлами путешествуют свободные электроны:
Эти свободные электроны называются электронным газом. Именно они обусловливают физические свойства простых веществ металлов:
- тепло- и электропроводность
- металлический блеск
- ковкость, пластичность
Это и есть металлическая связь: катионы металлов притягиваются к нейтральным атомам и все это «склеивают» склеивают свободные электроны.
Как определить тип кристаллической решетки.
P. S. Есть кое-что в школьной программе и программе ЕГЭ по этой теме то, с чем мы не совсем согласны. А именно: обобщение, о том, что любая связь металл-неметалл – это ионная связь. Это допущение, намеренно сделано, видимо, для упрощения программы. Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al 2 O 3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Есть кое-что в школьной программе и программе ЕГЭ по этой теме то, с чем мы не совсем согласны. А именно: обобщение, о том, что любая связь металл-неметалл – это ионная связь. Это допущение, намеренно сделано, видимо, для упрощения программы. Но это ведет к искажению. Граница между ионной и ковалентной связью условная. У каждой связи есть свой процент «ионности» и «ковалентности». Связь с малоактивным металлом имеет малый процент «ионности», она больше похожа на ковалентную. Но по программе ЕГЭ, она «округляется» в сторону ионной. Это порождает, порой абсурдные вещи. Например, Al 2 O 3 – вещество с атомной кристаллической решеткой. О какой ионности здесь может идти речь. Только ковалентная связь может удерживать таким образом атомы. Но по стандарту «металл-неметалл» мы квалифицируем эту связь как ионную. И получается противоречие: решетка атомная, а связь ионная. Вот к чему приводит, излишнее упрощение.
Химическая связь. Кристаллические решетки. (Лекция 2.2)
Лекция 2-2«Химическая связь»
1
Способы образования ковалентной связи.

а) обменный
Общая электронная пара, осуществляющая ковалентную
связь,
образуется за счет неспаренных электронов,
имеющихся во взаимодействующих атомах.
Атом азота может участвовать в образовании трех
ковалентных связей (N2 или Nh4).
2
Число ковалентных связей может быть и больше числа
имеющихся у невозбужденного атома неспаренных электронов
за
счет
процесса
возбуждения,
сопровождающегося
«распариванием» электронов.
Затраты на «распаривание» электронов компенсируются
энергией образования связей в молекуле.
Для углерода характерны соединения с четырьмя
ковалентными связями (СО2, СН4).
3
4
У атомов элементов третьего и последующих периодов
появляется d-подуровень, на который при возбуждении могут
переходить s и р электроны внешнего слоя.
НClO
НClO2
НСlО3
НСlО4
5
Для кислорода и фтора возрастание числа неспаренных
электронов возможно только путем перехода
одного из
электронов на 3s уровень.

Эти
затраты
не
компенсируются
энергией
образования новых связей и
процесс,
в
целом,
оказывается
энергетически
невыгодным.
Для этих элементов
характерна
постоянная
ковалентность, равная двум
для кислорода и единице для фтора.
6
б) донорно-акцепторный
Ковалентная связь образуется за счет неподеленных
электронных пар, имеющихся во внешнем электронном слое
одного атома со свободной орбиталью другого атома .
донор — атом азота;
акцептор — атом водорода.
Четыре связи N — Н в ионе аммония Nh5+ во всех отношениях
равноценны.
Связь, образованная донорно-акцепторным механизмом, не
отличается по своим свойствам от ковалентной связи,
7
создаваемой по обменному механизму!!!
Метод валентных связей (ВС)
В методе валентных связей (ВС) образуется двухэлектронная
двухцентровая связь, в которой электроны в равной степени
принадлежат каждому из атомов.

8
Условия образования химической связи:
1. Наличие неспаренных электронов (ē)
НСlО4
9
2. Противоположно направленные спины
↑↓
10
3. Энергия молекулы меньше суммарной
энергии атомов — процесс экзотермический
(+Q)
ЕАВ
Зависимость энергии вандерваальсова взаимодействия
сближающихся молекул от расстояния между ними 11
Для более прочных молекул расстояние между центрами атомов
( длина связи) уменьшается, энергия связи увеличивается
12
— и π-связи
-связь образуется за счет взаимного перекрывания атомных
орбиталей вдоль линии, соединяющей центры
взаимодействующих атомов.
13
π-связь образуется за счет двукратного взаимного
перекрывания атомных орбиталей перпендикулярно линии,
соединяющей центры взаимодействующих атомов.
π-связь образуется только после образования σ-связи!
14
σ-связь более прочная, чем
Сначала образуется
потом
π-связь!!!!!
σ-связь и только
π-связи (максимум две)!!!!!!
O
C
O
H
C
N
Связи между двумя атомами углерода
в молекуле этилена
СН2=СН2
осуществляется перекрыванием двух
облаков по оси молекулы (σ-связь) и
боковым перекрыванием двух других
электронных облаков (π-связь).

15
Полярность — характеризует смещение электронной плотности
к более электроотрицательному атому.
16
Для оценки смещения электронной плотности к одному из атомов
используется шкала относительных
электроотрицательностей (ЭО) атомов (шкала Полинга)
Потенциал ионизации (ПИ) Энергия сродства (ЭС)
ЭО
2
ПИ = А – ē = А+
— энергия, необходимая для отрыва электрона от атома
с образованием катиона;
ЭС = В + ē = В- энергия, выделяющаяся при присоединении электрона к атому
с образованием аниона.
Энергия присоединения или
отрыва электронов зависит
от радиуса атомов
17
Значения электроотрицательности нужно! использовать для оценки
направления смещения электронов при образовании молекул. 18
19. Химическая связь в молекуле фтороводорода:
1) ковалентная полярная2) ковалентная неполярная
3) ионная
4) водородная
19
Гибридизация процесс взаимодействия двух или нескольких разных по форме
и энергии орбиталей с образованием такого же количества
одинаковых по форме и энергии орбиталей.
1. sp-гибридизация
(s+р)
(Beh3)
20
2. sp2–гибридизация
(s+p+p)
(ВF3)
21
3. sp3–гибридизация
(s+p+p+p)
(СН4)
22
Гибридизации могут подвергаться не все s- и p-орбитали.
Негибридизованные р-орбитали участвуют в образовании π-связей
Две sp-гибридные орбитали и две р-орбитали
23
Три sp2-гибридные орбитали и одна р-орбиталь
24
Тип гибридизации (число орбиталей, участвующих в
гибридизации) определяется суммой σ — связей и
неподелённых электронных пар!!!!!!!!
n=2
sp
n=3
sp2
n = ñâÿçè +
n=4
sp3 (dsp2)
n=5
dsp3
n=6
d2sp3
Пространственная ориентация гибридизованных орбиталей25
Донорно-акцепторный механизм
Образование химической связи в
Nh5+
26
Образование химической связи в BeF42BeF42- — описать химическую связь в этом ионе можно,
как и в предыдущем
Второй подход предполагает, что Ве – центральный атом имеет
заряд +2 , а окружающие его атомы F отрицательно заряжены
( F- — лиганды ).

27
Акцепторы электронов.
Доноры электронов.
K3[Fe(CN)6], K2[HgI4], [Al(h3O)6]Cl3, [Ag(Nh4)2]OH,
[Pt(Nh4)2Cl2], K3[Cr(OH)6], Li[Alh5], Na[Bh5]
28
Наизусть!!!!!
Донорно-акцепторный механизм
образования связи:
Ионы: Nh5+, h4O+, Ph5+, Аsh5+, C6H5Nh4+,BF4-;
Молекулы: O3, CO,
Кислоты:h3[SiF6],
Комплексные соли –Na[Al(OH)4], Na2[Zn(OH)4], [Ag(Nh4)2]OH.
[Cu(Nh4)4]SO4 K3[Fe(CN)6], K4[Fe(CN)6], Na3 ]AlF6] (криолит),
Большинство комплексных соединений,
как и сами ионы металлов, имеют окраску
29
Для углерода (С) легко запомнить, что:
H
H
C
H
4ϭ-связи –
sp3-гибридизация
(тетраэдр)
H
30
C
C
3ϭ- связи и 1 π-связь –
sp2-гибридизация
(плоскостно-тригональная)
31
C
C
C
C
C
2ϭ- связи и 2π-связи –
sp-гибридизация
(линейная)
32
Водородная связь
— связь между атомом водорода
и сильно электроотрицательным элементом.

Механизм:
частично электростатический,
частично донорно-акцепторный.
а) межмолекулярная
H F …. H F
H
H
H
H
O …. H
H
O
N H …. N
— 28 КДж/моль
— 20-25 КДж/моль
H
КДж
/моль
H — 18
H
б) внутримолекулярная
HO
O
H
O
33
Образование водородной связи может существенно
изменять физические свойства вещества — теплоты плавления
и испарения, температуры кипения, вязкость, твердость!!!!
Именно из-за прочных водородных связей плавиковая кислотa
HF – слабая, т.к. образует ассоциаты !!!!
H F …. H F
34
35. Наибольшую температуру плавления имеет вещество:
1) Sih52) РН3
3) h3S
4) HCI
35
Высокая теплота испарения воды обусловлена водородными
связями и делает ее эффективным средством охлаждения!
36
Способность льда плавиться при повышенном давлении
позволяет кататься на коньках по льду, так как образующаяся
под коньками жидкая вода играет роль смазки.

37
Водородные связи
в органической химии
Класс соединений
Наличие водородных
связей
Спирты
да
Фенолы
да
Эфиры
нет
Альдегиды
нет
Кетоны
нет
Карбоновые кислоты
да
Амины
да
Аминокислоты
да
38
Межмолекулярные водородные связи реализуются
в полинуклеотидах
39
Ионная связь
Предельный случай полярной
ковалентной связи.
Образуется
при
взаимодействии двух атомов,
резко
различающихся
электроотрицательностью.
Наблюдается только в твердом
состоянии, для кристаллов
(CsF, KBr, NaCl) .
кристалл NaCI
40
В воде ионные соединения легко диссоциируют на ионы.
Для них характерны высокие температуры плавления и
кипения, их расплавы и растворы проводят электрический ток.
кристалл CsCI
41
Металлическая связь
Характеризуется небольшим числом электронов на внешнем
уровне, слабо удерживаемых ядром, и большим числом
свободных атомных орбиталей, близких по энергии.

Электроны делокализованы
(распределены) между всеми
атомами в кристалле, что
обеспечивает
устойчивость
данной связи.
Делокализованное «море»
валентных электронов
Металлы имеют особую
кристаллическую решетку, в
узлах которой находятся как
атомы, так и ионы металла, а
между
ними
свободно
перемещаются
обобществленные
электроны
(«электронный газ»).
42
Эти особенности строения металлов определяют их
высокую электропроводимость, теплопроводность, а также
ковкость и особый металлический блеск.
43
Металлическая связь характерна для металлов не только в
твердом состоянии, но и в расплаве.
NB!!!
В газообразном состоянии атомы металлов в молекулах
связаны между собой ковалентной связью.
44
Типы кристаллических решеток
Атомная
Молекулярная
Ионная
Металлическая
45
АТОМНЫЕ
1. Атомными называют кристаллические решётки, в узлах которых
находятся отдельные атомы, которые соединены очень прочными
ковалентными связями в протяженную пространственную сеть
2.
 Вещества с АКР имеют высокие температуры плавления, обладают
Вещества с АКР имеют высокие температуры плавления, обладаютповышенной твёрдостью.
3. В природе встречается немного веществ с атомной
кристаллической решёткой.
К ним относятся:
алмаз(С), графит(С), кремний(Si), германий(Ge), бор (B), песок (SiO2),
карборунд (SiC), нитрид бора (BN), черный и красный фосфор
Кристаллическая решётка алмаза.
46
Структура отличается таким внутренним единством, что можно
сказать, что весь кристалл представляет одну молекулу.
Представим эту структуру виде гимнастической пирамиды
Кристаллическая
решётка алмаза.
Каждый гимнаст на ней символизирует атом углерода,
связанный четырьмя ковалентными связями с соседними
атомами.
Целостность
структуры
поддерживается
исключительно благодаря усилиям каждого из гимнастов.
Пирамида демонстрирует также высокую взаимосвязанность
узлов атомной кристаллической решетки: стоит одному из
гимнастов ослабить только одну связку, и вся структура может
рухнуть.

47
В кристалле графита атомы углерода связаны несколько поиному Они объединены в плоские слои, состоящие из
правильных шестиугольников.
Расстояние между слоями в графите
довольно велико, а силы взаимодействия
между ними довольно слабы (в основном
это слабые межмолекулярные связи,
показанные
пунктирными
линиями),
поэтому графит может расщепляться на
тонкие чешуйки.
Чешуйки легко прилипают к бумаге – вот
почему из графита делают грифели
карандашей.
Кристаллическая
структура графита
48
МОЛЕКУЛЯРНЫЕ
1. Молекулярными называют кристаллические решётки, в узлах
которых располагаются молекулы. Химические связи в них
ковалентные, как полярные, так и неполярные. Связи в
молекулах прочные, но между молекулами связи не прочные.
2. Вещества с МКР имеют малую твёрдость, плавятся при низкой
температуре, летучие, при обычных условиях находятся в
газообразном или жидком состоянии
3.
 К ним относятся: «сухой лед»(твердый СО2), вода(h3O),
К ним относятся: «сухой лед»(твердый СО2), вода(h3O),аммиак(Nh4), HCl, галогены, Ar , сера S8, этанол(C2H5OH),
глюкоза(С6Н12О6), фенол (С6Н5-ОН) белый фосфор Р4.
NB!!! Практически все органические вещества также
образуют молекулярные кристаллы.
— молекулярная
кристаллическая решётка I2
49
Можно уподобить эту структуру группе семейных пар В каждой
паре супругов связывают прочные узы брака (подобно
прочной связи атомов внутри молекулы), а вот отношения
между парами носят поверхностный характер: они могут
дружить семьями, испытывать дружеские чувства, но
довольно свободно могут обойтись и друг без друга.
Группа супружеских пар (аналогия молекулярного кристалла).
50
ИОННЫЕ
1. Ионными называют кристаллические решетки, в узлах которых
находятся ионы. Их образуют вещества с ионной связью.
2. Ионные кристаллические решётки имеют:
основные оксиды, щелочи, соли, гидриды (NaH, Cah3), нитриды
(Na3N, Ca3N2), фосфиды (Na3P, Mg3P2, AIP).
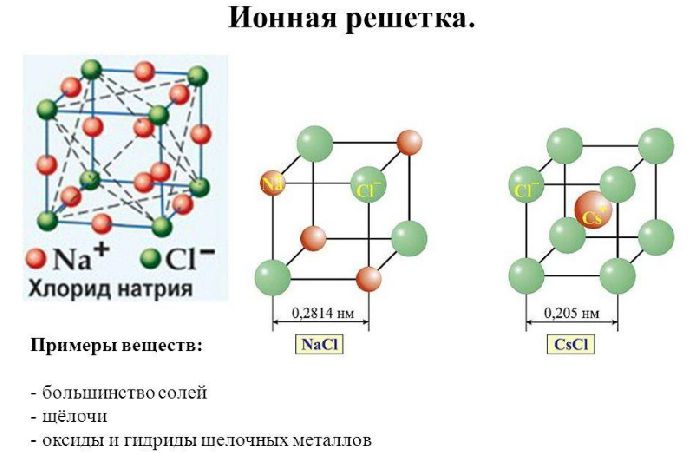
3. Связи между ионами в кристалле очень прочные и устойчивые.
Поэтому: вещества с ионной решёткой обладают высокой
твёрдостью и прочностью, тугоплавки и нелетучи.
Cтроение кристалла поваренной соли, в узлах которого
находятся ионы хлора и натрия:
51
Уподобим ионную структуру группе расположенных в
шахматном порядке мужчин и женщин Пусть мужчины
символизируют катионы, а женщины — анионы. Тогда каждый
человек оказывается в зоне действия обаяния окружающих его
представителей противоположного пола, к которым он (она) в силу
закона притяжения противоположностей испытывает интерес.
Интерес этот одинаково выражен во всех направлениях, поскольку
на рисунке — холостые мужчины и незамужние женщины. Этим и
объясняется повышенная прочность ионного кристалла.
Романтическая сила влечения – аналогия ионного кристалла. 52
МЕТАЛЛИЧЕСКИЕ
Металлическими называют решётки, в узлах которых находятся
атомы и ионы металла.

Для металлов характерны физические свойства:
пластичность, ковкость, металлический блеск, высокая электрои теплопроводность.
s-металлы обычно имеют низкие температуры плавления,
d-металлы – более высокие.
53
Для иллюстрации строения металлов в твердом
состоянии можно провести экстравагантную
аналогию:
Группа мужчин изображает катионы металлов (узлы
металлической кристаллической решетки). Все
пространство между ними заполнено летающими
пчелами (это, понятно, свободные электроны).
Рисунок убедительно иллюстрирует силы,
удерживающие одноименно заряженные катионы в
узлах решетки:
при всем желании деваться некуда – всюду пчелы!
Среди пчел — аналогия структуры металла.
54
55. Типы кристаллических решеток
Тип решеткиКраткая
характеристика
Свойства веществ с
данным типом
решетки
Атомная
Алмаз, графит,
кремний, германий,
бор, черный фосфор и
красный фосфор
SiO2 ,SiC, BN
В узлах решетки
находятся отдельные
атомы, соединенные
между собой
ковалентными
прочными связями
Большая прочность,
твердость, высокие
температуры
плавления и кипения,
практически
нерастворимы в воде
Молекулярная
«Сухой лед»(твердый СО2),
аммиак, HCl, галогены,
белый фосфор, этанол,
глюкоза, фенол
В узлах решетки
находятся молекулы,
связанные друг с
другом слабыми
межмолекулярными
силами
В обычных условиях
– газы, жидкости или
легкоплавкие
твердые вещества,
плохо растворимые в
воде, летучи
55
Тип решетки
Краткая
характеристика
Свойства веществ с
данным типом решетки
Ионная
Основные оксиды,
щелочи, соли, гидриды
металлов (NaH, Cah3),
нитриды (Na3N, Ca3N2),
фосфиды(Na3P, Mg3P2, AIP),
В узлах решетки находятся
разноименно заряженные
атомные или молекулярные
ионы, прочно связанные
между собой силами
электростатического
притяжения
NB! Понятие «молекула» для
веществ с ионной
кристаллической решеткой
неприменимо!
Тугоплавки, мало летучи,
без запаха, хорошо
растворимы в воде, в
твердом состоянии не
проводят электрический
ток, т.
 к в ионных
к в ионныхкристаллах нет
свободных электронов, а
сами ионы не могут
свободно перемещаться
по кристаллу
Металлическая
Металлы
В узлах решетки находятся
нейтральные и
ионизированные атомы,
окруженные свободными
электронами («электронный
газ»)
Высокая электро- и
теплопроводность
(переходные Ме в
сравнении с металлами
главных подгрупп имеют
более высокие Тпл. и Ткип.,
плотность.
56
атомная решетка
молекулярная решетка
ионная решетка
металлическая решетка
57
58. Тест №7 Химическая связь (один вариант ответа)
5859. Атомы химических элементов 2-го периода периодической системы Д. И. Менделеева образуют соединения с ионной химической связью состава:
1)Атомы химических элементов 2-го
периода периодической системы
Д. И. Менделеева образуют
соединения с ионной химической
связью состава:
1) BaS
2) CO2
3) Al2О3
4) LiF
59
60.
 2) В веществах, образованных путем соединения одинаковых атомов, химическая связь: 1) ионная
2) В веществах, образованных путем соединения одинаковых атомов, химическая связь: 1) ионная2) ковалентная полярная
3) ковалентная неполярная
4) водородная
60
61. 3) Химическая связь в молекуле фтороводорода:
1) ковалентная полярная2) ковалентная неполярная
3) ионная
4) водородная
61
62. 4) В нитриде калия химическая связь:
1) ковалентная неполярная2) ковалентная полярная
3) металлическая
4) ионная
62
63. 5) Число π-связей между атомами углерода в молекуле ацетилена равно:
1) 12) 2
3) 3
4) 4
63
64. 6) Наибольшую температуру плавления имеет вещество:
1) Sih52) РН3
3) h3S
4) HCI
64
65. 7) В каком соединении ковалентная связь между атомами образуется по донорно-акцепторному механизму?
7) В каком соединении ковалентная связьмежду атомами образуется по донорноакцепторному механизму?
1) KCI
2) ССI4
3) Nh5CI
4) СаСI2
65
66.
 8 ) Отрицательная степень окисления у атома серы в соединении: 1) NaHS
8 ) Отрицательная степень окисления у атома серы в соединении: 1) NaHS2) NaHSO3
3) SO2
4) h3SO4
66
67. 9) Степень окисления железа в соединении FeSO3 равна:
1) +12) +2
3) +3
4) +6
67
68. 10) Степень окисления молибдена в соединении Na2MoO4 равна:
1) +42) +6
3) -4
4) -6
68
69. 11) Ионную кристаллическую решетку имеет:
1) фторид натрия2) вода
3) серебро
4) бром
69
70. 12) Кристаллическая решетка оксида углерода (IV) СО2 является:
1) ионной2) атомной
3) молекулярной
4) металлической
70
71. 13) Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для:
13) Утверждение о том, что структурнойчастицей данного вещества является
молекула, справедливо только для:
1) алмаза
2) азота
3) кремния
4) поваренной соли
71
72. 14) Для какой пары веществ структурной единицей является ион?
1) СН4 и I22) SO2 и Н2О
3) СI2 и Nh4
4) LiF и КСI
72
73.
 15) Только молекулярную кристаллическую решетку имеют простые вещества, образованные элементами главной подгруппы: 1) VII группы
15) Только молекулярную кристаллическую решетку имеют простые вещества, образованные элементами главной подгруппы: 1) VII группы2) VI группы
3) V группы
4) IV группы
73
74. 16) Простые вещества, образованные элементами главной подгруппы I группы:
1) имеют молекулярное строение2) имеют металлическую кристаллическую
решетку
3) образуют кристаллы с ионной
кристаллической решеткой
4) являются аморфными веществами
74
75. 17) Наибольшую температуру плавления имеет вещество, формула которого:
1) СН42) SiO2
3) Sn
4) KF
75
76. 18) К числу веществ с молекулярным строением принадлежит:
1) алмаз С2) известняк СаСО3
3) кварц SiO2
4) сахароза С12Н22О11
76
77. 19) Атомную кристаллическую решетку имеет
1) азот2) кремний
3) красный фосфор
4) олово
77
20. Молекулярное строение имеет:
1) графит
2) сульфат железа(III)
3) оксид железа(III)
4)оксид углерода(IV)
78
Ответы (Тест 7)
1
2
3
4
5
6
7
8
4
3
1
4
2
4
3
1
9
2
10
2
11 12 13 14 15 16 17 18 19 20
1
3
2
4
1
2
2
4
2
4
79
80.
 Тест №8 Химическая связь (один вариант ответа) 80
Тест №8 Химическая связь (один вариант ответа) 801. Число водородных связей, которое
может образовать каждая молекула
глицерина, равно
1) 3
2) 1
3) 2
4) 0
81
2. Степень окисления железа в
соединении K4[Fe(CN)6] равна
1) 0
2) +3
3) +2
4) +1
82
3. Верны ли следующие суждения о
веществах с молекулярной
кристаллической решеткой?
А) эти вещества тугоплавкие;
Б) эти вещества обладают высокой
электропроводностью.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны
83
4. Из предложенных веществ выберите
соли:
А) Nh5Cl
В) N2h3
Д) CS2
Ж) Al4C3
Б) NaH
Г) K[Al(OH)4]
Е) C6H5Nh4Cl
З) Ch4COH
1) Б, Д, Е
2) А, В, Ж
3) А, Г, Е
4) Г, Е, З
84
5. Высший гидроксид хрома
1) проявляет кислотные свойства
2) проявляет основные свойства
3) проявляет амфотерные свойства
4) не проявляет кислотно-основных свойств
85
6.
 Какому из указанных оксидов не
Какому из указанных оксидов несоответствует гидроксид?
1) оксиду серы (IV)
2) оксиду углерода (IV)
3) оксиду углерода (II)
4) оксиду азота(III)
86
7. Энергия связи между атомами
углерода в ряду
одинарная-двойная-тройная
1) уменьшается
2) увеличивается
3) не изменяется
4) увеличивается, а затем уменьшается
87
8. Степень окисления атома углерода
в соединении Ch3Cl2 равна
1) -4
2) 0
3) +4
4) +2
88
9. Понятие «молекула» неприменимо
по отношению к структурной
единице вещества
1) хлороформа
2) кислорода
3) алмаза
4) озона
89
10. Длина связи и энергия связи Э-Н у
элементов VA группы Периодической
системы химических элементов Д.И.
Менделеева соответственно
1) уменьшается и уменьшается
2) увеличивается и увеличивается
3) увеличивается и уменьшается
4) уменьшается и увеличивается
90
11. Атомная кристаллическая решетка
характерна для
1) алюминия и карбида кремния
2) серы и иода
3) оксида кремния и хлорида натрия
4) алмаза и бора
91
12.
 Соединения, образованные только
Соединения, образованные толькоковалентной полярной связью
А) Ch4COONa
Б) SCl2
В) NaHCO3
Г) Al2O3
Д) Ch4OH
Е) NaH
1) А, В, Г
2) Б, Г, Д
3) А, Б, Д 4) В, Г, Д
92
13. Если вещество хорошо растворимо
в воде, имеет высокую температуру
плавления, неэлектропроводно, то
его кристаллическая решетка
1) молекулярная
2) атомная
3) ионная
4) металлическая
93
14. Вещества, которые не могут
образовывать межмолекулярные
водородные связи
1) Ch4COCh4 и h3O
2) Ch4CNh3Ch3COOH и C2H5OH
3) Ch4COH и C6H5Cl
4) Nh4 и C3H8
94
15. Атомы азота в нитрате аммония,
находящиеся в составе катиона и
аниона, проявляют степени
окисления соответственно
1) +3 и 5
2) -3 и +5
3) +1 и +3
4) +5 и -3
95
16. При комнатной температуре
вещество газообразное, плохо
растворимое в воде,
неэлектропроводное. Его
кристаллическая решетка
1) Атомная
2) Молекулярная
3) Ионная
4) Металлическая
96
17.
 Вещества расположены в
Вещества расположены всоответствии с увеличением
полярности связи Э-Н в ряду
1) HCl, h3S, Ph4
2) Nh4, Ph4, Ash4
3) HF, HCl, HI
4) Ch5, Nh4, h3O
97
18. Верны ли следующие суждения о
веществах с ковалентной полярной связью?
А. В узлах кристаллической решетки
находятся атомы.
Б. Как правило, вещества с ковалентной
полярной связью тугоплавки.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны
98
19. Атомную кристаллическую
решетку не образует
1) кремний
2) германий
3) алюминий
4) углерод
99
20. В ряду HF, HClO, HBr, HI кислотные
свойства
1) изменяются периодически
2) ослабевают
3) не изменяются
4) усиливаются
100
Ответы (Тест 8)
1
2
3
4
5
6
7
8
9
10
1
3
4
3
1
3
2
2
3
3
11
12
13
14
15
16
17
18
19
20
4
2
3
3
2
2
4
4
3
4
101
102.
 Спасибо за внимание!102
Спасибо за внимание!102Задание 4
Задание 4.1
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1) Ca(ClO2)2
2) HClO3
3) NH4Cl
4) HClO4
5) Cl2O7
Запишите в поле ответа номера выбранных соединений.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
Ионную связь зачастую рассматривают как предельный случай ковалентной полярной связи,
данная связь образуется между элементами с большой разностью электроотрицательностей.
В данном случае электронная пара практически полностью переходит от одного атома к другому,
при этом связанные частицы становятся заряженными и их можно считать ионами.
В представленных соединениях ионная связь имеется в молекулах хлорита кальция Ca(ClO2)2 и хлорида аммония NH4Cl.
Ответ: 13
Задание 4.2
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) P2O5
2) NaCl
3) O2
4) HBr
5) P4
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентная неполярная связь образуется между одноименными атомами, при этом связующая их общая электронная пара в равной степени принадлежит обоим соединяющимся атомам. В представленных соединениях ковалентная неполярная связь присутствует в молекулах O2 и P4.
Ответ: 35
Задание 4.3
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
1) HClO3
2) N2
3) CaO
4) H2S
5) KBr
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентная полярная связь образуется между атомами с различной электроотрицательностью. В представленных соединениях ковалентная полярная связь присутствует в молекулах хлорноватой кислоты HClO3 и сероводорода H2S.
Ответ: 14
Задание 4.4
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1) HNO3
2) NaHCO3
3) SO3
4) PCl3
5) CaCl2
Запишите в поле ответа номера выбранных соединений.
Решение
Ионную связь зачастую рассматривают как предельный случай ковалентной полярной связи, данная связь образуется
между элементами с большой разностью электроотрицательностей. В данном случае электронная пара
практически полностью переходит от одного атома к другому, при этом связанные частицы становятся заряженными
и их можно считать ионами. В представленных соединениях ионная связь имеется в молекулах
гидрокарбоната натрия NaHCO3 и хлорида кальция CaCl2.
В представленных соединениях ионная связь имеется в молекулах
гидрокарбоната натрия NaHCO3 и хлорида кальция CaCl2.
Ответ: 25
Задание 4.5
Из предложенного перечня выберите два соединения, для которых характерно образование межмолекулярных водородных связей.
1) NH3
2) H2
3) HF
4) NaH
5) KHCO3
Запишите в поле ответа номера выбранных соединений.
Решение
Водородной называют химическую связь, которая образуется за счет сил электростатического притяжения полярных молекул, включающих атомы химических элементов с наибольшей электроотрицательностью (F, O, N). Среди представленных соединений образование межмолекулярных водородных связей характерно для молекул NH3 и HF.
Ответ: 13
Задание 4.6
Из предложенного перечня выберите два соединения, в которых имеется химическая связь, образованная
по донорно-акцепторному механизму.
1) Al(OH)2F
2) NaNO3
3) KBr
4) NH4Cl
5) N2
Запишите в поле ответа номера выбранных соединений.
Решение
Донорно-акцепторная связь образуется при предоставлении одним атомом (донором) неподеленной пары электронов, которая становится общей между ним и другим атомом (акцептором). В представленных соединениях донорно-акцепторная связь присутствует в молекулах нитрата натрия NaNO3 и хлорида аммония NH4Cl.
Ответ: 24
Задание 4.7
Из предложенного перечня выберите два соединения, которые имеют ионную кристаллическую решетку.
1) HF
2) KF
3) I2
4) N2O
5) Li2O
Запишите в поле ответа номера выбранных соединений.
Источник — Открытый банк заданий ЕГЭ
Решение
В узлах ионной кристаллической решетки расположены ионы.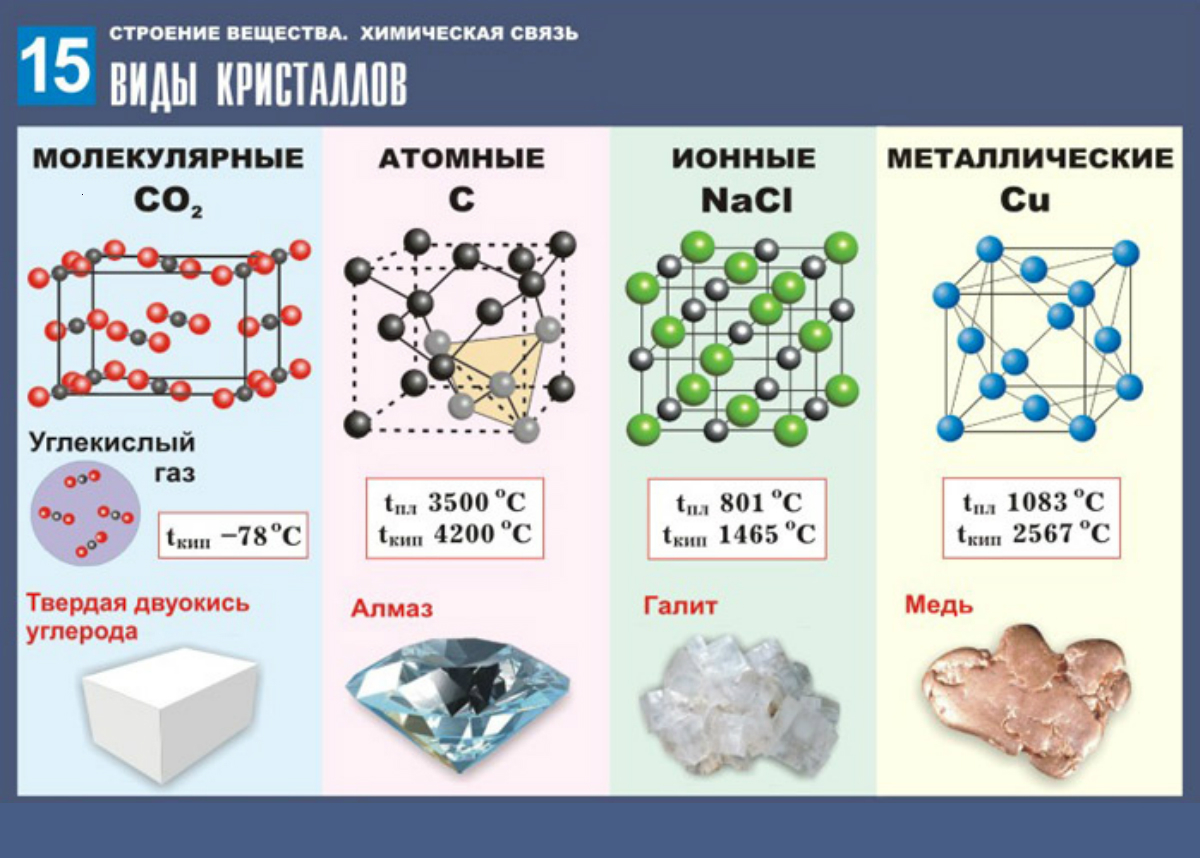 Данным типом кристаллической решетки обладают щелочи, кислоты, оксиды активных металлов.
Среди представленных соединений ионную кристаллическую решетку имеют фторид калия KF и оксид лития Li2O.
Данным типом кристаллической решетки обладают щелочи, кислоты, оксиды активных металлов.
Среди представленных соединений ионную кристаллическую решетку имеют фторид калия KF и оксид лития Li2O.
Ответ: 25
Задание 4.8
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
1) Cl2
2) NH3
3) LiCl
4) Na2O
5) H2O
Запишите в поле ответа номера выбранных соединений.
Решение
Ионную связь зачастую рассматривают как предельный случай ковалентной полярной связи, данная связь образуется
между элементами с большой разностью электроотрицательностей. В данном случае электронная пара
практически полностью переходит от одного атома к другому, при этом связанные частицы становятся заряженными
и их можно считать ионами. В представленных соединениях ионная связь имеется в молекулах
хлорида лития LiCl и оксида натрия Na2O.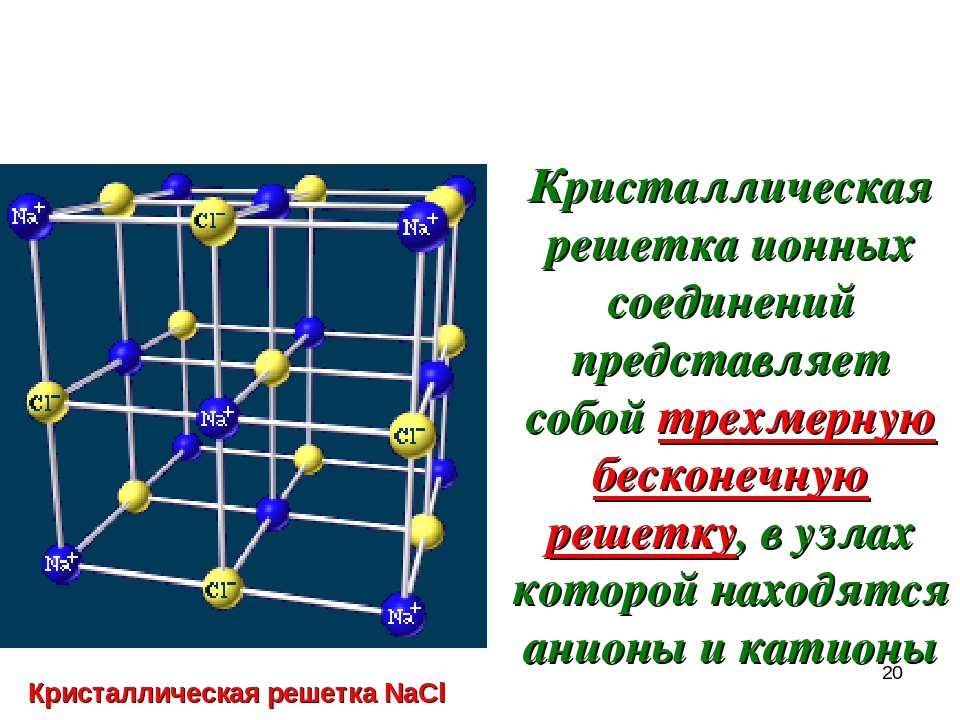
Ответ: 34
Задание 4.9
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) хлорид лития
2) хлорид аммония
3) хлорид серы (II)
4) хлорид рубидия
5) хлор
Запишите в поле ответа номера выбранных соединений.
Источник — Открытый банк заданий ЕГЭ
Решение
Ковалентная полярная связь образуется между атомами с различной электроотрицательностью. В представленных соединениях ковалентная полярная связь присутствует в молекулах хлорида аммония NH4Cl и хлорида серы (II) SCl2.
Ответ: 23
Задание 4.10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) иодид калия
2) иод
3) аммиак
4) иодид рубидия
5) пероксид водорода
Запишите в поле ответа номера выбранных соединений.
Решение
Ковалентная полярная связь образуется между атомами с различной электроотрицательностью. В представленных соединениях ковалентная полярная связь присутствует в молекулах аммиака NH3 и пероксида водорода H2O2.
Ответ: 35
Задание 4.11
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) пероксид водорода
2) метанол
3) этан
4) гидроксид натрия
5) вода
Запишите в поле ответа номера выбранных соединений.
Источник — Открытый банк заданий ЕГЭ
Решение
Ковалентная неполярная связь образуется между одноименными атомами, при этом связующая их общая электронная пара
в равной степени принадлежит обоим соединяющимся атомам. В представленных соединениях ковалентная неполярная связь
присутствует в молекулах пероксида водорода H2O2 и этана H3C-CH3.
Ответ: 13
Ионная решетка — Ионные соединения — AQA — GCSE Combined Science Revision — AQA Trilogy
Ионное соединение представляет собой гигантскую структуру ионов. Ионы имеют регулярное повторяющееся расположение, называемое ионной решеткой. Решетка образуется потому, что ионы притягиваются друг к другу и образуют регулярную структуру с противоположно заряженными ионами рядом друг с другом.
Двумерная объемная модель ионной решетки хлорида натрия Трехмерная объемная модель ионной решетки хлорида натрияПомните, что структура решетки гигантская — например, одна крупинка соли может содержать 1 .2 × 10 18 (1 200 000 000 000 000 000) ионов. Расположение решетки продолжается в трех измерениях. Вот почему твердые ионные соединения образуют кристаллы правильной формы.
Трехмерная шаростержневая модель ионной решетки в хлориде натрия jiy7ou9oli.0.0.0.1:0.1.0.$0.$2.$0″> Ионная связьИонная решетка удерживается вместе сильными электростатическими силами притяжения между противоположно заряженными ионами. Силы действуют во всех направлениях решетки. Это называется ионной связью.
Представление ионных соединений
Различные типы моделей используются для представления гигантских ионных структур.У каждого есть свои преимущества и ограничения. Например:
- двумерная модель заполнения пространства четко показывает расположение ионов в одном слое, но не показывает, как устроен следующий слой ионов
- трехмерная модель шарика и палочки показывает расположение ионов в большей части кристалла, но использование палочек для связей вводит в заблуждение, потому что силы притяжения между ионами на самом деле действуют во всех направлениях jiy7ou9oli.0.0.0.1:0.1.0.$0.$2.$4.$2″> трехмерная модель также вводит в заблуждение, потому что она показывает много свободного пространства между ионами, которых нет
Ionic Crystal — обзор
3.1.1 Теория случайных сетей Захариасена (RNT)
В классической статье, которая, возможно, оказала наибольшее влияние на мышление в науке о стекле, Захариасен [2] утверждал, что, поскольку механические свойства стекол подобны свойствам соответствующих кристаллов , атомные силы в обоих должны быть одного порядка. Размытость спектров рентгеновской дифракции (XRD) стекол ясно указывает на то, что само стекло имеет бесконечно большую элементарную ячейку. Следовательно, стекло будет состоять из случайной сети в трех измерениях.Прямое следствие этой хаотичности приведет к тому, что стекло будет иметь более высокую внутреннюю энергию, чем кристалл. Захариасен считал, что это отличие внутренней энергии от энергии соответствующего кристалла должно быть небольшим. В противном случае было бы достаточно движущей силы для кристаллизации. И эта небольшая разница в энергии, как он предположил, требует открытой и гибкой структуры.
И эта небольшая разница в энергии, как он предположил, требует открытой и гибкой структуры.
В ионных кристаллах катионные полиэдры обычно имеют общие вершины. Это особенно верно для катионов с малым радиусом, но высоким зарядом.Захариасен считал, что совместное использование углов является основным требованием для создания открытой и случайной структуры. Таким образом, если гипотетическое соединение A 2 O 3 может кристаллизоваться в двух измерениях, то расположение атомов в кристалле и стекле должно выглядеть так, как показано на рис. 3.1. Обратите внимание, что и кристаллическая, и стеклообразная формы состоят из треугольников АО 3 , соединенных друг с другом углами, за исключением того, что стеклообразная форма имеет беспорядок, вызванный в основном изменениями углов АОА, называемыми валентными углами .(Читатели должны отметить, что рис. 3.1 можно рассматривать как представляющий структуры АО 2 , где А образует тетраэдры с атомами кислорода в углах, причем четвертый кислород находится «вне плоскости бумаги». Длина связи АО может вносить вклад как основной источник беспорядка, такие изменения, как известно, не происходят в какой-либо измеримой степени.Треугольники, тетраэдры или сами углы АО не должны сильно деформироваться.) Также легко понять, почему соединение АО не будет образовывать стекло (рис.3.2). Если бы катионные полиэдры были треугольниками, то координация А вокруг О также была бы равной 3. Это явно подразумевало бы совместное использование кислорода тремя А, и, следовательно, упорядочение следовало бы просто из топологических ограничений. Поэтому Захариасен определил стекло как «вещество, (которое) может образовывать расширенные трехмерные [3D] сети без периодичности с содержанием энергии, сравнимым с содержанием энергии в соответствующей кристаллической сети». Соответственно, он сформулировал четыре правила стеклообразования в соединении A m O n :
Длина связи АО может вносить вклад как основной источник беспорядка, такие изменения, как известно, не происходят в какой-либо измеримой степени.Треугольники, тетраэдры или сами углы АО не должны сильно деформироваться.) Также легко понять, почему соединение АО не будет образовывать стекло (рис.3.2). Если бы катионные полиэдры были треугольниками, то координация А вокруг О также была бы равной 3. Это явно подразумевало бы совместное использование кислорода тремя А, и, следовательно, упорядочение следовало бы просто из топологических ограничений. Поэтому Захариасен определил стекло как «вещество, (которое) может образовывать расширенные трехмерные [3D] сети без периодичности с содержанием энергии, сравнимым с содержанием энергии в соответствующей кристаллической сети». Соответственно, он сформулировал четыре правила стеклообразования в соединении A m O n :
Рис.3.1. Представление атомной структуры кристалла (A) A 2 O 3 и стекла (B) A 2 O 3 .
Рис. 3.2. Структурное представление гипотетического кристаллического соединения АО.
- (1)
Атом кислорода связан не более чем с двумя атомами A.
- (2)
Координация кислорода вокруг A мала, скажем, 3 или 4.
- (2) )
Катионные полиэдры имеют общие углы, а не ребра или грани.
- (4)
Как минимум три угла являются общими.
Захариасен заявил, что вопрос о том, действительно ли атомы ионизированы или нет, не имеет большого значения, пока мы можем использовать ионную интерпретацию в качестве удобного средства описания. Так, оксиды формулы А 2 О и АО (для катионов групп 1 и 2) не могут удовлетворять многим из этих правил. Например, MgO кристаллизуется в решетке каменной соли (две взаимосвязанные структуры ГЦК). Катионы образуют октаэдры, которые имеют общие углы, а также ребра.Кислород также является общим для шести катионов. Очевидно, нарушаются правила 1–3, свидетельствующие о том, что стеклообразования происходить не должно, как это и происходит на самом деле. В оксиде группы 13 A 2 O 3 , если атомы кислорода образуют треугольники вокруг A, то все правила выполняются. B 2 O 3 является примером формирователя стекла в этой категории. (Рис. 3.1B фактически представляет собой плоскую проекцию или «блинчатую версию» стекла B 2 O 3 ). ) были бы стеклообразователями, если бы атомы кислорода образовывали тетраэдры вокруг катионов.Их примерами являются SiO 2 , GeO 2 , P 2 O 5 и As 2 O 5 . Оксиды АО 3 , А 2 О 7 и АО 4 могут удовлетворять правилам 1, 3 и 4, если образуются катионные октаэдры. Однако правило 2 будет нарушено. Оксид MoO 3 обычно не образует стекло при плавлении в одиночку, но стекла, содержащие высокие проценты MoO 3 , могут быть получены путем плавления оксида либо с P 2 O 5 , либо с некоторыми другими основными оксидами.
В оксиде группы 13 A 2 O 3 , если атомы кислорода образуют треугольники вокруг A, то все правила выполняются. B 2 O 3 является примером формирователя стекла в этой категории. (Рис. 3.1B фактически представляет собой плоскую проекцию или «блинчатую версию» стекла B 2 O 3 ). ) были бы стеклообразователями, если бы атомы кислорода образовывали тетраэдры вокруг катионов.Их примерами являются SiO 2 , GeO 2 , P 2 O 5 и As 2 O 5 . Оксиды АО 3 , А 2 О 7 и АО 4 могут удовлетворять правилам 1, 3 и 4, если образуются катионные октаэдры. Однако правило 2 будет нарушено. Оксид MoO 3 обычно не образует стекло при плавлении в одиночку, но стекла, содержащие высокие проценты MoO 3 , могут быть получены путем плавления оксида либо с P 2 O 5 , либо с некоторыми другими основными оксидами.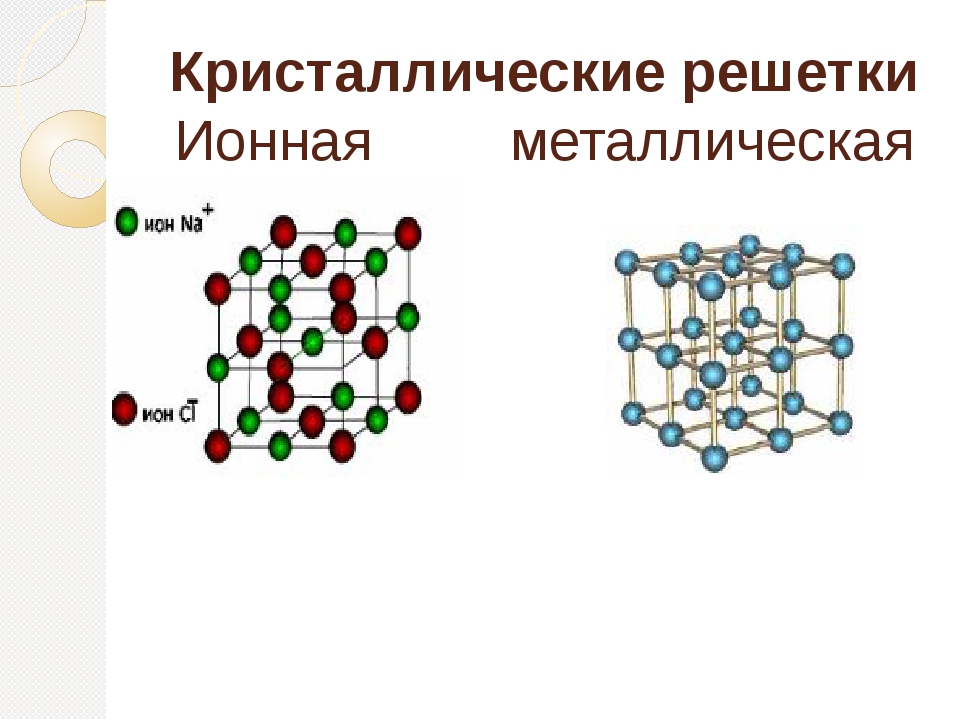
RNT Захариасена получила широкую поддержку, особенно благодаря работе Уоррена и его студентов в Массачусетском технологическом институте по рентгеновской дифракции [3]. Уоррен легко смог опровергнуть представление Рэндалла, Руксби и Купера [4] о том, что стекло представляет собой совокупность микрокристаллов. Как указывалось ранее в главе 2, отсутствие малоуглового рассеяния в плавленом кварце использовалось для подтверждения отсутствия каких-либо микрокристаллов, таких как обнаруженные в силикагеле. Спектры дифракции от щелочно-силикатных и боросиликатных стекол также показали в основном сходные черты, т.е., широкие горбы на ближних расстояниях (вместо острых пиков, характерных для кристаллов) и отсутствие сколько-нибудь заметного малоуглового рассеяния. Как будет показано в последующих главах, Уоррен и его коллеги даже показали, что почти соседние координации, которые можно извлечь из дифракционных спектров различных стекол (как однокомпонентных, так и многокомпонентных), по существу хорошо согласуются с предсказаниями случайной сети. модель.
модель.
Ранняя критика работы Захариасена возникла из-за сомнений относительно того, могут ли определенные оксиды образовывать стекла.Сам Zachariasen был не слишком уверен в формате стекла в P 2 O 3 , как 2 O 3 , SB 2 O 3 , V 2 O 5 , SB 2 O 5 , Nb 2 O 5 и Ta 2 O 5 . Как оказалось, ни один из этих оксидов не образует стекла обычными способами; однако все они образуют стеклянные сетки при добавлении различного количества «стабилизирующего» оксида-модификатора.В этих стеклах координация кислорода оксида катиона, образующего сеть (NWF), обычно составляет 6–8. Обзор стекол с неклассическими стеклянными НВФ-катионами см. в работе Крейдла [5].
Самый важный вызов модели случайной сети исходил от Лебедева и его российских коллег [6, 7], которые поставили под сомнение точное значение слова «случайный». Последующее открытие металлических стекол, полупроводниковых халькогенидов и стекол из фторидов тяжелых металлов, вообще не содержащих кислорода, потребовало пересмотра наших представлений о «случайно упакованных» структурах. Критика Лебедева и его сотрудников обсуждается далее в этой главе, а обсуждение структуры металлических стекол проводится в главе 5.
Критика Лебедева и его сотрудников обсуждается далее в этой главе, а обсуждение структуры металлических стекол проводится в главе 5.
Ионные кристаллические структуры: влияние заряда, размера и соотношения катионов и анионов | Химия
11.17: Ионные кристаллические структуры
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металлов того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение к ионам противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1) когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда и (2) когда катионы и анионы контактируют друг с другом. Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением числа положительных и отрицательных ионов в соединении. Размер иона также зависит от природы и величины заряда, которым он обладает. По мере увеличения положительного заряда катиона его размер уменьшается, наоборот, увеличение отрицательного заряда увеличивает размер аниона, что, в свою очередь, влияет на кристаллическую структуру.
Размер иона также зависит от природы и величины заряда, которым он обладает. По мере увеличения положительного заряда катиона его размер уменьшается, наоборот, увеличение отрицательного заряда увеличивает размер аниона, что, в свою очередь, влияет на кристаллическую структуру.
В простых ионных структурах мы обычно обнаруживаем, что анионы, которые обычно крупнее катионов, расположены в наиболее плотно упакованном массиве. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притянутых к тому же ядру, делают катионы меньше по сравнению с атомами, из которых они образованы.) Меньшие катионы обычно занимают один из двух типов отверстий (или промежутков), остающихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены в углах тетраэдра, поэтому отверстие называется тетраэдрическим отверстием. Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием.В зависимости от относительных размеров катионов и анионов катионы ионного соединения могут занимать тетраэдрические или октаэдрические пустоты. Относительно небольшие катионы занимают тетраэдрические пустоты, а более крупные катионы — октаэдрические пустоты. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простая кубическая матрица. Тогда более крупные катионы могут занимать более крупные кубические отверстия, что стало возможным благодаря более открытому промежутку.
Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием.В зависимости от относительных размеров катионов и анионов катионы ионного соединения могут занимать тетраэдрические или октаэдрические пустоты. Относительно небольшие катионы занимают тетраэдрические пустоты, а более крупные катионы — октаэдрические пустоты. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простая кубическая матрица. Тогда более крупные катионы могут занимать более крупные кубические отверстия, что стало возможным благодаря более открытому промежутку.
В массиве анионов с плотной гексагональной упаковкой (HCP) или плотной кубической упаковкой (CCP) для каждого аниона есть две тетраэдрические дырки для каждого аниона.Соединение, которое кристаллизуется в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены в этом отношении.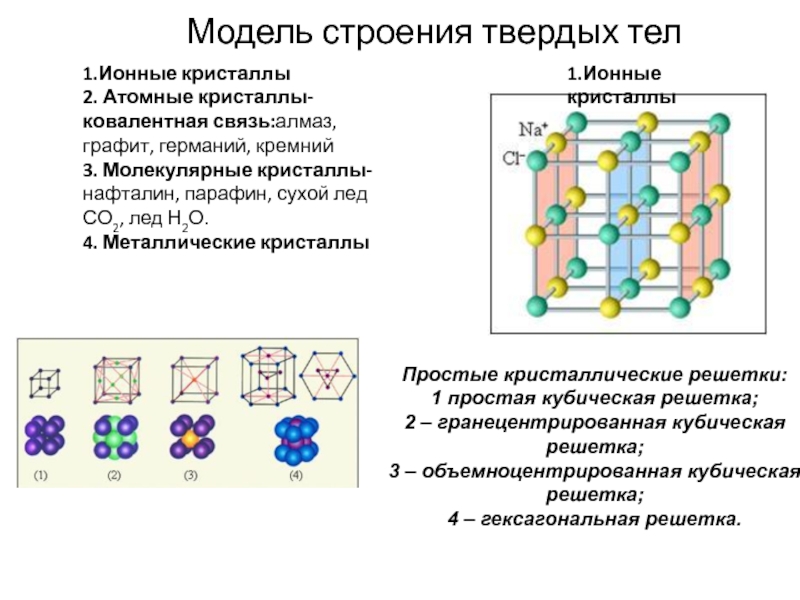 Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2:1 также могут кристаллизоваться в наиболее плотно упакованном массиве анионов с катионами. в тетраэдрических дырках, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических отверстий остается вакантной.Отношение октаэдрических дырок к анионам в структуре ГПУ или ГПУ составляет 1:1. Таким образом, соединения с катионами в октаэдрических отверстиях в наиболее плотно упакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Соотношения менее 1:1 наблюдаются, когда некоторые октаэдрические отверстия остаются пустыми.
Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2:1 также могут кристаллизоваться в наиболее плотно упакованном массиве анионов с катионами. в тетраэдрических дырках, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических отверстий остается вакантной.Отношение октаэдрических дырок к анионам в структуре ГПУ или ГПУ составляет 1:1. Таким образом, соединения с катионами в октаэдрических отверстиях в наиболее плотно упакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Соотношения менее 1:1 наблюдаются, когда некоторые октаэдрические отверстия остаются пустыми.
В простом кубическом массиве анионов имеется одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве.В CsCl и других соединениях с такой же структурой все кубические отверстия заняты. Половина кубических отверстий занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 . Различные типы ионных соединений часто кристаллизуются в одну и ту же структуру, когда относительные размеры их ионов и их стехиометрия (две основные особенности, определяющие структуру) подобны.
Половина кубических отверстий занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 . Различные типы ионных соединений часто кристаллизуются в одну и ту же структуру, когда относительные размеры их ионов и их стехиометрия (две основные особенности, определяющие структуру) подобны.
Примеры ионных кристаллических структур
Хлорид цезия (CsCl) представляет собой ионное соединение с простой кубической структурой решетки, в которой катионы и анионы имеют одинаковый размер.Ионы хлора занимают узлы решетки, а один ион цезия находится в центре элементарной ячейки (рис. 1). Координационное число хлорида цезия равно 8, что означает, что каждый ион цезия находится в непосредственном контакте с восемью ионами хлорида (и наоборот). Элементарная ячейка хлорида цезия содержит один анион хлорида и один катион цезия.
Рисунок 1 . Структуры элементарных ячеек хлорида цезия (простая кубическая), хлорида натрия (гранецентрированная кубическая) и сульфида цинка (цинковая обманка).
Хлорид натрия (NaCl) имеет структуру каменной соли , где анионы хлорида занимают узлы решетки гранецентрированной кубической структуры, а более мелкие катионы натрия расположены в промежутках между анионами. NaCl имеет координационное число 6; каждый анион хлорида окружен шестью катионами натрия и наоборот. Элементарная ячейка NaCl содержит четыре аниона хлорида и четыре катиона натрия.
Сульфид цинка (ZnS) имеет кристаллическую структуру цинковой обманки с координационным числом всего 4.Анионы сульфида занимают узлы решетки гранецентрированной кубической структуры, а более мелкие катионы цинка занимают четыре из восьми пространств тетраэдрической формы, расположенных непосредственно под каждым угловым атомом. Каждая элементарная ячейка ZnS содержит четыре сульфидных аниона и четыре катиона цинка. Помимо цинковой обманки, ZnS также может присутствовать в структуре вюрцита, которая демонстрирует гексагональную плотную упаковку в отличие от кубической плотной упаковки цинковой обманки.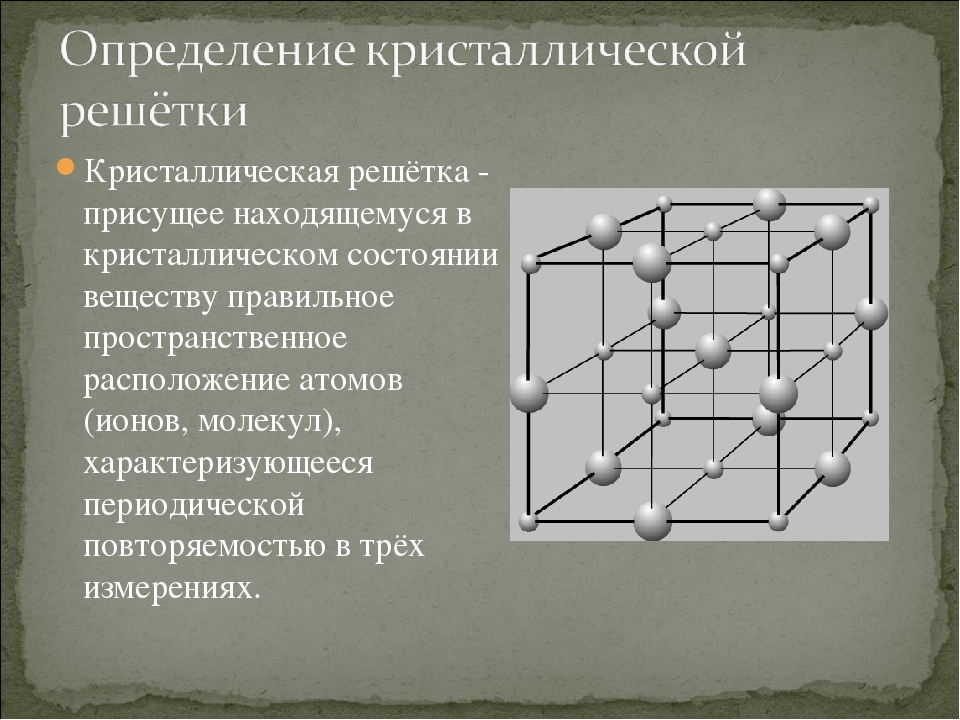 Подобно цинковой обманке, и катион, и анион имеют координационное число четыре, и катионы занимают половину тетраэдрических пустот (отверстий), тогда как анион занимает узлы решетки гексагональной структуры.
Подобно цинковой обманке, и катион, и анион имеют координационное число четыре, и катионы занимают половину тетраэдрических пустот (отверстий), тогда как анион занимает узлы решетки гексагональной структуры.
Часто кристаллические структуры имеют неодинаковое количество катионов и анионов. Ионные соединения с соотношением катиона и аниона 1:2 имеют структуру флюорита или CaF 2 . Фторид натрия (NaF) — простейший пример со структурой, похожей на хлорид натрия. CaF 2 и MgF 2 являются другими распространенными примерами.
Оксиды, такие как TiO 2 , приобретают кристаллическую структуру, известную как рутил. Здесь координационные числа катионов и анионов различны.Например, в случае TiO 2 катионы титана будут иметь координационное число шесть, тогда как координационное число анионов кислорода будет равно трем.
Этот текст адаптирован из Openstax, Chemistry 2e, Section 10.6: Решетчатые структуры в кристаллических твердых телах .
Ионные соединения: образование, энергия решетки и свойства — видео и стенограмма урока
Энергия решетки
Сила ионных соединений измеряется чем-то, что называется энергией решетки .Это энергия, выделяемая при образовании одного моля ионного соединения. Это означает, что когда отдельные ионы соединения собираются вместе, образуя кристаллическую решетку, им требуется меньше энергии, чтобы оставаться вместе, поэтому они выделяют ее, а высвобождаемая энергия называется энергией решетки. Сила связи между ионами противоположного заряда наиболее сильна, когда ионы малы. Это связано с тем, что валентные электроны находятся ближе всего к своему ядру, а ядро имеет сильную силу или притяжение к ним. Эта же сила действует на соседние атомы.Связь также становится прочнее по мере увеличения заряда ионов. Таким образом, сила связи между катионом +1 и анионом -1 не так сильна, как сила связи между катионом +3 и анионом -2.
Некоторые реальные примеры этих различий:
| Соединение | Имя | Заряд каждого иона | Энергия решетки (кДж/моль) |
|---|---|---|---|
| NaCl | хлорид натрия | 1, -1 | -787. 5 5 |
| NaBr | бромид натрия | 1, -1 | -751,4 |
| CaF2 | фторид кальция | +2, -1 | -2634,7 |
| MgO | оксид магния | +2, -2 | -3760 |
Энергия решетки отрицательна, чтобы показать, что энергия высвобождается, когда соединение объединяется.Таким образом, чем более отрицательное число, тем больше энергии высвобождается и тем прочнее связь. При сравнении бромида натрия с хлоридом натрия оба имеют одинаковый заряд ионов, но бром больше, чем хлор, поэтому он имеет меньшую энергию. Оксид магния меньше и имеет больший заряд, чем фторид кальция.
Свойства ионных соединений
1.Ионные соединения обладают уникальными свойствами. Все они образуют кристаллы. Кристалл состоит из упорядоченной и симметричной структуры атомов, называемой кристаллической решеткой. Форма кристаллической решетки — это устройство, для поддержания которого требуется наименьшее количество энергии. Внутри кристалла действуют силы между противоположно заряженными ионами и между ядрами и электронами соседних ионов.
Все они образуют кристаллы. Кристалл состоит из упорядоченной и симметричной структуры атомов, называемой кристаллической решеткой. Форма кристаллической решетки — это устройство, для поддержания которого требуется наименьшее количество энергии. Внутри кристалла действуют силы между противоположно заряженными ионами и между ядрами и электронами соседних ионов.
2. Имеют высокие температуры плавления и кипения. Это связано с прочностью ионной связи. Связи настолько прочны, что требуется много энергии, чтобы перевести их из одного состояния в другое, будь то из твердого состояния в жидкое или из жидкого в газообразное.
3. Они твердые и хрупкие. Ионные связи в этих соединениях крепкие и не позволяют молекулам сильно перемещаться, что делает их легко разрушаемыми.
4. Хорошо проводят электричество при растворении в воде. Это связано с тем, что ионное соединение состоит из ионов, которые заряжены либо положительно, либо отрицательно. Когда ионы разделяются в воде, они позволяют электронам течь.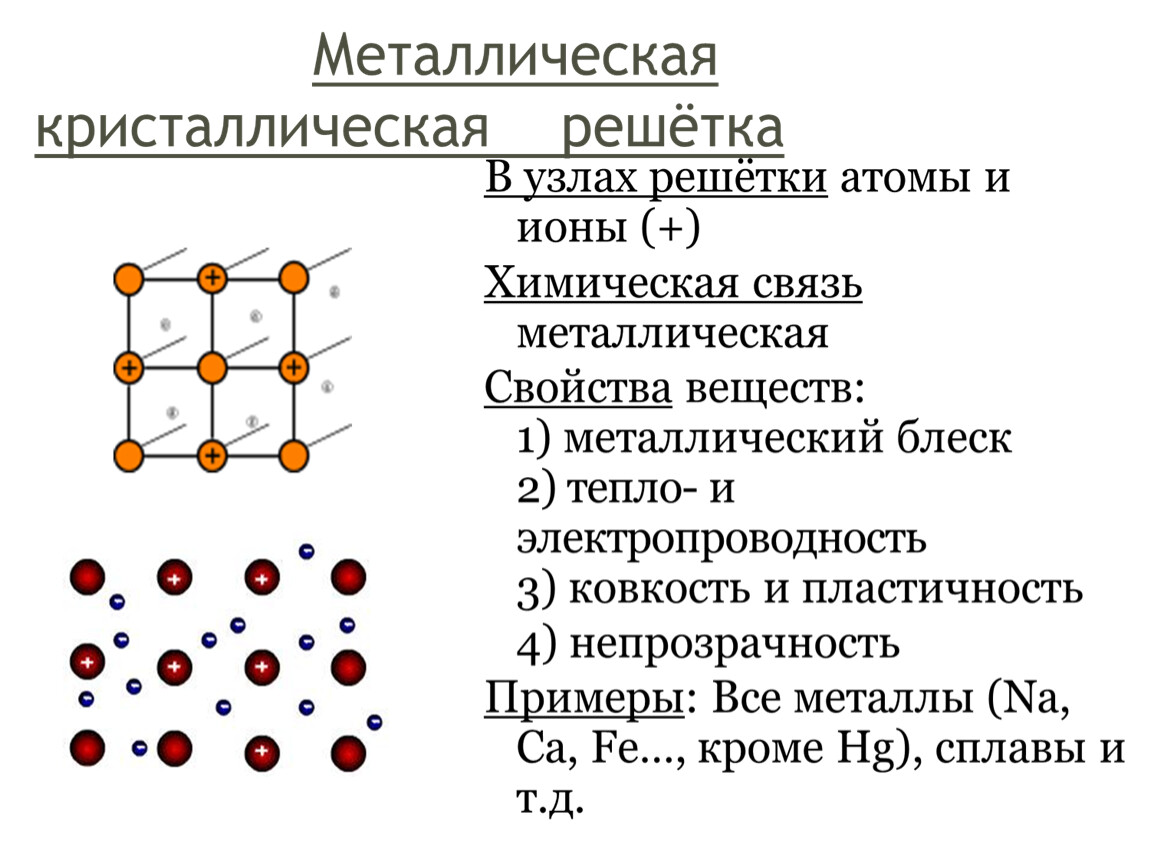
5.В твердом состоянии ионные соединения являются хорошими изоляторами.
Краткое содержание урока
Большинство горных пород и минералов на Земле представляют собой ионные соединения, удерживаемые вместе ионными связями. Эти прочные связи образуются между положительно заряженным катионом металла и отрицательно заряженным анионом неметалла.
Свойства ионных соединений включают образование структур кристаллической решетки, высокую температуру плавления и кипения, твердость и хрупкость, хорошую электропроводность при растворении в воде, но изоляцию в твердой форме.
Энергия решетки — это энергия связей в кристаллической форме. Эта энергия увеличивается, когда атомы, составляющие соединение, малы и когда заряды на каждом атоме велики.
Результаты обучения
После просмотра этого видео вы сможете:
- Описывать, что такое ионное соединение
- Определение энергии решетки
- Перечислите свойства ионных соединений
Энергия решетки
Энергия решеткиЭнергия решетки
Энергии решетки и сила ионной Бонд
Сила притяжения между противоположно заряженными частицами прямо пропорциональна
произведению начислений на два объекта ( q 1 и q 2 )
и обратно пропорциональна квадрату расстояния между объектами ( r 2 ).
Прочность связи между ионами противоположного заряда в ионном соединении поэтому зависит от зарядов ионов и расстояния между центрами ионы, когда они упаковываются, образуя кристалл.
Оценку прочности связей в ионном соединении можно получить с помощью измерение энергии решетки соединения, которая представляет собой энергию, выделяемую при противоположно заряженные ионы в газовой фазе объединяются, образуя твердое тело.
Пример. Энергия решетки NaCl представляет собой энергию, выделяемую при соединении Na + и Cl — . ионы в газовой фазе объединяются, образуя решетку чередующихся Na + и Ионы Cl — в кристалле NaCl показаны на рисунке ниже.
| Na + ( г ) + Cl — ( г ) NaCl( с ) | H или = -787. 3 кДж/моль 3 кДж/моль |
Энергии решетки ионных соединений относительно велики. Энергия решетки NaCl, например, составляет 787,3 кДж/моль, что лишь немного меньше выделяемой энергии когда горит природный газ.
Связь между ионами противоположного заряда наиболее прочна, когда ионы маленькие.
Энергии решетки для галогенидов щелочных металлов, таким образом, самые большие для LiF и наименьший для CsI, как показано в таблице ниже.
Энергия решетки галогенидов щелочных металлов (кДж/моль)
| Ф — | Класс — | Бр — | I — | |||||
| Ли + | 1036 | 853 | 807 | 757 | ||||
| Нет данных + | 923 | 787 | 747 | 704 | ||||
| К + | 821 | 715 | 682 | 649 | ||||
руб. + + | 785 | 689 | 660 | 630 | ||||
| Cs + | 740 | 659 | 631 | 604 |
Ионная связь также должна становиться прочнее по мере увеличения заряда ионов.Данные в таблице ниже показывают, что энергии решетки для солей ОН — и O 2- быстро возрастают по мере увеличения заряда иона.
Энергии решетки солей ОН — и О 2- Ионы (кДж/моль)
| ОХ — | О 2- | |||
| Нет данных + | 900 | 2481 | ||
| мг 2+ | 3006 | 3791 | ||
| Ал 3+ | 5627 | 15 916 |
Энергия решетки и растворимость
Когда соль, такая как NaCl, растворяется в воде, кристаллы исчезают на макроскопическом
масштаб. В атомном масштабе ионы Na + и Cl — в кристалле равны
выпущен в раствор.
В атомном масштабе ионы Na + и Cl — в кристалле равны
выпущен в раствор.
| NaCl( s ) | Н 2 О | Na + ( водный раствор ) + Cl — ( водный раствор ) |
Таким образом, энергия решетки соли дает приблизительное представление о растворимости соль в воде, потому что она отражает энергию, необходимую для разделения положительного и отрицательные ионы в соли.
Соли натрия и калия растворимы в воде, так как имеют относительно небольшую
энергии решетки. Соли магния и алюминия часто гораздо менее растворимы, потому что они
требуется больше энергии, чтобы разделить положительные и отрицательные ионы в этих солях. NaOH, для
Например, хорошо растворяется в воде (420 г/л), но Mg(OH) 2 растворяется в воде
только до 0,009 г/л, а Al(OH) 3 практически нерастворим в воде.
Кристаллическая решетка хлорида цезия
Кристаллическая решетка хлорида цезия ЦЕЗИЯ ХЛОРИД ИОННОЕ СОЕДИНЕНИЕИонные соединения обычно имеют более сложные конструкции, чем металлы.Это наверное потому что:
(1) Теперь есть как минимум два вида частиц в решетке, как правило, разного размера.
(2) Катионы притягивают анионы, но подобно ионы отталкиваются друг от друга. Конструкция должна уравновешивать оба типа сил.
(3) Многие ионы (например, нитраты, карбонаты, азиды)
имеют очень некруглую форму. Таким образом, они будут упакованы по-разному в разных
направления.
Одна простая ионная структура:
 Нажмите на ячейку устройства выше, чтобы просмотреть видео об устройстве
вращающаяся ячейка. Когда эти элементарные ячейки укладываются в решетку, они
сформируйте структуру, как показано ниже.
Нажмите на ячейку устройства выше, чтобы просмотреть видео об устройстве
вращающаяся ячейка. Когда эти элементарные ячейки укладываются в решетку, они
сформируйте структуру, как показано ниже. Нажмите на изображения ниже, чтобы увидеть решетку цезия вращающийся. горизонтальный вертикальный
Обратите внимание, что вы не можете видеть сквозь структуру; Есть нет каналов. Тем не менее, плотно упакованные конструкции затрудняют просмотреть внутренние отношения. Та же структура, но с более удаленными друг от друга ионами позволяет интерьер для просмотра. Нажмите на изображения ниже, чтобы увидеть вращающуюся открытую конструкцию. горизонтальный вертикальный
Одним из способов описания кристалла является рассмотрение катионов и анионов
по отдельности. Начнем с более крупных (золотистых) ионов Cl — .Игнорируя Cs + , отметим, что сами Cl — образуют простую кубическую анионную подрешетку .
Начнем с более крупных (золотистых) ионов Cl — .Игнорируя Cs + , отметим, что сами Cl — образуют простую кубическую анионную подрешетку .
Учитывая только Cs + , они образуют простую кубическую катион подрешеточный е.
На этой анимации показана решетка CsCl, только бирюзовый Cs + (подрешетка Cs) и только золото Cl — (подрешетка Cl).
(Эти две подрешетки не обязательно одинаковы, хотя в этом например они есть.)
Напомним, что простая кубическая решетка имеет большие междоузлия
между каждыми 8 атомами. Поэтому мы можем думать о получении CsCl путем
взяв простую кубическую решетку Cs и поместив Cl в междоузлия.
Это очевидно, если сравнить элементарную ячейку CsCl с простой
кубическая элементарная ячейка, показывающая междоузлие.
Каждый Cl — также окружен 8 Cs + на
углы куба, поэтому Cl — имеет CN = 8.
 Барбара Л. Солс и доктор Фредерик С. Солс
1998. Свяжитесь с владельцами для получения индивидуального разрешения
использовать. [email protected]
Барбара Л. Солс и доктор Фредерик С. Солс
1998. Свяжитесь с владельцами для получения индивидуального разрешения
использовать. [email protected] 10.6 Решетчатые структуры в кристаллических твердых телах – Химия
Цели обучения
К концу этого раздела вы сможете:
- Описывать расположение атомов и ионов в кристаллических структурах
- Вычисление ионных радиусов с использованием размеров элементарной ячейки
- Объяснить использование рентгеновской дифракции для определения кристаллических структур
Более 90% природных и искусственных твердых тел являются кристаллическими.Большинство твердых тел образуются с регулярным расположением их частиц, потому что общее притяжение между частицами максимизируется, а общая межмолекулярная энергия минимизируется, когда частицы упаковываются наиболее эффективно. Регулярное расположение на атомном уровне часто отражается на макроскопическом уровне. В этом модуле мы рассмотрим некоторые детали структуры металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
В этом модуле мы рассмотрим некоторые детали структуры металлических и ионных кристаллических твердых тел и узнаем, как эти структуры определяются экспериментально.
Мы начнем обсуждение кристаллических твердых тел с рассмотрения элементарных металлов, которые относительно просты, поскольку каждый из них содержит только один тип атома. Чистый металл представляет собой кристаллическое твердое вещество, в котором атомы металла плотно упакованы в повторяющуюся структуру. Некоторые свойства металлов в целом, такие как их ковкость и пластичность, в значительной степени обусловлены наличием одинаковых атомов, расположенных в регулярном порядке. Различные свойства одного металла по сравнению с другим частично зависят от размеров их атомов и особенностей их пространственного расположения.В следующих разделах мы рассмотрим сходства и различия четырех наиболее распространенных геометрических форм кристаллов металлов.
Структуру кристаллического твердого тела, будь то металл или нет, лучше всего описать, рассматривая его простейшую повторяющуюся единицу, которая называется его элементарной ячейкой . Элементарная ячейка состоит из точек решетки, которые представляют собой расположение атомов или ионов. Таким образом, вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Элементарная ячейка состоит из точек решетки, которые представляют собой расположение атомов или ионов. Таким образом, вся структура состоит из этой элементарной ячейки, повторяющейся в трех измерениях, как показано на рисунке 1.
Рис. 1. Элементарная ячейка показывает расположение точек решетки, повторяющихся во всех направлениях.
Давайте начнем наше исследование структуры кристаллической решетки и элементарных ячеек с самой простой структуры и самой простой элементарной ячейки. Чтобы визуализировать это, представьте, что вы берете большое количество одинаковых сфер, таких как теннисные мячи, и равномерно размещаете их в контейнере. Простейший способ сделать это — создать слои, в которых сферы одного слоя находятся непосредственно над сферами нижнего слоя, как показано на рисунке 2.Эта компоновка называется простой кубической структурой , а элементарная ячейка называется простой кубической элементарной ячейкой или примитивной кубической элементарной ячейкой.
Рисунок 2. Когда атомы металла расположены в виде сфер в одном слое непосредственно над или под сферами в другом слое, структура решетки называется простой кубической. Обратите внимание, что сферы соприкасаются.
В простой кубической структуре сферы не упакованы так плотно, как могли бы быть, и они «заполняют» только около 52% объема контейнера.Это относительно неэффективная схема, и только один металл (полоний, Po) кристаллизуется в простой кубической структуре. Как показано на рис. 3, твердое тело с таким типом расположения состоит из плоскостей (или слоев), в которых каждый атом контактирует только с четырьмя ближайшими соседями в своем слое; один атом непосредственно над ним в слое выше; и один атом непосредственно под ним в слое ниже. Количество других частиц, с которыми контактирует каждая частица в кристаллическом твердом теле, известно как ее координационное число .Таким образом, для атома полония в простой кубической матрице координационное число равно шести.
Рис. 3. Атом в простой кубической решетке контактирует с шестью другими атомами, поэтому его координационное число равно шести.
В простой кубической решетке элементарная ячейка, которая повторяется во всех направлениях, представляет собой куб, определяемый центрами восьми атомов, как показано на рисунке 4. Атомы в соседних углах этой элементарной ячейки контактируют друг с другом, поэтому длина ребра этой ячейка равна двум атомным радиусам или одному атомному диаметру.Кубическая элементарная ячейка содержит только те части этих атомов, которые находятся внутри нее. Поскольку атом в углу простой кубической элементарной ячейки содержится всего в восьми элементарных ячейках, только одна восьмая часть этого атома находится внутри конкретной элементарной ячейки. А поскольку каждая простая кубическая элементарная ячейка имеет по одному атому в каждом из восьми «углов», в одной простой кубической элементарной ячейке есть атом.
Рис. 4. Элементарная ячейка простой кубической решетки содержит одну восьмую атома в каждом из ее восьми углов, поэтому всего она содержит один атом.
Элементарная ячейка простой кубической решетки содержит одну восьмую атома в каждом из ее восьми углов, поэтому всего она содержит один атом.
Пример 1
Расчет атомного радиуса и плотности металлов, часть 1
Длина ребра элементарной ячейки альфа-полония составляет 336 пм.
а) Определите радиус атома полония.
(b) Определите плотность альфа-полония.
Раствор
Альфа-полоний кристаллизуется в простой кубической элементарной ячейке:
(а) Два соседних атома Po контактируют друг с другом, поэтому длина ребра этой ячейки равна двум радиусам атомов Po: l = 2 r .Следовательно, радиус Po равен .
(b) Плотность определяется как . Плотность полония можно найти, определив плотность его элементарной ячейки (масса, содержащаяся в элементарной ячейке, деленная на объем элементарной ячейки). Поскольку элементарная ячейка Po содержит одну восьмую атома Po в каждом из восьми углов, элементарная ячейка содержит один атом Po.
Массу элементарной ячейки Po можно найти по формуле:
Объем элементарной ячейки Po можно найти по формуле:
(Обратите внимание, что длина ребра была преобразована из пм в см, чтобы получить обычные единицы объема для плотности.)
Следовательно, плотность
Проверьте свои знания
Длина ребра элементарной ячейки для никеля составляет 0,3524 нм. Плотность никеля 8,90 г/см 3 . Кристаллизуется ли никель в виде простой кубической структуры? Объяснять.
Ответ:
Нет. Если бы Ni был простой кубической формой, его плотность определялась бы как:
Тогда плотность никеля будет
Поскольку фактическая плотность Ni не близка к этой, Ni не образует простой кубической структуры.
Большинство металлических кристаллов являются одним из четырех основных типов элементарных ячеек. Сейчас мы сосредоточимся на трех кубических элементарных ячейках: простой кубической (которую мы уже видели), объемно-центрированной кубической элементарной ячейке и гранецентрированной кубической элементарной ячейке — все они показаны на рисунке 5. (Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек. Мы оставляем более сложные геометрии на потом в этом модуле.)
(Обратите внимание, что на самом деле существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего 14 различных типов элементарных ячеек. Мы оставляем более сложные геометрии на потом в этом модуле.)
Рис. 5. Кубические элементарные ячейки металлов показывают (на верхних рисунках) расположение узлов решетки и (на нижних рисунках) атомов металла, находящихся в элементарной ячейке.
Некоторые металлы кристаллизуются в виде кубической элементарной ячейки с атомами во всех углах и атомом в центре, как показано на рисунке 6. Это называется объемно-центрированным кубическим (ОЦК) твердым телом . Атомы в углах элементарной ячейки ОЦК не контактируют друг с другом, а контактируют с атомом в центре.Элементарная ячейка ОЦК содержит два атома: одну восьмую атома в каждом из восьми углов (атом из углов) плюс один атом из центра. Любой атом в этой структуре касается четырех атомов в слое над ним и четырех атомов в слое под ним. Таким образом, атом в ОЦК-структуре имеет координационное число восемь.
Таким образом, атом в ОЦК-структуре имеет координационное число восемь.
Рис. 6. В объемно-центрированной кубической структуре атомы в определенном слое не соприкасаются друг с другом. Каждый атом касается четырех атомов в слое над ним и четырех атомов в слое под ним.
Атомы в ОЦК-структурах гораздо более эффективно упакованы, чем в простой кубической структуре, занимая около 68% всего объема. Изоморфные металлы со структурой ОЦК включают K, Ba, Cr, Mo, W и Fe при комнатной температуре. (Элементы или соединения, кристаллизующиеся с одинаковой структурой, называются изоморфными .)
Многие другие металлы, такие как алюминий, медь и свинец, кристаллизуются в форме кубической элементарной ячейки с атомами во всех углах и в центре каждой грани, как показано на рисунке 7.Такое расположение называется гранецентрированным кубическим (FCC) телом . Элементарная ячейка ГЦК содержит четыре атома: по одной восьмой атома на каждом из восьми углов (атомы с углов) и по половине атома на каждой из шести граней (атомы с граней). Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в одинаковых точках решетки, они имеют одинаковое окружение.
Атомы в углах касаются атомов в центрах соседних граней по диагоналям граней куба. Поскольку атомы находятся в одинаковых точках решетки, они имеют одинаковое окружение.
Рис. 7. Гранецентрированное кубическое твердое тело имеет атомы в углах и, как следует из названия, в центрах граней его элементарных ячеек.
Атомы в FCC-конфигурации упакованы как можно плотнее, при этом атомы занимают 74% объема. Эта структура также называется кубической плотнейшей упаковкой (CCP) . В CCP есть три повторяющихся слоя шестиугольно расположенных атомов. Каждый атом контактирует с шестью атомами в своем слое, с тремя в верхнем слое и с тремя в нижнем слое. В этом расположении каждый атом касается 12 ближайших соседей и, следовательно, имеет координационное число 12. Тот факт, что расположения FCC и CCP эквивалентны, может быть не сразу очевиден, но почему они на самом деле имеют одну и ту же структуру, показано на рисунке 8.
Рис. 8. Схема CCP состоит из трех повторяющихся слоев (ABCABC…) шестиугольно расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Повернув нашу перспективу, мы можем увидеть, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине грани) и атом из слоя C в оставшемся углу.Это то же самое, что и гранецентрированная кубическая компоновка.
Схема CCP состоит из трех повторяющихся слоев (ABCABC…) шестиугольно расположенных атомов. Атомы в структуре CCP имеют координационное число 12, потому что они контактируют с шестью атомами в своем слое, плюс три атома в слое выше и три атома в слое ниже. Повернув нашу перспективу, мы можем увидеть, что структура CCP имеет элементарную ячейку с гранью, содержащей атом из слоя A в одном углу, атомы из слоя B по диагонали (в двух углах и в середине грани) и атом из слоя C в оставшемся углу.Это то же самое, что и гранецентрированная кубическая компоновка.
Поскольку более плотная упаковка максимизирует общее притяжение между атомами и минимизирует общую межмолекулярную энергию, атомы в большинстве металлов упаковываются таким образом. Мы обнаруживаем два типа плотнейшей упаковки в простых металлических кристаллических структурах: CCP, с которой мы уже сталкивались, и гексагональная плотнейшая упаковка (HCP) , показанная на рисунке 9. Оба состоят из повторяющихся слоев гексагонально расположенных атомов. В обоих типах второй слой (В) помещается на первый слой (А), так что каждый атом во втором слое находится в контакте с тремя атомами в первом слое.Третий слой расположен одним из двух способов. В ГПУ атомы в третьем слое находятся непосредственно над атомами в первом слое (т. е. третий слой также относится к типу А), а укладка состоит из чередующихся плотноупакованных слоев типа А и типа В (т. е. ABABAB⋯). В CCP атомы в третьем слое не выше атомов ни в одном из первых двух слоев (т. е. третий слой относится к типу C), а укладка состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т. е. ABCABCABC⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационными числами 12.К металлам, которые кристаллизуются в ГПУ-структуре, относятся Cd, Co, Li, Mg, Na и Zn, а к металлам, которые кристаллизуются в ГПУ-структуре, относятся Ag, Al, Ca, Cu, Ni, Pb и Pt.
В обоих типах второй слой (В) помещается на первый слой (А), так что каждый атом во втором слое находится в контакте с тремя атомами в первом слое.Третий слой расположен одним из двух способов. В ГПУ атомы в третьем слое находятся непосредственно над атомами в первом слое (т. е. третий слой также относится к типу А), а укладка состоит из чередующихся плотноупакованных слоев типа А и типа В (т. е. ABABAB⋯). В CCP атомы в третьем слое не выше атомов ни в одном из первых двух слоев (т. е. третий слой относится к типу C), а укладка состоит из чередующихся плотноупакованных слоев типа A, типа B и типа C ( т. е. ABCABCABC⋯). Около двух третей всех металлов кристаллизуются в плотноупакованных массивах с координационными числами 12.К металлам, которые кристаллизуются в ГПУ-структуре, относятся Cd, Co, Li, Mg, Na и Zn, а к металлам, которые кристаллизуются в ГПУ-структуре, относятся Ag, Al, Ca, Cu, Ni, Pb и Pt.
Рис. 9. В обоих типах плотнейшей упаковки атомы упакованы максимально компактно. Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Кубическая плотнейшая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Гексагональная плотнейшая упаковка состоит из двух чередующихся слоев (ABABAB…). Кубическая плотнейшая упаковка состоит из трех чередующихся слоев (ABCABCABC…).
Пример 2
Расчет атомного радиуса и плотности металлов, часть 2
Кальций кристаллизуется в гранецентрированной кубической структуре.Длина ребра его элементарной ячейки составляет 558,8 пм.
(а) Каков атомный радиус Са в этой структуре?
(b) Рассчитайте плотность Ca.
Раствор
(а) В ГЦК-структуре атомы Са контактируют друг с другом по диагонали грани, поэтому длина диагонали равна четырем атомным радиусам Са (d = 4 r ). Два смежных ребра и диагональ грани образуют прямоугольный треугольник, длина каждой стороны которого равна 558.8 пм, а длина гипотенузы равна четырем атомным радиусам Са:
Решение дает .
(b) Плотность определяется как . Плотность кальция можно найти, определив плотность его элементарной ячейки: например, массу, содержащуюся внутри элементарной ячейки, деленную на объем элементарной ячейки. Элементарная ячейка Ca с гранецентрированием имеет одну восьмую атома на каждом из восьми углов (атом) и половину атома на каждой из шести граней), всего четыре атома в элементарной ячейке.
Элементарная ячейка Ca с гранецентрированием имеет одну восьмую атома на каждом из восьми углов (атом) и половину атома на каждой из шести граней), всего четыре атома в элементарной ячейке.
Массу элементарной ячейки можно найти по формуле:
Объем элементарной ячейки Ca можно найти по формуле:
(Обратите внимание, что длина ребра была преобразована из пм в см, чтобы получить обычные единицы объема для плотности.)
Тогда плотность
Проверьте свои знания
Серебро кристаллизуется в структуре FCC. Длина ребра его элементарной ячейки составляет 409 пм.
(а) Каков атомный радиус Ag в этой структуре?
(b) Рассчитайте плотность Ag.
Ответ:
(а) 144 часа; (б) 10,5 г/см 3
В общем, элементарная ячейка определяется длинами трех осей ( a , b и c ) и углами ( α , β и γ ) между ними, как показано на рисунке 10. Оси определяются как длины между точками в пространственной решетке. Следовательно, оси элементарных ячеек соединяют точки с одинаковыми средами.
Оси определяются как длины между точками в пространственной решетке. Следовательно, оси элементарных ячеек соединяют точки с одинаковыми средами.
Рис. 10. Элементарная ячейка определяется длинами трех ее осей ( a , b и c ) и углами ( α , β и γ ) между осями.
Существует семь различных систем решеток, некоторые из которых имеют более одного типа решетки, всего четырнадцать различных элементарных ячеек, форма которых показана на рисунке 11.
Рис. 11. Имеется семь различных систем решетки и 14 различных элементарных ячеек.
Ионные кристаллы состоят из двух или более различных типов ионов, которые обычно имеют разные размеры. Упаковка этих ионов в кристаллическую структуру более сложна, чем упаковка атомов металлов того же размера.
Большинство одноатомных ионов ведут себя как заряженные сферы, и их притяжение к ионам противоположного заряда одинаково во всех направлениях. Следовательно, стабильные структуры для ионных соединений возникают (1) когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда и (2) когда катионы и анионы контактируют друг с другом.Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением числа положительных и отрицательных ионов в соединении.
Следовательно, стабильные структуры для ионных соединений возникают (1) когда ионы одного заряда окружены как можно большим количеством ионов противоположного заряда и (2) когда катионы и анионы контактируют друг с другом.Структуры определяются двумя основными факторами: относительными размерами ионов и соотношением числа положительных и отрицательных ионов в соединении.
В простых ионных структурах мы обычно обнаруживаем, что анионы, которые обычно крупнее катионов, расположены в наиболее плотно упакованном массиве. (Как было замечено ранее, дополнительные электроны, притянутые к одному и тому же ядру, делают анионы больше, а меньшее количество электронов, притянутых к тому же ядру, делают катионы меньше по сравнению с атомами, из которых они образованы.) Меньшие катионы обычно занимают один из двух типов отверстий (или промежутков), остающихся между анионами. Меньшее из отверстий находится между тремя анионами в одной плоскости и одним анионом в соседней плоскости. Четыре аниона, окружающие это отверстие, расположены в углах тетраэдра, поэтому отверстие называется тетраэдрическим отверстием . Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием .На рис. 12 показаны отверстия обоих типов.
Четыре аниона, окружающие это отверстие, расположены в углах тетраэдра, поэтому отверстие называется тетраэдрическим отверстием . Дырка большего типа находится в центре шести анионов (три в одном слое и три в соседнем слое), расположенных в углах октаэдра; это называется октаэдрическим отверстием .На рис. 12 показаны отверстия обоих типов.
Рисунок 12. Катионы могут занимать два типа пустот между анионами: октаэдрические или тетраэдрические.
В зависимости от относительных размеров катионов и анионов катионы ионного соединения могут занимать тетраэдрические или октаэдрические отверстия, как показано на рисунке 13. Относительно небольшие катионы занимают тетраэдрические отверстия, а более крупные катионы занимают октаэдрические отверстия. Если катионы слишком велики, чтобы поместиться в октаэдрические отверстия, анионы могут принять более открытую структуру, такую как простая кубическая матрица.Тогда более крупные катионы могут занимать более крупные кубические отверстия, что стало возможным благодаря более открытому промежутку.
Рис. 13. Размер катиона и форма отверстия, занятого соединением, напрямую связаны.
Для каждого аниона в массиве анионов HCP или CCP имеется две тетраэдрические дырки. Соединение, которое кристаллизуется в наиболее плотно упакованном массиве анионов с катионами в тетраэдрических отверстиях, может иметь максимальное соотношение катион: анион 2: 1; все тетраэдрические отверстия заполнены в этом отношении.Примеры включают Li 2 O, Na 2 O, Li 2 S и Na 2 S. Соединения с соотношением менее 2:1 также могут кристаллизоваться в наиболее плотно упакованном массиве анионов с катионами. в тетраэдрических дырках, если подходят ионные размеры. Однако в этих соединениях часть тетраэдрических отверстий остается вакантной.
Пример 3
Заполнение тетраэдрических отверстий
Сульфид цинка является важным промышленным источником цинка, а также используется в качестве белого пигмента в красках.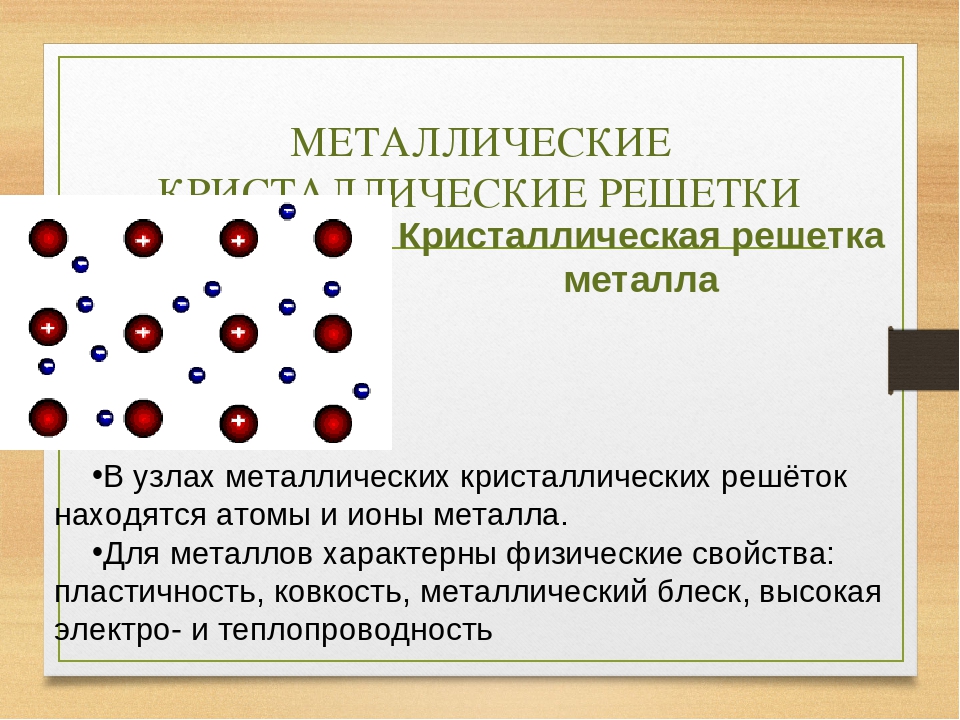 Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотно упакованном массиве сульфидных ионов. Какова формула сульфида цинка?
Сульфид цинка кристаллизуется с ионами цинка, занимающими половину тетраэдрических отверстий в плотно упакованном массиве сульфидных ионов. Какова формула сульфида цинка?
Решение
Поскольку на анион (ион сульфида) приходится две тетраэдрические дырки, и половина этих дырок занята ионами цинка, на ион сульфида должно приходиться , или 1, иона цинка. Таким образом, формула ZnS.
Check Your Learning
Селенид лития можно описать как плотно упакованный массив ионов селенида с ионами лития во всех тетраэдрических отверстиях.Какова формула селенида лития?
Отношение октаэдрических дырок к анионам в структуре HCP или CCP составляет 1:1. Таким образом, соединения с катионами в октаэдрических отверстиях в наиболее плотно упакованном массиве анионов могут иметь максимальное соотношение катион: анион 1: 1. Например, в NiO, MnS, NaCl и KH все октаэдрические отверстия заполнены. Соотношения менее 1:1 наблюдаются, когда некоторые октаэдрические отверстия остаются пустыми.
Пример 4
Стехиометрия ионных соединений
Сапфир представляет собой оксид алюминия.Оксид алюминия кристаллизуется с ионами алюминия в двух третях октаэдрических отверстий в плотно упакованном массиве оксидных ионов. Какова формула оксида алюминия?
Решение
Поскольку на анион (ион оксида) приходится одна октаэдрическая дырка, и только две трети этих дырок заняты, отношение алюминия к кислороду должно быть , что дает . Простейшее соотношение целых чисел — 2:3, поэтому формула выглядит так: Al 2 O 3 .
Проверьте свои знания
Белый пигмент оксида титана кристаллизуется с ионами титана в половине октаэдрических отверстий в плотно упакованном массиве оксидных ионов.Какова формула оксида титана?
В простом кубическом массиве анионов имеется одно кубическое отверстие, которое может быть занято катионом для каждого аниона в массиве. В CsCl и других соединениях с такой же структурой все кубические отверстия заняты. Половина кубических отверстий занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Половина кубических отверстий занята в SrH 2 , UO 2 , SrCl 2 и CaF 2 .
Различные типы ионных соединений часто кристаллизуются в одну и ту же структуру, когда относительные размеры их ионов и их стехиометрия (две основные характеристики, определяющие структуру) сходны.
Многие ионные соединения кристаллизуются с кубическими элементарными ячейками, и мы будем использовать эти соединения для описания общих черт ионных структур.
Когда ионное соединение состоит из катионов и анионов одинакового размера в соотношении 1:1, оно обычно образует простую кубическую структуру. Примером этого является хлорид цезия, CsCl (показан на рисунке 14), где Cs + и Cl — имеют радиусы 174 пм и 181 пм соответственно. Мы можем представить себе это как ионы хлорида, образующие простую кубическую элементарную ячейку с ионом цезия в центре; или как ионы цезия, образующие элементарную ячейку с ионом хлорида в центре; или как простые кубические элементарные ячейки, образованные ионами Cs + , перекрывающимися элементарными ячейками, образованными ионами Cl — . Ионы цезия и ионы хлора соприкасаются по диагоналям тел элементарных ячеек. На элементарную ячейку приходится один ион цезия и один ион хлорида, что дает стехиометрию 1:1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, а CsCl не является ОЦК-структурой, поскольку ион цезия не идентичен иону хлорида.
Ионы цезия и ионы хлора соприкасаются по диагоналям тел элементарных ячеек. На элементарную ячейку приходится один ион цезия и один ион хлорида, что дает стехиометрию 1:1, требуемую формулой для хлорида цезия. Обратите внимание, что в центре ячейки нет точки решетки, а CsCl не является ОЦК-структурой, поскольку ион цезия не идентичен иону хлорида.
Рисунок 14. Ионные соединения с катионами и анионами одинакового размера, такие как CsCl, обычно образуют простую кубическую структуру.Их можно описать элементарными ячейками либо с катионами по углам, либо с анионами по углам.
Мы сказали, что расположение узлов решетки произвольно. Это иллюстрируется альтернативным описанием структуры CsCl, в которой узлы решетки расположены в центрах ионов цезия. В этом описании ионы цезия расположены в узлах решетки по углам ячейки, а ион хлора — в центре ячейки. Две элементарные ячейки различны, но они описывают идентичные структуры.
Когда ионное соединение состоит из катионов и анионов в соотношении 1:1, которые значительно различаются по размеру, оно обычно кристаллизуется с элементарной ячейкой FCC, как показано на рисунке 15. Примером этого является хлорид натрия, NaCl. с Na + и Cl — , имеющими радиусы 102 пм и 181 пм соответственно. Мы можем представить это как ионы хлорида, образующие ячейку FCC, с ионами натрия, расположенными в октаэдрических отверстиях в середине краев ячейки и в центре ячейки.Ионы натрия и хлора соприкасаются друг с другом по краям клетки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1:1, требуемую формулой NaCl.
Примером этого является хлорид натрия, NaCl. с Na + и Cl — , имеющими радиусы 102 пм и 181 пм соответственно. Мы можем представить это как ионы хлорида, образующие ячейку FCC, с ионами натрия, расположенными в октаэдрических отверстиях в середине краев ячейки и в центре ячейки.Ионы натрия и хлора соприкасаются друг с другом по краям клетки. Элементарная ячейка содержит четыре иона натрия и четыре иона хлорида, что дает стехиометрию 1:1, требуемую формулой NaCl.
Рисунок 15. Ионные соединения с анионами, которые намного больше, чем катионы, такие как NaCl, обычно образуют структуру FCC. Они могут быть описаны элементарными ячейками ГЦК с катионами в октаэдрических отверстиях.
Кубическая форма сульфида цинка, цинковая обманка, также кристаллизуется в элементарной ячейке FCC, как показано на рисунке 16.Эта структура содержит сульфид-ионы в узлах решетки ГЦК-решетки. (Расположение сульфид-ионов идентично расположению хлорид-ионов в хлориде натрия. ) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти небольшие ионы Zn 2+ расположены в чередующиеся тетраэдрические отверстия, то есть в одной половине тетраэдрических отверстий. В элементарной ячейке четыре иона цинка и четыре сульфидных иона, что дает эмпирическую формулу ZnS.
) Радиус иона цинка составляет всего около 40% от радиуса сульфид-иона, поэтому эти небольшие ионы Zn 2+ расположены в чередующиеся тетраэдрические отверстия, то есть в одной половине тетраэдрических отверстий. В элементарной ячейке четыре иона цинка и четыре сульфидных иона, что дает эмпирическую формулу ZnS.
Рис. 16. ZnS, сульфид цинка (или цинковая обманка) образует элементарную ячейку FCC с ионами сульфида в узлах решетки и гораздо меньшими ионами цинка, занимающими половину тетраэдрических отверстий в структуре.
Элементарная ячейка фторида кальция, подобная показанной на рис. 17, также является элементарной ячейкой FCC, но в этом случае катионы расположены в узлах решетки; эквивалентные ионы кальция расположены в узлах решетки ГЦК решетки. Все тетраэдрические позиции в массиве ГЦК ионов кальция заняты ионами фтора.В элементарной ячейке четыре иона кальция и восемь ионов фтора, что дает соотношение кальция и фтора 1:2, как того требует химическая формула CaF 2 .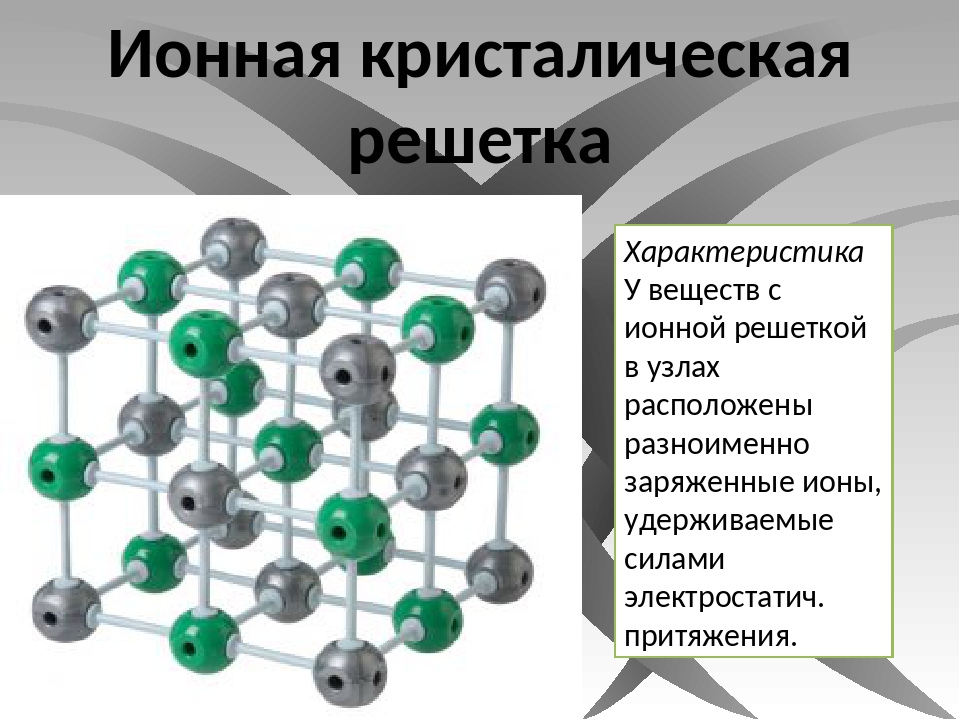 Внимательное изучение рисунка 17 выявит простой кубический массив ионов фтора с ионами кальция в одной половине кубических отверстий. Структура не может быть описана в терминах пространственной решетки точек ионов фтора, потому что ионы фтора не все имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Внимательное изучение рисунка 17 выявит простой кубический массив ионов фтора с ионами кальция в одной половине кубических отверстий. Структура не может быть описана в терминах пространственной решетки точек ионов фтора, потому что ионы фтора не все имеют одинаковое окружение. Ориентация четырех ионов кальция относительно ионов фтора различается.
Рисунок 17. Фторид кальция, CaF 2 , образует элементарную ячейку FCC с ионами кальция (зеленый) в узлах решетки и ионами фторида (красный), занимающими все тетраэдрические позиции между ними.
Если мы знаем длину ребра элементарной ячейки ионного соединения и положение ионов в ячейке, мы можем рассчитать ионные радиусы для ионов в соединении, если мы сделаем предположения об индивидуальных формах ионов и контактах.
Пример 5
Расчет ионных радиусов
Длина края элементарной ячейки LiCl (NaCl-подобная структура, FCC) равна 0.514 нм или 5,14 Å. Предполагая, что ион лития достаточно мал, чтобы ионы хлорида находились в контакте, как показано на рисунке 15, рассчитайте ионный радиус для иона хлорида.
Предполагая, что ион лития достаточно мал, чтобы ионы хлорида находились в контакте, как показано на рисунке 15, рассчитайте ионный радиус для иона хлорида.
Примечание. Единица длины ангстрем, Å, часто используется для представления размеров в атомном масштабе и эквивалентна 10 −10 м.
Раствор
На поверхности элементарной ячейки LiCl ионы хлорида контактируют друг с другом по диагонали грани:
Нарисовав на грани элементарной ячейки прямоугольный треугольник, мы увидим, что длина диагонали равна четырем радиусам хлора (по одному радиусу от каждого углового хлорида и одному диаметру, равному двум радиусам, от иона хлора в центре лица), поэтому d = 4 r .Из теоремы Пифагора имеем:
, что дает:
Решение дает:
. Проверьте свои знания
Длина ребра элементарной ячейки KCl (NaCl-подобная структура, FCC) составляет 6,28 Å. Предполагая анион-катионный контакт вдоль края клетки, рассчитайте радиус иона калия. Радиус иона хлорида составляет 1,82 Å.
Радиус иона хлорида составляет 1,82 Å.
Ответ:
Радиус иона калия составляет 1,33 Å.
Важно понимать, что значения ионных радиусов, рассчитанные по длинам ребер элементарных ячеек, зависят от многочисленных предположений, таких как идеальная сферическая форма ионов, которые в лучшем случае являются приблизительными.Следовательно, такие расчетные значения сами по себе являются приблизительными, и сравнения не могут быть слишком далекими. Тем не менее, этот метод оказался полезным для расчета ионных радиусов на основе экспериментальных измерений, таких как рентгеноструктурные определения.
Размер элементарной ячейки и расположение атомов в кристалле можно определить из измерений дифракции рентгеновских лучей на кристалле, называемой рентгеновской кристаллографией . Дифракция — это изменение направления движения электромагнитной волны, когда она встречает физический барьер, размеры которого сравнимы с размерами длины волны света. Рентгеновские лучи представляют собой электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Рентгеновские лучи представляют собой электромагнитное излучение с длиной волны, равной расстоянию между соседними атомами в кристаллах (порядка нескольких Å).
Когда пучок монохроматического рентгеновского излучения падает на кристалл, его лучи рассеиваются во всех направлениях атомами внутри кристалла. Когда рассеянные волны, движущиеся в одном и том же направлении, сталкиваются друг с другом, они подвергаются интерференции , процессу, при котором волны объединяются, что приводит либо к увеличению, либо к уменьшению амплитуды (интенсивности) в зависимости от степени, в которой максимумы объединяющихся волн совпадают. разделены (см. рис. 18).
Рис. 18. Световые волны, занимающие одно и то же пространство, испытывают интерференцию, объединяясь в волны большей (а) или меньшей (б) интенсивности, в зависимости от разделения их максимумов и минимумов.
Когда рентгеновские лучи с определенной длиной волны, λ , рассеиваются атомами в соседних кристаллических плоскостях, разделенных расстоянием d , они могут подвергаться конструктивной интерференции, когда разница между расстояниями, пройденными двумя волнами до их комбинация представляет собой целочисленный множитель длины волны n . Это условие выполняется, когда угол дифрагированного луча θ связан с длиной волны и межатомным расстоянием уравнением:
Это условие выполняется, когда угол дифрагированного луча θ связан с длиной волны и межатомным расстоянием уравнением:
Это соотношение известно как уравнение Брэгга в честь У. Х. Брэгга , английского физика, впервые объяснившего это явление. На рисунке 19 показаны два примера дифрагированных волн от одних и тех же двух плоскостей кристалла. На рисунке слева изображены волны, дифрагированные под углом Брэгга, что приводит к конструктивной интерференции, а на рисунке справа — дифракция и другой угол, не удовлетворяющий условию Брэгга, что приводит к деструктивной интерференции.
Рис. 19. Дифракция рентгеновских лучей, рассеянных атомами внутри кристалла, позволяет определить расстояние между атомами. Верхнее изображение изображает конструктивную интерференцию между двумя рассеянными волнами и результирующей дифрагированной волной высокой интенсивности. На нижнем изображении показаны деструктивная интерференция и дифрагированная волна низкой интенсивности.
Посетите этот сайт для получения более подробной информации об уравнении Брэгга и симуляторе, позволяющем исследовать влияние каждой переменной на интенсивность дифрагированной волны.
Рентгеновский дифрактометр, подобный изображенному на рис. 20, можно использовать для измерения углов, под которыми дифрагируют рентгеновские лучи при взаимодействии с кристаллом, как описано ранее. На основе таких измерений можно использовать уравнение Брэгга для вычисления расстояний между атомами, как показано в следующем примере упражнения.
Рисунок 20. (a) В дифрактометре пучок рентгеновских лучей попадает на кристаллический материал, создавая (b) картину дифракции рентгеновских лучей, которую можно анализировать для определения кристаллической структуры.
Пример 6
Использование уравнения Брэгга
В дифрактометре рентгеновские лучи с длиной волны 0,1315 нм использовались для получения дифракционной картины меди.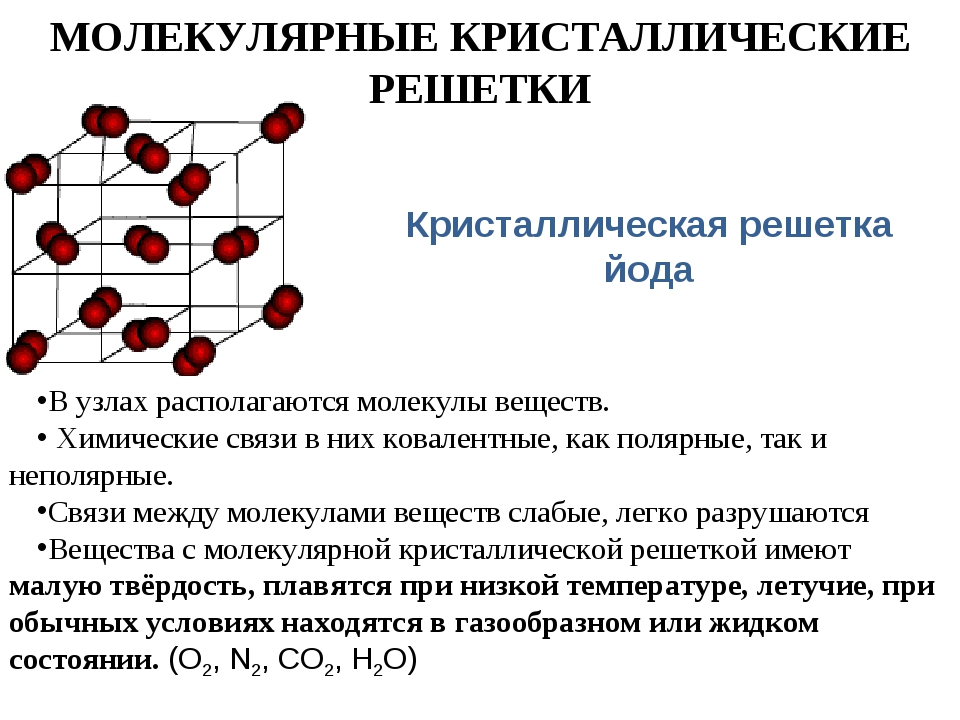 Дифракция первого порядка ( n = 1) происходила под углом θ = 25,25°. Определить расстояние между дифракционными плоскостями в меди.
Дифракция первого порядка ( n = 1) происходила под углом θ = 25,25°. Определить расстояние между дифракционными плоскостями в меди.
Решение
Расстояние между плоскостями находится путем решения уравнения Брэгга, nλ = 2 d sin θ , для d .
Это дает:
Проверьте свои знания
Кристалл с расстоянием между плоскостями, равным 0,394 нм, дифрагирует рентгеновские лучи с длиной волны 0,147 нм. Каков угол дифракции первого порядка?
Рентгеновский кристаллограф Розалинда Франклин
Открытие структуры ДНК в 1953 году Фрэнсисом Криком и Джеймсом Уотсоном является одним из величайших достижений в истории науки. Они были удостоены Нобелевской премии 1962 года по физиологии и медицине вместе с Морисом Уилкинсом , который предоставил экспериментальное доказательство структуры ДНК.Британский химик Розалинда Франклин внесла неоценимый вклад в это монументальное достижение своей работой по измерению рентгеновских дифракционных изображений ДНК. В начале своей карьеры исследования Франклин о структуре углей оказались полезными для британских военных действий. Переключив свое внимание на биологические системы в начале 1950-х годов, Франклин и докторант Рэймонд Гослинг обнаружили, что ДНК состоит из двух форм: длинное тонкое волокно, образующееся во влажном состоянии (тип «В»), и короткое широкое волокно, образующееся при сушке (тип «В»). наберите «А»).Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсон и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры. Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди многих посмертных признаний ее работы Чикагская медицинская школа Университета медицинских наук Финча изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году.
В начале своей карьеры исследования Франклин о структуре углей оказались полезными для британских военных действий. Переключив свое внимание на биологические системы в начале 1950-х годов, Франклин и докторант Рэймонд Гослинг обнаружили, что ДНК состоит из двух форм: длинное тонкое волокно, образующееся во влажном состоянии (тип «В»), и короткое широкое волокно, образующееся при сушке (тип «В»). наберите «А»).Ее рентгеновские дифракционные изображения ДНК (рис. 21) предоставили важную информацию, которая позволила Уотсон и Крику подтвердить, что ДНК образует двойную спираль, и определить детали ее размера и структуры. Франклин также провел новаторское исследование вирусов и РНК, содержащей их генетическую информацию, обнаружив новую информацию, которая радикально изменила совокупность знаний в этой области. После развития рака яичников Франклин продолжала работать до своей смерти в 1958 году в возрасте 37 лет. Среди многих посмертных признаний ее работы Чикагская медицинская школа Университета медицинских наук Финча изменила свое название на Университет медицины и науки Розалинды Франклин в 2004 году. , и принял изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
, и принял изображение ее знаменитого рентгеновского дифракционного изображения ДНК в качестве официального логотипа университета.
Рис. 21. На этой иллюстрации показано рентгеновское дифракционное изображение, подобное тому, которое Франклин нашла в своем исследовании. (кредит: Национальный институт здоровья)
Структуры кристаллических металлов и простых ионных соединений могут быть описаны в терминах упаковки сфер. Атомы металлов могут упаковываться в гексагональные структуры с плотнейшей упаковкой, кубические структуры с плотнейшей упаковкой, объемно-центрированные структуры и простые кубические структуры. Анионы в простых ионных структурах обычно принимают одну из этих структур, а катионы занимают пространство, остающееся между анионами.Небольшие катионы обычно занимают тетраэдрические отверстия в наиболее плотно упакованном массиве анионов. Более крупные катионы обычно занимают октаэдрические пустоты. Катионы еще большего размера могут занимать кубические отверстия в простом кубическом массиве анионов. Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и содержимое ячейки. Тип структуры и размеры элементарной ячейки можно определить с помощью рентгенодифракционных измерений.
Структуру твердого тела можно описать, указав размер и форму элементарной ячейки и содержимое ячейки. Тип структуры и размеры элементарной ячейки можно определить с помощью рентгенодифракционных измерений.
Химия Упражнения в конце главы
- Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в элементарной кубической ячейке.
- Опишите кристаллическую структуру платины, которая кристаллизуется с четырьмя эквивалентными атомами металла в элементарной кубической ячейке.
- Какое координационное число атома хрома в объемно-центрированной кубической структуре хрома?
- Какое координационное число атома алюминия в гранецентрированной кубической структуре алюминия?
- Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре. Какое координационное число у атома кобальта?
- Металлический никель кристаллизуется в кубической плотноупакованной структуре.
 Какое координационное число у атома никеля?
Какое координационное число у атома никеля? - Вольфрам кристаллизуется в объемно-центрированной кубической элементарной ячейке с длиной ребра 3,165 Å.
(а) Каков атомный радиус вольфрама в этой структуре?
(b) Рассчитайте плотность вольфрама.
Платина - (атомный радиус = 1,38 Å) кристаллизуется в кубической плотноупакованной структуре. Вычислите длину ребра гранецентрированной кубической элементарной ячейки и плотность платины.
- Барий кристаллизуется в элементарной объемно-центрированной кубической ячейке с длиной ребра 5.025 Å
а) Каков атомный радиус бария в этой структуре?
(b) Рассчитайте плотность бария.
Алюминий - (атомный радиус = 1,43 Å) кристаллизуется в кубической плотноупакованной структуре. Вычислите длину ребра гранецентрированной кубической элементарной ячейки и плотность алюминия.
- Плотность алюминия 2,7 г/см 3 ; у кремния 2,3 г/см 3 . Объясните, почему Si имеет более низкую плотность, хотя в нем более тяжелые атомы.

- Свободное пространство в металле можно найти, вычитая объем атомов в элементарной ячейке из объема ячейки. Вычислите процент свободного пространства в каждой из трех кубических решеток, если все атомы в каждой из них имеют одинаковый размер и касаются своих ближайших соседей. Какая из этих структур представляет собой наиболее эффективную упаковку? То есть, что упаковывается с наименьшим количеством неиспользуемого пространства?
- Сульфид кадмия, иногда используемый художниками в качестве желтого пигмента, кристаллизуется с кадмием, занимая половину тетраэдрических отверстий в плотно упакованном массиве сульфидных ионов.Какова формула сульфида кадмия? Поясните свой ответ.
- Соединение кадмия, олова и фосфора используется в производстве некоторых полупроводников. Он кристаллизуется с кадмием, занимающим одну четверть тетраэдрических отверстий, и оловом, занимающим одну четверть тетраэдрических отверстий в плотно упакованном массиве фосфид-ионов. Какова формула соединения? Поясните свой ответ.

- Какова формула магнитного оксида кобальта, используемого в записывающих лентах, который кристаллизуется с атомами кобальта, занимающими одну восьмую тетраэдрических отверстий и половину октаэдрических отверстий в плотно упакованном массиве оксидных ионов?
- Соединение, содержащее цинк, алюминий и серу, кристаллизуется с наиболее плотно упакованным массивом сульфид-ионов.Ионы цинка находятся в одной восьмой части тетраэдрических отверстий, а ионы алюминия — в половине октаэдрических отверстий. Какова эмпирическая формула соединения?
- Соединение таллия и йода кристаллизуется в виде простого кубического массива ионов йодида с ионами таллия во всех кубических отверстиях. Какова формула этого йодида? Поясните свой ответ.
- Какой из следующих элементов реагирует с серой с образованием твердого тела, в котором атомы серы образуют плотно упакованный массив со всеми занятыми октаэдрическими отверстиями: Li, Na, Be, Ca или Al?
- Какова массовая доля титана в рутиле, минерале, содержащем титан и кислород, если структуру можно описать как плотно упакованный массив оксидных ионов с ионами титана в половине октаэдрических отверстий? Какая степень окисления у титана?
- Объясните, почему химически сходные хлориды щелочных металлов NaCl и CsCl имеют различное строение, а химически разные NaCl и MnS имеют одинаковое строение.

- Поскольку минералы формировались из расплавленной магмы, разные ионы занимали одни и те же места в кристаллах. Вместе с магнием в минералах часто встречается литий, несмотря на различие зарядов их ионов. Предложите объяснение.
- Иодид рубидия кристаллизуется с кубической элементарной ячейкой, которая содержит ионы йодида по углам и ион рубидия в центре. Какова формула соединения?
- Один из различных оксидов марганца кристаллизуется с кубической элементарной ячейкой, которая содержит ионы марганца по углам и в центре.Оксид-ионы расположены в центре каждого края элементарной ячейки. Какова формула соединения?
- NaH кристаллизуется с той же кристаллической структурой, что и NaCl. Длина ребра кубической элементарной ячейки NaH составляет 4,880 Å.
(a) Рассчитайте ионный радиус H − . (Ионный радиус Li + равен 0,0,95 Å.)
(b) Рассчитайте плотность NaH.
- Иодид таллия (I) кристаллизуется с той же структурой, что и CsCl.
 Длина ребра элементарной ячейки TlI равна 4.20 Å. Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
Длина ребра элементарной ячейки TlI равна 4.20 Å. Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.) - Кубическая элементарная ячейка содержит ионы марганца в углах и ионы фтора в центре каждого края.
а) Какова эмпирическая формула этого соединения? Поясните свой ответ.
б) Какое координационное число у иона Mn 3+ ?
(в) Рассчитайте длину ребра элементарной ячейки, если радиус иона Mn 3+ равен 0,65 А.
(d) Рассчитайте плотность соединения.
- Каково расстояние между плоскостями кристалла, преломляющими рентгеновские лучи с длиной волны 1,541 нм под углом θ , равным 15,55° (отражение первого порядка)?
- Дифрактометр, использующий рентгеновские лучи с длиной волны 0,2287 нм, дал дифракционный пик первого порядка для кристаллического угла θ = 16,21°. Определите расстояние между дифрагирующими плоскостями в этом кристалле.
- Металл с расстоянием между плоскостями, равным 0,4164 нм, дифрагирует рентгеновские лучи с длиной волны 0.
 2879 нм. Какой угол дифракции соответствует дифракционному пику первого порядка?
2879 нм. Какой угол дифракции соответствует дифракционному пику первого порядка? - Золото кристаллизуется в элементарной гранецентрированной кубической ячейке. Отражение второго порядка (n = 2) рентгеновских лучей для плоскостей, составляющих верх и низ элементарных ячеек, составляет θ = 22,20°. Длина волны рентгеновского излучения составляет 1,54 Å. Какова плотность металлического золота?
- Когда электрон в возбужденном атоме молибдена падает с L на K оболочку, испускается рентгеновское излучение. Эти рентгеновские лучи преломляются под углом 7.75° плоскостями с расстоянием 2,64 Å. Какова разница в энергии между K-оболочкой и L-оболочкой в молибдене, если предположить дифракцию первого порядка?
Глоссарий
- объемно-центрированная кубическая (BCC) сплошная
- кристаллическая структура, имеющая кубическую элементарную ячейку с точками решетки по углам и в центре ячейки
- элементарная объемно-центрированная кубическая ячейка
- простейшее повторяющееся звено объемно-центрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре куба
- Уравнение Брэгга
- уравнение, связывающее углы, под которыми рентгеновские лучи дифрагируют на атомах внутри кристалла
- координационный номер
- число атомов, ближайших к любому данному атому в кристалле или к центральному атому металла в комплексе
- кубическая ближайшая упаковка (CCP)
- кристаллическая структура, в которой плоскости плотно упакованных атомов или ионов уложены друг на друга в виде серии из трех чередующихся слоев с различными относительными ориентациями (ABC)
- дифракция
- перенаправление электромагнитного излучения, возникающее при встрече с физическим барьером соответствующих размеров
- гранецентрированная кубическая (FCC) сплошная
- кристаллическая структура, состоящая из элементарной кубической ячейки с точками решетки по углам и в центре каждой грани
- элементарная гранецентрированная кубическая ячейка
- простейшее повторяющееся звено гранецентрированного кубического кристалла; это куб, содержащий точки решетки в каждом углу и в центре каждой грани
- шестигранная ближайшая упаковка (HCP)
- кристаллическая структура, в которой плотно упакованные слои атомов или ионов уложены друг на друга в виде серии из двух чередующихся слоев с различной относительной ориентацией (AB)
- отверстие
- (также междоузлие) пространство между атомами внутри кристалла
- изоморфный
- , обладающий такой же кристаллической структурой, как
- восьмигранное отверстие
- открытое пространство в кристалле в центре шести частиц, расположенных по углам октаэдра
- простая кубическая элементарная ячейка
- (также примитивная кубическая элементарная ячейка) элементарная ячейка в простой кубической структуре
- простая кубическая структура
- кристаллическая структура с кубической элементарной ячейкой с точками решетки только по углам
- пространственная решетка
- все точки внутри кристалла с одинаковым окружением
- четырехгранное отверстие
- тетраэдрическое пространство, образованное четырьмя атомами или ионами в кристалле
- элементарная ячейка
- наименьшая часть пространственной решетки, которая повторяется в трех измерениях, образуя всю решетку
- Рентгеновская кристаллография
- экспериментальная методика определения расстояний между атомами в кристалле путем измерения углов, под которыми дифрагируют рентгеновские лучи при прохождении через кристалл
Решения
Ответы на упражнения в конце главы по химии
1. Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемно-центрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома и по одному атому в центре куба.
Структура этой низкотемпературной формы железа (ниже 910 ° C) является объемно-центрированной кубической. В каждом из восьми углов куба находится по одной восьмой атома и по одному атому в центре куба.
3. восемь
5. 12
7. (а) 1,370 Å; (б) 19,26 г/см
9. (а) 2,176 Å; (б) 3,595 г/см 3
11. Кристаллическая структура Si показывает, что он менее плотно упакован (координационное число 4) в твердом теле, чем Al (координационное число 12).
13.В плотно упакованном массиве для каждого аниона существует две тетраэдрические дырки. Если занята только половина тетраэдрических отверстий, числа анионов и катионов равны. Формула сульфида кадмия — CdS.
15. Со 3 О 4
17. В простой кубической матрице только одна кубическая дырка может быть занята катионом для каждого аниона в матрице. Соотношение таллия и йодида должно быть 1:1; следовательно, формула таллия — TlI.
19,59,95%; Степень окисления титана +4.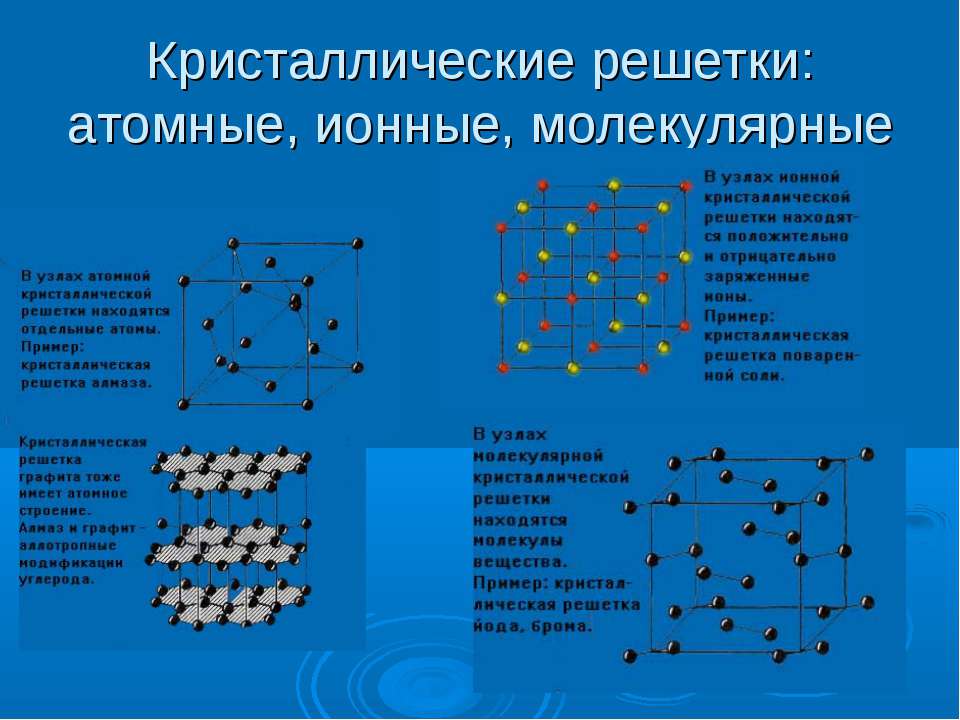



 Какое координационное число у атома никеля?
Какое координационное число у атома никеля?

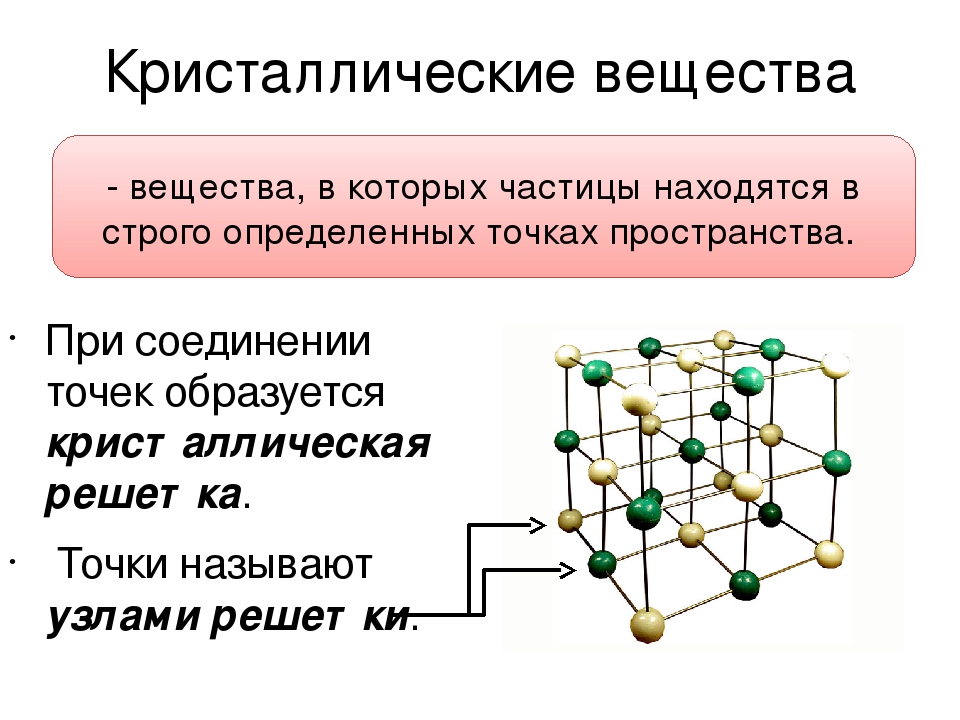
 Длина ребра элементарной ячейки TlI равна 4.20 Å. Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)
Длина ребра элементарной ячейки TlI равна 4.20 Å. Рассчитайте ионный радиус TI + . (Ионный радиус I — составляет 2,16 Å.)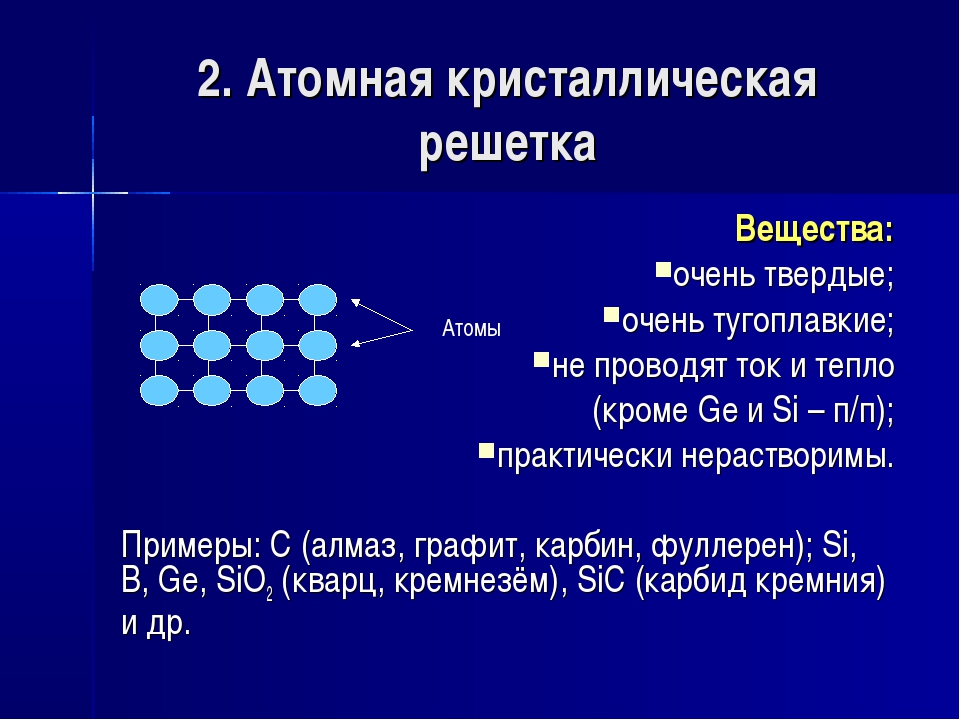 2879 нм. Какой угол дифракции соответствует дифракционному пику первого порядка?
2879 нм. Какой угол дифракции соответствует дифракционному пику первого порядка?