Живая соль – Огонек № 49 (5644) от 14.12.2020
Засушливое лето в Крыму наложило отпечаток и на крупнейшее соляное озеро полуострова. Эта уникальная естественная лаборатория под Евпаторией в уходящем году поражала глаз всеми мыслимыми оттенками розового не несколько недель, как обычно, а несколько месяцев, вплоть до осени.
Фото: Виктор Коротаев. Текст: Иван Волонихин
Впервые оказавшись перед розовой гладью этой части озера Сасык-Сиваш под ярко-голубым крымским небом, зажмуриваешься: от буйства красок в глазах рябит. А когда приглядишься, то завораживает: этим бесконечным оттенкам розового, от кораллового и терракотового до карминового с малиновым, большинство из нас даже не знает названий…
Сразу ясно, что здесь и должны сниматься фильмы про инопланетян с красной планеты: настолько космическим открывается пейзаж на километры вокруг — чистый Марс, не иначе. Даже не верится, что где-то рядом курортная Евпатория.
Еще память подкидывает строчки из песенного хита 1990-х — «розовый фламинго, дитя заката», но это зря: какой фламинго, даже наглые чайки облетают стороной эту розовую красоту.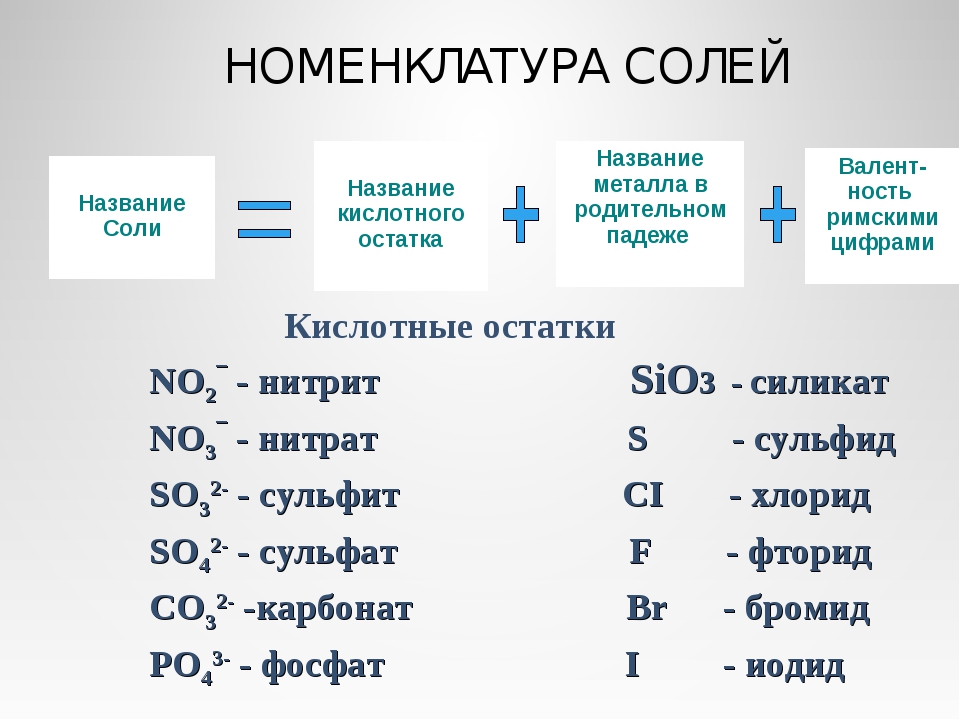
Удивительные свойства этой соли заметили еще колонисты из Древней Греции, которые наладили ее добычу 2 тысячи лет назад. На Руси про нее знали со времен Ивана Грозного — в Московию из Причерноморья ее везли обозами по степным дорогам, которые именовались Чумацкий шлях (чумаками звали солеторговцев). Продавали, впрочем, на вывоз ее неохотно: турки до того ценили эту pembe baharat (розовую приправу), что в XVIII веке, когда соглашались на вхождение Крыма в Российскую Империю, отдельным пунктом в мирном договоре выторговали себе разрешение покупать эту соль без ограничений.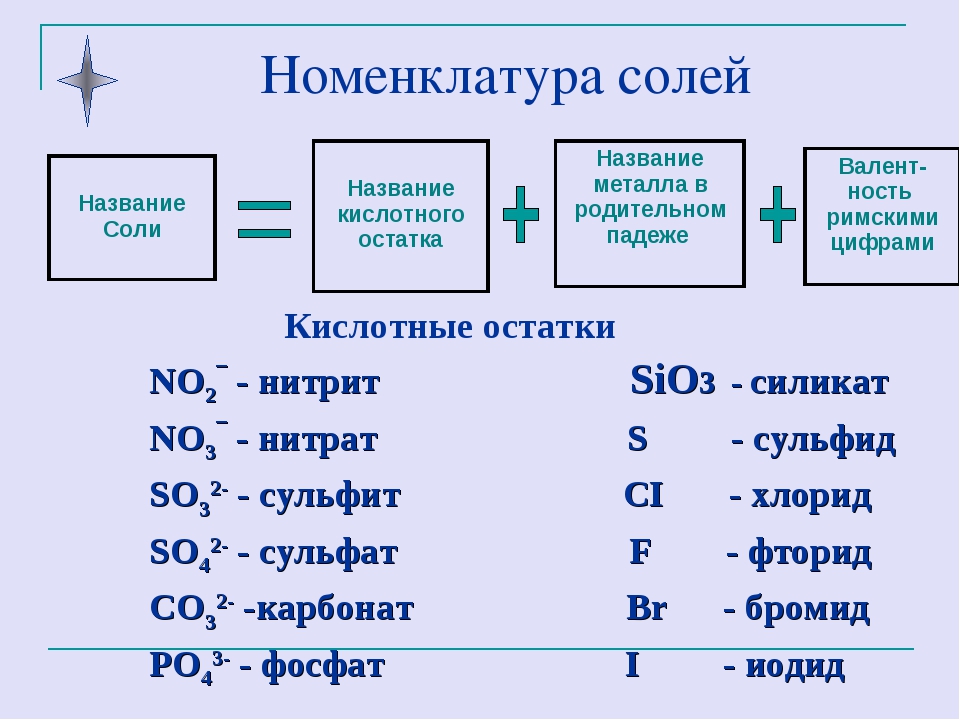
Что в ней такого ценного? Прежде всего натуральность: благодаря естественному выпариванию солнечными лучами без применения какой-либо химии розовая сакская соль сохраняет уникальный минеральный коктейль, в который вместе с бета-каротином входит масса полезнейших элементов. Мало того, она полностью усваивается организмом и не оседает в тканях внутренних органов. По химическому составу близка крови человека. Говорят, верный способ отличить настоящую соль от подделки — растереть ее ладонями: если на руках остались розовые следы, значит, фальсификат.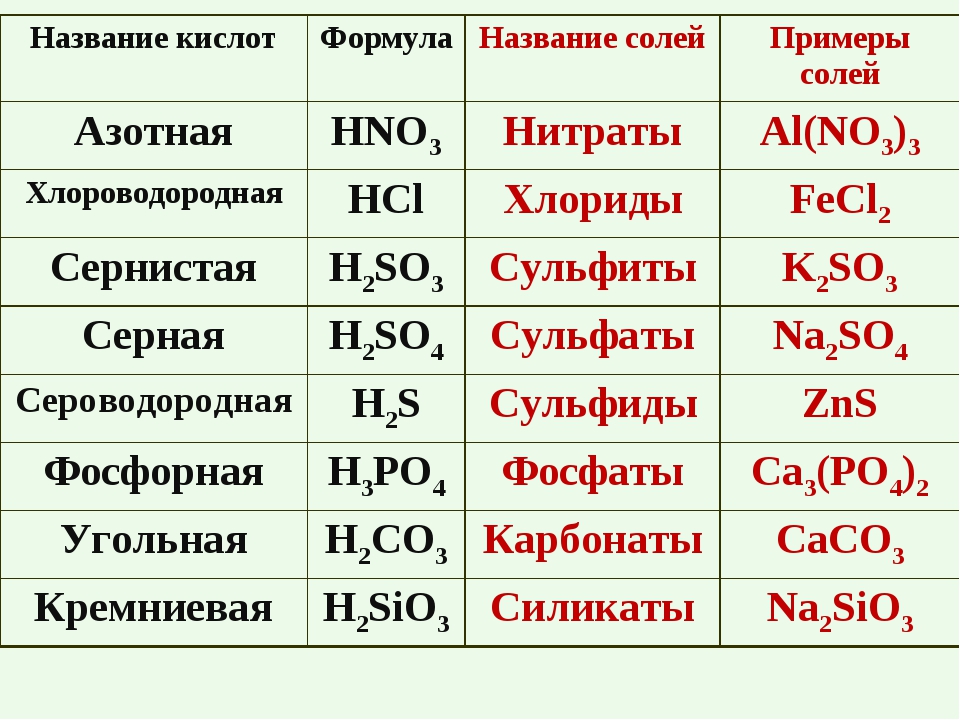
Понятно, что модницы, которые спешат сюда сделать фото для соцсетей на фоне розового озера, ни об истории, ни об уникальном природном «биозаводе» не думают. Но они уже тоже часть «розовой легенды», ставшей одним из чудес Крыма.
— В этом сезоне туристов было так много, что пришлось закрывать проход на нашу производственную базу, но и это не помогло, так как оградить все 300 гектаров невозможно,— рассказывает Алексей Турченко, коммерческий директор кооператива, который занимается здесь добычей соли не первое десятилетие.— Вот на следующий год планируем разработать совместно с Минтуризма Крыма специальную экскурсионную программу, чтобы любопытство не мешало технологическим процессам. Мы все-таки считаемся пищевым производством, хотя наша соль идет и для косметической промышленности, и для лечебных бальнеологических процедур, и даже для примитивных технических нужд — дороги зимой посыпать, например. Все зависит от степени очистки. А заказчики по всей стране: и Новосибирск, и Петербург, и Москва…
На предприятии — около полусотни человек.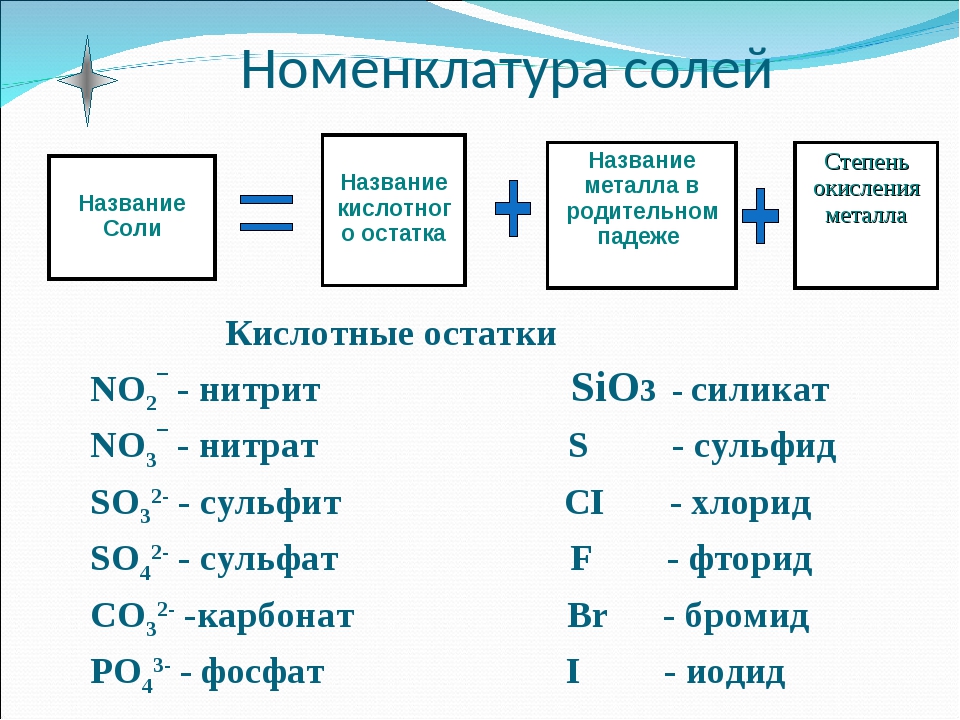 Спецтехника, вроде солеуборочного комбайна, есть, но ручного труда хватает. Да и технология добычи за те века, что она здесь ведется, радикально не поменялась: вся надежда по-прежнему на жаркое солнце и воду из озера Сасык-Сиваш. Первоначально это был обычный мелководный залив на западе полуострова. Но степные ветры и зимние шторма создали песчаную дамбу, которая отделила от моря 75 квадратных километров воды.
Спецтехника, вроде солеуборочного комбайна, есть, но ручного труда хватает. Да и технология добычи за те века, что она здесь ведется, радикально не поменялась: вся надежда по-прежнему на жаркое солнце и воду из озера Сасык-Сиваш. Первоначально это был обычный мелководный залив на западе полуострова. Но степные ветры и зимние шторма создали песчаную дамбу, которая отделила от моря 75 квадратных километров воды.
Как это работает? Весной запускают озерную воду в садочные бассейны, разделенные между собой валиками, которые прикрепляются к деревянным столбикам — на них и образуются соляные наросты. В безветренные дни порой можно видеть, как озеро даже немного кипит благодаря полусотне действующих подводных фонтанов, каждый из который диаметром от 10 до 25 сантиметров. Дальше трудится мать-природа: в летнюю жару вода выпаривается, соляной раствор осаживается на дно бассейна, превращаясь в кристаллы соли, которую сверху укрывает слой грязи — той самой, о целебных свойствах которой написано столько медицинских трудов. Кстати, само название озера Сасык-Сиваш на крымско-татарском означает «зловонная грязь», и пусть для желающих запечатлеть себя на розовом фоне это неблагозвучно, но именно этой грязи и обязаны своим появлением лечебные курорты Саки и Евпатории.
Кстати, само название озера Сасык-Сиваш на крымско-татарском означает «зловонная грязь», и пусть для желающих запечатлеть себя на розовом фоне это неблагозвучно, но именно этой грязи и обязаны своим появлением лечебные курорты Саки и Евпатории.
В наши дни сбор соли начинают в конце лета и продолжают нередко до новогодних праздников: солеуборочные комбайны вытягивают ее из-под грязи со дна бассейна и грузят в вагонетки, которые снуют по узкоколейке. Каждый год направление узкоколейки меняют, шпалы и рельсы перекладывают вручную. Оно и понятно: техника в таких условиях гниет или ржавеет. А рабочие ничего: меняют сапоги и снова берутся за кирки и лопаты.
Добытые пласты соли вагонетками увозят и складывают в огромные бурты высотой 7 и шириной 130 метров. В буртах соль вылеживается: это необходимо, чтобы на открытом пространстве под ветерком из сырья ушли избытки отдельных микроэлементов типа магния и по показателям кристаллы достигли стандартов пищевой соли. Но от обычного белого соленого порошка, что продается во всех продмагах страны, эту соль отличает насыщенность не только такими элементами, как кальций, йод, калий и магний, но и биологически активными веществами, которые образуются в результате процесса жизнедеятельности микроорганизмов,— один бета-каротин, укрепляющий иммунитет и заживляющий раны, чего стоит.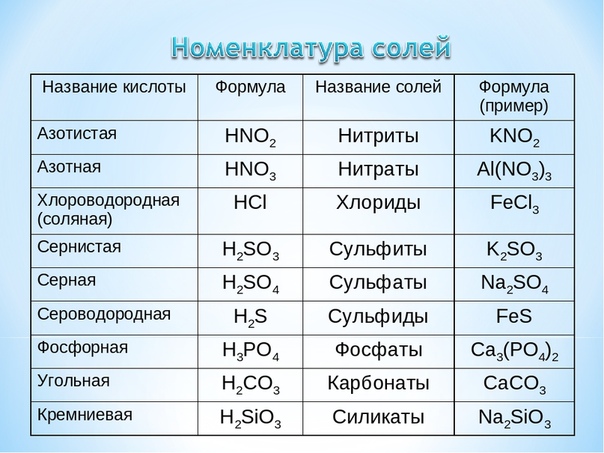
А еще она стала непременной составляющей местного сувенирного ассортимента наравне с ракушками и магнитиками с изображением Ласточкина гнезда. Ее покупают мешками на предприятии предприимчивые местные жители, раскладывают по мешочкам, чтобы затем втридорога загнать туристам, которым, скорее всего, будет недосуг заглянуть на розовые озера, где рождается эта живая соль.
Удаление потемнения серебра
Серебро темнеет на воздухе и образуют черный налет сульфида серебра, который имеет формулу Ag 2S. Серебро тускнеет после реакции с сероводородом (h3S) химическое уравнение которой выглядит следующим образом:2 Ag(т) + H2S(г) → Ag2S(т) + H2(г)
Есть предположение, что, на сегодняшний день, потускнения серебра происходит быстрее из-за возросшего количества сероводорода который выделяется в атмосферу при сгорании ископаемого топлива и тому подобное. Сульфид серебра который и дает потускнение может быть довольно легко удален с помощью полиролей, содержащих абразивные вещества, чтобы стереть с серебра его сульфид, но недостатком этого процесса является то что удаляется и небольшое количеств серебра. Однако, химия предоставляет метод, который обходит эту проблему.
Однако, химия предоставляет метод, который обходит эту проблему.
В этом простом методе используется алюминиевая фольга, кипяток, питьевая сода (натрия гидрокарбонат) и поваренная соль (натрия хлорид). В миску с фольгой, добавить чайную ложку соды и немного соли, затем просто добавьте кипяток. Потускневшую серебряную вещь помещают в воду, убедившись, что нет контакта между ней и алюминиевой фольгой. Потемнения серебра тускнеют и быстро исчезают.
Алюминий имеет более сильное сродство к сере, чем серебро, поэтому в этой реакции алюминий просто вытесняет серебро из его сульфидного соединения, высвобождая чистое металлическое серебро и образуя сульфидное соединение алюминия:
3 Ag2S(т) + 2 Al(т) → 6 Ag(т) + Al2S3(т)
Реакция сама по себе является собственно электрохимической реакцией – по сути, крошечный электрический ток протекает между серебряной вещью и алюминиевой фольгой когда они находятся в контакте, и количество серебра в сульфиде серебра снижается (прирост электронов) в виде металлического серебра, а алюминий окисляется (теряет электроны) замещая Аl3+ на ионы:
3 Ag+ + 3 e– → 3 Ag
Al → Al3+
+ 3eОбъединив эти две половины уравнений получаем полное уравнение окислительно-восстановительной реакции:
Al + 3 Ag+ → Al3+ + 3 Ag
Необходимость соды и соли при удалении потемнения серебраЭто реакция замечательная, но не объясняет необходимость соды или соли во время реакции, а ведь оба вещества являются важными компонентами в этой реакции. Натрия бикарбонат необходим, чтобы удалить тонкий слой гидроксида алюминия, который образуется на алюминиевой фольге; без этого, реакция будет не в состоянии начать образование ионов алюминия, и как таковая не начнется. Реакция между содой и алюминивой фольгой также производит водород, который не играет никакой роли в удалении потускнения серебра и просто улетучивается в виде газа. Соль, между тем, выступает в качестве “солевого моста” – это помогает в передаче электронов по мере протекания реакции, предотвращая дисбаланс и позволяет окислительно-восстановительной реакции продолжаться до конца.
Натрия бикарбонат необходим, чтобы удалить тонкий слой гидроксида алюминия, который образуется на алюминиевой фольге; без этого, реакция будет не в состоянии начать образование ионов алюминия, и как таковая не начнется. Реакция между содой и алюминивой фольгой также производит водород, который не играет никакой роли в удалении потускнения серебра и просто улетучивается в виде газа. Соль, между тем, выступает в качестве “солевого моста” – это помогает в передаче электронов по мере протекания реакции, предотвращая дисбаланс и позволяет окислительно-восстановительной реакции продолжаться до конца.
Al2S3(s) + 6 H2O(l) → 2 Al(OH)3(aq) + 3 H2S(g)
Сероводород, Н2S – тот же газ, что образуется при гниении яиц – отсюда и узнаваемый неприятный запах.
Статья написана по материалам сайта Compound Interest.
Соли
С солью люди знакомы еще из глубокой древности. Значение соли отражено во многих пословицах и поговорках: «Хлеб да соль» — такое пожелания использовали люди вовремя приема пищи, в этом выражении подчеркивалось значение соли наравне с хлебом. Хлеб и соль стали символом гостеприимства и радушия русской души. Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, двое людей за 2 года съедают пуд соли (16 кг). Каждый человек в год потребляет 3 – 5,5 кг соли.
В названиях многих городов и поселков присутствует слово соль: Соликамск, Соль-Илецк, Усолье, Солт-Лейк-Сити, Солтвиль, Зальцбург и др.
Соли
образуют мощные отложения в земной коре. В Соль-Илецке, толщина пласта
соли превышает 1,5 км. Огромное количество соли содержится в воде морей и
океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать сушу
земного шара слоем 130 м. Во многих странах Азии и Африки соль добывают из
соляных озер, а в европейских странах – из соляных шахт.
Солью, извлеченной из Мирового океана, можно было бы засыпать сушу
земного шара слоем 130 м. Во многих странах Азии и Африки соль добывают из
соляных озер, а в европейских странах – из соляных шахт.
Соли могут иметь различную окраску: голубую, синюю, фиолетовую розовую и т.д. Некоторые озера имеют окраску из-за присутствия в них окрашенных солей. Например: Розовое, Красное, Малиновое.
Слово «соль» мы часто используем в повседневной жизни, а в химии соли – сложные вещества, состоящие из ионов металла и кислотного остатка.
По
составу соли схожи с кислотами, но в кислотах атом водорода и кислотный
остаток, в солях – ион металла и кислотный остаток. Поэтому соли являются
продуктами замещения атомов водорода в кислоте на ионы металла. Например,
поваренная соль – NaCl
–
продукт замещения атома водорода в соляной кислоте – HCl
–
на ион натрия. Заряд иона натрия 1+, хлора 1-, т.к. соединение
электронейтрально, то формула поваренной соли – Na+Cl—.
Заряд иона натрия 1+, хлора 1-, т.к. соединение
электронейтрально, то формула поваренной соли – Na+Cl—.
Все соли делятся на средние соли и кислые. В состав средней соли входят ионы металла и кислотного остатка, кислые соли состоят из ионов металла и кислотного остатка, содержащего 1 или 2 иона водорода. Посмотрите, NaNO3, K2CO3 – средние соли, а NaHSO4, KH2PO4 – кислые соли. Кислые соли образуют только многоосновные.
Выведение формулы соли
Если
нужно вывести формулу хлорида кальция, то поступают следующим образом, обозначают
заряды ионов, из которых состоит соль – Ca2+,
Cl1-.
Заряд иона кальция 2+, т.к. это металл II
A группы,
у хлора заряд 1-, т. к. в соляной кислоте заряд иона хлора 1-. Находим
наименьшее общее кратное числовых значений зарядов ионов кальция и хлора,
т.е. 2 и 1, оно равно 2. Находим индексы, разделив наименьшее общее
кратное на величины зарядов: 2 делим на 2 = 1. Индекс у кальция 1, он не
пишется, 2 делим на 1 = 2, значит, индекс у хлора 2. Записываем формулу:
CaCl2.
к. в соляной кислоте заряд иона хлора 1-. Находим
наименьшее общее кратное числовых значений зарядов ионов кальция и хлора,
т.е. 2 и 1, оно равно 2. Находим индексы, разделив наименьшее общее
кратное на величины зарядов: 2 делим на 2 = 1. Индекс у кальция 1, он не
пишется, 2 делим на 1 = 2, значит, индекс у хлора 2. Записываем формулу:
CaCl2.
Аналогично
выводят формулы солей кислородсодержащих кислот. Выведем формулу фосфата
бария – бариевой соли фосфорной кислоты. Обозначаем заряды ионов, из
которых состоит соль, т.е. у Ва будет 2+, т.к. это металл II
A группы,
у РО4 – кислотного остатка фосфорной кислоты будет 3-, т.к. в
составе кислоты 3 атома водорода. Находим наименьшее общее кратное числовых
значений зарядов ионов бария и фосфат-иона. Наименьшее общее кратное 6, 6 делим
на 2 = 3, значит, индекс у бария 3, индекс у фосфат-иона будет 2, т. к. 6
делим на 3 = 2. Отсюда, формула будет иметь вид – Вa3(PO4)2.
к. 6
делим на 3 = 2. Отсюда, формула будет иметь вид – Вa3(PO4)2.
Название солей
Для того чтобы дать название солей, поступают следующим образом: сначала называют ион кислотного остатка в именительном падеже, затем ион металла в родительном падеже. Если металл имеет переменную степень окисления, то при названии солей в скобках римскими цифрами указывают численное значение степени окисления. Например, соль Al2(SO4)3 называется сульфат алюминия, т.к. кислотный остаток серной кислоты – SO42- имеет название – сульфат.
Назовем
соль Fe(NO3)3.
Название начинаем с иона кислотного остатка – остаток азотной кислоты
называется нитрат, добавляем название иона металла. Получается нитрат железа,
т.к. железо имеет переменную степень окисления, то в скобках указываем
численное значение степени окисления. В данном случае, степень окисления железа
+3, поэтому соль называется нитрат железа (III).
Получается нитрат железа,
т.к. железо имеет переменную степень окисления, то в скобках указываем
численное значение степени окисления. В данном случае, степень окисления железа
+3, поэтому соль называется нитрат железа (III).
По
растворимости в воде соли делят на: растворимые в воде,
малорастворимые и нерастворимые. Для того чтобы определить растворима или
нерастворима соль в воде, используют таблицы растворимости. Если на
пересечении иона металла и кислотного остатка стоит буква «Р», значит,
соль растворима в воде, если на пересечении стоит буква «М», значит,
соль малорастворима, если буква «Н», то нерастворима. Из
таблицы видно, что соли азотной кислоты – нитраты, все растворимы, почти все
соли соляной кислоты – хлориды тоже растворимы, за исключением AgCl,
PbCl2.
Растворимы соли натрия и калия. Растворимы все соли серной кислоты – сульфаты,
кроме BaSO4,
PbSO4,
CaSO4,
Ag2SO4. Нерастворимы все фосфаты, силикаты, карбонаты, силикаты, сульфиды, кроме этих
солей для натрия и калия.
Нерастворимы все фосфаты, силикаты, карбонаты, силикаты, сульфиды, кроме этих
солей для натрия и калия.
Рассмотрим несколько примеров солей.
Поваренная соль – NaCl – хлорид натрия, хорошо растворяется в воде, она очень важна для человека, животных и растений: в крови создает условия для жизни красных кровяных телец, в мышцах способствует возбудимости, в желудке образует соляную кислоту. Хлорид натрия используют для получения натрия, хлора, соляной кислоты, приготовления пищи, консервирования.
Карбонат
кальция – СаСО3 – нерастворимая в воде соль,
из нее построены раковины моллюсков, покровы раков, кораллы. Остатки коралловых
полипов образуют атоллы и коралловые рифы. Наиболее известен Большой Барьерный
риф в Австралии. Их раковины за много миллионов лет сформировали пласты соединений
кальция – известняк. Мрамор, используемый в строительстве,
тоже имеет формулу СаСО3, как и мел, который добывают из
меловых гор или карьеров. Из известняка получают негашеную и гашеную известь,
которую используют в строительстве. Из карбоната кальция строят свой скелет
наземные животные. Мрамор идет на изготовление статуй, им отделаны станции
метро.
Из известняка получают негашеную и гашеную известь,
которую используют в строительстве. Из карбоната кальция строят свой скелет
наземные животные. Мрамор идет на изготовление статуй, им отделаны станции
метро.
Фосфат кальция – Са3(РО4)2 – нерастворим в воде. Это основная часть фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых невозможно получить высокие урожаи. Кроме того, фосфат кальция входит в состав костей животных.
Хлорид натрия | Encyclopedia.com
Свойства
Связи
Местонахождение и переработка
Добыча полезных ископаемых
Испарение
Использование
Ресурсы
Хлорид натрия (химическая формула NaCl), галит представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора. Он отвечает за соленость мирового океана. Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения. Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Хлорид натрия в чистом виде бесцветен. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде. Его растворение в воде является эндотермическим, что означает, что он отбирает у воды некоторое количество тепловой энергии. Хлорид натрия плавится при 1474°F (801°C), кипит при 2670°F (1465°C), имеет плотность 2.16 г/см 3 (при 25°C), проводит электричество в растворенном или расплавленном состоянии.
Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется, когда противоположно заряженные ионы притягиваются. Это притяжение похоже на притяжение двух противоположных полюсов магнита. Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Натрий (химический символ Na) является щелочным металлом и имеет тенденцию терять электрон с образованием положительного иона натрия (Na + ).Хлор (химический символ Cl) является неметаллом и имеет тенденцию приобретать электрон с образованием отрицательного иона хлорида (Cl —).
Противоположные ионы Na + и Cl — притягиваются, образуя ионную связь. Таким образом, многие ионы натрия и хлорида удерживаются вместе, в результате чего получается соль с характерной кристаллической формой. Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na + окружен шестью анионами (Cl — ), а каждый Cls окружен шестью катионами (Na + ).Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Хлорид натрия, в изобилии встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в отложениях сухой каменной соли. Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эта соль также может быть получена химическим путем путем взаимодействия соляной кислоты (химическая формула HCl) с гидроксидом натрия (химическая формула NaOH) с образованием хлорида натрия и воды.К странам-лидерам по производству соли относятся США, Китай, Мексика и Канада.
Два способа извлечения соли из земли: камерно-столбовая добыча и добыча раствором. При камерно-столбовом методе шахты погружаются в землю, и горняки используют такие методы, как бурение и взрывные работы, для разрушения каменной соли. Соль удаляется таким образом, что остаются пустые помещения, поддерживаемые соляными столбами.
При добыче раствором вода добавляется в соляные отложения для образования рассола.Рассол представляет собой раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
Обычный способ производства соли из рассола – выпаривание воды с помощью вакуумных ванн. В этом методе рассол кипятят и перемешивают в огромных резервуарах, называемых вакуумными ваннами.Образуются высококачественные кубики соли, которые оседают на дно посуды. Затем кубики собирают, сушат и обрабатывают.
Солнечное выпаривание морской воды для получения соли — старый метод, который широко используется и сегодня. Он использует солнце как источник энергии. Этот метод эффективен в местах, где есть обильные источники соленой воды, земля для испарительных прудов и жаркий сухой климат для увеличения испарения. Морская вода проходит через ряд испарительных бассейнов. Минералы, содержащиеся в морской воде, осаждаются или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
С древних времен большое значение имела соль хлорид натрия. Он использовался по-разному, включая приправу и консервирование пищи, и даже как форму денег. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыры, и является важным консервантом мяса, молочных продуктов, маргарина и других продуктов, поскольку замедляет рост микроорганизмов.Соль способствует естественному развитию цвета ветчины и хот-догов, а также повышает нежность колбасных изделий, таких как ветчина, заставляя их поглощать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза гормонов щитовидной железы, влияющих на рост, развитие и скорость метаболизма).
Химическая промышленность использует большое количество соли хлорида натрия для производства других химикатов. Хлор и гидроксид натрия получают электролизом из рассола.
КЛЮЧЕВЫЕ ТЕРМИНЫ
Рассол — Раствор хлорида натрия и воды, который может содержать или не содержать другие соли.
Ион — Атом или молекула, которые приобрели электрический заряд либо отдавая электроны (положительно заряженный ион), либо приобретая электроны (отрицательно заряженный ион).
Ионная связь — Силы притяжения между положительными и отрицательными ионами, возникающие при переносе электронов от одного атома к другому.
Ионное соединение — Соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионов неметаллов), удерживаемых вместе за счет электростатического притяжения.
Солнечное испарение — Метод испарения воды, использующий солнце в качестве источника энергии.
Хлорсодержащие продукты используются в очистителях металлов, отбеливателях для бумаги, пластмассах и при очистке воды. Химическая кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Хлорид натрия имеет широкий и разнообразный спектр применения.Он распространяется по дорогам, чтобы растопить лед, понизив температуру плавления льда. Соль играет важную роль в регуляции жидкостей организма. Используется в лекарствах и кормах для скота. Кроме того, соляные пещеры используются для хранения химических веществ, таких как нефть и природный газ.
См. также Консервирование пищевых продуктов; Соленая вода.
КНИГИ
Эмсли, Джон. Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд, Великобритания: Издательство Оксфордского университета, 2003.
Курланский Марк. Соль: всемирная история . Нью-Йорк: Penguin Books, 2003.
Лиде, Дэвид Р., изд. CRC Handbook of Chemistry and Physics Boca Raton, FL: CRC Press, 2005.
Myers, R. Thomas, Keith B. Oldham, and Salvatore Tocci. Холт Химия Визуализация Материи . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Thomas, Keith B. Oldham, and Salvatore Tocci. Холт Химия Визуализация Материи . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Секерский, Славомир. Краткая химия элементов . Чичестер, Великобритания: Horwood Publishing, 2002.
Снайдер, К.Х. Необыкновенная химия обычных вещей . 4-е изд. New York: John Wiley and Sons, 2002.
Дана М. Барри
Новые соединения солей бросают вызов основам химии — ScienceDaily
Все хорошие исследования открывают новые горизонты, но редко исследования открывают истины, которые бросают вызов основам химии. наука. Это то, что сделал Артем Р. Оганов, а работа профессора теоретической кристаллографии кафедры геонаук будет опубликована в декабре 2018 года.20, 2013, выпуск журнала Science .
Статья под названием «Неожиданные стабильные стехиометрии хлоридов натрия» документирует его предсказания и эксперименты по сжатию хлорида натрия — каменной соли — с образованием новых соединений. Эти соединения подтверждают его методологию предсказания свойств объектов — методологию, которая в настоящее время используется во всем мире для вычислительного открытия материалов — и обещают новые материалы и приложения.
Эти соединения подтверждают его методологию предсказания свойств объектов — методологию, которая в настоящее время используется во всем мире для вычислительного открытия материалов — и обещают новые материалы и приложения.
«Я думаю, что эта работа — начало революции в химии», — говорит Оганов.«Мы обнаружили при низких давлениях, достижимых в лаборатории, совершенно стабильные соединения, которые противоречат классическим правилам химии. Если вы примените довольно скромное давление в 200 000 атмосфер — для сравнения, давление в центре Земли составляет 3,6 миллиона атмосфер. атмосферы — все, что мы знаем из учебников химии, разваливается».
Стандартные учебники по химии говорят, что натрий и хлор имеют очень разные электроотрицательности и, следовательно, должны образовывать ионное соединение с четко определенным составом.Заряд натрия +1, заряд хлора -1; натрий отдаст электрон, хлор хочет взять электрон. Согласно учебникам по химии и здравому смыслу, единственно возможное сочетание этих атомов в соединении — 1:1 — каменная соль, или NaCl.
«Мы обнаружили сумасшедшие соединения, которые нарушают правила учебника — NaCl3, NaCl7, Na3Cl2, Na2Cl и Na3Cl», — говорит Вэйвэй Чжан, ведущий автор и приглашенный научный сотрудник лаборатории Оганова и Центра дизайна материалов Stony Brook под руководством Оганова. .«Эти соединения термодинамически стабильны и, однажды образовавшись, остаются неизменными; ничто не заставит их развалиться. Классическая химия запрещает само их существование. Классическая химия также говорит, что атомы пытаются выполнить правило октета — элементы приобретают или теряют электроны, чтобы получить электрон конфигурации ближайшего инертного газа с полными внешними электронными оболочками, что делает их очень стабильными. Что ж, здесь это правило не выполняется».
Это открывает все возможности. Оганов предположил, что если смешать NaCl с металлическим натрием, спрессовать в ячейке с алмазной наковальней и нагреть, то можно получить соединения, богатые натрием, такие как Na3Cl.Он также предположил, что если вы возьмете NaCl, смешаете его с чистым хлором, спрессуете и нагреете, вы получите соединения, богатые хлором, такие как NaCl3. Именно это и наблюдалось в экспериментах, проведенных группой Александра Федоровича Гончарова из Института Карнеги в Вашингтоне, подтверждающих предсказания Оганова. «Когда вы меняете теоретические основы химии, это большое дело», — говорит Гончаров. «Но это также означает, что мы можем создавать новые материалы с экзотическими свойствами.»
Именно это и наблюдалось в экспериментах, проведенных группой Александра Федоровича Гончарова из Института Карнеги в Вашингтоне, подтверждающих предсказания Оганова. «Когда вы меняете теоретические основы химии, это большое дело», — говорит Гончаров. «Но это также означает, что мы можем создавать новые материалы с экзотическими свойствами.»
Среди соединений, созданных Огановым и его командой, есть двумерные металлы, где электричество проводится по слоям конструкции. «Один из этих материалов — Na3Cl — имеет удивительную структуру», — говорит он. «Он [состоит] из слоев NaCl и слоев чистого натрия. Слои NaCl действуют как изоляторы, слои чистого натрия проводят электричество. Большой интерес вызывают системы с двумерной электропроводностью».
Как и большая часть науки, поиски Оганова начались с любопытства — и упрямства.
«Долгое время меня преследовала эта мысль — когда в учебнике химии говорится, что какое-то соединение невозможно, что это значит, невозможно? Потому что я могу на компьютере расположить атомы в определенных положениях и в определенных пропорции. Затем я могу вычислить энергию. «Невозможно» на самом деле означает, что энергия будет высокой. Так насколько высокой она будет? И есть ли способ снизить эту энергию и сделать эти соединения стабильными?»
Затем я могу вычислить энергию. «Невозможно» на самом деле означает, что энергия будет высокой. Так насколько высокой она будет? И есть ли способ снизить эту энергию и сделать эти соединения стабильными?»
Для Оганова невозможное не означало чего-то абсолютного.«Правила химии не похожи на математические теоремы, которые нельзя нарушить», — говорит он. «Правила химии можно нарушать, потому что невозможное означает только «мягко» невозможное! Вам просто нужно найти условия, при которых эти правила больше не действуют».
Команда Оганова использовала собственные силы, чтобы довести исследование до конца. «У нас фантастическая команда, — говорит он. «Теоретическая работа проводилась здесь, в Стоуни-Брук, экспериментальная работа проводилась в Геофизической лаборатории Института Карнеги в Вашингтоне.»
Кроме того, команда Оганова использовала финансируемую NSF среду Extreme Science and Engineering Discovery Environment (XSEDE), запустив код USPEX — ведущий в мире код для прогнозирования структуры кристаллов — на Stampede, суперкомпьютере в Техасском центре передовых вычислений при университете. Техаса в Остине. USPEX был разработан лабораторией Оганова, и, по его оценкам, его используют более 1500 исследователей по всему миру.
Техаса в Остине. USPEX был разработан лабораторией Оганова, и, по его оценкам, его используют более 1500 исследователей по всему миру.
Его открытие может найти применение в науках о планетах, где наблюдается большое количество явлений высокого давления.Это может объяснить результаты других экспериментов, в которых исследователи сжимали материалы и получали загадочные результаты. Его вычислительная методология и алгоритмы прогнозирования структуры помогут исследователям прогнозировать комбинации материалов и структуры, которые будут обладать желаемыми свойствами и уровнями стабильности.
«Мы усвоили важный урок — даже в четко определенных системах, таких как хлорид натрия, можно найти совершенно новую химию и совершенно новые и очень интересные материалы», — говорит Оганов.«Это похоже на открытие нового континента; теперь нам нужно нанести на карту землю. Нынешние правила не справляются с этой новой химией. Нам нужно изобрести что-то, что справится».
Зачем мы зимой посыпаем солью обледеневшие тротуары?
[ Примечание редактора: в своем ответе на этот вопрос покойный Джон Маргрейв утверждал, что соль растворяется в воде в виде ионов натрия и хлора, и эти ионы гидратируют или присоединяются к молекулам воды. В ходе этого процесса выделяется тепло, которое оттаивает лед. Ряд читателей предупредил нас о проблемах с этим объяснением.Профессор химического машиностроения Артур Пелтон из Университета Монреаля внес репрезентативную поправку. Далее следует его объяснение, а ниже приводится первоначальный ответ Маркгрейва. ]
В ходе этого процесса выделяется тепло, которое оттаивает лед. Ряд читателей предупредил нас о проблемах с этим объяснением.Профессор химического машиностроения Артур Пелтон из Университета Монреаля внес репрезентативную поправку. Далее следует его объяснение, а ниже приводится первоначальный ответ Маркгрейва. ]Хотя в процессе гидратации выделяется тепло, это с лихвой компенсируется теплом, поглощаемым при начальном разложении соли на ионы. Другими словами, весь процесс растворения — разложение на ионы плюс гидратация — поглощает тепло. Это легко продемонстрировать: налейте немного воды в стакан и проверьте ее температуру пальцем.Добавьте немного соли, перемешайте и снова проверьте. Температура снизится.
Фактическая причина того, что применение соли вызывает таяние льда, заключается в том, что раствор воды и растворенной соли имеет более низкую температуру замерзания, чем чистая вода. При добавлении ко льду соль сначала растворяется в пленке жидкой воды, всегда присутствующей на поверхности, тем самым понижая температуру ее замерзания ниже температуры льда. Поэтому лед при контакте с соленой водой тает, создавая более жидкую воду, которая растворяет больше соли, тем самым вызывая таяние большего количества льда, и так далее.Чем выше концентрация растворенной соли, тем ниже ее общая температура замерзания. Однако существует ограничение на количество соли, которое можно растворить в воде. Вода, содержащая максимальное количество растворенной соли, имеет температуру замерзания около нуля градусов по Фаренгейту. Следовательно, применение соли не растопит лед на тротуаре, если температура ниже нуля градусов по Фаренгейту.
Поэтому лед при контакте с соленой водой тает, создавая более жидкую воду, которая растворяет больше соли, тем самым вызывая таяние большего количества льда, и так далее.Чем выше концентрация растворенной соли, тем ниже ее общая температура замерзания. Однако существует ограничение на количество соли, которое можно растворить в воде. Вода, содержащая максимальное количество растворенной соли, имеет температуру замерзания около нуля градусов по Фаренгейту. Следовательно, применение соли не растопит лед на тротуаре, если температура ниже нуля градусов по Фаренгейту.
Чтобы понять, почему вода, содержащая растворенные соли, имеет более низкую температуру замерзания, чем чистая вода, учтите, что при контакте льда и воды происходит динамический обмен на границе двух фазовых состояний.Из-за тепловых колебаний во льду большое количество молекул в секунду отрывается от его поверхности и попадает в воду. За это же время большое количество молекул воды прикрепляется к поверхности льда и становится частью твердой фазы. При более высоких температурах первая скорость выше, чем вторая, и лед тает. При более низких температурах происходит обратное. В точке замерзания обе скорости равны. Если соль растворена в воде, скорость отрыва молекул льда не изменяется, но скорость, с которой молекулы воды прикрепляются к поверхности льда, уменьшается, главным образом потому, что концентрация молекул воды в жидкости (молекул на кубический сантиметр) ниже.Следовательно, температура плавления ниже.
При более высоких температурах первая скорость выше, чем вторая, и лед тает. При более низких температурах происходит обратное. В точке замерзания обе скорости равны. Если соль растворена в воде, скорость отрыва молекул льда не изменяется, но скорость, с которой молекулы воды прикрепляются к поверхности льда, уменьшается, главным образом потому, что концентрация молекул воды в жидкости (молекул на кубический сантиметр) ниже.Следовательно, температура плавления ниже.
Джон Маргрейв, профессор химии Университета Райса, объясняет.
Все ледяные поверхности содержат небольшие лужи воды. Поскольку соль растворима в воде, соль, нанесенная на такие поверхности, растворяется. Жидкая вода обладает так называемой высокой диэлектрической проницаемостью, которая позволяет ионам соли (положительно заряженному натрию и отрицательно заряженному хлору) разделяться. Эти ионы, в свою очередь, реагируют с молекулами воды и гидратируются, т. е. образуют гидратированные ионы (заряженные ионы, присоединенные к молекулам воды). В этом процессе выделяется тепло, поскольку гидраты более стабильны, чем отдельные ионы. Затем эта энергия плавит микроскопические части поверхности льда. Таким образом, значительное количество соли, разбросанной по большой поверхности, может фактически растопить лед. Кроме того, если вы едете по льду в своем автомобиле, давление помогает вдавливать соль в лед, и происходит дополнительное увлажнение.
В этом процессе выделяется тепло, поскольку гидраты более стабильны, чем отдельные ионы. Затем эта энергия плавит микроскопические части поверхности льда. Таким образом, значительное количество соли, разбросанной по большой поверхности, может фактически растопить лед. Кроме того, если вы едете по льду в своем автомобиле, давление помогает вдавливать соль в лед, и происходит дополнительное увлажнение.
Каменная соль, которой зимой наносят на обледенелые дороги, — это то же самое вещество, которое вытекает из вашей солонки.Единственная разница заключается в размере. Каменная соль представляет собой материал, который кристаллизовался в более крупные куски, тогда как поваренная соль была измельчена и измельчена до более или менее равномерного распределения по размеру. Хлористый кальций так же широко используется для растапливания льда на улицах, как и хлористый натрий. На самом деле, это дешевле, чем хлорид натрия. Компании производят большое количество хлорида кальция из рассолов и других природных материалов, которые можно использовать для той же цели.
Первоначально опубликовано 8 декабря 2003 г.
Демонстрации — Натрий + хлор
Демонстрации — Натрий + хлорНатрий + хлор:
Передай соль, пожалуйста
Натрий — металл серебристого цвета, достаточно мягкий для резки нож. Это чрезвычайно реакционноспособный металл, и в природе он всегда присутствует в ионные соединения, а не в чистом металлическом виде. Чистый металлический натрий реагирует бурно (а иногда и взрывоопасно) с водой, образуя гидроксид натрия, газообразный водород и тепло:
2Na(т) + 2H 2 O(л) ——> 2NaOH(водн.) + H 2 (г)
Хлор — ядовитый желто-зеленый газ с очень резким запах и использовался в газовой войне во время Первой мировой войны.
Натрий и хлор реагируют друг с другом, однако с образованием вещества это знакомо почти всем в мире: хлорид натрия , или поваренная соль:
2Na(т) + Cl 2 (г) ——> 2NaCl(т)
Легко понять, почему эта реакция протекает так легко, если посмотреть на нее. на атомном уровне: натрий имеет один электрон на самом внешнем уровне (валентность)
оболочке, в то время как хлор имеет семь электронов в своей валентной оболочке.Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
на атомном уровне: натрий имеет один электрон на самом внешнем уровне (валентность)
оболочке, в то время как хлор имеет семь электронов в своей валентной оболочке.Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
Реакция чрезвычайно экзотермична, дает ярко-желтый свет и большое количество тепловой энергии.
В следующих демонстрациях 2,5-литровая бутыль заполняется хлором.
газ. Покрытие из песка на дне бутылки поглощает часть
тепловая энергия, выделяющаяся в ходе реакции, и предотвращает ее разрушение.А
в колбу помещают небольшой кусочек свеженарезанного металлического натрия, а затем
добавляется небольшое количество воды, которая вступает в реакцию с натрием и вызывает его
стать горячим. Затем горячий натрий вступает в реакцию с хлором, образуя
ярко-желтый свет, большое количество тепловой энергии и пары хлорида натрия,
который оседает на стенках бутылки.
В первом ролике натрий вспыхивает практически сразу после реагирует с водой и быстро «выгорает».(Не моргай, иначе вы его пропустите.) Во втором случае воду добавляют дважды, чтобы получить один короткая вспышка, за которой следует более длинная. (Эту реакцию можно провести и с расплавленным натрием, но я никогда не был смелым достаточно попробовать.)
Видеоклип 1: НАСТОЯЩИЙ, 679 КБ
Видеоклип 2: НАСТОЯЩИЙ, 1,74 МБ
!!! Опасности !!!
Не подвергайте металлический натрий воздействию воды! Реакция натрия и воды производит газообразный водород и тепло, что является хорошей комбинацией , а не ! натрий должны храниться под минеральным маслом или каким-либо другим высокомолекулярным углеводород.
Газообразный хлор токсичен и сильно раздражает глаза и слизистые. мембраны.
мембраны.
Эта реакция выделяет большое количество тепловой энергии; убедитесь, что колба не имеет в нем трещин.
Процедуры
Бассам З. Шахашири, Химическая промышленность Демонстрации: Пособие для учителей химии, том 1. Мэдисон: Издательство Висконсинского университета, 1983, с.61-63.
Ли Р. Саммерлин, Кристи Л. Боргфорд и Джули Б. Или, 90 083 Химические демонстрации: A Справочник для учителей, Том 2, 2-е изд. Вашингтон, округ Колумбия: Американское химическое общество, 1988, с. 56-57.
Каталожные номера
Джон Эмсли, Элементы, 3-е изд. Оксфорд, Clarendon Press, 1998, с. 56-57, 194-195.
Дэвид Л. Хейзерман, Изучение химических элементов и их Соединения. Нью-Йорк: TAB Books, 1992, с. 43-48, 70-74.
Марта Виндхольц (ред.), The Merck Index, 10-е изд. Рэуэй: Merck & Co., Inc., 1983.
Рэуэй: Merck & Co., Inc., 1983.
Химикаты и соли | AMERICAN ELEMENTS®
#19: American Elements помогает Toyota в разработке каталитического нейтрализатора с низким содержанием платины
СМОТРЕТЬ ИССЛЕДОВАНИЕ>Соли представляют собой ионные соединения, состоящие из катионов и анионов в соответствующих пропорциях для образования электрически нейтральных частиц.Соли называются по видам катионов, а затем по видам анионов. Примеры обычных солей включают хлорид натрия, бисульфат натрия, хлорид кальция и дихромат калия.
Галогениды
Галогениды представляют собой соединения, в которых атом галогена (фтор, хлор, бром, йод) действует как анион, связанный с катионом. Галогениды металлов обычно используются для освещения, фотографических пленок и других применений в зависимости от конкретного соединения. Фториды используются в зубных пастах, в качестве пищевых добавок, в оптических материалах и в биологических приложениях в качестве ингибиторов фосфатазы. Хлориды часто используются в электролизе и опреснении. Бромиды используются в ветеринарии и диагностике. Йодиды добавляют в поваренную соль в качестве добавки. Многие галогениды металлов служат важными материалами-предшественниками при осаждении тонких пленок и, в последнее время, при формировании перовскитных солнечных элементов.
Хлориды часто используются в электролизе и опреснении. Бромиды используются в ветеринарии и диагностике. Йодиды добавляют в поваренную соль в качестве добавки. Многие галогениды металлов служат важными материалами-предшественниками при осаждении тонких пленок и, в последнее время, при формировании перовскитных солнечных элементов.
Оксианионы
Оксианионы представляют собой многоатомные анионы, которые включают кислород и могут быть образованы большинством элементов. Обычные оксианионные соединения включают бораты, броматы, бромиды, карбонаты, хлораты, хлориты, фосфаты, нитраты, силикаты и сульфаты.Оксианионы названы по степени окисления центрального атома, связанного с кислородом. Примеры оксианионов включают фосфатные соединения, которые в изобилии встречаются в биологических системах в качестве соединений-аккумуляторов энергии, АТФ и АДФ, нитратные соединения, которые используются в удобрениях и в качестве окислителей, и карбонаты, обнаруженные в биологических системах в качестве pH-буфера.
Применение
Соли используются во многих продуктах и процессах, включая батареи, металлургию, возобновляемые источники энергии, химический синтез, промышленные процессы и биоматериалы.Батареи и топливные элементы обычно используют соли в качестве электролитов, позволяющих ионам перемещаться от одного электрода к другому. Например, электролиты с соленой водой используются как в топливных элементах, так и в батареях, обеспечивая протекание тока между электродами. Другая область активного исследования и применения солей включает использование расплавленных солей в добывающей металлургии, хранении тепла, термообработке и модификации поверхности металла. В добывающей металлургии одним из широко используемых методов является превращение металлов в растворимые или расплавленные соли.Термическая обработка отжигом стали обычно использует расплавленные соли хлорида, а соли фтора используются в продукте из алюминия. Кроме того, соли металлов используются для получения ярких цветов фейерверков.
Для неорганических солей существует широкий спектр промышленных применений, включая производство целлюлозы и бумаги, сельскохозяйственных удобрений и пестицидов, а также красителей или пигментов для стекла. Соли металлов также часто используются в качестве присадок к полупроводникам для выполнения определенных требований к электропроводности.
Мембрана, которая может более эффективно удалять соли из воды
Послушайте эту историю
Ваш браузер не поддерживает элемент
Наслаждайтесь большим количеством аудио и подкастов на iOS или Android.
АЛАН ТЮРИНГ не был ленивым. Он заложил математическую основу для современных вычислений. Он возглавил успешную попытку взлома немецкого кода Enigma во время Второй мировой войны. И он также, хотя он и менее известен, внес важный вклад в химию, написав статью, удачно озаглавленную «Химические основы морфогенеза». В нем он описал, как диффузия двух химических веществ, которые реагируют друг с другом, может при определенных обстоятельствах создавать сложные структуры пятен и полос. Эти узоры, называемые теперь «структурами Тьюринга», имеют сверхъестественное сходство со многими природными узорами: например, с полосами зебры или пятнами божьей коровки.
В нем он описал, как диффузия двух химических веществ, которые реагируют друг с другом, может при определенных обстоятельствах создавать сложные структуры пятен и полос. Эти узоры, называемые теперь «структурами Тьюринга», имеют сверхъестественное сходство со многими природными узорами: например, с полосами зебры или пятнами божьей коровки.
Степень участия таких процессов в эмбриональном развитии животных обсуждается. Но с более практической точки зрения, Чжан Линь из Чжэцзянского университета в Ханчжоу, Китай, и его коллеги теперь надеются использовать химические идеи Тьюринга для улучшения опреснения воды, процесса, который обеспечивает питьевой водой около 300 миллионов человек.Для этого они создали мембрану с микроскопическими узорами Тьюринга, которая может удалять соли из воды в четыре раза быстрее, чем коммерческие альтернативы. Их исследование опубликовано на этой неделе в журнале Science .
При опреснении морская вода часто сначала прокачивается через пористую «нанофильтрационную» мембрану, изготовленную из вещества, называемого полиамидом. Это удаляет объемные ионы, такие как магний и сульфат, а также бактерии и другие крупные частицы. После этого он проходит через вторую мембрану с еще более мелкими порами.На этом этапе, называемом обратным осмосом, удаляются ионы меньшего размера, чем магний и сульфат, особенно ионы натрия и хлора, составляющие поваренную соль и придающие морской воде ее характерный вкус.
Это удаляет объемные ионы, такие как магний и сульфат, а также бактерии и другие крупные частицы. После этого он проходит через вторую мембрану с еще более мелкими порами.На этом этапе, называемом обратным осмосом, удаляются ионы меньшего размера, чем магний и сульфат, особенно ионы натрия и хлора, составляющие поваренную соль и придающие морской воде ее характерный вкус.
Мембраны, используемые для обратного осмоса, являются шероховатыми и поэтому имеют большую площадь поверхности, через которую может проходить вода. Нанофильтрационные мембраны, напротив, гладкие. Это, по мнению доктора Чжана, означает, что их можно улучшить. Чтобы придать необходимую шероховатость, ему нужно было каким-то образом изменить химическую реакцию, посредством которой создаются мембраны.В этом процессе, известном как межфазная полимеризация, участвуют два химических вещества. Один из них, пиперазин, растворим в воде. Другой, тримезоилхлорид (TMC), можно растворить только в органическом растворителе, таком как декан, маслянистый углеводород.
Когда пиперазин и ТМС встречаются, они реагируют с образованием полиамида. Но если одно растворить в воде, а другое в масле, которые, как известно, не смешиваются, то реакция может произойти только на поверхности, где масло плавает по воде. В результате получается полиамидный лист.На практике в промышленных условиях эту реакцию обычно проводят на пористой подложке, которую сначала пропитывают пиперазином, а затем одну сторону подвергают воздействию ТМС. Полиамидный лист затем формируется на той стороне подложки. Проницательность доктора Чжана состояла в том, чтобы увидеть, что это расположение может быть изменено, чтобы стать типом двуххимической системы, описанной Тьюрингом в его статье, и что, если это возможно, получающиеся узоры будут действовать как выпуклости, увеличивающие площадь поверхности.
Чтобы система сформировала паттерны Тьюринга, два химических вещества должны диффундировать с разной скоростью через среду, в которой протекает реакция.Однако ставки не могут быть слишком разными. Идеальное расхождение составляет примерно десять раз. Для этого д-р Чжан добавил поливиниловый спирт в раствор пиперазина, чтобы сделать его более вязким и замедлить диффузию пиперазина.
Идеальное расхождение составляет примерно десять раз. Для этого д-р Чжан добавил поливиниловый спирт в раствор пиперазина, чтобы сделать его более вязким и замедлить диффузию пиперазина.
В результате были созданы полиамидные листы, заполненные крошечными полыми пузырьками или соединительными трубками, в зависимости от концентрации используемого поливинилового спирта. Это как раз те функции, увеличивающие площадь поверхности, на которые надеялся д-р Чжан. И они сделали работу.Лучшие из них смогли справиться с четырехкратным увеличением расхода без потери производительности.
Вдохновленный успехом, д-р Чжан обратил свое внимание на мембраны обратного осмоса. Хотя они уже грубые, он думает, что может сделать их еще грубее. Они тоже сделаны методом межфазной полимеризации, так что он вполне может это сделать. И если оба типа мембран можно будет улучшить, процесс опреснения, который, вероятно, станет более важным по мере увеличения потребности в воде, станет дешевле и эффективнее.
Эта статья была опубликована в разделе «Наука и технологии» печатного издания под заголовком «Как опреснение получило свои преимущества»
Взгляд на то, почему успешные заменители соли остаются такими неуловимыми | Новости
Хорошо известно, что чрезмерное потребление соли является основной причиной заболеваний, связанных с гипертонией, во всем мире, при этом правительства и организации здравоохранения поощряют людей сокращать потребление хлорида натрия в рационе. Заменитель соли, который имеет приятный вкус и не вызывает (или меньше) проблем со здоровьем, будет иметь большое значение для решения этого кризиса со здоровьем.Тем не менее, вкусный заменитель соли остается упорной загадкой, которая сводит на нет все усилия по ее решению.
Брайан Левандовски из Центра химических ощущений Монелла в Филадельфии, США, был среди исследователей на 256-м собрании Американского химического общества в Бостоне, которые искали что-то, кроме хлорида натрия, которое может придать соленый вкус. «Было бы неплохо иметь что-то вроде искусственного подсластителя, но для соли», — говорит Левандовски Chemistry World .
«Было бы неплохо иметь что-то вроде искусственного подсластителя, но для соли», — говорит Левандовски Chemistry World .
В настоящее время лучшей альтернативой соли являются смеси, которые обычно заменяют хлорид натрия хлоридом калия. Однако хлорид калия может придать пище неприятный вкус. В этих продуктах обычно используются сложные комбинации хлорида калия и других солей, а затем добавляются дополнительные соединения, чтобы заблокировать любой горький вкус.
«Соль обладает множеством очень привлекательных свойств, и, таким образом, ее уменьшение и замена чем-то, что на самом деле не имеет хорошего вкуса, является сложной проблемой для пищевой промышленности», — пояснил Левандовски.«Даже самые лучшие попытки заменителей соли на данный момент все равно будут иметь неприятный вкус».
Вкус соли значительно сложнее, чем четыре других вкуса — сладкий, горький, умами и кислый, — которые обычно имеют один тип вкусовых рецепторов. Например, рецептор, отвечающий за ощущение сладости, представляет собой комбинацию двух белков, называемых T1R2 и T1R3, а рецептор умами представляет собой комбинацию T1R1 и T1R3.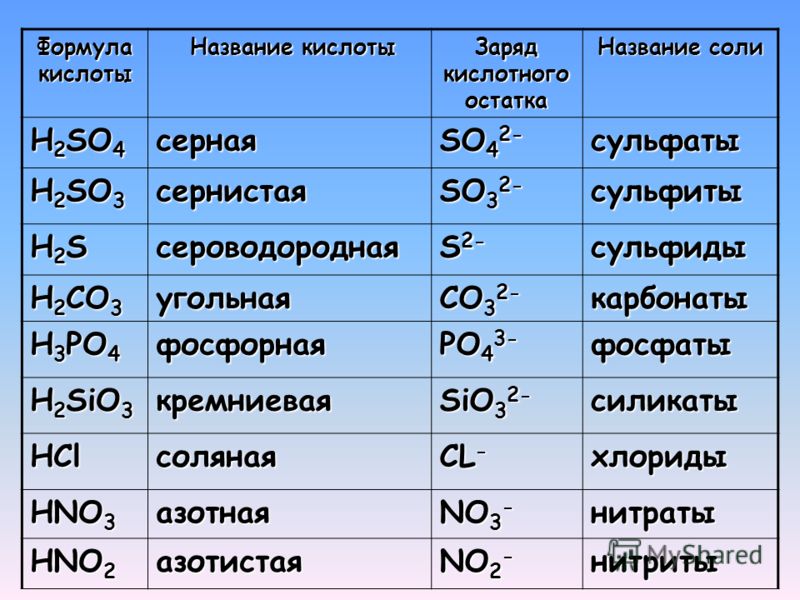 В зависимости от того, как они сочетаются, это родственное семейство белков образует либо рецептор сладкого вкуса, либо рецептор вкуса умами.
В зависимости от того, как они сочетаются, это родственное семейство белков образует либо рецептор сладкого вкуса, либо рецептор вкуса умами.
Рецепторы горького вкуса относятся к семейству белков, называемых T2R, и ученые определили популяцию клеток, реагирующих на кислый вкус, многие из которых имеют свой собственный специфический рецептор. «Мы значительно сузили возможности для кислого рецептора — мы знаем, что это своего рода калиевый канал и, вероятно, также протонный канал, работающий согласованно», — сказал Левандовски.
Однако воспроизвести вкус соли сложнее, поскольку в его основе лежат два разных биологических пути: чувствительный к амилориду и нечувствительный к амилориду.Как следует из названий, первый путь более чувствителен к соли и активируется при более низких концентрациях соли, в то время как для активации второго пути требуются более высокие концентрации соли.
Два биологических пути
Еще больше сбивает с толку поиск заменителя соли тот факт, что, в отличие от других вкусовых качеств, несколько популяций клеток реагируют на соль, как и подмножества других типов вкусовых клеток.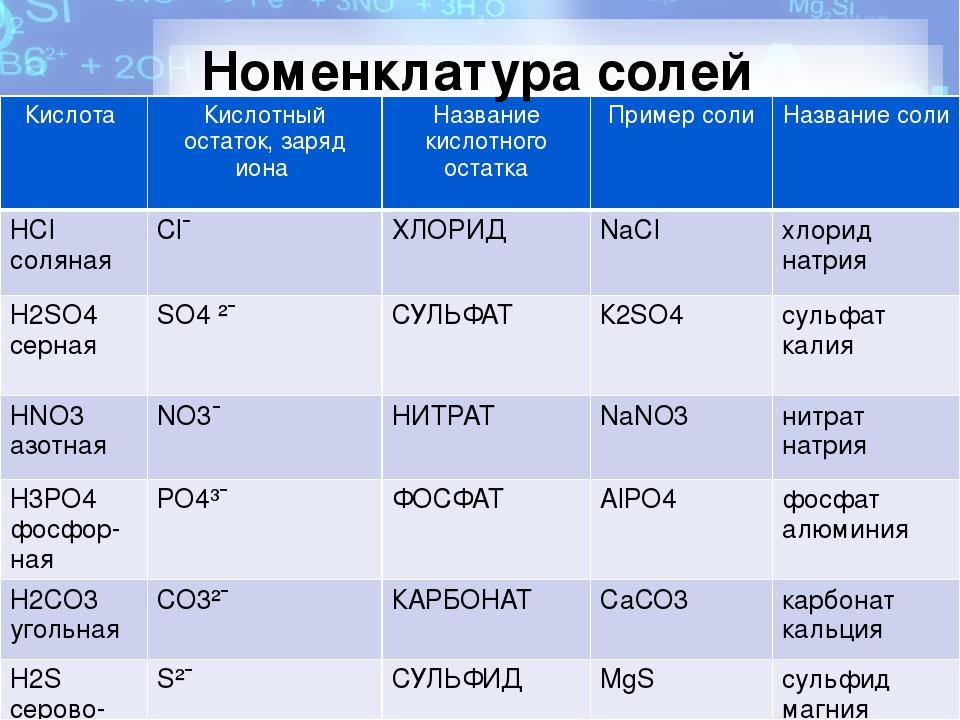 «Вместо одной выделенной популяции вкусовых клеток реакция на соль распределяется по множеству различных типов вкусовых клеток, которые выполняют другие задачи», — объяснил Левандовски.
«Вместо одной выделенной популяции вкусовых клеток реакция на соль распределяется по множеству различных типов вкусовых клеток, которые выполняют другие задачи», — объяснил Левандовски.
Ученые идентифицировали эпителиальный натриевый канал как солевой рецептор для чувствительного к амилориду пути, но рецептор для нечувствительного к амилориду пути остается загадкой. ’ Идентификация нечувствительного к амилориду рецептора — своего рода последний большой вопрос, поскольку речь идет о молекулярной основе вкуса», — сказал Левандовски. «Если бы мы могли определить этот механизм, то у компаний, которые хотят производить искусственную соль или усилитель соленого вкуса, теперь была бы цель для поиска.Такое открытие позволило бы целенаправленному скринингу найти соединения, влияющие на активность этого конкретного рецептора.
Учитывая сложность имитации небольшой молекулы, такой как хлорид натрия, может быть более реалистичным разработать усилитель вкуса соли — химическое вещество, которое взаимодействует с рецепторами соли, делая их более активными, — а не заменитель соли.