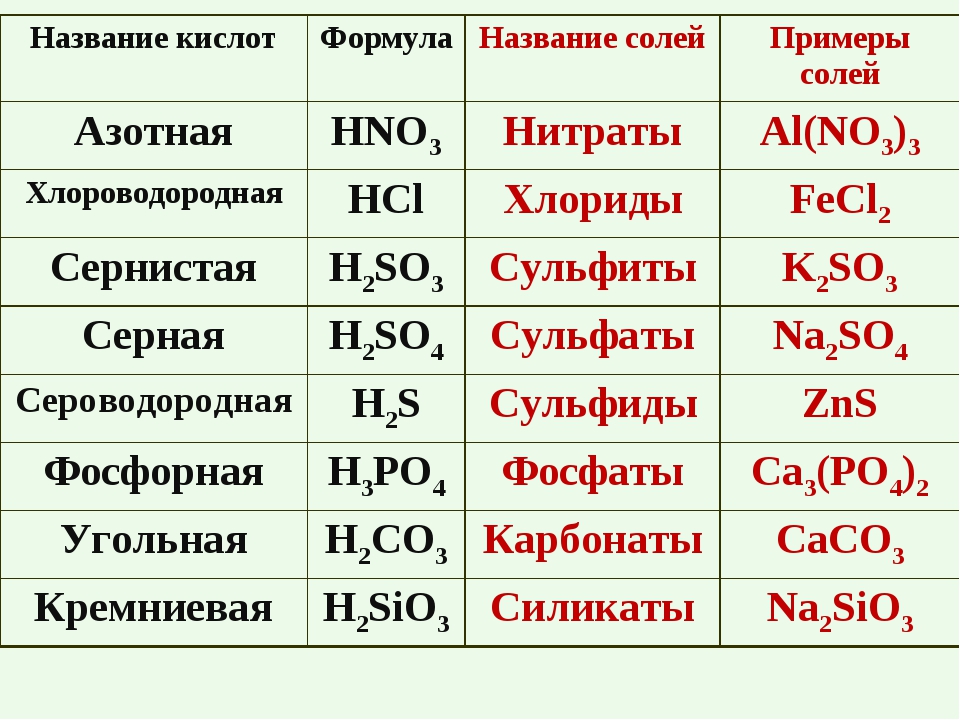
Названия основных неорганических кислот и солей. Неорганические кислоты, соли
| Формулы кислот | Названия кислот | Названия соответствующих солей |
| HClO4 | хлорная | перхлораты |
| HClO3 | хлорноватая | хлораты |
| HClO2 | хлористая | хлориты |
| HClO | хлорноватистая | гипохлориты |
| H5IO6 | иодная | периодаты |
| HIO3 | иодноватая | иодаты |
| H2SO4 | серная | сульфаты |
| H2SO3 | сернистая | сульфиты |
| H2S2O3 | тиосерная | тиосульфаты |
| H2S4O6 | тетратионовая | тетратионаты |
| азотная | нитраты | |
| HNO2 | азотистая | нитриты |
| H3PO4 | ортофосфорная | ортофосфаты |
| HPO3 | метафосфорная | метафосфаты |
| H3PO3 | фосфористая | фосфиты |
| H3PO2 | фосфорноватистая | гипофосфиты |
| H2CO3 | угольная | карбонаты |
| H2SiO3 | кремниевая | силикаты |
| HMnO4 | марганцовая | перманганаты |
| H2MnO4 | марганцовистая | манганаты |
| H2CrO4 | хромовая | хроматы |
| H2Cr2O7 | дихромовая | дихроматы |
| HF | фтороводородная (плавиковая) | фториды |
| HCl | хлороводородная (соляная) | хлориды |
| HBr | бромоводородная | бромиды |
| HI | иодоводородная | иодиды |
| H2S | сероводородная | сульфиды |
| HCN | циановодородная | цианиды |
| HOCN | циановая | цианаты |
Напомню кратко на конкретных примерах, как следует правильно называть соли.
Пример 1. Соль K2SO4 образована остатком серной кислоты (SO4) и металлом К. Соли серной кислоты называются сульфатами. K2SO4 — сульфат калия.
Пример 2. FeCl3 — в состав соли входит железо и остаток соляной кислоты (Cl). Название соли: хлорид железа (III). Обратите внимание: в данном случае мы не только должны назвать металл, но и указать его валентность (III). В прошлом примере в этом не было необходимости, т. к. валентность натрия постоянна.
Важно: в названии соли следует указывать валентность металла только в том случае, если данный металл имеет переменную валентность!
Пример 3. Ba(ClO)2 — в состав соли входит барий и остаток хлорноватистой кислоты (ClO). Название соли: гипохлорит бария. Валентность металла Ва во всех его соединениях равна двум, указывать ее не нужно.
Пример 4. (NH4)2Cr2O7. Группа NH4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
Группа NH4 называется аммоний, валентность этой группы постоянна. Название соли: дихромат (бихромат) аммония.
В приведенных выше примерах нам встретились только т. н. средние или нормальные соли. Кислые, основные, двойные и комплексные соли, соли органических кислот здесь обсуждаться не будут.
Для тренировки рекомендую вам самостоятельно назвать следующие соединения: LiF, NaClO3, Al2(SO4)3, Ni(NO3)2, KMnO4, AgBr, ZnCO3, (NH4)3PO4.
Если вас интересует не только номенклатура солей, но и методы их получения и химические свойства, рекомендую обратиться к соответствующим разделам справочника по химии: «Химические свойства неорганических соединений» и «Методы получения неорганических соединений».
КИСЛЫЕ СОЛИ — это… Что такое КИСЛЫЕ СОЛИ?
кислые соли — – соли двух и более многоосновных кислот, в которых водород не полностью замещен на катион металла. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Кислые соли
Кислые соли — (хим.). Вопрос об основности кислот и о том, должно ли рассматривать некоторые соли, в которых не весь водород еще замещеи металлами, как К. или же как двойные соли, сильно занимал одно время химиков. Известно негодующее замечание Лорана ( Méth.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ФОСФОРНО-КИСЛЫЕ СОЛИ — Фосфор, встречающийся в моче, костях и некоторых минералах. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
МАРГАНЦОВИСТО-КИСЛЫЕ СОЛИ — Соединение марганцовистой кислоты с окисями металлов.
ФИЗИОЛОГИЧЕСКИ КИСЛЫЕ СОЛИ — соли, из которых растение быстрее и в большей степени поглощает катион, а анион остается в среде и подкисляет ее (напр., Nh5C1 или (Nh5)2S04, KC1, K2S04) … Словарь ботанических терминов
Уксусно-кислые соли — см. Уксусная кислота … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Соли — Соли класс химических соединений, состоящих из катионов и анионов[1]. В роли катионов в солях могут выступать катионы металлов, ониевые катионы (катионов аммония , фосфония , гидроксония и их органические производные), комплексные катионы и … Википедия
СОЛИ — класс хим. соединений, в твёрдом состоянии кристаллические вещества, состоящие из катионов (см.) и анионов (см.), а в водном растворе диссоциирующие на эти (см.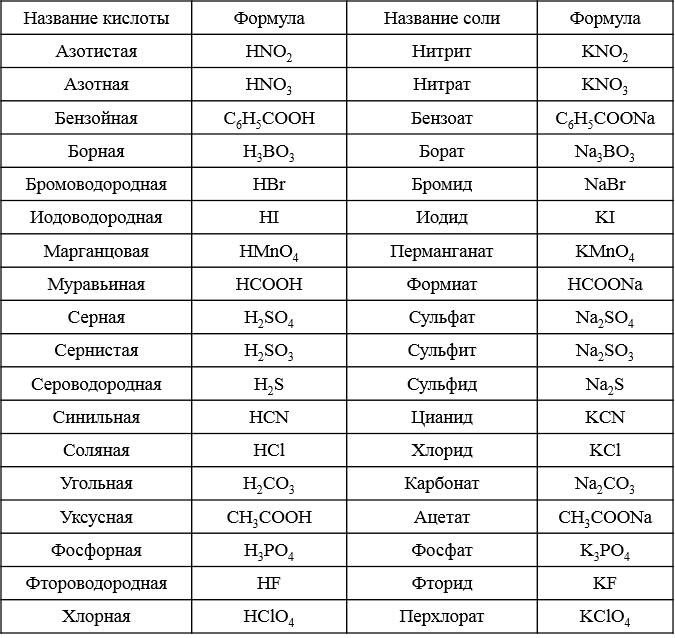
соли — продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н кислые (напр., NaHCO3), неполном … Энциклопедический словарь
Код ТН ВЭД 2915400000. Кислоты моно-, ди- и трихлоруксусные, их соли и сложные эфиры. Товарная номенклатура внешнеэкономической деятельности ЕАЭС
Позиция ТН ВЭД
|
Позиция ОКПД 2
| Базовая ставка таможенной пошлины | 5% реш. 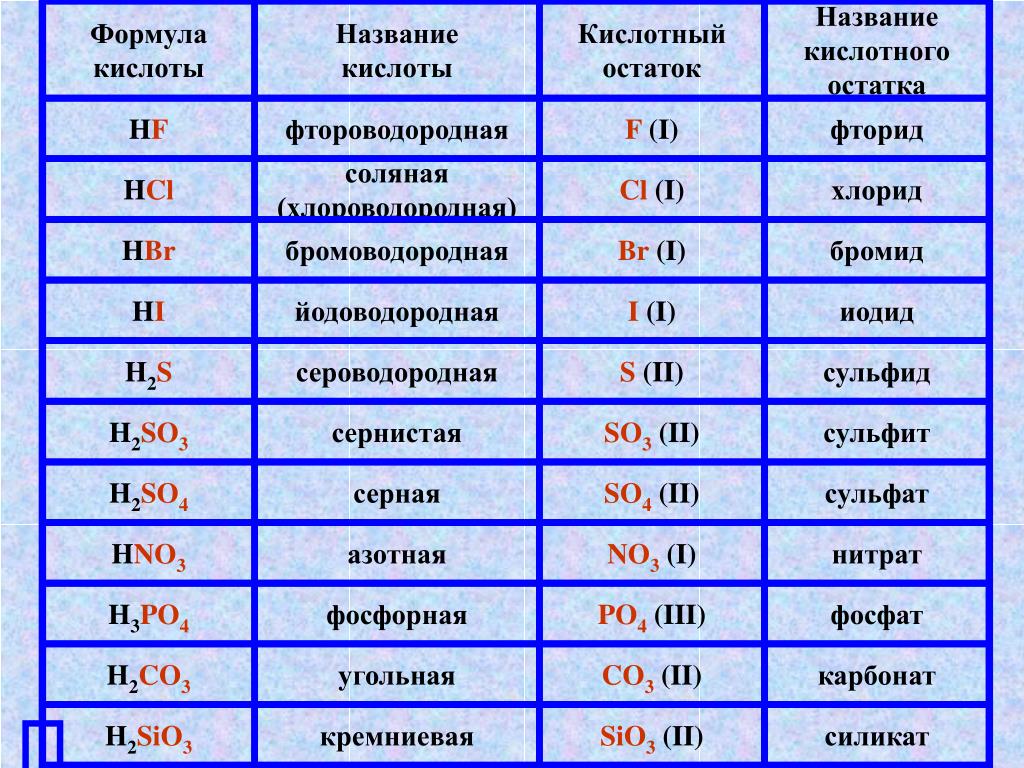 54 54 |
| Акциз | Не облагается |
| НДС | Жизненно необходимая медтехника Кислоты ациклические.
10% — Лекарственные средства (Регистрационное удостоверение) 20% — Прочие
Освобождение и льготы Органические химические соединения (НДС Прод.товары): Постановление 908 от 31. 12.2004 Правительства РФ 12.2004 Правительства РФ
10% — сахарозаменители для людей, больных сахарным диабетом, для использования в пищевых целях и кормовых целях (в том числе предназначенных для проведения сертификационных испытаний, проверок, экспериментов) 20% — прочие |
| Базовая ставка таможенной пошлины | Беспошлинно |
| Акциз | Не облагается |
Рассчитать контракт
Особенности товараЗагрузить особенности ИМ Загрузить особенности ЭК
Код ТН ВЭД 2919900000.
 Прочие эфиры фосфорной кислоты сложные и их соли, включая лактофосфаты; их галогенированные, сульфированные, нитрованные или нитрозированные производные. Товарная номенклатура внешнеэкономической деятельности ЕАЭС Позиция ТН ВЭД
Прочие эфиры фосфорной кислоты сложные и их соли, включая лактофосфаты; их галогенированные, сульфированные, нитрованные или нитрозированные производные. Товарная номенклатура внешнеэкономической деятельности ЕАЭС Позиция ТН ВЭД
|
Позиция ОКПД 2
|
| Базовая ставка таможенной пошлины | 5% реш.54 |
| Акциз | Не облагается |
| НДС | Освобождение и льготы Органические химические соединения (НДС Прод.
10% — сахарозаменители для людей, больных сахарным диабетом, для использования в пищевых целях и кормовых целях (в том числе предназначенных для проведения сертификационных испытаний, проверок, экспериментов) 20% — прочие |
| Базовая ставка таможенной пошлины | Беспошлинно |
| Акциз | Не облагается |
Рассчитать контракт
Особенности товараЗагрузить особенности ИМ Загрузить особенности ЭК
Соли — классификация, получение и свойства » HimEge.
 ru
ruОбщая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)2 – CaOHCl;
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl2 + H2O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
K2[Zn(OH)4] + 4HBr изб = 2KBr + ZnBr2 + 4H2O
K3[Cr(OH)6] + 6HNO3 изб.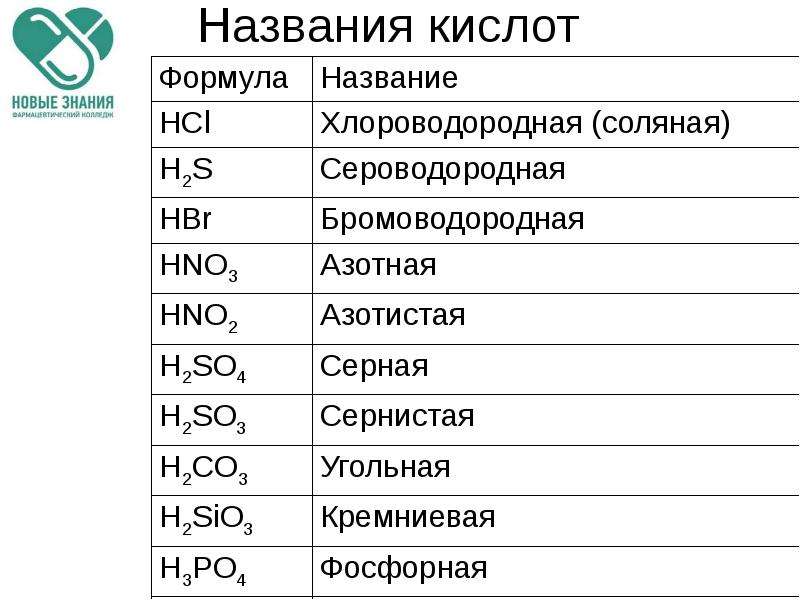 = 3KNO3 + Cr(NO3)3 + 6H2O
= 3KNO3 + Cr(NO3)3 + 6H2O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)4] = KAlO2 + 2H2O
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3↓
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3↓
Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
Сокращение потребления соли
Наращивание производства пищевых продуктов все более глубокой переработки, быстрая урбанизация и изменение образа жизни меняют тенденции в области питания.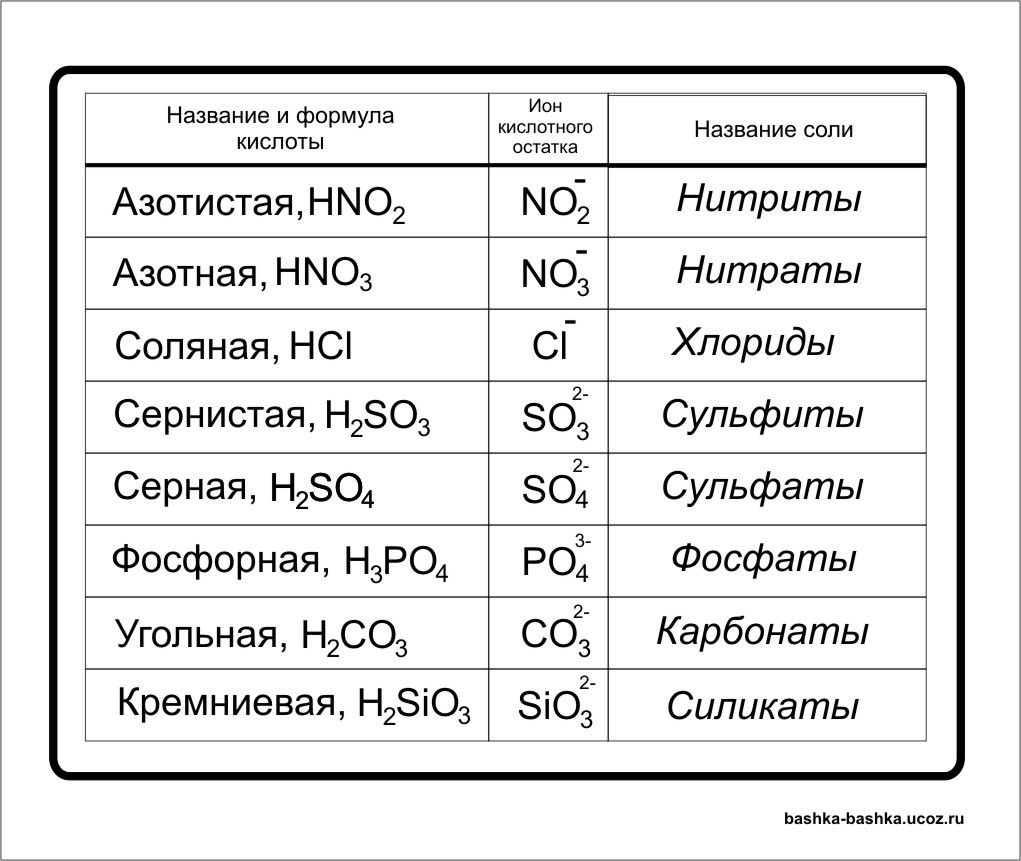 Доступность и ценовая приемлемость продуктов, прошедших глубокую технологическую переработку, повышаются.
Во всем мире население потребляет все больше высококалорийной пищи со значительным содержанием насыщенных жиров, трансжиров, сахаров и соли. Соль является основным источником натрия, при этом установлена связь между повышенным потреблением натрия
и гипертонией, а также увеличением риска сердечно-сосудистых заболеваний и инсульта.
Доступность и ценовая приемлемость продуктов, прошедших глубокую технологическую переработку, повышаются.
Во всем мире население потребляет все больше высококалорийной пищи со значительным содержанием насыщенных жиров, трансжиров, сахаров и соли. Соль является основным источником натрия, при этом установлена связь между повышенным потреблением натрия
и гипертонией, а также увеличением риска сердечно-сосудистых заболеваний и инсульта.
Одновременно, по мере отхода от привычных схем питания снижается потребление ключевых составляющих здорового рациона — фруктов, овощей и пищевых волокон (в частности, цельных злаков). Фрукты и овощи содержат калий, способствующий снижению кровяного давления.
Роль переработанных пищевых продуктов как источника соли в рационе объясняется тем, что содержание соли в них особенно высоко (в случае готовых блюд, мясопродуктов, таких как бекон, ветчина и сырокопченая колбаса, сыров, соленых снеков, лапши быстрого
приготовления и т.д.), а также тем, что они потребляются часто и в больших количествах (в случае хлеба и переработанных зерновых продуктов). Соль также добавляется в пищу во время приготовления (в виде бульонных кубиков) или уже на столе (в виде соевого
или рыбного соуса и пищевой соли).
Соль также добавляется в пищу во время приготовления (в виде бульонных кубиков) или уже на столе (в виде соевого
или рыбного соуса и пищевой соли).
Вместе с тем многие производители меняют рецептуру своей продукции для сокращения содержания соли, и потребителям рекомендуется обращать внимание на этикетки продуктов и выбирать продукты с низким содержанием натрия.
Рекомендации по снижению потребления соли
- Взрослые. ВОЗ рекомендует взрослым потреблять менее 5 г соли в день (чуть меньше одной чайной ложки) (1).
- Дети. Для детей в возрасте от двух до 15 лет ВОЗ рекомендует корректировать рекомендованное максимальное потребление соли в сторону уменьшения исходя из их потребностей в энергии по сравнению с взрослыми. Эта рекомендация в отношении детей не охватывает период исключительно грудного вскармливания (0–6 месяцев) или период прикорма при продолжающемся грудном вскармливании (6–24 месяца).
- Вся потребляемая соль должна быть йодированной, т.
 е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.
е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.
Информация о соли, натрии и калии
- Натрий является важнейшим биогенным элементом, необходимым для поддержания объема плазмы крови и водно-щелочного баланса, передачи нервных импульсов и нормального функционирования клеток.
- Избыток натрия сопровождается негативными последствиями для здоровья, в том числе повышением кровяного давления.
- Основные источники потребления натрия в пище определяются культурными особенностями и кулинарными предпочтениями населения.
- Натрий естественным образом содержится в целом ряде продуктов питания, таких как молоко, мясо и морепродукты. Он нередко встречается в большом количестве в переработанных пищевых продуктах, таких как хлебобулочные изделия, мясопродукты и снеки, а
также во вкусовых добавках к пище (например, соевом и рыбном соусах).

- Натрий содержится также в глутамате натрия, который используется в качестве пищевой добавки во многих регионах мира.
- Калий — важнейший микроэлемент, необходимый для поддержания общего объема жидкостей в организме, кислотного и водно-электролитного баланса и нормального функционирования клеток.
- Калий содержится в самых разнообразных необработанных пищевых продуктах, особенно фруктах и овощах.
- Установлено, что увеличение потребления калия снижает систолическое и диастолическое давление у взрослых людей.
Как сократить потребление соли с продуктами питания
Государственная политика и стратегии должны обеспечивать создание условий, позволяющих населению потреблять достаточное количество безопасных и питательных продуктов, составляющих основу здорового рациона, к которым относятся продукты с низким содержанием
соли. Оздоровление привычек в области питания является обязанностью не только общества, но и каждого человека. Эта задача должна решаться с учетом характеристик и культурных особенностей населения и с участием целого ряда секторов.
Можно выделить следующие ключевые стратегии общего характера по сокращению потребления соли:
- политика государства, в том числе надлежащая налоговая политика и регулирование, обеспечивающие поставку производителями и розничными предприятиями более здоровых продуктов питания и расширение ассортимента доступной и недорогой здоровой пищевой продукции;
- взаимодействие с частным сектором для обеспечения поставок и повышения доступности продуктов с низким содержанием соли;
- информирование и расширение прав и возможностей потребителей методами социального маркетинга и мобилизации для повышения их осведомленности о необходимости сокращать потребление соли;
- создание благоприятных предпосылок для сокращения потребления соли за счет инициатив в области местной политики и содействие формированию «сред здорового питания», в частности на уровне школ, общин и городов;
- мониторинг потребления соли населением, источников соли в рационе питания, а также уровня осведомленности, установок и поведения людей в отношении этой проблемы для учета полученных данных при принятии решений о мерах политики.

Программы сокращения потребления соли и программы, направленные на обогащение соли, вкусовых добавок и приправ с высоким содержанием соли (бульонных кубиков, соевого и рыбного соусов) питательными микроэлементами, могут дополнять друг друга.
Потребление соли дома можно сократить, если:
- не солить блюда во время их приготовления;
- не держать на обеденном столе солонку;
- ограничить потребление соленых снеков;
- выбирать продукты с низким содержанием натрия.
Сокращению потребления соли способствует целый ряд других практических мер местного уровня:
- включение вопросов сокращения потребления соли в программы обучения работников пищевой промышленности и общественного питания;
- изъятие солонок и соевого соуса со столов на предприятиях общественного питания; размещение уведомлений о том, что определенная продукция содержит много натрия на упаковке или на полках магазинов;
- предоставление специальных рекомендаций в отношении питания посетителям учреждений здравоохранения;
- разъяснительная работа о необходимости сокращения потребления соли и ограниченном ее использовании при приготовлении пищи;
- разъяснительная работа с детьми и создание для детей обстановки, способствующей формированию у них привычки к низкосолевому рациону уже в молодом возрасте.

Действия пищевой промышленности должны включать в себя:
- постепенное сокращение содержания соли в продукции с течением времени, с тем чтобы потребители привыкли к ее вкусу постепенно, не переходя на альтернативную продукцию;
- пропаганду преимуществ употребления продуктов питания с пониженным содержанием соли в рамках информационных мероприятий для потребителей на предприятиях общественного питания и в магазинах;
- сокращение содержания соли в пищевых продуктах и блюдах, предлагаемых ресторанами и службами питания, и указание содержания натрия в них.
Заблуждения о сокращении потребления соли
- «В жаркий и влажный день человек потеет, и в его пище должно быть больше соли». Потея, организм теряет совсем немного соли, поэтому даже в условиях жары и высокой влажности лишняя соль не нужна; однако важное значение имеет обильное питье.
- Морская соль не «полезнее» промышленно произведенной лишь потому, что «создана природой».
 Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий.
Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий. - Добавление соли при приготовлении пищи — не основной источник потребляемой соли. Во многих странах примерно 80% соли в рационе потребляется в составе промышленно переработанных пищевых продуктов.
- Чтобы придать пище приятный вкус, не обязательно использовать соль. Вкусовые рецепторы человека адаптируются не сразу, но, привыкнув к пониженному потреблению соли, он с большей вероятностью будет получать удовольствие от пищи и чувствовать более широкий диапазон вкусов.
- «Пища без соли кажется пресной». Поначалу это может быть и так, однако вскоре вкусовые рецепторы адаптируются к уменьшению содержания соли, и человек привыкает ценить менее соленую, но более выраженную во вкусовом отношении пищу.
- «Пища, в которой много соли, соленая на вкус». Некоторые продукты питания с высоким содержанием соли не имеют выраженного соленого вкуса, потому что он сочетается с другими, маскирующими соленость ингредиентами, например, сахарами.
 Чтобы выяснить содержание натрия в продуктах питания, необходимо обращать внимание на этикетки.
Чтобы выяснить содержание натрия в продуктах питания, необходимо обращать внимание на этикетки. - «Беспокоиться о количестве потребляемой соли стоит только пожилым людям». Избыточное потребление соли может приводить к повышению кровяного давления у лиц любого возраста.
- «Сокращение потребления соли может плохо повлиять на мое здоровье». Потреблять слишком мало соли очень трудно, потому что она содержится в большом количестве повседневных продуктов питания.
Деятельность ВОЗ
В руководствах ВОЗ о потреблении натрия и калия определены предельные значения их потребления без ущерба для здоровья. В руководствах также описываются меры по оздоровлению питания и профилактике НИЗ у взрослых и детей.
В 2004 г. Всемирная ассамблея здравоохранения приняла Глобальную стратегию по питанию, физической активности и здоровью. Она содержит призыв к правительствам, ВОЗ, международным партнерам, частному сектору и гражданскому обществу принимать меры в
поддержку здорового питания и физической активности на глобальном, региональном и местном уровнях.
В 2010 г. Всемирная ассамблея здравоохранения одобрила свод рекомендаций в отношении маркетинга продуктов питания и безалкогольных напитков, ориентированного на детей. Рекомендации служат странам ориентиром при выработке новых и укреплении существующих мер политики по уменьшению негативных последствий маркетинга вредных для здоровья продуктов питания для детей. ВОЗ также содействует разработке модели профилей питательных веществ, которая может использоваться странами в качестве инструмента при выполнении рекомендаций, касающихся маркетинга.
В 2011 г. мировые лидеры взяли на себя обязательство сокращать негативное воздействие нездорового питания на людей. Данное обязательство было провозглашено в Политической декларации Совещания высокого уровня Генеральной Ассамблеи по профилактике НИЗ и борьбе с ними.
В 2012 г. Всемирная ассамблея здравоохранения утвердила шесть глобальных целей в области питания, включающих сокращение числа детей, страдающих задержкой роста, истощением и ожирением, повышение показателей грудного вскармливания и уменьшение числа
случаев анемии и низкой массы тела при рождении.
В 2013 г. Всемирная ассамблея здравоохранения согласовала девять глобальных добровольных целей в области профилактики НИЗ и борьбы с ними, которые, в частности, предусматривают прекращение распространения диабета и ожирения, а также сокращение потребления соли на 30% к 2025 г. Глобальный план действий по профилактике неинфекционных заболеваний и борьбе с ними на 2013–2020 гг. содержит руководящие указания и набор вариантов политики для достижения этих целей государствами-членами, ВОЗ и другими учреждениями ООН.
В мае 2014 г., ввиду быстрого роста распространенности ожирения среди младенцев и детей, ВОЗ учредила комиссию по ликвидации детского ожирения. Комиссия подготовила доклад за 2015 г., в котором уточнила, какие подходы и действия с большой вероятностью будут наиболее эффективны в условиях различных стран мира.
(1) Эти рекомендации применимы ко всем лицам, независимо от того, страдают ли они повышенным кровяным давлением (включая беременных и кормящих грудью женщин), за исключением лиц, которые страдают заболеваниями или принимают лекарства, которые могут
приводить к снижению уровня натрия или резкому накоплению воды в организме, либо лиц, нуждающихся в специальной диете под наблюдением врача (например, пациентов с сердечной недостаточностью или диабетом первого типа). Для этих подгрупп населения может
быть установлена специфическая взаимосвязь между потреблением натрия и показателями здоровья (Руководство ВОЗ о потреблении натрия для взрослых и детей, 2012 г.).
Для этих подгрупп населения может
быть установлена специфическая взаимосвязь между потреблением натрия и показателями здоровья (Руководство ВОЗ о потреблении натрия для взрослых и детей, 2012 г.).
Краткий конспект подготовки к ЗНО по химии №11 Соли
Подготовка к ВНО. Химия.
Конспект 11. Соли
Соли – это электролиты, в результате диссоциации их водных растворов образуются катионы металлов и анионы кислотных остатков.
Классификация солей
Соли бывают:
1. Средние
2. Кислые
3. Основные
4. Двойные
5. Смешанные
6. Комплексные
Средние соли
В состав солей входят катионы металлов и кислотные остатки. Если кислотный остаток не содержит водорода, соли называют средними
– сульфат кальция
– нитрат свинца(II)
– ортофосфат кальция
– карбонат меди(II)
– нитрат лантана(III)
Средние соли – продукты полной нейтрализации кислот основаниями:
↓ .
Кислые соли – продукты неполной нейтрализации:
Соли, содержащие кислотные остатки с незамещенными атомами водорода, называются кислыми, например:
– гидросульф т кальция
– гидрокарбонат железа(II)
– дигидроортофосфат бария
– гидроортофосфат бария
Основные соли.
Соли, содержащие в своем составе гидроксогруппы, называются оснóвными, например:
– дигидроксид-сульфат кальция
– дигидроксид-карбонат димеди
Оснóвные соли – продукты неполной нейтрализации:
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида
Двойные и смешанные соли
Известны также соли, содержащие два химически разных катиона – двойные соли или аниона – смешанные соли. Примеры:
– сульфат алюминия-калия
– сульфат диаммония-железа(II)
– метасиликат алюминия-лития
– хлорид-гипохлорит кальция
– гидрокарбонат-карбонат натрия
– нитрат-иодат натрия
Часто двойные и смешанные соли малорастворимы в воде. Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
Многие двойные и смешанные соли могут быть получены путем совместной кристаллизации при охлаждении из растворе смеси солей. Например:
Соли в природе
Очень многие соли, используемые химиками, встречаются в природе.
Природные соли можно классифицировать следующим образом.
Минеральные соли.
| Бинарные соединения | Сульфиды, галогениды |
| Соли с анионом, содержащим неметалл (металлоид) | Карбонаты, сульфаты, фосфаты, нитраты, бораты, арсенаты, силикаты, алюмосиликаты. |
| Соли с анионом, содержащим металл |
Хроматы, вольфраматы, молибдаты, ванадаты. |
Физические свойства
В обычных условиях все соли – это твердые бесцветные вещества. Но некоторые ионы придают им окраску. Например, соли двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.
Растворимость солей может быть различной. Хорошо растворимы нитраты, почти все соли щелочных металлов и аммония.
Химические свойства солей
1. Взаимодействие с металлами.
Более активные восстановители вытесняют менее активные из раствора их солей. Активность метала можно определить в электрохимическом ряду напряжения металлов.
Однако щелочные и щелочноземельные металлы реагируют с растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом образуется щелочь и выделяется водород.
↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
↓
2. Реагируют со щелочами.
↓
3. Реакция с кислотами (если образуется осадок или газ)
↓ (качественная реакция на галогеноводородные кислоты.)
↓ (качественная реакция на серную кислоту и её соли. )
)
↑ (качественная реакция на карбонаты)
4. Реагируют с кислотами (с более сильными или менее летучими).
(тв.)(конц.) ↑
(тв.) (конц.)
↑
5. Реагируют с солями.
↓
6. Разложение при нагревании.
7. Гидролиз
Некоторые соли способны подвергаться необратимому гидролизу в водных растворах.
2Al(NO3)3 +3 Na2S + 6h3O = 2Al(OH)3↓ +3h3S↑ + 6NaNO3
Химические свойства кислых солей
Кислые соли, как правило, растворимы в воде лучше, чем средние соли. Например, гидрокарбонат кальция растворим в воде, а карбонат кальция – нет. Дигидропроизводные кислот растворимы в воде лучше гидропроизводных соответствующих кислот.
1. Разлагаются при нагревании.
Ca(НCO 3)2 CaСO3↓ + CO2 ↑+ Н2О
2. Взаимодействую с основаниями с получением средних солей.
Ca(НCO 3)2 +Сa(OH)2 = 2CaСO3↓ + 2Н2О
Nah3PO4 + 2NaOH = Na3PO4 + 2h3O
3. Кислые соли вступают в такие же реакции, как и средние. Обменные реакции друг с другом.
↓
Получение средних солей
1. Взаимодействие гидроксидов с кислотами.
2. Реакция кислотных оксидов со щелочами.
3. Реакция основного оксида с кислотой.
4. Реакция металла и неметалла (соли бескислородных кислот)
Методы получения кислых солей
1. Неполная нейтрализация многоосновных кислот.
2. Взаимодействие средних солей с оксидами.
↓
Тесты подготовки к ЗНО:
Online-тест подготовки к ЗНО по химии№13 «Классы неорганических соединений. Соли»
Кислоты, основания и соли | CPD
Хлорид натрия в нашем рационе является источником натрия, необходимого для передачи нервных импульсов и поддержания надлежащего баланса жидкости в организме.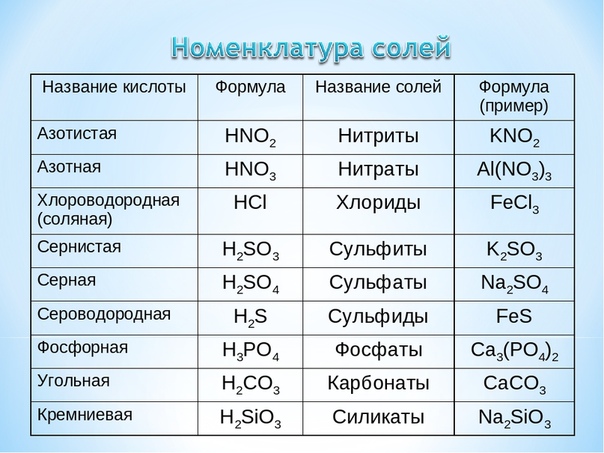 На протяжении всей истории люди использовали эту соль для консервирования мяса, очистки ран и изготовления мыла.
На протяжении всей истории люди использовали эту соль для консервирования мяса, очистки ран и изготовления мыла.
Натрия хлорид является одним из примеров соли. В химии термин «соль» относится к группе ионных соединений, образующихся в результате реакции нейтрализации между кислотой и основанием.
Понятия кислот, оснований и солей вводятся в начале обучения в средней школе, развиваются и уточняются по мере успеваемости учащихся и лежат в основе многих будущих тем.Вот несколько идей, которые помогут заинтересовать студентов, избежать неправильных представлений и связать практическую работу с основными концепциями.
Что нужно знать студентам
- Кислоты — водородсодержащие вещества с кислым вкусом, которые образуют растворы со значением pH менее 7. Обычные примеры включают соляную кислоту, серную кислоту, лимонную кислоту и этановую кислоту (уксус / уксусная кислота).
- Основания — это группа веществ, нейтрализующих кислоты.
- Растворимые основания называются щелочами.
 Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак.
Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак. - Нейтрализация — это реакция между кислотой и щелочью, при которой образуется соль и вода.
- Соли не имеют запаха и имеют соленый вкус, многие из них растворимы в воде. Общие примеры включают хлорид натрия, йодид калия, карбонат кальция и сульфат меди.
- Шкала pH используется для измерения кислотности и щелочности.
- Индикаторы — это вещества, меняющие цвет при изменении кислотности / щелочности. Лакмус — общий индикатор; щелочные растворы окрашиваются в красный лакмусовый синий цвет, а кислые растворы — в синий лакмусовый красный цвет.
- Кислоты могут реагировать с некоторыми металлами с образованием соли и газообразного водорода.
Идеи для занятий
Учащиеся имеют богатый опыт работы с кислотами, основаниями и солями, накопленный как в школе, так и в повседневной жизни. Стоит начать обсуждение темы с выявления их существующих идей путем совместного построения интеллект-карты. Будьте внимательны к недопониманиям и постарайтесь устранить их, прежде чем двигаться дальше.
Стоит начать обсуждение темы с выявления их существующих идей путем совместного построения интеллект-карты. Будьте внимательны к недопониманиям и постарайтесь устранить их, прежде чем двигаться дальше.
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи. Загрузите подборку анекдотов о кислотах, основаниях и солях (MS Word или pdf).
Использование реальных примеров и анекдотов в классе может помочь закрепить идеи. Загрузите подборку анекдотов о кислотах, основаниях и солях с веб-сайта Education in Chemistry : rsc.li / 2Oj0lQk.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба похожи на воду. Учащимся сложно использовать химические свойства для характеристики этих растворов. Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учащемся (MS PowerPoint или pdf) и заметки учителя (MS Word или pdf) для этого упражнения.
Загрузите информацию об учащемся (MS PowerPoint или pdf) и заметки учителя (MS Word или pdf) для этого упражнения.
Одна особая проблема, которая может возникнуть при введении лабораторных кислот и щелочей, заключается в том, что они оба похожи на воду. Учащимся сложно использовать химические свойства для характеристики этих растворов. Задача «Мудрец и писец» может использоваться для демонстрации ограничений визуального описания и усиления необходимости искать наличие или отсутствие определенных характеристик или свойств. Загрузите информацию об учениках и заметки для учителей для этого упражнения: rsc.li/2Oj0lQk.
В этом упражнении мудрец должен описать простое изображение двум писцам.Один писец записывает описание мудреца, а другой пытается нарисовать по нему рисунок. Могут ли переписчики идентифицировать изображение? Описания субъективны и могут быть неправильно истолкованы, тогда как идентификация требует объективного подхода.
Свяжите эту идею с тем, как мы можем четко различать два раствора, которые выглядят как вода, особенно с использованием индикаторов с кислотами и щелочами.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах.В качестве домашнего задания попросите учащихся определить бытовые вещества, которые являются кислотами и щелочами. Их обычно можно найти на кухне и в ванной. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами. Студент может принести образцы и протестировать их с помощью кислоты или щелочи? Кислый или щелочной? Мероприятия. Затем активность Color creactions может быть использована для введения универсального индикатора и шкалы pH перед переходом к нейтрализации.
Стремитесь одинаково вводить кислоты и щелочи, а не сосредотачиваться только на кислотах.В качестве домашнего задания попросите учащихся определить бытовые вещества, которые являются кислотами и щелочами. Их обычно можно найти на кухне и в ванной. Например, уксус и лимонный сок являются кислотами, а разрыхлитель и зубная паста — щелочами. Студент может принести образцы и протестировать их с помощью «Кислоты или щелочи? Кислая или щелочная активность? ’(Rsc.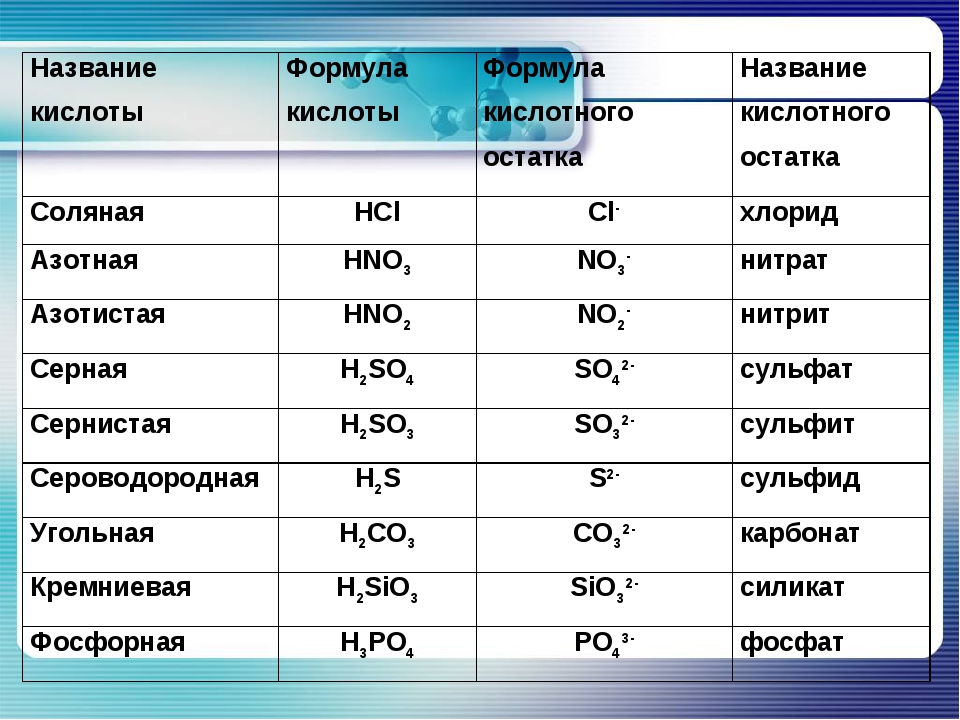 li/2PueBT7). Затем активность «Цветные реакции» можно использовать для введения универсального индикатора и шкалы pH перед переходом к нейтрализации (rsc.li / 2CaCriy).
li/2PueBT7). Затем активность «Цветные реакции» можно использовать для введения универсального индикатора и шкалы pH перед переходом к нейтрализации (rsc.li / 2CaCriy).
Важно продумать, чему вы хотите, чтобы учащиеся узнали из этих занятий, и как этого можно достичь. Время должно быть поровну разделено между практическими занятиями (включая просмотр демонстраций и видео) и последующей умственной деятельностью по обсуждению лежащих в основе концепций и идей. Учащиеся могут совместно работать над развитием своего понимания, используя структурированные беседы, которые позволяют установить связи между практической работой и лежащими в основе концепциями.
Связывание практических задач с основополагающими концепциями
Помните, что время, выделяемое на практическую работу, должно быть поровну разделено между практическими занятиями и установлением связей между явлениями и лежащими в их основе концепциями.
Призывайте студентов наблюдать и интерпретировать, задавая вопросы. Попробуйте повторить их ответы на правильном языке. Например, замените «проделал дыру» или «прожжил» на «корродировал».
Попробуйте повторить их ответы на правильном языке. Например, замените «проделал дыру» или «прожжил» на «корродировал».
С практикой студенты могут вести свои собственные практические беседы в своей группе.У структурированных разговоров должны быть строгие ограничения по времени. Строительные леса, такие как основы предложений, побуждают как слушать, так и отвечать друг другу.
Вопросы
- Что вы наблюдали?
- Что вы можете сделать из этого?
- Почему…?
- Что вы думаете о…?
- Каковы последствия для…?
- Как может…?
Основы приговора
- Я видел…
- Я думаю, это показывает…
- Это говорит о том, что…
- Я думаю, это говорит нам…
- А как насчет…?
- Я с вами не согласен, потому что…
- Не понимаю…
Распространенные заблуждения
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы.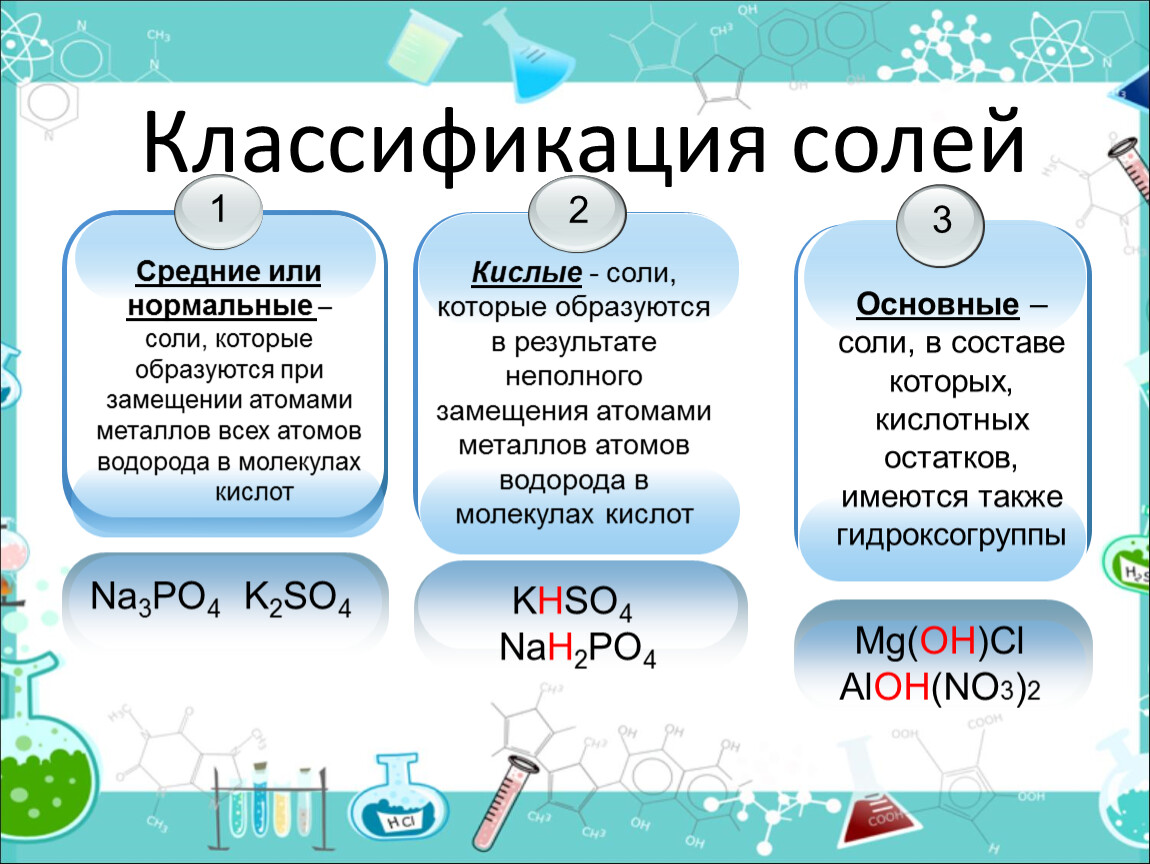 Однако щелочи также могут быть очень агрессивными, как показано на видео о банках из-под кока-колы.
Однако щелочи также могут быть очень агрессивными, как показано на видео о банках из-под кока-колы.
Студенты часто считают, что только кислоты вызывают коррозию и могут быть идентифицированы, потому что они разъедают / сжигают материалы. Однако щелочи также могут вызывать сильную коррозию, как показано в видеоролике «Коксовые банки в кислоте и щелоче» (bit.ly/2C5YyXv).
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой».Деградация — это изменение объемных свойств материала, который будет по-другому выглядеть, станет слабее или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частицы) уровне. Например, раствор гидроксида натрия добавляется в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические). .
.
Используйте видео как подсказку, чтобы выявить идеи коррозии. Объясните, что коррозию можно определить как «разрушение или разрушение материала из-за реакции с окружающей средой». Деградация — это изменение объемных свойств материала, который будет по-другому выглядеть, станет слабее или даже разрушится из-за химических изменений. Это описание побуждает студентов видеть материалы как на макроскопическом (объемном) уровне, так и на субмикроскопическом (частичном) уровне (узнайте больше о том, как заставить ваших учеников задуматься о том, как они учатся: rsc.li / 2C596X0). Например, раствор гидроксида натрия добавляется в алюминиевую банку, которая распадается с выделением газа (макроскопически), потому что частицы гидроксида натрия реагируют с частицами алюминия с образованием соли алюминия и газообразного водорода (субмикроскопические). .
Старайтесь избегать использования антропоморфных описаний, таких как «атаковать» или «съесть». Эти термины, как правило, приводят к представлениям о химических веществах, которые «хотят» или «нуждаются» в реакции. Это усложнит учащимся четкое понимание того, как и почему протекают химические реакции.
Это усложнит учащимся четкое понимание того, как и почему протекают химические реакции.
Формирующее оценивание
Сопоставление понятий — полезный инструмент для усиления связи этой темы с учебной программой. Упражнение «Пересмотр кислот» (rsc.li/2OTINtu) было адаптировано как оценивание для учебной деятельности (rsc.li/2A365VQ).
Предоставьте студентам возможность практиковаться как в более длинных ответах (четыре и шесть баллов), так и в вопросах с несколькими вариантами ответов (одна оценка) при подготовке к экзаменам. Покажите вопрос и дайте студентам две минуты, чтобы написать свой ответ на мини-доске.Важно отметить, что попросите их написать, почему они выбрали свой ответ. Это дает возможность выявить недопонимание и незамедлительно дать обратную связь.
Переход к 14–16
В уроках 14–16 используется более сложная модель кислотности, основанная на ионах водорода и гидроксида. Кислоты выделяют ионы водорода (H + ) в растворе и щелочные ионы гидроксида (OH — ).
pH формально определяется как логарифмическая мера концентрации ионов водорода.Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды. Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, есть специальные устройства и методы, которые необходимо использовать и понимать, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE).
pH формально определяется как логарифмическая мера концентрации ионов водорода. Нейтрализация определяется как реакция ионов водорода и гидроксид-ионов с образованием воды.Также проводится различие между разбавленным / концентрированным (количество вещества) и слабым / сильным (степень ионизации). Наконец, необходимо использовать и понимать определенные устройства и методы, включая скорость реакции и титрование (см. Наши руководства по практической работе в спецификациях GCSE: rsc. li/2pIPwbD).
li/2pIPwbD).
Итого
- Кислые и щелочные растворы можно определить по химическим свойствам.
- Усилить твердую природу кислот, оснований и солей, чтобы учащиеся отошли от простого упоминания об объемных свойствах и антропоморфных описаниях, таких как «съел дыры».
- Сделайте явным связь между практической работой и основополагающими концепциями, используя макроскопические и субмикроскопические представления.
- Эта тема лежит в основе многих будущих тем, включая синтез и анализ химических веществ.
Кислотная соль — обзор
14.2.3 Безводные нанокомпозиты, наполненные твердой кислотой
Соли суперпротонных кислот — хорошо известные протонные проводники с общим составом M m H n (XO 4 ) (m + N) / 2 (M = K, Rb, NH 4 или Cs; X = S или Se) и CsH 2 (RO 4 ) (R = P или As).По структуре они делятся на нормальные кислоты и нормальные соли и содержат оксианионы, связанные водородными связями. Они претерпевают структурный фазовый переход при определенной температуре, и голые протоны подвижны в безводных состояниях из-за существования динамически неупорядоченной сети Н-связей (Баранов и др. , 1989) (рис. 14.11). Таким образом, суперпротонные фазы характеризуются быстрой диффузией протонов и интенсивными колебаниями тетраэдров XO 4 или RO 4 .Таким образом, протонная проводимость является внутренним свойством из-за идеальной кристаллической решетки, и любые структурные дефекты уменьшают протонную проводимость. Эти соединения не содержат в своей структуре молекул воды, поэтому обладают высокой термической и электрохимической стабильностью. Их проводимость не зависит от влажности воздуха и может быть увеличена за счет приготовления неорганических композитов с оксидами металлов с большой площадью поверхности (Пономарева и др. , 1996; Пономарева, Лаврова, 1998).
Они претерпевают структурный фазовый переход при определенной температуре, и голые протоны подвижны в безводных состояниях из-за существования динамически неупорядоченной сети Н-связей (Баранов и др. , 1989) (рис. 14.11). Таким образом, суперпротонные фазы характеризуются быстрой диффузией протонов и интенсивными колебаниями тетраэдров XO 4 или RO 4 .Таким образом, протонная проводимость является внутренним свойством из-за идеальной кристаллической решетки, и любые структурные дефекты уменьшают протонную проводимость. Эти соединения не содержат в своей структуре молекул воды, поэтому обладают высокой термической и электрохимической стабильностью. Их проводимость не зависит от влажности воздуха и может быть увеличена за счет приготовления неорганических композитов с оксидами металлов с большой площадью поверхности (Пономарева и др. , 1996; Пономарева, Лаврова, 1998).
14.11. Структурно-фазовый переход твердых кислот.
Наиболее известным соединением является CsHSO 4 , структура которого показана на рис. 14.12 2. Оно демонстрирует высокую протонную проводимость 10 −2 См / см при температурах> 141 ° C, где происходит фазовый переход и он суперпротонный. Как показано в Таблице 14.5 и на Рис. 14.13, температура суперпротонного перехода обычно составляет 70–250 ° C, и эти материалы обладают очень высокой проводимостью (от 10 –3 до 10 –1 См / см).Это делает эти материалы очень перспективными для использования в топливных элементах, работающих при средних температурах (100–250 ° C). Для получения более низкой температуры суперпротонного перехода и высокой проводимости были приготовлены новые твердые соединения, например, CsHSO 4 • CsH 2 PO 4 и CsHSO 4 • CsH 2 PO 4 (Crisholm and Haile , 2000; Haile et al. , 1995).
14.12 2. Оно демонстрирует высокую протонную проводимость 10 −2 См / см при температурах> 141 ° C, где происходит фазовый переход и он суперпротонный. Как показано в Таблице 14.5 и на Рис. 14.13, температура суперпротонного перехода обычно составляет 70–250 ° C, и эти материалы обладают очень высокой проводимостью (от 10 –3 до 10 –1 См / см).Это делает эти материалы очень перспективными для использования в топливных элементах, работающих при средних температурах (100–250 ° C). Для получения более низкой температуры суперпротонного перехода и высокой проводимости были приготовлены новые твердые соединения, например, CsHSO 4 • CsH 2 PO 4 и CsHSO 4 • CsH 2 PO 4 (Crisholm and Haile , 2000; Haile et al. , 1995).
14.12. Кристаллическая структура твердой кислоты CsHSO 4 : (а) моноклинная фаза II и (б) тетрагональная фаза III, где каждая позиция кислорода имеет половинное заполнение, а атомы водорода расположены в середине неупорядоченных водородных костей (пунктирные линии) .
Таблица 14.5. Различные твердые кислоты и их свойства
| Соединения | Температура перехода (° C) | Протонная проводимость (См / см) | Структура суперпротонной фазы | Ссылка |
|---|---|---|---|---|
| KHS14O 4 177 | 10 −1 выше 177 ° C | — | Баранов и др. , 2005 | |
| RbHSO 4 | — | ~ 10 −2 | — | Баранов и др., 2005 |
| RbHSeO 4 | 172 | ~ 10 −2 | — | Баранов и др. , 2005 |
| CsHSO 4 | 140 | 4 × 10 −2 при 200 ° C | — | Haile et al. , 2001 |
| CsHSeO 4 | 124 | ~ 10 −2 | — | Haile et al.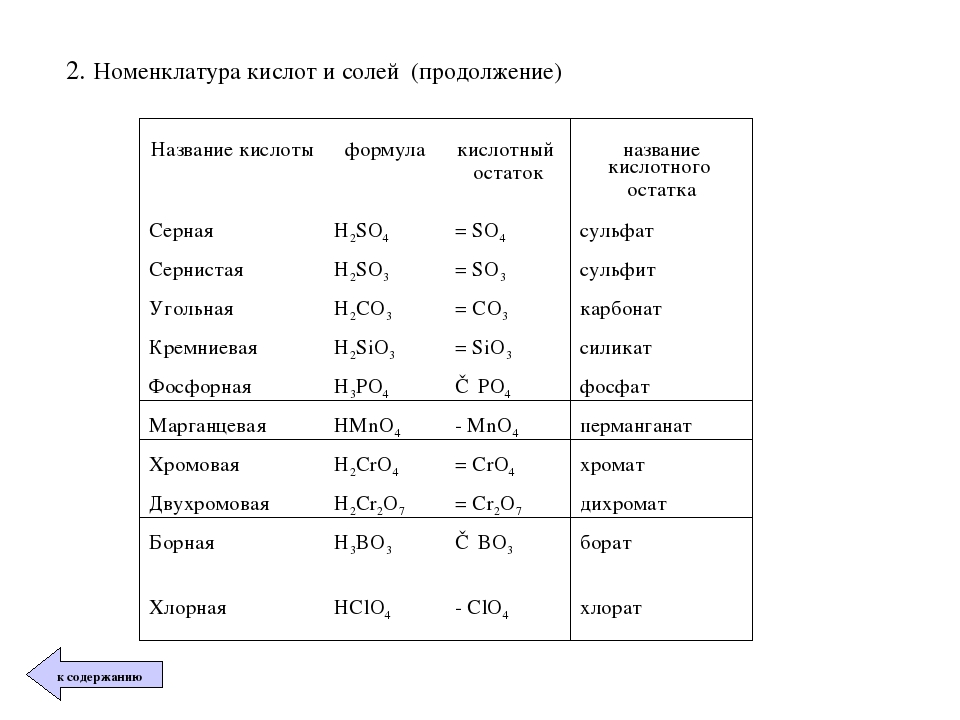 , 2001 , 2001 |
| Х3ПО 4 | 178 | 7 × 10 −5 при 185 ° C | Monoclinic | Ortiz et al., 1999 |
| RbH 2 PO 4 | 71 | 6,8 × 10 −2 при 340 ° C | Monoclinic | Ortiz et al. , 1999 |
| CsH 2 PO 4 | 230 | 2,2 × 10 −2 при 240 ° C | Кубический | Баранов и др. , 1989 |
| NH 4 H 2 PO 4 | 160 | 4 × 10 −2 при 180 ° C | Кубический | Баранов и др., 1989 |
| K 3 H (SO 4 ) 2 | 205 | 4 × 10 −3 при 208 ° C | — | Boysen et al. , 2004 |
| K 3 H (SeO 4 ) 2 | 117 | ~ 10 −3 при 127 ° C | Ромбоэдрический | Синицын и др. , 2000 , 2000 |
| Rb 3 H (SeO 4 ) 2 | 174 | 2 × 10 −4 при 186 ° C | Ромбоэдрический | Синицын и др., 2000 |
| Cs 3 H (SeO 4 ) 2 | 182 | ~ 2 × 10 −4 при 187 ° C | — | Boysen et al. , 2004 |
| (NH 4 ) 3 H (SeO 4 ) 2 | 27 | 4 × 10 −3 при 110 ° C | — | Boysen al. , 2004 |
14,13. Протонная проводимость твердых кислот при разных температурах.
Твердые кислоты являются хорошими кандидатами в протонпроводящие мембраны из-за их высокой протонной проводимости в безводном состоянии, что устраняет деликатную проблему управления водными ресурсами. Тем не менее, они также обладают серьезными недостатками, такими как хрупкость, узкий температурный диапазон для суперпротонной фазы (между температурой перехода и температурой плавления) (Piao et al. , 2009), химическая нестабильность (Baranov et al. , p. 2005), растворимость в воде и плохие механические свойства (Boysen et al., 2004). Поэтому их композиционные материалы направлены на объединение преимуществ твердых кислот для устранения этих недостатков. Однако этот тип нанокомпозитного материала до сих пор мало изучен по сравнению с другими типами неорганических наполнителей. В литературе можно было найти только предварительные исследования полимерных композитов на основе CsHSO 4 и поливинилиденфторида (PVDF) (Boysen et al. , 2000) и CsHSO 4 с поли (акрилонитрилом) (Andronie и другие., 2008 г.).
, 2009), химическая нестабильность (Baranov et al. , p. 2005), растворимость в воде и плохие механические свойства (Boysen et al., 2004). Поэтому их композиционные материалы направлены на объединение преимуществ твердых кислот для устранения этих недостатков. Однако этот тип нанокомпозитного материала до сих пор мало изучен по сравнению с другими типами неорганических наполнителей. В литературе можно было найти только предварительные исследования полимерных композитов на основе CsHSO 4 и поливинилиденфторида (PVDF) (Boysen et al. , 2000) и CsHSO 4 с поли (акрилонитрилом) (Andronie и другие., 2008 г.).
Первый отчет о применении CsHSO 4 в топливном элементе был в 2001 году (Haile et al. , 2001). Эта система могла работать при 150–160 ° C в конфигурации H 2 / O 2 с напряжением холостого хода 1,1 В и плотностью тока короткого замыкания 44 мА / см 2 . Он также был стабильным во влажной среде, но по своим характеристикам был значительно ниже, чем у эквивалентных композитных полимерных мембран, работающих при 130–140 ° C (Costamagna et al. , 2002). Позже те же группы использовали электролитную мембрану CsH 2 PO 4 в топливном элементе, работающем при 250 ° C. Ячейка работала стабильно, и пиковая и максимальная плотности мощности составляли 48,9 мВт / см 2 и 301 мА / см 2 (короткое замыкание), соответственно. Это был очень положительный результат, но проводимость CsH 2 PO 4 при низких температурах (<140 ° C) была очень низкой (10 -6 См / см). Следовательно, вполне вероятно, что эти топливные элементы могут иметь ряд проблем с запуском при использовании в циклических приложениях (например, в автомобилях).
, 2002). Позже те же группы использовали электролитную мембрану CsH 2 PO 4 в топливном элементе, работающем при 250 ° C. Ячейка работала стабильно, и пиковая и максимальная плотности мощности составляли 48,9 мВт / см 2 и 301 мА / см 2 (короткое замыкание), соответственно. Это был очень положительный результат, но проводимость CsH 2 PO 4 при низких температурах (<140 ° C) была очень низкой (10 -6 См / см). Следовательно, вполне вероятно, что эти топливные элементы могут иметь ряд проблем с запуском при использовании в циклических приложениях (например, в автомобилях).
Было проведено больше исследований смеси твердых кислот с частицами оксидов. Гетерогенное легирование высокодисперсными инертными оксидами показало заметное увеличение протонной проводимости для некоторых твердых кислот, в частности, при температурах ниже, чем температура суперпротонов (Otomo et al. , 2008; Saito et al. , 2009). В этих композитах имело место сильное поверхностное взаимодействие компонентов, которое привело не только к стабилизации новой фазы на поверхности оксида, но и к изменению объемных свойств солей (Лаврова, Пономарева, 2008). ).Часто используемые оксидные частицы являются пористыми, и влияние их пористости на проводимость было изучено. Однако низкотемпературная протонная проводимость этих композитов остается неясной, но часто утверждают, что твердая кислота принимает аморфную фазу с высокой протонопроводящей способностью в мезопорах при более низких температурах (Лаврова и Пономарева, 2008). Другое объяснение могло бы заключаться в существовании метастабильной фазы во время охлаждения композитов, вызванной упругими силами сдвига (Otomo et al., 2008 г.). Окончательное объяснение будет заключаться в том, что изменение кристаллической структуры и усиление межфазного взаимодействия между двумя фазами в композите приводит к более низкой температуре плавления для твердой кислоты в композите, чем для чистой твердой кислоты (Piao et al.
, 2009). В этих композитах имело место сильное поверхностное взаимодействие компонентов, которое привело не только к стабилизации новой фазы на поверхности оксида, но и к изменению объемных свойств солей (Лаврова, Пономарева, 2008). ).Часто используемые оксидные частицы являются пористыми, и влияние их пористости на проводимость было изучено. Однако низкотемпературная протонная проводимость этих композитов остается неясной, но часто утверждают, что твердая кислота принимает аморфную фазу с высокой протонопроводящей способностью в мезопорах при более низких температурах (Лаврова и Пономарева, 2008). Другое объяснение могло бы заключаться в существовании метастабильной фазы во время охлаждения композитов, вызванной упругими силами сдвига (Otomo et al., 2008 г.). Окончательное объяснение будет заключаться в том, что изменение кристаллической структуры и усиление межфазного взаимодействия между двумя фазами в композите приводит к более низкой температуре плавления для твердой кислоты в композите, чем для чистой твердой кислоты (Piao et al. , 2009 ).
, 2009 ).
Наблюдалось, что диспергирование частиц SiO 2 в твердо-кислотной матрице улучшает механические свойства мембраны (Бондаренко, и др., , 2009). Введение CsH 2 PO 4 в пористые мембраны из анодного оксида алюминия дало высокую выходную мощность при комнатной температуре, и, кроме того, опора мембраны из анодного оксида алюминия гарантирует работу топливного элемента с хорошей воспроизводимостью без какой-либо внешней поддержки (Bocchetta et al. ., 2009 г.).
Безводные кислоты обычно страдают плохими механическими свойствами и растворимостью в воде, а также чрезмерной пластичностью и объемным расширением при повышении температуры. Однако, когда они встроены в каналы полимерной мембраны, они могут быть очень полезны при высоких температурах, поскольку их проводимость не зависит от влажности. Однако до того, как твердые кислоты можно будет использовать в топливных элементах, все еще остаются технологические проблемы: (а) изготовление тонких, непроницаемых твердокислотных мембран, (б) улучшение характеристик электрода и (в) конструкция системы для защиты электролита. от жидкой воды во время отключения топливного элемента (Haile et al., 2004).
от жидкой воды во время отключения топливного элемента (Haile et al., 2004).
ЦЕЛИ:
Список ингредиентов практически любого домашнего продукта обязательно должен включать хотя бы одно соединение, которое химики классифицируют как соль. Хотя вы можете думать о соли как о белых гранулах, используемых для ароматизации пищевых продуктов (известных химиками как хлорид натрия, NaCl), химики классифицируют многие соединения как соли.Для химиков соль — это любое ионное соединение, которое могло образоваться в результате кислотно-щелочной реакции. Хлорид натрия подходит под это определение, поскольку он может быть образован реакцией соляной кислоты и гидроксида натрия: HCl + NaOH NaCl + H 2 O При объединении любой кислоты и основания происходит обмен реакция происходит, производя соль и воду. HA + BOH BA + H 2 O Отрицательный ион соли (A — ) является сопряженным основанием кислоты HA, а положительный ион соли (B + ) является сопряженной кислотой основания BOH.В зависимости от силы кислоты и основания полученный раствор может быть кислым, основным или нейтральным. Если силы исходной кислоты (HA) и основания (BOH) известны, можно определить силу их сопряженной кислоты и основания, поскольку константы ионизации сопряженных кислотно-основных пар связаны: K a x K b = K w = 1,0 x 10 -14 Завершено следующие заявления: Хорошо!
Эта взаимосвязь также наблюдается с основаниями и их сопряженными кислотами.Если BOH — очень сильное основание, B + будет очень слабой кислотой.
и не повлияет на pH раствора.
А
сильная кислота — это кислота, которая полностью ионизируется в воде. Предположим слабая кислота имеет константу ионизации 1,0 x 10 -4 . В Константа ионизации его сопряженного основания будет 1,0 x 10 -10 . Как бы вы классифицировали силу этой базы? А теперь предположим слабый кислота имеет константу ионизации 1.0 x 10 -11 . Ионизация Константа его сопряженного основания будет 1,0 x 10 -3 . Было бы сила этой базы должна быть в той же классификации, что и первая пример? Помните что основание (если оно не очень слабое, ) вызовет pH раствор для увеличения. А очень слабое основание не повлияет на pH раствора. |
14.4 Гидролиз солевых растворов — Химия
Цели обучения
К концу этого раздела вы сможете:
- Предсказать, будет ли солевой раствор кислым, основным или нейтральным
- Рассчитать концентрации различных веществ в солевом растворе
- Опишите процесс, при котором растворы некоторых ионов металлов становятся кислыми
Как мы видели в разделе о химических реакциях, когда кислота и основание смешиваются, они подвергаются реакции нейтрализации.Слово «нейтрализация», по-видимому, подразумевает, что стехиометрически эквивалентный раствор кислоты и основания будет нейтральным. Иногда это верно, но соли, которые образуются в этих реакциях, могут обладать собственными кислотными или основными свойствами, как мы сейчас увидим.
Раствор считается нейтральным, если он содержит равные концентрации ионов гидроксония и гидроксида. Когда мы смешиваем растворы кислоты и основания, происходит кислотно-щелочная реакция нейтрализации.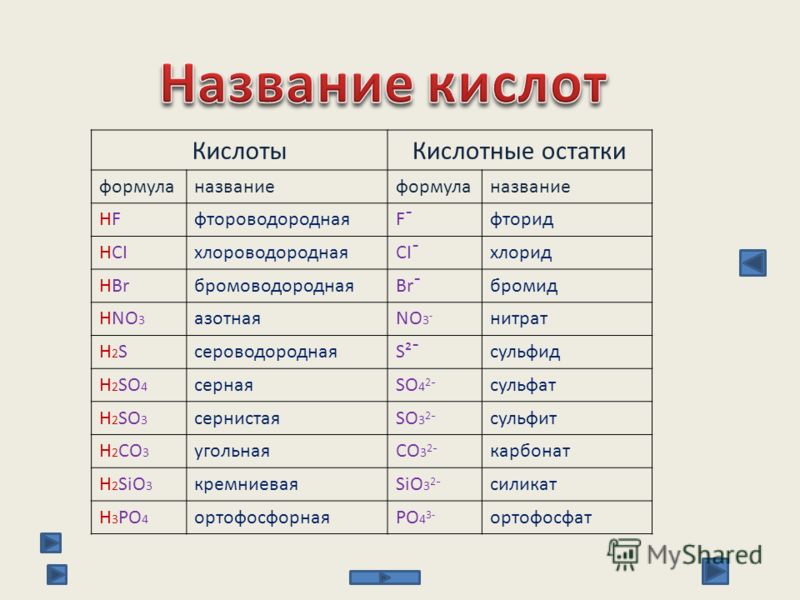 Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным.Он может содержать либо избыток ионов гидроксония, либо избыток гидроксид-ионов, поскольку природа образующейся соли определяет, будет ли раствор кислотным, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут возникать после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
Однако, даже если мы смешаем стехиометрически эквивалентные количества, мы можем обнаружить, что полученный раствор не является нейтральным.Он может содержать либо избыток ионов гидроксония, либо избыток гидроксид-ионов, поскольку природа образующейся соли определяет, будет ли раствор кислотным, нейтральным или основным. Следующие четыре ситуации иллюстрируют, как растворы с различными значениями pH могут возникать после реакции нейтрализации с использованием стехиометрически эквивалентных количеств:
- Сильная кислота и сильное основание, такие как HCl ( водн. ) и NaOH ( водн. ), будут реагировать с образованием нейтрального раствора, поскольку полученные конъюгированные партнеры имеют незначительную силу (см. Главу 14.3 Относительная сила кислот и оснований):
[латекс] \ text {HCl} (aq) \; + \; \ text {NaOH} (aq) \; {\ rightleftharpoons} \; \ text {NaCl} (aq) \; + \; \ text {H } _2 \ text {O} (l) [/ латекс]
- Сильная кислота и слабое основание образуют слабокислый раствор не из-за задействованной сильной кислоты, а из-за сопряженной кислоты слабого основания.

- Слабая кислота и сильное основание дают слабощелочной раствор. Раствор слабой кислоты реагирует с раствором сильного основания с образованием сопряженного основания слабой кислоты и сопряженной кислоты сильного основания.Конъюгированная кислота сильного основания является более слабой кислотой, чем вода, и не влияет на кислотность полученного раствора. Однако сопряженное основание слабой кислоты является слабым основанием и слегка ионизируется в воде. Это увеличивает количество гидроксид-иона в растворе, образующемся в реакции, и делает его слегка щелочным.
- Слабая кислота плюс слабое основание могут давать кислотный, основной или нейтральный раствор. Это самый сложный из четырех типов реакций. Когда конъюгированная кислота и конъюгат основания имеют неодинаковые силы, раствор может быть либо кислотным, либо основным, в зависимости от относительной силы двух конъюгатов.Иногда слабая кислота и слабое основание будут иметь одинаковую силу и , поэтому их соответствующие конъюгированные основание и кислота будут иметь одинаковую силу, и раствор будет нейтральным.
 Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения конъюгатов K .
Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения конъюгатов K .
Желудочные антациды
Наши желудки содержат раствор примерно 0,03 M HCl, который помогает нам переваривать пищу, которую мы едим.Чувство жжения, связанное с изжогой, является результатом утечки желудочной кислоты через мышечный клапан в верхней части желудка в нижнюю часть пищевода. Выстилка пищевода не защищена от разъедающего воздействия желудочной кислоты, как слизистая оболочка желудка, и результаты могут быть очень болезненными. Когда у нас изжога, мы чувствуем себя лучше, если уменьшаем избыток кислоты в пищеводе с помощью антацидов. Как вы уже догадались, антациды — это основы.Одним из наиболее распространенных антацидов является карбонат кальция CaCO 3 . Реакция,
[латекс] \ text {CaCO} _3 (s) \; + \; 2 \ text {HCl} (aq) \; {\ rightleftharpoons} \; \ text {CaCl} _2 (aq) \; + \; \ текст {H} _2 \ text {O} (l) \; + \; \ text {CO} _2 (g) [/ latex]
не только нейтрализует желудочную кислоту, но и производит CO 2 ( г, ), что может вызвать удовлетворительную отрыжку.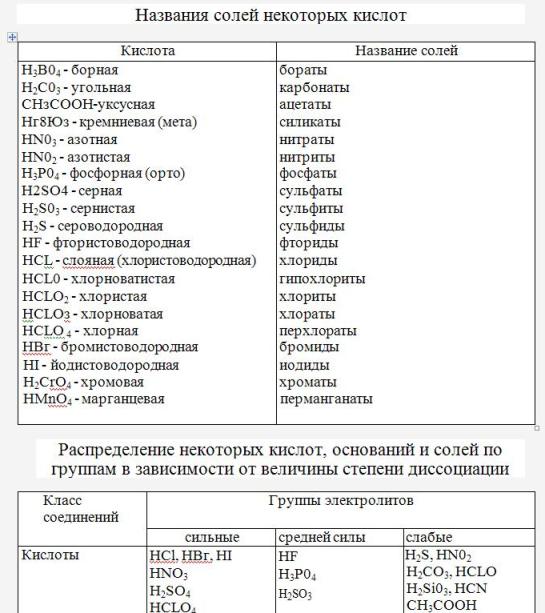
Молоко магнезии представляет собой суспензию труднорастворимого основного гидроксида магния, Mg (OH) 2 .{-} \; {\ rightleftharpoons} \; 2 \ text {H} _2 \ text {O} (l) [/ latex]
При этой реакции не образуется углекислый газ, но антациды, содержащие магний, могут оказывать слабительное действие.
Некоторые антациды содержат гидроксид алюминия, Al (OH) 3 , в качестве активного ингредиента. Гидроксид алюминия имеет тенденцию вызывать запоры, а некоторые антациды используют гидроксид алюминия вместе с гидроксидом магния, чтобы сбалансировать побочные эффекты двух веществ.
Кулинарные аспекты химии
Кулинария — это синтетическая химия, которую можно употреблять в пищу.В кулинарном мире существует ряд примеров кислотно-щелочной химии. Одним из примеров является использование пищевой соды или бикарбоната натрия в выпечке. NaHCO 3 — основание. Когда он вступает в реакцию с кислотой, такой как лимонный сок, пахта или сметана в жидком тесте, в результате разложения образовавшейся угольной кислоты образуются пузырьки углекислого газа, и тесто «поднимается». Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислотных солей, которые вступают в реакцию, когда два химических вещества вступают в контакт с водой в жидком тесте.
Разрыхлитель представляет собой комбинацию бикарбоната натрия и одной или нескольких кислотных солей, которые вступают в реакцию, когда два химических вещества вступают в контакт с водой в жидком тесте.
Многие люди любят добавлять в приготовленную рыбу лимонный сок или уксус, которые являются кислотами (рис. 1). Оказывается, в системе рыб есть летучие амины (основания), которые нейтрализуются кислотами с образованием нелетучих солей аммония. Это уменьшает запах рыбы, а также добавляет «кислый» вкус, который нам нравится.
Рис. 1. Реакция нейтрализации происходит между лимонной кислотой в лимонах или уксусной кислотой в уксусе и основаниями в мясе рыбы. Маринование — это метод консервирования овощей в кислой среде естественного происхождения. Овощ, например огурец, помещают в герметичную банку, погруженную в рассол. Рассол способствует росту полезных бактерий и подавляет рост вредных бактерий. Полезные бактерии питаются крахмалом в огурце и производят молочную кислоту в качестве побочного продукта в процессе, называемом ферментацией. Молочная кислота в конечном итоге увеличивает кислотность рассола до уровня, который убивает любые вредные бактерии, которым необходима щелочная среда.Без вредных бактерий, потребляющих огурцы, они могут прожить гораздо дольше, чем если бы они были незащищенными. Побочный продукт процесса маринования изменяет вкус овощей из-за кислоты, делая их кислыми на вкус.
Молочная кислота в конечном итоге увеличивает кислотность рассола до уровня, который убивает любые вредные бактерии, которым необходима щелочная среда.Без вредных бактерий, потребляющих огурцы, они могут прожить гораздо дольше, чем если бы они были незащищенными. Побочный продукт процесса маринования изменяет вкус овощей из-за кислоты, делая их кислыми на вкус.
Когда мы нейтрализуем слабое основание сильной кислотой, продукт представляет собой соль, содержащую сопряженную кислоту слабого основания. Эта сопряженная кислота является слабой кислотой. Например, хлорид аммония, NH 4 Cl, представляет собой соль, образованную реакцией слабого основного аммиака с сильной кислотой HCl:
[латекс] \ text {NH} _3 (aq) \; + \; \ text {HCl} (aq) \; {\ longrightarrow} \; \ text {NH} _4 \ text {Cl} (aq) [/ латекс]
Раствор этой соли содержит ионы аммония и ионы хлорида.{\; \; +} [/ latex] из значения константы ионизации воды, K w и K b , константы ионизации сопряженного с ней основания, NH 3 , используя следующие отношения:
[латекс] K _ {\ text {w}} = K _ {\ text {a}} \; \ times \; K _ {\ text {b}} [/ латекс]
Это соотношение сохраняется для любого основания и сопряженной с ним кислоты или для любой кислоты и сопряженного с ним основания. {\; \; +} [/ latex] равно 2.{\; \; +} [/ latex] — более сильная кислота.
{\; \; +} [/ latex] равно 2.{\; \; +} [/ latex] — более сильная кислота.
Когда мы нейтрализуем слабую кислоту сильным основанием, мы получаем соль, содержащую сопряженное основание слабой кислоты. Это сопряженное основание обычно является слабым основанием. Например, ацетат натрия, NaCH 3 CO 2 , представляет собой соль, образованную реакцией слабокислой уксусной кислоты с сильным основным гидроксидом натрия:
[латекс] \ text {CH} _3 \ text {CO} _2 \ text {H} (aq) \; + \; \ text {NaOH} (aq) \; {\ longrightarrow} \; \ text {NaCH} _3 \ text {CO} _2 (aq) \; + \; \ text {H} _2 \ text {O} (aq) [/ latex]
Раствор этой соли содержит ионы натрия и ионы ацетата.{-10} [/ латекс]
В некоторых справочниках не указаны значения K b . Они сообщают только константы ионизации для кислот. Если мы хотим определить значение K b с помощью одного из этих справочников, мы должны найти значение K a для конъюгированной кислоты и преобразовать его в значение K b .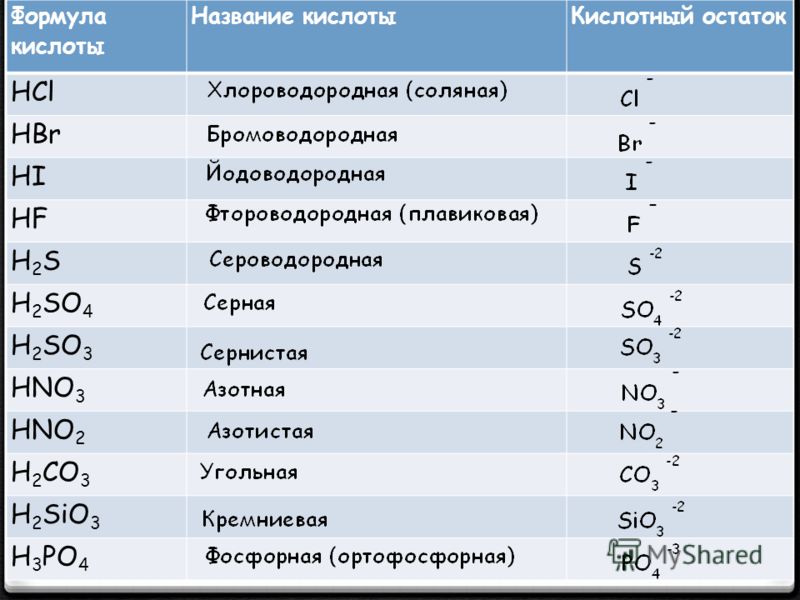 {\; \; -}] = 0.{-10} [/ латекс]
{\; \; -}] = 0.{-10} [/ латекс]
Решая это уравнение, мы получаем [CH 3 CO 2 H] = 1,1 × 10 −5 M .
Проверьте свои знания
Каков pH 0,083- M раствора CN —? Используйте 4,9 × 10 −10 как K a для HCN. Подсказка: нам, вероятно, потребуется преобразовать pOH в pH или найти [H 3 O + ], используя [OH — ] на заключительных этапах решения этой проблемы.
В растворе соли, образованной реакцией слабой кислоты и слабого основания, чтобы предсказать pH, мы должны знать как K a слабой кислоты, так и K b слабая база.Если K a > K b , раствор является кислым, а если K b > K a , раствор является основным.
Пример 3
Определение кислотной или основной природы солей
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) KBr
(б) NaHCO 3
(в) NH 4 Класс
(г) Na 2 HPO 4
(e) NH 4 F
Раствор
Рассмотрим каждый из ионов отдельно с точки зрения его влияния на pH раствора, как показано здесь:
(a) Катион K + и анион Br — являются зрителями, поскольку они являются катионом сильного основания (KOH) и анионом сильной кислоты (HBr) соответственно. {\; \; +} [/ latex] составляет 5,6 × 10 −10 , что кажется очень маленьким, но K b из F — составляет 1,4 × 10 −11 , поэтому решение является кислым, так как K a > K b .
{\; \; +} [/ latex] составляет 5,6 × 10 −10 , что кажется очень маленьким, но K b из F — составляет 1,4 × 10 −11 , поэтому решение является кислым, так как K a > K b .
Проверьте свои знания
Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) K 2 CO 3
(б) CaCl 2
(в) KH 2 PO 4
(г) (NH 4 ) 2 CO 3
(e) AlBr 3
Ответ:
(а) базовый; (б) нейтральный; (c) базовая; (г) базовая; (д) кислая
Если мы измерим pH растворов различных ионов металлов, мы обнаружим, что эти ионы действуют как слабые кислоты, когда находятся в растворе.{\; \; -} (водн.) [/ латекс]
Мы часто видим формулу этого иона просто как «Al 3+ ( вод. (гидратированный). Это похоже на упрощение формулы иона гидроксония, H 3 O + до H + . Однако в этом случае гидратированный ион алюминия представляет собой слабую кислоту (рис. 2) и отдает протон молекуле воды.{+} (aq) \; + \; \ text {Al (H} _2 \ text {O}) _ 3 (\ text {OH}) _ 3 (aq) \ end {array} [/ latex]
(гидратированный). Это похоже на упрощение формулы иона гидроксония, H 3 O + до H + . Однако в этом случае гидратированный ион алюминия представляет собой слабую кислоту (рис. 2) и отдает протон молекуле воды.{+} (aq) \; + \; \ text {Al (H} _2 \ text {O}) _ 3 (\ text {OH}) _ 3 (aq) \ end {array} [/ latex]
Обратите внимание, что некоторые из этих разновидностей алюминия проявляют амфипротическое поведение, поскольку они действуют как кислоты, когда они появляются в левой части выражений равновесия, и как основания, когда они появляются в правой части.
Рис. 2. Когда ион алюминия реагирует с водой, гидратированный ион алюминия становится слабой кислотой.Однако ионизация катиона, несущего более одного заряда, обычно не происходит за пределами первой стадии.{2 +}] [/ latex] в 0,15- M растворе Al (NO 3 ) 3 , который содержит достаточно сильной кислоты HNO 3 , чтобы получить [H 3 O + ] до 0,10 M ?
Константы для различных стадий ионизации для многих ионов металлов неизвестны, поэтому мы не можем рассчитать степень их ионизации. Однако практически все гидратированные ионы металлов, кроме ионов щелочных металлов, ионизируются с образованием кислых растворов. Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Однако практически все гидратированные ионы металлов, кроме ионов щелочных металлов, ионизируются с образованием кислых растворов. Ионизация увеличивается по мере увеличения заряда иона металла или уменьшения размера иона металла.
Характерные свойства водных растворов кислот Бренстеда-Лоури обусловлены присутствием ионов гидроксония; водные растворы оснований Бренстеда-Лоури обусловлены присутствием гидроксид-ионов. Нейтрализация, которая происходит при объединении водных растворов кислот и оснований, является результатом реакции ионов гидроксония и гидроксида с образованием воды. Некоторые соли, образующиеся в реакциях нейтрализации, могут сделать растворы продуктов слабокислыми или слабощелочными.
Растворы, содержащие соли или гидратированные ионы металлов, имеют pH, который определяется степенью гидролиза ионов в растворе. PH растворов может быть рассчитан с использованием известных методов равновесия, или он может быть качественно определен как кислотный, основной или нейтральный в зависимости от относительных K a и K b вовлеченных ионов.
Химия: упражнения в конце главы
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(a) Al (NO 3 ) 3
(б) РБИ
(в) KHCO 2
(г) CH 3 NH 3 Br
- Определите, являются ли водные растворы следующих солей кислотными, основными или нейтральными:
(а) FeCl 3
(б) К 2 CO 3
(в) NH 4 Br
(г) KClO 4
- Новокаин, C 13 H 21 O 2 N 2 Cl, представляет собой соль основного прокаина и соляной кислоты.Константа ионизации новокаина составляет 7 · 10 −6 . Кислый или щелочной раствор новокаина? Что такое [H 3 O + ], [OH –] и pH 2,0% -ного по массе раствора новокаина, при условии, что плотность раствора составляет 1,0 г / мл.

Решения
Ответы на упражнения по химии в конце главы
2. (а) кислая; (б) базовый; (в) кислая; (г) нейтральный
Кислоты и Основания — Соли, Кислоты и Основания
Соли, Кислоты и Основания
Передайте Соль, Кислоту и Основание Пожалуйста,
В этом разделе мы поговорим о маленьком грязном секрете, который могут имеют кислую или щелочную тенденцию.Здесь соль будет относиться к молекуле, которая полностью диссоциирует при добавлении в водный раствор, которым в нашем случае будет вода.
Большинство людей знакомы с хорошей старой поваренной солью или, как говорят химики, с NaCl. (На самом деле, поваренная соль имеет более тонкие нюансы и, откровенно говоря, более восхитительна, чем простой старый NaCl — на ваш взгляд, химики.) NaCl — это пример соли, которая не имеет кислотных или основных свойств при растворении в растворе.
Причина, по которой NaCl не изменяет pH раствора, заключается в том, что катион (Na + ) и анион (Cl — ), которые образуются при растворении NaCl, являются действительно слабыми кислотами и основаниями. Мы знаем это, потому что их сопряженные кислоты и основания действительно сильные кислоты и основания. Основание конъюгата Na + представляет собой NaOH, а сопряженная кислота Cl — представляет собой HCl.
Мы знаем это, потому что их сопряженные кислоты и основания действительно сильные кислоты и основания. Основание конъюгата Na + представляет собой NaOH, а сопряженная кислота Cl — представляет собой HCl.
Посмотрите, насколько малы эти константы диссоциации. Эти константы диссоциации говорят нам, что реакция будет лежать очень лево. Если мы дадим этим уравнениям вращение на 180 °, это может иметь больше смысла, потому что NaOH и HCl являются сильным основанием и сильной кислотой соответственно. В растворе они почти полностью диссоциируют.Между прочим, объединение HCl и NaOH в равных пропорциях приводит к нейтральному раствору Na + и Cl —. Комбинирование любой сильной кислоты и сильного основания приводит к нейтральному раствору.
Для справки, вот некоторые катионы и анионы, которые не реагируют с водой с образованием кислотных или основных растворов:
- Катионы:
- Щелочные металлы из группы 1A: Li + , Na + , и K +
- Щелочноземельные металлы из группы 2A: Ca 2+ , Sr 2+ и Ba 2+
- Щелочные металлы из группы 1A: Li + , Na + , и K +
- Анионы:
- Cl — , Br — , I — , NO 3 — и ClO 4 —
Ситуация становится опасной, когда определенный катион или анион из соли действительно вступает в реакцию с водой. Одним из примеров соли, которая дает кислотный раствор, является соль NH 4 Cl (хлорид аммония). Когда NH 4 Cl растворяется в воде, молекула распадается на анионы NH 4 + и Cl —. Выше мы показали, что Cl — не будет существенно взаимодействовать с водой, потому что его партнер по конъюгату является сильной кислотой, но NH 4 + будет реагировать с водой в некоторой небольшой степени, действуя как кислота и передавая протон:
Одним из примеров соли, которая дает кислотный раствор, является соль NH 4 Cl (хлорид аммония). Когда NH 4 Cl растворяется в воде, молекула распадается на анионы NH 4 + и Cl —. Выше мы показали, что Cl — не будет существенно взаимодействовать с водой, потому что его партнер по конъюгату является сильной кислотой, но NH 4 + будет реагировать с водой в некоторой небольшой степени, действуя как кислота и передавая протон:
Если бы мы захотели, мы могли бы вычислить все виды, присутствующие в растворе NH 4 Cl, рассматривая NH 4 + , выделяемый солью, как слабый кислотный раствор.Не волнуйся. У вас будет возможность сделать это позже в примерах задач.
Оказывается, соли также могут обладать основными свойствами, когда они выделяют ионы, которые реагируют с водой с образованием OH — . Например, соль NaCN выделяет как катион Na + , который не реагирует, с водой, потому что его сопряженное основание действительно сильное, так и анион CN —, который действительно реагирует с водой, потому что его конъюгат кислота слабая. Чего-чего?
Чего-чего?
Взгляните на химическое уравнение для CN — , действующего как основание:
Обратите внимание, что конъюгированная кислота, HCN, является слабой кислотой, которая не любит полностью диссоциировать.Некоторые из CN — будут реагировать с образованием HCN. Опять же, чтобы рассчитать равновесные концентрации и значения pH, вы можете использовать ту же процедуру, которую мы использовали ранее.
Наконец, возможно, что растворение соли в воде может привести к образованию анионов и катионов, которые реагируют с водой с образованием H 3 O + и OH —. Пусть начнется битва за протоны.
Если катион (обычно действующий как кислота) сильнее аниона (обычно действующего как основание), то катион победит, и раствор будет кислым.Если анион побеждает и действует как основание, то раствор будет основным. Вот пример реакции соли NH 4 F с водой при растворении в растворе:
Сравнение констант диссоциации, приведенных выше, показывает, что NH 4 + является более сильным из двух ионов. Поскольку это кислота, она вытесняет анион F — , и раствор будет кислым.
Поскольку это кислота, она вытесняет анион F — , и раствор будет кислым.
Вот правила определения pH любого солевого раствора:
- Если K a > K b , раствор будет иметь больше H 3 O + и pH будет меньше 7.
- Если K a < K b , раствор будет иметь больше OH — и pH будет больше 7.
- Если K a ≈ K b раствор будет содержать примерно равные количества H 3 O + и OH —, а pH будет приблизительно 7. Если значения константы диссоциации приблизительно равны или меньше константы диссоциации для воды (1 × 10 -14 ), тогда раствор будет иметь значение pH примерно 7.
Кислотные основы и соли | Свойства кислот, оснований и солей
Кислоты, основания и соли влияют на химию, а также на нашу повседневную жизнь. Их легко определить по вкусу; то есть кислоты имеют кислый вкус, а основания горькие, а сами соли имеют соленый вкус.
Их легко определить по вкусу; то есть кислоты имеют кислый вкус, а основания горькие, а сами соли имеют соленый вкус.
Кислоты обычно содержатся во многих веществах, включая различные продукты питания, но их присутствие во многих фруктах очень заметно, например:
Кроме них, есть некоторые кислоты, которые широко используются в лаборатории, такие как соляная кислота, серная кислота и азотная кислота.
Обычно основы используются в бытовых чистящих средствах только для удаления жира с окон и полов, а также в мыле, зубной пасте, яичных белках, жидкостях для мытья посуды и бытовом аммиаке.
Наше тело содержит некоторые очень распространенные кислоты в желудке, такие как разбавленная соляная кислота, которая вызывает расстройство пищеварения. Когда содержимое желудка становится слишком кислым, обычно возникает несварение желудка и ощущение жжения в желудке.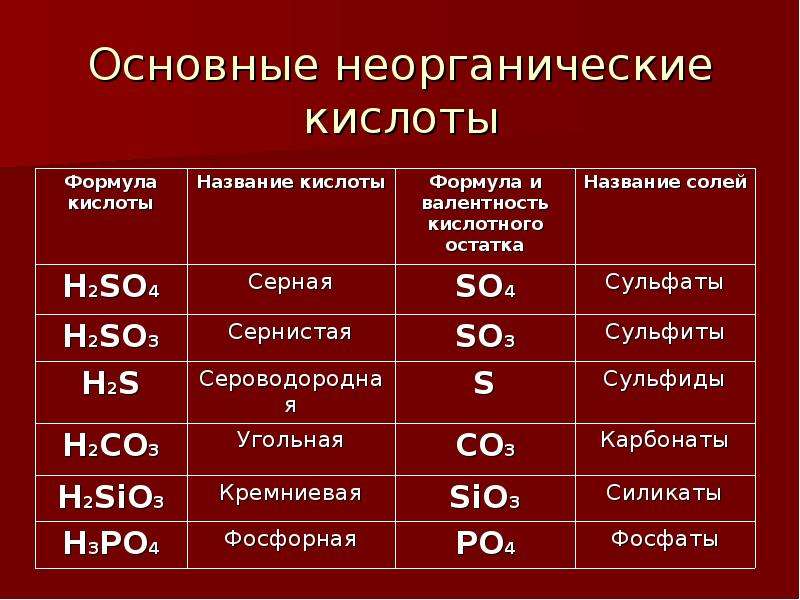
Кислоты и основания также регулируют некоторые метаболические процессы в организме человека посредством процесса равновесия. Укусы пчел имеют кислую природу, в то время как укусы ос имеют щелочную природу.
Все кислоты при реакции с металлами выделяют водород. Водород обычно является общим для всех кислот.
Кислота + Металл = Соль + Водород
Свойства кислот
HCl + H 2 O → H + + Cl —
Zn + 2HCl → ZnCl₂ + H₂
Когда кислоты реагируют с известняком (CaCO₃), образуется диоксид углерода.Например, HCl реагирует с известняком с образованием угольной кислоты и хлорида кальция.
CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
Кислоты подразделяются на органические и неорганические.
 Лучшим примером органической кислоты является уксусная кислота CH₃COOH, а неорганические кислоты — это кислоты, полученные из минералов; например, серная кислота H₂SO₄, соляная кислота и т. д.
Лучшим примером органической кислоты является уксусная кислота CH₃COOH, а неорганические кислоты — это кислоты, полученные из минералов; например, серная кислота H₂SO₄, соляная кислота и т. д.
По количеству ионов водорода кислоты можно классифицировать как:
1.+} \] ионов на моль кислоты, \ [ex — {H_3} P {O_4} \].
На основании способности отдавать ионы водорода кислоты можно классифицировать как:
Сильные кислоты: Эти кислоты полностью (100%) ионизируются в водных растворах. Таким образом, при равновесии концентрация молекул кислоты становится очень меньшей, а концентрация иона водорода достигает максимума; например, \ [HCl, \; HN {O_3}, \; HCl {O_4} \].
Слабые кислоты: Эти кислоты только частично ионизируются в растворе в равновесном состоянии.В равновесном состоянии молекулы кислоты присутствуют в значительном количестве, а концентрация иона водорода меньше, например, \ [HF, \; C {H_3} COOH \]. — \]
— \]
Слабые основания: это основания, которые частично ионизированы, и равновесие в основном находится на стороне реагентов, т.е.- \]
Свойства солей:
Соли образуются путем сочетания кислоты и основания в результате реакции нейтрализации.
Кислая и основная природа солей обычно зависит от кислоты и основания, из которых соль выделяется в реакции нейтрализации.
Пример:
\ [NaOH + HCl \ to NaCl + {H_2} O \]
\ [HCl {\ text {}} + {\ text {}} N {H_4} OH {\ текст {}} \ to {\ text {}} N {H_4} Cl {\ text {}} + {\ text {}} {H_2} O \]
\ [C {H_3} COOH {\ text {} } + {\ text {}} NaOH {\ text {}} \ to {\ text {}} C {H_3} COONa {\ text {}} + {\ text {}} {H_2} O \]
\ [C {H_3} COOH {\ text {}} + {\ text {}} N {H_4} OH {\ text {}} \ to {\ text {}} C {H_3} COON {H_4} + {\ text {}} {H_2} O \]
Самая известная или обычная соль — это хлорид натрия или поваренная соль, которая образована комбинацией сильного основного гидроксида натрия и сильнокислой соляной кислоты.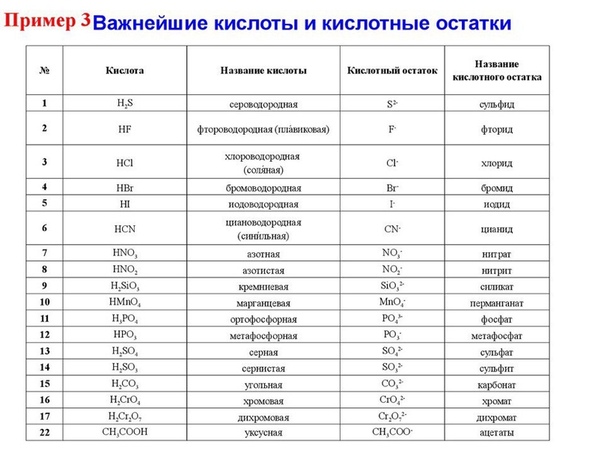
\ [HC {l _ {(aq)}} + NaO {H _ {(aq)}} \ to NaC {l _ {(aq)}} + {H_2} {O _ {(l)}} \]
Другие примеры включают английскую соль \ [(MgS {O_4}) \], которая используется в солях для ванн, нитрат аммония \ [(N {H_4} N {O_3}) \], используемый в качестве удобрения, и пищевую соду \ [(NaHC {O_3}) \] используется в кулинарии.
pH раствора соли также зависит от силы кислот и оснований, которые объединяются в реакции нейтрализации.
Добавление кислот или оснований в воду:
Процесс растворения кислоты или основания в воде сильно экзотермичен.Поскольку в этой реакции обычно выделяется много тепла, необходимо соблюдать особую осторожность при смешивании концентрированных кислот с водой, особенно когда азотная кислота или серная кислота смешиваются с водой.
Правила: Кислоту следует добавлять медленно в воду при непрерывном и постоянном перемешивании, в противном случае смесь может выплеснуться и вызвать ожоги.
Стеклянная емкость также может разбиться из-за чрезмерного нагрева, что может привести к ее повреждению.-}) \] на единицу объема, тем самым легко рассеивая эффект тепла.
Кислотные и основные солевые растворы: объяснение и примеры — видео и стенограмма урока
Что такое соль?
Прежде чем мы перейдем к определению pH солевого раствора, давайте сделаем небольшой шаг назад и определим для вас несколько важных терминов. Во-первых, этот урок посвящен солям. Соль представляет собой твердое ионное вещество, состоящее из двух ионов: положительного катиона и отрицательного аниона.Катион — это любой положительный ион, отличный от H +, а анион — любой отрицательный ион, отличный от OH- или O2-. Соль образуется в результате реакции кислоты и основания, и это называется реакцией нейтрализации .
Здесь вы можете увидеть общую реакцию, при которой вместе с водой образуется соль.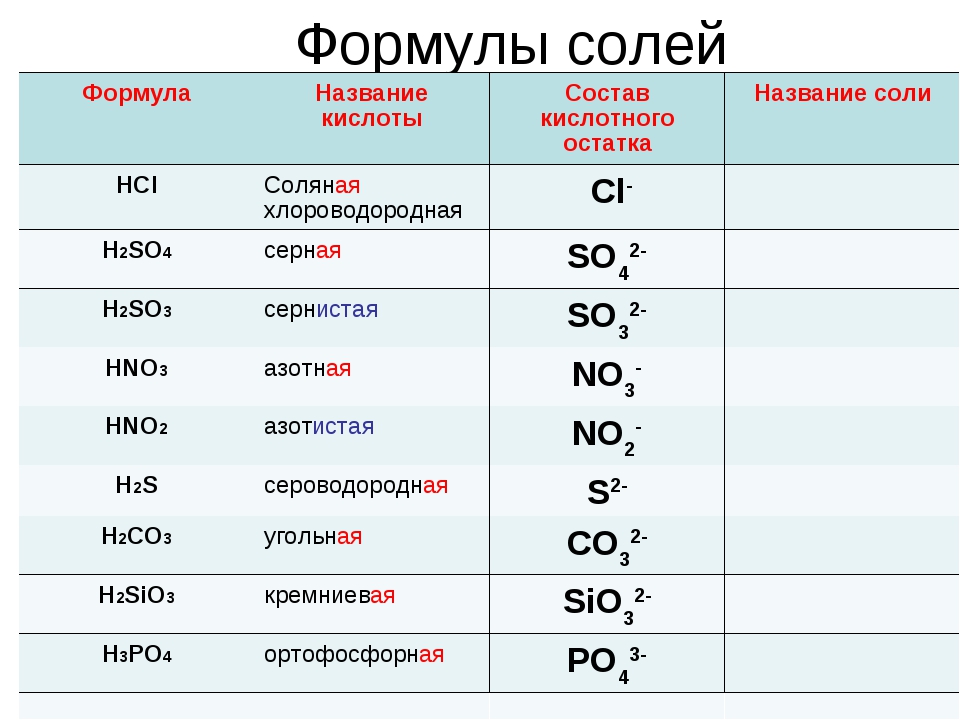 Во время реакции нейтрализации партнеры кислот и оснований меняются местами. Вы можете видеть, что соль образована из иона сульфата кислоты и ионов аммония основания.Два атома водорода и гидроксиды соединяются вместе, образуя два моля воды.
Во время реакции нейтрализации партнеры кислот и оснований меняются местами. Вы можете видеть, что соль образована из иона сульфата кислоты и ионов аммония основания.Два атома водорода и гидроксиды соединяются вместе, образуя два моля воды.
Кислоты и основания
Вы скоро увидите, что идентичность ионов в соли является нашим ключом к предсказанию pH солевого раствора. Каждая образованная соль будет различаться в зависимости от кислоты и основания, из которых она образовалась.
Хорошо, давайте вкратце подумаем о кислотах и основаниях. Определение, которое очень хорошо работает для нас здесь, — это кислота , — это молекула, которая отдает ионы водорода, или H +, а основание , принимает ионы водорода, H +.Кислоты и основания также можно назвать сильными или слабыми. И это связано с тем, насколько легко они могут отказаться или принять ионы водорода. Позвольте мне использовать аналогию с футболом, чтобы помочь вам в этом.
Представьте, что кислоты — это защитники футбольной команды, чья задача — избавляться от мяча (H +).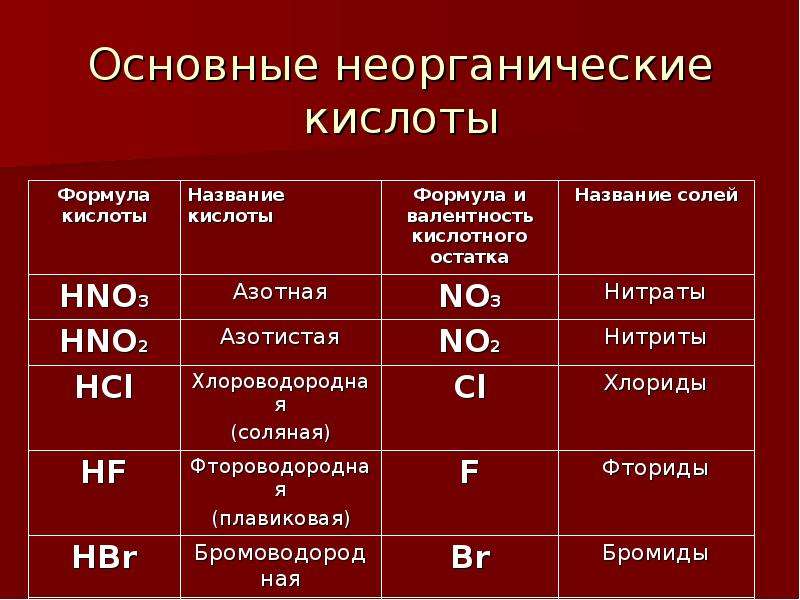 Сильная кислота, как и отличный квотербек, хорошо передает мяч. С другой стороны, слабая кислота, например, плохой защитник, часто остается с мячом. Теперь представьте, что основание — это широкий приемник, задача которого — ловить и удерживать мяч (H +).Сильная база, как устрашающий широкий ресивер, держит мяч. Но слабая база, как плохой широкий ресивер, часто сбрасывает мяч.
Сильная кислота, как и отличный квотербек, хорошо передает мяч. С другой стороны, слабая кислота, например, плохой защитник, часто остается с мячом. Теперь представьте, что основание — это широкий приемник, задача которого — ловить и удерживать мяч (H +).Сильная база, как устрашающий широкий ресивер, держит мяч. Но слабая база, как плохой широкий ресивер, часто сбрасывает мяч.
Нам нужно уметь различать сильную и слабую кислоту и основание из-за воздействия, которое они оказывают на образующуюся соль.
Есть только несколько сильных кислот и оснований, и их следует усвоить. Посмотрите на таблицу ниже.
| Сильные кислоты | HCl, HNO3, h3SO4, HBr, HI, HClO4 |
| Крепкие основания | Гидроксиды металлов I группы и Ca (OH) 2, Sr (OH) 2 |
Все остальные кислоты и основания, кроме этих, считаются слабыми.
Солевые растворы и pH
Хорошо, теперь вернемся к солям. Когда соль растворяется в воде, ионы отделяются друг от друга. Гидролиз может происходить, если ионы реагируют с молекулами воды с образованием ионов h4O + и OH-. Пусть вас не смущает h4O +. Это то же самое, что и H +. Мы просто понимаем, что H + не может оставаться в одиночестве в воде, поэтому он приносит с собой молекулу воды. Вы можете видеть, что если ионы гидролизуют воду и производят ионы h4O + или OH-, это повлияет на pH раствора.
Когда соль растворяется в воде, ионы отделяются друг от друга. Гидролиз может происходить, если ионы реагируют с молекулами воды с образованием ионов h4O + и OH-. Пусть вас не смущает h4O +. Это то же самое, что и H +. Мы просто понимаем, что H + не может оставаться в одиночестве в воде, поэтому он приносит с собой молекулу воды. Вы можете видеть, что если ионы гидролизуют воду и производят ионы h4O + или OH-, это повлияет на pH раствора.
Чтобы предсказать, будет ли солевой раствор кислым, основным или нейтральным, мы должны рассмотреть влияние ионов в растворе, если таковое имеется. Ключом к этому является то, происходят ли ионы из сильной или слабой кислоты и сильного или слабого основания. К счастью, есть несколько полезных рекомендаций, которым мы можем следовать:
1. Соли, полученные из сильных оснований и сильных кислот, НЕ гидролизуют воду, поэтому pH остается равным 7. Наш проход завершен, и реакция полностью нейтрализована.
2.Соли, полученные из сильных оснований и слабых кислот, ДЕЙСТВИТЕЛЬНО гидролизуют воду, придавая ей pH больше 7. Здесь широкий приемник очень старается получить этот H + и доминирует в игре.
Здесь широкий приемник очень старается получить этот H + и доминирует в игре.
3. Соли слабых оснований и сильных кислот ДЕЙСТВИТЕЛЬНО гидролизуют воду, придавая ей pH ниже 7. Здесь квотербек очень старается избавиться от H + и доминирует в игре.
Теперь вы можете спросить, что произойдет, если объединятся слабая кислота и слабое основание. Что ж, как и в игре с мячом, исход предсказать сложно.Это зависит от того, насколько плохой ресивер по сравнению с квотербеком. Нам нужно больше узнать об относительной силе вступающих в реакцию кислоты и основания. Это вы узнаете на более продвинутых курсах химии.
Прогнозирование pH солевых растворов
Хорошо, теперь мы вооружены нашими новыми знаниями, давайте посмотрим, сможем ли мы определить, какие соли отвечают за pH раствора Шелли. Солями являются фторид лития (LiF), йодид калия (KI) и хлорид магния (MgCl2).Мы делаем это таким образом, чтобы идентифицировать исходную кислоту и исходное основание и применять наши рекомендации:
| Исходная кислота | Материнская база | Результат |
|---|---|---|
| ВЧ (слабый) | LiOH (прочный) | Базовое решение |
| HI (сильный) | КОН (крепкий) | Нейтральный раствор |
| HCl (сильная) | Mg (OH) 2 (слабый) | Кислый раствор |
Итак, для фторида лития исходной кислотой является плавиковая кислота (HF). Его нет в нашем списке из 6 сильных кислот, поэтому он должен быть слабым. Исходное основание — гидроксид лития (LiOH). Это в нашем списке сильных оснований, значит, он сильный. Правило 2 говорит нам, что pH будет больше 7, так что это базовый вариант. Это стакан 2.
Его нет в нашем списке из 6 сильных кислот, поэтому он должен быть слабым. Исходное основание — гидроксид лития (LiOH). Это в нашем списке сильных оснований, значит, он сильный. Правило 2 говорит нам, что pH будет больше 7, так что это базовый вариант. Это стакан 2.
Далее йодид калия. Исходная кислота — HI. Он входит в наш список из 6 сильных кислот, поэтому он сильный. Исходное основание — гидроксид калия (КОН). Это в нашем списке сильных оснований, так что оно тоже сильное. Правило 1 говорит нам, что pH будет равен 7, так что это нейтральный показатель.Это стакан 3.
И, наконец, хлорид магния. Исходной кислотой является соляная кислота (HCl), и она входит в наш список из 6 сильных кислот, поэтому она сильная. Исходное основание — гидроксид магния (Mg (OH) 2). Этого нет в нашем списке сильных оснований, поэтому он должен быть слабым. Правило 3 говорит нам, что pH будет меньше 7, так что это кислая среда. Это стакан 1.
Шелли, мы правы? Да, мы.
Краткое содержание урока
На этом уроке вы узнали, что соль представляет собой твердое ионное вещество, состоящее из двух ионов: положительного катиона и отрицательного аниона.
 Продукция химической и связанных с ней отраслей промышленности (Группы 28-38)
Продукция химической и связанных с ней отраслей промышленности (Группы 28-38) КИСЛОТЫ КАРБОНОВЫЕ И ИХ АНГИДРИДЫ, ГАЛОГЕНАНГИДРИДЫ, ПЕРОКСИДЫ, ПЕРОКСИКИСЛОТЫ И ИХ ГАЛОГЕНИРОВАННЫЕ, СУЛЬФИРОВАННЫЕ, НИТРОВАННЫЕ ИЛИ НИТРОЗИРОВАННЫЕ ПРОИЗВОДНЫЕ
КИСЛОТЫ КАРБОНОВЫЕ И ИХ АНГИДРИДЫ, ГАЛОГЕНАНГИДРИДЫ, ПЕРОКСИДЫ, ПЕРОКСИКИСЛОТЫ И ИХ ГАЛОГЕНИРОВАННЫЕ, СУЛЬФИРОВАННЫЕ, НИТРОВАННЫЕ ИЛИ НИТРОЗИРОВАННЫЕ ПРОИЗВОДНЫЕ . (НДС Лек.средства):
. (НДС Лек.средства):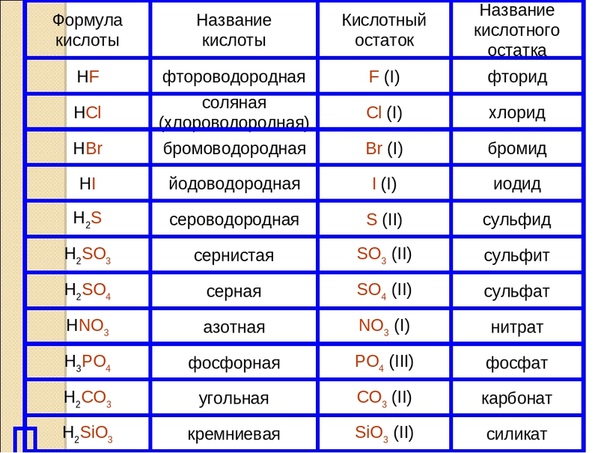 ..
.. 14.53
14.53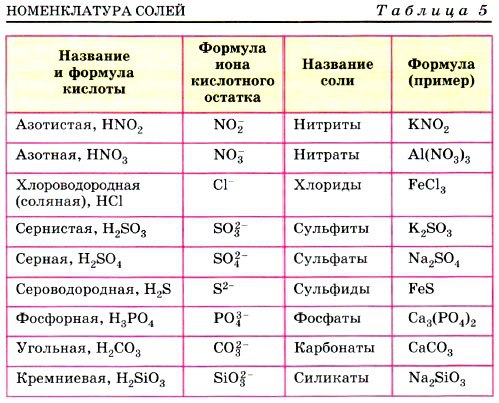 товары):
товары): е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.
е. обогащенной йодом, который имеет важнейшее значение для здорового развития головного мозга у плода и у детей младшего возраста и общего укрепления психических функций у всех людей.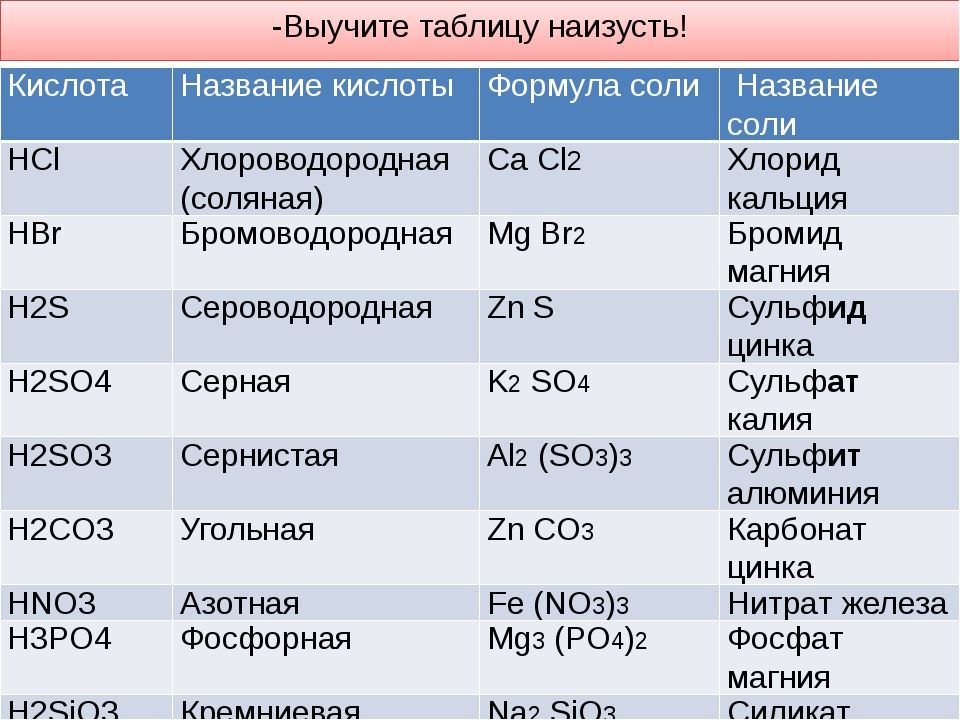


 Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий.
Независимо от происхождения соли, негативные последствия для здоровья вызывает содержащийся в ней натрий. Чтобы выяснить содержание натрия в продуктах питания, необходимо обращать внимание на этикетки.
Чтобы выяснить содержание натрия в продуктах питания, необходимо обращать внимание на этикетки. Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак.
Они кажутся скользкими, мыльными и образуют растворы со значением pH выше 7. Обычные примеры включают гидроксид натрия, гидроксид магния, гидрокарбонат натрия (бикарбонат натрия), гипохлорит натрия и аммиак. Общее уравнение для этого процесса
показано ниже:
Общее уравнение для этого процесса
показано ниже: Если BOH является слабым основанием, B + будет слабой кислотой и вызовет снижение pH раствора.
Эти отношения кратко описаны в таблице ниже:
Если BOH является слабым основанием, B + будет слабой кислотой и вызовет снижение pH раствора.
Эти отношения кратко описаны в таблице ниже: Его ионизация
константа слишком велика для измерения. В этом случае сопряженная
база будет иметь константу ионизации, которая невероятно мала (тоже
малы по размеру!) и могут быть отнесены к категории очень слабых.
Его ионизация
константа слишком велика для измерения. В этом случае сопряженная
база будет иметь константу ионизации, которая невероятно мала (тоже
малы по размеру!) и могут быть отнесены к категории очень слабых.

 Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения конъюгатов K .
Чтобы предсказать, будет ли конкретная комбинация кислотной, основной или нейтральной, необходимо сравнить табличные значения конъюгатов K .
 Лучшим примером органической кислоты является уксусная кислота CH₃COOH, а неорганические кислоты — это кислоты, полученные из минералов; например, серная кислота H₂SO₄, соляная кислота и т. д.
Лучшим примером органической кислоты является уксусная кислота CH₃COOH, а неорганические кислоты — это кислоты, полученные из минералов; например, серная кислота H₂SO₄, соляная кислота и т. д.