Типы химических уравнений Интерпретация химических уравнений 195.
Рассмотрим следующее полное уравнение: Fe(TB.) + Си804(водн.) FeSO4 (водн.) + Си(тв.)
Это уравнение описывает всю реакционную систему в целом. Однако рассматриваемую реакцию можно также представить в упрощенном виде при помощи ионного уравнения:
Fe (тв.) + Cu2 + (водн.) = Fe2 + (водн.) + Cu (тв.)
Это уравнение не включает сведений о сульфат-ионах SO2.-, которые не указаны в нем потому, что они не принимают участия в рассматриваемой реакции. Такие ионы называют ионами-наблюдателями.
Реакция между железом и медью (II) является примером окислительно-восстановительных реакций (см. гл. 10). Ее можно условно разделить на две реакции, одна из которых описывает восстановление, а другая-окисление, протекающие одновременно в общей реакции:
Восстановление Cu2+ (водн.) + 2е- = Сu(тв.
Окисление Fe (тв.) = Fe2 + (водн.) + 2е-
Эти два уравнения называются уравнениями полуреакций. Они особенно часто используются в электрохимии для описания процессов, протекающих на электродах
Интерпретация химических уравнений
Рассмотрим следующее простое стехиометрическое уравнение: h3 (г.) + Br2 (г.) = 2HBr (г.)
Его можно интерпретировать двумя способами. Во-первых, согласно этому уравнению, один моль молекул водорода h3 реагирует с одним молем молекул брома Br2, образуя два моля молекул бромоводорода HBr. Такое истолкование химического уравнения иногда называют его молярной интерпретацией.
Однако можно истолковать данное уравнение и так, что в результирующей реакции (см. ниже) одна молекула водорода h3 реагирует с одной молекулой брома Br2, образуя две молекулы бромоводорода HBr. Подобное истолкование химического уравнения иногда называют его молекулярной интерпретацией.
И молярная, и молекулярная интерпретации одинаково правомочны.
Таким образом, рассматриваемая реакция в действительности представляет собой цепную реакцию, в которой участвуют интермедиаты (промежуточные реагенты), называемые радикалами (см. гл. 9). Механизм рассматриваемой реакции включает еще и другие стадии и побочные реакции. Таким образом, стехиометрическое уравнение указывает только результирующую реакцию. Оно не дает сведений о механизме реакции.
Оглавление:
Химические реакции, типы реакций, виды реакций, окислительно-восстановительные реакции
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О. Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения A + B = AB Пример: Из нескольких простых или сложных веществ образуется одно сложное |
химические реакции разложения AB = A + B Пример: Из сложного вещества образуется несколько простых или сложных веществ |
химические реакции замещения A + BC =AC + B Пример: Атом простого вещества замещает один из атомов сложного |
химические реакции ионного обмена AB+CD = AD+CB Пример: Сложные вещества обмениваются своими составными частями |
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Признаки химических реакций. По ним можно судить, прошла ли химическая реакция между реагентами или нет. К таким признакам принято относить следующие:
— Изменение цвета (например, светлое железо покрывается во влажном воздухе бурым налётом оксида железа — химическая реакция взаимодействия железа с кислородом).
— Выделение газа (например, если капнуть лимонной кислотой на пищевую соду, то выделится углекислый газ).

— Образование слабодиссоциированных веществ (например, реакции, при которых одним из продуктов реакции является вода).
— Свечение раствора.
Примером свечения раствора может служить реакция с использованием такого реагента как раствор люминола (люминол- это сложное химическое вещество, которое может излучать свет при химических реакциях).
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
Сложные вещества, понижающие свою степень окисления — окислители, а повышающие степень окисления — восстановители. Например:
2Na + Cl2→ 2NaCl,
— здесь окислитель — хлор (он присоединяет к себе электроны), а восстановитель — натрий (он отдаёт электроны).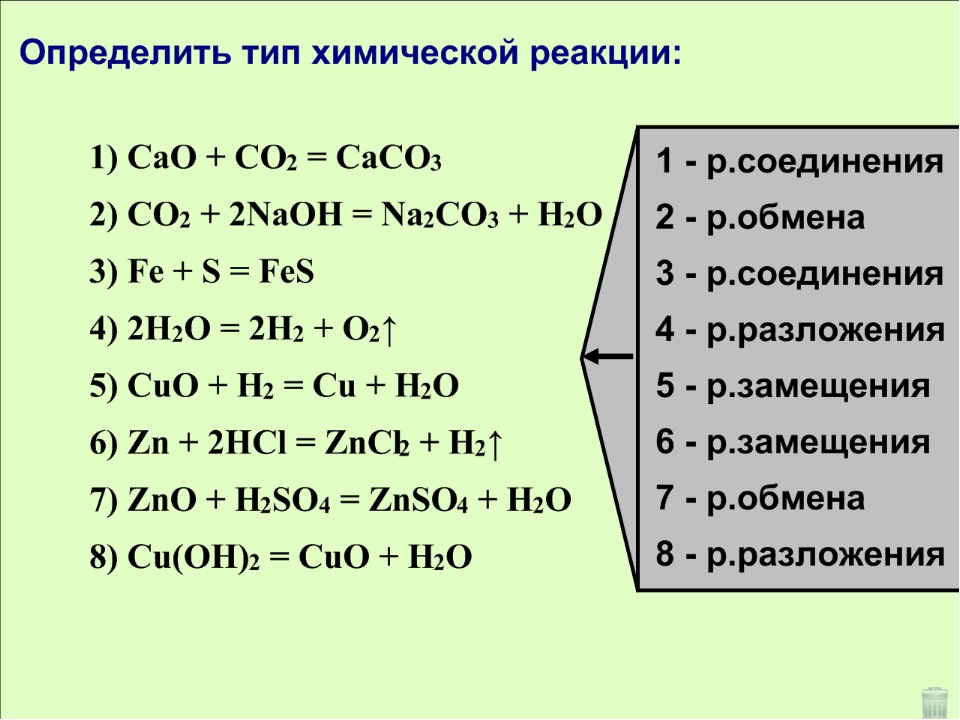
Реакция замещения NaBr-1+ Cl20→ 2NaCl-1 + Br20 (характерна для галогенов) тоже относится к окислительно -восстановительным реакциям. Здесь хлор — окислитель (принимает 1 электрон), а бромид натрия (NaBr) — восстановитель (атом брома отдаёт электрон).
Реакция разложения дихромата аммония ((NH4)2Cr2O7) тоже относится к окислительно-восстановительным реакциям:
(N-3H4)2Cr2+6O7→ N20 + Cr2+3O3 + 4H2O
Ещё одна из распространённых классификаций химических реакций — это их разделение по тепловому эффекту.
Разделяют эндотермические реакции и экзотермические реакции.
Эндотермические реакции — химические реакции, сопровождающиеся поглощением окружающего тепла (вспомните охлаждающие смеси). Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Экзотермические (наоборот) — химические реакции, сопровождающиеся выделением тепла (например — горение).
Опасные химические реакции :»БОМБА В РАКОВИНЕ»- забавно или не очень?!
Существуют некоторые химические реакции, которые протекают спонтанно при смешивании реагентов. При этом образуются достаточно опасные смеси, которые могут взрываться, воспламеняться или отравлять. Вот одна и них!
В некоторых американских и английских клиниках наблюдались странные явления. Время от времени из раковин раздавались звуки, напоминающие пистолетные выстрелы, а в одном случае неожиданно взорвалась сливная трубка. К счастью, никто не пострадал. Расследование показало, что виновником всего этого был очень слабый (0,01%) раствор азида натрия NaN3, который использовали в качестве консерванта физиологических растворов.
Излишки раствора азида в течение многих месяцев, а то и лет сливали в раковины — иногда до 2 л в день.
Сам по себе азид натрия — соль азидоводородной кислоты HN3 — не взрывается. Однако азиды тяжёлых металлов (меди, серебра, ртути, свинца и др.) — весьма неустойчивые кристаллические соединения, которые взрываются при трении, ударе, нагревании, действии света. Взрыв может произойти даже под слоем воды! Азид свинца Pb(N3)2 используется как инициирующее взрывчатое вещество, с помощью которого подрывают основную массу взрывчатки. Для этого достаточно всего двух десятков миллиграммов Pb(N3)2. Это соединение более взрывчато, чем нитроглицерин, а скорость детонации (распространения взрывной волны) при взрыве достигает 45 км/с — в 10 раз больше, чем у тротила.
Но откуда в клиниках могли взяться азиды тяжёлых металлов? Оказалось, во всех случаях сливные трубки под раковинами были изготовлены из меди или латуни (такие трубки легко гнутся, особенно после нагревания, поэтому их удобно устанавливать в сливной системе). Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Выливаемый в раковины раствор азида натрия, протекая по таким трубкам, постепенно реагировал с их поверхностью, образуя азид меди. Пришлось менять трубки на пластмассовые. Когда в одной из клиник проводили такую замену, оказалось, что снятые медные трубки сильно забиты твёрдым веществом. Специалисты, которые занимались «разминированием», чтобы не рисковать, подорвали эти трубки на месте, сложив их в металлический бак массой 1 т. Взрыв был настолько силён, что сдвинул бак на несколько сантиметров!
Медиков не очень интересовала сущность химических реакций, приводящих к образованию взрывчатки. В химической литературе также не удалось найти описания этого процесса. Но можно предположить, исходя из сильных окислительных свойств HN3, что имела место такая реакция: анион N-3, окисляя медь, образовал одну молекулу N2 и атом азота, который вошёл в состав аммиака. Это соответствует уравнению реакции: 3NaN3+Cu+3Н2О→ Cu(N3)2+3NaOH+N2+NH3.
С опасностью образования бомбы в раковине приходится считаться всем, кто имеет дело с растворимыми азидами металлов, в том числе и химикам, поскольку азиды используются для получения особо чистого азота, в органическом синтезе, в качестве порообразователя (вспенивающего агента для производства газонаполненных материалов: пенопластов, пористой резины и т. п.). Во всех подобных случаях надо проследить, чтобы сливные трубки были пластмассовыми.
Сравнительно недавно азиды нашли новое применение в автомобилестроении. В 1989 г. в некоторых моделях американских автомобилей появились надувные подушки безопасности. Такая подушка, содержащая азид натрия, в сложенном виде почти незаметна. При лобовом столкновении электрический запал приводит к очень быстрому разложению азида: 2NaN3=2Na+3N2. 100 г порошка выделяют около 60 л азота, который примерно за 0,04 с надувает подушку перед грудью водителя, спасая тем самым ему жизнь.
Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:
- Галогенирование — присоединение молекулы галогена:
- Гидрогалогенирование — присоединение молекулы галогенводорода:
- Гидратация — присоединение молекулы воды:
- Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения, например:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:
- Дегидратация – отщепление молекулы воды:
- Дегидрогалогенирования – отщепления молекулы галогеноводородов:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения.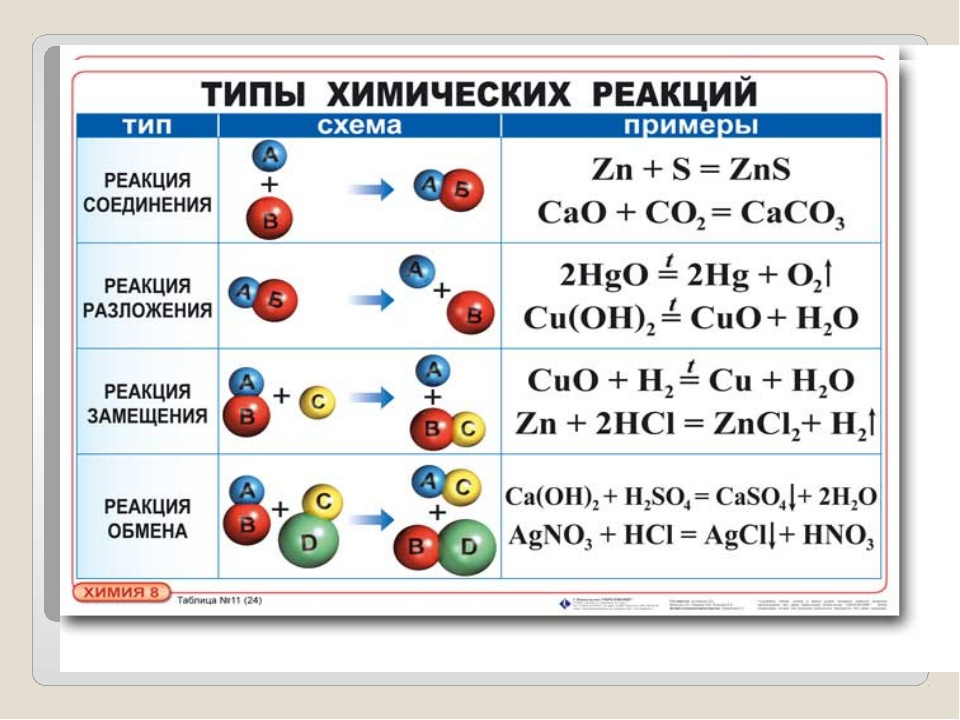 В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
С18H38 → С9H18 + С9H20
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO—,RO—, Cl—, RCOO—, CN—, R—, NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н+, R3C+, AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
просто и понятно об их значении в химии
Характеристика реакцийХарактеристика реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Fe+CuSO4→ FeSO4+Cu
Реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
NaOH+HCl→ NaCl+Н2О
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.

- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Видео
И в завершение интересно видео про самые удивительные химические реакции.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Chemical Reactions.
Открытый урок химии в 8 классе на тему «Типы химических реакций» | Официальный сайт МОУ СОШ №7 г. Коряжмы
Автор: Нагишева Ольга Викторовна, учитель химии МОУ «СОШ №7».
Цели урока:
деятельностная: сформировать познавательные универсальные учебные действия при изучении типов химических реакций.
предметно-дидактическая: сформировать понятия: реакции соединения, реакции разложения, реакции замещения, реакции обмена; сформировать знание о признаках химических реакций, научить определять тип реакции по числу и составу продуктов и реагентов реакции.
Планируемые образовательные результаты урока
личностные: убеждаются в познаваемости мира.
метапредметные:
регулятивные: умение планировать и регулировать свою деятельность, владение основами самоконтроля и самооценки;
коммуникативные: готовность получать необходимую информацию, продуктивно взаимодействовать со своими партнерами и учителем;
познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
предметные: знать определения «типы химических реакций», «признаки классификации реакций», «реакции соединения, разложения, замещения, обмена», «закон сохранения массы веществ».
Тип урока:
1. По ведущей дидактической цели: урок изучения нового материала, последовательного изучения ключевых вопросов темы.
- По способу организации: синтетический урок
- По ведущему методу обучения: проблемный урок
Метод обучения: самостоятельная работа, работа с карточками, взаимоконтроль
Основные вопросы урока:
- Типы химических реакций по числу и составу продуктов и реагентов
- Реакции соединения.
- Реакции разложения.
- Реакции замещения.
- Реакции обмена.
Оборудование: учебник, карточки, презентация
Ход урока:
Организационный момент
— Добрый день! Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
— Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.
-О чем же пойдет речь на сегодняшнем уроке?
-Чтобы ответить на этот вопрос, попробуйте отгадать загадку: » Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
Актуализация
На доске корзина “Химические реакции”
— Ребята, чтобы отправиться дальше в страну знаний, нам с вами необходимо взять с собой багаж. На доске перед вами корзина «Химические реакции». Она пуста. Давайте заполним ее.
-Что мы знаем о химических реакциях? (говорят мнения, учитель прикрепляет над корзиной таблички с вариантами ответов:
— Итак, что такое химические реакции — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
— Как мы можем отразить химическую реакцию на письме? (с помощью химического уравнения)
— А что такое химическое уравнение? В чем отличие от реакции? (запись химической реакции с помощью формул и математических знаков)
— Какой закон мы используем при составлении химического уравнения? (закон сохранения массы веществ)
— Сформулируйте этот закон (Масса веществ вступивших в химическую реакцию равна массе веществ, образовавшихся в результате ее)
— Кто открыл закон сохранения массы веществ? (М.В.Ломоносов в 1748г)
— Как закон сохранения массы отображается в уравнении? (уравниваем с помощью коэффициентов)
— Скажите, какими признаками сопровождаются химические реакции? (образование осадка или газа, изменение цвета, выделение или поглощение теплоты, появление запаха)
— Ребята, мы с вами разобрали понятие химические реакции.
— Сегодня, по мере выполнения заданий, баллы за правильные ответы вы заносите в оценочные листы . В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
Работа у доски
На доске написаны реакции. Учитель вызывает к доске 2 учащихся и предлагает выполнить задание.
— Вспомним, как реализуется закон сохранения массы веществ в химических реакциях.
Задание. Расставить коэффициенты и объяснить.
- Al + CuCl2 → AlCl3 + Cu
- N2 + O2 → NO
- P + O2 → P2O5
- NaOH + H3PO4 → Na3PO4 + H2O
- H2O → H2 + O2
- Al2O3 + HCl→ AlCl3 + H2O
- KOH +H2SO4 → K2SO4 + H2O
- Al + O2 → Al2O3
2 ученика работают у доски, уравнивая по 4 реакции
— Остальным учащимся предлагаю выполнить задание на карточке №1, ответив вопрос:
Карточка №1
Выполняется ли закон сохранения массы в следующих схемах химических реакций? (Нужно ответить ДА или НЕТ)
|
Схемы химических реакций |
Да/Нет |
|
1. |
|
|
2. 2C + O2 → 2CO |
|
|
3. Fe(OH)2 → FeO + H2O |
|
|
4. CaCO3 → CaO + CO2 |
|
|
5. 2Zn + HCl → ZnCl2 + H2 |
|
|
6. Fe + CuCl2 → Cu + FeCl2 |
|
|
7. АgNO3 + NaCl → AgCl + NaNO3 |
|
|
8. Na2SO4 + BaCl2 → NaCl + BaSO4 |
Учитель проверяет выполненные задания. Ответы на карточку №1 написаны на слайде.
Учащиеся сверяют свои ответы с эталоном (ответы «да» или «нет»)
— У всех совпало с ответом?
— Почему в некоторых уравнениях закон не сохраняется? (учитель выводит на экран схемы с коэффициентами, учащиеся определяют ошибки)
— Посчитайте количество правильных ответов и занесите в лист. 1 уравнение – 1 балл (максимально – 4 баллов)
1 уравнение – 1 балл (максимально – 4 баллов)
— Посмотрите, пожалуйста, на уравнения реакций на доске. Найдите ошибки, если есть.
Изучение нового материала
Учитель предлагает решить проблему: почему в срезанных вечером зеленных культурах (салат, петрушка, укроп и др.) содержится больше питательных веществ, чем в срезанных их в утреннее время? (Зная условия протекания реакций фотосинтеза. Можно утверждать, что к вечеру происходит максимальное накопление углеводов в листьях, а к утру они частично расходуются на процесс дыхания. Вечерняя зелень полезнее утренней.)
— В природе существует огромное число реакций. Как же удержать в памяти всё это многообразие и ориентироваться в нем?
Учитель напоминает учащимся о многообразии живых организмов, о разнообразии видов растений и животных
Вопрос классу: как поступали ученые — биологи в подобном случае? (Ученики вместе с учителем вспоминают основы классификации и систематики видов животных и растений. Приводят примеры.)
Приводят примеры.)
ΙΙ. – Итак, в любой науке применяется метод классификации, позволяющей по общим признакам разделить всё множество объектов на группы. (Учащиеся вспоминают, что им известно о классификации простых веществ по свойствам на металлы и неметаллы)
- 1. Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций)
- 2. Что такое классификация? (Деление на группы)
- 3. Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Учитель. Используя эти знания, мы сегодня продолжим изучать химические реакции и познакомимся с типами химических реакций и их классификацией.
Запишите тему урока в тетрадь (открывается тема урока)
(учащиеся записывают это в тетрадях.)
На экране появляется, на котором представлены несколько химических реакций:
2H2 + O2 -> 2H2O; CaO + H2O -> Ca(OH)2 Cu(OH)2 -> CuO + H2O; 2HgO -> 2Hg + O2
— можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
— различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
Обсуждаются вопросы:
— что объединяет все эти реакции? — в чём их отличие?
— как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом — сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
A + B -> AB AB + CB -> AB2C
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена.
После изучения всех типов реакций проводится обобщение материала. Итак, мы узнали, как классифицируют химические реакции.
Итак, мы узнали, как классифицируют химические реакции.
соединения разложения замещения обмена
— А сейчас откройте учебник на стр.41. (Схема «Типы химических реакций»). Посмотрите, пожалуйста, на схему. В ней описаны типы химических реакций, написаны примеры уравнений каждого типа. На протяжении урока вы будете работать с этой таблицей.
Закрепление
1.1.. Работают с уравнениями реакции предложенными учителем( у всех групп одинаковые), каждая группа работает по принципу оформления своих уравнений на листах при помощи картинок или рисунков и записи уравнений, предложенных учителем.
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы реакций
Карточка №2
|
Тип реакции |
Уравнение реакции |
|
а) |
а) CuCl2 + Zn → |
|
б) |
б) Cu(OH)2 → |
|
в) |
в) KI + Pb(NO3)2 → |
|
г) |
г) Ca + O2 → |
1. 2. Презентация работ учащимися
2. Презентация работ учащимися
1.3. Оценивание группами по очереди друг друга.
Раздает и поясняет задания, помогает, группам справиться с работой
Если определили правильно, то ставим себе 8 баллов (4 –за написание 4-х уравнений, 4 –за схемы).
2. Найдите ошибки в предложенных реакциях, укажите их количество и исправьте (работа индивидуальная)
а) H2 + O2 = H2O – реакция соединения
б) 2KCl + AgNO3 = KNO3 + AgCl↓ – реакция обмена
в) Mg(OH)2 + HNO3 = Mg(NO3)2 + 2H2O – реакция обмена
г) Cu + HCl = CuCl2 + H2 – реакция замещения
д) FeCl3 + 3NaOH = Fe(OH)3 +3NaCl – реакция замещения
е) Na2O + H2O = 2NaOH — реакция замещения
— Обменяйтесь карточками, проверьте ответы одноклассников по образцу. Посчитайте баллы 1 уравнение – 1 балл ( всего -6 баллов)
— Занесите баллы в оценочный лист и подсчитайте общую сумму баллов и определите отметки за урок.
Учитель выводит критерии отметок:
18-15 баллов – отметка «5»
14-11 баллов – отметка «4»
10-7 баллов – отметка «3»
— Поднимите руку, у кого «5». А «4» есть?
Подведение итога и рефлексия
Учитель подводит итог урока
— Ребята, как вы думаете, достигли ли мы цели урока?
— Сможете ли вы по числу и составу реагентов и продуктов определить тип химической реакции?
— Сейчас еще раз проверим. О каких реакциях идет речь?
Зачитываются загадки.
Ты было сложным, я простым, мы встретились однажды,
В тебе я атом заместил, мы подружились даже.
И сразу изменился мир: я сложным стал, а ты простым. (замещения)
Нас было много, мы соединились,
В одно большое вместе превратились.
Такое процесс объединения – реакция … (соединения)
Когда два сложных вещества в реакцию вступают,
Меняются фрагментами (себя не обижают),
И происходят с ними тут простые перемены
Такой процесс мы назовем реакцией … (обмена)
Домашнее задание: п. 16 –всем,
16 –всем,
На оценку «5» — из учебника выписать по 3 примера на каждый тип реакции,
на оценку «4» — из учебника выписать по 2примера на каждый тип реакции,
на оценку «3» — из учебника выписать 1 пример на каждый тип реакции
Перед уходом детей учитель предлагает учащимся проанализировать свое эмоциональное состояние:
— Сдайте, пожалуйста, оценочные листы.
— Спасибо за работу на уроке!
Урок химии в 8 классе по теме «Химические уравнения. Типы химических реакций».
Урок химии в 8 классе по теме «Химические уравнения. Типы химических реакций».
Тип урока –изучение нового материала.
Тема. Химические уравнения. Типы химических реакций.
Цели.
1. Закрепить знания о законе сохранения массы веществ и на его основе объяснить, что такое «химическая реакция»; правила составления реакций. Познакомить с классификацией реакций.
2. Развивать умения писать уравнения химических реакций, определять тип реакции и правильно расставлять коэффициенты в уравнениях.
3. Развивать познавательный интерес к теме и к предмету, повышать творческую активность.
4. Вырабатывать умения логически рассуждать и грамотно выражать свои мысли.
Методы. Беседа, рассказ, демонстрация опытов, работа в тетради, в рабочей тетради.
Оборудование: реактивы-магниевая лента, Fe и CuSO4, пробирки, спички, спички, скрепка (Fe).
Ход урока.
I. Организационный момент.
II. Повторение.
Учитель. Здравствуйте, ребята! Мы с вами начали в 8 классе изучать химию. Без нее прожить нельзя! И это действительно так, без нее никуда. Это наука – волшебница. Химия нас кормит, одевает, обувает, наконец, предоставляет блага, без которых немыслимо наше общество. Каждый человек, каждый из вас, сам того не подозревая, ежедневно осуществляет химические реакции, даже не выходя из дома: намыливая руки, зажигая спички и газ, приготавливая пищу. Да и сам человеческий организм – большая химическая фабрика, в которой происходит множество химических реакций. Переваривание пищи. Сидение волос. Старение организма. Вокруг нас химические реакции – горение дров, горение бензина, скисание молока, квашение капусты, порча продуктов, гниение листьев. Что такое химическая реакция?
Каждый человек, каждый из вас, сам того не подозревая, ежедневно осуществляет химические реакции, даже не выходя из дома: намыливая руки, зажигая спички и газ, приготавливая пищу. Да и сам человеческий организм – большая химическая фабрика, в которой происходит множество химических реакций. Переваривание пищи. Сидение волос. Старение организма. Вокруг нас химические реакции – горение дров, горение бензина, скисание молока, квашение капусты, порча продуктов, гниение листьев. Что такое химическая реакция?
Тема нашего урока- «Химические уравнения. Типы химических реакций». Мы должны научиться писать химические уравнения, правильно проставлять коэффициенты и узнать, какие типы реакций существуют. К изучению данной темы, мы провели большую подготовительную работу: изучали химические элементы, валентность, научились составлять формулы. Давайте вспомним наиболее важные моменты.
Вопросы.
— По составу все вещества делятся на какие группы?
— Приведите примеры простых веществ.
— Какое вещество называется простым?
— Приведите примеры сложных веществ.
— Какие вещества называются сложными?
— Что такое химическая формула?
— Под диктовку на доске пишутся формулы: AL2O3, CuO, H20. Дайте названия.
— На доске написаны формулы веществ. Ученик правильно произносит.
— Составить формулу оксида Fe(III). Составить формулу соединения Na с S.
Молодцы! Последний вопрос, который нам необходим для составления уравнений – это знание закона сохранения массы веществ. Дайте формулировку закона.
III. Новая тема.
Все химические реакции мы можем записать с помощью уравнений. Что это такое?
1) Химическим уравнением называют условную запись химической реакции с помощью химических знаков и формул.
2) Демонстрация опытов.
а) Горение магния.
— При горении Mg взаимодействует с каким веществом?
— Какое вещество образуется?
2Mg+ O2 = 2MgO
Начинаем уравнивать количество атомов. Надо начать с того элемента, чьих атомов больше вступает в реакцию. Количество атомов до реакции и после должно быть равно. (Дети читают уравнение вслух).
Надо начать с того элемента, чьих атомов больше вступает в реакцию. Количество атомов до реакции и после должно быть равно. (Дети читают уравнение вслух).
Эта реакция лежит в основе фейерверков, бенгальских огней.
б) Горение Cu.
2Cu+ O2 = 2CuO (оксид меди). Реакция соединения.
(Проверяем. Читаем вслух).
в) Горение фосфора.
4P+ 5O2 = 2P2O5 (оксид фосфора). Реакция соединения.
(Проверяем. Читаем вслух).
3). Эти три реакции относятся к одному типу реакции. Что общего? Что происходит в этих реакциях?
Это реакции соединения (определение читаем из учебника).
4). Реакции разложения. Что происходит в ходе этих реакций?
Реакции разложения. Что происходит в ходе этих реакций?
2H2O = 2H2 + O2
(Определение – из учебника).
5). Реакции замещения.
Это реакции между простым и сложным веществом.
Демонстрация опыта.
Fe + CuSO4 = FeSO4 + Cu
(Определение – из учебника).
IV. Закрепление.
1). Каждую химическую реакцию мы можем записать в виде уравнения.
— Что называется химическим уравнением?
— Каким правилом мы должны пользоваться при расстановке коэффициентов?
— Дать определения реакциям: соединения, разложения, замещения.
2). Выполняется упражнение на расстановку коэффициентов в уравнениях реакций и на определение типа реакции.
V. Домашнее задание: п.27 (1), 30, упражнения в тетради.
Автор: Фаттахова Оксана Владимировна
МБОУ «Гимназия № 22», г. Нижнекамск, Республика Татарстан
Нижнекамск, Республика Татарстан
Виды химических реакций. Химические реакции
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
По изменению степени окисления элементовПервый признак классификации — по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
б) без изменения степени окисления
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из нескольких более простых, например:
4Li + O 2 = 2Li 2 O
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
CaCO 3 = CaO + CO 2
Реакции разложения можно рассматривать как процессы, обратные соединению.
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Fe + 2HCl = FeCl 2 + H 2
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
— обмена (в том числе и нейтрализации).
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
AgNO 3 + KBr = AgBr + KNO 3
По возможности протекать в обратном направлении – обратимые и необратимые.
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N 2 +3H 2 ↔2NH 3
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O 2 = 2CaO
BaBr 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaBr
По тепловому эффектуЭкзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q 0.
Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатораКатализатор – вещество ускоряющее химическую реакцию.
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора.
По типу разрыва связейПо типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
- гомолитические (равный разрыв, каждый атом по 1 электрону получает)
- гетеролитический (неравный разрыв – одному достается пара электронов)
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH 4 + Cl 2 hv →CH 3 Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO 3 = KNO 3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C 6 H 6 + Cl 2 FeCl3 → C 6 H 5 Cl + HCl
H 2 C =CH 2 + Br 2 → BrCH 2 –CH 2 Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH 3 Br + NaOH → CH 3 OH + NaBr
CH 3 C(O)H + C 2 H 5 OH → CH 3 CH(OC 2 H 5) 2 + H 2 O
Классификация органических реакций
Классификация органических реакций приведена в таблице:
Понятие «реакции соединения» является антонимом понятия «реакции разложения». Попробуйте, используя приём противопоставления, дать определение понятия «реакции соединения». Верно! У вас получилась следующая формулировка.
Рассмотрим этот тип реакций с помощью ещё одной, новой для вас формы записи химических процессов — так называемых цепочек переходов, или превращений. Например, схема
Например, схема
показывает превращение фосфора в оксид фосфора (V) Р 2 O 5 , который, в свою очередь, затем превращается в фосфорную кислоту Н 3 РO 4 .
Число стрелок в схеме превращения веществ соответствует минимальному числу химических превращений — химических реакций. В рассматриваемом примере это два химических процесса.
1-й процесс. Получение оксида фосфора (V) Р 2 O 5 из фосфора. Очевидно, что это реакция соединения фосфора с кислородом.
Поместим немного красного фосфора в ложечку для сжигания веществ и подожжём его. Фосфор горит ярким пламенем с образованием белого дыма, состоящего из маленьких частичек оксида фосфора (V):
4Р + 5O 2 = 2Р 2 O 5 .
2-й процесс. Внесём ложечку с горящим фосфором в колбу. Она заполняется густым дымом из оксида фосфора (V). Вынем ложечку из колбы, прильём в колбу воду и взболтаем содержимое, предварительно закрыв горлышко колбы пробкой. Дым постепенно редеет, растворяется в воде и, наконец, исчезает совсем. Если к полученному в колбе раствору добавить немного лакмуса, он окрасится в красный цвет, что является доказательством образования фосфорной кислоты:
Р 2 O 5 + ЗН 2 O = 2Н 3 РO 4 .
Реакции, которые проводят для осуществления рассматриваемых переходов, протекают без участия катализатора, поэтому их называют некаталитическими. Рассмотренные выше реакции протекают только в одном направлении, т. е. являются необратимыми.
Проанализируем, сколько и каких веществ вступало в рассмотренные выше реакции и сколько и каких веществ в них образовалось. В первой реакции из двух простых веществ образовалось одно сложное, а во второй — из двух сложных веществ, каждое из которых состоит из двух элементов, образовалось одно сложное вещество, состоящее уже из трёх элементов.
Одно сложное вещество может также образоваться и в результате реакции соединения сложного и простого веществ. Например, при производстве серной кислоты из оксида серы (IV) получают оксид серы (VI):
Эта реакция протекает как в прямом направлении, т. е. с образованием продукта реакции, так и в обратном, т. е. происходит разложение продукта реакции на исходные вещества, поэтому в них вместо знака равенства ставят знак обратимости .
В этой реакции участвует катализатор — оксид ванадия (V) V 2 O 5 , который указывают над знаком обратимости:
Сложное вещество также может быть получено и в реакции соединения трёх веществ. Например, азотную кислоту получают по реакции, схема которой:
NO 2 + Н 2 O + O 2 → HNO 3 .
Рассмотрим, как подобрать коэффициенты для уравнивания схемы этой химической реакции.
Число атомов азота уравнивать не нужно: и в левой, и в правой частях схемы по одному атому азота. Уравняем число атомов водорода — перед формулой кислоты запишем коэффициент 2:
NO 2 + Н 2 O + O 2 → 2HNO 3 .
но при этом нарушится равенство числа атомов азота — в левой части остался один атом азота, а в правой их стало два. Запишем коэффициент 2 перед формулой оксида азота (IV):
2NO 2 + Н 2 O + O 2 → 2HNO 3 .
Подсчитаем число атомов кислорода: в левой части схемы реакции их семь, а в правой части — шесть. Чтобы уравнять число атомов кислорода (по шесть атомов в каждой части уравнения), вспомним, что перед формулами простых веществ можно записать дробный коэффициент 1/2:
2NO 2 + Н 2 O + 1/2O 2 → 2HNO 3 .
Сделаем коэффициенты целыми. Для этого перепишем уравнение, удвоив коэффициенты:
4NO 2 + 2Н 2 O + O 2 → 4HNO 3 .
Следует отметить, что почти все реакции соединения относятся к экзотермическим реакциям.
Лабораторный опыт № 15
Прокаливание меди в пламени спиртовки
- Рассмотрите выданную вам медную проволоку (пластину) и опишите её внешний вид. Прокалите проволоку, удерживая её тигельными щипцами, в верхней части пламени спиртовки в течение 1 мин. Опишите условие проведения реакции. Опишите признак, подтверждающий, что произошла химическая реакция. Составьте уравнение проведённой реакции. Назовите исходные вещества и продукты реакции.
Объясните, изменилась ли масса медной проволоки (пластины) после окончания проведения опыта. Ответ обоснуйте, используя знания о законе сохранения массы веществ.
Ключевые слова и словосочетания
- Реакции соединения — антонимы реакций разложения.
- Каталитические (в том числе и ферментативные) и некаталитические реакции.

- Цепочки переходов, или превращений.
- Обратимые и необратимые реакции.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
Реакции разложения играют большую роль в жизни планеты. Ведь именно они способствуют уничтожению отходов жизнедеятельности всех биологических организмов. Кроме того, этот процесс ежедневно помогает человеческому телу усваивать различные сложные соединения путем расщепления их на простые (катаболизм). Помимо всего перечисленного, данная реакция способствует образованию простых органических и неорганических веществ из сложных. Давайте узнаем больше об этом процессе, а также рассмотрим практические примеры химической реакции разложения.
Давайте узнаем больше об этом процессе, а также рассмотрим практические примеры химической реакции разложения.
Что называется реакциями в химии, какие виды их бывают и от чего они зависят
Прежде чем изучить информацию о разложении, стоит узнать о в целом. Под этим названием подразумевается способность молекул одних веществ взаимодействовать с другими и образовывать таким способом новые соединения.
К примеру, если между собою провзаимодействуют кислород и две в результате получится две молекулы оксида гидрогена, который мы все знаем под названием вода. Данный процесс можно записать с помощью такого химического уравнения: 2Н 2 + О 2 → 2Н 2 О.
Хотя существуют разные критерии, по которым различают химические реакции (тепловой эффект, катализаторы, наличие/отсутствие границ раздела фаз, изменение степеней окисления реагентов, обратимость/необратимость), чаще всего их классифицируют по типу превращения взаимодействующих веществ.
Таким образом, выделяется четыре вида химических процессов.
- Соединение.
- Разложение.
- Обмен.
- Замещение.
Все вышеперечисленные реакции графически записываются с помощью уравнений. Общая их схема выглядит таким образом: А → Б.
В левой части этой формулы находятся исходные реагенты, а в правой — вещества, образующиеся вследствие реакции. Как правило, для ее начала необходимо воздействие температурой, электричеством или использование катализирующих добавок. Их наличие также должно указываться в химическом уравнении.
разложения (расщепления)
Для этого вида химического процесса характерно образование двух и больше новых соединений из молекул одного вещества.
Говоря более простым языком, реакцию разложения можно сравнить с домиком из конструктора. Решив построить машинку и кораблик, ребенок разбирает начальное строение и из его деталей сооружает желаемое. При этом структура самих элементов конструктора не меняется, так же как это происходит с атомами вещества, участвующего в расщеплении.
Как выглядит уравнение рассматриваемой реакции
Несмотря на то, что на разъединение на более простые составляющие способны сотни соединений, все подобные процессы происходят по одному принципу. Изобразить его можно с помощью схематической формулы: АБВ → А+Б+В.
В ней АБВ — это начальное соединение, подвергшееся расщеплению. А, Б и В — это вещества, образованные из атомов АБВ в процессе реакции разложения.
Виды реакций расщепления
Как уже было сказано выше, чтобы начать какой-то химический процесс, часто необходимо оказать определенное воздействие на реагенты. В зависимости от типа подобной стимуляции, выделяют несколько видов разложения:
Реакция разложения перманганата калия (KMnO4)
Разобравшись с теорией, стоит рассмотреть практические примеры процесса расщепления веществ.
Первым из них станет распад KMnO 4 (в простонародье именуется марганцовкой) вследствие нагревания. Уравнение реакции выглядит таким образом: 2KMnO 4 (t 200°С) → K 2 MnO 4 + MnO 2 + O 2 .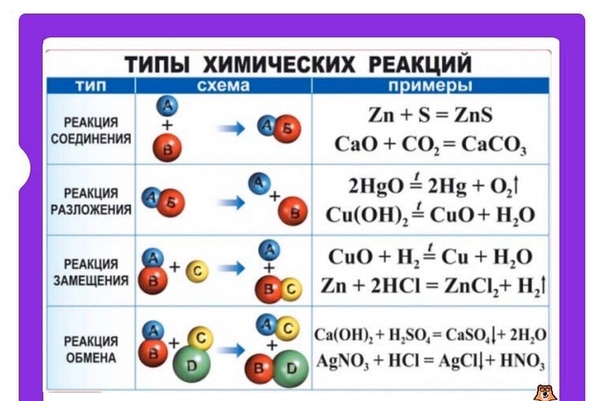
Из представленной химической формулы видно, что для активации процесса необходимо нагреть исходный реагент до 200 градусов по Цельсию. Для лучшего протекания реакции марганцовку помещают в вакуумный сосуд. Из этого можно сделать вывод, что данный процесс является пиролизом.
В лабораториях и на производстве он проводится для получения чистого и контролируемого кислорода.
Термолиз хлората калия (KClO3)
Реакция разложения бертолетовой соли — это еще один пример классического термолиза в чистом виде.
Проходит упоминаемый процесс в два этапа и выглядит таким образом:
- 2 KClO 3 (t 400 °С) → 3KClO 4 + KCl.
- KClO 4 (t от 550 °С) → KCl + 2О2
Также термолиз хлората калия можно провести и при более низких температурах (до 200 °С) в один этап, но для этого нужно, чтобы в реакции приняли участие катализирующие вещества — оксиды различных металлов (купрум, ферум, манган и т. п.).
Уравнение такого рода будет выглядеть таким образом: 2KClO 3 (t 150 °С, MnO 2) → KCl + 2О 2 .
Как и перманганат калия, бертолетова соль используется в лабораториях и промышленности для получения чистого кислорода.
Электролиз и радиолиз воды (Н20)
Еще одним интересным практическим примером рассматриваемой реакции будет разложение воды. Его можно произвести двумя способами:
- Под воздействием на оксид гидрогена электрического тока: Н 2 О → Н 2 + О 2 . Рассматриваемый способ получения кислорода используют подводники на своих субмаринах. Также в будущем его планируют употреблять для получения водорода в больших количествах. Главным препятствием для этого сегодня являются огромные энергетические затраты, необходимые для стимуляции реакции. Когда будет найден способ их минимизировать, электролиз воды станет основным способом производства не только водорода, но и кислорода.
- Расщепить воду можно и при воздействии на нее альфа-излучением: Н 2 О → Н 2 О + +е — . В результате этого молекула оксида гидрогена теряет один электрон, ионизируясь. В таком виде Н2О + снова вступает в реакцию с другими нейтральными молекулами воды, образуя высокореактивный гидроксид-радикал: Н2О+ Н2О + → Н2О + ОН.
 Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н 2 О + е — → Н + ОН.
Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н 2 О + е — → Н + ОН.
Расщепление алканов: метан
Рассматривая различные способы разъединения сложных веществ, стоит уделить особое внимание реакции разложения алканов.
Под этим названием скрываются предельные углеводороды с общей формулой С Х Н 2Х+2. В молекулах рассматриваемых веществ все атомы карбона соединены одинарными связями.
Представители этого ряда встречаются в природе во всех трех агрегатных состояниях (газ, жидкость, твердое тело).
Все алканы (реакция разложения представителей этого ряда — ниже) легче воды и не растворяются в ней. При этом они сами являются отличными растворителями для других соединений.
Среди основных химических свойств таких веществ (горение, замещение, галогенирование, дегидрирование) — и способность расщепляться. Однако данный процесс может происходить как полностью, так и частично.
Вышеупомянутое свойство можно рассмотреть на примере реакции разложения метана (первый член алканового ряда). Этот термолиз происходит при 1000 °С: СН 4 → С+2Н 2 .
Однако если проводить реакцию разложения метана при более высокой температуре (1500 °С), а потом резко снизить ее, этот газ расщепится не полностью, образуя этилен и водород: 2СН 4 → C 2 H 4 + 3H 2 .
Разложение этана
Второй член рассматриваемого алканового ряда — это С 2 Н 4 (этан). Реакция разложения его происходит также под воздействием высокой температуры (50 °С) и при полном отсутствии кислорода или других окислителей. Выглядит она следующим образом: C 2 H 6 → C 2 H 4 + H 2 .
Представленное выше уравнение реакции разложения этана до водорода и этилена нельзя считать пиролизом в чистом виде. Дело в том, что данный процесс происходит с присутствием катализатора (например, металла никеля Ni или водяного пара), а это противоречит определению пиролиза. Поэтому о представленном выше примере расщепления корректно говорить как о процессе разложения, происходящем при пиролизе.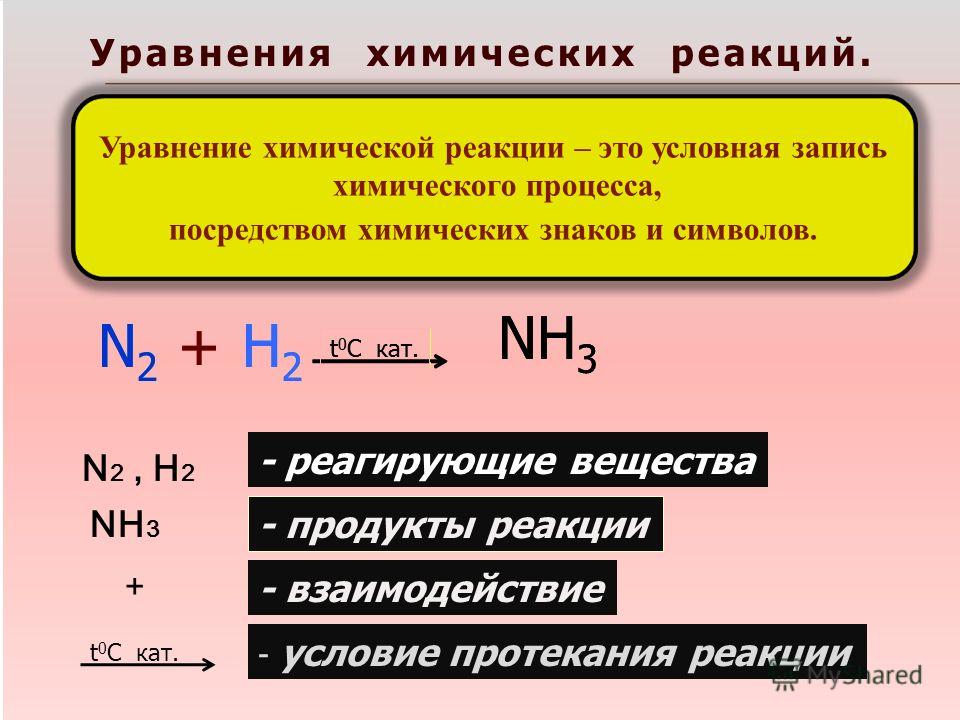
Стоит отметить, что рассмотренная реакция в промышленности широко используется для получения самого производимого органического соединение в мире — газа этилена. Однако из-за взрывоопасности C 2 H 6 чаще этот простейший алкен синтезируют из других веществ.
Рассмотрев определения, уравнение, виды и различные примеры реакции разложения, можно сделать вывод, что она играет очень большую роль не только для человеческого организма и природы, но и для промышленности. Также с ее помощью в лабораториях удается синтезировать многие полезные вещества, что помогает ученым проводить важных
5.3: Типы химических реакций
Результаты обучения
- Классифицируют реакцию как комбинацию, разложение, однократное замещение, двойное замещение или горение.
- Предсказать продукты и уравновесить реакцию горения.
Многие химические реакции можно разделить на пять основных типов. Полное понимание этих типов реакций будет полезно для предсказания продуктов неизвестной реакции. Пять основных типов химических реакций — это комбинация, разложение, однократное замещение, двойное замещение и горение.Анализ реагентов и продуктов данной реакции позволит вам отнести ее к одной из этих категорий. Некоторые реакции можно отнести к нескольким категориям.
Пять основных типов химических реакций — это комбинация, разложение, однократное замещение, двойное замещение и горение.Анализ реагентов и продуктов данной реакции позволит вам отнести ее к одной из этих категорий. Некоторые реакции можно отнести к нескольким категориям.
Комбинированные реакции
Реакция объединения , также известная как реакция синтеза , представляет собой реакцию, в которой два или более вещества объединяются с образованием единого нового вещества. Реакции сочетания также могут называться реакциями синтеза. Общая форма реакции сочетания:
\ [\ ce {A} + \ ce {B} \ rightarrow \ ce {AB} \]
Одна реакция сочетания — это соединение двух элементов с образованием соединения.Твердый металлический натрий реагирует с газообразным хлором с образованием твердого хлорида натрия.
\ [2 \ ce {Na} \ left (s \ right) + \ ce {Cl_2} \ left (g \ right) \ rightarrow 2 \ ce {NaCl} \ left (s \ right) \]
Обратите внимание, что для того, чтобы правильно написать и сбалансировать уравнение, важно помнить о семи элементах, которые существуют в природе в виде двухатомных молекул (\ (\ ce {H_2} \), \ (\ ce {N_2} \), \ (\ ce {O_2} \), \ (\ ce {F_2} \), \ (\ ce {Cl_2} \), \ (\ ce {Br_2} \) и \ (\ ce {I_2} \)) .
Одним из часто встречающихся видов комбинированной реакции является реакция элемента с кислородом с образованием оксида.И металлы, и неметаллы легко реагируют с кислородом в большинстве условий. Магний быстро и резко реагирует при воспламенении, соединяясь с кислородом воздуха с образованием тонкого порошка оксида магния.
\ [2 \ ce {Mg} \ left (s \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {MgO} \ left (s \ right) \]
Реакция разложения
Реакция разложения — это реакция, в которой соединение распадается на два или более простых вещества. Общая форма реакции разложения:
\ [\ ce {AB} \ rightarrow \ ce {A} + \ ce {B} \]
Большинство реакций разложения требуют ввода энергии в виде тепла, света или электричества.
Бинарные соединения — это соединения, состоящие всего из двух элементов. Самый простой вид реакции разложения — это когда бинарное соединение разлагается на элементы. Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
Оксид ртути (II), красное твердое вещество, разлагается при нагревании с образованием ртути и газообразного кислорода.
\ [2 \ ce {HgO} \ left (s \ right) \ rightarrow 2 \ ce {Hg} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \]
Реакция также считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением.Карбонат металла разлагается на оксид металла и газообразный диоксид углерода. Например, карбонат кальция разлагается на оксид кальция и диоксид углерода.
\ [\ ce {CaCO_3} \ left (s \ right) \ rightarrow \ ce {CaO} \ left (s \ right) + \ ce {CO_2} \ left (g \ right) \]
Гидроксиды металлов разлагаются при нагревании с образованием оксидов металлов и воды. Гидроксид натрия разлагается с образованием оксида натрия и воды.
\ [2 \ ce {NaOH} \ left (s \ right) \ rightarrow \ ce {Na_2O} \ left (s \ right) + \ ce {H_2O} \ left (g \ right) \]
Реакции при однократной замене
Реакция однократного замещения — это реакция, в которой один элемент заменяет аналогичный элемент в соединении . Общая форма реакции однократного замещения (также называемой однократным перемещением):
Общая форма реакции однократного замещения (также называемой однократным перемещением):
\ [\ ce {A} + \ ce {BC} \ rightarrow \ ce {AC} + \ ce {B} \]
В этой общей реакции элемент \ (\ ce {A} \) является металлом и заменяет элемент \ (\ ce {B} \), также металл, в соединении. Когда элемент, выполняющий замену, является неметаллом, он должен заменить другой неметалл в соединении, и общее уравнение принимает следующий вид:
\ [\ ce {Y} + \ ce {XZ} \ rightarrow \ ce {XY} + \ ce {Z} \]
\ (\ ce {Y} \) является неметаллом и заменяет неметалл \ (\ ce {Z} \) в соединении на \ (\ ce {X} \).
Магний является более химически активным металлом, чем медь. Когда полоса металлического магния помещается в водный раствор нитрата меди (II), она заменяет медь. Продуктами реакции являются водный раствор нитрата магния и твердая металлическая медь.
\ [\ ce {Mg} \ left (s \ right) + \ ce {Cu (NO_3) _2} \ left (aq \ right) \ rightarrow \ ce {Mg (NO_3) _2} \ left (aq \ right) + \ ce {Cu} \ left (s \ right) \]
Многие металлы легко вступают в реакцию с кислотами, и, когда они это делают, одним из продуктов реакции является газообразный водород. Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (см. Рисунок ниже).
Цинк реагирует с соляной кислотой с образованием водного хлорида цинка и водорода (см. Рисунок ниже).
\ [\ ce {Zn} \ left (s \ right) + 2 \ ce {HCl} \ left (aq \ right) \ rightarrow \ ce {ZnCl_2} \ left (aq \ right) + \ ce {H_2} \ влево (г \ вправо) \]
Рисунок 10.6.1: Металлический цинк реагирует с соляной кислотой с выделением газообразного водорода в реакции однократного замещения.
Рисунок 10.6.2: На этом изображении показано примерно 3 фунта металлического натрия, реагирующего с водой.Металлический натрий бурно реагирует при попадании в емкость с водой с выделением газообразного водорода. Большой кусок натрия часто выделяет столько тепла, что водород воспламеняется.
Реакция двойной замены
Реакция двойной замены — это реакция, в которой положительные и отрицательные ионы двух ионных соединений обмениваются местами с образованием двух новых соединений . Общая форма реакции двойного замещения (также называемой двойным вытеснением):
Общая форма реакции двойного замещения (также называемой двойным вытеснением):
\ [\ ce {AB} + \ ce {CD} \ rightarrow \ ce {AD} + \ ce {CB} \]
В этой реакции \ (\ ce {A} \) и \ (\ ce {C} \) являются положительно заряженными катионами, а \ (\ ce {B} \) и \ (\ ce {D} \) являются отрицательно заряженными анионами.Реакции двойного замещения обычно происходят между веществами в водном растворе. Для протекания реакции одним из продуктов обычно является твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного из реагентов объединяются с анионами другого реагента с образованием нерастворимого ионного соединения. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
\ [2 \ ce {KI} \ left (aq \ right) + \ ce {Pb (NO_3) _2} \ left (aq \ right) \ rightarrow 2 \ ce {KNO_3} \ left (aq \ right) + \ ce {PbI_2} \ left (s \ right) \]
Рисунок 10. 6.3: Когда несколько капель нитрата свинца (II) добавляются к раствору иодида калия, сразу же образуется желтый осадок иодида свинца (II) в реакции двойного замещения.
6.3: Когда несколько капель нитрата свинца (II) добавляются к раствору иодида калия, сразу же образуется желтый осадок иодида свинца (II) в реакции двойного замещения.
Реакция горения
Реакция горения — это реакция, при которой вещество реагирует с газообразным кислородом, выделяя энергию в виде света и тепла. Реакции горения должны включать \ (\ ce {O_2} \) в качестве одного реагента. При сгорании газообразного водорода образуется водяной пар (см. Рисунок ниже).
\ [2 \ ce {H_2} \ left (g \ right) + \ ce {O_2} \ left (g \ right) + 2 \ ce {H_2O} \ left (g \ right) \]
Обратите внимание, что эта реакция также квалифицируется как реакция комбинации.
Рисунок 10.6.4: Hindenburg был дирижаблем, заполненным водородом, который потерпел аварию при попытке приземлиться в Нью-Джерси в 1937 году.Водород немедленно загорелся, образовав огромный огненный шар, уничтожив дирижабль и убив 36 человек. Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Химическая реакция была простой: водород соединяется с кислородом с образованием воды.
Многие реакции горения происходят с углеводородом, соединением, состоящим исключительно из углерода и водорода. Продуктами сгорания углеводородов всегда являются углекислый газ и вода. Многие углеводороды используются в качестве топлива, поскольку при их сгорании выделяется очень большое количество тепловой энергии.Пропан \ (\ left (\ ce {C_3H_8} \ right) \) — газообразный углеводород, который обычно используется в качестве источника топлива в газовых грилях.
\ [\ ce {C_3H_8} \ left (g \ right) + 5 \ ce {O_2} \ left (g \ right) \ rightarrow 3 \ ce {CO_2} \ left (g \ right) + 4 \ ce {H_2O } \ left (g \ right) \]
Пример 10.6.1
Этанол можно использовать в качестве источника топлива в спиртовой лампе. Формула для этанола \ (\ ce {C_2H_5OH} \). Напишите сбалансированное уравнение горения этанола.
Решение:
Шаг 1. Спланируйте проблему.
Спланируйте проблему.
Реагентами являются этанол и кислород. Как и в случае с углеводородами, продуктами сгорания спирта являются углекислый газ и вода.
Шаг 2: Решить.
Запишите скелетные уравнения: \ (\ ce {C_2H_5OH} \ left (l \ right) + \ ce {O_2} \ left (g \ right) \ rightarrow \ ce {CO_2} \ left (g \ right) + \ ce {H_2O} \ left (g \ right) \)
Сбалансируйте уравнение.
\ [\ ce {C_2H_5OH} \ left (l \ right) + 3 \ ce {O_2} \ left (g \ right) \ rightarrow 2 \ ce {CO_2} \ left (g \ right) + 3 \ ce {H_2O } \ left (g \ right) \]
Шаг 3. Подумайте о своем результате.
Реакции горения должны включать кислород в качестве реагента. Обратите внимание, что получаемая вода находится в газообразном, а не в жидком состоянии из-за высоких температур, сопровождающих реакцию горения.
Авторы
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.

Эллисон Соулт, Ph.D. (Департамент химии, Университет Кентукки)
Химические реакции: типы, определения и примеры
Что такое химическая реакция?
Химическая реакция — это процесс, в котором одно или несколько веществ превращаются в одно или несколько разных веществ.Исходные вещества называются реагентами, а образующиеся новые вещества — продуктами.
Что происходит во время химической реакции?
Химическая реакция может включать атомы, ионы, соединения или молекулы одного элемента. Во время химической реакции в реагентах разрываются химические связи между атомами, и в продуктах образуются новые химические связи. Атомы перестраиваются, образуя новые связи. Когда химические связи разрываются, положения электронов меняются, в результате чего получаются продукты, свойства которых отличаются от свойств реагентов.
Характеристики химической реакции
Есть способы определить химическую реакцию. Признаки, указывающие на реакцию, называются индикаторами химической реакции. Разрыв и образование связей считаются важной характеристикой протекания химической реакции. Следовательно, характеристики химической реакции включают:
Признаки, указывающие на реакцию, называются индикаторами химической реакции. Разрыв и образование связей считаются важной характеристикой протекания химической реакции. Следовательно, характеристики химической реакции включают:
- изменение цвета
- образование осадка
- образование газа
- изменение запаха
- изменение температуры
Как написать химическую реакцию?
Химическая реакция записывается уравнением с использованием химического символа элемента или соединения, участвующего в процессе реакции.Реагенты написаны слева, а продукты написаны справа. Стрелка разделяет их. Коэффициент перед соединением представляет собой количество молей, которые потребляются или образуются. Нижний индекс представляет количество атомов конкретного элемента, присутствующего в соединении. Наконец, балансировка уравнения гарантирует, что соотношение между реагентами и продуктом правильное.
Как уравновесить химическую реакцию?
Шаг 1: Определите каждый элемент уравнения. Количество атомов элемента должно быть одинаковым с каждой стороны уравнения.
Количество атомов элемента должно быть одинаковым с каждой стороны уравнения.
Шаг 2: Проверьте чистую оплату с каждой стороны уравнения. Чистая плата должна быть одинаковой с каждой стороны.
Шаг 3: Начните с элемента, входящего в состав одного соединения с каждой стороны уравнения, и найдите его количество атомов. Измените коэффициент так, чтобы количество атомов было одинаковым с каждой стороны уравнения. Не меняйте нижний индекс.
Шаг 4: После уравновешивания одного элемента повторите процесс с другим элементом.Продолжайте, пока все элементы не будут сбалансированы. Проще всего оставить элементы в чистом виде напоследок.
Шаг 5: Проверьте уравнение еще раз и убедитесь, что заряд и количество элементов в обеих частях уравнения также уравновешены.
Пример
Водород (H 2 ) и кислород (O 2 ) объединяются с образованием воды (H 2 O).
H 2 + O 2 → H 2 O
Реакция неуравновешенная.Чтобы сбалансировать это, сначала умножьте кислород на ½, как показано ниже:
H 2 + ½ x O 2 → H 2 O
Затем умножьте обе части на два, чтобы коэффициенты были целыми числами и уравнение получилось сбалансированным:
2 H 2 + O 2 → 2 H 2 O
Различные типы химических реакций и их классификация
Многие химические реакции можно разделить на пять основных типов.Полное понимание этих типов реакций полезно для предсказания продуктов неизвестной реакции. Пять основных типов химических реакций: комбинация, разложение, однократное замещение, двойное замещение и горение [1 — 5] .
Типы химических реакций1. Реакция синтеза или комбинирования
В реакции сочетания два или более веществ объединяются, образуя одно новое вещество. Комбинированные реакции называются реакциями синтеза.
Комбинированные реакции называются реакциями синтеза.
А + В → АВ
Примеры
- Твердый металлический натрий (Na) реагирует с газообразным хлором (Cl) с образованием твердого хлорида натрия (NaCl)
Na (s) + Cl 2 (г) → NaCl (s)
- Магний (Mg) быстро реагирует при воспламенении кислородом (O 2 ) с образованием тонкодисперсного порошка оксида магния (MgO).
2 мг (тв) + O 2 (г) → 2 MgO (тв)
2. Реакция разложения
В реакции разложения соединение распадается на два или более простых вещества.
АВ → А + В
Примеры
- Карбонат кальция (CaCO 3 ) разлагается на оксид кальция (CaO) и диоксид углерода (CO 2 ).
CaCO 3 (т) → CaO (т) + CO 2 (г)
- Гидроксид натрия (NaOH) разлагается с образованием оксида натрия (Na 2 O) и воды (H 2 O).

2 NaOH (тв) → Na 2 O (тв) + H 2 O (г)
3.Реакция однократного замещения или одинарного вытеснения
В реакции однократного замещения один элемент заменяет аналогичный элемент в соединении.
А + ВС → АС + В
Примеры
- Цинк (Zn) реагирует с соляной кислотой (HCl) с образованием водного хлорида цинка (ZnCl 2 ) и водорода (H 2 ).
Zn (тв.) + 2 HCl (водн.) → ZnCl 2 (водн.) + H 2 (г)
- Когда полоса металлического магния (Mg) помещается в водный раствор нитрата меди (II) (CuNO 3 ), она заменяет медь, что приводит к образованию водного раствора нитрата магния (MgNO 3 ) и твердой меди (Cu ) металл.
Mg (тв.) + Cu (NO 3 ) 2 (водн.) → Mg (NO 3 ) 2 (водн.) + Cu (s)
4. Реакция двойного замещения или двойного вытеснения
В реакции двойного замещения положительные и отрицательные ионы двух ионных соединений меняются местами с образованием двух новых соединений.
AB + CD → AD + CB
Реакция двойного замещения бывает двух типов.
а) Реакция осаждения
Образование нерастворимого твердого вещества в водном растворе называется реакцией осаждения.Твердое вещество называется осадком.
Примеры
- При смешивании водных растворов йодида калия (KI) и нитрата свинца (II) (Pb (NO 3 ) 2 ) в водном растворе нитрата калия (K 2) образуется нерастворимый йодид свинца (PbI 2 ). НЕТ 3 ).
2 KI (водн.) + Pb (NO 3 ) 2 (водн.) → K 2 NO 3 (водн.) + PbI 2 (s / ppt.)
- Раствор хлорида калия (KCl) и нитрата серебра (AgNO 3 ) образует белое нерастворимое твердое вещество, хлорид серебра (AgCl), в полученном растворе нитрата калия (KNO 3 ).
2 KCl (водн.) + AgNO 3 (водн. ) → KNO 3 (водн.) + AgCl (s / ppt.)
) → KNO 3 (водн.) + AgCl (s / ppt.)
б) Кислотно-основная реакция или реакция нейтрализации
Реакция между кислотой и основанием называется кислотно-основной реакцией или реакцией нейтрализации, и образуется вода.
Пример
- Смесь серной кислоты (H 2 SO 4 ) и гидроксида натрия (NaOH) дает сульфат натрия (Na 2 SO 4 ) и воду (H 2 O).
H 2 SO 4 (водн.) + 2 NaOH (водн.) → Na 2 SO 4 (водн.) + 2 H 2 O (л)
5. Реакция горения
Реакция горения — это реакция, при которой вещество реагирует с газообразным кислородом (O 2 ), выделяя энергию в виде света и тепла. Кислород должен присутствовать, чтобы произошла реакция горения.
Примеры
- При сгорании газообразного водорода (H 2 ) в присутствии кислорода (O 2 ) образуется водяной пар (H 2 O).

2 H 2 (г) + O 2 (г) → 2 H 2 O (г)
- Сжигание угля (углерода) в кислороде (O 2 ) с образованием диоксида углерода (CO 2 ).
C (т) + O 2 (г) → CO 2 (г)
- Пропан (C 3 H 8 ), газообразный углеводород, обычно используется в качестве источника топлива в газовых грилях. Он сгорает в кислороде (O 2 ) с образованием диоксида углерода (CO 2 ) и воды (H 2 O).
C 3 H 8 (г) + 5 O 2 (г) → 3 CO 2 (г) + 4 H 2 O (г)
Обратите внимание, что приведенные выше примеры представляют собой некоторые общие химические реакции, происходящие в повседневной жизни.
Другие типы химических реакций
1. Редокс-реакция
Окислительно-восстановительная реакция — это окислительно-восстановительная реакция, в которой степень окисления молекулы, атома или иона изменяется за счет получения или потери электронов. Считается, что атом, теряющий электроны, окислился, а атом, получающий электроны, восстанавливается.Окислительно-восстановительная реакция может быть комбинацией, разложением, однократным замещением и реакциями горения. Однако не все реакции горения являются окислительно-восстановительными.
Считается, что атом, теряющий электроны, окислился, а атом, получающий электроны, восстанавливается.Окислительно-восстановительная реакция может быть комбинацией, разложением, однократным замещением и реакциями горения. Однако не все реакции горения являются окислительно-восстановительными.
Пример
- Железо с нулевой степенью окисления реагирует с кислородом (O 2 ) с образованием оксида железа (III) со степенью окисления железа +3.
4 Fe + 3 O 2 → 2 Fe 2 O 3
Вышеупомянутая реакция также является реакцией сочетания.Здесь кислород называют окислителем, поскольку он окисляет железо до оксида железа (III).
2. Полимеризация
Полимеризация — это процесс, в котором относительно небольшие молекулы, называемые мономерами, химически соединяются с образованием обширной цепочечной или сетевой молекулы, называемой полимером. Этот процесс известен как цепная реакция.
Пример
- Полимеризация этилена (C 2 H 4 ) дает полиэтилен.
C 2 H 4 + C 2 H 4 + C 2 H 4 + — → (C 2 H 4 ) n
3. Гидролиз
Гидролиз — это процесс добавления воды для разложения молекулы на две части.
Пример
- Растворение серной кислоты (H 2 SO 4 ) в воде (H 2 O) дает бисульфат (HSO 3 —) и гидроний (H 3 O + )
4.Обезвоживание Синтез
Синтез дегидратации противоположен гидролизу. Здесь две молекулы объединяются, чтобы сформировать новую молекулу, сопровождающуюся удалением воды.
Пример
- Дегидратация этанола (C 2 H 5 OH) при 170 ⁰C дает этен (C 2 H 4 )
CH 3 — CH 2 — OH → CH 2 = CH 2 + H 2 O
5.Фотохимическая реакция
Фотохимическая реакция — это тип химической реакции, в которой реагенты получают энергию в виде фотонов от источника света, такого как солнце, с образованием продуктов.
Пример
- Фотография использует воздействие света на зерна хлорида серебра (AgCl) для создания изображения. Хлорид серебра (AgCl) разлагается на газообразное серебро (Ag) и хлор (Cl 2 ).
2 AgCl + hν → 2 Ag + Cl 2
6.Эндотермическая реакция
Химическая реакция называется эндотермической, когда она поглощает тепло из окружающей среды.
Пример
- Известняк или карбонат кальция (CaCO 3 ) разлагается при нагревании до высокой температуры.
 Это негашеная известь или оксид кальция (CaO) и диоксид углерода (CO 2 ).
Это негашеная известь или оксид кальция (CaO) и диоксид углерода (CO 2 ).
CaCO 3 (т) + тепло → CaO (т) + CO 2 (г)
7. Экзотермическая реакция
Химическая реакция называется экзотермической, когда выделяется тепло в окружающую среду.
Пример
- Оксид кальция (CaO) бурно реагирует с водой (H 2 O) с образованием гидроксида кальция (Ca (OH) 2 ) или гашеной извести.
CaO (тв.) + H 2 O (л) → Ca (OH) 2 (водн.) + Тепло
Скорость химической реакции
В химической реакции реагенты расходуются с образованием продуктов — концентрация реагентов уменьшается, а концентрация продуктов увеличивается.Скорость или скорость химической реакции — это изменение концентрации реагента или продукта в единицу времени.
Факторы, влияющие на скорость химических реакций
Это некоторые из факторов, влияющих на скорость химических реакций.
- Концентрация реагента
- Физическое состояние реагентов и площадь поверхности
- Температура
- Наличие катализатора — Катализатор — это вещество, которое может активировать и ускорять химическую реакцию.
Некоторые химические реакции также обратимы, т. Е. Продукты рекомбинируют, возвращая реагенты. В этом случае и прямая, и обратная реакции будут иметь свои скорости.
Химические реакции в повседневной жизни
Принимая во внимание изобилие веществ внутри и вокруг нас, нет ничего необычного в том, чтобы наблюдать примеры химических реакций в повседневной жизни. Вот некоторые из ярких примеров:
- Дыхание — Люди вдыхают кислород и выделяют углекислый газ.Это пример экзотермической реакции.
- Фотосинтез — Растения используют солнечный свет для преобразования углекислого газа в кислород, вид фотохимической реакции.
- Ржавчина — Железо постепенно вступает в реакцию с кислородом и окисляется с образованием оксида железа (III), широко известного как ржавчина.

- Горение — Горение топлива происходит экзотермически в транспортных средствах и на заводах.
Часто задаваемые вопросы
Q.1. Пожар — это химическая реакция?Отв. Пожар — это результат горения, при котором выделяются различные газы, такие как диоксид углерода, диоксид серы, диоксид азота, водяной пар, дым и другие газообразные вещества, в зависимости от источника пожара. Следовательно, это химическая реакция.
Q.2. Что происходит во время химической реакции?Отв. Материя состоит из атомов. Во время химической реакции атомы никогда не создаются и не разрушаются. Масса реагентов равна массе продуктов.Следовательно, масса или вещество сохраняется во время химической реакции.
Q.3. Что должно произойти, прежде чем может начаться химическая реакция? Отв. В любой химической реакции химические связи в реагентах разрываются, и образуются новые связи в продуктах. Следовательно, чтобы эффективно инициировать реакцию, реагенты должны двигаться достаточно быстро и с достаточной энергией, чтобы они сталкивались с силой, достаточной для разрыва связей.
Следовательно, чтобы эффективно инициировать реакцию, реагенты должны двигаться достаточно быстро и с достаточной энергией, чтобы они сталкивались с силой, достаточной для разрыва связей.
Отв. Нет. Во время таяния льда происходят только физические изменения. Химического изменения нет.
Q.5. Горение свечи — это химическая реакция?Отв. Да. Горение свечи — это реакция горения.
Q.6. Кипящая вода — это химическая реакция?Отв. Нет. Кипение воды — это физическое изменение, а не химическое изменение.
Q.7. В чем ключевое различие между химическими и ядерными реакциями? Отв. Ядерные реакции включают изменение ядра атома с образованием другого элемента. С другой стороны, химические реакции включают только перегруппировку электронов и не включают изменений ядер.
Отв. Взрывающийся фейерверк состоит из нескольких химических реакций, которые происходят одновременно или в быстрой последовательности.Две простые реакции, которые происходят при фейерверке, — это горение и окисление. Сгорание дает тепло, необходимое для быстрого окисления.
Рабочие листы по типам химических реакций
Список литературы
- Chem.libretexts.org
- Ucdsb.on.ca
- Ric.edu
- Opentextbc.ca
- Ausetute.com.au
- Chemistry.wustl.edu
Типы химических реакций — Введение и примеры
Что такое химическая реакция?
Химическая реакция — это процесс, в котором реагенты вступают в химическую реакцию и превращаются в продукты путем химического превращения.Например — Дыхание — мы вдыхаем кислород, который реагирует с глюкозой и производит углекислый газ, воду и энергию. Реакция приведена ниже —
Реакция приведена ниже —
C6h22O6 + 6O2 🡪 6CO2 + 6h3O + Energy
Характеристики химической реакции
Химические реакции показывают одну или несколько из следующих характеристик —
Выделение газа — Некоторые химические реакции происходят с выделение газа. Например, когда цинк реагирует с соляной кислотой, выделяется газообразный водород с образованием хлорида цинка.
Реакция — Zn + 2HCl 🡪 ZnCl2 + h3
Изменение цвета — Некоторые химические реакции сопровождаются изменением цвета. Например, при взаимодействии бесцветного нитрата свинца с иодидом калия образуется желтый осадок иодида свинца и бесцветного нитрата калия.
Реакция — Pb (NO3) + 2KI 🡪 PbI2 + 2KNO3
Бесцветный Бесцветный Желтый ppt бесцветный
Изменение температуры — Некоторые химические реакции сопровождаются изменением температуры.Например, некоторые реакции являются экзотермическими по своей природе, а некоторые — эндотермическими.
Изменение энергии — Химические реакции часто включают изменение энергии. Во время химической реакции энергия может выделяться или поглощаться. Например, в реакциях горения выделяется энергия, такая как горение топлива.
Образование осадка — Некоторые химические реакции сопровождаются образованием осадка. Например, хлорид бария реагирует с сульфатом натрия и образует хлорид натрия и осадок сульфата бария.
Реакция — BaCl2 + Na2SO4 🡪 BaSO4 + NaCl
Осадок
Изменение состояния — Некоторые химические реакции сопровождаются изменением состояния. Например, газообразный аммиак реагирует с газообразным хлористым водородом и образует твердые кристаллы хлорида аммония.
Реакция — Nh4 (г) + HCl (г) ↔️ Nh5Cl (т)
Типы химических реакций
Химические реакции бывают многих типов. Здесь мы рассмотрим восемь наиболее распространенных типов химических реакций, которые также входят в учебную программу по химии класса X.
Реакция разложения
Комбинированная реакция
Реакция горения
Реакция нейтрализации
Реакция однократного вытеснения
Реакция одинарного вытеснения
936
Реакция разложения — В реакции разложения молекулы или соединения распадаются на два или более чем два более простых химически новых вещества.Например, электролиз воды. При электролизе воды вода распадается на водород и кислород, которые обладают совершенно другими свойствами, чем вода.
Реакция — 2h3O электричество → 2h3 + O2
Комбинированная реакция — В комбинированной реакции две или более молекулы химически соединяются вместе с образованием нового вещества (соединения). Реакции объединения и разложения противоположны друг другу. Например, когда мы сжигаем магниевую ленту (или магний), получается серо-черный пепел оксида магния.
Реакции объединения и разложения противоположны друг другу. Например, когда мы сжигаем магниевую ленту (или магний), получается серо-черный пепел оксида магния.
Реакция — Mg + O2 🡪 MgO
Реакция горения — Это экзотермическая реакция, при которой выделяется энергия, обычно в виде тепла. Это реакция между топливом и окислителем (обычно кислородом воздуха), в результате чего образуется дым, вода и тепло. Например, когда мы сжигаем метан, он дает углекислый газ и воду.
Реакция — Ch5 + 2O2 🡪 CO2 + 2h3O
Реакция нейтрализации — В этих реакциях кислота и основание реагируют друг с другом и образуют соль и воду.Например, соляная кислота реагирует с гидроксидом натрия (основанием) и образует хлорид натрия (соль) и воду.
Реакция одинарного вытеснения — в этих реакциях более химически активный металл вытесняет менее химически активный металл из своей соли. В этих реакциях продукты могут быть определены с помощью ряда реактивности. Ряд реактивности — это ряд, в котором элементы расположены в порядке убывания их реактивности. Это означает, что элементы, присутствующие в верхней части этого ряда реактивности, более реактивны, чем элементы, присутствующие в нижней части.
Ряд реактивности — это ряд, в котором элементы расположены в порядке убывания их реактивности. Это означает, что элементы, присутствующие в верхней части этого ряда реактивности, более реактивны, чем элементы, присутствующие в нижней части.
Реакция калия с хлоридом магния является примером реакции однократного вытеснения. В этой реакции калий вытесняет магний из своей соли, потому что калий более активен, чем магний. Калий присутствует в верхней части ряда реакционной способности и является наиболее реактивным элементом.
Реакция — 2K + MgCl2 🡪 2KCl + Mg
Реакция двойного вытеснения — в этих реакциях два водных ионных соединения обмениваются своими ионами (в основном катионами) и образуют два новых соединения.Например, нитрат калия реагирует с хлоридом алюминия и образует нитрат алюминия и хлорид калия.
Реакция — KNO3 + AlCl3 🡪 Al (NO3) 3 + KCl
Реакция осаждения — В этих реакциях образуется нерастворимый осадок. В реакциях осаждения две растворимые соли в водных растворах объединяются и образуют нерастворимый осадок.
В реакциях осаждения две растворимые соли в водных растворах объединяются и образуют нерастворимый осадок.
Реакция — AgNO3 (водн.) + KCl (водн.) 🡪 AgCl + KNO3 (водн.)
Окислительно-восстановительная реакция — Те химические реакции, в которых окисление и восстановление протекают одновременно, называются окислительно-восстановительными реакциями.Окисление — это добавление кислорода, а восстановление — это добавление водорода (или удаление кислорода). Мы уже обсуждали окисление и восстановление в отдельной статье под названием «Окисление и восстановление». Вы можете обратиться к этой статье для подробного объяснения окисления и восстановления.
Реакция оксида меди с водородом является примером окислительно-восстановительной реакции. В этой реакции водород подвергся окислению за счет получения атома кислорода, в то время как оксид меди подвергся восстановлению за счет удаления кислорода.
(изображение будет скоро загружено)
Мы даем здесь общий список общих химических реакций —
Список общих химических реакций
S. | Химическая реакция | Уравнение | ||||||
Электролиз воды | 2h3O 9106 910 910 910 910 910 9109 910 910 910 9109 Ржавление железа | 4Fe + 3O2 🡪 2Fe2O3 | ||||||
Реакция негашеной извести (CaO) с водой | Ca🡪O0003 | Ca🡪O 2 OH) 2 известна как гашеная известь. | ||||||
Фотосинтез | 6CO2 + 6h3O 🡪 C6h22O6 + 6O2 (реакция протекает в присутствии солнечного света и хлорофилла) | 103
9 |
9 |
9 |
8 |
C6h22O6 + 6O2 🡪 6CO2 + 6h3O | ||
Сжигание водорода — реакция газообразного водорода с чистым водородом. | 2h3 + O2 🡪 2h3O + энергия | |||||||
Разложение FeSO4 | 2FeSO4 SO3 (г) + тепло Fe2O (Fe2O3 (s) зеленого цвета) | |||||||
Разложение нитрата свинца — В этой реакции образуются коричневые пары газообразного диоксида азота с желтым остатком оксида свинца. | 2Pb (NO3) 2 🡪 2PbO + 4NO2 + O2 | |||||||
Реакция вытеснения сульфата железа и меди — Железо более реактивно, чем медь, поэтому его соль вытесняет медь производит сульфат железа. | Fe + CuSO4 🡪 FeSO4 + Cu |
На этом мы заканчиваем рассмотрение Списка различных типов химических реакций. Мы надеемся, что вам понравилось учиться и вы смогли понять концепции.Мы надеемся, что после прочтения этой статьи вы сможете легко различать различные реакции, и это также поможет вам в экспериментах, потому что мы рассмотрели почти все важные химические реакции химических экспериментов класса X. Если вы ищете решения проблем NCERT Textbook на основе этой темы, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы получите доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакциях, пробным тестам и многому другому.
Мы надеемся, что вам понравилось учиться и вы смогли понять концепции.Мы надеемся, что после прочтения этой статьи вы сможете легко различать различные реакции, и это также поможет вам в экспериментах, потому что мы рассмотрели почти все важные химические реакции химических экспериментов класса X. Если вы ищете решения проблем NCERT Textbook на основе этой темы, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning App. Таким образом вы получите доступ к бесплатным PDF-файлам решений NCERT, а также к заметкам о редакциях, пробным тестам и многому другому.
6 типов химических реакций с примерами, уравнением и определением
Типы химических реакций — Химия — это все о связях и реакциях. Химическая реакция — это процесс, в котором происходят химические изменения между реагентами и продуктами образования. Движение электронов, разрыв связей, образование блондей приводит как к образованию продукта, так и к образованию побочных продуктов. Если вы химик, вам придется столкнуться с различными химическими реакциями. В химической промышленности химические реакции проводятся в реакторах в больших масштабах для производства продуктов.Вы можете узнать о типах реакторов в статье, т.е. о типах химических реакторов.
В химической промышленности химические реакции проводятся в реакторах в больших масштабах для производства продуктов.Вы можете узнать о типах реакторов в статье, т.е. о типах химических реакторов.
Есть несколько типов химических реакций, но есть 6 основных типов реакции , и они представляют собой комбинацию, разложение, однократное вытеснение, второе вытеснение, осаждение. Давайте разберемся с этими различными типами химических реакций вместе с примерами.
Вы можете увидеть число «N» реакций, которое вы используете, если подготовка является продуктом и результатом химической реакции, пластмассы, стекла, кирпичей, бумаги и многих других.Следовательно, химические реакции важны для полезного для нас продукта. Прежде чем перейти к типам химических реакций, давайте вкратце разберемся, что такое химическая реакция и определение химической реакции.
Что такое химическая реакция?
Химическая реакция — это процесс, в котором два или более элемента позволяют взаимодействовать друг с другом с образованием продукта. В химической реакции. Элемент, используемый в химической реакции, известен как реагенты. Во время химической реакции происходит разрыв и образование химической связи, что приводит к информации о продукте.
В химической реакции. Элемент, используемый в химической реакции, известен как реагенты. Во время химической реакции происходит разрыв и образование химической связи, что приводит к информации о продукте.
Химическая реакция происходит с определенной скоростью, известной как скорость реакции, которая зависит от таких факторов, как концентрация реагентов, давление и температура. Во время химической реакции исходные свойства реагента изменяются, и, следовательно, свойства продукта отличаются от свойств реагента.
Это было введение в то, что такое химическая реакция, теперь давайте изучим типы химических реакций с примерами и объяснениями.
Типы химических реакций
Существует множество химических реакций или, можно сказать, бесчисленное количество, но для простоты мы можем разделить в основном на 6 типов химических реакций.Тип реакции также может делиться на несколько типов. Давайте двинемся вперед и посмотрим типы химических реакций.
1. Комбинированная реакция
Комбинированный тип химической реакции также известен как реакция синтеза, при которой двухкомпонентные компоненты взаимодействуют друг с другом и приводят к новому продукту.
А + В → С
Это простейшая форма реакции, в которой А и В являются реагентами, которым позволяют реагировать друг с другом, и они образуют C в качестве продукта.
Пример 1 — Реакция сочетания
S + O2 → SO2
Это пример комбинированной реакции, в которой S, то есть сера, может реагировать с кислородом, и в результате образуется диоксид серы
Пример 2 — Комбинированная химическая реакция
2Na (т.) + Cl2 (г) → 2NaCl (т)
В указанной выше реакции натрий реагирует с хлорином, и мы получаем хлорид натрия в качестве продукта.
2. Реакция разложения
Реакция разложения — это тип реакции, в которой соединение распадается на два или несколько простых веществ / элементов.Его также можно определить как реакцию, которая расщепляет компонент на более простые формы вещества, но при определенных условиях. Это можно рассматривать как обратную реакцию реакции сочетания. Существуют различные типы реакций разложения, такие как реакция термического разложения, реакция электролитического разложения, фотолитическое разложение и т. Д.
Существуют различные типы реакций разложения, такие как реакция термического разложения, реакция электролитического разложения, фотолитическое разложение и т. Д.
AB → A + B
В указанной выше реакции AB представляет собой продукт, который при определенных условиях распадается на двухкомпонентные, то есть A и B.
Реакция разложения пример
CaCO3 → CaO + CO2
В этой реакции карбонат кальция разлагается с образованием карбоната кальция и диоксида углерода в газообразной форме.
3. Реакция вытеснения / реакция одинарного вытеснения
В реакции замещения еще один реактивный элемент заменит другой менее реактивный элемент в соединении. В этой реакции элементы, образующие анион, могут только замещать анионы, а элементы, образующие катион, могут только замещать катион.
AB + C → AC + B
В приведенной выше реакции AB — это вещество, которое вступает в реакцию с веществом C. Во время этой реакции C более реакционноспособен, чем B, и, следовательно, B заменяется на C и образует продукт AC.
Во время этой реакции C более реакционноспособен, чем B, и, следовательно, B заменяется на C и образует продукт AC.
4. Реакция двойного вытеснения
В реакции двойного замещения реагенты каждого соединения образуют анион и катион и меняют положение аниона на анион и катион на катион между двумя разными соединениями и образуют совершенно разные продукты.
A + B — + C + D — → A + C — + B + D —
В указанной выше реакции AB и CD являются реагентами, которые образуют анион и катион, и положение переключателя
BaCl 2 + Na 2 SO 4 → BaSO 4 + 2NaCl
В указанной выше химической реакции BaCl 2 будет из катионов Ba +2 и Cl — в качестве аниона, а в Na2SO4, в котором Na будет терять электроны и образовывать катионы i.е. Na +, в то время как SO2-4 получит электор и образует анион. Эти анионы обмениваются с анионом и из
Эти анионы обмениваются с анионом и из
5. Реакция горения
Реакция горения — это тип реакции, в которой вещество, обычно углеводород, подвергается реакции окисления. Он в основном реагирует с газообразным кислородом и выделяет энергию в виде тепла или света, а также с другими веществами. Есть разные типы реакций горения. Мы подробно рассмотрели этапы возгорания.
C x H y + O 2 → + OCO + H 2 O Тепло (энергия)
Реакция горения широко используется в нашей повседневной жизни i.е для приготовления пищи. Сжиженный нефтяной газ, который мы получаем в баллонах с трубным газом при образовании искры, выделяет тепло, и это сгорание используется для приготовления пищи.
C (т) + O 2 (г) → CO 2 (г) + энергия
6. Реакция осаждения
В реакции осаждения два водных раствора, содержащих соли, объединяются, образуется нерастворимая соль. Эта нерастворимая соль известна как осадок. Эти реакции в основном представляют собой реакции двойного замещения, в которых образуется твердая нерастворимая соль, также известная как осадок.
Эта нерастворимая соль известна как осадок. Эти реакции в основном представляют собой реакции двойного замещения, в которых образуется твердая нерастворимая соль, также известная как осадок.
AB + CD → AD (нерастворимый) + BC
Пример реакции осаждения
AgNO 3 (водн.) + K 2 Cr 2 O 7 (водн.) → Ag 2 Cr 2 O 7 (с) + KNO 3 (водн.)
В указанной выше реакции AgNO 3 (водн.) и K 2 Cr 2 O 7 (водн.) находятся в водной форме при смешивании друг с другом, Ag 2 Cr 2 O 7 , поскольку нерастворимая соль образуется в виде осадка, а KNO 3 находится в водном состоянии.
Примеры химических реакций
| Типы реакций | Примеры |
|---|---|
| Комбинированная реакция | A + B → C |
| Реакция разложения | AB → A + B |
| Двойное вытеснение | A + B — + C + D — → A + C — + B + D — |
| C x H y + O 2 → + OCO + H 2 O Тепло (энергия) | |
| Реакция осаждения | AB + CD → AD (нерастворимый) + BC |
FAQ — Типы химических реакций
Que 1 — Какие 6 типов химических реакций?
Существует шесть основных типов химической реакции, и это
1. Комбинированная реакция
Комбинированная реакция
2. Реакция разложения
3. Реакция вытеснения
4. Реакция двойного вытеснения
5. Реакция горения
6. Реакция осаждения
Que 2 — Какая химическая реакция приведите пример?
Химическая реакция — это процесс, в котором два или более элемента позволяют взаимодействовать друг с другом с образованием продукта
Завершение
Это была статья об определении химической реакции и типах химических реакций, объясненных с примерами.Если у вас есть сомнения по теме, не стесняйтесь использовать раздел комментариев. Вы также можете предложить нам тему, которую мы рассматриваем. Мы публиковали различные статьи, связанные с химической инженерией и промышленной безопасностью, например, что такое заливка насоса. Мы также рассмотрели «Типы опасностей в химической промышленности», которые помогут вам расширить свои знания о безопасности на рабочем месте. Убедитесь, что вы загрузили наше официальное приложение из Google PlayStore, чтобы получать знания на кончиках пальцев.
Химические уравнения — Типы реакций — KS3 Chemistry Revision
Изменения в химических реакциях можно моделировать с помощью уравнений.Обычно вы пишете:
Реагенты показаны слева от стрелки, а продукты показаны справа от стрелки. Не пишите знак равенства вместо стрелки. Если реагентов или продуктов несколько, они разделяются знаком плюс.
Словарные уравнения
Словесные уравнения показывают названия каждого вещества, участвующего в реакции, и не должны включать никаких химических символов или формул. Например:
медь + кислород → оксид меди
В этой реакции медь и кислород являются реагентами, а оксид меди является продуктом.
11k4zg5tfr8.0.0.0.1:0.1.0.$0.$3.$0″> Сбалансированные уравненияСбалансированное уравнение дает больше информации о химической реакции, поскольку включает символы и формулы соответствующих веществ. Написание сбалансированного уравнения состоит из двух этапов:
- замените название каждого вещества его символом или формулой
- используйте числа, чтобы сбалансировать уравнение, если оно еще не сбалансировано
В приведенном выше примере (реакция между медь и кислород для образования оксида меди), мы получаем это на первом этапе:
Cu + O 2 → CuO
11k4zg5tfr8.0.0.0.1:0.1.0.$0.$3.$5″> Это несбалансированное, потому что есть один атом меди с каждой стороны стрелки, но два атома кислорода на слева и только один справа.Чтобы сбалансировать уравнение, вам нужно отрегулировать количество единиц некоторых веществ, пока мы не получим равное количество атомов каждого типа с обеих сторон. Вы никогда не должны изменять формулу вещества для этого.Вот уравнение сбалансированного символа:
2Cu + O 2 → 2CuO
Вы можете видеть, что теперь у нас есть два атома меди и два атома кислорода с каждой стороны. Это соответствует тому, что происходит в реакции:
Два атома меди реагируют с одной молекулой кислорода с образованием двух единиц оксида меди Вот еще несколько примеров сбалансированных уравнений. Убедитесь, что вы понимаете, почему они сбалансированы:
Убедитесь, что вы понимаете, почему они сбалансированы:
- C + O 2 → CO 2
- 2H 2 + O 2 → 2H 2 O
- 2Mg + O 2 → 2MgO
- CuCO 3 → CuO + CO $3″> 2
- Mg + 2HCl → MgCl 2 + H 2
Химическая реакция — New World Encyclopedia
Пары хлористого водорода в химическом стакане и аммиак в тесте трубки встречаются, чтобы сформировать облако нового вещества, хлорида аммония.химическая реакция — это процесс, который приводит к взаимному превращению химических веществ. [1] Вещества, изначально участвующие в химической реакции, называются реагентами , а вещества, образующиеся в результате реакции, называются продуктами . Учитывая, что химические реакции обычно характеризуются химическим изменением, они дают один или несколько продуктов, которые, как правило, отличаются от реагентов.
Классически химические реакции включают в себя изменения, которые строго связаны с движением электронов в образовании и разрыве химических связей. Однако общее понятие химической реакции, в частности понятие химического уравнения, применимо к превращениям элементарных частиц и ядерным реакциям.
Однако общее понятие химической реакции, в частности понятие химического уравнения, применимо к превращениям элементарных частиц и ядерным реакциям.
Для синтеза желаемого продукта может быть проведена серия различных химических реакций. В биохимии набор химических реакций, катализируемых ферментами, составляет метаболические пути, в которых осуществляются синтез и разложение, которые обычно невозможны в условиях внутри клетки.
В каждом живом организме происходят химические реакции, позволяющие ему выживать, расти и воспроизводиться.Кроме того, исследователи и инженеры-химики используют химические реакции для производства широкого спектра материалов, включая нефтехимические продукты, агрохимикаты, керамику, полимеры и каучук (эластомеры), олеохимические вещества (масла, жиры и воски), взрывчатые вещества, ароматизаторы и ароматизаторы. Современное общество сильно зависит от этих продуктов.
Химические уравнения
Химическая реакция символически представлена химическим уравнением , в котором один набор веществ, называемый реагентами , преобразуется в другой набор веществ, называемый продуктами . Реагенты и продукты показаны с использованием их химических формул, а стрелка используется для указания направления реакции. Реагенты обычно располагаются слева от стрелки, а продукты — справа. Если реакция необратима, используется одинарная стрелка; если реакция обратимая, используется двойная стрелка (указывающая в противоположных направлениях).
Реагенты и продукты показаны с использованием их химических формул, а стрелка используется для указания направления реакции. Реагенты обычно располагаются слева от стрелки, а продукты — справа. Если реакция необратима, используется одинарная стрелка; если реакция обратимая, используется двойная стрелка (указывающая в противоположных направлениях).
Например, горение метана в кислороде может быть представлено следующим уравнением:
- CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Это уравнение представляет собой необратимую реакцию, в которой одна молекула метана реагирует с двумя молекулами кислорода с образованием одной молекулы углекислый газ и две молекулы воды.
Типы реакций
Большое разнообразие химических реакций и подходов к их изучению приводит к существованию нескольких совпадающих, часто частично совпадающих, способов их классификации. Ниже приведены примеры широко используемых терминов для описания общих типов реакций.
- Изомеризация, при которой химическое соединение претерпевает структурную перестройку без изменения его чистого атомного состава; см. стереоизомерию
- Прямая комбинация или синтез, в котором два или более химических элемента или соединения объединяются с образованием более сложного продукта:
- N 2 + 3 H 2 → 2 NH 3
- 2 H 2 O → 2 H 2 + O 2
- Одиночное перемещение или замещение, характеризующееся тем, что элемент вытесняется из соединения более реактивным элементом:
- 2 Na (s) + 2 HCl (водн.) → 2 NaCl (водн.) + H 2 (g)
- Метатезис или Реакция двойного вытеснения , в которой два соединения обмениваются ионами или связями с образованием различных соединений:
- NaCl (водн.) + AgNO 3 (водн.
 ) → NaNO 3 (водн.) + AgCl (s)
) → NaNO 3 (водн.) + AgCl (s)
- NaCl (водн.) + AgNO 3 (водн.
- Кислотно-основные реакции, в целом охарактеризованные как реакции между кислота и основание могут иметь разные определения в зависимости от используемой кислотно-основной концепции.Вот некоторые из наиболее распространенных:
- Определение Аррениуса: кислоты диссоциируют в воде с выделением ионов H 3 O + ; основания диссоциируют в воде, высвобождая ионы OH — .
- Определение Бренстеда-Лоури: кислоты являются донорами протонов (H + ); основания являются акцепторами протонов. Включает определение Аррениуса.
- Определение Льюиса: Кислоты являются акцепторами электронных пар; основания являются донорами электронных пар. Включает определение Бренстеда-Лоури.
- Окислительно-восстановительные реакции, в которых происходят изменения степени окисления атомов в участвующих частицах. Эти реакции часто можно интерпретировать как перенос электронов между разными молекулярными участками или видами.
 В следующем примере окислительно-восстановительной реакции I 2 (йод) восстанавливается до I — (йодид-анион), а S 2 O 3 2- (тиосульфат-анион) окисляется до S . 4 O 6 2-:
В следующем примере окислительно-восстановительной реакции I 2 (йод) восстанавливается до I — (йодид-анион), а S 2 O 3 2- (тиосульфат-анион) окисляется до S . 4 O 6 2-:
- 2 S 2 O 3 2- (водн.) + I 2 (водн.) → S 4 O 6 6 6 2- (водн.) + 2 I — (водн.)
- Горение, разновидность окислительно-восстановительной реакции, в которой любое горючее вещество соединяется с окисляющим элементом, обычно кислородом, с выделением тепла и образованием окисленных продуктов. .Термин горение обычно используется только для крупномасштабного окисления целых молекул, т.е. контролируемое окисление одной функциональной группы не является горением.
- C 10 H 8 + 12 O 2 → 10 CO 2 + 4 H 2 O
- CH 2 S + 6 F 2 → CF 4 + 2 HF + SF 6
Реакции также можно классифицировать по их механизму, некоторые типичные примеры:
- Реакции ионов, эл.
 г. диспропорционирование гипохлорита
г. диспропорционирование гипохлорита - Реакции с реакционноспособными ионными промежуточными продуктами, например реакции енолятов
- Радикальные реакции, например горение при высокой температуре
- Реакции карбенов
- Реакции ионов, эл.
Органические реакции
Органические реакции охватывают широкий спектр реакций с участием соединений, в молекулярной структуре которых основным элементом является углерод. Реакции, в которых может принимать участие органическое соединение, в значительной степени определяются его функциональными группами.
Нет ограничений на количество возможных органических реакций и механизмов. Однако наблюдаются определенные общие закономерности, которые можно использовать для описания многих общих или полезных реакций. Каждая реакция имеет ступенчатый механизм реакции, объясняющий, как это происходит. Органические реакции можно разделить на несколько основных типов, при этом некоторые реакции можно отнести к нескольким категориям. Некоторые из основных типов органических химических реакций указаны ниже.
Некоторые из основных типов органических химических реакций указаны ниже.
- Реакции присоединения, включая такие реакции, как галогенирование, гидрогалогенирование и гидратация.Основываясь на механизме, основные реакции присоединения классифицируются как электрофильные, нуклеофильные или радикальные.
- Реакции элиминирования, включая такие процессы, как дегидратация.
- Реакции замещения делятся на несколько типов: нуклеофильное алифатическое замещение с механизмами реакции SN1, SN2 и SNi; нуклеофильное ароматическое замещение; нуклеофильное ацильное замещение; электрофильное замещение; электрофильное ароматическое замещение; и радикальное замещение.
- Органические окислительно-восстановительные реакции — это окислительно-восстановительные реакции, характерные для органических соединений и очень распространенные.
- Реакции перегруппировки делятся на 1,2-перегруппировки, перициклические реакции и реакции метатезиса.

- В реакциях конденсации два реагента объединяются, и небольшая молекула (обычно вода) отщепляется. Противоположная реакция, когда в реакции расходуется вода, называется гидролизом. Многие реакции полимеризации происходят из органических реакций.Они подразделяются на полимеризацию присоединением и полимеризацию ступенчатого роста.
Химическая кинетика
Скорость химической реакции — это мера того, как концентрация или давление вовлеченных веществ изменяется со временем. Анализ скоростей реакций важен для нескольких приложений, таких как химическая инженерия или исследование химического равновесия. Скорость реакции зависит в основном от:
- Концентрации реагента, которые обычно заставляют реакцию протекать быстрее, если повышаются за счет увеличения количества столкновений в единицу времени.
- Площадь поверхности, доступная для контакта между реагентами, в частности твердыми в гетерогенных системах. Большая площадь поверхности приводит к более высокой скорости реакции.

- Давление: увеличивая давление, вы уменьшаете объем между молекулами. Это увеличит частоту столкновений молекул.
- Энергия активации, которая определяется как количество энергии, необходимое для начала и самопроизвольного протекания реакции. Более высокая энергия активации означает, что реагентам требуется больше энергии для начала, чем реакция с более низкой энергией активации.
- Температура, которая при повышении ускоряет реакцию, поскольку более высокая температура увеличивает энергию молекул, вызывая больше столкновений в единицу времени,
- Наличие или отсутствие катализатора. Катализаторы — это вещества, которые изменяют путь (механизм) реакции, что, в свою очередь, увеличивает скорость реакции за счет снижения энергии активации, необходимой для протекания реакции. Катализатор не разрушается и не изменяется во время реакции, поэтому его можно использовать снова.
- Для некоторых реакций необходимо присутствие электромагнитного излучения, особенно ультрафиолетового, чтобы способствовать разрыву связей и началу реакции.
 Это особенно верно для реакций с участием радикалов.
Это особенно верно для реакций с участием радикалов.
Скорость реакции связана с концентрацией веществ, участвующих в реакции, что определяется законом скорости каждой реакции. Обратите внимание, что скорость некоторых реакций не зависит от концентраций реагентов. Это реакции нулевого порядка.
См. Также
Банкноты
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Раймонд.2006. Химия , 9 изд. Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия , 4-е изд. Нью-Йорк: Вили. ISBN 0471027758
- Макмерри, Дж. И Р.С. Фэй. 2004. Химия , 4-е изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0131402080
- Макмерри, Джон. 2004. Органическая химия , 6-е изд. Бельмонт, Калифорния: Брукс / Коул. ISBN 0534420052
- Моррисон, Роберт Т.
 , и Роберт Н. Бойд. 1992. Органическая химия , 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-643669-2
, и Роберт Н. Бойд. 1992. Органическая химия , 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-643669-2 - Solomons, T.W. Грэхем и Крейг Б. Фрайл. 2004. Органическая химия , 8-е изд. Хобокен, Нью-Джерси: Джон Вили. ISBN 0471417998
Внешние ссылки
Все ссылки получены 8 февраля 2017 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, и на самоотверженных добровольцев, вносящих вклад в Фонд Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
класс 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula.

 Ca + Cl2→ CaCl2
Ca + Cl2→ CaCl2
 Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н 2 О + е — → Н + ОН.
Потерянный электрон, в свою очередь, также параллельно реагирует с нейтральными молекулами оксида гидрогена, способствуя их распаду на радикалы Н и ОН: Н 2 О + е — → Н + ОН.


 Это негашеная известь или оксид кальция (CaO) и диоксид углерода (CO 2 ).
Это негашеная известь или оксид кальция (CaO) и диоксид углерода (CO 2 ).
 No.
No. Это экзотермическая реакция.
Это экзотермическая реакция. ) → NaNO 3 (водн.) + AgCl (s)
) → NaNO 3 (водн.) + AgCl (s) В следующем примере окислительно-восстановительной реакции I 2 (йод) восстанавливается до I — (йодид-анион), а S 2 O 3 2- (тиосульфат-анион) окисляется до S . 4 O 6 2-:
В следующем примере окислительно-восстановительной реакции I 2 (йод) восстанавливается до I — (йодид-анион), а S 2 O 3 2- (тиосульфат-анион) окисляется до S . 4 O 6 2-: г. диспропорционирование гипохлорита
г. диспропорционирование гипохлорита

 Это особенно верно для реакций с участием радикалов.
Это особенно верно для реакций с участием радикалов. , и Роберт Н. Бойд. 1992. Органическая химия , 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-643669-2
, и Роберт Н. Бойд. 1992. Органическая химия , 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0-13-643669-2