Агрегатные состояния вещества: твердое жидкое и газообразное. Влияние температуры, давления и примесей
Существует три основные состояния вещества — газообразное, жидкое и твердое. В физике эти состояния называют агрегатными. Итак, агрегатное состояние вещества называют физическое состояние, которое напрямую зависит от таких основных характеристик как давление и температура.
Пребывая в том или ином состоянии, веществам свойственны разнообразные структуры. Кроме перечисленных трех основных агрегатных состояний существуют и другие, но мы в рамках статьи не будем в них углубляться.

Влияние энергии движения частиц на свойства агрегатных состояний веществ
Как известно, любое вещество состоит из молекул, которые в свою очередь делятся на атомы. В качестве частиц кроме молекул могут рассматриваться и ионы, в которые превращаются атомы или их группы. На самом деле, ионы или молекулы имеют сложную форму построения, но для упрощения их построения и создания визуальной наглядности их представляют в сферическом виде.
Абсолютно во всех веществах сила взаимного притяжения между их частицами препятствуют их передвижению друг относительно друга. Однако с ростом температуры кинетическая энергия частиц начинает расти и тем создавая все большее противодействие силе притяжения между частицами. Агрегатное состояние вещества зависит от отношения приобретенной кинетической энергии частицы к силе их взаимного притяжения.
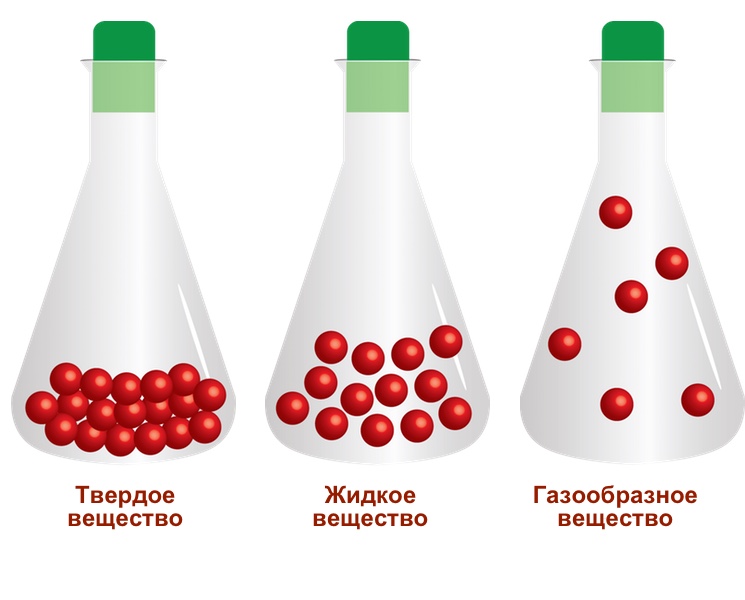
Проще говоря, от того, насколько свободно и дальше может «гулять» молекулы относительно других и зависит текущее физическое состояние вещества. Изменяя показатели температуры и давления можно наблюдать переход из одного состояния в другое.
Самый распространенный пример перехода из одного состояния в другое в жизни можно наблюдать на примере трех состояний молекулы воды: твердом в качестве льда при температуре ниже 0 0С, жидком при температуре выше 00С и газообразном паре, который образуется после закипания воды при температуре 100 0С и выше.
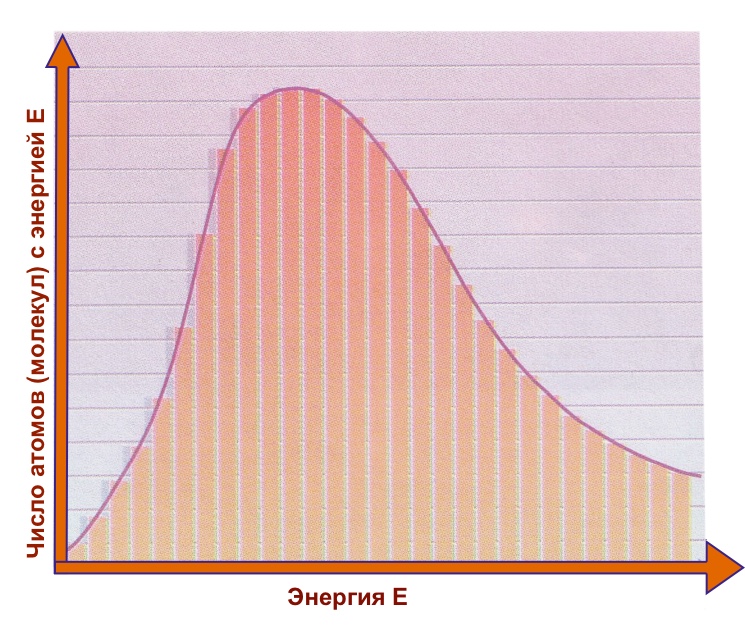
На этом графике показано, как изменяется энергия частиц вещества в твердом, жидком и газообразном состояниях. Чем больше энергия, тем быстрее частицы движутся или колеблются. Небольшая доля частиц обладает очень низкой или очень высокой энергией.
Твердое агрегатное состояние
В твердых веществах за счет сильного взаимного притяжения у частиц нет возможности развивать необходимую кинетическую энергию и тем самым передвигаться свободно от заданной позиции при условии сохранения текущей температуры и давления. Частицы твердых веществ располагаются тесно друг от друга и образуют определенную структуру, которую называют кристаллической решеткой.
В твердом веществе молекулы плотно «упакованы». Как правило они образуют регулярную структуру, называемую кристаллической решеткой.
Эталонным примером регулярной кристаллической решетки является кристалл.
Жидкое агрегатное состояние
Отличительным свойством жидкости является их текучесть, вследствие чего они способны менять свою форму. Жидкость, налитая в сосуд, моментально принимает его форму и под воздействием гравитационной силы Земли располагается на его дне. Граница верхней поверхности жидкости при этом образует гладкую плоскость. Кинетическая энергия движения молекул воды превосходит их взаимное притяжение, которое не способно в свою очередь удержать их не месте. Молекула воды словно перекатывается от одной к другой создавая видимую нашим глазом текучесть.
Молекулы жидкости могут свободно двигаться как и молекулы газ. Однако «упакованы» они плотнее, что больше похоже на твердое вещество.
Жидкость, в отличие от твердых тел, не имеет кристаллической решетки.
Газообразное агрегатное состояние
Газообразное вещество как и жидкость заполняет сосуд, только в отличии от жидкости — весь его объем. Прощу говоря, наполовину налитая жидкость в сосуд не может заполнить весь ее объем, а газ может. Это достигается благодаря очень высокой кинетической энергии молекул газа, которая в разы превосходит энергию их взаимного притяжения, а также гравитационную силу. Поэтому газ не скатывается как жидкость на дно сосуда. Газ, как и жидкость не имеет кристаллической решетки в отличии от твердого тела.
Молекулы газа расположены на значиельном расстояниии друг от друга. Они движутся с большой скоростью. Скорость около 300 км/ч, сталвикаясь при этом между собой и ударяяс о стенки сосуда, в котором находятся.
Взаимное расположения между молекулами газа свободно изменяется, что позволяет различным телам проходить сквозь его молекулы.
Точка плавления
Физические агрегатные состояния веществ способны переходить с одного вида в другие — из твердых в жидкие, из жидких в газообразные при изменении их температуры. Изменение температуры ведет к увеличению или к уменьшению кинетической энергии. Переход твердого вещества в жидкое называют плавлением.
Границу перехода из твердого состояния в жидкое задает так называемая точка плавления с температурой, способной возбудить кинетическую энергию в частице, которой будет достаточно, чтобы отделиться от своего стационарного положения кристаллической решетки. Чем больше температура, тем больше передаваемая кинетическая энергия частицам элемента. Чем сильнее сила притяжения между частицами, тем больше необходимо создать кинетической энергии для высвобождения частиц из кристаллической решетки.
К примеру, железо необходимо нагреть до 1538 0С для того, чтобы оно начало плавиться, а тугоплавкий вольфрам — до 3422 0С.
Во время литья расплавленное (раскаленное добела) железо выливается в приготовленную форму.

При температуре ниже 1535 0С железо затвердевает, принимая вид литейной формы.
Температура плавления вещества зависит от сил притяжения составляющих его частиц.
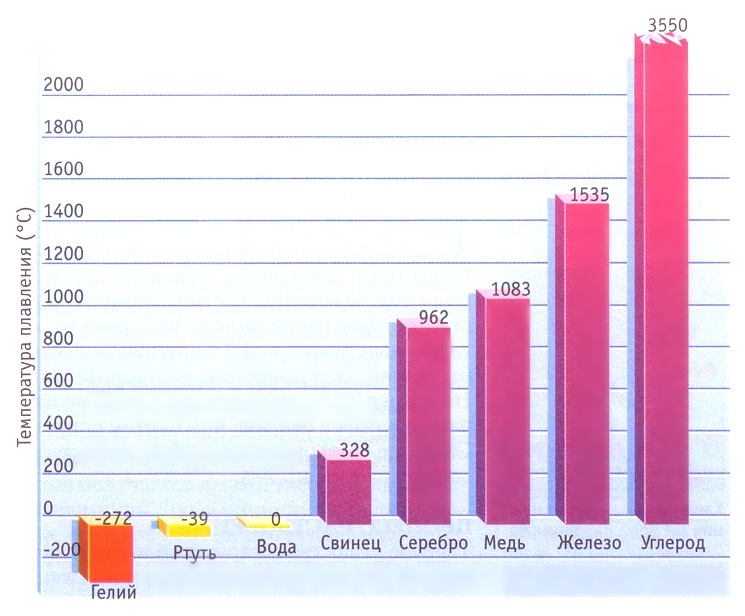
Для гелия эти силы настолько малы, что он становится твердым при давлении по крайней мере в 25 раз выше атмосферного.
Точка кипения
Пожалуй, самое распространенное явление перехода жидкого состояния в газообразное в быту — это кипение воды. Заваривая чай каждый из нас мог наблюдать рождение процесса кипения воды. Маленькие пузырьки пара в толще подогревающейся воды постепенно растут и достигая критических размеров начинают подниматься на поверхность, где лопаясь превращаются в газообразное состояние — пар.
Как и в случае с плавлением существует граничная температура, называемая точкой кипения, при которой кинетическая энергия становится достаточной для того, чтобы преодолеть силы взаимного притяжения частиц, не дающие оторваться друг от друга и покинуть занимаемый объем. Любой элемент таблицы Менделеева или вещество из нескольких элементов имеет свою точку кипения. Чистая дистиллированная вода (H2O) имеет температуру кипения 100 0С, этиловый спирт — (-79 0С), а высококонцентрированная серная кислота кипит при температуре 338 0С.
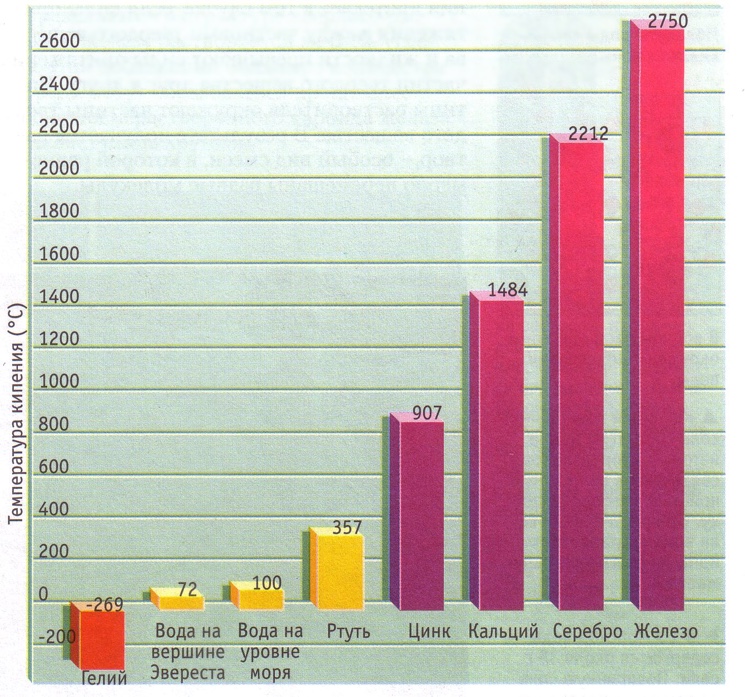
Температура кипения также зависит от давления и сил притяжения между частицами.
На вершине Эвереста температура кипения воды на 28 0С ниже, чем внизу, над уровнем моря.
Однако, существуют исключения, при котором вещества могут миновать при переходе из одного агрегатного состояния в другую целую фазу превращения — переходя из твердого сразу в газообразную. Этот эффект называют сублимацией или возгонкой.
Видео подборки опытов с сухим льдом
В качестве примера можно привести превращение сухого льда (диоксид углерода в твердом виде сразу в газообразное при температуре -78,5 0С.
Влияние давления и различных примесей на кипение или плавление
Вторым фактором, влияющим на агрегатное состояние вещества это давление. Повышая давление сила прижатия одной частицы вещества к другой растет, и таким образом необходимо для перехода из одного состояния в другое приложить большую кинетическую энергию (температуру). Образуется следующая взаимосвязь: температура кипения и плавления растет при повышении давления.
Примеси в частицах вещества также влияют на фактическую температуру плавления или кипения за чтоб того, что они влияют на существующие силы притяжения между частицами. Одним из ярких примеров влияние примесей — рассыпанные кристаллы соли на льду, которые заставляют лед превращаться в жидкость при температуре окружающей среды ниже нуля.
Агрегатное состояние — Википедия
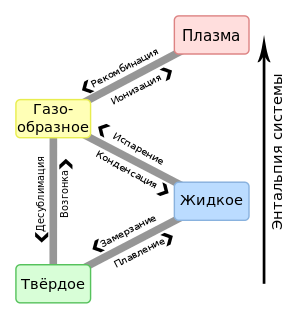
Агрега́тное состоя́ние вещества (от лат. aggrego «присоединяю») — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин. [1]
Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ. К агрегатным состояниям принято причислять также плазму[2], в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Существуют и другие агрегатные состояния.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью
Четыре основных состояния
Твёрдое тело
 Кристаллические вещества: атомное разрешение изображения титаната стронция. Яркие атомы — Sr, темнее их Ti.
Кристаллические вещества: атомное разрешение изображения титаната стронция. Яркие атомы — Sr, темнее их Ti.В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все вещества замерзают — превращаются в твёрдые тела. Температура затвердевания может быть несколько повышена при увеличении давления. Твёрдые тела делятся на кристаллические и аморфные. С микроскопической точки зрения твёрдые тела характерны тем, что молекулы или атомы в них в течение длительного времени сохраняют своё среднее положение неизменным, только совершая колебания с небольшой амплитудой вокруг них. В кристаллах средние положения атомов или молекул строго упорядочены. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки. Естественная форма кристаллов — правильные многогранники.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Частным случаем аморфного состояния является стеклообразное состояние. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется. Аморфное тело можно рассматривать как жидкость с очень большой (часто бесконечно большой) вязкостью. Кристаллические твёрдые тела имеют анизотропные свойства, то есть их отклик на приложенные внешние силы зависит от ориентации сил относительно кристаллографических осей. В твердотельном состоянии вещества могут иметь много фаз, которые отличаются составлением атомов или другими характеристиками, такими как упорядочение спинов в ферромагнетиках.
Жидкость
Структура классической одноатомной жидкости.В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твёрдым телом и газом. Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает изменение формы (внутренних частей жидкого тела). Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии. Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твёрдое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления. Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения — это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза). Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей. Как и газ, жидкости тоже в основном изотропные. Однако, существуют жидкости с анизотропными свойствами — жидкие кристаллы. Кроме изотропной, так называемой нормальной фазы, эти вещества, мезогены, имеют одну или несколько упорядоченных термодинамических фаз, которые называют мезофазы. Составление в мезофазы происходит благодаря особой форме молекул жидких кристаллов. Обычно это длинные узкие молекулы, которым выгодно укладываться так, чтобы их оси совпадали.
Газ
Основная статья: Газ Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Молекулы в газе могут перемещаться свободно и быстро.
Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Молекулы в газе могут перемещаться свободно и быстро.Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Газ заполняет всё доступное пространство и проникает в любые его закоулки. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой. С микроскопической точки зрения газ — это состояние вещества, в котором его отдельные молекулы взаимодействуют слабо и движутся хаотически. Взаимодействие между ними сводится к спорадическим столкновениям. Кинетическая энергия молекул превышает потенциальную. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц — фотонов, электронов, броуновских частиц, а также плазму. Некоторые вещества не имеют газообразного состояния. Это вещества со сложным химическим строением, которые при повышении температуры распадаются вследствие химических реакций раньше, чем становятся газом. Не существует различных газообразных термодинамических фаз одного вещества. Газам свойственна изотропия, то есть независимость характеристик от направления. В привычных для человека земных условиях, газ имеет одинаковую плотность в любой точке, однако это не является универсальным законом, во внешних полях, например в поле тяготения Земли, или в условиях различных температур плотность газа может меняться от точки к точке. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Плазма
 Плазменная декоративная лампа.
Плазменная декоративная лампа.Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или полностью ионизированным газом и в равновесном состоянии обычно возникает при высокой температуре, от нескольких тысяч К[1] и выше. В земных условиях плазма образуется в газовых разрядах. Её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика, то есть равноправной с ионами и электронами составляющей плазмы является электромагнитное поле.
Плазма — самое распространённое во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд и вещество, наполняющее межпланетное, межзвёздное и межгалактическое пространство. Бо́льшая часть барионного вещества (по массе около 99,9 %) во Вселенной находится в состоянии плазмы.[4].
Фазовый переход
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Низкотемпературные состояния
Сверхтекучесть
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фешбаха[en].
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов. (В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше. [5]
Вырожденный газ
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Высокоэнергетические состояния
Глазма
Состояние адронного поля[6], предшествующее при столкновениях кварк-глюонной плазме. Состоит из цветных токовых трубок.[7] Глазма является особенностью теоретической модели «конденсата цветового стекла» (англ. color glass condensate) — подхода к описанию сильного взаимодействия в условиях высоких плотностей[8].
Глазма образуется при столкновении адронов друг с другом (например, протонов с протонами, ионов с ионами, ионов с протонами). Считается также, что в эволюции Вселенной состояние глазмы предшествовало кварк-глюонной плазме, которая существовала в первые миллионные доли секунды сразу после Большого взрыва. Время существования глазмы — несколько иоктосекунд[9].
Кварк-глюонная плазма
Состояние вещества в физике высоких энергий и физике элементарных частиц, при котором адронное вещество переходит в состояние, аналогичное состоянию, в котором находятся электроны и ионы в обычной плазме. Ему предшествует состояние глазмы[10] (глазма термализуется, то есть разрушается, порождая множество хаотично движущихся кварков, антикварков и глюонов: кварк-глюонную плазму[11]).
Состояния при большом давлении
Нейтронное состояние
Принципиально отличное от других состояние вещества, состоящее только из нейтронов. В нейтронное состояние вещество переходит при сверхвысоком давлении, недоступном пока в лаборатории, но которое существует внутри нейтронных звезд. При переходе в нейтронное состояние, электроны вещества объединяются с протонами и превращаются в нейтроны. Для этого необходимо, чтобы силы гравитации сжали вещество настолько, чтобы преодолеть отталкивание электронов, обусловленное принципом Паули. В результате, в нейтронном состоянии, вещество полностью состоит из нейтронов и имеет плотность порядка ядерной. Температура вещества при этом не должна быть очень высокой (в энергетическом эквиваленте, в пределах от сотни МэВ).
Другие состояния
Тёмная материя
Форма материи, которая не испускает электромагнитного излучения и не взаимодействует с ним. Это свойство данной формы вещества делает невозможным её прямое наблюдение. Однако возможно обнаружить присутствие тёмной материи по создаваемым ею гравитационным эффектам.
Обнаружение природы тёмной материи поможет решить проблему скрытой массы, которая, в частности, заключается в аномально высокой скорости вращения внешних областей галактик.
Сверхкритический флюид
Состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также исчезает. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определёнными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
Вырожденная материя
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно[12], деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
См. также
Примечания
Литература
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука. 1988 ISBN 5-02-024564-X
Агрегатные состояния вещества
Задание: В теплоизолированном сосуде находятся вода и лед при температуре $t_i= 0^oС$. Масса воды ($m_{v\ })$ и льда ($m_{i\ })$ соответственно равны 0,5 кг и 60 гр. В воду впускается водяной пар массой $m_{p\ }=$10 гр. при температуре $t_p= 100^oС$. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда не учитывать.

Рис. 1
Решение: Определим, какие процессы происходят в системе, какие агрегатные состояния вещества мы имели и какие получили.
Водяной пар конденсируется, отдавая тепло.
Это тепло идет на плавление льда и, возможно, нагрев имеющейся и полученной изо льда воды.
Проверим сначала, какое количество теплоты выделяется при конденсации имеющейся массы пара:
\[Q_p=-rm_{p\ }\ Q_p=2,26\cdot 10^6\cdot 10^{-2}=2,26\cdot 10^4\left(Дж\right)\left(1.1\right),\]здесь из справочных материалов имеем $r=2,26•10^6\frac{Дж}{кг}$- удельная теплота парообразования (применима и для конденсации).
Для плавления льда необходимо тепла:
\[Q_i=\lambda m_{i\ }\ Q_i=6\cdot 10^{-2}\cdot 3,3\cdot 10^5\approx 2\cdot 10^4\left(Дж\right)(1.2),\]здесь из справочных материалов имеем $\lambda =3,3\cdot 10^5\frac{Дж}{кг}$- удельная теплота плавления льда.
Получаем, что пар отдает тепла больше, чем требуется, только для расплавления имеющегося льда, следовательно уравнение теплового баланса запишем в виде:
\[rm_{p\ }+cm_{p\ }\left(T_p-T\right)=\lambda m_{i\ }+c\left(m_v+m_i\right)\left(T-T_i\right)\left(1.3\right)\]Теплота выделяется при конденсации пара массой $m_{p\ }$ и остывании воды, которая образуется из пара от температуры $T_p$ до искомой T. Теплота поглощается при плавлении льда массой $m_{i\ }$ и нагревании воды массой $m_v+m_i$ от температуры $T_i$до $T.\ $ Обозначим $T-T_i=\triangle T$, для разности $T_p-T$ получим:
\[T_p-T=T_p-T_i-∆T=100-∆T\]Уравнение теплового баланса приобретет вид:
\[rm_{p\ }+cm_{p\ }\left(100-\triangle T\right)=\lambda m_{i\ }+c\left(m_v+m_i\right)\triangle T\left(1.4\right)\] \[c\left(m_v+m_i+m_{p\ }\right)\triangle T=rm_{p\ }+cm_{p\ }100-\lambda m_{i\ }\left(1.5\right)\] \[\triangle T=\frac{rm_{p\ }+cm_{p\ }100-лm_{i\ }}{c\left(m_v+m_i+m_{p\ }\right)}\left(1.6\right)\]Проведем вычисления, учитывая, что теплоемкость воды табличная $c=4,2\cdot 10^3\frac{Дж}{кгК}$, $T_p=t_p+273=373K,$ $T_i=t_i+273=273K$:
$\triangle T=\frac{2,26\cdot 10^6\cdot 10^{-2}+4,2\cdot 10^3\cdot 10^{-2}10^2-6\cdot 10^{-2}\cdot 3,3\cdot 10^5}{4,2\cdot 10^3\cdot 5,7\cdot 10^{-1}}\approx 3\left(К\right)$тогда T=273+3=276 (K)Ответ: Температура воды в сосуде после установления теплового равновесия станет равна 276 К.
Агрегатное состояние вещества
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- Образовательная:
- повторить и закрепить основные положения МКТ.
- изучить физические свойства веществ в различных агрегатных состояниях.
- выяснить особенности строения веществ в различных агрегатных состояниях и объяснить их.
- Развивающая:
- совершенствовать навыки самостоятельной работы,
- активизировать мышление школьников, умение самостоятельно формулировать выводы, развивать речь.
- Воспитательная:
- развитие познавательного интереса к предмету,
- развитие чувства взаимопонимания и взаимопомощи в процессе совместного решения задач.
Оборудование: модели кристаллических решеток твердых тел, проектор, компьютер.
ХОД УРОКА
Оргмомент
Эпиграфом к нашему уроку послужит высказывание знаменитого Альберта Эйнштейна: «Радость видеть и понимать есть величайший дар природы».
1. Повторение изученного по теме «Строение вещества»
Ученики отвечают на вопросы:
- Из чего состоят все вещества?
- Что такое молекула?
- Как ведут себя молекулы в веществах?
- Как связана быстрота движения молекул с температурой тела?
- Какие два вида взаимодействия существуют между молекулами веществ?
Подведем итоги:
- Все вещества состоят из отдельных частиц – молекул, между которыми есть промежутки.
- Частицы вещества непрерывно и беспорядочно движутся.
- Частицы вещества взаимодействуют друг с другом.
2. Новый материал «Агрегатные состояния вещества»
Любое вещество, состоящее из атомов или
молекул, может находиться в одном из трех
агрегатных состояний: а) твердом; б) жидком
или в) газообразном. (слайд 2)
– Что же отличает одно агрегатное состояние
вещества от другого?
– Каковы особенности молекулярного строения
газов, жидкостей и твердых тел? (слайды 3, 4)
На примере моделей кристаллических решеток (демонстрируется модель) видно, что в твердом состоянии положение молекул упорядочено. Они не могут свободно перемещаться по телу. (Слайд 5) Запись в тетрадь
Молекулы жидкости не имеют такой структуры в
расположении, силы взаимодействия у них меньше,
чем у молекул твердых тел, и поэтому даже под
действием небольших внешних сил они легко
перемещаются. Жидкости обладают текучестью.
(слайд 6) запись в тетрадь
Молекулы газа еще слабее связаны друг с другом и
поэтому перемещаются по всему объему с большими
скоростями. При этом они часто сталкиваются друг
с другом. На примере распространения запаха
духов комнате это можно наблюдать. (слайд 7)
Запись в тетрадь
Вывод:
во-первых, в разных агрегатных состояниях
расположение атомов и молекул различно;
во-вторых, внутренняя энергия одинаковых масс
твердого тела, жидкости и газа при одинаковых
температурах различна. (слайд 8)
Запись в тетрадь
Но как из одного состояния получить другое?
(Слайд 9) рисунок в тетрадь
Процесс перехода вида «твердое вещество —
жидкость» связан с увеличением внутренней
энергии. Значит, в таких превращениях вещество
поглощает тепло, и кинетическая энергия движения
молекул возрастает. Процесс называется
плавлением (слайд 10) запись в тетрадь (слайд 11,
пример)
Процесс перехода вида «жидкость — твердое
вещество» идет с выделением тепла. При этом
скорость молекул уменьшается и внутренняя
энергия уменьшаются. Процесс называется
кристаллизацией. (слайд 12) Запись в тетрадь
(слайд 13 пример)
Процесс перехода вида «жидкость – газ»
связан с увеличением внутренней энергии. Значит,
в таких превращениях вещество поглощает тепло, и
кинетическая энергия движения молекул
возрастает. Процесс называется парообразованием
(слайд 14) запись в тетрадь (слайд 15, пример)
Процесс перехода вида «газ – жидкость»
идет с выделением тепла. При этом скорость
молекул уменьшается и внутренняя энергия
уменьшаются. Процесс называется конденсацией.
(слайд 16) запись в тетрадь (слайд 17 пример)
Иногда бывает так, что вещество из твердого
состояния сразу переходит в газ, минуя жидкую
фазу. (слайд 18) запись в тетрадь
Процесс перехода из твердого состояния в
газообразное, называется сублимацией
или возгонкой. Любое тело в твердом
состоянии, если оно имеет запах, сублимирует.
Сублимирует кусочек нафталина в бабушкином
сундуке. (слайд 19 пример)
Очень интересным процессом является процесс,
обратный сублимации, – десублимация. (слайд
20) запись в тетрадь
3. Закрепление изученного материала
Весь класс делится на 2 команды
1. (Слайд 21) Обсуждение ответа в команде,
объяснение своего ответа, выслушиваем
соперников, жетон получает отвечающий.
2. (Слайд 22) Обсуждение ответа в команде,
объяснение своего ответа, выслушиваем
соперников, жетон получает отвечающий.
3. (Слайд 23) Обсуждение ответа в команде,
объяснение своего ответа, выслушиваем
соперников, жетон получает отвечающий.
(Жетон является бонусом для получения отметки на следующем уроке).
Домашнее задание
1. § 37 учебника; вопросы и задания к параграфу;
2. Сборник задач В.И.Лукашика, Е.В.Ивановой: № 1012,
1013.
Если осталось время, можно поработать с «литературной минуткой»
Загадки
1. Над водою – ушко,
Под водою – брюшко. (Айсберг)
– О каких состояниях воды идет речь в загадке?
2. Через нос проходит в грудь
И обратный держит путь.
Он невидимый, и все же
Без него мы жить не можем. (Воздух)
– Может ли воздух быть в жидком состоянии?
3. Что за звёздочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмёшь – вода в руке. (Снежинка)
– О каком процессе идет речь?
4. Утром падаю всегда —
Не дождинка, не звезда —
И сверкаю в лопухах
На опушках и лугах.(Роса)
– Как называется процесс при котором наблюдается выпадение росы?
5. А ну, скорей снимите шляпу!
Я дочь космического папы.
И вездесуща и легка, –
Я лед, я пот, я – облака.
Я иней, чай, бульон, туман,
Река, ручей и океан.
Когда я злюсь, то закипаю;
А от мороза – застываю. (Вода)
– Перечислите все переходы воды в различные состояния которые здесь встречаются?
«Агрегатные состояния вещества» | Социальная сеть работников образования
Слайд 1
Научно-исследовательская работа на тему: « Агрегатные состояния вещества » Работу подготовила подготовила : ученица МБОУ 2-Гавриловской СОШ 7а класса Баронина Александра Научный руководитель : Филимонов Анатолий Александрович, учитель физикиСлайд 2
Актуальность исследования Тема выбрана «Агрегатное состояние вещества», потому что это очень интересная проблема для изучения. Очень занимательное занятие исследовать агрегатные состояния вещества с помощью опытов. Необходимо проверить правда ли, что в жидком состоянии вещество не имеет постоянной формы, но имеет постоянный объём? Правда ли что вещество в твёрдом агрегатном состоянии имеет и постоянную форму и постоянный объём? В результате этой работы предстоит ответить на несколько поставленных вопросов.
Слайд 3
Цель исследования Изучить агрегатные состояния вещества. Вода.
Слайд 4
Задачи: 1.Изучить жидкое агрегатное состояние вещества (на примере воды): а) Используя метод наблюдения. б) Провести эксперименты. 2.Изучить твёрдое агрегатное состояние (на примере воды): а) Используя метод наблюдения . б) Провести эксперименты. 3.Изучить газообразное агрегатное состояние (на примере воды): а) Используя метод наблюдения . б) Провести эксперименты. 4. Изучить свойства воды. 5. Провести опыт подтверждающий один из фактов. 6.Оформить полученные данные с помощью наглядной интерпретации информации. 7. Защитить исследовательскую работу.
Слайд 5
Методы исследования: 1.Наблюдение 2.Эксперимент 3.Анализ 4.Защита исследовательской работы
Слайд 6
Введение В работе будем исследовать вещество: вода. Э то удивительное вещество, которое в таких огромных количествах есть только на нашей планете и только это вещество может быть во всех трёх агрегатных состояниях при нормальных условиях . Если говорить на научном языке, то вода это — бинарное неорганическое соединение, а если говорить на языке науки химии, то вода-это H₂O, т.е. молекула воды состоит из двух атомов водорода и одного – кислорода.
Слайд 7
Опыт 1 Проведём опыт. В результате этого опыта мы изучим свойства твёрдого агрегатного состояния вещества
Слайд 8
Объект исследования: Вода в твёрдом агрегатном состоянии Цель: Изучить свойства твёрдого агрегатного состояния вещества Приборы: 3 сосуда разной формы
Слайд 9
Ход работы и её результат 1.Возьмём три одинаковых кусочка льда и попробуем каждый положить в разные по форме сосуды. 2. Мы видим, что полностью поместился кусок льда только в сосуд 1. Поместился, но не полностью кусок льда в сосуд 2. А не поместился совсем в сосуд 3. Также лёд сохранил свою форму т.е. не принял форму ни одного сосуда.Это мы тоже можем заметить на фотографиях. Вывод: вещество в твёрдом агрегатном состоянии имеет и постоянную форму, и постоянный объём. Сосуд 1 Сосуд 2 Сосуд 3
Слайд 10
Стоит это подтвердить и теорией. Молекулы вещества в твёрдом агрегатном состоянии очень сильно притягиваются друг к другу, поэтому вещества в твёрдом агрегатном состоянии имеют и постоянную форму и постоянный объём
Слайд 11
Опыт 2 Проведём опыт с помощью которого изучим свойства жидкого состояния вещества.
Слайд 12
Цель: Доказать, что вода в жидком агрегатном состоянии не имеет постоянной формы, но сохраняет объём Объект исследования: Вода Приборы: 1. Три сосуда разной формы 1.1. Маленький контейнер 1.2. Большой стакан 1.3. Маленький стакан 2. Шприц объёмом 22 мл. 3. Сосуд с водой
Слайд 13
Ход работы В каждый сосуд из нальём по 60 г или 60мл. воды ( Жидкое агрегатное состояние).Основной единицей возьмём 20 г. или 20мл. т .е. наливать будем по 20 г., всего получается три шприца на один сосуд. Сосуд 1 Сосуд 2 Сосуд 3
Слайд 14
Результат опыта 2 Я налила в каждый сосуд по 60 г. Каждый сосуд вода заполнила по разному (это можно наблюдать по чёрным отметкам на сосудах) т.е приняла форму сосуда. Также из этого опыта можно доказать, что жидкость имеет постоянный объём т. к. не один сосуд вода не заполнила больше того объёма, которым наполняли эти сосуды Сосуд 1 Сосуд 2 Сосуд 3
Слайд 15
Стоит это подтвердить и теорией. В жидком состоянии, молекулы вещества слабо притягиваются друг к другу. Поэтому жидкости не имеют постоянной формы
Слайд 16
Опыт 3 Проведём ещё один опыт. В результате этого опыта мы изучим свойства газообразного агрегатного состояния вещества
Слайд 17
Цель: Доказать, что вода в газообразном состоянии вещества не имеет постоянной формы и постоянного объёма Объект исследования: Вода в газообразном агрегатном состоянии Инструменты: 1.Сосуд любой 2 . Сосуд с кипящей водой
Слайд 18
Ход работы и её результат Для начала вскипятим воду чтобы появился пар. 1.Далее, когда вода закипела и появился пар я попробовала собрать его руками. У меня ничего не получилось. Это говорит, о том что у пара нет постоянной формы и постоянного объёма. 2. Я решила провести ещё один опыт, что я сделала, я взяла полый сосуд. Перевернула его и попыталась собрать пар в него. Пар проник в сосуд и заполнил его весь, но при этом этот же пар постепенно распространялся по всей комнате. Это говорит, о том что у пара нет постоянной формы и постоянного объёма К сожалению фотографии сделать не удалось.
Слайд 19
Стоит это подтвердить и теорией Молекулы вещества в газообразном агрегатном состоянии очень слабо притягиваются друг к друг. Слабее, чем молекулы вещества в твёрдом и жидком агрегатном состоянии. Поэтому у пара нет постоянной формы и постоянного объёма
Слайд 20
Интересный момент! Я заметила очень интересный момент. И решила его отметить в своей работе. Вещество в одном агрегатном состоянии может уничтожить другое агрегатное состояние этого же вещества. Как я это поняла? Я взяла один из кусочков льда используемых в опыте 1, и решила попробовать полить на него воды. И вода в жидком агрегатном состоянии уничтожила твёрдое агрегатное состояние воды и превратила в жидкое. Результат вы можете наблюдать на фотографиях.
Слайд 21
Лед быстрее получить из горячей воды? Какая вода быстрее превратится в лед: горячая или холодная? Если рассуждать логически, то, конечно, холодная. Ведь горячей нужно сначала остыть, а потом уже замерзнуть, а вот холодной остывать не нужно. Однако опыты показывают, что в лед быстрее превращается именно горячая вода. Точного ответа на вопрос, почему все-таки горячая вода замерзает быстрее холодной, до сих пор не существует. Возможно, дело в разнице в переохлаждении, испарении, образовании льда, конвекции, либо причина в воздействии разжиженных газов на горячую и холодную воду.
Слайд 22
Опыт 4 Я решила попробовать подтвердить факт, о том что горячая вода превращается в лёд быстрее, чем холодная. Для этого я провела опыт.
Слайд 23
Цель : Подтвердить факт, о том что горячая вода превращается в лёд быстрее, чем холодная Объект исследования: Холодная и горячая вода в жидком агрегатном состоянии Инструменты: 2 сосуда Сосуд 1 (холодная вода) Сосуд 2 (горячая вода)
Слайд 24
Ход работы: 1.Заполним два пустых сосуда водой холодной и горячей. Подпишем. 2.Эти два сосуда поместим в морозилку. 3. Через три часа проверим, в каком из сосудов замёрзло больше воды
Слайд 25
Результат опыта 4 У меня подтвердить этот факт не получилось. Возможно на снимках плохо видно, но в сосуде 1 (с холодной водой) за такое время замёрзло больше воды, чем в сосуде 2 ( с горячей водой). Но отрицательный результат, тоже результат. Сосуд 1 Сосуд 2
Слайд 26
Интересные факты Рассмотрим несколько фактов о воде
Слайд 27
1. Где самая чистая вода? По данным ЮНЕСКО, самая чистая вода находится в Финляндии. финская вода из под крана высочайшего качества и ее можно пить по всей стране. Комитет по водным ресурсам при ООН признал водопроводную воду в Финляндии самой чистой в мире. Всего в исследовании свежей природной воды принимало участие 122 страны. При этом 1 млрд. людей по всему миру вообще не имеет доступа к безопасной воде.
Слайд 28
2. Вода, как стекло Что будет, если взять замёрзшую чистую воду и продолжить охлаждение? С водой произойдут чудесные превращения. При минус 120 градусах по Цельсию вода становится сверхвязкой или тягучей, а при температуре ниже минус 135 градусов она превращается в «стеклянную» воду. «Стеклянная» вода – это твердое вещество, в котором отсутствует кристаллическая структура, как в стекле. Состояние воды при -120 градусах по Цельсию (Вода становится тягучей) Состояние воды при -135 градусах по Цельсию (Вода становится «стеклянной»)
Слайд 29
3. Больше всего воды – в ледниках Где больше всего воды? Ответ кажется очевидным: в Мировом океане. Однако на самом деле, в мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане. Если рассматривать вопрос о пресной воде, почти вся имеющаяся на планете масса воды не пригодна для питья. Мы можем пить только 3% воды – именно столько у нас запасов пресной воды. Но даже большая часть этих 3% недоступна, так как содержится в ледниках.
Слайд 30
4. Криовулкан Существует ледяной вулкан ( криовулкан ). Рассматривая интересные факты о воде, нельзя обойти стороной существование криовулкана . У Энцелада , одного из спутников Сатурна, есть особенность ,на его северном полюсе расположены криовулканы — уникальные гейзеры, извергающие лед, а не лаву. Такое случается, когда лед, залегающий глубоко под поверхностью, нагревается и становится паром, а затем извергается в холодную атмосферу спутника в виде ледяных частиц. Криовулкан Энцелад- спутник Сатурна
Слайд 31
Факты «Вода и человек» 1. Люди, которые регулярно выпивают норму воды, меньше подвержены сердечным приступам. 2.Вода жизненно важна для человека. Без еды человек проживет 30-40 дней, а без воды всего 5-6 дней. 3.Организм взрослого человека на 75% состоит из воды, ребенка —на 85%, а младенца —на 95%. 4.За жизнь человек употребляет в среднем 35-40 тонн воды.
Слайд 32
Результат Я исследовала 3 агрегатных состояния вещества и изучила некоторые факты о воде . Результат я оформила, как ответы на вопросы. 1. Почему вода в твёрдом агрегатном состоянии имеет и постоянную форму, и постоянный объём? Ответ: Молекулы вещества в твёрдом агрегатном состоянии очень сильно притягиваются друг к другу, поэтому вещества в твёрдом агрегатном состоянии имеют и постоянную форму и постоянный объём 2. Почему вода в жидком агрегатном состоянии не имеет постоянную форму, но имеет постоянный объём? Ответ: В жидком состоянии, молекулы вещества слабо притягиваются друг к другу. Поэтому жидкости не имеют постоянной формы 3. Почему вода в газообразном агрегатном состоянии не имеет постоянной формы и постоянного объёма? Ответ: Молекулы вещества в газообразном агрегатном состоянии очень слабо притягиваются друг к друг. Слабее, чем молекулы вещества в твёрдом и жидком агрегатном состоянии. Поэтому у пара нет постоянной формы и постоянного объёма
Слайд 33
Спасибо за внимание!
Слайд 34
Список ресурсов 1. https://www.healthwaters.ru/articles/fakty-o-vode-dlya-detey-i-vzroslykh/ 2. https://fishki.net/1256802-15-interesnyh-faktov-o-vode.html 3. Учебник «Физика 7 класс» Пёрышкина А.В