Доклад по химии «Металлы» | Kratkoe.com


Металлы сообщение по химии кратко расскажет Вам много полезной информации об этих химических элементах. Также сообщение о металлах поможет подготовиться к занятию.
Доклад по химии «Металлы»
На сегодняшний день металлы широко распространены в природе и встречаются в водах рек, морей, океанов, озер, в недрах земли, даже в телах растений, животных и атмосфере.
Свойства металлов:
- Кристаллическая плотная структура
- Металлический блеск
- Электрическая проводимость
- Высокая теплопроводность
- С повышением температуры уменьшается электрическая проводимость
- Легко отдает электроны
- Тягучесть и ковкость
- Могут образовывать сплавы
Металлы и сплавы, разделяются на 2 группы:
- Черные металлы и его сплавы
К сплавам относятся сталь и чугун. В технике используются никель, хром, вольфрам, кобальт, титан, молибден, ванадий другие металлы. Они получаются путем легирования. Обладают высокой прочностью, сопротивляемостью к истиранию, коррозионной устойчивостью.
2.Цветные металлы и его сплавы
Они так называются, потому что их раскраска разнообразна. Медь, к примеру, медь светло-красная, олово, серебро, никель – белого окраса, золото – желтое, а свинец — голубовато-белый. Сплавы цветных металлов широко используются в ювелирном деле.
Часто с цветными и черными металлами выделяют и благородные металлы — золото, серебро, рутений и платину. Они на воздухе не окисляются и не разрушаются даже при воздействии щелочей и кислот.
Химические свойства металлов
Основное химическое свойство – способность атомов с легкостью отдавать валентные электроны и переходить в состояние положительно заряженных ионов. Типичные металлы не присоединяют электронов – их ионы всегда положительные. Поэтому они считаются энергичными восстановителями. И чем легче определенный металл отдает электроны, тем он стает активнее и энергичнее вступает в действие с другими металлами. Данное химическое свойство изучил русский ученый Бекетов, который расположил их по убыванию химической активности, так именуемый «вытеснительный ряд». Расположенные по возрастанию металлы образовывают электрохимический ряд напряжений. Выглядит он следующим образом: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Химические свойства металлов:
- Чем электродный потенциал у металла меньше, тем выше его восстановительная способность.
- Металл может вытеснять из растворов солей металлы, которые в ряду напряжений стоят после него.
- Металлы с отрицательным стандартным электродным потенциалом могут вытеснять из растворов кислот металлы, которые стоят левее водорода в ряду напряжений.
- Металлы обладают электромеханической и химической активностью.
Где применяют металлы?
Металлы применяются в следующих областях:
- В конструкционной промышленности
Металлы являются главным конструкционным материалом из-за их однородности, высокой прочности и непроницаемости для газов и жидкостей. Благодаря возможности менять рецептуру сплавов можно и изменять их свойства.
- В электротехнической промышленности
Металлы являются прекрасными проводниками электричества, особенно алюминий и медь. Их используют для электронагревательных элементов и резисторов как материал с повышенным сопротивлением.
- Для изготовления инструментальных материалов
Сплавы и металлы применяются для изготовления рабочей части инструментов. Преимущественно это сталь, твердые сплавы, алмаз, керамика и нитрид бора.
Надеемся, что доклад на тему «Металлы» помог Вам узнать новую информацию об этих химических элементах. А сообщение по химии на тему «Металлы» Вы можете дополнить через форму комментариев ниже.
kratkoe.com
Доклад на тему Металлы сообщение (описание для детей)
В химии вещества делятся на две группы: неметаллы и металлы. Первая группа не так интересна, в отличие от другой. Сами металлы представляют собой группу простых веществ, обладающие металлическими свойствами.
Количество, виды и общая характеристика
В таблице Менделеева насчитывают около 98 металлов. К ним относятся такие элементы, как железо, алюминий, магний, золото, платина, вольфрам и много других. Входят в состав оксидов, солей, оснований и других соединений. Чаще всего металлы находят в виде руд. Могут быть щелочные, щелочноземельные, переходные, лантаноиды, актиноиды и полуметаллы. Существует наука о переработке металлов – металлургия. На внешнем электронном слое от 1 до 3 электронов, поэтому металлы – восстановители. Если глубоко смотреть в строение атомов металлов, то можно обнаружить кристаллическую решетку.
Физические свойства металлов
• Твердость. По сути, все металлы имеют твердую структуру, за исключением ртути, так как в обычном состоянии он жидкий. Самый мягкий металл — рубидий, а самый твердый – хром.
• Плотность. Самый легкий – литий, его плотность равна 0, 53 г/см3. Самый тяжелый же металл пока неизвестен. Если точнее, то лидирующих элемента 2 – это осмий и иридий. Их плотности равны.
• Пластичность. Проще говоря, способность изгибать предмет в разные формы, то есть деформировать. Самым пластичным металлом считается золото. Из него удавалось сделать проволоку толщиной 0, 003 мм!
• Электропроводность и теплопроводность. Все металлы достаточно хорошо проводят и тепло, и ток. А потому, 2 ряда проводников схожи друг с другом. Лучшими являются серебро, медь и алюминий.
• Металлический блеск. Блеск – это явление отражения солнечных лучей от предмета. Металлы отлично блестят, но не в состоянии порошка. Исключение из данного правила составляют алюминий и магний. Самыми блестящими металлами считаются серебро, палладий и алюминий.
Основные химические свойства металлов.
• Реакции с кислородом (золото и платина не реагируют):
4 Al + 3 O2 = 2 Al2O3
• Реакции с азотом (только активные металлы):
2 Al + N2 = 2 AlN
• Реакции с серой (золото и платина – исключения):
Fe + S = FeS
• Реакции с водородом (только активные металлы):
Mg + H2 = MgH2
• Реакции с углеродом (только активные металлы):
2Na + 2C = Na2C2
Сообщение 2
В химии все вещества делятся на 2 вида: они либо металлы, либо неметаллы. У каждой группы свои свойства и строение. Металлов гораздо больше, чем неметаллов, и их функции имеют такую же важность. Так что же представляют собой металлы, какие свойства имеют и какую роль на нашей планете играют?
Краткие сведения о металлах.
Металлы – это химические элементы, обладающие определенными металлическими свойствами. Металлы находятся практически везде. От зданий, машин и мебели до шахт – металлы вокруг нас. Разве что в Антарктиде данных веществ не имеется, и то, может это под вопросом.
Металлы тоже делятся на группы. Например, существуют щелочные и щелочно-земельные металлы. Принято считать, что в периодической таблице Менделеева металлы размещены согласно диагонали, начинающаяся бором и заканчивающаяся астатом. На внешнем уровне от 1 до 3 электронов. У металлов сравнительно большой радиус атома.
Свойства металлов
Опять же, надо обратиться к таблице элементов. Зачем? А чтобы кое – что уточнить. В химии есть правило: металлические свойства уменьшаются по периоду (слева направо) и увеличиваются по группе (сверху вниз). А теперь к физическим свойствам. Их на самом деле много, но перечислить надо все.
Металлы – твердые вещества, если в нормальном состоянии, но ртуть – исключение, так как она жидкой формы. Отлично проводят электричество и тепло, а также блестят. Обладают пластичностью, а золото – лучший в этом плане. Все металлы звенят. Цвет, как правило, либо серебристо – серый, либо серебристо – белый. Однако, то же золото ярко – желтого оттенка. Имеют разную плотность, твердость (самый твердый – хром) и температуру плавления (самый тугоплавкий – вольфрам).
Кроме физических свойств есть же еще и химические. И вторых в разы больше, все точно не назвать. Но привести несколько примеров возможно. Из простых веществ металлы реагируют с водородом, кислородом, серой и галогенами. Теперь пара реакций со сложными веществами:
Металл реагирует с кислотой, если получится соль и металл находится в таблице электроотрицательности до водорода. Результатом будет соль и выделяющийся водород. У реакции 2 исключения – серная и азотная кислоты.
Активный металл вытеснит неактивный. Вот наглядное пособие: Fe + CuSO4 = FeSO4 + Cu. От лития до алюминия металлы брать нельзя, так как они – самые активные.
Картинка к сообщению Металлы

Популярные сегодня сообщения и доклады
- Сообщение доклад на тему Австрия
Австрия, официально Австрийская Республика, является не имеющей выхода к морю страной в восточной части Центральной Европы, которая граничит с чешской Республикой, Германией, Венгрией, Италие
- Доклад Образование и здоровье
Образование – это то, что необходимо каждому человеку в современном мире. Но образование подразумевает определенного рода нагрузки. Как же быть, чтобы учёба негативно не отразилась на здоровь
- Доклад-сообщение Инфузория-туфелька (биология 7 класс)
Инфузория туфелька — это клетка, находящаяся в движение и относится к классу простейших. Эта клетка по своему строению очень проста, но именно от инфузории туфельки в своё время произошли сло
- Доклад-сообщение Иван-Чай (2, 3 класс)
Иван-чай – растение из семейства многолетних. Его используют для приготовления лекарственных чайных напитков, обладающих мощными оздоровительными и целебными свойствами. Растение на хорошем с
- Доклад на тему Лемминг
Леммингом называется животное небольшого размера, относящееся к отряду грызунов из семейства хомяковых класса млекопитающих, проживающее в тундре и лесотундре на североамериканской и евроазиа
- Доклад на тему Созвездие Кассиопея (сообщение)
Давным-давно люди обращали внимание на звездные и астрономические явления, оказывающимися в непонятной глубине темного небосвода. Поэтому они и преподнесли людям основную схему неба
doklad-i-referat.ru
Металлы доклад по химии 9 класс сообщение
Металлы – химические элементы, которые имеют свойство высокой электропроводимости. Они широко распространены в морях, реках, горах, полях, в недрах земли и даже в телах живых организмов.
На сегодня, люди открыли 114 элементов, из которых 96 занимают металлы. Чтобы выяснить принадлежность вещества к металлам или неметаллам, нужно воспользоваться таблицей Менделеева. Нужно всего лишь провести диагональ с Астата к Бору. Все что находиться слева металлы. Все что справа неметаллы.
Они играют незаменимую роль в жизни. Они постоянно участвуют в процессах живых организмов. Именно поэтому отказаться от металлов нельзя.
Многие из металлов окисляются на свежем воздухе. Есть группа металлов, они называются благородные, воздух на них никак не влияет. В эту группу входят: золото, платина, серебро и многие другие. Некоторые со временем делают оксидную пленку и после этого реакция не продолжается.
Металлы можно поделить на 2 вида: цветные металлы и сплавы, черные металлы и его сплавы.
Первая группа, а именно золото, серебро, олово, медь, никель, называется так, потому что имеет разнообразный цвет. Его широко используют в ювелирных делах, для сознания украшений.
Черные элементы и сплавы. Сплавы получаются за счет легирования. Это добавление в металл другие элементы для придания новых свойств: прочность, гибкость, хрупкость, коррозионная устойчивость. Самым распространённым сплавом считается чугун и сталь.
Самой главным химическим свойством является, способность атомов отдавать электроны. Тем самым они становиться положительно заряженными ионами. Именно это изучал Бекетов. Он изобрел электрохимический ряд напряжений. Выглядит он так: Li, К, Ва, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb (H
Металлы используются в строительстве, потому как они прочны и не пропускают газы и жидкость. Также они являются хорошими проводниками. Этим активно пользуется человек. Их используют для электронагревательных элементов и резервистов как материал с сопротивлением. Еще из металлов и сплавов делают инструменты. В основном это сталь, алмаз, керамика.
Вариант 2
Металлы, это обширная часть элементов или просто веществ, имеющих определенные характеристики — большой коэффициент электропроводности, достаточный запас пластичности и прочности, специфический цвет и большую степень ковки.
Первыми металлами, известными людям с глубоко древности, стали золото и серебро, доступно встречающиеся на поверхности земли.
В жизни металлы очень разнообразны, представлены в больших объемах и различных видах. Можно выделить несколько групп состояний металлов:
- Ag, Au, Rt, Cu – самородный вид.
- Fe3O4, Fe2O3, (NaK)2O×AlO3 — оксиды.
- KCl, BaSO4, Ca3(PO4)2),- соли.
- Cd – , Nb, Tl – сопутствующие минералы
Одними из часто находящихся на поверхности всей земли металлами являются алюминий и железо, а самыми редкими – калий и титан.
Можно выделить и рассмотреть основные свойства металлов:
- Температура плавления, у большинства веществ достаточна высокая, но есть металлы, которые легко плавятся даже на обычной газовой горелке, например олово.
- Такой показатель как плотность, позволяет разделить металлы на две категории: легкие, например литий, и тяжелые, например осмий или иридий. Это свойство позволяет применять металлы и их разнообразные сплавы для изготовления инструментов и станков, автомобилей и военной техники.
- Такое свойство как пластичность, позволяет использовать предметы из металлов в тех областях промышленности, где требуются особые гибкие и прочные на разрыв изделия.
- Электропроводность, обусловлена присутствием подвижных электронов в кристаллических решетках металлов. Медь и алюминий обычно используют при производстве проводниковой продукции, так как они имеют самую высокую электропроводность. Нихром, материал с повышенным сопротивлением, используют при производстве резисторов и в электронагревательных приборах.
- Высокая теплопроводность металлов, например натрия, позволяет использовать предметы из металла в устройствах, требующих быстрого охлаждения.
- Большинство металлов имеют примерно одинаковый светлый цвет — серого, голубого или желто-красного оттенка.
В современном мире все большее развитие приобретают изделия из металла, обработанного специальными методами, изготовленными по специальным технологиям с добавлением инновационных добавок. Свойства таких материалов улучшаются с каждым годом, хотя в этой области науки ученых ждет еще много открытий.
Металлы
Интересные ответы
- Что такое аллегория в литературе?
Например, мудрость, храбрость, доброта, юность. Второй элемент — это предметный объект, который должен передать в произведение названное понятие. Например, сова – это существо, которое означает мудрость.
- Сон и сновидения — сообщение доклад 8 класс по биологии
Сон является великим уравнителем, так как он объединяет всех людей. Каким бы не был человек, он всегда спит, а если не спит, то в довольно скором времени перестает быть живым.
- Жизнь и творчество Марка Твена
Американский писатель, завоевавший своим неповторимым ироничным творчеством миллионы детских, взрослых сердец – это Марк Твен (Сэмюэл Клеменс). Он был не просто писателем, а также журналистом, общественным деятелем.
- Доклад на тему Правила речевого этикета для 7 класса (сообщение)
Каждый человек маленькая частичка общества и у каждого из нас есть свой статус. Кто-то стоит выше, кто-то ниже, но всем нам нужно быть цивилизованными людьми в своей речи.
- Леопард — сообщение доклад
Леопард – это хищник из рода млекопитающих, семейства кошачьих, представитель рода пантер, подвиды которого занесены в Красную книгу.
sochinite.ru
| Металл (название происходит от лат. metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий. | |
| Металлы — суть светлые тела, которые ковать можно. (Михаил Васильевич Ломоносов) | |
| Некоторые металлы | |
| Щелочные металлы: Литий, Натрий, Калий | |
| Щелочноземельные металлы: Бериллий, Магний, Кальций | |
| Переходные металлы: Железо, Платина | |
| Другие металлы: Алюминий, Свинец, Медь, Цинк | |
| Металлургия — совокупность связанных между собой отраслей и стадий производственного процесса от добычи сырья до выпуска готовой продукции — черных и цветных металлов и их сплавов. К черным металлам относят железо, марганец и хром. Все остальные — цветные. По физическим свойствам и назначению цветные металлы условно делят на тяжелые (медь, свинец, цинк, олово, никель) и легкие (алюминий, титан, магний). | |
| Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды черных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Исключением можно назвать около 16 элементов: т. н. благородные металлы (золото, серебро и др.), и некоторые другие (например, ртуть, медь), которые присутствуют без примесей. Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль). | |
| Характерные свойства металлов | |
| Физические свойства металла | |
| Все металлы (кроме ртути) тверды при нормальных условиях. Температуры плавления лежат в диапазоне от 39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на легкие (плотность 0,53 ч 5 г/смі) и тяжелые (5 ч 22,5 г/смі). Металлы тонут | |
| Механические свойства металла | |
| Это способность металлов подвергаться различным способам механической обработки. | |
| Микроскопическое строение металла | |
| Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решетке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решетки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твердость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.). Из-за легкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий. Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твердых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешенные зоны, причем зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для ее полного заполнения. Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течет электрический ток. Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придает металлам характерный блеск). | |
| Применение металлов | |
| Конструкционные материалы | |
| Металлы и их сплавы — один их главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах. | |
| Электротехнические материалы | |
| Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.). | |
| Инструментальные материалы | |
| Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика. |
acrossteel.ru
Доклад — Металлы — Химия
Металлы – этоэлементы, проявляющие в своих соединениях только положительные степениокисления, и в простых веществах которые имеют металлические связи. Металлическаякристаллическая решетка — решетка, образованная нейтральными атомами и ионами металлов, связанными междусобой свободными электронами./> У металловв узлах кристаллической решетки находятся атомы и положительные ионы.Электроны, отданные атомами, находятся в общем владении атомов и положительныхионов. Такая связь называется металлической. Для металлов наиболее характерны следующие физические свойства: металлическийблеск, твердость, пластичность, ковкость и хорошая проводимость тепла иэлектричества. Теплопроводность и электропроводность уменьшается в рядуметаллов: Аg Сu Аu Аl Мg Zn Fе РЬ Hg.
Многие металлы широкораспространены в природе. Так, содержание некоторых металлов в земной кореследующее: алюминия — 8,2%; железа — 4,1%; кальция — 4,1%; натрия — 2,3%;магния — 2,3%; калия — 2,1%; титана — 0,56%.
С внешней стороны металлы, какизвестно, характеризуются прежде всего особым “металлическим” блеском, которыйобусловливается их способностью сильно отражать лучи света. Однако этот блескнаблюдается обыкновенно только в том случае, когда металл образует сплошнуюкомпактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучипревращенными в порошок, но большинство металлов в мелкораздробленном видеимеет черный или темно-серый цвет. Затем типичные металлы обладают высокойтепло- и электропроводностью, причем по способности проводить тепло и токрасполагаются в одном и том же порядке: лучшие проводники — серебро и медь,худшие — свинец и ртуть. С повышением температуры электропроводность падает,при понижении температуры, наоборот, увеличивается.
Оченьважным свойством металлов является их сравнительно легкая механическаядеформируемость. Металлы пластичны, они хорошо куются, вытягиваются впроволоку, прокатываются в листы и т.п.
Характерныефизические свойства металлов находятся в связи с особенностями их внутреннейструктуры. Согласно современным воззрениям, кристаллы металлов состоят изположительно заряженных ионов и свободных электронов, отщепившихся отсоответствующих атомов. Весь кристалл можно себе представить в видепространственной решетки, узлы которой заняты ионами, а в промежутках междуионами находятся легкоподвижные электроны. Эти электроны постоянно переходят отодних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Таккак электроны не связаны с определенными ионами, то уже под влиянием небольшойразности потенциалов они начинают перемещаться в определенном направлении, т.е.возникает электрический ток.
Наличиемсвободных электронов обусловливается и высокая теплопроводность металлов. Находясьв непрерывном движении, электроны постоянно сталкиваются с ионами иобмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в даннойчасти металла вследствие нагревания, сейчас же передаются соседним ионам, отних — следующим и т.д., и тепловое состояние металла быстро выравнивается; всямасса металла принимает одинаковую температуру.
Поплотности металлы условно подразделяются на две большие группы: легкие металлы,плотность которых не больше 5 г/см3, и тяжелые металлы — всеостальные.
Частицыметаллов, находящихся в твердом и жидком состоянии, связаны особым типомхимической связи — так называемой металлической связью. Она определяетсяодновременным наличием обычных ковалентных связей между нейтральными атомами икулоновским притяжением между ионами и свободными электронами. Таким образом,металлическая связь является свойством не отдельных частиц, а их агрегатов.
/> /> /> /> /> /> /> /> />Методы получения металлов
/> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> /> />пирометаллургические
гидрометаллургические
электрометаллургические
/> /> /> /> /> /> /> />Восстановление металлов из соединений при высокой температуре
/>Восстановление металлов из водных растворов их соединений
/>Восстановление металлов из расплавов соединений под действием электрического тока
/>
Химическиесвойства металлов
Взаимодействие с простыми веществами:
1. с галогенами:
Na + Cl2 → 2NaCl
2. с кислородом:
4Al + 3O2 → 2Al2O3
В реакциях с галогенами и кислородомметаллы наиболее энергично проявляют восстановительные способности.
3. с серой:
2Na + S→ Na2S
4. с азотом:
3Mg + N2 →Mg3N2
5. с фосфором:
3Ca + 2P→ Ca3P2
6. с водородом:
Ca + h3 →Cah3
Наиболее активные металлы главных подгруппявляются сильными восстановителями, поэтому восстанавливают водород до степениокисления -1 и образуют гидриды.
Взаимодействиесо сложными веществами:
1. с кислотами:
2Al+3h3SO4 → Al2(SO4)3+ 3h3
2Al+ 6H + 3SO4 → 2Al + 3SO4 + 3h3
2Al + 6H→ 2Al + 3h3
Металлы, которые в электрохимическом рядунапряжений металлов находятся до водорода, восстанавливают ионы водорода изразбавленных кислот, а те, которые находятся после водорода, восстанавливаютатом основного элемента, образующего данную кислоту.
2. с водными растворами солей:
Zn+ Pb(NO3)2 → Zn(NO3)2 + Pb
Zn+ Pb + 2NO3 = Zn + 2NO3 + Pb
Zn + Pb = Zn + Pb
При взаимодействии с водными растворамисолей металлы, находящиеся в электрохимическом ряду напряжений металлов левее,восстанавливают металлы, находящиеся в этом ряду правее от них. Однако металлыс сильными восстановительными свойствами (Li, Na, K, Ca) в этихусловиях будут восстанавливать водород воды, а не металл соответствующей соли.
3. с водой:
Самые активные металлы реагируют с водой при обычныхусловиях, и в результате этих реакций образуются растворимые в воде основания ивыделяется водород.
2Na + 2HOH→ 2NaOH + h3
Менее активные металлы реагируют с водой при повышеннойтемпературе с выделением водорода и образованием оксида соответствующегометалла.
Zn + h3O→ ZnO +h3
Характеристика металлов главной подгруппы Iгруппы.
Главную подгруппу I группыпериодической системы составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Все щелочные металлы имеют один s-электрон на внешнемэлектронном слое, который при химических реакциях легко теряют, проявляястепень окисления +1. Поэтому щелочные металлы являются сильнымивосстановителями. Радиусы их атомов возрастают от лития к францию. Электронвнешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силыпритяжения ослабевают и, следовательно, увеличивается способность к отдачеэтого электрона, т.е. химическая активность. В электрохимическом рядунапряжений металлов все щелочные металлы стоят левее водорода. Все щелочныеметаллы в твердом состоянии хорошо проводят электрический ток. Они легкоплавки,быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги,чаще всего под керосином. Щелочные металлы образуют соединения спреимущественно ионной связью. Оксиды щелочных металлов – твердыегигроскопичные вещества, легко взаимодействующие с водой. При этом образуютсягидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочныхметаллов, как правило, тоже хорошо растворяются в воде.
Всещелочные металлы — очень сильные восстановители, в соединениях проявляютединственную степень окисления +1. Восстановительная способность увеличиваетсяв ряду ––Li–Na–K–Rb–Cs.
Все соединения щелочных металлов имеют ионный характер.
Практически все соли растворимы в воде.
1. Активно взаимодействуют с водой:
2Na + 2h3O→ 2NaOH + h3
2Li + 2h3O → 2LiOH + h3
2. Реакция с кислотами:
2Na + 2HCl →2NaCl + h3
3. Реакция с кислородом:
4Li + O2→ 2Li2O(оксид лития)
2Na + O2 → Na2O2(пероксид натрия)
K + O2 → KO2(надпероксид калия)
На воздухе щелочные металлымгновенно окисляются. Поэтому их хранят под слоем органических растворителей(керосин и др.).
4.В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2→ 2LiCl(галогениды)
2Na + S → Na2S(сульфиды)
2Na + h3 → 2NaH(гидриды)
6Li + N2 → 2Li3N(нитриды)
2Li + 2C → 2Li2C2(карбиды)
Реагируют со спиртами и галогенопроизводными углеводородов (смотри«Органическую химию»)
5. Качественная реакция на катионы щелочных металлов — окрашивание пламени вследующие цвета:
Li+– карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Характеристикаэлементов главной подгруппы IIгруппы.
Главнуюподгруппу II группы Периодической системы элементовсоставляют бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Атомы этихэлементов имеют на внешнем электронном уровне два s-электрона:ns2. В хим. реакциях атомы элементовподгруппы легко отдают оба электрона внешнего энергетического уровня и образуютсоединения, в которых степень окисления элемента равна +2.
Всеэлементы этой подгруппы относятся к металлам. Кальций, стронций, барий и радийназываются щелочноземельными металлами.
В свободномсостоянии эти металлы в природе не встречаются. К числу наиболеераспространенных элементов относятся кальций и магний. Основнымикальцийсодержащими минералами являются кальцит CaCO3 (егоразновидности – известняк, мел, мрамор), ангидрит CaSO4, гипс CaSO4 ∙ 2h3O<sub/>,флюорит CaF2 ифторапатит Ca5(PO4)3F. Магнийвходит в состав минералов магнезита MgCO3, доломита MgCO3 ∙ CaCo3,карналлита KCl ∙ MgCl2 ∙ 6h3O.Соединения магния в больших количествах содержатся в морской воде.
Свойства.Бериллий, магний, кальций, барий и радий – металлы серебристо-белого цвета.Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотностиимеют кальций, магний, бериллий.
Радийявляется радиоактивным химическим элементом.
Бериллий,магний и особенно щелочноземельные элементы – химически активные металлы. Ониявляются сильными восстановителями. Из металлов этой подгруппы несколько менееактивен бериллий, что обусловлено образованием на поверхности этого металлазащитной оксидной пленки.
1. Взаимодействиес простыми веществами. Все легко взаимодействуют с кислородом и серой, образуяоксиды и сульфаты:
2Be+ O2 = 2BeO
Ca+ S = CaS
Бериллий имагний реагируют с кислородом и серой при нагревании, остальные металлы – приобычных условиях.
Все металлыэтой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
Принагревании все реагируют с водородом, азотом, углеродом, кремнием и другиминеметаллами:
Ca + h3 = Cah3 (гидридкальция)
3Mg + N2 = Mg3N2 (нитридмагния)
Ca + 2C = CaC2 (карбидкальция)
Карибиткальция – бесцветное кристаллическое вещество. Технический карбит, содержащийразличные примеси, может иметь цвет серый, коричневый и даже черный. Карбиткальция разлагается водой с образованием газа ацетилена C2h3 – важногопродукта хим. промышленности:
CaC2 + 2h3O = CaOH)2+ C2h3
Расплавленныеметаллы могут соединяться с другими металлами, образуя интерметаллическиесоединения, например CaSn3, Ca2Sn.
2. Взаимодействуютс водой. Бериллий с водой не взаимодействует, т.к. реакции препятствуетзащитная пленка оксида на поверхности металла. Магний реагирует с водой принагревании:
Mg + 2h3O = Mg(OH)2 + h3
Остальныеметаллы активно взаимодействуют с водой при обычных условиях:
Ca + 2h3O = Ca(OH)2 + h3
3. Взаимодействиес кислотами. Все взаимодействуют с хлороводородной и разбавленной сернойкислотами с выделением водорода:
Be + 2HCl = BeCl2 + h3
Разбавленнуюазотную кислоту металлы восстанавливают главным образом до аммиака или нитратааммония:
2Ca + 10HNO3(разб.)= 4Ca(NO3)2 + Nh5NO3 + 3h3O
Вконцентрированных азотной и серной кислотах (без нагревания) бериллийпассивирует, остальные металлы реагируют с этими кислотами.
4.Взаимодействие с щелочами. Бериллий взаимодействует с водными растворамищелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2h3O = Na2[Be(OH)4]+ h3
Магний ищелочноземельные металлы с щелочами не реагируют.
5.Взаимодействие с оксидами и солями металлов. Магний и щелочноземельные металлымогут восстанавливать многие металлы из их оксидов и солей:
TiCl4 + 2Mg = Ti + 2MgCl2
V2O5 + 5Ca = 2V + 5CaO
Бериллий,магний и щелочноземельные металлы получают электролизом расплавов их хлоридовили термическим восстановлением их соединений:
BeF2 + Mg = Be + MgF2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
Радийполучают в виде сплава с ртутью электролизом водного раствора RaCl2 с ртутнымкатодом.
Получение:
1) Окисление металлов (кроме Ba, которыйобразует пероксид)
2)Термическое разложение нитратов или карбонатов
CaCO3 –t°→CaO + CO2
2Mg(NO3)2 –t°→ 2MgO + 4NO2 + O2
Характеристикаэлементов главной подгруппы IIIгруппы. Алюминий.
Алюминий находится в главной подгруппе III группыпериодической системы. На внешнем энергетическом уровне атома алюминия имеютсясвободные р-орбитали, что позволяет ему переходить в возбужденное состояние. Ввозбужденном состоянии атом алюминия образует три ковалентные связи илиполностью отдает три валентных электрона, проявляя степень окисления +3.
Алюминий является самым распространенным металлом на Земле:его массовая доля в земной коре составляет 8,8%. Основная масса природногоалюминия входит в состав алюмосиликатов – веществ, главными компонентамикоторых являются оксиды кремния и алюминия.
Алюминий – легкий металл серебристо-белогоцвета, плавится при 600°C, очень пластичен, легковытягивается в проволоку и прокатывается в листы и фольгу. Поэлектропроводности алюминий устпает лишь серебру и меди.
Взаимодействие с простымивеществами:
1. с галогенами:
2Al + 3Cl2 → 2AlCl3
2. с кислородом:
4Al + 3O2 → 2Al2O3
3. с серой:
2Al+ 3S → Al2S3
4. с азотом:
2Al + N2 →AlN
С водородом алюминий непосредственно не реагирует, но егогидрид Alh4 полученкосвенным путем.
Взаимодействиесо сложными веществами:
1. с кислотами:
2Al+ 6HCl → 2AlCl3 + 3h3
2. со щелочами:
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3
Если NaOH в твердом состоянии:
2Al+ 2NaOH + 6h3O → 2NaAlO2 + 3h3
3. с водой:
2Al + 6h3O→2Al(OH)3 + 3h3
Свойстваоксида и гидроксида алюминия:
Оксидалюминия, или глинозем, Al2O3 представляетсобой белый порошок. Оксид алюминия можно получить, сжигая металл илипрокаливая гидроксид алюминия:
2Al(OH)3→ Al2O3 + 3h3O
Оксид алюминия практически не растворяется в воде.Соответствующий этому оксиду гидроксид Al(OH)3 получают действием гидроксида аммония или растворов щелочей, взятых внедостатке, на растворы солей алюминия:
AlCl3+ 3Nh4 ∙ h3O → Al(OH)3 ↓ + 3Nh5Cl
Оксид и гидроксид этого металлаявляются амфотерными, т.е. проявляют как основные, так и кислотные свойства.
Основные свойства:
Al2O3 + 6HCl→2AlCl3 + 3h3O
2Al(OH)3 + 3h3SO4 → Al2(SO4)3 + 6h3O
Кислотныесвойства:
Al2O3 + 6KOH +3h3O →2K3[Al(OH)6]
2Al(OH)3+ 6KOH → K3[Al(OH)6]
Al2O3 + 2NaOH→2NaAlO2 + h3O
Алюминий получают электролитическим методом. Он не можетбыть выделен из водных растворов солей, т.к. является очень активным металлом.Поэтому основным промышленным методом получения металлического алюминияявляется электролиз расплава, содержащего оксид алюминия и криолит.
Металлический алюминий широко используется впромышленности, по объему производства занимает второе место после железа.Основная масса алюминия идет на изготовление сплавов:
Дуралюмин – сплав алюминия, содержащий медь и небольшоеколичество магния, марганца и других компонентов. Дуралюмины – легкие прочные икоррозионностойкие сплавы. Используют в авиа- и машиностроении.
Магналин – сплав алюминия с магнием. Используют в авиа- имашиностроении, в строительстве. Стоек к коррозии в морской воде, поэтому егоприменяют в судостроении. Силумин – сплав алюминия, содержащий кремний. Хорошо подвергаетсялитью. Этот сплав используют в автомобиле-, авиа- и машиностроении,производстве точных приборов. Алюминий – пластичный металл, поэтому из негоизготавливают тонкую фольгу, используемую в производстве радиотехническихизделий и для упаковки товаров. Из алюминия делают провода, краски «подсеребро».
Переходные металлы.
Железо.
Впериодической системе железо находится в четвертом периоде, в побочнойподгруппе VIII группы.
Порядковыйномер – 26, электронная формула 1s2 2s2 2p6 3d64s2.
Валентныеэлектроны у атома железа находятся на последнем электронном слое (4s2)и предпоследнем (3d6). В химических реакциях железо может отдаватьэти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Железо является вторым пораспространенности металлом в природе (после алюминия).Наиболее важныеприродные соединения: Fe2O3 · 3h3O – бурый железняк;Fe2O3– красный железняк;Fe3O4(FeO · Fe2O3) –магнитный железняк;FeS2 — железный колчедан (пирит).Соединенияжелеза входят в состав живых организмов.
Железо – серебристо серый металл,обладает большой ковкостью, пластичностью и сильными магнитными свойствами.Плотность железа – 7,87 г/см3, температура плавления 1539°С.
В промышленности железо получаютвосстановлением его из железных руд углеродом (коксом) и оксидом углерода (II)в доменных печах. Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3+ CO = 2Fe3O4 + CO2,
Fe3O4+ CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
В реакциях железо являетсявосстановителем. Однако при обычной температуре оно не взаимодействует даже ссамыми активными окислителями (галогенами, кислородом, серой), но принагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO· Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железореагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Во влажном воздухе железо быстроокисляется (корродирует):
4Fe + 3O2 + 6h3O= 4Fe(OH)3,
Железо находится в середине электрохимическогоряда напряжений металлов, поэтому является металлом средней активности.Восстановительная способность у железа меньше, чем у щелочных, щелочноземельныхметаллов и у алюминия. Только при высокой температуре раскаленное железореагирует с водой:
3Fe + 4h3O = Fe3O4+ 4h3
Железо реагирует с разбавленнымисерной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2+ h3
Fe + h3SO4= FeSO4 + h3
При обычной температуре железо невзаимодействует с концентрированной серной кислотой, так как пассивируется ею.При нагревании концентрированная h3SO4 окисляет железо досульфита железа (III):
2Fe + 6h3SO4= Fe2(SO4)3 + 3SO2 + 6h3O.
Разбавленная азотная кислота окисляетжелезо до нитрата железа (III):
Fe + 4HNO3 =Fe(NO3)3 + NO + 2h3O.
Концентрированная азотная кислотапассивирует железо.
Из растворов солей железо вытесняетметаллы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 =FeSO4 + Cu, Fe0+ Cu2+ = Fe2+ + Cu0.
Оксид железа (II) FeO – черное кристаллическое вещество,нерастворимое в воде. Оксид железа (II) получают восстановлением оксидажелеза(II,III) оксидом углерода (II):
Fe3O4 + CO =3FeO + CO2.
Оксид железа (II) – основной оксид,легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2+ h3O, FeO + 2H+ = Fe2+ + h3O.
Гидроксид железа (II) Fe(OH)2 – порошок белого цвета, нерастворяется в воде. Получают его из солей железа (II) при взаимодействии их сощелочами:
FeSO4 + 2NaOH =Fe(OH)2¯ + Na2SO4,
Fe2+ + 2OH- =Fe(OH)2¯.
Гидроксид железа (II) Fe(OH)2проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl= FeCl2 + 2h3O,
Fe(OH)2 + 2H+ =Fe2+ + 2h3O.
При нагревании гидроксид железа (II)разлагается:
Fe(OH)2 = FeO + h3O.
Соединения со степенью окисленияжелеза +2 проявляют восстановительные свойства, так как Fe2+ легкоокисляются до Fe+3:
Fe+2 – 1e = Fe+3
Так, свежеполученный зеленоватыйосадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменениеокраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородомвоздуха:
4Fe+2(OH)2+ O2 + 2h3O = 4Fe+3(OH)3.
Оксид железа (III) Fe2O3 – порошок бурого цвета, нерастворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа(III):
2Fe(OH)3 = Fe2O3+ 3h3O
Б) окислением пирита (FeS2):
4Fe+2S2-1+ 11O20= 2Fe2+3O3 + 8S+4O2-2.
Оксид железа (III) проявляетамфотерные свойства:
А) взаимодействует с твердымищелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2O3+ 2NaOH = 2NaFeO2 + h3O,
Fe2O3+ 2OH- = 2FeO2- + h3O,
Fe2O3+ Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) привзаимодействии их со щелочами:
FeCl3 + 3NaOH =Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- =Fe(OH)3¯.
Гидроксид железа (III) является болееслабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (спреобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3легко образует соответствующие соли:
Fe(OH)3 + 3HCl « FeCl3 + h3O
2Fe(OH)3 + 3h3SO4« Fe2(SO4)3+ 6h3O
Fe(OH)3 + 3H+ « Fe3+ + 3h3O
Реакции с концентрированнымирастворами щелочей протекают лишь при длительном нагревании.
Соединения со степенью окисленияжелеза +3 проявляют окислительные свойства, так как под действиемвосстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III)окисляет йодид калия до свободного йода:
2Fe+3Cl3+ 2KI = 2Fe+2Cl2 + 2KCl + I20
Хром.
Хром находится в побочной подгруппе VI группы Периодическойсистемы. Строение электронной оболочки хрома: Cr3d54s1.
Массовая доля хрома в земной коре составляет 0,02%.Важнейшими минералами, входящими в состав хромовых руд, являются хромит, илихромистый железняк, и его разновидности, в которых железо частично заменено намагний, а хром – на алюминий.
Хром – серебристо серый металл. Чистый хромдостаточно пластичный, а технический самый твердый из всех металлов.
Хромхимически малоактивен. В обычных условиях он реагирует только с фтором (изнеметаллов), образуя смесь фторидов. При высокихтемпературах (выше 600°C) взаимодействует с кислородом,галогенами, азотом, кремнием, бором, серой, фосфором:
4Cr + 3O2 –t°→ 2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В азотной и концентрированной серной кислотах онпассивирует, покрываясь защитной оксидной пленкой. В хлороводородной иразбавленной серной кислотах растворяется, при этом, если кислота полностьюосвобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекаетна воздухе – соли хрома (III):
Cr + 2HCl → CrCl2 + h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
Оксидхрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединенияхрома (II) — сильные восстановители;переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3
Соединения трёхвалентного хрома
Оксидхрома (III) Cr2O3 – зелёный, нерастворимый вводе порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия иаммония:
2Cr(OH)3 –t°→ Cr2O3 + 3h3O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°→ Cr2O3 + N2+ 4h3O
Амфотерныйоксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаютсясоединения хрома со степенью окисления (+3):
Cr2O3+ 2NaOH → 2NaCrO2 + h3O
Cr2O3+ Na2CO3 → 2NaCrO2 + CO2
Cr2O3+ 6KHSO4 → Cr2(SO4)3 + 3K2SO4+ 3h3O
Присплавлении со смесью щёлочи и окислителя получают соединения хрома в степениокисления (+6):
2Cr2O3 + 4KOH + KClO3 → 2K2Cr2O7(дихромат калия) + KCl + 2h3O
Гидроксидхрома (III) Cr(OH)3 — нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3+ 6NaOH →2Cr(OH)3¯ + 3Na2SO4
Обладаетамфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4→ Cr2(SO4)3 + 6h3O
Cr(OH)3 + KOH →K[Cr(OH)4]
Оксидхрома (VI) CrO3 — ярко-красные кристаллы,растворимые в воде.
Получаютиз хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4+ h3SO4 → CrO3 + K2SO4+ h3O
K2Cr2O7+ h3SO4 → 2CrO3 + K2SO4+ h3O
CrO3 — кислотный оксид, сощелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + h3O
Вкислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 → K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакцияпротекает в обратном направлении:
K2Cr2O7+ 2KOH → 2K2CrO4+ h3O
Всесоединения хрома (VI)- сильные окислители.
4CrO3 + 3S → 3SO2+ 2Cr2O3
Медь.
Медьнаходится в побочной подгруппе I группы Периодическойсистемы. Строение электронных оболочек атомов элементов этой подгруппывыражается формулой (n-1)d10ns1. Навнешнем энергетическом уровне атома находится один электрон, однако вобразовании хим. связей могут принимать участие и электроны с d-подуровняпредпоследнего уровня. Поэтому они могут проявлять степени окисления +1, +2,+3, для меди наиболее устойчивы соединения со степенью окисления +2.
Медь –мягкий пластичный металл, имеет розово-красную окраску. Обладает высокойэлектрической проводимостью.
Медь –химически малоактивный металл. С кислородом реагирует только при нагревании:
2Cu + O2 = 2CuO
Нереагирует с водой, растворами щелочей, хлороводородной и разбавленной сернойкислотами. Медь растворяется в кислотах, являющихся сильными окислителями:
3Cu + 8HNO3 (разб.) =3Cu(NO3)2 + 2NO + 4h3O
Cu + 2h3SO4 (конц.)=CuSO4 + SO2 +2h3O
Во влажнойатмосфере, содержащей диоксид углерода, поверхность меди обычно покрываетсязеленоватым налетом основного карбоната меди:
2Cu + O2 + CO2 +h3O= Cu(OH)2 ∙ CuCO3
Оксид меди(II) CuO – черное вещество, можетбыть получен из простых веществ или путем нагревания гидроксида меди (II):
Cu(OH)2 = CuO + h3O
Гидроксидмеди (II) представляет собой малорастворимое в водесоединение голубого цвета. Легко растворяется в кислотах и при нагревании вконцентрированных растворах щелочей, т.е. проявляет свойства амфотерногогидроксида:
Cu(OH)2 + h3SO4 =CuSO4 + 2h3O
Cu(OH)2 + 2KOH = K2[Cu(OH)4]
Основнаямасса производимой меди используется в электротехнической промышленности. Вбольших количествах медь идет на производство сплавов.
Цинк.
Цинкнаходится в побочной подгруппе II группы. Атомы элементовэтой подгруппы имеют следующую электронную оболочку: (n-1)s2p6d10ns2. Проявляютв соединениях степень окисления +2.
Цинк –серебристо-белый металл. Обладает хорошей электро- и теплопроводимостью. Навоздухе цинк покрывается защитной пленкой оксидов и гидроксидов, котораяослабляет его металлический блеск.
Цинк –химически активный металл. При нагревании легко взаимодействует с неметаллами(серой, хлором, кислородом):
2Zn + O2 = 2ZnO
Растворяетсяв разбавленных и концентрированных кислотах HCl, h3SO4, HNO3 и в водныхрастворах щелочей:
Zn + 2HCl = ZnCl2 + h3
4Zn + 10HNO3 = 4Zn(NO3)2+ Nh5NO3 + 3h3O
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4]+ h3
Оксид цинка– белое вещество, практически нерастворимое в воде. Оксид и гидроксид цинкаявляются амфотерными соединениями; они реагируют с кислотами и щелочами:
ZnO +2HCl = ZnCl2 + h3O
ZnO + 2KOH + h3O = K2[Zn(OH)4]
Гидроксидцинка растворяется в водном растворе аммиака, образуя комплексное соединение:
Zn(OH)2 + 6Nh4 = [Zn(Nh4)6](OH)2
Приполучение цинка его руды подвергают обжигу:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnCO3 = ZnO + CO2
Далее оксидцинка восстанавливают углем:
ZnO + C = Zn + CO
Дляполучения более чистого металла оксид цинка растворяют в серной кислоте ивыделяют электролизом.
Цинкиспользуют для производства сплавов. Цинком покрывают стальные и чугунныеизделия для защиты их от коррозии.
Понятие о сплавах.
Характернойособенностью металлов является их способность образовывать друг с другом или снеметаллами сплавы. Чтобы получить сплав, смесь металлов обычно подвергаютплавлению, а затем охлаждают с различной скоростью, которая определяетсяприродой компонентов и изменением характера их взаимодействия в зависимости оттемпературы. Иногда сплавы получают спеканием тонких порошков металлов, неприбегая к плавлению (порошковая металлургия). Итак сплавы — это продуктыхимического взаимодействия металлов.
Кристаллическаяструктура сплавов во многом подобна чистым металлам, которые, взаимодействуядруг с другом при плавлении и последующей кристаллизации, образуют: а)химические соединения, называемые интерметаллидами; б) твердые растворы; в)механическую смесь кристаллов компонентов.
Тот илииной тип взаимодействия определяется соотношением энергии взаимодействияразнородных и однородных частиц системы, то есть соотношением энергийвзаимодействия атомов в чистых металлах и сплавах.
Современнаятехника использует огромное число сплавов, причем в подавляющем большинстве случаевони состоят не из двух, а из трех, четырех и большего числа металлов.Интересно, что свойства сплавов часто резко отличаются от свойствиндивидуальных металлов, которыми они образованы. Так, сплав, содержащий 50%висмута, 25% свинца, 12,5% олова и 12,5% кадмия, плавится всего при 60,5градусах Цельсия, в то время как компоненты сплава имеют соответственнотемпературы плавления 271, 327, 232 и 321 градус Цельсия. Твердость оловяннойбронзы (90% меди и 10% олова) втрое больше, чем у чистой меди, а коэффициентлинейного расширения сплавов железа и никеля в 10 раз меньше, чем у чистыхкомпонентов.
Однаконекоторые примеси ухудшают качество металлов и сплавов. Известно, например, чточугун (сплав железа и углерода) не обладает той прочностью и твердостью, которыехарактерны для стали. Помимо углерода, на свойства стали влияют добавки серы ифосфора, увеличивающие ее хрупкость.
Средисвойств сплавов наиболее важными для практического применения являютсяжаропрочность, коррозионная стойкость, механическая прочность и др. Для авиациибольшое значение имеют легкие сплавы на основе магния, титана или алюминия, дляметаллообрабатывающей промышленности — специальные сплавы, содержащие вольфрам,кобальт, никель. В электронной технике применяют сплавы, основным компонентомкоторых является медь. Сверхмощные магниты удалось получить, используя продуктывзаимодействия кобальта, самария и других редкоземельных элементов, асверхпроводящие при низких температурах сплавы — на основе интерметаллидов,образуемых ниобием с оловом и др.
ronl.org
Доклад-сообщение на тему Металлы 4, 7, 9 класс
На сегодняшний день благодаря открытиям многих ученых, нам известны многие химические элементы. Большую часть этих элементов составляют металлы. Их можно обнаружить в самых разных местах, и это не всегда недра земли. Металлы могут находиться в океанах, и даже реках. То, что металлы сильно отличаются от неметаллов, определили еще Ломоносов. Он давно знал, что все металлы имеют твердую основу и отблеск. Сегодня почти все виды металлов люди научились применять в технике. Большой популярностью пользуется железо и его сплавы. Многие металлические сплавы имеют хорошую прочность и устойчивость от коррозии.
Металл всегда обладал особенными металлическими свойствами. Самым распространенным металлом, который люди научились добывать из недр земли — является алюминий. Единственная отрасль, которая занимается добычей, и изготовлением продукции из металлов — называется металлургия. Почти все металлы, имеющиеся в природе, предстают перед человеком в виде соединений и руд. Единственная задача правильно их обнаружить, достать и применить. Достаточно кропотливый процесс отделения и чистки, металлических руд, имеющихся в природе. А все это для получения потом, чистого металла. Любой металл в нормальных условиях, всегда будет твердым. Плавится, металлы начинают уже при достаточно высокой температуре. Все металлы различают по многим характеристикам. Есть виды тяжелых металлов и легких.
Современное цивилизованное общество широко применяет металлы и их сплавы. Это связано с их высокой прочностью и непроницаемостью. Многие металлы люди научились использовать в виде проводников электричества. А другие применяют как состав резисторов во многих электронагревательных элементах. Металлы хорошо поддаются деформациям. При высокой температуре они гнутся и куются. Это дает возможность изготовить из них проволоку и железные листы. Каждый день люди всего мира заняты добычей металла. Есть такие металлы, которые встречаются в природе в свободном состоянии. Весь процесс добычи таких металлов, заключается в разъединении основного металла от приставшей к нему породы. Каждый добытый, и полученный металл, играет большую роль и пользу для многих отраслей.
Доклад Металлы сообщение
История человечества получила огромный толчок вперед, с тех времен, когда люди научились получать металлы. В связи с этим нам сегодня известны этапы развития промышленности и науки, новые эры человечества. Данные материалы и сегодня используются во всех отраслях жизнедеятельности человека.
Металлы имеют множество свойств, которые также люди постигали на протяжении истории. Основные свойства это прочность и пластичность, также ковкость. Металлы могут пропускать через себя тепло и электричество. Электропроводность зависит от температуры. Основа металлов это состав атомов и кристаллическая решетка. Металлы устроены так, что электроны могут осуществлять движение по всему металлу. Далее люди выяснили, что металлы также могут сплавляться друг с другом. В таком случае образуется сплав, основой которого являются несколько металлов.
Металлы можно разделить на два типа, которыми является черные металлы и цветные металлы. Сплавы из этих металлов можно получать благодаря тому, что каждый из этих типов имеет множество разнообразных и уникальных свойств. Также существуют металлиды и интерметаллиды. К черным металлам относятся сталь, чугун, а также другие элементы, имеющие в основе своего строения железо.
Цветные металлы включат в себя золото, платину, серебро. Также более редкие виды как титан и вольфрам. Более тяжелые как свинец, цинк и ртуть, а также легкие, как магний и алюминий.
 В промышленности и других отраслях могут использовать многие из выше перечисленных металлов. А другие используют меньше или вообще нашли замену, ведь металл может быть очень редким или доступным в мизерном количестве. В изготовлении металлопроката в основном используют черный сплав, который пока является доступным и имеет довольно хорошие показатели при его эксплуатации. Из цветных металлов самый распространенный металл, который используется в промышленности это алюминий. Данные детали из алюминия используются во многих отраслях.
В промышленности и других отраслях могут использовать многие из выше перечисленных металлов. А другие используют меньше или вообще нашли замену, ведь металл может быть очень редким или доступным в мизерном количестве. В изготовлении металлопроката в основном используют черный сплав, который пока является доступным и имеет довольно хорошие показатели при его эксплуатации. Из цветных металлов самый распространенный металл, который используется в промышленности это алюминий. Данные детали из алюминия используются во многих отраслях.
Сплавы и металлы, отличимые друг от друга. Это заметно по внешним признакам, но и не только. Также их можно различить по физическим свойствам. К железным сплавам относят такие отличимые черты, как проводимость электричества и тепла, а также плавление при очень высокой температуре и намагничивание. Как уже сказано выше, электропроводность зависит от температуры, когда она падает, то одни из видов металлов могут получить электропроводность гораздо выше, чем при высокой температуре. Также разные металлы по-своему реагируют на окружающую их среду. То есть ржавчина по-разному может проявляться на разных видах металлов.
Что касается металлов относящихся к цветным, то их можно различать по прочности, твердости и пластичности. Электро и теплопроводность, а также плотность являются составляющими, которые помогают различить металлы по физическим характеристикам. Широкое распространение имеют алюминий, титан, бронза и латунь. Все эти металлы используются в производстве различных деталей и составляющих используемых в различных отраслях промышленности.
Если брать, в общем, то все металлы разделяют по их области применения и назначению. Существуют специально разработанные стандарты, которые называются ГОСТ. Перед тем как выбрать тот или иной металл, следует тщательно разобраться в стандартах, чтоб понимать правильность выбора.
4, 7, 9 класс, кратко по химии
Металлы

Популярные доклады
- Доклад на тему Созвездие Водолея 2 класс сообщение
Ночью в небе появляется множество звёзд, которые образуют светящиеся узоры. Какие-то из них горят ярче, а какие-то тусклее и находясь в городской местности разглядеть их практически невозможно из-за высотных зданий и искусственного освещения.
- Доклад про Морковь 2, 3, 4, 5, 6 класс сообщение
Морковь, что мы знаем о ней? В первую очередь все скажут, что это вытянутый в длину овощ, оранжевого цвета, сладкий на вкус, что растёт он в огороде и является корнеплодом. И это действительно так! Морковь можно есть как сырой,
- Бабочка Павлиний глаз описание для детей сообщение-доклад
Павлиний глаз – один из европейских и необычайших видов бабочки, которому удалось получить такое название, за её необычные пятнышки, на её крыльях. Бабочка небольших, но и не малых размеров. У такой бабочки, размах достигает: от 4 до 5 см — самцы,
more-dokladov.ru
Доклад — Металлы — Химия
Общая характеристика металлов.
Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют металлические связи. Металлическая кристаллическая решетка — решетка, образованная нейтральными атомами и ионами металлов, связанными между собой свободными электронами.У металлов в узлах кристаллической решетки находятся атомы и положительные ионы. Электроны, отданные атомами, находятся в общем владении атомов и положительных ионов. Такая связь называется металлической. Для металлов наиболее характерны следующие физические свойства: металлический блеск, твердость, пластичность, ковкость и хорошая проводимость тепла и электричества. Теплопроводность и электропроводность уменьшается в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2%; железа — 4,1%; кальция — 4,1%; натрия — 2,3%; магния — 2,3%; калия — 2,1%; титана — 0,56%.
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро, золото, платина, медь, иногда ртуть
— в виде оксидов: магнетит Fe3 O4, гематит Fe2 О3 и др.
— в виде смешанных оксидов: каолин Аl2 O3 • 2SiO2 • 2Н2 О, алунит (Na,K)2 O • АlО3 • 2SiO2 и др.
— различных солей:
сульфидов: галенит PbS, киноварь НgS,
хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2 О, сульфатов: барит ВаSO4, ангидрид Са8 О4 фосфатов: апатит Са3 (РО4 )2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3 .
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Элементы I группы Li, Na, K, Rb, Cs, Fr
Общая характеристика: К элементам главной подгруппы I-ой группы Периодической системы относятся Li, Na, K, Rb, Cs, Fr. Их принято называть щелочными металлами. История открытия химических элементов IA группы.
Эти металлы в своих рядах являются первыми, т.е. именно у них начинается заполнение электронами нового электронного слоя. Их валентную электронную конфигурацию можно в общем виде обозначить так: ns1, где n — номер периода, в котором находится металл. Плотность, температура плавления, температура кипения простых веществ элементов IA группы.
Щелочные металлы имеют серебристо-белый цвет, а цезий — золотисто-желтый. Хранят щелочные металлы под слоем керосина или бензола. Металлические К, Rb, Cs самопроизвольно загораются на воздухе.
Первый потенциал ионизации, сродство к электрону и электроотрицательность по Полингу атомов элементов IA группы.
При комнатной температуре щелочные металлы находиться в твердом (кристаллическом) состоянии, хотя все они имеют очень невысокую температуру плавления. Первые три металла легче воды и плавают на ее поверхности, вступая в бурную реакцию:
2 Me + 2 h3 O = 2 MeOH + h3 .
Щелочные металлы самые активные из всех металлов. Поэтому иногда говорят, что атомы щелочных металлов «стремятся отдавать свой валентный электрон, чтобы приобрести устойчивую электронную оболочку инертного газа». Это не совсем так: чтобы у атома щелочного металла отнять электрон и превратить его в положительно заряженный ион:
Me — e + ПИ = Me+
необходимо затратить достаточно большую энергию ПИ (потенциал ионизации). При переходе от Li к Cs она уменьшается и поэтому активность металла, т.е. способность к химическому взаимодействию — увеличивается. И уж совсем неожиданны данные о сродстве к электрону (СЭ) у атомов щелочных металлов: изолированные атомы щелочных металлов «с удовольствием», т.е. с выделением энергии (СЭ) присоединяют к себе электрон:
Me + e = Me- + СЭ.
Отсюда следует очень важный вывод, что поведение изолированных атомов щелочных металлов — это одно, а их поведение в молекулах, т.е. при взаимодействии с атомами других химических элементов — это качественно другая ситуация. В молекулах атомные орбитали преобразовываются в молекулярные орбитали, валентные электроны атомов в молекуле находятся в совместном пользовании или сильно смещаются к одному из атомов вплоть до образования ионной связи.
Типичные степени окисления элементов IA группы в различных соединениях +1. Таким образом, имеются две степени окисления у элементов IA группы: 0 — в молекулах Ме2 и в металлическом состоянии и +1 — в соединениях ( ярко выраженная ионная связь. Очень высокая химическая активность щелочных металлов обусловлена низкими ПИ, легко разрушаемой кристаллической структурой и малой плотностью.
Получение
Li, Na, K (Ме) получают электролизом расплавов их хлоридов или гидроксидов:
2KCl = 2K+ + 2Cl- ,
катод 2K+ + 2e = 2K; анод 2Cl- -2e = Cl2 .
Температуры плавления хлоридов и гидроксидов щелочных металлов, o С
| Анион | Li | Na | K | Rb | Cs |
| Cl- | 610 | 801 | 776 | 723 | 645 |
| OH- | 473 | 322 | 405 | 385 | 343 |
Гидроксиды МеОН имеют меньшую, чем у хлоридов, температуру плавления, они термически вполне устойчивы, а при электролизе из расплавов идет процесс:
4МеOH = 4Ме + 2h3 O + O2 .
Используя относительно меньшую, чем у Al, Si, Ca, Mg, температуру кипения, можно получать щелочные металлы восстановлением их из оксидов, хлоридов, карбонатов при высоких температурах:
3Li2 O + 2Al  6Li + Al2 O3 ,
6Li + Al2 O3 ,
4NaCl + 3CaO + Si  4Na + 2CaCl2 + CaSiO3 .
4Na + 2CaCl2 + CaSiO3 .
Свойства: Щелочные металлы — очень сильные восстановители. Они энергично реагируют с большинством неметаллов, разлагают воду и бурно взаимодествуют с кислотами. В общем виде (обозначая атом щелочного металла просто Ме) эти реакции будут выглядеть так:
2Me + h3 = 2MeH (гидриды),
2Me + Г2 = 2MeГ (галогениды),
2Me + S = Me2 S (сульфиды),
3Me + P = Me3 P (фосфиды),
6Me + N2 = 2Me3 N (нитриды),
2Me + 2h3 O = 2MeOH + h3 .
Гидриды щелочных металлов реагируют с водой и кислородом:
MeH + h3 O = MeOH + h3 ,
2MeH + O2 = 2 MeOH.
Из солей щелочных металлов с галогенами гидролизуются только фториды:
MeF + h3 O = MeOH + HF.
Li используют в некоторых сплавах и для получения трития в термоядерном синтезе. Na и K применяют для получения Ti, Zr, Nb, Ta:
TiCl4 + 4Na = Ti + 4NaCl.
Li, Na, и K используют в реакциях органического синтезах. Na эффективен при осушке органических растворителей. Сs применяется для изготовления фотоэлементов, так как у его атомов самое малое значение ПИ из всех химических элементов.
Оксиды и пероксиды щелочных металлов
Атомы щелочных металлов (Ме) в соединениях одновалентны. Поэтому общая формула оксидов — Me2 O, пероксидов — Me2 O2. Приведем перечень всех соединений щелочных металлов с кислородом:
- Li2 O,
- Na2 O, Na2 O2 (пероксид),
- K2 O, K2 O2 (пероксид), KO2 (надпероксид), KO3 (озонид),
- Rb2 O, Rb2 O2 (пероксид), RbO2 (надпероксид),
- Cs2 O, Cs2 O2 (пероксид), CsO2 (надпероксид).
Литий не образует пероксидов, у Na — один пероксид, у K, Rb и Cs есть надпероксиды типа MeO2, у калия известен озонид. Все это надо учитывать при изучении взаимодействия щелочных металлов с кислородом и озоном:
4 Li + O2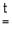 2 Li2 O,
2 Li2 O,
2 Na + O2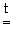 Na2 O2 ,
Na2 O2 ,
K + O2 = KO2 .
Оксиды щелочных металлов можно получить из надпероксидов:
2МеO2 Ме2 O2 + О2
Ме2 O2 + О2
и пероксидов:
Ме2 O2 + 2Ме 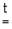 2 Ме2 O.
2 Ме2 O.
Li2 О обычно получают при нагревании его карбоната:
Li2 CO3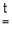 Li2 O + CO2 .
Li2 O + CO2 .
Оксиды щелочных металлов, растворяясь в воде, дают щелочи:
Ме2 O + h3 O = 2 МеOH.
Пероксиды и надпероксиды также реагируют с водой:
Ме2 O2 + 2 h3 O = 2 МеOH + h3 O2 ,
2 МеO2 + 2 h3 O = 2 МеOH + h3 O2 + O2 ,
с кислотными оксидами и кислотами:
Me2 O + SO3 = Me2 SO4 ,
Me2 O + 2HNO3 = 2MeNO3 + h3 O,
Me2 O2 + h3 SO4 = Me2 SO4 + h3 O2 ,
4MeO2 + 2CO2 = 2Me2 CO3 + 3O2 .
Пероксиды и надпероксиды являются сильными окислителями:
Me2 O2 + 2FeSO4 + 2h3 SO4 ® Fe2 (SO4 )3 + Me2 SO4 + 2h3 O,
но могут и сами окисляться:
5Me2 O2 + 2KMnO4 +8h3 SO4 ® 2MnSO4 + 5Me2 SO4 + K2 SO4 + 8h3 O + 5O2 .
Надпероксид калия поглощает СО2 и регенерирует кислород:
4KO2 + 2h3 O + 2CO2 = 4KHCO3 + O2 .
Гидроксиды
Гидроксиды имеют общую формулу МеОН.
Получение
Гидроксиды получают с помощью обменных реакций из сульфатов и карбонатов:
Me2 SO4 + Ba(OH)2 = BaSO4 ¯ + 2 MeOH,
Me2 CO3 + Ca(OH)2 = CaCO3 ¯ + 2 MeOH,
электролизом водных растворов хлоридов щелочных металлов:
2 МеCl + 2 h3 O = 2 МеOH + h3 + Cl2 ,
катод: 2H+ + 2e = h3; анод: 2Cl- — 2e = Cl2 .
Свойства
Галогениды щелочных металлов в воде полностью диссоциируют на ионы — это самые сильные основания. Твердые щелочи очень гигроскопичны и это позволяет использовать их в качестве эффективных осушителей. Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли.
2Al + 2 MeOH + 6 h3 O = 2Me[Al(OH)4 ] + 3h3 ,
Cl2 + 2MeOH = MeCl + MeClO + h3 O,
MeOH + HCl = MeCl + h3 O,
Nh5 Cl + MeOH = MeCl + Nh4 + h3 O,
CuCl2 + 2MeOH = Cu(OH)2 ¯ + 2MeCl,
Nah3 PO4 + NaOH = Na2 HPO4 + h3 O,
2 MeOH + CO2 = Me2 CO3 + h3 O,
2 MeOH + h3 SO4 = Me2 SO4 + 2 h3 O.
Натриевые соли очень широко используются в химической промышленности, их применение рассматривается в соответствующих группах неметаллов.
Калийные соли используют как удобрение и при получении стекла.
Элементы главной IIA группы: Be, Mg, Ca, Sr, Ba, Ra
Общая характеристика
К элементам главной IIA группы относятся Be, Mg, Ca, Sr, Ba, Ra. История открытия химических элементов группы IIA.
Атомы металлов IIA подгруппы имеют валентную электронную конфигурацию ns2, где n — номер периода, в котором находится металл.
Плотность, температура плавления, температура кипения простых веществ элементов IIA группы.
Как видно из табл. 13.2, металлы IIА группы относительно легкоплавки. Самым тугоплавким является Ве. Все эти металлы сравнительно легкие.
Первый потенциал ионизации (ПИ1 ), сродство к электрону (СЭ) и электроотрицательность по Полингу атомов элементов группы IIA.
Металлы от кальция до радия могут взаимодействовать с водой, давая гидроксиды, растворимые в воде (т.е. щелочи), поэтому их называют щелочноземельными:
Me + 2 h3 O = Me(OH)2 + h3 .
Щелочноземельные металлы самые активные после щелочных металлов. Поэтому иногда говорят, что атомы щелочноземельных металлов «стремятся отдавать валентные электроны, чтобы приобрести устойчивую электронную оболочку инертного газа». Из данных табл. следует, что это не совсем так. Чтобы у атома металла отнять даже один электрон и превратить его в положительно заряженный ион
Me — e + ПИ1 = Me+
необходимо затратить достаточно большую энергию ПИ1. Чтобы у иона Ме+ отнять еще один электрон, необходимо затратить еще большую энергию ПИ2 :
Me+ -e + ПИ2 = Ме2+ .
Эта большая, (по химическим масштабам) затрата энергии будет компенсирована прежде всего электростатическим взаимодействием с противоположно заряженными ионами. При переходе от Be к Ra и ПИ1, и ПИ2 уменьшаются, и поэтому активность металла, т.е. способность к химическому взаимодействию — увеличивается. Типичные степени окисления элементов IIA группы в различных соединениях +2.
Получение
Be, Mg, Ca и Sr (Ме) получают электролизом расплавов их хлоридов:
MeCl2 = Me2+ + 2Cl- ,
катод: Me2+ + 2e = Me; анод: 2Cl- -2e = Cl2 ,
а Ва — электролизом его окислов.
Используя относительно меньшую, чем у Al, С, Si, температуру кипения, можно получать эти металлы восстановлением их из оксидов и фторидов при высоких температурах:
4МеO + 2Al 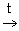 Ме(AlO2 )2 + 3Me
Ме(AlO2 )2 + 3Me
(Ме = Ca, Sr, Ba),
MeO + C  CO + Me,
CO + Me,
2MeO + CaO + Si  CaSiO3 + 2Me,
CaSiO3 + 2Me,
BeF2 + Mg = MgF2 + Be.
Свойства
Хранят Са, Sr, Ва под слоем керосина, так как при обычной температуре они окисляются кислородом воздуха.
Металлы IIA группы (Ме) — сильные восстановители. Они сравнительно легко реагируют с большинством неметаллов, разлагают воду (кроме Ве и Мg), растворяются в кислотах. В общем виде эти реакции будут выглядеть так:
Me + h3 Meh3 (гидриды),
Meh3 (гидриды),
Me + Г2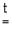 MeГ2 (галогениды),
MeГ2 (галогениды),
Me + S  MeS (сульфиды),
MeS (сульфиды),
3Me + 2P 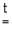 Me3 P2 (фосфиды),
Me3 P2 (фосфиды),
3Me + N2 Me3 N2 (нитриды),
Me3 N2 (нитриды),
Me + 2h3 O = Me(OH)2 + h3 (кроме Be и Mg),
Ме + 2НГ = МеГ2 + Н2 .
Гидриды металлов IIA группы реагируют с водой и кислородом:
Meh3 + 2h3 O = Me(OH)2 + 2h3 ,
Meh3 + O2 = Me(OH)2 (кроме Be и Mg).
Галогениды (Г) Be и Mg сильно гидролизуются, давая оксосоли:
MeГ2 + h3 O = Me(OH)Г + HГ
Mg и Ca применяют для получения Ti, U и редкоземельных металлов. Основная масса производимого Ве используется в атомной промышленности. Бериллиевые сплавы обладают высокой химической стойкостью. Магниевые сплавы используют в авиационной промышленности. Для осушки и очистки ряда веществ (CaCl2 ) и в других областях.
Оксиды и пероксиды металлов IIA группы
Атомы металлов IIA группы в соединениях двухвалентны. Поэтому общая формула оксидов — MeO и пероксидов — MeO2 (ВеО2 — не получен).
Получение
Оксиды получают при нагревании:
2Me + O2 = 2 MeO,
Me(OH)2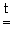 MeO + h3 O (Me = Be, Mg)
MeO + h3 O (Me = Be, Mg)
MeCO3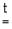 MeO + CO2 (Me = Be, Mg, Ca, Sr)
MeO + CO2 (Me = Be, Mg, Ca, Sr)
2Me(NO3 )2 2MeO + 4NO2 + O2
2MeO + 4NO2 + O2
Пероксиды получают по реакции нейтрализации Н2 О2 :
Me(OH)2 + h3 O2 = MeO2 + 2h3 O (кроме BaO2 ),
2BaO + O2 2BaO2 .
2BaO2 .
Свойства
Оксиды металлов IIA группы являются основными оксидами, а ВеО проявляет амфотерные свойства. Оксиды реагируют с водой:
МеO + h3 O = Ме(OH)2 (кроме ВеО),
легко растворяются в кислотах:
MeO + 2HCl = MeCl2 + h3 O,
а ВеО взаимодействует и со щелочами:
BeO + 2NaOH  Na2 BeO2 + h3 O,
Na2 BeO2 + h3 O,
BeO + 2NaOH + h3 O = Na2 [Be(OH)4 ],
BeO + Na2 CO3 = Na2 BeO2 + CO2 .
Пероксиды подвергаются сильному гидролизу:
MeO2 + 2h3 O = Me(OH)2 + h3 O2 ,
BaO2 + h3 SO4 = BaSO4 ¯ + h3 O2 (в лаборатории),
легко разлагаются кислотами, даже очень слабыми:
MeO2 + h3 CO3 = MeCO3 + h3 O2 .
Пероксиды являются сильными окислителями:
MeO2 + 2NaI + 2h3 O ® Me(OH)2 + 2NaOH + I2 ¯,
но могут и сами окисляться.
Они реагируют с кислотными оксидами и кислотами:
MeO + SO3 = MeSO4 ,
MeO + 2HNO3 = Me(NO3 )2 + h3 O.
Гидроксиды
Гидроксиды имеют общую формулу Ме(ОН)2 .
Получение
Их получают взаимодействием оксидов Ca, Sr, Ba (Ме) с водой:
MeO + h3 O = Me(OH)2 .
Be(OH)2 и Mg(OH)2 получают с помощью обменных реакций:
BeГ2 + 2NaOH = 2NaГ + Be(OH)2 ¯.
Свойства
Гидроксиды щелочноземельных металлов в воде полностью диссоциируют на ионы. Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли:
Cl2 + Ca(OH)2 = Ca(ClO)Cl + h3 O
(хлорная известь),
Me(OH)2 + 2HCl = MeCl2 + 2h3 O,
2Nh5 Cl + Me(OH)2 = MeCl2 + 2Nh4 + 2h3 O,
CuCl2 + Me(OH)2 = Cu(OH)2 ¯ + MeCl2 ,
Ca(HCO3 )2 + Ca(OH)2 = 2CaCO3 ¯ + 2h3 O,
Ca(OH)2 + CO2 = CaCO3 ¯ + h3 O,
Ba(OH)2 + h3 SO4 = BaSO4 ¯ + 2 h3 O.
Все содинения бериллия и растворимые соли бария весьма токсичны.
Известняк и известь применяют в сельском хозяйстве для известкования почв с целью понижения ее кислотности и улучшения структуры. Гипс (CaSO4 ·2h3 O) при нагревании превращается в алебастр (CaSO4 ·0.5h3 O). Они широко используются в строительном деле:.
CaSO4 ·0,5h3 O + 1,5h3 O = CaSO4 ·2h3 O.
Катионы кальция и магния обуславливают жесткость воды. При кипячении воды бикарбонаты разлагаются:
Ca(HCO3 )2 CaCO3 ¯ + h3 O + CO2
CaCO3 ¯ + h3 O + CO2
и образуется накипь, что приводит к взрыву паровых катлов. Для борьбы с карбонатной жесткостью воду подвергают предварительному кипячению либо обрабатывают гашеной известью. Некарбонатная жесткость воды устраняется с помощью соды.
Ca2+ + CO32- = CaCO3 ¯,
Mg2+ + CO32- = MgCO3 ¯.
Наиболее эффективным способом борьбы с жесткостью воды является применение ионнообменных смол. Важнейший строительный материал — цемент — это силикат и алюмосиликат кальция.
Переходные металлы.
Общая характеристика.
Переходные элементы расположены в Периодической системе в рядах с 4 по 7. Те переходные элементы, символы которых расположены в самой таблице, называют d-переходными элементами, а те элементы, символы которых расположены в низу таблицы, называют лантаноидами и актиноидами или f-переходными элементами. Отстановимся на получении и свойствах соединений элементов Cr, Mn, Fe, Cu, Zn, и Ag. История открытия этих элементов.
Все эти элементы в свободном состоянии — металлы. На внешней электронной оболочке, номер которой совпадает с номером периода, расположены, как правило, два электрона. С ростом заряда ядра (при переходе в ряду слева на право) происходит заполнение d-орбиталей предыдущего электронного слоя. Несмотря на то, что d- и f-электроны расположены во внутреннем электронном слое, они в момент заполнения электронной оболочки могут как валентные электроны участвовать в образовании химической связи.
Электронные конфигурации атомов переходных элементов:
| Cr | 1s2 2s2 2p6 3s2 3p6 3d5 4s1 |
| Mn | 1s2 2s2 2p6 3s2 3p6 3d5 4s2 |
| Fe | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 |
| Cu | 1s2 2s2 2p6 3s2 3p6 3d10 4s1 |
| Zn | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 |
| Ag | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 |
При заполнении электронной оболочки у атома хрома правило Клечковского (минимум энергии атома определяется минимумом суммы квантовых чисел n+l ) конкурирует с правилом Хунда (минимуму энергии отвечает максимальный суммарный спин электронов у атома). У Cr победило правило Хунда.
У Zn полностью завершена электронная оболочка внутренних электронных слоев, а на s-подуровне внешнего электронного слоя находятся два электрона, поэтому цинк проявляет в соединениях только одну степень окисления: +2. Незавершенность d-подуровня и один электрон на внешнем s-подуровне указывают на способность химического элемента проявлять в соединениях несколько степеней окисления.
Хром и его соединения
Хром — серебристо-белый с голубоватым оттенком металл, встречается в природе в виде хромита железа Fe(CrO2 )2 и хромата свинца PbCrO4.
Получение
Хром получают восстановлением:
Fe(CrO2 )2 + 4C = Fe + 2Cr + 4CO,
K2 Cr2 O7 + 2C = Cr2 O3 + K2 CO3 + CO,
Cr2 O3 + 2Al = 2Cr + Al2 O3 .
Свойства
Реагирует с неметаллами: галогенами, кислородом и т.д.:
2Cr + 3Г2 = 2CrГ3 ,
4Cr + 3O2 = 2Cr2 O3 .
При высокой температуре хром реагирует с водой:
2Cr + 3h3 O = Cr2 O3 + 3h3 ,
растворяется в кислотах:
Cr + h3 SO4 = CrSO4 + h3
(без доступа воздуха).
Хром не растворяется в концентрированных серной и азотных кислотах на холоде (пассивируется), но растворяется в них при нагревании:
2Cr + 6h3 SO4(конц) = Cr2 (SO4 )3 + 3SO2 + 6h3 O.
Применение
Хром используется для получения нержавеющих сталей и различных сплавов, применяется для хромирования изделий.
Соединения хрома со степенью окисления +2
Получение
Эти содеинения получают растворением хрома в кислотах без доступа воздуха:
Cr + 2HCl = CrCl2 + h3 (голубой раствор),
2CrCl3 + h3 = 2CrCl2 + 2HCl,
Cr + Ch4 COOH = Cr(Ch4 COO)2 + h3 .
Свойства
Cr(Ch4 COO)2 + 2NaOH = 2Ch4 COONa + Cr(OH)2 ¯.
Степень окисления: +2 очень неустойчивая и даже кислород воздуха окисляет Cr+2 до Cr+3 :
4Cr(OH)2 + O2 + 2h3 O = 4Cr(OH)3
(зелено-голубоватый осадок).
При нагревании Cr(OH)2 разлагается.
Соединения хрома со степенью окисления +3
Они напоминают по свойствам соединения Al+3 .
Оксид
Оксид получают:
4Cr + 3O2 = 2Cr2 O3 ,
(Nh5 )2 Cr2 O7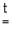 Cr2 O3 + N2 + 4h3 O.
Cr2 O3 + N2 + 4h3 O.
Оксид хрома (III) малорастворим и воде и в кислотах. Отвечающий ему гидрооксид обладает амфотерными свойствами:
Cr2 (SO4 )3 + 6КOH = 2Cr(OH)3 ¯ + 3К2 SO4
(зеленоватый осадок).
Cr(OH)3 растворяется в избытке щелочи:
Cr(OH)3 + NaOH = Na[Cr(OH)4 ],
И в кислотах:
Cr(OH)3 + 3HCl = CrCl3 + 3h3 O.
При прокаливании Сr(OH)3 разлагается:
2Сr(OH)3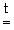 Cr2 O3 + 3h3 O.
Cr2 O3 + 3h3 O.
При сплавлении Сr2 O3 со щелочами или карбонатами получают метахромиты:
Сr2 O3 + 2КOH = 2КCrO2 + h3 O ,
Сr2 O3 + К2 CO3 = 2КCrO2 + CO2 .
Галогениды
Галогениды получают:
2Cr + 3Cl2 = 2CrCl3 ,
Cr2 O3 + 3Cl2 + 3C = 2CrCl3 + 3CO.
2CrCl3(тв) + 3h3 S(газ)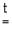 Cr2 S3 + 6HCl 2CrCl3 + 3Na2 S + 6h3 O = 2Cr(OH)3 + 3h3 S + 6NaCl ,
Cr2 S3 + 6HCl 2CrCl3 + 3Na2 S + 6h3 O = 2Cr(OH)3 + 3h3 S + 6NaCl ,
CrCl3 + Nh4 CrN + 3HCl ,
CrN + 3HCl ,
2CrCl3 + 3h3 O2 + 10KOH = 2K2 CrO4 + 6KCl + 8h3 O.
CrCl3 + 3NaHCO3 = Cr(OH)3 + 3CO2 + 3NaCl
Соединения хрома со степенью окисления +6
В этих соединениях по свойствам хром напоминает S+6 .
Кислотный оксид CrO3 получают разложением дихромовой кислоты:
K2 Cr2 O7 + h3 SO4(конц) = 2CrO3 + K2 SO4 + h3 O.
Свойства
Свойства галогенидов передают реакций:
CrO3 является ангидридом хромовой и дихромовой кислот, хорошо растворим в воде:
CrO3 + h3 O = h3 CrO4 ,
h3 CrO4 + CrO3 = h3 Cr2 O7 .
В кислой среде существуют дихроматы:
| 2K2 CrO4 + h3 SO4 = | K2 Cr2 O7 + K2 SO4 + h3 O, |
| желтый | оранжевый |
а в щелочной — хроматы:
| K2 Cr2 O7 + 2KOH = | 2K2 CrO4 + h3 O. |
| оранжевый | желтый |
В кислой среде Cr+6 сильный окислитель:
K2 Cr2 O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2 + 7h3 O.
6FeSO4 + K2 Cr2 O7 + 7h3 SO4 = 3Fe2 (SO4 )3 + Cr2 (SO4 )3 + K2 SO4 + 7h3 O
в нейтральной среде:
K2 Cr2 O7 + 3(Nh5 )2 S + h3 O = 2Cr(OH)3 ¯+ 3S ¯+ 6Nh4 + 2KOH.
Бихромат калия используется как окислитель.
Железо и его соединения
Железо встречается в природе в виде минералов: Fe3 O4 — магнитный железняк, Fe2 O3 — красный железняк, Fe2 O3 ·h3 O — бурый железняк, FeS2 — пирит.
Получение : Восстановлением оксидов при высокой температуре с помощью окиси углерода, кокса, водорода:
3Fe2 O3 + CO = 2Fe3 O4 + CO2 ,
Fe3 O4 + CO = 3FeO + CO2 ,
FeO + C = Fe + CO,
Fe2 O3 + 3h3 = 2Fe + 3h3 O.
Свойства : Для железа наиболее характерной степенью окисления является +3, возможна и +2, мало встречается +6. В ряду активностей металлов железо стоит левее водорода и вытесняет его из кислот:
Fe + 2HCl = FeCl2 + h3 .
При нагревании железо растворяется в кислотах — сильных окислителях. При высокой температуре (8000С) железо разлагает воду (промышленный способ получения водорода): 3Fe + 4h3 O = Fe3 O4 + 4h3 .
Железо реагирует с активными неметаллами:
2Fe + 3Cl2 = 2FeCl3 ,
Fe + S = FeS.
На воздухе в присутствии паров воды и углекислого газа происходит ржавление железа:
Fe + 1/2 O2 + h3 O + 2 CO2 = Fe(HCO3 )2 ,
Fe(HCO3 )2 + 2 h3 O = Fe(OH)2 + 2h3 O + 2CO2 ,
2Fe(OH)2 + 1/2 O2 + h3 O = 2Fe(OH)3 .
Железо вытесняет менее активные металлы из растворов их солей:
CuCl2 + Fe = FeCl2 + Cu¯ .
Кислородные соединения железа
Некоторые способы получения оксидов:
FeC2 O4 FeO + CO2 + CO
FeO + CO2 + CO
3Fe + O2 = Fe3 O4
2Fe(OH)3 Fe2 O3 + 3h3 O
Fe2 O3 + 3h3 O
Оксиды FeO и Fe2 O3 не растворяются в воде, но растворяются в кислотах:
FeO + 2HCl = FeCl2 + h3 O,
Fe2 O3 + 6HCl = 2FeCl3 + 3h3 O.
Отвечающие оксидам железа гидроксиды получают, действуя щелочами на соли железа:
| FeCl2 + 2NaOH = | Fe(OH)2 ¯ + 2NaCl |
| белый |
| FeCl3 + 3NaOH = | Fe(OH)3 ¯ + 3NaCl |
| коричневый |
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Соли двухвалентного железа легко окисляются кислородом воздуха
4FeSO4 + 2h3 O + O2 = 4Fe(OH)SO4 ,
и другими окислителями:
6FeSO4 + K2 Cr2 O7 + 7h3 SO4 = 3Fe2 (SO4 )3 + Cr2 (SO4 )3 + K2 SO4 + 7h3 O
Получение и свойства карбонатов железа:
FeCl2 + 2NaHCO3 = FeCO3 + h3 O + CO2 + 2NaCl FeCO3 + h3 O + CO2 = Fe(HCO3 )2 ,
FeS + 2HCl = FeCl2 + h3 S.
При сильном нагревании соли разлагаются:
Fe2 (SO4 )3 ® Fe2 O3 + 3SO3 .
Соли железа (III) реагируют с сильными восстановителями:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 2FeCl3 + 3Na2 S = 2FeS + S + 2KCl + 6NaCl
Качественные реакции на ионы Fe2+ и Fe3+ :
FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl
(вишневый цвет раствора)
Комплексные соединения железа:
| Fe(CN)2 + 4KCN = | K4 [Fe(CN)6 ] |
| гексоцианоферрат (II) калия | |
| желтая кровяная соль | |
| Fe(CN)3 + 3KCN = | K3 [Fe(CN)6 ] |
| гексоцианоферрат (III) калия | |
| красная кровяная соль |
Эти соли являются реактивами на Fe2+ и Fe3+ :
| 3K4 [Fe(CN)6 ] + 4FeCl3 = | Fe4 [Fe(CN)6 ]3 ¯ + 12KCl |
| берлинская лазурь | |
| 2K3 [Fe(CN)6 ] + 3FeCl2 = | Fe3 [Fe(CN)6 ]2 ¯ + 6KCl |
| турнбулева синь |
Применение: Широко используются в промышленности сплавы железа с углеродом (стали, чугуны). На основе Fe2 O3 получаются ферриты, важнейшие магнитные материалы для современной техники. Железо используется как катализатор во многих химических производствах. Оно входит в состав ферментов, катализирующих различные биохимические реакции.
Цинк и его соединения
Цинк — серебристо-серый металл, встречается в природе только в связанном состоянии: ZnS — цинковая обманка, ZnCO3 — цинковый шпат.
Получение . Цинк можно получить по реакциям:
2ZnS + 3O2 = 2ZnO + 2SO2 ,
ZnCO3 ZnO + CO2 ,
ZnO + CO2 ,
ZnO +C  Zn + CO,
Zn + CO,
ZnO + CO  Zn + CO2 ,
Zn + CO2 ,
ZnO + h3 SO4 = ZnSO4 + h3 O,
электролизом ZnSO4 .
Свойства
Для цинка характерна только одна степень окисления +2. Цинк растворяется как в кислотах, так и в щелочах, вытесняя водород:
Zn + 2 HCl = ZnCl2 + h3 ,
Реакция цинка с соляной кислотой ускорятся в присутствии солей меди и замедляется в присутствии солей ртути:
Zn + 2NaOH +2h3 O = Na2 [Zn(OH)4 ] + h3 .
Цинк растворяется в кислотах — сильных окислителях:
4Zn + 10HNO3(разб) =
= 4Zn(NO3 )2 + 3h3 O + Nh5 NO3 ,
Zn + 4HNO3(конц) = Zn(NO3 )2 + 2h3 O + 2NO2 ,
Zn + 2h3 SO4(конц) = ZnSO4 + 2h3 O + SO2 .
Кислородные соединения цинка
Оксид цинка получают: 2Zn + O2 = 2ZnO,
ZnCO3 ZnO + CO2 .
ZnO + CO2 .
Оксид цинка амфотерен и растворяется как в кислотах, так и в щелочах:
ZnO + 2HCl = ZnCl2 + h3 O,
ZnO + 2KOH + h3 O = K2 [Zn(OH)4 ].
В воде ZnO не растворим, и гидроксид цинка получают из его солей:
ZnCl2 + 2KOH = Zn(OH)2 +2KCl.
Гидроксид цинка обладает амфотерными свойствами и растворяется как в кислотах, так и в щелочах.
Сульфид цинка:
Zn + S = ZnS,
BаS + ZnSO4 = BaSO4 ¯ + ZnS,
ZnS + 2O2 = ZnSO4 .
Применение : Zn используется для изготовления оцинкованного железа, для получения сплавов (латуни).
Медь и ее соединения
Медь обладает высокой тепло- и электропроводностью. Медь встречается в природе в самородном виде и в виде соединений: CuS×·FeS — медный колчадан, Cu2 S — медный блеск, CuCO3 ·Cu(OH)2 — малахит.
Получение
Медь получают вытеснением из ее солей:
CuCl2 + Fe = FeCl2 + Cu¯,.
CuCl2 + Zn = ZnCl2 + Cu¯
обжигом природных минералов:
3Cu2 S + 3O2 = 6Cu + 3SO2 .
Получаемую таким образом черновую медь, очищают, подвергая электролизу.
Свойства
Для меди наиболее характерной степенью окисления является +2, хотя возможны соединения со степенью окисления +1 и, в исключительных случаях, +3.
В ряду активности металлов медь стоит правее водорода, поэтому растворяется только в кислотах — сильных окислителях.
3Cu + 8HNO3(разб) = 3Cu(NO3 )2 + 2NO + 4h3 O,
Cu + 4HNO3(конц) = Cu(NO3 )2 + 2NO2 + 2h3 O,
Cu + 2h3 SO4(конц) = CuSO4 + SO2 + 2h3 O.
Реагирует с галогенами (Г = F, Cl, Br):
Cu + Г2 = CuГ2 ,
2CuCl2 + 4KI = 2CuI¯ + I2 + 4KCl,
CuCl2 + Cu  2CuCl.
2CuCl.
Галогениды меди с аммиаком дают растворимые комплексные соединения :
CuCl + 2Nh4 =[Cu(Nh4 )2 ]Cl,
CuCl2 + 2Nh4 =[Cu(Nh4 )2 ]Cl2 .
Кислородные соединения меди
Оксиды меди и соли можно получить:
2Cu + O2 = 2CuO,
Cu(OH)2 CuO + h3 O,
CuO + h3 O,
CuO + h3 SO4 = CuSO4 + h3 O.
Ионы меди в растворе существуют в виде комплексов [Cu(h3 O)6 ]2+, которые придают растворам солей меди сине-голубую окраску:
CuSO4 + 2KOH = K2 SO4 + Cu(OH)2 ¯ ,
Cu(OH)2 + 4Nh4 = [Cu(Nh4 )4 ](OH)2
(реактив Швейцера),
2CuCl + 2KOH = Cu2 O¯ + 2KCl + h3 O,
2Cu2 O + O2 + 4h3 O = 4Cu(OH)2 ,
Cu2 O + h3 SO4 = CuSO4 + Cu¯ + h3 O.
Сульфид меди не растворим в обычных кислотах
CuSO4 + h3 S = CuS¯ + h3 SO4 CuSO4 + Na2 S = CuS¯ + Na2 SO4 ,
во влажном воздухе легко окисляется:
CuS + 2O2 = СuSO4 .
Карбонат меди не растворим в воде, но из-за гидролиза он не может быть получен при сливании водных растворов соды и хлорида меди:
CuCl2 + 2NaHCO3 = Cu(OH)2 + 2CO2 + 2NaCl
Медь стоит левее ртути в ряду активности металлов, поэтому она вытесняет ртуть из растворов ее солей:
Cu + Hg(NO3 )2 = Cu(NO3 )2 + Hg
Применение
Медь используется в электротехнике, для изготовления химических аппаратов и получения различных сплавов с оловом (бронзы), цинком (латунь), никелем, марганцем.
ronl.org