| 1. |
Агрегатное состояние оксидов
Сложность: лёгкое |
1 |
| 2. |
Распознавание химических формул оксидов
Сложность: лёгкое |
1 |
3.
|
Классификация оксидов
Сложность: лёгкое |
1 |
| 4. |
Составление формулы оксида по его названию
Сложность: лёгкое |
1 |
5. |
Составление формулы оксида и расчёт его молярной массы
Сложность: лёгкое |
2 |
| 6. |
Распознавание и классификация оксидов
Сложность: среднее |
2 |
7.
|
Составление названия оксида
Сложность: среднее |
2 |
| 8. |
Составление названия оксида и расчёт его молярной массы
Сложность: среднее |
2 |
9.
|
Химические свойства и получение оксидов
Сложность: среднее |
2 |
| 10. |
Распознавание оксидов по описанию их свойств
Сложность: сложное |
|
11.
|
Химические свойства и получение оксидов
Сложность: сложное |
3 |
| 12. |
Расчёт формулы оксида
Сложность: сложное |
3 |
Классификация, получение и свойства оксидов.
 Способы получения оксидов
Способы получения оксидовВещества, составляющие основу нашего физического мира, состоят из разных видов химических элементов. Четыре из них встречаются чаще всех остальных. Это водород, углерод, азот и кислород. Последний элемент может связываться с частицами металлов или неметаллов и образовывать бинарные соединения — окислы. В нашей статье мы изучим наиболее важные способы получения оксидов в лабораторных условиях и промышленности. Также рассмотрим их основные физические и химические свойства.
Агрегатное состояние
Оксиды, или окислы, существуют в трех состояниях: газообразном, жидком и твердом. Например, к первой группе относятся такие известные и широко распространенные в природе соединения, как углекислый газ — CO 2 , угарный газ — CO, двуокись серы — SO 2 и другие. В жидкой фазе существуют такие окислы, как вода — H 2 O, серный ангидрид — SO 3 , оксид азота — N 2 O 3 . Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Классификация окислов
Можно выделить несколько видов кислородсодержащих веществ, состоящих из двух элементов. Химические свойства и способы получения оксидов будут зависеть от того, к какой из перечисленных групп относится вещество. углерода, получают прямым соединением углерода с кислородом, проводя реакцию жесткого окисления. Углекислый газ можно выделить и в процессе обмена и сильных неорганических кислот:
HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
Какая же реакция является визитной карточкой кислотных оксидов? Это их взаимодействие со щелочами:
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
Амфотерные и несолеобразующие окислы
Безразличные окислы, например CO или N 2 O, не способны к реакциям, ведущим к появлению солей. С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
Получение оксидов серы
В своих соединениях с кислородом сера проявляет различную валентность. Так, в сернистом газе, формула которого SO 2 , она четырехвалентна. В лаборатории диоксид серы получают в реакции между сульфатной кислотой и гидросульфитом натрия, уравнение которой имеет вид
NaHSO 3 + H 2 SO 4 → NaHSO 4 + SO 2 + H 2 O
Еще один способ добычи SO 2 — это окислительно-восстановительный процесс между медью и сульфатной кислотой высокой концентрации. Третий лабораторный метод получения оксидов серы — сжигание под вытяжкой образца простого вещества серы:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
В промышленности диоксид серы можно добыть выжиганием серосодержащих минералов цинка или свинца, а также обжигом пирита FeS 2 . Полученный таким методом сернистый газ используют для добычи трехокиси серы SO 3 и далее — сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H 2 SO 3:
Полученный таким методом сернистый газ используют для добычи трехокиси серы SO 3 и далее — сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H 2 SO 3:
SO 2 + H 2 O = H 2 SO 3
Данная реакция является обратимой. Степень диссоциации кислоты невелика, поэтому соединение относят к слабым электролитам, да и сама сернистая кислота может существовать только в водном растворе. В нем всегда присутствуют молекулы сернистого ангидрида, которые придают веществу резкий запах. Раагирующая смесь находится в состоянии равенства концентрации реагентов и продуктов, которое можно сместить, изменяя условия. Так, при добавлении к раствору щелочи реакция будет проходить слева направо. В случае выведения из сферы реакции сернистого ангидрида нагреванием или продуванием через смесь газообразного азота динамическое равновесие будет смещаться влево.
Серный ангидрид
Продолжим рассматривать свойства и способы получения оксидов серы. Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H 2 SO 4 добывают, растворяя серный ангидрид в концентрированной В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H 2 SO 4 добывают, растворяя серный ангидрид в концентрированной В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Основные окислы
Изучив свойства и получение оксидов серы, относящихся к группе кислотных бинарных соединений с кислородом, рассмотрим кислородные соединения металлических элементов.
Основные окислы можно определить по такому признаку, как наличие в составе молекул частиц металлов главных подгрупп первой или второй групп периодической системы. Они относятся к щелочным или щелочноземельным. Например, окись натрия — Na 2 O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды — щелочи. Однако главное химическое свойство основных оксидов — это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
Они относятся к щелочным или щелочноземельным. Например, окись натрия — Na 2 O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды — щелочи. Однако главное химическое свойство основных оксидов — это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
CuO + 2HCl = CuCl 2 + H 2 O
Нагревание твердых нерастворимых гидроксидов — еще один важных способов получения основных оксидов:
Ca(OH) 2 → CaO + H 2 O
Условия: 520-580 °C.
В нашей статье мы рассмотрели наиболее важные свойства бинарных соединений с кислородом, а также способы получения оксидов в лаборатории и промышленности.
2. Классификация, получение и свойства оксидов
Из бинарных соединений наиболее известны оксиды. Оксидами
называются соединения, состоящие из двух элементов, одним из которых является
кислород, имеющий степень окисления -2. По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные) .
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные) .
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
Названия оксидов образуются с применением слова «оксид» и русского названия элемента в родительном падеже с указанием римскими цифрами валентности элемента, например: SO 2 — оксид серы (IV ), SO 3 — оксид серы (VI ), CrO — оксид хрома (II ), Cr 2 O 3 — оксид хрома (III ).
2.1. Основные оксиды
Основными называются оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с образованием солей.
К основным оксидам относятся оксиды типичных металлов , им соответствуют гидроксиды, обладающие свойствами оснований (основные гидроксиды), причем степень окисления элемента не изменяется при переходе от оксида к гидроксиду, например,
Получение основных оксидов
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + O 2 = 2MgO,
2Cu
+ O 2 = 2CuO.
Этот метод неприменим для щелочных металлов, которые при окислении обычно дают пероксиды и супероксиды, и только литий, сгорая, образует оксид Li 2 O .
2. Обжиг сульфидов:
2 CuS + 3 O 2 = 2 CuO + 2 SO 2 ,
4 FeS 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 .
Метод неприменим для сульфидов активных металлов , окисляющихся до сульфатов.
3. Разложение гидроксидов (при высокой температуре):
С u (OH ) 2 = CuO + H 2 O .
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот (при высокой температуре):
ВаСО 3 = ВаО + СО 2 ,
2Pb(NO 3) 2 = 2PbO + 4NO 2 + O 2 ,
4 FeSO 4 = 2 Fe 2 O 3 + 4 SO 2 + O 2 .
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
(ZnOH) 2 CO 3 = 2ZnO +CO 2 + H 2 O.
Свойства основных оксидов
Большинство основных
оксидов представляет собой твердые кристаллические вещества ионного характера,
в узлах кристаллической решетки расположены ионы металлов, достаточно прочно
связанные с оксид-ионами О —2 , поэтому оксиды типичных металлов
обладают высокими температурами плавления и кипения.
1. Большинство основных оксидов не распадаются при нагревании, исключение составляют оксиды ртути и благородных металлов:
2HgO = 2Hg + O 2 ,
2Ag 2 O = 4Ag + O 2 .
2. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами:
BaO + SiO 2 = BaSiO 3 ,
MgO + Al 2 O 3 = Mg(AlO 2) 2 ,
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O.
3. Присоединяя (непосредственно или косвенно) воду, основные оксиды образуют основания (основные гидроксиды). Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Li 2 O + H 2 O = 2 LiOH ,
CaO + H 2 O = Ca (OH ) 2 .
Исключение составляет оксид магния MgO . Из него нельзя получить гидроксид магния Mg (OH ) 2 при взаимодействии с водой.
4. Как и все другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
Fe 2 O 3 + 2Al = Al 2 O 3 + 2Fe,
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O,
4
FeO
+
O
2
= 2
Fe
2
O
3
.
М.В. Андрюxoва, Л.Н. Бopoдина
1. Окисление простых веществ кислородом (сжигание простых веществ):
2Mg + O 2 = 2МgО
4Р + 5O 2 = 2Р 2 О 5 .
Метод не применим для получения оксидов щелочных металлов, т.к. при окислении щелочные металлы обычно дают не оксиды, а пероксиды (Na 2 O 2 , K 2 O 2) .
Не окисляются кислородом воздуха благородные металлы, напрмер, Аu, Аg, Рt.
2. Окисление сложных веществ (солей некоторых кислот и водородных соединений неметаллов):
2ZnS + 3O 2 = 2ZnO + 2SO 2
2Н 2 S + 3O 2 = 2SO 2 + 2Н 2 О
3. Разложение при нагревании гидроксидов (оснований и кислородсодержащих кислот):
Сu(ОН) 2 СuО + Н 2 О
H 2 SO 3 SO 2 + H 2 O
Нельзя пользоваться этим методом для получения оксидов щелочных металлов, так как разложение щелочей происходит при слишком высоких температурах.
4. Разложение некоторых солей кислородсодержащих кислот:
СаСО 3 СаО + СО 2
2Рb(NO 3) 2 2РbО + 4NO 2 + O 2
Следует иметь в виду, что соли щелочных металлов не разлагаются при нагревании с образованием оксидов.
1.1.7. Области применения оксидов.
Ряд природных минералов представляют собой оксиды (см. табл.7) и используются как рудное сырье для получения соответствующих металлов.
Например:
Боксит А1 2 O 3 · nH 2 O.
Гематит Fe 2 O 3 .
Магнетит FеО · Fe 2 O 3 .
Касситерит SnO 2 .
Пиролюзит МnO 2 .
Рутил ТiО 2 .
Минерал корунд (А1 2 O 3) обладающий большой твердостью, используют как абразивный материал. Его прозрачные, окрашенные в красный и синий цвет кристаллы представляют собой драгоценные камни – рубин и сапфир.
Негашеная известь (CaO) , получаемая обжигом известняка (СаСО 3) , находит широкое применение в строительстве, сельском хозяйстве и как реагент для буровых растворов.
Оксиды железа (Fе 2 О 3 , Fе 3 О 4) используются при бурении нефтяных и газовых скважин в качестве утяжелителей и реагентов-нейтрализаторов сероводорода.
Оксид кремния (IV) (SiO 2) в виде кварцевого песка широко используется для производства стекла, цемента и эмалей, для пескоструйной обработки поверхности металлов, для гидропескоструйной перфорации и при гидроразрыве в нефтяных и газовых скважинах. В виде мельчайших сферических частиц (аэрозоля) находит применение в качестве эффективного пеногасителя буровых растворов и наполнителя при производстве резинотехнических изделий (белая резина).
Ряд оксидов (А1 2 O 3 ,Cr 2 O 3 , V 2 O 5 , СuО, NО) используются в качестве катализаторов в современных химических производствах.
Являющийся одним из главных продуктов сгорания угля, нефти и нефтепродуктов углекислый газ (СО 2) при закачке в продуктивные пласты способствует повышению их нефтеотдачи. Используется СО 2 также для заполнения огнетушителей и газирования напитков.
Образующиеся при нарушении режимов сгорания топлива (NO, СО) или при сгорании сернистого топлива (SO 2) оксиды являются продуктами загрязняющими атмосферу. Современное производство, а также транспорт предусматривают строгий контроль за содержанием таких оксидов и их нейтрализацию,
Оксиды азота (NO, NO 2) и серы (SO 2 , SO 3) являются промежуточными продуктами в крупнотоннажных производствах азотной (НNO 3) и серной (Н 2 SО 4) кислот.
Оксиды хрома (Сг 2 O 3) и свинца (2РbО · РbО 2 – сурик) используются для производства антикоррозионных красочных составов.
Вопросы для самоконтроля по теме оксиды
1. На какие основные классы подразделяются все неорганические соединения?
2. Что такое оксиды?
3. Какие типы оксидов Вам известны?
4. Какие оксиды относятся к несолеобразующим (безразличным)?
5. Дайте определения: а) основной оксид, б) кислотный оксид,
в) амфотерный оксид.
6. Какие элементы образуют основные оксиды?
Какие элементы образуют основные оксиды?
7. Какие элементы образуют кислотные оксиды?
8. Напишите формулы некоторых амфотерных оксидов.
9. Как составляются названия оксидов оксиды?
10. Назовите следующие оксиды: Cu 2 O, FeO, Al 2 O 3 , Mn 2 O 7 , SO 2 .
11. Изобразите формулы следующих оксидов графически: а) оксид натрия, б) оксид кальция, в) оксид алюминия, г) оксид серы (1V), д) оксид марганца (VII) . Укажите их характер.
12. Напишите формулы высших оксидов элементов II и III периодов. Назовите их. Как изменяется химический характер оксидов II и III периодов?
13. Каковы химические свойства а) основных оксидов, б) кислотных оксидов, г) амфотерных оксидов?
14. Какие оксиды реагируют с водой? Приведите примеры.
15. Докажите амфотерность следующих оксидов: а) оксид бериллия, б) оксид цинка, в) оксид олова (IV).
16. Какие способы получения оксидов Вам известны?
17. Напишите уравнения реакций получения всеми известными Вам способами следующих оксидов: а) оксид цинка, б) оксид меди (II), в) оксид кремния (1V).
Напишите уравнения реакций получения всеми известными Вам способами следующих оксидов: а) оксид цинка, б) оксид меди (II), в) оксид кремния (1V).
18. Назовите некоторые из областей применения оксидов.
1.2. Основания
Оcнованиями называются химические вещества, распадающиеся (диссоциирующие) в водном растворе (или в расплаве) на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила (определение Аррениуса):
гидроксид натрия катион натрия гидроксид-ион
Основаниями являются сложные вещества, образующиеся при гидратации основных оксидов.
Например:
Na 2 O + H 2 O = NaOH – гидроксид натрия
BaO + H 2 O = Ва(ОН) 2 – гидроксид бария
Оксиды.
Это – сложные вещества состоящие из ДВУХ элементов, один из которых кислород. Например:
CuO– оксид меди(II)
AI 2 O 3 – оксид алюминия
SO 3 – оксид серы (VI)
Оксиды делятся (их классифицируют) на 4 группы:
Na 2 O– Оксид натрия
СаО – Оксид кальция
Fe 2 O 3 – оксид железа (III)
2). Кислотные – Это оксидынеметаллов .
А иногда и металлов если степень окисления
металла > 4. Например:
Кислотные – Это оксидынеметаллов .
А иногда и металлов если степень окисления
металла > 4. Например:
СО 2 – Оксид углерода (IV)
Р 2 О 5 – Оксид фосфора (V)
SO 3 – Оксид серы (VI)
3). Амфотерные – Это оксиды которые имеют свойства, как основных так и кислотных оксидов. Необходимо знать пять наиболее часто встречающихся амфотерных оксидов:
BeO–оксид бериллия
ZnO– Оксид цинка
AI 2 O 3 – Оксид алюминия
Cr 2 O 3 – Оксид хрома (III)
Fe 2 O 3 – Оксид железа (III)
4). Несолеобразующие (безразличные) – Это оксиды которые не проявляют свойств ни основных, ни кислотных оксидов. Необходимо запомнить три оксида:
СО – оксид углерода (II) угарный газ
NO– оксид азота (II)
N 2 O– оксид азота (I) веселящий газ, закись азота
Способы получения оксидов.
1). Горение, т.е. взаимодействие с кислородом простого вещества:
4Na + O 2 = 2Na 2 O
4P + 5O 2 = 2P 2 O 5
2). Горение, т. е.
взаимодействие с кислородом сложного
вещества (состоящего из двух
элементов )
при этом образуются два
оксида.
е.
взаимодействие с кислородом сложного
вещества (состоящего из двух
элементов )
при этом образуются два
оксида.
2ZnS + 3O 2 = 2ZnO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
3). Разложение трех слабых кислот. Другие не разлагаются. При этом образуются – кислотный оксид и вода.
Н 2 СО 3 = Н 2 О + СО 2
Н 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
4). Разложение нерастворимых оснований. Образуются основный оксид и вода.
Mg(OH) 2 = MgO + H 2 O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
5). Разложение нерастворимых солей. Образуются основный оксид и кислотный оксид.
СаСО 3 = СаО + СО 2
МgSO 3 = MgO + SO 2
Химические свойства.
I . Основных оксидов.
щелочь.
Na 2 O + H 2 O = 2NaOH
CaO + H 2 O = Ca(OH) 2
СuO + H 2 O = реакция не протекает, т.к. возможное основание в состав которого входит медь — нерастворимо
2). Взаимодействие
с кислотами, при этом образуется соль
и вода. (Основный оксид и кислоты реагируют
ВСЕГДА)
(Основный оксид и кислоты реагируют
ВСЕГДА)
К 2 О + 2НСI = 2KCl + H 2 O
CaO + 2HNO 3 = Ca(NO 3) 2 + H 2 O
3). Взаимодействие с кислотными оксидами, при этом образуется соль.
Li 2 O + CO 2 = Li 2 CO 3
3MgO + P 2 O 5 = Mg 3 (PO 4) 2
4). Взаимодействие с водородом, при этом образуется металл и вода.
CuO + H 2 = Cu + H 2 O
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
II. Кислотных оксидов.
1). Взаимодействие с водой, при этом должна образоваться кислота. (Только SiO 2 не взаимодействует с водой)
CO 2 + H 2 O = H 2 CO 3
P 2 O 5 + 3H 2 O = 2H 3 PO 4
2). Взаимодействие с растворимыми основаниями (щелочами). При этом образуется соль и вода.
SO 3 + 2KOH = K 2 SO 4 + H 2 O
N 2 O 5 + 2KOH = 2KNO 3 + H 2 O
3). Взаимодействие с основными оксидами. При этом образуется только соль.
N 2 O 5 + K 2 O = 2KNO 3
Al 2 O 3 + 3SO 3 = Al 2 (SO 4) 3
Основные
упражнения.
1). Закончить уравнение реакции. Определить её тип.
К 2 О + Р 2 О 5 =
Решение.
Что бы записать, что образуется в результате – необходимо определить – какие вещества вступили в реакцию – здесь это оксид калия (основный) и оксид фосфора (кислотный) согласно свойств – в результате должна получиться СОЛЬ (смотри свойство № 3) а соль состоит из атомов металлов (в нашем случае калия) и кислотного остатка в состав которого входит фосфор (т.е. РО 4 -3 – фосфат) Поэтому
3К 2 О + Р 2 О 5 = 2К 3 РО 4
тип реакции – соединение (так как вступают в реакцию два вещества, а образуется – одно)
2). Осуществить превращения (цепочка).
Са → СаО → Са(ОН) 2 → СаСО 3 → СаО
Решение
Для выполнения
этого упражнения необходимо помнить,
что каждая стрелочка это одно уравнение
(одна химическая реакция). Пронумеруем
каждую стрелочку. Следовательно,
необходимо записать 4 уравнения. Вещество
записанное слева от стрелочки(исходное
вещество) вступает в реакцию, а вещество
записанное справа – образуется в
результате реакции(продукт реакции). Расшифруем первую часть записи:
Расшифруем первую часть записи:
Са + …..→ СаО Мы обращаем внимание, что вступает в реакцию простое вещество, а образуется оксид. Зная способы получения оксидов (№ 1) приходим к выводу, что в данной реакции необходимо добавить –кислород (О 2)
2Са + О 2 → 2СаО
Переходим к превращению № 2
СаО → Са(ОН) 2
СаО + ……→ Са(ОН) 2
Приходим к выводу, что здесь необходимо применить свойство основных оксидов – взаимодействие с водой, т.к. только в этом случае из оксида образуется основание.
СаО + Н 2 О → Са(ОН) 2
Переходим к превращению № 3
Са(ОН) 2 → СаСО 3
Сa(OH) 2 + ….. = CaCO 3 + …….
Приходим к выводу, что здесь речь идет об углекислом газе СО 2 т.к. только он при взаимодействии со щелочами образует соль (смотри свойство № 2 кислотных оксидов)
Сa(OH) 2 + СО 2 = CaCO 3 + Н 2 О
Переходим к превращению № 4
СаСО 3 → СаО
СаСО 3 = ….. СаО + ……
Приходим к выводу
что здесь образуется еще СО 2
, т.к. СаСО 3
нерастворимая соль и именно при
разложении таких веществ образуются
оксиды.
СаСО 3 = СаО + СО 2
3). С какими из перечисленных веществ взаимодействует СО 2 . Напишите уравнения реакций.
А). Соляная кислота Б). Гидроксид натрия В). Оксид калия г). Вода
Д). Водород Е). Оксид серы (IV).
Определяем, что СО 2 – это кислотный оксид. А кислотные оксиды вступают в реакции с водой, щелочами и основными оксидами … Следовательно из приведенного списка выбираем ответы Б, В, Г И именно с ними записываем уравнения реакций:
1). СО 2 + 2NaOH = Na 2 CO 3 + H 2 O
2). CO 2 + K 2 O = K 2 CO 3
Свойства оксидов
Оксиды — это сложные химические вещества, представляющие собой химические соединения простых элементов с кислородом. Они бывают солеобразующими и не образующие соли .
При этом солеобразующие бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными .
Примером окислов, не образующих соли, могут быть: NO (окись азота) — представляет собой бесцветный газ, без запаха. Он образуется во время грозы в атмосфере. CO (окись углерода) — газ без запаха, образуется при сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Он образуется во время грозы в атмосфере. CO (окись углерода) — газ без запаха, образуется при сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Основные оксиды
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:
K 2 O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
Рассмотрим химические свойства оксидов на примерах
1. Взаимодействие с водой:
— взаимодействие с водой с образованием основания (или щёлочи)
CaO+H 2 O→ Ca(OH) 2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
— взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H 2 SO 4 → CaSO 4 + H 2 O (Кристаллы этого вещества CaSO 4 известны всем под названием «гипс»).
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO 2 → CaCO 3 (Это вещество известно всем — обычный мел!)
Кислотные оксиды
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO 2 (всем известный углекислый газ), P 2 O 5 — оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO 3 — триокись серы — это вещество используют для получения серной кислоты .
Химическая реакция с водой
CO 2 +H 2 O→ H 2 CO 3 — это вещество — угольная кислота — одна из слабых кислот, её добавляют в газированную воду для «пузырьков» газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
Реакция с щелочами (основаниями):
CO 2 +2NaOH→ Na 2 CO 3 +H 2 O- образовавшееся вещество (соль) широко используется в хозяйстве. Её название — кальцинированная сода или стиральная сода, — отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
Её название — кальцинированная сода или стиральная сода, — отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
Реакция с основными оксидами:
CO 2 +MgO→ MgCO 3 — получившая соль — карбонат магния — ещё называется «горькая соль».
Амфотерные оксиды
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами ) и основаниями (или основными оксидами ). Наиболее частое применение слово «амфотерный» в нашем случае относится к оксидам металлов .
Примером амфотерных оксидов могут быть:
ZnO — окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al 2 O 3 — окись алюминия (называют еще «глинозёмом»).
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
Например:
Реакция с кислотным оксидом:
ZnO+H 2 CO 3 → ZnCO 3 + H 2 O — Образовавшееся вещество — раствор соли «карбоната цинка» в воде.
Реакция с основаниями:
ZnO+2NaOH→ Na 2 ZnO 2 +H 2 O — полученное вещество — двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды . Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, — вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами. Продуктом реакции будет чёрный порошок оксида железа FeO:
2Fe+O 2 → 2FeO
Полностью аналогичны химические реакции с другими металлами и неметаллами. Цинк сгорает в кислороде с образованием окисла цинка
Цинк сгорает в кислороде с образованием окисла цинка
2Zn+O 2 → 2ZnO
Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
2C+O 2 → 2CO — образование угарного газа.
C+O 2 → CO 2 — образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом — путём химической реакции разложения . Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов :
Fe(OH) 2 → FeO+H 2 O
Твёрдый оксид алюминия — минерал корунд
Оксид железа (III). Поверхность планеты Марс имеет красновато-оранжевый цвет из-за наличия в грунте оксида железа (III).
Твёрдый оксид алюминия — корунд
2Al(OH) 3 → Al 2 O 3 +3H 2 O,
а также при разложении отдельных кислот:
H 2 CO 3 → H 2 O+CO 2 — разложение угольной кислоты
H 2 SO 3 → H 2 O+SO 2 — разложение сернистой кислоты
Получение оксидов можно осуществить из солей металлов при сильном нагревании:
CaCO 3 → CaO+CO 2 — прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
2Cu(NO 3) 2 → 2CuO + 4NO 2 + O 2 — в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO 2 (его ещё называют бурым газом из-за его действительно бурого цвета).
Ещё одним способом, которым можно осуществить получение окислов — это окислительно-восстановительные реакции
Cu + 4HNO 3 (конц.)→ Cu(NO 3) 2 + 2NO 2 + 2H 2 O
S + 2H 2 SO 4 (конц.)→ 3SO 2 + 2H 2 O
Оксиды хлора
Молекула ClO 2 Молекула Cl 2 O 7 Закись азота N 2 O Азотистый ангидрид N 2 O 3 Азотный ангидрид N 2 O 5 Бурый газ NO 2Известны следующие оксиды хлора : Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 . Все они, за исключением Cl 2 O 7 , имеют желтую или оранжевую окраску и не устойчивы, особенно ClO 2 , Cl 2 O 6 . Все оксиды хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорсодержащие кислоты :
Так, Cl 2 O — кислотный оксид хлора хлорноватистой кислоты.
Cl 2 O + H 2 O→ 2HClO — Хлорноватистая кислота
ClO 2 — кислотный оксид хлора хлорноватистой и хлорноватой кислоты, так как при химической реакции с водой образует сразу две этих кислоты:
ClO 2 + H 2 O→ HClO 2 + HClO 3
Cl 2 O 6 — тоже кислотный оксид хлора хлорноватой и хлорной кислот:
Cl 2 O 6 + H 2 O→ HClO 3 + HClO 4
И, наконец, Cl 2 O 7 — бесцветная жидкость — кислотный оксид хлора хлорной кислоты:
Cl 2 O 7 + H 2 O→ 2HClO 4
Оксиды азота
Азот — газ, который образует 5 различных соединений с кислородом — 5 оксидов азота . А именно:
N 2 O — гемиоксид азота . Другое его название известно в медицине под названием веселящий газ или закись азота — это бесцветный сладковатый и приятный на вкус на газ.
— NO — моноксид азота — бесцветный, не имеющий ни запаха ни вкуса газ.
— N 2 O 3 — азотистый ангидрид — бесцветное кристаллическое вещество
— NO 2 — диоксид азота . Другое его название — бурый газ — газ действительно имеет буро-коричневый цвет
Другое его название — бурый газ — газ действительно имеет буро-коричневый цвет
— N 2 O 5 — азотный ангидрид — синяя жидкость, кипящая при температуре 3,5 0 C
Из всех этих перечисленных соединений азота наибольший интерес в промышленности представляют NO — моноксид азота и NO 2 — диоксид азота. Моноксид азота (NO) и закись азота N 2 O не реагируют ни с водой, ни с щелочами. (N 2 O 3) при реакции с водой образует слабую и неустойчивую азотистую кислоту HNO 2 , которая на воздухе постепенно переходит в более стойкое химическое вещество азотную кислоту Рассмотрим некоторые химические свойства оксидов азота :
Реакция с водой:
2NO 2 + H 2 O→ HNO 3 + HNO 2 — образуется сразу 2 кислоты: азотная кислота HNO 3 и азотистая кислота.
Реакция с щелочью:
2NO 2 + 2NaOH→ NaNO 3 + NaNO 2 + H 2 O — образуются две соли: нитрат натрия NaNO 3 (или натриевая селитра) и нитрит натрия (соль азотистой кислоты).
Реакция с солями:
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2 — образуются образуются две соли: нитрат натрия и нитрит натрия, и выделяется углекислый газ.
Получают диоксид азота (NO 2) из моноксида азота (NO) с помощью химической реакции соединения c кислородом :
2NO + O 2 → 2NO 2
Оксиды железа
Железо образует два оксида : FeO — оксид железа (2-валентный) — порошок чёрного цвета, который получают восстановлением оксида железа (3-валентного) угарным газом по следующей химической реакции:
Fe 2 O 3 +CO→ 2FeO+CO 2
Этот основной оксид, легко вступающий в реакции с кислотами. Он обладает восстановительными свойствами и быстро окисляется в оксид железа (3-валентный).
4FeO +O 2 → 2Fe 2 O 3
Оксид железа (3-валентный) — красно-бурый порошок (гематит), обладающий амфотерными свойствами (может взаимодействовать и с кислотами и со щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что наиболее часто он его используют, как основной оксид .
Есть ещё так называемы смешанный оксид железа Fe 3 O 4 . Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным железняком или магнетитом). Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Оксид серы
Сернистый газ SO 2Оксид серы SO 2 — или сернистый газ относится к кислотным оксидам , но кислоту не образует, хотя отлично растворяется в воде — 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой).
При нормальных обстоятельствах — это бесцветный газ с резким и удушливым запахом горелой серы. При температуре всего -10 0 C его можно перевести в жидкое состояние.
В присутствии катализатора -оксида ванадия (V 2 O 5) оксид серы присоединяет кислород и превращается в триоксид серы
2SO 2 +O 2 → 2SO 3
Растворённый в воде сернистый газ — оксид серы SO 2 — очень медленно окисляется, в результате чего сам раствор превращается в серную кислоту
Если сернистый газ пропускать через раствор щелочи, например, гидроксида натрия, то образуется сульфит натрия (или гидросульфит — смотря сколько взять щёлочи и сернистого газа)
NaOH + SO 2 → NaHSO 3 — сернистый газ взят в избытке
2NaOH + SO 2 → Na 2 SO 3 + H 2 O
Если сернистый газ не реагирует с водой, то почему его водный раствор даёт кислую реакцию?! Да, не реагирует, но он сам окисляется в воде, присоединяя к себе кислород. И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
Получение оксидов и их свойства
Вещества, составляющие основу нашего физического мира, состоят из разных видов химических элементов. Четыре из них встречаются чаще всех остальных. Это водород, углерод, азот и кислород. Последний элемент может связываться с частицами металлов или неметаллов и образовывать бинарные соединения — окислы. В нашей статье мы изучим наиболее важные способы получения оксидов в лабораторных условиях и промышленности. Также рассмотрим их основные физические и химические свойства.
Агрегатное состояние
Оксиды, или окислы, существуют в трех состояниях: газообразном, жидком и твердом. Например, к первой группе относятся такие известные и широко распространенные в природе соединения, как углекислый газ — CO2, угарный газ — CO, двуокись серы — SO2 и другие. В жидкой фазе существуют такие окислы, как вода – H2O, серный ангидрид – SO3, оксид азота – N2O3. Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как монооксид углерода и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как монооксид углерода и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
Классификация окислов
Можно выделить несколько видов кислородсодержащих веществ, состоящих из двух элементов. Химические свойства и способы получения оксидов будут зависеть от того, к какой из перечисленных групп относится вещество. Например, диоксид углерода, относящийся к кислотным окислам, получают прямым соединением углерода с кислородом, проводя реакцию жесткого окисления. Углекислый газ можно выделить и в процессе обмена солей угольной кислоты и сильных неорганических кислот:
HCl + Na2CO3 = 2NaCl + H2O + CO2
Какая же реакция является визитной карточкой кислотных оксидов? Это их взаимодействие со щелочами:
SO2 + 2NaOH → Na2SO3 + H2O
Амфотерные и несолеобразующие окислы
Безразличные окислы, например CO или N2O, не способны к реакциям, ведущим к появлению солей. С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения — это известные окислы алюминия и цинка.
Получение оксидов серы
В своих соединениях с кислородом сера проявляет различную валентность. Так, в сернистом газе, формула которого SO2, она четырехвалентна. В лаборатории диоксид серы получают в реакции между сульфатной кислотой и гидросульфитом натрия, уравнение которой имеет вид
NaHSO3 + H2SO4 → NaHSO4 + SO2 + H2O
Еще один способ добычи SO2 – это окислительно-восстановительный процесс между медью и сульфатной кислотой высокой концентрации. Третий лабораторный метод получения оксидов серы – сжигание под вытяжкой образца простого вещества серы:
Третий лабораторный метод получения оксидов серы – сжигание под вытяжкой образца простого вещества серы:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
В промышленности диоксид серы можно добыть выжиганием серосодержащих минералов цинка или свинца, а также обжигом пирита FeS2. Полученный таким методом сернистый газ используют для добычи трехокиси серы SO3 и далее – сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H2SO3:
SO2 + H2O = H2SO3
Данная реакция является обратимой. Степень диссоциации кислоты невелика, поэтому соединение относят к слабым электролитам, да и сама сернистая кислота может существовать только в водном растворе. В нем всегда присутствуют молекулы сернистого ангидрида, которые придают веществу резкий запах. Раагирующая смесь находится в состоянии равенства концентрации реагентов и продуктов, которое можно сместить, изменяя условия. Так, при добавлении к раствору щелочи реакция будет проходить слева направо. В случае выведения из сферы реакции сернистого ангидрида нагреванием или продуванием через смесь газообразного азота динамическое равновесие будет смещаться влево.
Раагирующая смесь находится в состоянии равенства концентрации реагентов и продуктов, которое можно сместить, изменяя условия. Так, при добавлении к раствору щелочи реакция будет проходить слева направо. В случае выведения из сферы реакции сернистого ангидрида нагреванием или продуванием через смесь газообразного азота динамическое равновесие будет смещаться влево.
Серный ангидрид
Продолжим рассматривать свойства и способы получения оксидов серы. Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H2SO4 добывают, растворяя серный ангидрид в концентрированной сульфатной кислоте. В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Основные окислы
Изучив свойства и получение оксидов серы, относящихся к группе кислотных бинарных соединений с кислородом, рассмотрим кислородные соединения металлических элементов.
Основные окислы можно определить по такому признаку, как наличие в составе молекул частиц металлов главных подгрупп первой или второй групп периодической системы. Они относятся к щелочным или щелочноземельным. Например, окись натрия — Na2O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды – щелочи. Однако главное химическое свойство основных оксидов – это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
CuO + 2HCl = CuCl2 + H2O
Нагревание твердых нерастворимых гидроксидов — еще один важных способов получения основных оксидов:
Ca(OH)2 → CaO + H2O
Условия: 520-580 °C.
В нашей статье мы рассмотрели наиболее важные свойства бинарных соединений с кислородом, а также способы получения оксидов в лаборатории и промышленности.
Контрольная работа по химии «Класс неорганических соединений: оксиды»
План контрольной работы по теме: «Класс неорганических соединений: ОКСИДЫ»
№ задания |
Элемент содержания |
Количество баллов |
А 1 |
Химические свойства основных оксидов. |
1 балл |
А 2 |
Классификация оксидов. |
1 балл |
А 3 |
Характерные химические свойства кислотных оксидов. |
1 балл |
А 4 |
Физические свойства оксидов. |
1 балл |
А 5 |
Названия оксидов. |
1 балл |
А 6 |
Способы получения оксидов. |
1 балл |
А 7 |
Характерные химические свойства амфотерных оксидов. |
1 балл |
В 1 |
Соответствие классификации предложенных оксидов. |
2 балла |
В 2 |
Химические свойства класса оксидов. |
2 балла |
С 1 |
Расчетная задача на нахождение количества вещества и массы вещества. |
3 балла |
Инструкция для учащихся по выполнению контрольной работы
На выполнение контрольной работы по химии отводится 40 минут. Работа состоит из 3 частей и включает 10 заданий. Часть1 включает 7 заданий (А1-А7) базового уровня. Каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый верный ответ дается 1 балл. Внимательно прочитай каждое задание и проанализируй все варианты предложенных ответов.
Каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый верный ответ дается 1 балл. Внимательно прочитай каждое задание и проанализируй все варианты предложенных ответов.
Часть 2 — повышенного уровня, состоит из двух заданий (В1-В2), на которые надо дать краткий ответ в виде последовательности цифр. За каждый верный ответ задания, в части 2 дается 2 балла.
Часть 3 (С1) содержит одно задание высокого уровня. Это задача. Задание (С1) требует развернутого ответа. Полностью выполненное задание оценивается в 3 балла.
Постарайся выполнять задания в том порядке, в котором они даны. Для экономии времени пропускай задание, которое не удается выполнить сразу, и переходи к следующему. К пропущенному заданию ты сможешь вернуться после выполнения всей работы, если останется время.
При выполнении работы ты можешь пользоваться периодической системой химических элементов Д. И. Менделеева и непрограммируемым калькулятором.
И. Менделеева и непрограммируемым калькулятором.
Баллы, полученные тобой за выполненные задания, суммируются. Постарайся выполнить как можно больше заданий и набрать наибольшее количество баллов.
Баллы |
Оценка |
0-6 баллов |
2 |
7-9 баллов |
3 |
10-12 баллов |
4 |
13-14 баллов |
5 |
Инструкция по проверке и оценке контрольной работы учащихся по химии
Часть 1
Задание с выбором ответа считается выполненным верно, если учащийся указал цифру правильного ответа. Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует), задание считается невыполненным.
Во всех остальных случаях (выбран другой ответ; выбрано два или больше ответов, среди которых может быть и правильный; ответ на вопрос отсутствует), задание считается невыполненным.
№ задания |
Ответ |
А 1 |
4 |
А 2 |
3 |
А 3 |
1 |
А 4 |
2 |
А 5 |
3 |
А 6 |
1 |
А 7 |
2 |
Часть 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (числа).
За полный правильный ответ в заданиях В1-В2 ставится 2 балла, одна ошибка – 1 балл, за неверный ответ или его отсутствие – 0 баллов.
№ задания |
Ответ |
В 1 |
1, 2, 6, 3 |
В 2 |
3, 2, 1 |
Часть 3
Критерии проверки и оценки выполнения заданий с развернутым ответом.
За выполнение задания С1 ставится от 0 до 3 баллов.
С1. Оксид ванадия (V) получают сжиганием порошка металла в кислороде.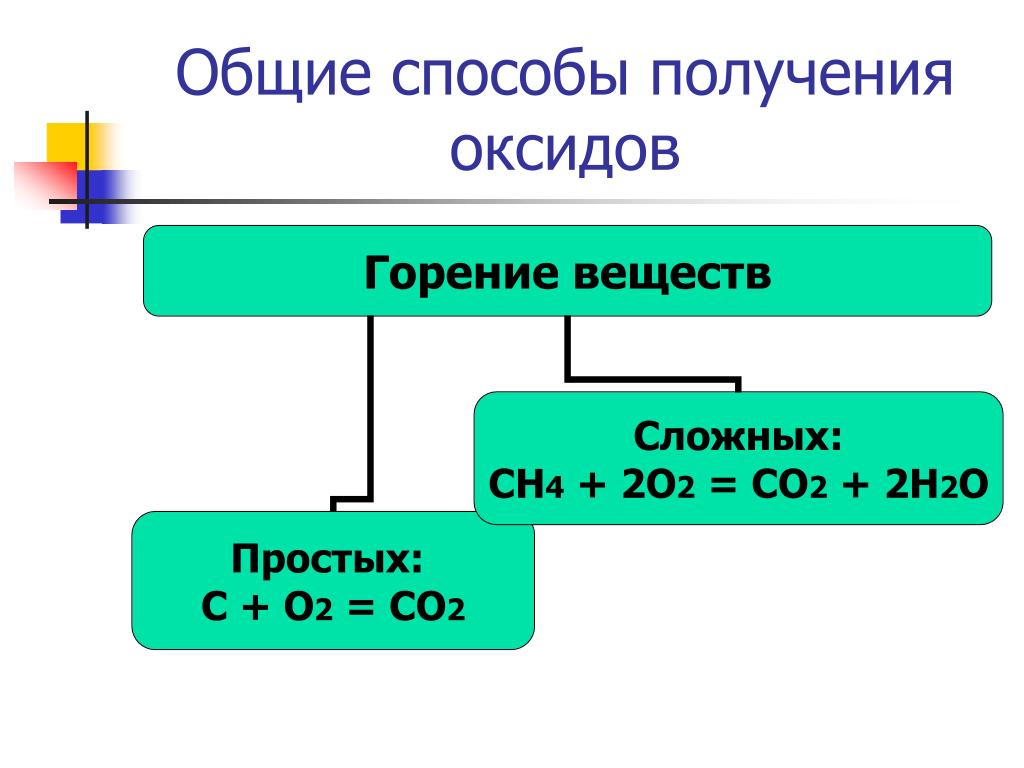 Рассчитай массу ванадия, необходимую для получения оксида массой 50 г.
Рассчитай массу ванадия, необходимую для получения оксида массой 50 г.
ЗАДАНИЕ
ЧАСТЬ 1
При выполнении заданий этой части в тетради рядом с номером выполняемого тобой задания (А1 – А7) поставь через две клетки цифру выбранного верного ответа.
А1. С какими из перечисленных веществ будет реагировать оксид натрия?
1) NO
2) NaCl
3) H2
4) H2O
A2. В перечне веществ:
1) Na2O, N2O5, CaO
2) N2O5, SO2, SiO2
3) CaO, SiO2, SO3
4) CuO, CO2, MgO
к кислотным оксидам относят:
1) 1
2) 3
3) 2
4) 4
А3. С какими из перечисленных веществ будет взаимодействовать оксид азота (V).
1) KOH;
2) HCl;
3) NaCl;
4) O2
А4. Какие химические свойства характерны для оксида кальция?
Выбери правильный ответ.
1) газ при обычных условиях;
2) вещество твердое, белого цвета;
3) твердое вещество черного цвета;
4) бесцветная летучая жидкость.
А5. Как называется вещество SO3?
1) оксид серы;
2) оксид серы (II)
3) оксид серы (VI)
4) оксид серы (IV).
А6. Оксиды образуются:
1) при горении простых и сложных веществ;
2) при разложении растворимых оснований;
3) только при горении сложных веществ;
4) при разложении кремниевой кислоты.
А7. С какими из перечисленных веществ будет вступать в реакцию оксид цинка?
1) H2O
2) HCl
3) O2
4) Al2O3
ЧАСТЬ 2
Ответом к заданиям этой части (В1 – В2) являются цифры, которые следует записать в тетрадь в виде таблицы ниже номера соответствующего задания.
В1. Установи соответствие между формулой и названием соответствующего оксида:
Формула |
Название оксида |
А) CuO |
1) оксид меди (II) |
В2. Установи соответствие между формулой оксида и реагентами с каждым, из которых он может взаимодействовать.
Формула |
Реагенты |
А) Na2O |
1) HCl, Na(OH), K2CO3 |
ЧАСТЬ 3
Для записи ответа к заданию этой части (С1) ниже запиши сначала номер задания (С1), а затем полное решение. Ответы записывай четко и разборчиво.
Ответы записывай четко и разборчиво.С1. Оксид ванадия (V) получают сжиганием порошка металла в кислороде. Рассчитай массу ванадия, необходимую для получения оксида массой 50 г.
Оксиды, свойства и способы получения
1. Оксиды, свойства и способы получения
2. Физические свойства оксидов
По агрегатному состоянию:• Твердые
• Жидкие
• Газообразные
3. По растворимости в воде оксиды делятся:
• Растворимые• Нерастворимые
• Все кислотные оксиды, кроме оксида
кремния (II) – растворимы в воде
• Оксиды щелочных и щелочно-земельных
металлов – растворимы в воде
• Амфотерные оксиды – не растворимы в воде
4. Химические свойства основных оксидов
• Взаимодействуют с кислотами с образованием соли иводы
• Взаимодействуют с кислотными оксидами
• Оксиды щелочных и щелочно-земельных металлов
взаимодействуют с водой с образованием щелочей
5. Химические свойства кислотных оксидов
• Взаимодействуют с основаниями с образованием соли и воды• Взаимодействуют с основными оксидами
• Взаимодействуют с водой с образованием кислот
6.
 Химические свойства амфотерных оксидов • Взаимодействуют с кислотами с образованием соли и воды
Химические свойства амфотерных оксидов • Взаимодействуют с кислотами с образованием соли и воды• Взаимодействуют с щелочами с образованием соли и воды
• Взаимодействуют с кислотными оксидами с образованием солей
при нагревании
• Взаимодействуют с основными оксидами с образованием солей при
нагревании
7. Получение оксидов
• Взаимодействие простых веществ с кислородом• Разложение оксокислот
• Разложение нерастворимых оснований
• Разложение солей
8. Основания, свойства и способы получения
9. Физические свойства оснований
• Все неорганические основаниянерастворимы в воде, кроме гидроксида
аммония
10. Химические свойства оснований
• Взаимодействуют с кислотами с образованием солей и воды(реакции нейтрализации)
• Взаимодействуют с кислотными оксидами с образованием
солей и воды
• Щелочи взаимодействуют с солями, если образуется
нерастворимое основание или нерастворимая соль
11.
 Химические свойства оснований • Нерастворимые основания при нагревании образуют основный
Химические свойства оснований • Нерастворимые основания при нагревании образуют основныйоксид и воду
• Щелочи при взаимодействии с металлами образуют
амфотерные оксиды или гидроксиды
12. Получение оснований
Получение растворимых оснований• Взаимодействие щелочных и щелочно-земельных металлов с
водой
• Взаимодействие оксидов щелочных и щелочно-земельных
металлов с водой
Получение нерастворимых оснований
• Взаимодействие щелочи с растворимой солью
1.
2.
3.
С какими из следующих соединений будет
взаимодействовать оксид углерода (IV)?
MgO,
NaCl,
AgNO3,
NaOH,
ZnO
С какими из следующих соединений будет
взаимодействовать гидроксид калия?
NaCl,
h3SO4
Zn
ZnO
Kh3PO4
SO2
4.
С какими из следующих соединений будет
взаимодействовать оксид цинка?
CaCO3
BaSO4
SO3
P2O5
CaO
Ba(OH)2
BaSO4
С какими из следующих соединений будет
взаимодействовать оксид бария?
Al
Al2O3
S
SO2
h3SO4
Na2SO4
5.

С какими из следующих соединений будет
взаимодействовать N2O5?
KOH
Al
Al2O3
Al(OH)3
h3O
6.
С какими из следующих соединений будет
взаимодействовать NaOH?
HNO3
CaO
CO2
CuSO4
Cu(OH)2
P2O5
Оксиды, их химические свойства
Химические свойства
Способы получения
900igr.net
Классификация оксидов по химическим свойствам
ОКСИДЫ
Солеобразующие
Несолеобразующие
Безразличные
СО, NO, N 2 O, SiO
Основные
Кислотные
ВаО, СаО
SO 3 , N 2 O 5
Амфотерные
ZnO, Al 2 O 3
химические свойства
Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей
СО, NO, N 2 O, SiO
Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды
Основные оксиды – это оксиды, которым в качестве гидроксидов соответствуют основания
- Образованы металлами в степени окисления +1, +2
К 2 О → КОН
MgO → Mg(OH) 2
Кислотные оксиды – это оксиды, которым в качестве гидроксидов соответствуют кислоты
- Образованы неметаллами и металлами в степени окисления +5 и выше
S О 3 → Н 2 S О 4
Амфотерные оксиды – это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот
- Образованы металлами в степени окисления +3, +4, а также оксиды ВеО, ZnO, SnO, PbO
ZnO → Zn(OH) 2 или Н 2 Zn О 2
Химические свойства основных оксидов
- основной оксид + вода = основание
Са O + H 2 O = Са( O Н) 2
- основный оксид + кислота = соль + вода
CuO + 2 HCL = CuCL 2 + H 2 O
- основный оксид + кислотный оксид = соль
MgO + SO 3 = MgSO 4
Химические свойства кислотных оксидов
- кислотный оксид + вода = кислота
Р 2 O 5 + 3 H 2 O = 2 H 3 Р O 4
- кислотный оксид + основание = соль + вода
CO 2 + Mg ( O Н) 2 = MgCO 3 + H 2 O
- кислотный оксид + основный оксид = соль
SO 3 + MgO = MgSO 4
Химические свойства амфотерных оксидов
Основные
- С кислотами: ZnO + 2НС l → Zn С l 2 + Н 2 О
- С кислотными оксидами: ZnO + SiO 2 = ZnSiO 3
Кислотные
- С основаниями: ZnO + 2 Na ОН = Na 2 ZnO 2 +Н 2 О
- С основными оксидами: ZnO + Mg О = MgZnO 2
Способы получения оксидов
- Горение сложных веществ: СН 4 + 2О 2 = СО 2 + 2Н 2 О
- Горение простых веществ:
2 Mg + О 2 = 2 Mg О
- Разложение сложных веществ:
1. Нерастворимых оснований
Нерастворимых оснований
Cu ( O Н) 2 = Cu О + H 2 O
2. Некоторых кислот
H 2 SiO 3 = SiO 2 + H 2 O
3. Некоторых солей
СаСО 3 = СО 2 + Н 2 О
18.9 Возникновение, получение и соединения кислорода – химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Описать свойства, получение и соединения кислорода
- Описать получение, свойства и использование некоторых типичных оксидов, пероксидов и гидроксидов металлов
Кислород — самый распространенный элемент в земной коре. Земная поверхность состоит из земной коры, атмосферы и гидросферы.Около 50% массы земной коры состоит из кислорода (в сочетании с другими элементами, главным образом кремнием). Кислород встречается в воздухе в виде молекул O 2 и, в ограниченной степени, в виде молекул O 3 (озона). Он составляет около 20% массы воздуха. Около 89% воды по массе состоит из связанного кислорода. В сочетании с углеродом, водородом и азотом кислород составляет большую часть растений и животных.
Земная поверхность состоит из земной коры, атмосферы и гидросферы.Около 50% массы земной коры состоит из кислорода (в сочетании с другими элементами, главным образом кремнием). Кислород встречается в воздухе в виде молекул O 2 и, в ограниченной степени, в виде молекул O 3 (озона). Он составляет около 20% массы воздуха. Около 89% воды по массе состоит из связанного кислорода. В сочетании с углеродом, водородом и азотом кислород составляет большую часть растений и животных.
Кислород — бесцветный газ без запаха и вкуса при обычных температурах.Он немного плотнее воздуха. Хотя он мало растворим в воде (49 мл газа растворяется в 1 л при нормальных условиях), растворимость кислорода очень важна для водной жизни.
Большая часть кислорода, выделяемого в промышленных масштабах, поступает из воздуха, а оставшаяся часть — в результате электролиза воды. Отделение кислорода от воздуха начинается с охлаждения и сжатия воздуха до тех пор, пока он не станет жидким. При нагревании жидкого воздуха кислород с его более высокой температурой кипения (90 К) отделяется от азота с более низкой температурой кипения (77 К).В то же время можно разделить другие компоненты воздуха на основе различий в их температурах кипения.
При нагревании жидкого воздуха кислород с его более высокой температурой кипения (90 К) отделяется от азота с более низкой температурой кипения (77 К).В то же время можно разделить другие компоненты воздуха на основе различий в их температурах кипения.
Кислород необходим в процессах горения, таких как сжигание топлива. Растения и животные используют для дыхания кислород из воздуха. Введение воздуха, обогащенного кислородом, является важной медицинской практикой, когда пациент получает недостаточно кислорода из-за шока, пневмонии или какого-либо другого заболевания.
Химическая промышленность использует кислород для окисления многих веществ.Значительное количество кислорода, производимого в промышленных масштабах, важно для удаления углерода из железа при производстве стали. Большие количества чистого кислорода также необходимы при производстве металлов, а также при резке и сварке металлов с помощью кислородно-водородных и кислородно-ацетиленовых горелок.
Жидкий кислород важен для космической отрасли. Это окислитель в ракетных двигателях. Это также источник газообразного кислорода для жизнеобеспечения в космосе.
Это окислитель в ракетных двигателях. Это также источник газообразного кислорода для жизнеобеспечения в космосе.
Как мы знаем, кислород очень важен для жизни.Энергия, необходимая для поддержания нормальных функций организма человека и других организмов, поступает от медленного окисления химических соединений. Кислород является конечным окислителем в этих реакциях. У человека кислород переходит из легких в кровь, где соединяется с гемоглобином, образуя оксигемоглобин. В этой форме кровь переносит кислород к тканям, где он передается тканям. Конечными продуктами являются углекислый газ и вода. Кровь переносит углекислый газ по венам в легкие, где кровь высвобождает углекислый газ и собирает еще один запас кислорода.Переваривание и усвоение пищи регенерируют материалы, израсходованные путем окисления в организме; высвобождаемая энергия такая же, как если бы пища сгорала вне тела.
Зеленые растения постоянно пополняют кислород в атмосфере с помощью процесса, называемого фотосинтезом. Продукты фотосинтеза могут различаться, но в целом процесс превращает углекислый газ и воду в глюкозу (сахар) и кислород с использованием энергии света:
Продукты фотосинтеза могут различаться, но в целом процесс превращает углекислый газ и воду в глюкозу (сахар) и кислород с использованием энергии света:
Таким образом, кислород, превратившийся в углекислый газ и воду в результате обменных процессов в растениях и животных, возвращается в атмосферу путем фотосинтеза.
При пропускании сухого кислорода между двумя электрически заряженными пластинами образуется озон (O 3 , показанный на рис. 18.42), аллотроп кислорода, обладающий характерным запахом. Образование озона из кислорода является эндотермической реакцией, в которой энергия исходит от электрического разряда, тепла или ультрафиолетового света:
3O2(г)→электрический разряд2O3(г)ΔH°=287 кДж3O2(г)→электрический разряд2O3(г)ΔH°=287 кДж Резкий запах, связанный с искрением электрического оборудования, частично связан с озоном.
Фигура 18.42 На изображении показана изогнутая молекула озона (O 3 ) и резонансные структуры, необходимые для описания ее связи.
Озон естественным образом образуется в верхних слоях атмосферы под действием солнечного ультрафиолетового света на содержащийся там кислород. Большая часть атмосферного озона находится в стратосфере, слое атмосферы, простирающемся от 10 до 50 километров над поверхностью земли. Этот озон действует как барьер для вредного ультрафиолетового излучения солнца, поглощая его посредством химической реакции разложения:
O3(г)→ультрафиолетовый светO(г)+O2(г)O3(г)→ультрафиолетовый светO(г)+O2(г) Активные атомы кислорода рекомбинируют с молекулярным кислородом, завершая цикл озона.Присутствие стратосферного озона снижает частоту рака кожи и других повреждающих эффектов ультрафиолетового излучения. Было ясно продемонстрировано, что хлорфторуглероды, фреоны (известные коммерчески как фреоны), которые присутствовали в качестве аэрозольных пропеллентов в аэрозольных баллончиках и в качестве хладагентов, вызывали истощение озона в стратосфере. Это произошло потому, что ультрафиолетовое излучение также вызывает разложение ХФУ с образованием атомарного хлора. Атомы хлора реагируют с молекулами озона, что приводит к удалению из стратосферы молекул O 3 .Этот процесс подробно исследуется в нашем обзоре химической кинетики. Во всем мире предпринимаются усилия по сокращению количества ХФУ, используемых в коммерческих целях, и озоновая дыра уже начинает уменьшаться в размерах по мере уменьшения концентрации атомарного хлора в атмосфере. В то время как озон в стратосфере помогает защитить нас, озон в тропосфере представляет собой проблему. Этот озон является токсичным компонентом фотохимического смога.
Это произошло потому, что ультрафиолетовое излучение также вызывает разложение ХФУ с образованием атомарного хлора. Атомы хлора реагируют с молекулами озона, что приводит к удалению из стратосферы молекул O 3 .Этот процесс подробно исследуется в нашем обзоре химической кинетики. Во всем мире предпринимаются усилия по сокращению количества ХФУ, используемых в коммерческих целях, и озоновая дыра уже начинает уменьшаться в размерах по мере уменьшения концентрации атомарного хлора в атмосфере. В то время как озон в стратосфере помогает защитить нас, озон в тропосфере представляет собой проблему. Этот озон является токсичным компонентом фотохимического смога.
Применение озона зависит от его реакционной способности по отношению к другим веществам. Его можно использовать в качестве отбеливателя для масел, воска, тканей и крахмала: он окисляет окрашенные соединения в этих веществах до бесцветных соединений.Это альтернатива хлору в качестве дезинфицирующего средства для воды.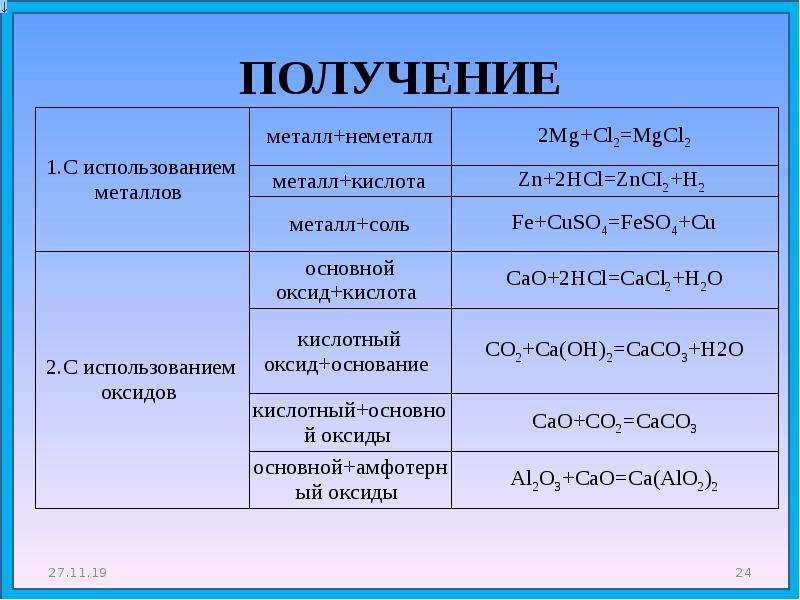
Реакции
Элементарный кислород является сильным окислителем. Он реагирует с большинством других элементов и многими соединениями.
Реакция с элементами
Кислород непосредственно реагирует при комнатной температуре или при повышенных температурах со всеми другими элементами, за исключением инертных газов, галогенов и нескольких переходных металлов второго и третьего ряда с низкой реакционной способностью (с более высоким восстановительным потенциалом, чем у меди).Ржавчина является примером реакции кислорода с железом. Более активные металлы образуют пероксиды или супероксиды. Менее активные металлы и неметаллы дают оксиды. Два примера таких реакций:
2Mg(т)+O2(г)⟶2MgO(т)2Mg(т)+O2(г)⟶2MgO(т) P4(т)+5O2(г)⟶P4O10(т)P4(т)+5O2(г)⟶P4O10(т) Оксиды галогенов, по крайней мере одного из благородных газов и металлов с более высоким восстановительным потенциалом, чем медь, не образуются при прямом действии элементов с кислородом.
Реакция с соединениями
Элементарный кислород также реагирует с некоторыми соединениями.Если возможно окислить какой-либо из элементов в данном соединении, возможно дальнейшее окисление кислородом. Например, сероводород H 2 S содержит серу со степенью окисления 2-. Поскольку сера не проявляет максимальную степень окисления, можно ожидать, что H 2 S будет реагировать с кислородом. Это происходит, давая воду и диоксид серы. Реакция:
2h3S(г)+3O2(г)⟶2h3O(ж)+2SO2(г)2h3S(г)+3O2(г)⟶2h3O(ж)+2SO2(г)Также можно окислять оксиды, такие как CO и P 4 O 6 , которые содержат элемент с более низкой степенью окисления.Легкость, с которой элементарный кислород захватывает электроны, отражается в трудности удаления электронов из кислорода в большинстве оксидов. Из элементов только очень реакционноспособный фтор может окислять оксиды с образованием газообразного кислорода.
Оксиды, пероксиды и гидроксиды
Соединения репрезентативных металлов с кислородом делятся на три категории: (1) оксиды, содержащие оксид-ионы, O 2− ; (2) пероксиды, содержащие пероксид-ионы, O22-, O22-, с ковалентными одинарными связями кислород-кислород и очень ограниченное количество супероксидов, содержащие супероксид-ионы, O2-, O2-, с ковалентными связями кислород-кислород, которые имеют связь порядок 112,112. Кроме того, имеются (3) гидроксиды, содержащие гидроксид-ионы, ОН — .Все типичные металлы образуют оксиды. Некоторые металлы группы 2 образуют также пероксиды МО 2 , а металлы группы 1 также образуют пероксиды М 2 О 2 и супероксиды МО 2 .
Кроме того, имеются (3) гидроксиды, содержащие гидроксид-ионы, ОН — .Все типичные металлы образуют оксиды. Некоторые металлы группы 2 образуют также пероксиды МО 2 , а металлы группы 1 также образуют пероксиды М 2 О 2 и супероксиды МО 2 .
Оксиды
Можно получить оксиды большинства типичных металлов путем нагревания соответствующих гидроксидов (с образованием оксида и газообразной воды) или карбонатов (с образованием оксида и газообразного CO 2 ). Уравнения для примера реакции:
2Al(OH)3(т)→ΔAl2O3(т)+3h3O(г)2Al(OH)3(т)→ΔAl2O3(т)+3h3O(г) CaCO3(т)→ΔCaO(т)+CO2(г)CaCO3(т)→ΔCaO(т)+CO2(г)Однако соли щелочных металлов обычно очень стабильны и плохо разлагаются при нагревании.Оксиды щелочных металлов образуются в результате окислительно-восстановительных реакций, возникающих при нагревании нитратов или гидроксидов с металлами. Уравнения для образцов реакций:
2KNO3(т)+10K(т)→Δ6K2O(т)+N2(г)2KNO3(т)+10K(т)→Δ6K2O(т)+N2(г) 2LiOH(т)+2Li(т)→Δ2Li2O(т)+h3(г)2LiOH(т)+2Li(т)→Δ2Li2O(т)+h3(г) За исключением оксида ртути(II), можно получить оксиды металлов групп 2–15 путем сжигания соответствующего металла на воздухе. Самый тяжелый член каждой группы, член, для которого эффект инертной пары наиболее выражен, образует оксид, в котором степень окисления иона металла на два меньше, чем степень окисления группы (эффект инертной пары).Так, при сжигании таллия, свинца и висмута образуются Tl 2 O, PbO и Bi 2 O 3 . Оксиды более легких членов каждой группы проявляют степень окисления группы. Например, при сжигании олова образуется SnO 2 . Оксид ртути (II), HgO, медленно образуется при нагревании ртути ниже 500 ° C; он разлагается при более высоких температурах.
Самый тяжелый член каждой группы, член, для которого эффект инертной пары наиболее выражен, образует оксид, в котором степень окисления иона металла на два меньше, чем степень окисления группы (эффект инертной пары).Так, при сжигании таллия, свинца и висмута образуются Tl 2 O, PbO и Bi 2 O 3 . Оксиды более легких членов каждой группы проявляют степень окисления группы. Например, при сжигании олова образуется SnO 2 . Оксид ртути (II), HgO, медленно образуется при нагревании ртути ниже 500 ° C; он разлагается при более высоких температурах.
Сжигание элементов групп 1 и 2 на воздухе не является подходящим способом образования оксидов этих элементов. Эти металлы достаточно реакционноспособны, чтобы соединиться с азотом в воздухе, поэтому они образуют смеси оксидов и ионных нитридов.Некоторые также образуют пероксиды или супероксиды при нагревании на воздухе.
Все ионные оксиды содержат ион оксида, очень мощный акцептор ионов водорода. За исключением очень нерастворимого оксида алюминия Al 2 O 3 , олова (IV), SnO 2 и свинца (IV), PbO 2 , оксиды репрезентативных металлов реагируют с кислотами до образуют соли. Вот некоторые уравнения для этих реакций:
За исключением очень нерастворимого оксида алюминия Al 2 O 3 , олова (IV), SnO 2 и свинца (IV), PbO 2 , оксиды репрезентативных металлов реагируют с кислотами до образуют соли. Вот некоторые уравнения для этих реакций:
Оксиды металлов 1 и 2 групп и оксид таллия(I) реагируют с водой с образованием гидроксидов.Примеры таких реакций:
Na2O(т)+h3O(ж)⟶NaOH(водн.) Na2O(т)+h3O(ж)⟶NaOH(водн.) CaO(т)+h3O(ж)⟶Ca(OH)2(водн.)CaO(т)+h3O(ж)⟶Ca(OH)2(водн.) Tl2O(т)+h3O(водн.)⟶2TlOH(водн.)Tl2O(тв.)+h3O(водн.)⟶2TlOH(водн.) Оксиды щелочных металлов имеют небольшое промышленное применение, в отличие от оксида магния, оксида кальция и оксида алюминия. Оксид магния играет важную роль в производстве огнеупорного кирпича, тиглей, футеровки печей и теплоизоляции — приложений, требующих химической и термической стабильности. Оксид кальция, иногда называемый негашеной известью или известью на промышленном рынке, очень реакционноспособен, и его основные области применения отражают его реакционную способность.Чистый оксид кальция излучает интенсивный белый свет при нагревании до высокой температуры (как показано на рис. 18.43). Блоки оксида кальция, нагретые газовым пламенем, использовались для освещения сцены в театрах до того, как стало доступно электричество. Это источник фразы «в центре внимания».
Оксид кальция, иногда называемый негашеной известью или известью на промышленном рынке, очень реакционноспособен, и его основные области применения отражают его реакционную способность.Чистый оксид кальция излучает интенсивный белый свет при нагревании до высокой температуры (как показано на рис. 18.43). Блоки оксида кальция, нагретые газовым пламенем, использовались для освещения сцены в театрах до того, как стало доступно электричество. Это источник фразы «в центре внимания».
Фигура 18.43 Оксид кальция имеет множество промышленных применений. При нагревании до высоких температур он излучает интенсивный белый свет.
Оксид кальция и гидроксид кальция являются недорогими основаниями, широко используемыми в химической обработке, хотя большинство полезных продуктов, получаемых из них, не содержат кальция.Оксид кальция, CaO, производится путем нагревания карбоната кальция, CaCO 3 , который широко и недорого доступен в виде известняка или устричных раковин:
. CaCO3(т)⟶CaO(т)+CO2(г)CaCO3(т)⟶CaO(т)+CO2(г)
CaCO3(т)⟶CaO(т)+CO2(г)CaCO3(т)⟶CaO(т)+CO2(г)Хотя эта реакция разложения является обратимой, можно получить 100%-ный выход CaO, позволив CO 2 выйти. Можно получить гидроксид кальция по известной кислотно-щелочной реакции растворимого оксида металла с водой:
CaO(т)+h3O(ж)⟶Ca(OH)2(т)CaO(т)+h3O(ж)⟶Ca(OH)2(т)Как CaO, так и Ca(OH) 2 можно использовать в качестве оснований; они принимают протоны и нейтрализуют кислоты.
Глинозем (Al 2 O 3 ) встречается в природе в виде минерального корунда, очень твердого вещества, используемого в качестве абразива для шлифовки и полировки. Корунд так же важен для ювелирной торговли, как рубин и сапфир. Цвет рубина обусловлен наличием небольшого количества хрома; другие примеси дают большое разнообразие цветов, возможных для сапфиров. Искусственные рубины и сапфиры теперь производятся путем плавления оксида алюминия (температура плавления = 2050 ° C) с небольшим количеством оксидов для получения желаемых цветов и охлаждения расплава таким образом, чтобы получить большие кристаллы. Рубиновые лазеры используют синтетические кристаллы рубина.
Рубиновые лазеры используют синтетические кристаллы рубина.
Оксид цинка, ZnO, был полезным пигментом белой краски; однако загрязняющие вещества имеют тенденцию обесцвечивать соединение. Соединение также важно при производстве автомобильных шин и других резинотехнических изделий, а также при приготовлении лечебных мазей. Например, солнцезащитные средства на основе оксида цинка, как показано на рис. 18.44, помогают предотвратить солнечные ожоги. Оксид цинка в этих солнцезащитных средствах присутствует в виде очень маленьких зерен, известных как наночастицы. Двуокись свинца входит в состав заряженных свинцовых аккумуляторных батарей.Свинец (IV) имеет тенденцию превращаться в более стабильный ион свинца (II), приобретая два электрона, поэтому диоксид свинца является сильным окислителем.
Фигура 18.44 Оксид цинка защищает открытые участки кожи от солнечных ожогов. (кредит: модификация работы «ossous»/Flickr)
Пероксиды и супероксиды
Пероксиды и супероксиды являются сильными окислителями и играют важную роль в химических процессах. Перекись водорода H 2 O 2 , получаемая из пероксидов металлов, является важным отбеливающим и дезинфицирующим средством.Пероксиды и супероксиды образуются, когда металл или оксиды металлов групп 1 и 2 реагируют с чистым кислородом при повышенных температурах. Пероксид натрия и пероксиды кальция, стронция и бария образуются при нагревании соответствующего металла или оксида металла в чистом кислороде:
Перекись водорода H 2 O 2 , получаемая из пероксидов металлов, является важным отбеливающим и дезинфицирующим средством.Пероксиды и супероксиды образуются, когда металл или оксиды металлов групп 1 и 2 реагируют с чистым кислородом при повышенных температурах. Пероксид натрия и пероксиды кальция, стронция и бария образуются при нагревании соответствующего металла или оксида металла в чистом кислороде:
Пероксиды калия, рубидия и цезия могут быть получены путем нагревания металла или его оксида в тщательно контролируемом количестве кислорода:
2K(т)+O2(г)⟶K2O2(т)(2моль K на мольO2)2K(т)+O2(г)⟶K2O2(т)(2моль K на мольO2)При избытке кислорода образуются супероксиды KO 2 , RbO 2 , CsO 2 .Например:
K(s)+O2(g)⟶KO2(s)(1 моль K на моль O2)K(s)+O2(g)⟶KO2(s)(1моль K на моль O2) Стабильность пероксидов и супероксидов щелочных металлов увеличивается по мере увеличения размера катиона.
Гидроксиды
Гидроксиды — это соединения, содержащие ион ОН — . Эти соединения можно получить двумя основными типами реакций. Растворимые гидроксиды металлов могут быть получены реакцией металла или оксида металла с водой. Нерастворимые гидроксиды металлов образуются, когда раствор растворимой соли металла соединяется с раствором, содержащим ионы гидроксида.
За исключением бериллия и магния, металлы групп 1 и 2 реагируют с водой с образованием гидроксидов и газообразного водорода. Примеры таких реакций включают:
2Li(т)+2h3O(ж)⟶2LiOH(водн.)+h3(г)2Li(т)+2h3O(ж)⟶2LiOH(водн.)+h3(г) Ca(т)+2h3O(ж)⟶Ca(OH)2(водн.)+h3(г)Ca(т)+2h3O(ж)⟶Ca(OH)2(водн.)+h3(г)Однако эти реакции могут быть бурными и опасными; поэтому предпочтительно получать растворимые гидроксиды металлов реакцией соответствующего оксида с водой:
Li2O(т)+h3O(ж)⟶2LiOH(водн.)Li2O(т)+h3O(ж)⟶2LiOH(водн.) CaO(т)+h3O(ж)⟶Ca(OH)2(водн.)CaO(т)+h3O(ж)⟶Ca(OH)2(водн.) Большинство оксидов металлов являются основными ангидридами. Это очевидно для растворимых оксидов, поскольку они образуют гидроксиды металлов. Большинство других оксидов металлов нерастворимы и не образуют гидроксидов в воде; однако они все еще являются ангидридами оснований, потому что они будут реагировать с кислотами.
Это очевидно для растворимых оксидов, поскольку они образуют гидроксиды металлов. Большинство других оксидов металлов нерастворимы и не образуют гидроксидов в воде; однако они все еще являются ангидридами оснований, потому что они будут реагировать с кислотами.
Нерастворимые гидроксиды бериллия, магния и других характерных металлов можно получить добавлением гидроксида натрия к раствору соли соответствующего металла. Общие ионные уравнения для реакций с участием соли магния, соли алюминия и соли цинка:
Mg2+(водн.)+2OH-(водн.)⟶Mg(OH)2(т)Mg2+(водн.)+2OH-(водн.)⟶Mg(OH)2(т) Al3+(водн.)+3OH-(водн.)⟶Al(OH)3(т)Al3+(водн.)+3OH-(водн.)⟶Al(OH)3(т) Zn2+(водн.)+2OH-(водн.)⟶Zn(OH)2(т)Zn2+(водн.)+2OH-(водн.)⟶Zn(OH)2(т) При приготовлении гидроксидов алюминия, галлия, цинка и олова (II) следует избегать избытка гидроксида, иначе гидроксиды будут растворяться с образованием соответствующих комплексных ионов: Al(OH)4-, Al(OH)4- , Ga(OH)4-, Ga(OH)4-, Zn(OH)42-, Zn(OH)42- и Sn(OH)3-Sn(OH)3- (см. Рисунок 18.45). Важным аспектом комплексных ионов для этой главы является то, что они образуются в результате кислотно-основной реакции Льюиса с металлом, являющимся кислотой Льюиса.
Рисунок 18.45). Важным аспектом комплексных ионов для этой главы является то, что они образуются в результате кислотно-основной реакции Льюиса с металлом, являющимся кислотой Льюиса.
Фигура 18.45 (a) Смешивание растворов NaOH и Zn(NO 3 ) 2 дает белый осадок Zn(OH) 2 . (b) Добавление избытка NaOH приводит к растворению осадка. (кредит: модификация работы Марка Отта)
Промышленность использует большое количество гидроксида натрия в качестве дешевого сильного основания.Хлорид натрия является исходным материалом для производства NaOH, поскольку NaCl является менее дорогим исходным материалом, чем оксид. Гидроксид натрия входит в десятку лучших химических веществ, производимых в Соединенных Штатах, и это производство почти полностью осуществляется путем электролиза растворов хлорида натрия. Этот процесс представляет собой хлорно-щелочной процесс и является основным методом производства хлора.
Гидроксид натрия является ионным соединением и плавится без разложения. Он хорошо растворяется в воде, выделяя много тепла и образуя очень щелочные растворы: 40 граммов гидроксида натрия растворяются всего в 60 граммах воды при 25 °C.Гидроксид натрия используется в производстве других соединений натрия и используется для нейтрализации кислых растворов при производстве других химических веществ, таких как нефтехимические продукты и полимеры.
Он хорошо растворяется в воде, выделяя много тепла и образуя очень щелочные растворы: 40 граммов гидроксида натрия растворяются всего в 60 граммах воды при 25 °C.Гидроксид натрия используется в производстве других соединений натрия и используется для нейтрализации кислых растворов при производстве других химических веществ, таких как нефтехимические продукты и полимеры.
Многие из применений гидроксидов связаны с нейтрализацией кислот (таких как антацид, показанный на рис. 18.46) и для получения оксидов путем термического разложения. Водная суспензия гидроксида магния представляет собой антацидное молочко магнезии. Из-за своей доступности (в результате реакции воды с оксидом кальция, полученного при разложении известняка, CaCO 3 ), низкой стоимости и активности гидроксид кальция широко используется в коммерческих целях, где требуется дешевое сильное основание.Реакцию гидроксидов с соответствующими кислотами используют также для получения солей.
Фигура
18. 46
Карбонат кальция, CaCO 3 , можно употреблять в виде антацида, чтобы нейтрализовать действие кислоты в желудке. (кредит: «Midnightcomm»/Wikimedia Commons)
46
Карбонат кальция, CaCO 3 , можно употреблять в виде антацида, чтобы нейтрализовать действие кислоты в желудке. (кредит: «Midnightcomm»/Wikimedia Commons)
Химия в повседневной жизни
Хлорно-щелочной процесс
Хотя они очень разные химически, между хлором и гидроксидом натрия существует связь, потому что существует важный электрохимический процесс, который производит два химических вещества одновременно.В процессе, известном как хлорно-щелочной процесс, используется хлорид натрия, который встречается на крупных месторождениях во многих частях мира. Это электрохимический процесс окисления ионов хлорида до хлора и образования гидроксида натрия.
Прохождение постоянного электрического тока через раствор NaCl вызывает миграцию ионов хлорида к положительному электроду, где происходит окисление до газообразного хлора, когда ион отдает электрон электроду:
2Cl-(водн.)⟶Cl2(г)+2e-(на положительном электроде)2Cl-(водн.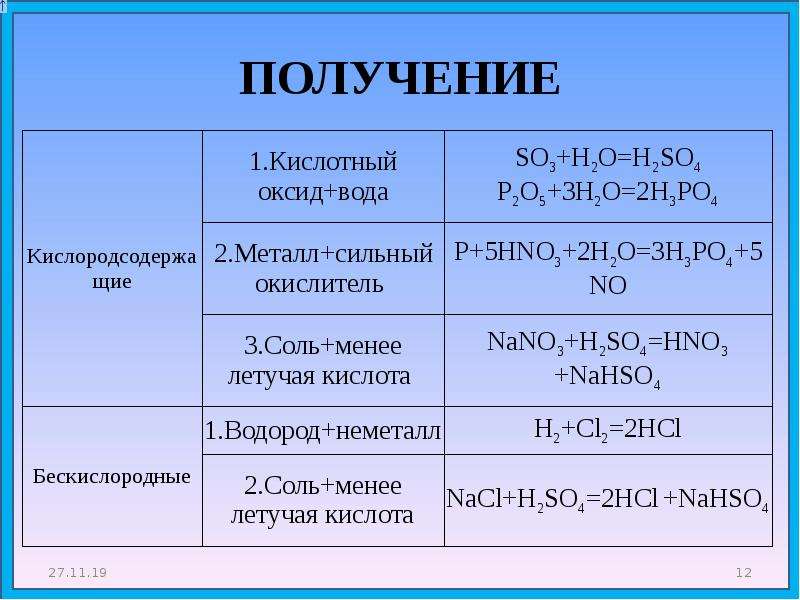 )⟶Cl2(г)+2e-(на положительном электроде)
)⟶Cl2(г)+2e-(на положительном электроде)Образовавшиеся электроны проходят через внешнюю электрическую цепь к отрицательному электроду.Хотя положительные ионы натрия мигрируют к этому отрицательному электроду, металлический натрий не образуется, потому что ионы натрия слишком трудно восстановить в используемых условиях. (Вспомните, что металлический натрий достаточно активен, чтобы реагировать с водой, и, следовательно, даже если он образуется, он немедленно реагирует с водой, снова образуя ионы натрия.) Вместо этого молекулы воды захватывают электроны с электрода и подвергаются восстановлению с образованием газообразного водорода и гидроксида. ионы:
2h3O(ж)+2e-(от отрицательного электрода)⟶h3(г)+2OH-(водн.)2h3O(ж)+2e-(от отрицательного электрода)⟶h3(г)+2OH-(водн.)Общий результат представляет собой преобразование водного раствора NaCl в водный раствор NaOH, газообразный Cl 2 и газообразный H 2 :
2Na+(водн.)+2Cl-(водн.)+2h3O(ж)→электролиз2Na+(водн. )+2OH-(водн.)+Cl2(г)+h3(г)2Na+(водн.)+2Cl-(водн.)+2h3O(ж )→электролиз2Na+(водн.)+2OH-(водн.)+Cl2(г)+h3(г)
)+2OH-(водн.)+Cl2(г)+h3(г)2Na+(водн.)+2Cl-(водн.)+2h3O(ж )→электролиз2Na+(водн.)+2OH-(водн.)+Cl2(г)+h3(г)Соединения неметаллов с кислородом
Большинство неметаллов реагируют с кислородом с образованием оксидов неметаллов.В зависимости от доступных степеней окисления элемента могут образовываться различные оксиды. Фтор будет соединяться с кислородом с образованием фторидов, таких как OF 2 , где кислород имеет 2+ степень окисления.
Соединения серы и кислорода
Двумя распространенными оксидами серы являются диоксид серы, SO 2 , и триоксид серы, SO 3 . Запах горящей серы исходит от двуокиси серы. Диоксид серы, показанный на рис. 18.47, встречается в вулканических газах и в атмосфере вблизи промышленных предприятий, сжигающих топливо, содержащее соединения серы.
Фигура
18.47
На этом изображении показана молекулярная структура (слева) и резонансные формы (справа) диоксида серы.
Промышленное производство двуокиси серы осуществляется путем либо сжигания серы, либо обжига сульфидных руд, таких как ZnS, FeS 2 и Cu 2 S, на воздухе. (Обжиг, при котором образуется оксид металла, является первым этапом выделения многих металлов из их руд.) Удобным методом получения диоксида серы в лаборатории является воздействие сильной кислоты на любую сульфитную соль, содержащую SO32– Ионы SO32– или гидросульфитные соли, содержащие HSO3–.HSO3-. Сернистая кислота H 2 SO 3 образуется первой, но быстро разлагается на двуокись серы и воду. Диоксид серы также образуется, когда многие восстановители реагируют с горячей концентрированной серной кислотой. Триоксид серы образуется медленно при совместном нагревании диоксида серы и кислорода, и реакция является экзотермической:
2SO2(г)+O2(г)⟶2SO3(г)ΔH°=-197,8 кДж2SO2(г)+O2(г)⟶2SO3(г)ΔH°=-197,8 кДж Двуокись серы представляет собой газ при комнатной температуре, а молекула SO 2 изогнута. Триоксид серы плавится при 17°С и кипит при 43°С.В парообразном состоянии его молекулы представляют собой единичные единицы SO 3 (показаны на рис. 18.48), но в твердом состоянии SO 3 существует в нескольких полимерных формах.
Триоксид серы плавится при 17°С и кипит при 43°С.В парообразном состоянии его молекулы представляют собой единичные единицы SO 3 (показаны на рис. 18.48), но в твердом состоянии SO 3 существует в нескольких полимерных формах.
Фигура 18.48 На этом изображении показана структура (вверху) триоксида серы в газовой фазе и его резонансные формы (внизу).
Оксиды серы реагируют как кислоты Льюиса со многими оксидами и гидроксидами в кислотно-основных реакциях Льюиса с образованием сульфитов или гидросульфитов, а также сульфатов или гидросульфатов соответственно.
Соединения галогенов и кислорода
Галогены не реагируют напрямую с кислородом, но можно получить бинарные кислород-галогенные соединения по реакции галогенов с кислородсодержащими соединениями. Соединения кислорода с хлором, бромом и йодом являются оксидами, поскольку кислород является более электроотрицательным элементом в этих соединениях. С другой стороны, соединения фтора с кислородом являются фторидами, поскольку фтор является более электроотрицательным элементом.
С другой стороны, соединения фтора с кислородом являются фторидами, поскольку фтор является более электроотрицательным элементом.
Оксиды как класс чрезвычайно реакционноспособны и нестабильны, и их химический состав не имеет большого практического значения.Оксид дихлора, формально называемый моноксидом дихлора, и диоксид хлора, показанные на рис. 18.49, являются единственными коммерчески важными соединениями. Они важны как отбеливатели (для использования с целлюлозой и мукой) и для очистки воды.
Фигура 18.49 На этом изображении показаны структуры молекул Cl 2 O (а) и ClO 2 (б).
Оксикислоты неметаллов и их соли
Оксиды неметаллов образуют кислоты при взаимодействии с водой; это ангидриды кислот.Образовавшиеся оксианионы могут образовывать соли с ионами различных металлов.
Азотные оксикислоты и соли
Пентаоксид азота, N 2 O 5 и NO 2 реагируют с водой с образованием азотной кислоты, HNO 3 . Алхимики еще в восьмом веке знали азотную кислоту (показана на рис. 18.50) как aqua fortis (что означает «крепкая вода»). Кислота была полезна при отделении золота от серебра, потому что она растворяет серебро, но не золото. Следы азотной кислоты появляются в атмосфере после гроз, а ее соли широко распространены в природе.Имеются огромные залежи чилийской селитры, NaNO 3 , в пустынной области недалеко от границы Чили и Перу. Бенгальская селитра, КНО 3 , встречается в Индии и других странах Дальнего Востока.
Алхимики еще в восьмом веке знали азотную кислоту (показана на рис. 18.50) как aqua fortis (что означает «крепкая вода»). Кислота была полезна при отделении золота от серебра, потому что она растворяет серебро, но не золото. Следы азотной кислоты появляются в атмосфере после гроз, а ее соли широко распространены в природе.Имеются огромные залежи чилийской селитры, NaNO 3 , в пустынной области недалеко от границы Чили и Перу. Бенгальская селитра, КНО 3 , встречается в Индии и других странах Дальнего Востока.
Фигура 18.50 На этом изображении показана молекулярная структура (слева) азотной кислоты, HNO 3 и ее резонансных форм (справа).
В лаборатории можно получить азотную кислоту путем нагревания нитратной соли (например, нитрата натрия или калия) с концентрированной серной кислотой:
NaNO3(т)+h3SO4(ж)→ΔNaHSO4(т)+HNO3(г)NaNO3(т)+h3SO4(ж)→ΔNaHSO4(т)+HNO3(г) Процесс Оствальда — это коммерческий метод производства азотной кислоты. Этот процесс включает окисление аммиака до оксида азота NO; окисление оксида азота в диоксид азота, NO 2 ; и дальнейшее окисление и гидратация диоксида азота с образованием азотной кислоты:
Этот процесс включает окисление аммиака до оксида азота NO; окисление оксида азота в диоксид азота, NO 2 ; и дальнейшее окисление и гидратация диоксида азота с образованием азотной кислоты:
или
4NO2(г)+O2(г)+2h3O(г)⟶4HNO3(ж)4NO2(г)+O2(г)+2h3O(г)⟶4HNO3(ж)Чистая азотная кислота представляет собой бесцветную жидкость.Однако он часто бывает желтого или коричневого цвета, потому что при разложении кислоты образуется NO 2 . Азотная кислота стабильна в водном растворе; растворы, содержащие 68% кислоты, представляют собой коммерчески доступную концентрированную азотную кислоту. Это одновременно сильный окислитель и сильная кислота.
Действие азотной кислоты на металл редко приводит к образованию H 2 (путем восстановления H + ) в более чем небольших количествах. Вместо этого происходит восстановление азота. Образующиеся продукты зависят от концентрации кислоты, активности металла и температуры.В норме образуется смесь нитратов, оксидов азота и различных продуктов восстановления. Менее активные металлы, такие как медь, серебро и свинец, восстанавливают концентрированную азотную кислоту в основном до двуокиси азота. Реакция разбавленной азотной кислоты с медью дает NO. В каждом случае азотнокислые соли металлов кристаллизуются при упаривании полученных растворов.
Вместо этого происходит восстановление азота. Образующиеся продукты зависят от концентрации кислоты, активности металла и температуры.В норме образуется смесь нитратов, оксидов азота и различных продуктов восстановления. Менее активные металлы, такие как медь, серебро и свинец, восстанавливают концентрированную азотную кислоту в основном до двуокиси азота. Реакция разбавленной азотной кислоты с медью дает NO. В каждом случае азотнокислые соли металлов кристаллизуются при упаривании полученных растворов.
Неметаллические элементы, такие как сера, углерод, йод и фосфор, окисляются концентрированной азотной кислотой до их оксидов или оксикислот с образованием NO 2 :
S(т)+6HNO3(водн.)⟶h3SO4(водн.)+6NO2(г)+2h3O(ж)S(т)+6HNO3(водн.)⟶h3SO4(водн.)+6NO2(г)+2h3O(ж) C(т)+4HNO3(водн.)⟶CO2(г)+4NO2(г)+2h3O(ж)C(т)+4HNO3(водн.)⟶CO2(г)+4NO2(г)+2h3O(ж) Азотная кислота окисляет многие соединения; например, концентрированная азотная кислота легко окисляет соляную кислоту до хлора и двуокиси хлора. Смесь из одной части концентрированной азотной кислоты и трех частей концентрированной соляной кислоты (называемая царской водкой , что означает королевская вода) энергично реагирует с металлами. Эта смесь особенно полезна для растворения золота, платины и других металлов, которые труднее окислить, чем водород. Упрощенное уравнение для представления действия царской водки на золото:
Смесь из одной части концентрированной азотной кислоты и трех частей концентрированной соляной кислоты (называемая царской водкой , что означает королевская вода) энергично реагирует с металлами. Эта смесь особенно полезна для растворения золота, платины и других металлов, которые труднее окислить, чем водород. Упрощенное уравнение для представления действия царской водки на золото:
Ссылка на обучение
Хотя золото, как правило, не реагирует, вы можете посмотреть видео о том, как сложная смесь соединений, присутствующих в царской водке , растворяется в растворе.
Нитраты, соли азотной кислоты, образуются при взаимодействии металлов, оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде; действительно, одним из важных применений азотной кислоты является получение растворимых нитратов металлов.
Азотная кислота находит широкое применение в лабораториях и в химической промышленности как сильная кислота и сильный окислитель. Он важен при производстве взрывчатых веществ, красителей, пластмасс и лекарств. Соли азотной кислоты (нитраты) ценны как удобрения.Порох представляет собой смесь нитрата калия, серы и древесного угля.
Реакция N 2 O 3 с водой дает бледно-голубой раствор азотистой кислоты HNO 2 . Однако HNO 2 (показана на рис. 18.51) легче приготовить добавлением кислоты к раствору нитрита; азотистая кислота является слабой кислотой, поэтому нитрит-ион является основным в водном растворе:
NO2−(водн.)+h4O+(водн.)⟶HNO2(водн.)+h3O(ж)NO2−(водн.)+h4O+(водн.)⟶HNO2(водн.)+h3O(ж) Азотистая кислота очень нестабильна и существует только в растворе.Он медленно диспропорционирует при комнатной температуре (быстро при нагревании) на азотную кислоту и оксид азота. Азотистая кислота является активным окислителем с сильными восстановителями, а сильные окислители окисляют ее до азотной кислоты.
Фигура 18.51 На этом изображении показана молекулярная структура молекулы азотистой кислоты HNO 2 .
Нитрит натрия, NaNO 2 , является добавкой к мясу, такому как хот-доги и мясное ассорти. Ион нитрита выполняет две функции.Он ограничивает рост бактерий, которые могут вызвать пищевое отравление, и продлевает сохранение красного цвета мяса. Добавление нитрита натрия к мясным продуктам вызывает споры, поскольку азотистая кислота реагирует с некоторыми органическими соединениями с образованием класса соединений, известных как нитрозамины. Нитрозамины вызывают рак у лабораторных животных. Это побудило FDA ограничить количество NaNO 2 в пищевых продуктах.
Нитриты намного стабильнее кислоты, но нитриты, как и нитраты, могут взрываться.Нитриты, как и нитраты, также растворимы в воде (AgNO 2 мало растворим).
Оксикислоты и соли фосфора
Чистая ортофосфорная кислота, H 3 PO 4 (показана на рис. 18.52), образует бесцветные расплывающиеся кристаллы, плавящиеся при 42 °C. Общее название этого соединения — фосфорная кислота, и оно коммерчески доступно в виде вязкого 82%-ного раствора, известного как сиропообразная фосфорная кислота. Одним из способов использования фосфорной кислоты является добавка ко многим безалкогольным напиткам.
18.52), образует бесцветные расплывающиеся кристаллы, плавящиеся при 42 °C. Общее название этого соединения — фосфорная кислота, и оно коммерчески доступно в виде вязкого 82%-ного раствора, известного как сиропообразная фосфорная кислота. Одним из способов использования фосфорной кислоты является добавка ко многим безалкогольным напиткам.
Один из коммерческих методов получения ортофосфорной кислоты заключается в обработке фосфата кальция концентрированной серной кислотой:
Ca3(PO4)2(тв)+3h3SO4(вод)⟶2h4PO4(вод)+3CaSO4(тв)Ca3(PO4)2(тв)+3h3SO4(вод)⟶2h4PO4(вод)+3CaSO4(тв)Фигура 18.52 Ортофосфорная кислота, H 3 PO 4 , в чистом виде бесцветна и имеет такую молекулярную (слева) и структуру Льюиса (справа).
Разбавление продуктов водой с последующей фильтрацией для удаления сульфата кальция дает разбавленный кислый раствор, загрязненный дигидрофосфатом кальция, Ca(H 2 PO 4 ) 2 и другими соединениями, связанными с кальцийфосфатной породой . Можно получить чистую ортофосфорную кислоту, растворив P 4 O 10 в воде.
Можно получить чистую ортофосфорную кислоту, растворив P 4 O 10 в воде.
Действие воды на P 4 O 6 , PCl 3 , PBr 3 или PI 3 образует фосфористую кислоту, H 3 PO 8 3 (показана на рис. 1 3). Наилучший метод получения чистой фосфористой кислоты — гидролиз треххлористого фосфора:
PCl3(ж)+3h3O(ж)⟶h4PO3(вод)+3HCl(г)PCl3(ж)+3h3O(ж)⟶h4PO3(вод)+3HCl(г)Нагревание полученного раствора приводит к удалению хлористого водорода и испарению воды.Когда испарится достаточное количество воды, при охлаждении появятся белые кристаллы фосфористой кислоты. Кристаллы расплываются, хорошо растворяются в воде и имеют запах чеснока. Твердое вещество плавится при 70,1 °C и разлагается примерно при 200 °C путем диспропорционирования на фосфин и ортофосфорную кислоту:
4h4PO3(ж)⟶Ph4(г)+3h4PO4(ж)4h4PO3(ж)⟶Ph4(ж)+3h4PO4(ж) Фигура
18.53
В молекуле фосфористой кислоты H 3 PO 3 кислотными являются только два атома водорода, связанные с атомом кислорода.
Фосфористая кислота образует только два ряда солей, которые содержат ион дигидрофосфита, h3PO3-, h3PO3-, или ион гидрофосфата, HPO32-, HPO32-, соответственно. Заменить третий атом водорода невозможно, потому что он не очень кислый, так как ионизировать связь Р-Н нелегко.
Оксикислоты и соли серы
Получение серной кислоты, H 2 SO 4 (показано на рис. 18.54), начинается с окисления серы до триоксида серы и последующего превращения триоксида в серную кислоту.Чистая серная кислота представляет собой бесцветную маслянистую жидкость, замерзающую при 10,5°С. Он дымит при нагревании, потому что кислота разлагается на воду и триоксид серы. Процесс нагревания вызывает потерю большего количества триоксида серы, чем воды, до достижения концентрации кислоты 98,33%. Кислота этой концентрации кипит при 338 °C без дальнейшего изменения концентрации (постоянно кипящий раствор) и является промышленно концентрированной H 2 SO 4 . Количество серной кислоты, используемой в промышленности, превышает количество любого другого промышленного соединения.
Количество серной кислоты, используемой в промышленности, превышает количество любого другого промышленного соединения.
Фигура 18.54 Серная кислота имеет тетраэдрическую молекулярную структуру.
Сильное сродство концентрированной серной кислоты к воде делает ее хорошим обезвоживающим средством. Газы и несмешивающиеся жидкости, которые не реагируют с кислотой, можно осушать, пропуская их через кислоту.
Серная кислота является сильной двухосновной кислотой, которая ионизируется в две стадии. В водном растворе первая стадия практически завершена. Вторичная ионизация не столь полная, и HSO4-HSO4- является умеренно сильной кислотой (около 25% ионизировано в растворе соли HSO4-HSO4-: K a = 1.2 × × 10 −2 ).
Будучи двухосновной кислотой, серная кислота образует как сульфаты, такие как Na 2 SO 4 , так и гидросульфаты, такие как NaHSO 4 . Большинство сульфатов растворимы в воде; однако сульфаты бария, стронция, кальция и свинца мало растворимы в воде.
Среди важных сульфатов Na 2 SO 4 ⋅10H 2 O и соли Эпсома, MgSO 4 ⋅7H 2 O. как NaHSO 4 , проявляют кислотное поведение, и это соединение является основным ингредиентом некоторых бытовых чистящих средств.
Горячая концентрированная серная кислота является окислителем. В зависимости от концентрации, температуры и силы восстановителя серная кислота окисляет многие соединения и в процессе восстанавливается до SO 2 , HSO3-, HSO3-, SO32-, SO32-, S, H 2 S , или S 2− .
Диоксид серы растворяется в воде с образованием раствора сернистой кислоты, как и ожидается для оксида неметалла. Сернистая кислота нестабильна, и выделить безводную H 2 SO 3 невозможно.При нагревании раствора сернистой кислоты выделяется двуокись серы. Как и другие двухосновные кислоты, сернистая кислота ионизируется в два этапа: образуются ион сульфита водорода, HSO3-, HSO3-, и ион сульфита, SO32-, SO32-. Сернистая кислота является умеренно сильной кислотой. На первой ступени ионизация составляет около 25 %, а на второй значительно меньше ( К a1 = 1,2 × × 10 −2 и K a2 = 6,2 × × 10 −8 ).
Сернистая кислота является умеренно сильной кислотой. На первой ступени ионизация составляет около 25 %, а на второй значительно меньше ( К a1 = 1,2 × × 10 −2 и K a2 = 6,2 × × 10 −8 ).
Для получения твердых сульфитных и сероводородных солей необходимо к раствору сернистой кислоты добавить стехиометрическое количество основания и затем выпарить воду.Эти соли также образуются в результате реакции SO 2 с оксидами и гидроксидами. При нагревании твердого гидросульфита натрия образуются сульфит натрия, диоксид серы и вода:
2NaHSO3(т)→ΔNa2SO3(т)+SO2(г)+h3O(ж)2NaHSO3(т)→ΔNa2SO3(т)+SO2(г)+h3O(ж)Сильные окислители могут окислять сернистую кислоту. Кислород в воздухе медленно окисляет его до более стабильной серной кислоты:
2h3SO3(водн.)+O2(г)+2h3O(ж)→Δ2h4O+(водн.)+2HSO4−(водн.)2h3SO3(водн.)+O2(г)+2h3O(ж)→Δ2h4O+(водн.)+2HSO4−(водн.) Растворы сульфитов также очень восприимчивы к окислению воздухом с образованием сульфатов. Таким образом, растворы сульфитов после воздействия воздуха всегда содержат сульфаты.
Таким образом, растворы сульфитов после воздействия воздуха всегда содержат сульфаты.
Галогеноксикислоты и их соли
Соединения HXO, HXO 2 , HXO 3 и HXO 4 , где X представляет собой Cl, Br или I, представляют собой гипогалогеновую, галоидную, галоидную и пергалогеновую кислоты соответственно. Сила этих кислот увеличивается от гипогалоидных кислот, которые являются очень слабыми кислотами, к пергалогенным кислотам, которые являются очень сильными. В таблице 18.2 перечислены известные кислоты, и, если они известны, их значения рК и приведены в скобках.
Оксикислоты галогенов
| Имя | Фтор | Хлор | Бром | Йод |
|---|---|---|---|---|
| гипогалогенный | ХОФ | HOCl (7,5) | НОБр (8. 7) 7) | HOI (11) |
| галоус | HClO 2 (2,0) | |||
| галоид | HClO 3 | HBrO 3 | ХИО 3 (0.8) | |
| пергалогенный | HClO 4 | HBrO 4 | HIO 4 (1,6) | |
| парааэральный | H 5 IO 6 (1,6) |
Таблица 18.2
Единственной известной оксикислотой фтора является очень нестабильная гипофтористая кислота HOF, которую получают реакцией газообразного фтора со льдом:
F2(г)+h3O(т)⟶HOF(г)+HF(г)F2(г)+h3O(т)⟶HOF(г)+HF(г) Соединение очень нестабильно и разлагается при температуре выше -40 °C. Это соединение не ионизируется в воде, и в нем нет известных солей. Неясно, подходит ли название гипофтористая кислота для HOF; более подходящим названием может быть гипофлюорит водорода.
Это соединение не ионизируется в воде, и в нем нет известных солей. Неясно, подходит ли название гипофтористая кислота для HOF; более подходящим названием может быть гипофлюорит водорода.
Реакции хлора и брома с водой аналогичны реакциям фтора со льдом, но эти реакции не доходят до конца и образуются смеси галогена с соответствующими галогеноводородной и галогеноводородной кислотами. За исключением HOF, гипогалоидные кислоты существуют только в растворе.Гипогалогеновые кислоты — все очень слабые кислоты; однако HOCl является более сильной кислотой, чем HOBr, которая, в свою очередь, сильнее HOI.
Добавление основания к растворам гипогалоидных кислот дает растворы солей, содержащие основные ионы гипогалита, OX − . Эти соли можно выделить в виде твердых веществ. Все гипогалиты неустойчивы по отношению к диспропорционированию в растворе, но реакция гипохлорита идет медленно. Гипобромит и гипойодит быстро диспропорционируют даже на холоде:
3XO-(водн.)⟶2X-(водн. )+XO3-(водн.)3XO-(водн.)⟶2X-(водн.)+XO3-(водн.)
)+XO3-(водн.)3XO-(водн.)⟶2X-(водн.)+XO3-(водн.)Гипохлорит натрия — недорогой отбеливатель (Clorox) и гермицид.Коммерческий препарат включает электролиз холодных разбавленных водных растворов хлорида натрия в условиях, когда образующиеся ион хлора и гидроксида могут реагировать. Чистая реакция:
Cl-(водн.)+h3O(ж)→электрическая энергияClO-(водн.)+h3(г)Cl-(водн.)+h3O(ж)→электрическая энергияClO-(водн.)+h3(г)Единственной достоверно известной галогенистой кислотой является хлористая кислота HClO 2 , полученная реакцией хлорита бария с разбавленной серной кислотой:
Ba(ClO2)2(водн.)+h3SO4(водн.)⟶BaSO4(тв)+2HClO2(водн.)Ba(ClO2)2(водн.)+h3SO4(водн.)⟶BaSO4(тв.)+2HClO2(водн.) После фильтрации нерастворимого сульфата бария остается раствор HClO 2 .Хлористая кислота не стабильна; он медленно разлагается в растворе с образованием диоксида хлора, соляной кислоты и воды. Хлористая кислота реагирует с основаниями с образованием солей, содержащих ион хлорита (показан на рис. 18.55). Хлорит натрия находит широкое применение при отбеливании бумаги, поскольку является сильным окислителем и не повреждает бумагу.
18.55). Хлорит натрия находит широкое применение при отбеливании бумаги, поскольку является сильным окислителем и не повреждает бумагу.
Хлорная кислота, HClO 3 , и бромная кислота, HBrO 3 , стабильны только в растворе.Реакция йода с концентрированной азотной кислотой дает стабильную белую йодистую кислоту HIO 3 :
. I2(т)+10HNO3(вод)⟶2HIO3(т)+10NO2(г)+4h3O(ж)I2(т)+10HNO3(вод)⟶2HIO3(т)+10NO2(г)+4h3O(ж) Более легкие галогеновые кислоты можно получить из их солей бария путем реакции с разбавленной серной кислотой. Реакция аналогична реакции получения хлорноватистой кислоты. Все галоидные кислоты являются сильными кислотами и очень активными окислителями. Кислоты реагируют с основаниями с образованием солей, содержащих хлорат-ионы (показаны на рисунке 18.56). Другим препаративным методом является электрохимическое окисление горячего раствора галогенида металла с образованием соответствующих хлоратов металлов. Хлорат натрия является убийцей сорняков; хлорат калия используется как окислитель.
Хлорат натрия является убийцей сорняков; хлорат калия используется как окислитель.
Хлорная кислота, HClO 4 , образуется при обработке перхлората, такого как перхлорат калия, серной кислотой при пониженном давлении. HClO 4 можно перегнать из смеси:
KClO4(т)+h3SO4(водн.)⟶HClO4(г)+KHSO4(т)KClO4(тв)+h3SO4(водн.)⟶HClO4(г)+KHSO4(т) Разбавленные водные растворы хлорной кислоты достаточно термически устойчивы, но концентрации выше 60% нестабильны и опасны.Хлорная кислота и ее соли являются сильными окислителями, так как сам электроотрицательный хлор более стабилен в более низкой степени окисления, чем 7+. Серьезные взрывы произошли при нагревании концентрированных растворов с легко окисляющимися веществами. Однако его реакции в качестве окислителя протекают медленно, когда хлорная кислота холодная и разбавленная. Кислота является одной из самых сильных из всех кислот. Большинство солей, содержащих перхлорат-ион (показан на рис. 18.57), растворимы. Их можно получать из реакций оснований с хлорной кислотой и в промышленных масштабах электролизом горячих растворов их хлоридов.
Большинство солей, содержащих перхлорат-ион (показан на рис. 18.57), растворимы. Их можно получать из реакций оснований с хлорной кислотой и в промышленных масштабах электролизом горячих растворов их хлоридов.
Соли пербромата трудно получить, и лучшие синтезы в настоящее время включают окисление броматов в основном растворе газообразным фтором с последующим подкислением. Коммерческих применений этой кислоты или ее солей мало, если вообще есть.
Существует несколько различных кислот, содержащих йод в 7+-степени окисления; они включают метапериодную кислоту HIO 4 и парапериодную кислоту H 5 IO 6 .Эти кислоты являются сильными окислителями и реагируют с основаниями с образованием соответствующих солей.
Наноструктуры оксидов металлов путем простой обработки горячей водой
В этом исследовании 45 различных типов металлов, включающих несколько чистых элементов, сплавов и соединений, были обработаны горячей деионизированной водой в поисках металлов, которые реагируют на HWT и образуют MONSTR. Впервые мы исследовали изменение морфологии металлических поверхностей после проведения ГИО при температуре воды 75 °С. Те металлы, которые не образовывали MONSTR, обрабатывались в течение более длительного времени, а некоторые при 95 °C.На рисунке 1 показаны изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ) тех металлов, которые образовали MONSTR на поверхности, что соответствует 30 из 45 исследованных металлов. Другими словами, MONSTR удалось вырастить на поверхности примерно 67% всех металлов, использованных в этой работе, что показано на круговой диаграмме на рис. 2. Было подтверждено, что большинство наноструктур, наблюдаемых на рис. 1, представляют собой оксиды металлов. термодинамически стабильных составов, о чем свидетельствуют данные энергодисперсионной рентгеновской спектроскопии (ЭДС, таблица S1) и рентгеноструктурного анализа (РФА) (рис.С1). Считается, что фаза гидроксида металла, которая может образовываться в результате гидролиза, которая обычно является аморфной 38 , незначительна во время роста HWT MONSTR в основном из-за заметного образования пузырьков водорода, наблюдаемого для большинства исследованных металлов (например, дополнительное видео 1 для Al) и хорошо выраженные текстурированные формы кристаллов MONSTR (рис.
Впервые мы исследовали изменение морфологии металлических поверхностей после проведения ГИО при температуре воды 75 °С. Те металлы, которые не образовывали MONSTR, обрабатывались в течение более длительного времени, а некоторые при 95 °C.На рисунке 1 показаны изображения, полученные с помощью сканирующей электронной микроскопии (СЭМ) тех металлов, которые образовали MONSTR на поверхности, что соответствует 30 из 45 исследованных металлов. Другими словами, MONSTR удалось вырастить на поверхности примерно 67% всех металлов, использованных в этой работе, что показано на круговой диаграмме на рис. 2. Было подтверждено, что большинство наноструктур, наблюдаемых на рис. 1, представляют собой оксиды металлов. термодинамически стабильных составов, о чем свидетельствуют данные энергодисперсионной рентгеновской спектроскопии (ЭДС, таблица S1) и рентгеноструктурного анализа (РФА) (рис.С1). Считается, что фаза гидроксида металла, которая может образовываться в результате гидролиза, которая обычно является аморфной 38 , незначительна во время роста HWT MONSTR в основном из-за заметного образования пузырьков водорода, наблюдаемого для большинства исследованных металлов (например, дополнительное видео 1 для Al) и хорошо выраженные текстурированные формы кристаллов MONSTR (рис.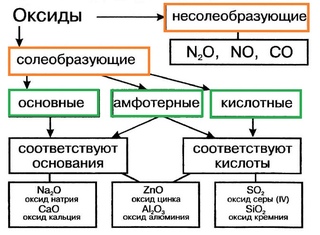 1). Изображения на рис. 1 были упорядочены в порядке, основанном на времени обработки, необходимом для формирования четко определенных наноструктур оксида металла.Например, олово (Sn) образует MONSTR через 10 мин при 75 °C (рис. 1, группа элементов, вверху слева), тогда как для меди (Cu; рис. 1, группа элементов, внизу справа) требуется 24 часа. Среди исследованных сплавов и соединений алюминиевые сплавы образовывали MONSTR за 10 минут, а бронза формировала наноструктуры только через 7 часов при 75 °C. Никаких MONSTR не наблюдалось при 75 °C для некоторых металлов даже через 24 часа. Затем эти образцы обрабатывали при 95 °C, что приводило к образованию MONSTR. Например, наноструктуры наблюдались на индии (In) при 95 °C примерно через 10 часов.В зависимости от используемого металла на рис. 1 можно увидеть несколько форм MONSTR, включая кубы, пирамиды, пластины, проволоки, сферы и листовидные наноструктуры. Как будет обсуждаться ниже, считается, что такие разные геометрические формы возникают из-за различных кристаллических структур, поверхностной диффузии и минимизации поверхностной энергии за счет образования определенных граней кристалла 39 .
1). Изображения на рис. 1 были упорядочены в порядке, основанном на времени обработки, необходимом для формирования четко определенных наноструктур оксида металла.Например, олово (Sn) образует MONSTR через 10 мин при 75 °C (рис. 1, группа элементов, вверху слева), тогда как для меди (Cu; рис. 1, группа элементов, внизу справа) требуется 24 часа. Среди исследованных сплавов и соединений алюминиевые сплавы образовывали MONSTR за 10 минут, а бронза формировала наноструктуры только через 7 часов при 75 °C. Никаких MONSTR не наблюдалось при 75 °C для некоторых металлов даже через 24 часа. Затем эти образцы обрабатывали при 95 °C, что приводило к образованию MONSTR. Например, наноструктуры наблюдались на индии (In) при 95 °C примерно через 10 часов.В зависимости от используемого металла на рис. 1 можно увидеть несколько форм MONSTR, включая кубы, пирамиды, пластины, проволоки, сферы и листовидные наноструктуры. Как будет обсуждаться ниже, считается, что такие разные геометрические формы возникают из-за различных кристаллических структур, поверхностной диффузии и минимизации поверхностной энергии за счет образования определенных граней кристалла 39 . Кроме того, некоторые металлы (например, Al, Mg, Ni) образовывали взаимосвязанные MONSTR, в то время как для других они были хорошо изолированы (например,г. Zn, Mo, In, Cu). MONSTR во всех изученных металлах на подложках с однородным покрытием (рис. S2), что указывает на масштабируемость метода HWT.
Кроме того, некоторые металлы (например, Al, Mg, Ni) образовывали взаимосвязанные MONSTR, в то время как для других они были хорошо изолированы (например,г. Zn, Mo, In, Cu). MONSTR во всех изученных металлах на подложках с однородным покрытием (рис. S2), что указывает на масштабируемость метода HWT.
Показаны снимки СЭМ сверху различных элементарных металлов и некоторых сплавов и металлических соединений после обработки горячей водой (HWT). Последовательность изображений упорядочена в зависимости от времени обработки, необходимого для формирования четко определенных наноструктур оксида металла (MONSTR): от самого короткого до самого длительного времени обработки в порядке ( a ) слева направо и сверху вниз. нижняя ( b ) сверху вниз.
Рисунок 2 Гистограмма иллюстрирует приблизительное минимальное время HWT, необходимое для того, чтобы можно было наблюдать отдельные MONSTR на металлах в этом исследовании. Большинство металлов образуют наноструктуры при 75 °C (указаны справа на гистограмме), в то время как для некоторых других требуется более высокая температура 95 °C (слева). В правом столбце приведены некоторые статистические данные о реакции металлов на ГВ в зависимости от группы металлов (верхний график гистограммы), требуемых периодах обработки для формирования наноструктуры (в центре) и проценте металлов, которые реагировали или не реагировали на ГВ (нижний график). ).
Большинство металлов образуют наноструктуры при 75 °C (указаны справа на гистограмме), в то время как для некоторых других требуется более высокая температура 95 °C (слева). В правом столбце приведены некоторые статистические данные о реакции металлов на ГВ в зависимости от группы металлов (верхний график гистограммы), требуемых периодах обработки для формирования наноструктуры (в центре) и проценте металлов, которые реагировали или не реагировали на ГВ (нижний график). ).
Хотя об образовании тонкой пленки оксида металла на границе раздела металл/вода во время HWT широко сообщалось 33, 40,41,42,43,44 , наши результаты впервые показывают, что широкий диапазон металлов может также образуют MONSTR вместо тонких пленок с помощью HWT. Одна из возможных причин, по которой такой простой процесс формирования наноструктуры был упущен из виду, может быть связана с тем, что более ранние исследования уделяли больше внимания составу оксида металла, чем изменению морфологии. Другая причина может быть связана с процессом подготовки образцов в этих исследованиях, который, возможно, не удалял естественный оксид на поверхности перед HWT, который может действовать как самодиффузионный барьер 45 и препятствовать образованию MONSTR. Как мы обсудим ниже, ростовые механизмы образования МОНСТР при ГВТ могут сильно зависеть от наличия неокисленных атомов металла на границе раздела вода/металл. Мы также отмечаем, что оставшиеся 15 металлов из 45, которые не реагировали на HWT в условиях, используемых в наших экспериментах, могут по-прежнему образовывать MONSTR при более длительном времени обработки или более высоких температурах, что требует дальнейшего изучения.
Другая причина может быть связана с процессом подготовки образцов в этих исследованиях, который, возможно, не удалял естественный оксид на поверхности перед HWT, который может действовать как самодиффузионный барьер 45 и препятствовать образованию MONSTR. Как мы обсудим ниже, ростовые механизмы образования МОНСТР при ГВТ могут сильно зависеть от наличия неокисленных атомов металла на границе раздела вода/металл. Мы также отмечаем, что оставшиеся 15 металлов из 45, которые не реагировали на HWT в условиях, используемых в наших экспериментах, могут по-прежнему образовывать MONSTR при более длительном времени обработки или более высоких температурах, что требует дальнейшего изучения.
Гистограмма на рис. 2 (слева) суммирует значения температуры и критическое время обработки, использованные для формирования MONSTR на поверхности тех 30 металлов, которые отреагировали на HWT. Как видно, 22 из 30 металлов способны образовывать MONSTR при более низкой температуре 75 °C, а для остальных 8 требуется 95 °C. Это показывает потенциал процесса HWT как низкотемпературного метода синтеза наноструктур оксидов металлов. Кроме того, как показано на гистограмме на рис. 2 (в центре справа), большинство исследованных металлов образовывали MONSTR всего за несколько часов после обработки, что делает HWT хорошим кандидатом для высокопроизводительного метода изготовления.В частности, металлы, важные для промышленного применения, такие как Al, Zn, Mg, Pb, алюминиевые сплавы и стали, образовывали MONSTR даже в течение десятков минут.
Это показывает потенциал процесса HWT как низкотемпературного метода синтеза наноструктур оксидов металлов. Кроме того, как показано на гистограмме на рис. 2 (в центре справа), большинство исследованных металлов образовывали MONSTR всего за несколько часов после обработки, что делает HWT хорошим кандидатом для высокопроизводительного метода изготовления.В частности, металлы, важные для промышленного применения, такие как Al, Zn, Mg, Pb, алюминиевые сплавы и стали, образовывали MONSTR даже в течение десятков минут.
Кроме того, как видно на рис. 3 и гистограмме групп металлов на рис. 2, переходные, постпереходные и щелочные металлы кажутся более реактивными к HWT по сравнению с другими группами, как и ожидалось, исходя из общего поведения реакция металл-вода 46 . Среди переходных металлов, охваченных этим исследованием (21 металл), 13 из них (Sc, Ti, V, Mn, Cr, Fe, Co, Ni, Cu, Zn, Mo, Cd и Ta) реагировали на HWT, и наблюдались MONSTR. , в то время как другие (Zr, Y, Nb, Ag, Hf, W, Pt и Au) не показали заметного отклика. Например, HWT при 95 ° C в течение 36 часов была проведена для Pt и W, однако при характеристике SEM, XRD и EDS не было обнаружено никаких морфологических или композиционных изменений. За исключением Ga, который плавится при комнатной температуре и был исключен из этого исследования, поверхность всех постпереходных металлов (Al, In, Tl, Sn, Pb и Bi) показала образование наноразмерных элементов после HWT. Кроме того, в это исследование были включены Mg и Be из группы щелочноземельных металлов, и после HWT на их поверхности наблюдались MONSTR.Из исследованных лантаноидов (Nd, Gd, Tb, Dy и Er) только Nd и Er реагировали на процесс ГВТ. Наконец, только Sb из изученных металлоидов (B, Si, Ge, As, Sb и Te) показал образование MONSTR после HWT.
Например, HWT при 95 ° C в течение 36 часов была проведена для Pt и W, однако при характеристике SEM, XRD и EDS не было обнаружено никаких морфологических или композиционных изменений. За исключением Ga, который плавится при комнатной температуре и был исключен из этого исследования, поверхность всех постпереходных металлов (Al, In, Tl, Sn, Pb и Bi) показала образование наноразмерных элементов после HWT. Кроме того, в это исследование были включены Mg и Be из группы щелочноземельных металлов, и после HWT на их поверхности наблюдались MONSTR.Из исследованных лантаноидов (Nd, Gd, Tb, Dy и Er) только Nd и Er реагировали на процесс ГВТ. Наконец, только Sb из изученных металлоидов (B, Si, Ge, As, Sb и Te) показал образование MONSTR после HWT.
Периодическая таблица элементов, показывающая элементарные металлы, включенные в это исследование (жирный синий шрифт), и их реакцию на время и температуру HWT. Зеленые сплошные кружки относятся к металлам, которые реагировали на процесс HWT, и наблюдались MONSTR; в то время как красные сплошные кружки соответствуют металлам, которые не проявляют никаких признаков образования MONSTR. Температуры обработки представлены квадратными формами для обработки HWT при 75°C и треугольными формами для 95°C. Время обработки обозначено сплошными столбиками.
Температуры обработки представлены квадратными формами для обработки HWT при 75°C и треугольными формами для 95°C. Время обработки обозначено сплошными столбиками.
Кроме того, мы исследовали потенциальные механизмы роста, участвующие в формировании MONSTR. Образование плоских пленок оксидов металлов в воде широко описано в литературе 47,48,49,50,51 (Примечание: как обсуждалось выше, в нашей работе считается, что образование гидроксидов металлов незначительно). Как показано на рис.4b, процесс начинается с образования положительно заряженного иона металла, который высвобождается в воду, оставляя электроны на поверхности. Этот катион металла все еще остается близко к границе раздела вода/металл из-за отрицательного потенциала твердой поверхности. Затем электроны на поверхности могут реагировать с адсорбированными молекулами кислорода и воды с образованием гидроксильных ионов. Наконец, ионы металлов в воде могут реагировать с ионами гидроксила на поверхности с образованием молекулы оксида металла вместе с водородом 48 . Высвобождается водород, и молекулы оксида могут образовывать плоскую пленку оксида металла, но сам по себе этот механизм не может объяснить наноструктуры оксида металла, наблюдаемые в HWT. Здесь мы предлагаем новый механизм роста, который может привести к образованию MONSTR с помощью HWT.
Высвобождается водород, и молекулы оксида могут образовывать плоскую пленку оксида металла, но сам по себе этот механизм не может объяснить наноструктуры оксида металла, наблюдаемые в HWT. Здесь мы предлагаем новый механизм роста, который может привести к образованию MONSTR с помощью HWT.
Процесс HWT и этапы формирования MONSTR. ( a ) проиллюстрированы процесс HWT, ( b ) образование оксида металла во время HWT на границе раздела металл/вода и ( c ) этапы образования MONSTR во время HWT.Основной механизм образования наноструктур включает «закупорку» и поверхностную диффузию.
На рисунке 4c показаны важные этапы формирования MONSTR во время HWT. Первый этап включает образование молекул оксида металла на поверхности металлической подложки («оксид металла № 1» на рис. 4), что следует за реакцией, аналогичной этапам формирования пленки оксида металла, описанным выше (рис. 4b). . В наших экспериментах с HWT мы наблюдали образование газообразного водорода, что еще раз подтверждает этот первый шаг (дополнительное видео 1). В качестве потенциального следующего шага во время роста MONSTR молекулы оксида металла могут диффундировать по поверхности. Однако поверхностная диффузия не считается доминирующим механизмом, объясняющим формирование наноструктуры при относительно низкотемпературных условиях ГВТ (<100 °С). Более вероятным следующим шагом является процесс растворения-осаждения, называемый «закупориванием» 52 , который использовался для описания коррозии металлов. Он включает высвобождение молекулы оксида металла («высвобождение № 2») с поверхности в жидкость с последующим переносом через воду («миграция № 3») и осаждением («пере осаждение № 4») в другом положении на поверхности.Переосажденные молекулы могут инициировать образование изолированных наноструктур. Однако случайного характера закупорки может быть недостаточно для объяснения гладких кристаллических поверхностей, наблюдаемых в наноструктурах HWT. Повторно осажденные молекулы оксида металла могут диффундировать по поверхности, что может помочь в формировании гладких отдельных наноструктур, наблюдаемых на изображениях СЭМ на рис.
В качестве потенциального следующего шага во время роста MONSTR молекулы оксида металла могут диффундировать по поверхности. Однако поверхностная диффузия не считается доминирующим механизмом, объясняющим формирование наноструктуры при относительно низкотемпературных условиях ГВТ (<100 °С). Более вероятным следующим шагом является процесс растворения-осаждения, называемый «закупориванием» 52 , который использовался для описания коррозии металлов. Он включает высвобождение молекулы оксида металла («высвобождение № 2») с поверхности в жидкость с последующим переносом через воду («миграция № 3») и осаждением («пере осаждение № 4») в другом положении на поверхности.Переосажденные молекулы могут инициировать образование изолированных наноструктур. Однако случайного характера закупорки может быть недостаточно для объяснения гладких кристаллических поверхностей, наблюдаемых в наноструктурах HWT. Повторно осажденные молекулы оксида металла могут диффундировать по поверхности, что может помочь в формировании гладких отдельных наноструктур, наблюдаемых на изображениях СЭМ на рис. 1.
1.
Эти отдельные этапы могут зависеть от нескольких важных факторов. Например, на стадии окисления металлов скорость окисления может зависеть от подробного химического состава воды, такого как уровень pH, электропроводность и растворенный кислород 53 .Это также может зависеть от конкретных свойств металла, включая энергию ионизации, электроотрицательность, отношение заряда к размеру и энергию образования оксида, которые все могут играть решающую роль в чувствительности данного металла в HWT при формировании MONSTR. Однако мы не смогли наблюдать четкой корреляции между любым из этих отдельных параметров с критическим временем реакции, наблюдаемым на гистограмме на рис. 2. Это указывает на то, что ограничивающая промежуточная реакция при образовании оксида металла варьируется от материала к материалу.После стадии окисления, когда сила сцепления между молекулой оксида металла и металлической подложкой слаба или наблюдается движение жидкости, стадия высвобождения может стать легче и сделать процесс закупоривания более доминирующим. Особенно в случае низких скоростей поверхностной диффузии такой процесс закупоривания может привести к образованию фракталоподобных шероховатых наноструктур. Кроме того, исходная химия поверхности подложки может играть решающую роль в зарождении наноструктур оксида металла. Считается, что молекулы оксида металла могут преимущественно прилипать к местам дефектов (например, к дефектам).г., пустоты или границы зерен с оборванными связями), которые могут выступать в качестве областей зародышеобразования. Миграция и повторное отложение могут также зависеть от внешних факторов, таких как характер течения жидкости, морфология субстрата, механические вибрации или даже внешние магнитные и электрические поля.
Особенно в случае низких скоростей поверхностной диффузии такой процесс закупоривания может привести к образованию фракталоподобных шероховатых наноструктур. Кроме того, исходная химия поверхности подложки может играть решающую роль в зарождении наноструктур оксида металла. Считается, что молекулы оксида металла могут преимущественно прилипать к местам дефектов (например, к дефектам).г., пустоты или границы зерен с оборванными связями), которые могут выступать в качестве областей зародышеобразования. Миграция и повторное отложение могут также зависеть от внешних факторов, таких как характер течения жидкости, морфология субстрата, механические вибрации или даже внешние магнитные и электрические поля.
Дополнительные доказательства этапов миграции и повторного отложения, происходящих при HWT, показаны при одновременном размещении пластин Zn и Cu на расстоянии друг от друга (около 2 см) и проведении HWT при 75°C в течение 60 минут (рис.С3). Во время эксперимента мы непрерывно и осторожно перемешивали воду, чтобы получить равномерный ламинарный поток в контейнере HWT. Изображения SEM поверхности Cu и Zn после HWT и соответствующего анализа EDS, которые показаны на рис. S3, показывают наличие нанопроволок ZnO не только на подложке Zn, но и на Cu. При этом, как показал анализ с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) образца воды, взятого из эксперимента HWT, молекулы ZnO мигрировали через воду и повторно откладывались на поверхности Cu.Это еще раз подтверждает важный вклад этапа миграции как части механизма закупорки в формировании MONSTR во время HWT.
Изображения SEM поверхности Cu и Zn после HWT и соответствующего анализа EDS, которые показаны на рис. S3, показывают наличие нанопроволок ZnO не только на подложке Zn, но и на Cu. При этом, как показал анализ с помощью инфракрасной спектроскопии с преобразованием Фурье (FTIR) образца воды, взятого из эксперимента HWT, молекулы ZnO мигрировали через воду и повторно откладывались на поверхности Cu.Это еще раз подтверждает важный вклад этапа миграции как части механизма закупорки в формировании MONSTR во время HWT.
Что касается стадии поверхностной диффузии, ожидается, что подвижность повторно осажденных молекул оксида будет зависеть от поверхностной энергии граней кристалла, на которые они попадают. Их поверхностная диффузия будет выше на плоскостях с низкой поверхностной энергией, что заставляет повторно осажденные молекулы двигаться к краям и еще больше увеличивает размер грани. Следовательно, кристаллические плоскости с низкой поверхностной энергией могут расти быстрее и определять окончательную форму MONSTR. Для этой цели мы сначала идентифицировали кристаллические структуры MONSTR на основе рентгеноструктурного анализа (рис. S1 и S5), большинство из которых представляют собой термодинамически стабильные оксидные фазы. Затем мы разделили формы наноструктур на четыре различные категории, включая сферические, проволочные (например, провода и стержни), двухмерные многоугольные (листовидные формы, такие как пластины, диски и листы) и трехмерные многоугольные (например, кубы и пирамиды) геометрии. Гистограмма на рис. S5 сравнивает взаимосвязь между кристаллической структурой и формой MONSTR.Замечено, что большинство моноклинных, тетрагональных и орторомбических оксидов образуют двумерные полигональные наноструктуры. Это указывает на преобладающую скорость поверхностной диффузии на плоскости кристалла с заметно низкой поверхностной энергией для этих кристаллических структур. С другой стороны, корреляции между формой наноструктуры и кристаллической структурой для исследованных нами кубических и гексагональных оксидов, по-видимому, не существует.
Для этой цели мы сначала идентифицировали кристаллические структуры MONSTR на основе рентгеноструктурного анализа (рис. S1 и S5), большинство из которых представляют собой термодинамически стабильные оксидные фазы. Затем мы разделили формы наноструктур на четыре различные категории, включая сферические, проволочные (например, провода и стержни), двухмерные многоугольные (листовидные формы, такие как пластины, диски и листы) и трехмерные многоугольные (например, кубы и пирамиды) геометрии. Гистограмма на рис. S5 сравнивает взаимосвязь между кристаллической структурой и формой MONSTR.Замечено, что большинство моноклинных, тетрагональных и орторомбических оксидов образуют двумерные полигональные наноструктуры. Это указывает на преобладающую скорость поверхностной диффузии на плоскости кристалла с заметно низкой поверхностной энергией для этих кристаллических структур. С другой стороны, корреляции между формой наноструктуры и кристаллической структурой для исследованных нами кубических и гексагональных оксидов, по-видимому, не существует. Это может быть связано с конкурирующими и более сопоставимыми скоростями поверхностной диффузии на разных кристаллических плоскостях кубических и гексагональных оксидов металлов.
Это может быть связано с конкурирующими и более сопоставимыми скоростями поверхностной диффузии на разных кристаллических плоскостях кубических и гексагональных оксидов металлов.
Кроме того, мы выполнили HWT на шероховатой цинковой пластине с помощью пескоструйной обработки и сравнили результаты с результатами относительно гладкой полированной цинковой пластины. Как показано на рис. S6, мы заметили, что ZnO MONSTR преимущественно росли на вершинах холмов, в то время как на полированной пластине рост был более равномерным. Это может быть связано с относительно большой длиной свободного пробега молекул ZnO, которая может зависеть от нескольких факторов, включая их концентрацию в воде. Концентрация молекулярного оксида может снижаться на более поздних стадиях роста ГВТ из-за ограниченного поступления ионов металлов, блокируемых оксидом, образовавшимся на более ранних стадиях.Например, на основе измерений ИК-Фурье-спектрометра (рис. S3) на образце раствора HWT с более поздних стадий роста ZnO мы наблюдали низкие концентрации ~3,28 × 10 −12 моль/см 3 , что соответствует приблизительному расстоянию ~0,4 мкм среди молекул ZnO. Такое разделение между молекулами ZnO сравнимо с особенностями поверхности от микрометра до субмикрометра на шероховатой подложке Zn. Следовательно, большая длина свободного пробега молекул оксида может привести к предпочтительному осаждению на вершинах холмов, а не в долинах из-за «эффекта затенения», который наблюдается в тонких пленках и наноструктурах, осажденных из паровой фазы 54, 55 .
Такое разделение между молекулами ZnO сравнимо с особенностями поверхности от микрометра до субмикрометра на шероховатой подложке Zn. Следовательно, большая длина свободного пробега молекул оксида может привести к предпочтительному осаждению на вершинах холмов, а не в долинах из-за «эффекта затенения», который наблюдается в тонких пленках и наноструктурах, осажденных из паровой фазы 54, 55 .
Также важно соблюдать баланс между температурой воды и растворенным кислородом во время ГВТ. Хотя при более высоких температурах воды скорость высвобождения катионов металлов в воду увеличивается из-за усиленной активации поверхности, с другой стороны, уровни растворенного кислорода снижаются. Затем это может привести к снижению уровня ионов гидроксида из-за более низкой концентрации кислорода. Следовательно, образование молекул оксидов металлов и MONSTR может быть ограничено при относительно высоких температурах воды.Другими словами, более высокие температуры HWT могут быть желательны для активации поверхности металла с образованием катионов; тем не менее, это не обязательно означает, что наноструктуры оксидов металлов будут формироваться быстрее по сравнению с более низкими температурами. Для этого может потребоваться дополнительный кислород с помощью таких средств, как продувка воды O 2 , чтобы увеличить скорость роста MONSTR. Кроме того, мы также провели эксперименты с закрытой крышкой стакана HWT, чтобы изолировать воду от окружающего воздуха и намеренно снизить уровень растворенного кислорода.Мы заметили, что образование MONSTR значительно уменьшилось, что еще раз показывает важность стадии образования оксида металла в предложенных механизмах роста, описанных выше.
Для этого может потребоваться дополнительный кислород с помощью таких средств, как продувка воды O 2 , чтобы увеличить скорость роста MONSTR. Кроме того, мы также провели эксперименты с закрытой крышкой стакана HWT, чтобы изолировать воду от окружающего воздуха и намеренно снизить уровень растворенного кислорода.Мы заметили, что образование MONSTR значительно уменьшилось, что еще раз показывает важность стадии образования оксида металла в предложенных механизмах роста, описанных выше.
Другим фактором, влияющим на образование катионов, является состояние поверхности, которое можно улучшить с помощью таких средств, как предварительная обработка кислотой. Например, мы обрабатывали Cu азотной кислотой (HNO 3 ) перед HWT и наблюдали, что критическое время образования MONSTR уменьшилось с 24 часов до 8 часов. Кроме того, предварительная обработка поверхности может увеличить количество оборванных связей, которые могут усилить стадию повторного осаждения в механизме роста MONSTR (рис. 4). Для некоторых материалов может быть достаточно простых методов предварительной обработки, таких как механическое шлифование, чтобы активировать поверхность. Мы наблюдали заметное увеличение плотности MONSTR на поверхности Zn, когда основной металл подвергался пескоструйной очистке перед HWT. С другой стороны, образование катионов может быть затруднено из-за примесей либо в объеме, либо на поверхности основного металла. Такие примеси могут действовать как инертные вещества по отношению к HWT и предотвращать реакцию воды с нижележащим металлом, или они могут быть более реакционноспособными, чем основной металл, и образовывать защитный оксидный слой сверху.
4). Для некоторых материалов может быть достаточно простых методов предварительной обработки, таких как механическое шлифование, чтобы активировать поверхность. Мы наблюдали заметное увеличение плотности MONSTR на поверхности Zn, когда основной металл подвергался пескоструйной очистке перед HWT. С другой стороны, образование катионов может быть затруднено из-за примесей либо в объеме, либо на поверхности основного металла. Такие примеси могут действовать как инертные вещества по отношению к HWT и предотвращать реакцию воды с нижележащим металлом, или они могут быть более реакционноспособными, чем основной металл, и образовывать защитный оксидный слой сверху.
Управление свойствами HWT-MONSTR, такими как размер, геометрия, разделение и кристаллическая структура, потенциально может быть достигнуто путем изменения факторов роста, описанных выше. Например, размер MONSTR можно просто контролировать с помощью времени HWT до определенного момента, когда еще есть поступление катионов из основного металла. Как обсуждалось ранее, геометрия тесно связана с кристаллической структурой. Следовательно, вопрос может заключаться в том, как мы можем контролировать кристаллическую структуру. Такие параметры, как растворенный кислород, могут влиять на тип фазы оксида металла и косвенно приводить к различным формам наноструктур.Наконец, разделение можно контролировать количеством дефектов поверхности подложки или уже существующими поверхностными неровностями, на которых MONSTR могут предпочтительно расти из-за эффекта затенения.
Как обсуждалось ранее, геометрия тесно связана с кристаллической структурой. Следовательно, вопрос может заключаться в том, как мы можем контролировать кристаллическую структуру. Такие параметры, как растворенный кислород, могут влиять на тип фазы оксида металла и косвенно приводить к различным формам наноструктур.Наконец, разделение можно контролировать количеством дефектов поверхности подложки или уже существующими поверхностными неровностями, на которых MONSTR могут предпочтительно расти из-за эффекта затенения.
Мы отмечаем, что миграция молекул оксидов металлов через воду потенциально может представлять опасность для здоровья, особенно в ситуациях, когда металлы находятся в непосредственном контакте с горячей водой. Кроме того, из-за рассмотренных выше общих механизмов роста MONSTR могут образовываться на повседневных металлических инструментах даже в присутствии неочищенной воды, что может еще больше увеличить опасные риски.С этой целью мы провели предварительные испытания медного котла, который использовался для нагрева водопроводной воды до 75 °C. Поверхность горшка была отполирована перед экспериментом, чтобы имитировать чистку скребком, которая удаляет ранее существовавший слой оксида меди и может активировать поверхность. На рисунке S7a показано СЭМ-изображение наноструктур оксида меди, которые образовались через 18 часов. Хотя эти MONSTR не очень хорошо развиты, они все же могут отрываться от поверхности горшка при повторном трении в процессе очистки, что в конечном итоге может загрязнить водные ресурсы.Другой пример, который мы рассмотрели, — алюминиевая фольга, обернутая вокруг горячей пищи. Пар, поступающий от пищи, может конденсироваться на поверхности алюминиевой фольги, образовывать каплю горячей воды и, по сути, создавать условия для образования МОНСТРА при ГВТ. На рисунке S7b показаны изображения наноструктур оксида алюминия, появившихся на поверхности алюминиевой фольги после воздействия источника пара в течение 25 минут. В таких случаях вполне вероятно, что молекулы оксидов металлов могут примешиваться к нагретой воде и потребляться человеком или животными, что требует детального исследования.
Поверхность горшка была отполирована перед экспериментом, чтобы имитировать чистку скребком, которая удаляет ранее существовавший слой оксида меди и может активировать поверхность. На рисунке S7a показано СЭМ-изображение наноструктур оксида меди, которые образовались через 18 часов. Хотя эти MONSTR не очень хорошо развиты, они все же могут отрываться от поверхности горшка при повторном трении в процессе очистки, что в конечном итоге может загрязнить водные ресурсы.Другой пример, который мы рассмотрели, — алюминиевая фольга, обернутая вокруг горячей пищи. Пар, поступающий от пищи, может конденсироваться на поверхности алюминиевой фольги, образовывать каплю горячей воды и, по сути, создавать условия для образования МОНСТРА при ГВТ. На рисунке S7b показаны изображения наноструктур оксида алюминия, появившихся на поверхности алюминиевой фольги после воздействия источника пара в течение 25 минут. В таких случаях вполне вероятно, что молекулы оксидов металлов могут примешиваться к нагретой воде и потребляться человеком или животными, что требует детального исследования.
Свойства и применение функционализированного оксида графена
Разделы статей
Введение
Растущий интерес к разработке новых типов имплантируемых и носимых электрохимических датчиков для использования в медицинских целях способствовал развитию графена и других новых материалов. Графен, открытый в 2004 году, представляет собой наноматериал на основе углерода, который принимает форму углеродного листа sp2 с атомами, расположенными в сотовой решетке, 1,2 . Он обладает высокой внутренней подвижностью, непревзойденной пластичностью и непроницаемостью, высокой теоретической удельной площадь поверхности (2630 м 2 /г для одного слоя) и замечательные возможности переноса электронов.Из-за свойств, придаваемых его двумерной структурой, графен становится высокочувствительным и селективным при функционализации линкерной молекулой, что делает его многообещающим кандидатом для множества приложений биосенсоров. 3-5
Графен может принимать различные формы, каждая со своими характеристиками: малослойный графен (FLG), 6 многослойный графен (MLG), 7 нанопластинки графена (GNP), 8 оксид графена (GO), 10-12 и восстановленный оксид графена (rGO). 9 FLG используется в датчиках, батареях и устройствах наноэлектроники, в то время как MLG и GNP известны своим применением в качестве проводящих чернил, добавок к пластмассам и смазочных материалов. rGO похож на GO, но имеет пониженное соотношение кислорода и углерода, что делает его особенно подходящим для различных химических и биосенсорных приложений.
9 FLG используется в датчиках, батареях и устройствах наноэлектроники, в то время как MLG и GNP известны своим применением в качестве проводящих чернил, добавок к пластмассам и смазочных материалов. rGO похож на GO, но имеет пониженное соотношение кислорода и углерода, что делает его особенно подходящим для различных химических и биосенсорных приложений.
Оксид графена обычно получают методом Хаммерса, 10 , который является простым и недорогим. GO продолжает вызывать большой интерес у исследователей наноматериалов из-за его высокой проводимости после восстановления, селективности после функционализации и чувствительности.Этот обзор посвящен GO, его методам функционализации и многочисленным приложениям.
Оксид графена состоит из однослойного графенового листа, ковалентно связанного с кислородными функциональными группами на базовых плоскостях и краях листа. На базисных плоскостях присутствуют как гидроксильные, так и эпоксидные группы; ребра могут включать карбоксильные, карбонильные, фенольные, лактонные и хиноновые группы. 11-14 Эти оксигенированные функциональные группы ковалентно связываются с атомами углерода в GO, создавая окисленные области sp 3 — гибридизированные атомы углерода, которые разрушают неокисленные области исходной сотовой сети sp 2 .Листы графена сами по себе имеют ограниченную растворимость в воде из-за сильных π-π-связей между слоями, поэтому GO или rGO обычно используются для биосенсорных приложений. 15 Функциональные группы, присутствующие в ГО, являются полярными, что делает его очень гидрофильным и водорастворимым, что важно для обработки и химической дериватизации. С другой стороны, эти функциональные группы на основе кислорода могут ухудшать электронные, механические и электрохимические свойства ОГ, создавая значительные структурные дефекты, снижая электропроводность и потенциально ограничивая его прямое применение в электрически активных материалах и устройствах.Однако вместо этого GO можно функционализировать, частично восстановив его до rGO с помощью различных химических или термических обработок, 15 , чтобы облегчить транспортировку носителей.
11-14 Эти оксигенированные функциональные группы ковалентно связываются с атомами углерода в GO, создавая окисленные области sp 3 — гибридизированные атомы углерода, которые разрушают неокисленные области исходной сотовой сети sp 2 .Листы графена сами по себе имеют ограниченную растворимость в воде из-за сильных π-π-связей между слоями, поэтому GO или rGO обычно используются для биосенсорных приложений. 15 Функциональные группы, присутствующие в ГО, являются полярными, что делает его очень гидрофильным и водорастворимым, что важно для обработки и химической дериватизации. С другой стороны, эти функциональные группы на основе кислорода могут ухудшать электронные, механические и электрохимические свойства ОГ, создавая значительные структурные дефекты, снижая электропроводность и потенциально ограничивая его прямое применение в электрически активных материалах и устройствах.Однако вместо этого GO можно функционализировать, частично восстановив его до rGO с помощью различных химических или термических обработок, 15 , чтобы облегчить транспортировку носителей. 16 Эта химическая модификация снижает его сопротивление на несколько порядков 17 и превращает материал в графеноподобный полупроводниковый материал.
16 Эта химическая модификация снижает его сопротивление на несколько порядков 17 и превращает материал в графеноподобный полупроводниковый материал.
Химическая функционализация — это простой способ модификации GO, который оказался чрезвычайно полезным для создания датчиков для биомедицинских, электрохимических и диагностических приложений.Реакционноспособные и модифицируемые оксигенированные функциональные группы ГО могут быть функционализированы различными электроактивными частицами. 18 Эта ковалентная функционализация определенных молекул может смягчить неспецифическое связывание, которое обычно происходит с простыми графеновыми сенсорами. Было разработано множество методов, чтобы свести к минимуму недостатки GO при одновременном повышении преимуществ качества графена. 1 Например, ковалентное связывание различных химических линкеров с GO может изменить поверхность графена и точно настроить его свойства.Тщательная функционализация GO увеличивает его проводимость, стабильность и селективность для приложений электрохимического зондирования, 1,2,18 , а также повышает его чувствительность за счет увеличения площади поверхности.
Применение функционализированного оксида графена
Применение оксида графена с использованием гидроксильной (ОН) функционализации
Гидроксильные группы, прикрепленные к базисным плоскостям листов GO, могут быть эффективными местами присоединения различных химических агентов. Например, поверхность можно модифицировать путем силанизации — процесса, при котором поверхность покрывается органофункциональными молекулами алкоксисилана.Было показано, что этот метод модификации позволяет производить углеродные наноматериалы с оптимальными химическими и физическими свойствами для изготовления проводящих пленок. 19-21
Разработка наноматериалов, обладающих сильной адсорбцией металлов и антимикробными свойствами, для экологических, 23,24 каталитических, 25-27 и биомедицинских применений 28 поставила задачу. В 2014 году Карпио и соавт. провели эксперименты по функционализации ГО с использованием этилендиаминтриуксусной кислоты (ЭДТА), сильного хелатирующего агента, для повышения многофункциональности ГО, тем самым увеличивая его адсорбцию металлов и антимикробные свойства. 22 В этом исследовании ГО функционализировали N-(триметоксисилилпропил)этилендиаминтриуксусной кислотой (ЭДТА-силан). В реакции дегидратации-конденсации гидролиз триалкоксигрупп в Si-EDTA создает группы -Si-OH, которые взаимодействуют с гидроксильными группами (OH-C) с образованием связей Si-O-C. По сравнению с ГО, ГО-ЭДТА демонстрирует улучшенные антимикробные характеристики с увеличением инактивации клеток B. subtilis (грамположительных) и C на 10,1% и 7,1%.metallidurans (грамотрицательные) соответственно. GO-EDTA также демонстрирует максимальную адсорбционную способность для Cu 2+ и Pb 2+ , которая превышает способность традиционных адсорбирующих материалов. Кроме того, после 24-часового воздействия на линии эпителиальных клеток роговицы человека ГО-ЭДТА проявляет минимальную токсичность в отношении клеток человека, поскольку 99% клеточной культуры остаются жизнеспособными. Это делает GO-EDTA перспективным углеродным наноматериалом для будущих клинических применений.
22 В этом исследовании ГО функционализировали N-(триметоксисилилпропил)этилендиаминтриуксусной кислотой (ЭДТА-силан). В реакции дегидратации-конденсации гидролиз триалкоксигрупп в Si-EDTA создает группы -Si-OH, которые взаимодействуют с гидроксильными группами (OH-C) с образованием связей Si-O-C. По сравнению с ГО, ГО-ЭДТА демонстрирует улучшенные антимикробные характеристики с увеличением инактивации клеток B. subtilis (грамположительных) и C на 10,1% и 7,1%.metallidurans (грамотрицательные) соответственно. GO-EDTA также демонстрирует максимальную адсорбционную способность для Cu 2+ и Pb 2+ , которая превышает способность традиционных адсорбирующих материалов. Кроме того, после 24-часового воздействия на линии эпителиальных клеток роговицы человека ГО-ЭДТА проявляет минимальную токсичность в отношении клеток человека, поскольку 99% клеточной культуры остаются жизнеспособными. Это делает GO-EDTA перспективным углеродным наноматериалом для будущих клинических применений.
В другом исследовании использовалась ЭДТА для функционализации rGO путем создания композита rGO-EDTA, взвешенного в растворе нафион-этанол. 29 Пленка rGO-EDTA/Nafion была затем нанесена на электрод из стеклоуглерода (GC), и это устройство rGO-EDTA могло обнаруживать дофамин (DA) посредством окисления.
Ху и др. исследовали силанизацию, восстановление, силанизацию в сочетании с восстановлением и сополимеризацию на месте в качестве методов функционализации GO с целью улучшения прочности на разрыв и растворимости. 30 Гидроксильные группы на оксиде графена и листах rGO силанизировали 3-метакрилоксипропилтриметоксисиланом (MPS, кат.№ 440159) 34 (рисунок 1). Испытания водной суспензии для GO, rGO, MPS-GO и MPS-rGO показали, что MPS-GO и MPS-rGO обладают повышенной растворимостью в воде. Ху и др. затем производные GO и rGO функционализировали поли(метилметакрилатом) (кат. №№ 182230, 200336, 445746 и 182265, ПММА) путем сополимеризации in situ для улучшения механических свойств полимера.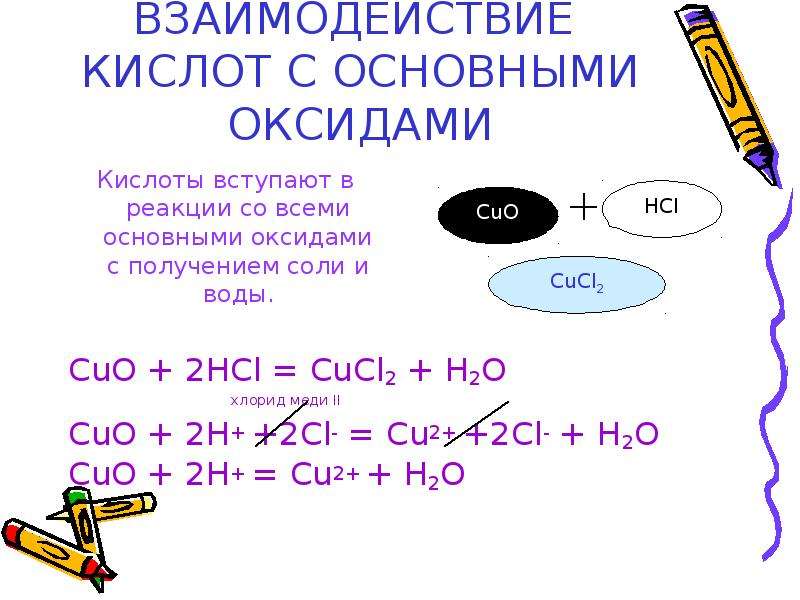 Композиты MPS-rGO/PMMA имели на 30% большую прочность на растяжение по сравнению с исходным PMMA из-за стабильной дисперсии нанолистов в полимерной матрице, которая увеличивала межфазную прочность, что указывает на потенциал для будущего промышленного применения. 30
Композиты MPS-rGO/PMMA имели на 30% большую прочность на растяжение по сравнению с исходным PMMA из-за стабильной дисперсии нанолистов в полимерной матрице, которая увеличивала межфазную прочность, что указывает на потенциал для будущего промышленного применения. 30
границ | Кислородные дефекты и химия поверхности восстанавливаемых оксидов
Введение
Учитывая экологические и политические проблемы, создаваемые зависимостью от ископаемого топлива, в сочетании с вероятным сокращением запасов нефти, в частности, поиск новых возобновляемых источников энергии и химических веществ становится все более важным. Для решения этой проблемы были предприняты значительные усилия по диверсификации наших источников энергии, особенно для транспортного сектора, и, таким образом, указать путь к поиску более чистых источников энергии.Однако альтернативные виды топлива доступны не везде, и в одном регионе может отдаваться предпочтение этанолу, а в другом — биодизелю, бензину или метанолу. Кроме того, для эффективной работы большинства видов топлива требуются различные технологии двигателей. Однако водород в принципе может быть получен из различного сырья и является побочным продуктом вышеупомянутых альтернативных видов топлива, а также многих других, т. е. являясь перспективным альтернативным и универсальным топливом (Holladay et al., 2009).
Кроме того, для эффективной работы большинства видов топлива требуются различные технологии двигателей. Однако водород в принципе может быть получен из различного сырья и является побочным продуктом вышеупомянутых альтернативных видов топлива, а также многих других, т. е. являясь перспективным альтернативным и универсальным топливом (Holladay et al., 2009).
Преобразование более крупных молекул, присутствующих в биодизельном топливе или нефтехимических производных, в водород включает несколько стадий, которые необходимо тщательно контролировать для получения желаемого продукта.Таким образом, использование катализаторов в сложных и многостадийных реакциях имеет основополагающее значение для облегчения процесса (Trane et al., 2012). Процесс преобразования сложных молекул в H 2 включает отдельные стадии окисления и восстановления. Следовательно, желаемый катализатор должен проявлять эту двойственность. Катализатор не только очень активен, но и должен легко изготавливаться, а также обладать высокой стабильностью и длительным сроком службы. В этом контексте оксидные катализаторы могут широко использоваться в качестве многообещающей альтернативы для удовлетворения этих жестких требований.До использования в катализе восстанавливаемые оксиды широко использовались в области физики сверхпроводников и спинтроники из-за их превосходной ионной подвижности при высоких температурах (Barcaro and Fortunelli, 2019). По словам профессора Мисоно: «Катализатор можно назвать каталитическим преобразователем только тогда, когда он катализирует какую-то полезную для практики и общества реакцию». Он утверждает, что «развитие катализаторов на основе смешанных и восстанавливаемых оксидов может стать ключом к развитию каталитических технологий» (Misono, 2005).Улучшение каталитических характеристик восстанавливаемых оксидов вызвало значительный интерес со стороны научного сообщества с целью лучшего понимания их механизмов и электронных структур на наноуровне.
В этом контексте оксидные катализаторы могут широко использоваться в качестве многообещающей альтернативы для удовлетворения этих жестких требований.До использования в катализе восстанавливаемые оксиды широко использовались в области физики сверхпроводников и спинтроники из-за их превосходной ионной подвижности при высоких температурах (Barcaro and Fortunelli, 2019). По словам профессора Мисоно: «Катализатор можно назвать каталитическим преобразователем только тогда, когда он катализирует какую-то полезную для практики и общества реакцию». Он утверждает, что «развитие катализаторов на основе смешанных и восстанавливаемых оксидов может стать ключом к развитию каталитических технологий» (Misono, 2005).Улучшение каталитических характеристик восстанавливаемых оксидов вызвало значительный интерес со стороны научного сообщества с целью лучшего понимания их механизмов и электронных структур на наноуровне.
В этом обзоре будет представлено краткое обсуждение восстанавливаемых оксидов на основе материалов, имеющих двумерную (2D) структуру, а также их образование, миграция и димеризация вакансий. Также будет рассмотрено потенциальное использование этих передовых материалов для производства водорода из биомассы и бионефти, а также в реакции замещения газа водой и предпочтительном окислении CO.
Что такое восстанавливаемые оксиды?
Восстанавливаемые оксиды представляют собой твердые материалы, на которые сильно влияет обратимое состояние окисления металла. Благодаря обратимости эти материалы перспективны для хранения и выделения кислорода, а также для огромного разнообразия каталитических процессов. Установлено, что уменьшение степени окисления металла происходит при потере кристаллом атома кислорода и образовании вакансии. Кроме того, также было замечено, что уменьшение размера частиц теоретически может повысить стабильность металла во многих его применениях (Van Santen et al., 2015). Это ключевое явление схематично показано на рисунке 1А.
Рис. 1. (A) Иллюстрация образования вакансий на поверхности церия; (B) Фазовая диаграмма кривых перехода кристаллической структуры в присутствии O 2 , полученная методом DFT (MV, средний вакуум; HV, высокий вакуум; VHV, очень высокий вакуум; и UHV, сверхвысокий вакуум ) и (C) Схема образования вакансии и ее влияния на электронные уровни восстанавливаемого оксида (адаптировано из Esch et al., 2005; Сан и др., 2012; Пайер и др., 2013).
Термодинамически любой оксид восстанавливаем (Swartz, 2002), но кислородные вакансии представляют собой дефекты, преимущественно образующиеся при низких парциальных давлениях кислорода и высоких температурах. Следовательно, различие между приводимым и неприводимым обычно связано с необходимыми условиями для образования вакансии. Для восстанавливаемых оксидов эти условия (например, температура и давление) являются умеренными и технически достижимыми, в то время как соответствующие условия, необходимые для образования вакансий в невосстанавливаемых оксидах, теоретически достичь труднее (Swartz, 2002; Schaub et al. ., 2003; Уолстро и др., 2004). Чтобы проиллюстрировать эти условия, Paier et al. (2013) использовали структуру теории функционала плотности (DFT) для исследования CeO 2 (111), TiO 2 (110), Al 2 O 3 (0001) и MgO (001). Результаты их расчетов воспроизведены на рисунке 1B.
Из анализа рисунка 1В становится ясно, что две оксидные поверхности можно считать «восстанавливаемыми», CeO 2 (зеленый) и TiO 2 (синий), поскольку достижимы условия, необходимые для термодинамически благоприятной восстановимости.Однако для Al 2 O 3 и MgO эти условия достаточно экстремальны и поэтому обычно считаются неприводимыми (Barcaro, Fortunelli, 2019). Таким образом, необходимые условия для возникновения сложных дефектов были широко исследованы, где одни авторы идентифицировали образование температурных дефектов (Namai et al., 2003a,b), а другие наблюдали образование вакансий только выше 400°C (Esch и др., 2005). Вероятно, образование кислородных вакансий зависит от многих факторов, в том числе от природы анализируемого оксида, его чистоты, анализа поверхности, условий синтеза, а также статуса легирования.Можно наблюдать вакансии при обычной комнатной температуре с высокой степенью «примесей», способствующих вакансионному образованию. Эти факторы будут дополнительно обсуждаться в следующих разделах. Среди различных приводимых оксидов мы особенно заинтересованы в Tio 2 , генеральный директор 2 , ZRO 2 , V 2 O 5 , FEO x , Pro 2 , SMO x , COO x , MNO x , MNO x , V 2 o 5 , Moo 3 и WO 3 и более сложные твердые вещества, такие как BATIO 3 , LACOO 3 , а также HFSIO X (Livage, 2010; Paier et al., 2013; де Кастро и др., 2017).
Электронная структура
Миграция электронов из кислородных 2p-орбитальных состояний в валентной зоне (VB) в зону проводимости (CB) (рис. 1C) возможна только в том случае, если энергия между ними (запрещенная зона) относительно мала, в видимой и частота ультрафиолетового излучения. Например, восстанавливаемые оксиды обычно образуются металлами, которые содержат наполовину заполненные d- и f-орбитали, также вероятно, что такие соединения образуют смесь ковалентных или ионных связей.Для Ce это 4f-орбитали; 3d-орбитали для Ti и V; и 4d для Zr. В оксидах, считающихся невосстанавливаемыми, d- и f-орбитали обычно незаняты (например, Mg и Al), что, вероятно, образует большую запрещенную зону, что делает промежуточную и термодинамическую миграцию электронов с высокой энергией неблагоприятной (Esch et al., 2005). ). Однако эти современные вычислительные методологии привели к заметному прогрессу в области катализа (Seh et al., 2017). Таким образом, компьютерный дизайн катализатора играет все большую роль в разработке устойчивых наноразмерных сложных материалов следующего поколения и, как правило, находится в авангарде научных исследований в области катализа.
Откуда берутся вакансии?
Энергетические потребности для образования вакансий в восстанавливаемых оксидах относительно низки по сравнению с другими материалами и являются термодинамически благоприятными при высоких температурах и низких парциальных давлениях кислорода (Rasmussen et al., 2004; Esch et al., 2005; Zhou и др., 2008; Пайер и др., 2013). Во всех случаях ожидается, что образование вакансий термодинамически более выгодно на террасах и поверхностях, чем внутри объема оксида.Другими словами, образованию поверхностных вакансий способствует больший межатомный потенциал (потенциал между двумя телами, возникающий из-за стерического отталкивания ионов) внутри оксида (Nolan et al., 2006). Координационное число экспонируемой поверхности экспонирования меньше, чем внутри сетки, т. е. способствует формированию значительного количества поверхностных дефектных состояний. Следовательно, поверхности с меньшими координационными числами благоприятствуют образованию дефектов. Эш и др. (2005) наблюдали за образованием кислородных вакансий в CeO 2 (111) с помощью сканирующей туннельной микроскопии (СТМ), и полученные изображения показаны на рисунке 2.
Рисунок 2 . СТМ-изображения кислорода в фасетке CeO 2 (111) (адаптировано из Esch et al., 2005).
По этим результатам в принципе можно наблюдать наличие подповерхностных вакансий (синие треугольники) и вакансий типа «гантели» или тримеров (красные треугольники). В нижней части рисунка 2 приведена схема упорядочения атомов кислорода и церия в каждом типе вакансии. Образование вакансий происходит в подповерхностном слое (второй слой), потому что эти атомы металла восстанавливаются, а самый внешний слой состоит в основном из атомов кислорода.Однако, когда обычно образуется вакансия, она обнажает два атома Ce 3+ и один атом Ce 4+ , который меньше, чем Ce 3+ . Из-за размера увеличивается общая мощность сети. После образования волна становится положительным центром, который притягивает электроотрицательные частицы, такие как O 2 . Как правило, когда они притягиваются, дефект устраняется, и путем хемосорбции на поверхность добавляется O 2 . Эта химическая адсорбция и миграция дефектных состояний на поверхности TiO 2 показаны на рисунке 3.
Рисунок 3 . Подвижность кислородных вакансий на поверхности TiO 2 . Изображения СТМ (слева) и схематическая диаграмма (справа) (адаптировано из Campbell, 2003; Schaub et al., 2003). На левых изображениях каждое число символизирует микроскопию отдельной области. Каждое число показывает два микроскопических изображения, первое до движения и второе после движения.
Другим явлением, ответственным за образование вакансий, является термин энтропийная стабилизация, который появится для поверхностей с большим количеством пустот, обычно получаемых путем удаления части ионов на полярном конце, чтобы зарядить слой до нуля.В целом поверхности восстанавливаемых оксидов сильно разупорядочены на наноуровне (Capdevila-Cortada and López, 2017; Mora-Fonz et al., 2017).
После адсорбции на поверхности один атом в молекуле кислорода может рекомбинировать (и снова образовать О 2 ) с тем же атомом кислорода или с соседним атомом кислорода. Таким образом, в этой перспективе вакансии становятся подвижными и могут занимать любое место на поверхности сети, поскольку энергия в любой точке поверхности (при условии чистой поверхности) одинакова (Campbell, 2003; Schaub et al., 2003; Эш и др., 2005). Приобретя определенную подвижность, вакансии стремятся занять низкоэнергетические пространства, т. е. области, где полная энергия сетки минимальна. Ранее упоминалось, что при образовании вакансии два атома металла обнажаются и один атом металла находится в исходной степени окисления. При димеризации эти скопления вакансий обнажают только восстановленные атомы металла без искажений в кристаллической решетке и поэтому являются термодинамически более выгодными.Явление димеризации вакансий и обнажения восстановленных атомов металла в этих димерах показано на рис. 4.
Рисунок 4 . Димеризация кислородных вакансий в фасете CeO 2 (111) (A) СТМ-изображение (B) Соответствующая структурная модель (адаптировано из Esch et al., 2005).
В интересном исследовании Esch et al. (2005) использовали СТМ в разное время для образцов CeO 2 , подвергнутых воздействию температуры 900°C в вакууме, и изображения показаны на рисунке 5.Из рис. 5 видно, что с увеличением времени выдержки в условиях 900°С наблюдается увеличение количества вакансий, особенно в виде димеров. В частности, со временем количество вакансий стабилизировалось, а структура уравновешивалась. Брайант и др. (2011) показали, что на поверхности PrSr 2 Mn 2 O 7 присутствуют вакансии и пики, образованные при адсорбции кислорода. Следовательно, адсорбированные атомы кислорода называются адатомами (ад = адсорбированный и атом = атом).Иллюстративная схема этого сценария показана на рисунке 6А.
Рисунок 5 . Рост кислородных вакансий в CeO 2 (111). (A) 1 мин и (B) 5 мин выдержки при 900°C (адаптировано из Esch et al., 2005).
Рис. 6. (A) Схема топографии поверхности обычного восстанавливаемого оксида с соответствующими адатомами и вакансиями. (B,C) Микроскопии (СТМ) с разницей в 1 мин, показывающие рекомбинацию между аденомами и вакансиями (адаптировано из Bryant et al., 2011).
Брайант и др. (2011) также выполнили STM, чтобы контролировать поведение вакансий, которые показаны на рисунках 6B, C.
На рисунках 6B,C показана рекомбинация между вакансией и адатомом с образованием «плоского» участка на PrSr 2 Mn 2 O 7 . Эта рекомбинация показывает, что возможно повторное введение кислорода в восстанавливаемую оксидную структуру, а также придание циклической способности к восстановлению (образование вакансии) и возврату в исходное состояние (ревключение кислорода в структуру).Применение циклических способностей этих материалов будет дополнительно рассмотрено ниже. Оксиды, помимо кислородных вакансий, могут также содержать в своей кристаллической структуре межфазные дефекты, называемые также плоскими или линейными дефектами (Callister, Rethwisch, 2012). Например, к таким несовершенствам относятся внешние поверхности, контуры зерен, контуры фаз, контуры краев и дефекты упаковки. Примечательно, что граница зерен имеет различную кристаллографическую ориентацию и обычно представляет собой контуры, которые естественным образом имеют два измерения, которые также разделяют материалы.Таким образом, существует межфазная или зернограничная энергия, аналогичная поверхностной энергии (которая зависит от открытой поверхности и направления роста). Следовательно, величина этой энергии обусловлена степенью дезориентации, которая более значительна для большеугловых контуров, тогда как границы зерен теоретически более реактивны (Callister, Rethwisch, 2012). Также, естественно, атомы примесей, внедренные в материал-хозяин, часто сегрегируют в контурах (т. е. из-за их более высоких энергетических уровней).В этом случае межфазная энергия, в свою очередь, меньше в материалах с более крупными или крупными зернами именно из-за границ зерен. Однако с этой точки зрения, несмотря на беспорядочное расположение атомов и отсутствие регулярной связи по контурам зерен, поликристаллический материал очень устойчив, вероятно, из-за того, что в контурах и через них присутствуют когезионные силы (Callister and Rethwisch, 2012).
Тем не менее, многие недавние исследования показали, что передовые материалы, содержащие зернограничные дефекты высокой плотности, могут создавать новые и уникальные функциональные возможности для огромного разнообразия возникающих приложений (Guo and Waser, 2006; Lee et al., 2012). Например, в исследовании, проведенном Feng et al. (2016), дают представление о том, что количество кислородных вакансий, присутствующих в материалах CeO 2 в том виде, в котором они были приготовлены, в значительной степени зависит от структуры зернограничных дефектов и, следовательно, является ключевым фактором для выяснения их каталитического наномасштабного поведения.
Добавление легирующих добавок и формирование вакансий
Знаменитая цитата Аристотеля «вещество ведет себя не так, как его компоненты» как нельзя лучше подходит под этот подпункт. При добавлении примесей к восстанавливаемому оксиду добавляется другой металл («примесь»), увеличивающий энтропию системы за счет разрушения кристаллической решетки и уменьшения энергии, необходимой для образования вакансий.Таким образом, невосстанавливаемые оксиды могут стать восстанавливаемыми при соответствующем легировании. Следовательно, с этой точки зрения основным эффектом образования вакансий после добавления легирующей примеси в структуру является сохранение груза. Например, добавление примеси 3+ в структуру сетки, образованной атомами в состоянии 4+, приведет к образованию вакансии (выход ½ O 2 ) на каждые два добавленных атома примеси 3+. Однако хорошо известно, что образование вакансий в легированных сложных оксидах также зависит от размера легирующих и кулоновских взаимодействий, которые определяются степенью окисления легирующего металла и его поляризуемостью.Восстановлению металла способствует, когда присадка, добавленная в структуру, проявляет характеристики, аналогичные характеристикам восстановленного металла. Когда легирующая примесь вводится с радиусом, большим, чем у окисленного объемного металла, металл будет уменьшаться, увеличивая его размер, уменьшая искажение сетки, что минимизирует сеть. Параллельно энергия образования вакансии уменьшается с увеличением ионного радиуса добавляемой легирующей примеси, что показано на рисунке 7А.
Рис. 7.(A) Ce 4+ /Ce 3+ энергия восстановления (расчетная → сплошная линия; экспериментальная → пунктирная линия) в зависимости от состава примеси и (B) Ce 4+ /Ce 3+ Энергия восстановления (расчетная → сплошная линия; экспериментальная → пунктирная линия) в зависимости от состава легирующей примеси (адаптировано из Trovarelli and Fornasiero, 2013).
Из рисунка 7А видно, что увеличение ионного радиуса легирующей примеси влияет на общую энергию экранирования (энергию, необходимую для образования вакансионного типа).Однако с увеличением размера атома легирующей примеси (Gd → La), в частности, увеличивается энергия экранирования. Другим важным фактором, как показано на рис. 7, является надежность прогнозных расчетов поведения легированных металлом сплавов. Хотя точности не хватает, общий тренд кривой прослеживается для расчетной и эмпирической моделей. Кулоновские взаимодействия в целом зависят от поляризуемости каждого иона и общей поляризации. Таким образом, для образования вакансий необходимы более сильные взаимодействия и расположение с более низкой энергией.Эффект поляризуемости показан на рисунке 7B, изображающем уменьшение энергии восстановления (образование вакансии) с увеличением концентрации примесей Th и Zr. Следовательно, уменьшение энергии восстановления при легировании Th более выражено из-за его большего ионного радиуса и поляризуемости. Кроме того, хорошо известно, что двумерные структуры церия могут быть получены с использованием различных доступных способов синтеза (Umar et al., 2015; Song et al., 2017; Li et al., 2018). В этом контексте Ли и соавт.(2018) сообщили о возможности получения оксида церия с формами наночешуек с более активными плоскостями путем легирования кобальтом с использованием гидротермального метода в качестве стратегии. Согласно данным РФА, в частности, легированный продукт имел кубическую структуру флюорита, относящуюся к группе Fm-3M (№: 225) с a = 5,41134 Å (Morris et al., 1964). Они сообщили, что система Co-CeO 2 обладает превосходной каталитической активностью в отношении удаления Hg 0 . В частности, Hg 0 окисляется активными формами кислорода легированной матрицы-хозяина, которые были связаны с кислородными дефектами, возникшими в решетке CeO 2 (Li et al., 2018). При этом хорошо известно, что такие виды обладают высокой подвижностью. Оптические отклики широко применяются для выявления структурных дефектов во многих материалах (Kripal et al., 2011; Wang et al., 2013; Liu et al., 2014). Например, ионы Eu(III) обычно используются для изучения локальной структуры различных материалов (Montini et al., 2009; Tiseanu et al., 2014). Предполагается, что интенсивный переход 5 D 0 → 7 F 0 ионов Eu(III) может быть использован в основном в этом контексте для дифференциации его предпочтительности включения в объем и на поверхность матрицы-хозяина. (Монтини и др., 2009), как показано на рисунке 8A. Параллельно для наночешуек CeO 2 наблюдался один хорошо выраженный пик поглощения в УФ-видимой области при 344 нм (см. рис. 8B). Из характеристики образца методом комбинационного рассеяния света можно было заметить, что доминирующий пик при 464 см −1 относится к характеристической полосе CeO 2 и соответствует активной моде F 2g CeO 2 кубическая структура (см. рис. 8D) (Lu et al., 2010; Liu et al., 2011). Остальные четыре слабые рамановские моды (377, 429, 550 и 593 см −1 ) характеризуют структурный беспорядок в решетке CeO 2 (Grower et al., 2008; Araújo et al., 2012; Aškrabiać et al., 2012). Для изучения подвижности кислорода О 2 -ТПД был испытан при различных температурах. На рисунке 8C показано, что чистые пики CeO 2 при 200–300 и 400–650°C были приписаны поверхностному кислороду, слабо связанному с поверхностью, и химически адсорбированным формам кислорода на вакансиях, соответственно (Jiang et al., 2015). По сравнению с чистым CeO 2 повышенная химическая адсорбция O 2 между 100 и 500°C Co-CeO 2 позволяет предположить, что он имеет более эффективную активацию на своей поверхности из-за увеличения количества кислородных вакансий (Zheng et al. др., 2016). В результате эти структурные дефекты ответственны за создание новых промежуточных уровней внутри запрещенной зоны, которые могут быть более активными местами для многих реакций. Таким образом, фотокаталитическую активность нанохлопьев CeO 2 оценивали по разложению красителя DR-23 под действием УФ-облучения (Umar et al., 2015). Предлагаемый механизм представлен на рисунке 8E и согласуется с литературой (Umar et al., 2015).
Рис. 8. (А) УФ-видимый спектр УФ-видимый спектр СеО 2 нанохлопьев, (Б) Спектр комбинационного рассеяния приготовленного СеО 2 нанохлопьев, (В) O 41 2 2 Профили -TPD чистого CeO 2 и Co-CeO 2 (D) CeO 2 элементарной ячейки и (E) Графическое представление механизма фотокаталитического разложения DR-23 под действием УФ-света облучение (адаптировано из Umar et al., 2015; Ли и др., 2018).
Металлы на оксидах
Использование металлов, нанесенных на восстанавливаемые оксиды, становится все более популярным для развития гетерогенного катализа. Высокая каталитическая конверсия, циклический потенциал и доступность этих катализаторов вызвали значительный интерес со стороны исследователей в промышленности и научных кругах (Rodríguez and Hrbek, 2010). Носители на основе смешанных оксидов широко используются для катализа (особенно выделяются CeO 2 и TiO 2 ) благодаря их относительно большой площади, термической стабильности и их функции носителя и каталитического промотора.Система «восстанавливаемый оксид + металл-донор электронов» часто использовалась в литературе и в различных формах (рис. 9). Поверхность раздела между оксидом и металлом является наиболее активным каталитическим центром в этих материалах и называется «зоной горячей точки».
Металл-донор электронов действует как стимулятор образования вакансий, а с другой стороны, оксид может отдавать электроны (противоположное направление восстановления) металлу. Эта система «оксид + металл» активна в окислительных и окислительно-восстановительных реакциях (Вайсилов и др., 2011). Пример образования вакансии в восстанавливаемых оксидах при добавлении доноров электронов показан на рис. 10. При добавлении Cu к CeO 2 интенсивность пика около 533 эВ уменьшилась по сравнению с пиком при 530,5 эВ. Поэтому компонент с захваченными электронами O1s обычно связывают с наличием вакансий (Hardacre et al., 1995). Таким образом, добавление металлов-доноров способствует образованию вакансий за счет донорства электронов. С другой стороны, взаимодействие между металлом и оксидом зависит от размера структур.Эти материалы имеют большую площадь на единицу массы, и образование вакансий происходит преимущественно на поверхности, вызывая снижение энергии. В дополнение к большой площади поверхности наноструктурированные материалы способствуют большему взаимодействию между металлами-донорами электронов, легирующими добавками и восстанавливаемым оксидом, образуя дополнительные «горячие точки» (Migani et al., 2010; Vayssilov et al., 2011).
Рисунок 10 . Спектр XPS O1 и влияние легирования медью на церий (адаптировано из Aranda et al., 2012).
Взаимодействие с кислородом
Понимание механизма взаимодействия молекул кислорода с восстанавливаемыми оксидными поверхностями имеет решающее значение для понимания оксидных катализаторов. Образовавшиеся вакансии взаимодействуют с молекулами O 2 (см. рис. 11), образуя на поверхности частицы пероксо [MOOM], которые являются чрезвычайно реакционноспособными и сильными окислителями (Paier et al., 2013).
Рисунок 11 . Два типа связывания на поверхности: (а) супероксо-η1, (б) супероксо-μ, (в) η2-пероксо, (г) μ-пероксо и (д) трапециевидно-пероксо (адаптировано из Wagnerová and Lang, 2011).
Из-за увеличения расстояния связи по сравнению с O 2 , а также соответствующего смещения частоты растяжения O-O, супероксо и пероксо, поверхностные частицы могут быть экспериментально идентифицированы с помощью колебательной (инфракрасной или рамановской) спектроскопии. Следовательно, энергия адсорбции различных видов кислорода поверхностью металла (как показано на рисунке 11) изменяет динамику отдачи кислорода и его повторного включения, что влияет на скорость реакции для каждого материала (Paier et al., 2013).
Электрохимическое потенциальное использование
При применении фотогальванической солнечной энергии, поскольку она широко распространена, такие устройства в принципе могут обеспечивать более устойчивую чистую, зеленую энергию без токсичных или опасных газов (Nunes et al., 2018). Количество разработанных материалов для этих приложений значительно увеличилось за последние годы, что изменило общую стоимость этой технологии, вероятно, из-за быстрого повышения эффективности, а также простоты изготовления этих устройств.Например, фотоэлектрические устройства на основе кремния можно рассматривать в настоящее время как основной фотоэлектрический материал, используемый сегодня, преобладающий на фотоэлектрическом рынке с высокой эффективностью преобразования мощности (PCE) до 27,6%, однако, он имеет высокую стоимость производства (Glunz et al., 2012; Национальная лаборатория возобновляемых источников энергии, 2019; Velilla et al., 2019). Однако тонкопленочные солнечные элементы на основе материалов, родственных перовскиту, также находятся в стадии интенсивного изучения, поскольку эти устройства обычно демонстрируют PCE в диапазоне от 10 до 25%.Совсем недавно было широко принято несколько стратегий разработки фотоэлектрических устройств следующего поколения, особенно на основе новых материалов (Protesescu et al., 2015; Brenner et al., 2016; Manser et al., 2016; Saliba et al. ., 2016). Эти новые новые материалы химически и термически стабильны и обладают невероятным потенциалом для многих применений, а в некоторых случаях могут быть широко совместимы с огромным разнообразием недорогих производств (Masi et al., 2018; Nunes et al., 2018; Fernandes). и другие., 2019; Рамирес и др., 2019). Однако химический состав таких новых материалов еще очень мало изучен, что в принципе может быть интересным вариантом для появления многих технологий.
В конце концов, если рассматривать эволюцию солнечных элементов с наиболее выдающимися достижениями, то они также включают в себя солнечные элементы, сенсибилизированные красителем (DSSC), которые играли заметную роль в прошлом, но остаются очень важными для фотогальванических технологий (O’Regan and Gratzel, 1991). ; Wang et al., 2006; Gong et al., 2017). В DSSC, в частности, мезопористый оксид металла в основном на основе TiO 2 с ПЭК < 8% (Sharma et al., 2017). Тем не менее, многие другие оксиды также могут использоваться для применения в DSSC, которые интегрируются в устройства, закрепленные на красителе, помещаются между двумя стеклянными проводящими пластинами в присутствии электролита, который обычно представляет собой окислительно-восстановительную систему (Polman et al., 2016; Sharma и др., 2017; да Фонсека и др., 2018). В основном, привлекая внимание к применению DSSC, когда молекулы красителей (также известные как фотосенсибилизаторы) захватывают фотоны солнечного света.Следовательно, фотоэлектроны перемещаются непосредственно с НСМО (низшей незанятой молекулярной орбитали), которая является возбужденным состоянием красителя (жидкий окислительно-восстановительный электролит, обычно I − / I 3− неводный раствор), в CB полупроводникового материала в качестве электроноселективного контакта и, следовательно, диффундирует к проводнику электрода (da Fonseca et al., 2018; Nunes et al., 2018). Следовательно, ионизированные молекулы красителя, в свою очередь, восстанавливаются за счет восстанавливаемого оксидного заряда электролита.Кроме того, в этом процессе краситель регенерируется электрохимически (Nunes et al., 2018).
Восстанавливающие оксиды, применяемые в катализе
Огромная универсальность оксидных материалов обеспечивает широкий спектр технологических применений, включая катализ, датчики, электрохимию, накопление энергии, фотохимическое преобразование энергии и топливные элементы (Seh et al., 2017). При обсуждении использования восстанавливаемых оксидов в катализе следует упомянуть их использование для хранения кислорода, контроля выбросов в дизельных двигателях, окисления углеводородов, трехкомпонентных катализаторов и производства водорода.Производство водорода может быть достигнуто с использованием нескольких источников, включая биомассу и бионефть, а также с помощью таких реакций, как замещение газа водой (конверсия водяного газа) и предпочтительное окисление CO (Prox) (Trane et al., 2012).
Производство водорода из биомассы
Биомасса – это органическое вещество (неископаемое) животного или растительного происхождения, которое можно использовать в качестве источника энергии. Общие примеры включают солому, жмых, рисовую шелуху, опилки, древесную щепу, брикеты и растительные масла (биодизель) (Barandas, 2009).Биомасса была первым источником энергии, использованным человечеством, и ее использование может уменьшить мировую зависимость от нефти. Биомасса может быть получена из сельскохозяйственных, промышленных и бытовых отходов во многих формах. Прямое использование биомассы в качестве источника энергии неблагоприятно для биомассы с низкой теплотворной способностью. Поэтому давно разработаны реакции с участием H 2 и CO (так называемый синтез-газ) (de Lasa et al., 2011). Реакции с участием биомассы обычно проводят путем газификации ее компонентов при нагревании, что способствует образованию газовой фазы, состоящей из Н 2 , СО, СО 2 , СН 4 , смолы (бензол и другие ароматические соединения) , водяной пар, твердые отходы (кокс) и жидкости (бионефть).Первые используемые катализаторы (и, возможно, наиболее часто используемые на сегодняшний день) основаны на таких материалах, как Al 2 O 3 , доломит (CaMg(CO 3 ) 2 ), оливин ((Mg, Fe) 2 SiO 4 ) и оксиды щелочных металлов. Сложность этих реакций и быстрая дезактивация, вызванная высокой концентрацией углерода, приводят к короткому сроку службы этих катализаторов (de Lasa et al., 2011; Trane et al., 2012). Сложные реакции с высоким содержанием углерода и образованием кокса включают стадии как восстановления, так и окисления, и восстанавливаемые оксиды были предложены в качестве жизнеспособных альтернативных катализаторов.Согласно Ламачу и соавт. (2011), восстанавливаемые оксиды разлагают компоненты биомассы, используя свои вакансии, но добавление доноров металлов увеличивает образование H 2 и CO. Авторы предположили, что ассоциация между восстанавливаемыми оксидами и электронодонорными металлами (такими как Ni, Au, Pt и Pd) являются наиболее перспективными системами для этих реакций. де Ласа и др. (2011) рассмотрели использование различных носителей (a-Al 2 O 3 , γ-Al 2 O 3 , SiO 2 , MgO, CeO 2 2 0 и TiO ) для паровой конверсии биомассы с никелем в качестве металла-носителя.Оксиды церия и титана показали одинаковую эффективность преобразования во время начальных циклов, но отложили лишь меньшее количество кокса (нагара) на поверхности. Вакансии способствовали большему взаимодействию с кислородом и способствовали окислению углеродных отложений (de Lasa et al., 2011). Таким образом, оксидные носители показали лучшие характеристики в течение многих циклов и более пригодны для длительного использования.
Производство водорода из бионефти
Как упоминалось ранее, в процессе газификации биомассы образуются газообразные, жидкие и твердые продукты.Жидкий продукт газификации имеет темно-коричневый цвет и называется бионефтью. Бионефть состоит из сложной смеси органических соединений и мелких неорганических фракций. Чтобы проиллюстрировать состав бионефти, в Таблице 1 перечислены основные компоненты и их содержание.
Таблица 1 . Химический состав бионефти.
Таблица 1 показывает, что бионефть в основном содержит воду и лигнин. Однако присутствие альдегидов, кислот, карбоновых кислот, спиртов и кетонов составляет 45% бионефти.Так, в большинстве исследований риформинга бионефти используется водная фракция бионефти, содержащая уксусную кислоту (Basagiannis and Verykios, 2006, 2007; Vagia and Lemonidou, 2008), ацетол (Barandas et al., 2011; Dubey and Vaidya , 2012) и этанол (Song et al., 2010; Ávila-neto et al., 2012; Soykal et al., 2012). Однако основная проблема риформинга бионефти связана с катализаторами, которые требуют высокой активности, селективности в отношении H 2 и высокой стабильности. Разнообразие реакций, необходимых для превращения кислородных соединений, присутствующих в бионефти, показано на рисунке 12.
На рис. 12 показано количество стадий (дегидратация, дегидрирование, гидрирование, а также разрыв связей СС и СО), вовлеченных в превращение комплексных молекул в Н 2 , СО и СО 2 . Для риформинга биомассы катализаторы на основе восстанавливающих оксидов весьма перспективны, учитывая количество и сложность образующихся фаз. Эти стадии, описанные на рисунке 10, включают донорные и акцепторные центры электронов, и подвижность этих электронов, а также обратимость адсорбции кислорода на поверхности благоприятствуют этим реакционным стадиям, увеличивая скорость реакции и сводя к минимуму дезактивацию катализаторов из-за отложения углерода ( Кортрайт и др., 2002).
Ян и др. (2010) протестировали конверсию водорода никелевых катализаторов, нанесенных на CeO 2 -ZrO 2 , и коммерческие никелевые катализаторы (Z417). Присутствие носителя с восстанавливаемыми оксидами увеличивало процент водорода, образующегося на грамм катализатора, способствовало увеличению числа циклов катализатора и увеличивало срок службы катализатора. Чжан и др. (2012) сообщили об аналогичных результатах с использованием биметаллических катализаторов Ni и Co на носителях CeO 2 -ZrO 2 по сравнению с катализаторами Ni и Co.Взаимодействия смешанных оксидов создают каталитические центры для разрыва связей СС и СН, образования вакансий и реабсорбции молекул кислорода, что способствует удалению углеродистых отложений, образовавшихся на поверхности катализатора.
Производство водорода с помощью реакции вытеснения газа водой (конверсия водяного газа)
Реакция замещения газа водой (WGS) важна, поскольку она снижает концентрацию CO и одновременно производит водород (целевой продукт). Даже в небольших количествах выхлопной газ CO необходимо удалять из-за его неблагоприятного воздействия на аноды топливных элементов, что приводит к дезактивации электрокатализаторов (Ghenciu, 2002).
CO(г)+h3O(пар)CO2(г)+h3(г)(WGS-реакция)Несмотря на относительно простоту (по сравнению с реакциями с бионефтью), WGS требует высокой селективности и высокого выхода. Реакция рекомбинации между молекулами СО и СО 2 с образованием короткоцепочечных оксигенатов также должна быть подавлена. Образование углеродистых молекул на поверхности катализаторов может привести к углеродным отложениям и последующей пассивации катализатора. Две характеристики восстанавливаемых оксидов подчеркивают их применимость для этой реакции: (i) большое количество вакансий и (ii) взаимодействие с кислородом (Zhai et al., 2010). Создание электроположительных участков (вакансий) увеличивает перенос молекул воды и образование высокореакционноспособных радикалов (ОН и ООН). Высвобождение и адсорбция кислорода является еще одним ключом к превосходным характеристикам катализаторов на основе восстанавливаемых оксидов, поскольку они могут удалять O из H 2 O и реагировать с CO с образованием CO 2 и H 2 (Pazmiño et al. ., 2012). Кроме того, восстанавливаемые оксиды образуют пероксо-частицы, которые очень реакционноспособны на поверхности, сводя к минимуму образование углеродистых отложений.Эти оксиды также демонстрируют высокую подвижность кислорода на поверхности, увеличивая динамику реакции между пероксосоединениями и углеродистыми отложениями, оставляя катализаторы (зоны горячих точек) доступными для реакции. В целом более высокая реакционная способность восстанавливаемых оксидов связана с образовавшимися вакансиями. Виндигни и др. (2012) наблюдали улучшенную дисперсию и более мелкие наночастицы золота при добавлении ZrO 2 к носителям, содержащим CeO 2 . При этом вакансии и их взаимодействие с наночастицами эффективно предотвращали агломерацию.Благодаря улучшенной дисперсии наночастиц и большому количеству вакансий становится доступным большее количество реакционных центров, что приводит к большей активности. В этом же исследовании было подтверждено, что при добавлении ZrO 2 к CeO 2 происходит значительное увеличение кислотности носителя, что неблагоприятно для некоторых реакций (Vindigni et al., 2012). Даже при увеличении числа вакансий и повышенной дисперсности нанесенного металла взаимодействие реагентов с катализатором может быть затруднено из-за повышенного электростатического отталкивания.Чтобы избежать этих проблем, многие исследователи сосредоточились на добавлении основных промоторов (обычно атомов групп I и II) для увеличения основности поддержки и распространения (Zhai et al., 2010; Pazmiño et al., 2012).
Производство водорода в результате преимущественного окисления CO (Prox)
Традиционный способ получения водорода сочетает в себе реакции риформинга бионефти с ВГС, при котором образуются газы следующего состава: 45% H 2 , 25% CO 2 , 10% H 2 O, 20% N 2 и 0.5–1% CO. При низких концентрациях (0,5–1%) CO отрицательно влияет на работу электрокатализаторов топливных элементов. Таким образом, удаление СО, т. е. снижение его концентрации до < 10 ppm, может быть достигнуто за счет преимущественного окисления СО (Prox). Вутч и др. (2004) сравнили характеристики наночастиц Pt, нанесенных на Al 2 O 3 , с теми же наночастицами, нанесенными на CeO 2 -ZrO 2 , для реакции Prox. CeO 2 -ZrO 2 более активен при низких температурах из-за неконкурентного механизма реакции, когда молекулы H 2 и CO не реагируют на каталитических центрах.Молекулы Н 2 реагируют вблизи наночастиц за счет взаимодействия благородного металла с Н 2 , тогда как присоединение кислорода к СО происходит преимущественно по вакансионным позициям. Однако использование восстанавливаемых оксидов для реакции Прокса при высоких температурах неэффективно по сравнению с другими оксидными катализаторами, поскольку с повышением температуры образуется много вакансий и окисление H 2 становится выгодным. Это приводит к снижению активности окисления CO при потреблении H 2 , образующегося на других этапах (Wootsch et al., 2004). Sangeetha and Chen (2009) добавили CeO 2 и CoO в катализаторы, содержащие наночастицы Au, нанесенные на TiO 2 . При добавлении этих смешанных оксидов к катализатору активность и селективность реакции Прокса улучшались.
Электрокаталитические реакции из оксида
Таким образом, в принципе электрокатализатор обычно можно определить как сложный материал, который взаимодействует с некоторыми определенными частицами, не расходуясь в ходе целевой электрохимической реакции (Seh et al., 2017). Некоторые примеры восстанавливаемых оксидов, применяемых в качестве электрокатализаторов, будут рассмотрены ниже.
Производство твердых видов углерода из CO
2Недавнее исследование показывает взаимодействие CO 2 в газообразном состоянии с тонким двумерным слоем наночастиц церия, сформированным на границе металл/электролит, что обеспечивает фарадеевскую эффективность ~75% (Esrafilzadeh et al., 2019) . Реакция электрокатализа происходит в результате этого взаимодействия и приводит к образованию твердых углеродсодержащих частиц при обычной комнатной температуре и низком напряжении (-310 мВ) (Esrafilzadeh et al., 2019). Этот процесс реверсивного горения по сравнению с жидким катализатором имеет большое преимущество перед твердыми катализаторами. Поскольку последний легко дезактивируется за счет образования поверхностного кокса, первый становится альтернативой, представляющей большой технологический интерес, и может производиться в больших масштабах для применения в технологии с отрицательным выбросом CO 2 (Taccardi et al., 2017; Esrafilzadeh et al. др., 2019). Однако (Esrafilzadeh et al., 2019) экспериментировали с изменением потенциала, применяемого при электрокатализе, и также производили CO в качестве одного из продуктов.В диапазоне потенциалов от -3 до -2,5 В по сравнению с Ag/Ag + наблюдалось более высокое образование CO, в то время как от -1,8 до -2,0 В по сравнению с Ag/Ag + наблюдалось более высокое образование углеродистых материалов. Таким образом, потенциальный диапазон показал селективность продуктов (Esrafilzadeh et al., 2019).
Сокращение N
2 до NH 3Электрохимическая реакция восстановления N 2 (NRR) в условиях окружающей среды для образования NH 3 , проведенная с наностержнями CeO 2 с кислородными вакансиями по Xu et al., имел производительность 16,4 мкг ч -1 мгкат-1 при -0,5 В по сравнению с обратимым водородным электродом (RHE) и фарадеевскую эффективность 3,7% при -0,4 В по сравнению с RHE с использованием 0,1 М водного Na 2 SO электролит 4 (Xu et al., 2019). С другой стороны, нетронутый CeO 2 показал производительность 5,4 мкг -1 мгкат-1 и 2,1% соответственно. Кислородные вакансии, вызванные термообработкой с током H 2 внутри трубчатой печи, сыграли ключевую роль в кристаллической сети CeO 2 , оптимизирующей производство по 2.8 раз. Эта технология позволяет внедрить искусственную фиксацию N 2 , имеющую большое значение, например, в производстве удобрений, лекарств и топлива для сжигания (Christensen et al., 2006; Erisman et al., 2008; Service, 2014; Xu et al. др., 2019).
Заключительные замечания и точки зрения
Таким образом, восстанавливаемые оксиды — это материалы, способные изменять степень окисления за счет выхода атома кислорода из оксидной сети. В целом, образование вакансий благоприятствует более высоким температурам и более низким парциальным давлениям O 2 .При добавлении примесей структура способствует восстановлению оксидов за счет дестабилизации кристаллической решетки и передачи электронной плотности в энергетическую щель. Таким образом, использование восстанавливаемых оксидов может увеличить каталитическую активность в результате усиленного взаимодействия между легирующей примесью и оксидом. Использование смешанных восстанавливаемых оксидов (CeO 2 + ZrO 2 ) или более сложных оксидов (таких как BaTiO 3 , LaCoO 3 и HfSiO X ) стабилизирует вакансии и обеспечивает термическую и физическую стабильность. восстанавливаемые оксидные системы.Однако роль обеих фаз оксида и общепринятый механизм реакции окисления остаются неизвестными. Следовательно, вакансионное образование необходимо для каталитических характеристик огромного разнообразия восстанавливаемых оксидов. Многие реакции, естественно, зависят от границы раздела металлических вакансий для разрыва связи и образования желаемого продукта. Поэтому использование восстанавливаемых оксидов для получения водорода выгодно, так как увеличивает число циклов катализатора, снижает отложение углерода, повышает конверсию и селективность реакций.Несмотря на многие достижения, теоретическое и экспериментальное исследование материалов на основе восстанавливаемых оксидов остается в зачаточном состоянии, так как остается много важных вопросов, касающихся этих систем. Теоретические методы требуют точного предсказания многоэлектронных орбитальных энергий при различных степенях окисления. Помимо теоретических достижений, требуется больший объем данных для понимания природы и роли дефектов в реакционной способности катализаторов на основе восстановительных оксидов. Использование восстанавливаемых оксидов в больших масштабах еще не достигнуто из-за высокой стоимости этих материалов по сравнению с другими обычно используемыми оксидами.Таким образом, сравнивая рыночные цены на оксиды кремния и алюминия (которые имеются в изобилии и легко эксплуатируются) с рыночными ценами на восстанавливаемые оксиды (которые менее распространены и часто требуют удаления из других минералов), становится ясно, что производство и улучшение их применения необходимо для достижения положительного соотношения затрат и результатов.
Вклад авторов
FL разработал исследование и участвовал в обзоре всей рукописи. FP написал большую часть рукописи с помощью VS и RS.Все авторы обсудили результаты и внесли свой вклад в окончательный вариант рукописи.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят за финансовую поддержку CNPq, CAPES, Fundação Araucária и FAPEMIG.
Каталожные номера
Аранда, А., Агурам, С., López, J.M., Mastral, A.M., Sellick, D.R., Solsona, B., et al. (2012). Кислородные дефекты: ключевой параметр, контролирующий активность и селективность мезопористого оксида церия, легированного медью, в отношении полного окисления нафталина. Заяв. Катал. Б Окружающая среда. 127, 77–88. doi: 10.1016/j.apcatb.2012.07.033
Полнотекстовая перекрестная ссылка | Академия Google
Араужо, В. Д., Аванси, В., Де Карвалью, Х. Б., Морейра, М. Л., Лонго, Э., Рибейро, К., и др. (2012). CeO 2 наночастицы, синтезированные гидротермальным методом с использованием микроволнового излучения: эволюция от наносфер к наностержням. CrystEngComm 14, 1150–1154. дои: 10.1039/C1CE06188G
Полнотекстовая перекрестная ссылка | Академия Google
Ашкрабиач, С., Дохчевяч-Митровяч, З., Кременович, А., Лазаревич, Н., Каленберг, В., и Поповяч, З. В. (2012). Индуцированные вакансиями кислорода микроструктурные изменения отожженных нанокристаллов CeO 2 -x. J. Raman Spectrosc. 43, 76–81. doi: 10.1002/jrs.2987
Полнотекстовая перекрестная ссылка | Академия Google
Авила-нето, К. Н., Либератори, Дж.W.C., Silva, A.M., Zanchet, D., Hori, C.E., Noronha, F.B., et al. (2012). Понимание стабильности нанесенных на кобальт катализаторов во время риформинга этанола в соответствии с анализом in situ с температурным и пространственным разрешением XAFS. J. Катал. 287, 124–137. doi: 10.1016/j.jcat.2011.12.013
Полнотекстовая перекрестная ссылка | Академия Google
Barandas, AP, Passos, MG, and Noronha, FB (2011) «Estudo do mecanismo da reação de produção de hidrogenio a partir da reforma oxidativa do acetol utilizando catalisadores de Ni/γ-Al 2 O 3 », в 16o Congresso Brasileiro de Catálise , (Кампус-ду-Жордау), 678–683.
Академия Google
Барандас, APMG (2009). Produção de Hidrogênio a Partir do Acetol Em Catalisadores de Níquel Suportados Produção de Hidrogênio a Partir do Acetol em Catalisadores de Níquel Suportados ANA PAULA MAURO GONÇALVES BARANDAS.
Basagiannis, A.C., и Verykios, X.E. (2006). Реакции риформинга уксусной кислоты на никелевых катализаторах в широком диапазоне температур. Заяв. Катал. Генерал 308, 182–193. doi: 10.1016/j.апката.2006.04.024
Полнотекстовая перекрестная ссылка | Академия Google
Basagiannis, A.C., и Verykios, X.E. (2007). Каталитический паровой риформинг уксусной кислоты для производства водорода. Междунар. J. Hydrogen Energy 32, 3343–3355. doi: 10.1016/j.ijhydene.2007.04.039
Полнотекстовая перекрестная ссылка | Академия Google
Бреннер, Т. М., Эггер, Д. А., Кроник, Л., Ходс, Г., и Кахен, Д. (2016). Гибридные органические и неорганические перовскиты: недорогие полупроводники с интригующими свойствами переноса заряда. Нац. Преподобный Матер. 1:15007. doi: 10.1038/natrevmats.2015.7
Полнотекстовая перекрестная ссылка | Академия Google
Брайант Б., Реннер С. Х., Токунага Ю., Токура Ю. и Эппли Г. (2011). Визуализация кислородных дефектов и их движения на поверхности манганита. Нац. коммун. 2, 212–216. doi: 10.1038/ncomms1219
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Каллистер, В. Д., и Ретвиш, Д. (2012). Основы материаловедения и инженерии: комплексный подход. Хобокен, Нью-Джерси: John Wiley & Sons.
Академия Google
Кристенсен, С. Х., Йоханнессен, Т., Соренсен, Р. З., и Норсков, Дж. К. (2006). К водородной экономике, основанной на аммиаке? Катал. Сегодня 111, 140–144. doi: 10.1016/j.cattod.2005.10.011
Полнотекстовая перекрестная ссылка | Академия Google
Кортрайт, Р. Д., Давда, Р. Р., и Думесик, Дж. А. (2002). Водород в результате каталитического риформинга углеводородов, полученных из биомассы, в жидкой воде. Природа 418, 964–967. doi: 10.1038/nature01009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
da Fonseca, A.F.V., Siqueira, R.L., Landers, R., Ferrari, J.L., Marana, N.L., Sambrano, J.R., et al. (2018). Теоретическое и экспериментальное исследование наностержней ZnO, легированных Eu, и их применение в солнечных элементах, сенсибилизированных красителем. J. Alloys Compd. 739, 939–947. doi: 10.1016/j.jallcom.2017.12.262
Полнотекстовая перекрестная ссылка | Академия Google
де Кастро, И.А., Датта Р.С., Оу Дж.З., Кастелланос-Гомес А., Шрирам С., Даенеке Т. и соавт. (2017). Оксиды молибдена – от основы к функциональности. Доп. Матер. 29, 1–31. doi: 10.1002/adma.201701619
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
де Ласа, Х., Салаис, Э., Мазумдер, Дж., и Лаки, Р. (2011). Каталитическая паровая газификация биомассы: катализаторы, термодинамика и кинетика. Хим. Ред. 111, 5404–5433. дои: 10.1021/cr200024w
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дубей, В.Р. и Вайдья, П. Д. (2012). Кинетика паровой конверсии ацетола на катализаторе Pt/C. Хим. англ. J. 180, 263–269. doi: 10.1016/j.cej.2011.11.034
Полнотекстовая перекрестная ссылка | Академия Google
Эрисман, Дж. В., Саттон, М. А., Галлоуэй, Дж., Климонт, З., и Уинивартер, В. (2008). Как столетие синтеза аммиака изменило мир. Нац. Geosci. 1, 636–639. дои: 10.1038/ngeo325
Полнотекстовая перекрестная ссылка | Академия Google
Эш, Ф., Fabris, S., Zhou, L., Montini, T., Africh, C., Fornasiero, P., et al. (2005). Локализация электронов определяет дефектообразование на подложках из оксида церия. Наука 309, 752–755. doi: 10.1126/science.1111568
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эсрафилзаде Д., Завабети А., Джалили Р., Аткин П., Чой Дж., Кэри Б.Дж. и соавт. (2019). Комнатная температура CO 2 восстановление до твердых частиц углерода на жидких металлах с атомарно тонкими интерфейсами оксида церия. Нац. коммун. 10:865. doi: 10.1038/s41467-019-09228-4
Полнотекстовая перекрестная ссылка | Академия Google
Фэн Б., Сугияма И., Ходжо Х., Охта Х., Шибата Н. и Икухара Ю. (2016). Атомные структуры и кислородная динамика границ зерен CeO 2 . науч. Респ. 6, 1–7. дои: 10.1038/srep20288
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фернандес, С. Л., Альбано, Л. Г. С., Афонсо, Л. Дж., да Силва, Дж. Х.Д., Лонго Э. и Графф ЦФО (2019). Изучение свойств пленок оксида ниобия для слоев переноса электронов в перовскитных солнечных элементах. Фронт. хим. 7:50. doi: 10.3389/fchem.2019.00050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Генчу, А.Ф. (2002). Обзор катализаторов обработки топлива для производства водорода в системах топливных элементов PEM. Курс. мнение Твердотельный материал. науч. 6, 389–399. дои: 10.1016/S1359-0286(02)00108-0
Полнотекстовая перекрестная ссылка | Академия Google
Глунц, С.В., Преу Р. и Биро Д. (2012). «Солнечные элементы из кристаллического кремния: современные и будущие разработки», в Комплексная возобновляемая энергия 1: Фотоэлектрическая солнечная энергия (технология) (Elsevier), 353–387.
Академия Google
Гонг Дж., Сумати К., Цяо К. и Чжоу З. (2017). Обзор сенсибилизированных красителем солнечных элементов (DSSC): передовые методы и направления исследований. Продлить. Поддерживать. Энергия Rev . 68, 234–246. doi: 10.1016/j.rser.2016.09.097
Полнотекстовая перекрестная ссылка | Академия Google
Гровер, В., Банерджи, А., Сенгупта, П., и Тьяги, А.К. (2008). Рамановские, рентгеновские и микроскопические исследования систем CeO 2 -Lu 2 O 3 и CeO 2 -Sc 2 O 3 : исследование эволюции субсолидусной фазы. J. Solid State Chem. 181, 1930–1935 гг. doi: 10.1016/j.jssc.2008.04.001
Полнотекстовая перекрестная ссылка | Академия Google
Го, X., и Васер, Р. (2006). Электрические свойства границ зерен проводников ионов кислорода: легированных акцепторами диоксида циркония и церия. Прог. Матер. науч. 51, 151–210. doi: 10.1016/j.pmatsci.2005.07.001
Полнотекстовая перекрестная ссылка | Академия Google
Hardacre, C., Roe, G.M., and Lambert, R.M. (1995). Структура, состав и термические свойства пленок оксида церия на платине {111}. Прибой. науч. 326, 1–10. дои: 10.1016/0039-6028(94)00783-7
Полнотекстовая перекрестная ссылка | Академия Google
Холладей, Дж. Д., Ху, Дж., Кинг, Д. Л., и Ван, Ю. (2009). Обзор технологий производства водорода. Катал. Сегодня 139, 244–260. doi: 10.1016/j.cattod.2008.08.039
Полнотекстовая перекрестная ссылка | Академия Google
Цзян Д., Ван В., Чжан Л., Чжэн Ю. и Ван З. (2015). Взгляд на зависимость фотореактивности от дефектов поверхности нанокристаллов CeO 2 с четко определенными кристаллическими гранями. ACS Катал. 5, 4851–4858. doi: 10.1021/acscatal.5b01128
Полнотекстовая перекрестная ссылка | Академия Google
Крипал Р., Гупта А.К., Шривастава Р.К. и Мишра С.К. (2011). Фотопроводимость и фотолюминесценция наночастиц ZnO, синтезированных методом соосаждения. Спектрохим. Акта Часть А Мол. биомол. Спектроск. 79, 1605–1612. doi: 10.1016/j.saa.2011.05.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ламач, А., Кржтон, А., и Джега-Мариадассу, Г. (2011). Паровая конверсия компаундов модельных газификационных смол на никелевых церий-циркониевых катализаторах. Катал.Сегодня. 176, 347–351. doi: 10.1016/j.cattod.2010.11.067
Полнотекстовая перекрестная ссылка | Академия Google
Lee, W., Jung, H.J., Lee, M.H., Kim, Y.B., Park, J.S., Sinclair, R., et al. (2012). Поверхностный кислородный обмен на границах зерен оксидно-ионных проводников. Доп. Функц. Матер. 22, 965–971. doi: 10.1002/adfm.201101996
Полнотекстовая перекрестная ссылка | Академия Google
Ли, К., Ли, X., Лю, Л., Ван, Х., и Ян, В. (2018). Синтез новых двумерных нанохлопьев церия с повышенной каталитической активностью, индуцированной легированием кобальтом. Матер. лат. 230, 80–83. doi: 10.1016/j.matlet.2018.07.030
Полнотекстовая перекрестная ссылка | Академия Google
Лю Б., Лю Б., Ли К., Ду Х., Яо М., Ли З. и др. (2011). Легкий гидротермальный синтез нанолистов CeO 2 с поверхностью с высокой реакционной способностью. J. Alloys Compd. 509, 6720–6724. doi: 10.1016/j.jallcom.2011.03.156
Полнотекстовая перекрестная ссылка | Академия Google
Лю Д., Лв Ю., Чжан М., Лю Ю., Чжу Ю., Цзун Р., и другие. (2014). Дефектная фотолюминесценция и фотокаталитические свойства пористых нанолистов ZnO. Дж. Матер. хим. А 2, 15377–15388. дои: 10.1039/C4TA02678K
Полнотекстовая перекрестная ссылка | Академия Google
Lu, X.H., Huang, X., Xie, S.L., Zheng, D.Z., Liu, Z.Q., Liang, C.L., et al. (2010). Легкий электрохимический синтез монокристаллических октаэдров CeO 2 и их оптические свойства. Ленгмюр 26, 7569–7573. дои: 10.1021/la2t
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мансер, Дж.С., Христианс, Дж. А., и Камат, П. В. (2016). Интригующие оптоэлектронные свойства металлогалогенидных перовскитов. Хим. Версия . 116, 12956–13008. doi: 10.1021/acs.chemrev.6b00136
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маси, С., Мастриа, Р., Скарфиелло, Р., Каралло, С., Нобиле, К., Гамбино, С., и др. (2018). Обработанные при комнатной температуре пленки коллоидных вырезанных стержнеобразных нанокристаллов восстановленного оксида вольфрама в качестве промежуточных слоев перовскитных солнечных элементов. Физ. хим. хим. физ. 20, 11396–11404. дои: 10.1039/C8CP00645H
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мигани А., Вайсилов Г. Н., Бромли С. Т., Иллас Ф. и Нейман К. М. (2010). Значительно облегчает образование кислородных вакансий в нанокристаллитах церия. Хим. коммун. 46, 5936–5938. дои: 10.1039/c0cc01091j
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мисоно, М. (2005). Взгляд на будущее смешанных оксидных катализаторов. Катал. Сегодня 100, 95–100. doi: 10.1016/j.cattod.2004.12.010
Полнотекстовая перекрестная ссылка | Академия Google
Montini, T., Speghini, A., De Rogatis, L., Lorenzut, B., Bettinelli, M., Graziani, M., et al. (2009). Идентификация структурных фаз Ce(x)Zr(1-x)O2 по люминесцентным исследованиям Eu(III). J Am Chem Soc. 131, 13155–13160. дои: 10.1021/ja8p Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Мора-Фонз, Д., Лазаускас Т., Фэрроу М.Р., Кэтлоу С.Р.А., Вудли С.М. и Сокол А.А. (2017). Почему полярные поверхности ZnO стабильны? Хим. Матер. 29, 5306–5320. doi: 10.1021/acs.chemmater.7b01487 Полнотекстовая перекрестная ссылка | Академия Google Morris, M.C., McMurdie, H.F., Evans, E.H., Paretzkin, B., Parker, H.S., et al. (1964). Стандартные порошковые рентгенограммы. Монография 25 Раздел 20 . Вашингтон, округ Колумбия: Государственная типография. Намаи Ю., Фукуи К. и Ивасава Ю. (2003b). Бесконтактные атомно-силовые микроскопические наблюдения с атомным разрешением поверхностей CeO 2 (111) с различными степенями окисления: структура поверхности и поведение поверхностных атомов кислорода. J. Phys. хим. Б 107, 11666–11673. дои: 10.1021/jp030142q Полнотекстовая перекрестная ссылка | Академия Google Намаи Ю., Фукуи К.-И. и Ивасава Ю. (2003a). Наблюдения за структурой и динамическим поведением поверхностей CeO 2 (111) с помощью бесконтактной атомно-силовой микроскопии и сканирующей туннельной микроскопии с атомным разрешением. Катал. Сегодня 85, 79–91. doi: 10.1016/S0920-5861(03)00377-8 Полнотекстовая перекрестная ссылка | Академия Google Нолан, М., Фирон, Дж. Э., и Уотсон, Г. В. (2006). Образование кислородных вакансий и миграция в церии. Ионика твердого тела 177, 3069–3074. doi: 10.1016/j.ssi.2006.07.045 Полнотекстовая перекрестная ссылка | Академия Google Нуньес Д., Пиментел А., Сантос Л., Баркинья П., Перейра Л., Фортунато Э. и др. (ред.). (2018). «6 — Оксидные материалы для энергетических применений», в Metal Oxide Nanostructures (Elsevier), 199–234.doi: 10.1016/B978-0-12-811512-1.00006-0 Полнотекстовая перекрестная ссылка О’Реган, Б., и Грацель, М. (1991). Недорогой высокоэффективный солнечный элемент на основе сенсибилизированных красителем коллоидных пленок TiO2. Природа 353, 737–740. дои: 10.1038/353737a0 Полнотекстовая перекрестная ссылка | Академия Google Пайер, Дж., Пеншке, К., и Зауэр, Дж. (2013). Кислородные дефекты и химия поверхности оксида церия: квантово-химические исследования по сравнению с экспериментом. Хим. Ред. 113, 3949–3985.doi: 10.1002/chin.201333211 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Пазминьо, Дж. Х., Шекхар, М., Дэмион Уильямс, В., Джем Акатай, М., Миллер, Дж. Т., Николас Дельгасс, В., и др. (2012). Металлическая Pt как активный центр реакции конверсии вода-газ на промотированных щелочью нанесенных катализаторах. J. Катал. 286, 279–286. doi: 10.1016/j.jcat.2011.11.017 Полнотекстовая перекрестная ссылка | Академия Google Полман А., Найт М., Гарнетт Э.К., Эрлер Б. и Синке В. К. (2016). Фотогальванические материалы – нынешняя эффективность и будущие вызовы. Наука 352:aad4424. doi: 10.1126/science.aad4424 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Протесеску Л., Якунин С., Боднарчук М.И., Криг Ф., Капуто Р., Хендон С.Х. и соавт. (2015). Нанокристаллы перовскитов галогенидов цезия и свинца (CsPbX3, X = Cl, Br и I): новые оптоэлектронные материалы, демонстрирующие яркое излучение с широкой цветовой гаммой. Нано Летт. 15, 3692–3696. дои: 10.1021/nl5048779 Полнотекстовая перекрестная ссылка | Академия Google Рамирес, Д., Велилья, Э., Монтойя, Дж. Ф., и Харамильо, Ф. (2019). Смягчение проблем масштабируемости перовскитной фотоэлектрической технологии с помощью архитектуры солнечных элементов с мезонадстройкой p-i-n. Материал солнечной энергии. Солнечные элементы 195, 191–197. doi: 10.1016/j.solmat.2019.03.014 Полнотекстовая перекрестная ссылка | Академия Google Расмуссен, М.Д., Молина Л.М. и Хаммер Б. (2004). Адсорбция, диффузия и диссоциация молекулярного кислорода на дефектном TiO2(110): исследование теории функционала плотности. J. Chem. физ. 120, 988–997. дои: 10.1063/1.1631922 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Родригес, Дж. А., Грациани, Дж., Эванс, Дж., Парк, Дж. Б., Ян, Ф., Стаккиола, Д., и другие. (2009). Реакция конверсии водяного газа на высокоактивном обратном катализаторе CeO, x/Cu(111): уникальная роль наночастиц церия. Анжю. хим. Междунар. Эд. 48, 8047–8050. doi: 10.1002/anie.200 Полнотекстовая перекрестная ссылка | Академия Google Родригес, Дж. А., и Хрбек, Дж. (2010). Обратные оксидные/металлические катализаторы для исследования поверхности: универсальный подход к испытаниям активности и механистическим исследованиям. Прибой. науч. 604, 241–244. doi: 10.1016/j.susc.2009.11.038 Полнотекстовая перекрестная ссылка | Академия Google Салиба, М., Мацуи, Т., Домански, К., Корреа-Баэна, Ж.-П., Назируддин, М.К., Закируддин С.М. и соавт. (2016). Перовскитные солнечные элементы с тройным катионом, содержащие цезий: повышенная стабильность, воспроизводимость и высокая эффективность. Энергетика Окружающая среда. Наука . 9, 1989–1997. дои: 10.1039/C5EE03874J Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Сангита П. и Чен Ю.-В. (2009). Преимущественное окисление СО в потоке h3 на катализаторах Au/CeO 2 –TiO2. Междунар. J. Hydrogen Energy 34, 7342–7347. doi: 10.1016/j.ijhydene.2009.06.045 Полнотекстовая перекрестная ссылка | Академия Google Шауб, Р., Вальстрем, Э., Рённау, А., Легсгаард, Э., Стенсгаард, И., и Безенбахер, Ф. (2003). Опосредованная кислородом диффузия кислородных вакансий на поверхности TiO2(110). Наука 299, 377–379. doi: 10.1126/science.1078962 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Seh, Z.W., Kibsgaard, J., Dickens, C.F., Chorkendorff, I.B., Nørskov, J.K., and Jaramillo, T.Ф. (2017). Сочетание теории и эксперимента в электрокатализе: понимание дизайна материалов. Наука 355:eaad4998. doi: 10.1126/science.aad4998 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Шарма С., Сивах Б., Гошал С. К. и Мохан Д. (2017). Сенсибилизированные красителем солнечные элементы: от генезиса до недавних дрейфов. Продлить. Поддерживать. Энергия Rev . 70, 529–537. doi: 10.1016/j.rser.2016.11.136 Полнотекстовая перекрестная ссылка | Академия Google Песня, К., Чжао Дж., Ли Х., Луо С., Тан Ю. и Ван Д. (2017). Дизайн, управляемый синтез и свойства двумерных гетероструктурных сборок CeO 2 /NiO. CrystEngComm 19, 7339–7346. дои: 10.1039/C7CE01769C Полнотекстовая перекрестная ссылка | Академия Google Сонг, Х., Миркеламоглу, Б., и Озкан, США (2010). Влияние предшественника кобальта на характеристики кобальтовых катализаторов, нанесенных на оксид церия, для паровой конверсии этанола. Заяв. Катал. Генерал 382, 58–64.doi: 10.1016/j.apcata.2010.04.016 Полнотекстовая перекрестная ссылка | Академия Google Сойкал, И. И., Байрам, Б., Сон, Х., Гаваде, П., Миллер, Дж. Т., и Озкан, США (2012). Паровая конверсия этанола на катализаторах Co/CeO 2 : исследование влияния морфологии оксида церия. Заяв. Катал. Генерал 449, 47–58. doi: 10.1016/j.apcata.2012.09.038 Полнотекстовая перекрестная ссылка | Академия Google Сун, К., Ли, Х., и Чен, Л. (2012). Наноструктурированные материалы на основе церия: синтез, свойства и применение. Энергетика Окружающая среда. науч. 5, 8475–8505. дои: 10.1039/c2ee22310d Полнотекстовая перекрестная ссылка | Академия Google Шварц, С.Л. (2002). «Катализ церием и родственными материалами. Под редакцией Алессандро Троварелли (Университет Удине, Италия). каталитическая научная серия. том 2. Серия под редакцией Грэма Дж. Хатчингса. Imperial College Press: Лондон. 2002. vviii + 508 стр. 78,00 долл. США. ISBN: 1-86094-29. Дж. Ам. хим. соц. 124, 12923–12924. дои: 10.1021/ja025256e Полнотекстовая перекрестная ссылка | Академия Google Таккарди, Н., Grabau, M., Debushewitz, J., Distaso, M., Brandl, M., Hock, R., et al. (2017). Богатые галлием фазы Pd-Ga в качестве жидкометаллических катализаторов на носителе. Нац. хим. 9, 862–867. doi: 10.1038/nchem.2822 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Тисеану, К., Парвулеску, В., Аврам, Д., Кожокару, Б., Бутоннет, М., и Санчес-Домингес, М. (2014). Локальная структура и наноразмерная однородность CeO 2 -ZrO 2 : различия и сходство с исходными оксидами, выявленные с помощью люминесценции с временным и спектральным разрешением. Физ. хим. хим. физ. 16, 703–710. дои: 10.1039/C3CP52893F Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Trane, R., Dahl, S., Skjøth-Rasmussen, M.S., and Jensen, A.D. (2012). Каталитический паровой риформинг бионефти. Междунар. J. Hydrogen Energy 37, 6447–6472. doi: 10.1016/j.ijhydene.2012.01.023 Полнотекстовая перекрестная ссылка | Академия Google Троварелли, А., и Форнасьеро, П. (ред.). (2013). Катализ церием и родственными материалами .Том. 12. Всемирная научная. дои: 10.1142/p870 Полнотекстовая перекрестная ссылка | Академия Google Умар А., Кумар Р., Ахтар М.С., Кумар Г. и Ким С.Х. (2015). Рост и свойства хорошо кристаллического оксида церия (CeO 2 ) нанохлопьев для применения в окружающей среде и датчиках. J. Коллоидный интерфейс Sci. 454, 61–68. doi: 10.1016/j.jcis.2015.04.055 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Вагия, Э. К., и Лемониду, А.А. (2008). Термодинамический анализ получения водорода методом автотермической паровой конверсии отдельных компонентов водной бионефтяной фракции. Междунар. J. Hydrogen Energy 33, 2489–2500. doi: 10.1016/j.ijhydene.2008.02.057 Полнотекстовая перекрестная ссылка | Академия Google Ван Сантен, Р. А., Транка, И., и Хенсен, Э. Дж. М. (2015). Теория химии поверхности и реакционной способности восстанавливаемых оксидов. Катал. Сегодня 244, 63–84. doi: 10.1016/j.cattod.2014.07.009 Полнотекстовая перекрестная ссылка | Академия Google Вайсилов Г.Н., Лыхач Ю., Мигани А., Штаудт Т., Петрова Г.П., Цуд Н. и др. (2011). Наноструктура поддержки повышает перенос кислорода к каталитически активным наночастицам платины. Нац. Матер. 10, 310–315. doi: 10.1038/nmat2976 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Велилья, Э., Рамирес, Д., Урибе, Дж.-И., Монтойя, Дж. Ф., и Харамильо, Ф. (2019). Перовскитная солнечная технология на открытом воздухе: сравнение кремния и конкурентные преимущества при разной освещенности. Материал солнечной энергии. Солнечные элементы 191, 15–20. doi: 10.1016/j.solmat.2018.10.018 Полнотекстовая перекрестная ссылка | Академия Google Виндигни Ф., Манзоли М., Табакова Т., Идакиев В., Боккуцци Ф. и Чиорино А. (2012). Золотые катализаторы низкотемпературной реакции конверсии водяного газа: влияние добавления ZrO 2 на носитель CeO 2 . Заяв. Катал. Б Окружающая среда. 125, 507–515. doi: 10.1016/j.apcatb.2012.05.031 Полнотекстовая перекрестная ссылка | Академия Google Вагнерова, Д.М. и Ланг, К. (2011). Фотовыделение триплетного и синглетного кислорода из дикислородных комплексов. Координ. хим. Ред. 255, 2904–2911. doi: 10.1016/j.ccr.2011.06.017 Полнотекстовая перекрестная ссылка | Академия Google Вальстро, Э., Рённау, А., Вестергаард, М., Легсгаард, Э., Стенсгаард, И., и Безенбахер, Ф. (2004). Индуцированная электронным переносом динамика молекул кислорода на поверхности TiO 2 (110). Наука 303, 511–513. doi: 10.1126/science.1093425 Полнотекстовая перекрестная ссылка | Академия Google Ван, Дж., Ян, К., Магдасси, С., и Ли, П.С. (2013). Нанопроволоки Zn2GeO4 как эффективный материал для инжекции электронов для электролюминесцентных устройств. Приложение ACS Матер. Интерфейсы 5, 6793–6796. дои: 10.1021/am401234a Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Wang, Q., Ito, S., Gratzel, M., Fabregat-Santiago, F., Mora-Seró, I., Bisquert, J., et al. (2006). Характеристики высокоэффективных солнечных элементов, сенсибилизированных красителем. J. Phys. хим. Б 110, 25210–25221.дои: 10.1021/jp064256o Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Вутч, А., Дескорм, К., и Дюпре, Д. (2004). Преимущественное окисление монооксида углерода в присутствии водорода (PROX) по сравнению с Pt катализаторами, нанесенными на оксид церия и циркония, и оксидом алюминия. J. Катал. 225, 259–266. doi: 10.1016/j.jcat.2004.04.017 Полнотекстовая перекрестная ссылка | Академия Google Сюй Б., Ся Л., Чжоу Ф., Чжао Р., Чен Х., Ван Т. и др. (2019). Усиление электрокаталитического восстановления N 2 до NH 3 наностержнем CeO 2 с кислородными вакансиями. ACS Sustain. хим. англ. 7, 2889–2893. doi: 10.1021/acssuschemeng.8b05007 Полнотекстовая перекрестная ссылка | Академия Google Ян, К.Ф., Ченг, Ф.Ф., и Ху, Р.Р. (2010). Получение водорода каталитическим паровым риформингом водной фракции бионефти на катализаторах Ni/CeO 2 -ZrO2. Междунар. J. Hydrogen Energy 35, 11693–11699. doi: 10.1016/j.ijhydene.2010.08.083 Полнотекстовая перекрестная ссылка | Академия Google Чжай Ю., Пьер Д., Si, R., Deng, W., Ferrin, P., Nilekar, A.U., et al. (2010). Стабилизированные щелочью частицы Pt-OHx катализируют низкотемпературные реакции конверсии водяного газа. Наука 329, 1633–1636. doi: 10.1126/science.1192449 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google Чжан Ю., Ли В., Чжан С., Сюй К. и Ян Ю. (2012). Паровая конверсия бионефти для производства водорода: влияние биметаллических катализаторов Ni-Co. Хим. англ. Технол. 35, 302–308. дои: 10.1002/ceat.201100301 Полнотекстовая перекрестная ссылка | Академия Google Чжэн Ю., Ли К., Ван Х., Ван Ю., Тянь Д., Вэй Ю. и соавт. (2016). Структурная зависимость и механизм реакции окисления СО: модельное исследование на макропористых катализаторах CeO 2 и CeO 2 -ZrO 2 . J. Катал. 344, 365–377. doi: 10.1016/j.jcat.2016.10.008 Полнотекстовая перекрестная ссылка | Академия Google Чжоу, Г., Хэнсон, Дж., и Горте, Р. Дж. (2008).Термодинамическое исследование окислительно-восстановительных свойств смешанных оксидов церия и титана. Заяв. Катал. Генерал 335, 153–158. doi: 10.1016/j.apcata.2007.11.011 Полнотекстовая перекрестная ссылка | Академия Google Оксид цинка в Австралии обычно используется в качестве важного ингредиента для многих различных видов продукции. От косметики до керамики и автомобилей, оксид цинка с его уникальными физическими и химическими свойствами привнес множество преимуществ в продукты.Оксид цинка в Австралии очень популярен как многофункциональный материал, обладающий высокой химической стабильностью, широким диапазоном поглощения излучения и высоким коэффициентом электрохимической связи. Существует множество способов получения оксида цинка, которые позволяют получить различные структуры и свойства оксида цинка. Некоторые методы получения оксида цинка, такие как гидротермальный синтез, осаждение из паровой фазы, золь-гель процесс, осаждение в водном растворе и многие другие позволяют получать оксид цинка различной формы, размеров и пространственной структуры.В Австралии существует множество разновидностей оксида цинка, которые можно использовать для производства конкретных продуктов с различным качеством. Согласно стандарту ISO 9298 оксид цинка подразделяется на два типа. Первый тип — это тип А, который производится по американскому или прямому процессу. Второй — тип B, который получают французским способом или непрямым способом. Этот другой метод затем приведет к различным типам оксида цинка. Американский или прямой процесс осуществляется путем восстановления цинковой руды путем нагревания углем с последующим окислением паров цинка в том же реакторе в одном производственном цикле.В результате получается оксид цинка типа А, который содержит примеси в виде соединений других металлов из цинковой руды. В результате этого процесса образуется оксид цинка с частицами в основном игольчатой, а иногда и сфероидальной формы. Во французском или косвенном процессе металлический цинк плавится в печи и испаряется при 910 °C. Реакция возникает из паров цинка, образующихся с кислородом воздуха, затем образуется оксид цинка. Частицы оксида цинка транспортируются по охлаждающему каналу и собираются на станции рукавных фильтров.Оксид цинка, полученный в результате этого процесса, состоит из агломератов со средним размером частиц от 0,1 до нескольких микрометров. Частицы оксида цинка в основном имеют сфероидальную форму. Оксид цинка, полученный этим методом (тип B), имеет более высокую степень чистоты, чем оксид цинка, полученный по американскому процессу (тип A). Варианты оксида цинка в Австралии варьируются от типа A до типа B и обычно используются во многих отраслях промышленности для производства различных типов продукции. Растущий спрос на рынке и продукции приводит к росту спроса на высококачественный оксид цинка в Австралии. *** Citra CakraLogam (CCL) — производитель оксида цинка, использующий французский производственный процесс для производства высококачественного оксида цинка. Citra CakraLogam (CCL) стремится производить оксид цинка самого высокого качества и самого чистого из возможных на рынке, поэтому в качестве основного сырья использует только цинковые слитки специального высокого качества (SHG). Используя правильный метод и материал отличного качества, Citra CakraLogam (CCL) может гибко контролировать чистоту, цвет и физические свойства получаемого оксида цинка. Citra CakraLogam является квалифицированным производителем оксида цинка и обслуживает глобальные поставки в несколько крупных стран, таких как Австралия, Япония, Сингапур, Малайзия, Тайвань, Филиппины, Вьетнам, Шри-Ланка, Индия, и будет продолжать расширять глобальное распространение. Citra CakraLogam также зарекомендовала себя как глобальный поставщик для известных брендов в различных отраслях промышленности, таких как производство керамики, фритты, фармацевтика, краска, комбикормовый завод и стабилизатор ПВХ. Некоторые из брендов включают Nippon Paint, Jotun, Kalbe, Platinum Ceramic, Hisamitsu и многие другие. Если вам нужна поставка оксида цинка в Австралию, вы можете связаться с нами, и наша команда проведет вас через весь процесс. 21 ноября 2017 г. | ООО «АСС МАТЕРИАЛ» Коммерциализация графена была основным интересом в исследованиях и технологиях, но его высокая стоимость и некоторые трудности с производством больших количеств материала остаются предметом обсуждения.Однако оксид графена исключительно подходит для создания масштабируемого производства; на самом деле, это был привлекательный исходный материал для крупномасштабного производства материалов на основе графена. Здесь мы подробнее обсудим оксид графена, его синтез и то, как он может быть отличным материалом для различных применений. Знакомство с оксидом графена Графен представляет собой двумерный кристаллический аллотроп с гексагональной структурой решетки, состоящий из чистых атомов углерода.Они наиболее известны своими уникальными свойствами, включая высокую оптическую прозрачность, лучшую теплопроводность при комнатной температуре и способность быть гибкими внутри прочного наноразмерного материала. Графен был впервые обнаружен путем механического расслоения трехмерных кристаллов графита и отслаивания одного слоя графена с помощью скотча. С тех пор графен получил признание благодаря своим характеристикам, и были протестированы различные методы, чтобы найти наилучший способ производства в больших количествах с низкими затратами, но его производство по-прежнему сложно с такими спецификациями. Оксид графена (GO) оказался отличным предшественником для получения графена с более высокими выходами и меньшими затратами. Для получения ОГ сначала производят оксид графита, используя кристаллы графита, которые были окислены сильными окислителями, такими как серная кислота. Благодаря обработке ультразвуком графит принимает кислородсодержащие функциональные группы, которые позволяют материалу быть диспергируемым в воде, увеличивая расстояние между слоями. 1 Затем оксид графита можно расслоить на один или несколько слоев функционализированного кислородом оксида графена (GO).Разница между оксидом графита и ОГ заключается в их разной структуре, но химический состав остается одинаковым. GO — это однослойный материал, состоящий из молекул углерода, водорода и кислорода, который в конечном итоге становится недорогим, но широко распространенным. 2 Однако из-за нарушения гибридизации sp 2 GO обычно описывают как электрический изолятор, а не как проводник. Чтобы противодействовать этому разрушению, GO можно восстановить с образованием восстановленного оксида графена (rGO), чтобы восстановить его гексагональную структуру решетки и получить листы, подобные графену, путем удаления большой части кислородных групп, чтобы они были очень похожи на графен. Рис. 1. Молекулярная структура оксида графена состоит из углерода, водорода и кислорода. Одной из наиболее важных особенностей GO является то, что его можно производить с использованием графита (поскольку он недорогой) с использованием различных химических методов, обеспечивая высокую производительность при исключительной экономической эффективности. Вторая характеристика заключается в том, что GO хорошо диспергируется в воде и может образовывать стабильные водные коллоиды для сборки макроскопических структур с более дешевыми процессами растворения.Хотя поверхность этих листов GO имеет некоторые дефекты, общий размер элементарных ячеек остается очень похожим на графен. 2 Таким образом, ОГ представляет собой окисленную версию графена, состоящую из кислородсодержащих групп. Из-за наличия различных функциональных групп ГО имеет более низкую эластичность, а его модуль Юнга зависит от функционализации и молекулярной структуры функциональных групп. 3 Синтез В настоящее время ГО можно синтезировать различными способами, такими как модифицированный метод Хаммера и метод Штауденмайера.Оба метода включают окисление графита, но различаются минеральными кислотами, окислителями, временем приготовления и типом процессов промывки/сушки. 4 В оригинальном методе Хаммерса GO был синтезирован с использованием KMnO 4 и NaNO 3 в концентрированном H 2 SO 4 . Обычно для модифицированного метода Хаммера использовали реактивы Хаммера с добавлением NaNO 3 . GO получают из порошка чистого графита, который постепенно добавляют (вместе с NaNO 3 ) в горячую концентрацию раствора H 2 SO 4 , который охлаждают на ледяной бане.KMnO 4 следует добавлять медленно, чтобы поддерживать температуру реакции ниже 20°C во избежание перегрева и взрывов. Для завершения реакции с KMnO 4 суспензию затем обрабатывают раствором H 2 O 2 и промывают HCl и H 2 O. После фильтрации и сушки получают листы ГО. 5, 6 Этот модифицированный метод оказался очень распространенным и надежным при получении высоких выходов ГО. Метод Штауденмайера представляет собой еще один химический синтез GO, который усовершенствовал уже существующий метод (Brodie, 1859) с использованием KClO3 для получения суспензии графита в дымящейся HNO 3 ; при импровизированном варианте дополнительно включает в качестве окислителей концентрированные H 2 SO 4 и HNO 3 . 7 Дополнительный KClO 3 будет медленно добавляться в течение одной недели во время процедуры. 8 Небольшие изменения обеспечили простую процедуру производства высокоокисленного GO. Приложения Большое и удобное производство GO привело к его появлению в качестве прекурсора для изготовления прозрачных проводящих пленок (TCF). 9 Поскольку GO является гидрофильным, из него можно делать стабильные и гомогенные коллоидные суспензии в водных или полярных органических растворителях, что позволяет легко проводить процесс диспергирования для получения TCF на подложке.Использование монослоя ОГ увеличивает прозрачность тонких пленок за счет более низкой концентрации ОГ в дисперсии, что позволяет тонким пленкам получить более высокую прозрачность и проводимость. 10 Фактически, TCF, изготовленные из GO, могут даже заменить прозрачные проводники из оксида индия и олова. 11 Между тем, функционализированный ГО можно использовать в качестве флуоресцентного и фотолюминесцентного средства в клеточной визуализации. На самом деле, исследование проводилось с использованием скваариновых красителей, которые были загружены внутрь наночастиц мезопористого кремнезема, где поверхности наночастиц были обернуты ультратонкими листами GO.Этот процесс может эффективно защитить загруженный краситель от нуклеофильной атаки и имеет важное значение для приложений, связанных с флуоресцентной визуализацией in vitro. 12 Другие применения были применены к материалам биодатчиков, обнаружения и носителям лекарств на основе его флуоресценции. Заключение Получение графена с масштабируемым производством и низкой стоимостью является жизнеспособным для коммерциализации материала. GO является отличным предшественником графена, поскольку он обладает отличительными чертами и им можно манипулировать, чтобы получить молекулярную структуру графена после процесса восстановления.Использование как модифицированного метода Хаммера, так и метода Штауденмайера было очень осуществимым и распространенным при эффективном производстве высоких выходов ГО. Как производное графена, GO обладает уникальными качествами и множеством возможностей для использования в различных приложениях. Материалы ACS Продукция: Каталожные номера 1. Сун, Цзяньго и др. «Подготовка и характеристика оксида графена». Журнал наноматериалов, 2014 (2014), 11 мар.2014 г., дои: 10.1155/2014/276143. 2. Рэй, Сехар. (2015). Глава 2. Применение и использование оксида графена и восстановленного оксида графена. 39-55. 10.1016/B978-0-323-37521-4.00002-9. 3. Чжэн, Циньбин и др. «Прозрачные проводящие пленки на основе оксида графена». Прогресс в материаловедении, том. 64, июль 2014 г., стр. 200–247., doi:https://doi.org/10.1016/j.pmatsci.2014.03.004. 4. Рамакришнан, Минита Черукутти и Раджендракумар Рамасами Тангавелу.«СИНТЕЗ И ХАРАКТЕРИСТИКА ВОССТАНОВЛЕННОГО ОКСИДА ГРАФЕНА». Передовые исследования материалов, Vol. 678 (2013), 25 марта 2013 г., стр. 56–60., doi:doi:10.4028/www.scientific.net/AMR.678.56. 5. Шахриари, Лейла и Анджали А. Атавале. «Оксид графена синтезирован с использованием модифицированного подхода Хаммерса». Международный журнал возобновляемых источников энергии и инженерной защиты окружающей среды, январь 2014 г. 6. Zaaba, N.I., et al. «Синтез оксида графена с использованием модифицированного метода Хаммерса: влияние растворителя.Procedia Engineering, vol. 184, 2 мая 2017 г., стр. 469–477., doi:10.1016/j.proeng.2017.04.118. 7. Алам, Сайед Насимул и др. «Синтез оксида графена (ОГ) модифицированным методом Хаммерса и его термическое восстановление с получением восстановленного оксида графена (ВОГ)*». Графен, вып. 06, нет. 01, 2017, стр. 1–18., doi:10.4236/graphene.2017.61001. 8. Ли, Цзяньчан и др. «Получение оксида графена и его производных и их применение в биотрибологических системах». Смазочные материалы, вып.2, нет. 3, 2014, стр. 137–161., doi: 10.3390/lubricants2030137. 9. Чжу, Янву и др. «Графен и оксид графена: синтез, свойства и применение». Advanced Materials Research, 29 июня 2010 г., doi: 10.1002/adma.201001068. 10. Чжэн, Цинбин и др. «Прозрачные проводящие пленки, состоящие из сверхбольших графеновых листов, произведенных Langmuir-Blodgett Assembly». АКС Нано, вып. 5, нет. 7, 2011, стр. 6039–6051., doi: 10.1021/nn2018683. 11. Некахи, А., и другие. «Прозрачная проводящая тонкая пленка сверхбольших восстановленных монослоев оксида графена». Прикладная наука о поверхности, том. 295, 15 марта 2014 г., стр. 59–65., doi:10.1016/j.apsusc.2014.01.004. 12. Sreejith, S, et al. «Обертывание из оксида графена на наночастицы мезопористого кремнезема, загруженные сккараином, для биоимиджинга». Журнал Американского химического общества, Национальная медицинская библиотека США, 24 октября 2012 г., www.ncbi.nlm.nih.gov/pubmed/22799451. Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины: Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня. Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется. Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Оксид цинка в Австралии – производственный процесс и спрос
Оксид графена | Материал ACS
Оксид графена | Материал ACS
Произошла ошибка при настройке пользовательского файла cookie
Настройка браузера на прием файлов cookie
Почему этому сайту требуются файлы cookie?
Что сохраняется в файле cookie?

