| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| Найти число нейтронов | Tc | ||
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| Найти число нейтронов | Na | ||
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
Хром. Степени окисления хрома
Степени окисления у хрома
Введение
Степень окисления (СО) – это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов). Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное – без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям. Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется. Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части – практике.
Хром – Cr, положение в таблице Менделеева, физические и химические свойства
Хром – это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета. Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами – устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной (H2SO4) и азотной (HNO3) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл – значит, он может растворяться как в кислотах, так и в щелочах. Элемент растворяется в сильных разбавленных кислотах (например, соляная кислота HCl), в нормальных условиях (н.у.) взаимодействует только с фтором (F). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O2, бором B, азотом N2, серой S2, кремнием Si. Если раскалить Cr, то способен вступить в реакцию с водяными парами.
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 – в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr приобретает СО +2, вещество демонстрирует основные и очень сильные восстановительные свойства. К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее.
- +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного H2O). Для примера приведём оксид Cr2O3 (это зеленоватый порошок, который не растворяется в ), Cr(OH)3, хромиты NaCrO2.
- +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO2, тетрагалогенид CrF4, CrCl4.
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO3 (имеет вид кристаллов красного цвета), K2CrO4, H2CrO4, H2Cr2O7. Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы. А что, если соединение имеет, например, целых три элемента?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Рассмотрим пример:
- PbCrO4 – хромат свинца (II), имеющий вид красной соли. На конце формулы находится кислород, степень окисления которого всегда (за исключением некоторых случаев) будет -2. -2*4=-8. Pb (свинец) имеет СО +2. Дальнейшие действия будут похожи на алгебраическое уравнение, но если честно, то когда человек уже неплохо разбирается в определении степеней окислений и умеет пользоваться таблицей растворимости, вполне возможно избежать таких расчётов. Итак, элемент с неизвестной степенью окисления (хром) обозначим за буквенную переменную.
Степени окисления в следующих формулах попробуйте расставить сами:
- Na2CrO4;
- BaCrO4;
- Fe(CrO2)2;
- Cr2O7;
- H2CrO4.
Хром – один из самых интересных химических элементов, соединения с которым – штука сложная, но необходимая для понимания. Будет замечательно, если данные примеры помогут разобраться со столь кропотливой темой.
Редакция «Учисьучись.рф»
Примеры ОВР соединений хрома
ОВР соединений хромаКак и марганец, хром также образует соединения, в которых проявляет самые разнообразные степени окисления. Соединения хрома в низших степенях окисления являются восстановителями, а в высших – окислителями. Более или менее устойчивыми являются степени окисления 0, +2, +3 и +4 Самая устойчивая из них +3. Как и для марганца, условия протекания окислительно-восстановительных превращений соединений хрома можно изобразить в виде схемы:
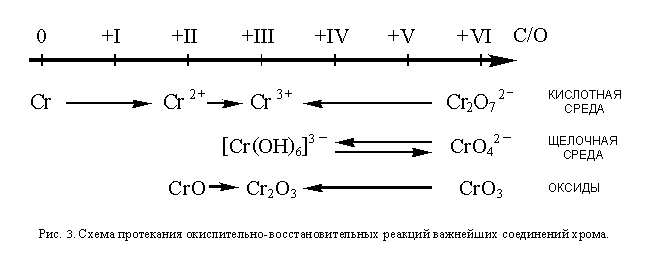
В отличие от перманганат-иона MnO4—, устойчивого как в кислотной, так и в щелочной среде, хромат-ион CrO42- устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции:
2CrO42- + 2H3O + = Cr2O72- + 3H2O
Дихромат-ион, в свою очередь, устойчив только в кислотной и, отчасти, в нейтральной среде, а в щелочной превращается в хромат-ион:
Cr2O72- + 2OH— = 2CrO42- + H2O
Так как в кислотной среде окислительные свойства кислотных остатков оксокислот всегда проявляются сильнее, чем в щелочной, дихромат-ион значительно более сильный окислитель, чем хромат-ион. И наоборот, гексагидроксохромат (+3) — ионы, существующие только в щелочной среде, легко окисляются до хроматов (+6) такими сильными окислителями, как хлор, бром или пероксид водорода.
Как и металлический марганец, хром проявляет восстановительные свойства, легко окисляясь ионами оксония (без доступа кислорода – до Cr2+, на воздухе – до Cr3+). Ион Cr2+, в отличие от Mn2+, – очень сильный восстановитель; он легко окисляется кислородом воздуха, восстанавливает ионы Fe3+ до Fe2+, а также вступает и в другие ОВР.
Кристаллический оксид хрома (VI) – очень сильный окислитель. Как и оксид марганца (VII), это кислотный оксид. Он легко реагирует с водой с образованием хромовой кислоты H2CrO4. Следовательно, в ОВР он может вступать только в твердом виде. В частности, органические вещества при соприкосновении с CrO3 окисляются до углекислого газа, сероводород – до SO2, аммиак – до азота.
Составление уравнений ОВР с участием растворов соединений хрома полностью аналогично составлению уравнений реакций в случае соединений марганца, поэтому здесь приводятся лишь уравнения полуреакций ионов, содержащих хром:
Cr2O72- + 14H3O+ + 6e– = 2Cr3+ + 21H2O
CrO42- + 4H2O + 3e– = [Cr(OH)6]3- + 2OH—
[Cr(OH)6]3- + 2OH— – 3e– = CrO42- + 4H2O
Cr2+ – e– = Cr3+
Рассмотрим примеры реакций, которые не являются окислительно — восстановительными:
1. В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + K2SO4 + H2O
2. В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH 2K2CrO4 + H2O
2K2CrO4 + H2O
2CrO42- + 2H+
Cr2O72- + H2O
щелочная среда
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH 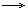 K2CrO4 + H2O
K2CrO4 + H2O
K2CrO4 + H2SO4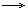 CrO3 + K2SO4 + H2O
CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4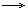 2CrO3 + K2SO4 + H2O
2CrO3 + K2SO4 + H2O
Пример 1. Составить уравнение реакции, протекающей при взаимодействии бихромата калия, серной кислоты и углерода.
K+, Cr2O7 2-, H2O, C0, SO4 2-, H+
В кислой среде бихромат калия образует соли Cr+3:
Cr2O72- + 14H3O+ + 6е— = 2Сr3+ +7H2O 2
C0 + 2H2O – 4e— = CO2 + 4H3O+ 3
3C0 + 2Cr2O72- + 28 16H3O+ + 6H2O = 4Сr3+ + 3CO2 + 12H3O+ + 14 8 H2O
3C0 + 2K2Cr2O7 + 8H2SO4 = 2Сr2(SO4)3 + 2K2SO4 + 3CO2 + 8H2O
Пример 2. Составить уравнение реакции, протекающей при взаимодействии бихромата калия и соляной кислоты.
K+, Cr2O7 2-, Cl—, H+
1. В кислой среде бихромат калия образует соли Cr+3:
Cr2О72- + 14 Н+ + 6е— = 2Сr3+ + 7Н2О 1
2Cl— + 2e— = Cl20 3
2. Добавив в обе части уравнения необходимое количество ионов, запишем молекулярное уравнение:
K2Cr2O7 + 14 HCl = 2СrСl3 + 2KCl + 3Cl2 + 7H2O
Пример 3. Составить уравнение реакции, протекающей при взаимодействии бихромата натрия и гидроксида цезия (реакция не ОВР).
Na+, Cr2O7 2-,Cs+, OH—
Na2Cr2O7 + 2CsOH = Na2CrO4 + Cs2CrO4 + H2O
Пример 4. Составить уравнение реакции, протекающей при взаимодействии бихромата калия и концентрированной серной кислотой (реакция не ОВР).
К2Cr2O7 + 2H2SO4 = 2CrO3 + 2КHSO4 + H2O