История развития представлений о строении атома » HimEge.ru
Все тела живой и неживой природы, несмотря на их разнообразие, состоят из мельчайших частиц — атомов. Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»). Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
Первые представления об атоме
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.
Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Атоми́зм — натурфилософская теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. (В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы).
Основы атомной теории строения вещества
В 1808 г. физик Дальтон Джон (1766–1844) возродил атомизм, доказал реальность существования атомов. Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
Дальтон был одним из самых знаменитых и уважаемых учёных своего времени, ставший широко известным благодаря своим новаторским работам в разных областях знания. Он впервые (1794) провёл исследования и описал дефект зрения, которым страдал сам, — цветовая слепота, позже названный в его честь дальтонизмом; открыл закон парциальных давлений (закон Дальтона) (1801), закон равномерного расширения газов при нагревании (1802), закон растворимости газов в жидкостях (закон Генри-Дальтона). Установил закон кратных отношений (1803), обнаружил явление полимеризации (на примере этилена и бутилена).
Однако вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
В 1897 г. английский физик Дж. Томсон изучая катодные лучи, пришел к выводу, что атомы любого вещества содержат отрицательно заряженные частицы, которые он назвал электронами. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью,в положительно заряженной сфере находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
Ядерная модель атома (планетарная)
Резерфорд бомбардировал α-частицами атомы тяжелых элементов (золото, серебро, медь и др.). α-частицы – это полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома (планетарная):
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома.
Датским физик Нильс Бор (1885 — 1962) считал что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и «спасающих») атом Резерфорда. Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.
Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией.
Квантовая теория строения атома
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности Гейзенберга служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N,
N = А — Z,
А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
Квантовая механика — математически очень сложная теория. Но главная трудность не в этом. Процессы, которые описывает квантовая механика, — процессы микромира — недоступны не только восприятию нашими органами чувств, но и воображению. Люди лишены возможности представить их себе наглядно в полной мере, так как они совершенно отличны от тех макроскопических явлений, которые человечество наблюдало на протяжении миллионов лет. Человеческое воображение не создает новые, а лишь комбинирует известные, поэтому практически невозможно на нашем макроскопическом языке описать поведение фотонов и других частиц.
См. также Современная теория строения атома
История открытия атома и его строения
09.10.2015Физика относится к науке полной тайн и загадок, а одной из увлекательных страниц ее истории, несомненно, является открытие строения сложного атома. Так к концу XIX века в обществе витало много предположений, что строение атома не так уж и просто. Все это стало известно благодаря открытию электролиза и самого электрона. Теории о существовании атома, как неделимой частицы, которая нас окружает, уходит своими корнями еще в далекое прошлое. Само понятие атом существовало еще и до н.э. Ученый Демокрит был убежденным исследователем атома. Он представлял себе картину мира следующим образом.
Все тела состоят из атомов, у которых неделимая и неизменная форма, число этих атомов неограниченно, так же как и число их типов, они смело могут образовывать различные соединения, благодаря различным крючкам и выступам, ну и ко всему они находятся в постоянном движении. В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы. Основываясь на этих данных, ученые физики продолжали философствовать о строении атома, и, вскоре, после открытия электрона в 1897 году, Дж. Дж. Томсоном была представлена модель атомного строение.
В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы. Основываясь на этих данных, ученые физики продолжали философствовать о строении атома, и, вскоре, после открытия электрона в 1897 году, Дж. Дж. Томсоном была представлена модель атомного строение.
Согласно модели Томсона атом имеет положительный заряд, который равномерно заполняет весь его объем, внутри его расположены электроны, тем самым атом несколько напоминает пудинг с изюмом. Предполагалось, что электронов большое количество, и они могут находиться в движении. Сам атом являлся электро-нейтральным. Устойчивость атома определяло расположение электронов. Своей разработкой Томсон трактовал ряд физических явлений у некоторых веществ.
Вскоре была доказана несостоятельность этой теории. Модель строения атома Томсона противоречила опытам, которые были проведены Резерфордом. Резерфорд – это выдающийся ученый, основатель некоторых направлений в физики, лауреат Нобелевской премии. В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Д.И. Менделеев, открыв свой закон, подтвердил то, что между химическими элементами есть своя закономерность. Отсюда следовал вывод – все атомы тоже имеют что-то общее. До конца XIX века, считалось, что атом не может разрушаться, но в дальнейшем были сделаны открытия по строению атома, оно достаточно сложное, ко всему у него есть способность к превращениям. Так было доказано выделение электронов, получение рентгеновских лучей (В. Рентген в 1895 году) и радиоактивного излучения (А. Беккерелей в 1896 году).
Большой шаг в исследовании строения атома сделал Н. Бор. Им был сделан анализ всех данные, что привело его к выводу – описание систем атомов не должно ограничиваться привычными представлениями в физики. Им были написаны постулаты – о стационарных состояниях и правило частот. Его теория оказала огромный клад в развитие физики, химии, выяснении структуры атома, спектроскопии и т.д. Но оставались вещи, которые она и не могла объяснить. Так Бор представлял, что движение электронов просто механическое, хотя оно не являлось таковым. В дальнейшем это было объяснено с помощью новой теории кванта.
Им были написаны постулаты – о стационарных состояниях и правило частот. Его теория оказала огромный клад в развитие физики, химии, выяснении структуры атома, спектроскопии и т.д. Но оставались вещи, которые она и не могла объяснить. Так Бор представлял, что движение электронов просто механическое, хотя оно не являлось таковым. В дальнейшем это было объяснено с помощью новой теории кванта.
Открытие урана в 1939 году доподлинно подтвердило, что атом способен делится. Ко всему он состоит не только из мелких частиц. Эти части способны к самопроизвольному испусканию при радиоактивном разрушении. Атом еще и способен давать излучение, и которое может быть не только видимое, но также и электромагнитное (пример: х-лучи).
Рейтинг статьи: 29083 просмотра
Автор: Елена Мазина
Открытия и атом [ВИДЕО]
3.2.1. Строение атома — Энергетика: история, настоящее и будущее
3.
 2.1. Строение атома
2.1. Строение атомаВсе в мире состоит из молекул, которые представляют собой сложные комплексы взаимодействующих атомов. Молекулы — это наименьшие частицы вещества, сохраняющие его химические свойства. Молекула состоит из одинаковых (в простом веществе) или разных (в химическом соединении) атомов, объединенных химическими связями.
Атом – наименьшая частица химического элемента, которая является носителем его химических свойств. Все атомы химических элементов имеют одинаковую структуру. Их линейный размер в диаметре составляет примерно 10-10м. Атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов, которые размещены на электронных орбитах атома.
Электроны в атоме сгруппированы по оболочкам (слоям), которые принято обозначать буквами К, L, М, N, O, P, Q. Строение электронных оболочек подчинено строгому физическому закону – «в одном атоме не может быть двух электронов, находящихся в одном и том же энергетическом состоянии». Это состояние определяется тремя параметрами: энергией связи электрона в атоме, характером его вращения вокруг ядра (орбитальным моментом) и вращения вокруг собственной оси (спином). Каждая электронная орбита соответствует вполне конкретному значению энергии связи, благодаря которой электроны удерживаются в атоме. Электроны, получившие дополнительную энергию, могут переходить на орбиту, более удаленную от ядра, или вообще покидать пределы атома. Состояние атома, в котором электроны перешли со свойственной им оболочки на более удаленную от ядра орбиту, является, как правило, неустойчивым. Время его нахождения в таком возбужденном состоянии не превышает 10-8с. При переходе электрона с удаленной на более близкую к ядру орбиту выделяется энергия.
Это состояние определяется тремя параметрами: энергией связи электрона в атоме, характером его вращения вокруг ядра (орбитальным моментом) и вращения вокруг собственной оси (спином). Каждая электронная орбита соответствует вполне конкретному значению энергии связи, благодаря которой электроны удерживаются в атоме. Электроны, получившие дополнительную энергию, могут переходить на орбиту, более удаленную от ядра, или вообще покидать пределы атома. Состояние атома, в котором электроны перешли со свойственной им оболочки на более удаленную от ядра орбиту, является, как правило, неустойчивым. Время его нахождения в таком возбужденном состоянии не превышает 10-8с. При переходе электрона с удаленной на более близкую к ядру орбиту выделяется энергия.
Ядро – центральная часть атома, состоящая из положительно заряженных протонов и нейтральных нейтронов. Эти частицы, называемые нуклонами, удерживаются в ядрах короткодействующими силами притяжения, возникающими за счет обмена квантами так называемого «сильного» взаимодействия.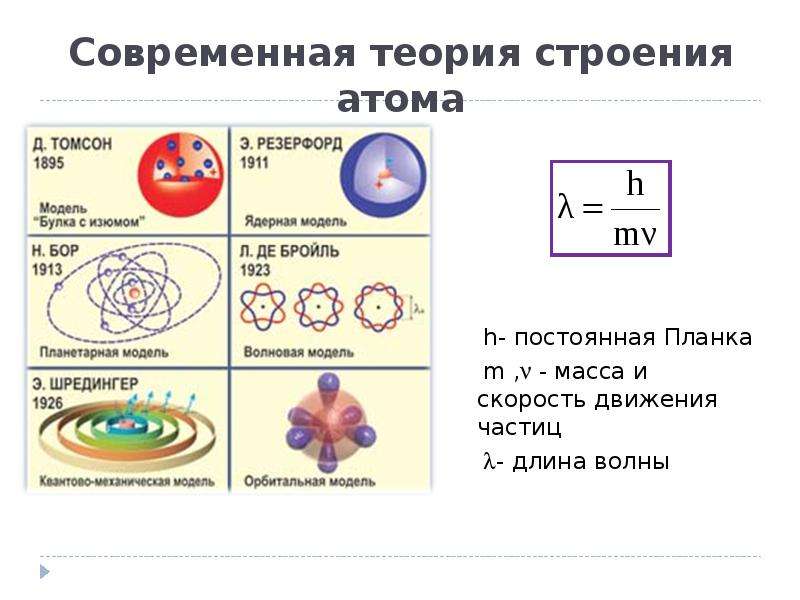 Размеры ядра примерно в 10–100 тысяч раз меньше линейных размеров атома (диаметр ядра порядка 10-14м). Несмотря на относительно малые размеры ядра, в нем сосредоточена практически вся масса атома, что обусловливает очень высокую плотность ядерного вещества. Масса ядра несколько ниже суммы масс составляющих его протонов и нейтронов в свободном состоянии. Эта разница называется «дефектом массы».
Размеры ядра примерно в 10–100 тысяч раз меньше линейных размеров атома (диаметр ядра порядка 10-14м). Несмотря на относительно малые размеры ядра, в нем сосредоточена практически вся масса атома, что обусловливает очень высокую плотность ядерного вещества. Масса ядра несколько ниже суммы масс составляющих его протонов и нейтронов в свободном состоянии. Эта разница называется «дефектом массы».
Ядро элемента X принято обозначать как илиX7A, где Z – заряд ядра, равный числу протонов, определяющий атомный номер ядра;A– массовое число ядра, равное суммарному числу протонов и нейтронов.
Протон – элементарная частица, носящая единичный положительный заряд, равный по абсолютной величине заряду электрона. Он является ядром атома простейшего водорода.
Нейтрон – незаряженная элементарная частица с массой покоя, несколько превышающей массу протона. В свободном состоянии нейтрон – неустойчивая частица и претерпевает превращения. Большая проникающая способность нейтронов объясняется тем, что эти частицы не заряжены. Они свободно пролетают сквозь атомы, не взаимодействуя с их электронами и не задерживаясь в своем движении, если только не сталкиваются с ядрами.
Они свободно пролетают сквозь атомы, не взаимодействуя с их электронами и не задерживаясь в своем движении, если только не сталкиваются с ядрами.
Протон и нейтрон обозначаются соответственно и, где нижние индексы обозначают заряд, а верхние – массу в атомных единицах массы (а. е. м.), которая округляется до единицы. В качестве а. е. м. принята 1/12 часть массы атома углерода. Масса протона и нейтрона в 1840 раз больше массы электрона. Для протонов и нейтронов существует общее название нуклоны. Положительный заряд ядра определяется количеством протонов в нем. Атом любого химического элемента характеризуется двумя главными параметрами: массовым числом и атомным номером элемента в Периодической системе химических элементов Д.И. Менделеева. Массовое число А– суммарное число протонов и нейтронов в ядре данного атома. Атомный номер Z–число протонов, входящих в состав ядра. Исходя из этих определений, число нейтронов в ядре равно N=A–Z.
Ядра элементов с одинаковым числом протонов, но разным числом нейтронов называются изотопами. В качестве примера можно привести природный уран, который имеет три изотопа:В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
В качестве примера можно привести природный уран, который имеет три изотопа:В настоящее время известно около 1500 изотопов. Одни из них устойчивые (стабильные), другие – неустойчивые, радиоактивные.
Заряд и массовое число являются основными характеристиками атомных ядер. Разновидности атомов, характеризующиеся определенным массовым числом и атомным номером, называют нуклидами и обозначают символом элемента с указанием атомного номера (внизу слева) и массового числа (вверху слева), например:В периодической системе элементы расположены строго последовательно в порядке возрастания заряда ядер их атомов. При этом свойства элементов находятся в периодической зависимости от заряда ядер их атомов. В каждом периоде системы химических элементов Д.И. Менделеева идет построение нового электронного слоя, а в больших периодах также достройка внутренних слоев. Поэтому число электронных слоев в атоме обычно равно номеру периода, в котором находится соответствующий элемент.
При нормальном состоянии атома количество его электронов, движущихся вокруг ядра, соответствует количеству протонов в ядре, что приводит к нейтрализации суммарных отрицательных зарядов электронов и положительного заряда ядра. В этом состоянии атом является электрически нейтральной системой.
В этом состоянии атом является электрически нейтральной системой.
Устойчивость атомных ядер обусловлена ядерными силами притяжения, удерживающими нуклоны в ядре. Особенность их заключается в том, что они достаточно велики на расстояниях, сопоставимых с размерами ядра (в 2–3 раза превосходят силы отталкивания Кулона, действующие между заряженными частицами, входящими в состав ядра). Эта особенность ядерных сил обусловлена энергией связи, которая составляет несколько миллионов электрон-вольт, что от нескольких сотен до нескольких тысяч раз превышает энергию связи электрона в атоме. При этом важно подчеркнуть, что устойчивость ядер атомов обеспечивается лишь при вполне определенных соотношениях протонов и нейтронов. Для легких ядер их число почти одинаково, для тяжелых – доля нейтронов возрастает. Ядра атомов, которые находятся в конце таблицы Менделеева (с атомным номером Z>82), как правило, неустойчивы. При увеличении суммарного числа нуклонов уменьшается сила ядерных притяжений и эффект кулоновских сил отталкивания начинает превалировать. В таких атомах силы ядерных притяжений уже не хватает для обеспечения полной устойчивости ядер, что приводит к процессам их внутренней перестройки (самопроизвольным превращениям), сопровождающимся выделением энергии. Таким образом, у химических элементов с атомным номером (зарядом ядра) Z<83 существуют как стабильные, так и радиоактивные изотопы. У элементов с атомным номером Z>84 имеются лишь радиоактивные изотопы. Такие изотопы называют радионуклидами.
В таких атомах силы ядерных притяжений уже не хватает для обеспечения полной устойчивости ядер, что приводит к процессам их внутренней перестройки (самопроизвольным превращениям), сопровождающимся выделением энергии. Таким образом, у химических элементов с атомным номером (зарядом ядра) Z<83 существуют как стабильные, так и радиоактивные изотопы. У элементов с атомным номером Z>84 имеются лишь радиоактивные изотопы. Такие изотопы называют радионуклидами.
Процесс спонтанного перехода атомного ядра в другое ядро или ядра с испусканием при этом различных частиц называется радиоактивным распадом, или радиоактивностью.
«История развития учения о строении атома. Ядерная модель атома. Опыты Э. Резерфорда»
Похваленная Т.В. — преподаватель физики
ГБОУ СЕВКИТИП.
Конспект урока в группе №208 по профессии «Секретарь руководителя»
по теме «История развития учения о строении атома» по учебнику Е.В.Коршака
Тема: «История развития учения о строении атома. Ядерная модель атома. Опыты Э. Резерфорда»
Ядерная модель атома. Опыты Э. Резерфорда»
Тип урока: Урок изучения нового материала
Цель урока: Формирование системы научных знаний о строении материи, в частности о строении атома
Задачи:
образовательная – ознакомить учащихся со строением атома, расширить представление о физической картине мира. Способствовать формированию устойчивых межпредметных связей физики с химией, информатикой и математикой. Формировать основы материалистического мировоззрения.
развивающая – заинтересовать процессом мышления первооткрывателей атома, полетом их мыслей, отработать навыки определения состава атома, состава ядра атома по периодической системе химических элементов, продолжить развитие навыков работы с опорным конспектом, таблицами и схемами, развитие внимательности, умений анализировать, сравнивать, делать логические выводы, пользоваться ПО ПК, сетью Интернет.
воспитательная – развивать навыки коллективной работы. Способствовать развитию любознательности, формировать умение излагать свою точку зрения и отстаивать свою правоту.
Девиз урока:
«Атом неисчерпаем так же как Вселенная»
Оборудование: компьютер, мультимедийный проектор, экран, презентации по теме, фрагменты фильмов «Открытая физика», видеоролик о строении атома «Внутрь вещества», периодическая таблица элементов Д.И.Менделева, видеофрагмент «Опыт Резерфорда», набор карточек с тестами, схема конспекта урока.
План урока:
1.Организационный момент:
— мотивация учащихся – сообщение содержания и целей урока
— актуализация знаний (беседа по выявлению опорных знаний учащихся)
2. Изучение нового материала
3. Закрепление материала
4. Подведение итогов, выставление оценок, домашнее задание
Подведение итогов, выставление оценок, домашнее задание
5. Рефлексия
Конспект урока:
I. Организационный момент (слайд 1-5)
— мотивация учащихся – сообщение содержания и целей урока
Учение об атомах стало важнейшей областью физики. Мир атома никто не видел, но тем не менее он реален. Много проблем ставит перед нами жизнь. Одни решаются очень легко, над другими человечество бьется тысячи лет, А знаете над каким вопросом?
— Как устроен мир?
— Из чего все состоит?
-Откуда мы появились?
А такой вопрос мы задаем при взгляде на небо.
-Как были созданы Звезды?
-И как были сделаны все элементы?
-Что положило начало самой вселенной?
Примечательно то, что это понимание пришло в процессе изучения самых маленьких строительных блоков материи – атомов. Изучив их структуру, ученым стало понятно, что теперь они смогут объяснить строение окружающего мира. Все в окружающем мире сделано из крошечных объектов, называемых атомами. Но люди доказали их существование только в начале 20 века. Мы теперь не только знаем точное количество атомов во вселенной, но и то, что они представляют 92 различных вида. Многие из этих атомов вам знакомы и представлены давно известными вещами окружающего мира: кислород и железо, углерод и олово, золото и серебро и т д. Все во вселенной: Звезды, планеты, горы, моря, птицы, животные, Вы и я состоим из этих атомов или их комбинаций. Оказывается, что ключ к тайне самого мироздания находиться в сердцевине каждого атома во вселенной. Для сравнения – атомов в одном стакане воды больше чем стаканов воды во всех океанах мира.
Изучив их структуру, ученым стало понятно, что теперь они смогут объяснить строение окружающего мира. Все в окружающем мире сделано из крошечных объектов, называемых атомами. Но люди доказали их существование только в начале 20 века. Мы теперь не только знаем точное количество атомов во вселенной, но и то, что они представляют 92 различных вида. Многие из этих атомов вам знакомы и представлены давно известными вещами окружающего мира: кислород и железо, углерод и олово, золото и серебро и т д. Все во вселенной: Звезды, планеты, горы, моря, птицы, животные, Вы и я состоим из этих атомов или их комбинаций. Оказывается, что ключ к тайне самого мироздания находиться в сердцевине каждого атома во вселенной. Для сравнения – атомов в одном стакане воды больше чем стаканов воды во всех океанах мира.
«В одном мгновенье видеть вечность
Огромный мир – в зерне песка.
В единой горсти – бесконечность
И небо – в чашечке цветка»
— актуализация знаний (беседа по выявлению опорных знаний учащихся)
1. Скажите, а какие явления доказывают нам, что любое тело состоит из частиц? (явление диффузии, броуновское движение и, наконец фотографии, полученные с помощью электронного микроскопа).
Скажите, а какие явления доказывают нам, что любое тело состоит из частиц? (явление диффузии, броуновское движение и, наконец фотографии, полученные с помощью электронного микроскопа).
2. Что вы знаете о строении молекул и атомов ( молекулы состоят из атомов, атомы состоят из ядра и вращающихся вокруг него электронов, каждый по своей орбите)
3. Из чего состоит ядро атома? (из протонов и нейтронов). Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае, он обладает некоторым положительным или отрицательным зарядом, и называется ионом).
II. Изучение нового материала (слайд 6)
При подготовке к уроку, мы с учащимися широко использовали информационные технологии (электронные пособия, мультимедийный проектор, интернет для составлении презентаций и составления видеороликов).
Сегодня мы постараемся изучить и закрепить знания по данной теме, расширить свое представление об атомах. Вспомним выдающихся ученых и их открытия в этой области атомной физике. По опережающим заданиям вы подобрали материал и подготовили презентации, ролики по предложенным вопросам. По ходу выступлений каждый из вас на месте будет заполнять хронологическую таблицу по теме нашего урока, которую вы должны были подготовить дома.
Вспомним выдающихся ученых и их открытия в этой области атомной физике. По опережающим заданиям вы подобрали материал и подготовили презентации, ролики по предложенным вопросам. По ходу выступлений каждый из вас на месте будет заполнять хронологическую таблицу по теме нашего урока, которую вы должны были подготовить дома.
Вопрос «Из чего образуются все тела в мире» всегда интересовал и интересует всех людей. Сейчас мы с вами откроем историческую страницу.
В истории изучения атома можно выделить ключевые фигуры:
— Демокрит- высказал идею, что все тела состоят из неделимых частиц – атомов.
-Томсон открыл электрон и предложил первую модель атома
— Резерфорд – планетарная модель атома
— Чедвик – открыл нейтрон, создав окончательный вариант планетарной модели атомов.
Сообщения учащихся – переход осуществляется по гиперссылкам.
Опыт Резерфорда – (вопрос к учащимся)
Как можно объяснить столь разные углы отклонения альфа-частиц?
Результаты опыта можно объяснить следующим образом:
Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота. Это возможно потому, что легкие электроны почти не влияют на движение тяжелой альфа-частицы. Так как они в большинстве случаев. отклоняются на малые углы, атомы в большей части своего объема заполнены электронами и лишь небольшую их часть занимает положительно заряженное вещество. Это центральная часть атома получила название ядра. Из опытов следует, что ядро и отталкивает альфа-частицу, причем тем сильнее, чем ближе к ядру она проходит.
Просмотр видеоролика «Атом»
Так каково же строение атома?
Вывод:
— Вещества состоят из молекул, молекулы из атомов, атомы из ядра, вокруг которого вращаются электроны.
— Ядро состоит из протонов и нейтронов
— Протоны заряжены положительно, электроны – отрицательно, нейтроны заряда не имеют
— В атоме число электронов равно числу протонов, поэтому атом электронейтрален.
— Одной из первых научных теорий в области атомной физики была планетарная модель атома Э. Резерфорда
III. Закрепление материала (слайд 7-8)
Решение задач на вычисление кол-ва протонов (р), электронов (е) и нейтронов (n) в атомах с использованием таблицы Менделеева
(период 2 ряд 2, период 3 ряд 3).
После решения задачи – вопрос:
Какие сведения о строении атома можно получить из периодической системы химических элементов Д.И. Менделеева? –
( кол-во р,е.n, А – массовое число, т.е. характеристики химических элементов) (сколько в природе химических элементов, столько и видов атомов, «кирпичиков мироздания).
Итак, главной характеристикой химического элемента является заряд ядра. Он совпадает с порядковым номером элемента. Атом в целом, электронейтрален.
Попробуйте поработать над загадками из атомной физики.
… встали в ряд
В … их растёт заряд
Значит столько в них …
А в округе …
(элементы, ядра, протоны, электроны)
Есть в ядре ещё …
Что … иметь не склонны
Ну а то, что в … дробь
В том виновен …
(нейтроны, заряд, масса, изотоп)
Рядом много …
Не живут определённо
И уже на новой …
… восходит свой.
(электроны, слой)
Контроль знаний. Тест
Тест
1 вариант
1. Учёный, создатель планетарной модели строения атома:
а) П.Кюри; б) Э. Резерфорд; в) Д.Томсон.
2. Делим ли атом с точки зрения химии?
а) да; б) нет.
3. Атом состоит из:
а) ядра и электронной оболочки; б) ионов и электронов; в) катионов и протонов.
4. Символ протона:
а) n; б) e; в) p.
5. Заряд нейтрона равен:
а) 0; б) –1; в) +1.
6. Масса электрона:
а) 1,00728 а.е.м.; б) 1,00866 а.е.м.; в) 5,486 · 10–4 а.е.м.
7. Разновидности атомов химического элемента, отличающиеся по массе, называются:
а) изомерами; б) изотопами; в) гомологами.
8. Массовое число –
а) число протонов в ядре; б) число нейтронов в ядре; в) число электронов в электронной оболочке; г) число нуклонов в ядре.
9. Ядро изотопа лития с относительной атомной массой 7 содержит:
а) 3p и 7n; б) 3p и 4n; в) 3p и 10 n.
2 вариант
1. Учёные-создатели протонно-нейтронной модели атома:
а) П.Кюри и М.Кюри; б) Д.Томсон и Э.Резерфорд; в) Д.Иваненко и В.Гейзенберг.
2. Делим ли атом с точки зрения физики?
а) да; б) нет.
3. Ядро любого вещества состоит из:
а) электронов; б) протонов и нейтронов; в) ядра и электронной оболочки.
4. Символ нейтрона:
а) n; б) e; в) p.
5. Заряд электрона равен:
а) 0; б) –1; в) +1.
6. Масса протона равна:
а) 1,00728 а.е.м.; б) 1,00866 а.е.м.; в) 5,486 · 10–4 а.е.м.
7. Зарядовое число – это:
а) число нейтронов в ядре; б) число протонов в ядре; в) число электронов в электронной оболочке.
8. Ядро изотопа гелия с относительной атомной массой 4 содержит:
а) 2p и 2n; б) 2p и 4n; в) 2p и 6n.
9. Определите с помощью таблицы Д.И.Менделеева, атом какого химического элемента имеет 3 протона в ядре?
а) гелий; б) литий; в) бериллий.
В помощь тем, кто не до конца составил хронологическую таблицу по основному вопросу темы, презентация (общая).
IV. Подведение итогов, выставлении оценок
Давайте подведем итоги нашего урока.
Одной из основной задач физики, является формирование материалистического мировоззрения:
«Закон единства и борьбы противоположностей» ярко проявляется в строении атомов, так как атом представляет собой единство двух противоположностей: положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Вы сегодня хорошо поработали, за что всем вам огромное спасибо.
Оценки за проделанную работу:
V. Рефлексия
1. Что нового вы узнали на уроке?
2. Что вам понравилось на уроке? Что не понравилось?
3. Где вы можете применить полученные знания и умения?
4. Какое настроение на конец урока?
5. Какие замечания и предложения на будущее?
Какие замечания и предложения на будущее?
Домашнее задание
Составить кроссворд по данной теме
Придумать загадки по данной теме
Конспект урока и § урока №64
Литература
1. Е.В.Коршак – Физика 11 класс
2. А.В.Перышкин – Физика 8 класс
3. Е.А.Орлова –« Путешествие в мир атома»
4. В.Н.Максимов «Межпредметные связи в процессе обучения»
5. «Открытая физика» — СD диск
основные сведения, из каких частиц состоит, описание структуры
Сегодня даже дети дошкольного возраста знают, что все вокруг состоит из молекул и атомов. А вот что это такое и из чего они, в свою очередь, состоят — знает далеко не каждый взрослый. В этой статье просто и доступно, поделимся современными знаниями о мельчайших частицах.
В этой статье просто и доступно, поделимся современными знаниями о мельчайших частицах.
Что такое атом — история открытия
Итак, все окружающие нас объекты и мы сами состоим из крошечных частиц, которые называются атомами. В их состав входят еще меньшие частицы: протоны, нейтроны и электроны. Современное строение атома наука открыла сравнительно недавно, до этого его долго считали неделимой частицей.
Мысль о том, что все вокруг состоит из мельчайших, невидимых глазу частиц возникла в Древней Греции и Древней Индии еще до нашей эры. Древнегреческий философ Демокрит был материалистом. Именно он первым ввел в обиход понятие атома (с греческого — atomos — неделимый). Демокрит считал, что невидимые частицы вечны, их бесчисленное множество, они постоянно двигаются, обладают весом, размером и формой.
Последующее развитие теория атомизма получила в Средние века и Новое время в работах французского физика Пьера Гассенди (1592—1655 гг.) и английского ученого Роберта Бойля (1627-1691 гг. ).
).
Развитием атомистической теории и превращением ее в атомно-молекулярное учение занимались также Ломоносов, Лавуазье, Дальтон.
Долгое время атом считали элементарной, т.е. неделимой частицей. Но в 1897 году Джозеф Дж. Томсон открыл первую субатомную частицу — электрон. Это открытие имело огромное значение. Ученый впервые предложил определенную структуру строения, считавшейся ранее неделимой частицы, которая получила название «пудинг с изюмом». Согласно этой модели атом — это положительно заряженная сфера, внутри которой находятся отрицательно заряженные электроны.
Но теорию Томсона опроверг Эрнест Резерфорд. В 1917 году британским физиком было совершено открытие протона — положительно заряженной элементарной частицы. Открыв протон, Резерфорд предположил и наличие нейтронов — нейтрально заряженных частиц в атоме. Позже их существование экспериментально подтвердил Джеймс Чэдвик. Основываясь на своем открытии, Резерфорд предложил свое описание атомной модели: положительно заряженное ядро и окружающие его электроны.
В 1913 году датчанин Нильс Бор предложил свой вариант строения атома, получивший название «планетарной модели». Согласно теории Бора, электроны находятся на определенном расстоянии от атомного ядра и вращаются по специальным орбитам (по аналогии с планетами, вращающимися вокруг Солнца).
В начале XX века планетарную модель заменила волновая модель, принятая научным сообществом во всем мире.
Современные представления о строении атома были бы невозможны без открытия элементарных частиц и явления радиоактивности. Огромный вклад в науку, помимо вышеназванных ученых, внесли Эрвин Шредингер, Макс Планк, Вольфганг Паули.
Атомная структура — современные знания
Источник: infourok.ruНа чем базируется, из скольки главных частиц состоит
Основу современных представлений теории атомизма составляют следующие положения:
- Атом состоит из ядра и окружающей его электронной оболочки.
- Электронная оболочка представляет собой движущиеся вокруг ядра электроны.

- Ядро всегда положительно заряжено — оно состоит из протонов, обозначающихся символом — p и нейтронов — n. Заряд ядра всегда равен сумме протонов в нем.
- Атом электронейтрален, так как число отрицательных частиц — электронов (е–) равняется числу положительных частиц — протонов (p+).
- Его электронейтральность может нарушаться, при условии, что он отдает или присоединяет электроны, при этом он становится положительно или отрицательно заряженным ионом соответственно.
- Электроны располагаются вокруг ядра в трехмерном пространстве. Они находятся в специальных областях, которые называют орбиталями. Каждая из этих областей характеризуется формой, размером и ориентацией внутри атома, каждой из орбиталей присваивается буквенно-цифровое обозначение.
Атомная теория — Американское химическое общество
Бесплатные статьи
«Следуй за углеродом». Следуйте за Что?
Февраль 2008 г. (стр. 16–19)
Автор: Lora Bleacher
Химические связи: Атомная теория, ядерная, органическая / биохимия
Описание: Описывает набор инструментов для анализа проб на Марсе (SAM) на борту Марсианской научной лаборатории (MSL), чтобы приземлиться на Марсе в конце 2009 года и оставайтесь там, блуждая по поверхности и собирая данные. Приборы включают лазерный спектрометр, газовый хроматограф и квадрупольный масс-спектрометр. Далее следует обсуждение ценности изучения углерода как важнейшего ингредиента жизни и его роли в органических соединениях. Разговоры об изотопах углерода, дающие информацию о происхождении органических материалов, которые может обнаружить SAM.
Приборы включают лазерный спектрометр, газовый хроматограф и квадрупольный масс-спектрометр. Далее следует обсуждение ценности изучения углерода как важнейшего ингредиента жизни и его роли в органических соединениях. Разговоры об изотопах углерода, дающие информацию о происхождении органических материалов, которые может обнаружить SAM.
Февраль 2006 г. (стр. 8–10)
Автор: Лоис Фруен
Химические связи: Атомная теория, равновесие, история / биография, ядерная, органическая / биохимия
Описание: Обсуждаются методы, используемые для аутентификации древностей, с упором на радиоуглеродное датирование.Описываются процесс и справочная информация. Другие описанные методы: определение твердости и плотности, микроскопический анализ минерального состава, масс-спектрометрия для измерения отношения изотопов О-18 к О-16. Ученые заявили, что артефакты были подделкой, но дальнейшие исследования, проведенные другими учеными, опровергли заявления о подделке. Вопрос остается без ответа. Химия сосредотачивается на изотопном составе и присутствии углекислого газа в грунтовых водах, растворяющих кальцит (уравнения равновесия приведены).
Вопрос остается без ответа. Химия сосредотачивается на изотопном составе и присутствии углекислого газа в грунтовых водах, растворяющих кальцит (уравнения равновесия приведены).
Super Fibers
Февраль 2006 г. (стр. 11–13)
Автор: Кристен Браунли
Химические связи: Атомная теория, связь
Описание: Говорит об одежде пехоты в будущем, предоставляя все, от личного кондиционирования воздуха до показаний состояния здоровья, двусторонней связи и смены камуфляжа в соответствии с местность, защита от снарядов, все это спроектировано в ткани униформы на основе углеродных нанотрубок.Обсуждается открытие и история разработки и производства нанотрубок, а также предполагаемые роли волокон, сделанных из них, в том числе печально известный космический лифт и всемирный дистрибьютор электроэнергии.
Откуда берутся химические элементы?
Октябрь 2009 г. (стр. 6–8)
Автор: Кэролин Рут
Химия Связи: Атомная теория, Ядерная, Периодичность, Реакции
Описание: Описывает различные процессы образования различных элементов в звездах различных типов. Подробно описаны реакции синтеза, деления и r-реакции. Спектроскопия используется для идентификации элементов в звездах и газовых облаках.
Подробно описаны реакции синтеза, деления и r-реакции. Спектроскопия используется для идентификации элементов в звездах и газовых облаках.
ChemHistory: The New Alchemy
Октябрь 2006 г. (стр. 15–17)
Автор: Майкл МакКлюр
Химия Связи: Атомная теория, История / Биография, Ядерная, Периодичность
Описание: Относится к истории открытия / объяснения различных ядерных реакций (синтез, радиоактивность, деление, трансмутация). Работая с трансурановыми элементами, Сиборг предложил ряд актинидов.
ChemSumer: Химия цифровой фотографии и печати
Февраль 2006 г. (стр. 4–7)
Автор: Брайан Рориг
Химические связи: Атомная теория, связывание, металлы / неметаллы, периодичность
Описание: Начинается с очень краткого описания пленочной фотографии и ее химии. Затем описывается роль полупроводников типа «n» и «p» в формировании диодов, фотосайтов или пикселей в датчике цифровой камеры. Также обсуждаются различия между черным и белым и цветными датчиками.Затем обсуждаются процессы струйной и лазерной печати, уделяя особое внимание разнице в заряде для передачи изображения или текста.
Также обсуждаются различия между черным и белым и цветными датчиками.Затем обсуждаются процессы струйной и лазерной печати, уделяя особое внимание разнице в заряде для передачи изображения или текста.
Чудесный год Эйнштейна
декабрь 2005 г. (стр. 4–6)
Автор: Дорис Кимбро
Химические связи: Атомная теория, история / биография, твердые тела / жидкости / газы
Описание: Обсуждаются три основные проблемы, решенные Эйнштейном в 1905 году: фотоэлектрический эффект, природа атомной структуры и пространственно-временной континуум.Фотоэлектрический эффект: описывает свет как электромагнитные волны и утверждает, что частота, а не интенсивность, определяет, выбрасываются ли электроны, когда свет падает на металл, а более высокая частота означает, что электроны выбрасываются быстрее. Ответ Эйнштейна: думайте о свете здесь как о частице (фотоне), а не как о волне. Атомная теория: Эйнштейн объяснил броуновское движение как движение атомов и молекул, сталкивающихся друг с другом, и рассчитал размер атомов на основе своих наблюдений, закрепив идею атомов для сомневающихся ученых. Специальная теория относительности: Эйнштейн показал, что время и пространство относительны, в зависимости от системы координат наблюдателя. Схема иллюстрирует фотоэлектрический эффект.
Специальная теория относительности: Эйнштейн показал, что время и пространство относительны, в зависимости от системы координат наблюдателя. Схема иллюстрирует фотоэлектрический эффект.
Antimatter
Апрель 2005 г. (стр 10–13)
Автор: Брайан Рориг
Химия Связи: Атомная теория, Ядерная
Описание: Определяет антивещество и устанавливает существование частиц антивещества для каждой известной частицы во Вселенной. Обсуждает историю открытий частиц антивещества, их существование во Вселенной, огромные инструменты, необходимые для создания этих частиц (Стэнфордский линейный ускоритель и ЦЕРН), а также энергии, участвующие в столкновении этих частиц и античастиц.Рассказывает о том, как создается антивещество для использования в позитронно-эмиссионной спектроскопии (ПЭТ) при сканировании тела.
MysteryMatters: Сканирующая электронная микроскопия раскрывает тайну!
декабрь 2003 г. (стр. 17–19)
Автор: Тим Грэм
Химия Связи: Атомная теория, реакции
Описание: Использование рассеивающей электронной микроскопии (SEM) для анализа химического состава дефектной окраски автомобиля. Принципиальная схема показывает основы работы РЭМ, результаты анализа краски и ответы на причину дефекта краски.
Принципиальная схема показывает основы работы РЭМ, результаты анализа краски и ответы на причину дефекта краски.
Учебные ресурсы по истории атомной теории K12 Обучение, химия, планы уроков естествознания, мероприятия, эксперименты, помощь на дому
План урока— Получите!
Аудио:Сегодня принято считать, что вся материя состоит из крошечных частиц.Кто открыл эти частицы? И, если эти частицы такие крошечные, как они были обнаружены?
Атомная теория — это научная теория, которая утверждает, что вся материя состоит из крошечных частиц, называемых атомами .
Все, включая воздух, которым мы дышим, считается материей . Это означает, что теория атома влияет практически на всех и вся на Земле! Некоторые ученые даже заявляют, что теория атома является самым важным научным достижением в истории!
Теорию атома нельзя доверять только одному человеку.Он был разработан несколькими учеными на протяжении сотен лет.
В этом уроке вы исследуете роли Демокрита, Джона Далтона, Дж. Дж. Томпсона, Эрнеста Резерфорда и Нильса Бора в развитии теории атома. Если вы точно не знаете, что такое атом, возможно, будет хорошей идеей завершить цикл «Все об атомах», прежде чем двигаться дальше в этом уроке.
Скопируйте следующую таблицу на отдельный лист бумаги. Просматривая видео и читая статьи, заполните таблицу:
Ученый | лет жизни | Образование | Вклад в атомную теорию | Его идеи все еще принимаются? |
Демокрит | ||||
Джон Далтон | ||||
Дж. | ||||
Эрнест Резерфорд | ||||
Нильс Бор |
Приготовьтесь исследовать микроскопический мир атомов и узнать, как они попали в фокус в качестве основы всей материи, посмотрев видео TEDEd, 2400-летние поиски атома — Тереза Доуд , чтобы узнать больше о история атомной теории.
Затем посетите каждый из следующих сайтов, чтобы продолжить обучение:
Просмотрите таблицу, которую вы создали вместе с учителем или родителями.
- Какое открытие показалось вам наиболее интересным?
Перейти к Понятно? раздел для небольшой викторины.
Химия, жизнь, Вселенная и все остальное
Мелани М. Купер и Майкл У.Климковский
Если в каком-то катаклизме все научные знания должны были быть уничтожены и только одно предложение было передано следующему поколению существ, какое утверждение содержало бы больше информации в наименьшем количестве слов? Я считаю, что это атомная гипотеза (или атомный факт, или как вы хотите это называть), что все вещи состоят из атомов — маленьких частиц, которые вращаются в вечном движении, притягивая друг друга, когда они находятся на небольшом расстоянии друг от друга, но отталкивая друг от друга.В этом одном предложении вы увидите огромное количество информации о мире, если приложить немного воображения и мышления. — Нобелевский лауреат Ричард Фейнман, 1963
Большинство из нас хорошо знакомы с основным принципом атомной теории — идеей о том, что материя состоит из атомов — потому что нам говорили, что это так с детства. Но многие ли из нас на самом деле, а мы имеем в виду, что действительно верят этому, используют это в нашей повседневной жизни, понимают его значение или знают причины, по которым это считается правдой? Это кажется совершенно и совершенно невозможным и невероятным, потому что мы не ощущаем атомы напрямую, и очень легко прожить жизнь довольно успешно, по крайней мере, для подавляющего большинства из нас, не принимая атомы всерьез.Мозг среднего человека просто не устроен так, чтобы верить в реальность таких вещей, как атомы, конкретным и повседневным образом. Тем не менее, большинство ученых и, конечно же, большинство химиков согласятся, что обманчиво простое утверждение Фейнмана заключает в себе суть химии.
Но многие ли из нас на самом деле, а мы имеем в виду, что действительно верят этому, используют это в нашей повседневной жизни, понимают его значение или знают причины, по которым это считается правдой? Это кажется совершенно и совершенно невозможным и невероятным, потому что мы не ощущаем атомы напрямую, и очень легко прожить жизнь довольно успешно, по крайней мере, для подавляющего большинства из нас, не принимая атомы всерьез.Мозг среднего человека просто не устроен так, чтобы верить в реальность таких вещей, как атомы, конкретным и повседневным образом. Тем не менее, большинство ученых и, конечно же, большинство химиков согласятся, что обманчиво простое утверждение Фейнмана заключает в себе суть химии.
Атомная теория также имеет решающее значение для понимания значительного числа основных концепций биологии и физики, не говоря уже о геологии, астрономии, экологии и инженерии. Как в одном предложении может содержаться столько информации? Можем ли мы действительно объяснить такой обширный и разнообразный набор научных наблюдений, используя так мало информации? В следующих двух главах мы расширим предложение Фейнмана, чтобы увидеть, что вы можете сделать с небольшим воображением и мышлением. В то же время стоит помнить, что тот факт, что атомы настолько нереальны с точки зрения нашего повседневного опыта, означает, что атомная теория представляет собой серьезный барьер для понимания современной химии. Это препятствие, с которым можно справиться только в том случае, если вы явным образом его распознаете и попытаетесь устранить и приспособиться к нему. Вы будете перестраивать свой мозг, чтобы серьезно относиться к атомам и их последствиям. Мы понимаем, что это непростая задача. Это требует усилий, и большая часть этих усилий будет включать саморефлексию, решение проблем и ответы на вопросы.В важном смысле вам не обязательно верить в атомы, но вы должны понимать их.
В то же время стоит помнить, что тот факт, что атомы настолько нереальны с точки зрения нашего повседневного опыта, означает, что атомная теория представляет собой серьезный барьер для понимания современной химии. Это препятствие, с которым можно справиться только в том случае, если вы явным образом его распознаете и попытаетесь устранить и приспособиться к нему. Вы будете перестраивать свой мозг, чтобы серьезно относиться к атомам и их последствиям. Мы понимаем, что это непростая задача. Это требует усилий, и большая часть этих усилий будет включать саморефлексию, решение проблем и ответы на вопросы.В важном смысле вам не обязательно верить в атомы, но вы должны понимать их.
Вы почти наверняка слышали об атомах, и очень вероятно, что вас учили об атомах. Если вас спросят, вы можете заявить, что верите в их реальность. Вы можете согласиться с тем, что материя во всех ее формах состоит из атомов — частиц, которые представляют собой мельчайшие сущности, сохраняющие идентичность элемента (мы обсудим элементы более подробно в следующих нескольких главах). Это очень вероятно. что вас учили, что атомы состоят из еще более мелких частиц: положительно заряженных протонов, незаряженных нейтронов и отрицательно заряженных электронов.Возможно, вы даже слышали и, возможно, даже полагали, что протоны и нейтроны можно разделить на кварки и глюоны, в то время как электроны неделимы. Столь же трудно понять, что все атомы организованы очень похожим образом, с очень крошечным, но относительно тяжелым положительно заряженным ядром, окруженным гораздо более легкими отрицательно заряженными электронами.
Это очень вероятно. что вас учили, что атомы состоят из еще более мелких частиц: положительно заряженных протонов, незаряженных нейтронов и отрицательно заряженных электронов.Возможно, вы даже слышали и, возможно, даже полагали, что протоны и нейтроны можно разделить на кварки и глюоны, в то время как электроны неделимы. Столь же трудно понять, что все атомы организованы очень похожим образом, с очень крошечным, но относительно тяжелым положительно заряженным ядром, окруженным гораздо более легкими отрицательно заряженными электронами.
Частично сложность понимания атомов состоит в том, что силы, удерживающие атомное ядро вместе, так называемые сильные и слабые силы, действуют на таких бесконечно малых расстояниях, что мы не испытываем их напрямую.Это контрастирует с электромагнетизмом и гравитацией, которые мы испытываем напрямую, потому что они действуют на более длинных, макроскопических или видимых расстояниях. Вторая проблема связана с тем, что для познания мира нам нужно использовать энергию; в атомном масштабе энергия, используемая для наблюдения за системой, также нарушает ее.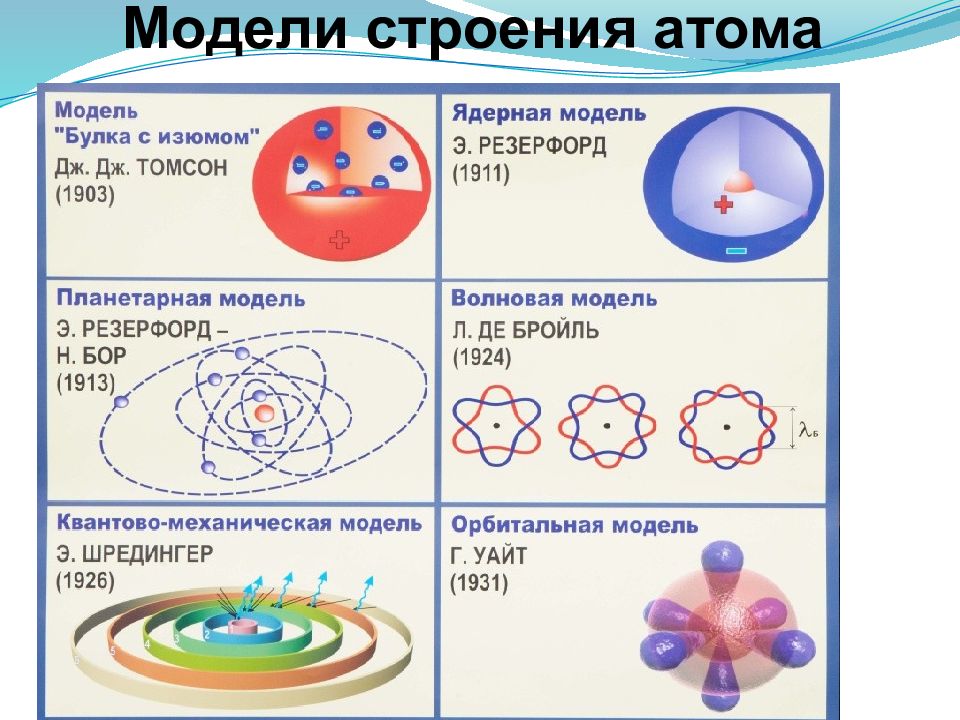 Это основа принципа неопределенности Гейзенберга, с которым вы, возможно, сталкивались или, по крайней мере, слышали раньше, и к которому мы еще вернемся. Наконец, объекты атомарного и субатомного масштабов ведут себя иначе, чем макроскопические объекты, с которыми мы обычно взаимодействуем.Каждая частица света, фотон, электрон, протон или нейтрон ведет себя как частица и как волна. С точки зрения физики, это не частицы и не волны; они квантово-механические частицы. К счастью, более странное поведение атомных и субатомных сущностей часто, но не всегда, можно игнорировать в химических и биологических системах. Мы будем касаться этих тем по мере необходимости.
Это основа принципа неопределенности Гейзенберга, с которым вы, возможно, сталкивались или, по крайней мере, слышали раньше, и к которому мы еще вернемся. Наконец, объекты атомарного и субатомного масштабов ведут себя иначе, чем макроскопические объекты, с которыми мы обычно взаимодействуем.Каждая частица света, фотон, электрон, протон или нейтрон ведет себя как частица и как волна. С точки зрения физики, это не частицы и не волны; они квантово-механические частицы. К счастью, более странное поведение атомных и субатомных сущностей часто, но не всегда, можно игнорировать в химических и биологических системах. Мы будем касаться этих тем по мере необходимости.
Текущая теория утверждает, что каждый атом содержит очень, очень маленькое, но очень плотное ядро, которое содержит протоны и нейтроны и окружено электронами.Эти электроны относительно легкие, но пространство, занимаемое движущимися электронами, составляет большую часть объема атома. Поскольку количество положительно заряженных протонов и отрицательно заряженных электронов равно, а размер зарядов одинаков, но противоположен, атомы электрически нейтральны, если рассматривать их как единое целое; то есть каждый положительно заряженный протон уравновешивается отрицательно заряженным электроном.
Часто определение атома содержит некоторый язык о том, как атомы являются самой маленькой частицей, которую можно идентифицировать как этот элемент.Что мы имеем в виду? Например, могут ли атомы обладать химическими свойствами? И как могут ансамбли одних и тех же частиц, то есть протонов, электронов и нейтронов, иметь разные свойства? Это загадка атома, и понимание этого — основа химии. В этой первой главе мы надеемся привести вас к базовому пониманию атомной структуры и межатомных взаимодействий. Последующие главы расширят и углубят это понимание.
Вопросы для размышления
- Если бы вам пришлось объяснить не ученому, почему ученые принимают идею о том, что все материальные вещи состоят из атомов, какие доказательства вы бы использовали?
- Влияет ли способность науки так много объяснять мир на ваше мнение о реальности сверхъестественных сил?
Мы предполагаем, что у вас есть много идей об атомах, но задумывались ли вы когда-нибудь о том, как мы пришли к тому, чтобы принять эту информацию как разумную или что реальность атомов подразумевает, как ведет себя мир, который мы воспринимаем? Атомы невероятно и невообразимо малы. Атом золота с полным набором электронов меньше нанометра (1 x 10 –9 метров) в диаметре, а его ядро, которое содержит 79 протонов и обычно около 116 нейтронов, имеет радиус ~ 1,5 x 10 — 14 метров. Хотя эти размеры на самом деле невообразимы, существует ряд сетевых действий, которые могут помочь вам понять масштабы атомов. Невозможно увидеть атом глазом или в световой микроскоп, хотя сейчас существуют методы, которые позволяют нам просматривать компьютерные изображения отдельных атомов с использованием различных типов электронных микроскопов и микроскопов силового зонда.Самая маленькая частица материи, которую вы видите невооруженным глазом, содержит больше атомов, чем людей в мире. Каждая клетка вашего тела содержит огромное количество атомов. Очевидно, все, что мы знаем об атомах, основано на косвенных доказательствах; мы не воспринимаем атомы напрямую.
Атом золота с полным набором электронов меньше нанометра (1 x 10 –9 метров) в диаметре, а его ядро, которое содержит 79 протонов и обычно около 116 нейтронов, имеет радиус ~ 1,5 x 10 — 14 метров. Хотя эти размеры на самом деле невообразимы, существует ряд сетевых действий, которые могут помочь вам понять масштабы атомов. Невозможно увидеть атом глазом или в световой микроскоп, хотя сейчас существуют методы, которые позволяют нам просматривать компьютерные изображения отдельных атомов с использованием различных типов электронных микроскопов и микроскопов силового зонда.Самая маленькая частица материи, которую вы видите невооруженным глазом, содержит больше атомов, чем людей в мире. Каждая клетка вашего тела содержит огромное количество атомов. Очевидно, все, что мы знаем об атомах, основано на косвенных доказательствах; мы не воспринимаем атомы напрямую.
Полная история того, как мы узнаем то, что мы знаем о существовании и структуре атомов, увлекательна, сложна и, возможно, к счастью для вас, слишком длинна, чтобы вдаваться в подробности. Что мы действительно хотим сделать, так это рассмотреть ряд ключевых моментов, которые иллюстрируют, как наши представления об атомах возникли и изменились с течением времени.Мы представим доказательства, которые сделали принятие атомной теории неизбежным, если вы хотите объяснить химические реакции и поведение материи и управлять ими.
Что мы действительно хотим сделать, так это рассмотреть ряд ключевых моментов, которые иллюстрируют, как наши представления об атомах возникли и изменились с течением времени.Мы представим доказательства, которые сделали принятие атомной теории неизбежным, если вы хотите объяснить химические реакции и поведение материи и управлять ими.
Атомная теория — это пример научной теории, которая зародилась как предположение и, благодаря ограничениям, обеспечиваемым тщательным наблюдением, экспериментированием и логической последовательностью, со временем превратилась в подробный набор идей, которые позволяют делать точные прогнозы и могут объяснить растущий ряд разнообразных и часто ранее неизвестных явлений.По мере того как ученые делали новые наблюдения, атомная теория была адаптирована для учета и организации этих наблюдений.
Ключевой особенностью научных идей, в отличие от других типов идей, является не то, правильны они или неправильны, а то, являются ли они логически последовательными и дают однозначные, наблюдаемые и в целом количественные прогнозы. Они говорят нам, что искать, и предсказывают, что мы найдем, если посмотрим или измерим это. Когда мы смотрим, мы можем обнаружить, что мир действует так, как было предсказано, или что происходит что-то иное.Если мир отличается от того, что предполагают наши научные идеи, тогда мы предполагаем, что упускаем что-то важное: либо наши идеи нуждаются в изменении, либо, возможно, мы смотрим на мир неправильно. Как мы увидим, типы наблюдений и экспериментальных данных о материи становятся все более точными, сложными и часто абстрактными, то есть не являются частью нашего непосредственного опыта. Некоторые из этих наблюдений могут быть довольно трудными для понимания, потому что материя ведет себя совершенно иначе в атомном и субатомном масштабе, чем в нормальном макроскопическом мире.Это макроскопический мир, который эволюционные процессы адаптировали нас к пониманию или, по крайней мере, к тому, чтобы справляться с ним, и с которым мы знакомы. Тем не менее, если мы хотим быть научными, мы должны идти туда, куда нас ведут данные.
Они говорят нам, что искать, и предсказывают, что мы найдем, если посмотрим или измерим это. Когда мы смотрим, мы можем обнаружить, что мир действует так, как было предсказано, или что происходит что-то иное.Если мир отличается от того, что предполагают наши научные идеи, тогда мы предполагаем, что упускаем что-то важное: либо наши идеи нуждаются в изменении, либо, возможно, мы смотрим на мир неправильно. Как мы увидим, типы наблюдений и экспериментальных данных о материи становятся все более точными, сложными и часто абстрактными, то есть не являются частью нашего непосредственного опыта. Некоторые из этих наблюдений могут быть довольно трудными для понимания, потому что материя ведет себя совершенно иначе в атомном и субатомном масштабе, чем в нормальном макроскопическом мире.Это макроскопический мир, который эволюционные процессы адаптировали нас к пониманию или, по крайней мере, к тому, чтобы справляться с ним, и с которым мы знакомы. Тем не менее, если мы хотим быть научными, мы должны идти туда, куда нас ведут данные. Если мы получаем результаты, которые не согласуются с нашей интуицией и текущими теориями, мы должны пересмотреть эти теории, а не игнорировать данные.
Если мы получаем результаты, которые не согласуются с нашей интуицией и текущими теориями, мы должны пересмотреть эти теории, а не игнорировать данные.
Однако ученые, как правило, консервативны, когда дело доходит до пересмотра устоявшихся теорий, потому что новые данные иногда могут вводить в заблуждение.Это одна из причин, по которой так много внимания уделяется воспроизводимости. Единичный отчет, каким бы тщательным он ни казался, может быть неправильным или неверно истолкованным, и способность других ученых воспроизвести наблюдение или эксперимент является ключом к его принятию. Поэтому в науке чудес не бывает. Даже в этом случае значение наблюдения не всегда очевидно или однозначно; чаще всего наблюдение, которое на первый взгляд кажется революционным, имеет простое и даже скучное объяснение.Поистине революционные наблюдения немногочисленны. Это одна из причин, по которой ученые так часто цитируют цитату Карла Сагана (1934–1996): « экстраординарные утверждения требуют экстраординарных доказательств». В большинстве случаев, когда сообщаются революционные данные, последующие исследования показывают, что результаты были вызваны плохим экспериментальным планом, небрежностью или каким-то несущественным фактором. Тот факт, что не у всех нас есть электростанции, работающие на холодном синтезе, приводящие в движение холодильники с вечным двигателем, является доказательством того, что принятие скептического подхода, ожидающего экспериментального подтверждения, является разумным.
В большинстве случаев, когда сообщаются революционные данные, последующие исследования показывают, что результаты были вызваны плохим экспериментальным планом, небрежностью или каким-то несущественным фактором. Тот факт, что не у всех нас есть электростанции, работающие на холодном синтезе, приводящие в движение холодильники с вечным двигателем, является доказательством того, что принятие скептического подхода, ожидающего экспериментального подтверждения, является разумным.
Распространенное заблуждение о научных теориях состоит в том, что это просто идеи, которые кто-то придумал спонтанно. В повседневном использовании слово теория может означать идею или даже предположение, гипотезу или рабочее предположение, но в науке слово теория зарезервировано для объяснений, которые охватывают и объясняют широкий спектр наблюдений. Теория должна быть не просто объяснением, она должна быть хорошо проверена и давать четкие прогнозы, относящиеся к новым наблюдениям или экспериментам.Например, теория эволюции предсказывала, что летопись окаменелостей покажет доказательства существования животных, которые имеют многие из черт современного человека. Это предсказание было сделано до того, как были найдены такие окаменелости; с тех пор были и продолжают обнаруживаться многие окаменелости человекоподобных организмов. На основе этих открытий и сравнительного анализа структуры организмов можно предложить правдоподобные родословные, известные как филогении, соединяющие различные типы организмов. Современные методы молекулярной генетики, в частности секвенирование генома (ДНК), подтвердили эти прогнозы и предоставили сильную экспериментальную поддержку нынешнему мнению о том, что все организмы, ныне живущие на Земле, являются частью одной семьи, то есть у них есть общий предок, который жил миллиарды лет назад.Теория эволюции также предсказывает, что чем старше породы, тем больше будут отличаться найденные ископаемые организмы от современных. В породах, датируемых примерно 410 миллионами лет назад, мы находим окаменелости различных видов рыб, но не тех рыб, которые существуют сегодня. Мы не находим свидетельств существования людей того периода; на самом деле нет ни млекопитающих, ни рептилий, ни насекомых, ни птиц.
Это предсказание было сделано до того, как были найдены такие окаменелости; с тех пор были и продолжают обнаруживаться многие окаменелости человекоподобных организмов. На основе этих открытий и сравнительного анализа структуры организмов можно предложить правдоподобные родословные, известные как филогении, соединяющие различные типы организмов. Современные методы молекулярной генетики, в частности секвенирование генома (ДНК), подтвердили эти прогнозы и предоставили сильную экспериментальную поддержку нынешнему мнению о том, что все организмы, ныне живущие на Земле, являются частью одной семьи, то есть у них есть общий предок, который жил миллиарды лет назад.Теория эволюции также предсказывает, что чем старше породы, тем больше будут отличаться найденные ископаемые организмы от современных. В породах, датируемых примерно 410 миллионами лет назад, мы находим окаменелости различных видов рыб, но не тех рыб, которые существуют сегодня. Мы не находим свидетельств существования людей того периода; на самом деле нет ни млекопитающих, ни рептилий, ни насекомых, ни птиц.
Также говорят, что научная теория опровергается, что не означает, что она ложна, а скорее, что она может быть доказана путем экспериментов или наблюдений.Например, было бы трудно согласовать текущую теорию эволюции с открытием ископаемых кроликов из пород старше 300 миллионов лет. Точно так же атомная теория потребовала бы серьезного пересмотра, если бы кто-нибудь обнаружил элемент, не вписывающийся в периодическую таблицу; законы термодинамики пришлось бы пересмотреть, если бы кто-нибудь разработал успешный вечный двигатель. Теория, которую можно слишком легко адаптировать к любым новым свидетельствам, не имеет реальной научной ценности.
Вторая основополагающая посылка науки состоит в том, что все теории ограничиваются естественными явлениями; то есть явления, которые можно наблюдать и измерять прямо или косвенно. Объяснения, которые ссылаются на сверхъестественное или полностью субъективное, по определению не являются научными, потому что не существует вообразимого эксперимента, который мог бы быть проведен, который мог бы тем или иным образом подтвердить их достоверность. В важном смысле не имеет значения, верны эти сверхъестественные объяснения или нет; они остаются ненаучными.Представьте себе инструмент, который может обнаруживать присутствие ангелов. Если бы такой инструмент можно было построить, ангелов можно было бы изучать с научной точки зрения; их количество и передвижения можно было отслеживать, а их структуру и поведение анализировать; возможно, даже удастся предсказать или контролировать их поведение. Таким образом, они перестанут быть сверхъестественными и станут просто еще одной частью природного мира. Учитывая эти допущенные произвольные ограничения науки как дисциплины и предприятия, довольно удивительно, насколько хорошо наука работает в объяснении (и позволяя нам манипулировать) окружающим нас миром.В то же время науке практически нечего сказать о значении окружающего нас мира, хотя часто бывает трудно не размышлять о значении, основываясь на современных научных идеях. Учитывая, что все теории являются предварительными и могут быть пересмотрены или отвергнуты, возможно, будет разумным не использовать научные идеи для определения того, что хорошо, а что плохо, в любом моральном смысле.
В важном смысле не имеет значения, верны эти сверхъестественные объяснения или нет; они остаются ненаучными.Представьте себе инструмент, который может обнаруживать присутствие ангелов. Если бы такой инструмент можно было построить, ангелов можно было бы изучать с научной точки зрения; их количество и передвижения можно было отслеживать, а их структуру и поведение анализировать; возможно, даже удастся предсказать или контролировать их поведение. Таким образом, они перестанут быть сверхъестественными и станут просто еще одной частью природного мира. Учитывая эти допущенные произвольные ограничения науки как дисциплины и предприятия, довольно удивительно, насколько хорошо наука работает в объяснении (и позволяя нам манипулировать) окружающим нас миром.В то же время науке практически нечего сказать о значении окружающего нас мира, хотя часто бывает трудно не размышлять о значении, основываясь на современных научных идеях. Учитывая, что все теории являются предварительными и могут быть пересмотрены или отвергнуты, возможно, будет разумным не использовать научные идеи для определения того, что хорошо, а что плохо, в любом моральном смысле.
Как мы увидим, история атомной теории изобилует примерами того, что одна теория оказывается неадекватной, после чего ее необходимо пересматривать, расширять, а иногда и полностью заменять новой теорией, которая дает проверяемые объяснения как старой, так и старой теории. новые экспериментальные данные.Это не означает, что исходная теория обязательно была полностью ложной, а скорее, что она не могла полностью охватить наблюдаемую Вселенную или точно предсказать новые наблюдения. Старые теории обычно попадают в категорию новых; на самом деле новая теория должна объяснять все, что объясняется старой и многим другим.
Вопросы для ответа: Научные вопросы и теории:
- Как бы вы решили, можно ли дать научный ответ на конкретный вопрос?
- Как бы вы решили, был ли ответ на вопрос научным?
- В чем разница между научным и ненаучным вопросом? Приведите пример каждого.
Вопросы для размышления
- В каких вещах есть атомы? Воздух, золото, клетки, тепло, свет?
- Откуда вы знаете, что атомы существуют?
Современные атомные теории уходят корнями в мышление древних людей, в частности древнегреческих философов, живших более 2500 лет назад. В то время культурный, экономический и интеллектуальный климат в Древней Греции позволил огромному всплеску философского и научного развития, так называемому греческому чуду.В то время как большинство людей того времени считали, что миром правит когорта полурациональных богов, ряд философов, начиная с Фалеса Милетского (умер в 546 г. до н. Э.), Стремились разработать рациональные и несверхъестественные объяснения наблюдаемых явлений, таких как как то, из чего мы сделаны и откуда пришли. Как мы теперь знаем, они не могли понять основную природу материи, потому что им не хватало инструментов для наблюдений и экспериментов в атомном масштабе. Однако это не значит, что их идеи были пустыми домыслами.Идеи, которые они породили, хотя и не были научными, как мы понимаем этот термин сегодня, содержали замечательные идеи, некоторые из которых кажутся правдивыми.
В то время культурный, экономический и интеллектуальный климат в Древней Греции позволил огромному всплеску философского и научного развития, так называемому греческому чуду.В то время как большинство людей того времени считали, что миром правит когорта полурациональных богов, ряд философов, начиная с Фалеса Милетского (умер в 546 г. до н. Э.), Стремились разработать рациональные и несверхъестественные объяснения наблюдаемых явлений, таких как как то, из чего мы сделаны и откуда пришли. Как мы теперь знаем, они не могли понять основную природу материи, потому что им не хватало инструментов для наблюдений и экспериментов в атомном масштабе. Однако это не значит, что их идеи были пустыми домыслами.Идеи, которые они породили, хотя и не были научными, как мы понимаем этот термин сегодня, содержали замечательные идеи, некоторые из которых кажутся правдивыми.
Эта эпоха дала начало новому подходу к изучению природных явлений с целью понимания их сложности и разнообразия с точки зрения естественных объяснений. Стоит учесть, что такой рациональный подход не обязательно должен быть продуктивным; может случиться так, что мир на самом деле является совершенно иррациональным, неустойчивым и немеханистическим местом, постоянно управляемым сверхъестественными силами; но, учитывая, что наука не может обратиться к такого рода идеям, давайте просто оставим их авторам-фантазиям.Предположение о том, что миром правят исключительно силы природы, оказалось чрезвычайно продуктивным; то есть согласуется с тем, как мир ведет себя, когда мы смотрим на него беспристрастно.
Стоит учесть, что такой рациональный подход не обязательно должен быть продуктивным; может случиться так, что мир на самом деле является совершенно иррациональным, неустойчивым и немеханистическим местом, постоянно управляемым сверхъестественными силами; но, учитывая, что наука не может обратиться к такого рода идеям, давайте просто оставим их авторам-фантазиям.Предположение о том, что миром правят исключительно силы природы, оказалось чрезвычайно продуктивным; то есть согласуется с тем, как мир ведет себя, когда мы смотрим на него беспристрастно.
Древние греки разработали сложные представления о природе Вселенной и материи, из которой она состоит, некоторые из которых были приняты в течение долгого времени. Однако в ответ на более тщательное наблюдение и экспериментальный анализ эти идеи в конечном итоге были вытеснены более основанными на фактах теориями.По большей части это было связано с процессом, с помощью которого люди серьезно относились к старым идеям и пытались на их основе объяснять мир и манипулировать им. Когда их наблюдения и манипуляции не приводили к ожидаемым или желаемым результатам, таким как превращение неблагородных металлов в золото, излечение болезней или вообще избегание смерти, они были более или менее вынуждены пересмотреть свои идеи, часто отказываясь от старых идей в пользу новых, которые казались работать.
Когда их наблюдения и манипуляции не приводили к ожидаемым или желаемым результатам, таким как превращение неблагородных металлов в золото, излечение болезней или вообще избегание смерти, они были более или менее вынуждены пересмотреть свои идеи, часто отказываясь от старых идей в пользу новых, которые казались работать.
Развитие атомных теорий переплетается с идеями о фундаментальной природе материи, не говоря уже о происхождении Вселенной и ее эволюции.Большинство греческих философов считали, что материя состоит из некоторого набора основных элементов, например, знакомых нам земли, воздуха, огня и воды. Некоторые философы предполагали наличие пятого элемента, известного как квинтэссенция или эфир. Эти явно неадекватные идеи сохраняются и сегодня как часть астрологии и знаков Зодиака — плохая дань уважения некоторым очень серьезным мыслителям.
Первоначальные элементы, то есть земля, воздух, огонь и вода, как полагали, состояли из крошечных неразрушимых частиц, названных атомами Левкиппом и Демокритом (жившим около 460 г.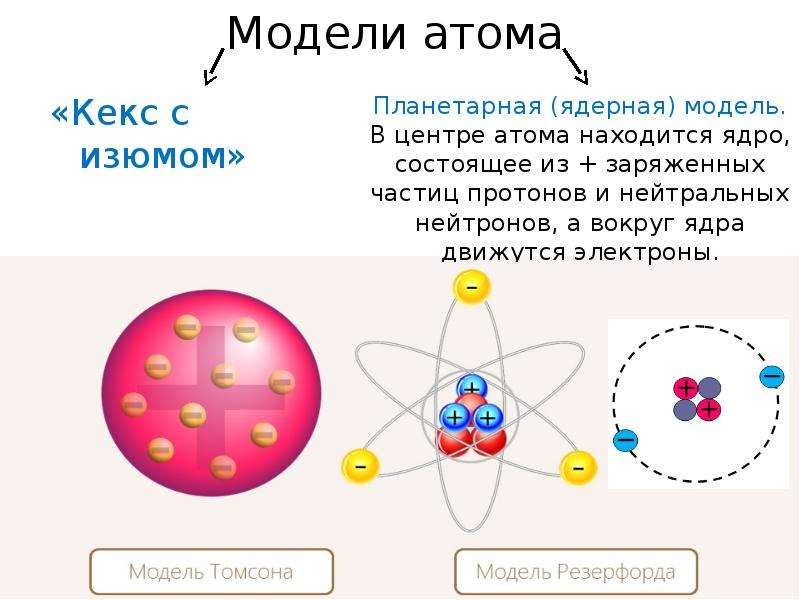 до н. Э.).Предполагалось, что атомы разных элементов имеют разные размеры и формы, и их форма напрямую определяет свойства конкретного элемента. Например, атомы земли считались кубическими; их плотная упаковка делала землю твердой и трудной для перемещения. Мысль о том, что структура атомов определяет наблюдаемые свойства материала, мы будем возвращаться в несколько иной форме снова и снова. Хотя подробности были неверными, основная идея оказалась верной.
до н. Э.).Предполагалось, что атомы разных элементов имеют разные размеры и формы, и их форма напрямую определяет свойства конкретного элемента. Например, атомы земли считались кубическими; их плотная упаковка делала землю твердой и трудной для перемещения. Мысль о том, что структура атомов определяет наблюдаемые свойства материала, мы будем возвращаться в несколько иной форме снова и снова. Хотя подробности были неверными, основная идея оказалась верной.
Считалось, что в дополнение к своей форме атомы также находятся в постоянном движении, основываясь на наблюдении за движением пылинок в солнечном свете, когда между ними ничего или пустота. Много веков спустя анализ Эйнштейном этого типа движения, известного как броуновское движение, обеспечил сильную экспериментальную поддержку физической реальности молекул, более крупных структур, состоящих из атомов, и взаимосвязи между движением молекул, температурой и энергией, которые мы рассмотрим позже. в этой главе.
В целом, объединенные концепции греческих философов обеспечивали самосогласованную и удовлетворительную основу для объяснения поведения материи, насколько они могли сказать.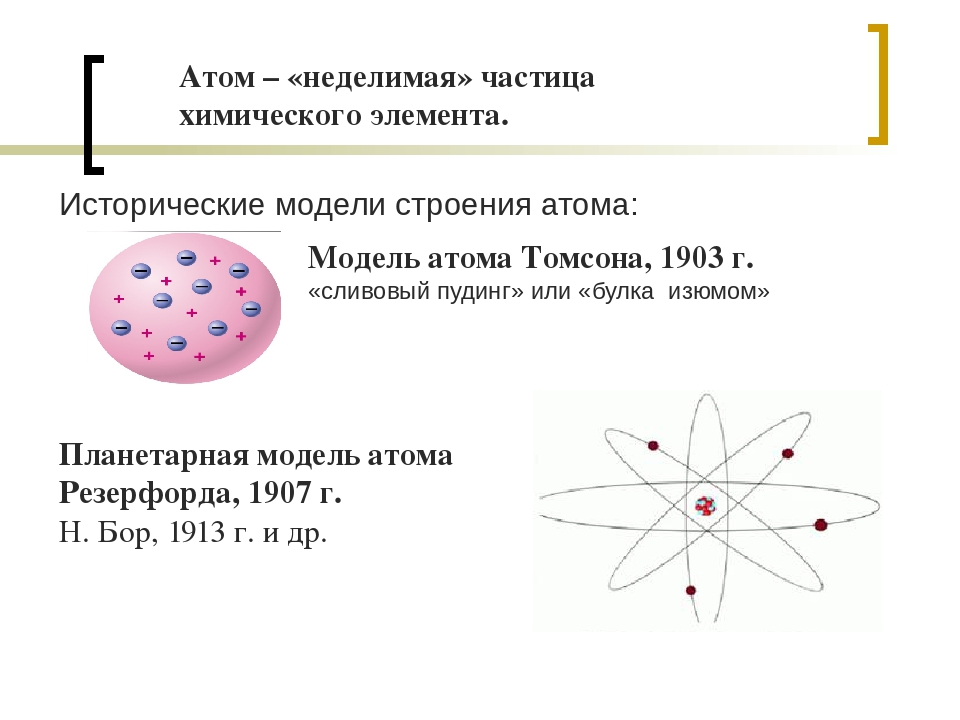 Здесь очень легко попасть в ловушку, а именно: удовлетворительное объяснение явления не обязательно верно. Даже если оно кажется непротиворечивым, полезным или утешительным, объяснение не является научным, если оно не дает проверяемых количественных прогнозов. Например, считалось, что разные материалы состоят из четырех древних элементов разной пропорции.Кости были сделаны из воды, земли и огня в пропорции 1: 1: 2, тогда как плоть состояла из этих элементов в соотношении 2: 1: 1. Хотя сейчас эти идеи считаются странными, они содержат предзнаменование «закона множественных пропорций», который придет примерно 2300 лет спустя и с которым мы поговорим позже в этой главе. Некоторые философы даже думали, что душа состоит из атомов или что сами атомы имеют форму сознания — две идеи, которые сегодня кажутся совершенно чуждыми (большинству) из нас.
Здесь очень легко попасть в ловушку, а именно: удовлетворительное объяснение явления не обязательно верно. Даже если оно кажется непротиворечивым, полезным или утешительным, объяснение не является научным, если оно не дает проверяемых количественных прогнозов. Например, считалось, что разные материалы состоят из четырех древних элементов разной пропорции.Кости были сделаны из воды, земли и огня в пропорции 1: 1: 2, тогда как плоть состояла из этих элементов в соотношении 2: 1: 1. Хотя сейчас эти идеи считаются странными, они содержат предзнаменование «закона множественных пропорций», который придет примерно 2300 лет спустя и с которым мы поговорим позже в этой главе. Некоторые философы даже думали, что душа состоит из атомов или что сами атомы имеют форму сознания — две идеи, которые сегодня кажутся совершенно чуждыми (большинству) из нас.
Такие идеи об атомах и элементах дали логические и рациональные, то есть несверхъестественные объяснения многих свойств материи. Но греки были не единственными древними людьми, которые предложили объяснения природы материи и ее поведения. Фактически, считается, что корнем слов «алхимия» и «химия» является древнегреческое слово «Хем», греческое название Египта, откуда, как считается, возникли алхимия и химия. Подобные теории были разработаны в Индии примерно в то же время, хотя именно греческие идеи об атомах были сохранены и использовались людьми, которые в конечном итоге разработали наши современные атомные теории.С течением времени древние идеи об атомах и материи поддерживались историками и летописцами, в частности учеными арабского мира. В средневековье Европы и в средневековье было несколько разрозненных возрождений идей об атомах, но только в эпоху Возрождения культурный и интеллектуальный климат снова позволил относительно свободное расцвет идей. Сюда входили предположения о природе материи, атомов и жизни. Экспериментальные исследования, основанные на этих идеях, привели к их пересмотру и, в конечном итоге, появлению науки в том виде, в каком мы ее теперь знаем.Также стоит помнить, что этому относительному взрыву новых идей время от времени, а иногда и решительно противодействовали религиозные учреждения, что приводило к пыткам, заключениям и казням.
Фактически, считается, что корнем слов «алхимия» и «химия» является древнегреческое слово «Хем», греческое название Египта, откуда, как считается, возникли алхимия и химия. Подобные теории были разработаны в Индии примерно в то же время, хотя именно греческие идеи об атомах были сохранены и использовались людьми, которые в конечном итоге разработали наши современные атомные теории.С течением времени древние идеи об атомах и материи поддерживались историками и летописцами, в частности учеными арабского мира. В средневековье Европы и в средневековье было несколько разрозненных возрождений идей об атомах, но только в эпоху Возрождения культурный и интеллектуальный климат снова позволил относительно свободное расцвет идей. Сюда входили предположения о природе материи, атомов и жизни. Экспериментальные исследования, основанные на этих идеях, привели к их пересмотру и, в конечном итоге, появлению науки в том виде, в каком мы ее теперь знаем.Также стоит помнить, что этому относительному взрыву новых идей время от времени, а иногда и решительно противодействовали религиозные учреждения, что приводило к пыткам, заключениям и казням.
Вопросы к ответу:
- Какие свойства, приписываемые атомам греками, мы все еще считаем действительными?
Вопросы для размышления:
- Если бы у Земли были атомы кубической формы, какую форму вы бы приписали элементам воздух, вода и огонь?
Вопросы на будущее
- Если атомы находятся в постоянном движении, что, по вашему мнению, заставляет их двигаться?
Греческое представление об атомах и элементах просуществовало много веков, и в конечном итоге оно было уточнено за счет добавления еще нескольких элементов, в основном благодаря усилиям алхимиков.Некоторые элементы, такие как золото, были открыты намного раньше — в основном потому, что они существуют в виде элементов, а не соединений. К концу восемнадцатого века идея элемента как вещества, которое нельзя разделить на более фундаментальные вещества, начала приниматься. В 1789 году Антуан Лавуазье (1743–1794) составил список из 33 элементов. В его список не вошли земля, воздух, огонь и вода, но он содержал свет и тепло, а также ряд современных элементов, включая кобальт, ртуть, цинк и медь.Уже было установлено, что кислород и водород являются элементами, а вода — нет. Была подготовлена почва для быстрого роста наших знаний о глубинной структуре материи. Теперь мы знаем о 91 природном элементе и довольно большом количестве неестественных, то есть созданных человеком элементов, которые не встречаются в природе из-за их нестабильности. Эти созданные человеком элементы тяжелее в атомном отношении, чем природные элементы, и обычно образуются в результате столкновения атомов природных элементов друг с другом; они быстро распадаются или распадаются на атомы других элементов.В качестве примеров того, как наука может устранить часть тайны из Вселенной: наше понимание атомов и элементов означает, что теоретически невозможны никакие новые естественные, легкие элементы. Мы знаем обо всех легких элементах, которые могут существовать где угодно во Вселенной, и это довольно удивительный факт.
В его список не вошли земля, воздух, огонь и вода, но он содержал свет и тепло, а также ряд современных элементов, включая кобальт, ртуть, цинк и медь.Уже было установлено, что кислород и водород являются элементами, а вода — нет. Была подготовлена почва для быстрого роста наших знаний о глубинной структуре материи. Теперь мы знаем о 91 природном элементе и довольно большом количестве неестественных, то есть созданных человеком элементов, которые не встречаются в природе из-за их нестабильности. Эти созданные человеком элементы тяжелее в атомном отношении, чем природные элементы, и обычно образуются в результате столкновения атомов природных элементов друг с другом; они быстро распадаются или распадаются на атомы других элементов.В качестве примеров того, как наука может устранить часть тайны из Вселенной: наше понимание атомов и элементов означает, что теоретически невозможны никакие новые естественные, легкие элементы. Мы знаем обо всех легких элементах, которые могут существовать где угодно во Вселенной, и это довольно удивительный факт.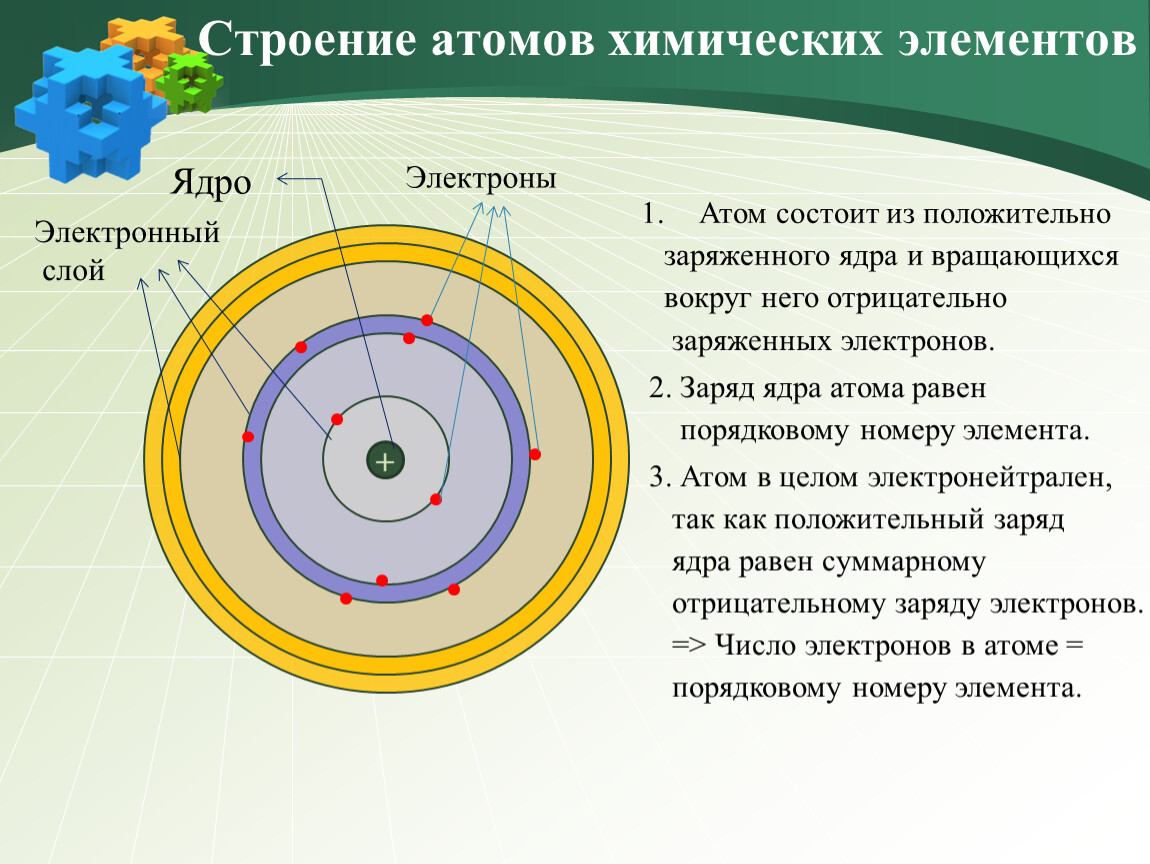 Точно так же наше нынешнее понимание общей теории относительности и законов термодинамики делает невозможными путешествия со сверхсветовой скоростью и вечные двигатели, хотя это не мешает людям строить догадки о них.
Точно так же наше нынешнее понимание общей теории относительности и законов термодинамики делает невозможными путешествия со сверхсветовой скоростью и вечные двигатели, хотя это не мешает людям строить догадки о них.
Первое современное химическое выделение элемента приписывается алхимику Хеннигу Бранду (ок. 1630 – ок. 1710). Он выделил фосфор из мочи, преследуя философский камень. Хотя это может показаться странным, люди делали гораздо более странные вещи в поисках золота или лекарств от таких болезней, как сифилис. Каково же было его удивление, когда после выкипания всей воды из мочи осадок загорелся и выделил газ, который при конденсации давал твердое вещество, которое светилось зеленым в темноте.По этой причине он назвал его фосфором от греческого «светоносец». Точно так же ртуть была первоначально выделена путем обжига минеральной киновари. Несмотря на свою токсичность, ртуть использовалась для лечения сифилиса до открытия эффективных антибиотиков.
Вопросы к ответу
- Учитывая то, что вы знаете, как бы вы объяснили разницу между атомом и элементом?
- Что отличает один элемент от другого?
- В чем разница между атомом и молекулой?
- В чем разница между элементом и составом?
Вопросы для размышления
- Какие типы доказательств можно использовать, чтобы доказать, что вы изолировали новый элемент?
- Когда недоказанные / необоснованные предположения могут быть научными?
- При каких условиях такие предположения полезны?
- Как вы думаете, почему золото было признано элементом раньше, чем многие другие?
Важно отметить, что с того времени, когда возникли первые идеи об атомах, и в течение тысяч лет после этого не было ни малейшего доказательства дисперсной природы материи или физического существования атомов. Идея атомов была чисто плодом воображения, и, хотя о природе материи велись яростные споры, эти споры не могли быть разрешены с научной точки зрения до тех пор, пока так или иначе не будут объективные эмпирические доказательства.
Идея атомов была чисто плодом воображения, и, хотя о природе материи велись яростные споры, эти споры не могли быть разрешены с научной точки зрения до тех пор, пока так или иначе не будут объективные эмпирические доказательства.
Итак, возникает вопрос, как ученые девятнадцатого века в конечном итоге получили убедительные доказательства существования атомов? Мы уже сказали, что атомы слишком малы, чтобы их можно было увидеть каким-либо прямым методом. Так что же привело ученых к неизбежному выводу о том, что материя состоит из дискретных атомов? Часто приходится совершать огромный интуитивный скачок, чтобы объяснить результаты научных наблюдений.Например, история об Исааке Ньютоне (1643–1727) и падающем яблоке отражает этот трюизм, а именно замечательное предположение о том, что движение Земли вокруг Солнца, траектория пушечного ядра и падение яблока на Землю являются все из-за общего основного фактора, силы тяжести, которая действует на расстоянии и подчиняется соотношению обратных квадратов, 1 / r2, где r — расстояние между двумя объектами. Это кажется довольно странным и довольно надуманным предположением; как работает это «действие на расстоянии» между двумя объектами? Тем не менее, если следовать с научной точки зрения, он оказался очень мощным и удивительно точным.Дело в том, что Ньютон смог разобраться в данных, что отнюдь не является тривиальным. Это требует способности к глубокому, оригинальному и сложному мышлению. Тем не менее, до тех пор, пока Альберт Эйнштейн (1874-1955) не предложил свою общую теорию относительности в 1915 году, не было последовательного, механистического объяснения гравитационных сил.
Это кажется довольно странным и довольно надуманным предположением; как работает это «действие на расстоянии» между двумя объектами? Тем не менее, если следовать с научной точки зрения, он оказался очень мощным и удивительно точным.Дело в том, что Ньютон смог разобраться в данных, что отнюдь не является тривиальным. Это требует способности к глубокому, оригинальному и сложному мышлению. Тем не менее, до тех пор, пока Альберт Эйнштейн (1874-1955) не предложил свою общую теорию относительности в 1915 году, не было последовательного, механистического объяснения гравитационных сил.
Первая научная теория атомной структуры была предложена Джоном Далтоном (1766–1844), квакером-самоучкой, жившим в Манчестере, Англия. В 1805 году Дальтон опубликовал свою атомную теорию, чтобы объяснить наблюдаемый закон множественных или определенных пропорций, в котором вкратце говорилось, что «когда элементы объединяются, они делают это в соотношении малых целых чисел», мы вернемся к этой идее позже, гораздо подробнее. Довольно удивительно, что Далтон так и не объяснил, что побудило его предложить свою атомную теорию, хотя он определенно использовал ее для объяснения существующих правил о том, как разные элементы сочетаются. Среди этих правил было наблюдение, что все вещество, присутствующее в системе, не изменяется во время химической реакции, хотя реакция может привести к переходу от твердого тела к газу или наоборот. Атомная теория Дальтона (1805 г.) включала ряд важных компонентов:
Довольно удивительно, что Далтон так и не объяснил, что побудило его предложить свою атомную теорию, хотя он определенно использовал ее для объяснения существующих правил о том, как разные элементы сочетаются. Среди этих правил было наблюдение, что все вещество, присутствующее в системе, не изменяется во время химической реакции, хотя реакция может привести к переходу от твердого тела к газу или наоборот. Атомная теория Дальтона (1805 г.) включала ряд важных компонентов:
- Элементы состоят из небольших неделимых неразрушимых частиц, называемых атомами.
- Все атомы элемента идентичны, имеют одинаковую массу и свойства.
- Атомы данного элемента отличаются от атомов других элементов.
- Соединения образуются комбинациями атомов двух или более элементов.
- Химические реакции происходят из-за перегруппировки атомов, а атомы (материя) не создаются и не разрушаются во время реакции.
Основываясь на этих принципах, он смог объяснить многие из наблюдений, которые были сделаны им самим и другими, о том, как материя ведет себя и реагирует. Более современные атомные теории внесли некоторые изменения, например, чтобы включить существование атомных изотопов, то есть атомов с разным числом нейтронов, но одинаковым числом протонов и электронов, а также преобразование энергии в материю и наоборот, но Основные идеи Далтона остаются в силе.
Более современные атомные теории внесли некоторые изменения, например, чтобы включить существование атомных изотопов, то есть атомов с разным числом нейтронов, но одинаковым числом протонов и электронов, а также преобразование энергии в материю и наоборот, но Основные идеи Далтона остаются в силе.
Вопросы к ответу
- Чем атомная теория Дальтона отличается от идей греческих философов?
- Какие положения теории Далтона актуальны и сегодня?
- Спланируйте эксперимент, чтобы выяснить, происходит ли изменение массы при изменении фазы воды.Какие данные вы бы собирали? Как бы вы это проанализировали?
Вопросы для размышления
- Как Дальтон пришел к выводу, что полуатомов нет?
- Какие части теории Дальтона были необоснованными предположениями, а какие были основаны на непосредственном наблюдении?
Утверждение, противоположное правильному, — это ложное.
Но противоположностью глубокой истины вполне может быть другая глубокая истина. Нилс Бор (1865–1962)
Теория Дальтона об атомах как неделимых, неразрушимых объектах разного размера, веса и, возможно, формы, в зависимости от элемента, выдерживалась почти 100 лет, хотя существовало значительное разногласие по поводу того, действительно ли атомы существуют, особенно среди философов.К 1900 году атомная теория была почти повсеместно принята химиками. Начали накапливаться больше доказательств, было обнаружено больше элементов, и даже стало возможным подсчитать количество атомов в конкретном образце. Первый шаг в этом направлении сделал Амедео Авогадро (1776–1856). В 1811 году он предположил, что в условиях равной температуры и давления равные объемы газов содержали равное количество частиц (молекул) и что плотности газов, то есть их вес, деленный на их объем, были пропорциональны весу газа. отдельные молекулы.Это было расширено австрийским учителем средней школы Йозефом Лошмидтом (1821–1895), который в 1865 году объединил вывод Авогадро с предположением, что атомы и молекулы движутся очень как упругие объекты, как бильярдные шары. Это позволило ему вычислить силу, которую молекула будет оказывать при движении с определенной скоростью, что трудно измерить, и связать это с давлением, которое легко измерить. Фактически, это предположение позволило физикам сделать вывод, что температура газа связана со средней кинетической энергией молекул внутри него, и к этой концепции мы вскоре вернемся.
Это позволило ему вычислить силу, которую молекула будет оказывать при движении с определенной скоростью, что трудно измерить, и связать это с давлением, которое легко измерить. Фактически, это предположение позволило физикам сделать вывод, что температура газа связана со средней кинетической энергией молекул внутри него, и к этой концепции мы вскоре вернемся.
Исследование субструктуры атомов
Первоначальное греческое предположение заключалось в том, что атомы неделимы, по существу неизменны с момента их первоначального создания. Однако постепенно начали накапливаться свидетельства того, что атомы нельзя назвать неделимыми и неразрушимыми. Доказательства существования частиц меньшего размера, чем атомы, накапливались в течение некоторого времени, хотя они и не были признаны таковыми. Например, хорошо известное явление статического электричества было известно еще со времен древних греков.Название «электричество» происходит от латинского «electricus», что означает «янтарный». Натирание янтаря мехом генерирует статическое электричество — искру того же типа, которая перескакивает с вашего пальца на дверную ручку или другого человека в сухих условиях. В конце 1700-х годов Луиджи Гальвани (1737–1798) обнаружил, что животные могут вырабатывать электричество и реагировать на него. Возможно, самым ярким примером являются электрические угри и скаты, которые оглушают свою жертву электрическим током. Открытие биоэлектричества использовалось во многих романах и фильмах, начиная с романа Мэри Шелли (1797–1851) «Франкенштейн» и заканчивая романом Мела Брука (р.1926) комедийный фильм, Молодой Франкенштейн. Гальвани обнаружил, что нога мертвой лягушки подергивается в ответ на воздействие статического электричества; Казалось, он ожил, как и чудовище Франкенштейна. Он предположил, и оказалось, что это правильно, что электрическая активность участвует в нормальном движении животных. Он думал, что особая форма электричества, биоэлектричество, переносится в жидкости в мышцах и является уникальным продуктом биологических систем, типом жизненной силы.
Натирание янтаря мехом генерирует статическое электричество — искру того же типа, которая перескакивает с вашего пальца на дверную ручку или другого человека в сухих условиях. В конце 1700-х годов Луиджи Гальвани (1737–1798) обнаружил, что животные могут вырабатывать электричество и реагировать на него. Возможно, самым ярким примером являются электрические угри и скаты, которые оглушают свою жертву электрическим током. Открытие биоэлектричества использовалось во многих романах и фильмах, начиная с романа Мэри Шелли (1797–1851) «Франкенштейн» и заканчивая романом Мела Брука (р.1926) комедийный фильм, Молодой Франкенштейн. Гальвани обнаружил, что нога мертвой лягушки подергивается в ответ на воздействие статического электричества; Казалось, он ожил, как и чудовище Франкенштейна. Он предположил, и оказалось, что это правильно, что электрическая активность участвует в нормальном движении животных. Он думал, что особая форма электричества, биоэлектричество, переносится в жидкости в мышцах и является уникальным продуктом биологических систем, типом жизненной силы. Теперь мы осознаем, что ряд биологических явлений, таких как сокращение мышц и активность мозга, инициируется изменениями электрических полей (через мембраны) и что лежащие в их основе физико-химические принципы аналогичны тем, которые имеют место в небиологических системах.
Теперь мы осознаем, что ряд биологических явлений, таких как сокращение мышц и активность мозга, инициируется изменениями электрических полей (через мембраны) и что лежащие в их основе физико-химические принципы аналогичны тем, которые имеют место в небиологических системах.
Интерес к электричеству и его возможностям побудил Алессандро Вольта (1745–1827) разработать первую современную батарею, теперь известную как гальваническая батарея. Он чередовал листы двух разных металлов, таких как цинк и медь, с дисками, пропитанными соленой водой (рассолом).Он произвел первый устойчивый электрический ток, который при воздействии на мышцы лягушки заставлял их сокращаться. Такие наблюдения показали, что биологические системы могут как генерировать электрические токи, так и реагировать на них, предполагая, что биоэлектричество ничем не отличается от любой другой формы электричества. Ни Вольта, ни Гальвани не знали природу электричества. Что это было на самом деле и как оно перетекало с места на место? Что было в искре, прыгнувшей с пальца на металлическую дверную ручку или от струны змея Бенджамина Франклина (1705–1790) до его пальца? Из чего была сделана эта «электрическая жидкость»?
Прогресс в понимании природы и поведения электричества продолжался на протяжении всего XIX века, и сила электричества была использована для кардинальных изменений в образе жизни и работы людей, в обеспечении энергией фабрик, освещении домов и улиц и т.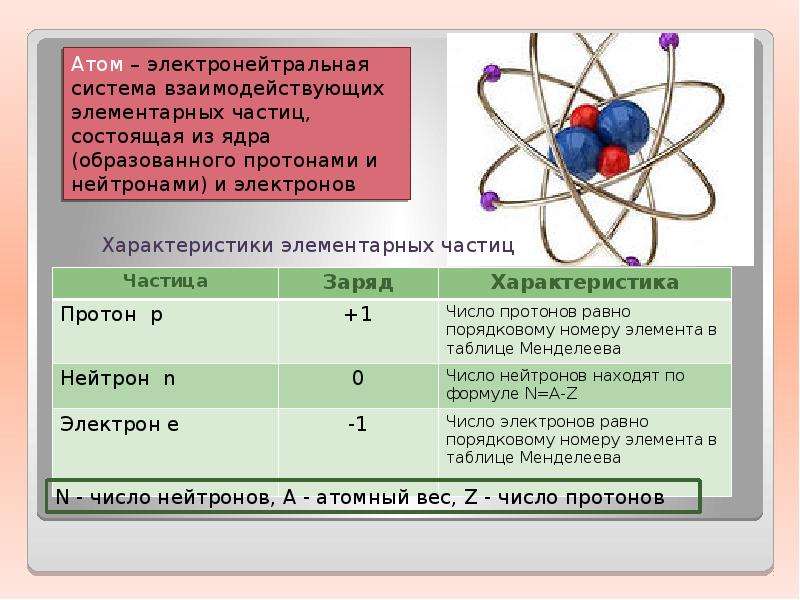 Д.Тем не менее, не было глубокого понимания физической природы электричества. Было известно, что электрический заряд бывает двух видов: положительный и отрицательный, и что эти заряды сохраняются; то есть, они не могли быть созданы или уничтожены — идеи, впервые предложенные Франклином. Электрическая (заряженная) природа материи была точно установлена, но неизвестно, откуда эти заряды и что они собой представляют.
Д.Тем не менее, не было глубокого понимания физической природы электричества. Было известно, что электрический заряд бывает двух видов: положительный и отрицательный, и что эти заряды сохраняются; то есть, они не могли быть созданы или уничтожены — идеи, впервые предложенные Франклином. Электрическая (заряженная) природа материи была точно установлена, но неизвестно, откуда эти заряды и что они собой представляют.
Ключевым шагом к пониманию электричества стало раскрытие идеи неделимого атома и серия экспериментов Дж.Дж. Томпсон (1856–1940), еще один манкунианец. Хотя идея электричества теперь была хорошо оценена, Томпсон и другие ученые хотели изучить ее более контролируемым образом. Они использовали то, что было и сейчас известно как электронно-лучевые трубки (ЭЛТ). Когда-то распространенные в телевизорах, теперь они заменены различными устройствами с плоским экраном. ЭЛТ — это стеклянные трубки со встроенными в них проводами; эти провода соединены с металлическими дисками. Внутренняя часть трубки покрыта химическим веществом, которое светится (флуоресцирует) в ответ на электричество.У них обычно есть отверстия в стенках, которые могут быть подключены к вакуумному насосу, так что большая часть воздуха внутри трубки может быть удалена, обычно порты затем герметично закрываются. При подключении к источнику электричества, например, гальванической батарее, флуоресцентный материал на одном конце трубки светится. В серии экспериментов (1897 г.) Томсон смог показать, что:
Внутренняя часть трубки покрыта химическим веществом, которое светится (флуоресцирует) в ответ на электричество.У них обычно есть отверстия в стенках, которые могут быть подключены к вакуумному насосу, так что большая часть воздуха внутри трубки может быть удалена, обычно порты затем герметично закрываются. При подключении к источнику электричества, например, гальванической батарее, флуоресцентный материал на одном конце трубки светится. В серии экспериментов (1897 г.) Томсон смог показать, что:
- Лучи выходили из одного диска (катода) и переходили на другой (анод).
- «Катодные» лучи отклонялись электрическими полями в направлении, указывающем на их отрицательный заряд.
- Лучи также могут отклоняться магнитными полями.
- Лучи несут электрический заряд; то есть, если луч искривлялся, например, магнитным полем, заряд уходил вместе с ним.
- Металл, из которого был сделан катод, не влиял на поведение луча; Таким образом, каким бы ни был состав луча, он казался независимым от элемента, из которого он исходит.

Во всех этих экспериментах необходимо подчеркнуть, что «положительный» и «отрицательный» означают противоположное и назначаются по соглашению.Это означает, что завтра мы можем решить, что положительное — отрицательное, а отрицательное — положительное, и ничего не изменится, если мы будем последовательны. Из этих экспериментов Томпсон пришел к выводу, что «катодные» лучи переносятся дискретными заряженными частицами, он назвал их корпускулами и приписал этим частицам отрицательный заряд. Но поистине ошеломляющий вывод, к которому он пришел, заключался в том, что эти частицы должны исходить из атомов металлического катода . Поскольку тип металла не влиял на природу или поведение катодных лучей, он предположил, что эти частицы не были вновь созданы, а должны существовать заранее в атомах катода.Более того, он предположил, что идентичные частицы должны присутствовать во всех атомах, а не только в атомах одного конкретного металла. Вы видите, как он перескакивает от экспериментальных результатов с использованием нескольких металлов ко всем элементам и всем атомам? Конечно, теперь мы знаем эти частицы как электроны, но трудно представить, какое огромное влияние эта новая теория оказала на ученых того времени.
Поскольку электроны могут образовываться всеми химическими элементами, мы должны сделать вывод, что они входят в состав всех атомов.Таким образом, мы сделали первый шаг в понимании структуры атома. —J. Дж. Томсон, Атомная теория, 1914
Открытие электрона сделало старую идею атома как небольшого неразрушимого объекта, похожего на бильярдный шар, устаревшим и потребовало новой модели. Это пример смены парадигмы — фундаментального изменения научного мышления, вызванного новыми данными. Первая версия этой новой модели Томпсона стала известна как модель сливового пудинга. Его основная идея заключалась в том, что атом представляет собой шар из положительно заряженной, но очевидно аморфной материи с электронами, усеянными тут и там, как изюм в пудинге.Поскольку он содержал равное количество положительных и отрицательных зарядов, вся конструкция была электрически нейтральной. Последующая работа Томпсона и Роберта А. Милликена (1868–1953) установила, что все электроны идентичны, каждый с одинаковой, очень малой массой и отрицательным зарядом.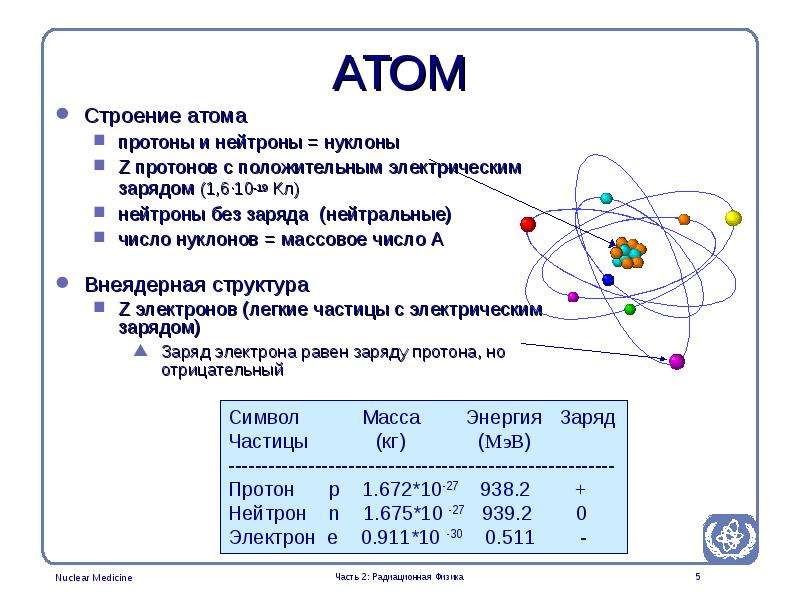 Масса электрона составляет менее 1/1000 массы атома водорода.
Масса электрона составляет менее 1/1000 массы атома водорода.
Предложенная Томпсоном модель атома из сливового пудинга стимулировала большую экспериментальную и теоретическую работу и привела к значительному количеству последующих открытий.Например, вскоре было обнаружено, что β-частицы, испускаемые некоторыми радиоактивными минералами и элементами, на самом деле являются электронами. Другие исследования показали, что количество электронов, присутствующих в атомах определенного элемента, было примерно пропорционально половине атомного веса элемента, хотя неясно, почему это должно быть так.
Однако по мере того, как стало накапливаться все больше и больше данных, от модели сливового пудинга пришлось отказаться, потому что она просто не могла объяснить наблюдаемые явления.Ключевой эксперимент, приведший к новой модели атома, был проведен в 1908 году Эрнестом Резерфордом (1871–1937). Как вы уже догадались, он работал в Манчестерском университете. В этом эксперименте он исследовал, как альфа (α) -частицы, которые, как он знал, были положительно заряженными частицами, состоящими из элемента гелия без его электронов, вели себя, когда они стреляли в очень тонкий металлический лист, такой как золото или платина. В эксперименте узкий параллельный пучок α-частиц направлялся на тонкий лист золотой фольги и регистрировались углы, под которыми рассеиваются отклоненные частицы.Наблюдаемый результат был совершенно неожиданным. Вместо того, чтобы пройти сквозь тонкий лист фольги, он обнаружил, что несколько частиц отклоняются, некоторые из них — под большими углами. Резерфорд писал: «Это как если бы я выстрелил пушечным ядром по куску папиросной бумаги, и оно отскочило назад». Здесь мы снова видим особый аспект научного предприятия, а именно то, что, несмотря на то, что назад отскочили только несколько альфа-частиц, нам все же нужно объяснить, как это могло произойти. Мы не могли просто сказать: «Отразилось лишь несколько частиц, так что это не имеет значения»; мы должны предоставить правдоподобный сценарий, чтобы объяснить наблюдение.Часто он уделяет внимание неожиданному результату, ведущему к самым глубоким открытиям, и воспринимает его всерьез.
В эксперименте узкий параллельный пучок α-частиц направлялся на тонкий лист золотой фольги и регистрировались углы, под которыми рассеиваются отклоненные частицы.Наблюдаемый результат был совершенно неожиданным. Вместо того, чтобы пройти сквозь тонкий лист фольги, он обнаружил, что несколько частиц отклоняются, некоторые из них — под большими углами. Резерфорд писал: «Это как если бы я выстрелил пушечным ядром по куску папиросной бумаги, и оно отскочило назад». Здесь мы снова видим особый аспект научного предприятия, а именно то, что, несмотря на то, что назад отскочили только несколько альфа-частиц, нам все же нужно объяснить, как это могло произойти. Мы не могли просто сказать: «Отразилось лишь несколько частиц, так что это не имеет значения»; мы должны предоставить правдоподобный сценарий, чтобы объяснить наблюдение.Часто он уделяет внимание неожиданному результату, ведущему к самым глубоким открытиям, и воспринимает его всерьез.
Основываясь на этих экспериментальных результатах, Резерфорд пришел к выводу, что положительно заряженные α-частицы отталкиваются положительными частями атома. Поскольку только очень небольшой процент альфа-частиц отклонялся, только очень небольшая область каждого атома могла быть заряжена положительно. То есть положительный заряд в атоме не может быть распределен более или менее равномерно, как предполагала модель сливового пудинга; вместо этого он должен быть сконцентрирован в очень небольшом регионе.Это означало, что большая часть атома пуста (помните пустоту древних греков?) Или занята чем-то, что практически не оказывает сопротивления прохождению α-частиц. Остается необъяснимым, почему положительно заряженные частицы (которые мы теперь знаем как протоны), сконцентрированные в таком маленьком объеме, не отталкиваются друг от друга — ответ на этот вопрос должен был подождать до открытия сильного ядерного взаимодействия (см. Ниже). Мы снова видим ученого, совершающего огромный интуитивный скачок от экспериментального наблюдения к гипотезе, которая согласовывалась с этим свидетельством и которая делает конкретные прогнозы, которые могут быть подтверждены или опровергнуты дальнейшими экспериментами и наблюдениями.
Поскольку только очень небольшой процент альфа-частиц отклонялся, только очень небольшая область каждого атома могла быть заряжена положительно. То есть положительный заряд в атоме не может быть распределен более или менее равномерно, как предполагала модель сливового пудинга; вместо этого он должен быть сконцентрирован в очень небольшом регионе.Это означало, что большая часть атома пуста (помните пустоту древних греков?) Или занята чем-то, что практически не оказывает сопротивления прохождению α-частиц. Остается необъяснимым, почему положительно заряженные частицы (которые мы теперь знаем как протоны), сконцентрированные в таком маленьком объеме, не отталкиваются друг от друга — ответ на этот вопрос должен был подождать до открытия сильного ядерного взаимодействия (см. Ниже). Мы снова видим ученого, совершающего огромный интуитивный скачок от экспериментального наблюдения к гипотезе, которая согласовывалась с этим свидетельством и которая делает конкретные прогнозы, которые могут быть подтверждены или опровергнуты дальнейшими экспериментами и наблюдениями. Модель Резерфорда, получившая название планетарной модели, постулировала очень, очень маленькое ядро, в котором находится весь положительный заряд и почти вся масса атома; это ядро было окружено электронами. В 1920 году Резерфорд определил единицу положительного заряда и назвал ее протоном. В 1932 году Джеймс Чедвик (1891–1974) (который параллельно учился в Манчестерском университете) идентифицировал второй компонент ядра — нейтрон. Нейтроны тяжелые, как протоны.На самом деле они немного тяжелее протонов, но не имеют заряда. Идентичность элемента зависит от количества протонов, однако количество нейтронов может быть различным в разных атомах одного и того же элемента. Например, у атома углерода всегда шесть протонов, но у него может быть разное количество нейтронов. У большинства атомов углерода шесть нейтронов (C-12), но у некоторых — семь (C-13), а у некоторых — восемь (C-14).
Модель Резерфорда, получившая название планетарной модели, постулировала очень, очень маленькое ядро, в котором находится весь положительный заряд и почти вся масса атома; это ядро было окружено электронами. В 1920 году Резерфорд определил единицу положительного заряда и назвал ее протоном. В 1932 году Джеймс Чедвик (1891–1974) (который параллельно учился в Манчестерском университете) идентифицировал второй компонент ядра — нейтрон. Нейтроны тяжелые, как протоны.На самом деле они немного тяжелее протонов, но не имеют заряда. Идентичность элемента зависит от количества протонов, однако количество нейтронов может быть различным в разных атомах одного и того же элемента. Например, у атома углерода всегда шесть протонов, но у него может быть разное количество нейтронов. У большинства атомов углерода шесть нейтронов (C-12), но у некоторых — семь (C-13), а у некоторых — восемь (C-14).
Вопросы на потом
- Если атомы — это в основном пустое пространство, почему мы не можем проходить сквозь стены?
- Что такое радиация?
- Как изменяется атом, когда он испускает альфа-частицу? Или бета-частица / электрон?
Вопросы для размышления
- Если бы первооткрыватели электричества решили, что электроны имеют положительный заряд, изменило бы это наше понимание электричества?
- Как вы думаете, почему электроны были первыми открытыми субатомными частицами?
- Как именно Резерфорд обнаружил альфа-частицы?
- Можете ли вы придумать альтернативную модель атома, основанную на наблюдениях Резерфорда?
- Как бы изменился эксперимент, если бы он использовал электроны или нейтроны?
На этом этапе мы пришли к относительно простой модели атома.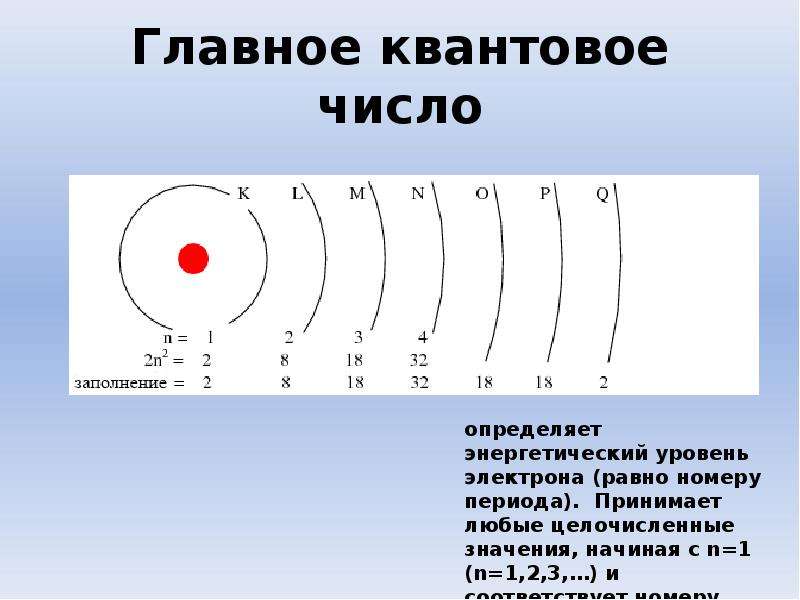 Не волнуйтесь, в следующей главе мы перейдем к более сложным и реалистичным моделям. В этой простой модели атом имеет очень маленькое, но тяжелое ядро, которое содержит как протоны, так и нейтроны. Когда мы время от времени говорим о биологии, старайтесь не путать ядро атома с ядром клетки; они совершенно разные — не считая того, что они очень разных размеров. Например, вокруг ядра атома нет барьера — ядро атома представляет собой сгусток протонов и нейтронов.Ядро атома окружают электроны в том же количестве, что и протонов. У атома нет чистого электрического заряда, поскольку количество электронов равно количеству протонов.
Не волнуйтесь, в следующей главе мы перейдем к более сложным и реалистичным моделям. В этой простой модели атом имеет очень маленькое, но тяжелое ядро, которое содержит как протоны, так и нейтроны. Когда мы время от времени говорим о биологии, старайтесь не путать ядро атома с ядром клетки; они совершенно разные — не считая того, что они очень разных размеров. Например, вокруг ядра атома нет барьера — ядро атома представляет собой сгусток протонов и нейтронов.Ядро атома окружают электроны в том же количестве, что и протонов. У атома нет чистого электрического заряда, поскольку количество электронов равно количеству протонов.
Однако вопрос о том, где на самом деле находятся электроны в атоме, сложнее ответить из-за соображений квантовой механики, в частности принципа неопределенности Гейзенберга, к которому мы вернемся в следующей главе. А пока предположим, что электроны находятся вне ядра и движутся.Мы можем думать о них, как если бы они были облаком электронной плотности, а не летающими частицами (не волнуйтесь, мы скоро предоставим доказательства этой модели). Эта простая модель фиксирует важные особенности и позволяет нам начать рассмотрение того, как атомы взаимодействуют друг с другом, образуя молекулы, и как эти молекулы могут быть перестроены — настоящая химия!
Эта простая модель фиксирует важные особенности и позволяет нам начать рассмотрение того, как атомы взаимодействуют друг с другом, образуя молекулы, и как эти молекулы могут быть перестроены — настоящая химия!
В настоящий момент мы знаем о четырех фундаментальных силах: гравитация, электромагнитное взаимодействие, сильное ядерное взаимодействие и слабое ядерное взаимодействие.На данный момент мы можем в значительной степени игнорировать сильную ядерную силу, которая участвует в удержании ядра вместе: это сила притяжения между нейтронами и протонами и самая сильная из всех известных сил во Вселенной, в ~ 137 раз сильнее, чем электромагнитная сила. Сильное ядерное взаимодействие действует на очень коротких дистанциях, ~ 10 -15 м, или около диаметра ядра. Другая сила, участвующая в ядерном поведении, слабая сила, играет роль в ядерной стабильности, в частности, в стабильности нейтронов, но она имеет еще более короткий диапазон действия (10 -18 м).Поскольку ядро намного меньше самого атома, мы можем (и будем) игнорировать слабые и сильные ядерные взаимодействия, когда мы рассматриваем химические взаимодействия. Сила, с которой мы, вероятно, наиболее знакомы, — это гравитация, которая является самой слабой силой, более чем в 10 -37 раз слабее, чем электромагнитная сила, и мы можем игнорировать ее с точки зрения химии, хотя она имеет отношение к биологии. динозавров, слонов, китов и космонавтов. Электромагнитная сила ответственна почти за все явления, с которыми мы сталкиваемся в повседневной жизни.Хотя мы остаемся заземленными на Земле из-за гравитационного взаимодействия между нашим телом и Землей, тот факт, что мы не падаем в центр Земли, полностью обусловлен электромагнитными взаимодействиями. Одна очевидная особенность нашего мира состоит в том, что он полон твердых вещей — вещей, которые мешают друг другу. Если бы атомы и молекулы не взаимодействовали друг с другом, можно было бы ожидать, что можно будет проходить сквозь стены, учитывая, что атомы в основном представляют собой пустое пространство, но очевидно, что это не так.Точно так же ваше собственное тело не могло бы держаться вместе, если бы ваши атомы и молекулы, которые они образуют, не могли взаимодействовать.
Сила, с которой мы, вероятно, наиболее знакомы, — это гравитация, которая является самой слабой силой, более чем в 10 -37 раз слабее, чем электромагнитная сила, и мы можем игнорировать ее с точки зрения химии, хотя она имеет отношение к биологии. динозавров, слонов, китов и космонавтов. Электромагнитная сила ответственна почти за все явления, с которыми мы сталкиваемся в повседневной жизни.Хотя мы остаемся заземленными на Земле из-за гравитационного взаимодействия между нашим телом и Землей, тот факт, что мы не падаем в центр Земли, полностью обусловлен электромагнитными взаимодействиями. Одна очевидная особенность нашего мира состоит в том, что он полон твердых вещей — вещей, которые мешают друг другу. Если бы атомы и молекулы не взаимодействовали друг с другом, можно было бы ожидать, что можно будет проходить сквозь стены, учитывая, что атомы в основном представляют собой пустое пространство, но очевидно, что это не так.Точно так же ваше собственное тело не могло бы держаться вместе, если бы ваши атомы и молекулы, которые они образуют, не могли взаимодействовать. Как мы увидим, все атомы и молекулы притягиваются друг к другу — факт, который непосредственно следует из того, что мы знаем о структуре атомов и молекул.
Как мы увидим, все атомы и молекулы притягиваются друг к другу — факт, который непосредственно следует из того, что мы знаем о структуре атомов и молекул.
Вопросы для размышления
- Как могла бы выглядеть современная диаграмма атома и что с ее помощью можно было бы объяснить?
- Почему протоны в ядре не отталкиваются друг от друга?
- Почему электроны и протоны не притягиваются друг к другу и не попадают в ядро?
- Как взаимодействуют электроны внутри атома?
Вопросы на будущее
- Может ли атом обладать химическими и / или физическими свойствами; Если так, то кто они?
- Каковы химические и физические свойства? Вы можете привести несколько примеров?
- Что отличает один элемент от другого?
Взаимодействие между атомами: диапазон эффектов
Притяжение и отталкивание заряженных частиц и магнитов являются проявлениями электромагнитной силы. 2} [/ latex].
2} [/ latex].
Разница между двумя силами заключается в следующем: а) гравитационные взаимодействия намного слабее электромагнитных взаимодействий и б) гравитация — это исключительно взаимодействие притяжения, в то время как электромагнитные взаимодействия могут быть либо притягивающими, либо отталкивающими.
Теперь давайте рассмотрим, как атомы взаимодействуют друг с другом. В целом атомы электрически нейтральны, но состоят из дискретных электрически заряженных частиц. Более того, их электроны ведут себя как движущиеся объекты.При усреднении по времени вероятность нахождения электрона равномерно распределена вокруг атома, атом нейтрален. Однако в любой момент времени существует ненулевая вероятность того, что электронов больше на одной стороне атома, чем на другой. Это приводит к мгновенным колебаниям плотности заряда вокруг атома и к мгновенному накоплению заряда; на мгновение одна сторона атома слегка положительна (δ +), а другая сторона слегка отрицательна (δ–). Это создает так называемый мгновенный и переходный электрический диполь — разделение зарядов. Когда один искаженный атом приближается к другому, это влияет на распределение электронной плотности второго атома и приводит к так называемому «индуцированному диполю». Так, например, если слегка положительный конец атома расположен рядом с другим атомом, он будет притягивать электрон (ы) в другом атоме. Это приводит к общему притяжению между атомами, которое изменяется как 1 / r 6 — где r — расстояние между атомами. Обратите внимание, что это отличается от притяжения между полностью заряженными частицами, кулоновского притяжения, которое изменяется как 1 / r2.Что это означает на практике? Что ж, самое главное, это означает, что эффекты взаимодействия будут ощущаться только тогда, когда два атома находятся довольно близко друг к другу.
Когда один искаженный атом приближается к другому, это влияет на распределение электронной плотности второго атома и приводит к так называемому «индуцированному диполю». Так, например, если слегка положительный конец атома расположен рядом с другим атомом, он будет притягивать электрон (ы) в другом атоме. Это приводит к общему притяжению между атомами, которое изменяется как 1 / r 6 — где r — расстояние между атомами. Обратите внимание, что это отличается от притяжения между полностью заряженными частицами, кулоновского притяжения, которое изменяется как 1 / r2.Что это означает на практике? Что ж, самое главное, это означает, что эффекты взаимодействия будут ощущаться только тогда, когда два атома находятся довольно близко друг к другу.
По мере приближения двух атомов они будут все больше притягиваться друг к другу. Но у этого притяжения есть свой предел — когда атомы приближаются достаточно близко, взаимодействия между отрицательно заряженными электронами (и положительно заряженными ядрами) каждого атома очень быстро увеличиваются, что приводит к общему отталкиванию, которое остановит такое близкое сближение двух атомов. .
.
Аналогичный эффект был также замечен в эксперименте Резерфорда. Напомним, он ускорял положительно заряженные альфа-частицы в направлении листа атомов золота. Когда альфа-частица приближается к ядру атома золота, положительно (+2) заряженная альфа-частица и положительно (+79) ядро атома золота начинают отталкиваться друг от друга. Если бы никакие другие факторы не были задействованы, сила отталкивания приблизилась бы к бесконечности, когда расстояние между ядрами (r) приблизилось бы к нулю (вы должны быть в состоянии объяснить, почему.) Но бесконечные силы — это не то, что происходит в макроскопическом, атомном или субатомном мирах, хотя бы потому, что полная энергия во Вселенной не бесконечна. Когда расстояние между альфа-частицей и ядром золота приближается к нулю, отталкивающее взаимодействие становится достаточно сильным, чтобы замедлить входящую альфа-частицу, а затем оттолкнуть ее от целевой частицы. Если целевая частица тяжелее по сравнению с входящей частицей, как это было в экспериментах Резерфорда, цель, состоящая из атомов золота, которые весят примерно в 50 раз больше, чем альфа-частица, не будет сильно двигаться, в то время как входящая альфа-частица будет отражаться. прочь.Но если цель и входящая частица имеют одинаковую массу, то взаимодействие затронет обе, и обе будут двигаться. Интересно, что если бы у падающей частицы было достаточно начальной энергии, чтобы подойти достаточно близко (в пределах ~ 10 -15 м) к ядру-мишени, то сильная ядерная сила притяжения вступила бы в игру и начала стабилизировать систему. Результатом будет слияние двух ядер и создание другого элемента, процесс, который происходит только в системах с очень высокой энергией, таких как центр звезд или во время взрыва звезды, сверхновая.Мы вернемся к этой идее в главе 3.
прочь.Но если цель и входящая частица имеют одинаковую массу, то взаимодействие затронет обе, и обе будут двигаться. Интересно, что если бы у падающей частицы было достаточно начальной энергии, чтобы подойти достаточно близко (в пределах ~ 10 -15 м) к ядру-мишени, то сильная ядерная сила притяжения вступила бы в игру и начала стабилизировать систему. Результатом будет слияние двух ядер и создание другого элемента, процесс, который происходит только в системах с очень высокой энергией, таких как центр звезд или во время взрыва звезды, сверхновая.Мы вернемся к этой идее в главе 3.
Вопросы к ответу
- Как открытие того, что атомы состоят из частей, меняет атомную теорию Дальтона?
- Как бы выглядело распределение альфа-частиц относительно падающего луча, если бы положительное ядро заняло весь атом (вроде как сливовый пудинг)? Что, если бы оно заняло 50% атома?
- Как на самом деле выглядит распределение альфа-частиц (напомним, что одна из 8000 частиц была отклонена)?
Силы и энергия: обзор.

Мы хотели бы уделить время, чтобы помочь вам подумать о взаимодействиях (силах) между атомами и молекулами и о том, как эти взаимодействия приводят к изменениям энергии. Эти изменения энергии ответственны за образование молекул, их реорганизацию посредством химических реакций и макроскопические свойства химических веществ (то есть всего). Хотя вы, возможно, узнали о силах и энергии на уроках физики, скорее всего, эти концепции не были явно связаны с тем, как вещи ведут себя на атомно-молекулярном уровне.Мы собираемся начать с обсуждения взаимодействий и изменений энергии, которые возникают в результате действия силы тяжести, потому что эти идеи почти наверняка вам знакомы, определенно более знакомы, чем электромагнитные взаимодействия, но цель этого раздела состоит в том, чтобы поможет вам установить связи между тем, что вы уже знаете (на макроскопическом уровне), и тем, как эти идеи переносятся на молекулярный уровень, включая сходства и различия. Например, законы движения Ньютона описывают поведение объектов при соприкосновении, например, при контакте бейсбольного мяча с битой. Но часто объекты взаимодействуют друг с другом на расстоянии. После удара по мячу его движения определяются в первую очередь его гравитационным взаимодействием со всеми другими объектами во Вселенной, хотя из-за природы гравитационного взаимодействия, безусловно, наиболее важное взаимодействие происходит между мячом и Землей (см. Ниже). .
Но часто объекты взаимодействуют друг с другом на расстоянии. После удара по мячу его движения определяются в первую очередь его гравитационным взаимодействием со всеми другими объектами во Вселенной, хотя из-за природы гравитационного взаимодействия, безусловно, наиболее важное взаимодействие происходит между мячом и Землей (см. Ниже). .
Сила — это взаимодействие между объектами, которое вызывает притяжение (притяжение) или толчок (отталкивание) между этими объектами. Когда происходит такое взаимодействие, происходит изменение энергии предметов.Как отмечалось выше, существует четыре основных силы: гравитационная, электромагнитная, сильная и слабая ядерные силы. Нам нужно будет больше сказать об электромагнитной силе, которая имеет отношение к пониманию химических взаимодействий, то есть того, как ведут себя атомы и молекулы. Многие из знакомых вам явлений основаны на электромагнитных силах. Например, электромагнитные силы не дают мячу пройти сквозь биту — или вам не удастся упасть в центр Земли.
Теперь давайте посмотрим, что происходит, когда вы подбрасываете мяч прямо в воздух.Вы прикладываете силу к мячу (через действие ваших мышц), и как только он покидает вашу руку, единственная сила, действующая на мяч, — это гравитация (мы, конечно, игнорируем трение из-за взаимодействия с молекулами в воздухе). . Мяч, изначально находящийся в состоянии покоя, начинает двигаться вверх. Со временем вы наблюдаете, как изменяется скорость мяча, когда мяч замедляется, останавливается и падает обратно на землю. Итак, какие силы вызывают эти изменения? Ответ — сила тяжести, которая является функцией масс шара и Земли, которые не меняются с течением времени, и расстояния (r) между Землей и мячом, которое меняется.Эту гравитационную силу F можно смоделировать с помощью уравнения, которое показывает, что она пропорциональна произведению масс шара (M 1 ) и Земли (M 2 ), разделенных на квадрат расстояния между объектами. (р).
При гравитационном взаимодействии сила уменьшается по мере увеличения расстояния между объектами (уменьшение пропорционально 1 / r 2 ), что означает, что чем дальше вы удаляетесь от Земли, тем меньше сила притяжения между вами и Землей. .Если вы уйдете достаточно далеко, и вы удаляетесь от Земли, взаимодействия будет недостаточно, чтобы удерживать вас влечение к Земле, и вы продолжите удаляться навсегда.
.Если вы уйдете достаточно далеко, и вы удаляетесь от Земли, взаимодействия будет недостаточно, чтобы удерживать вас влечение к Земле, и вы продолжите удаляться навсегда.
Конечно, , почему объектов с массой притягиваются друг к другу, является предметом физики — выходит за рамки этого курса. Мы можем сказать, что сила опосредована гравитационным полем. Любой объект с массой будет взаимодействовать с другими объектами с массой через это поле. Можно также сказать, что поле передает энергию в пространстве между двумя (или более) объектами.То есть взаимодействие приводит к изменению энергии в системе взаимодействующих объектов. В химии нас интересуют как силы, вызывающие взаимодействия, так и возникающие в результате изменения энергии.
Как силы влияют на энергию? Если мы возьмем наш макроскопический пример, когда вы бросаете мяч вверх, мы знаем, что вы передаете мячу некоторую энергию. Конечно, возникает вопрос: «Что мы подразумеваем под энергией?» и, к сожалению, у нас нет простого ответа. Ричард Фейнман однажды сказал: «В физике мы не имеем представления о том, что такое энергия».Физики могут сказать, что энергия — это способность выполнять работу, а затем определить работу как силу, умноженную на расстояние, что на самом деле никуда нас не приведет, особенно в химии, где понятие работы часто бесполезно. Мы можем сказать, что любые изменения сопровождаются изменениями энергии, и что мы можем рассчитать или измерить эти изменения энергии.
Ричард Фейнман однажды сказал: «В физике мы не имеем представления о том, что такое энергия».Физики могут сказать, что энергия — это способность выполнять работу, а затем определить работу как силу, умноженную на расстояние, что на самом деле никуда нас не приведет, особенно в химии, где понятие работы часто бесполезно. Мы можем сказать, что любые изменения сопровождаются изменениями энергии, и что мы можем рассчитать или измерить эти изменения энергии.
Возможно, вы знакомы с тем, что часто называют «формами энергии», такими как механическая, эластичная или химическая, но на самом базовом уровне все формы энергии, которые нас интересуют, могут быть описаны либо как кинетическая энергия , потенциальная энергия или электромагнитная энергия (например,г. светлый). Кинетическую энергию часто называют энергией движения (KE = ½ mv 2 , где m — масса, а v — скорость объекта), а потенциальную энергию — энергией положения или запасенной энергией (она рассчитывается различными способами. как мы увидим). Изменения между кинетической и потенциальной формами энергии связаны с силами. Мяч, который вы бросаете вверх, а затем падает, имеет изменяющееся количество кинетической энергии (она изменяется при изменении скорости мяча) и потенциальной энергии (которая изменяется при изменении расстояния между Землей и мячом.) По мере того, как мяч поднимается, вы можете заметить, что скорость мяча уменьшается, и, следовательно, KE уменьшается. В то же время PE увеличивается, так как расстояние между Землей и мячом увеличивается. По пути вниз верно обратное, мяч начинает двигаться быстрее — KE увеличивается, а PE уменьшается. Напомним принцип сохранения энергии; после того, как мяч покидает вашу руку, энергия не добавляется и не отнимается, когда мяч движется, если одна форма энергии увеличивается, другая должна уменьшаться.
как мы увидим). Изменения между кинетической и потенциальной формами энергии связаны с силами. Мяч, который вы бросаете вверх, а затем падает, имеет изменяющееся количество кинетической энергии (она изменяется при изменении скорости мяча) и потенциальной энергии (которая изменяется при изменении расстояния между Землей и мячом.) По мере того, как мяч поднимается, вы можете заметить, что скорость мяча уменьшается, и, следовательно, KE уменьшается. В то же время PE увеличивается, так как расстояние между Землей и мячом увеличивается. По пути вниз верно обратное, мяч начинает двигаться быстрее — KE увеличивается, а PE уменьшается. Напомним принцип сохранения энергии; после того, как мяч покидает вашу руку, энергия не добавляется и не отнимается, когда мяч движется, если одна форма энергии увеличивается, другая должна уменьшаться.
Еще один важный момент, связанный с энергией, заключается в том, что это свойство системы, а не объекта. Хотя может показаться заманчивым предположить, что движущийся мяч обладает определенным количеством кинетической энергии, важно помнить систему отсчета, из которой вы рассматриваете мяч. Конечно, скорость мяча связана с KE, но эта скорость зависит от того, откуда вы смотрите на мяч. Обычно (почти всегда) мы рассматриваем скорость с точки зрения наблюдателя, который находится в неподвижном состоянии, но если бы мы изменили рассматриваемую систему и наблюдали за шаром, пока мы тоже двигались, то скорость шара была бы другой. .Это может показаться довольно абстрактным, но это очень важный момент.
Конечно, скорость мяча связана с KE, но эта скорость зависит от того, откуда вы смотрите на мяч. Обычно (почти всегда) мы рассматриваем скорость с точки зрения наблюдателя, который находится в неподвижном состоянии, но если бы мы изменили рассматриваемую систему и наблюдали за шаром, пока мы тоже двигались, то скорость шара была бы другой. .Это может показаться довольно абстрактным, но это очень важный момент.
Точно так же весьма соблазнительно сказать, что мяч обладает потенциальной энергией, но на самом деле это тоже не совсем верно. Более точно — и более полезно — сказать, что система мяча и Земля обладают потенциальной энергией — опять же, здесь мы используем системную перспективу. В отличие от кинетической энергии, потенциальная энергия в системе также зависит от силы, действующей на нее, и эта сила является функцией положения объектов, которые взаимодействуют внутри гравитационного поля.Например, объект «без трения», путешествующий через пространство, свободное от полей (гравитационных или иных) с постоянной скоростью, имеет постоянную кинетическую энергию, но не имеет потенциальной энергии.
Потенциальная энергия (часто называемая накопленной энергией) или энергия положения поднимает вопрос — где эта энергия «хранится»? Полезно подумать об этом: в примере с мячом и Землей эта энергия хранится в гравитационном поле. Таким образом, мы можем согласиться с идеей, что PE зависит от расстояния между двумя взаимодействующими объектами.Это также позволит нам создать более всеобъемлющую концепцию потенциальной энергии, которая будет полезна в химии, поскольку мы распространим эти идеи на взаимодействия атомов и молекул. Вы можете спросить, почему тогда нормально говорить, что объект имеет кинетическую энергию (если вы указываете систему отсчета), и разница здесь в том, что любой движущийся объект может иметь связанную с ним энергию (например, вы, атом или автомобиль), но потенциальная энергия должна быть связана с объектами, которые взаимодействуют через поле, будь то гравитационное или электромагнитное.Тем не менее, поля есть везде — во Вселенной нет места, где бы не было полей (хотя их можно уравновесить, оставив результирующую силу равной нулю). Здесь важно то, что i) вы понимаете, что объекты взаимодействуют, ii) что эти взаимодействия вызывают изменение энергии системы, и iii) что взаимодействующие силы зависят от расстояния между взаимодействующими объектами (а также других факторов, такие как масса, которые постоянны).
Здесь важно то, что i) вы понимаете, что объекты взаимодействуют, ii) что эти взаимодействия вызывают изменение энергии системы, и iii) что взаимодействующие силы зависят от расстояния между взаимодействующими объектами (а также других факторов, такие как масса, которые постоянны).
Электромагнитная сила: Хотя гравитационные взаимодействия для всех намерений и целей не имеют отношения к химии (кроме как удерживать стакан на лабораторном столе!), Они представляют собой знакомый пример взаимосвязи между кинетической и потенциальной энергиями система, которую мы можем использовать для изучения электромагнитных взаимодействий, отвечающих за поведение атомов и молекул.Есть некоторые важные сходства между гравитационным и электромагнитным взаимодействиями; оба действуют на расстоянии, оба опосредуются полями, и оба демонстрируют одинаковую взаимосвязь между силой и расстоянием. Есть и важные отличия. В контексте химии электромагнитные взаимодействия намного сильнее, и хотя гравитация всегда притягивает, электромагнитные взаимодействия могут быть как притягивающими, так и отталкивающими.
Все электрически заряженные объекты взаимодействуют посредством электромагнитных сил.Как мы уже видели (и вернемся к этому снова), атомы и молекулы состоят из заряженных частиц (электронов и протонов), и они создают неравное распределение заряда, которое приводит к одинаковым видам взаимодействий. Сила этих взаимодействий между заряженными частицами может быть смоделирована с помощью уравнения, закона Кулона. Вы заметите, что его форма похожа на закон всемирного тяготения Ньютона. Однако вместо масс двух взаимодействующих объектов электромагнитная сила зависит от зарядов двух частиц (q 1 и q 2 ).Электромагнитная сила обычно действует на гораздо более коротких расстояниях, чем гравитация, но намного сильнее. Это сила, которая влияет на взаимодействие атомов и молекул.
Как и в случае с гравитационной силой, когда заряженные частицы сближаются, взаимодействие (притягивающее или отталкивающее) становится сильнее. Как и гравитация, взаимодействие между заряженными частицами осуществляется посредством поля, которое передает энергию между взаимодействующими объектами. Мы можем идентифицировать (и вычислять) типы изменений энергии, которые происходят при взаимодействии частиц.Например, две противоположно заряженные частицы притягиваются друг к другу. По мере приближения друг к другу сила притяжения становится сильнее, частицы будут двигаться быстрее, а их кинетическая энергия увеличивается. Учитывая тот факт, что энергия сохраняется, потенциальная энергия системы частиц должна уменьшаться в такой же степени. Если же, с другой стороны, два заряда одного знака, то сила между ними отталкивающая. Таким образом, если две частицы с одинаковым зарядом движутся навстречу друг другу, эта сила отталкивания уменьшит их скорость (и кинетическую энергию) и увеличит их потенциальную энергию.По мере того, как расстояние между частицами уменьшается, отталкивание в конечном итоге приводит к тому, что две частицы удаляются друг от друга.
Мы можем идентифицировать (и вычислять) типы изменений энергии, которые происходят при взаимодействии частиц.Например, две противоположно заряженные частицы притягиваются друг к другу. По мере приближения друг к другу сила притяжения становится сильнее, частицы будут двигаться быстрее, а их кинетическая энергия увеличивается. Учитывая тот факт, что энергия сохраняется, потенциальная энергия системы частиц должна уменьшаться в такой же степени. Если же, с другой стороны, два заряда одного знака, то сила между ними отталкивающая. Таким образом, если две частицы с одинаковым зарядом движутся навстречу друг другу, эта сила отталкивания уменьшит их скорость (и кинетическую энергию) и увеличит их потенциальную энергию.По мере того, как расстояние между частицами уменьшается, отталкивание в конечном итоге приводит к тому, что две частицы удаляются друг от друга.
Конечно, вы могли заметить, что есть небольшая проблема с уравнениями, которые описывают как гравитацию, так и электромагнитные силы. Если силы изменяются при уменьшении r, что происходит, когда расстояние между взаимодействующими объектами приближается к нулю? Если бы мы полагались на уравнения, которые использовали до сих пор, при приближении r к 0 сила (отталкивающая или притягивающая) приблизилась бы к бесконечности.Очевидно, здесь что-то не так, поскольку бесконечные силы невозможны (вы знаете, почему?). Мяч останавливается поверхностью Земли — он не падает к центру Земли, и заряженные частицы не сливаются друг с другом (и не улетают с бесконечной скоростью). Что нам не хватает? Что ж, проблема заключается в идее, что эти уравнения действительно имеют дело с идеализированными ситуациями, такими как точечные заряды или массы, а не в учете того факта, что материя состоит из атомов, молекул и ионов.Когда два атома или две молекулы (или две частицы, состоящие из атомов или молекул) приближаются друг к другу, они в конечном итоге сблизятся настолько, что отталкивание между одинаковыми зарядами станет сильнее, чем силы притяжения между разными зарядами.
Если силы изменяются при уменьшении r, что происходит, когда расстояние между взаимодействующими объектами приближается к нулю? Если бы мы полагались на уравнения, которые использовали до сих пор, при приближении r к 0 сила (отталкивающая или притягивающая) приблизилась бы к бесконечности.Очевидно, здесь что-то не так, поскольку бесконечные силы невозможны (вы знаете, почему?). Мяч останавливается поверхностью Земли — он не падает к центру Земли, и заряженные частицы не сливаются друг с другом (и не улетают с бесконечной скоростью). Что нам не хватает? Что ж, проблема заключается в идее, что эти уравнения действительно имеют дело с идеализированными ситуациями, такими как точечные заряды или массы, а не в учете того факта, что материя состоит из атомов, молекул и ионов.Когда два атома или две молекулы (или две частицы, состоящие из атомов или молекул) приближаются друг к другу, они в конечном итоге сблизятся настолько, что отталкивание между одинаковыми зарядами станет сильнее, чем силы притяжения между разными зарядами. Как мы увидим, когда кажется, что два макроскопических объекта соприкасаются, на самом деле это не так — их останавливает электрон-электронное отталкивание атомов на поверхности объектов. Мы вернемся ко всем этим идеям, когда будем обсуждать, как атомы и молекулы взаимодействуют на атомно-молекулярном уровне и как ведут себя электроны (квантово-механически).
Как мы увидим, когда кажется, что два макроскопических объекта соприкасаются, на самом деле это не так — их останавливает электрон-электронное отталкивание атомов на поверхности объектов. Мы вернемся ко всем этим идеям, когда будем обсуждать, как атомы и молекулы взаимодействуют на атомно-молекулярном уровне и как ведут себя электроны (квантово-механически).
Взаимодействующие атомы: силы, сохранение и преобразование энергии
Давайте сделаем шаг назад, соберемся с мыслями и поразмышляем над физикой ситуации. Во-первых, помните, что все вещество и энергия изолированной системы сохраняются; это первый закон термодинамики. Как мы упоминали выше, хотя энергия и материя могут при определенных обстоятельствах взаимно преобразовываться, обычно они остаются разными. Это означает, что в большинстве систем сохраняется общее количество материи и сохраняется общее количество энергии, и что они разделены.
Итак, давайте рассмотрим положение атомов или молекул в газе. Эти атомы и молекулы беспорядочно перемещаются в контейнере, сталкиваясь друг с другом и стенками контейнера. Мы можем думать об атомах / молекулах как о популяции. Популяционное мышление полезно для ряда явлений, от радиоактивного распада до биологической эволюции. Для совокупности атомов / молекул в целом существует средняя скорость, и эта средняя скорость является функцией температуры системы.Однако, если бы мы внимательно присмотрелись к совокупности молекул, мы бы обнаружили, что некоторые молекулы движутся очень быстро, а некоторые — очень медленно; есть распределение скоростей и скоростей (скорость + направление).
Мы можем думать об атомах / молекулах как о популяции. Популяционное мышление полезно для ряда явлений, от радиоактивного распада до биологической эволюции. Для совокупности атомов / молекул в целом существует средняя скорость, и эта средняя скорость является функцией температуры системы.Однако, если бы мы внимательно присмотрелись к совокупности молекул, мы бы обнаружили, что некоторые молекулы движутся очень быстро, а некоторые — очень медленно; есть распределение скоростей и скоростей (скорость + направление).
Когда два атома / молекулы приближаются друг к другу, они будут ощущать силу притяжения, вызванную искажениями электронной плотности, они известны как силы лондонской дисперсии, которые мы будем сокращать как LDF. Эффекты этих LDF зависят от силы взаимодействия (то есть величины зарядов и расстояния между ними) и от кинетической энергии атомов и молекул.ЛДФ — одна из многих межмолекулярных сил (ММП), которые мы рассмотрим позже. LDF лежат в основе ван-дер-ваальсовых взаимодействий в биологических системах.
Для упрощения представим очень простую систему: предположим, что есть только два изолированных атома: atom1 и atom2. Атомы покоятся друг относительно друга, но достаточно близко, чтобы притягивающие взаимодействия на основе LDF между ними были значительными. Чтобы это произошло, они должны быть достаточно близкими, поскольку такие притягивающие взаимодействия быстро уменьшаются, как 1 / r 6 , где r — расстояние между двумя атомами.На данный момент система, которую мы определим как два атома, имеет определенное количество энергии. Точное количество не имеет значения, но пока эти два атома остаются изолированными и не взаимодействуют ни с чем другим, энергия остается постоянной.
Так какое отношение все это имеет к сближению атомов? Мы можем использовать те же рассуждения, чтобы понять изменения энергии, которые происходят при сближении атомов друг с другом. Первоначально система будет иметь определенное количество энергии (кинетическая + потенциальная).Если атомы находятся достаточно близко, чтобы почувствовать влияние притягивающих LDF, они начинают двигаться навстречу друг другу, представьте себе шар, падающий на Землю, и некоторая часть потенциальной энергии, связанной с начальным состоянием атомов, преобразуется в кинетическую энергию. (E K = ½ мВ 2 ).
(E K = ½ мВ 2 ).
По мере приближения друг к другу ЛДФ становятся сильнее, атомы сильнее притягиваются друг к другу; потенциальная энергия системы уменьшается и преобразуется в кинетическую энергию, атомы движутся быстрее.Полная энергия остается такой же, пока вокруг нет других атомов. Это продолжается до тех пор, пока атомы не подойдут достаточно близко, чтобы отталкивающие взаимодействия между электронами стали сильнее, и, когда они приближаются еще ближе, вступают в игру отталкивающие взаимодействия между положительно заряженными ядрами, вызывая повышение потенциальной энергии в системе. Когда атомы начинают замедляться, их кинетическая энергия превращается обратно в потенциальную. В конце концов они остановятся, а затем будут отталкиваться друг от друга.В этот момент потенциальная энергия будет преобразована обратно в кинетическую энергию. Однако по мере удаления отталкивание сменится притяжением, и они замедлятся; их кинетическая энергия будет преобразована обратно в потенциальную энергию. Без каких-либо других факторов, действующих в системе, два атома будут колебаться вечно. На графике зависимости потенциальной энергии от расстояния между атомами мы видим, что потенциальная энергия системы достигает минимума на некотором расстоянии. Ближе к этому моменту в игру вступают отталкивающие электромагнитные силы, а дальше — электромагнитные силы притяжения (LDF) являются доминирующими.Расстояние между двумя атомами зависит от относительной силы взаимодействий притяжения и отталкивания. Однако даже в минимуме в системе есть некоторая потенциальная энергия, запасенная в электромагнитном поле между двумя атомами. При температурах выше абсолютного нуля (0 К) пара атомов также будет обладать кинетической энергией, поскольку они колеблются взад и вперед.
Без каких-либо других факторов, действующих в системе, два атома будут колебаться вечно. На графике зависимости потенциальной энергии от расстояния между атомами мы видим, что потенциальная энергия системы достигает минимума на некотором расстоянии. Ближе к этому моменту в игру вступают отталкивающие электромагнитные силы, а дальше — электромагнитные силы притяжения (LDF) являются доминирующими.Расстояние между двумя атомами зависит от относительной силы взаимодействий притяжения и отталкивания. Однако даже в минимуме в системе есть некоторая потенциальная энергия, запасенная в электромагнитном поле между двумя атомами. При температурах выше абсолютного нуля (0 К) пара атомов также будет обладать кинетической энергией, поскольку они колеблются взад и вперед.
Здесь у нас есть основной принцип, к которому мы будем возвращаться снова и снова: стабилизирующее взаимодействие всегда снижает потенциальную энергию системы, и, наоборот, дестабилизирующее взаимодействие всегда увеличивает потенциальную энергию системы. В изолированной системе всего с двумя атомами это колебание будет продолжаться вечно, потому что нет возможности изменить энергию системы. В реальной жизни такой ситуации не бывает, потому что двухатомных систем не бывает. Например, даже в газе, где атомы находятся далеко друг от друга, в системе обычно присутствует большое количество атомов, которые имеют диапазон скоростей и кинетических энергий. Эти атомы часто сталкиваются и передают друг другу энергию. Следовательно, когда два атома сталкиваются и начинают колебаться, некоторая энергия может передаваться другим частицам в результате столкновений.Если это произойдет, между двумя частицами может образоваться устойчивое взаимодействие; они будут «держаться» вместе. Если приближается больше частиц, они также могут притягиваться, и если их дополнительная энергия передается в результате столкновений, частицы могут образовывать все больший и больший сгусток.
В изолированной системе всего с двумя атомами это колебание будет продолжаться вечно, потому что нет возможности изменить энергию системы. В реальной жизни такой ситуации не бывает, потому что двухатомных систем не бывает. Например, даже в газе, где атомы находятся далеко друг от друга, в системе обычно присутствует большое количество атомов, которые имеют диапазон скоростей и кинетических энергий. Эти атомы часто сталкиваются и передают друг другу энергию. Следовательно, когда два атома сталкиваются и начинают колебаться, некоторая энергия может передаваться другим частицам в результате столкновений.Если это произойдет, между двумя частицами может образоваться устойчивое взаимодействие; они будут «держаться» вместе. Если приближается больше частиц, они также могут притягиваться, и если их дополнительная энергия передается в результате столкновений, частицы могут образовывать все больший и больший сгусток.
Как мы обсуждали ранее, LDF возникают из-за флуктуаций электронной плотности вокруг ядер и являются общей характеристикой всех атомов; все атомы / молекулы притягиваются друг к другу таким образом. Расстояние между атомами / молекулами, где это притяжение является наибольшим, известно как радиус Ван-дер-Ваальса атома / молекулы.Если атомы / молекулы перемещаются друг к другу ближе, чем их ван-дер-ваальсовы радиусы, они отталкиваются друг от друга. Радиус Ван-дер-Ваальса атома характерен для каждого типа атома / элемента. Как упоминалось ранее, только в условиях экстремальной температуры и давления ядра двух атомов могут сливаться вместе, образуя атом нового типа; такое событие ядерного / атомного слияния приводит к взаимному преобразованию материи в энергию.
Расстояние между атомами / молекулами, где это притяжение является наибольшим, известно как радиус Ван-дер-Ваальса атома / молекулы.Если атомы / молекулы перемещаются друг к другу ближе, чем их ван-дер-ваальсовы радиусы, они отталкиваются друг от друга. Радиус Ван-дер-Ваальса атома характерен для каждого типа атома / элемента. Как упоминалось ранее, только в условиях экстремальной температуры и давления ядра двух атомов могут сливаться вместе, образуя атом нового типа; такое событие ядерного / атомного слияния приводит к взаимному преобразованию материи в энергию.
Вопросы к ответу
- Что такое потенциальная энергия? Вы можете привести пример?
- Что такое кинетическая энергия? Вы можете привести пример?
- Как вы думаете, что такое потенциальная энергия на атомном уровне?
- Как вы думаете, что такое кинетическая энергия на атомном уровне?
- Почему повышение температуры влияет на скорость молекулы газа?
Вопросы для размышления
- Что такое энергия (изменились ли ваши представления по сравнению с прошлым)?
Вопросы на будущее:
- Что означает система, когда мы говорим о потенциальной энергии системы?
- Гелий сжижается при температуре около 4K.
 Что заставляет атомы гелия слипаться? (Почему они не превращаются в газ?)
Что заставляет атомы гелия слипаться? (Почему они не превращаются в газ?) - Рассмотрим два атома, разделенных 1 пространственной единицей, по сравнению с 4 пространственными единицами. Насколько слабее взаимодействие между более удаленными атомами? Как это по сравнению с поведением простых зарядов (а не атомов)?
Теперь давайте взглянем на пару реальных систем. Мы начнем с рассмотрения взаимодействий между простейшими атомами водорода (H) и гелием (He) и простейшей молекулой, молекулярным водородом (H 2 ).Типичный атом водорода состоит из одного протона и одного электрона, хотя некоторые из них содержат один или два нейтрона и образуют «изотопы», известные как дейтерий и тритий соответственно. Молекула водорода — это совершенно другое химическое соединение: она содержит два атома водорода, но ее свойства и поведение совершенно разные. Атомы гелия имеют 2 протона и 2 нейтрона в своих ядрах и 2 электрона в своих электронных облаках. Мы рассмотрим более сложные атомы и молекулы после того, как обсудим атомную структуру более подробно в следующей главе. Одним из преимуществ сосредоточения внимания на молекулярном водороде и гелии является то, что это также позволяет нам ввести, сравнить и кратко рассмотреть как ван-дер-ваальсовы взаимодействия (из-за IMF), так и ковалентные связи; мы сделаем гораздо больше, учитывая позже.
Одним из преимуществ сосредоточения внимания на молекулярном водороде и гелии является то, что это также позволяет нам ввести, сравнить и кратко рассмотреть как ван-дер-ваальсовы взаимодействия (из-за IMF), так и ковалентные связи; мы сделаем гораздо больше, учитывая позже.
Когда два атома гелия сближаются, вступают в действие LDF и возникает притягивающее взаимодействие. В случае He падение потенциальной энергии из-за взаимодействия довольно мало, то есть стабилизация из-за взаимодействия, и не требуется много энергии, чтобы разбить два атома.Эта энергия передается за счет столкновений с другими атомами He. Фактически, при атмосферном давлении гелий никогда не бывает твердым телом, а жидкий He кипит при температуре ~ 4 К (-268,93 ° C), всего на несколько градусов выше абсолютного нуля или 0 K (-273,15 ° C). Это означает, что при всех температурах выше ~ 4 K в атомах системы достаточно кинетической энергии, чтобы нарушить взаимодействие между атомами He. Слабость этих взаимодействий означает, что при более высоких температурах, выше 4 К, атомы гелия не «слипаются». Гелий — это газ при температуре выше 4 К.
Гелий — это газ при температуре выше 4 К.
Теперь сравним поведение гелия с поведением водорода (H). Когда два атома водорода сближаются, они образуют гораздо более стабильное взаимодействие, примерно в 1000 раз более сильное, чем лондоновские силы дисперсии He – He. При взаимодействии H – H атомы удерживаются вместе притяжением каждого ядра к обоим электронам. Сила притяжения намного сильнее, и по мере приближения атомов это приводит к большему падению потенциальной энергии и к минимуму для двух взаимодействующих атомов водорода, который намного глубже, чем для He – He.Из-за своей радикально другой стабильности система H – H получила новое имя; он известен как молекулярный водород или H 2 , а взаимодействие между атомами H известно как ковалентная связь. Чтобы разделить молекулу водорода на два атома водорода, то есть разорвать ковалентную связь, мы должны подвести энергию. Эта энергия может принимать несколько форм: например, энергия, доставляемая столкновениями молекул с окружающими молекулами или поглощением света, приводит к разрыву связи.
Каждый H может образовывать только одну ковалентную связь, приводящую к образованию молекул H – H, которые часто также записывают как H 2 молекул. Эти молекулы H – H сами притягиваются друг к другу через LDF. Мы можем сравнить энергию, связанную с ковалентной связью H – H и H 2 — H 2 IMF. Чтобы разорвать ковалентную связь H – H, необходимо нагреть систему примерно до 5000 K. С другой стороны, чтобы разорвать межмолекулярные силы между отдельными молекулами H 2 , температура системы должна подняться только до ~ 20 K; выше этой температуры H 2 — газ.При этой температуре IMFs между отдельными молекулами H 2 недостаточно сильны, чтобы противостоять кинетической энергии сталкивающихся молекул. Теперь вы можете спросить себя, почему H 2 кипит при более высокой температуре, чем He? Хороший вопрос! Оказывается, сила ЛДФ зависит от нескольких факторов, включая форму молекулы, площадь поверхности и количество электронов. Например, чем больше площади поверхности, разделяемые между взаимодействующими атомами или молекулами, тем сильнее возникают LDF и тем сильнее результирующее взаимодействие.Другой фактор — способность электронного облака становиться заряженным, свойство, известное как поляризуемость. Вы можете думать о поляризуемости как о гибкости электронного облака. Грубо говоря, чем дальше от ядра находятся электроны, тем более поляризуемым (гибким) становится электронное облако. Мы вернемся к этой и связанным с ней темам позже. Как мы увидим, более крупные молекулы с более сложной геометрией, такие как биологические макромолекулы (белки и нуклеиновые кислоты), могут взаимодействовать через большую площадь поверхности и поляризуемые области, что приводит к соответственно более сильным взаимодействиям.
Например, чем больше площади поверхности, разделяемые между взаимодействующими атомами или молекулами, тем сильнее возникают LDF и тем сильнее результирующее взаимодействие.Другой фактор — способность электронного облака становиться заряженным, свойство, известное как поляризуемость. Вы можете думать о поляризуемости как о гибкости электронного облака. Грубо говоря, чем дальше от ядра находятся электроны, тем более поляризуемым (гибким) становится электронное облако. Мы вернемся к этой и связанным с ней темам позже. Как мы увидим, более крупные молекулы с более сложной геометрией, такие как биологические макромолекулы (белки и нуклеиновые кислоты), могут взаимодействовать через большую площадь поверхности и поляризуемые области, что приводит к соответственно более сильным взаимодействиям.
В этот момент вы, вероятно (или должны) задать себе несколько серьезных вопросов, например, почему атомы гелия не образуют ковалентных связей друг с другом? Почему атом водорода образует только одну ковалентную связь? Что происходит, когда взаимодействуют другие виды атомов? Чтобы понять ответы на эти вопросы, нам нужно рассмотреть, чем структура атомов различается между различными элементами, что является предметом следующей главы.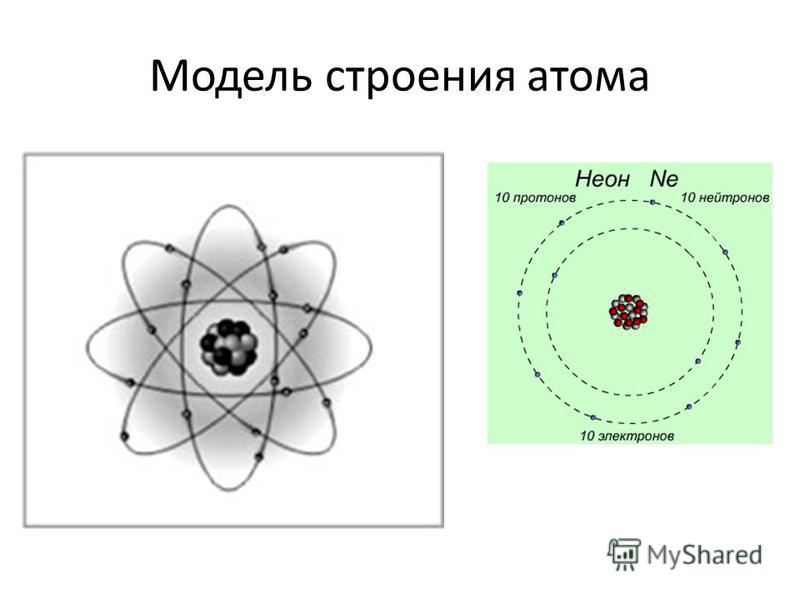
Вопросы к ответу
- Можете ли вы нарисовать картину (примерно с 20 атомами гелия, представленными в виде кружков) того, как бы выглядел твердый гелий, если бы вы могли его увидеть?
- Чем это будет отличаться от представлений о жидком гелии или газообразном гелии?
- Теперь сделайте аналогичный рисунок H 2 .Помогает ли это объяснить более высокую температуру плавления H 2 ?
Вопрос для размышления
- Чем отличаются свойства твердых тел, жидкостей и газов?

 Дж. Томпсон
Дж. Томпсон Но противоположностью глубокой истины вполне может быть другая глубокая истина. Нилс Бор (1865–1962)
Но противоположностью глубокой истины вполне может быть другая глубокая истина. Нилс Бор (1865–1962)
 Что заставляет атомы гелия слипаться? (Почему они не превращаются в газ?)
Что заставляет атомы гелия слипаться? (Почему они не превращаются в газ?)