История развития представлений о строении атома » HimEge.ru
Все тела живой и неживой природы, несмотря на их разнообразие, состоят из мельчайших частиц — атомов. Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»). Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
Первые представления об атоме
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.е. неделимой частью яблока). Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению; все атомы одинаковы, но они различаются внешне (атомы воды, например, гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они зацепляются друг за друга, что придает железу свойства твердого тела). Представления Демокрита были умозрительными.
Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Атоми́зм — натурфилософская теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. (В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы).
Основы атомной теории строения вещества
В 1808 г. физик Дальтон Джон (1766–1844) возродил атомизм, доказал реальность существования атомов. Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
Дальтон был одним из самых знаменитых и уважаемых учёных своего времени, ставший широко известным благодаря своим новаторским работам в разных областях знания. Он впервые (1794) провёл исследования и описал дефект зрения, которым страдал сам, — цветовая слепота, позже названный в его честь дальтонизмом; открыл закон парциальных давлений (закон Дальтона) (1801), закон равномерного расширения газов при нагревании (1802), закон растворимости газов в жидкостях (закон Генри-Дальтона). Установил закон кратных отношений (1803), обнаружил явление полимеризации (на примере этилена и бутилена).
Однако вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
В 1897 г. английский физик Дж. Томсон изучая катодные лучи, пришел к выводу, что атомы любого вещества содержат отрицательно заряженные частицы, которые он назвал электронами. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью,в положительно заряженной сфере находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
Ядерная модель атома (планетарная)
Резерфорд бомбардировал α-частицами атомы тяжелых элементов (золото, серебро, медь и др.). α-частицы – это полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к явлениям атомных масштабов законы классической физики неприемлемы.
Датским физик Нильс Бор (1885 — 1962) считал что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и «спасающих») атом Резерфорда. Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.
Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
Квантовая теория строения атома
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности Гейзенберга служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N,
N = А — Z,
А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
Квантовая механика — математически очень сложная теория. Но главная трудность не в этом. Процессы, которые описывает квантовая механика, — процессы микромира — недоступны не только восприятию нашими органами чувств, но и воображению. Люди лишены возможности представить их себе наглядно в полной мере, так как они совершенно отличны от тех макроскопических явлений, которые человечество наблюдало на протяжении миллионов лет. Человеческое воображение не создает новые, а лишь комбинирует известные, поэтому практически невозможно на нашем макроскопическом языке описать поведение фотонов и других частиц.
См. также Современная теория строения атома
himege.ru
История создания модели атома | CHEM-MIND.com
История атома: теории и модели
Вся материя состоит из атомов. Это то, что мы теперь представляем, как само собой разумеющееся, и одна из первых вещей, которую вы узнаете сразу в начале своего обучения химии. Несмотря на это, наши представления о том, что же такое атом появилось совсем недавно: всего за сто лет назад, причем ученые до сих пор спорят, как именно атом выглядит.
Графическое представление модели атома было предложено в 1800-х годах, но идея «атома» существовала задолго до того. Слово «атом» происходит от древнегреческого «ἄτομος» и примерно переводится как «неделимый». Древнегреческая теория чаще всего приписывается Демокриту (460-370 до н.э.) и его наставнику Левкиппу. Хотя их идеи об атомах были рудиментарными по сравнению с нынешней концепцией сегодня, они обрисовал важную идею, состоящую в том, что все состоит из атомов — невидимых и неделимых сфер материи бесконечного типа и числа.
![clip_image001[6] clip_image001[6]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0016.jpg) Демокрит Абдерский
Демокрит АбдерскийДревнегреческие философы предположили, что атомы отличаются своей формой в зависимости от типа. Например, атомы железа представлялись виде крючков, которые цеплялись друг за друга, что объясняло почему железо было твердым при комнатной температуре, а атомы воды были гладкими и скользкими, поэтому вода была жидкой при комнатной температуре. И хоть теперь мы знаем, что это не так, их идеи были заложены в основу будущих атомных моделей.
Новое представление об атоме появилось лишь в 1803 году, когда английский химик Джон Дальтон начал развивать научное определение атома. Он основывался на идеи древних греков в описании атомов как маленьких, твердых, неделимых сфер, как и у греческих философов, у Дальтона атомы одного элемента идентичны друг другу. Последний пункт по-прежнему является в значительной степени верным, исключением являются изотопы различных элементов, которые отличаются по числу нейтронов. Однако, так как нейтрон не был обнаружен до 1932 года, мы, вероятно, можем простить Дальтону эту ошибку. Дальтон также придумал теорию о том, как атомы объединяются, образуя соединения, а также представил первый набор химических символов для известных элементов.
![clip_image002[4] clip_image002[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0024.jpg) Джон Дальтон
Джон Дальтон![clip_image003[4] clip_image003[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0034.png) Модель твердой сферы
Модель твердой сферыПредставление атомной теории Дальтона было началом развития современной модели атома. Однако затем последовал еще один период где наши знания об атоме никак не прогрессировала. Конечно существовали попытки понять, как атомы могут выглядеть, например, такими попытками являлись например предположения лорда Кельвина, что атомы — это вихревые частицы, вращение которых объясняет их основные свойства, по аналогии с теорией гидродинамических вихрей.
Первый прорыв произошел в конце 1800-х годов, когда английский физик Джозеф Джон Томсон обнаружил, что атом не был столь же неделимым, как заявлялось ранее. Он проводил эксперименты с использованием катодных лучей (электронных пучков), произведенных в разрядной трубке, и обнаружил, что лучи притягиваются положительно заряженными металлическими пластинами, но отталкивается отрицательно заряженными. Из этого он сделал вывод, что лучи должны быть заряжены отрицательно.
![clip_image004[6] clip_image004[6]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0046.jpg) Джозеф Джон Томсон
Джозеф Джон Томсон![clip_image005[4] clip_image005[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0054.png) Модель сливового пудинга
Модель сливового пудингаИзучая частицы в лучах, он смог сделать вывод о том, что они были в две тысячи раз легче, чем водород, а также путем изменения металла катода, он продемонстрировал, что эти частицы присутствовали во многих типах атомов. Таким образом он открыл электрон (хотя он называл его как «корпускул»), и показал, что атомы не являются неделимыми. За это открытие он получил Нобелевскую премию в 1906 году.
В 1904 году он выдвинул свою модель атома на основе своих выводов, названную «пудинговой моделью атома». Данная модель представляла атом как положительно заряженную сферу, с электронами, усеянными в сфере, как сливы в пудинге. Модель Томсона была вскоре опровергнута его учеником.
Эрнест Резерфорд являлся физиком из Новой Зеландии, обучался в Кембриджском университете у Томсона. Работая в Университете Манчестера, он представил новое представление о модели атома. Его работа была опубликована уже после того, как он получил Нобелевскую премию в 1908 году за исследования в химии радиоактивных веществ.
![clip_image006[4] clip_image006[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0064.jpg) Эрнест Резерфорд
Эрнест Резерфорд![clip_image007[4] clip_image007[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0074.png) Атомная модель
Атомная модельРезерфорд разработал эксперимент, который помог исследовать атомную структуру. Для этого он стрелял положительно заряженными альфа-частицами в тонкий лист золотой фольги. Альфа-частицы были настолько малы, что проходили сквозь золотую фольгу. В соответствии с моделью Томсона, в которой положительный заряд диффундирует по всему атому, альфа частицы должны были пройти насквозь листа практически без отклонения. Проводя этот эксперимент, Резерфорд надеялся, подтвердить модель Томсона — своего учителя, однако, все оказалось как раз наоборот.
В ходе эксперимента, большинство из альфа-частиц, проходили через фольгу практически без отклонения. Тем не менее, очень небольшое число частиц отклонялись от намеченного пути, отклоняясь при этом на очень большой угол. Это было совершенно неожиданно; как заметил сам Резерфорд, «Это было почти так же невероятно, как если бы вы выпустили 15-дюймовый снаряд в папиросную бумагу, а он вернулся бы и ударил бы тебя». Единственным возможным объяснением было то, что положительный заряд не распространялся по всему атому, а был локализован в небольшом, плотном центре — ядре. Согласно этому, большой частью остальной части атома являлось просто пустое пространство.
Открытие Резерфордом ядра означало необходимость переосмысления атомной модели. Он предложил модель, в которой электроны вращаются вокруг положительно заряженного ядра. Однако, он не объяснил, что держит электроны, вращающиеся вокруг ядра вместо того, чтобы просто упасть на ядро.
Новая модель была представлена Нильсом Бором. Бор был датским физик, который приступил к решению проблем, связанных с моделью Резерфорда. Так как, классическая физика не могла правильно объяснить, что происходит на атомном уровне, он обратился к квантовой теории для объяснения расположение электронов. Его модель постулировала существование энергетических уровней или электронных оболочек. Электроны могут находится только на этих энергетических уровнях; Другими словами, их энергия квантуется, и не может принять только какое-либо значение между квантованными уровнями. Электроны могут перемещаться между этими энергетическими уровнями (именуемыми Бором как «стационарные состояния»), но при условии поглощения или испускания энергии.
![clip_image008[4] clip_image008[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0084.jpg) Нильс Бор
Нильс Бор![clip_image009[4] clip_image009[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0094.png) Планетарная модель
Планетарная модельПредложение Бором стабильных энергетических уровней в некоторой степени решала проблему падения электронов по спирали на ядро. Истинные причины сложнее, и они скрыты в сложном мире квантовой механики; и, как Бор сам сказал: «Если квантовая механика вас не потрясла до глубины души, то вы просто еще этого поняли (или вы еще недостаточно хорошо понимаете квантовую механику — игра слов, прим. переводчика)».
Модель Бора не решает всех проблем атомной модели. Она хорошо подходит для атомов водорода, но не может объяснить наблюдения за более тяжелыми элементами. Это также нарушает принцип неопределенности Гейзенберга, один из краеугольных камней квантовой механики, в которой говорится, что мы не можем знать точное местоположение и импульс электрона одновременно. Тем не менее, модель атома Бора наиболее широко распространена и известна, что связано с удобством объяснения химической связи и реакционной способности некоторых групп элементов на начальном этапе обучения.
Во всяком случае, модель все еще требует переработки. На данный момент, многие ученые проводили исследования и пытаясь разработать квантовую модель атома. Главным среди них являлся австрийский физик Эрвин Шредингер, которого вы, вероятно, знаете благодаря «Коту Шредингера». В 1926 Шредингер предположил, что, электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
![clip_image010[6] clip_image010[6]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0106.jpg) Эрвин Шредингер
Эрвин Шредингер![clip_image011[4] clip_image011[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/clip_image0114.png) Квантовая модель
Квантовая модельШредингер решил ряд математических уравнений для описания модели распределения электрона в атоме. Его модель демонстрирует ядро, окруженное облаками электронной плотности. Эти облака являются облаками вероятности; хотя мы не знаем точно где электроны в тот или иной момент времени, но мы знаем в каких заданных областях пространства они вероятно могут находится. Эти участки пространства называются электронными орбитами. Становится понятно, почему в средней школе уроки химии зачастую не приводят эту модель, хотя это модель считается наиболее точной!
Уже после Шредингера, в 1932 году английский физик Джеймс Чедвик (ученик Эрнеста Резерфорда) обнаружил существование нейтрона, завершая нашу картину субатомных частиц, составляющих атом. Однако, история не заканчивается на этом; физики обнаружили, что протоны и нейтроны, составляющие ядро, сами делится на частицы, называемые кварками — но это уже совсем другая история! Во всяком случае, модель атома дает нам отличный пример того, как научные модели могут меняться с течением времени, и показывает, как новые данные могут привести к появлению новых моделей.
![clip_image011[4] clip_image011[4]](/800/600/http/www.chem-mind.com/wp-content/uploads/2017/03/historyopen.png)
www.chem-mind.com
История открытия атома и его строения
09.10.2015Физика относится к науке полной тайн и загадок, а одной из увлекательных страниц ее истории, несомненно, является открытие строения сложного атома. Так к концу XIX века в обществе витало много предположений, что строение атома не так уж и просто. Все это стало известно благодаря открытию электролиза и самого электрона. Теории о существовании атома, как неделимой частицы, которая нас окружает, уходит своими корнями еще в далекое прошлое. Само понятие атом существовало еще и до н.э. Ученый Демокрит был убежденным исследователем атома. Он представлял себе картину мира следующим образом.
Все тела состоят из атомов, у которых неделимая и неизменная форма, число этих атомов неограниченно, так же как и число их типов, они смело могут образовывать различные соединения, благодаря различным крючкам и выступам, ну и ко всему они находятся в постоянном движении. В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы. Основываясь на этих данных, ученые физики продолжали философствовать о строении атома, и, вскоре, после открытия электрона в 1897 году, Дж. Дж. Томсоном была представлена модель атомного строение.
Согласно модели Томсона атом имеет положительный заряд, который равномерно заполняет весь его объем, внутри его расположены электроны, тем самым атом несколько напоминает пудинг с изюмом. Предполагалось, что электронов большое количество, и они могут находиться в движении. Сам атом являлся электро-нейтральным. Устойчивость атома определяло расположение электронов. Своей разработкой Томсон трактовал ряд физических явлений у некоторых веществ.
Вскоре была доказана несостоятельность этой теории. Модель строения атома Томсона противоречила опытам, которые были проведены Резерфордом. Резерфорд – это выдающийся ученый, основатель некоторых направлений в физики, лауреат Нобелевской премии. В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Д.И. Менделеев, открыв свой закон, подтвердил то, что между химическими элементами есть своя закономерность. Отсюда следовал вывод – все атомы тоже имеют что-то общее. До конца XIX века, считалось, что атом не может разрушаться, но в дальнейшем были сделаны открытия по строению атома, оно достаточно сложное, ко всему у него есть способность к превращениям. Так было доказано выделение электронов, получение рентгеновских лучей (В. Рентген в 1895 году) и радиоактивного излучения (А. Беккерелей в 1896 году).
Большой шаг в исследовании строения атома сделал Н. Бор. Им был сделан анализ всех данные, что привело его к выводу – описание систем атомов не должно ограничиваться привычными представлениями в физики. Им были написаны постулаты – о стационарных состояниях и правило частот. Его теория оказала огромный клад в развитие физики, химии, выяснении структуры атома, спектроскопии и т.д. Но оставались вещи, которые она и не могла объяснить. Так Бор представлял, что движение электронов просто механическое, хотя оно не являлось таковым. В дальнейшем это было объяснено с помощью новой теории кванта.
Открытие урана в 1939 году доподлинно подтвердило, что атом способен делится. Ко всему он состоит не только из мелких частиц. Эти части способны к самопроизвольному испусканию при радиоактивном разрушении. Атом еще и способен давать излучение, и которое может быть не только видимое, но также и электромагнитное (пример: х-лучи).
Рейтинг статьи: 20992 просмотра
Автор: Елена Мазина
Открытия и атом [ВИДЕО]
geo-storm.ru
3.7 Эволюция представлений о строении атомов
Представление об атомах как неделимых мельчайших частицах веществ возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К концу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье, великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона была доказана реальность существования атомов. До конца XIX века господствовало убеждение, что атомы – предел делимости материи. В конце XIX века появился ряд доказательств о сложной структуре атомов.
В 1897 году Дж.Томпсон открыл электроны и предложил первую модель атома, представив атом как положительно заряженный сгусток материи, в который вкраплено столько электронов, что превращает его в электрически нейтральное образование (рис. 2). Положительно заряженных частиц внутри атома модель Томсона не предполагала. После открытия испускания положительно заряженных альфа-частиц радиоактивными веществами его модель была признана неверной.
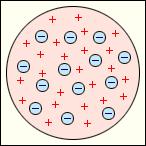
Рис. 2. Модель атома Дж.Томпсона.
В 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. При прохождении пучка параллельных лучей сквозь слои газа или тонкую металлическую пластинку происходит рассеяние альфа-частиц, т.е. отклонение их от первоначального пути. Углы отклонения невелики, но всегда имеется небольшое число частиц (примерно одна из нескольких тысяч), которые отклоняются очень сильно. Некоторые частицы отбрасываются назад, как если бы на пути встретилась непроницаемая преграда. Исходя из этих опытов, Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Поскольку масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
Предложенная Резерфордом планетарная модель атома (рис. 3), легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов, поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути (рис. 4). Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
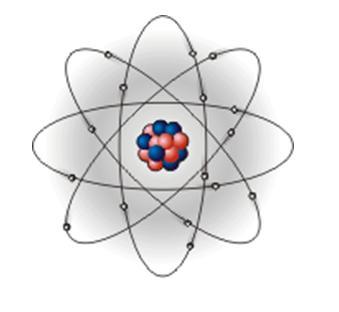
Рис. 3. Планетарная модель атома.
Планетарная модель атома не объясняла устойчивости атомов. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы — очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности.

Рис. 4. Рассеяние альфа-частиц в опыте Резерфорда.
Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. Н.Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров и ядерную модель атома Резерфорда. В основу своей теории атома Бор положил следующие постулаты.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. Этот постулат находится в противоречии с классической теорией. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантовые значения момента импульса.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией hν=En-Em, равной разности энергий соответствующих стационарных состояний.
При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn< Еm — его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот квантовых переходов и определяет линейчатый спектр атома (рис. 5).
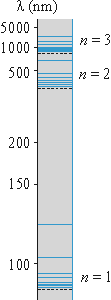
Рис. 5. Линейчатый спектр атома водорода.
Теория Бора блестяще объяснила экспериментально наблюдаемый линейчатый спектр водорода. Относительно атома гелия и более сложных атомов теория Бора позволила делать лишь качественные (хотя и очень важные) заключения.
Вопросы для самоконтроля:
Какие факты подтверждают волновую концепцию света? Корпускулярную?
Для каких материальных объектов характерен корпускулярно-волновой дуализм?
Сформулируйте соотношение неопределенностей. Каково его значение в исследовании объектов микромира?
Сформулируйте принцип тождественности. Применим ли он в классической механике?
В чем заключается отличие динамических законов от статистических?
Чем объясняется эффект конфайнмента кварков?
Расположите основные физические взаимодействия по величине относительной интенсивности от меньшего к большему.
studfile.net
1. История развития учения о строении атома
1.1. Модель атома по резерфорду
Э.Резерфордом в 1911 – 1913 г.г. исследовал прохождение α — частиц через тонкую металлическую фольгу. Схематически сущность эксперимента приведена на рисунке 1.
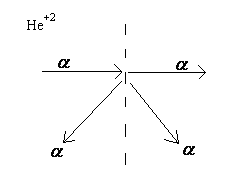
Рисунок 1. Прохождение α-частиц через фольгу
Оказалось, что большая часть α — частиц проходила через фольгу не отклонялась, а лишь малая часть изменяла направление и даже отбрасывалась в противоположном напревлении, т.е. в очень малой части объема атома находится частица с большой массой и положительным зарядом сталкиваясь с которой α-частица изменяла свое направление движения.
Вывод: Атом состоит из положительно заряженного ядра, занимающего малый объем, и отрицательно заряженных легких частиц – электронов. Такая система может быть устойчива при условии вращения электронов вокруг ядра и при этом центробежная сила вращения электронов должна быть равна электростатическому притяжению электронов к ядру. Такую модель по аналогии с солнечной системой назвали планетарной.
Модель атома по Резерфорду не могла объяснить следующее:
1) Устойчивости системы ядро – электрон. При движении вокруг ядра, электрон должна непрерывно излучать энергию, что будет приводить к уменьшению радиуса орбиты электрона и в конечном итоге электрон должен упасть на ядро. На самом деле в отсутствие внешнего воздействия атом не излучает энергию.
2) Линейчатой природы спектра. Согласно предложенной модели радиус орбиты электрона должен непрерывно уменьшаться, что должно приводить к сплошному спектру. Но спектры атомов имеют линейчатую природу, т.е. электроны излучают и поглощают энергию не непрерывно, а отдельными порциями («квантами»).
Устранить эти противоречия смог Нильс Бор.
1.2. Модель атома по бору
В 1900 году Макс Планк показал, что энергия электромагнитного излучения видимой части спектра квантуется, т.е. свет излучается и поглощается не непрерывно, а отдельными порциями — квантами. Энергия квантов связана с частотой излучения υ следующей формулой
Е = h · υ,
где h — постоянная Планка, υ – частота излучения.
Основываясь на квантовой теории излучения, Нильс Бор сделал вывод о том, что энергия электронов в атоме изменяется скачками, т.е. электрон в атоме может принимать не любые, а строго определённые значения энергии. Переход электрона из одного энергетического состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
На основе квантовой теории излучения и планетарной модели атома по Резерфорду Бор предложил модель атома, которая базировалась на следующих постулатах:
1) Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
2) Двигаясь по стационарным орбитам, электрон не излучает энергию.
3) При переходе с более низкой на более высокую орбиту электрон поглощает энергию, равную разности энергий между соответствующими орбитами. Такое состояние электрона называется возбужденным. В этом состоянии он пребывает примерно 10-8 секунды и после излучения избыточной энергии он переходит обратно на стационарную орбиту.
Таким образом всю информацию о состоянии электрона в атоме можно получить исследуя спектры поглощения и испускания(эмиссионный спектр). Образно говоря можно сказать, что спектр – это зеркало электронных состояний.
Предложенный Бором математический аппарат позволил рассчитать спектр только атома водорода и водородоподобных атомов.
Основные недостатки модели атома по Бору:
studfile.net
История открытия строения атома до ХХ века
Министерство образования и науки РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Тамбовский государственный университет имени Г.Р. Державина»
Медицинский институт
Реферат
По дисциплине: «Химия»
На тему: «История открытия строения атома до ХХ века»
Выполнила: студентка 1 курса
Группы 103 (Подгруппы 106)
Мамонтова А.М.
Тамбов, 2016
Содержание
Введение
1. Общие представления об атоме
2. Положения Демокрита
3. Слово об атоме в поэме Тита Лукреция Кара
4. Гипотезы Древней Греции
5. Теория о мельчайших частицах в России
Заключение
Литература
Введение
В истории развития одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце ХIX – начале ХХ в. Идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в то время ничего о внутреннем строении атома не было известно. Задача реферата – совершить экскурс в историю развития взглядов на строение атома, начиная с древних времен до начала 20-го века.
1. Общие представления об атоме
В древнегреческой философии, а позднее и в средние века, люди предполагали, что вещи вокруг них состоят из двух частей: неделимые атомы, каким-то образом сцепленные друг с другом, и из пустоты между атомами. Атомы считались вечными и неразрушимыми корпускулами. Эта позиция была отражена в трудах таких философов как Демокрит или Левкипп, но никаких доказательств этой теории в то время не было.
Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита (ок. 460 – ок. 370 до н. э.), много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур (ок. 342–270 до н.э.) принял атомную теорию, и в первом веке до н.э. один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель (384–322 до н.э.), один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент.
В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе «неделимых частиц». Р.Бойль (1627–1691) и И.Ньютон (1643–1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах «атомов».
2. Положения Демокрита
Демокрит (460-370 гг. до н.э.). Демокрит происходил из богатого и знаменитого рода в Северной Греции. Все доставшиеся ему в наследство деньги он потратил на путешествия. За это его осудили: по греческим законам растрата отцовского имущества являлась серьезным преступлением. Но он был оправдан, так как ему удалось доказать, что в своих путешествиях он приобрел обширные знания. В конечном счете, горожане признали Демокрита мудрецом и выделили денежное содержание, которое позволило ему продолжать научные занятия. Основные элементы его картины природы таковы:
— Все тела состоят из атомов, которые неделимы и имеют неизменную форму. атом неделимый частица химия
— Число атомов бесконечно, число различных типов атомов тоже бесконечно.
— Атомы обладают различными выступами, углублениями и крючками, позволяющими им сцепляться друг с другом и тем самым образовывать устойчивые соединения.
— Атомы находятся в постоянном движении.
Демокрит полагал, что свойства того или иного вещества определяются формой, массой и пр. характеристиками образующих его атомов. Так. скажем, у огня атомы остры, поэтому огонь способен обжигать, у твердых тел они шероховаты, поэтому накрепко сцепляются друг с дружкой, у воды – гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
3. Слово об атоме в поэме Тита Лукреция Кара
Античный автор Тит Лукреций Кар писал в своей поэме «О природе вещей»:
-Вот посмотри: всякий раз, когда солнечный свет проникает
-В наши жилища и мрак прорезает своими лучами,
-Множество маленьких тел в пустоте, ты увидишь, мелькая
— Мечутся взад и вперед в лучистом сиянии света;
-Будто бы в вечной борьбе они бьются в сраженьях и битвах,
-В схватках бросаются вдруг по отрядам, не зная покоя.
-Может из этого ты уяснишь себе, как неустанно
-Первоначала вещей в пустоте необъятной метутся.
4. Гипотезы Древней Греции
Древние греки считали, что все сущее состоит из атомов. В сущности, слово «атом» происходит от греческого слова, означающего «неделимый», поскольку греки думали, что, если делить некую вещь до тех пор, пока станет невозможным это делать, в результате последним останется атом. Сейчас, даже несмотря на то, что греки знали об этом, мы не можем доподлинно сказать, что именно они открыли атом. Прежде всего их вера в атом была ненаучной: она не исходила ни из какой-либо научной информации и не подтверждалась ею. Это была просто «философская» идея о бытии и мире.
Атом, как мы знаем, был открыт на основе научных исследований и теорий. Приблизительно до начала XIX века идея, из чего состоит материя, или субстанция, рассматривалась только философами! Потом появился английский химик и математик Джон Дальтон, и в 1803 году он был первым, кто развил научную теорию атома.
Дальтон был старательным экспериментатором. Он взвешивал образцы многих газов и выявлял разницу в их массах. Он обнаружил, что газы так же, как и твердые и жидкие вещества, состоят из невероятно мелких частиц, которые он также назвал атомами. Он высчитал относительные массы для атомов известных ему элементов. Когда Дальтон установил, что атомы разных элементов имеют различные свойства и различные массы, он по-настоящему положил начало научному познанию атома.
Конечно, точного объяснения, что есть атом и какую роль он играет, еще не было. Другой англичанин, Эрнест Резерфорд, почти 100 лет спустя обосновал теорию атома, напоминающую описание Солнечной системы: тяжелое положительно заряженное ядро в центре, окруженное отрицательно заряженными электронами.
5. Теория о мельчайших частицах в России
В России теорию о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов. Различая два вида частиц материи, он дает им названия «элементы» — атомы и «корпускулы» — молекулы.
«Элемент есть часть тела, не состоящая из каких-либо других частиц, а «корпускула» есть собрание элементов в одну большую массу»
Так прозвучала мысль о том, что молекула состоит из атомов.
Однако к концу 19-го века появляются неопровержимые факты, которые свидетельствуют о сложном строении атома. Наиболее серьезный удар по привычным представлениям об атомах нанесло открытие электрона – частицы, входящей в состав атома и последовавшая после этого первая попытка создания модели атома, которую разработал английский физик Джозеф Джон Томсон.
Заключение
Первая модель атома сыграла положительную роль: в дальнейшем была использована верная идея о слоях электронов в атоме, о потере электронов атомами. Однако скоро обнаружилось несоответствие модели реальной действительности. В частности, модель атома Томсона оказалась в противоречии с результатами опыта Резерфорда.
Сегодня ученые думают, что атом состоит из электронов, протонов, нейтронов, позитронов, нейтрино, мезонов и гиперонов. Вообще они открыли более 20 различных частиц в составе атома. Но, что самое странное, до сих пор не существует полного описания атома, способного объяснить все о нем.
Литература
1. Григорьев В.И., Мякишев Г.Я. Силы в природе. Москва, «Наука», 1983 г.
2. Кудрявцев П.С. Курс истории физики. Москва, «Просвещение», 1982 г.
3. Яворский Б.М., Детлаф А.А. Справочник по физике. Москва, «Наука», 1990 г.
4. В.К. Васильев, А.Н. Шувалова. Строение вещества. Москва, «Наука», 1987.
5. А.Л. Дайнэко Физическая химия. Москва, «Наука», 1987
studfile.net
Строение атома
Строение атома
Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости и газы. Опыты выдающегося английского ученого М. Фарадея в 30-х гг. XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили название электронов.
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 г. французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газы, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой способностью обладает не только уран. Титанические усилия, связанные с переработкой огромных масс урановой смоляной руды, позволили П. Кюри и М. Склодовской-Кюри открыть два новых радиоактивных элемента: полоний и радий. Последовавшее за этим установление природы , - и -лучей, образующихся при радиоактивном распаде (Э. Резерфорд, 1899—1903 гг.), открытие ядер атомов диаметром 10-6 нм, занимающих незначительную долю объема атома (Э. Резерфорд, 1909— 1911гг.), определение заряда электрона (Р. Милликен, 1909—1914 гг.) и доказательство дискретности его энергии в атоме (Дж. Франк, Г. Герц, 1912 г.), открытие того факта, что заряд ядра равен номеру элемента (Г. Мозли, 1913 г.), и, наконец, открытие протона (Э. Резерфорд, 1920 г.) и нейтрона (Дж. Чедвик, 1932 г.) позволили предложить следующую модель строения атома:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна l/1823 а.е.м.).
3. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
4. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра (см. табл.1).
Таблица 1. Свойства элементарных частиц, образующих атом
Частица | Заряд | Масса | ||
Кл | условн.ед. | г | а.е.м. | |
Электрон | -1,6 • 10-19 | -1 | 9,1 • 10-28 | 0.00055 |
Протон | 1,6 • 10-19 | +1 | 1,67 • 10-24 | 1,00728 |
Нейтрон | 0 | 0 | 1,67 • 10-24 | 1,00866 |
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров:
А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = A – N, N = A – Z, A = Z + N
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Данная модель строения атома получила название планетарной модели Резерфорда. Она оказалась очень наглядной и полезной для объяснения многих экспериментальных данных. Но эта модель сразу же обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к нарушению равновесия между электроном и ядром. Электрон, постепенно теряя свою энергию, должен был бы двигаться вокруг ядра по спирали и в конце концов неизбежно упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было (все наблюдаемые явления говорят как раз об обратном), отсюда следовало, что модель Резерфорда в чем-то ошибочна.
Теория Бора. В 1913 г. датский физик Н. Бор предложил свою теорию строения атома. При этом Бор не отбрасывал полностью старые представления о строении атома:
как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца, однако в основу новой теории были положены два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам. Радиус орбиты г и скорость электрона u связаны квантовым соотношением Бора:
mur = n ħ,
где т — масса электрона, n — номер орбиты, ħ — постоянная Планка (h = 1,05 • 10-34 Дж • с).
2. При движении по этим орбитам электрон не излучает и не поглощает энергию.
Таким образом. Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния, например с энергией Е1. в другое — с энергией Е2, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия Е, величина которой определяется соотношением
Е = Е1 – Е2 = hv
где v — частота излучения, h = 2 ħ = 6,62 • 10-34 Дж • с.
Бор, используя это уравнение, рассчитал частоты линий спектра атома водорода, которые очень хорошо согласовывались с экспериментальными значениями. Такое же согласие теории и эксперимента было получено и для многих других атомов элементов, но было обнаружено также и то, что для сложных атомов теория Бора не давала удовлетворительных результатов. После Бора многие ученые пытались усовершенствовать его теорию, но все усовершенствования предлагались исходя из тех же законов классической физики.
Квантовая теория строения атома. В последующие годы некоторые положения теории Бора были переосмыслены, видоизменены, дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. На смену теории Бора пришла квантовая теория строения атома, которая учитывает волновые свойства электрона.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время движущийся поток электронов проявляет волновые свойства, например характеризуется способностью к дифракции. Длина волны электрона и его скорость u связаны соотношением де Бройля:
= h / mu
где т — масса электрона.
2. Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
х • т • u > ħ /2
где х — неопределенность положения координаты, u — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталъю.
Эти положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики. Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В. Гейзенберг, австриец Э. Шре-дингер и англичанин П. Дирак.
Квантовая механика имеет очень сложный математический аппарат, поэтому сейчас нам важны лишь те следствия квантово-механической теории, которые помогут нам разобраться в вопросах строения атома и молекулы, валентности элементов и т. п. С этой точки зрения наиболее важным следствием из квантовой механики является то, что вся совокупность сложных движений электрона в атоме описывается пятью квантовыми числами: главным п, побочным l, магнитным mi, спиновым s и проекцией спина тs. Что же представляют собой квантовые числа?
Квантовые числа электронов. Главное квантовое число п определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (п = 1,2, 3,…). Под главным квантовым числом, равным , подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n — 1 {l = 0, 1,…, п — 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l 0 1 2 3 4
Буквенное обозначение s p d f g
В этом случае говорят о s-, p-, d-, f-, g-состояниях электронов, или о s-, p-, d-, f-, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т. е. область пространства, в которой наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент p — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
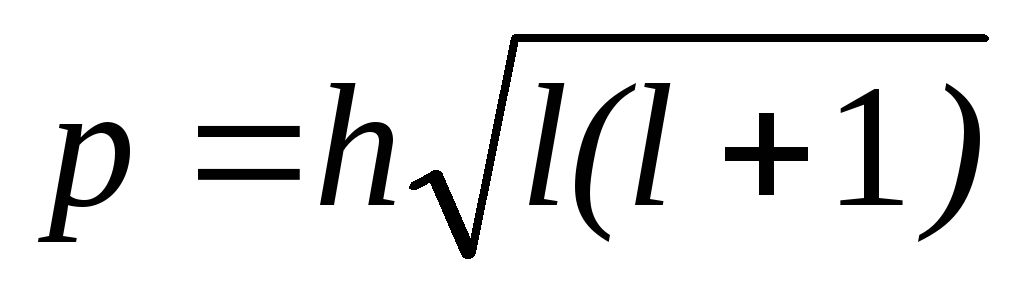
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-,p-,d-, f-, g- состояниях различна.
Рис.1.
Форма электронного облака
s-орбитали 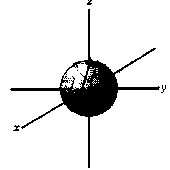
Еще раз подчеркнем, что форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет сферическую форму (шаровидную симметрию) и не обладает направленностью в пространстве (рис. 1).
При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из «восьмерки» (рис. 2). Формы электронных облаков d-, f-, g-электронов намного сложнее.
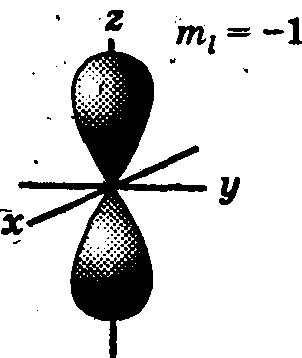


Рис. 2. Формы электронных облаков р-орбиталей
Движение электрического заряда (электрона) по замкнутой орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным тi. Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля магнитное квантовое число тi может принимать значения любых целых чисел, как положительных, так и отрицательных, от -l до +l, включая 0, т. е. всего (2l + 1) значений. Например, при l = 0 тi, = 0; при l = 1 mi = -1, 0, +1; при l = 3, например, магнитное квантовое число может иметь семь (2l + 1= 7) значений: -3, -2, -1, 0,+1, +2, +3.
Таким образом, mi характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, р-орбиталь («гантель») в магнитном поле может ориентироваться в пространстве в трех различных положениях, так как в случае l = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по координатным осям х. у я г, причем ось каждого из них перпендикулярна двум другим (рис. 2).
Для полного объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина (сначала в самом простом приближении — для наглядности — считалось, что это явление аналогично вращению Земли вокруг своей оси при движении ее по орбите вокруг Солнца). Спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. Строго говоря, спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось z (магнитное спиновое число ms,) может иметь лишь два значения: тs = + 1/2 или тs = — 1/2.
Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрода в атоме, и говорят о четырех квантовых числах.
studfile.net