Справочник по органической химии — Викиучебник
Глава I. Введение[править]
Органическая химия — химия углеводородов и их производных. Как наука органическая химия возникла в 19ом веке, но некоторые органические вещества известны человеку с древности: уксус, ткани, воск, мёд, различные красители и т.д.
В данном пособии органические вещества разобраны по классам. Для удобства и достаточной полноты изложения предлагается следующий план описания каждого класса веществ:
- Определение
- Общая эмпирическая формула
- Гомологический ряд
- Номенклатура
- Виды изомерии
- Электронное строение:
- Структурная формула
- Электронная формула
- Валентное состояние атомов углерода — тип гибридизации
- Виды связей в молекуле
- Пространственное строение молекулы
- Образование всех связей
- Расположение связей
- Длины связей, энергия связей, углы связей
- Конфигурация молекул
- Физические свойства
- Химические свойства
- Способы получения
- Применение
Изомеры — это вещества, имеющие одинаковый качественный и количественный состав, но разную структурную формулу, а значит и разные свойства.
Глава II. Углеводороды[править]
Углеводороды — простейшие органические соединения, состоящие только из атомов углерода и водорода. Углеводороды делят на предельные (насыщенные), непредельные (ненасыщенные), циклические и ароматические.
§1. Алканы (Предельные углеводороды)[править]
Строение[править]
Углеводороды, с общей молекулярной формулой CnH2n+2 атомы углерода которых связаны между собой простыми одиночными связями, а все остальные валентности насыщены атомами водорода, называются предельными, насыщенными, алканами или парафинами. Все связи в молекулах предельных углеводородов являются σ-связями. Простейшим предельным углеводородом (и органическим соединением вообще), является метан.

Номенклатура[править]
| Вещество, формула соединения | Название | ||
|---|---|---|---|
| Тривиальная номенклатура | Рациональная номенклатура | IUPAC номенклатура | |
| CH4 | Метан | Метан | Метан |
| C2H6 | Этан | Метилметан | Этан |
| C3H8 | Пропан | Этилметан | Пропан |
| C4H10 | Бутан | Метилэтилметан | Бутан |
| C5H12 | Пентан | Диэтилметан | Пентан |
| C6H14 | Гексан | Этилпропилметан | Гексан |
| C7H16 | Гептан | Метан | Гептан |
| C8H18 | Октан | Метан | Октан |
| C9H20 | Нонан | Метан | Нонан |
| C10H22 | Декан | Метан | Декан |
Физические свойства[править]
При комнатной температуре первые четыре вещества гомологического ряда алканов — газообразные вещества, от C5 до C15 — жидкости, а начиная с C16 — твердые вещества.
| Название | Формула | Температура, °C | |
|---|---|---|---|
| плавления | кипения | ||
| Метан | CH4 | -184,0 | -161,5 |
| Этан | C2H6 | -172,0 | -88,3 |
| Пропан | C3H8 | -189,9 | -42,1 |
| Бутан | C4H10 | -135,0 | -0,5 |
| Пентан | C5H12 | -131,6 | 36,2 |
| Гексан | C6H14 | -94,3 | 69,0 |
| Гептан | C7H16 | -90,5 | 98,5 |
Все алканы легче воды и в ней не растворяются
Химические свойства[править]
Алканы обладают сильной химической инертностью, так как все валентности в их молекулах насыщены. По этой же причине они не способны к реакциям присоединения. Типичными свойствами предельных углеводородов являются реакции замещения, а реакции окисления проходят только при высоких температурах.
Способы получения[править]
Алканы содержатся в природе в виде запаса нефти, угля и газа.
Общие реакции[править]
1) Горение Сh4-Ch4+2½O2→2CO2+3h3O
2)Термическое разложение Сh4-Ch4→t°C→C2+3h3
См. Алканы на Википедии
§2. Алкены[править]
Алкены-это углеводороды нециклического строения, в молекулах которых два атома углерода находится в состоянии sp2- гибридизации и связаны друг с другом двойной связью.
Длина связи C=C равна 0,133 нм, т.е. меньше, чем длина одинарной связи C-C. Общая формула алкенов Cnh3n (где «n» больше или равно 2).
Типы изомерии: а)изомерия цепи Ch3=Ch3-Ch3-Сh4-►Сh3=CH(Ch4)-Ch4 б)изомерия положения двойной связи Ch4-Ch3-CH=Ch3-Ch4-►Ch3=CH-Ch3-Ch3-Ch4 в)цис,транс-изомерия г)межклассовая изомерия
Химическое строение[править]
Реакции присоединения[править]
Реакции окисления[править]
Реакции полимеризации[править]
Аллильное замещение[править]
Алиллен — историческое название пропина.
См. алкены на Википедии
§3. Алкадиены[править]
Непредельные углеводороды,в молекуле которых содержится две Двойные связи. Окончание диен.
Общая формула Cnh3n-2
Общие формулы[править]
1) Горение Сh3=CH-CH=Ch3+8½O2→4CO2+3h3O
2)Термическое разложение Ch3=CH-CH=Ch3→t°C→4C+3h3
См. Диены на Википедии
§4. Алкины[править]
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой Cnh3n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Методы получения[править]
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)[править]
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
CaO+3C→CaC2+CO{\displaystyle {\mbox{CaO}}+3{\mbox{C}}\rightarrow {\mbox{CaC}}_{2}+{\mbox{CO}}}
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
CaC2+2h3O→C2h3+Ca(OH)2{\displaystyle {\mbox{CaC}}_{2}+2{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+{\mbox{Ca(OH)}}_{2}}
Пиролиз углеводородов (промышленный способ)[править]
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана[1]:
2Ch5→C2h3+3h3{\displaystyle 2{\mbox{CH}}_{4}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+3{\mbox{H}}_{2}}
Крекинг природного газа (промышленный способ)[править]
Электрокрекинг[править]
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением[2].
Термоокислительный крекинг[править]
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании[2]:
6Ch5+4O2→C2h3+8h3+3CO+CO2+3h3O{\displaystyle 6{\mbox{CH}}_{4}+4{\mbox{O}}_{2}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+8{\mbox{H}}_{2}+3{\mbox{CO}}+{\mbox{CO}}_{2}+3{\mbox{H}}_{2}{\mbox{O}}}
Метод прямого синтеза[править]
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
2C+h3→C2h3{\displaystyle 2{\mbox{C}}+{\mbox{H}}_{2}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}}
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот[править]
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия[3]:
NaOOCHC=CHCOONa+2h3O→C2h3+2CO2+2NaOH+h3{\displaystyle {\mbox{NaOOCHC}}\!\!=\!\!{\mbox{CHCOONa}}+2{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{C}}_{2}{\mbox{H}}_{2}+2{\mbox{CO}}_{2}+2{\mbox{NaOH}}+{\mbox{H}}_{2}}
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
См. алкины на Википедии
§5. Циклоалканы[править]
Строение: Имеют замкнутый круг от 3 до 6 углеводов.
Общая формула: Сnh3n т. к. общая формула сходно с формулой алкенов, то алкены и будут являться меж классовыми изомерами.
§6. Арены[править]
Глава III. Кислородосодержащие органические соединения[править]
§1. Спирты[править]
§2. Альдегиды и кетоны[править]
§3. Карбоновые кислоты[править]
§4. Сложные эфиры[править]
§5. Жиры[править]
§6. Углеводы[править]
Глава IV. Азотосодержащие органические соединения[править]
§1. Нитро соединения[править]
§2. Амины[править]
§3.Аминокислоты[править]
Глава V. Гетероциклические соединения[править]
- ↑ Ацетилен // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 428-431.
- ↑ а б Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990. — 750 с. — ISBN 5-06-001471-1
- ↑ Щелкунов А. В., Васильева Р. Л., Кричевский Л. А. Органическая химия: Учеб. для хим. вузов. — Алма-Ата: «Наука», 1976. — С. 31-32.
Брутто, структурные и электронные формулы соединений — ОБЩАЯ ХАРАКТЕРИСТИКА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ — ОРГАНИЧЕСКАЯ ХИМИЯ — ОБЩАЯ ХИМИЯ — Химия подготовка к ЗНО и ДПА
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ОРГАНИЧЕСКАЯ ХИМИЯ
ОБЩАЯ ХАРАКТЕРИСТИКА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙБрутто, структурные и электронные формулы соединений
Второй постулат Вутлерова. Химические реакционные способности определенных групп атомов существенно зависят от их химического окружения, то есть от того, с какими атомами или группами атомов соседствует определенная группа.
Формулы соединений, которыми мы пользовались при изучении неорганической химии, отражают только количество атомов того или иного элемента в молекуле. Такие формулы называют «брутто — формулами», или «молекулярными формулами».
Как вытекает из первого постулата Вутлерова, в органической химии важна не только количество тех или иных атомов в молекуле, а еще и порядок их связывания, то есть брутто-формулы не всегда целесообразно использовать для органических соединений. Например, для наглядности при рассмотрении структуры молекулы метана мы использовали структурные формулы — схематическое изображение порядка связывания атомов в молекулу. При изображении структурных формул химическая связь обозначают чертой, двойная связь — двумя черточками и т.д.
Электронная формула (или формула Льюиса) очень похожа на структурную формулу, но в этом случае изображают не образованные связи, а электроны, как те, что образуют связь, так и те, что его не образуют.
Например, уже рассмотренную сульфатную кислоту можно записать с помощью следующих формул. Брутто-формула — Н2804, структурная и электронная формулы имеют такой вид:
Структурные формулы органических соединений
Почти все органические вещества состоят из молекул, состав которых выражается химическими формулами, например СН4, С4Н10, С2Н4О2. А какое строение имеют молекулы органических веществ? Этот вопрос задавали себе в середине XIX века основатели органической химии — Ф. Кекуле и А. М. Вутлеров. Исследуя состав и свойства различных органических веществ, они пришли к следующих выводов:
— атомы в молекулах органических веществ соединены химическими связями в определенной последовательности, согласно их валентности. Эту последовательность принято называть химическим строением;
— атомы Углерода во всех органических соединениях чотиривалентні, а другие элементы проявляют характерные для них валентности.
Эти положение является основой теории строения органических соединений, сформулированной О. М. Бутлеровим в 1861 году.
Химическую строение органических соединений наглядно подают структурными формулами, в которых химические связи между атомами обозначают черточками. Общее число черточек, отходящих от символа каждого элемента, равна его валентности атома. Кратные связи изображают двумя или тремя черточками.
На примере насыщенного углеводорода пропана С3Н8 рассмотрим, как составить структурную формулу органического вещества.
1. Изображаем карбоновый скелет. В данном случае цепь состоит из трех атомов Углерода:
С-С-С
2. Карбон четырехвалентное, поэтому от каждого атома Карбона изображаем недостаточные черты таким образом, чтобы рядом с каждым атомом было по четыре черты:
3. Дописываем символы атомов Водорода:
Часто структурные формулы записывают в сокращенном виде, не изображая связи С — Н. Сокращенные структурные формулы гораздо компактнее, чем развернутые:
СН3 — СН2 — СН3.
Структурные формулы показывают только последовательность соединения атомов, но не отображают пространственного строения молекул, в частности валентные углы. Известно, например, что угол между связями С в пропане равен 109,5°. Однако структурная формула пропана выглядит так, будто этот угол равен 180°. Поэтому правильнее было бы записывать структурную формулу пропана в менее удобном, но в более истинном виде:
Профессиональные химики используют следующие структурные формулы, в которых вообще не показаны ни атомы Карбона, ни атомы Водорода, а изображен только карбоновый скелет в виде соединенных между собой С-С-связей, а также функциональные группы. Для того чтобы костяк не выглядел одной сплошной линией, химические связи изображают под углом друг к другу. Так, в молекуле пропана С3Н8 всего две связи С-С, поэтому пропан изображают двумя черточками.
Гомологические ряды органических соединений
Рассмотрим структурные формулы двух соединений одного класса, например спиртов:
Молекулы метилового СН3ОН и этилового С2Н5ОН спиртов имеют одинаковую функциональную группу ОН, общую для всего класса спиртов, но отличаются длиной карбонового скелета: в этаноле на один атом Углерода больше. Сравнивая структурные формулы, можно заметить, что при увеличении карбонового цепи на один атом Углерода состав вещества меняется на группу СН2, при удлинении карбонового цепи на два атома — на две группы СН2 т.д.
Соединения одного класса, имеющих подобное строение, но отличающиеся по составу на одну или несколько групп СН2, называют гомологами.
Группу СН2 называют гомологической разностью. Совокупность всех гомологов образует гомологический ряд. Метанол и этанол относятся к гомологическому ряду спиртов. Все вещества одного ряда имеют сходные химические свойства, а их состав можно выразить общей формулой. Например, общая формула гомологического ряда спиртов — СnН2n+1ВОН, где n — натуральное число.
|
Класс соединений |
Общая формула |
Общая формула с выделением функциональной группы |
|
Алканы |
СnН2n+2 |
|
|
Циклоалкани |
СnН2n |
|
|
Алкены |
СnН2n |
|
|
Алкадієни |
СnН2n-2 |
|
|
Алкіни |
СnН2n-2 |
|
|
Одноядерные арены (гомологический ряд бензену) |
СnН2n-6 |
|
|
Одноатомные спирты насинені |
СnН2n+2В |
СnН2n+1ВH |
|
Многоатомные спирты |
СnН2n+2Оx |
СnН2n+2-x(ВH)x |
|
Альдегиды |
СnН2nВ |
СnН2n+1CHO |
|
Одноосновны карбоновые кислоты |
СnН2nО2 |
СnН2n+1COOH |
|
Эстеры |
СnН2nВ |
СnН2n+1COOCnH2n+1 |
|
Углеводы |
Сn(Н2О)m |
|
|
Амины первичные |
СnН2n+3N |
СnН2n+1NH2 |
|
Аминокислоты |
СnН2n+1NO |
Н2NCnH2nCOOH |
Изомерия в органической химии | CHEMEGE.RU
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
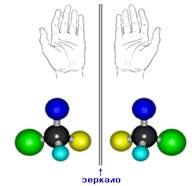
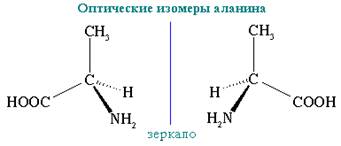
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Поделиться ссылкой:
Структурные формулы в органической химии
Состав большинства неорганических веществ однозначно характеризует их молекулярное строение Н2304 — это всегда серная кислота ЫазР04 — это всегда фосфат натрия КА1 (504)2 —это всегда алюмокалиевые квасцы и т. д. В органической химии широко распространено явление изомерии— существуют разные вещества, имеющие одинаковый состав молекул. Эмпирические, суммарные формулы становятся поэтому для органических соединений неоднозначными простая формула С2Н6О отвечает как этиловому спирту, так и диметиловому эфиру более сложные эмпирические формулы могут соответствовать десяткам, сотням и даже тысячам различных веществ. С созданием бутлеровской теории химического строения стало ясно, что изомеры отличаются друг от друга порядком химической связи атомов — химическим строением. Определение химического строения, установление структурной формулы стало (и остается до сих пор) главной задачей при исследовании органических веществ. [c.84]Структурные формулы — язык органической химии [c.220]
В истории развития органической и неорганической химии XIX столетия наблюдается любопытная параллель. В первые десятилетия число вновь открытых органических соединений, а также элементов увеличивалось ошеломляюще быстро. В третьей четверти столетия органические соединения были в определенной степени систематизированы благодаря введению структурных формул. До некоторой степени упорядочены были и элементы отчасти этому способствовали итоги Международного химического конгресса, который состоялся в начале сентября 1860 г. в г. Карлсруэ. [c.92]
Предмет органической химии. Теория химического строения А. М. Бутлерова. Развернутые и сокращенные структурные формулы. Изомерия. Ациклические и циклические соединения. Первичный, вторичный, третичный, и четвертичный атомы водорода. [c.194]
При установлении любой структурной формулы необходимо исходить из хорошо известного свойства элементов образовывать химическую связь с вполне определенным числом атомов других элементов. Это свойство обычно выражают тем, что приписывают данному элементу одну или несколько определенных валентностей. Так, например, водород, как известно, одновалентен, кислород в большинстве случаев двухвалентен (в оксониевых солях он может иметь, как мы увидим на стр. 151 другую валентность), азот — трех- и пятивалентен (или же координационно четырехвалентен) и т. п. В органической химии особо важную роль играет валентность углерода, который почти всегда бывает четырехвалентным, как видно, например, из существования простейших углеродных соединений СНь СС ь СОо, СЗг и т. п. Не четы-рехвалеитным углерод является лишь в очень немногих соединениях, обладаюиа,их специфическим строением, чрезвычайно ненасыщенным характером и часто неустойчивостью. С ними мы встретимся позднее в других главах этой книги. Исключением является окись углерода СО, известная уже из неорганической химии. [c.14]
Научные интересы преимущественно были сосредоточены в области теоретической органической химии и органического синтеза. Высказал (1857) мысль о валентности как о цело.м числе единиц сродства, которым обладает атом. Предложил (1865) циклическую структурную формулу бензола, распространив тем самым теорию хи.мического строения Бутлерова на ароматические соединения. Экспериментальные работы Кекуле тесно связаны с его теоретическими исследованиями. С целью проверки гипотезы о равноценности всех шести атомов водорода в бензоле получил его галоген-, нитро-, а.мино-и карбоксипроизводные. [c.346]
Из изложенного очевидна колоссальная важность для органической химии структурных формул. Действительно, только они отображают вполне определенные вещества, между тем как простая формула дает представление лишь о более или менее многочисленной группе веществ, сходных по составу, но отличающихся друг от друга по свойствам. Вместе с тем, указывая расположение в молекуле отдельных связей между атомами, структурная формула позволяет делать важные выводы о свойствах рассматриваемого соединения. Она представляет, следовательно, как бы стенографическую запись его химической характеристики, хорошо понятную опытному химику. [c.542]
Под определением строения химических соединений понимают установление структурной формулы, т. е. природы и последовательности связей между атомами в молекуле, а также конфигурации и конформации молекулы. Определение строения — одна из важнейших задач органической химии. Структурный анализ соединений обычно включает четыре этапа. [c.5]
Структурные формулы органических соединений, принятые в современной органической химии, дают четкое представление о последовательности расположения атомных ядер в молекуле. Так как валентные углы и ковалентные радиусы, характеризующие отдельные атомы, входящие в состав молекул, известны, можно без труда представить строение органической молекулы в отношении распределения в ней ядер атомов. Однако на основании структурных формул не всегда можно сделать вывод о распределении облаков валентных электронов и тг-электронов по связям. Так как электронная теория во многих случаях позволяет понять связь между некоторыми закономерностями в поведении органических соединений и электронным строением молекул, возникла необходимость иметь удобный простой и по возможности четкий метод изображения органических соединений, позволяющий отобразить в формулах не только взаимное расположение ядер, но приближенно и распределение облака валентных электронов. [c.156]
Существует аналогия между графами комбинаторной теории и структурными формулами органической химии. Структура графа, в котором отсутствуют петли, определена, когда нам известно, сколько ребер связывает каждую пару вершин. Излишне упрощая, говорят, что структура молекулы может быть описана, если указать, сколько валентных связей соединяет каждую пару атомов. Но аналогия имеется и здесь. [c.304]
Паул ИНГ, а вслед за ним и его последователи стали изображать валентные схемы с учетом а-связей. Эти схемы в ряде случаев оказались внешне сходными с обычными структурными формулами органической химии, после чего их незаконно стали отождествлять с обычными структурными формулами. [c.65]
В настоящее время наиболее распространены два способа изображения взаимного влияния атомов в молекуле в структурных формулах органической химии. Первый способ заключается в оснащении структурной формулы стрелками, показывающими паправление электронных смещений. Второй способ сост
Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Тема: Введение в органическую химию
Урок: Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C2H6O соответствуют два вещества с разными структурными формулами – этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт – жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,50С. При тех же условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -230С.
Эти вещества отличаются своим строением – разным веществам соответствует одинаковая молекулярная формула.
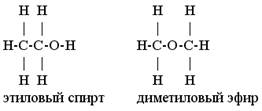
Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» – «равный» и «мерос» – «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир – структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой. Рис. 1.
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C5H12 соответствуют три разных углеводорода. Это изомерия углеродного скелета. Рис. 2.
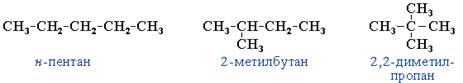
Рис. 2 Примеры веществ – структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения.


Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4
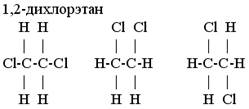
Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах – по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.


Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру – тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия. Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью – от греческого сhier – «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios – «противоположный» и meros – «часть»), а оптические изомеры – энантиомерами. Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d-, или (+)-изомер, – вправо, l-, или (–)-изомер, – влево. Смесь равных количеств энантиомеров, называемая рацематом, оптически недеятельна и обозначается символом d,l- или (±).
Подведение итога урока
В ходе урока вы получили общее представление о видах изомерии, что такое изомер. Узнали о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрели подвиды структурной изомерии (скелетную и изомерию положений), познакомились с разновидностями пространственной изомерии: геометрической и оптической.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Interneturok.ru (Источник).
2. Органическая химия (Источник).
3. Химик (Источник).
Домашнее задание
1. №№ 1,2 (с.39) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Почему число изомеров у углеводородов ряда этилена больше, чем предельных углеводородов?
3. Какие углеводороды имеют пространственные изомеры?