Гидроксиды — Википедия
Материал из Википедии — свободной энциклопедии
Гидрокси́ды (гидроо́киси, водокиси) — неорганические соединения, содержащие в составе гидроксильную группу −OH{\displaystyle {\ce {-OH}}}. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных и щёлочноземельных металлов, а также аммония являются растворимыми и называются щелочами.
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
- основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}}, гидроксид калия KOH{\displaystyle {{\ce {KOH}}}}, гидроксид натрия NaOH{\displaystyle {\ce {NaOH}}} и др.) При реакциях и диссоциации отщепляется группа −OH{\displaystyle {\ce {-OH}}}.
- кислотные гидроксиды
- амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(OH)3{\displaystyle {\ce {Al(OH)3}}}, гидроксид цинка Zn(OH)2{\displaystyle {\ce {Zn(OH)2}}}).
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам. Также иногда называют гидроксидом воду.
Основные гидроксиды[править | править код]
Оксиды щелочных и некоторых щëлочноземельных металлов взаимодействуют с водой, образуя щëлочи:
- Na2O+h3O⟶2NaOH{\displaystyle {\ce {Na2O + h3O -> 2NaOH}}},
- CaO+h3O⟶Ca(OH)2{\displaystyle {\ce {CaO + h3O -> Ca(OH)2}}}.
Нерастворимые основания при нагревании, как правило, разлагаются на оксид и воду, например:
- 2Fe(OH)3⟶Fe2O3+3h3O{\displaystyle {\ce {2Fe(OH)3 -> Fe2O3 + 3h3O}}},
- Cu(OH)2⟶CuO+h3O{\displaystyle {\ce {Cu(OH)2 -> CuO + h3O}}}.
ru.wikipedia.org
Кислотно-основные свойства гидроксидов
с кислотами
KOH+HCl=KCl+H2O
с кислотными оксидами
2KOH+CO2=K2CO3+ H2O не характерны
с амфотерными оксидами
2KOH+ZnO=K2
с солями, если образуется малорастворимая соль или малорастворимое основание
NaOH+CuCl2=Cu(OH)2=2NaCl не реагируют
Амфотерные гидроксиды (Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3
Взаимодействуют с кислотами и щелочами:
Zn(OH)2+2HCl=ZnCl2+2 H2O
Al(OH)3+NaOH=Na[Al(OH)4
Амфотерность — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Al2O3+CaO=CA(AlO2)2 и Al2O3+3P2O3=2Al(PO2)3
7. Два принципа квантовой механики (корпускулярно-волновой дуализм и принцип неопределенности). Уравнение Шредингера.
Основная идея квантовой механики в том, что можно говорить только о вероятности нахождения e в той или иной точке пространства
1принцип: корпускулярно-волновой дуализм. Поведение объекта микромира может быть описано с одной стороны как поведение частицы, а с другой (частица — корпускула) стороны как волновой процесс. λ=h/mv.
2принцип (неопределенности): 1927 Гейзенберг для микрочастицы принципиально невозможно определить в любой момент времени с абсолютной точностью его положения и импульс движения. По этому квант.механика не использует понятия координат и траекторий движения а говорят только о вероятности. Область пространства, в которой может находиться e, называется электронным облаком. e облако характеризует состояние движения e в различных областях пространства. Область пространства, в которой e ̄̄ находится с вероятностью max 95% — называется орбиталь. Орбитали, как и облака имеют различную форму. Вероятность нахождения e ̄̄ в определенной области описывается – ψ(пси) которая характеризует амплитуду, как функцию координат e.
Уравнение Шредингера (1926). f(ψ,ε(энергия))=0.
 .
.
ψ- не имеет физических значений. Борн показал, что |ψ|^2 определяет относ.вероятность нахождения e ̄̄ в той или иной точке пространства, но при этом значения энергии ограничены или квантованы конечными условиями налагаемыми на ψ функцию. Если эти значения будут иметь строго определенные и зависящие друг от друга величины, то энергии .Совокупность е с одинаковым набором главного и орбитального квантовых чисел называется подуровнем энергии.
8. Квантово-механическая модель строения атома водорода. Собственная функция уравнения Шредингера (орбиталь) и связанные с ней квантовые числа.
В простейшем из
атомов — атоме водорода – потенциальная
энергия электрона опр. его кулоновским
притяжением к ядру. Поскольку в атомных
единицах заряды электрона и ядра равны
-1 и +1 соответственно, то Еп = -1/r.(r-
расстояние от ядра до электрона) Если
подставить данное выражение для пот
энергии в уравнение Шредингера, то
можно найти, что распределение по
энергиям определяется 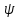 волновой функцией. зависящей от
параметров (r,
волновой функцией. зависящей от
параметров (r,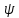 ,θ)
и (n,l,m),
последние значения называются квантовыми
числами,
также электрон характеризуется спиновым
квантовым числом.
,θ)
и (n,l,m),
последние значения называются квантовыми
числами,
также электрон характеризуется спиновым
квантовым числом.
Квантовые числа:
1)n-главное кв. число(1,2,3…) Определяет энергию e в атомах. Определяет размер e облака.(уровень энергии)
2)l- побочное, орбитальное кв. число (не превышает n-1) : (0,1,2…(n-1)). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).Количество значений l, при заданном значении n, показывает число подуровней на данном уровне. e ̄̄ с квантовым числом l называются p электроны. 3)m магнитное кв. число. m:-l…0…+l (шаг 1). Магнитное кв. число характеризует положение соответствующих орбиталей в пространстве.
4) S— спиновое квантовое число.S:+1/2;-1/2. spin-вращение. spin- собственный механический момент движения. + и – значения связаны с направлением, обозначается .
Из взаимодействий кв. чисел можно установить, последовательность разрешенных энергетических состояний электрона в атоме водорода, т.е. значения уровней и подуровней.
studfile.net
Амфотерные гидроксиды — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 февраля 2017; проверки требуют 10 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 февраля 2017; проверки требуют 10 правок.Амфоте́рные гидрокси́ды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
- 2Fe(OH)3 →150−200 ∘C Fe2O3 + 3h3O{\displaystyle {\mathsf {2Fe(OH)_{3}\ {\xrightarrow {150-200\ ^{\circ }C}}\ Fe2O3\ +\ 3H_{2}O}}}
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
- Al(OH)3 →200 ∘C AlO(OH) + h3O{\displaystyle {\mathsf {Al(OH)_{3}\ {\xrightarrow {200\ ^{\circ }C}}\ AlO(OH)\ +\ H_{2}O}}}
- 2AlO(OH) →>575 ∘C Al2O3 + h3O{\displaystyle {\mathsf {2AlO(OH)\ {\xrightarrow {>575\ ^{\circ }C}}\ Al_{2}O_{3}\ +\ H_{2}O}}}
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
- Zn(OH)2 + 2HCl ⟶ ZnCl2 + 2h3O{\displaystyle {\mathsf {Zn(OH)_{2}\ +\ 2HCl\ \longrightarrow \ ZnCl_{2}\ +\ 2H_{2}O}}}
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
- Zn(OH)2 + 2NaOH ⇄ Na2[Zn(OH)4]{\displaystyle {\mathsf {Zn(OH)_{2}\ +\ 2NaOH\ \rightleftarrows \ Na_{2}[Zn(OH)_{4}]}}}
Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
- ZnSO4 + 2NaOH ⟶ Zn(OH)2↓ + Na2SO4{\displaystyle {\mathsf {ZnSO_{4}\ +\ 2NaOH\ \longrightarrow \ Zn(OH)_{2}\downarrow \ +\ Na_{2}SO_{4}}}}
В избытке щёлочи начнётся растворение осадка гидроксида:
- Zn(OH)2+2NaOH→Na2[Zn(OH)4]{\displaystyle {\mathsf {Zn(OH)_{2}+2NaOH\rightarrow Na_{2}[Zn(OH)_{4}]}}}
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.). Химические свойства таких гидратов по большей части аналогичны свойствам соответствующих гидроксидов.
К амфотерным относятся следующие гидроксиды:
гидроксид хрома(III)Cr(OH)3{\displaystyle {\mathsf {Cr(OH)_{3}}}},
полигидрат оксида железа (III)
Fe(OH)3{\displaystyle {\mathsf {Fe(OH)_{3}}}},
гидроксид меди(II)
Cu(OH)2{\displaystyle {\mathsf {Cu(OH)_{2}}}},
гидроксид цинка
Zn(OH)2{\displaystyle {\mathsf {Zn(OH)_{2}}}},
гидроксид кадмия
Cd(OH)2{\displaystyle {\mathsf {Cd(OH)_{2}}}},
и др.;
гидроксид алюминия,
Al(OH)3{\displaystyle {\mathsf {Al(OH)_{3}}}},
гидроксид галлия,
Ga(OH)3{\displaystyle {\mathsf {Ga(OH)_{3}}}},
гидрат оксида олова(II),
Sn(OH)2{\displaystyle {\mathsf {Sn(OH)_{2}}}},
гидроксид свинца(II)
Pb(OH)2{\displaystyle {\mathsf {Pb(OH)_{2}}}},
и др.;
гидроксид бериллия
Be(OH)2{\displaystyle {\mathsf {Be(OH)_{2}}}};
- формально к амфотерным гидроксидам может быть отнесена вода.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
ru.wikipedia.org
Основные классы неорганических соединений. Типы оксидов и гидроксидов, их свойства (основные, кислотные, амфотерные) на примере реакций.
Теоретические вопросы на конференц–неделю.
Весна 2017г
Оксиды — соединения, содержащие только элемент и кислород в степени окисления -2. Оксидами не являются перекиси Na2O2, H2O2, BaO2 и фторид кислорода O+2F2.
Оксиды делятся на:
— Основные оксиды. Оксиды, которым соответствуют основные гидроксиды. Это оксиды металлов в степени окисления+1 и +2, кроме ZnO и BeO. Примерами основных оксидов могут служить оксид кальция СаО и оксид магния MgO. Оксид кальция взаимодействует с водой, образуя гидроксид кальция Са(ОН)2:
СаО + Н2О = Са(ОН)2.
Оксид магния малорастворим в воде; однако ему соответствует основание — гидроксид магния Mg(OH)2, который можно получить из оксида магния косвенным путем.
— Амфотерные оксиды. Оксиды, которым соответствует амфотерные гидроксиды. Это оксиды металлов в степенях окисления +3 и +4, а также ZnO и BeO. Например, амфотерными оксидами являются Fe2O3, Al2O3, TiO2, BeO, Cr2O3.
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H2SO4→ ZnSO4+ H2O
Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например:
ZnO + 2NaOH → Na2ZnO2 + H2O
— Несолеобразующие оксиды. Несолеобразующие оксиды не реагируют с кислотами и щелочами, иногда их называют безразличными оксидами. К несолеобразующим оксидам относится, например, оксид азота (I) N2О. Нет такой кислоты или основания, которые отвечали бы этому оксиду.
— Кислотные оксиды. Оксиды, которым соответствуют кислотные гидроксиды. Кислотными считаются все оксиды неметаллов, кроме несолеобразующих, и оксиды металлов со степенями окисления +5, +6, +7. Примерами кислотных оксидов могут служить триоксид серы SO3 и диоксид кремния SiO2. Первый из них взаимодействует с водой, образуя серную кислоту H2SO4:
SO3 + Н2О = H2SO4.
Диоксид кремния с водой не взаимодействует, но ему соответствует кремниевая кислота H2SiО3, которую можно получить из SiO2 косвенным путем.
Гидроксиды. В состав гидроксидов входят атомы водорода, кислорода и еще некоего элемента. В зависимости от характера гидроксидов, их изображают либо как R(OH)
n или как HxROy.Гидроксиды делятся на:
— Основные гидроксиды или основания. Это соединения вида Me(OH)n, проявляющие определенный набор свойств (основных свойств). Основаниями являются гидроксиды металлов в степенях окисления +1 и +2, кроме Zn(OH)2 и Be(OH)2. Например, основаниями являютсяMg(OH)2, KOH, Ba(OH)2, Cu(OH)2, LiOH. Оснóвные гидроксиды содержат гидроксогруппы ОН—, способные замещаться на кислотные остатки:
NaOH+Al2(SO4)3=Na2SO4+Al(OH)3
— Амфотерные гидроксиды. Гидроксиды, проявляющие свойства оснований и кислот. Амфотерными являются гидроксиды вида Me(OH)n, где степень окисления металла+3 или +2(в случае Be и Zn). Например, амфотерными гидроксидами являютсяAl(OH)
— Кислотные гидроксиды или кислородосодержащие кислоты. Имеют общий вид HxROy, где R – неметалл или металл в степени окисления +5, +6, +7. Примерами кислородосодержащих кислот могут бытьHNO3, H2SO4, HMnO4, H2CrO4, H2SiO3.
При записи формулы кислотного гидроксида атомы водорода ставят на первое место, учитывая его электролитическую диссоциацию в воде:
SO2(OH)2 → H2SO4
PO(OH)3 → H3PO4
NO2(OH) → HNO3
CO(OH)2 → H2CO3
Стоит заметить, что кислоты бывают и бескислородными, но они не являются гидроксидами. Бескислородные кислоты: HCl, HBr, HI, H
2S, HF.studfile.net
Кислотно-основные свойства гидроксидов (11 класс)
Урок по теме «Кислотно-основные свойства гидроксидов»
Цель урока.
Образовательная: используя проблемно-интегративный подход к обучению направить поисковую деятельность учащихся на установление закономерности в изменении свойств гидроксидов.
Развивающая: развивать познавательную активность, интеллектуальные способности и логическое мышление учащихся.
Воспитательная: формировать научное мировоззрение, творческое мышление, радость познания.
Оборудование: таблицы «Периодическая система химических элементов Д.И. Менделеева», « Растворимость кислот, оснований, солей в воде», «Относительная электроотрицательность элементов», компьютер, мультимедийный проектор.
Ход урока
I. Актуализация опорных знаний
— Какой процесс называют электролитической диссоциацией?
— На какие группы можно разделить вещества по способности проводить электрический ток в водном растворе или расплаве?
— Какие вещества называются электролитами?
— Неэлектролитами?
— Какие связи имеются в электролитах?
— В неэлектролитах?
— Какие бывают электролиты по способности распадаться на ионы?
— Как идет диссоциация сильных электролитов?
— Слабых электролитов?
_ какая величина характеризует степень распада слабых электролитов на ионы?
— как ее выражают?
— От каких условий зависит степень диссоциации?
— Какая величина характеризует способность электролита диссоциировать на ионы?
— О чем мы можем судить по константе диссоциации?
— способны ли к диссоциации молекулы воды?
— какая величина характеризует ее диссоциацию?
— Что она показывает?
— как оно изменяется с повышением температуры?
— Что позволяет определить ионное произведение воды?
— что называют водородным показателем?
А теперь выполним задание
Задание 1 Соотнесите:
[H⁺] [ОHˉ] pH Среда
I) 10ˉ¹² А)10ˉ¹¹ 1) 3 а) кислотная
II) 10ˉ³ Б)10ˉ⁹ 2) 7 б) нейтральная
III) 10ˉ⁵ В)10ˉ⁷ 3) 12 в) щелочная
IV) 10ˉ⁷ Г) 10ˉ² 4) 5
Решение
I
II
III
IV
Г
А
Б
В
3
1
4
2
в
а
а
б
Задание 2 Составьте уравнения диссоциации гидроксидов, формулы которых: NaOH, H₂SO₄.
Решение.
NaOH = Na⁺ + OHˉ
I) H₂SO₄ = H⁺ + HSO₄ ˉ
II) HSO₄ ˉ = H⁺ + SO₄ ²ˉ
— На какие ионы распадаются основания?
— На какие ионы распадаются кислоты?
— Следовательно, по каким направлениям протекает диссоциация гидроксидов?
Э – О – Н
(разрыв связи Э – О)
Э – О – Н
(разрыв связи О – Н)
Постановка проблемы
— Когда диссоциация идет по кислотному типу, когда – по основному?
-Что определяет характер ЭД?
(Цель и тему выводят дети)
Постановка цели: определить зависимость кислотно-основных свойств гидроксидов от положения элементов, образующих данные вещества, в Периодической системе химических элементов и типа химической связи.
II
Тема урока: Кислотно-основные свойства гидроксидов
— Вспомним основные закономерности изменения свойств атомов в периоде.
— Как происходить изменение заряда ядра?
— Как его увеличение влияет на радиусы атомов?
— Как изменяется относительная электроотрицательность?
— как изменяются высшие степени окисления центральных атомов в гидроксидах?
— Определим теперь, как изменяется полярность связи Э – О в гидроксидах в периоде слева направо.

Рассмотрим изменение полярности связей Э-О и О-Н в гидроксидах. Для этого определим разности электроотрицательностей и место диссоциации в молекуле.
Диссоциация будет происходить по месту более полярной связи.
— Как изменяется полярность связи Э-О в гидроксидах?
Вывод: полярность связи Э_О слева направо уменьшается, относительная полярность связи О-Н по сравнению со связью Э_О возрастает → возрастает способность гидроксидов к диссоциации по кислотному типу.
— Подумайте, почему я не предложила рассмотреть гидроксиды алюминия и кремний?
Задание 3 Приведенные формулы гидроксидов расположите в порядке увеличения кислотных свойств веществ:
H₂CO₃, H₃BO₃, HNO₃, LiOH, Be(OH)₂
Ответ:
LiOH Be(OH)₂ H₃BO₃ H₂CO₃ HNO₃
— Выясним, как полярность связей Э-О и О-Н зависит от взаимного влияния атомов в молекуле.

Посмотрите на структурную формулу серной кислоты. В молекуле 2 атома кислорода, связанные с атомом серы двойными связями, оттягивают на себя электроны связей. Это приводит к более сильному смещению электронов от атомов водорода в гидроксогруппах к атомам кислорода. В результате полярность связей О_Н в молекуле увеличивается.
— Что происходит в молекуле хлорной кислоты? (Три атома кислорода, связанные с атомом хлора двойными связями, оттягивают на себя электроны связей)
— К чему это приводит? (Еще большее смещение электронов от водорода к атому хлора)
В результате полярность связей О-Н в молекуле хлорной кислоты увеличивается в еще большей степени.
— Какая кислота сильнее, серная или хлорная?
Отметим еще одну закономерность изменения свойств гидроксидов.

Вывод: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, а кислотные усиливаются.
Задание 4 Расположите формулы в порядке увеличения силы кислот: HClO₃, HClO₂, HClO₄, HClO.
Ответ: HClO, HClO₂, HClO₃, HClO₄
Теперь рассмотрим закономерности изменения свойств гидроксидов элементов главных подгрупп.
— Как изменяются радиусы атомов сверху вниз?
— электроотрицательность?
— Степень окисления атомов в соединениях ЭОН?

-Как изменяется разность электроотрицательностей атомов кислорода и элемента
(Э-О)? (возрастает.)
В результате возрастает способность гидроксидов к диссоциации по основному типу.
III Закрепление
1. Полярность связи Э — О слева направо уменьшается, относительная полярность связи О-Н по сравнению со связью Э-О возрастает → возрастает способность гидроксидов к диссоциации по кислотному типу.
2. С увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, а кислотные усиливаются.
Итоги урока
Домашнее задание
infourok.ru