Состав и общие свойства оснований. Видеоурок. Химия 8 Класс
Тема: Обобщение пройденного материала
Урок: Состав и общие свойства оснований
Основания – это сложные вещества, в состав которых входят атомы металлов и гидроксильные группы – ОН. Валентность гидроксильной группы равна единице. Поэтому общую формулу оснований можно записать так: Ме(ОН)n, где n – число, равное валентности металла.
Названия оснований состоят из двух слов: первое слово в названии – «гидроксид», а второе – название металла. Если валентность металла переменная, то она указывается в скобках в конце названия. Например:
NaOH – гидроксид натрия
Cu(OH)2 – гидроксид меди(II)
У некоторых оснований есть исторически сложившиеся названия. Например, гидроксид натрия получил название едкий натр или каустическая сода, гидроксид калия – едкое кали, гидроксид кальция – гашеная известь (пушонка). Эти названия веществ часто встречаются в технической литературе.
По растворимости основания делят на растворимые в воде (или щелочи) и нерастворимые в воде основания. К щелочам относятся гидроксиды натрия, калия, лития, бария. Гидроксид кальция, несмотря на то, что является малорастворимым в воде, относится к щелочам. Это связано с его едкостью. К нерастворимым основаниям относятся, например, гидроксиды алюминия, меди, двух- и трехвалентного железа (Рис. 1).
Рис. 1. Классификация оснований
По своим физическим свойствам щелочи очень схожи: все они твердые, белые вещества. Правда, на воздухе гидроксиды натрия и калия поглощают пары воды и как бы расплываются. Это свойство называется гигроскопичностью. Нерастворимые в воде основания тоже твердые вещества, но могут иметь различную окраску.
Химические свойства щелочей и нерастворимых в воде оснований имеют и сходства, и различия. Начнем с общего для них свойства. Все основания взаимодействуют с кислотами. При этом образуются соль и вода. Данная реакция, как вы знаете, называется реакцией нейтрализации. Запишем уравнение реакции между гидроксидом бария и азотной кислотой. В результате данной реакции образуется нитрат бария и вода. Реакция нейтрализации относится к реакциям обмена.
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Щелочи и нерастворимые в воде основания по-разному взаимодействуют с индикаторами. Щелочи изменяют окраску индикатором, а нерастворимые оснований – нет.

Рис. 2. Индикаторы в растворе щелочи (слева направо): фенолфталеин, метилоранж и лакмус
Как индикаторы реагируют на щелочную среду? Приготовим пробирки с раствором щелочи – гидроксидом натрия. Для определения кислотности используют лакмус, метилоранж, фенолфталеин. В щелочной среде лакмус окрашивается в синий цвет, метилоранж – в желтый, фенолфталеин становится малиновым.
Для щелочей характерна реакция с кислотными оксидами. В результате такого взаимодействия образуются соль и вода. Например, при взаимодействии оксида серы(IV) с гидроксидом натрия образуется сульфит натрия и вода
SO2 + 2NaOH = Na2SO3 + H2O
Нерастворимым в воде основаниям свойственна реакция разложения при нагревании на оксид металла и воду.
Например, при нагревании голубой гидроксид меди(II) разлагается на два оксида: черный оксид меди (II) и воду.
Сu(OH)2 = СuO + H2O
Щелочи могут вступать в реакцию обмена с растворами солей, если в результате реакции образуется осадок. Например, при взаимодействии сульфата меди(II) с гидроксидом натрия образуется нерастворимый в воде гидроксид меди(II) и сульфат натрия. Данная реакция относится к типу обмена.
CuSO4 + 2NaOH = Cu(OH)2
↓ + Na2SO4
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.120-123)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.111-115)
3. Химия. 8 класс. Учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.:Астрель, 2013. (§36)
4. Химия: 8-й класс: учеб.для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§46)
5. Химия: неорг. химия: учеб.для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§31)
6. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. (Источник).
2. Химическая информационная сеть (Источник).
3. Химия и жизнь (Источник).
Домашнее задание
1. с. 129 №№ 4,6 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под.ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
2. с.201 №№ А1, А2 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
interneturok.ru
Химические свойства оснований – HIMI4KA

Основаниями называют класс химических соединений, которые состоят из катиона металла или иона аммония и одной или нескольких гидроксильных групп, способных к замещению на анионы. Классификация оснований и основные способы их получения описаны ранее в уроке 6.
Все основания легко реагируют с кислотами (реакция нейтрализации) и кислотными оксидами с образованием солей и воды:


Основания реагируют с кислыми солями с образованием солей и воды:


Щёлочи при сплавлении с амфотерными оксидами дают соль и воду:


Щёлочи могут вступать в реакции обмена с солями, если в результате этой реакции образуется осадок, например:


Нерастворимые в воде основания, а также гидроксид лития при нагревании разлагаются на оксид и воду:


Проиллюстрируем химические свойства амфотерных гидроксидов на примере реакций гидроксида цинка:


Тренировочные задания
1. Гидроксид лития вступает в реакцию с
1) гидроксидом аммония
2) гидроксидом натрия
3) гидроксидом алюминия
4) гидроксидом бария
2. Гидроксид лития реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) SO2, SO3
3. Верны ли следующие суждения о гидроксиде лития?
А. Это вещество нерастворимо в воде.
Б. Гидроксид лития не вступает в реакцию с хлоридом натрия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
4. Гидроксид натрия вступает в реакцию с
1) сульфатом калия
2) сульфитом калия
3) хлоридом лития
4) хлоридом магния
5. Гидроксид натрия реагирует со всеми веществами набора
1) P2O5, SO3
2) KCl, FeCl3
3) NO, HNO3
4) N2O, Al(OH)3
6. Верны ли следующие суждения о гидроксиде натрия?
А. Гидроксид натрия является более слабым основанием по сравнению с гидроксидом магния.
Б. Гидроксид натрия не вступает в реакцию с хлоридом цинка.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Гидроксид калия вступает в реакцию с
1) сульфатом натрия
2) хлоридом меди
3) хлоридом лития
4) оксидом азота (II)
8. Гидроксид калия реагирует со всеми веществами набора
1) SO2, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) Ca3(PO4)2, NO
9. Верны ли следующие суждения о гидроксиде калия?
А. Гидроксид калия является более сильным основанием по сравнению с гидроксидом магния.
Б. Гидроксид калия вступает в реакцию с хлоридом железа (II).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
10. Гидроксид цинка вступает в реакцию с
1) сульфатом калия
2) хлоридом натрия
3) оксидом железа (II)
4) гидроксидом бария
11. Гидроксид цинка реагирует со всеми веществами набора
1) NO, P2O5
2) CO, NO
3) N2O, FeO
4) HNO3, SO3
12. Верны ли следующие суждения о гидроксиде цинка?
А. Это вещество нерастворимо в воде.
Б. Гидроксид цинка не вступает в реакцию с сульфатом калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Гидроксид алюминия вступает в реакцию с
1) сульфатом натрия
2) хлороводородом
3) фосфатом калия
4) оксидом азота (I)
14. Гидроксид алюминия реагирует со всеми веществами набора
1) K2SO3, SiO2
2) P2O5, LiOH
3) NaCl, H3PO4
4) CaSO4, NO
15. Верны ли следующие суждения о гидроксиде алюминия?
А. Гидроксид алюминия является более сильным основанием по сравнению с гидроксидом натрия.
Б. Гидроксид вступает в реакции с основаниями и основными оксидами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + HI →
Б) NaOH + NaHSO4 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Na2SO4
3) NaI + H2O
4) NaAlO2 + H2O
5) Na2SO4 + H2O
17. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + NaOH (водн. р-р) →
Б) Zn(OH)2 + NaOH ⎯⎯сплавление→
В) Zn(OH)2 ⎯⎯t→
ПРОДУКТЫ РЕАКЦИИ
1) ZnO
2) ZnO + H2O
3) Na2ZnO2
4) Na2[Zn(OH)4]
5) Na2ZnO2 + H2O
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) LiOH + HNO3 →
Б) LiOH + S →
В) LiOH + Al(OH)3 →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) Li2S + Li2SO3 + H2O
4) LiNO3 + H2O
5) Li[Al(OH)4]
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Zn(OH)2 + H2SO4 →
Б) Zn(OH)2 + Na2CO2 ⎯⎯сплавление→
В) Zn(OH)2 + Na2O ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) ZnSO4 + H2O
2) ZnSO4 + H2↑
3) Na2[Zn(OH)4] + H2↑
4) Na2ZnO2 + H2O 5) Na2ZnO2 + CO2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaOH + ZnCl2 →
Б) NaOH + FeCl2 →
В) NaOH + Al2O3 ⎯⎯сплавление→
ПРОДУКТЫ РЕАКЦИИ
1) NaAlO2
2) Fe(OH)2 + NaCl
3) Na2[Zn(OH)4] + H2O
4) NaAlO2 + H2O
5) Na2[Zn(OH)4] + NaCl
21. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
22. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
23. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
24. Дана схема превращений:


Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Ответы




himi4ka.ru
Свойства оснований и кислот | Дистанционные уроки
24-Май-2013 | Нет комментариев | Лолита Окольнова
Задание А10 ЕГЭ по химии —
Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот

Темы, которые нужно знать:
И опять определять основные химические свойства оснований и кислот мы будем по таблице:

Химические свойства оснований:
1. Взаимодействие с неметаллами (идем по желтым стрелочкам):
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение — взаимодействие щелочей с хлором:

Эту реакцию мы уже рассматривали много раз, например, в контексте свойств простых веществв.
2. Взаимодействие с кислотными оксидами с образованием солей:
2NaOH + SO2 = Na2SO3 + H2O
3. Взаимодействие с кислотами — реакция нейтрализации:
- с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли — избыток щелочи; - с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли — избыток кислоты; - с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли — избыток основания.
4. С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества:
2NaOH + CuCl2 = Cu(OH)2 ↓+ 2NaCl
NaOH + NH4Cl = NaCl + NH4OH — малодисс.
Амфотерные гидроксиды:
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
Al(OH)3 + NaOH = Na[Al(OH)4]
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
Основные свойства кислот
1. Кислоты взаимодействуют с металлами с выделением водорода, если металл стоит в ряду напряжений до водорода H:
2Na + 2HCl =2 NaCl + H2
с металлами после водорода Н взаимодействуют только кислоты — окислители и уже без выделения водорода:
Cu +2 H2SO4 = CuSO4 + SO2 +2 H2
Кислоты — окислители могут взаимодействовать и с неметаллами:
S +2H2SO4 = 3SO2 +2 H2O
Какие кислоты являются окислителями? Те, в которых элемент кислотного остатка проявляет высшую (или близкую к высшей) степень окисления (соответствует номеру группы элемента):
| Кислота — окислитель | Степень окисления элемента |
| H2SO4 | степень окисления серы S= +6 |
| HNO3 | степень окисления азота N= +5 |
| HClO4 | степень окисления хлора Cl= +7 |
| HMnO4 | степень окисления марганца Mn= +7 |
| h3Cr2O7 | степень окисления хрома Cr= +6 |
2. С основными и амфотерными оксидами и основаниями кислоты дают соли:
Na2O + 2HCl = 2NaCl + H2O
2Al(OH)3 +3 H2SO4 = Al2(SO4)3 + H2O
3. C солями кислоты реагируют, если образуется осадок, газ или малодиссоциирующее вещество:
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3 + H2SO4= Na2SO4 + CO2 ↑+ H2O
Свойства оснований и кислот определяются самыми простыми реакциями обмена и замещения, дополнительно — различные окислительно-восстановительные с участием кислот — окислителей.
Кстати, в нашем вопросе с гидроксидом калия:
1) Осадок. газ или малодиссоциирующее вещество не образуется — не подходит;
2) С гидроксидом алюминия реакция пойдет, а вот с нитратом серебра — нет;
3) С гидроксидом цинка реакция пойдет, с оксидом — нет, т.к. он основной;
4) 2KOH + ZnCl2 = Zn(OH)2 ↓+ 2KCl — выпадает осадок
6KOH + P2O5 (кислотный оксид) = 2K3PO4 + 3H2O
Ответ: 4)
Еще на эту тему:
Обсуждение: «Свойства оснований и кислот»
(Правила комментирования)distant-lessons.ru
3.1.3 Физические свойства оснований.
Гидроксиды щелочных металлов – при обычных условиях представляют собой твердые белые кристаллические вещества, гигроскопичные, мылкие на ощупь, очень хорошо растворимы в воде (их растворение – экзотермический процесс), легкоплавки. Гидроксиды щелочноземельных металлов Са(ОН)2, Sr(OH)2, Ва(ОН)2) – белые порошкообразные вещества, гораздо менее растворимы в воде по сравнению с гидроксидами щелочных металлов. Нерастворимые в воде основания обычно образуются в виде гелеобразных осадков, разлагающихся при хранении. Например, Сu(ОН)2 – синий студенистый осадок.
3.1.4 Химические свойства оснований.
Свойства оснований обусловлены наличием ионов ОН–. В свойствах щелочей и нерастворимых в воде оснований имеются отличия, однако общим свойством является реакция взаимодействия с кислотами. Химические свойства оснований представлены в таблице 6.
Таблица 6 – Химические свойства оснований
Щелочи | Нерастворимые основания |
Все основания реагируют с кислотами (реакция нейтрализации) | |
2NaOH + H2SО4 = Na2SО4 + 2H2О | Сr(ОН)2+ 2НС1 = СrС12 + 2Н2O |
Основания реагируют с кислотными оксидами с образованием соли и воды: 6КОН + Р2O5 = 2К3РO4 + 3Н2O | |
Щелочи реагируют с растворами солей, если один из продуктов реакции выпадает в осадок (т. е. если образуется нерастворимое соединение): CuSO4 + 2KOH = Cu(OH)2+ K2SO4 Na2SO4 + Ba(OH)2 = 2NaOH + BaSO4 | Нерастворимые в воде основания и амфотерные гидроксиды разлагаются при нагревании на соответствующий оксид и воду: Мn(ОН)2 МnО + Н2O Сu(ОН)2 СuО + Н2O |
Щелочи можно обнаружить индикатором. В щелочной среде: лакмус – синий, фенолфталеин – малиновый, метиловый оранжевый – желтый | – |
3.1.5 Важнейшие основания.
NaOH – едкий натр, каустическая сода. Легкоплавкие (tпл= 320 °С) белые гигроскопичные кристаллы, хорошо растворимы в воде. Раствор мылкий на ощупь и является опасной едкой жидкостью. NaOH – один из важнейших продуктов химической промышленности. В больших количествах требуется для очистки нефтепродуктов, широко применяется в мыловаренной, бумажной, текстильной и других отраслях промышленности, а также для производства искусственного волокна.
КОН – едкое кали. Белые гигроскопичные кристаллы, хорошо растворимы в воде. Раствор мылкий на ощупь и является опасной едкой жидкостью. Свойства КОН аналогичны свойствам NaOH, но применяется гидроксид калия гораздо реже ввиду его более высокой стоимости.
Са(ОН)2 – гашеная известь. Белые кристаллы, мало растворимы в воде. Раствор называется «известковой водой», суспензия – «известковым молоком». Известковая вода применяется для распознавания углекислого газа, она мутнеет при пропускании СO2. Гашеная известь широко используется в строительном деле в качестве основы для изготовления вяжущих веществ.
studfile.net
1.2.4. Химические свойства оснований
Растворы щелочей — мыльные на ощупь и меняют окраску индикаторов:
а) фиолетовый лакмус — в синий цвет,
б) бесцветный раствор фенолфталеина — в малиновый цвет.
1. Большинство малорастворимых оснований при нагревании легко разлагаются на оксид и воду:
Сu(ОН)2  СuО
+ Н2О
СuО
+ Н2О
Sn(OH)2  SnO + Н2О
SnO + Н2О
Основания щелочных металлов термически устойчивы. Так, гидроксид натрия NaОН кипит при Т = 1400oC без разложения.
2. Основания взаимодействуют с кислотами (реакция нейтрализации), образуя соль и воду:
Например:
NaОН + НС1 = NaС1 + Н2О
Сu(ОН)2 + Н2SO4 = СuSO4 + 2H2O
Мg(ОН)2 + 2НNO3 = Мg(NO3)2 + 2Н2О.
3. Основания взаимодействуют с кислотными оксидами:
Са(ОН)2 + СO2 = СаСО3 ↓+ Н2О
Ва(OH)2 + SO3 = ВаSO4 ↓+ Н2О
6NaОН + Р2О5 = 2NaЗPO4 + 3H2O
4. Растворимые в воде основания (щелочи) взаимодействуют с амфотерными оксидами, образуя при сплавлении соответствующие соли:
Al2O3 + 2NaOH  NаА1O2 + Н2О
NаА1O2 + Н2О
ZnO + 2КОН  K2ZnO2 + H2O
K2ZnO2 + H2O
При взаимодействии амфотерных оксидов с растворами щелочей образуются гидроксокомплексы.
ZnO + 2КОН + H2O  K2[Zn(OH)4]
K2[Zn(OH)4]
5. Щелочи взаимодействуют с растворами солей, образуя новое основание и новую соль:
2NaОН + СuSО4 = Сu(ОH)2 ↓+ Na2SО4
ЗNH4ОН + АlСl3 = А1(ОН)3 ↓+ 3NH4Cl
2КОН + МnС12 = Мn(ОН)2 ↓+ 2КС1
1.2.5. Амфотерные гидроксиды
Амфотерными называются такие гидроксиды, которые в зависимости от условий проявляют свойства либо оснований, либо кислот.
К амфотерным гидроксидам относятся: Ве(ОН)2, Zn(ОН)2, Сг(ОН)3, Sn(ОН)2, А1(ОН)3, Рb(OH)2 и некоторые другие.
Амфотерные гидроксиды реагируют:
с кислотами,
А1(ОН)3 + ЗНС1 = А1С13 + ЗН2О
Zn(ОН)2 + Н2SО4 = ZnSO4 + 2Н2О
б) с кислотными оксидами,
2А1(ОН)3 +3SiO2  А12(SiO3)3 + ЗН2О
А12(SiO3)3 + ЗН2О
В этих реакциях амфотерные гидроксиды проявляют свойства оснований.
в) с основаниями,
при сплавлении твердых веществ образуются соли:
А1(ОН)3 + NaОН тв.  NaА1O2 + 2Н2О
NaА1O2 + 2Н2О
Zn(ОН)2 + 2КОН тв.  К2ZnO2 + 2H2O
К2ZnO2 + 2H2O
В этих реакциях амфотерные гидроксиды проявляют свойства кислот.
В реакциях с водными растворами щелочей образуются соответствующие комплексные соединения:
А1(ОН)3 + NaОН раствор = Na[А1(OH)4]
Zn(ОН)2 + 2КОН раствор = K2[Zn(OH)4]
г) с основными оксидами:
2Cr(OH)3 + K2O  2KCrO2+
3H2O
2KCrO2+
3H2O
В этой реакции амфотерный гидроксид проявляет кислотные свойства.
1.2.6. Способы получения оснований
1. Общим методом получения оснований является реакция обмена. При взаимодействии соли со щелочью образуется новое основание и новая соль:
CuSO4 + 2КОН = Cu(OH)2 ↓ + К2SО4.
K2CO3 + Ва(ОН)2 = 2КОН + ВаСО3.↓
Этим методом могут быть получены как нерастворимые, так и растворимые основания.
2. Щелочи можно получить взаимодействием щелочных и щелочноземельных металлов с водой:
2Nа +2Н2О = 2NаОН + Н2↑
Са +2Н2О = Са(ОН)2 + Н2↑
3. Щелочи могут быть получены также взаимодействием оксидов щелочных и щелочноземельных металлов с водой:
Nа2О + Н2О = 2NаОН
СаО+Н2О = Са(ОН)2
4. В технике щелочи получают электролизом растворов солей (например, хлоридов):
2NaС1
+ 2Н2О 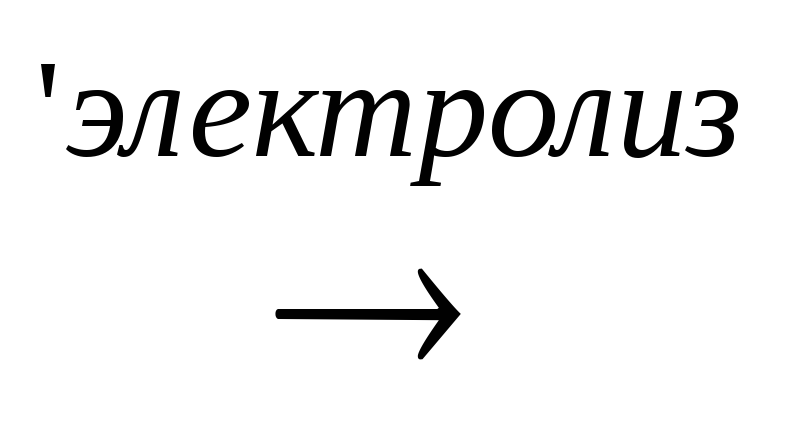 2NаОН
+ Н2↑ + С12↑
2NаОН
+ Н2↑ + С12↑
1.2.7. Области применения оснований.
Получаемые в промышленности в больших количествах гидроксиды натрия и калия (NаОН и КОН) находят разнообразное применение. Они используются для очистки нефтепродуктов, для производства мыла, искусственного шелка, бумаги, применяются в текстильной и кожевенной промышленности. Щелочи входят в состав растворов для химического обезжиривания поверхностей черных и некоторых цветных металлов перед нанесением защитных и декоративных покрытий.
Гидроксиды калия, кальция, бария применяются в нефтяной промышленности для приготовления ингибированных буровых растворов, позволяющих разбуривать неустойчивые горные породы. Закачка в пласт щелочей способствует повышению нефтеотдачи продуктивных прластов..
Гидроксиды железа (Ш), кальция и натрия используются в качестве реагентов для очистки газов от сероводорода.
Гашеная известь Са(ОН)2 применяется в качестве ингибитора коррозии металлов под действием морской воды, а также в качестве реагента для устранения жесткости воды и очистки мазута, идущего на приготовление смазочных масел.
Гидроксиды алюминия и железа (Ш) используются в качестве флокулянтов для очистки воды, а также для приготовления буровых растворов.
studfile.net