Алканы — Википедия
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan. |
 |
| Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (также насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы относятся к более крупному классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Рациональная[править | править код]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:
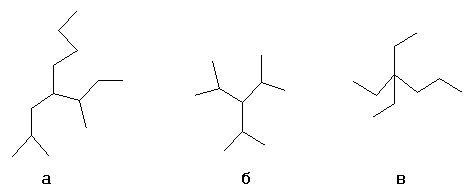
- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
- б: триизопропилметан
Систематическая ИЮПАК[править | править код]
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2]
Например:
 2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии[6]:
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было[7]. При n→1{\displaystyle n\rightarrow {\mathcal {1}}} число различных структурных изомеров алканов можно оценить посредством теоремы Редфилда — Пойи[8].
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C13H28 — жидкостями, а начиная с C14H30 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
- Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см³ | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при Tкип | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,638 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 378,3 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 399,7 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
ИК-спектроскопия[править | править код]
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия[править | править код]
Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для снятия УФ-спектров других соединений.
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения[править | править код]
Галогенирование[править | править код]
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
- Ch5+Cl2→Ch4Cl+HCl{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
- Ch4Cl+Cl2→Ch3Cl2+HCl{\displaystyle {\mathsf {CH_{3}Cl+Cl_{2}\rightarrow CH_{2}Cl_{2}+HCl}}}
- Ch3Cl2+Cl2→CHCl3+HCl{\displaystyle {\mathsf {CH_{2}Cl_{2}+Cl_{2}\rightarrow CHCl_{3}+HCl}}}
- CHCl3+Cl2→CCl4+HCl{\displaystyle {\mathsf {CHCl_{3}+Cl_{2}\rightarrow CCl_{4}+HCl}}}
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
- Cl:Cl→hνCl·+·Cl{\displaystyle {\ce {\mathsf {Cl{\text{:}}Cl->[{h\nu }]Cl{\text{·}}+{\text{·}}Cl}}}}
2) Рост цепи
- Ch4-Ch3-Ch4+Cl·→Ch4-CH˙-Ch4+HCl{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+HCl}}}
- Ch4-CH˙-Ch4+Cl:Cl→Ch4-CHCl-Ch4+Cl·{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{:}}Cl\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}+Cl{\text{·}}}}}
3) Обрыв цепи
- Ch4-CH˙-Ch4+Cl·→Ch4-CHCl-Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}{\dot {CH}}{\text{-}}CH_{3}+Cl{\text{·}}\rightarrow CH_{3}{\text{-}}CHCl{\text{-}}CH_{3}}}}
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование[править | править код]
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
- Ch4-Ch3-Ch3-Ch4→O2;SO2;hνCh4-Ch3-Ch3-Ch3-SO2OH{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{3}{\xrightarrow {O_{2};SO_{2};h\nu }}CH_{3}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}}SO_{2}OH}}}
Сульфохлорирование (реакция Рида)[править | править код]
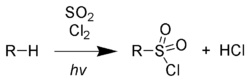 При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
- RH+Cl⋅→R⋅+HCl{\displaystyle {\mathsf {RH+Cl\cdot \rightarrow R\cdot +HCl}}}
- R⋅+SO2→RSO2⋅{\displaystyle {\mathsf {R\cdot +SO_{2}\rightarrow RSO_{2}\cdot }}}
- RSO2⋅+Cl2→RSO2Cl+Cl⋅{\displaystyle {\mathsf {RSO_{2}\cdot +Cl_{2}\rightarrow RSO_{2}Cl+Cl\cdot }}}
Легче всего сульфохлорируются углеводы линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование[править | править код]
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
- RH+HNO3→RNO2+h3O{\displaystyle {\mathsf {RH+HNO_{3}\rightarrow RNO_{2}+H_{2}O}}}
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления[править | править код]
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- RH+O2→R⋅+HOO⋅{\displaystyle {\mathsf {RH+O_{2}\rightarrow R\cdot +HOO\cdot }}}
- R⋅+O2→ROO⋅{\displaystyle {\mathsf {R\cdot +O_{2}\rightarrow ROO\cdot }}}
- ROO⋅+RH→ROOH+R⋅{\displaystyle {\mathsf {ROO\cdot +RH\rightarrow ROOH+R\cdot }}}
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
- Ch5+2O2→CO2+2h3O+ΔQ{\displaystyle {\mathsf {CH_{4}+2O_{2}\rightarrow CO_{2}+2H_{2}O+\Delta Q}}}
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
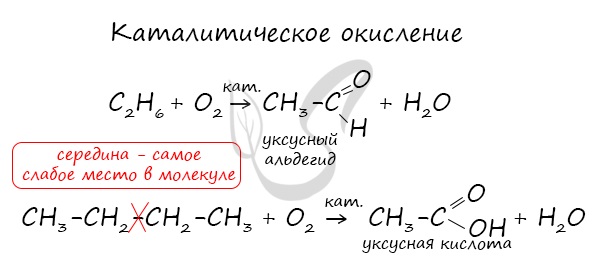
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
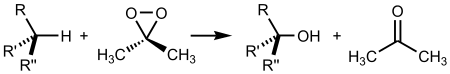
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
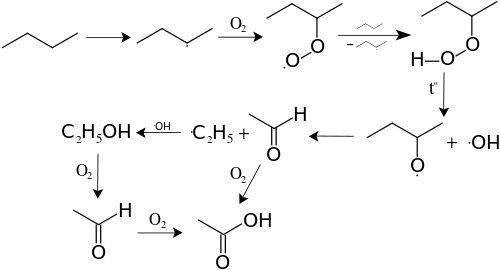
Термические превращения алканов[править | править код]
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Ch5→ot>1000oCC+2h3{\displaystyle {\mathsf {CH_{4}{\xrightarrow[{}]{^{o}t>1000^{o}C}}C+2H_{2}}}}
- C2H6→2C+3h3{\displaystyle {\mathsf {C_{2}H_{6}\rightarrow 2C+3H_{2}}}}
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
- 2Ch5→ot>1500oCC2h3+3h3{\displaystyle {\mathsf {2CH_{4}{\xrightarrow[{}]{^{o}t>1500^{o}C}}C_{2}H_{2}+3H_{2}}}}
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов.
- Ch4-Ch3:Ch4→1500∘CCh4-Ch3·+·Ch4{\displaystyle {\mathsf {CH_{3}{\text{-}}CH_{2}{\text{:}}CH_{3}{\xrightarrow {1500^{\circ }C}}CH_{3}{\text{-}}CH_{2}{\text{·}}+{\text{·}}CH_{3}}}}
1) Рекомбинация
ru.wikipedia.org
Алканы, подготовка к ЕГЭ по химии
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
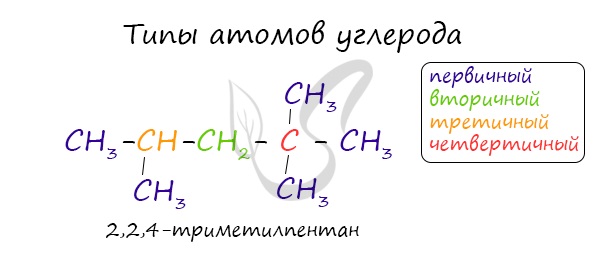
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2 — NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Урок химии на тему «Алканы. Гомологический ряд. Номенклатура алканов»
Тип урока: комбинированный
Цели урока:
- Изучить гомологический ряд и строение веществ ряда алканов.
- Научиться давать название веществам, принадлежащим к ряду алканов.
Оснащение урока:
- Компьютерная презентация (Приложение 1), компьютер, проектор.
- Раздаточный материал –
- листочки с таблицей «Классификация и характеристика углеводородов» (Приложение 2),
- листочки с таблицей «Гомологический ряд алканов» (Приложение 3),
- листочки «Алгоритм определения названия органического вещества» (Приложение 4) (на каждом листочке с обратной стороны прикреплен двусторонний скотч)
- Карточки с заданиями для парной работы (Приложение 5)
- на нахождение молекулярной формулы алканов
- определение названия алканов
ХОД УРОКА
I. Фронтальная беседа
Вопросы для повторения:
- Какой химический элемент является основой всех органических веществ?
- Что изучает органическая химия?
- Кто из ученых ввел понятие «органическая химия»?
- Дайте определение валентности.
- Какова валентность углерода во всех органических веществах?
- Назовите валентности водорода, галогенов, кислорода и азота в органических веществах
- Какое количество органических веществ известно? Чем можно объяснить такое многообразие?
- Какой ученый создал теорию строения органических веществ и тем самым помог их систематизации?
- Что показывают следующие записи формул веществ,
например:
- Какие вещества называются гомологами?
II. Проверка выполнения домашнего задания
К доске выходит учащийся и выполняет задание по написанию возможных изомеров веществ с молекулярной формулой С6H14.
(Во время выполнения учащимся задания на доске, остальные учащиеся обмениваются тетрадями и осуществляют взаимопроверку домашнего задания, выставляют оценки и расписываются.)
III. Объяснение нового материала
Учитель объявляет тему и цели нового урока: (слайды № 1,2)
3.1. Рассказ учителя:
На данный момент известно около 60 миллионов
органических веществ. Как
разобраться в таком количестве? Это удобно
делать, когда все вещества распределены на
определенные группы по сходным признакам.
Общепринятая классификация органических
соединений основана именно на теории строения
А.М. Бутлерова.
В любом органическом веществе есть атомы
углерода, которые соединяясь друг с другом,
образуют основу («скелет») и для правильной
структуры вещества и сохранения
четырехвалентности углерода, остальные связи
закрывают атомы водорода.
3.2. Объяснение понятия «Углеводороды»
Учитель задает вопрос: «Как называется группа
веществ, состоящих из улерода и водорода?»
Учащиеся делают вывод «Углеводороды».
Записывают понятие в тетрадь.
Возникает вопрос: какое отношение понятие
«углеводороды» имеет к теме урока?
3.3. Объяснение понятия «Алканы»
Учитель предлагает учащимся найти среди листочков, лежащих на столе, листок (Приложение 2) «Классификация и характеристика углеводородов». Исходя из этой таблицы, можно ответить на поставленный вопрос.
«Алканы» – это класс органических веществ, относящийся к группе углеводородов. Учитель предлагает на чистый лист своей тетради прикрепить при помощи двустороннего скотча Приложение 2. (По мере изучения различных классов углеводородов таблица будет заполняться. На данном уроке заполняется только один столбик, касающийся алканов.)
При объяснении понятия алканы, учитель
показывает структурные формулы этана, пропана,
бутана и просит учащихся подумать в чем
сходство строения всех этих веществ? (Слайд № 3)
Ученики делают вывод, о том, что, во всех этих
веществах встречаются только простые одинарные
связи. На основании этого вывода в тетрадь
записывается определение «Алканы» или
предельные углеводороды. Также заполняется в
таблице «Классификация и характеристика
углеводородов» пункт «отличительный
признак».
3.4. Изучение гомологического ряда алканов
Приложение 3 «Гомологический ряд алканов» вклеивается в тетрадь и заполняется совместно с учителем. (Слайд № 4).
Учитель обращает внимание учащихся, что
порядок расположения веществ зависит от
количества атомов углерода в молекуле и, чтобы
легче было запомнить каким по счету идет то или
иное вещество, можно загибать пальцы на руках
(один палец – один атом углерода). В таблице
заполняются пункты «название вещества» и
«молекулярная формула», а затем все вместе хором
повторяют название всех записанных веществ.
Учитель обращает внимание, что все вещества
заканчиваются на суффикс -ан, так же
как и название класса «алканы».
При заполнении таблицы учитель просит обратить
внимание учащихся на то, чем отличается
формула каждого последующего вещества от
предыдущего
Ученики делают вывод, что все вещества
отличаются друг от друга на группу атомов –СН2.
Учитель на основе вывода дает понятие гомологов и гомологического ряда. Ученики записывают в тетрадь понятие «гомологи» (Слайд № 5)
Учитель обращает внимание на то, что количество
углерода и водорода в формулах алканов можно
определить, зная порядковый номер вещества в
гомологическом ряду
(Учитель еще раз напоминает, что для лучшего
заполнения можно использовать пальцы рук) так
как есть общая формула алканов и записывается
она СnH2n+2 (слайд № 6), где маленькая
буква «n» – обозначает количество атомов
углерода в молекуле. Учитель на примере
показывает, каким образом сосчитать количество
атомов водорода, зная количество атомов углерода
в молекуле.
3.5. Выполнение парного задания на нахождение молекулярной формулы алканов по общей формуле. (Приложение 4)
3.6. Изучение номенклатуры алканов.
В таблице «Гомологический ряд алканов» (слайд № 4) заполняется пункт «структурная формула вещества». Первые четыре учитель заполняет сам, а следующие шесть заполняет ученик, приглашенный к доске.
Учитель делает вывод о том, что все вещества, имеющие прямолинейное строение именно так и будут называться, как записано в таблице.
Для определения названия органических веществ разветвленного строения существует международная номенклатуре IUPAK (International Union of Pure and Applied Chemistry) (или в русской транскрипции – ИЮПАК) (слайд № 7), такая номенклатура позволяет понимать ученым всего мира друг друга. Эта система понятна и лаконична, главное знать название первых представителей ряда алканов.
Учащиеся прикрепляют листочек «Алгоритм определения названия органических веществ» в тетрадь. (Слайд № 8)
Идет прочтение каждого пункта, после которого учитель показывает на примере как правильно, следуя алгоритму дать название веществу (на примере 2-метилбутана, 2,2-диметилбутана, 2-метил, 3-этилгексана).
При этом учитель обращает внимание на понятие «радикал» и направляет учеников к таблице № 2 «Гомологический ряд алканов», где остается незаполненным этот пункт. Ученики заполняют его, вписывая названия первых четырех радикалов
3.7.Работа в парах. Выполнение задания по карточкам. (Приложение 5)
IV. Повторение пройденного материала
Фронтальный опрос
Вопросы:
- Какие вещества называют углеводородами?
- Какие классы органических веществ относятся к углеводородам?
- Какие органические вещества называются алканами?
- Общая формула алканов?
- Как определить по этой формуле количество атомов водорода в молекуле алкана?
- Как дать название веществу нелинейного строения?
V. Подведение итогов урока. Выставление оценок за урок
VI. Выдача домашнего задания
Список литературы
- Габриелян О.С. Химия для профессий и специальностей технического профиля/ О.С. Габриелян, И.Г. Остроумов. – М.: ОИЦ «Академия», 2010
urok.1sept.ru
План-конспект урока химии (10 класс) на тему: Гомологический ряд и номенклатура алканов.
Тема: Гомологический ряд и номенклатура алканов.
Цель: Ознакомить учащихся с составом и номенклатурой углеводородов ряда
метана.
Тип урока: Урок изучения нового материала.
Дидактические и материальные оснащения: ноутбук, интерактивная доска, мультимедейный проектор, таблица «Гомологический ряд предельных углеводородов и их алкильных радикалов».
Содержание и ход урока.
I. Организационный момент.
II. Формирование новых знаний, умений и навыков.
Предельными называются углеводороды, в молекулах которых все атомы углерода соединены между собой одинарной связью и полностью насыщены атомами водорода.
Общее название предельных углеводородов по международной номенклатуре – алканы. Общая формула алканов: Cnh3n + 2.
Простейшим представителем предельных углеводородов является метан – СН4. К предельным углеводородам относятся также ряд углеводородов, смотрим таблицу №2. Рассматривая состав углеводородов, мы видим, что каждый последующий член этого ряда отличается от предыдущего на СН2 группу.
Вещества, сходные по строению и химическим свойствам, но отличающиеся друг от друга по составу молекул на одну или несколько СН2 групп, называют гомологами.
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. СН2 группу называют гомологической разностью. Смотрим таблицу №2.
Первые четыре представителя предельных углеводородов имеют исторически сложившиеся названия. Названия следующих предельных углеводородов образуют из греческих и латинских числительных с добавлением суффикса – ан.
При отрыве одного атома водорода от молекулы алкана получается углеводородный радикал, его название образуют от названия соответствующего углеводорода путем замены суффикса – ан на – ил:
СН4 — СН3 С2Н6 —- С2Н5 С3Н8 —— С3Н7
метан метил этан этил пропан пропил
Номенклатура алканов.
Для того чтобы назвать углеводород с разветвленной цепью атомов углерода, надо выделить главную и боковые цепи. Главная содержит большее число последовательно соединенных атомов углерода, она самая длинная. С ней могут быть связаны несколько боковых цепей – радикалов.
Алгоритм составления названия алкана с разветвленной цепью.
- Выбрать самую длинную цепь и пронумеровать атомы углерода в ней. Нумерацию начинают с того конца цепи, к которому ближе стоит радикал. Если радикалов несколько, то нумеруют так, чтобы атомы углерода, с которыми связаны радикалы, получили минимальные номера, т.е. сумма цифр в названии должна иметь наименьшее значение.
- Назвать радикалы в порядке увеличения количества углерода.
- Перед названием каждого радикала указать номера атомов углерода, с которыми связаны радикалы.
- Если один и тот же атом углерода связан с двумя одинаковыми радикалами, то цифру, указывающую на номер этого атома, нужно повторить дважды.
- Число одинаковых радикалов указать числовыми приставками ( ди- — два, три- — три, тетра- — четыре). Все цифры в названиях отделяют от слов дефисами, а друг от друга – запятыми.
- Назвать углеводород по числу атомов углерода в пронумерованной цепи.
Рассмотрим примеры:
Назовите по систематической номенклатуре следующие углеводороды:
- СН3 – СН – СН – СН2 – СН3
СН3 СН3
Выбираем самую длинную цепь и пронумеруем атомы углерода в ней. В данном случае нумерацию начинаем слева, потому что к этому концу ближе расположен радикал.
1 2 3 4 5
СН3 – СН – СН – СН2 – СН3
СН3 СН3
В молекуле имеются два радикала, у второго и третьего углеродного атома. Определяем название алкана по количеству атомов углерода в главной цепи. Следовательно, алкан имеет название: 2-метил, 3этил пентан.
1 2 3 4 5 6
- СН3 – СН – СН2 – СН – СН2 – СН3
СН3 С2Н5
2- метил, 4- этил гексан.
1 2 3 4 5
- СН3 – СН – СН- СН2 – СН – СН2 – СН3
6
С2Н5 СН3 СН2
7
СН2
8 9
СН2 – СН3
3-метил, 2,5 диметил нонан.
Если известно название алкана, то по названию можно написать структурную формулу алкана.
Например: Напишите структурные формулы следующих веществ:
3 – метил, 3- этилпентан, 2,3,4 – триметил – 2 –изопропилгексан.
СН3
СН3 –СН2 – С – СН2 – СН3
С2Н5
СН3 СН3 СН3
СН3 – С – СН- СН- СН2 – С Н3
СН – СН3
СН3
III. Применение знаний, умений и навыков.
- Назовите по международной номенклатуре следующие соединения:
а) СН3 СН2 – СН3
СН3 — С — СН — СН – СН3
СН3 СН
СН3 СН3
б) СН3 СН2 – СН3 СН2 – СН2 – СН3
СН3 – С — С — СН2 — С – СН2 – СН3
СН3 СН2 – СН3 СН
Н3С СН3
в) СН3
СН3 – СН СН3
СН3 – СН2 — С – СН2 – С – СН3
Н3С – СН2 СН2 – СН3
- Напишите структурные формулы следующих веществ:
а) 2,2,3 – триметил- 4,6- диэтил- 5 – пропилоктан;
б) 4-метил – 3- этилгептан;
в) 2,3,6 – триметилгептан.
IV. Д/З s 4, упр.1,4,5,6.
nsportal.ru
ГОМОЛОГИЧЕСКИЙ РЯД И ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
⇐ ПредыдущаяСтр 2 из 4Следующая ⇒
Алканы – это предельные углеводороды нециклического строения. Их называют также парафинами.
Общая формула алканов – CnH2n+2.
В гомологическом ряду алканов температуры плавления и кипения увеличиваются с ростом молекулярной массы веществ (табл. 1). Метан, этан, пропан и бутан – газы без цвета и запаха. Алканы с числом атомов углерода от 5 до 15 при обычных условиях бесцветные жидкости, начиная с углеводорода С16Н34 – твердые, белые, воскоподобные вещества.
Таблица 1
Формулы, названия и физические свойства некоторых нормальных алканов
| Название | Формула | Тпл, оС | Ткип, оС | Состояние при обычных условиях |
| Метан | СН4 | -184 | -162 |  газы
без запаха
газы
без запаха
|
| Этан | С2Н6 | -172 | -88 | |
| Пропан | С3Н8 | -190 | -42 | |
| Бутан | С4Н10 | -135 | -0,5 | |
| Пентан | С5Н12 | -132 |  жидкости с запахом нефти или
бензина
жидкости с запахом нефти или
бензина
| |
| Гексан | С6Н14 | -95 | ||
| Гептан | С7Н16 | -90 | ||
| Октан | С8Н18 | -57 | ||
| Нонан | С9Н20 | -54 | ||
| Декан | С10Н22 | -30 |
Алканы практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях, например, в бензоле. Плотность жидких алканов немного меньше, чем у воды.
СТРОЕНИЕ МОЛЕКУЛ АЛКАНОВ
Каждый атом углерода в молекулах алканов образует четыре простые σ-связис атомами водорода или другими атомами углерода. Электронные орбитали атомов углерода находятся в состоянии sp3—гибридизации.Гибридные орбитали, а, значит, и связи каждого атома углерода направлены к вершинам тетраэдра (рис. 1).
 |
 а
а
| б |
Рисунок 1. Модели молекул метана: а – полусферическая; б – шаростержневая (показано распределение электронной плотности).
Валентный угол в молекуле метана и его гомологов составляет 109,5◦. Поэтому углеродная цепь в молекулах алканов имеет зигзагообразную форму:

Вокруг σ-связей С-С возможно вращение, в результате которого молекулы могут принимать различные формы, называемые конформациями (рис. 2).




Рисунок 2. Модели молекулы гексана в разных конформациях.
Углеродный скелет молекул алканов может иметь как нормальное, так и разветвленное строение. В молекулах гомологов метана различают первичные, вторичные, третичные и четвертичные атомы углерода (см. приложение 1).
Связи С-С в молекулах алканов являются ковалентными неполярными, а связи С-Н – ковалентными полярными. Однако значения электроотрицательности атомов углерода и водорода близки и равны соответственно 2,5 и 2,1 по Полингу. Поэтому по свойствам связьС-Н близка к неполярной и проявляет склонность к гомолитическому разрыву с образованием свободных радикалов:
 .
.
Следовательно, для алканов характерны реакции, протекающие по радикальному механизму.
НОМЕНКЛАТУРА АЛКАНОВ
В соответствии с рекомендациями ИЮПАК при построении названий алканов соблюдают следующие правила.
1. Находят основную, то есть самую длинную углеродную цепь. Название основной цепи совпадает с названием алкана с тем же числом углеродных атомов (см. табл. 1). Суффикс –ануказывает на принадлежность углеводорода к классу алканов.
2. Нумеруют атомы углерода в основной цепи, начиная с того конца, к которому ближе располагается первый из имеющихся заместителей.
3. Формулируют название алкана. Для этого перечисляют заместители в алфавитном порядке, (например, сначала метил-, затем этил-), указывая перед каждым заместителем номер атома углерода основной цепи, к которому он прикреплен, и добавляют название основной цепи.
Если одинаковых заместителей два, три или четыре, то используют умножающие приставки ди-, три- и тетра- соответственно.
Пример. Назовем алкан, структурная формула которого изображена ниже.

Самая длинная углеродная цепь в формуле алкана выделена жирным шрифтом. Она содержит 8 атомов углерода. Алкан с таким же числом атомов углерода называется октан. Это слово и будет основой названия всего вещества.
В молекуле три заместителя – два радикала СН3— и один СН3-СН2-. Нумерацию атомов углерода ведем в данном случае справа налево, тогда атом углерода, к которому прикреплен ближайший к началу цепи заместитель СН3— получит номер 2.
Перечисляем заместители по алфавиту, указывая перед каждым из них цифрой номер атома углерода основной цепи, к которому он прикреплен, и добавляем название основной цепи ‑ слово октан.
Итак, название алкана 2,6-диметил-3-этилоктан.
ВИДЫ ИЗОМЕРИИ
Для алканов характерен только один вид структурной изомерии ‑ изомерия углеродного скелета.
Ниже приведены структурные формулы всех изомеров гексана С6Н14.
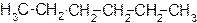
гексан
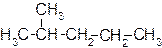
2-метилпентан

3-метилпентан

2,3-диметилбутан

2,2-диметилбутан
Для некоторых разветвленных алканов наряду с систематическими названиями используют и тривиальные:
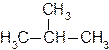

2-метилпропан 2,2-диметилпропан
изобутан неопентан
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Предельные углеводороды при обычных условиях химически инертны, поскольку для начала реакции с их участием нужно разорвать весьма прочные связи С‑С или С‑Н.
Поэтому алканы не реагируют при обычных условиях с такими активными веществами, как серная и азотная кислоты, металлический натрий, перманганат калия.
Важно помнить, что с бромную воду и раствор перманганата калия алканы не обесцвечивают.
Реакции присоединения для алканов невозможны, так как все их валентности насыщены. Для этих веществ характерны, в основном, реакции радикального замещения атомов водородана другие атомы или группы атомов, протекающие в довольно жестких условиях – при УФ-освещении или сильном нагревании.
При высоких температурах могут протекать реакции с разрывом связей С-С, а также дегидрирование и ароматизация.
Наконец, как и для большинство органических веществ, алканы могут вступать в реакции горения и каталитического окисления. Рассмотрим подробно примеры реакций с участием алканов.
Рекомендуемые страницы:
lektsia.com
Алканы. Общая характеристика: строение, изомерия, номенклатура.
⇐ ПредыдущаяСтр 2 из 11Следующая ⇒Алканы (парафины или предельные углеводороды)– наиболее простой по элементному составу класс органических соединений. Они состоят из углерода и водорода. Родоначальником этого класса является метан СН4. Все остальные углеводороды, относящиеся к алканам, являются членами гомологического ряда метана. Общая формула алканов СnН2n+2
Углерод имеет на внешней оболочке четыре валентных электрона, поэтому он может образовывать с атомами водорода четыре двухэлектронные ковалентные связи:
 или
или 
При переходе к высшим гомологам число изомеров резко возрастает (смотри выше).
Углеродный атом, связанный с одним соседним углеродным атомом, называется первичным, с двумя – вторичным, с тремя – третичным и с четырьмя – четвертичным:

Для названий алканов может использоваться несколько номенклатур: историческая, или тривиальная номенклатура –это сводка исторически устоявшихся названий часто употребимых органических соединений. – рациональная номенклатура.При составлении названия по этой номенклатуре соединение рассматривается как полученное из самого простого представителя ряда в результате замещения в нем водородных атомов на алкильные радикалы.
 – номенклатура IUPAC
– номенклатура IUPAC
Гомологический ряд, последовательность органических соединений с одинаковыми функциональными группами и однотипным строением, каждый член которой отличается от соседнего на постоянную структурную единицу (гомологическую разность), чаще всего метиленовую группу —СН2—. Члены гомологического ряда называют гомологами. В гомологических рядах многие физические свойства закономерно изменяются. Например, температуры кипения в середине ряда соединений с неразветвленной цепью (С5-С14) различаются у соседних гомологов на 20-30°С; гомологической разности —СН2—соответствует возрастание теплоты сгорания на 630-640 кДж/моль и молекулярной рефракции на 4,6 для D-линии натрия. У высших членов гомологического ряда эти различия постепенно сглаживаются.
Физические и химические свойства алканов. Методы получения и идентификации алканов. Отдельные представители.
Физические свойства алканов.
Первые четыре члена ряда – метан, этан, пропан и бутан – при комнатных условиях газы. Алканы С5–С15 – жидкие, а С16 и далее – твердые.
В обычных условиях
Химические свойства алканов
Углеводороды ряда метана при обыкновенной температуре химически весьма инертны. Они не присоединяют водород (отсюда – предельные), не реагируют без инициирования с Cl2 и Br2, не окисляются на холоду такими сильными окислителями, как перманганат калия и хромовая кислота В то же время эти связи сравнительно легко подвергаются гомолитическому разрыву с образованием радикалов. Поэтому для алканов в большей мере свойственны реакции радикального замещения.
– Галоидирование
На свету алканы могут последовательно замещать атомы водорода на атомы галоида, например:
При температуре » 500 °С метан под воздействием азотной кислоты и двуокиси азота нитруется:
– Сульфирование
Серная кислота (олеум) при нагревании медленно сульфирует алканы с третичным атомом углерода:
– Сульфохлорирование
Под действием ультрафиолетового освещения алканы вступают в реакцию замещения со смесью SO2 + Cl2:
– Окисление
У изоалканов сравнительно легко окисляется третичная группа СН. Промышленный интерес представляет каталитическое окисление смеси высших предельных углеводородов С8 – С18:
– Дегидрирование
При t = 300 °C…400 °С алканы, пропущенные над катализатором теряют два атома водорода и превращаются в алкены:
– Изомеризация
Под действием кислых катализаторов (например, AlCl3, H2SO4 и др.) алканы способны к перестройке углеродного скелета:
Способы получения алканов
– Гидрирование ненасыщенных углеводородов
– Из галоидных алкилов (реакция Вюрца, 1870 г.)
– Из карбоновых кислот
– Крекинг и пиролиз алканов нефти:
5. Алкены. Общая характеристика: строение, изомерия, номенклатура.
Гомологический ряд алкенов начинается с этилена. Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.

Изомерия. Номенклатура
Как и в ряду предельных углеводородов структурная изомерия алкенов начинается с четвертого члена ряда. Однако число изомеров значительно больше. Изомерия олефинов обусловлена строением углеродной цепи, во-вторых – положением двойной связи в цепи и в-третьих – пространственным расположением атомов или групп при углеродах с двойной связью
Называют алкены по различным номенклатурам. В тривиальной номенклатуре к названию соответствующего радикала предельного углеводорода добавляют суффикс –ен: этилен, пропилен, бутилен, изобутилен, амилен и т.д. По рациональной номенклатуре олефины называются как производные этилена. При составлении названия по номенклатуре ИЮПАК в качестве основной цепи соединения выбирается самая длинная углеродная цепочка, включающая двойную связь. За основу названия берется название алкана с заменой окончания -ан на
-ен. Цифрой обозначают номер атома углерода, за которым следует двойная связь. Нумеровать углеродные атомы основной цепи следует с того конца, к которому ближе двойная связь.
Например:
СН2=СН2 этилен; этен



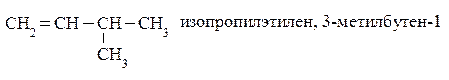

infopedia.su