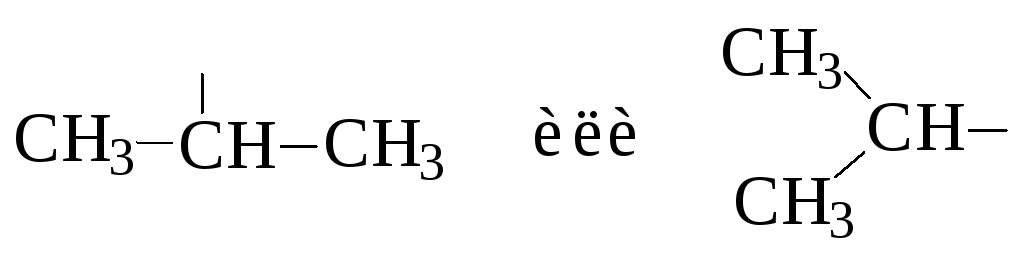Класс | Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Арены | Галоген-производные | ||
Общая формула | СnH2n+2 | СnH2n | СnH2n | СnH2n-2 | СnH2n-2 | СnH2n-6 | СnH2n+1Г (RГn) | ||
Особенность строения | C-C 0,154 | Цикл 0,154 | C=C 0,134 | С=C-C=С 0,140 | C≡C 0,120 | 0,140 | C-C 0,154 | ||
Тип связи | σ | σ | σ + π | σ+ π | σ+ π+ π | σ+6πсистема | σ | ||
тип характерных реакций | SRЗамещение | SRЗамещение, Присоединение с разрывом цикла | АЕ Присоединение | АЕ Присоединение | АЕ Присоединение | SЕЗамещение АR Присоединение | Замещение | ||
Вид гибридизации | sp3 109028’ | sp3 зависит от цикла | sp2 1200 | sp2 1200 | sp 1800 | sp2 1200 | sp3 109028’ | ||
Изомерия | УС, оптическая | УС, геометрическая, межклассовая с алкенами | УС, положения С=С, геометрическая, межклассовая с циклоалканами | УС, положения С=С, геометрическая, межклассовая с алкинами | УС, положения С≡С межклассовая с алкадиенами | Положения заместителей, изомерия боковой цепи | УС, оптическая, положения галогенов | ||
Номенклатура | …-ан | Цикло…ан | …-ен-… | …-диен-…,… | …-ин-… | …бензол | …-ан | ||
Физ. свойства | До С4 –газы, далее – жидкости, после С17 — твердые | ||||||||
Химические свойства: а) общие б) особые | Галогенирование Нитрование Изомеризация Крекинг | Галогенирование Нитрование Изомеризация Крекинг гидрирование | Галогенирование Гидрогалогенирование Гидрирование Гидратация Полимеризация Окисление Алкилирование | Галогенирование (кат. и на свету) Гидрирование Окисление | Сгорание Крекинг Изомеризация | ||||
Правило Марковникова! | Диеновый синтез | *Р.Кучерова *Тримеризация *c Ag2O | |||||||
или качественные | Обесцвечивание бромной воды и р-ра перманганата калия Образование ацетиленидов | Сине-зеленое пламя (медная спираль) | |||||||
Получение | Нефть, газ Р.Вюрца Гидрирование Из солей карбоновых кислот | Дегалогенирование Гидрирование бензола Денгидроциклизация | Крекинг Дегидрирование алканов Дегидратация спиртов Дегалогенирование Дегидрогалогенирование | Синтез Лебедева Дегидрирование | Дегалогенирование Дегидрогалогенирование Из карбида кальция | Тримеризация ацетилена Дегидрирование циклогексана Сплавление солей бензойной кислоты с NaOH Ароматизация нефти | Галогенирование алканов Гидрогалогенирование непредельных угл-дов, спиртов | ||
Применение | Топливо, органический синтез, получение сажи, мыла, лаков,эмалей | Получение жирных кислот | Полимеры, пластмассы, анестезия, растворители, антифризы | Каучук, резина, гутаперча | Органический синтез, сварка и резка металлов, растворители, взрывчатые в-ва | Лекарства, пластмассы, красители, ядохимикаты, взрывчатые в-ва | Растворители, анестезирующие в-ва, пластмассы | ||
multiurok.ru
| Б) по положению двойной (тройной) связи | CH2=CH-CH2-CH3 (бутен 1) CH3-CH=CH-CH3 (бутен2) | 1)CH2=C=CH-CH2-CH3 (пентадиен 1,2) 2)CH3=CH-CH=CH-CH3 (пентадиен 1,3) | 1)CH≡C-Ch3-CH3 (бутин 1) 2)CH3-C≡C-CH3 (бутин 2) | |||
| В) с углеводородом Другого класса | 1)с алкенами 2) CHCH2=CH-CH3 CH———CH (пропен) (циклопропан) | С циклоалканами (см циклоалканы) | С алкинами (см Алкины) | С диеновыми : 1) CH2=C=CH2 (пропадиен) 2) CH≡C-CH3 (пропин) | ||
| Г) по положению радикала | 1) CH2-CH-CH3 2)CH2-CH-CH3 CH2-CH-CH3 CH3-CH-CH2 (1,2диметилбутан) (1,3диметилбутан) | |||||
| 2.Пространственная | ||||||
| Д)Пространственная изомерия (цис-транс изомерия) | CH3 CH3 CH3 H C=C C=C H (цис) H H (транс) CH3 | CH3 CH=CH2 CH3 H C=C C=C H H H CH=Ch3 | ||||
| 3.Химические свойства . | ||||||
| А)Горение | CH4+O2→CO2+H2O+Q МЕТАН | CH2 CH2——CH2+O2→CO2+H2O+Q | С2H4+O2→CO2+H2O+Q ЭТЕН | Те же свойства что и у алкенов но реакции происходят в 2 этапа ! | 1.полное сгорание 2C2H2+5O2→4CO2+2H2O+Q 2 неполное сгорание С2H2+O2→C+H2O | 1.полное сгорание C6H6 +O2→CO2+H2O 2. Неполное сгорание C6H6+O2→C+H2O+Q |
| Б)Термическое разложение | C4H10→4C+5H2+Q БУТАН | С2H4→C+H2-Q ЭТЕН | 1. CH2=CH-CH=CH2+H2→ бутадиен CH2-CH=CH-CH2 Бутен2 HH 2. CH3-CH=CH=CH3+H2→ бутэн2 CH3-(CH2)2-CH3бутан | C2H2→C+H2 | C6H6→C+H2-Q | |
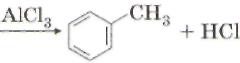
| В)р замещения | *Ch5+CL2→CH3CL+HCL хлорметан *CH3CL+CL2→CH2CL2+HCL дихлорметан *CH2CL2+CL=CHCL3+HCL Трихлорметан *CHCL3+CL2→CCL4+HCL тэтрахлорметан | C7h24+Br2→C7h23Br+HBr (бромциклогептан) | 1. C6H6+CL2→C6H5-CL хлорбензол 2.C6H6+HNO3→C6H5-NO3 нитробензол | |||
Г)Р присоединения (+H2, +HHAL ,+HAL2, +H2O) | Р изомеризации CH3-Ch3-CH2-CH3→ CH3-CH-CH3 CH3 (2 МЕТИЛПРОПАН) | CH CH2—CH2+H2→CH3-CH2-CH3 (пропан) СH2 CH2—CH2+Br2→CH2+CH2+CH2 (1,3ДИБРОМПРОПАН) Br Br | *CH2=CH2+H2→CH3+CH3ЭТАН *С2H4+HOH→CH3-CH2OHЭТАНОЛ *C2H4+HCL→CH3-CH2CLХЛОРЭТАН *C2H4+CL2→CH2CL-CH2CLДИХЛОРЭТАН | 2 ЭТАПА : ≡→=→- 1. CH≡CH+2H2→CH3-CH3 ЭТИН 2.СH≡CH+2CL2→ ЭТИН CHCL2-CHCL2 (1122ТЕТРАХЛОЭТАН) 3. C2H2+2HCL→CH2CL=CH2CL 1,2 ДИХЛОРЭТАН 4. C2H2+H2O→CH3-C=O H (Альдегид) | 1. Гидрирование C6H6+3H2→C6H12 (циклогексан) 2.C6H6+3CL2→C6H5CL | |
| Д) Полимеризация | *2С2H4+O2→2CH2-CH2 O ПОЛИЭТИЛЕН | n(CH2=CH-CH=CH2) → ДИВИНИЛ (-CH2-CH=CH-CH2-)n поливинил | 3C2H2→C6H6 (Бензол) |
mirznanii.com
Предельные и непредельные углеводороды в таблице
Соединения, содержащие только атомы углерода и водорода, классифицируются на предельные и непредельные углеводороды. Каждая группа включает несколько классов веществ, которые отличаются строением и свойствами.


Определения
Предельные углеводороды отличаются от непредельных одинарными связями. Атомы углерода в предельных углеводородах соединены простыми одинарными связями. При этом все дополнительные связи атомов углерода заняты водородами. Поэтому предельные углеводороды вступают в реакции присоединения и замещения только под действием катализаторов или высокой температуры.
Непредельные углеводороды содержат двойные или тройные связи и могут присоединять дополнительные атомы к местам разрыва кратных связей, превращаясь в предельные углеводороды.

Рис. 1. Схема классификации углеводородов.
Физические и химические свойства углеводородов меняются в зависимости от строения молекулы и количества углеродов в цепи.
К предельным или насыщенным углеводородам относятся алканы и циклоалканы. К непредельным или ненасыщенным углеводородам относятся алкены, алкины, алкадиены.
Сравнительная таблица
В сводной таблице предельных и непредельных углеводородов отображены основные характеристики классов.
Класс | Общая формула | Строение | Гомологи | Изомерия |
Алканы | Cnh3n+2 | Линейные молекулы, содержащие одинарные связи |
| Структурная по углеродному скелету. В некоторых случаях возможна оптическая |
Циклоалканы | Cnh3n | Циклические молекулы, содержащие одинарные связи |
| Структурная углеродного скелета, межклассовая, пространственная |
Алкены | Cnh3n | Включают одну двойную связь (СН2=СН2) |
| Структурная по углеродному скелету и положению двойной связи, межклассовая с циклоалканами, пространственная |
Алкадиены | Cnh3n-2 | Содержат две двойные связи (СН2=С=СН2) |
| Структурная углеродного скелета, положения двойных связей, межклассовая с алкинами, пространственная |
Алкины | Cnh3n-2 | Содержат одну тройную связь (CH≡CH) |
| Структурная по углеродному скелету, положению тройной связи, межклассовая |

Рис. 2. Строение предельных углеводородов.
Класс аренов (ароматических углеводородов) выделяется в отдельную группу. Арены содержат бензольное кольцо и отличаются химическими свойствами от насыщенных и ненасыщенных углеводородов.

Рис. 3. Примеры непредельных углеводородов.
Что мы узнали?
Предельные (насыщенные) и непредельные (ненасыщенные) углеводороды – две группы веществ, включающие отдельные классы, которые отличаются строением и свойствами. К предельным углеводородам относятся линейные алканы и циклические циклоалканы. К непредельным углеводородам относятся алкены с одной двойной связью, алкадиены с двумя двойными связями и алкины с одной тройной связью. Между классами возможна межклассовая изомерия: между алкенами и циклоалканами, между алкинами и алкадиенами.
ПредыдущаяХимияПолучение алкенов – способы и методы
Следующая ХимияПредельные углеводороды – молекулярная масса, способы получения, форма, группаsprint-olympic.ru
Углеводороды – HIMI4KA

Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Для алканов характерна изомерия углеродного скелета.
Способы получения алканов. Как правило, алканы получают из природного сырья, однако известно большое число синтетических методов их получения. Это реакции гидрирования алкенов и алкинов, декарбоксилирование натриевых или калиевых солей карбоновых кислот, восстановление йодалканов йодоводородом, реакция Вюрца:




Для алканов характерны реакции замещения, которые идут при нагревании или УФ-облучении. При этом происходит разрыв связи C—H с последующей заменой атома водорода на другой атом или группу атомов или же разрыв молекулы по связи C—С.
Большинство реакций алканов протекают по механизму радикального замещения SR. В этих реакциях реакционная способность атомов водорода убывает в ряду: третичные > вторичные > первичные.
Ниже приведены уравнения химических реакций, характерных для алканов.
1. Галогенирование:


Реакция идет на свету или при температуре 250— 400 °С.
Реакционная способность галогенов в этой реакции уменьшается в ряду F2 > Cl2 > Br2 > I2.


Реакции замещения в алканах протекают по радикальному механизму. При этом легче всего происходит замещение атома водорода, связанного с третичным углеродным атомом, затем — со вторичным и наконец — с первичным. Это объясняют значением энергии связей C–H, имеющих величину для первичной около 419 кДж/моль, вторичной — 393,6 кДж/моль и третичной — 372,6 кДж/ моль.
Наиболее широко известны реакции галогенирования алканов. Эти реакции идут на свету или при нагревании в присутствии инициаторов радикальных реакций. Рассмотрим механизм реакции на примере хлорирования метана.
На первой стадии этой реакции происходит распад молекулы хлора на два свободных радикала:
Cl:Cl → 2Cl• — зарождение, или инициирование цепи. Затем начинается рост цепи, связанный с взаимодействием свободного радикала с молекулой метана, что приводит к образованию новых радикалов:


Реакция заканчивается обрывом цепи, который наступает в результате взаимодействия между собой свободных радикалов:


Механизм реакции галогенирования был установлен академиком Н.Н. Семеновым.
2. Нитрование:


3. Термические превращения:


4. Окисление:


Каталитическое окисление бутана приводит к уксусной кислоте, а горение в кислороде — к углекислому газу и воде:


5. Дегидрирование:
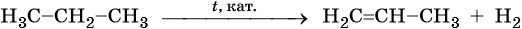
Реакции дегидрирования (отщепления водорода) протекают по разным направлениям:


Изомеризация:


Крекинг:


Реакции циклизации и ароматизации:


Последние две реакции идут при температурах 450–500 °С с использованием в качестве катализаторов оксидов хрома или алюминия.
Алициклическими называют углеводороды, которые содержат один или несколько циклов неароматического характера. По своим свойствам они схожи с соответствующими соединениями алифатического ряда. Термин «алициклические» означает «алифатические циклические» углеводороды. Несмотря на большое сходство между алифатическими и алициклическими соединениями, у последних имеются некоторые специфические свойства, обусловленные их циклической структурой. Общая формула гомологического ряда циклоалканов CnH2n.
Иногда циклоалканы называют нафтенами, т. к. производные циклопентана и циклогексана содержатся в некоторых сортах нефти.
Для гомологов и производных циклоалканов возможны следующие виды изомерии: изомерия, связанная с размером цикла, например, циклобутан является изомером метилциклопропана; изомерия положений заместителей в цикле; изомерия боковых цепей.
Циклопентан, циклогексан и их производные широко распространены в природе и составляют основную часть некоторых сортов нефти.
Низшие циклы синтезируют циклизацией дигалоидпроизводных, например:
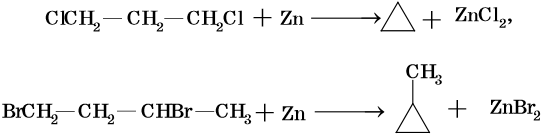
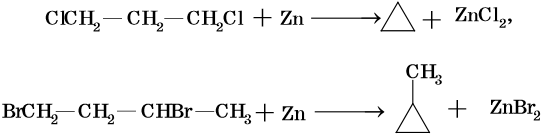
Циклобутан и циклопентан получают циклизацией 1,4-дибромбутана и 1,5-дибромпентана под действием амальгамы лития. Циклогексан и его производные получают из нефти или гидрированием бензола и его производных.


Химические свойства циклоалканов во многом определяются размерами цикла. Наибольшей химической стойкостью обладают пяти- и шестичленные циклы. Циклопропан склонен к многочисленным реакциям раскрытия цикла.
Гидрирование циклопропана и циклобутана идет над никелевым катализатором при температуре 80 и 120 °С соответственно. При этом образуются пропан и бутан.


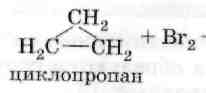
Циклопропановый цикл легко раскрывают при бромировании или гидробромировании, например:


В аналогичных условиях углеводороды от циклобутана до циклогексана вступают в реакции замещения:


Циклопропан используют в качестве анестезирующего средства. Циклогексан используют как растворитель. Окислением циклогексана получают циклогексанол C6H11OH, циклогексанон C6H10O и адиптиновую кислоту HOOC(CH2)4COOH. Циклогексанон является промежуточным продуктом при получении полиамидного волокна — капрона.
Алкенами, или олефинами, называют алифатические непредельные углеводороды, молекулы которых отвечают общей формуле CnH2n и имеют в своем составе одну двойную связь C=C. Родоначальником этого класса органических соединений является этилен CH2=CH2. Для алкенов характерна изомерия углеродного скелета, изомерия положения кратной связи, геометрическая изомерия, а также межклассовая изомерия с циклоалканами.
Способы получения алкенов. Этилен, пропилен и бутилены выделяют из газов нефтепереработки, образующихся при термическом крекинге. Алкены также образуются в большом количестве при пиролизе нефти.
Промышленным способом получения алкенов является дегидрирование алканов на катализаторе (K2O—Cr2O3—Al2O3), при температуре 560—620 °C из н-бутана образуются изомерные бутены. Еще легче этот процесс идет в случае изобутана:


Алкены получают дегидратацией спиртов при катализе серной или фосфорной кислотами, оксидом алюминия или хлоридом цинка:


При дегидратации спиртов атом водорода наиболее легко отщепляется от наименее гидрогенизированного атома углерода (правило Зайцева):


Алкены образуются при действии на галоидные алкилы спиртовой или измельченной твердой щелочи. Эта реакция дегидрогалогенирования также идет по правилу Зайцева:


Алкены можно получить обработкой цинковым или магниевым порошком вицинальных дигалоидалканов:


Алкены вступают в реакции соединения по двойной связи. Они протекают по механизму электрофильного присоединения, или AE. Присоединение галогеноводородов и воды к несимметричным алкенам идет по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному, т. е. связанному с наибольшим числом водородных атомов, атому углерода. По легкости присоединения к алкенам галогеноводороды можно расположить в ряд: HI > HBr > HCl > HF.
Ниже приведены реакции алкенов на примере этена и пропена:
Этен:
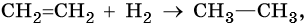
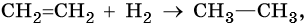
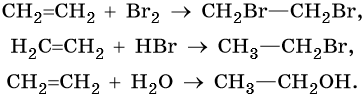

Реакция гидратации катализируется кислотами.


Пропен:




Реакция алкилирования протекает между алканами и алкенами в присутствии катализаторов:


Кроме реакций соединения для алкенов возможны отдельные реакции замещения, которые протекают по радикальному механизму, а также реакции разложения:
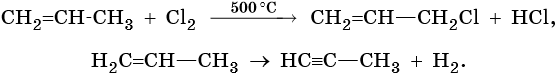

C позиции электронной теории правило Марковникова объясняют так: под действием метильного радикала в молекуле пропилена происходит перераспределение электронной плотности электронного облака π-связи в сторону крайнего ненасыщенного атома углерода, в результате чего на атомах углерода, связанных двойной связью, возникают частичные заряды:


При взаимодействии такой молекулы с галогенводородом присоединение положительно заряженного иона водорода идет по атому углерода с частичным отрицательным зарядом, а отрицательно заряженного галогенидиона — по атому углерода с частичным положительным зарядом.
Другое объяснение правила Марковникова следующее. В результате электрофильного присоединения возможно образование двух различных карбокатионов: из-за положительного индуктивного эффекта двух метильных групп карбокатион 1 более стабилен, чем карбокатион 2.


Таким образом, реакции электрофильного присоединения по двойной связи идут в направлении образования наиболее устойчивого промежуточного карбокатиона.
Существуют исключения из правила Марковникова. Это присоединение бромоводорода к алкенам в присутствии органических пероксидов или кислорода. В этом случае из пропена и бромоводорода образуется 1-бромпропан (перекисный эффект Хараша). Подчеркнем особо: перекисный эффект имеет место только в случае реакции алкенов с бромоводородом. При присоединении к алкенам HCl, H2O, HI пероксиды не влияют на направление реакции, и она идет по правилу Марковникова.
Диеновыми углеводородами называют класс химических соединений, молекулы которых отвечают общей формуле CnH2n–2 и содержат в своем составе две двойные углерод-углеродные связи. Для диенов характерна изомерия углеродного скелета, изомерия положения кратных связей, геометрическая изомерия, а также межклассовая изомерия с ацетиленовыми углеводородами.
Способы получения диенов. Дивинил и изопрен выделяют из продуктов пиролиза нефти. Основным промышленным способом получения бутадиена-1,3 является дегидрирование бутан-бутеновой смеси над катализатором, состоящим из окиси хрома, нанесенной на окись алюминия.
Метод получения дивинила по С.В. Лебедеву заключается в дегидрировании-дегидратации этилового спирта над катализатором MoO — ZnO при 450 °С.


Диены, у которых двойные связи разделены более чем одной одинарной связью, в химическом отношении ведут себя подобно алкенам.
Диены, у которых двойные связи разделены одной простой связью, называют конъюгированными или сопряженными диенами. Эти соединения обладают специфическими химическими свойствами и имеют важное практическое значение.
Своеобразные химические свойства диенов проявляются в реакциях присоединения, которые идут не только по одной или двум отдельным двойным связям (1,2-присоединение), но и по противоположным концам молекулы (1,4-присоединение). Выход продуктов 1,2- или 1,4-присоединения определяется характером реагента и условиями реакции.


При низких температурах преобладают продукты 1,2-присоединения, при повышенных — 1,4-присоединения.
Полное бромирование бутадиена-1,3 приведет к 1,2,3,4-тетрабромбутану:


Неполное гидрирование диенов приводит к смеси алкенов, а при полном образуются алканы:


Окисление сопряженных диенов, в зависимости от используемого окислителя и условий проведения реакции, может протекать с образованием различных кислородсодержащих соединений. При частичном окислении в нейтральной среде образуется щавелевая кислота, а действие перманганата калия в кислой среде при нагревании приведет к полному окислению диена до углекислого газа и воды.
Полимеризация диенов:


Ацетиленовыми углеводородами, или алкинами, называют класс органических соединений, которые соответствуют общей формуле CnH2n–2 и содержат в молекуле одну тройную связь. Родоначальником этого класса соединений является ацетилен, или этин, — HC≡CH. Для ацетиленовых углеводородов характерна изомерия углеродной цепи, изомерия положения кратной связи и межклассовая изомерия с диеновыми углеводородами.
Общим методом получения алкинов является реакция спиртовых растворов щелочи с дигалоидалканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомах углерода:


Производные ацетилена можно получить, действуя на его металлические производные галоидными алкилами:


Ацетилен получают действием воды на карбид кальция:


Кроме того, ацетилен получают термолизом метана и дегидрированием этилена:


Для алкинов характерны реакции соединения и некоторые реакции замещения, которые приведены ниже на примере ацетилена и пропина. Катализаторами для реакций гидрирования алкинов являются Pd или PbO. Следует отметить, что реакции галогенирования и гидрогалогенирования алкинов идут медленнее, чем с алкенами.
Ацетилен:


Реакция Кучерова:


Реакции винилирования:
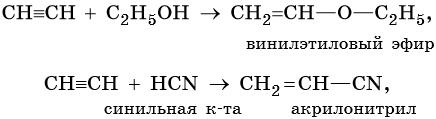
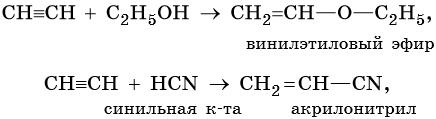
Реакции ди- и тримеризации:



Реакции замещения:
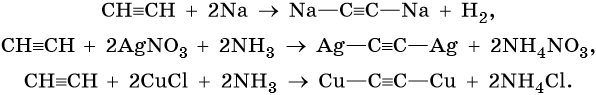
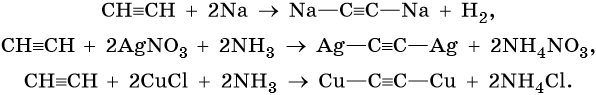
Реакции окисления:


Пропин:


Тримеризация:


Ароматическими углеводородами, или аренами, называют класс химических соединений, который отвечает общей формуле CnH2n–6 и имеет в своем составе устойчивую циклическую группировку (бензольное кольцо), обладающую особыми химическими свойствами.
Получение ароматических углеводородов. Основным природным источником ароматических углеводородов является нефть. Для получения гомологов бензола разработаны многочисленные синтетические методы.
Некоторые сорта нефти содержат достаточное количество ароматических углеводородов, которые выделяют простой перегонкой, пиролизом или каталитическим крекингом.
Синтетические методы — это ароматизация алканов, алкилирование бензола и т.д.
Так, например, бензол можно получить реакцией декарбоксилирования бензоата натрия или калия:


Для ароматических углеводородов наиболее характерны реакции замещения и некоторые реакции присоединения.
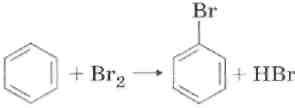
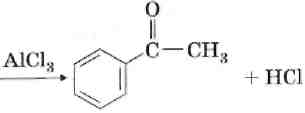
Как правило, все реакции замещения в ароматических соединениях протекают по электрофильному механизму SE. К таким реакциям относятся реакции алкилирования, галогенирования, нитрования, сульфирования, ацилирования и другие. Характерные химические свойства бензола:




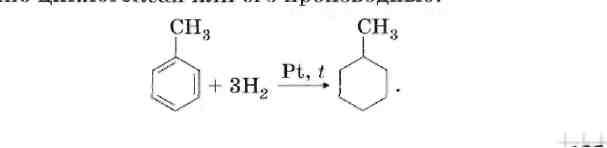
Гидрирование бензола до циклогексана идет при повышенной температуре, в присутствие катализатора (никель, платина), а хлорирование до гексахлорциклогексана — в газовой фазе под ультрафиолетовым излучением.




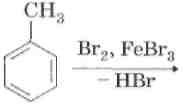
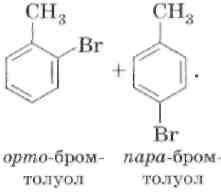
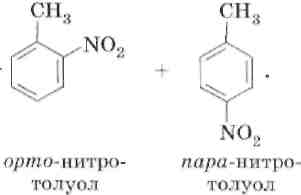
В молекуле толуола проявляется взаимное влияние метильного радикала на ароматическое ядро и ароматического ядра на метильный радикал. Толуол вступает в реакции замещения легче, чем бензол. При этом метильная группа ориентирует вхождение заместителей в орто— и пара-положения:


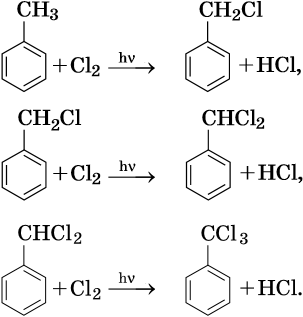
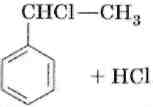
Галогенирование атомов водорода боковой цепи:

Окисление метильного радикала сильными окислителями, в зависимости от среды реакции, идет по разным направлениям:


В ходе реакций окисления алкилбензолов происходит окисление боковой цепи, а бензольное кольцо изменений не претерпевает:


Исключением являются третбутильные группы, связанные с бензольным кольцом — бензольное кольцо окисляется легче, чем эти группы.
При окислении жирноароматических соединений, содержащих ненасыщенные радикалы, соблюдаются общие закономерности, например:
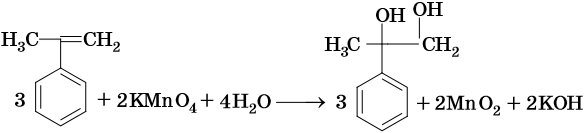
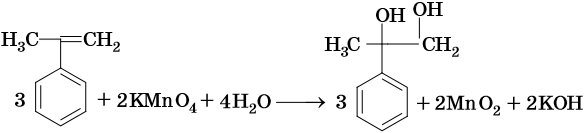
Этилбензол вступает в реакцию дегидрирования с образованием стирола:


Реакция протекает с высоким (92%) выходом при катализе оксидом цинка при температуре 600–650 °С.
Стирол легко вступает в реакции по двойной связи и в реакции полимеризации и сополимеризации:


Свойства бутадиен-стирольных каучуков зависят от их состава. На их основе изготавливают шины и другие резинотехнические изделия.
himi4ka.ru
Обобщающая таблица по химии «Сравнительная характеристика углеводородов предельного и непредельного строения» (9,10 класс)











 Таблица
Таблица
«Сравнительная характеристика углеводородов предельного и непредельного строения»
общая формула
CnH2n+2
CnH2n
CnH2n-2
CnH2n-6
Название
Алкан
Циклоалкан
Алкен
Алкадиен
Алкин
Арены
Название и пример соединения
Этан
СН3-СН3
циклоэтан
Этен (этилен)
СН2=СН2
Бутадиен-1,3
СН2=СН-СН=СН2
Этин
(ацетилен)
СH≡СН
Бензол
отличительный признак,
строение
ан
—
цикло, ан
○ , —
ен
=
диен
=, =
СН2=С=СН2 — с кумулированными связями
СН2=СН-СН=СН2 – с
СН2=СН- СН2 –с сопряженными связями
СН=СН2 — с изолированными связями
ин
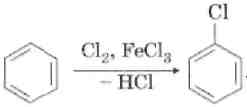
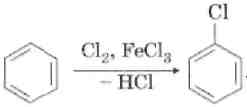
Циклическая система сопряженных, перекрывающихся π — связей
вид гибридизации
sp3 -гибридизация
sp3 -гибридизация
sp2 — гибридизация
sp2,sp — гибридизация
sp — гибридизация
sp2 — гибридизация
характеристика
химической связи
l=0,154 нм,
∠=109◦28‘
l=0,154 нм,
∠=(109◦28‘ – валентный угол цикла):2
l=0,134нм,
∠=120◦
Двойная связь l=0,137нм,
Одинарная связь l=0,146нм
l=0,120 нм
∠=180◦
l=0,139нм
∠=120◦
Получение
1. Синтез Вюрца
(с увеличением углеродного скелета)
Н3С-I+2Na+I-CH3 → СH3 — CH3 + NaI.
2. Сплавление солей карбоновых кислот со щелочами (метод Дюма).
Н3С-СООNa + NaOH → CH4 +Na2CO3
3. Восстановление производных алканов(галогеналкилов, спиртов, кетонов и др.)
С3Н-I + HI →CH4 + I2
C2H5OH+2HI→C2H6+
HOH + I2
4. Гидролиз магнийорганических соединений
R-MgCl +HOH→R-H + MgOHCl
5. электролиз расплавов солей карбоновых кислот (синтез Кольбе)
2CH3COONaэл.ток→CH3-CH3 + 2Na + 2CO2
1. Гидрирование бензола.
2. дегалогенирова-
ние дигалогенпроизводных.
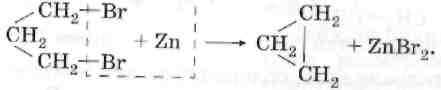
3. Пиролиз солей дикарбоновых кислот.
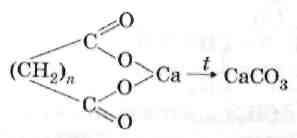
+
1. Дегидрирование алканов в присутствии алюмохромокалиевых катализаторов.
СН3-СН2–СН2-СН3-Н2→СН2 =СН –СН2-СН или СН3 -СН =СН-СН3
2. Дегидратация спиртов.
СН3СН2ОН→СН2=Н2
+Н2О
3. Дегидро
галогенирование
СН3-СН –СН2Сl
СН3
+KOH спирт. р-р → СН3-С=СН2+ KCl+H2O
СН3
4. Дегалогенированиедигалогенпроизводных
R-CHClCH2Cl
+Zn→RCH=CH2+ZnCl2
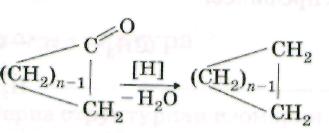
5. Гидрирование
Ni
С2Н2 + Н2 СН2=СН2
6.Дегидрогалогенирование моногалогенпроизводных
СН3-СНBr –СН3 → СН3-СН=СН2 + HBr
1. Получение из
бутана
СН3-СН2СН2СН3
→ СН2= СНСН=СН2
Бутадиен-1,3 (дивинил)
2. Из этанола (метод С.В. Лебедева)
2С2Н5ОН→СН2= СН-СН=СН2+2Н2О + Н2
3. Дегидрирование изопентана получают 2-метилбутадиен-1,3 (изопрен)
4. Дивинил и изопрен получают также дегидратацией гликолей:
бутандиол-1,3→дивинил
3-метилбутандиол-
1,3→изопрен
5. Дегидро
галогенирование.
СН2 Сl-СН2— СН2 –СН2Сl +KOH спирт. → СН2=СН- СH= СН2+ KCl+H2O
1. Гидролиз карбида кальция
СаС2+2Н2О → С2Н2+Са(ОН)
этин (ацетилен)
2. Из дигалоген
производных
СН3СН2СНCl2+2KOH(с. р.)→ СН3-С≡СН +2КСl +2H2O пропин
3. Из природного газа
2СН4→ С2Н2 + 3Н2
4. Алкилирование
металлических производных ацетилена
CH3— СН2-I + NaC≡C→ CH3— СН2-С≡СН + NaI
Бутин
5. Из тетрагалоген
алканов
СНCl2-CHCl2 +2Zn→ СH≡СН + 2ZnCl2
1. Дегидрирование циклогексана.
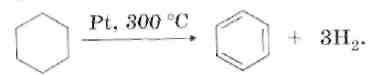
2. Ароматизация (дегидроциклизация) алканов.
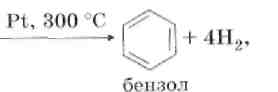
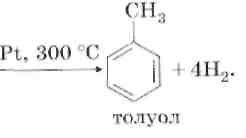
3. Тримеризация ацетилена.
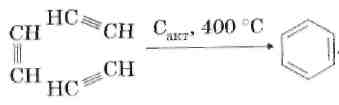
4. Синтез Вюрца.
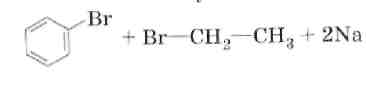
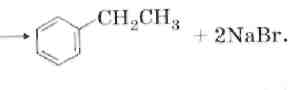
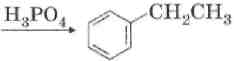
5. Алкилирование.
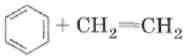
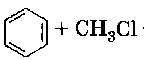
Физические свойства
Углеводороды состава от СН4 до С5Н12 –газы,
С5Н12 до С15Н32 – жидкости, более тяжелые углеводороды – твердые вещества.
Температуры кипения и плавления постепенно увеличивается с возрастанием углеродной цепи.
Плохо растворимы в воде.
Углеводороды состава от С3Н6 до С4Н8 –газы, С5Н10 до С16Н32 – жидкости, с С17Н34 и высшие алкены – твердые вещества.
Температуры кипения и плавления немного выше, чем у алканов при одинаковом числе атомов углерода.
Углеводороды состава от С2Н4 до С4Н8 –газы, С5Н10 до С16Н32 – жидкости, высшие алкены – твердые вещества.
Температуры кипения и плавления постепенно увеличивается с возрастанием молекулярной массы соединений.
Практически не растворимы в воде и хорошо растворимы в органических растворителях.
В обычных условиях пропадиен-1,2, бутадиен-1,3 – газы, 2-метилбутадиен-1,3 – летучая жидкость. Алкадиены с изолированными двойными связями пентадие-1,4 – жидкости. Высшие диены – твердые вещества.
Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук.
Температуры кипения и плавления постепенно увеличивается с возрастанием молекулярной массы соединений. Алкины имеют специфический запах. Лучше растворимы в воде чем алканы и алкены.
Бензол представляет прозрачную бесцветную легколетучую жидкость с характерным запахом. Температура плавления 5,5С, кипения -80С. Не смешивается с водой, но хорошо смешивается с органическими растворителями. Является растворителем для неполярных орг. веществ. Горит коптящим пламенем. Ядовит.
Химические свойства
1. Реакции замещения.
1.Галогенирование
СН4 +Cl2 → CH3Cl + HCl
2. Нитрование.
СН3-СН2-СН2-СН3 + НNO3→СН3-СНNO2-СН2-СН3 + H2O
3. Сульфирование.
R-H + H2SO4 →R-SO3H
4.Сульфохлорирование.
R-H + SO2 + Cl2 →R-SO2Cl+HCl
2. Отщепление:
1. Дегидрирование (с разрывом С-Н связи)
С3Н8 →С3Н6 + Н2
3. Окисление:
СН4+2О2 → С02 + 2Н20 + 880кДЖ
Окисление алканов.
Алканы
Гидропероксид
Спирт кетон
Карбоновые кислоты
4. Разрушение цепи:
1. Крекинг (с разрывом С-С сязи)
С10Н22→С5Н12+С5Н10
2. Изомеризация
СН3-СН2 –СН2-СН3 →
СН3 — СН –СН3
СН3
Изобутан
3.Термическое расщепление
СН41000С→С +2Н2
2СН4 1500С→СН≡СН +3Н2
5. Ароматизация
СН3— СН2 -СН2 -СН2–СН2-СН3→ 4 Н2 +
1. Реакции присоединения.
1. Гидрирование.
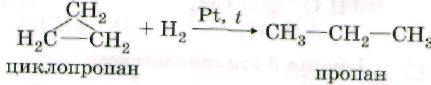
2. Галогенирование.
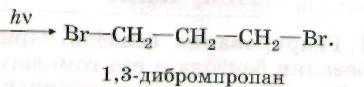
3. Гидро
галогенирование.
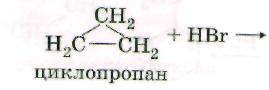
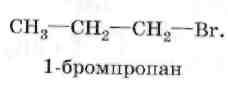
2. Реакции замещения.
1. Галогенирование.
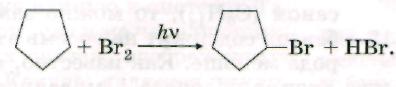
2. Нитрование.
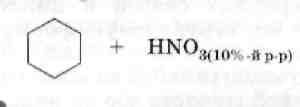
1. Реакции присоединения.
1. Гидрирование
СН2=СН2 + Н2 →
СН3-СН3
2. Галогенирование
СН3-СН=СН2 + Cl2 →СН3-СНCl -СН2Cl
3. Гидро
галогенирование
СН3-СН=СН2 + НСl → СН3-СНCl-СН3
2-хлорпропан
протекает в соответствии с правилом В. В. Марковникова. Отклонении — .реакция идет по радикальному механизм ( в присутствии пероксида водорода или кислорода), то, как показал М. Хараш (1933), («пероксидный эффект» Хараша):
СН3-СН=СН2 + HBr →СН3-СН2-СН2Br
Пероксидный эффект имеет место только в случае присоединения HBr.
4. Гидратация
СН3-СН=СН2 + НОН(AL2O3 )
→ СН3-СНOH-СН3
5. Гипо
галогенирование
СН3-СН=СН2+НОСl
→СН3-СНСl-СН2OH
6. Алкилирование
изобутан + изобутилен = 2,2,4-триметилпентан.
7. Оксосинтез (синтез Репе)
СН2=СН2 + СО2 + Н2 → СН3-СН2-СНО
2. Реакции полимеризации
nСН2=СН2 → (-СН2-СН2-)n
полиэтилен
3. Реакции окисление
1. СН2=СН2 +3О2→2СО2 + 2Н2О
2. Жестких условиях
СН3-СН=СН-СН3 + [O]→
2CH3COOH
3. Мягкие условия
3СН2=СН2+ 2KMnO4+4H2O
→CH2OH-CH2OH
+2MnO2+2KOH
Этиленгликоль
4. Реакции замещения.
СН2=СН2+Cl2→СН2=СНCl+HCl
винилхлорид
СН2=СН-СН3+Сl2 →СН2=СН СН2Cl + HCl алилхлорид
5. Изомеризация
Бутен-1=буте-2 и2метилпропен
1. Реакции присоединения.
а) Диены, содержащие несопряженные двойные связи, ведут себя как обычные алкены. присоединение идет к каждой из этих связей. При этом могут затрачиваться две молекулы реагента (галогена, галогеноводорода и др.)
СН2=СН-(СН2)2-СН=СН2 +2Br2→
гексадиен-1,5 1,2,5,6
тетрабромгексан
б) Диены сопряженными двойными связями обладают своеобразными свойствами.
1 2 3 4
СН2= СН-СН=СН2+
Cl2→1,2присоединение и 1,4-
Выход продуктов 1,4- или 1,2-присоединения определяется характером реагента и условиями проведения реакции. Например присоединения бромоводорода в присутствии пероксидных соединений идет в 1,4-положении, а в отсутствии – в положении 1,2.
Водород в момент выделения (при действии на кислот металлами) присоединяется в положении 1,4, а газообразный водород на Ni гидрирует диен до бутана или присоединяется в положение 1,2:
2Н2/Ni
СН2= СН-СН=СН2 →
(а) СН3— СН=СН-СН3
(б) СН3-СН2-СН2СН3
(в) СН3-СН2-СН=СН2
Гипогалогенные кислоты присоединяются к диенам преимущественно в 1,2-положение:СН2= СНСН=СН2+НОВr
→ СН2Вr- СНOH-СН=СН2
1-бромбутен-3-ол-2
В молекуле бутадиена-1,3 представляющую собой сопряженную систему π-электронов, нет «чистых» двойных и простых связей .
СН2= СН-СН=СН2 +НСl→1,2-присоединение и 1,4-присоединение.
2. Диеновый синтез (реакция Дильса-Альдера).
2СН2= СН-СН=СН2 →Циклогексен
3. Реакция полимеризации
n(СН2= СН-СН=СН2 )→ (-СН2-СН=СН-СН2-)n
1. Реакции присоединение
1. Присоединение СН3СООН+
СН≡СН+СН3СООН→СН3СООСН
=СН2 винилацетат
2. Гидрирование
СН≡СН+Н2→СН2=СН2 +Н2→СН3-СН3
3. Галогенирование
СН≡СН +Br2→
СНBr=СНBr +
Br2→СНBr2 -СНBr2
4. Гидро
галогенирование
СН≡СН +НСl→
CH2=CHCl→CH3CHCl2
5. Присоединение воды
СН≡СН +НОН
(Нg SO4кат)→
[CH2=CH-OH]→ CH3CHO
виниловый спирт
уксусный альд.
При гидратации гомологов этина образуются кетоны.
6. Присоединение НСN
СН≡СН + НСN→ CH2=CH-CN акрилонитрил
7. Присоединение спиртов СН≡СН+НОС2Н5→ CH2=CH-О-С2Н5 этилвиниловый эфир
2. Реакции замещение
δ+ δ- δ- δ+
Н→С≡С←Н
Поэтому ацетилен проявляет кислотные свойства. СН≡СН+2[Ag(NH3)2]OH→Ag-С≡С-Ag +4NH3+2H2O
ацетиленид серебра
СН≡СН+2Na→ NaС≡С-Na +H2
ацетиленид натрия
3. Реакции конденсации с карбонильными соединениями.
Ацетон + этин→3-метил-3
гидроксобутин-1→3-метил-3-гидроксобутен-1→изопрен
4. Реакции полимеризации
1. Тримеризация
3СН≡СН→С6Н6
2. Димеризация
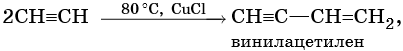
2СН≡СН→
СН≡ССН=СН2 винилацетилен
5. Окисление:
С2Н2+5О2 → 4С02 + 2Н20 + 2600 кДЖ
Обесцвечивает перманганат калия.
1. Реакции присоединения.
1. Гидрирование.
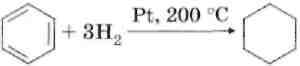
2. Хлорирование.
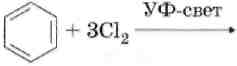
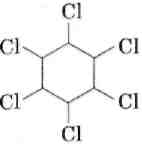
2. Реакции замещения.
1. Галогенирование.
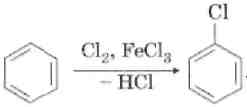
2. Нитрование
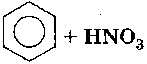
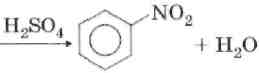
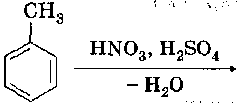
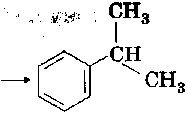
3. Алкилирование.
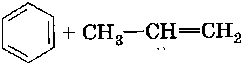
4. Ацилирование.
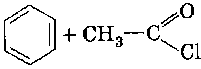
3. Реакции по алкильному заместителю.
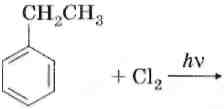
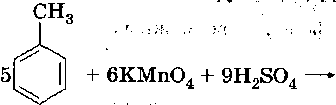
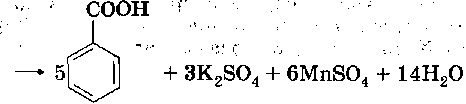
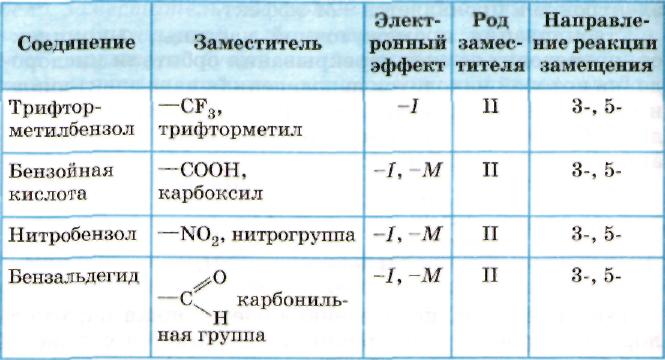
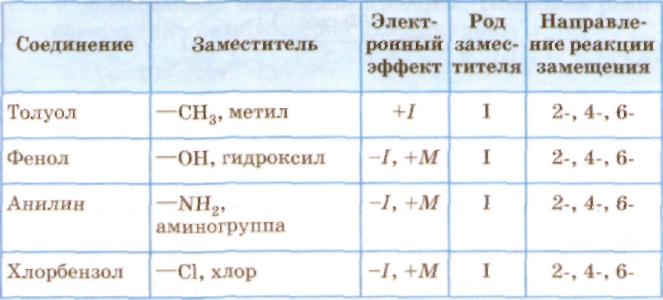
Влияние заместителей при бензольном кольце называют ориентирую
щим действием заместителей:
1. донорные, подающие электронную плотность заместители направляют реакции электрофильного замещения в 2-, 4-, 6- (орто-, пара) положения — заместители (ориентанты) первого (I) рода;
2. акцепторные, принимающие электронную плотность заместители направляют реакции электрофильного замещения в 3-, 5- (мета) положения, снижают скорость реакции – заместители (II) рода
Применение
Используются как дешевое топливо. Из алканов также получают многие ценные химические продукт.
Входят в состав нефти, эфирных масел. Находят применение в разных областях народного хозяйства. Циклопентан используется в разных синтезах и как добавки к моторному топливу. Циклогексан для синтеза полупродуктов при производстве синтетических волокон найлона и капрона
Применяется для синтеза различных органических веществ: этилового спирта, стирола, полиэтилена и. т. д.
Необходимо подчеркнуть, что Алкены применяются в качестве мономеров для производства высокомолекулярных соединений,
Являются одним из важнейших мономеров для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Применяются как ценное сырье для многих химических соединений: уксусного альдегида и уксусной кислоты, акрилонитрила и хлорвинила (используемых для производства полимеров), а также хлоропренового каучука из хлоропрена,
Бензол применяется как растворитель и сырье для получения многих важных ароматических соединений, которые используют для производства красителей (анилин), полимеров (стирол, фенол), лекарственных препаратов, взрывчатых веществ, консервантов (бензойная кислота)
Влияние заместителей на ароматическое кольцо.
infourok.ru
Предельные углеводороды
Алканы
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
| Название вещества | Структурная формула |
|---|---|
|
Метан |
CH4 |
|
Этан |
C2H6 |
|
Пропан |
C3H8 |
|
Бутан |
C4H10 |
|
Пентан |
C5H12 |
|
Гексан |
C6H14 |
|
Гептан |
C7H16 |
|
Октан |
C8H18 |
|
Нонан |
C9H20 |
| Декан |
C10H22 |
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1H3 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C3H(CH3) – CH3 (3- третичный атом углерода)
CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода)
Изомерия
Для предельных углеводородов характерны структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH
CH3 –CH(CH3)-CH2-CH3 (2-метилбутан)
CH3-C(CH3)2-CH3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Строение
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Рассмотрим это на примере метана – CH4. Молекула метана в общем виде соответствует формуле AB4. Центральный атом – атом углерода, атомы водорода – лиганды.
6С 1s22s22p2
Основное состояние
Чтобы принять четыре атома водорода, атому углерода необходимо перейти в возбужденное состояние:
1H 1s1
В гибридизацию вступают все валентные электроны углерода, следовательно, атом углерода находится в sp 3-гибридизации. Углы между связями в молекулах алканов 109,5.
Физические свойства
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле.
Получение
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H2 = CnH2n+2 (1)
nCO + (2n+1)H
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH=CH-R2 (алкен) → R1-CH2 – CH2 -R2 (алкан) (1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
CH3COONa↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан) (3)
CH3COONa + NaOH → CH4 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Химические свойства
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Галогенирование. При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH4 + Cl2 = CH3Cl + HCl (хлорметан)
CH3Cl +Cl2 = CH2Cl2 + HCl (дихлорметан)
CH2Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4 + HCl (тетрахлорметан)
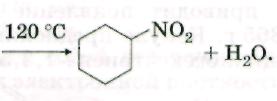
Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140С и небольшом давлении протекает радикальная реакция:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (нитроэтан) + H2O
Крекинг – радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8H18 = C4H10 (бутан)+ C3H8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2↑
Окисление. При мягком окислении метана кислородом воздухха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
CnH2n+2 + (3n+1)/2 O2 = nCO2 + (n+1)H2O
Примеры решения задач
ru.solverbook.com
Углеводороды и углеводородные радикалы (перечислены в порядке возрастания старшинства)
Углеводород | Радикал | Название |
CH4 метан | CH3 | метил |
CH3CH3 этан | CH3CH2 | этил |
CH3CH2CH3 пропан | CH3CH2CH2 | пропил |
| изопропил | |
CH3CH2CH2CH3 бутан | CH3CH2CH2CH2 | бутил |
| втор-бутил | |
2-метилпропан изобутан | | изобутил |
| трет-бутил |
Окончание табл. 2
Углеводород | Радикал | Название |
CH2=CH2 этен | CH2=CH | винил |
CH3CH=CH2 пропен | CH3CH=CH | пропенил |
CH2=CHCH2 | аллил | |
HCCH этин | HCC | этинил |
HCCCH3 пропин | HCCCH2 | пропаргил |
бензол | | фенил |
метилбензол | | бензил |
Таблица 3
Основы рациональных названий и окончаний по систематической номенклатуре основных классов органических соединений
Название класса | Основа рациональных названий | Название основы | Суффикс в систематической номенклатуре |
алканы | | метан | -ан |
алкены | | этилен | -ен |
алкины | | ацетилен | -ин |
арены | | бензол | бензол |
Окончание табл. 3
Название класса | Основа рациональных названий | Название основы | Суффикс в систематической номенклатуре |
спирты | | карбинол | -ол |
альдегиды | | уксусный альдегид | -аль |
кетоны | | кетон | -он |
карбоновые кислоты | | уксусная кислота | -овая кислота |
амины | | амин | -амин |
Таблица 4
Примеры названий органических соединений по рациональной номенклатуре
Соединение | Название |
| метилпропилвтор-бутилметан |
| сим—втор-бутилизобутилэтилен |
| изопропилвтор-бутилацетилен |
| метилэтилпропилкарбинол |
Окончание табл. 4
Соединение | Название |
| метилизопропилуксусный альдегид |
| этилизобутилкетон |
| метилвтор-бутилуксусная кислота |
Систематическая номенклатура (ИЮПАК). Название соединения строится в виде сложного слова, состоящего из корня (родоначальное название), префиксов и суффикса (рис. 2).

Рис. 2. Построение названия органического
соединения по номенклатуре ИЮПАК
Алгоритм построения названия органического соединения по систематической номенклатуре:
1. Определить главную цепь – родоначальную структуру – самую длинную цепь углеродных атомов, которая должна содержать:
все имеющиеся функциональные группы;
кратные связи;
максимальное число алкильных радикалов.
Число атомов углерода в главной цепи определяет название нормального предельного углеводорода, лежащего в основе называемого соединения (например: гексан, циклопентан).
2. Выявить все функциональные группы и кратные связи. Определить старшую функциональную группу, название которой в виде суффикса будет отражаться в конце названия соединения. Названия остальных групп даются в названии соединения в виде префиксов (приставок).
3. Обозначить ненасыщенность соединения соответствующим суффиксом (-ен или -ин).
4. Пронумеровать главную цепь, присваивая старшей группе наименьший из возможных номеров.
5. Перечислить префиксы в алфавитном порядке (умножающие приставки ди-, три— и т. д. не учитываются). Цифры-локанты ставят перед префиксами и суффиксами, отделяя их от букв дефисами.
6. Составить полное название соединения, согласно рис. 2. (В табл. 5 приведены примеры).
Таблица 5
studfile.net