Классификация химических реакций в неорганической и органической химии / Справочник :: Бингоскул
Общие понятия
Процесс преобразования одних веществ в другие, при этом отличающихся от исходных по своему составу и свойствам называется химической реакцией.
Это явление сопровождается разрывом старых и образованием новых связей между атомными частицами.
Многообразие взаимодействий требует от химиков их классифицирования по следующим признакам (см. Табл. 1)
Таблица 1
Классифицирующие признаки химических реакций
Классифицирующий признак | Класс реакции |
Изменяется степень окисления |
|
Характер взаимодействия, количество и состав исходных и полученных веществ |
|
| Направление реакции |
|
| Вид разрыва связей |
|
| Тепловой и эффект |
|
Агрегатное состояние фаз |
|
Участие катализатора |
|
I.
 Систематизация реакций в химии неорганических веществ. Примеры
Систематизация реакций в химии неорганических веществ. Примеры
- В процессе окисления-восстановления меняется степень окисления химических элементов:
Al0 + S0 → Al2+3S3-2
В этом примере к атому серы присоединяются два электрона – это полуреакция восстановления. Окислительная степень её сменилась с 0 до -2.
Сера здесь – окислитель (акцептор электронов).
Атом алюминия, отдав 3 электрона, изменил степень окисления с 0 до +3 и стал восстановителем (донором электронов). Это окислительная полуреакция.
Обе полуреакции составляют единый окислительно-восстановительный процесс.
- При проведении реакции соединения несколько реагентов образуют только один продукт:
4NO2 +O2 +2H2O=4HNO3
- Разложение наоборот продуцирует из одного химического реагента два или несколько других:
CaCO3 = CaO + CO2
- Взаимодействие простого и сложного вещества, которое ведёт к образованию других простых и сложных веществ, называется реакцией замещения:
Zn + CuSO4 = ZnSO4 + Cu
- В обменной реакции участвующие в ней реагенты меняются своими структурными частями:
2NaOH + CuCl2 = 2NaCl + Cu(OH)2
Частным случаем этого процесса является нейтрализация между собой кислот и оснований:
KOH + HCl = KCl + H2O
- Классифицирующий признак «направление реакции» разделяет их на необратимые и обратимые.
 Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях:
Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях: 3H2 + N2 ⇆ 2NH3 – обратимая реакция,
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ – необратимая реакция
- Преобразование веществ обязательно сопровождается разрывом связей в молекулах и созданием новых.
Если этот разрыв сопровождается образованием радикалов, что присуще молекулам с неполярными и малополярными ковалентными связями, то этот процесс — гомолитическая реакция:
Cl2свет→ Cl∙ + ∙Cl
Каждая частица хлора, обладая неспаренным электроном, превращается в радикал. Реакции, связанные с разрывом сильнополярных связей и образованием заряженных частиц – ионов, являются гетеролитическими:
HBr ⇆H+ +Br–
- Любое химическое превращение – это энергетический процесс.
 Поэтому ещё один показатель химического реагирования – тепловой эффект.
Поэтому ещё один показатель химического реагирования – тепловой эффект.Реакции, идущие с выделением тепловой энергии, называются экзотермическими. Практически все реакции соединения – экзотермические.
Если им ещё сопутствует световое излучение, то такая реакция носит название горение.
C + O2 = CO2 + Q, где Q – тепловой эффект.
Взаимодействие веществ с поглощением тепла эндотермическая реакция. К такому типу относятся реакции разложения:
CaCO3 → CaO + CO2 – Q
Для сведения. Уравнения, демонстрирующие тепловой эффект (Q), носят название термохимические.
- Группа гомогенных и гетерогенных реагирований определяется фазным (агрегатным) состоянием веществ.
В гомогенных – все исходные и полученные в ходе реакции вещества существуют в одной фазе.
 Например, в растворах, в газообразной среде:
Например, в растворах, в газообразной среде:NaOH(р-р) + HCl(р-р) = NaCl + H2O
2CO + O2 = 2CO2
Если реагенты и полученные продукты находятся в разных фазовых состояниях, то речь идёт о гетерогенном взаимодействии:
СаС2(т)+2Н2О(ж) = С2Н2↑+Са(ОН)2(р-р).
Большая группа реакций определяется участием в них особых веществ – катализаторов, т.е. соединений – ускорителей реакции.
Каталитические реакции идут только с их участием:
2H202MnO2→ 2H2O + O2 (катализатор MnO2)
Некаталитические реакции в присутствии катализаторов не нуждаются:
КOH + HCl → КCl + H2O
Для сведения. Существуют также вещества, которые замедляют химические реакции – ингибиторы.
 В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
II. Систематизация реакций в органической химии. Примеры
В классификации реакций органической химии есть много аналогичного неорганической химии, но есть и своеобразие.
Основные типы взаимодействий органических веществ
- замещение,
- присоединение,
- элиминирование (отщепление),
- изомеризация и перегруппировка, — окисление,
- конденсация и поликонденсация, — разложение
- В реакциях замещения в исходных молекулах происходит замена одного или группы атомов, прикрепленных к углеродному скелету на другие атомы. В таких превращениях чаще всего участвуют насыщенные и ароматические углеводороды.
Например, реакция спиртов с галогеноводородными кислотами:
C2H5OH + HBr = C2H5Br + H2O
- Реакции присоединения различают по типу присоединяемого вещества, например (такие реакции происходят, когда есть двойные и тройные связи):
Гидрирование — с присоединением водорода:
СН3—СН = СН2 (пропен) + Н2 → СН3—СН2—СН3 (пропан)
Гидрогалогенирование — с присоединением галогеноводорода:
СН2 = СН2(этен) + НСl → СН3—СН2—Сl (хлорэтан)
- Реакция отщепления (элиминирования) сопровождается потерей атомов, причем получается новое вещество с одной или несколькими кратными связями.
 В названиях этих реакций присутствует приставка де-:
В названиях этих реакций присутствует приставка де-:Дегидрирование – отрыв молекулы водорода:
Дегидратация – отрыв молекулы воды:
- Изомеризация и перегруппировка сопровождаются внутримолекулярной перестройкой, связанной с перемещением атомов в молекуле без изменения её формулы:
- При окислении благодаря действию окислителя повышается степень окисления углерода с отдачей электрона:
- Суть конденсации – взаимодействие группы органических веществ, при котором образуются новые C — C связи и низкомолекулярное соединения (например, вода):
НО—CH3—CH—OH + HO—CH3—CH—OH → НО—СH2—СH2—O—СH2—СH2— OH + H2O
При поликонденсации составные части (функциональные группы) образующегося полимера различаются с исходным мономером.

Например, реакция получения лавсана:
- Реакция разложения, как и в неорганической химии заключается в преобразование сложного соединения на несколько более простых веществ:
Все основные подходы к классификации сведены в Таблицу 2.
Заключение
Как и многие иные научные систематизации, приведенная в статье классификация реакций в определённом смысле условна. Химики договорились разложить химические превращения по классам на основе наиболее объективных признаков.
Но на деле всё сложнее. Многим реакциям соответствуют самые разные отличительные признаки.
Например, синтез аммиака (NH3) характеризуется признаками реакции окислительно- восстановительной, экзотермической, обратимой, соединения, гетерогенной, каталитической, идущей со снижением давления в реакционной среде.
Всё это надо учитывать в технологическом регламенте. Конкретный химический процесс всегда многогранен и качественно многообразен.
Смотри также:
Классификация химических реакций в неорганической и органической химии | ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.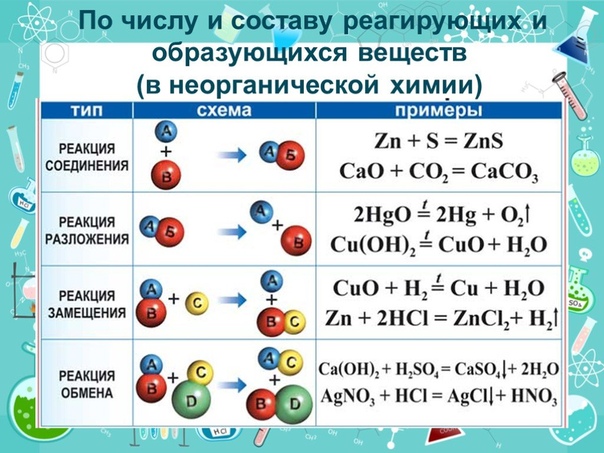 е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т. к. углеводороды изостроения обладают меньшей способностью к детонации.
к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2.
Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑. $
$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.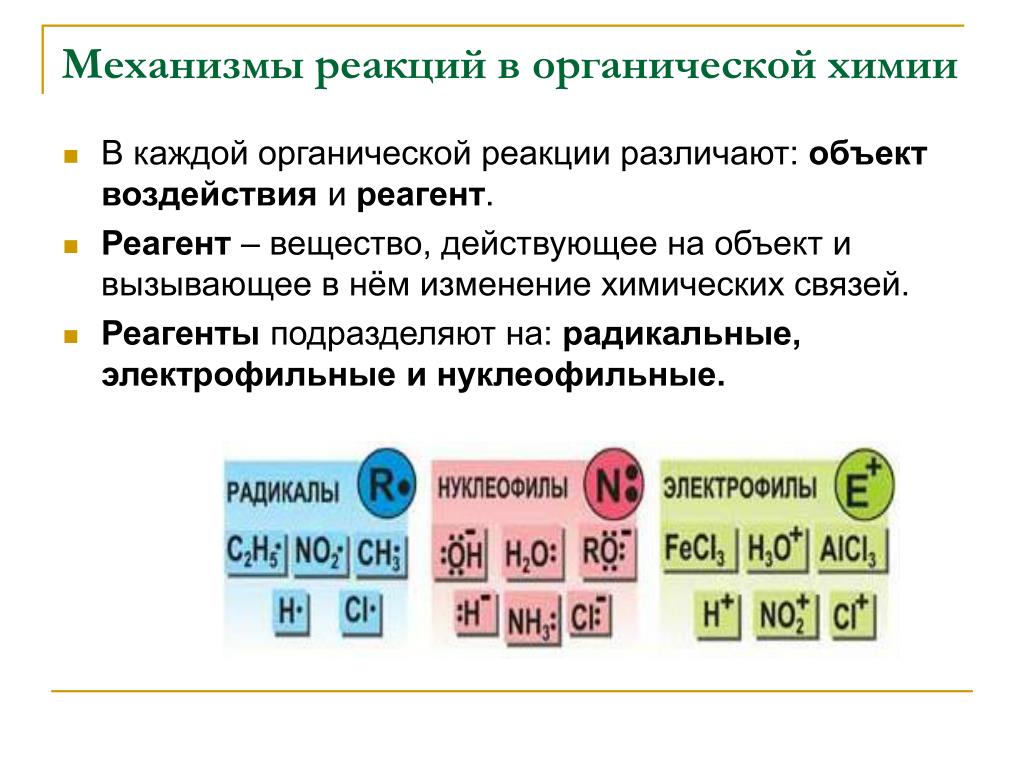
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$). {-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{\text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{\text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{\text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{\text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Классификация химических реакций в неорганической и органической химии
Чтобы поделиться, нажимайте
1) Первый признак классификации – по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
+2 +5 +3 +6 +4
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
б) без изменения степени окисления
CaO + 2HCl = CaCl2 + H2O
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2) Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения в органической химии.
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
-реакции разложения.
Реакции разложения можно рассматривать как процессы, обратные соединению.
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
– реакции замещения.
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
– обмена (в том числе и нейтрализации).
CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgCl¯ + KNO3
3) По возможности протекать в обратном направлении – обратимые и необратимые.
4) По типу разрыва связей – гомолитические (равный разрыв, каждый атом по 1 электрону получает) и гетеролитический (неравный разрыв – одному достается пара электронов)
5) По тепловому эффекту
экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
6) По фазе
а) Гомогенные (однородные вещества, в одной фазе, например г-г, реакции в растворах)
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между несмешивающимися жидкостями)
7) По использованию катализатора. Катализатор – вещество ускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без использование катализатора практически не идут.
б) некаталитические.
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + h3O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2 FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Каталитические реакции протекают только в присутствии катализатора. Некаталитические реакции идут в отсутствие катализатора.
Классификация органических реакций приведена в таблице:
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Классификация химических реакций. Химия. 11 класс. Разработка урока
УМК «Химия. 11 класс. Базовый уровень» О. С. Габриеляна.
Цель: Систематизировать знания учащихся о подходах к классификации химических реакций.
Задачи:
- Обучающие: систематизировать, обобщить и углубить знания учащихся о химических реакциях и их классификации. Рассмотреть некоторые из многочисленных классификаций химических реакций по различным признакам.
- Развивающие: развивать умение анализировать, сопоставлять данные и делать выводы, развитие познавательных способностей
- Воспитывающие: формирование коммуникативной компетенции: воспитание самостоятельности, сотрудничества.
Тип урока: урок изучения новых знаний.
Методы: диалог, частично-поисковый метод.
Форма организации деятельности учащихся: фронтальная и групповая.
Оборудование: компьютер, проектор, реактивы и лабораторное оборудование для проведения лабораторных опытов.
ЦОР: Видеоопыты с сайта «Единая коллекция цифровых образовательных ресурсов», презентация.
Ход урока
1. Организационный момент
2. Актуализация знаний
Слайд 2.
?Что объединяет эти явления? Что лежит в их основе?
«Осень. Обсыпается весь наш бедный сад,
Листья пожелтелые по ветру летят;
Лишь вдали красуются, там на дне долин,
Кисти ярко-красные вянущих рябин».(А.К.Толстой)
Во время грозы образовался озон.
Железный гвоздь, лежавший на влажной земле, покрылся ржавчиной.
Предполагаемые ответы: Все явления объединяет то, что в их основе лежат химические явления, химические реакции.
?Что происходит в ходе химической реакции с веществами?
Слайд 3. В ходе химической реакции из одних веществ образуются другие вещества, отличающиеся от исходных по составу, строению и свойствам.
3. Изучение новых знаний
Химические реакции можно классифицировать по различным признакам.
Слайд 4.
?Как вы думаете, по какой признак объединил все указанные реакции:
|
Р(белый) |
<=> |
Р (красный) |
|
C(графит) |
<=> |
С (алмаз) |
|
С4Н10 (бутан) |
<=> |
С4Н10 (изобутан) |
Данные реакции не сопровождаются изменением состава веществ.
?Как называется явление существования разных простых веществ, образованных одним элементом? (Аллотропия)
?Как называется процесс превращения бутана в изобутан? (изомеризация)
Вывод: Процесс взаимопревращений разных аллотропных модификаций одного химического элемента и реакции изомеризации относятся к реакциям, которые не сопровождаются изменением состава веществ. Слайд 5.
Классификацию химических реакций, протекающих с изменением состава вещества, можно проводить по самым разным признакам.
? Какие типы реакций, протекающих с изменением состава вещества вы знаете?
Предполагаемые ответы учащихся: реакция соединения, разложения, обмена, замещения.
Слайд 6. ?Определите, какой признак объединяет эти реакции:
|
В неорганической химии |
В органической химии |
|
S + O2 = SO2 |
CH2 = CH2 + H2 = CH3–CH3 |
|
SO3 + H2O = H2SO4 |
CH2 = CH2 + H2O = CH3–CH2–OH |
Предполагаемые ответы: из нескольких веществ образуется одно, происходит соединение.
?Одинаковый ли механизм протекания реакций такого типа в органической и неорганической химии?
Вывод: Реакции, в результате которых из двух и более веществ образуется одно сложное вещество называются реакциями соединения в неорганической химии и реакциями присоединения в органической химии.
Слайд 7. ? Какой признак объединяет реакции:
|
В неорганической химии |
В органической химии |
|
2КMnO4 = K2MnO4 + MnO2 + O2 |
|
|
2HgO = 2Hg + O2 |
|
Вывод: В ходе этих реакций из одного сложного вещества образуется несколько новых веществ. В неорганической химии реакции называются реакциями разложения, в органической – реакциями отщепления.
Реакции отщепления – антонимы реакциям присоединения.. Составьте самостоятельно реакции дегидрирования этана и дегидратации этанола.
Слайд 8. Просмотрите видеофрагменты: получение железа из его оксида, взаимодействие натрия с водой
Получение железа: http://school-collection.edu.ru/catalog/res/d77a30c4-8cff-11db-b606-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c11&interface=catalog&class=54&subject=31
Взаимодействие натрия с водой
http://school-collection.edu.ru/catalog/res/d77a30ab-8cff-11db-b606-0800200c9a66/?from=d05469af-69bd-11db-bd13-0800200c9c11&interface=catalog&class=54&subject=31
Составьте уравнения данных реакций.
?Какой признак объединяет эти реакции? Какие изменения происходят с веществами в ходе таких реакций?
В ходе реакций атомы простого вещества замещают атомы одного из элементов в сложном. Такие реакции называются реакциями замещения. В органической химии реакции замещения имеют свою специфику.
Слайд 9. Найдите среди перечисленных реакции замещения.
1) C6H6 + 6H2 = C6H12
2) C6H6 + HNO3 = C6H5NO2 + H2O
3) CH4 + Cl2 = CH3Cl + HCl
(К реакциям замещения относятся реакции №2 и №3.)
Ребята, определите к какому типу можно отнести реакции между предложенными веществами.
Лабораторная работа (работа в группах)
Проведите опыты, соблюдая правила техники безопасности, заполните таблицу:
|
Исходные вещества |
Продукты реакции |
Признак реакции |
Тип реакцции |
|
Na2CO3 + HCl |
|
|
|
|
Na2SO4 + BaCl2 |
|
|
|
|
KOH + ф/ф + HCl |
|
Вода (нейтрализация) |
|
Вывод: Реакции, в которых два сложных вещества обмениваются своими составными частями называются реакциями обмена. Реакции протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (вода).
Слайд 10. ?Какие признаки реакции ярко выражены в ходе реакции горения спирта, горения метана?
(Реакции сопровождаются выделением тепла.)
?Как называются реакции, которые сопровождаются выделением тепла? Поглощением тепла?
Слайд 11.
|
Тип реакции |
Экзотермические |
Эндотермические |
|
Теплота |
Выделяется |
Поглощается |
|
Примеры реакций |
Реакции соединения Искл. N2 + O2 = 2NO – Q H2 + I2 = 2HI – Q |
Реакции разложения |
Q – тепловой эффект реакции. Уравнение, в котором указывается тепловой эффект, называют термохимическим.
4. Первичная проверка освоения изученного материала
Слайд 12 Ребята, дайте классификацию реакции:
|
N2 |
+ |
3H2 |
<=> |
2NH3 + Q |
|
(г) |
|
(г) |
|
(г) |
?Вспомнили ли вы, какие еще классификации реакций существуют?
Предполагаемые ответы: обратимые-необратимые, каталитические-некаталитические, гомогенные-гетерогенные) Более подробно такие реакции рассмотрим на следующих уроках.
5. Закрепление материала
5.1. Тест «Типы химических реакций» (на столах учащихся)
1. Взаимодействие оксида серы (IV) с кислородом относится к реакциям
1) соединения, экзотермическим
2) замещения, экзотермическим
3) обмена, эндотермическим
4) соединения, эндотермическим.
2. Взаимодействие кислорода с азотом относится к реакции
1) соединения, экзотермическая
2) обмена, экзотермическая
3) соединения, эндотермическая
4) обмена, эндотермическая
3. Взаимодействие цинка с соляной кислотой относится к реакциям
1) разложения
2) ионного обмена
3) замещения
4) соединения.
4. Гидратация этилена – это реакция
1) присоединения
2) отщепления
3) обмена
4) замещения.
5. Дегидрирование пропана – это реакция
1) присоединения
2) отщепления
3) обмена
4) замещения.
6. Взаимодействие гидроксида калия с раствором сульфата меди относится к реакциям
1) соединения
2) разложения
3) обмена
4) замещения.
7. Взаимодействие гидроксида калия с серной кислотой относится к реакциям
1) соединения
2) разложения
3) обмена
4) замещения.
5.2. Слайд 13.
Составьте термохимическое уравнение реакции горения угля, тепловой эффект реакции 394 кДж.
5.3. упр № 6 к п.14 стр. 126
6. Рефлексия
Определите свой результат урока:
- Я всё это знал;
- Чувствовал себя уверенно;
- Чувствовал не очень уверенно;
- Узнал много нового;
- Часть материала оказалась для меня новой;
- Было не очень интересно;
- На уроке было интересно!
7. Подведение итогов урока
Независимо от того, между какими веществами – органическими или неорганическими – происходит химическое превращение, для них характерны одни и те же закономерности. Каждую химическую реакцию можно охарактеризовать, используя различные классификации.
8. Домашнее задание
п.13,14
Литература:
Программа: Программа курса химии для 8-11 классов общеобразовательных учреждений. Габриелян О.С. – М.: Дрофа, 2011.
Учебник: Химия. 11 класс. Базовый уровень: учеб. для общеобразовательных учреждений/ О.С. Габриелян – М.: Дрофа, 2010.
Методические пособия:
- Габриелян О.С., Яшукова А.В. Химия. 11 кл. Базовый уровень: Методическое пособие. – М.:Дрофа, 2006.
- Габриелян О.С., Лысова Г.Г., Введенская А.Г. Настольная книга учителя. Химия. 11 кл. В 2 ч. – М.: Дрофа, 2008.
- Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 11 кл. – М.: Дрофа, 2007.
- Химия. 11 кл.: Контрольные и проверочные работы к учебнику О.С. Габриеляна, Г.Г. Лысовой «Химия. 11»/О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – М.: Дрофа, 2008.
Цикл лекций по химии для школьников
Цикл лекций по химии для школьниковПреподаватели:
Селюнина Лилия Александровна – кандидат химических наук, старший преподаватель кафедры неорганической химии химического факультета Томского государственного университета.
Пахнутова Евгения Андреевна — кандидат химических наук, научный сотрудник лаборатории химической экологии химического факультета Томского государственного университета.
Лекция-семинар: Разрешенная шпаргалка на экзамене по химии
14 марта 2016 г. на лекции школьники узнали, как пользоваться Периодической системой Д.И.Менделеева, основные подходы, которые можно использовать при решении заданий ЕГЭ по химии.
Лекция-семинар: Химическая реакция
21 марта 2016 г состоялась лекция-семинар для всех,кто рассматривает химию в качестве своей будущей профессии и собирается сдавать ЕГЭ по этому предмету. Лекция посвящена всему, что связано с химической реакцией: типы химических реакций, «основные помощники» при написании химических уравнений, теория электролитической диссоциации.
Лекция: ОВР – трудная задача, но решаемая
28 марта 2016 г. Учащиеся 10-11 классов смогли преодолеть страх перед окислительно-восстановительными реакциями в неорганической и органической химии, познакомились с разными способами их уравнивания, узнали основные подсказки, которые помогаютпри написании продуктов. Теперь ониуже сами решат,каким способомпользоваться при расстановке коэффициентов в этих «сложных» реакциях.
Лекция-семинар: Классы неорганических соединений
04 апреля 2016 годаучащиеся 10-11 классов вспомнили классы неорганических соединений и основные реакции, в которые они вступают.Вместе с преподавателем химии смогли проследить зависимость химических свойств от положения элементов в периодической системе. Научились использовать таблицу растворимости и ряд электрохимического напряжения металлов для написания химических реакций.
Лекция-семинар: Генетическая связь классов неорганических соединений
11 апреля 2016 г.школьникам «покорилась» одна из самых сложных тем в неорганической химии.Много трудностей возникает из-за большого количества информации, с которой приходится сталкиваться учащимся. Оказывается, есть приемы, которые можно применять, чтобы облегчить эту непростую задачу.
Семинар: Решение задач по химии
18 апреля 2016 г. учащиеся10-11 классов общеобразовательных школсделали вывод, что решать задачи по химии это легко, главное написать уравнение реакции, а дальше при решении любой задачи используется один и тот же алгоритм. Теперь они справятся с любой задачей из ЕГЭ по химии, осталось только выучить химические свойства неорганических соединений.
Лекция-семинар: Классы органических соединений. Классификация.
Номенклатура. Изомерия
25 апреля 2016 г. начался новый цикл в химии – органическая химия. Кто-то думает, что органическая химия это сложно, но только не школьники, посетившие первую лекцию, посвященную классификации, номенклатуре и изомерии органических соединений, на которой преподаватель смогла донести до учащихся, что в органической химии главное иметь логику и все трудности будут преодолены.
Лекция-семинар: Углеводороды в ЕГЭ
16 мая 2016 г. после долгих майских праздников продолжился курс лекций по органической химии.На очередной лекции школьники вспомнили самый важные классы органических соединений, познакомились с основными механизмами химических реакций в органической химии, эффектами, которые влияют на образование тех или иных продуктов реакции.
Лекция-семинар: Кислородсодержащие органические соединения
23 мая 2016 г. учащиеся 10-11 классов продолжили изучение органических соединений и химических реакций, в которых они участвуют. На этой лекции они рассмотрели строение, получение и реакционную способность кислород содержащих органических веществ. Сравнили химические свойства органических и неорганических кислот, спиртов и фенолов, простых и сложных эфиров.
Лекция-семинар: Азотсодержащие органические соединения. Решение задач в органической химии
30 мая 2016 г. состоялась последняя в этом году лекция по подготовке к ЕГЭ. Но наши школьники не расслабляются, впереди их ждет сложный экзамен. И напоследок их ожидала одна из самых сложных тем в органической химии – азотсодержащие органические соединения.
Классификация химических реакций. 11-й класс
На первом уроке составляем таблицу по двум параграфам. В конце урока- тренировочный тест, при выполнении которого ученикам разрешено пользоваться таблицей. На втором уроке - закрепление: решение задач, выполнение тестовых заданий и т.д.
Таблица «Типы химических реакций»
При заполнении таблицы следует сразу обговорить с учениками некоторые правила заполнения:
1) при записи определения типа химической реакции будем опускать следующие слова «это такие реакции, которые или в результате которых»;
2) при рассмотрении реакций органической химии будем писать «в органической химии:»
| Тип реакции | Определение | Пример | |
| Реакции, идущие без изменения состава веществ | |||
| 1. Процессы превращения различных аллотропных модификаций одного химического элемента (явление аллотропии) | Способность атомов одного химического элемента образовывать несколько простых веществ. | to Ркр. = Рбел.,
to |
|
| 2. Реакции изомеризации | Реакции взаимопревращения изомеров. | н-гептан -> 2,2,3-метилбутан | |
| Реакции, идущие с изменением состава веществ | |||
| 3.Реакции соединения | Из двух или более простых или сложных
веществ, получается одно сложное вещество. (В органической химии: реакции галогенирования, гидрогалогени-рования, гидратации, гидрирования, полимеризации) |
СаО + СО2 = СаСО3 2Н2 + О2 = 2Н2О кат. СН2=СН2 + Н2 -> СН3-СН3 СН2=СН2 + Cl2 -> СН2Cl-СН2Cl СН2=СН2 + НCl -> СН3-СН2Cl СН2=СН2 + Н2O -> СН3-СН2-OH n(СН2=СН2) -> (-СН2-СН2-) n |
|
| 4. Реакции разложения | Из одного сложного вещества получается
два или более простых или сложных веществ. (В органической химии: реакции дегидратации, дегидрирования, дегалогенирования и дегидрогалогенирования.) |
2КMnO4 = K2MnO4 + MnO2
+ O2 2H2O = 2H2 + O2 СН3-СН2Cl -> СН2=СН2 + НCl |
|
| 5. Реакции замещения | Атомы простого вещества замещают атомы одного из химических элементов в сложном веществе. | Zn + 2HCl = ZnCl2 + H2 | |
| 6. Реакции обмена | Сложные вещества обмениваются своими
составными частями. (В органической химии - реакция этерификации) |
1) NaOH + HCl = NaCl + H2O — реакция
нейтрализации 2) BaCl2 + Na2SO4 = 2NaCl + BaSO4v HCOOH+CH3OH > HCOOCH3+H2O |
|
| Реакции, идущие с выделением или поглощением тепла | |||
| 7.Экзотермические реакции | Идут с выделением тепла. | S + O2 = SO2 +Q | |
| 8.Эндотермические реакции | Идут с поглощением тепла. | N2 + O2 = 2NO — Q | |
| Реакции, идущие в присутствии или отсутствии катализатора | |||
| 9. Каталитические | Протекают с участием катализатора. | MnO2 2H2O2 = 2H2O + O2 |
|
| 10. Некаталитические | Протекают без участия катализатора. | 2Ca + O2 = 2CaO | |
| Реакции, идущие с изменением степени окисления | |||
| 11.Окислительно-восстановительные | Происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества. | ||
Тест «Типы химических реакций»
1. Взаимодействие оксида серы (IV) с кислородом относится к реакциям
1) соединения, экзотермическим
2) замещения, экзотермическим
3) обмена, эндотермическим
4) соединения, эндотермическим.
2.Взаимодействие метановой кислоты с этанолом относится к реакциям
1) гидрирования
2) присоединения
3) этерификации
4) гидратации.
3. Взаимодействие водорода с азотом относится к реакциям
1) соединения, каталитическим
2) обмена, каталитическим
3) разложения, некаталитическим
4) замещения, некаталитическим.
4. Взаимодействие цинка с соляной кислотой относится к реакциям
1) разложения
2) ионного обмена
3) замещения
4) соединения.
5. Реакция спиртового брожения глюкозы относится к реакциям
1) обмена
2) замещения
3) соединения
4) разложения.
6. Гидратация этилена и ацетилена — это реакции
1) соединения
2) разложения
3) ионного обмена
4) замещения.
7. Дегидрирование бутана — это реакция
1) соединения
2) разложения
3) ионного обмена
4) замещения.
8. Взаимодействие гидроксида натрия с раствором сульфата меди относится к реакциям
1) соединения
2) разложения
3) ионного обмена
4) замещения.
9. Взаимодействие гидроксида натрия с серной кислотой относится к реакциям
1) соединения
2) разложения
3) ионного обмена
4) замещения.
Литература
1. О.С. Габриелян. Химия. 11 класс. Базовый уровень. М.: Дрофа, 2006. — 218, [6] с.: ил.
2. А.С.Корощенко, М.Г.Снастина. ЕГЭ — 2008: Химия: реальные задания. М.: АСТ: Астрель, 2008. — 126, [2] с.
3. Ю.Н.Медведев. Химия. ЕГЭ 2011. Типовые тестовые задания. М.: Издательство «Экзамен», 2011.- 159, [1]с.
Интересная органическая химия. Интересные факты о химии.
В эту самую минуту
Пока Вы читаете данную статью, Ваши глаза используют органическое соединение – ретиналь, который преобразует световую энергию в нервные импульсы. Пока Вы сидите в удобной позе, мышцы спины поддерживают правильную осанку благодаря химическому расщеплению глюкозы с высвобождением требуемой энергии. Как Вы понимаете, пробелы между нервными клетками так же заполнены органическими веществами – медиаторами (или нейространсмиттерами), которые помогают всем нейронам стать одним целым. И данная слаженная система работает без участия Вашего сознания! Так глубоко, как биологи, только химики-органики понимают, насколько филигранно создан человек, как логично устроены внутренние системы органов и их жизненный цикл. Отсюда следует, что изучение органической химии – основа понимания нашей жизни! А качественное изучение – это путь в будущее, ибо новые лекарства создаются прежде всего в химических лабораториях. Наша кафедра желает познакомить Вас поближе с этой прекрасной наукой.
11-цис-ретиналь, поглощает свет
серотонин – нейромедиатор
Органическая химия как наука
Органическая химия как наука возникла в конце девятнадцатого века. Она возникла на перекрещивании разных сфер жизни – от получения пищи до лечения миллионов людей, не подозревающих о роли химии в их жизни. Химия занимает уникальное место в структуре понимания Вселенной. Это наука о молекулах, но органическая химия является чем-то большим, чем это определение. Органическая химия в буквальном смысле сама себя создает, словно растет. Органическая химия, занимаясь изучением не только природных молекул имеет возможность самой создавать новые вещества, структуры, материи. Данная особенность подарила человечеству полимеры, красители для одежды, новые лекарства, духи. Некоторые считают, что синтетические материалы могут нанести вред человеку, либо быть экологически опасными. Однако, как порой отличить черное от белого, так и установить тонкую грань между «опасностью для человека» и «коммерческой выгодой» очень сложно. В этом вопросе так же поможет кафедра Органического синтеза и нанотехнологий (ОСиНТ).
Органические соединения
Органическая химия формировалась, как наука о жизни, ранее считалось, что она сильно отличается от неорганической химии в лаборатории. Затем ученые полагали, что органическая химия – это химия Углерода, особенно соединений каменного угля. В наше время органическая химия объединяет все соединения Углерода как живой, так и не живой природы.
Доступные для нас органические соединения получаются либо из живых организмов, либо из ископаемых материалов (нефть, уголь). Примером субстанций из природных источников являются эфирные масла – ментол (вкус мяты) и цис-жасмон (аромат цветков жасмина). Эфирные масла получают перегонкой с водяным паром; подробности раскроются при обучении на нашей кафедре.
- Ментол
- Цис-жасмон
- Хинин
Уже в 16 веке был известен алкалоид – хинин, который получают из коры хинного дерева (Южная Америка) и используют против малярии.
Иезуиты, что открыли данное свойство хинина, конечно же не знали его структуры. Тем более в те времена не стоял вопрос о синтетическом получении хинина – что удалось осуществить только в 20 столетии! Ещё любопытная история, связанная с хинином – это открытие фиолетового пигмента мовеина Уильямом Перкиным в 1856 году. Зачем он это сделал и какие результаты его открытия – так же можно узнать на нашей кафедре.
Но вернемся к истории становления органической химии. В 19 веке (времена У. Перкина) основным источником сырья для химической промышленности был уголь. Сухая перегонка угля давала коксовый газ, который использовался для обогрева и приготовления пищи, каменноугольную смолу, богатую на ароматические карбоциклические и гетероциклические соединения (бензол, фенол, анилин, тиофен, пиридин). На нашей кафедре Вам расскажут, чем они отличаются и какое они имеют значение в органическом синтезе.
Бензол, пиридин, фенол, анилин, тиофен
Фенол обладает антисептическими свойствами (тривиальное название – карболовая кислота), а анилин стал основой развития красочной промышленности (получение анилиновых красителей). Данные красящие вещества по-прежнему коммерчески доступны, например, Бисмарк-Браун (коричневый) показывает, что большая часть ранних трудов по химии была проведена в Германии:
Бисмарк-Браун
Однако в 20 столетии, нефть опередила уголь в качестве основного источника органического сырья и энергии, поэтому газообразные метан (природный газ), этан, пропан стали доступным энергетическим ресурсом.
В тоже время, химическая промышленность разделилась на массовую и тонкую. Первая занимается производством красок, полимеров – веществ, не имеющих сложное строение, однако, производимых в огромном количестве. А тонкая химическая промышленность, правильнее сказать – тонкий органический синтез занимается получением лекарств, ароматов, вкусовых добавок, в гораздо меньших объемах, что, однако более прибыльно. В настоящее время известно около 16 миллионов органических соединений. Сколько ещё возможно? В этой области, органический синтез не имеет ограничений. Представьте себе, что Вы создали самую длинную алкильную цепь, однако Вы можете легко добавить ещё один углеродный атом. Этот процесс бесконечен. Но не следует думать, что все эти миллионы соединений – обычные линейные углеводороды; они охватывают все виды молекул с удивительно разнообразными свойствами.
Алифатические соединения
Свойства органических соединений
Каковы же физические свойства органических соединений?
Они могут быть кристаллическими как сахар, или пластичными как парафин, взрывоопасными как изооктан, летучими как ацетон.
- Сахароза
- Изооктан (2,3,5-триметилпентан)
Окраска соединений так же может быть самая разнообразная. Человечество уже столько синтезировало красителей, что создается впечатление, что уже не осталось таких цветов, какие нельзя получить с помощью синтетических красителей.
К примеру, можно составить такую таблицу ярко окрашенных веществ:
Однако кроме этих характеристик, органические вещества обладают запахом, который помогает их дифференцировать. Любопытный пример – защитная реакция скунсов. Запах секрета скунсов обуславливают сернистые соединения – тиолы:
Компоненты секретов скунсов
Но самый ужасный запах был «унюхан» в городе Фрайбурге (1889), во время попытки синтеза тиоацетона разложением тримера, когда пришлось эвакуировать население города, поскольку «неприятный запах, которых быстро распространился по большой площади в городе, вызывает обмороки, рвоту и тревожные состояния». Лабораторию закрыли.
Но этот опыт решили повторить химики научной станции Ессо (Esso) к югу от Оксфорда. Передадим им слово:
«В последнее время, проблемы запаха вышли за пределы наших худших ожиданий. Во времена ранних экспериментов, пробка выскочила из бутылки с отходами и сразу была заменена, а наши колеги из соседней лаборатории (200 ярдов) немедленно почувствовали тошноту и рвоту.
Двое из наших химиков, которые просто изучали крекинг незначительных количеств тритиоацетона нашли себя как объект враждебных взглядов в ресторане и были посрамлены, когда официантка распылила дезодорант вокруг них. Запахи «бросили вызов» ожидаемым эффектам разбавления, поскольку работники лаборатории не считали запахи невыносимыми… и по-настоящему отрицали свою ответственность, так как они работали в закрытых системах. Чтобы убедить их в обратном, они были распределены с другими наблюдателями по всей территории лаборатории на расстояниях до четверти мили. Затем одна капля ацетон гем-дитиола, а позже маточного раствора перекристаллизации тритиоацетона была размещена на часовом стекле в вытяжном шкафу. Запах был обнаружен по ветру в считанные секунды». Т.е. запах этих соединений усиливается при понижении концентрации.
Существует два претендета на эту ужасную вонь – дитиол пропан (вышеуказанный гем-дитиол), либо 4-метил-4сульфанил-пентанон-2:
Вряд ли кто-то найдется чтобы определить из них лидера.
Однако, неприятный запах имеет свою область применения. Природный газ, что поступает в наши дома содержит небольшое количество ароматизатора – третбутил тиола. Небольшое количество – это столько, что люди способны почувствовать одну часть тиола в 50 миллиардах частей метана.
Напротив, некоторые другие соединения имеют восхитительные запахи. Чтобы искупить честь сернистых соединений мы должны сослаться на трюфель, который хрюшки могут унюхать через метр почвы и чей вкус и запах настолько восхитительны что они стоят дороже, чем золото. За аромат роз отвечают дамаскеноны. Если Вы имеете возможность понюхать запах одной капли, то Вы, вероятно, будете разочарованы, так как она пахнет как скипидар, или камфора. А на следующее утро Ваша одежда (и Вы в том числе) будете очень сильно благоухать розами. Так же, как и тритиоацетон, этот запах усиливается при разведении.
Компонент аромата трюфелей
Демаскенон – аромат роз
А как насчет вкуса?
Всем известно, что дети могут попробовать на вкус бытовую химию (средство для чистки ванны, туалета и т.д.). Перед химиками встала задача, чтобы несчастные дети больше не захотели попробовать какую-то химию в яркой упакове. Обратите внимание, что это сложное соединение является солью:
Битрекс денатониум бензоат
Некоторые другие вещества оказывают «странное» воздействие на человека, вызывая комплексы психических ощущений – галюцинации, эйфорию и т.д. К ним относятся наркотики, этиловый спирт. Они очень опасны, т.к. вызывают зависимость и уничтожают человека как личность.
Давайте не забывать и о других существах. Известно, что кошки любят спать в любое время. Недавно ученые получили из спинномозговой жидкости бедных кошек вещество, позволяющее им быстро засыпать. Оно так же действует и на человека. Это удивительно простое соединение:
Инициатор сна – цис-9,10-октадеценоамид
Подобная структура, носящая название Коньюгированная Линолевая Кислота (КЛК) обладает противоопухолевыми свойствми:
КЛК- противораковое средство цис-9-транс-11 сопряженная линолевая кислота
Ещё одна любопытная молекула – ресвератол, может быть отвечает за благотворное влияние красного вина в профилактике сердечных заболеваний:
Ресвератол из шкурки виноградинок
В качестве третьего примера «съедобных» молекул (после КЛК и ресвератрола) возьмем витамин С. Моряки дальнего плавания времен эпохи Великих Географических Открытий страдали заболеванием скорбут (цингой), когда происходят дегенеративные процессы мягких тканей, особенно ротовой полости. Нехватка данного витамина и вызывает цингу. Аскорбиновая кислота (тривиальное название витамина С) является универсальным антиоксидантом, она нейтрализует свободные радикалы, защищая людей от рака. Некоторые считают, что большие дозы витамина С защищают нас от простуды, но это ещё не доказано.
Витамин С
Органическая химия и промышленность
Витами С в больших колличествах получают в Швейцарии, на фармацевтическом заводе Roshe (не путать с РошеноМ). Во всем мире объемы промышленности органического синтеза исчисляются как килограмами (мелкотоннажные производства), так и миллионами тонн (крупнотоннажные производства). Это хорошая новость для студентов-органиков, т.к. дефицита рабочих мест (равно как и переизбытка выпускников) тут нет. Другими словами профессия инженера-химика очень актуальна.
Некоторые простые соединения можно получать как из нефти, так и из растений. Этиловый спирт используют в качестве сырья для получения резины, пластмасс, других органических соединений. Его можно получить каталитической гидратацией этилена (из нефти), либо путем ферментации отходов сахарной промышленности (как в Бразилии, где использование этанола в качестве топлива позволило улучшить экологическую ситуацию).
Стоит отдельно упомянуть полимерную промышленность. Она поглощает наибольшую часть продуктов переработки нефти в виде мономеров (стирол, акрилаты, винилхлорид, этилен). Производство синтетических волокон имеет оборот более чем 25 миллионов тонн в год. В получение поливинилхлорида вовлечено около 50 000 людей с годовым выпуском 20 миллионов тонн.
Следует так же упомянуть производство клеев, герметиков, покрытий. Например, известным суперклеем (на основе метил цианоакрилата) Вы можете приклеить почти все.
Цианоакрилат – основной компонент суперклея
Пожалуй, наиболее известным красителем является индиго, который раньше выделяли из растений, а сейчас получают синтетически. Индиго – это цвет синих джинсов. Для окраски полиэфирных волокон используются, к примеру, бензодифураноны (как дисперсол), которые придают ткани отличный красный цвет. Для окрашивания полимеров используют фталоцианины в виде комплексов с железом, или медью. Они так же находят применение в качестве компонента активного слоя CD, DVD, Blu Ray дисков. Новый класс «высокопроизводительных» красителей на основе DPP (1,4-diketopyrrolo[3,4-c]pyrroles) разработан Ciba-Geidy.
Индиго
Фотография сначала была черно-белой: галоиды серебра взаимодействуя со светом высвобождали атомы металла, которые и воспроизводили изображение. Окрашенные фотографии в цветной пленке марки Кодак возникали как следствие химической реакции между двумя бесцветными реагентами. Один из них, как правило ароматический амин:
От фотоискусства можно легко перейти в сладкую жизнь.
Подсластители, такие как классический сахар получают в огромных масштабах. Другие подсластители, как аспартам (1965) и сахарин (1879) производятся в аналогичных объемах. Аспартам представляет собой дипептид из двух натуральных аминокислот:
Фармацевтические компании производят лекарственные субстанции от многих болезней. Примером коммерчески успешного, революционного препарата является Ранитидин (от язвенной болезни) и Силденафил (Виагра, надеемся Вы в курсе кому и зачем она нужна).
Успех этих препаратов связан как с лечебной эффективностью, так и прибыльностью:
Это еще не всё. Это только начало
Ещё осталось много интересного об органической химии, поэтому обучение на кафедре ОСиНТ является приоритетным не только для любителей химии, но и для абитуриентов, которым интересен окружающий мир, которые желают расширить рамки своего восприятия и раскрыть свой потенциал.
Всё о поступлении на специальность Химические технологии и инженерияПоступлениена 1 курс
Все самое важное для абитуриента
смотрите здесь
Подробнее
Продолжение обученияПоступление на 2-4 курс, в магистратуру и аспирантуру. Все формы обучения!
Подробнее
Нашигалереи
Лучше 1 раз увидеть
Чем 100 раз услышать!
Смотрите наши фотографии
Подробнее
Вот несколько последних статей:
Говорили о том какой бывает этиловый спирт из чего его делают, как фальсифицируют и проводят анализы, и чего стоит остерегаться.…
Глицерин применение – пищевые продукты, косметика и взрывчатые вещества Читая этикетки косметических средств, мы зачастую замечаем в их составе глицерин.…
Не так давно Пепси объявила, что они больше не будут использовать подсластитель аспартам, искусственный сахарозаменитель, в диетической Пепси (на территории…
По доброй традиции встреча Нового года у большинства людей не обходится без открытой бутылки шампанского. Напиток в бокале с его…
СОСТАВ КРАСКИ ДЛЯ ВОЛОС КРАСИТЕЛИ И ПИГМЕНТЫ Сегодня, стойкая краска для волос широко используются, либо чтобы прикрыть седые волосы, либо…
Поделиться
Классификация органических реакций Вводное пособие по химии
Ключевые концепции
- Органические соединения — это, как правило, соединения, содержащие углерод (C). (1)
- Реакции, в которых принимают участие органические соединения, можно классифицировать в зависимости от того, что происходит с функциональной группой. (2)
- Основные типы реакций, в которых принимают участие органические соединения: (3) :
⚛ Реакции замещения: один атом замещает другой
⚛ Реакции присоединения: молекула добавляет по двойной связи
⚛ Реакции элиминирования
(i) Реакции дегидратации: удаление воды с образованием двойной связи
(ii) Реакции конденсации: Удаление воды при взаимодействии двух молекул
(iii) Реакции дегидрогалогенирования: отщепление галогенида водорода от молекулы с образованием двойной связи
⚛ Реакции окисления: Добавление кислорода или удаление водорода с использованием окислителя
⚛ Реакции восстановления: добавление водорода или удаление кислорода с использованием H 2 или восстановителя
⚛ Реакции полимеризации:
(i) Реакции присоединительной полимеризации: длинных цепей, образующихся при «раскрытии» двойных связей
(ii) Реакции конденсационной полимеризации: длинных цепей, образующихся при взаимодействии функциональных групп
- Важно уметь распознавать каждый тип реакции, потому что это поможет вам понять, как подойти к синтезу органического соединения.
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Реакции замещения
Алканы не вступают в реакцию с кислотами, основаниями, окислителями и восстановителями, но при правильных условиях они будут реагировать с галогенами в реакциях замещения.
В реакции замещения одна группа в молекуле заменяется другой.
Представьте, что у нас есть органическое соединение, содержащее группу с надписью X :
| H | | H | | |||
| H- | С | – | С | — х |
| | H | | H |
, которую мы реагируем с группой, помеченной как Y :
| H | | H | | |||||
| Y | + | H− | С | – | С | — х |
| | H | | H |
Y заменяет X на новый состав:
| H | | H | | H | | H | | |||||||||||
| Y | + | H− | С | – | С | — х | → | X + | H− | С | – | С | — Я | |
| | H | | H | | H | | H |
Это называется реакцией замещения, потому что новая группа Y была замещена или заменена исходной группой X .
Рассмотрим следующую химическую реакцию:
| Br- Br | + |
| → | H -Br | + |
|
Это реакция замещения, потому что атом Br заменил атом H в органической молекуле.
Алканы и галогеналканы (галогеноалканы или алкилгалогениды) могут подвергаться реакциям замещения.
В таблице ниже приведены реакции замещения, с которыми вам следует ознакомиться:
| Примеры реакций замещения | ||
|---|---|---|
| Описание | Пример | Причина классификации в качестве реакции на замену |
| алкан → галогеналкан | H 3 C − C H 3 + Br 2 → H 3 C − CH 2 Br + H Br | Атом Br заменил атом H в органической молекуле. |
| H 3 C − C H 3 + Класс 2 → H 3 C − CH 2 Класс + H Класс | Атом Cl заменил атом H в органической молекуле. | |
| галогеналкан → алканол | H 3 C − CH 2 Br + Na OH → H 3 C − CH 2 OH + Na Br | Функциональная группа OH заменила атом Br в органической молекуле. |
| галогеналкан → сложный эфир | H 3 C − CH 2 Br + CH 3 COO — Na + → CH 3 −COO− CH 2 −CH 3 + Na рублей | A CH 3 COO Группа заменила атом Br в органической молекуле. |
| галогеналкан → галогенид алканаминия | H 3 C − CH 2 Br + NH 3 → H 3 C − CH 2 NH 3 + + Br — | Функциональная группа NH 3 заменила атом Br в органической молекуле. |
| галогеналкан → алканнитрил | H 3 C − CH 2 Br + K CN → H 3 C − CH 2 CN + K Br | Функциональная группа CN заменила атом Br в органической молекуле. |
Реакции сложения
В реакции присоединения молекула «добавляет» через двойную связь в органической молекуле.
Промышленный этанол (CH 3 CH 2 OH), например, получают из этена (CH 2 = CH 2 ), продукта нефтяной промышленности, в реакции присоединения.
Представьте себе следующую ненасыщенную органическую молекулу (ненасыщенную, потому что она содержит двойную связь между 2 атомами углерода, C = C ):
| H | H | |||
| \ | / | |||
| С = С | ||||
| / | \ | |||
| H | H |
Если мы прореагируем это с реагентом X — Y так, чтобы мы разорвали двойную связь ( C = C ) и образовали две новые ковалентные связи ( C — X и C — Y ), то это реакция присоединения, как показано ниже:
| + X — Y → |
|
Обратите внимание, что исходный углеводород был изменен с ненасыщенного алкена на насыщенный алкан.
Рассмотрим следующую химическую реакцию ненасыщенной органической молекулы с Br 2 (представленной ниже как Br-Br):
| + руб. — руб. → |
|
Это реакция присоединения, потому что Br 2 ( Br — Br ) «добавлен» по двойной связи ( C = C ).
Двойная связь ( C = C ) стала одинарной связью ( C-C ).
Один из этих атомов углерода образовал новую ковалентную связь с одним атомом Br ( C -Br ), а другой атом углерода образовал новую ковалентную связь с другим атомом Br ( C -Br ).
В таблице ниже приведены реакции присоединения, с которыми вам следует ознакомиться:
| Примеры реакций присоединения | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция добавления |
| алкен → дигалогеналкан | H 2 C = C H 2 + Br 2 → Br H 2 C − C H 2 Br | Br 2 добавлено по двойной связи ( C = C ) |
| алкен → галогеналкан | H 2 C = C H 2 + H — Br → H 3 C − C H 2 Br | H Br добавлено по двойной связи ( C = C ) |
| алкен → алканол | H 2 C = C H 2 + H — OH → H 3 C − C H 2 OH | Вода, H 2 O, H — OH , добавлено по двойной связи ( C = C ) |
Реакция исключения
В реакции элиминирования малая молекула удаляется, то есть удаляется из реагента (или реагентов) во время химической реакции.
Мы рассмотрим 3 различных типа реакции элиминирования:
- Реакции дегидратации: насыщенная молекула реагирует с дегидратирующим агентом с образованием ненасыщенной молекулы и воды.
- Реакции конденсации: функциональная группа одного органического реагента реагирует с функциональной группой другой органической молекулы с образованием нового соединения и воды.
- Реакции дегидрогалогенирования: галогенид водорода удаляется из насыщенного галогеналкана с образованием одного или нескольких ненасыщенных органических продуктов.
Реакции обезвоживания
Реакция дегидратации преобразует насыщенную органическую молекулу в ненасыщенную молекулу путем устранения или удаления молекулы воды.
Рассмотрим реакцию, показанную ниже:
| → |
| + | |||||||||||||||||||||||||||||||||||||||||
Это реакция дегидратации, тип реакции элиминирования, потому что небольшая молекула, вода (H 2 O), была удалена из насыщенной органической молекулы ( C-C ) с образованием ненасыщенной молекулы, молекулы который содержит двойную связь ( C = C ).
| Примеры реакций дегидратации | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция исключения |
| Обезвоживание спиртов | C H 3 −CH 2 OH → H 2 C = C H 2 + H 2 O | Атом H и функциональная группа OH были удалены из молекулы, что привело к образованию двойной связи ( C = C ) |
Реакции конденсации
В реакции конденсации функциональная группа одной органической молекулы реагирует с функциональной группой другой органической молекулы с образованием новой органической молекулы и воды (H 2 O).
Реакции конденсации важны по своей природе. Дисахариды, такие как сахароза (столовый сахар), образуются, когда моносахариды вступают в реакцию конденсации.
Реакции конденсации также могут быть использованы для получения сложных эфиров, одной из групп соединений, составляющих запах и вкус пищи.
Рассмотрим реакцию ниже, в которой реагируют 2 молекулы с разными функциональными группами:
| + |
| → |
| + |
Это реакция конденсации, тип реакции элиминирования, потому что функциональная группа O H одной молекулы прореагировала с функциональной группой CO OH другой молекулы с образованием нового органического соединения и молекулы воды ( H 2 O).
В таблице ниже приведены некоторые реакции конденсации, с которыми вам следует ознакомиться.
| Примеры реакций конденсации | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция исключения |
| алкановая кислота + алканол | CH 3 −CO OH + H OCH 2 −CH 3 → CH 3 −COOCH 2 −CH 3 + H 2 O | Атом H из функциональной группы OH одной молекулы и OH из функциональной группы COOH другой молекулы были удалены, когда две молекулы соединяются вместе и образуется молекула воды. |
| аминокислоты → дипептиды | H 2 N-R-CO OH + H 2 N-R’-COOH → H 2 N-R-CO-NH-R’-COOH + H 2 O | Атом H из функциональной группы NH 2 одной молекулы и OH из функциональной группы COOH другой молекулы были удалены, когда две молекулы соединяются вместе и образуется молекула воды. |
| моносахариды → дисахариды | Атом Н из функциональной группы ОН одной молекулы и ОН из функциональной группы ОН другой молекулы были удалены, когда две молекулы соединяются вместе и образуется молекула воды. | |
Реакции дегидрогалогенирования
В реакции дегидрогалогенирования галогенид водорода (HX) удаляется из насыщенного галогеналкана с образованием новых ненасыщенных органических продуктов.
Например, хлористый водород может быть удален из 2-хлорпропана с образованием проп-1-ена:
| → |
| + HCl |
| Примеры реакций дегидрогалогенирования | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция исключения |
| галогеналкан → алкен | CH 3 −CH Cl −CH 3 → CH 2 = CH-CH 3 + H Cl | Атом H из метильной группы (CH 3 ) и функциональная группа Cl были удалены, удалены из молекулы в виде молекулы хлористого водорода, HCl. |
Реакции окисления
Реакции окисления — основная причина того, что еда «портится», вино превращается в уксус, а масло прогоркает.
Общее практическое правило для органических реакций состоит в том, что реакция окисления произошла, если: (4)
- К органическому реагенту добавлено
- атомов кислорода с образованием продукта
- атомов водорода с образованием продукта
или
Из органического реагента было удалено Обычно неорганический окислитель, такой как перманганат калия (KMnO 4 ) или дихромат калия (K 2 Cr 2 O 7 ), используется для окисления органической молекулы.
Присутствие окислителя может быть указано с помощью символа O в квадратных скобках [O] над стрелкой, показывающей направление реакции (→).
Рассмотрим следующую химическую реакцию:
| [O] → |
| ||||||||||||||||||||||||||||||||||||||||||
Это пример реакции окисления, потому что окислитель [O] вызвал увеличение количества атомов O в органическом продукте по сравнению с молекулой органического реагента.
В молекуле реагента 1 атом О, но в молекуле продукта 2 атома О.
Рассмотрим следующую химическую реакцию:
| [O] → |
| ||||||||||||||||||||||||||||||||||||||||||
Эта реакция является реакцией окисления, потому что окислитель [O] вызвал удаление 2 атомов H из молекулы реагента с образованием молекулы продукта.
В молекуле реагента 8 атомов H, но только 6 атомов H в молекуле продукта.
В таблице ниже приведены некоторые реакции окисления, с которыми вам следует ознакомиться.
| Примеры реакций окисления | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция окисления |
| алкен → алкандиолы | H 2 C = CH 2 → CH 2 O H − CH 2 O H | 2 O атомов были добавлены к молекуле реагента с образованием продукта. |
| 1 ° алканол → алканал | H 3 C − C H 2 O H → H 3 C − CHO | 2 H атомов были потеряны из молекулы реагента с образованием молекулы продукта. |
| алканаль → алкановая кислота | H 3 C − CHO → H 3 C − C O OH | Атом O был добавлен к молекуле реагента с образованием молекулы продукта. |
| 2 ° алканол → алканон | H 3 C − C H O H −CH 3 → H 3 C − CO − CH 3 | 2 H атомов были потеряны из молекулы реагента с образованием молекулы продукта. |
Реакция восстановления
Общее практическое правило для органических реакций состоит в том, что реакция восстановления произошла, если: (5)
- К органическому реагенту добавлено
- атомов водорода с образованием продукта
- атомов кислорода с образованием продукта
или
Из органического реагента было удалено Обычно для восстановления органической молекулы используют газообразный водород (H 2 ) или неорганический восстановитель.Мы можем использовать H в квадратных скобках, [H], над стрелкой, указывающей направление реакции (→), чтобы обозначить использование восстановителя.
Когда используется газообразный водород (с катализатором), реакцию обычно называют реакцией гидрирования.
В лаборатории реакции восстановления полезны, если вы хотите синтезировать амин.
Рассмотрим следующую реакцию:
| [В] → |
|
Это реакция восстановления, потому что восстановитель вызвал добавление 2 атомов H к молекуле реагента.
В молекуле реагента 4 атома H, в молекуле продукта 6 атомов H.
Рассмотрим химическую реакцию ниже:
| [В] → |
|
Это реакция восстановления, потому что O было удалено и 2 H атомов были добавлены к молекуле реагента с образованием продукта.
Молекула реагента содержит 2 атома О и 4 атома Н, молекула продукта — 1 атом О и 6 атомов Н.
В таблице ниже приведены некоторые реакции восстановления, с которыми вам следует ознакомиться.
| Примеры реакций восстановления | ||
|---|---|---|
| Описание | Пример | Причина отнесения к категории редукционной реакции |
| алкен → алкан | H 2 C = CH 2 → H 3 C − CH 3 | 2 H-атомов были добавлены к молекуле реагента с образованием молекулы продукта. |
| алканаль → алкан-1-ол | H 3 C − CHO → H 3 C − CH 2 OH | 2 H-атомов были добавлены к молекуле реагента с образованием молекулы продукта. |
| алкан-н-он → алкан-н-ол | H 3 C − CO − CH 3 → H 3 C − CHOH − CH 3 | 2 H-атомов были добавлены к молекуле реагента с образованием молекулы продукта. |
| алканнитрил → алканамин | H 3 C − C≡N → H 3 C − CH 2 −NH 2 | 4 атома H были добавлены к молекуле реагента с образованием молекулы продукта. |
Реакции полимеризации
Реакции полимеризации важны, потому что производимые продукты (полимеры) используются для производства синтетических волокон, таких как нейлон и полиэстер, и пластиков, таких как полиэтилен (полиэтилен) и политетрафторэтилен (Teflon ™).
В реакции полимеризации молекулы с небольшим числом атомов углерода (мономеры) реагируют с образованием длинных цепочек атомов углерода (полимеров).
Существует 2 типа реакций полимерации:
- Реакции аддитивной полимеризации
- Реакции конденсационной полимеризации
Реакции присоединения и полимеризации
Аддитивная полимеризация — важный промышленный процесс, поскольку он используется для производства полимеров, присутствующих в «пластмассах».Эти полимеры включают полиэтилен, поливинилхлорид (ПВХ), полипропилен, полистирол, политетрафторэтен (тефлон), полиакрилонитрил и поливинилацетат.
В реакции аддитивной полимеризации молекула реагента (мономер) является ненасыщенной (содержит двойную связь, C = C ).
Эта двойная связь «открывается», так что эта молекула может ковалентно связываться с другой молекулой, которая сама может связываться с другой молекулой, и так далее.Таким способом можно получить длинные цепочки из ковалентно связанных атомов углерода.
Эта длинная цепочка атомов углерода называется полимером.
Рассмотрим следующую реакцию полимеризации с участием мономеров H 2 C = CH 2 .
— указывает, что цепочка продолжается в том же порядке.
| → |
|
Это полимеризация, потому что маленькие молекулы соединились, чтобы произвести чрезвычайно длинные цепочки атомов углерода.
Это аддитивная полимеризация, потому что двойная связь в молекуле реагента, C = C , «раскрылась», позволяя другим небольшим молекулам «присоединяться» к растущей цепи.
В таблице ниже приведены некоторые реакции аддитивной полимеризации, с которыми вам следует ознакомиться.
| Примеры реакций присоединительной полимеризации | ||
|---|---|---|
| Описание | Пример | Причина классификации как реакция присоединительной полимеризации |
| алкен → полиалкен | nCH 2 = CH 2 → | C = C двойная связь в каждой молекуле CH 2 = CH 2 открылась, чтобы позволить им соединиться вместе с образованием длинной цепи. |
| галогеналкен → полигалогеналкен | nCH 2 = CHCl → | C = C двойная связь в каждой молекуле CH 2 = молекула CHCl открылась, чтобы позволить им соединиться вместе с образованием длинной цепи. |
| тетрагалогеналкен → политетрагалогеналкен | nCF 2 = CF 2 → | C = C двойная связь в каждой молекуле CF 2 = CF 2 открылась, чтобы позволить им соединиться вместе с образованием длинной цепи. |
Реакции конденсационной полимеризации
Реакции конденсационной полимеризации важны по своей природе. Белки — это полимеры, образующиеся, когда мономеры аминокислот вступают в реакцию конденсационной полимеризации. Полисахариды, такие как крахмал и целлюлоза, образуются, когда моносахаридные мономеры реагируют в реакциях конденсационной полимеризации.
В реакции конденсационной полимеризации каждая небольшая молекула мономера имеет 2 функциональные группы, давайте назовем их X и Y :
| H | | H | | |||
| X- | С | – | С | −Y |
| | H | | H |
Давайте представим, что каждая функциональная группа X может реагировать с функциональной группой Y , так что молекула X Y удаляется, и две органические молекулы соединяются вместе:
| + |
| → |
| + | X — Y |
Но функциональная группа X в этой новой цепи может реагировать с функциональной группой Y мономера или другой новой цепи.
И функциональная группа Y в этой цепи может реагировать с функциональной группой X мономера или другой цепи.
Итак, легко увидеть, как можно производить очень длинные полимеры.
Если удаляемая небольшая молекула представляет собой молекулу воды, то есть если X — Y представляет собой H 2 O, то это будет называться реакцией конденсационной полимеризации.
| Примеры реакций конденсационной полимеризации | ||||||
|---|---|---|---|---|---|---|
| Описание | Пример | Причина классификации как реакция конденсационной полимеризации | ||||
| дикарбоновая кислота + диол → полиэфир | HOOC-R-COOH + CH 2 OH-R’-CH 2 OH → | Функциональная группа COOH одной молекулы реагирует с функциональной группой OH другой молекулы с образованием нового продукта и молекулы воды.Затем новая органическая молекула может реагировать либо с функциональными группами другого мономера, либо с новой цепью, так что цепь продолжает расти (полимеризоваться). | ||||
| дикарбоновая кислота + диамин → полиамид | HOOC-R-COOH + NH 2 -R’-NH 2 → | Функциональная группа COOH одной молекулы реагирует с функциональной группой NH 2 другой молекулы с образованием нового органического продукта и молекулы воды.Функциональные группы этого нового продукта могут реагировать с функциональными группами мономера или молекулы нового продукта с образованием более длинных цепочек атомов углерода. | ||||
| моносахариды → полисахариды |
| Атом Н из функциональной группы ОН одной молекулы и ОН из функциональной группы ОН другой молекулы были удалены, когда две молекулы соединяются вместе и образуется молекула воды. | ||||
| аминокислоты → белки | H 2 NR-CO OH + H 2 N-R’-COOH → | Атом H из функциональной группы NH 2 одной молекулы и OH из функциональной группы COOH другой молекулы были удалены, когда две молекулы соединяются вместе и образуется молекула воды.Дальнейшие реакции между этими двумя функциональными группами на разных молекулах производят все более и более длинные цепи. | ||||
(1) Это общее определение органических соединений. Существует множество соединений, содержащих углерод, которые обычно классифицируются как неорганические, а не как органические, например, диоксид углерода (CO 2 ) и монооксид углерода (CO), а также карбонат-ионные и карбонатные соединения (CO 3 2 — ), даже цианистый водород (HCN) и цианистые соли (CN — ).
(2) Эти реакции могут быть дополнительно подразделены на подклассы в зависимости от природы атакующего агента, то есть электрофильного он или нуклеофильного, но, поскольку это обычно не рассматривается в химии в средней школе в Австралии, мы проигнорируем это.
(3) Другой тип органической реакции — это перегруппировка, но она редко рассматривается в старшей школе, поэтому мы ее проигнорируем.
(4) Более точное описание реакции окисления состоит в том, что использование окислителя вызывает увеличение электровалентности углерода в органической молекуле.
(5) Более точное описание реакции восстановления состоит в том, что использование восстанавливающего агента или каталитического гидрирования вызывает снижение электровалентности углерода в органической молекуле.
Классификация химических реакций
Химические реакции, которые мы описали, представляют собой лишь небольшую часть бесконечного числа возможных химических реакций. Как химики справляются с таким огромным разнообразием? Как они предсказывают, какие соединения будут реагировать друг с другом и какие продукты будут образовываться? Ключ к успеху — найти полезные способы категоризации реакций.Знакомство с несколькими основными типами реакций поможет вам предсказать продукты, которые образуются при контакте определенных видов соединений или элементов.
Большинство химических реакций можно разделить на один или несколько из пяти основных типов: кислотно-основные реакции, реакция общей формы кислота + основание → соль., Реакции обмена, химическая реакция, имеющая общую форму AB + C → AC + B или AB + CD → AD + CB., Реакции конденсации Химическая реакция, имеющая общий вид A + B → AB.Реакции конденсации противоположны реакциям расщепления. Некоторые, но не все, реакции конденсации также являются реакциями окисления и восстановления. (и наоборот, реакции расщепления — химическая реакция, которая имеет общую форму AB → A + B. Реакции расщепления являются обратными реакциям конденсации.), и реакции окисления-восстановления — химическая реакция, которая демонстрирует изменение степени окисления одного или нескольких элементы в реагентах, которые имеют общую форму окислитель + восстановитель → восстановленный окислитель + окисленный восстановитель.. Общие формы этих пяти типов реакций сведены в Таблицу 3.1 «Основные типы химических реакций» вместе с примерами каждого из них. Однако важно отметить, что многие реакции могут быть отнесены к более чем одной классификации, как вы увидите в нашем обсуждении. Схема классификации предназначена только для удобства; одну и ту же реакцию можно классифицировать по-разному, в зависимости от того, какая из ее характеристик наиболее важна. В этом разделе обсуждаются реакции окисления-восстановления, в которых происходит чистый перенос электронов от одного атома к другому, и реакции конденсации.Кислотно-основные реакции и один вид реакции обмена — образование нерастворимой соли, такой как сульфат бария, когда растворы двух растворимых солей смешиваются вместе, — будут обсуждаться в главе 4 «Реакции в водном растворе».
Реакции окисления-восстановления
Термин окисление: Потеря одного или нескольких электронов в химической реакции. Говорят, что вещество, теряющее электроны, окисляется. впервые был использован для описания реакций, в которых металлы реагируют с кислородом воздуха с образованием оксидов металлов.Когда железо подвергается воздействию воздуха в присутствии воды, например, железо превращается в ржавчину — оксид железа. При контакте с воздухом металлический алюминий образует на своей поверхности непрерывный, когерентный, прозрачный слой оксида алюминия. В обоих случаях металл приобретает положительный заряд, передавая электроны нейтральным атомам кислорода молекулы кислорода. В результате атомы кислорода приобретают отрицательный заряд и образуют оксидные ионы (O 2-). Поскольку металлы потеряли электроны из-за кислорода, они окислились ; окисление, следовательно, потеря электронов.И наоборот, поскольку атомы кислорода получили электроны, они были уменьшены на , на , поэтому уменьшение — это получение электронов. Для каждого окисления должно быть соответствующее восстановление.
Обратите внимание на узор
Любое окисление должно сопровождаться восстановлением и наоборот.
Первоначально термин «уменьшение» — усиление одного или нескольких электронов в химической реакции. Говорят, что вещество, которое получает электроны, восстанавливается.относится к уменьшению массы, наблюдаемому при нагревании оксида металла с оксидом углерода, реакцией, которая широко использовалась для извлечения металлов из их руд. Например, когда твердый оксид меди (I) нагревается водородом, его масса уменьшается, поскольку образование чистой меди сопровождается потерей атомов кислорода в виде летучего продукта (воды). Реакция следующая:
Уравнение 3,24
Cu 2 O (тв) + H 2 (г) → 2Cu (тв) + H 2 O (г)Реакции окисления и восстановления теперь определяются как реакции, которые демонстрируют изменение степени окисления одного или нескольких элементов в реагентах, что следует за мнемоническим кодом : окисление — это уменьшение потерь — это прирост или нефтяная вышка .Степень окисления — заряд, который был бы у каждого атома в соединении, если бы все его связывающие электроны были перенесены на атом с большим притяжением для электронов. каждого атома в соединении — это заряд, который имел бы атом, если бы все его связывающие электроны были перенесены на атом с более сильным притяжением электронов. Атомам в их элементарной форме, такой как O 2 или H 2 , приписывается нулевая степень окисления. Например, реакция алюминия с кислородом с образованием оксида алюминия составляет
Уравнение 3.25
4Al (т) + 3O 2 (г) → 2Al 2 O 3 (т)Каждый нейтральный атом кислорода получает два электрона и становится отрицательно заряженным, образуя ион оксида; таким образом, кислород в продукте имеет степень окисления -2 и был восстановлен. Каждый нейтральный атом алюминия теряет три электрона, чтобы произвести в продукте ион алюминия со степенью окисления +3, поэтому алюминий был окислен. При образовании Al 2 O 3 электроны переносятся следующим образом (верхний индекс 0 подчеркивает степень окисления элементов):
Уравнение 3.26
4Al 0 + 3O 2 0 → 4Al 3+ + 6O 2−Уравнение 3.24 и уравнение 3.25 являются примерами окислительно-восстановительных (окислительно-восстановительных) реакций. В окислительно-восстановительных реакциях происходит чистый перенос электронов от одного реагента к другому. В любой окислительно-восстановительной реакции общее количество потерянных электронов должно равняться общему количеству полученных электронов, чтобы сохранить электрическую нейтральность. В уравнении 3.26, например, общее количество электронов, потерянных алюминием, равно общему количеству электронов, приобретенных кислородом:
Уравнение 3.27
потеря электронов = 4 атома Al × 3 e− потерянный атом Al = 12 e− потерянных электронов = 6 атомов O × 2 e− полученный атом O = 12 e− полученныйТа же самая картина наблюдается во всех реакциях окисления-восстановления: количество потерянных электронов должно равняться количеству полученных электронов.
Дополнительный пример окислительно-восстановительной реакции, реакции металлического натрия с кислородом воздуха, показан на Рисунке 3.1 «Образцы из 1 моля некоторых обычных веществ».
Обратите внимание на узор
Во всех окислительно-восстановительных (окислительно-восстановительных) реакциях количество потерянных электронов равно количеству полученных электронов.
Назначение состояний окисления
Приписать элементам в бинарных ионных соединениях степени окисления несложно: степени окисления элементов идентичны зарядам одноатомных ионов. В главе 2 «Молекулы, ионы и химические формулы» вы узнали, как предсказывать формулы простых ионных соединений на основе знака и величины заряда одноатомных ионов, образованных нейтральными элементами. Примерами таких соединений являются хлорид натрия (NaCl; Рисунок 3.13 «Реакция нейтрального атома натрия с нейтральным атомом хлора»), оксидом магния (MgO) и хлоридом кальция (CaCl 2 ). В ковалентных соединениях, напротив, у атомов общие электроны. Состояния окисления в ковалентных соединениях в некоторой степени произвольны, но они являются полезными учетными приборами, помогающими понять и предсказать многие реакции.
Рис. 3.13 Реакция нейтрального атома натрия с нейтральным атомом хлора
Результат — перенос одного электрона от натрия к хлору с образованием ионного соединения NaCl.
Ниже приводится набор правил для присвоения степени окисления атомам в химических соединениях. Поскольку мы обсуждаем атомную и молекулярную структуру в главе 6 «Структура атомов», главе 7 «Периодическая таблица и периодические тенденции», главе 8 «Ионная и ковалентная связь» и главе 9 «Молекулярная геометрия и модели ковалентной связи», принципы, лежащие в основе этих правил, будут описаны более подробно.
Правила определения состояний окисления
- Степень окисления атома любого чистого элемента, будь то одноатомный, двухатомный или многоатомный, равна нулю.
- Степень окисления одноатомного иона такая же, как и его заряд — например, Na + = +1, Cl — = -1.
- Степень окисления фтора в химических соединениях всегда -1. Другие галогены также обычно имеют степень окисления -1, за исключением комбинации с кислородом или другими галогенами.
- Водороду присвоена степень окисления +1 в его соединениях с неметаллами и -1 в его соединениях с металлами.
- Кислороду обычно присваивается степень окисления -2 в соединениях, за двумя исключениями: в соединениях, которые содержат связи кислород-фтор или кислород-кислород, степень окисления кислорода определяется степенями окисления других присутствующих элементов.
- Сумма степеней окисления всех атомов в нейтральной молекуле или ионе должна равняться заряду молекулы или иона.
В любой химической реакции чистый заряд должен сохраняться; то есть в химической реакции общее количество электронов постоянно, как и общее количество атомов.В соответствии с этим, правило 1 гласит, что сумма индивидуальных степеней окисления атомов в молекуле или ионе должна равняться чистому заряду этой молекулы или иона. В NaCl, например, Na имеет степень окисления +1, а Cl равен -1. Чистая плата равна нулю, как и должно быть для любого соединения.
Правило 3 требуется, потому что фтор притягивает электроны сильнее, чем любой другой элемент, по причинам, которые вы узнаете в главе 6 «Строение атомов». Следовательно, фтор является эталоном для расчета степени окисления других атомов в химических соединениях.Правило 4 отражает разницу в химии, наблюдаемую для соединений водорода с неметаллами (такими как хлор), в отличие от соединений водорода с металлами (такими как натрий). Например, NaH содержит ион H —, тогда как HCl образует ионы H + и Cl — при растворении в воде. Правило 5 необходимо, потому что фтор имеет большее притяжение для электронов, чем кислород; это правило также предотвращает нарушение правила 2. Таким образом, степень окисления кислорода составляет +2 в OF 2 , но −½ в KO 2 .Обратите внимание, что степень окисления –½ для O в KO 2 вполне приемлема.
Восстановление оксида меди (I), показанное в уравнении 3.28, демонстрирует, как применять эти правила. Правило 1 гласит, что атомы в их элементарной форме имеют нулевую степень окисления, что применимо к H 2 и Cu. Согласно правилу 4 водород в H 2 O имеет степень окисления +1, а согласно правилу 5 кислород как в Cu 2 O, так и в H 2 O имеет степень окисления -2.Правило 6 гласит, что сумма степеней окисления в молекуле или формульной единице должна равняться чистому заряду этого соединения. Это означает, что каждый атом Cu в Cu 2 O должен иметь заряд +1: 2 (+1) + (−2) = 0. Таким образом, степени окисления следующие:
Уравнение 3,28
Cu2 + 1O – 2 (т) + h30 (г) → 2Cu0 (т) + h3 + 1O – 2 (г)Присвоение степеней окисления позволяет нам увидеть, что произошел чистый перенос электронов от водорода (0 → +1) к меди (+1 → 0).Итак, это окислительно-восстановительная реакция. Еще раз, количество потерянных электронов равно количеству полученных электронов, и есть чистое сохранение заряда:
Уравнение 3,29
потеря электронов = 2 атома H × 1 e — потерянный атом H = 2 e — потерянные электроны приобретены = 2 атома Cu × 1 e — получено, атом Cu = 2 e — полученоПомните, что степени окисления полезны для визуализации переноса электронов в окислительно-восстановительных реакциях, но степень окисления атома и его фактический заряд одинаковы только для простых ионных соединений.Состояния окисления — удобный способ отнесения электронов к атомам, и они полезны для предсказания типов реакций, которым подвергаются вещества.
Пример 14
Назначьте степени окисления всем атомам в каждом соединении.
- гексафторид серы (SF 6 )
- метанол (CH 3 OH)
- сульфат аммония [(NH 4 ) 2 SO 4 ]
- магнетит (Fe 3 O 4 )
- этановая (уксусная) кислота (CH 3 CO 2 H)
Дано: Молекулярная или эмпирическая формула
Запрошено: степеней окисления
Стратегия:
Начните с атомов, степень окисления которых можно однозначно определить из представленных правил (например, фтор, другие галогены, кислород и одноатомные ионы).Затем определите степени окисления других присутствующих атомов в соответствии с правилом 1.
Решение:
Мы знаем из правила 3, что фтор всегда имеет степень окисления -1 в своих соединениях. Шесть атомов фтора в гексафториде серы дают общий отрицательный заряд -6. Поскольку правило 1 требует, чтобы сумма степеней окисления всех атомов в нейтральной молекуле была равна нулю (здесь SF 6 ), степень окисления серы должна быть +6:
[(6 атомов F) (- 1)] + [(1 атом S) (+6)] = 0Согласно правилам 4 и 5, водород и кислород имеют степени окисления +1 и -2 соответственно.Поскольку метанол не имеет чистого заряда, углерод должен иметь степень окисления -2:
. [(4 атома H) (+ 1)] + [(1 атом O) (- 2)] + [(1 атом C) (- 2)] = 0Обратите внимание, что (NH 4 ) 2 SO 4 представляет собой ионное соединение, которое состоит как из многоатомного катиона (NH 4 + ), так и из многоатомного аниона (SO 4 2−) (см. Таблицу 2.4 «Общие многоатомные ионы и их названия»). Мы присваиваем степени окисления атомам в каждом многоатомном ионе отдельно. Для NH 4 + водород имеет степень окисления +1 (правило 4), поэтому азот должен иметь степень окисления −3:
. [(4 атома H) (+ 1)] + [(1 атом N) (- 3)] = +1, заряд на ионе NH 4 +Для SO 4 2− кислород имеет степень окисления -2 (правило 5), поэтому сера должна иметь степень окисления +6:
[(4 атома O) (−2)] + [(1 атом S) (+ 6)] = −2, заряд сульфат-ионаКислород имеет степень окисления -2 (правило 5), что дает общий заряд -8 на формульную единицу.Это должно быть уравновешено положительным зарядом на трех атомах железа, что дает степень окисления железа +8/3:
[(4 атома O) (- 2)] + [(3 атома Fe) (+ 83)] = 0Дробные степени окисления разрешены, потому что степени окисления — это несколько произвольный способ отслеживания электронов. Фактически, Fe 3 O 4 можно рассматривать как имеющий два иона Fe 3+ и один ион Fe 2+ на формульную единицу, что дает чистый положительный заряд +8 на формульную единицу.Fe 3 O 4 представляет собой магнитную железную руду, обычно называемую магнетитом. В древние времена магнетит был известен как магнитный камень, потому что его можно было использовать для изготовления примитивных компасов, указывающих на Полярную звезду (Полярную звезду), которую называли «путеводной звездой».
Первоначально мы приписываем степени окисления компонентам CH 3 CO 2 H так же, как и любому другому соединению.Водород и кислород имеют степени окисления +1 и -2 (правила 4 и 5 соответственно), в результате чего общий заряд водорода и кислорода составляет
. [(4 атома H) (+ 1)] + [(2 атома O) (- 2)] = 0Значит, степень окисления углерода также должна быть нулевой (правило 6). Это, однако, средняя степень окисления для двух присутствующих атомов углерода. Поскольку каждый атом углерода имеет разный набор связанных с ним атомов, они, вероятно, будут иметь разные степени окисления.Чтобы определить степени окисления отдельных атомов углерода, мы используем те же правила, что и раньше, но с дополнительным предположением, что связи между атомами одного и того же элемента не влияют на степени окисления этих атомов. Атом углерода метильной группы (-CH 3 ) связан с тремя атомами водорода и одним атомом углерода. Из правила 4 мы знаем, что водород имеет степень окисления +1, и мы только что сказали, что связь углерод-углерод можно не учитывать при вычислении степени окисления атома углерода.Чтобы метильная группа была электрически нейтральной, ее атом углерода должен иметь степень окисления -3. Точно так же атом углерода группы карбоновой кислоты (-CO 2 H) связан с одним атомом углерода и двумя атомами кислорода. Снова игнорируя связанный атом углерода, мы приписываем степени окисления -2 и +1 атомам кислорода и водорода соответственно, что приводит к общему заряду
[(2 атома O) (- 2)] + [(1 атом H) (+ 1)] = −3Чтобы получить электрически нейтральную группу карбоновой кислоты, заряд этого углерода должен быть +3.Таким образом, степени окисления отдельных атомов в уксусной кислоте равны
. С − 3h4 + 1C + 3O2−2H + 1Таким образом, сумма степеней окисления двух атомов углерода действительно равна нулю.
Упражнение
Назначьте степени окисления всем атомам в каждом соединении.
- фторид бария (BaF 2 )
- формальдегид (CH 2 O)
- дихромат калия (K 2 Cr 2 O 7 )
- оксид цезия (CsO 2 )
- этанол (CH 3 CH 2 OH)
Ответ:
- Ba, +2; F, −1
- С, 0; H, +1; О, −2
- К, +1; Cr, +6; О, −2
- Cs, +1; O, −½
- ° С, -3; H, +1; С, -1; H, +1; О, -2; H, +1
Окислители и восстановители
Соединения, способные принимать электроны, такие как O 2 или F 2 , называются окислителями (или окислителями). Соединение, способное принимать электроны; таким образом он сокращается.потому что они могут окислять другие соединения. В процессе приема электронов окислитель восстанавливается. Соединения, которые способны отдавать электроны, такие как металлический натрий или циклогексан (C 6 H 12 ), называются восстановителями (или восстановителями). Соединение, которое способно отдавать электроны; таким образом он окисляется. потому что они могут вызвать сокращение другого соединения. В процессе передачи электронов восстановитель окисляется. Эти отношения суммированы в уравнении 3.30:
Уравнение 3.30
окислитель + восстановитель → окисление-восстановление O2 (г) получает e– (восстанавливается) + 4Na (s) теряет e– (окисляется) → 2Na2O (s) окислительно-восстановительная реакцияНекоторые окислители обладают большей способностью, чем другие, удалять электроны из других соединений. Окислители могут варьироваться от очень сильных, способных окислять большинство соединений, с которыми они контактируют, до довольно слабых.И F 2 , и Cl 2 являются мощными окислителями: например, F 2 окисляет H 2 O в бурной, потенциально взрывоопасной реакции. Напротив, S 8 является довольно слабым окислителем, а O 2 находится где-то посередине. И наоборот, восстановители различаются по своей склонности отдавать электроны другим соединениям. Восстановители также могут варьироваться от очень мощных, способных отдавать электроны почти всем, до слабых. Щелочные металлы являются мощными восстановителями, поэтому их следует хранить вдали от кислорода воздуха, чтобы избежать потенциально опасной окислительно-восстановительной реакции.
Реакция горения Реакция окисления-восстановления, в которой окислителем является O2., Впервые введенная в разделе 3.2 «Определение эмпирических и молекулярных формул», представляет собой реакцию окисления-восстановления, в которой окислителем является O 2 . Одним из примеров реакции горения является горение свечи, показанное на Рисунке 3.9 «Пример реакции горения». Рассмотрим, например, сжигание циклогексана, типичного углеводорода, в избытке кислорода. Сбалансированное химическое уравнение реакции со степенью окисления для каждого атома выглядит следующим образом:
Уравнение 3.31
C6–2h22 + 1 + 9O20 → 6C + 4O2–2 + 6h3 + 1O – 2Если мы сравним степень окисления каждого элемента в продуктах и реагентах, мы увидим, что водород — единственный элемент, степень окисления которого не изменяется; остается +1. Углерод, однако, имеет степень окисления -2 в циклогексане и +4 в CO 2 ; то есть каждый атом углерода меняет свою степень окисления на шесть электронов во время реакции. Кислород имеет степень окисления 0 в реагентах, но он получает электроны, чтобы иметь степень окисления -2 в CO 2 и H 2 O.Поскольку углерод был окислен, восстановителем является циклогексан; поскольку кислород был восстановлен, он является окислителем. Таким образом, все реакции горения являются реакциями окисления и восстановления.
Реакции конденсации
Реакция брома с этиленом с образованием 1,2-дибромэтана, который используется в сельском хозяйстве для уничтожения нематод в почве, выглядит следующим образом:
Уравнение 3.32
C 2 H 4 (г) + Br 2 (г) → BrCH 2 CH 2 Br (г)Согласно таблице 3.1 «Основные типы химических реакций», это реакция конденсации, потому что она имеет общий вид A + B → AB. Эта реакция, однако, также может рассматриваться как реакция окисления-восстановления, в которой электроны передаются от углерода (-2 → -1) к брому (0 → -1). Другой пример реакции конденсации — реакция, используемая для промышленного синтеза аммиака:
Уравнение 3.33
3H 2 (г) + N 2 (г) → 2NH 3 (г)Хотя эта реакция также имеет общую форму реакции конденсации, водород был окислен (0 → +1), а азот восстановлен (0 → −3), поэтому ее также можно классифицировать как реакцию окисления-восстановления.
Не все реакции конденсации являются окислительно-восстановительными. Например, реакция амина с карбоновой кислотой представляет собой вариант реакции конденсации (A + B → A′B ′ + C): два больших фрагмента конденсируются с образованием одной молекулы, а молекула гораздо меньшего размера, такая как как H 2 O, исключено. В этой реакции -OH из группы карбоновой кислоты и -H из аминогруппы удаляются как H 2 O, и реакция образует амидную связь (также называемую пептидной связью ), которая связывает две фрагменты.Амидные связи являются важной структурной единицей, связывающей строительные блоки белков и многих полимеров вместе, как описано в главе 12 «Твердые тела». Например, нейлон получают в результате реакции конденсации (рис. 3.14 «Производство нейлона»).
Амидные связи. Реакция амина с карбоновой кислотой протекает путем удаления воды и образования новой C – N (амидной) связи.
Рисунок 3.14 Производство нейлона
Пример 15
Следующие ниже реакции имеют важное промышленное применение.Используя таблицу 3.1 «Основные типы химических реакций», классифицируйте каждую реакцию как реакцию окисления-восстановления, кислотно-щелочную реакцию, реакцию обмена, реакцию конденсации или реакцию расщепления. Для каждой окислительно-восстановительной реакции укажите окислитель и восстановитель и укажите, какие атомы окисляются или восстанавливаются. (Не забывайте, что некоторые реакции можно отнести к нескольким категориям.)
- C 2 H 4 (г) + Cl 2 (г) → ClCH 2 CH 2 Cl (г)
- AgNO 3 (водн.) + NaCl (водн.) → AgCl (т.) + NaNO 3 (водн.)
- CaCO 3 (т) → CaO (т) + CO 2 (г)
- Ca 5 (PO 4 ) 3 (OH) (s) + 7H 3 PO 4 (водн.) + 4H 2 O (л) → 5Ca (H 2 PO 4 ) 2 · H 2 O (с)
- Pb (с) + PbO 2 (с) + 2H 2 SO 4 (водн.) → 2PbSO 4 (с) + 2H 2 O (л)
Дано: вычисленное химическое уравнение
Запрошено: Классификация химической реакции
Стратегия:
A Определите общий вид уравнения, обратившись к таблице 3.1 «Основные типы химических реакций», а затем классифицируйте реакции.
B Для окислительно-восстановительных реакций присвойте степени окисления каждому атому, присутствующему в реагентах и продуктах. Если степень окисления одного или нескольких атомов изменяется, то реакция является окислительно-восстановительной. В противном случае реакция должна быть одним из других типов реакций, перечисленных в Таблице 3.1 «Основные типы химических реакций».
Решение:
A Эта реакция используется для получения 1,2-дихлорэтана, одного из 25 ведущих промышленных химикатов на Рисунке 2.22 «25 лучших химических веществ, произведенных в США в 2002 году *». Он имеет общий вид A + B → AB, который типичен для реакции конденсации. B Поскольку реакции могут относиться к нескольким категориям, нам необходимо посмотреть на степени окисления атомов:
C2–2h5 + 1 + Cl20 → Cl – 1C – 1h3 + 1C – 1h3 + 1Cl – 1Степени окисления показывают, что хлор восстанавливается от 0 до -1, а углерод окисляется от -2 до -1, так что это окислительно-восстановительная реакция, а также реакция конденсации.Этилен является восстановителем, а хлор — окислителем.
A Эта реакция используется для приготовления хлорида серебра для изготовления фотопленки. Химическое уравнение имеет общий вид AB + CD → AD + CB, поэтому оно классифицируется как реакция обмена. B Степени окисления атомов следующие
Ag + 1N + 5O3–2 + Na + 1Cl – 1 → Ag + 1Cl – 1 + Na + 1N + 5O3–2Нет изменений в степенях окисления, поэтому это не окислительно-восстановительная реакция.
AgCl (s) осаждается при смешивании растворов AgNO 3 (водный) и NaCl (водный). NaNO 3 (водн.) Находится в растворе в виде ионов Na + и NO 3 — .
A Эта реакция используется для получения извести (CaO) из известняка (CaCO 3 ) и имеет общую форму AB → A + B.Общая форма химического уравнения указывает на то, что его можно классифицировать как реакцию расщепления, обратную реакции конденсации. B Степени окисления атомов следующие:
Ca + 2C + 4O3–2 → Ca + 2O – 2 + C + 4O2–2Поскольку степени окисления всех атомов в продуктах и реагенте одинаковы, это , а не окислительно-восстановительная реакция.
A Эта реакция используется для получения «супертройного фосфата» в удобрении.Одним из реагентов является фосфорная кислота, которая переносит протон (H + ) на фосфат- и гидроксид-ионы гидроксиапатита [Ca 5 (PO 4 ) 3 (OH)] с образованием H 2 PO 4 — и H 2 O соответственно. Это кислотно-основная реакция, в которой H 3 PO 4 является кислотой (донор H + ), а Ca 5 (PO 4 ) 3 (OH) является основанием (H + акцептор).
B Чтобы определить, является ли это также окислительно-восстановительной реакцией, мы присваиваем атомам степени окисления:
Ca5 + 2 (P + 5O4–2) 3 (O – 2H + 1) + 7h4 + 1P + 5O4–2 + 4H + 12O – 2 → 5Ca + 2 (H + 12P + 5O4–2) 2 · h3 + 1O –2Поскольку степень окисления не изменяется, это не окислительно-восстановительная реакция.
A Эта реакция происходит в обычном автомобильном аккумуляторе при каждом запуске двигателя.Кислота (H 2 SO 4 ) присутствует и переносит протоны на кислород в PbO 2 с образованием воды во время реакции. Таким образом, реакцию можно описать как кислотно-щелочную реакцию.
B Степени окисления следующие:
Pb0 + Pb + 4O2–2 + 2h3 + 1S + 6O4–2 → 2Pb + 2S + 6O4–2 + 2h3 + 1O – 2Степень окисления свинца изменяется с 0 в Pb и +4 в PbO 2 (оба реагента) до +2 в PbSO 4 .Это также окислительно-восстановительная реакция, в которой элементарный свинец является восстановителем, а PbO 2 является окислителем. Какое описание правильное? Оба.
Схема автомобильного аккумулятора на 12 В. Показаны местоположения реагентов (металлический свинец в губчатой форме с большой площадью поверхности) и PbO 2 . Продукт (PbSO 4 ) образует белое твердое вещество между пластинами.
Упражнение
Используя таблицу 3.1 «Основные типы химических реакций» классифицируют каждую реакцию как реакцию окисления-восстановления, кислотно-щелочную реакцию, реакцию обмена, реакцию конденсации или реакцию расщепления. Для каждой окислительно-восстановительной реакции укажите окислитель и восстановитель и укажите, какие атомы окисляются или восстанавливаются.
- Al (тв.) + OH — (водн.) + 3H 2 O (л) → 3 / 2H 2 (г) + [Al (OH) 4 ] — (водн.)
- TiCl 4 (л) + 2Mg (л) → Ti (тв) + 2MgCl 2 (л)
- MgCl 2 (водн.) + Na 2 CO 3 (водн.) → MgCO 3 (т.) + 2NaCl (водн.)
- CO (г) + Cl 2 (г) → Cl 2 CO (л)
- H 2 SO 4 (л) + 2NH 3 (г) → (NH 4 ) 2 SO 4 (с)
Ответ:
- Окислительно-восстановительная реакция; восстановитель — Al, окислитель — H 2 O; Al окисляется, H восстанавливается.Это реакция, которая возникает, когда Drano используется для очистки забитого слива.
- Редокс-реакция; восстановитель — Mg, окислитель — TiCl 4 ; Mg окисляется, Ti восстанавливается.
- Обменная реакция. Эта реакция является причиной образования накипи в кофеварках в местах с жесткой водой.
- И реакция конденсации, и окислительно-восстановительная реакция; восстановитель — СО, окислитель — Cl 2 ; C окисляется, Cl восстанавливается.Продуктом этой реакции является фосген, высокотоксичный газ, который использовался в качестве химического оружия во время Первой мировой войны. В настоящее время фосген используется для получения полиуретанов, которые используются в пеноматериалах для постельных принадлежностей и мебели, а также в различных покрытиях.
- Кислотно-основная реакция.
Катализаторы
Многие химические реакции, включая некоторые из тех, что обсуждались ранее, протекают быстрее в присутствии катализатора — вещества, которое увеличивает скорость химической реакции, не претерпевая самого чистого химического изменения., которое является веществом, которое участвует в реакции и заставляет ее протекать быстрее, но может быть восстановлено без изменений в конце реакции и повторно использовано. Поскольку катализаторы не участвуют в стехиометрии реакции, они обычно показаны над стрелкой в чистом химическом уравнении. Химические процессы в промышленности в значительной степени зависят от использования катализаторов, которые обычно добавляются в реакционную смесь в следовых количествах, и большинство биологических реакций не происходит без биологического катализатора или фермента. Катализаторы, которые возникают в естественных условиях в живых организмах и катализируют биологические реакции.. Примерами катализируемых реакций в промышленности являются использование платины в крекинге и риформинге нефти, реакция SO 2 и O 2 в присутствии V 2 O 5 с получением SO 3 в промышленных условиях. синтез серной кислоты и использование серной кислоты в синтезе таких соединений, как этилацетат и прокаин. Катализаторы не только значительно увеличивают скорость реакций, но в некоторых случаях, например, при переработке нефти, они также контролируют образующиеся продукты.Ускорение реакции катализатором называется катализом. Ускорение химической реакции катализатором.
Гетерогенный катализатор. Эта большая круглая сетка, сотканная из родий-платиновой проволоки, является гетерогенным катализатором при промышленном производстве азотной кислоты путем окисления аммиака.
Катализаторы можно разделить на гомогенные и гетерогенные. Гомогенный катализатор — катализатор, который равномерно диспергирован в смеси реагентов с образованием раствора.равномерно диспергирован в смеси реагентов с образованием раствора. Например, серная кислота представляет собой гомогенный катализатор, используемый при синтезе сложных эфиров, таких как прокаин (Пример 13). Сложный эфир имеет структуру, аналогичную структуре карбоновой кислоты, в которой атом водорода, присоединенный к кислороду, заменен группой R. Они ответственны за ароматы многих фруктов, цветов и духов. Другими примерами гомогенных катализаторов являются ферменты, которые позволяют нашему телу функционировать.Напротив, гетерогенный катализатор — это катализатор, который находится в другом физическом состоянии, чем реагенты. находится в другом физическом состоянии, чем реагенты. По экономическим причинам в большинстве промышленных процессов используются гетерогенные катализаторы в виде твердых веществ, которые добавляют к растворам реагентов. Поскольку такие катализаторы часто содержат дорогие драгоценные металлы, такие как платина или палладий, имеет смысл формулировать их в виде твердых веществ, которые можно легко отделить от жидкой или газообразной смеси реагент-продукт и восстановить.Примерами гетерогенных катализаторов являются оксиды железа, используемые в промышленном синтезе аммиака, и каталитические преобразователи, используемые практически во всех современных автомобилях, которые содержат драгоценные металлы, такие как палладий и родий. Более подробно катализ будет обсуждаться в главе 14 «Химическая кинетика», когда мы будем обсуждать скорости реакции, но вы часто будете встречать этот термин по всему тексту.
Сводка
Химические реакции могут быть классифицированы как реакция цид-основание , реакция обмена , реакция конденсации и ее обратная реакция, реакция расщепления и реакция окисления-восстановления (или окислительно-восстановительной) .Чтобы отслеживать электроны в химических реакциях, атомам в соединениях приписываются степени окисления. Степень окисления — это заряд, который имел бы атом, если бы все его связывающие электроны были полностью переданы атому, который имеет большее притяжение для электронов. В реакции окисления-восстановления один атом должен потерять электроны, а другой — получить электроны. Окисление — это потеря электронов, а элемент, степень окисления которого увеличивается, называется окисленным . Восстановление — это усиление электронов, а элемент, степень окисления которого снижается, называется восстановленным . Окислители — это соединения, которые способны принимать электроны от других соединений, поэтому они восстанавливаются в процессе окислительно-восстановительной реакции. Напротив, восстановители представляют собой соединения, которые способны отдавать электроны другим соединениям, поэтому они окисляются во время реакции окисления-восстановления. Реакция горения представляет собой окислительно-восстановительную реакцию, в которой окислителем является O 2 (г).Амидная связь образуется в результате реакции конденсации между карбоновой кислотой и амином; это важная структурная единица белков и многих полимеров. Катализатор представляет собой вещество, которое увеличивает скорость химической реакции, не претерпевая самого чистого химического изменения. Биологический катализатор называется ферментом . Катализ — это ускорение скорости реакции, вызванное присутствием вещества, которое не фигурирует в химическом уравнении.Гомогенный катализатор равномерно диспергирован в растворе реагентов, тогда как гетерогенный катализатор присутствует в виде другой фазы, обычно твердой.
Key Takeaway
- Химические реакции можно разделить на кислотно-основные, обменные, конденсационные, расщепляющие и окислительно-восстановительные (окислительно-восстановительные).
Концептуальные проблемы
Что такое реакция горения? Как его отличить от реакции обмена?
Какие два продукта образуются при сгорании органического соединения, содержащего только углерод, водород и кислород? Возможно ли образование только этих двух продуктов в результате реакции, не являющейся реакцией горения? Поясните свой ответ.
Какие факторы определяют, можно ли классифицировать реакцию как окислительно-восстановительную?
Назовите три характеристики сбалансированной окислительно-восстановительной реакции.
Окислитель принимает электроны или отдает их?
Становится ли степень окисления восстановителя более положительной или более отрицательной во время окислительно-восстановительной реакции?
Известно, что азот, водород и аммиак существовали на первозданной земле, однако смеси азота и водорода обычно не реагируют с образованием аммиака.У какого природного явления было бы достаточно энергии, чтобы инициировать реакцию между этими двумя первичными газами?
Катализаторы не добавляют в реакции в стехиометрических количествах. Почему?
Укажите, используется ли в каждом из следующих случаев гомогенный или гетерогенный катализатор.
- Металлическая платина используется в автомобильном катализаторе.
- Азот биологически преобразуется в аммиак под действием фермента.
- Окись углерода и водород объединяются с образованием метана и воды с никелевым катализатором.
- Растворенное соединение родия используется в качестве катализатора превращения алкена в алкан.
Укажите, используется ли в каждом из следующих случаев гомогенный или гетерогенный катализатор.
- Гранулы ZSM-5, минерала, содержащего алюминий и кремний, используются для катализирования превращения метанола в бензин.
- Превращение глюкозы в карбоновую кислоту происходит при катализе ферментом глюкозооксидазой.
- Металлический родий используется для превращения окиси углерода и воды в двуокись углерода и водород.
Заполните следующую таблицу, чтобы описать некоторые ключевые различия между гомогенным и гетерогенным катализом.
Однородный Гетерогенный количество фаз простота отделения от продукта Простота восстановления катализатора Чтобы увеличить скорость реакции, ученый решил использовать катализатор.Неожиданно ученый обнаружил, что катализатор снижает выход желаемого продукта, а не увеличивает его. Что могло случиться?
Ответ
Однородный Гетерогенный количество фаз однофазный минимум две фазы простота отделения от продукта сложный легко Простота восстановления катализатора сложный легко
Числовые задачи
Классифицируйте каждую химическую реакцию в соответствии с типами, перечисленными в Таблице 3.1 «Основные типы химических реакций».
- 12FeCl 2 (с) + 3O 2 (с) → 8FeCl 3 (с) + 2Fe 2 O 3 (с)
- CaCl 2 (водн.) + K 2 SO 4 (водн.) → CaSO 4 (т.) + 2KCl (водн.)
- HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (л)
- Br 2 (л) + C 2 H 4 (г) → BrCH 2 CH 2 Br (л)
Классифицируйте каждую химическую реакцию по типам, перечисленным в таблице 3.1 «Основные типы химических реакций».
- 4FeO (т) + O 2 (г) → 2Fe 2 O 3 (т)
- Ca 3 (PO 4 ) 2 (с) + 3H 2 SO 4 (вод.) → 3CaSO 4 (с) + 2H 3 PO 4 (вод.)
- HNO 3 (водн.) + KOH (водн.) → KNO 3 (водн.) + H 2 O (л)
- этан (г) + кислород (г) → диоксид углерода (г) + вода (г)
Назначьте степени окисления атомам в каждом соединении или ионе.
- (NH 4 ) 2 S
- фосфат-ион
- [AlF 6 ] 3–
- CuS
- HCO 3 —
- NH 4 +
- H 2 SO 4
- муравьиная кислота
- n -бутанол
Назначьте степени окисления атомам в каждом соединении или ионе.
- ClO 2
- HO 2 —
- бикарбонат натрия
- MnO 2
- PCl 5
- [Mg (H 2 O) 6 ] 2+
- N 2 O 4
- бутановая кислота
- метанол
Выровняйте это химическое уравнение:
NaHCO 3 (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + CO 2 (г) + H 2 O (л)Что это за реакция? Обосновать ответ.
Присвойте атомам в каждом соединении степени окисления.
- нитрат железа (III)
- Al 2 O 3
- сульфат калия
- Cr 2 O 3
- перхлорат натрия
- Cu 2 S
- гидразин (N 2 H 4 )
- НЕТ 2
- n -пентанол
Присвойте атомам в каждом соединении степени окисления.
- карбонат кальция
- NaCl
- CO 2
- дихромат калия
- КМно 4
- оксид железа
- Cu (OH) 2
- Na 2 SO 4
- n -гексанол
Для каждой окислительно-восстановительной реакции определите идентичность окислителя, восстановителя, окисленных и восстановленных частиц.
- H 2 (г) + I 2 (с) → 2HI (г)
- 2Na (т) + 2H 2 O (л) → 2NaOH (водн.) + H 2 (г)
- 2F 2 (г) + 2NaOH (водн.) → OF 2 (г) + 2NaF (водн.) + H 2 O (л)
Для каждой окислительно-восстановительной реакции определите идентичность окислителя, восстановителя, окисленных и восстановленных частиц.
- 2Na (тв) + Cl 2 (г) → 2NaCl (тв)
- SiCl 4 (л) + 2Mg (с) → 2MgCl 2 (с) + Si (с)
- 2H 2 O 2 (водн.) → 2H 2 O (л) + O 2 (г)
Сбалансируйте каждое химическое уравнение. Затем определите окислитель, восстановитель, окисленные и восстановленные частицы.(Δ означает, что реакция требует нагревания.)
- H 2 O (г) + CO (г) → CO 2 (г) + H 2 (г)
- реакция оксида алюминия, углерода и газообразного хлора при 900 ° C с образованием хлорида алюминия и оксида углерода
- HgO (т) → ΔHg (л) + O2 (г)
Сбалансируйте каждое химическое уравнение.Затем определите окислитель, восстановитель, окисленные и восстановленные частицы. (Δ означает, что реакция требует нагревания.)
- реакция воды и углерода при 800ºC с образованием водорода и окиси углерода
- Mn (s) + S 8 (s) + CaO (s) → CaS (s) + MnO (s)
Реакция этилена и кислорода при повышенной температуре в присутствии серебряного катализатора с образованием оксида этилена
- ZnS (тв.) + H 2 SO 4 (водн.) + O 2 (г) → ZnSO 4 (водн.) + S 8 (т.) + H 2 O (л)
Серебро потускнело из-за сероводорода, атмосферного загрязнителя, с образованием тонкого слоя темного сульфида серебра (Ag 2 S) вместе с газообразным водородом.
- Напишите вычисленное химическое уравнение этой реакции.
- Какие виды были окислены, а какие восстановлены?
- Предполагая, что 2,2 г Ag превратилось в сульфид серебра, постройте таблицу, показывающую реакцию с точки зрения количества атомов в реагентах и продуктах, молей реагентов и продуктов, граммов реагентов и продуктов и молекул реактивы и продукты.
В целлюлозно-бумажной промышленности используется следующая реакция:
Na 2 SO 4 (водн.) + C (s) + NaOH (водн.) → Na 2 CO 3 (водн.) + Na 2 S (водн.) + H 2 O (л )- Выровняйте химическое уравнение.
- Укажите окислитель и восстановитель.
- Сколько углерода нужно для преобразования 2,8 кг сульфата натрия в сульфид натрия?
- Если бы выход реакции был только 78%, сколько килограммов карбоната натрия было бы произведено из 2,80 кг сульфата натрия?
- Если бы в реакции использовали 240 г углерода и 2,80 кг сульфата натрия, какой был бы ограничивающий реагент (при условии избытка гидроксида натрия)?
Реакция A 2 (синий) с B 2 (желтый) показана ниже.Слева показана исходная реакционная смесь, а справа — смесь после завершения реакции.
- Напишите вычисленное химическое уравнение реакции.
- Какой реагент является ограничивающим в исходной реакционной смеси?
- Сколько молей продукта AB 4 можно получить из смеси 0.020 моль A 2 и 0,060 моль B 2 ?
Реакция X 4 (оранжевый) с Y 2 (черный) показана ниже. Слева показана исходная реакционная смесь, а справа — смесь после завершения реакции.
- Напишите вычисленное химическое уравнение реакции.
- Какой реагент является ограничивающим в исходной реакционной смеси?
- Сколько молей продукта XY 3 можно получить из смеси 0,100 моль X 4 и 0,300 моль Y 2 ?
Метилбутират, искусственный яблочный ароматизатор, используемый в пищевой промышленности, получают реакцией бутановой кислоты с метанолом в присутствии кислотного катализатора (H + ):
Ch4Ch3Ch3COOH (л) + Ch4OH (л) → H + Ch4Ch3Ch3CO2Ch4 (л) + h3O (л)- Дано 7.8 г бутановой кислоты, сколько граммов метилбутирата можно было бы синтезировать при 100% выходе?
- В результате реакции получают 5,5 г метилбутирата. Какая была процентная доходность?
- Катализатор, используемый в этой реакции, гетерогенный или гомогенный?
В присутствии платинового катализатора водород и бром реагируют при повышенных температурах (300 ° C) с образованием бромистого водорода (тепло обозначается Δ):
h3 (г) + Br2 (ж) → ΔPt 2HBr (г)Рассчитайте массу произведенного бромистого водорода с учетом следующего:
- 8.23 × 10 22 молекул H 2
- 6,1 × 10 3 моль H 2
- 1,3 × 10 5 г H 2
- Катализатор, используемый в этой реакции, гетерогенный или гомогенный?
Убедитесь, что вы знакомы с темами, обсуждаемыми в разделе Основные навыки 2 (Раздел 3.7 «Основные навыки 2»), прежде чем переходить к числовым задачам.
ответы
- окислительно-восстановительная реакция
- обмен
- кислотно-щелочная
- конденсация
- S, -2; N, -3; H, +1
- П, +5; О, −2
- F, -1; Ал, +3
- S, −2; Cu, +2
- H, +1; О, -2; С, +4
- H, +1; N, −3
- H, +1; О, -2; S, +6
- H, +1, O, -2; С, +2
бутанол:
O, -2; H, +1
Слева направо: C, −3–2–2–1
2NaHCO 3 (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2CO 2 (г) + 2H 2 O (л) кислота –Основная реакция
- Ca, +2; О, -2; С, +4
- Na, +1; Cl, -1
- O, -2; С, +4
- К, +1; О, -2; Cr, +6
- К, +1; О, -2; Пн, +7
- O, -2; Fe, +3
- O, -2; H, +1; Cu, +2
- O, -2; S, +6
Гексанол
O, -2; H, +1
Слева направо: C: −3, −2, −2, −2, −2, −1
- Na — восстановитель, окисляется.Cl 2 является окислителем и восстанавливается.
- Mg является восстановителем и окисляется. Si является окислителем и восстанавливается.
- H 2 O 2 одновременно окислитель и восстановитель. Одна молекула окисляется, а одна молекула восстанавливается.
H 2 O (г) + C (т) → Δ H 2 (г) + CO (г)
C является восстановителем и окисляется.H 2 O является окислителем и восстанавливается.
8Mn (с) + S 8 (с) + 8CaO (с) → 8CaS (с) + 8MnO (с)
Mn является восстановителем и окисляется. S 8 является окислителем и восстанавливается.
2C 2 H 4 (г) + O 2 (г) → Δ 2C 2 H 4 O (г)
Этилен является восстановителем и окисляется.O 2 является окислителем и восстанавливается.
8ZnS (т) + 8H 2 SO 4 (водн.) + 4O 2 (г) → 8ZnSO 4 (водн.) + S 8 (т) + 8H 2 O (л)
Сульфид в ZnS является восстановителем и окисляется. O 2 является окислителем и восстанавливается.
- Na 2 SO 4 + 2C + 4NaOH → 2Na 2 CO 3 + Na 2 S + 2H 2 O
- Сульфат-ион является окислителем, а восстановитель — углеродом.
- 470 г
- 3300 г
- углерод
- 22,1 г
- 9.9 × 10 5 г
- 1,0 × 10 7 г
- неоднородный
Имена, свойства и реакции функциональных групп
Функциональные группы
Функциональные группы относятся к определенным атомам, связанным определенным образом, что придает соединению определенные физические и химические свойства.
Цели обучения
Дайте определение термину «функциональная группа» применительно к органическим молекулам.
Основные выводы
Ключевые точки
- Функциональные группы часто используются для «функционализации» соединения, придавая ему физические и химические свойства, отличные от его исходной формы.
- Функциональные группы будут вступать в реакции одного и того же типа независимо от соединения, частью которого они являются; однако присутствие определенных функциональных групп в непосредственной близости может ограничивать реакционную способность.
- Функциональные группы могут использоваться, чтобы отличать похожие соединения друг от друга.
Ключевые термины
- функциональная группа : Определенная группа элементов, которая характерна для класса соединений и определяет некоторые свойства и реакции этого класса.
- функционализация : Добавление определенных функциональных групп для придания соединению новых желаемых свойств.
Роль функциональных групп
В органической химии функциональная группа — это определенная группа атомов или связей внутри соединения, которая отвечает за характерные химические реакции этого соединения. Одна и та же функциональная группа будет вести себя аналогичным образом, претерпевая аналогичные реакции, независимо от соединения, частью которого она является.Функциональные группы также играют важную роль в номенклатуре органических соединений; объединение названий функциональных групп с названиями исходных алканов позволяет различать соединения.
Атомы функциональной группы связаны вместе и с остальной частью соединения ковалентными связями. Первый атом углерода, который присоединяется к функциональной группе, называется альфа-углеродом; второй — бета-углерод; третий — гамма-углерод и т.д. Аналогичным образом функциональная группа может называться первичной, вторичной или третичной, в зависимости от того, присоединена ли она к одному, двум или трем атомам углерода.
Классификация спиртов : Спирты представляют собой общую функциональную группу (-ОН). Их можно разделить на первичные, вторичные или третичные, в зависимости от того, к скольким атомам углерода присоединен центральный углерод.
Функциональные группы и реакционная способность
Функциональные группы играют важную роль в управлении органическими реакциями. Алкильные цепи часто нереактивны, и направление сайт-специфических реакций затруднено; ненасыщенные алкильные цепи с наличием функциональных групп обеспечивают более высокую реакционную способность и специфичность.Часто соединения функционализируются определенными группами для конкретной химической реакции. Функционализация относится к добавлению функциональных групп к соединению путем химического синтеза. С помощью обычных методов синтеза к поверхности можно присоединить любое органическое соединение. В материаловедении функционализация используется для достижения желаемых свойств поверхности; функциональные группы также можно использовать для ковалентного связывания функциональных молекул с поверхностями химических устройств.
В органической химии наиболее распространенными функциональными группами являются карбонилы (C = O), спирты (-OH), карбоновые кислоты (CO 2 H), сложные эфиры (CO 2 R) и амины (NH 2 ).Важно уметь распознавать функциональные группы, а также физические и химические свойства, которые они дают соединениям.
Органическая химия, Урок по функциональным группам : Это видео дает отличный обзор различных функциональных групп в органической химии.
Спирты
Спирты — это функциональные группы, характеризующиеся наличием -ОН-группы.
Цели обучения
Определить общие свойства функциональной группы спирта
Основные выводы
Ключевые точки
- Благодаря наличию группы -ОН, спирты могут образовывать водородные связи.Это приводит к более высоким температурам кипения по сравнению с их исходными алканами.
- Спирты полярны по своей природе. Это объясняется разницей в электроотрицательности между атомами углерода и кислорода.
- В химических реакциях спирты часто не могут покинуть молекулу самостоятельно; чтобы уйти, они часто становятся протонированными в воду, которая является лучшей уходящей группой. Спирты также могут депротонироваться в присутствии сильного основания.
Ключевые термины
- алкан : любой из насыщенных углеводородов, включая метан, этан и соединения с длинной углеродной цепью, известные как парафины и т. Д.- которые имеют химическую формулу вида Cnh3n + 2.
- альдегид : Любое из большого класса реакционноспособных органических соединений (R · CHO), имеющих карбонильную функциональную группу, присоединенную к одному углеводородному радикалу и атому водорода.
- карбоновая кислота : Любой из класса органических соединений, содержащих карбоксильную функциональную группу — углерод с двойной связью с кислородом и одинарной связью с другим кислородом, который, в свою очередь, связан с водородом.
- уходящая группа : В органической химии вид, который покидает родительскую молекулу после реакции замещения.
Спирты — это органические соединения, в которых гидроксильная функциональная группа (-ОН) связана с атомом углерода. Спирты представляют собой важный класс молекул, которые используются во многих научных, медицинских и промышленных целях.
Номенклатура спиртов
Согласно системе номенклатуры ИЮПАК, спирт называют, отбрасывая конец «-e» родительской углеродной цепи (в большинстве случаев алкан, алкен или алкин) и добавляя «-ол» в качестве окончания. Если необходимо указать расположение гидроксильной группы, число вставляется между названием исходного алкана и «-ол» (пропан-1-ол) или перед названием ИЮПАК (1-пропанол).Если присутствует группа с более высоким приоритетом, такая как альдегид, кетон или карбоновая кислота, тогда необходимо использовать префикс «гидрокси-» вместо окончания «-ол».
Спирты классифицируются как первичные, вторичные или третичные в зависимости от количества атомов углерода, связанных с атомом углерода, который несет гидроксильную группу.
Функциональная группа спирта : Спирты характеризуются наличием -ОН-группы, которая обычно имеет изогнутую форму, как у воды.
Структура и физические свойства спиртов
Спирт по своей структуре похож на воду, так как имеет изогнутую форму. Это геометрическое расположение отражает эффект отталкивания электронов и увеличивающийся стерический объем заместителей на центральном атоме кислорода. Как и вода, спирты полярны и содержат несимметричное распределение заряда между атомами кислорода и водорода. Высокая электроотрицательность кислорода по сравнению с углеродом приводит к укорачиванию и усилению связи -ОН.Присутствие групп -ОН позволяет образовывать водородные связи с другими группами -ОН, атомами водорода и другими молекулами. Поскольку спирты способны образовывать водородные связи, их температуры кипения выше, чем у их исходных молекул.
Спирты могут участвовать во многих химических реакциях. Они часто подвергаются депротонированию при наличии сильного основания. Такое поведение слабой кислоты приводит к образованию соли алкоксида и молекулы воды. Сами по себе гидроксильные группы не считаются хорошими уходящими группами.Часто их участие в реакциях нуклеофильного замещения инициируется протонированием атома кислорода, что приводит к образованию водного фрагмента — лучше уходящей группы. Спирты могут реагировать с карбоновыми кислотами с образованием сложного эфира, и они могут окисляться до альдегидов или карбоновых кислот.
Спирты находят множество применений в нашем повседневном мире. Они содержатся в напитках, антифризах, антисептических средствах и топливе. Их можно использовать в качестве консервантов для образцов в науке, а также в промышленности в качестве реагентов и растворителей, поскольку они обладают способностью растворять как полярные, так и неполярные вещества.
эфиров
Простые эфиры — это класс органических соединений, в которых атом кислорода связан с двумя алкильными или арильными группами.
Цели обучения
Определите термин «эфир» применительно к органическим соединениям
Основные выводы
Ключевые точки
- Эфиры имеют относительно низкие температуры кипения из-за их неспособности образовывать водородные связи друг с другом.
- Из-за разницы в электроотрицательности атомов кислорода и углерода в эфире молекула слабо полярна.
- Хотя в целом они имеют низкую реакционную способность, две неподеленные пары электронов на атоме кислорода действительно придают молекуле эфира некоторую реактивность; молекула эфира вступает в реакцию с сильными кислотами и служит основанием Льюиса.
Ключевые термины
- алкен : ненасыщенный алифатический углеводород с одной или несколькими двойными связями углерод-углерод.
- сложный эфир : соединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды.Он содержит функциональную группу C = O, присоединенную через углерод к другому атому кислорода.
- эфир : Соединение, содержащее атом кислорода, связанный с двумя углеводородными группами.
- амид : любое производное оксикислоты, в котором гидроксильная группа заменена амино или замещенной аминогруппой; особенно такие производные карбоновой кислоты, карбоксамиды.
Структура эфиров
Эфиры — это класс органических соединений, содержащих эфирную группу.Эфирная группа — это атом кислорода, связанный с двумя алкильными или арильными группами. Они следуют общей формуле R-O-R ’. Связь C-O-C характеризуется валентными углами, составляющими 104,5 градуса, с расстояниями C-O, составляющими около 140 мкм. Кислород эфира более электроотрицателен, чем атомы углерода. Таким образом, альфа-атомы водорода более кислые, чем в обычных углеводородных цепях.
Эфиры : Общая структура эфира. Простой эфир характеризуется кислородной связью с двумя алкильными или арильными группами, представленными здесь R и R ’.Заместители могут быть, но не обязательно, одинаковыми.
Номенклатура эфиров
Существует два способа называть эфиры. Наиболее распространенный способ — определить алкильные группы по обе стороны от атома кислорода в алфавитном порядке, а затем написать «эфир». Например, этилметиловый эфир — это эфир, который имеет этильную группу и метильную группу по обе стороны от атома кислорода. Если две алкильные группы идентичны, простой эфир называется ди [алкил] эфиром. Например, диэтиловый эфир — это эфир с этильной группой на каждой стороне атома кислорода.
Другой способ наименования эфиров — это формальный метод IUPAC. Таким образом, форма следующая: [короткая алкильная цепь] [окси] [длинная алкильная цепь]. Например, название этилметилового эфира по ИЮПАК — метоксиэтан.
В циклических эфирах основа соединения известна как оксациклоалкан. «Окса» является индикатором замещения углерода в кольце кислородом. Примером является оксациклопентан, пятичленное кольцо, в котором имеется , четыре, атомов углерода и один атом кислорода.
Тетрагидрофуран (THF) : обычное название циклического эфира «оксациклопентан» — тетрагидрофуран или THF. Это обычный органический растворитель, который смешивается с водой.
Свойства эфиров
Эфиры довольно неполярны из-за присутствия алкильных групп по обе стороны от центрального кислорода. Присутствие прилегающих к нему объемных алкильных групп означает, что атом кислорода в значительной степени неспособен участвовать в образовании водородных связей. Следовательно, простые эфиры имеют более низкие температуры кипения по сравнению со спиртами с аналогичной молекулярной массой.Однако по мере того, как алкильная цепь простых эфиров становится длиннее, разница в точках кипения становится меньше. Это связано с эффектом усиления ван-дер-ваальсовых взаимодействий по мере увеличения количества атомов углерода и, следовательно, количества электронов. Две неподеленные пары электронов, присутствующие на атомах кислорода, позволяют эфирам образовывать водородные связи с водой. Эфиры более полярны, чем алкены, но не так полярны, как сложные эфиры, спирты или амиды сопоставимых структур.
Реакция
Простые эфиры имеют относительно низкую химическую активность, но они все же более активны, чем алканы.Хотя они сопротивляются гидролизу, они часто расщепляются кислотами, что приводит к образованию алкилгалогенида и спирта. Эфиры склонны к образованию пероксидов в присутствии кислорода или воздуха. Общая формула — R-O-O-R ’. Эфиры могут служить основаниями Льюиса и Бренстеда, отдавать электроны в реакциях или принимать протоны. Эфиры могут быть образованы в лаборатории путем дегидратации спиртов (2R-OH → ROR + H 2 O при высокой температуре), нуклеофильного замещения алкилгалогенидов алкоксидами (R-ONa + R’-X → RO-R ‘ + NaX) или электрофильное присоединение спиртов к алкенам (R 2 C = CR 2 + R-OH → R 2 CH-C (-OR) -R 2 ) .
Альдегиды и кетоны
Альдегиды и кетоны — это классы органических соединений, содержащие карбонильную (C = O) группу.
Цели обучения
Определить общие свойства кетонов и альдегидов
Основные выводы
Ключевые точки
- Карбонильная функциональная группа представляет собой углерод, связанный двойной связью с кислородом. В зависимости от расположения карбонильной группы ее называют по-разному; кетоны содержат карбонил внутри соединения, а альдегиды содержат карбонил на конце органического соединения.
- Кетоны и альдегиды могут подвергаться кетоенольной таутомерии. Это относится к равновесию между двумя возможными таутомерами. Взаимопревращение двух форм включает движение протона и смещение связывающих электронов. Это равновесие дает соединениям большую реакционную способность.
- Кетоны и альдегиды участвуют во множестве реакций. Они могут подвергаться реакциям окисления, в которых они окисляются до соответствующих карбоновых кислот.
Ключевые термины
- таутомерия : форма изомерии, при которой существует динамическое равновесие между несколькими изомерами, например, между енолом и кетоном.
- окислить : Увеличить валентность (положительный заряд) элемента за счет удаления электронов.
- альдегид : органическое соединение, содержащее формильную группу, которая представляет собой функциональную группу со структурой R-CHO.
- sp2 : Гибридная орбиталь, которая образуется, когда для двойной связи требуется одна пи-связь, и только три σ-связи образуются на атом углерода. Орбиталь 2s смешана только с двумя из трех орбиталей 2p.
- кетон : соединение, содержащее атом кислорода, соединенный с атомом углерода двойной связью.
В органической химии карбонильная группа — это функциональная группа, которая имеет углеродную двойную связь с атомом кислорода: C = O.
Кето-енольные таутомеры : Существует равновесие между формами кетона и енола, которое включает сдвиг двойной связи и движение протона.
Кетоны
Когда в молекулу помещается карбонильная функциональная группа, она называется кетоном. Кетоны представляют собой органические соединения со структурой RC (= O) R ’, где R и R’ могут быть различными углеродсодержащими заместителями.Правила номенклатуры ИЮПАК диктуют, что молекулы кетонов называются путем изменения суффикса родительской молекулы углерода на «-он». Если положение кетона должно быть указано, то число помещается между названием родительской цепи и префиксом «-one» (например, пропан-2-он) или в начале имени IUPAC. Приставки «оксо-» и «кето-» используются для описания кетонной функциональной группы.
Кетон : Кетон — это тип органического соединения, в котором карбонильная группа связана с двумя другими атомами углерода в углеродной основной цепи.
Кетонный углерод sp 2 гибридизирован, и он принимает тригональную плоскую геометрию вокруг кетонового углерода. Таким образом, валентные углы C – C – O и C – C – C составляют примерно 120 градусов. Из-за карбонильной группы кетоны полярны и способны взаимодействовать с другими соединениями через водородные связи; эта способность к водородным связям делает кетоны более растворимыми в воде, чем родственные метиленовые соединения. Кетоны обычно не являются донорами водородных связей и, как правило, не проявляют межмолекулярного притяжения с другими кетонами.В результате кетоны часто более летучие, чем спирты и карбоновые кислоты сравнимой молекулярной массы. Кетоны содержат альфа-водороды, которые участвуют в кето-енольной таутомерии. В присутствии сильного основания будет происходить образование енолята и последующее депротонирование енолята.
Альдегиды
Альдегид : Альдегид характеризуется наличием карбонильной функциональной группы на конце углеродного скелета соединения.
Альдегид — это органическое соединение, которое содержит карбонильную группу с центральным углеродом, связанным с водородом, и группой R (R-CHO).Альдегиды отличаются от кетонов тем, что карбонил расположен в конце углеродного скелета, а не между двумя атомами углерода в основной цепи. Подобно кетонам, альдегиды гибридизированы sp 2 и могут существовать в кето- или еноловом таутомере. Альдегиды называют, отбрасывая суффикс родительской молекулы и добавляя суффикс «-al». Например, трехуглеродная цепь с альдегидной группой на концевом атоме углерода будет пропаналом. Если в соединении есть функциональные группы более высокого порядка, можно использовать префикс «оксо-», чтобы указать, какой атом углерода является частью альдегидной группы.Если необходимо указать расположение альдегида, можно использовать число между родительской цепочкой и суффиксом или в начале имени соединения.
Сходства альдегидов и кетонов
Как альдегиды, так и кетоны находятся в равновесии со своими енольными формами; енольная форма определяется как алкен с гидроксильной группой, присоединенной к одному из атомов углерода, составляющих двойную связь. Кето-форма преобладает в равновесии для большинства кетонов. Однако енольная форма важна для некоторых реакций, поскольку депротонированная енолятная форма является сильным нуклеофилом.Равновесие сильно термодинамически обусловлено, и при комнатной температуре предпочтение отдается кето-форме. Взаимное превращение может катализироваться присутствием кислоты или основания.
Кето-енольная таутомерия : Взаимопревращение двух форм может катализироваться кислотой или основанием.
Спектроскопия кетонов и альдегидов
Как кетоны, так и альдегиды можно идентифицировать спектроскопическими методами. Они демонстрируют сильные полосы поглощения CO около 1700 см –1 .В ЯМР-спектроскопии карбонильный водород показывает сильный пик поглощения, и любое взаимодействие с протонами на альфа-углероде также будет показывать сильные сигналы.
Кетоны и альдегиды могут быть легко восстановлены до спиртов, обычно в присутствии сильного восстанавливающего агента, такого как боргидрид натрия. В присутствии сильных окислителей они могут окисляться до карбоновых кислот. Как электрофилы, они подвергаются атаке нуклеофилов, что означает, что они участвуют во многих реакциях нуклеофильного присоединения.
Карбоновые кислоты
Карбоновые кислоты — это органические кислоты, которые содержат атом углерода, который участвует как в гидроксильной, так и в карбонильной функциональной группе.
Цели обучения
Распознавать общие свойства карбоновых кислот
Основные выводы
Ключевые точки
- Карбоновые кислоты используются в качестве предшественников для образования других соединений, таких как сложные эфиры, альдегиды и кетоны.
- Карбоновые кислоты могут образовывать водородные связи сами с собой, особенно в неполярных растворителях; это приводит к усилению стабилизации соединений и повышению их точек кипения.
- Так как карбоновые кислоты содержат как гидроксильные, так и карбонильные функциональные группы, они участвуют в образовании водородных связей как акцепторы водорода и как доноры водорода.
Ключевые термины
- нитрил : Любой из класса органических соединений, содержащих цианофункциональную группу (-C≡N).
- олефин : любой из класса ненасыщенных углеводородов с открытой цепью, таких как этилен; алкен только с одной двойной связью углерод-углерод.
- сложный эфир : соединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды.Он содержит функциональную группу C = O, присоединенную через углерод к другому атому кислорода.
Карбоксильная группа (COOH) представляет собой функциональную группу, состоящую из карбонильной группы (C = O) с гидроксильной группой (O-H), присоединенной к тому же атому углерода. Карбоксильные группы имеют формулу -C (= O) OH, обычно обозначаемую как -COOH или CO 2 H. Карбоновые кислоты — это класс молекул, которые характеризуются наличием одной карбоксильной группы. В качестве доноров протонов карбоновые кислоты характеризуются как кислоты Бренстеда-Лоури.Кислоты с двумя или более карбоксильными группами называются дикарбоновыми, трикарбоновыми и т. Д. Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-ионы стабилизированы резонансом. Эта повышенная стабильность приводит к повышенной кислотности по сравнению со спиртами. Обычно в номенклатуре ИЮПАК карбоновые кислоты имеют суффикс «-ойная кислота», хотя суффикс «-иновая кислота» является наиболее часто используемым.
Карбоновая кислота : Карбоновые кислоты — это органические оксикислоты, характеризующиеся наличием по крайней мере одной карбоксильной группы, которая имеет формулу -C (= O) OH, обычно обозначаемую как -COOH или -CO2H.
Физические свойства карбоновых кислот
Карбоновые кислоты действуют как акцепторы водородных связей за счет карбонильной группы, так и как доноры водородных связей за счет гидроксильной группы. В результате они часто участвуют в водородных связях. Карбоновые кислоты обычно существуют в виде димерных пар в неполярных средах из-за их тенденции к «самоассоциации». Эта склонность к образованию водородных связей придает им повышенную стабильность, а также более высокие температуры кипения по сравнению с кислотой в водном растворе.Карбоновые кислоты — полярные молекулы; они, как правило, растворимы в воде, но по мере удлинения алкильной цепи их растворимость снижается из-за возрастающей гидрофобной природы углеродной цепи. Карбоновые кислоты характеризуются как слабые кислоты, что означает, что они не полностью диссоциируют с образованием катионов H + в нейтральном водном растворе.
Водородная связь между карбоновыми кислотами : Водородная связь карбоновых кислот между собой, придавая им повышенный уровень стабильности.
Спектроскопия карбоновых кислот
Карбоновые кислоты можно охарактеризовать с помощью ИК-спектроскопии; они демонстрируют резкую полосу, связанную с колебанием связи C-O между 1680 и 1725 см -1 . Кроме того, появляется широкий пик в области от 2500 до 3000 см -1 . По данным спектроскопии ЯМР 1 H гидроксильный водород появляется в области 10–13 м.д., хотя часто он либо расширен, либо не наблюдается из-за обмена со следами воды.
Применение и реакционная способность карбоновых кислот
Карбоновые кислоты используются в производстве полимеров, фармацевтических препаратов, растворителей и пищевых добавок.По существу, они часто производятся в промышленных масштабах. Карбоновые кислоты обычно получают окислением альдегидов и углеводородов и катализируемым основанием дегидрированием спиртов. Их можно производить в лаборатории для небольших реакций путем окисления первичных спиртов или альдегидов, окислительного расщепления олефинов и путем гидролиза нитрилов, сложных эфиров или амидов.
Карбоновые кислоты широко используются в качестве прекурсоров для получения других соединений. Под воздействием основания карбоновая кислота депротонируется и образует карбоксилатную соль.Они также реагируют со спиртами с образованием сложных эфиров и могут вступать в реакции восстановления путем гидрирования или использования восстанавливающих агентов. Также существуют различные специализированные реакции, в которых участвуют карбоновые кислоты, которые приводят к образованию аминов, альдегидов и кетонов.
Сложные эфиры
Сложные эфиры представляют собой функциональные группы, полученные конденсацией спирта с карбоновой кислотой, и названы в соответствии с этими компонентами.
Цели обучения
Определите общие свойства функциональной группы сложного эфира
Основные выводы
Ключевые точки
- Сложные эфиры — это функциональная группа, обычно встречающаяся в органической химии.Они характеризуются углеродом, связанным с тремя другими атомами: одинарной связью с углеродом, двойной связью с кислородом и одинарной связью с кислородом. Односвязанный кислород связан с другим углеродом.
- Названия сложных эфиров образованы от исходного спирта и исходной кислоты. Хотя простые эфиры часто называют своими общими названиями, все сложные эфиры могут быть названы с использованием систематического названия ИЮПАК, основанного на названии кислоты, за которым следует суффикс «-оат».
- Сложные эфиры реагируют с нуклеофилами у карбонильного углерода.Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов. Связи C-H, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями.
Ключевые термины
- карбоновая кислота : Любой из класса органических соединений, содержащих карбоксильную функциональную группу — углерод с одной двойной связью с кислородом и одинарной связью с другим кислородом, который, в свою очередь, связан с водородом.
- спирт : Класс органических соединений, содержащих гидроксильную функциональную группу.
- нуклеофил : соединение или функциональная группа, которая притягивает центры положительного заряда и отдает электроны; жертвует электронную пару электрофилу для образования связи.
Сложные эфиры являются важной функциональной группой в органической химии, и их обычно обозначают как RCOOR ’или RCO 2 R’.
Сложные эфиры : Сложный эфир характеризуется ориентацией и связью показанных атомов, где R и R ’оба представляют собой инициированные углеродом цепи различной длины, также известные как алкильные группы.
Как обычно, R и R ’обе представляют собой алкильные группы или группы, начинающиеся с углерода. Сложные эфиры являются производными карбоновых кислот, в которых гидроксильная (ОН) группа заменена алкоксильной (O-R) группой. Обычно их синтезируют путем конденсации карбоновой кислоты со спиртом:
[латекс] \ text {RCO} _2 \ text {H} + \ text {R} ‘\ text {OH} \ rightarrow \ text {RCO} _2 \ text {R}’ + \ text {H} _2 \ text {O} [/ латекс]
Сложные эфиры встречаются повсеместно. Большинство встречающихся в природе жиров и масел представляют собой сложные эфиры жирных кислот и глицерина.Сложные эфиры, как правило, ароматные, а эфиры с достаточно низкой молекулярной массой, чтобы быть летучими, обычно используются в качестве отдушек и содержатся в эфирных маслах и феромонах. Полимеризованные сложные эфиры или полиэфиры являются важными пластиками, мономеры которых связаны сложноэфирными звеньями, например:
CO 2 RCO 2 RCO 2 R… и т. Д.
Номенклатура
Слово «сложный эфир» было придумано в 1848 году немецким химиком Леопольдом Гмелином, вероятно, как сокращение от немецкого Essigäther , означающего уксусный эфир.
Названия сложных эфиров образованы от исходного спирта и кислоты. Например, сложный эфир, образованный этанолом и этановой кислотой, известен как этилэтаноат; «Этанол» восстанавливается до «этила», а «этановая кислота» восстанавливается до «этаноата». Другие примеры названий сложных эфиров включают метилпропаноат из метанола и пропановой кислоты и бутилоктаноат из бутана и октановой кислоты.
Этилэтаноат : Название этилэтаноат происходит от компонентов, из которых он синтезируется: этанола и этановой кислоты.На этой диаграмме красная часть молекулы представляет часть, ранее относившуюся к этанолу (минус H), а зеленая часть молекулы представляет часть этановой кислоты (минус OH). Этерификация — это форма дегидратационного синтеза, поэтому компоненты H и OH удаляются в виде воды.
В случае сложных эфиров, образованных из обычных карбоновых кислот, иногда используются более разговорные термины. Например, этановая кислота более широко известна как уксусная кислота, и поэтому ее сложные эфиры содержат в своих названиях «ацетат» вместо «этаноат».Другие такие замены включают «формиат» вместо «метаноат», «пропионат» вместо «пропаноат» и «бутират» вместо «бутаноат».
Химические формулы органических сложных эфиров обычно записываются в формате RCO 2 R ’, где R и R’ представляют собой углеводородные части карбоновой кислоты и спирта, соответственно. Например, бутилацетат, систематически известный как этановая кислота, является производным бутанола и уксусной кислоты и будет записан как CH 3 CO 2 C 4 H 9 .Обычны альтернативные представления, включая BuOAc и CH 3 COOC 4 H 9 . Циклические сложные эфиры известны как лактоны.
Структура и связь
Сложные эфирысодержат карбонильный центр, который дает валентные углы C-C-O и O-C-O 120 градусов из-за гибридизации sp 2 . В отличие от амидов, сложные эфиры представляют собой структурно гибкие функциональные группы, поскольку вращение вокруг связей C-O-C имеет более низкий энергетический барьер. Их гибкость и низкая полярность влияют на их физические свойства в макроскопическом масштабе; они имеют тенденцию быть менее жесткими, что приводит к более низкой температуре плавления, и более летучими, что приводит к более низкой температуре кипения, чем соответствующие амиды.PK a альфа-атомов водорода, или атомов водорода, связанных с углеродом, соседним с карбонилом, на сложных эфирах составляет около 25, что делает их по существу некислотными, за исключением присутствия очень сильных оснований.
Физические свойства и характеристики
Сложные эфиры более полярны, чем простые эфиры, но менее полярны, чем спирты. Они участвуют в водородных связях как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от их родительских спиртов и карбоновых кислот.Эта способность участвовать в водородных связях придает некоторую растворимость в воде в зависимости от длины присоединенных алкильных цепей. Поскольку в них нет атомов водорода, связанных с атомами кислорода, в отличие от спиртов и карбоновых кислот, сложные эфиры не связываются самостоятельно. Следовательно, сложные эфиры более летучие, чем карбоновые кислоты аналогичной молекулярной массы.
Характеристика и анализ
Сложные эфиры обычно идентифицируются с помощью газовой хроматографии с учетом их летучести. В ИК (инфракрасном) спектрах сложных эфиров наблюдается интенсивная резкая полоса в диапазоне 1730–1750 см –1 , приписываемая νC = O, или колебанию связи C = O.Этот пик изменяется в зависимости от функциональных групп, присоединенных к карбонилу. Например, бензольное кольцо или двойная связь в сочетании с карбонилом уменьшит волновое число примерно до 30 см -1 .
Реакционная способность
Сложные эфиры реагируют с нуклеофилами у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов, таких как амины, алкоксиды, источники гидридов и литийорганические соединения. Электрофильность карбонила может увеличиваться, если он протонирован; в кислой среде сложный эфир может гидролизоваться водой с образованием карбоновой кислоты и спирта.
Связи C-H, прилегающие к карбонилу, являются слабокислотными, но подвергаются депротонированию с помощью сильных оснований. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород слабоосновен (меньше, чем в амидах), но может образовывать аддукты с кислотами Льюиса.
Амины
Амины — это соединения, характеризующиеся наличием атома азота, неподеленной пары электронов и трех заместителей.
Цели обучения
Определите общие свойства аминов
Основные выводы
Ключевые точки
- Из-за неподеленной пары электронов амины являются основными соединениями.На основность соединения могут влиять соседние атомы, стерический объем и растворимость соответствующего катиона, который должен быть образован.
- Аминовые соединения могут образовывать водородную связь, что обеспечивает им растворимость в воде и повышенных температурах кипения.
- Общая структура амина — атом азота с неподеленной парой электронов и тремя заместителями. Однако азот может связываться с четырьмя заместителями, оставляя положительный заряд на атоме азота. Эти заряженные частицы могут служить промежуточными продуктами для важных реакций.
Ключевые термины
- алифатических : из класса органических соединений, в которых атомы углерода расположены в разомкнутой цепи.
- хиральный : Буквально «рука»; относится к соединению, в котором центральные атомы связаны с несколькими различными заместителями, так что зеркальное отображение соединения не идентично исходному.
- амин : Органические соединения или функциональная группа, содержащая основной атом азота с неподеленной парой.
- инверсия : для вторичного или третичного амина, связанного с тремя разными заместителями, переворот трех связей вокруг центрального атома азота, приводящий к противоположному стереоизомеру.
Функциональная группа амина содержит основной атом азота с неподеленной парой электронов. По существу, группа является производной аммиака, в которой один или несколько атомов водорода заменены углеродсодержащим заместителем. Соединения с группой азота, присоединенной к карбонилу в структуре, называются амидами, и они имеют структуру R-CO-NR’R ».Аминные группы, связанные с ароматической (сопряженной циклической) структурой, известны как ароматические амины. Ароматическая структура эффективно снижает щелочность амина, в то время как присутствие аминогруппы значительно снижает реакционную способность кольца из-за эффекта донорства электронов. Префикс «амино-» или суффикс «-амин» используется при названии аминового соединения. Органическое соединение с несколькими аминогруппами называется диамин, триамин, тетрамин и т. Д.
Структура амина
Амины обычно делятся на категории в зависимости от среды их связывания.Амины, в которых один из трех атомов водорода замещен алкильным или ароматическим заместителем, называются первичными аминами. Вторичные амины — это амины, которые имеют два заместителя и один водород, связанный с азотом. Третичные амины — это амины, атомы водорода которых полностью заменены органическими заместителями. Наконец, циклические амины — это такие амины, в которых азот включен в кольцевую структуру, что фактически делает его вторичным или третичным амином. Общая структура амина содержит атом азота, неподеленную пару электронов и три заместителя.Однако возможно наличие четырех органических заместителей у азота, что делает его катионом аммония с заряженным азотным центром.
Третичный амин : Центральный углерод присоединен к аминогруппе и трем другим атомам углерода.
Физические свойства аминов
Амины способны образовывать водородную связь. В результате точки кипения этих соединений выше, чем у соответствующих фосфинов, но ниже, чем у соответствующих спиртов, которые имеют более сильную водородную связь.Амины также обладают некоторой растворимостью в воде. Однако растворимость уменьшается с увеличением количества атомов углерода из-за увеличения гидрофобности соединения по мере увеличения длины цепи. Алифатические амины, которые представляют собой амины, связанные с алкильной цепью, проявляют растворимость в органических полярных растворителях. Ароматические амины, которые представляют собой амины, которые участвуют в сопряженном кольце, отдают свою неподеленную пару электронов бензольному кольцу, и, таким образом, их способность участвовать в водородных связях уменьшается.Это приводит к снижению их растворимости в воде и высокой температуре кипения.
Кислотность и щелочность аминов
Амины типа NHRR ’и NR’R’R” ’являются хиральными молекулами и могут подвергаться инверсии. Поскольку барьер для инверсии достаточно низкий (~ 7 ккал / моль), эти соединения не могут быть разделены оптически. Амины являются основаниями, и их основность зависит от электронных свойств заместителей (алкильные группы увеличивают основность; арильные группы уменьшают ее), стерических затруднений и степени сольватации протонированного амина.В общем, действие алкильных групп увеличивает энергию неподеленной пары электронов, тем самым повышая основность. Таким образом, можно ожидать, что основность амина будет увеличиваться с увеличением числа алкильных групп в амине. Кроме того, действие ароматического кольца делокализует неподеленную пару электронов на азоте в кольцо, что приводит к снижению основности. Сольватация протонированных аминов изменяется при их превращении в соединения аммония. Обычно соли соединений аммония проявляют следующий порядок растворимости в воде: первичный аммоний (RNH 3 + )> вторичный аммоний (R 2 NH 2 + )> третичный аммоний (R 3 NH + ).Соли четвертичного аммония обычно демонстрируют самую низкую растворимость из ряда.
Получение амина и реакционная способность
Образование имина : первичный амин реагирует с альдегидом с образованием имина.
В промышленности амины получают из аммиака путем алкилирования спиртами. Их также можно получить восстановлением нитрилов до аминов с использованием водорода в присутствии никелевого катализатора. Амины довольно реактивны благодаря своей основности, а также своей нуклеофильности.Большинство первичных аминов являются хорошими лигандами и реагируют с ионами металлов с образованием координационных комплексов. Одной из наиболее важных реакций аминов является их образование иминов или органических соединений, в которых азот участвует в двойной связи, при взаимодействии с кетонами или альдегидами.
Применение аминов
Амины повсеместно встречаются в биологии. Многие важные молекулы основаны на аминах, например, нейротрансмиттеры и аминокислоты. Их применение в мире включает в себя использование в качестве исходного материала для красителей и моделей для создания лекарств.Они также используются для обработки газа, например, для удаления CO 2 из дымовых газов.
Имя Реакции
Пожалуйста, используйте следующий URL, если вы хотите установить ссылку: https://www.organic-chemistry.org/ namedreactions/.
а
Конденсация уксусного эфира
Синтез сложного эфира ацетоуксусной кислоты
Конденсация ацилоина
Alder-Ene Reaction
Добавление альдола
Конденсация альдола
Аппель Реакция
Арбузова Реакция
Синтез Арндта-Эйстера
Азид-алкиновое 1,3-диполярное циклоприсоединение
Муфта Azo
б
Окисление Байера-Виллигера
Бейкер-Венкатараман Перестановка
Реакция Бальца-Шимана
Реакция Бэмфорда-Стивенса
Декарбоксилирование Бартона
Реакция Бартона-Маккомби (Barton Дезоксигенация)
Реакция Бейлиса-Хиллмана
Перестановка Бекмана
Перегруппировка бензиловой кислоты
Конденсация бензоина
Циклизация Бергмана
Реагент Bestmann-Ohira
Реакция Бигинелли
Обрезка березы
Реакция Бишлера-Наперальского
Реакция Блеза
Блан Реакция
Синтез пиридина Больмана-Ратца
Бороновая кислота Реакция Манниха
Редукция Буво-Блан
Перестройка ручья
Коричневая гидроборация
Реакция Бухерера-Бергса
Поперечная муфта Бухвальда-Хартвига Реакция
с
Муфта Кадиот-Ходкевич
Снижение окисления Канниццаро
Сокращение CBS
Муфта Чан-Лам
Конденсация Клайзена
Перегруппировка Клайзена
Редукция Клемменсена
Нажмите Химия
Реагент Коллинза
Устранение ловкости
Перестановка копий
Реакция Кониа-Эне
Сокращение Кори-Бакши-Шибата
Реакция Кори-Чайковского
Реакция Кори-Фукса
Окисление Кори-Кима
Реакция Кори-Зеебаха
Кори-Саггс Реагент
Синтез олефинов Кори-Винтер
Синтез кумарина
Механизм Криджи для озонолиза
Перекрестный метатезис
Перегруппировка Курция (Реакция)
d
Реакция Дакина
Конденсация Дарзенса
Реакция Дарзенса
Окисление по Дэвису
Синтез азиридина De Kimpe
Реакция Дельпина
Окисление Десс-Мартина
Диазотизация
Конденсация Дикмана
Реакция Дильса-Альдера
1,3-диполярное циклоприсоединение
Направленная орто-металлизация
Модификация Добнера
e
Реакция Эглинтона
Ene Reaction
Энинский метатезис
Эпоксидирование
Реакция Эшвайлера-Кларка
Пиролиз сложного эфира
Этерификация
f
Реакция Фаворского
Реакция Финкельштейна
Этерификация Фишера
Синтез индола по Фишеру
Окисление Флеминга-Тамао
Ацилирование Friedel-Crafts
Алкилирование по Friedel-Crafts
Синтез Фридлендера
Перестановка картофеля
Муфта Фукуяма
Сокращение Фукуямы
г
Габриэль Синтез
Реакция Гевальда
Стеклянная муфта
Griesbaum Coozonolysis
Реакция Гриньяра
Реакция Граббса
h
Галоформная реакция
Hantzsch дигидропиридин Синтез (синтез пиридина)
Сцепка для сена
Чудесная реакция
Реакция Ад-Фольхарда-Зелинского
Реакция Генри
Муфта Hiyama
Муфта Хияма-Дания
Ликвидация Хофмана
Правило Гофмана
Реакция Хорнера-Уодсворта-Эммонса
Реакция Хосоми-Сакураи
Huisgen Cycloaddition
Реакция Хунсдикера
Гидроборация
я
Ирландия — Перегруппировка Клейзена
Сокращение Ицуно-Кори
Реакция Иванова (Реагент)
j
Эпоксидирование Якобсена
Эпоксидирование Якобсена-Кацуки
Шутливая реакция
Джонсон-Кори-Чайковский Реакция
Оксидейшн по Джонсу
Олефинирование Джулия-Литгоу
Юлия-Коценски Олефинирование
к
Реакция Кабачника-Поля
Реакция Киндлера
Конденсация Кневенагеля
Коти Реакция
Электролиз по Кольбе
Кольбе Нитрильный синтез
Реакция Кольбе-Шмитта
Реагент Козера
Кулинкович Реакция
Реакция Кулинковича-де Мейере
Реакция Кулинковича-Шимоняка
Муфта Kumada
л
Реагент Лавессона
Лейкарт Тиофенол Реакция
Люче Редукция
м
Синтез малонового эфира
Реакция Манниха
Правило Марковникова
Реакция Макмерри
Meerwein-Ponndorf-Verley Редукция
Модификация Майерса Реакция Рамберга-Бклунда
Циклизация Майерс-Сайто
Майкл Дополнение
Михаэлис-Арбузов Реакция
Мицунобу Реакция
Реакция борилирования Мияуры
Модифицированная Юлия Олефинирование
Дополнение Mukaiyama Aldol
n
Назаров Циклизация
Неф Реакция
Муфта Негиши
Перегруппировка Ньюмана-Кварта
Нитроальдол Реакция
Муфта Нодзаки-Хияма
Нуклеофильное замещение (S N 1 / S N 2)
o
Синтез аминокислот О’Доннелла
Реагент Охира-Бестманна
Метатезис олефинов
Окисление Оппенауэра
Перестановка сверхчеловека
Перегруппировка Окси-Копа
Озонолиз
п
Синтез фурана Пааль-Кнорра
Синтез пиррола Пааль-Кнорра
Paal-Knorr Синтез тиофена
Реакция Пассерини
Реакция Патерно-Бчи
Реакция Паусона-Ханда
Конденсация Пехмана
Петазисная реакция
Peterson олефинирование
Реакция связывания пинакола
Перегруппировка Пинакола
Пиннер Реакция
Prvost Реакция
Прилежаев Реакция
Реакция Принса
Реакция Пшорра
в
р
Реакция Рамберга-Бклунда
Реакция Реформатского
Метатезис замыкающего кольца
Метатезис открытия кольца (Полимеризация)
Реакция Риттера
Аннулирование Робинсона
Редукция Розенмунда
Реакция Розенмунда-фон Брауна
Рубиновое окисление
с
Сакурай Реакция
Реакция Сандмейера
Правило Сайцева
Реакция Шимана
Модификация Шлоссера
Реакция Шмидта
Реакция Шоттена-Баумана
Seebach Umpolung
Сертификат Сейферта-Гилберта
Реагент Саретта
Реакция Шапиро
Аминогидроксилирование по Шарплесу
Дигидроксилирование по Шарплесу
Эпоксидирование по методу Sharpless
Эпоксидирование Ши
Реакция Симмонса-Смита
Муфта Соногашира
Циклоприсоединение Staudinger
Реакция Штаудингера
Редукция Штаудингера
Синтез Штаудингера
Этерификация Штеглиха
Реакция Стеттера
Соединительная муфта
Синтез Стрекера
Suzuki Сцепление
Окисление по Сверну
т
Тамао-Кумада Окисление
Теббе Олефинирование
Тищенко Реакция
Реакция Цудзи-Троста
Аллиляция Троста
u
Уги Реакция
Реакция Ульмана
Дигидроксилирование Апджона
v
Синтез имидазола по Ван Лейзену
Синтез оксазола Ван Лойзена
Реакция Ван Лойзена
Викариозный нуклеофильный Замена
Реакция Вильсмайера
w
Окисление Wacker-Tsuji
Синтез кетонов Вайнреба
Синтез Венкера
Реакция Вильгеродта-Киндлера
Синтез Вильямсона
Реакция Виттига-Хорнера
Реакция Виттига
[1,2] -Перестановка Виттига
[2,3] -Перестановка Виттига
Реакция Воля-Циглера
Редукция Вольфа-Кишнера
Перестановка Вольфа
Woodward цис -Гидроксилирование
Реакция Вудворда
Реакция Вюрца
Реакция Вюрца-Фиттига
х
y
Этерификация Ямагути
z
Почему возникают именные реакции?
Название реакции почитают первооткрывателей революционных химических реакций или уточнения ранее известных преобразований способом, которым многие ученые имеют свои имена, связанные с эффектом или явлением, уравнением, константой, и т.п.В некоторых случаях человек, имя которого связано с реакцией, был не первый, кто обнаружил реакцию, но вместо этого сумел популяризировать ее. Названия реакций также могут просто описывать тип реакции, часто используя инициалы или относящиеся к структурным особенностям.
Например, очень важной областью химического синтеза является углерод-углерод. образование связи, и существует очень много именных реакций, описывающих такие трансформации. В этой области разработана процедура использования магнийорганические соединения Виктора Гриньяра привели к совершенно новому добавлению реакции, которые чрезвычайно расширили возможности органического синтеза.В исторический поворот, Гриньяр не был первым, кто использовал такие реагенты, а скорее упростил процедуру за счет создания реагента с высокой реакционной способностью на месте. Этот популяризировал использование родственных преобразований, которые ранее были довольно утомительно, так как необходимо было приготовить чувствительные магнийорганические реагенты отдельно и хранится. Чаще всего используются то, что мы теперь знаем как реактивы Гриньяра. в дополнение к карбонильным соединениям, которые обеспечивают спирты или другие продукты в высокие выходы, и этот процесс в настоящее время называют реакцией Гриньяра.В другом важном случае многим реакциям образования связи C-C способствует палладиевый катализ, что приводит к более эффективному использованию реагентов и многому другому легкодоступные условия. Примером является синтез биарильных фрагментов, субструктуры, которые часто встречаются в соединениях, представляющих интерес в медицинских химия. Как показатель того, насколько полезны эти реакции, названные реакции для многих вариантов катализируемого палладием биарильного сочетания реакции стали актуальными всего через несколько лет после открытия, даже во время время жизни соответствующих авторов, таких как (Макото) Кумада, (Джон Кеннет или Дж.К.) Муфта Стилла и (Акиры) Сузуки. Другие химики, разрабатывающие специфические варианты, улучшения или гибридные условия, их имена добавляются как в соединении Кумада-Тамао-Корриу.
Помимо использования имен химиков, у нас также есть новаторские реакции, которые стали известны по аббревиатурам описательных названий, таких как «RCM» (метатезис с замыканием кольца) или INOC (внутримолекулярный оксид нитрила) циклизация). Мы редко используем имя химика, разработавшего RCM (Роберт Граббс), чтобы указать на реакцию, но его вклад признается. применяя его имя к используемым рутениевым катализаторам.Таким образом, мы говорим о «Граббсе». катализатор »или« катализатор Граббса 2-го поколения ». Помимо таких названий, как« RCM », некоторые часто используемые реакции названы по структурным особенностям предшественника или продукт. Примеры включают «альдольную реакцию» («альдол» — это сокращение от соединение, которое содержит как альдегидные, так и спиртовые функциональные группы) или «пинакол» перестановка «.
Почему мы должны узнавать десятки (или сотни!) Именных реакций?
Как упоминалось выше, именные реакции используются для обозначения новаторских реакции или связанные механизмы или принципы, которые стоит знать и держась прямо.Так же, как врачи должны выучить названия органов и геологи названия минералов, химики или студенты химии используют название реакции как способ систематизации своих знаний и обмена информацией о химических трансформации. В лабораторных обсуждениях люди очень часто используют именные реакции. чтобы сослаться на эксперименты, которые они проводят, или на химические проблемы, которые они расследование. Реакция на имя — это своего рода сокращение, которое избавляет от необходимости дать более развернутое объяснение особенностей того или иного преобразования интерес.Упоминание названия реакции позволяет знающему слушателю высказать свое мнение. иметь в виду возможные субстраты, условия реакции или механистические детали. Ожидается, что каждый в этой области должен знать наизусть базовый набор именных реакций, и это сокращает время обсуждения. Таким образом, именные реакции стать частью общего словаря химиков по органическому синтезу. При встрече коллега-химик, например, на конференции или во время собеседования, это можно сделать первоначальную оценку уровня и глубины вашего слушателя знания и опыт, обращаясь к экзотической реакции имени.Такой распознавание может сигнализировать о том, что слушатель (или кандидат на работу) имеет команду конкретная область химии. Это означает, что он или она были бы способны понимание деталей синтетических маршрутов в описываемой работе и может возможно разработать альтернативы.
Глава 7 — Алканы и галогенированные углеводороды — Химия
Глава 7: Алканы и галогенированные углеводородыЭтот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Вступительное эссе 7.1 Распознавание органических структур 7.2 Введение в алканы Алканы с прямой цепью Алканы с разветвленной цепью Циклоалканы Классификация углеродных связей 7.3 Свойства алканов Точки плавления и кипения Растворимость Свойства алканов и опасность для окружающей среды: более внимательный взгляд 7.4 Химическая реакционная способность алканов Реакции горения Реакции галогенирования (Тип замещения) Алканы для крекинга 7.5 Краткое содержание главы 7.6 Упражнения в конце главы 7.7 СсылкиВступительное эссе
Углеводороды — это простейшие органические соединения, но они обладают интересными физиологическими эффектами.Эти эффекты зависят от размера молекул углеводородов и от того, где на теле или в теле они применяются. Алканы с низкой молярной массой — от 1 до примерно 10 или около того атомов углерода — представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («нюхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего действия является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или головного мозга или к немедленной смерти от удушья из-за отсутствия кислорода. Канистры под давлением с пропаном и бутаном, оба из которых предназначены для использования в качестве топлива, используются как ингалянты.
Рисунок 7.1. Ряд продуктов на нефтяной основе, которыми можно злоупотреблять в качестве ингалянтов . Автор фото: Лэнс Капрал. Мэтью К. Хакер
Проглоченные жидкие алканы в желудке не причиняют большого вреда. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах). Легкие не могут выводить жидкость, как при пневмонии, вызванной бактериями или вирусами. Людей, которые проглотили бензин или другие смеси жидких алканов, не следует вызывать рвоту, поскольку это увеличивает вероятность попадания алканов в легкие.(Противоядия от отравления бензином в домашних условиях не существует; позвоните в токсикологический центр.)
Жидкие алканы с приблизительно 5–16 атомами углерода на молекулу смывают естественные кожные кожные масла и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие приблизительно 17 или более атомов углерода на молекулу) действуют как смягчающие средства (смягчители кожи). В качестве защитной пленки можно использовать такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В этой главе мы исследуем алканы, соединения, содержащие только два элемента, углерод и водород, и имеющие только одинарные связи. Мы также будем исследовать алканы, в структуру которых входят галогены. Напомним, что галогены являются элементами семейства 7A периодической таблицы Менделеева и содержат репрезентативные элементы, такие как хлор, фтор, йод и бром. Есть несколько других видов углеводородов, различающихся типом связи между атомами углерода и свойствами, возникающими в результате этой связи.В главе 8 мы рассмотрим углеводороды с двойными связями, с тройными связями и с особым видом связи, называемым ароматичность . Затем в главе 9 мы изучим некоторые соединения, которые считаются производными от углеводородов, путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 10 посвящена органическим кислотам и основаниям.
(Вернуться к началу)7.1 Распознавание органических структур Цель обучения
- Чтобы уметь распознавать состав и свойства, типичные для органических и неорганических соединений.
Ученые 18-го и начала 19-го веков изучали соединения, полученные из растений и животных, и назвали их органическими , поскольку они были изолированы от «организованных» (живых) систем. Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были помечены как неорганические . В течение многих лет ученые считали, что органические соединения могут производиться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам.Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Велер синтезировал мочевину из неорганических исходных материалов. Он прореагировал цианат серебра (AgOCN) и хлорид аммония (NH 4 Cl), ожидая получить цианат аммония (NH 4 OCN). То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCN
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, легко выделяемое из мочи.Этот результат привел к серии экспериментов, в которых из неорганических исходных материалов были получены самые разные органические соединения. Теория жизненной силы постепенно исчезла, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия была реклассифицирована как изучение соединений, содержащих углерод, а неорганическая химия — это изучение химии всех других элементов. Может показаться странным, что мы разделяем химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 оставшихся элементов.Однако такое разделение кажется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.
ПримечаниеСлово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты — это, как правило, продукты, выращенные без синтетических пестицидов и удобрений. Органическая химия — это химия соединений углерода.Углерод уникален среди других элементов тем, что его атомы могут образовывать стабильные ковалентные связи друг с другом и с атомами других элементов во множестве вариаций. Полученные молекулы могут содержать от одного до миллионов атомов углерода.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах между органическими и неорганическими молекулами. Тем не менее, полезно сравнить типичные члены каждого класса, как в таблице 7.1 (Однако имейте в виду, что для каждой категории в этой таблице есть исключения.) Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, в таблице 7.1 также перечислены свойства неорганического соединения хлорида натрия (обычная поваренная соль, NaCl) и органическое соединение гексан (C 6 H 14 ), растворитель, который используется для экстракции соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию определенных типичных свойств, как показано в таблице 7.1.
Таблица 7.1 Общие контрастные свойства и примеры органических и неорганических соединений
Упражнения по обзору концепции: нажмите, чтобы ответить на вопросы
Ключевые вынос- Органическая химия — это изучение соединений углерода, почти все из которых также содержат атомы водорода.
Классифицируйте каждое соединение как органическое или неорганическое.
- С 6 В 10
- CoCl 2
- C 12 H 22 O 11
Классифицируйте каждое соединение как органическое или неорганическое.
- CH 3 NH 2
- NaNH 2
- Cu (NH 3 ) 6 Класс 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 OH и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
- органические
- неорганическое
- органический
(Вернуться к началу)
7.2 Введение в Алканы
Алканы — это органические соединения, которые полностью состоят из одинарных атомов углерода и водорода и лишены каких-либо других функциональных групп. Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также представляют собой насыщенных углеводородов, , то есть все атомы углерода «насыщены» атомами водорода и не содержат никаких углерод-углеродных двойных или тройных связей.Алканы — это простейшие и наименее химически активные углеводородные соединения, содержащие только углерод и водород. Они имеют большое коммерческое значение, поскольку являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (таких как гексаны) делегируется в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности.Другими словами, он не содержит двойных или тройных связей, которые обладают высокой реакционной способностью в органической химии. Хотя они не полностью лишены реакционной способности, их отсутствие реакционной способности в большинстве лабораторных условий делает их относительно неинтересным, но очень важным компонентом органической химии. Как вы узнаете позже, энергия, заключенная в связях углерод-углерод и углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Рисунок 7.2. Примеры алканов
Алканы с прямой цепью
Алканы с прямой цепью, метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) представляют собой начало ряда соединений, в которых любые два члены в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 (рис. 7.3)
Рисунок 7.3 Три простейших алкана
Первые 10 членов этой серии приведены в таблице 7.2. Обратите внимание, что по мере увеличения длины углеродной цепи количество возможных различных структурных изомеров также увеличивается.
Таблица 7.2 Первые 10 алканов с прямой цепью
Начиная с пропана (C 3 H 8) и далее, вы заметите, что единственное различие между углеводородами с более длинной цепью заключается в добавлении единиц CH 2 по мере продвижения вверх по ряду (рис.7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологической серией и может быть определено математически. Члены такой серии называли гомологами. В органической химии гомологи обладают свойствами, которые изменяются закономерно и предсказуемо. Таким образом, принцип гомологии обеспечивает организацию органической химии во многом так же, как периодическая таблица дает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и из них вывести некоторые свойства других соединений в этом ряду.
Рисунок 7.4 Члены гомологической серии
Обратите внимание, что на рис. 7.4 каждая следующая формула включает на один атом углерода и на два атома водорода больше, чем предыдущая формула. Принцип гомологии позволяет нам написать общую формулу для алканов: C n H 2 n + 2 .Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Упражнения по обзору концепцииВ гомологическом ряду алканов, какова молекулярная формула члена чуть выше C 8 H 18 ?
Воспользуйтесь общей формулой алканов, чтобы написать молекулярную формулу алкана с 12 атомами углерода.
Алканы с разветвленной цепью
Мы можем записать структуру бутана (C 4 H 10 ), разместив четыре атома углерода в ряд,
–C – C – C – C–
, а затем добавив достаточно атомов водорода, чтобы каждый атом углерода получил четыре связи:
Составной бутан имеет такую структуру, но есть другой способ соединить вместе 4 атома углерода и 10 атомов водорода. Поместите 3 атома углерода в ряд, а затем ответвите четвертый от среднего атома углерода:
Теперь мы добавляем достаточно атомов водорода, чтобы у каждого углерода было четыре связи.
Есть углеводород, который соответствует этой структуре, что означает, что два разных соединения имеют одинаковую молекулярную формулу (C 4 H 10 ), но разное расположение атомов в пространстве. Напомним, что соединения, имеющие ту же молекулярную формулу, но другое расположение в пространстве, называются структурными изомерами . Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Рис. 7.5 Бутан и изобутан. Шариковые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображена с изогнутой цепью на рисунке 7.5. Цепь из четырех атомов углерода может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей C – C. Однако это вращение не меняет идентичности соединения.Важно понимать, что изгиб цепи , а не не изменяет идентичность соединения; все следующие элементы представляют собой одно и то же соединение:
Формула изобутана показывает непрерывную цепочку только из трех атомов углерода, с четвертым присоединенным как ответвление от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H 8 ) не существуют в изомерных формы, потому что существует только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи.
Примечание
Непрерывная (неразветвленная) цепочка атомов углерода часто называется прямой цепью , хотя тетраэдрическое расположение каждого углерода придает ей зигзагообразную форму. Алканы с прямой цепью иногда называют нормальными алканами , и их названиям дается префикс n -. Например, бутан называется n -бутан.
Упражнения по обзору концепцииВ алканах может быть двухуглеродная ветвь от второго атома углерода четырехуглеродной цепи? Объяснять.
Студенту предлагается написать структурные формулы для двух разных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линию, с группой CH 3 , идущей вниз от первого, присоединенной к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.
Нет; ветвь будет самой длинной непрерывной цепочкой из пяти атомов углерода.
Нет; оба представляют собой пятиуглеродные непрерывные цепи.
- Алканы с четырьмя или более атомами углерода могут существовать в изомерных формах.
Кратко опишите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Изобразите структурные изомеры следующих алканов.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Канал 3 Канал 2 Канал 2 Канал 3 и
Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 и
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.
Напишите краткую структурную формулу для каждой структурной формулы.
Конденсированная структурная формула для изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 . Нарисуйте формулу линейного угла для изогексана.
Нарисуйте формулу линейного угла для соединения CH 3 CH 2 CH (CH 3 ) CH 2 CH 2 CH 3 .
Приведите структурную формулу соединения, представленного этой формулой линейного угла:
(Вернуться к началу)
Циклоалканы
Циклоалканы очень важны в компонентах продуктов питания, фармацевтических препаратов и многого другого.Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы — это алканы, имеющие форму кольца; следовательно, для названия этих алканов используется префикс цикло . Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5 °.
Источник: Википедия
Для образования некоторых циклоалканов угол между связями должен отклоняться от этого идеального угла, эффект известен как угловая деформация .Кроме того, некоторые атомы водорода могут оказаться ближе друг к другу, чем это желательно (затмиться), эффект, называемый деформацией кручения . Эти дестабилизирующие эффекты, угловая деформация и деформация кручения известны вместе как кольцевая деформация . Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие кольцевые деформации, поскольку их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан — более стабильная молекула с небольшой степенью деформации кольца, в то время как циклогексан способен принять идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 ° и никакие водороды не затмеваются; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рисунке 7.6 представлены примеры циклоалкановых структур.
Рисунок 7.6. Типичные циклоалкановые структуры. Указаны средние валентные углы и энергия деформации.
Для вашего здоровья: Циклопропан как анестетикЦиклопропан с температурой кипения -33 ° C представляет собой газ при комнатной температуре. Это также мощный анестетик быстрого действия с небольшим количеством нежелательных побочных эффектов в организме. Однако он больше не используется в хирургии, поскольку образует взрывоопасные смеси с воздухом почти во всех концентрациях.
(Вернуться к началу)
Классификация углеродных связейАтомы углерода, участвующие в химических связях внутри молекулы, можно классифицировать по количеству образующихся углерод-углеродных связей.
- первичный атом углерода : один сосед углерода
- вторичный атом углерода : два соседних атома углерода
- третичный атом углерода : три соседних атома углерода
- четвертичный атом углерода : четыре соседних атома углерода
Число соседних атомов углерода у атома углерода может помочь определить реакционную способность этого положения углерода. Таким образом, важно уметь распознавать, является ли атом углерода первичным, вторичным, третичным или четвертичным по своей структуре (рис.7.7).
Рисунок 7.7. Классификация атомов углерода на первичные, вторичные, третичные или четвертичные. В приведенных выше молекулах центральный углерод оценивается по количеству атомов углерода, которые связаны непосредственно с центральным углеродом. Первичный углерод связан с одним углеродом, вторичный углерод связан с двумя углеродными атомами, третичный углерод связан с тремя углеродными атомами, а четвертичный углерод связан с четырьмя углеродными атомами.
В любой данной молекуле можно классифицировать каждый атом углерода (рис.7.8).
Рисунок 7.8. Классификация атомов углерода в молекуле
(Вернуться к началу)
7.3 Свойства алкановАлканы — это простейшее семейство углеводородов — соединений, содержащих углерод и водород только с углеродно-водородными связями и одинарными углерод-углеродными связями. Алканы не очень реакционноспособны и обладают небольшой биологической активностью; все алканы не имеют цвета и запаха.Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Давайте сначала рассмотрим их физические свойства.
Таблица 7.3 описывает некоторые свойства некоторых из первых 10 алканов с прямой цепью. Почти все алканы имеют плотность менее 1,0 г / мл и поэтому менее плотны, чем вода (плотность H 2 O равна 1.00 г / мл при 20 ° C).
Таблица 7.3 Физические свойства некоторых алканов
Присмотритесь: плотность газа и опасность пожараТаблица 7.3 показывает, что первые четыре члена алканового ряда являются газами при обычных температурах. Природный газ состоит в основном из метана, плотность которого составляет около 0,67 г / л. Плотность воздуха около 1,29 г / л. Поскольку природный газ менее плотен, чем воздух, он поднимается вверх.Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть пропаном (плотность 1,88 г / л) или бутаном (смесь бутана и изобутана; плотность около 2,5 г / л). Оба намного тяжелее воздуха (плотность 1,2 г / л). Если баллонный газ попадает в здание, он собирается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что избавить помещение от более тяжелого газа труднее.
(Вернуться к началу)
Точки плавления и кипенияИ точки плавления, и точки кипения алканов являются характеристиками межмолекулярных сил, обнаруживаемых между молекулами. Разница в электроотрицательности углерода и водорода (2,1 — 1,9 = 0,2) мала; следовательно, связь C-H неполярна, а это означает, что единственными притяжениями между одной молекулой и ее соседями будут силы лондонской дисперсии.Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться с увеличением размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекулы из-за увеличения лондонских дисперсионных сил. (т.е. межмолекулярные силы сильнее в более крупных углеводородах, следовательно, требуется больше энергии, чтобы вызвать фазовые изменения). На рис. 7.9 показаны тенденции плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Рисунок 7.9. Точки плавления и кипения алканов с прямой цепью
По материалам: Techstepp
Что касается изомеров, то чем более разветвлена цепь, тем ниже температура кипения. Лондонские дисперсионные силы меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями. Коротким объемным молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактным) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, плавления и плотности, чем алканы. Это происходит из-за более сильных сил Лондона, потому что форма кольца допускает большую площадь контакта.
(Вернуться к началу) РастворимостьАлканы (как нормальные, так и циклоалканы) практически не растворимы в воде, но растворяются в органических растворителях. Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений.Когда молекулярное вещество растворяется в воде, должно происходить следующее:
- нарушение межмолекулярных сил внутри вещества. В случае алканов это лондонские дисперсионные силы.
- нарушение межмолекулярных сил в воде, чтобы вещество могло поместиться между молекулами воды. В воде основным межмолекулярным притяжением являются водородные связи.
Для разрушения любого из этих притяжений требуется энергия, хотя количество энергии, необходимое для разрушения лондонских дисперсионных сил в соединении, таком как метан, относительно незначительно; это не относится к водородным связям в воде.Напомним, что водородные связи намного прочнее.
Чтобы упростить, вещество будет растворяться, если при образовании новых связей между веществом и водой выделяется достаточно энергии, чтобы восполнить энергию, необходимую для разрушения первоначального притяжения. Единственное новое притяжение между алканом и молекулами воды — это лондонские дисперсионные силы. Эти силы не выделяют достаточного количества энергии для компенсации энергии, необходимой для разрыва водородных связей в воде.Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Рисунок 7.10. Углеводороды с длинной цепью нерастворимы в воде. Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности границы раздела вода / масло.В этом случае масло менее плотное, чем вода, и будет плавать поверх слоя воды.
Растворимость в органических растворителяхВ большинстве органических растворителей основными силами притяжения между молекулами растворителя являются дисперсионные силы Лондона. Следовательно, когда алкан растворяется в органическом растворителе, дисперсионные силы Лондона нарушаются и заменяются новыми дисперсионными силами Лондона между смесью. Эти два процесса более или менее энергетически нейтрализуют друг друга; таким образом, нет барьера для растворимости.
(Вернуться к началу)
Свойства алканов и опасность для окружающей среды: более пристальный взглядИз-за растворимости и плотности алканов разливы нефти в океане или других водоемах могут иметь разрушительные экологические последствия. Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рисунке 7.11. Поскольку нефтяное пятно остается на поверхности воды, организмы, наиболее подверженные воздействию нефтяных пятен, — это те организмы, которые встречаются на поверхности океана или вблизи береговой линии, в том числе каланы и морские птицы.Химические составляющие масла токсичны при проглатывании, вдыхании, а также при раздражении кожи и глаз.
Рисунок 7.11 Разливы нефти. Нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная вышка Deepwater Horizon затонула в результате взрыва. Утечка была на милю ниже поверхности, что затрудняло оценку размера разлива. Один литр масла может создать пятно размером 2,5 гектара (6,3 акра). Этот и аналогичные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Источник: Фото любезно предоставлено NASA Goddard / MODIS Rapid Response Team.
Упражнения по обзору концепцииНе обращаясь к таблице, сделайте прогноз, у которого температура кипения выше — гексан или додекан. Объяснять.
Если к 100 мл воды в химическом стакане добавить 25 мл гексана, чего из следующего вы ожидаете? Объяснять.
- Гексан растворяется в воде.
- Гексан не растворяется в воде и плавает сверху.
- Гексан не растворяется в воде и опускается на дно емкости.
додекан из-за большей молярной массы
б; гексан не растворим в воде и менее плотен, чем вода.
- Алканы — это неполярные соединения, низкокипящие и нерастворимые в воде.
Не обращаясь к таблице или другой справочной информации, спрогнозируйте, какой член каждой пары имеет более высокую точку кипения.
- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- натрия хлорид или соевое масло
(Вернуться к началу) 7.4 Химическая реакционная способность алкановАлканы содержат сильные одинарные углерод-углеродные связи и сильные углерод-водородные связи. Обе эти связи неполярны. Следовательно, в молекуле нет части, несущей сколько-нибудь значительный положительный или отрицательный заряд, который требуется для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей.Рассмотрим, например, бутан:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. Фактически, алканы подвергаются так мало реакциям, что их иногда называют парафинами , от латинского parum affinis , что означает «слабое сродство».
В результате алканы обладают очень низкой реакционной способностью и подвергаются только трем основным типам реакций, включая следующие:
- Реакции горения — сжечь их — уничтожить всю молекулу;
- Реакции галогенирования (замещения) — реагируют с некоторыми галогенами, разрывая углерод-водородные связи;
- Реакции крекинга — используют тепло и / или катализатор для крекинга алканов, разрыва углерод-углеродных связей.
Реакции горенияСжигание соединений углерода, особенно углеводородов, было самым важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массивные и неконтролируемые химические изменения, происходящие при горении, затрудняют установление механистических путей. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей.Никакая другая обычная реакция не включает в себя столь глубоких и всепроникающих изменений, а механизм горения настолько сложен, что химики только начинают исследовать и понимать некоторые из его элементарных особенностей.
CH 3 CH 2 CH 3 + 5O 2 → 3CO 2 + 4H 2 O + тепло
Обратите внимание, что в приведенной выше реакции соединения в левой части стрелки называются субстратами или реагентами , а соединения в правой части стрелки являются продуктами реакции .Энергия, чаще всего выделяемая в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от вовлеченных соединений. Также обратите внимание, что ни один из атомов не теряется в рамках данного химического уравнения. Закон сохранения массы гласит, что материю нельзя ни создать, ни уничтожить. Таким образом, уравнение должно быть сбалансировано и иметь такое же количество атомов в левой части уравнения, что и в правой. Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что, если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 моль диоксида углерода (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Химические связи также содержат потенциальную энергию. Если вы думаете о природе связи, она удерживается энергией притяжения. Чтобы разорвать связи на стороне реагента уравнения, требуется энергия, в то время как образование связей на стороне продукта высвободит энергию.Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, энергия будет высвобождаться в результате реакции. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпией .
Важны два момента относительно этой реакции:
- Поскольку все ковалентные связи в молекулах реагентов разорваны, количество тепла, выделяемого в этой реакции, связано с прочностью этих связей (и, конечно же, прочностью связей, образующихся в продуктах).Эти теплоты могут быть оценены с использованием энергии диссоциации / образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения и энергия, высвобождаемая при образовании связи на стороне продукта уравнения).
- Стехиометрия реагентов также важна. Если подается недостаточное количество кислорода, некоторые продукты будут состоять из менее окисленного газообразного монооксида углерода (CO).
Например, если бы присутствовало только 4 моля кислорода, при сгорании одного моля пропана образовался бы только 1 моль диоксида углерода и 2 моля монооксида углерода.
CH 3 CH 2 CH 3 + 4O 2 → CO 2 + 2CO + 4H 2 O + тепло
Энергия связиАтомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем они обладают как отдельные атомы. Количество энергии, равное разнице между энергиями связанных атомов и энергиями отделенных атомов, обычно выделяется в виде тепла.То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, в результате чего образуются другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
2H 2 O → 2H 2 + O 2
Для разрыва связи всегда требуется энергия, известная как энергия связи .Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Ключевые выводы:- Для разрыва связи всегда требуется энергия.
- Энергия всегда высвобождается при заключении облигации.
Хотя каждая молекула имеет свою характерную энергию связи, возможны некоторые обобщения.Например, хотя точное значение энергии связи C – H зависит от конкретной молекулы, все связи C – H имеют примерно одинаковую энергию связи, поскольку все они являются связями C – H. Для разрыва 1 моля связи C – H требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи C – H как около 100 ккал / моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а связь C = C имеет энергию связи около 145 ккал / моль. Мы можем вычислить более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.В таблице 7.2 представлен список средних значений энергии связи для обычных органических связей. Помните, что энергия может быть измерена в ккал или кДж, а коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
руб.Таблица 7.4: Средняя энергия связи (кДж / моль) Одинарные облигации Множественные облигации H — H 432
N — H 391
I — I 149
С = С 614
H — F 565
N — N 160
I — Класс 208
C ≡ C 839
H — Класс 427
N — F 272
I — Br 175
O = O 495
H — Br 363
N — Класс 200
C = O * 745
H — I 295
N – Br 243
S — H 347
C ≡ O 1072
N — O 201
S — F 327
N = O 607
C — H 413
O — H 467
S — Класс 253
N = N 418
С — С 347
O — O 146
S – Br 218
N ≡ N 941
C — N 305
O — F 190
S — S 266
C ≡ N 891
С — О 358
O — Cl 203
C = N 615
C — F 485
O — I 234
Si — Si 340
C — Класс 339
Si — H 393
C — Br 276
F — F 154
Si — C 360
C — I 240
F — Класс 253
Si — O 452
C — S 259
F — Br 237
Cl — Cl 239
Cl — Br 218
руб. — 193
* C = O дюйм (CO 2 ) = 799
Когда связь прочная, энергия связи выше, потому что для разрыва прочной связи требуется больше энергии.Это коррелирует с порядком и длиной облигации. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем выше энергия связи из-за повышенного электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Разрыв и образование связиКогда происходит химическая реакция, атомы в реагентах меняют свои химические связи, образуя продукты. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах.Следовательно, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энергии реакции или теплота реакции называется энтальпией . Он представлен математическим символом ΔH и рассчитывается как разность энергии, необходимой для разрыва связей реагентов, за вычетом энергии, высвобождаемой при образовании связей в продуктах.
ΔH = энергия реагентов — энергия продуктов
Рисунок 7.12: Энтальпия реакции. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции выделяется энергия, поскольку реагенты превращаются в продукты. (низшая реакция) Эндотермические реакции. При эндотермической химической реакции энергия поглощается, поскольку реагенты превращаются в продукты.
В некоторых реакциях энергия образующихся продуктов ниже энергии реагентов. Таким образом, в ходе реакции избыточная энергия, выделяемая при образовании продукта, будет передаваться в окружающую среду.Такие реакции являются экзотермическими и могут быть представлены диаграммой уровней энергии на рис. 7.12 (верхний). В большинстве случаев энергия выделяется в виде тепла (хотя некоторые реакции выделяют энергию в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы иметь возможность реагировать. Эти реакции являются эндотермическими и могут быть представлены в виде диаграмм уровней энергии, подобных рисунку 7.12 (внизу).
Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо «продукт» реакции, либо «реагент», соответственно.Экзотермические реакции высвобождают энергию, поэтому энергия — это продукт. Эндотермические реакции требуют энергии, поэтому энергия — это реагент.
Экзотермические реакции будут иметь отрицательную общую энтальпию, а эндотермические реакции будут иметь положительную общую энтальпию.
ΔH = энергия реагентов — энергия продуктов
Энергия реакции может быть обработана стехиометрически внутри реакции так же, как любое из соединений внутри реакции.При сжигании метана, CH 4 , каждый сожженный моль выделяет 824 кДж энергии. Таким образом, легко подсчитать, сколько энергии выделяется при сжигании любого количества CH 4 . Мы также можем легко подсчитать, сколько CO 2 образуется на каждый моль сожженного CH 4 , поскольку на каждый моль сожженного CH 4 образуется один моль CO 2 .
(Вернуться к началу)При полном сгорании (при наличии достаточного количества кислорода) любого углеводорода образуется диоксида углерода (CO 2 ) и воды (H 2 O) .Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые проще, чем другие. Например, для алканов алканы с четным числом атомов углерода немного сложнее, чем с нечетным числом!
Пример 1: Сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение.Ваш первый черновик будет:
C 3 H 8 +? O 2 → 3CO 2 + 4H 2 O
Подсчет кислорода приводит непосредственно к окончательной версии:
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
Пример 2: Сжигание бутана
С бутаном (C 4 H 10 ) вы снова можете сбалансировать углерод и водород, записывая уравнение.
C 4 H 10 +? O 2 → 4CO 2 + 5H 2 O
Подсчет кислорода приводит к небольшой проблеме — 13 справа. Наличие нечетного числа атомов кислорода на стороне продукта делает невозможным баланс с четным числом на стороне реагента. В подобных случаях начните пытаться сбалансировать уравнение, изменив кофактор перед алканом на 2. Затем повторно сбалансируйте углерод и водород на стороне продукта.В этом случае кислородное число должно быть положительным, и теперь вы сможете уравновесить уравнение.
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
Углеводороды становится труднее воспламенить по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция будет намного лучше, если кислород и углеводород хорошо смешаны как газы. Если жидкость не очень летучая, только молекулы на поверхности могут реагировать с кислородом.Более крупные молекулы имеют большее притяжение Ван-дер-Ваальса, что затрудняет им отрыв от своих соседей и превращение в газ.
При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем больше углеводород, тем больше вероятность получить желтое дымное пламя.
Неполное сгораниеНеполное сгорание (при недостаточном количестве кислорода) может привести к образованию углерода или окиси углерода.Проще говоря, водород в углеводороде получает первый шанс у кислорода образовать воду в продукте, а углерод получает все, что осталось! Когда образуется только углерод, присутствие светящихся углеродных частиц в пламени делает его желтым, и черный углерод часто виден в дыме. Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования диоксида углерода (CO 2 ), то оксид углерода (CO) образуется в виде бесцветного ядовитого газа.
Почему окись углерода ядовита: кислород переносится по крови гемоглобином, белком, содержащимся в красных кровяных тельцах.Углекислый газ также связывается с гемоглобином. Гемоглобин переносит кислород из ваших легких в каждую клетку вашего тела, где он отбрасывает кислород, улавливает углекислый газ и переносит его обратно в легкие. Затем гемоглобин будет заменять углекислый газ на кислород в воздухе, которым вы вдыхаете. Когда вы выдыхаете, вы выделяете углекислый газ. Окись углерода также может связываться с гемоглобином. Разница в том, что окись углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода.Если вы вдохнете достаточно угарного газа, вы умрете от внутренней формы удушья!
Теплота сгоранияТеплота сгорания, ΔH c , определяется как общая энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при определенных стандартных условиях. Он рассчитывается так же, как рассчитывается энтальпия, однако он специфичен для набора стандартных условий. Теплота сгорания является полезной величиной, поскольку она является постоянной величиной для типа сжигаемого материала и может использоваться для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , дерево, водород, этанол и т. д.).В США номинальные значения нагрева обычно выражаются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
БТЕ / фунт = (кДж / кг) * 2,326
Теплота сгорания, ΔHc, значения обычных источников топлива и связанные с ними выбросы CO2 указаны в таблице 7.5
Таблица 7.5 Профиль теплоты сгорания и выбросов CO2 для обычных видов топливаПо материалам: EPA — (2014) и Википедия — Теплота сгорания
Нефть (от греческого: petra: «порода» + oleum : «нефть») — это встречающаяся в природе жидкость от желтого до черного цвета, обнаруживаемая в геологических формациях под поверхностью Земли, которая обычно перерабатывается в различные типы. топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются как обычные компоненты нефти (также называемой сырой нефтью и ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, диоксида углерода (CO 2 ) и сероводорода (H 2 S).
Компоненты нефти разделяются по размеру с помощью метода, называемого фракционной перегонкой. Полученные образцы включают бензин с содержанием алканов от пяти до десяти атомов углерода и керосин со смесью алканов с длиной углерода от десяти до семнадцати. Алканы с более длинными углеродными цепями содержатся в дизельном топливе, мазуте, вазелине, парафиновом воске, моторных маслах, а самые длинные цепи используются в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 выбрасываются в атмосферу каждый день только в результате потребления масла! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других обычных источников топлива, таких как природный газ, уголь, древесина, и возобновляемых источников энергии, таких как этанол и биодизель.
В обсуждении:По оценкам, в Орегоне в зимние месяцы для обогрева среднего дома с хорошей теплоизоляцией требуется около 40 БТЕ в час на квадратный фут. Если бы у вас был дом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (предположим, 31 день в месяце). Если бы у вас был выбор отопления дома природным газом, углем (бурый уголь) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько СО2 будет производиться каждым видом топлива каждый зимний месяц?
(Вернуться к началу)
Реакции галогенирования (Тип замещения)В присутствии тепла или света алканы могут реагировать с галогенами с образованием алкилгалогенидов (или галогеналканов). Этот тип реакции называется реакцией замещения , потому что атом галогена занимает место (или замещает) один из атомов водорода в структуре алкана. Следует отметить, что не все галогены одинаково реагируют с алканами.
- Реакция между алканами и фтором: Эта реакция взрывоопасна даже на холоде и в темноте, и вы склонны получать углерод и фтороводород, а не желаемую реакцию замещения.Это не представляет особого интереса для химиков-органиков, поскольку реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом может быть алкилфторид:
CH 4 + F 2 → CH 3 F + HF
Но реакция идет так быстро, что вот и результат:
CH 4 + 2F 2 → C + 4HF
- Реакция между алканами и йодом: Йод никак не реагирует с алканами — по крайней мере, в нормальных лабораторных условиях.Так что и эта реакция бесполезна.
- Реакции между алканами и хлором или бромом: В темноте реакции не происходит, но при наличии света и тепла в результате реакции образуются желаемые алкилгалогениды. Таким образом, мы сосредоточим наше обсуждение на реакциях галогенирования с хлором и бромом.
В присутствии пламени реакции очень похожи на реакцию с фтором — образуется смесь углерода и галогенида водорода.При переходе от фтора к хлору к брому интенсивность реакции значительно снижается. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, происходящие при комнатной температуре. Мы рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
В реакции замещения атом водорода в метане заменяется атомом хлора. Это может происходить несколько раз, пока не будут заменены все атомы водорода.В конечном итоге, чем дольше протекает реакция, тем больше атомов водорода замещается в алкане. Таким образом, вы получаете смесь хлорметана (CH 3 Cl), дихлорметана (CH 2 Cl 2 ), трихлорметана (CHCl 3 ) и тетрахлорметана (CCl 4 ).
Исходная смесь бесцветного газа (CH 4 ) и зеленого газа (Cl 2 ) будет производить пары хлористого водорода (HCl) и туман органических жидкостей (смесь хлорированного метана).Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Эта реакция замещения является примером радикальной реакции, когда за один раз переносится только один электрон. Тепло или свет инициируют реакцию, разрывая связь между двумя атомами Cl в ионе хлорида. Это образует два радикала . Радикал — это атом, молекула или ион, имеющий неспаренные валентные электроны.Таким образом, они очень нестабильны и реактивны. На диаграмме ниже первая стадия реакции галогенирования показана ниже. Это называется инициация .
Реакция инициированияКак только радикал инициирован, он атакует алкан, в данном случае метан (CH 4 ), и создает новый углеродный радикал. Эта стадия реакции называется распространением , поскольку один вид радикала создает или распространяет другой радикал.
Реакция распространенияЗаключительной стадией радикальной реакции является реакция обрыва , которая гасит присутствующие радикалы. Для реакции метан-хлор это образование хлорметана (CH 3 Cl).
Реакция завершенияТаким образом, радикальные реакции протекают в три стадии:
- Инициирование — , когда радикальные частицы образуются, как правило, под действием тепла, света или другого каталитического процесса.
- Распространение — , где одна разновидность радикала взаимодействует с другой молекулой, создавая другую разновидность радикала.
- Обрыв — , когда две радикальные разновидности взаимодействуют и гасят радикальную реакцию, образуя стабильный продукт.
Как видно на примере метана, если вы галогенируете более крупные алканы, вы снова получите смесь продуктов замещения, но стоит кратко взглянуть на то, что произойдет, если будет замещен только один из атомов водорода (монозамещение) — просто чтобы показать что все не всегда так просто, как кажется! Например, с пропаном можно получить один из двух изомеров:
Если бы случай был единственным фактором, можно было бы ожидать получить в три раза больше изомера с хлором на конце.Есть 6 атомов водорода, которые можно заменить на концевых атомах углерода, по сравнению только с 2 атомами в середине. Фактически, вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта находится там, где бром присоединен к центральному атому углерода. Почему это происходит?
Это связано со стабильностью промежуточного углеродного радикала, образующегося во время реакции. Углероды, у которых больше углеродных соседей, легче теряют водород и образуют промежуточный углеродный радикал.Соседние атомы углерода, будучи крупнее соседних атомов водорода, могут помочь стабилизировать образование радикала углерода. Таким образом, в реакции галогенирования третичные атомы углерода будут наиболее реакционноспособными положениями, за ними следуют вторичные атомы углерода и, наконец, первичные атомы углерода. Четвертичные атомы углерода не реагируют, поскольку они не имеют доступных атомов водорода, которые можно было бы заменить галогеном.
Реакции галогенирования с циклоалканамиРеакции циклоалканов обычно такие же, как и реакции алканов, с заменой атомов водорода в циклической кольцевой структуре атомом галогена.Например, в присутствии УФ-света циклопропан будет вступать в реакции замещения хлором или бромом, как и нециклический алкан.
Однако небольшие кольцевые структуры, особенно циклопропан, также способны реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых кольцо разрывается. Например, с бромом циклопропан дает следующее линейное соединение.
Это все еще может происходить в присутствии УФ-света, но вы также получите смесь реакций замещения.Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца. Напомним, что валентные углы в кольце составляют 60 °, а не нормальное значение около 109,5 °, когда углерод образует четыре одинарные связи.
Упражнения по обзору концепцииПочему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Которая реагирует наименее охотно?
Алканы не вступают в реакцию со многими обычными химическими веществами.Иногда их называют парафинами, от латинского parum affinis , что означает «слабое сродство».
наиболее охотно: F 2 ; наименее охотно: I 2
Множество интересных и часто полезных соединений имеют один или несколько атомов галогена на молекулу. Например, метан (CH 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода атомами Cl. Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их использования.
Таблица 7.6: Некоторые галогенированные углеводороды
Для вашего здоровья: галогенированные углеводородыКогда-то широко применяемые в потребительских товарах, многие хлорированные углеводороды считаются канцерогенами (веществами, вызывающими рак), а также, как известно, вызывают серьезные повреждения печени. Примером может служить четыреххлористый углерод (CCl 4 ), который когда-то использовался в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендован для любого использования.Даже в небольших количествах его пары могут вызвать серьезное заболевание при продолжительном воздействии. Более того, он реагирует с водой при высоких температурах с образованием смертоносного фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.
Этилхлорид, напротив, используется в качестве наружного местного анестетика. При нанесении на кожу он быстро испаряется, охлаждая пораженный участок, делая его нечувствительным к боли. Его также можно использовать в качестве экстренной общей анестезии.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они тоже токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенированных соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слойАлканы, замещенные атомами фтора (F) и хлора (Cl), используются в качестве диспергирующих газов в аэрозольных баллончиках, в качестве вспенивающих агентов для пластмасс и в качестве хладагентов.Два наиболее известных из этих хлорфторуглеродов (ХФУ) перечислены в таблице 7.6.
Хлорфторуглероды способствуют парниковому эффекту в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением, высвобождая атомы Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного УФ-излучения. Действия по всему миру привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие озоноразрушающие соединения, содержащие Cl или бром (Br), заменяются более безвредными веществами.Одной альтернативой являются гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов. Другой — гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче распадаются в тропосфере, и меньшее количество молекул, разрушающих озон, достигает стратосферы.
Рисунок 7.13. Разрушение озонового слоя в верхних слоях атмосферы. Озон в верхних слоях атмосферы защищает поверхность Земли от ультрафиолетового излучения солнца, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и пурпурные области в центре) представляют собой большие области значительного разрушения озона. Они встречаются в основном над Антарктидой с конца августа до начала октября и заполняют их примерно в середине ноября. Истощение озонового слоя также отмечено в арктических регионах. Самая большая озоновая дыра из когда-либо наблюдавшихся произошла 24 сентября 2006 года.
Алканы крекингаЧто такое растрескивание? Крекингом называют разбиение больших молекул углеводородов на более мелкие и полезные части.Это достигается за счет использования высоких давлений и температур без катализатора или более низких температур и давлений в присутствии катализатора . Катализатор — это вещество, которое увеличивает скорость химической реакции без каких-либо постоянных химических изменений.
Источником крупных молекул углеводорода часто является фракция нафты или фракция газойля, образующаяся при фракционной перегонке сырой нефти (нефти).Эти фракции получают в процессе перегонки в виде жидкостей, но повторно испаряются в газовую фазу перед крекингом. В взломщике не происходит ни одной уникальной реакции. Молекулы углеводородов распадаются довольно случайным образом с образованием смесей более мелких углеводородов, некоторые из которых имеют двойные связи углерод-углерод. Одна возможная реакция с участием углеводорода C 15 H 32 может быть:
C 15 H 32 → 2C 2 H 4 + C 3 H 6 + C 8 H 18
Или, более ясно показывая, что происходит с различными атомами и связями:
Это только один из способов разрушения данной молекулы.Обратите внимание, что помимо получения более мелких алканов, реакция крекинга также может давать алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для изготовления пластмасс или производства других органических химикатов. Октан — одна из молекул бензина (бензина).
Присмотревшись ближе: алкановая основа свойств других соединенийПонимание физических свойств алканов важно в связи с тем, что нефть и природный газ, а также многие производные из них продукты — бензин, газ в баллонах, растворители, пластмассы и др. — состоят в основном из алканов.Это понимание также важно, потому что оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей. Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимой и водонерастворимой фазами.Эта характеристика важна для избирательной проницаемости клеточных мембран.
Рисунок 7.13 Сравнение липидов и алканов. Трипальмитин (а), типичная молекула жира, имеет длинные углеводородные цепи, характерные для большинства липидов. Сравните эти цепи с гексадеканом (b), алканом с 16 атомами углерода.
(Вернуться к началу)
7.5 Краткое содержание главыЧтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения следующих жирным шрифтом терминов в резюме и спросить себя, как они соотносятся с темами в главе.
Органическая химия — это химия соединений углерода, а — неорганическая химия — химия всех других элементов. Атомы углерода могут образовывать стабильные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений. Углеводороды содержат только атомы водорода и углерода.
Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами .Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду единицей CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологической серией .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, представляют собой изомеров, друг друга.У трех мельчайших алканов нет изомерных форм; начиная с C 4 H 10 , все другие алканы имеют изомерные формы.
Циклоалканы — это углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи. Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Напомним, что структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Сводная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены.Формула линейного угла — это формула, в которой атомы углерода подразумеваются в углах и на концах линий. Подразумевается, что каждый атом углерода присоединен к достаточному количеству атомов водорода, чтобы дать каждому атому углерода четыре связи
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы обычно не реагируют с лабораторными кислотами, основаниями, окислителями и восстановителями.Они действительно горят (претерпевают реакций горения ).
Алканы реагируют с галогенами, замещая атомы водорода одним или несколькими атомами галогена с образованием галогенированных углеводородов. Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана на атом галогена.
Алканы большего размера можно разделить на алканы и алкены меньшего размера с использованием высокой температуры или катализаторов.Эти реакции называются реакциями крекинга .
(Вернуться к началу)
7.6 Упражнения в конце главыВы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48 ° C. Он легко воспламеняется и легко горит. Вещество не растворяется в воде и плавает на поверхности. Вещество может быть органическим или неорганическим?
Что опасно при проглатывании жидкого алкана?
- Различают более легкие и тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приводится формула линии для алкана. Нарисуйте уплотненную структуру.
Напишите уравнения полного сгорания каждого соединения.
- бутан, C 4 H 10 (обычная жидкость для зажигалок) Октан
- , C 8 H 18 (типичный углеводород в бензине).
Плотность пробы бензина 0,690 г / мл. На основе полного сгорания октана рассчитайте количество в граммах диоксида углерода (CO 2 ) и воды (H 2 O), образовавшихся на галлон (3.78 л) бензина при использовании в автомобиле.
Изобразите структуры четырех из девяти изомерных гексанов (C 7 H 16 ).
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую конструкцию.
- Какая формула представляет собой галогенид алкила? Напишите его сокращенную структурную формулу.
- Какая формула представляет собой циклический алкан?
- Какова молекулярная формула соединения, обозначенного (i)?
(Вернуться к началу) 7.7 СсылкиТекст этой главы был адаптирован из ресурсов Creative Commons, перечисленных ниже, если в тексте не указано иное.
- Органическая химия (2016) Libretexts, U.C. Дэвис, под лицензией: Creative Commons Attribution-Noncommercial-Share Alike 3.0 Лицензия США. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry
- Ингалянт. (2017, 12 февраля). В Википедия, Бесплатная энциклопедия . Получено 01:21, 13 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Inhalant&oldid=765135147 .
- Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
- Физическая и теоретическая химия (2017) Libretexts, U.C. Дэвис, под лицензией: Creative Commons Attribution-Noncommercial-Share Alike 3.0 Лицензия США. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies.
- Нефть. (2017, 14 февраля). В Википедия, Бесплатная энциклопедия . Получено 06:29, 16 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Petroleum&oldid=765440823 .
- Болл Д. У., Хилл Дж. У. и Скотт Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
12.6 Механизмы реакций — Химия
Цели обучения
К концу этого раздела вы сможете:
- Отличить чистые реакции от элементарных реакций (стадии)
- Определить молекулярность элементарных реакций
- Напишите вычисленное химическое уравнение с учетом механизма реакции
- Вывести закон скорости, соответствующий заданному механизму реакции
Сбалансированное уравнение химической реакции указывает, что происходит и что образуется, но ничего не говорит о том, как на самом деле происходит реакция.Механизм реакции (или путь реакции) — это процесс или путь, по которому происходит реакция.
Химическая реакция обычно происходит поэтапно, хотя она не всегда может быть очевидна для наблюдателя. Например, разложение озона происходит по механизму, состоящему из двух этапов:
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} l} \ text {O} _3 (g) & \ text {O} _2 (g) \; + \; \ text {O } \\ [0.5em] \ text {O} \; + \; \ text {O} _3 (g) & 2 \ text {O} _2 (g) \ end {array} [/ latex]
Мы называем каждую стадию механизма реакции элементарной реакцией .Элементарные реакции происходят именно так, как они записаны, и не могут быть разбиты на более простые шаги. Элементарные реакции складываются в общую реакцию, которая для разложения составляет:
[латекс] 2 \ text {O} _3 (g) \; {\ longrightarrow} \; 3 \ text {O} _2 (g) [/ latex]
Обратите внимание, что атом кислорода, образующийся на первом этапе этого механизма, потребляется на втором этапе и, следовательно, не появляется как продукт в общей реакции. Виды, которые производятся на одном этапе и потребляются на последующем, называются промежуточными продуктами .
Хотя общее уравнение реакции разложения озона показывает, что две молекулы озона реагируют с образованием трех молекул кислорода, механизм реакции не включает столкновение и реакцию двух молекул озона. Скорее, он включает молекулу озона, разлагающуюся на молекулу кислорода и промежуточный атом кислорода; Затем атом кислорода реагирует со второй молекулой озона, давая две молекулы кислорода. Эти две элементарные реакции протекают точно так, как показано в механизме реакции.
Молекулярность элементарной реакции — это количество реагентов (атомов, молекул или ионов). Например, мономолекулярная реакция включает перегруппировку единичных реагентов с образованием одной или нескольких молекул продукта:
[латекс] A \; {\ longrightarrow} \; \ text {products} [/ latex]
Уравнение скорости мономолекулярной реакции:
[латекс] \ text {rate} = k [A] [/ латекс]
Мономолекулярная реакция может быть одной из нескольких элементарных реакций в сложном механизме.Например, реакция:
[латекс] \ text {O} _3 \; {\ longrightarrow} \; \ text {O} _2 \; + \; \ text {O} [/ latex]
иллюстрирует мономолекулярную элементарную реакцию, которая протекает как часть двухступенчатого механизма реакции. Однако некоторые мономолекулярные реакции могут иметь только одну реакцию в механизме реакции. (Другими словами, элементарная реакция в некоторых случаях также может быть общей реакцией.) Например, газофазное разложение циклобутана, C 4 H 8 , до этилена, C 2 H 4 , происходит по мономолекулярному одноступенчатому механизму:
Для того чтобы эти мономолекулярные реакции произошли, все, что требуется, — это разделение частей отдельных молекул реагентов на продукты.
Химические связи не просто распадаются во время химических реакций. Для разрыва химических связей требуется энергия. Энергия активации разложения C 4 H 8 , например, составляет 261 кДж на моль. Это означает, что требуется 261 килоджоулей, чтобы превратить один моль этих молекул в активированные комплексы, которые распадаются на продукты:
В образце C 4 H 8 несколько быстро движущихся молекул C 4 H 8 сталкиваются с другими быстро движущимися молекулами и набирают дополнительную энергию.Когда молекулы C 4 H 8 набирают достаточно энергии, они могут трансформироваться в активированный комплекс, и может происходить образование молекул этилена. Фактически, особенно энергичное столкновение вбивает молекулу C 4 H 8 в геометрию активированного комплекса. Однако лишь небольшая часть молекул газа движется с достаточно высокими скоростями и кинетической энергией, достаточной для этого. Следовательно, в любой момент только несколько молекул получают достаточно энергии от столкновений, чтобы реагировать.
Скорость разложения C 4 H 8 прямо пропорциональна его концентрации. Удвоение концентрации C 4 H 8 в образце дает вдвое больше молекул на литр. Хотя доля молекул с достаточной энергией для реакции остается прежней, общее количество таких молекул вдвое больше. Следовательно, C 4 H 8 на литр вдвое больше, а скорость реакции в два раза выше:
[латекс] \ text {rate} = — \ frac {{\ Delta} [\ text {C} _4 \ text {H} _8]} {{\ Delta} t} = k [\ text {C} _4 \ текст {H} _8] [/ latex]
Аналогичное соотношение применимо к любой мономолекулярной элементарной реакции; скорость реакции прямо пропорциональна концентрации реагента, и реакция проявляет поведение первого порядка.Константа пропорциональности — это константа скорости конкретной мономолекулярной реакции.
Столкновение и соединение двух молекул или атомов с образованием активированного комплекса в элементарной реакции называется бимолекулярной реакцией . Существует два типа бимолекулярных элементарных реакций:
[латекс] A \; + \; B \; {\ longrightarrow} \; \ text {products} \\ [0. 2 [/ latex]
Некоторые химические реакции имеют механизмы, состоящие из одной бимолекулярной элементарной реакции.Одним из примеров является реакция диоксида азота с оксидом углерода:
[латекс] \ text {NO} _2 (g) \; + \; \ text {CO} (g) \; {\ longrightarrow} \; \ text {NO} (g) \; + \; \ text { CO} _2 (г) [/ латекс]
Другой пример — разложение двух молекул иодистого водорода с образованием водорода H 2 и йода I 2 Рис. 1:
[латекс] 2 \ text {HI} (g) \; {\ longrightarrow} \; \ text {H} _2 (g) \; + \; \ text {I} _2 (g) [/ latex]
Рис. 1. Вероятный механизм диссоциации двух молекул HI с образованием одной молекулы H 2 и одной молекулы I 2 .Бимолекулярные элементарные реакции также могут быть этапами многоступенчатого механизма реакции. Примером может служить реакция атомарного кислорода с озоном:
[латекс] \ text {O} (g) \; + \; \ text {O} _3 (g) \; {\ longrightarrow} \; 2 \ text {O} _2 (g) [/ latex]
Элементарная термолекулярная реакция включает одновременное столкновение трех атомов, молекул или ионов. Термолекулярные элементарные реакции встречаются редко, потому что вероятность одновременного столкновения трех частиц меньше одной тысячной вероятности столкновения двух частиц.2 [\ text {Cl} _2] [/ латекс]
Часто бывает, что один шаг в механизме многоступенчатой реакции значительно медленнее, чем другие. Поскольку реакция не может протекать быстрее, чем ее самый медленный этап, этот этап ограничивает скорость, с которой происходит общая реакция. Поэтому самый медленный этап называется этапом ограничения скорости (или этапом определения скорости) реакции. Рис. 2.
Рис. 2. Желоб для скота является нехимическим примером этапа определения нормы.Скот можно перемещать из одного загона в другой только так быстро, как одно животное может пройти через желоб. (кредит: Лорен Кернс)Как описано ранее, законы скорости могут быть получены непосредственно из химических уравнений для элементарных реакций. Однако это не относится к обычным химическим реакциям. Наиболее часто встречающиеся сбалансированные уравнения представляют собой общее изменение для какой-либо химической системы, и очень часто это результат нескольких механизмов многоступенчатой реакции. В каждом случае мы должны определить общий закон скорости из экспериментальных данных и вывести механизм из закона скорости (а иногда и из других данных).Реакция NO 2 и CO дает наглядный пример:
[латекс] \ text {NO} _2 (g) \; + \; \ text {CO} (g) \; {\ longrightarrow} \; \ text {CO} _2 (g) \; + \; \ text {NO} (г) [/ латекс]
Для температур выше 225 ° C был найден закон скорости:
[латекс] \ text {rate} = k [\ text {NO} _2] [\ text {CO}] [/ latex]
Реакция первого порядка по NO 2 и первого порядка по CO. Это согласуется с одностадийным бимолекулярным механизмом, и возможно, , что это механизм для этой реакции при высоких температурах.2 [/ латекс]
Это согласуется с механизмом, который включает следующие две элементарные реакции, первая из которых протекает медленнее и, следовательно, является этапом, определяющим скорость:
[латекс] \ text {NO} _2 (g) \; + \; \ text {NO} _2 (g) \; {\ longrightarrow} \; \ text {NO} _3 (g) \; + \; \ текст {NO} (g) \; (\ text {slow}) \\ [0.5em] \ text {NO} _3 (g) \; + \; \ text {CO} (g) \; {\ longrightarrow} \; \ text {NO} _2 (g) \; + \; \ text {CO} _2 (g) \; (\ text {fast}) [/ latex]
Этап определения скорости дает закон скорости, показывающий зависимость второго порядка от концентрации NO 2 , а сумма двух уравнений дает чистую общую реакцию.
В общем, когда определяющий скорость (более медленный) шаг является первым шагом в механизме, закон скорости для всей реакции такой же, как закон скорости для этого шага. Однако, когда этапу определения скорости предшествует этап, включающий реакцию равновесия , получить закон скорости для всей реакции может быть труднее.
Элементарная реакция находится в равновесии, когда она протекает как в прямом, так и в обратном направлении с равной скоростью. Рассмотрим димеризацию NO до N 2 O 2 , где k 1 используется для представления константы скорости прямой реакции, а k -1 используется для представления константы скорости обратной реакции. :
[латекс] \ text {NO} \; + \; \ text {NO} \; {\ leftrightharpoons} \; \ text {N} _2 \ text {O} _2 \\ [0.2} {k _ {- 1}}) = [\ text {N} _2 \ text {O} _2] [/ latex]
Однако, опять же, промежуточные соединения не могут быть перечислены как часть общего выражения закона скорости, хотя они могут быть включены в отдельную элементарную реакцию механизма. Пример 1 проиллюстрирует, как вывести общие законы скорости из механизмов, включающих шаги равновесия, предшествующие шагу определения скорости.
Пример 1
Получение выражения закона общей скорости для многоступенчатого механизма реакции
Нитрилхлорид (NO 2 Cl) разлагается до диоксида азота (NO 2 ) и газообразного хлора (Cl 2 ) по следующему механизму:- [латекс] 2 \ text {NO} _2 \ text {Cl} (g) \; {\ leftrightharpoons} \; \ text {ClO} _2 (g) \; + \; \ text {N} _2 \ text {O} (g) \; + \; \ text {ClO} (g) [/ latex] (fast, k 1 представляет собой константу скорости прямой реакции, а k -1 скорость константа обратной реакции)
- [латекс] \ text {N} _2 \ text {O} (g) \; + \; \ text {ClO} _2 (g) \; {\ leftrightharpoons} \; \ text {NO} _2 (g) \ ; + \; \ text {NOCl} (g) [/ latex] (быстро, k 2 для прямой реакции, k −2 для обратной реакции)
- [латекс] \ text {NOCl} \; + \; \ text {ClO} \; {\ longrightarrow} \; \ text {NO} _2 \; + \; \ text {Cl} _2 [/ latex] (медленно , k 3 константа скорости прямой реакции)
Определите общую реакцию, напишите выражение закона скорости для каждой элементарной реакции, определите любые промежуточные соединения и определите выражение общего закона скорости.
Решение
Для общей реакции просто просуммируйте три этапа, отмените промежуточные соединения и объедините аналогичные формулы:[латекс] 2 \ text {NO} _2 \ text {Cl} (g) \; {\ longrightarrow} \; 2 \ text {NO} _2 (g) \; + \; \ text {Cl} _2 (g ) [/ латекс]
Затем запишите выражение закона скорости для каждой элементарной реакции. Помните, что для элементарных реакций, являющихся частью механизма, выражение закона скорости может быть получено непосредственно из стехиометрии:
[латекс] \ begin {array} {r @ {{} = {}} l} k_1 [\ text {NO} _2 \ text {Cl}] _ 2 & k _ {- 1} [\ text {ClO} _2] [\ text {N} _2 \ text {O}] [\ text {ClO}] \\ [0.5em] k_2 [\ text {N} _2 \ text {O}] [\ text {ClO} _2] & k _ {- 2} [\ text {NO} _2] [\ text {NOCl}] \\ [0.5em ] \ text {Rate} & k_3 [\ text {NOCl}] [\ text {ClO}] \ end {array} [/ latex]
Третий шаг, который является медленным, является шагом, определяющим скорость. Следовательно, выражение для общего закона скорости может быть записано как Rate = k 3 [NOCl] [ClO]. Однако как NOCl, так и ClO являются промежуточными продуктами. Алгебраические выражения должны использоваться для представления [NOCl] и [ClO] таким образом, чтобы в общем выражении закона скорости не осталось промежуточных продуктов.2} {k _ {- 2} k _ {- 1} [\ text {NO} _2]} \ end {array} [/ latex]
Обратите внимание, что этот закон скорости показывает обратную зависимость от концентрации одного из видов продукта, что согласуется с наличием стадии равновесия в механизме реакции.
Проверьте свои знания
Атомарный хлор в атмосфере реагирует с озоном в следующей паре элементарных реакций:[латекс] \ text {Cl} \; + \; \ text {O} _3 (g) \; {\ longrightarrow} \; \ text {ClO} (g) \; + \; \ text {O} _2 (g) \; \; \; \; \; \; \; (\ text {rate \; constant} \; k_1) [/ latex]
[латекс] \ text {ClO} (g) \; + \; \ text {O} \; {\ longrightarrow} \; \ text {Cl} (g) \; + \; \ text {O} _2 ( g) \; \; \; \; \; \; \; (\ text {rate \; constant} \; k_2) [/ латекс]
Определите общую реакцию, напишите выражение закона скорости для каждой элементарной реакции, определите любые промежуточные соединения и определите выражение общего закона скорости.
Ответ:
общая реакция: [латекс] \ text {O} _3 (g) \; + \; \ text {O} \; {\ longrightarrow} \; 2 \ text {O} _2 (g) [/ latex]
скорость 1 = k 1 [O 3 ] [Cl]; скорость 2 = k 2 [ClO] [O]
промежуточное соединение: ClO (г)
общая скорость = k 2 k 1 [O 3 ] [Cl] [O]
Последовательность отдельных стадий или элементарных реакций, посредством которых реагенты превращаются в продукты в ходе реакции, называется механизмом реакции.Общая скорость реакции определяется скоростью самого медленного этапа, называемого этапом определения скорости. Мономолекулярные элементарные реакции имеют законы скорости первого порядка, в то время как бимолекулярные элементарные реакции имеют законы скорости второго порядка. Сравнивая законы скорости, полученные из механизма реакции, с определенными экспериментально, механизм может быть признан либо неправильным, либо правдоподобным.
Химия. Упражнения в конце главы
- Почему элементарные реакции с участием трех или более реагентов очень редки?
- В общем, можем ли мы предсказать эффект удвоения концентрации A на скорость общей реакции [латекс] A \; + \; B \; {\ longrightarrow} \; C [/ latex]? Можем ли мы предсказать эффект, если известно, что реакция является элементарной?
- Дайте определение этим терминам:
(а) мономолекулярная реакция
(б) бимолекулярная реакция
(в) элементарная реакция
(d) общая реакция
- Каково уравнение скорости элементарной термолекулярной реакции [латекс] A \; + \; 2B \; {\ longrightarrow} \; \ text {products} [/ latex]? Для [латекса] 3A \; {\ longrightarrow} \; \ text {products} [/ latex]?
- Учитывая следующие реакции и соответствующие законы скорости, в каких реакциях элементарная реакция и общая реакция могут быть одинаковыми?
(a) [латекс] \ text {Cl} _2 \; + \; \ text {CO} \; {\ longrightarrow} \; \ text {Cl} _2 \ text {CO} \\ [0.2 [\ text {O} _2] [/ латекс]
(e) [латекс] \ text {NO} \; + \; \ text {O} _3 \; {\ longrightarrow} \; \ text {NO} _2 \; + \; \ text {O} _2 \\ [0.5em] \ text {rate} = k [\ text {NO}] \; [\ text {O} _3] [/ latex]
- Напишите уравнение скорости для каждой из следующих элементарных реакций:
(a) [латекс] \ text {O} _3 \; {\ xrightarrow {\ text {солнечный свет}}} \; \ text {O} _2 \; + \; \ text {O} [/ latex]
(b) [латекс] \ text {O} _3 \; + \; \ text {Cl} \; {\ longrightarrow} \; \ text {O} _2 \; + \; \ text {ClO} [/ latex ]
(c) [латекс] \ text {ClO} \; + \; \ text {O} \; {\ longrightarrow} \; \ text {Cl} \; + \; \ text {O} _2 [/ latex]
(d) [латекс] \ text {O} _3 \; + \; \ text {NO} \; {\ longrightarrow} \; \ text {NO} _2 \; + \; \ text {O} _2 [/ латекс]
(e) [латекс] \ text {NO} _2 \; + \; \ text {O} \; {\ longrightarrow} \; \ text {NO} \; + \; \ text {O} _2 [/ latex ]
- Оксид азота (II), NO, реагирует с водородом, H 2 , в соответствии со следующим уравнением:
[латекс] 2 \ text {NO} \; + \; 2 \ text {H} _2 \; {\ longrightarrow} \; \ text {N} _2 \; + \; 2 \ text {H} _2 \ text {O} [/ latex]Каким был бы закон скорости, если бы механизм этой реакции был:
[латекс] 2 \ text {NO} \; + \; \ text {H} _2 \; {\ longrightarrow} \; \ text {N} _2 \; + \; \ text {H} _2 \ text {O } _2 \; (\ text {slow}) \\ [0.5em] \ text {H} _2 \ text {O} _2 \; + \; \ text {H} _2 \; {\ longrightarrow} \; 2 \ text {H} _2 \ text {O} \; (\ text {fast}) [/ latex]
- Были проведены эксперименты для изучения скорости реакции, представленной этим уравнением.
[латекс] 2 \ text {NO} (g) \; + \; 2 \ text {H} _2 (g) \; {\ longrightarrow} \; \ text {N} _2 (g) \; + \; 2 \ text {H} _2 \ text {O} (g) [/ latex]Здесь приведены начальные концентрации и скорости реакции.
Эксперимент Начальная концентрация [NO] (моль / л) Начальная концентрация, [H 2 ] (моль / л) Начальная скорость образования N 2 (моль / л мин) 1 0.0060 0,0010 1,8 × 10 −4 2 0,0060 0,0020 3,6 × 10 −4 3 0,0010 0,0060 0,30 × 10 −4 4 0,0020 0,0060 1,2 × 10 −4 Таблица 35. Обдумайте следующие вопросы:
(a) Определите порядок для каждого из реагентов, NO и H 2 , на основе предоставленных данных и покажите свои рассуждения.
(b) Напишите общий закон скорости реакции.
(c) Рассчитайте значение константы скорости, k , для реакции. Включите единицы.
(d) Для эксперимента 2 рассчитайте концентрацию NO, оставшуюся после того, как была израсходована ровно половина первоначального количества H 2 .
(e) Следующая последовательность элементарных шагов представляет собой предлагаемый механизм реакции.
Шаг 1: [латекс] \ text {NO} \; + \; \ text {NO} \; {\ leftrightharpoons} \; \ text {N} _2 \ text {O} _2 [/ latex]
Шаг 2: [латекс] \ text {N} _2 \ text {O} _2 \; + \; \ text {H} _2 \; {\ leftrightharpoons} \; \ text {H} _2 \ text {O} \ ; + \; \ text {N} _2 \ text {O} [/ latex]
Шаг 3: [латекс] \ text {N} _2 \ text {O} \; + \; \ text {H} _2 \; {\ leftrightharpoons} \; \ text {N} _2 \; + \; \ text {H} _2 \ text {O} [/ latex]
На основании представленных данных, какой из этих шагов является этапом определения скорости? Покажите, что механизм согласуется с наблюдаемым законом скорости реакции и общей стехиометрией реакции.
- Реакция CO с Cl 2 дает фосген (COCl 2 ), нервно-паралитический газ, который использовался во время Первой мировой войны. Используйте показанный здесь механизм для выполнения следующих упражнений:
[латекс] \ text {Cl} _2 (g) \; {\ leftrightharpoons} \; 2 \ text {Cl} (g) [/ latex] (быстро, k 1 представляет константу прямой скорости, k -1 обратную константу скорости) [латекс] \ text {CO} (g) \; + \; \ text {Cl} (g) \; {\ longrightarrow} \; \ text {COCl} (g) [/ latex] (медленно, k 2 константа скорости)[латекс] \ text {COCl} (g) \; + \; \ text {Cl} (g) \; {\ longrightarrow} \; \ text {COCl} _2 (g) [/ latex] (быстро, k 3 константа скорости)
(a) Напишите общую реакцию.
(b) Определите все промежуточные соединения.
(c) Напишите закон скорости для каждой элементарной реакции.
(d) Напишите общее выражение закона скорости.
Глоссарий
- бимолекулярная реакция
- элементарная реакция, включающая столкновение и сочетание двух реагентов
- элементарная реакция
- реакция, протекающая в точности так, как показано в ее химическом уравнении
- средний
- молекула или ион, произведенные на одной стадии механизма реакции и потребленные на другой
- Молекулярность
- количество реагентов (атомов, молекул или ионов), участвующих в элементарной реакции
- этап определения скорости
- (также, лимитирующая стадия) самая медленная элементарная реакция в механизме реакции; определяет скорость общей реакции
- механизм реакции
- ступенчатая последовательность элементарных реакций, посредством которых происходит химическое изменение
- термолекулярная реакция
- элементарная реакция, включающая одновременное столкновение и сочетание трех реагентов
- мономолекулярная реакция
- элементарная реакция, включающая перегруппировку одного реагента с образованием одной или нескольких молекул продукта
Решения
Ответы на упражнения в конце главы по химии
2.Нет. В общем, для всей реакции мы не можем предсказать эффект изменения концентрации, не зная уравнения скорости. Да. Если реакция является элементарной, то удвоение концентрации A удваивает скорость.
4. Скорость = k [ A ] [ B ] 2 ; Скорость = k [ A ] 3
6. (a) Ставка 1 = k [O 3 ]; (b) Скорость 2 = k [O 3 ] [Cl]; (c) Скорость 3 = k [ClO] [O]; d) ставка 2 = k [O 3 ] [NO]; (e) Ставка 3 = k [NO 2 ] [O]
8.(a) Удвоение [H 2 ] увеличивает ставку вдвое. [H 2 ] необходимо ввести уравнение скорости в первой степени. Удвоение [НЕТ] увеличивает скорость в 4 раза. [НЕТ] должно вводить закон скорости во второй степени. (b) Скорость = k [NO] 2 [H 2 ]; (в) k = 5.0 × 10 3 моль −2 L −2 мин −1 ; (d) 0,0050 моль / л; (e) Этап II является этапом определения скорости. Если шаг I дает N 2 O 2 в достаточном количестве, шаги 1 и 2 объединяются, чтобы получить [латекс] 2 \ text {NO} \; + \; \ text {H} _2 \; {\ longrightarrow} \ ; \ text {H} _2 \ text {O} \; + \; \ text {N} _2 \ text {O} [/ latex].Эта реакция соответствует наблюдаемому закону скорости. Объедините шаги 1 и 2 с шагом 3, который выполняется предположительно быстро, чтобы получить соответствующую стехиометрию.
.
 Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях:
Если в ходе необратимой процесс идёт только в одном направлении до получения конечных продуктов, то в обратимой реакции он протекает в прямом и противоположном направлениях:  Поэтому ещё один показатель химического реагирования – тепловой эффект.
Поэтому ещё один показатель химического реагирования – тепловой эффект. Например, в растворах, в газообразной среде:
Например, в растворах, в газообразной среде: В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются.
В ходе реакций ни катализаторы, ни ингибиторы не расходуются и не изменяются. В названиях этих реакций присутствует приставка де-:
В названиях этих реакций присутствует приставка де-: