Фотосинтез — урок. Биология, Общие биологические закономерности (9–11 класс).
Фотосинтез — это процесс, благодаря которому существует большинство живых организмов на нашей планете.
Фотосинтез — процесс образования органических веществ из углекислого газа (CO2) и воды (h3O), протекающий с использованием солнечной энергии.
Фотосинтез происходит в хлоропластах у растений или на мезосомах у прокариот. На цитоплазматической мембране у этих организмов содержатся молекулы зелёного пигмента — хлорофилла.
Рис. \(1\). Хлоропласт
Молекулы хлорофилла способны улавливать кванты света и переходить в возбуждённое состояние. От них отрываются электроны, которые подхватываются молекулами переносчика НАДФ+ (никотинамидадениндинуклеотидфосфата). При этом энергия электронов частично расходуется на образование АТФ.
Процесс фотосинтеза включает две последовательные фазы: световую и темновую.
Световая фаза
Световая фаза — процесс преобразования поглощённой хлорофиллом энергии света в электрическую энергию электрон-транспортной цепи. Она протекает на мембранах тилакоидов с участием фермента АТФ-синтетазы и мембранных белков-переносчиков.
У растений в световой фазе фотосинтеза происходят два процесса: фотолиз воды и синтез АТФ (нециклическое фосфорилирование).
На фотосинтетических мембранах гран хлоропластов происходят следующие процессы:
- переход электронов хлорофилла под действием квантов света в возбуждённое состояние;
- восстановление окисленной формы молекул-переносчиков НАДФ+ до НАДФ ·Н2;
- разложение воды (фотолиз):
2h3O→4H++4e−+O2.
Результатами световых реакций являются:
- фотолиз воды и выделение молекулярного кислорода;
- образование АТФ;
- образование НАДФ-восстановленного.

Обрати внимание!
В световой фазе фотосинтеза энергия аккумулируется в НАДФ·Н2 и АТФ, которые используются для синтеза веществ в темновой фазе.
Процесс образования АТФ из АДФ за счёт световой энергии отличается высокой эффективностью: за единицу времени в хлоропластах синтезируется в \(30\) раз больше АТФ, чем в кислородном этапе энергетического обмена в митохондриях.
Образовавшиеся в световой фазе богатые энергией вещества используются в темновой фазе фотосинтеза.
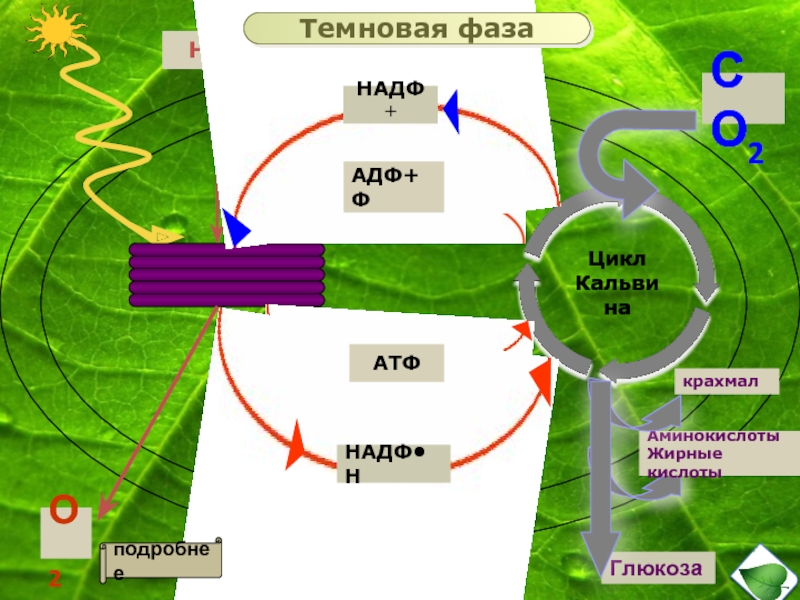
Темновая фаза
Реакции темновой фазы фотосинтеза протекают независимо от света.
Темновая фаза — процесс преобразования CO2 в глюкозу с использованием энергии, запасённой в молекулах АТФ и НАДФ·Н2.
Реакции темновой фазы происходят в строме хлоропластов, где находятся образовавшиеся в световой фазе молекулы НАДФ·Н
Источник углерода (CO2) растение получает из воздуха через устьица.
Процесс образования глюкозы из углекислого газа, протекающий в темновой фазе фотосинтеза, имеет название цикла Кальвина.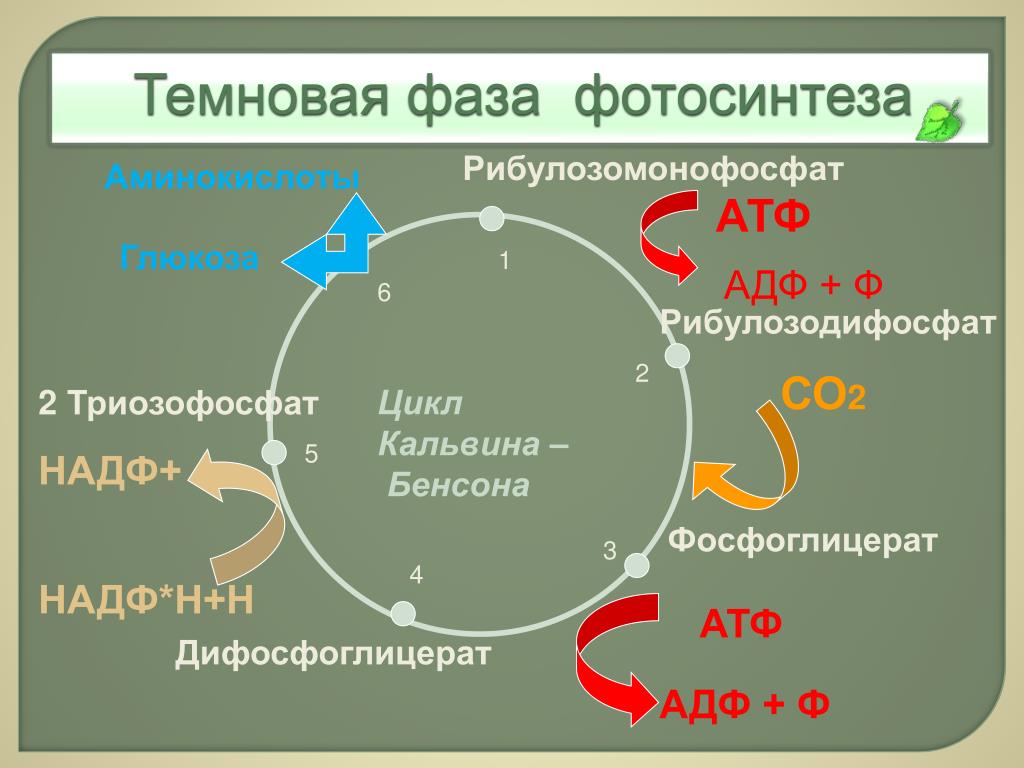
В результате реакций темновой фазы из углекислого газа образуется глюкоза, которая затем превращается крахмал.
Кроме глюкозы в хлоропластах синтезируются также другие органические вещества: аминокислоты, нуклеотиды и т. д.
Рис. \(2\). Схема фотосинтеза
Суммарные уравнения и частные реакции фотосинтеза представлены в таблице.
Значение фотосинтеза
1. При фотосинтезе образуются органические вещества, которые служат пищей для живых организмов.
2. При фотосинтезе выделяется свободный кислород, который нужен живым организмам для дыхания.
3. Фотосинтез обеспечивает постоянство уровня CO2 и O2 в атмосфере.
4. В верхних слоях воздушной оболочки Земли из кислорода образуется озон O3, из которого формируется защитный озоновый экран, предохраняющий организмы от опасного для жизни воздействия ультрафиолетового излучения.
Источники:
Рис. 1. Хлоропласт https://www.shutterstock.com/ru/image-vector/structure-typical-higherplant-chloroplast-diagram-749518939
Рис. 2. Схема фотосинтеза https://image.shutterstock.com/image-vector/diagram-process-photosynthesis-showing-light-600w-290826602.jpg
Фотосинтез темновая фаза — Справочник химика 21
Процесс фотосинтеза состоит из двух фаз-световой и темновой [c.687]Существуют две фазы процесса фотосинтеза — световая и темновая.
Различают две фазы фотосинтеза — световую и темновую . В первой фазе имеет место фотолиз воды с образованием атомов водорода и кислорода [c.321]
Темновая фаза фотосинтеза [c.216]
Общая характеристика фотосинтеза. Фотосинтез — это совокупность процессов, в ходе которых солнечная энергия запасается в виде химических связей органических соединений, синтезируемых из неорганических веществ.
 Он состоит из двух фаз световой (фото-физический и фотохимический этапы) и темновой. В ходе световой фазы происходит поглощение солнечной энергии хлорофиллом и передача ее в реакционный центр, где в результате химических реакций, включающих транспорт электронов между различными переносчиками и сопряженного с ним фосфорилирования, образуются восстановительные и энергетические эквиваленты (НАДФН и АТФ). Для протекания световой фазы требуются световая энергия, сборщики световой энергии и вода (или другой источник водорода). Темновая фаза фотосинтеза — это фиксация и восстановление СО2 с образованием углеводов и других конечных продуктов [c.193]
Он состоит из двух фаз световой (фото-физический и фотохимический этапы) и темновой. В ходе световой фазы происходит поглощение солнечной энергии хлорофиллом и передача ее в реакционный центр, где в результате химических реакций, включающих транспорт электронов между различными переносчиками и сопряженного с ним фосфорилирования, образуются восстановительные и энергетические эквиваленты (НАДФН и АТФ). Для протекания световой фазы требуются световая энергия, сборщики световой энергии и вода (или другой источник водорода). Темновая фаза фотосинтеза — это фиксация и восстановление СО2 с образованием углеводов и других конечных продуктов [c.193] Темновая фаза фотосинтеза (цикл Кальвина) включает в се в качестве основного процесса восстановление углекислоты, по. ченной клеткой из окружающей среды, до углеводородов. Восс новителем здесь служит образованный на световой. ф НАДФ-Нг, причем эта реакция эндотермична, и необходимая для развития энергия поставляется за счет расщепления АТФ. Хар терный тип реакции фиксации СО2 и образования углеводоро можно представить в виде [c.190]
Хар терный тип реакции фиксации СО2 и образования углеводоро можно представить в виде [c.190]
ТЕМНОВАЯ ФАЗА ФОТОСИНТЕЗА. [c.379]
Современные данные о последовательности реакций темновой фазы фотосинтеза приведены на схеме 3 этот процесс известен также под названиями цикл Кальвина или восстановительный пентозофосфатный цикл.
Сравните реакции глюконеогенеза, пентозофосфатного пути и темновой фазы фотосинтеза. Запишите эти реакции. [c.199]
Не останавливаясь подробно на световой фазе фотосинтеза [64], исследованной, главным образом, Кэлвиным и др., следует упомянуть, что важнейшими процессами здесь являются поглощение хлорофиллом квантов света и использование их энергии для синтеза богатых энергий пирофосфатных связей (АТФ, НАДФ-Н2) поглощаемая энергия света используется при разложении воды, кислород которой выделяется в виде О 2 как конечный продукт фотосинтеза, а водород используется для восстановления при участии АТФ и НАДФ-Н фосфоглицериновой кислоты на второй, темновой стадии фотосинтеза.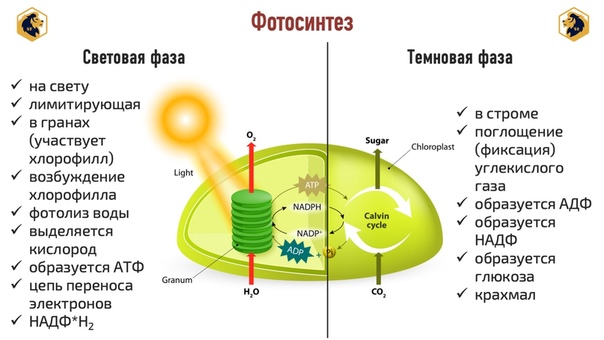 [c.204]
[c.204]
Непосредственными источниками энергии в процессе фотосинтеза во время темновой фазы служат 2 вещества — АТФ и НАДФ-Нз. Оба они образуются во время световой фазы за счет энергии солнечных лучей при участии хлорофилла. Доказано, что на каждый эквивалент выделяющегося Ог (т. е. па Ог) возникает 1 молекула АТФ и 1 молекула НАДФ Нз. [c.262]
При фракционировании изолированных хлоропластов было показано, что их общий процесс фотосинтеза может быть экспериментально разделен на световую и темновую фазы. Темновая фаза заключалась в некоторых энзиматических реакциях, которые превращают СОг в углеводы в интактных зеленых клетках. Эти темновые реакции направляются АТФ и НАД, которые образовались во время световой фазы циклического и нециклического фосфорилирования. [c.329]
Представление об участии в фотосинтезе темновой реакции выдвинул в 1905 г. Блекман.
 В процессе световой фазы накапливаются АТР и NADPH, во время темновой реакции эти вещества расходуются. [c.701]
В процессе световой фазы накапливаются АТР и NADPH, во время темновой реакции эти вещества расходуются. [c.701]В настоящее время процесс фотосинтеза разделяют на тем-новую и световую фазы. Темновая фаза состоит из реакций, при которых образуются углеводы и некоторые другие соединения из СО2. Синтез этих соединений в темновой фа е происходит с участием АТФ и НАДФ Н2, которые возникают в световой фазе при фотосинтетическом фосфорилировании. Было показано, что количество образующихся АТФ и НАДФ Нг, в результате циклического и нециклического фотофосфорилирования достаточно для восстановления СО2 до уровня углеводов в темповых реакциях без света. [c.136]
Суммирование уравнений (Ж) и (3) с учетом возможности превращения триозофосфатов во фруктозо-6-фосфат и неорганический фосфат приводит к следующему суммарному уравнению для процессов темновой фазы фотосинтеза
Согласно приведенным схемам (см. рис. 30, 32), где объединены световая и темновая фазы процесса фотосинтеза в хлоропласте, молекулы фотосистемы П, поглощая квант света, переводят электрон в возбужденное состояние, который и воспринимается пластохиноном Молекулы хлорофилла реакционного центра фотосистемы П вместо утраченного электрона присоединяют электрон молекулы воды или радикала ОН. Пластохинон при участии цитохромов и пластоцианина передает электрон реакционному центру фотосистемы I. Эта фотосистема, также поглощая квант света, отдает возбужденный электрон через катализатор ферредоксин и фермент—ферредоксин-НАДФ-ре-дуктаза НАДФ, который акцептирует иои водорода, образуя НАДФНг — восстановитель с высоким потенциалом. [c.186]
Пластохинон при участии цитохромов и пластоцианина передает электрон реакционному центру фотосистемы I. Эта фотосистема, также поглощая квант света, отдает возбужденный электрон через катализатор ферредоксин и фермент—ферредоксин-НАДФ-ре-дуктаза НАДФ, который акцептирует иои водорода, образуя НАДФНг — восстановитель с высоким потенциалом. [c.186]
С каким соединением связывается диоксид углерода в темновой фазе фотосинтеза [c.206]
Важным звеном в цепи доказательств, связывающих световую фазу фотосинтеза с темновой ассимиляцией СОг в хлоропластах, были опыты, показывающие значение циклического и нециклического фотофосфорилирования. Нециклическое фотофосфорилирование дает три продукта световой фазы фотосинтеза Ог, НАДФ-Нг и АТФ. Циклическое фотофосфорилирование дает только АТФ, и участие этой реакции в ассимиляции СОг необходимо только тогда, когда АТФ нециклического фотофосфорилирования недостаточно для ассимиляции СОг до уровня углевода. Таким образом, ассимиляция СОг зависит от должным образом сбалансированного участия обоих видов фотофосфорилирования. [c.329]
Таким образом, ассимиляция СОг зависит от должным образом сбалансированного участия обоих видов фотофосфорилирования. [c.329]
После того как флуоресценция релаксирует до уровня F (за счет оттока электронов от Од к пулу пластохинонов), включают актиничный свет (AL), который вызывает изменения выхода флуоресценции, аналогичные описанным выше для однолучевых установок (шкала времени на рис. 1.5 не позволяет увидеть быструю фазу индукционной кривой). Интенсивность флуоресценции в определенный момент времени в ходе индукции фотосинтеза обозначают F. Снижение уровня сигнала (тушение флуоресценции) вызвано окислением Од в результате активации реакций темновой фазы фотосинтеза фотохимическое тушение флуоресценции) и увеличением тепловой диссипации в светособирающей антенне ФСП нефотохимическое тушение флуоресценции). [c.18]
Другим доказательством существования темновой фазы фотосинтеза является величина его температурного коэффициента б 10, показывающего, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С.
 Для химических, в том числе энзиматических процессов, Q составляет от 2 до 4, для фотохимических, не зависящих от температуры,— он близок к единице. Для интенсивности фото- [c.64]
Для химических, в том числе энзиматических процессов, Q составляет от 2 до 4, для фотохимических, не зависящих от температуры,— он близок к единице. Для интенсивности фото- [c.64] Здесь следует непременно отметить одно очень важное обстоятельство. Всю последовательность реакций, изображенных на рис. 23-12, мы объединяем под общим названием световые реакции фотосинтеза. Такое определение удобно, поскольку оно вполне четко разграничивает энергогенерирующую фазу фотосинтеза и темновые реакции, обеспечивающие восстановление СОз до глюкозы. Однако название световые реакции не вполне точно. В действительности только для двух этапов этих световых реакций нужен свет, а именно для тех этапов, которые переводят в возбужденное состояние два фотохимических реакционных центра (рис. 23-12). После того как электроны, поглотив световую энергию, перейдут на более высокий энергетический уровень, все остальные этапы фотосинтетического переноса электронов могут уже идти и в темноте. [c.697]
[c.697]
На синтез одной молекулы глюкозы в реакгщи темновой фазы фотосинтеза затрачено АТФ [c.561]
Таким образом, в результате световой фазы фотосинтеза образуется АТФ и НАДФН для использования в ферментативных реакциях темновой фазы. [c.198]
Путь углеродо в фотосинтезе (темновая фаза фотосинтеза) [c.90]
Наличие в процессе фотосинтеза темновых реакций было подтверждено и работами Блэкмана по действию ограничивающих факторов на фотосинтез ( в1аскшап, 1905). №( показано, что когда интенсивность фотосинтеза больше не увеличивается ни при повышении освещенности, ни при поюшении уровня Og, усиление ее может быть вызвано повышением температуры. Блэкман первый шска-зал предположение о том, что в процессе фотосинтеза кроме световой имеется и темновая независимая от света фаза, которая и была названа «реакцией Блэкмана». [c.12]
Итого 12 НАДФН+Н» и 5 молекул Ф-6-Ф из 6 молекул Г-6-Ф. Функции 1) синтез НАДФН для биосинтезов и первой стадии обезвреживания ксенобиотиков 2) синтез пентозофосфатов для нуклеотидов 3) образование моносахаридов от 3 до 7 (в новых схемах до 8) углеводных атомов (триозы, тетрозы, пентозы, гексозы, гептозы) 4) в растениях участие в темновой фазе фотосинтеза. [c.168]
Функции 1) синтез НАДФН для биосинтезов и первой стадии обезвреживания ксенобиотиков 2) синтез пентозофосфатов для нуклеотидов 3) образование моносахаридов от 3 до 7 (в новых схемах до 8) углеводных атомов (триозы, тетрозы, пентозы, гексозы, гептозы) 4) в растениях участие в темновой фазе фотосинтеза. [c.168]
В дальнейшем были выявлены две фазы процесса фотосинтеза первая из них идет на свету а сводится к разлон ению воды, выделению кислоро-рода и возникновению с участием водорода восстановленных соединений, вторая (темновая) включает ассимиляцию углекислоты и образование различных органических соединений. [c.43]
В последнее время опыты с мечеными атомами показали (Кальвин и др.), что фотосинтез является сложным процессом, протекающим в две фазы световую и темновую, и что основным продуктом фотосинтеза является фосфоглицерино-вая кислота. В образовании фосфоглицериновой кислоты участвуют СОз, АТФ и рибулозофосфат. Вначале происходит фосфорилирование рибулозофосфата за счет АТФ под действием фермента фосфорибулокиназы . [c.258]
[c.258]
Однако сами по себе АТР и NADPH не в состоянии восстановить СО2. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления СО2. В настоящее время известны так называемые Сз-путь и С4-путь фиксации СО2, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности. [c.90]
В фотохимической фазе фотосинтеза оОразуются сильные окис-лители и восстановители, участвующие в последующих ферментативных реакциях. Предотвращение рекомбинации этих соединений с потерей энергии в виде тепла возможно только при наличии определенной организации, определенной структуры хлоропласта. Прохождение световых и темновых реакций фотосинтеза также связано с определенным расположением участвующих в них систем на соответственных структурах. Поэтому приятно то огромное внимание, которое сейчас уделяется изучению строения хлоропластов и других структурных образований, в которых осуществляется весь процесс фотосинтеза или только часть составляодих его реакций. [c.93]
[c.93]
У растений, цианобактерий и прохлофи-тов фотосинтез протекает в 2 фазы световые и темновые реакции. [c.193]
В ходе темновой фазы фотосинтеза энергия АТР и NADPH расходуется на восстановительное карбоксилирование (ассимиляцию СО2) с образованием 3-фосфоглицеринового альдегида (Сз-путь фотосинтеза) или органических кислот (Сд-путь) в качестве первичных продуктов. Энергия света в хлоропластах может использоваться также на восстановление NOf и ЗОд . При недостатке СО2 и избытке О2 включается фотодыхание с участием пероксисом. [c.123]
Фотосинтез фазы световая и темновая
Существуют две фазы процесса фотосинтеза — световая и темновая. [c.210]Различают две фазы фотосинтеза — световую и темновую . В первой фазе имеет место фотолиз воды с образованием атомов водорода и кислорода [c.321]
Процесс фотосинтеза состоит из двух фаз-световой и темновой [c. 687]
687]
Общая характеристика фотосинтеза. Фотосинтез — это совокупность процессов, в ходе которых солнечная энергия запасается в виде химических связей органических соединений, синтезируемых из неорганических веществ. Он состоит из двух фаз световой (фото-физический и фотохимический этапы) и темновой. В ходе световой фазы происходит поглощение солнечной энергии хлорофиллом и передача ее в реакционный центр, где в результате химических реакций, включающих транспорт электронов между различными переносчиками и сопряженного с ним фосфорилирования, образуются восстановительные и энергетические эквиваленты (НАДФН и АТФ). Для протекания световой фазы требуются световая энергия, сборщики световой энергии и вода (или другой источник водорода). Темновая фаза фотосинтеза — это фиксация и восстановление СО2 с образованием углеводов и других конечных продуктов [c.193]
Темновая фаза фотосинтеза (цикл Кальвина) включает в се в качестве основного процесса восстановление углекислоты, по.
 ченной клеткой из окружающей среды, до углеводородов. Восс новителем здесь служит образованный на световой. ф НАДФ-Нг, причем эта реакция эндотермична, и необходимая для развития энергия поставляется за счет расщепления АТФ. Хар терный тип реакции фиксации СО2 и образования углеводоро можно представить в виде [c.190]
ченной клеткой из окружающей среды, до углеводородов. Восс новителем здесь служит образованный на световой. ф НАДФ-Нг, причем эта реакция эндотермична, и необходимая для развития энергия поставляется за счет расщепления АТФ. Хар терный тип реакции фиксации СО2 и образования углеводоро можно представить в виде [c.190]Измеряя квантовый выход, можно установить, что фотосинтез сО стоит из двух фаз световой и темновой. В процессе световой фазы накапливаются АТР и NADPH, во время темновой реакции эти вещества расходуются. [c.701]
Непосредственными источниками энергии в процессе фотосинтеза во время темновой фазы служат 2 вещества — АТФ и НАДФ-Нз. Оба они образуются во время световой фазы за счет энергии солнечных лучей при участии хлорофилла. Доказано, что на каждый эквивалент выделяющегося Ог (т. е. па Ог) возникает 1 молекула АТФ и 1 молекула НАДФ Нз. [c.262]
При фракционировании изолированных хлоропластов было показано, что их общий процесс фотосинтеза может быть экспериментально разделен на световую и темновую фазы. Темновая фаза заключалась в некоторых энзиматических реакциях, которые превращают СОг в углеводы в интактных зеленых клетках. Эти темновые реакции направляются АТФ и НАД, которые образовались во время световой фазы циклического и нециклического фосфорилирования. [c.329]
Темновая фаза заключалась в некоторых энзиматических реакциях, которые превращают СОг в углеводы в интактных зеленых клетках. Эти темновые реакции направляются АТФ и НАД, которые образовались во время световой фазы циклического и нециклического фосфорилирования. [c.329]
Здесь следует непременно отметить одно очень важное обстоятельство. Всю последовательность реакций, изображенных на рис. 23-12, мы объединяем под общим названием световые реакции фотосинтеза. Такое определение удобно, поскольку оно вполне четко разграничивает энергогенерирующую фазу фотосинтеза и темновые реакции, обеспечивающие восстановление СОз до глюкозы. Однако название световые реакции не вполне точно. В действительности только для двух этапов этих световых реакций нужен свет, а именно для тех этапов, которые переводят в возбужденное состояние два фотохимических реакционных центра (рис. 23-12). После того как электроны, поглотив световую энергию, перейдут на более высокий энергетический уровень, все остальные этапы фотосинтетического переноса электронов могут уже идти и в темноте. [c.697]
[c.697]
Экспериментальные доказательства реального существования этих двух фаз фотосинтеза были получены в опытах с мигающим светом, которые ставились следующим образом. Между источником света и растением помещали непрозрачный вращающийся диск с вырезанным сектором. Изменяя скорость вращения диска и величину вырезанного сектора, создавали различную длительность и соотношение светового и темпового периодов. Были использованы и другие способы импульсного освещения. Определялась интенсивность фотосинтеза листьев или суспензии клеток хлореллы. Опыты с мигающим светом, проведенные в России (А. А. Рихтер, 1914) и в США (Р. Эмерсон и У. Арнольд, 1932, 1941), показали, что максимальная интенсивность фотосинтеза наблюдается не при непрерывном, а при импульсном освещении (пересчет сделан на время освещения) и особенно в тех случаях, когда продолжительность темновых промежутков составляла 0,04 — 0,06 с (при 25 °С). Оптимальное время световой вспышки оказалось порядка 10 с.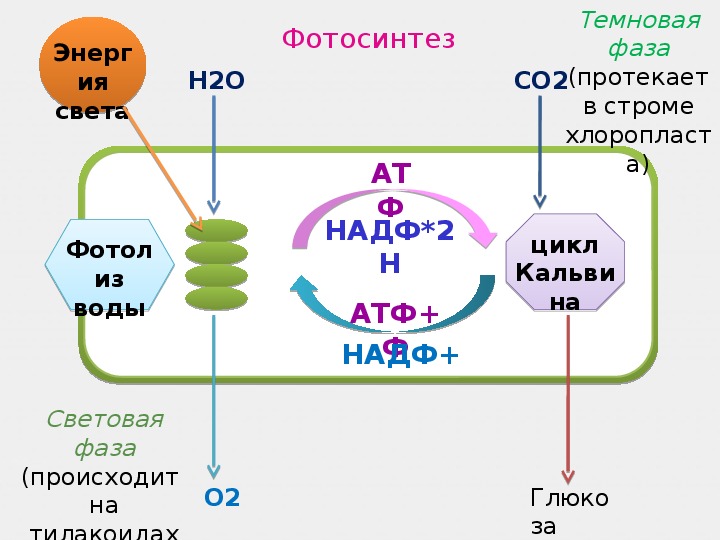 Большая эффективность импульсного света доказывает наличие темновых реакций в фотосинтезе, так как темновые (энзиматические) процессы осуществляются более медленно, чем фотохимические. [c.64]
Большая эффективность импульсного света доказывает наличие темновых реакций в фотосинтезе, так как темновые (энзиматические) процессы осуществляются более медленно, чем фотохимические. [c.64]
Восприятие растением сезонных изменений с помощью фотопериодизма связано не только с рецепцией световых и темновых сигналов, но и с передачей этих сигналов внутренним биологическим часам, на существование которых указывают легко наблюдаемые циркадные ритмы. Такие ритмы были обнаружены во многих процессах, включая движения листьев, фотосинтез, деление клеток и биолюминесценцию у водорослей, а также в активности некоторых клеточных ферментов. В то время как амплитуда и фаза ритмических колебаний чувствительны к температуре, период в большинстве случаев практически не зависит от нее. Механизм создания периодичности и природа температурной компенсации не ясны, но есть некоторые данные в пользу того, что ритмы связаны с циклическими изменениями в мембранах.
 [c.387]
[c.387]Процесс фотосинтеза сводится к двум фазам одна связана с поглощением световой энергии хлорофиллами айв и может протекать только на свету (световая стадия), другая обусловливает восстановление СОг, т. е. синтез углеводов, и происходит без непосредственного участия света (темновая стадия). [c.59]
Согласно приведенным схемам (см. рис. 30, 32), где объединены световая и темновая фазы процесса фотосинтеза в хлоропласте, молекулы фотосистемы П, поглощая квант света, переводят электрон в возбужденное состояние, который и воспринимается пластохиноном Молекулы хлорофилла реакционного центра фотосистемы П вместо утраченного электрона присоединяют электрон молекулы воды или радикала ОН. Пластохинон при участии цитохромов и пластоцианина передает электрон реакционному центру фотосистемы I. Эта фотосистема, также поглощая квант света, отдает возбужденный электрон через катализатор ферредоксин и фермент—ферредоксин-НАДФ-ре-дуктаза НАДФ, который акцептирует иои водорода, образуя НАДФНг — восстановитель с высоким потенциалом. [c.186]
[c.186]
У растений, цианобактерий и прохлофи-тов фотосинтез протекает в 2 фазы световые и темновые реакции. [c.193]
В последнее время опыты с мечеными атомами показали (Кальвин и др.), что фотосинтез является сложным процессом, протекающим в две фазы световую и темновую, и что основным продуктом фотосинтеза является фосфоглицерино-вая кислота. В образовании фосфоглицериновой кислоты участвуют СОз, АТФ и рибулозофосфат. Вначале происходит фосфорилирование рибулозофосфата за счет АТФ под действием фермента фосфорибулокиназы . [c.258]
Наличие в процессе фотосинтеза темновых реакций было подтверждено и работами Блэкмана по действию ограничивающих факторов на фотосинтез ( в1аскшап, 1905). №( показано, что когда интенсивность фотосинтеза больше не увеличивается ни при повышении освещенности, ни при поюшении уровня Og, усиление ее может быть вызвано повышением температуры. Блэкман первый шска-зал предположение о том, что в процессе фотосинтеза кроме световой имеется и темновая независимая от света фаза, которая и была названа «реакцией Блэкмана».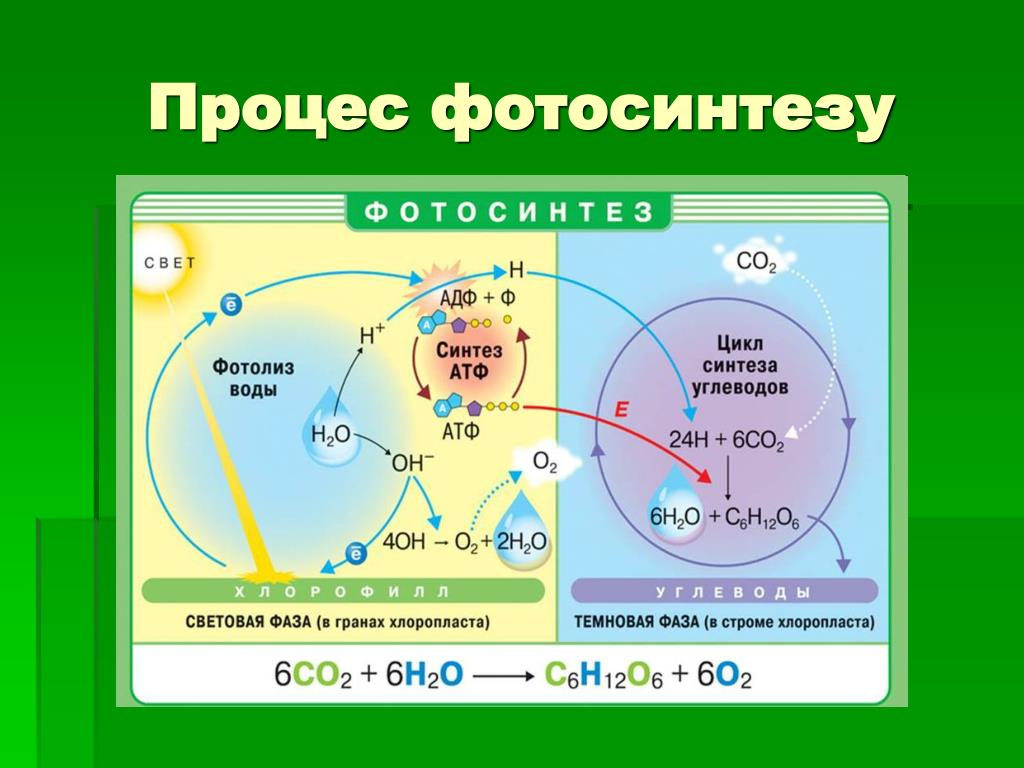 [c.12]
[c.12]
Представление об участии в фотосинтезе темновой реакции выдвинул в 1905 г. Блекман. В 1937 г. Мак-Алистер и Майерс отметили, что водоросли продолжают поглощать углекислоту в течение короткого промежутка времени после прекращения освещения. Использование С Ог позволило подтвердить данные Мак-Алистера и Майерс о том, что связывание углекислоты происходит в темноте, непосредственно после периода освещения. Недавно с помощью фракционирования хлоропластов на граны и строму удалось осуществить физическое разделение световой и темновой реакций. Световая фаза была завершена в освещенных хлоропластах (в соответствующей реакционной смеси) в отсутствие углекислоты. При этом выделился кислород и образовались субстратные количества АТФ и НАДФ-Нг- После этого граны удалили центрифугированием. Оставшаяся строма, содержащая полученные в результате предыдущей световой реакции АТФ и НАДФ-Нг, оказалась способной ассимилировать углекислоту в темноте с образованием триозофосфата и фосфатов сахаров. [c.275]
[c.275]
Таким образом, в результате световой фазы фотосинтеза образуется АТФ и НАДФН для использования в ферментативных реакциях темновой фазы. [c.198]
В настоящее время процесс фотосинтеза разделяют на тем-новую и световую фазы. Темновая фаза состоит из реакций, при которых образуются углеводы и некоторые другие соединения из СО2. Синтез этих соединений в темновой фа е происходит с участием АТФ и НАДФ Н2, которые возникают в световой фазе при фотосинтетическом фосфорилировании. Было показано, что количество образующихся АТФ и НАДФ Нг, в результате циклического и нециклического фотофосфорилирования достаточно для восстановления СО2 до уровня углеводов в темповых реакциях без света. [c.136]
В фотохимической фазе фотосинтеза оОразуются сильные окис-лители и восстановители, участвующие в последующих ферментативных реакциях. Предотвращение рекомбинации этих соединений с потерей энергии в виде тепла возможно только при наличии определенной организации, определенной структуры хлоропласта. Прохождение световых и темновых реакций фотосинтеза также связано с определенным расположением участвующих в них систем на соответственных структурах. Поэтому приятно то огромное внимание, которое сейчас уделяется изучению строения хлоропластов и других структурных образований, в которых осуществляется весь процесс фотосинтеза или только часть составляодих его реакций. [c.93]
Прохождение световых и темновых реакций фотосинтеза также связано с определенным расположением участвующих в них систем на соответственных структурах. Поэтому приятно то огромное внимание, которое сейчас уделяется изучению строения хлоропластов и других структурных образований, в которых осуществляется весь процесс фотосинтеза или только часть составляодих его реакций. [c.93]
Важным звеном в цепи доказательств, связывающих световую фазу фотосинтеза с темновой ассимиляцией СОг в хлоропластах, были опыты, показывающие значение циклического и нециклического фотофосфорилирования. Нециклическое фотофосфорилирование дает три продукта световой фазы фотосинтеза Ог, НАДФ-Нг и АТФ. Циклическое фотофосфорилирование дает только АТФ, и участие этой реакции в ассимиляции СОг необходимо только тогда, когда АТФ нециклического фотофосфорилирования недостаточно для ассимиляции СОг до уровня углевода. Таким образом, ассимиляция СОг зависит от должным образом сбалансированного участия обоих видов фотофосфорилирования.
 [c.329]
[c.329]Не останавливаясь подробно на световой фазе фотосинтеза [64], исследованной, главным образом, Кэлвиным и др., следует упомянуть, что важнейшими процессами здесь являются поглощение хлорофиллом квантов света и использование их энергии для синтеза богатых энергий пирофосфатных связей (АТФ, НАДФ-Н2) поглощаемая энергия света используется при разложении воды, кислород которой выделяется в виде О 2 как конечный продукт фотосинтеза, а водород используется для восстановления при участии АТФ и НАДФ-Н фосфоглицериновой кислоты на второй, темновой стадии фотосинтеза. [c.204]
Уровень фотосинтетической активности клетки снижается (рис. 2O, кривая 2, рис. За, кривая I). Сравнение газообмена интактных листьев и водорослей с лшинесцентными характеристиками хлорофилла а показало, что в этот мсжиент не изменяется пигментный состав фотосинтетического аппарата, не нарушается поступление энергии от светособирающих пигментов в реакционные центры, не тормозится существенно скорость фотосинтетического электронного транспорта. Однако в это время отказывает один из гомеостатических механизмов фотосинтетического аппарата, регулирующий оптимальное распределение световой энергии между фотосистемами. В результате во время лаг-фазы фотосинтеза тормозится светоиндуцированный структурный переход тилакоидных мембран из «темнового» состояния 1 в «световое» состояние 2. Об этом свидетельствовало уменьшение светозависимого изменения спектров флуоресценции при температуре жидкого азота (рис. За, кривая 2). [c.30]
Однако в это время отказывает один из гомеостатических механизмов фотосинтетического аппарата, регулирующий оптимальное распределение световой энергии между фотосистемами. В результате во время лаг-фазы фотосинтеза тормозится светоиндуцированный структурный переход тилакоидных мембран из «темнового» состояния 1 в «световое» состояние 2. Об этом свидетельствовало уменьшение светозависимого изменения спектров флуоресценции при температуре жидкого азота (рис. За, кривая 2). [c.30]
Световая и темновая фазы фотосинтеза
Растения
поставляют нам кислород и органические вещества, и всё это благодаря процессу фотосинтеза. Лист
является важнейшим органом растения, в котором из неорганических веществ
образуются органические. Вспомним, что способность к фотосинтезу характерна
только для зелёных растений,
фотосинтезирующих бактерий и цианобактерий.
Грибы, большая часть бактерий и животные не способны осуществлять фотосинтез,
так как в их клетках нет хлоропластов.
Процесс фотосинтеза представляет собой цепь окислительно-восстановительных реакций, где происходит восстановление углекислого газа до органических веществ. Всю совокупность фотосинтетических реакций делят на две фазы – световую и темновую. Световая фаза осуществляется на мембранах тилакоидов и только при наличии света. Реакции темновой фазы протекают в строме хлоропластов и не требуют света, однако для их прохождения необходимы продукты световой фазы. Поэтому темновая фаза идёт практически со световой.
Для световой фазы характерно то, что энергия солнечного света, поглощённая хлорофиллами, преобразуется сначала в электрохимическую, а затем в энергию макроэргических связей АТФ (это ковалентные связи, которые гидролизуются с выделением большого количества энергии).
Световая
фаза фотосинтеза разделяется на фотофизическую
и фотохимическую фазы. В фотофизической происходит поглощение
квантов света молекулами хлорофиллов. В фотохимической фазе обе фотосистемы
работают согласованно.
Рассмотрим подробно процессы, которые протекают в световой фазе.
1. Пигменты фотосистемы I и фотосистемы II поглощают свет разной длины волны. Полученная энергия передаётся в реакционные центры на молекулы хлорофиллов (молекулы-ловушки). Важнейшими из хлорофиллов реакционного центра являются хлорофиллы П700 в фотосистеме I и П680 вфотосистеме II. Они поглощают свет с длиной волны 700 и 680 нм соответственно. Молекулы хлорофиллов переходят в возбуждённое состояние и отдают электроны переносчикам.
Электрон из фотосистемы I транспортируется переносчиками на внешнюю сторону тилакоида. При этом молекула П700 окислятся и превращается в П700+.
В фотосистеме II возбуждённая молекула П680 отдаёт электрон акцептору, который из фотосистемы II с помощью
переносчиков доставляется в фотосистему I, каждый
раз теряя часть энергии. Он восстанавливает молекулу-ловушку в реакционном
центре. При этом молекула возбуждённая молекула П700 возвращается в
исходное состояние и становится вновь способной поглощать свет и переходить в
возбуждённое состояние. А молекула П680, отдав электрон,
превращается в П680+.
А молекула П680, отдав электрон,
превращается в П680+.
Получается, что фотосистема I восстанавливается за счёт электронов из фотосистемы II, которая, в свою очередь, получает электроны за счёт фотолиза воды:
2Н2О → О2 + 4е— + 4Н+
Фотолиз воды осуществляется благодаря наличию в фотосистеме II ферментного комплекса, который расщепляет молекулы воды с образованием кислорода, электронов и протонов водорода. Протоны водорода накапливаются внутри тилакоида. Кислород, который образуется при фотолизе воды, выделяется из хлоропласта в цитоплазму клетки, а затем через устьица в окружающую среду.
2. Таким образом, по разные стороны мембраны накапливаются
протоны и электроны, которые, соответственно, имеют положительный и
отрицательный заряды. Это ведёт к возникновению
электро-химического потенциала на мембране тилакоида. В мембране тилакоида
также содержится фермент АТФ-синтетаза. Когда
концентрация протонов достигает определённого уровня (200 мВ), они устремляются
в строму хлоропласта, проходя через специальные каналы АТФ-синтетазы,
то есть начинает работать протонная помпа. При этом АТФ-синтетаза
использует энергию движения протонов для синтеза АТФ. На выходе из протонного
канала создаётся высокий уровень энергии, которая используется для фосфорилирования молекул АДФ, имеющихся в
матриксе хлоропластов.
Когда
концентрация протонов достигает определённого уровня (200 мВ), они устремляются
в строму хлоропласта, проходя через специальные каналы АТФ-синтетазы,
то есть начинает работать протонная помпа. При этом АТФ-синтетаза
использует энергию движения протонов для синтеза АТФ. На выходе из протонного
канала создаётся высокий уровень энергии, которая используется для фосфорилирования молекул АДФ, имеющихся в
матриксе хлоропластов.
3. На внешней стороне тилакоида происходит восстановление НАДФокисленногоза счёт присоединения к нему электронов и протонов. НАДФ – никотинамидадениндинуклеотидфосфат – это переносчик водорода в процессе фотосинтеза.
НАДФ+ + 2е— + 2Н+ → НАДФН + Н+
Таким образом, в ходе световой фазы энергия света поглощается
и преобразуется в энергию макроэргических связей АТФ, происходит расщепление воды
с выделением кислорода и накопление атомов водорода (в форме НАДФ
восстановленного).
Продуктами световой фазы фотосинтеза являются АТФ, восстановленный НАДФ и кислород. Кислород – побочный продукт фотосинтеза, он выделяется в окружающую среду. Весь кислород воздуха на нашей планете был образован в результате фотосинтетической деятельности зелёных растений.
Далее начинается темновая фаза фотосинтеза, которая протекает в строме хлоропласта. Поскольку для прохождения реакций данной фазы не нужен свет, её назвали темновой. В ней используются продукты световой фазы, а именно АТФ и НАДФ восстановленный, поэтому реакции темновой фазы происходят почти одновременно с реакциями световой фазы.
Из окружающей среды через устьица в хлоропласты поступает углекислый газ, и происходит его восстановление до органических веществ, в химических связях которых запасена энергия, первоначально полученная при возбуждении электрона хлорофилла квантом света.
Углекислый газ способен реагировать с пятиуглеродным
соединением – рибулёзо-1,5-бифосфатом, которое образуется в строме в результате фосфорилирования с помощью АТФ молекул рибулозо-5-фосфата. Фермент присоединяет углекислый газ к рибулёзо-1,5-бифосфату, и полученный в
результате этого шестиуглеродный промежуточный
продукт быстро распадается на две молекулы 3-фосфоглицериновой кислоты. Затем
происходит цикл реакций, который называется циклом Кальвина (или С3-путь).
Через ряд промежуточных продуктов фосфоглицериновая кислота преобразуется в
глюкозу.
Фермент присоединяет углекислый газ к рибулёзо-1,5-бифосфату, и полученный в
результате этого шестиуглеродный промежуточный
продукт быстро распадается на две молекулы 3-фосфоглицериновой кислоты. Затем
происходит цикл реакций, который называется циклом Кальвина (или С3-путь).
Через ряд промежуточных продуктов фосфоглицериновая кислота преобразуется в
глюкозу.
Восстановление углекислого газа – это сложный многоступенчатый процесс, который можно выразить общим уравнением:
6СО2 + 12НАДФН+Н+ + 18АТФ → С6Н12О6 + 12НАДФ+ + 18АДФ + 18Н3РО4
Из записанного уравнения видно, что для синтеза одной молекулы
глюкозы необходимо окислить 12 молекул НАДФ восстановленного, которые служат источником
атомов водорода, и 18 молекул АТФ, которые служат источником энергии для
синтеза глюкозы. Таким образом, в темновой фазе
фотосинтеза энергия макроэргических связей АТФ преобразуется в энергию
химических связей органических веществ.
Если объединить процессы, протекающие в обеих фазах, исключив промежуточные стадии и вещества, можно получить суммарное уравнение процесса фотосинтеза:
6СО2 + 6Н2О → С6Н12О6 + 6О2
Фотосинтез происходит только на свету. Проведём опыт, который это доказывает.
Возьмём две ёмкости и опустим в них растения. Наполним ёмкости углекислым газом и плотно закроем, чтобы не проникал воздух. Первую ёмкость выставим на яркий свет, вторую оставим в темноте. Через сутки откроем ёмкости, опустим в них горящие лучинки. В первой – лучинка не гаснет, а продолжает ярко гореть. Значит, в этой ёмкости появился кислород, поддерживающий горение. Зелёные листья растения поглотили значительную часть углекислого газа и выделили некоторое количество кислорода. Опущенная во вторую ёмкость горящая лучинка потухнет. Следовательно, зелёные растения выделяют кислород только на свету.
На скорость фотосинтеза оказывают влияние различные
факторы окружающей среды: интенсивность падающего света, наличие
влаги и минеральных веществ, температура окружающей среды и концентрация
углекислого газа.
Проведём несложный опыт. Возьмём два одинаковых комнатных растения. Одно из них поставим туда, где оно будет освещаться ярким солнечным светом. Второе растение поставим в тёмное место, куда солнечный свет вообще не проникает. Через неделю срежем с каждого растения по одному листу. Опустим листья сначала в кипящую воду, а затем на несколько минут в горячий спирт, пока листья не обесцветятся. Промоем обесцвеченные листья, расправим их и обработаем слабым раствором йода. Известно, что от йода синеет крахмал. Тот лист, который был на свету, посинел. Второй же лист, на который не попадал солнечный свет, остался бесцветным. Опыт показывает, что только в том листе, который был освещён солнцем, образовался крахмал.
На
самом деле первоначально под действием света в листьях образуется глюкоза. Но
она быстро превращается в крахмал, который накапливается в листьях. В темноте
крахмал вновь превращается в глюкозу, которая по проводящим тканям оттекает от
листьев к другим органам растений.
Уникальность и биологическое значение фотосинтеза определяются тем, что жизнь на нашей планете всем своим существованием обязана этому процессу. Фотосинтез является основным источником питательных веществ для живых организмов, а также единственным поставщиком свободного кислорода на Земле. Из кислорода сформировался и поддерживается озоновый слой (часть стратосферы на высоте от 20 до 25 километров, с наибольшим содержанием озона). Озоновый слой защищает живые организмы от губительного воздействия ультрафиолетового излучения. Кроме того, благодаря фотосинтезу поддерживается относительно постоянное содержание углекислого газа в атмосфере.
Темновая фаза фотосинтеза
Кислород – важнейшая составляющая существования всего живого на Земле. Удивительно, но этот элемент на нашей планете, хоть его концентрация в воздухе по данным некоторых ученых неумолимо уменьшается, является восполнимым запасом. Еще более поразительным кажется тот факт, что синтезируется он из более чем доступных ресурсов – воды, солнечного света и углекислого газа. И осуществляют этот чудесный процесс растения.
И осуществляют этот чудесный процесс растения.
Конечно, речь идет о фотосинтезе – удивительном творении природы. Несмотря на то, что ученые досконально изучили этот вопрос, повторить этапы фотосинтеза в лабораторных условиях нереально по сей день.
Этот процесс принято делить на два этапа:
- Световая фаза фотосинтеза.
- Темновая фаза фотосинтеза.
Из их названия вполне ясно, что первая часть процесса протекает на свету, то есть при участии солнечных лучей. Происходит она только в зеленых листьях растений, поскольку те содержат хлоропласты – особые элементы, в мембранах которых осуществляется синтез АТФ – молекулы, в которой запасается энергия.
При попадании фотонов солнечного света на листья растений, содержащих хлорофилл, происходит превращение энергии солнечного света в энергетические молекулы АТФ, уже упомянутые выше. Кроме того, благодаря отщеплению двух атомов водорода от молекулы воды (что также происходит при помощи солнечного света) образуется молекула НАДФ. Разложенная молекула воды, лишенная двух атомов водорода, остается со свободным кислородом, который и поступает в атмосферу. Таким образом, продукты фотосинтеза в световой фазе – это:
Разложенная молекула воды, лишенная двух атомов водорода, остается со свободным кислородом, который и поступает в атмосферу. Таким образом, продукты фотосинтеза в световой фазе – это:
- кислород;
- энергетическая молекула АТФ;
- атомарный водород НАДФ Н2.
Любопытно, что образование кислорода в этом процессе вовсе не является конечной целью. Скорее, это побочный эффект. Далее происходит темновая фаза фотосинтеза, или хемосинтез, в котором принимают непосредственное участие продукты первой фазы. Рассмотрим его поподробнее.
Действительно, целью процесса не является образование кислорода. Темновая фаза фотосинтеза протекает в иной части листа – в стромах его хлоропластов. По окончанию световой фазы растение успевает запастись внушительным количеством энергетических молекул – АТФ и НАДФ Н2, следовательно, участие света больше не является необходимым. Именно с помощью этих молекул происходит синтез органических элементов. Логично, что задача энергетической молекулы АТФ – поставка энергии для осуществления процессов синтеза, в то время как роль НАДФ Н2 – восстановление.
В начале этой фазы молекула восстановителя окисляется, благодаря чему исчезают два атома водорода, что на выходе дает чистую молекулу НАДФ. В то же время АТФ отдает остаток фосфорной кислоты, превращаясь в АДФ. Эти два процесса происходят в матриксе листа. Вновь полученные молекулы после этого возвращаются в грани листьев, что дает возможность повторить весь процесс световой фазы. Однако и это не является ключевым процессом фотосинтеза, мы лишь обозначили цикличность и последовательность операций, происходящих в листьях.
Конечным продуктом данной фазы становится глюкоза – органическое соединение, относимое к простым сахарам. Впервые подробно описать синтез этой молекулы смог Мелвин Кальвин. Выяснилось, что обе молекулы, рассмотренные в рамках световой фазы, – энергетическая и восстановитель – участвуют в процессах синтеза. Кроме того, важными элементами для образования простых сахаров являются 6 молекул углекислого газа (CO2), 24 атомов водорода, 6 молекул воды:
6СО2 + 24Н + АТФ С6Н12О6 + 6Н2O.
Темновая фаза фотосинтеза важна растениям потому, что кроме глюкозы в этот период образуются различные аминокислоты, нуклеотиды, жирные кислоты и глицерин.
Фотосинтез – в высшей степени уникальный природный процесс. Он не только является залогом поддержания постоянного уровня кислорода в атмосфере и озоновом слое, но и являет собой совершенство природы, когда из неорганических элементов создаются органические.
Биология| Фотосинтез: световая и темновая фаза
Жизнь на Земле возможна благодаря световой, главным образом, солнечной энергии. Эта энергия преобразуется в энергию химических связей органических веществ, образующихся в процессе фотосинтеза.
Фотосинтезом обладают все растения и некоторые прокариоты (фотосинтезирующие бактерии и сине зелёные водоросли). Такие организмы называются фототрофами. Энергию для фотосинтеза даёт свет, который улавливается особыми молекулами –фотосинтетическими пигментами. Поскольку при этом поглощается свет лишь определённой длины волны, часть световых волн не поглощается, а отражается. В зависимости от спектрального состава отражённого света пигменты приобретают окраску – зелёную, жёлтую, красную и др.
В зависимости от спектрального состава отражённого света пигменты приобретают окраску – зелёную, жёлтую, красную и др.
Различают три типа фотосинтетических пигментов – хлорофиллы, каротиноиды и фикобилины. Наиболее важным пигментом является хлорофилл. Основой является плоское порфириновое ядро, образованное четырьмя пиррольными кольцами, соединёнными между собой метиловыми мостиками, с атомом магния в центре. Имеются различные хлорофиллы типа- а. У высших растений, зелёных и эвгленовых водорослей имеется хлорофилл-В, который образуется из хлорофилла — А. Бурые и диатомовые водоросли вместо хлорофилла-в содержат хлорофилл-С, а красные водоросли – хлорофилл-Д. Другую группу пигментов образуют каротиноиды, имеющие окраску от жёлтой до красной. Они содержатся во всех окрашенных пластидах (хлоропластах, хромопластах) растений. Причём в зелёных частях растений хлорофилл маскирует каротиноиды, делая их незаметными до наступления холодов. Осенью зелёные пигменты разрушаются и каротиноиды становятся хорошо заметными. Каротиноиды синтезируют фототрофные бактерии и грибы. Фикобилины присутствуют у красных водорослей и цианобактерий.
Каротиноиды синтезируют фототрофные бактерии и грибы. Фикобилины присутствуют у красных водорослей и цианобактерий.
Световая стадия фотосинтеза
Хлорофиллы и другие пигменты в хлоропластах образуют специфические светособирающие комплексы. Путём электромагнитного резонанса они передают собранную энергию на особые молекулы хлорофилла. Эти молекулы под действием энергии возбуждения отдают электроны молекулам других веществ – переносчикам, а затем отнимают электроны у белков и далее, от воды. Расщепление воды в процессе фотосинтеза называется фотолизом. Это происходит в полостях тилакоидов. Протоны через специальные каналы проходят в строму. При этом выделяется энергия, необходимая для синтеза АТФ:
2Н2О = 4е + 4Н+ + О2
АДФ + Ф = АТФ
Участие энергии света здесь является обязательным условием, поэтому данную стадию называют световой стадией. Кислород, образующийся как побочный продукт выводится наружу и используется клеткой для дыхания.
Кислород, образующийся как побочный продукт выводится наружу и используется клеткой для дыхания.
Темновая стадия фотосинтеза
Следующие реакции протекают в строме хлоропласта. Из углекислого газа и воды происходит образование моносахаридов. Сам по себе данный процесс противоречит законам термодинамики, но поскольку при этом участвуют молекулы АТФ, то за счёт этой энергии синтез глюкозы является реальным процессом. Позже, из её молекул создаются полисахариды – целлюлоза, крахмал и другие сложные органические молекулы. Суммарное уравнение фотосинтеза можно представить в следующем виде:
6СО2 + 6Н2О = С6Н12О6 + 6О2
Особенно много крахмала откладывается в хлоропластах днём при интенсивном течении фотосинтетических процессов, ночью же крахмал расщепляется до растворимых форм и используется растением.
Хотите более подробно разобраться в этой или другой теме по биологии? Записывайтесь на онлайн-уроки к автору этой статьи Владимиру Смирнову.
Статья является выдержкой из труда Владимира Смирнова «Генезис», любое копирование и использование материала обязательно с указанием авторства.
Также предлагаем посмотреть видеоурок о фотосинтезе от нашего ботаника Ирины:
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
световая фаза
Продукты световой фазы, в которых аккумулирована энергия света,— АТФ и НАДФ-Нг—Арнон назвал ассимиляционной силой. Образование этих соединений идет в отсутствии СОг. При паличии АТФ в НАДФ-Нг восстаповлепие СОг до уровня углеводов может происходить в темноте.[ …]
В процессах фотосинтеза различают световую и темновую фазы. В световой фазе происходит улавливание и преобразование энергии солнечного света в энергию химических связей органических соединений — в форму, пригодную для использования в процессах биосинтеза. [ …]
[ …]
Ряд фотосинтетических реакций можно сгруппировать в световую фазу (реакции, требующие света) и темновую фазу (реакции, не требующие света).[ …]
В отличие от ферментов, принимающих участие в цепи переноса электронов (световая фаза фотосинтеза) ферменты цикла Кальвина локализованы в матриксе хлоропластов. Согласованному осуществлению всех реакций способствует то, что эти ферменты часто ассоциированы на поверхности мембран и составляют определенные ансамбли.[ …]
Первая ступень этих реакций не зависит от температуры и состоит из улавливания световой энергии, которая расщепляет молекулу воды на водород и кислород (фотолиз). Кислород освобождается в виде газообразного молекулярного кислорода, а водород улавливается акцептором водорода никотинамидадениндинуклеотидфосфатом (НАДФ). Таким образом, освобождение кислорода в процессе фотосинтеза не зависит от синтеза углеводов. Эту фазу принято считать реакцией Хилла (НАДФ служит в качестве естественного реагента Хилла). Сочетание реакции Хилла и фосфорилирования известно как световая фаза фотосинтеза.[ …]
Сочетание реакции Хилла и фосфорилирования известно как световая фаза фотосинтеза.[ …]
При попадании в листья замещенные мочевины быстро подавляют фотосинтез, а именно световую фазу его (действуют на реакцию Хилла). С этим и связывают фитотоксическое действие этих препаратов.[ …]
Хотя главным местом действия указанных карбаматов являются корни растений, они, проникнув в листья, подавляют световую фазу фотосинтетического процесса и вызывают сильные изменения в составе растений. В обработанных, например, хлор-ИФК растениях сои (дозировка 8,96 кг на 1 га) общее содержание сахаров повышается на 90% по сравнению с контролем. Близкое к этому повышение содержания сахаров наблюдается в растениях кукурузы.[ …]
Бюннинг, естественно, предположил, что ф о топ е р и о д и ч е с к и й цикл запускается с рассветом, который начинает осцилляцию, и что скотофильная фаза продолжается 12 ч после этого «включения» светового сигнала. Однако впоследствии экспериментальные данные показали, что у некоторых видов осцилляция устанавливается в результате их перемещения со света в темноту, т.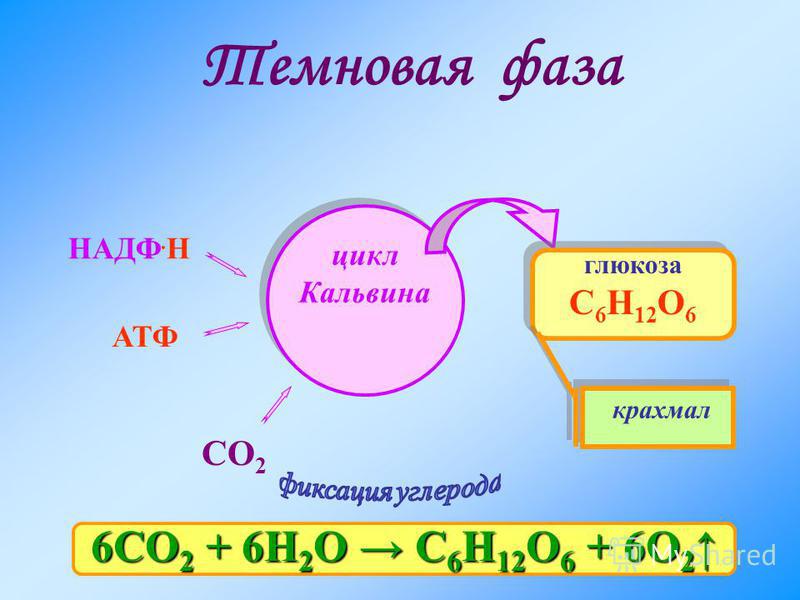 е. путем «выключения» светового сигнала. Есть некоторые данные, что фитохром участвует в реакции «выключения» сигнала. Например, у Lemna perpusiîta эндогенный ритм в выработке углекислого газа устанавливается «выключением» светового сигнала в конце периода красного света, и К/КД-вза-имообращаемость была продемонстрирована для световой фазы.[ …]
е. путем «выключения» светового сигнала. Есть некоторые данные, что фитохром участвует в реакции «выключения» сигнала. Например, у Lemna perpusiîta эндогенный ритм в выработке углекислого газа устанавливается «выключением» светового сигнала в конце периода красного света, и К/КД-вза-имообращаемость была продемонстрирована для световой фазы.[ …]
Целый ряд исследований показывает, что образование хлорофилла идет интенсивнее на прерывистом свете. Это подтверждает, что в образовании хлорофилла имеется темповая и световая фазы. При атом световая фаза значительно короче темновой.[ …]
Дальнейпше исследования показали, что те же самые ингибиторы, которые тормовят реакцию Хилла, приостанавливают и выделение кислорода в процессе фотосинтеза. Это дало основание считать, что световая фаза фотосинтеза включает разложение воды. Таким образом, в процессе фотосинтеза происходит разложение воды, на что в первую очередь затрачивается энергия света.[ …]
Образование хлорофилла зависит от- температуры.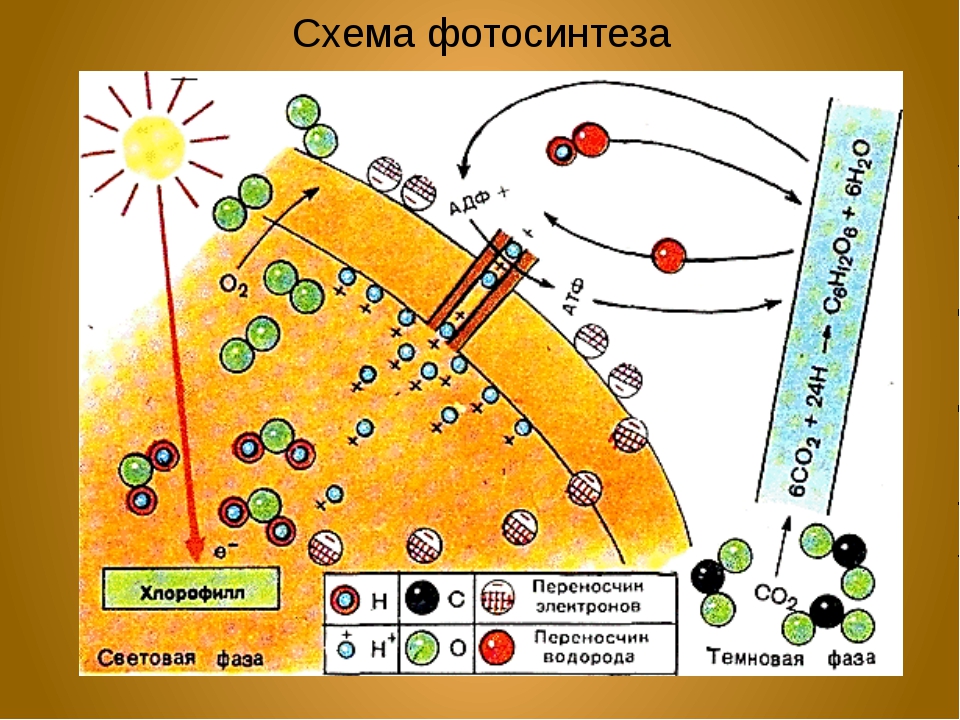 Оптимальная температура для накопления хлорофилла 26—30°С. Как и следовало ожидать, от температуры зависит лишь образование предшественпи-кол хлорофилла (темповая фаза). При наличии уже образовавшихся предшественников хлорофилла процесс зеленения (световая фаза) идет с одинаковой скоростью позависимо от температуры.[ …]
Оптимальная температура для накопления хлорофилла 26—30°С. Как и следовало ожидать, от температуры зависит лишь образование предшественпи-кол хлорофилла (темповая фаза). При наличии уже образовавшихся предшественников хлорофилла процесс зеленения (световая фаза) идет с одинаковой скоростью позависимо от температуры.[ …]
В настоящее время большинство специалистов все-таки поддерживают концепцию о циркадианной природе суточных ритмов животных. В основе этой концепции лежит представление об эндогенном ритме физиологических процессов, который используется для измерения времени. В эндогенном ритме имеются две фазы длительностью около 12 ч каждая: световая (светолюбивая) и темновая (темнолюбивая). На протяжении этих фаз реакция организма на световые воздействия полярно меняется. Так, у растений свет, действующий в течение световой фазы цикла, стимулирует цветение, а действующий в течение темновой фазы, тормозит его (Э. Бюннинг, 1961). Аналогичные отличия реакции на свет известны и для животных (см. ниже).[ …]
ниже).[ …]
Газовый режим также имеет свои особенности. В ночной период повышается концентрация углекислого газа (это связано с процессами фотосинтеза у растений и почвенного дыхания), в результате этого возникает так называемый парниковый эффект, который тоже способствует сглаживанию температурного режима. Днем содержание углекислого газа может падать больше, чем в атмосфере вне биоценоза (из-за фотосинтеза, имеющего темно-вую и световую фазы).[ …]
Приведенная выше реакция отражает основную суть фото« теза, предельно упрощая описание самого явления. На сам ствует ряд специфических белков, объединенных в электрон] транспортную цепь.[ …]
Эти соединения световой фазы в дальнейшем используются в темновой фазе фотосинтеза.[ …]
Механизм действия гербицидов-карбаматов на растения имеет ряд общих, типичных для всех препаратов этой группы закономерностей, а также некоторые отличия, характерные для отдельных препаратов. Хотя механизм действия гербицидов этой группы изучен еще недостаточно, установлено, что некоторые карбаматы нарушают митоз клеток, развитие корней и даже вызывают вначале потемнение, а затем некроз всходовых отростков и поражение тканевой структуры корневой сист емы; подавляют световую фазу фотосинтеза п сахарный . обмен, действуют на В-амилазу, нарушают развитие меристемы, задерживают перенос электронов в хлоропластах.[ …]
обмен, действуют на В-амилазу, нарушают развитие меристемы, задерживают перенос электронов в хлоропластах.[ …]
Как работают фотосинтез и его реакции на свет и темноту
фотосинтез , Процесс, с помощью которого зеленые растения и некоторые другие организмы преобразуют свет в химическую энергию. У зеленых растений световая энергия улавливается хлорофиллом в хлоропластах листьев и используется для преобразования воды, углекислого газа и минералов в кислород и богатые энергией органические соединения (простые и сложные сахара), которые являются основой как растений, так и животных. жизнь. Фотосинтез имеет решающее значение для поддержания жизни на Земле; если она прекратится, вскоре на планете останется мало пищи или других органических веществ, и большинство видов организмов исчезнет.
Фотосинтез состоит из ряда фотохимических и ферментативных реакций. Это происходит в два этапа. Во время светозависимой стадии («световые» реакции) хлорофилл поглощает световую энергию, которая возбуждает некоторые электроны в молекулах пигмента на более высокие энергетические уровни; они покидают хлорофилл и проходят через ряд молекул, образуя НАДФН (фермент) и высокоэнергетические молекулы АТФ. Кислород, выделяемый как побочный продукт, попадает в атмосферу через поры в листьях.НАДФН и АТФ запускают вторую стадию, «темные» реакции (или цикл Кальвина, открытый Мелвином Кальвином), которые не требуют света. На этом этапе глюкоза генерируется из атмосферного углекислого газа.
Кислород, выделяемый как побочный продукт, попадает в атмосферу через поры в листьях.НАДФН и АТФ запускают вторую стадию, «темные» реакции (или цикл Кальвина, открытый Мелвином Кальвином), которые не требуют света. На этом этапе глюкоза генерируется из атмосферного углекислого газа.
Световая реакция фотосинтеза. Световая реакция происходит в двух фотосистемах (единицах молекул хлорофилла). Световая энергия (обозначенная волнистыми стрелками), поглощаемая фотосистемой II, вызывает образование высокоэнергетических электронов, которые передаются вдоль ряда акцепторных молекул в цепи переноса электронов в фотосистему I.Фотосистема II получает заменяющие электроны от молекул воды, в результате чего они расщепляются на ионы водорода (H +) и атомы кислорода. Атомы кислорода объединяются, образуя молекулярный кислород (O 2 ), который выбрасывается в атмосферу. Ионы водорода попадают в просвет. Дополнительные ионы водорода закачиваются в просвет молекулами акцептора электронов. Это создает высокую концентрацию ионов внутри просвета. Обратный поток ионов водорода через фотосинтетическую мембрану обеспечивает энергию, необходимую для синтеза богатой энергией молекулы аденозинтрифосфата (АТФ).Электроны с высокой энергией, которые высвобождаются, когда фотосистема I поглощает световую энергию, используются для управления синтезом никотин-адениндинуклеотидфосфата (НАДФН). Фотосистема I получает заменяющие электроны из цепи переноса электронов. АТФ обеспечивает энергию, а НАДФН — атомы водорода, необходимые для запуска последующей фотосинтетической реакции темноты, или цикла Кальвина.
Это создает высокую концентрацию ионов внутри просвета. Обратный поток ионов водорода через фотосинтетическую мембрану обеспечивает энергию, необходимую для синтеза богатой энергией молекулы аденозинтрифосфата (АТФ).Электроны с высокой энергией, которые высвобождаются, когда фотосистема I поглощает световую энергию, используются для управления синтезом никотин-адениндинуклеотидфосфата (НАДФН). Фотосистема I получает заменяющие электроны из цепи переноса электронов. АТФ обеспечивает энергию, а НАДФН — атомы водорода, необходимые для запуска последующей фотосинтетической реакции темноты, или цикла Кальвина.
Темные реакции фотосинтеза: цикл Кальвина-Бенсона — видео и стенограмма урока
Цикл Кальвина
Ключ к созданию сахаров связан с фиксацией углерода , где неорганический углерод закреплен в органическом углероде, таком как сахара.В цикле Кальвина углекислый газ превращается в органическую молекулу с помощью фермента под названием RuBisCO .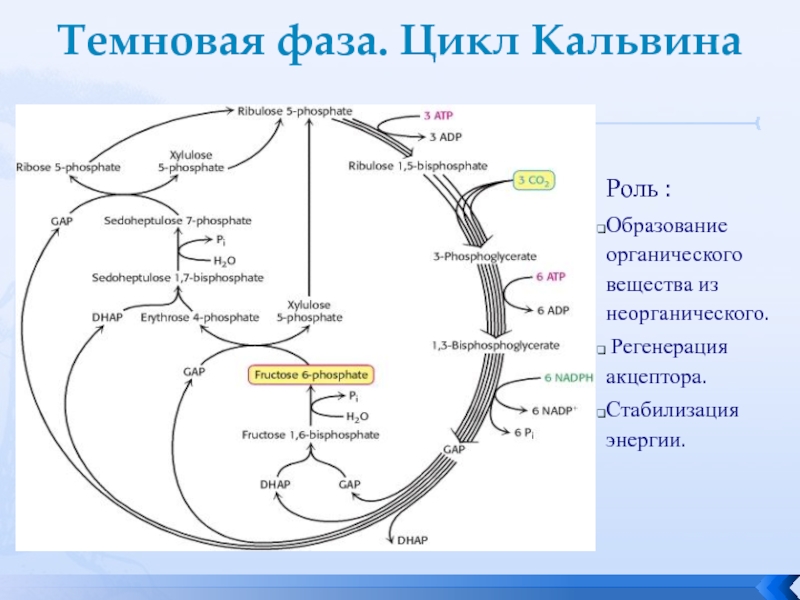 Здесь углекислый газ, который мы выдыхаем как отходы, используется растениями, выполняющими фотосинтез. Давайте выделим некоторые этапы этого цикла Кальвина.
Здесь углекислый газ, который мы выдыхаем как отходы, используется растениями, выполняющими фотосинтез. Давайте выделим некоторые этапы этого цикла Кальвина.
RuBisCO объединяет три молекулы углекислого газа с тремя 5-углеродными молекулами, каждая из которых имеет два фосфата, называемых RuBP . Создаются шесть трехуглеродных молекул, каждая из которых содержит один фосфат. Затем используются шесть молекул АТФ, отдавая каждой молекуле еще один фосфат.Затем шесть электронных носителей НАДФН из легких реакций переносят электроны в этот цикл Кальвина. Они окисляются до НАДФ +, отдавая электроны молекулам углерода, которые затем восстанавливаются. В результате образуются шесть суперэнергетических 3-углеродных молекул, называемых глицеральдегид-3-фосфатом, или G3P . Это делает молекулу из 3 атомов углерода с одной фосфатной группой. Одна из этих счастливых молекул G3P используется для создания глюкозы или других молекул углерода при выходе из цикла, в то время как остальные пять молекул перестраиваются с помощью трех АТФ, которые воссоздают три молекулы RuBP, которые могут снова начать цикл. Это регенерация RuBP, которая позволяет продолжить цикл Кальвина.
Это регенерация RuBP, которая позволяет продолжить цикл Кальвина.
Молекула G3P, выходящая из цикла, является наиболее важной. Две молекулы G3P могут создать одну молекулу глюкозы. Эта молекула глюкозы является строительным блоком для создания всего остального в растении и питает любой другой организм, питающийся растениями, такой как мы.
Когда фотодыхание заставляет цикл Кальвина повернуть не туда
Давайте вернемся к той первой стадии цикла Кальвина.На этом этапе три молекулы диоксида углерода присоединяются к трем молекулам из 5 атомов углерода, каждая из которых имеет два фосфата. Но вместо того, чтобы просто собрать нужное количество углекислого газа и превратить его в 5-углеродные молекулы, аккуратно продолжая цикл Кальвина, иногда фермент RuBisCO действует так, как будто у него есть собственный разум. Вместо этого он улавливает кислород, инициируя процесс, называемый фотодыханием .
Фотодыхание — это побочная реакция, которая иногда возникает во время цикла Кальвина.Он сводит на нет то хорошее, что обычно делает фотосинтез, потому что заставляет углерод, который уже был закреплен в органических соединениях, превращаться обратно в углекислый газ, откуда он пришел. Это снижает количество синтезируемой глюкозы.
Все проблемы начинаются с RuBisCO, который является непостоянным ферментом, поскольку он может связываться с углекислым газом или молекулярным кислородом. Но что определяет, какой из них он выберет? Факторы, которые определяют, кто будет на свидании RuBisCO вечером, — это относительная концентрация углекислого газа по отношению к кислороду и температура окружающей среды.Когда поры листа или устьиц растения открыты, кислород и водяной пар рассеиваются в атмосферу. Однако углекислый газ попадает в растение. Итак, когда устьица открыты, фотореспиратона гораздо меньше, так как RuBisCO связывается с углекислым газом. Однако, когда устьица закрыты, кислород может накапливаться внутри листа растения, и тогда более вероятно возникновение фотодыхания.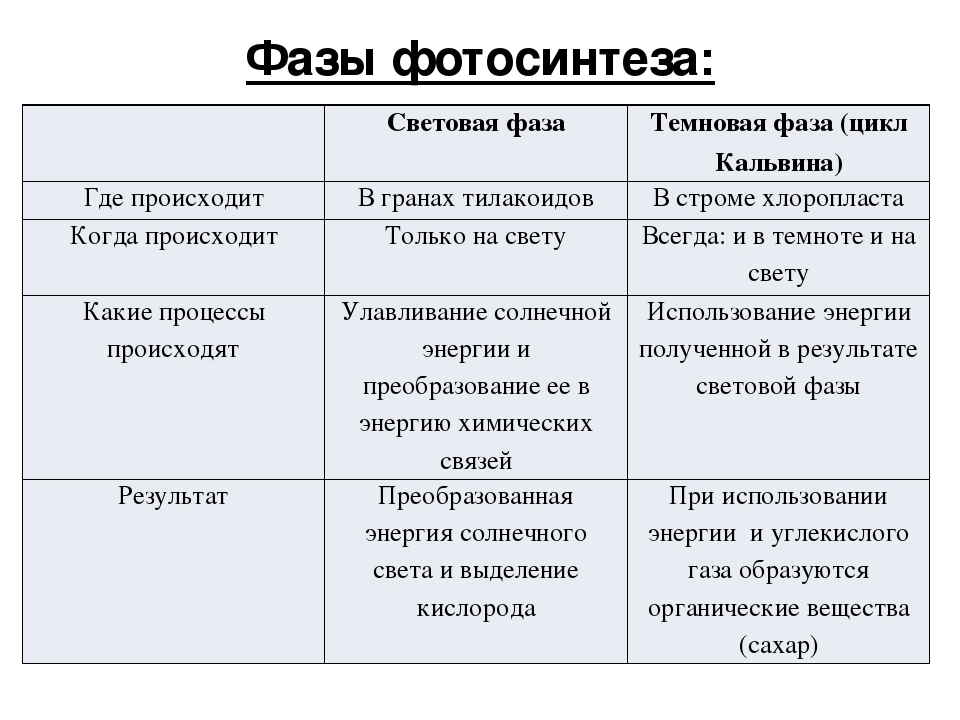 Непостоянный RuBisCO также имеет более высокое сродство к кислороду при повышении температуры окружающей среды, поэтому фотодыхание более вероятно в более жарких условиях.
Непостоянный RuBisCO также имеет более высокое сродство к кислороду при повышении температуры окружающей среды, поэтому фотодыхание более вероятно в более жарких условиях.
Краткое содержание урока
В этом уроке мы узнали, как в реакциях темноты , или цикла Кальвина используется углекислый газ из атмосферы, а также АТФ и НАДФН из световых реакций для производства сахара. Помните, что в легких реакциях также использовалась вода и выделялся кислород. Три молекулы CO2 используются для фиксации углерода ферментом RuBisCO. За один раз используется один углекислый газ, что приводит к этапам, которые фиксируют, перестраивают и активируют молекулы углерода, в конечном итоге образуя одну 3-углеродную молекулу, называемую G3P , или глицеральдегид-3-фосфат, которая высвобождается.G3P также является исходным материалом для глюкозы и других сахаров. Следовательно, продукты световых реакций, создаваемые солнечным светом, подпитывают темные реакции для создания пищи. Это завершает фотосинтез и помогает накормить мир!
Это завершает фотосинтез и помогает накормить мир!
Иногда, однако, цикл Кальвина может принимать другое направление, если RuBisCO связывается с кислородом, а не с углекислым газом. Этот процесс называется фотодыхание , и он сводит на нет все хорошее, что дает фотосинтез, потому что он превращает фиксированный углерод обратно в углекислый газ.
Результат обучения
Вы сможете объяснить этапы цикла Кальвина после просмотра этого урока.
5.12C: Цикл Кальвина — Biology LibreTexts
Цикл Кальвина состоит из трех основных этапов: фиксации, восстановления и регенерации.
Цели обучения
- Опишите цикл Кальвина
Ключевые моменты
- Цикл Кальвина относится к независимым от света реакциям фотосинтеза, которые происходят в три основных этапа.
- Хотя цикл Кальвина не зависит напрямую от света, он косвенно зависит от света, поскольку необходимые носители энергии (АТФ и НАДФН) являются продуктами светозависимых реакций.

- При фиксации, первой стадии цикла Кальвина, инициируются светонезависимые реакции; CO 2 превращается из неорганической молекулы в органическую.
- На втором этапе ATP и NADPH используются для восстановления 3-PGA до G3P; затем АТФ и НАДФН преобразуются в АДФ и НАДФ + соответственно.
- На последнем этапе цикла Кальвина RuBP регенерируется, что позволяет системе подготовиться к исправлению большего количества CO 2 .
Ключевые термины
- светонезависимая реакция : химические реакции во время фотосинтеза, которые преобразуют углекислый газ и другие соединения в глюкозу, происходящие в строме
- rubisco : (рибулозобифосфаткарбоксилаза) растительный фермент, который катализирует фиксацию атмосферного диоксида углерода во время фотосинтеза, катализируя реакцию между диоксидом углерода и RuBP
- рибулоза бисфосфат : органическое вещество, которое участвует в фотосинтезе, реагирует с диоксидом углерода с образованием 3-PGA
Цикл Кальвина
У растений углекислый газ (CO 2 ) попадает в листья через устьица, где он диффундирует на короткие расстояния через межклеточные пространства, пока не достигает клеток мезофилла. Попадая в клетки мезофилла, CO 2 диффундирует в строму хлоропласта, место светонезависимых реакций фотосинтеза. Эти реакции на самом деле имеют несколько названий. Другие названия светонезависимых реакций включают цикл Кальвина, цикл Кальвина-Бенсона и реакции темноты. Наиболее устаревшее название — темные реакции, которое может вводить в заблуждение, поскольку оно неверно подразумевает, что реакция происходит только ночью или не зависит от света, поэтому большинство ученых и инструкторов больше не используют его.
Попадая в клетки мезофилла, CO 2 диффундирует в строму хлоропласта, место светонезависимых реакций фотосинтеза. Эти реакции на самом деле имеют несколько названий. Другие названия светонезависимых реакций включают цикл Кальвина, цикл Кальвина-Бенсона и реакции темноты. Наиболее устаревшее название — темные реакции, которое может вводить в заблуждение, поскольку оно неверно подразумевает, что реакция происходит только ночью или не зависит от света, поэтому большинство ученых и инструкторов больше не используют его.
Светонезависимые реакции цикла Кальвина можно разделить на три основных этапа: фиксация, восстановление и регенерация.
Этап 1: Фиксация
В строме, помимо CO 2 , присутствуют два других компонента, инициирующих светонезависимые реакции: фермент, называемый рибулозобисфосфаткарбоксилазой (RuBisCO), и три молекулы рибулозобисфосфата (RuBP). RuBP имеет пять атомов углерода, окруженных двумя фосфатами. RuBisCO катализирует реакцию между CO 2 и RuBP. На каждую молекулу CO 2 , которая реагирует с одним RuBP, образуются две молекулы 3-фосфоглицериновой кислоты (3-PGA). 3-PGA имеет три атома углерода и один фосфат. Каждый виток цикла включает только один RuBP и один диоксид углерода и образует две молекулы 3-PGA. Число атомов углерода остается неизменным, поскольку атомы перемещаются, чтобы образовывать новые связи во время реакций (3 атома из 3CO 2 + 15 атомов из 3RuBP = 18 атомов в 3 атомах 3-PGA). Этот процесс называется фиксацией углерода, потому что CO 2 «фиксируется» из неорганической формы в органические молекулы.
3-PGA имеет три атома углерода и один фосфат. Каждый виток цикла включает только один RuBP и один диоксид углерода и образует две молекулы 3-PGA. Число атомов углерода остается неизменным, поскольку атомы перемещаются, чтобы образовывать новые связи во время реакций (3 атома из 3CO 2 + 15 атомов из 3RuBP = 18 атомов в 3 атомах 3-PGA). Этот процесс называется фиксацией углерода, потому что CO 2 «фиксируется» из неорганической формы в органические молекулы.
Этап 2: Редукция
АТФ и НАДФН используются для преобразования шести молекул 3-PGA в шесть молекул химического вещества, называемого глицеральдегид-3-фосфатом (G3P).Это реакция восстановления, потому что она включает в себя усиление электронов 3-PGA. Напомним, что уменьшение — это усиление электрона атомом или молекулой. Используются шесть молекул как АТФ, так и НАДФН. Для АТФ энергия высвобождается с потерей концевого атома фосфата, превращая его в АДФ; для НАДФН теряется энергия и атом водорода, превращая его в НАДФ + .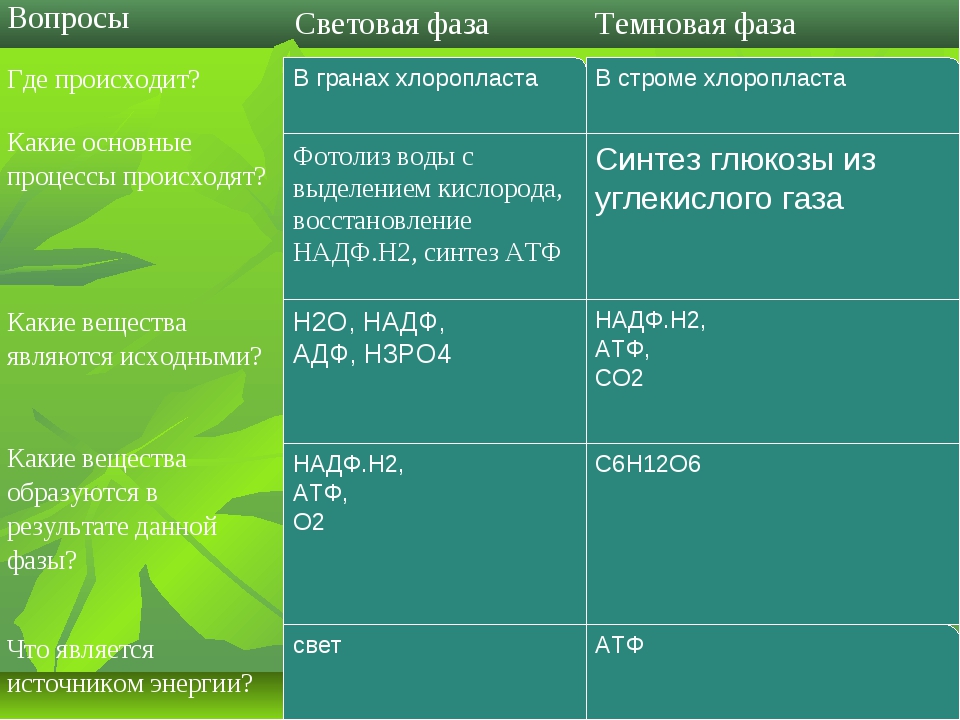 Обе эти молекулы возвращаются к ближайшим светозависимым реакциям для повторного использования и восстановления энергии.
Обе эти молекулы возвращаются к ближайшим светозависимым реакциям для повторного использования и восстановления энергии.
Этап 3: Регенерация
В этот момент только одна из молекул G3P покидает цикл Кальвина и отправляется в цитоплазму, чтобы способствовать образованию других соединений, необходимых для растения.Поскольку G3P, экспортированный из хлоропласта, имеет три атома углерода, требуется три «витка» цикла Кальвина, чтобы зафиксировать достаточно чистого углерода для экспорта одного G3P. Но каждый ход составляет два G3P, таким образом, три хода составляют шесть G3P. Одна экспортируется, в то время как остальные пять молекул G3P остаются в цикле и используются для регенерации RuBP, что позволяет системе подготовиться к фиксации большего количества CO 2 . В этих реакциях регенерации используются еще три молекулы АТФ.
Фотосинтез — биохимия
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту.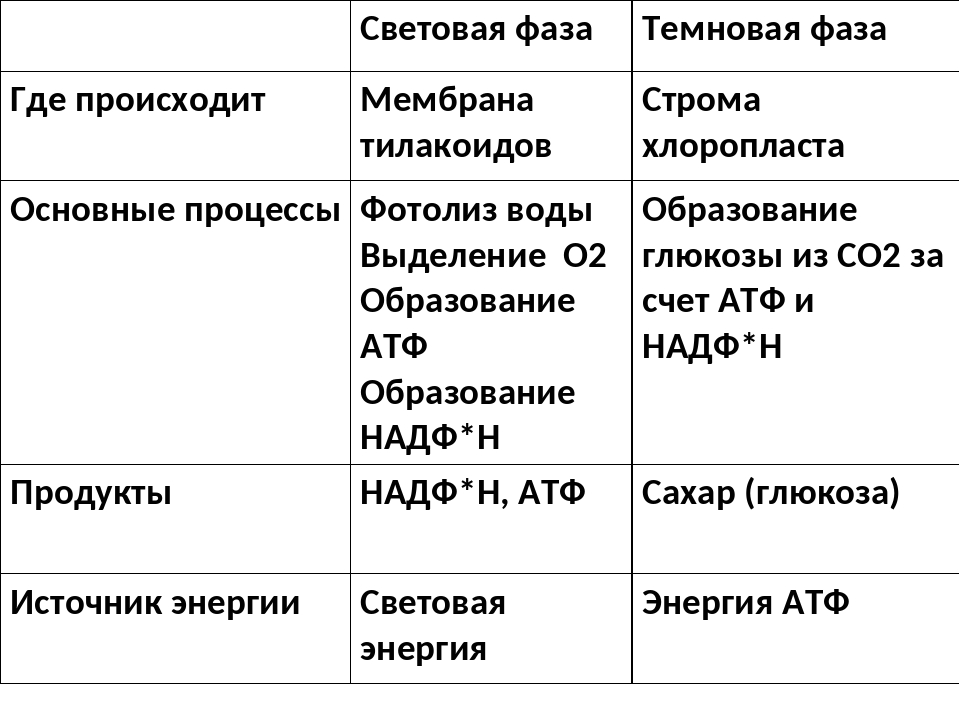 Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т.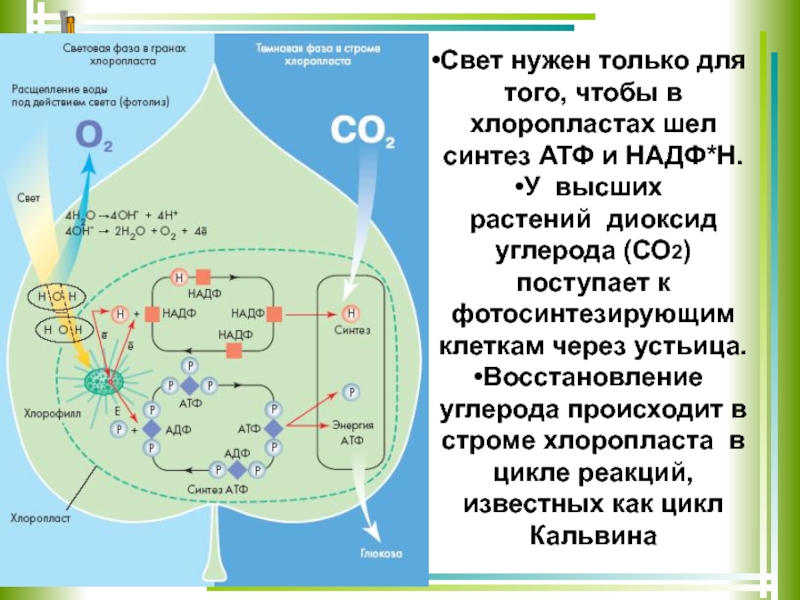 д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Баланс энергоснабжения во время фотосинтеза — теоретическая перспектива — Матушинская — 2019 — Physiologia Plantarum
Введение
Десятилетия междисциплинарных исследований фотосинтеза привели к детальному пониманию молекулярных, регуляторных и функциональных механизмов фиксации углерода под действием света.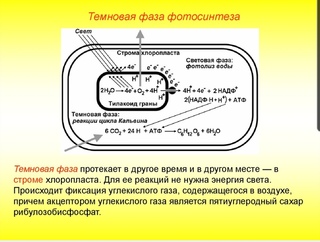 Тем не менее, еще многое предстоит открыть, особенно с точки зрения выявления процессов, ограничивающих продуктивность фотосинтеза, и потребуются дальнейшие фундаментальные исследования для изменения конструкции и потенциальной оптимизации фотосинтеза (Орт и др., 2015 г., Кардона и др., 2018 г.). Исторически процесс фотосинтеза делился на две части. Так называемые «световые реакции» фотосинтетической цепи переноса электронов (PETC) преобразуют свет в химическую энергию, поставляя АТФ и НАДФН. Эта энергия используется для запуска процессов восстановления и фиксации углекислого газа, известных как «темные реакции».Таким образом, фотосинтетические реакции на свет и темноту можно рассматривать как систему спроса и предложения молекулярной экономики (Hofmeyr and Cornish-Bowden 2000, Rohwer and Hofmeyr 2008, Christensen et al. 2015).
Тем не менее, еще многое предстоит открыть, особенно с точки зрения выявления процессов, ограничивающих продуктивность фотосинтеза, и потребуются дальнейшие фундаментальные исследования для изменения конструкции и потенциальной оптимизации фотосинтеза (Орт и др., 2015 г., Кардона и др., 2018 г.). Исторически процесс фотосинтеза делился на две части. Так называемые «световые реакции» фотосинтетической цепи переноса электронов (PETC) преобразуют свет в химическую энергию, поставляя АТФ и НАДФН. Эта энергия используется для запуска процессов восстановления и фиксации углекислого газа, известных как «темные реакции».Таким образом, фотосинтетические реакции на свет и темноту можно рассматривать как систему спроса и предложения молекулярной экономики (Hofmeyr and Cornish-Bowden 2000, Rohwer and Hofmeyr 2008, Christensen et al. 2015).
Несмотря на эту явную взаимозависимость, эти процессы часто изучаются изолированно. Такой подход позволяет проводить подробный и глубокий анализ отдельных компонентов за счет упрощения других. Это разделение нашло отражение и в теоретических исследованиях. Многочисленные подходы за последние десятилетия были направлены на перевод сложности фотосинтеза на математический язык, что привело к впечатляющему портфелю кинетических моделей.Большинство этих моделей ориентированы либо на предложение, либо на спрос. Многие классические модели цикла Кальвина-Бенсона-Бассама (CBB), такие как биохимические модели фотосинтетической ассимиляции C3 CO 2 (Hahn 1986, 1987, Pettersson and Ryde-Pettersson 1988, Poolman et al. 2000, Farquhar et al. 2007, Zhu et al. 2007, 2009), не предпринимали попыток смоделировать процессы PETC во всех деталях. Вместо этого они упрощают скорость переноса электронов, поставляющего АТФ и НАДФН, часто всего за одну сосредоточенную реакцию (например.г. непрямоугольная гипербола как функция поглощенной освещенности в исследовании Morales et al. (2018a)), или даже считал ключевые компоненты постоянными (НАДФН в исследовании Петтерссона и Райд-Петтерссона (1988)).
Это разделение нашло отражение и в теоретических исследованиях. Многочисленные подходы за последние десятилетия были направлены на перевод сложности фотосинтеза на математический язык, что привело к впечатляющему портфелю кинетических моделей.Большинство этих моделей ориентированы либо на предложение, либо на спрос. Многие классические модели цикла Кальвина-Бенсона-Бассама (CBB), такие как биохимические модели фотосинтетической ассимиляции C3 CO 2 (Hahn 1986, 1987, Pettersson and Ryde-Pettersson 1988, Poolman et al. 2000, Farquhar et al. 2007, Zhu et al. 2007, 2009), не предпринимали попыток смоделировать процессы PETC во всех деталях. Вместо этого они упрощают скорость переноса электронов, поставляющего АТФ и НАДФН, часто всего за одну сосредоточенную реакцию (например.г. непрямоугольная гипербола как функция поглощенной освещенности в исследовании Morales et al. (2018a)), или даже считал ключевые компоненты постоянными (НАДФН в исследовании Петтерссона и Райд-Петтерссона (1988)). Точно так же во многих моделях PETC не предпринимались попытки включить детали реакций, потребляющих энергию, и описать потребность в АТФ и НАДФН с помощью простых сосредоточенных реакций. Такое понятное упрощение стало результатом того факта, что эти модели были созданы для изучения конкретных механизмов сбора света, таких как переходы состояний (Ebenhöh et al.2014), нефотохимическое тушение (NPQ) (Ebenhöh et al. 2011, Zaks et al. 2012, Matuszyńska et al. 2016) или роль антенных комплексов в продуктивности фотосинтеза (Rubin and Riznichenko, 2009).
Точно так же во многих моделях PETC не предпринимались попытки включить детали реакций, потребляющих энергию, и описать потребность в АТФ и НАДФН с помощью простых сосредоточенных реакций. Такое понятное упрощение стало результатом того факта, что эти модели были созданы для изучения конкретных механизмов сбора света, таких как переходы состояний (Ebenhöh et al.2014), нефотохимическое тушение (NPQ) (Ebenhöh et al. 2011, Zaks et al. 2012, Matuszyńska et al. 2016) или роль антенных комплексов в продуктивности фотосинтеза (Rubin and Riznichenko, 2009).
Целью данного исследования является предоставление теоретического понимания взаимодействий и взаимозависимостей ПЭТК и цикла фиксации углерода с акцентом на изучение контроля спроса и предложения фотосинтеза. Для такого упражнения идеально подходят математические модели, поскольку они позволяют систематически изменять параметры, которые трудно получить экспериментально, и, таким образом, делать общие выводы о принципах регулирования. По-видимому, исследование тонкой системы спроса и предложения фотосинтеза требует математической модели, содержащей оба процесса. Примечательно, что существует несколько успешных попыток включить процессы переноса электронов и ассимиляции углерода в единую математическую структуру. Модель, предложенная Laisk et al. (2006) дает солидный обзор наших знаний о фотосинтезе. Модель была построена с упором на включение транспорта электронов через фотосистемы PSII и PSI вместе с подробным описанием последующего метаболизма.В результате модель может отображать устойчивый фотосинтез и флуоресценцию хлорофилла, но ее недостаточно для воспроизведения индукции фотосинтеза в темноте и света, свойства, которое является критическим в контексте предлагаемого нами анализа спроса и предложения. Модель «электронного фотосинтеза» Zhu et al. (2013) — исчерпывающее описание, включающее «как можно больше реакций, связанных с фотосинтезом». Из-за своей сложности использование модели электронного фотосинтеза (Zhu et al.
По-видимому, исследование тонкой системы спроса и предложения фотосинтеза требует математической модели, содержащей оба процесса. Примечательно, что существует несколько успешных попыток включить процессы переноса электронов и ассимиляции углерода в единую математическую структуру. Модель, предложенная Laisk et al. (2006) дает солидный обзор наших знаний о фотосинтезе. Модель была построена с упором на включение транспорта электронов через фотосистемы PSII и PSI вместе с подробным описанием последующего метаболизма.В результате модель может отображать устойчивый фотосинтез и флуоресценцию хлорофилла, но ее недостаточно для воспроизведения индукции фотосинтеза в темноте и света, свойства, которое является критическим в контексте предлагаемого нами анализа спроса и предложения. Модель «электронного фотосинтеза» Zhu et al. (2013) — исчерпывающее описание, включающее «как можно больше реакций, связанных с фотосинтезом». Из-за своей сложности использование модели электронного фотосинтеза (Zhu et al. 2013) для систематического анализа спроса и предложения является сложной задачей.Более того, очень подробное описание молекулярных процессов, включенных в модель, не позволяет делать общие выводы. Наконец, Моралес и др. (2018b) недавно разработали детальную модель PETC, включая все соответствующие процессы на уровне хлоропластов и листьев. Тем не менее, поскольку акцент в этой модели был сделан на регулировании PETC, цикл CBB был упрощен до двух этапов. Этот дисбаланс в уровнях детализации двух подпроцессов является основной причиной, по которой мы решили не использовать его.
2013) для систематического анализа спроса и предложения является сложной задачей.Более того, очень подробное описание молекулярных процессов, включенных в модель, не позволяет делать общие выводы. Наконец, Моралес и др. (2018b) недавно разработали детальную модель PETC, включая все соответствующие процессы на уровне хлоропластов и листьев. Тем не менее, поскольку акцент в этой модели был сделан на регулировании PETC, цикл CBB был упрощен до двух этапов. Этот дисбаланс в уровнях детализации двух подпроцессов является основной причиной, по которой мы решили не использовать его.
Поэтому мы разработали новую модель фотосинтеза, которая содержит ключевые компоненты обеих подсистем, но при этом достаточно проста для проведения систематических исследований. Модель была построена путем слияния модели PETC, первоначально разработанной для изучения фотозащитных механизмов (Ebenhöh et al., 2014, Matuszyńska et al., 2016), с кинетической моделью фиксации углерода C3 (Pettersson and Ryde-Pettersson 1988, Poolman и др. 2000). Мы демонстрируем, что объединение этих двух моделей в связанную систему спроса и предложения возможно, но отнюдь не тривиально и приводит к появлению новых свойств.Используя анализ метаболического контроля (Kacser and Burns 1973, Heinrich and Rapoport 1974, Heinrich and Schuster 1996) и метаболический анализ спроса и предложения (Hofmeyr and Cornish-Bowden 2000), мы даем количественное описание того, как распределяется контроль над общим фотосинтетическим потоком. в различных условиях. Более того, анализ нашей модели показывает необходимость режима ожидания цикла фиксации углерода в темноте, чтобы гарантировать его возобновление после продолжительных периодов темноты. Результаты нашей модели показывают, что окислительный пентозофосфатный путь (PPP) может обеспечить именно эту функциональность.Примечательно, что одной дезактивации ферментов CBB в темноте недостаточно для реактивации. Эти идеи не могли быть получены без модели, объединяющей светозависимые и независимые реакции.
2000). Мы демонстрируем, что объединение этих двух моделей в связанную систему спроса и предложения возможно, но отнюдь не тривиально и приводит к появлению новых свойств.Используя анализ метаболического контроля (Kacser and Burns 1973, Heinrich and Rapoport 1974, Heinrich and Schuster 1996) и метаболический анализ спроса и предложения (Hofmeyr and Cornish-Bowden 2000), мы даем количественное описание того, как распределяется контроль над общим фотосинтетическим потоком. в различных условиях. Более того, анализ нашей модели показывает необходимость режима ожидания цикла фиксации углерода в темноте, чтобы гарантировать его возобновление после продолжительных периодов темноты. Результаты нашей модели показывают, что окислительный пентозофосфатный путь (PPP) может обеспечить именно эту функциональность.Примечательно, что одной дезактивации ферментов CBB в темноте недостаточно для реактивации. Эти идеи не могли быть получены без модели, объединяющей светозависимые и независимые реакции.
Мы также ожидаем, что представленная здесь модель послужит основой для будущих разработок.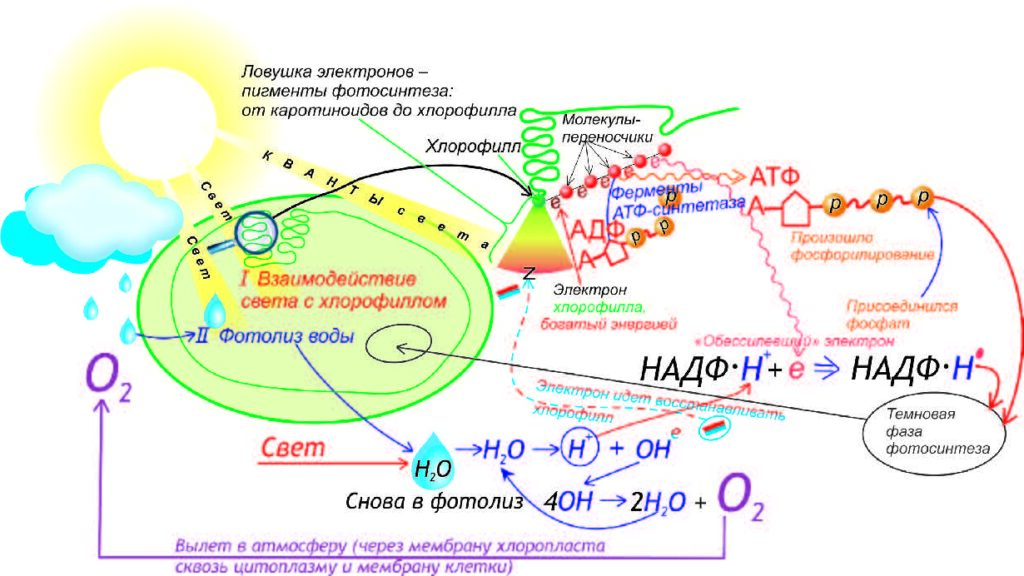 Мы специально построили модель в модульной архитектуре, которая делает технически простым включение других соответствующих взаимодействующих путей, таких как фотодыхание или другие процессы, потребляющие АТФ.Вместе с количественными экспериментальными данными можно будет параметризовать модель для конкретных организмов и условий. Утвержденная таким образом, мы ожидаем, что модель станет полезным инструментом для прогнозирования того, как эффективность фотосинтеза зависит от экологических или генетических нарушений. Таким образом, мы предполагаем, что наша модель с соответствующими модификациями предоставит обоснованную теорию, которая поддерживает попытки целенаправленного улучшения фотосинтетических характеристик.
Мы специально построили модель в модульной архитектуре, которая делает технически простым включение других соответствующих взаимодействующих путей, таких как фотодыхание или другие процессы, потребляющие АТФ.Вместе с количественными экспериментальными данными можно будет параметризовать модель для конкретных организмов и условий. Утвержденная таким образом, мы ожидаем, что модель станет полезным инструментом для прогнозирования того, как эффективность фотосинтеза зависит от экологических или генетических нарушений. Таким образом, мы предполагаем, что наша модель с соответствующими модификациями предоставит обоснованную теорию, которая поддерживает попытки целенаправленного улучшения фотосинтетических характеристик.
Модель
Мы представляем здесь результат соединения двух ранее разработанных кинетических моделей фотосинтеза, основанных на обыкновенных дифференциальных уравнениях (ОДУ).Первая модель описывает первичные фотосинтетические реакции через ПЭТК, ведущие к производству АТФ и НАДФН. Цикл CBB считается основным потребителем произведенной энергии и восстановительных эквивалентов. Следовательно, в этой модели нисходящий метаболизм был упрощен до двух реакций потребления, управляемых кинетикой действия массы. Он был разработан на основе нашей предыдущей работы: основная модель PETC, разработанная Ebenhöh et al. (2014) и модель высокоэнергетического тушения у высших растений, разработанная Matuszyńska et al.(2016). Используя эту модель, мы можем рассчитывать эмиссию флуоресценции при различных световых протоколах, отслеживать окислительно-восстановительное состояние тилакоидов и скорость синтеза АТФ и НАДФН. Вторая модель — это реализация Poolman (Poolman et al. 2000) модели фиксации углерода, разработанная Петтерссоном и Райд-Петтерссоном (1988), воспроизведенная в нашем институте с использованием программного обеспечения modelbase (Ebenhöh et al. 2018). В отличие от исходной модели (Петтерссон и Райд-Петтерссон, 1988), в представлении Пулмана предположения о быстром равновесии не решались явно, а вместо этого аппроксимировались кинетикой действия массы с очень большими константами скорости.
Цикл CBB считается основным потребителем произведенной энергии и восстановительных эквивалентов. Следовательно, в этой модели нисходящий метаболизм был упрощен до двух реакций потребления, управляемых кинетикой действия массы. Он был разработан на основе нашей предыдущей работы: основная модель PETC, разработанная Ebenhöh et al. (2014) и модель высокоэнергетического тушения у высших растений, разработанная Matuszyńska et al.(2016). Используя эту модель, мы можем рассчитывать эмиссию флуоресценции при различных световых протоколах, отслеживать окислительно-восстановительное состояние тилакоидов и скорость синтеза АТФ и НАДФН. Вторая модель — это реализация Poolman (Poolman et al. 2000) модели фиксации углерода, разработанная Петтерссоном и Райд-Петтерссоном (1988), воспроизведенная в нашем институте с использованием программного обеспечения modelbase (Ebenhöh et al. 2018). В отличие от исходной модели (Петтерссон и Райд-Петтерссон, 1988), в представлении Пулмана предположения о быстром равновесии не решались явно, а вместо этого аппроксимировались кинетикой действия массы с очень большими константами скорости. Решение системы ODE позволяет рассчитать различные скорости связывания углерода и активности реакции при различных концентрациях внешнего ортофосфата. В исходной модели ввод ETC был упрощен за счет единственной сосредоточенной реакции синтеза АТФ ( против 16 в исследовании Pettersson и Ryde-Pettersson 1988), в то время как НАДФН оставался постоянным параметром.
Решение системы ODE позволяет рассчитать различные скорости связывания углерода и активности реакции при различных концентрациях внешнего ортофосфата. В исходной модели ввод ETC был упрощен за счет единственной сосредоточенной реакции синтеза АТФ ( против 16 в исследовании Pettersson и Ryde-Pettersson 1988), в то время как НАДФН оставался постоянным параметром.
Включенные процессы и стехиометрия
Модель, схематически представленная на рис.1, включает 35 скоростей реакций и следует динамике 24 независимых переменных состояния (Приложение S1, Дополнительная информация, полный список скоростей реакций и ODE). Кроме того, мы вычисляем ряд значений, таких как испускаемая флуоресценция или переменные, полученные из сохраняемых величин. Свет считается внешней переменной, зависящей от времени. Поскольку основное внимание в этой модели уделяется изучению основных свойств системы, таких как реакция на относительные изменения интенсивности света, мы не калибровали наши модели для экспериментально измеренных значений интенсивности света.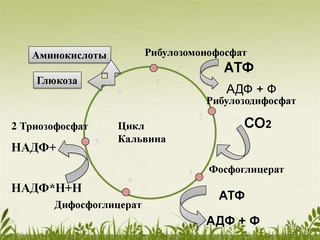 Поэтому в этой работе свет выражается в микромолях фотонов на квадратный метр в секунду (мкмоль м -2 с -1 ) и отражает количество эффективно используемого света, но коэффициент преобразования в плотность потока фотонов падающий свет неизвестен. Мы включили в нашу модель два отдела: просвет тилакоида и строму хлоропласта. В просвете кинетика реакции окисленного пластохинона (PQ), окисленного пластоцианина, окисленного ферродоксина, протонов просвета (H) и нефосфорилированной антенны (светособирающие комплексы) была взята из Ebenhöh et al.(2014). Четырехступенчатое описание активности тушителя, основанное на протонировании белка PsbS и активности цикла ксантофилла, было взято из нашей математической модели NPQ, первоначально разработанной для изучения кратковременной световой памяти у растений (Matuszyńska et al. 2016). Предыдущее описание реакций потребления АТФ и НАДФН дополнено подробным описанием цикла CBB, протекающего в строме. Процессы цикла CBB были реализованы, как в математической модели фотосинтеза C3 Poolman et al.
Поэтому в этой работе свет выражается в микромолях фотонов на квадратный метр в секунду (мкмоль м -2 с -1 ) и отражает количество эффективно используемого света, но коэффициент преобразования в плотность потока фотонов падающий свет неизвестен. Мы включили в нашу модель два отдела: просвет тилакоида и строму хлоропласта. В просвете кинетика реакции окисленного пластохинона (PQ), окисленного пластоцианина, окисленного ферродоксина, протонов просвета (H) и нефосфорилированной антенны (светособирающие комплексы) была взята из Ebenhöh et al.(2014). Четырехступенчатое описание активности тушителя, основанное на протонировании белка PsbS и активности цикла ксантофилла, было взято из нашей математической модели NPQ, первоначально разработанной для изучения кратковременной световой памяти у растений (Matuszyńska et al. 2016). Предыдущее описание реакций потребления АТФ и НАДФН дополнено подробным описанием цикла CBB, протекающего в строме. Процессы цикла CBB были реализованы, как в математической модели фотосинтеза C3 Poolman et al.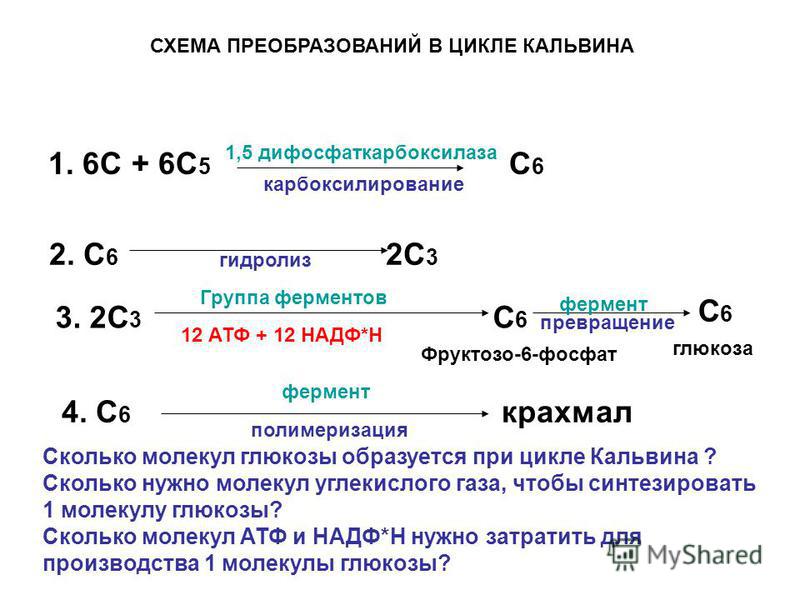 (2000), основанный на оригинальной работе Петтерссона и Райд-Петтерссона (1988). Исходная модель воспроизводит различные скорости связывания углерода и активность реакции при различных концентрациях внешнего ортофосфата и включает преобразование фиксированного углерода в триозофосфаты или сахар и крахмал. Эта модель была параметризована для условий насыщения CO 2 , и мы придерживались того же предположения для всех наших анализов. Предыдущее описание синтеза АТФ дополнено в нашей модели новой скоростью против АТФсинтазы , которая зависит от движущей силы протона, создаваемой активностью PETC.Более того, стромальная концентрация НАДФН динамична.
(2000), основанный на оригинальной работе Петтерссона и Райд-Петтерссона (1988). Исходная модель воспроизводит различные скорости связывания углерода и активность реакции при различных концентрациях внешнего ортофосфата и включает преобразование фиксированного углерода в триозофосфаты или сахар и крахмал. Эта модель была параметризована для условий насыщения CO 2 , и мы придерживались того же предположения для всех наших анализов. Предыдущее описание синтеза АТФ дополнено в нашей модели новой скоростью против АТФсинтазы , которая зависит от движущей силы протона, создаваемой активностью PETC.Более того, стромальная концентрация НАДФН динамична.
Схематическое изображение фотосинтетических процессов, описываемых нашей объединенной математической моделью. Реакции проходят в двух отсеках. В просвет встроены четыре белковых суперкомплекса (PSII, PSI, Cytb6f и ATPase), которые управляют переносом электронов в двух режимах, линейном и циклическом; строма обеспечивает камеру фиксации фотосинтетического углерода С3. Цитозоль определяет границу системы.Цветом (зеленым и синим) мы выделили реакции, связывающие две подмодели: производство и потребление АТФ и НАДФН соответственно.
Цитозоль определяет границу системы.Цветом (зеленым и синим) мы выделили реакции, связывающие две подмодели: производство и потребление АТФ и НАДФН соответственно.
Модель отсеков и агрегатов
Первоначальные модели были первоначально разработаны для различных организмов (Ebenhöh et al. (2014) для Chlamydomonas reinhardtii , Matuszyńska et al. (2016) для Arabidopsis thaliana и Петтерссон и Райд-Петтерссон (1988), Poolman et al.(2000) на основе данных для изолированных хлоропластов шпината). Причем концентрации и скорости были выражены в разных единицах. Эта комбинация параметров побудила нас создать общую модель фотосинтеза, которая не ограничивается одним организмом. Чтобы сохранить исходную структуру моделей, но обеспечить единообразие, мы сохранили исходные единицы для каждого из отделений и использовали коэффициент преобразования ( p convf , Приложение S1) для преобразования количеств там, где это необходимо. Таким образом, концентрации белков и размеры пула внутри просвета выражаются, как и в предыдущих моделях электронного транспорта (Ebenhöh et al., 2014, Matuszyńska et al., 2016), в ммоль (моль Chl) -1 , а скорости первого порядка в ммоль (моль Chl) −1 с −1 . Концентрации метаболитов и пулы внутри стромы выражаются в мМ, как в (Pettersson and Ryde-Pettersson 1988; Poolman et al. 2000). Чтобы преобразовать концентрацию АТФ, продуцируемого посредством активности цепи переноса электронов, выраженную в ммоль (моль Chl) -1 , в мМ, используемую для выражения концентраций в строме, мы сделали несколько предположений, как и в наших предыдущих моделях фотосинтеза ( Ebenhöh et al.2011, 2014, Matuszyńska et al. 2016), которые первоначально были получены из Laisk et al. (2006)): (1) содержание хлорофилла предполагается фиксированным и равным 350 · 10 −6 моль м −2 тилакоидной мембраны, (2) объем стромы и просвета тилакоидов составляет 0,0112 и 0,0014 л · м −2 соответственно.
Таким образом, концентрации белков и размеры пула внутри просвета выражаются, как и в предыдущих моделях электронного транспорта (Ebenhöh et al., 2014, Matuszyńska et al., 2016), в ммоль (моль Chl) -1 , а скорости первого порядка в ммоль (моль Chl) −1 с −1 . Концентрации метаболитов и пулы внутри стромы выражаются в мМ, как в (Pettersson and Ryde-Pettersson 1988; Poolman et al. 2000). Чтобы преобразовать концентрацию АТФ, продуцируемого посредством активности цепи переноса электронов, выраженную в ммоль (моль Chl) -1 , в мМ, используемую для выражения концентраций в строме, мы сделали несколько предположений, как и в наших предыдущих моделях фотосинтеза ( Ebenhöh et al.2011, 2014, Matuszyńska et al. 2016), которые первоначально были получены из Laisk et al. (2006)): (1) содержание хлорофилла предполагается фиксированным и равным 350 · 10 −6 моль м −2 тилакоидной мембраны, (2) объем стромы и просвета тилакоидов составляет 0,0112 и 0,0014 л · м −2 соответственно. Таким образом, 1 ммоль (моль Chl) −1 соответствует 2,5 · 10 −4 M в просвете и 3,2 · 10 −5 M в строме. Хотя представленные здесь результаты были получены для этих конкретных значений, описывающих отношение поверхности к объему внутри хлоропласта, в принципе легко изменить соответствующие параметры, чтобы отразить различные экспериментальные условия (Matuszyńska et al.2016).
Таким образом, 1 ммоль (моль Chl) −1 соответствует 2,5 · 10 −4 M в просвете и 3,2 · 10 −5 M в строме. Хотя представленные здесь результаты были получены для этих конкретных значений, описывающих отношение поверхности к объему внутри хлоропласта, в принципе легко изменить соответствующие параметры, чтобы отразить различные экспериментальные условия (Matuszyńska et al.2016).
Вычислительный анализ
Модель была реализована с использованием программного обеспечения modelbase, консольного приложения, написанного на Python, недавно разработанного нами (Ebenhöh et al. 2018). Стехиометрия и параметры представлены в Приложении S1, которое можно найти в нашем репозитории GitHub (www.github.com/QTB-HHU/photosynthesismodel). Кроме того, мы предоставляем Jupyter Notebook, который позволяет пользователю повторять все моделирование, ведущее к созданию фигур, представленных в этой рукописи.
Надежность модели
Мы собрали модель фотосинтеза, адаптировав ранее проверенные и опубликованные математические модели двух взаимозависимых процессов.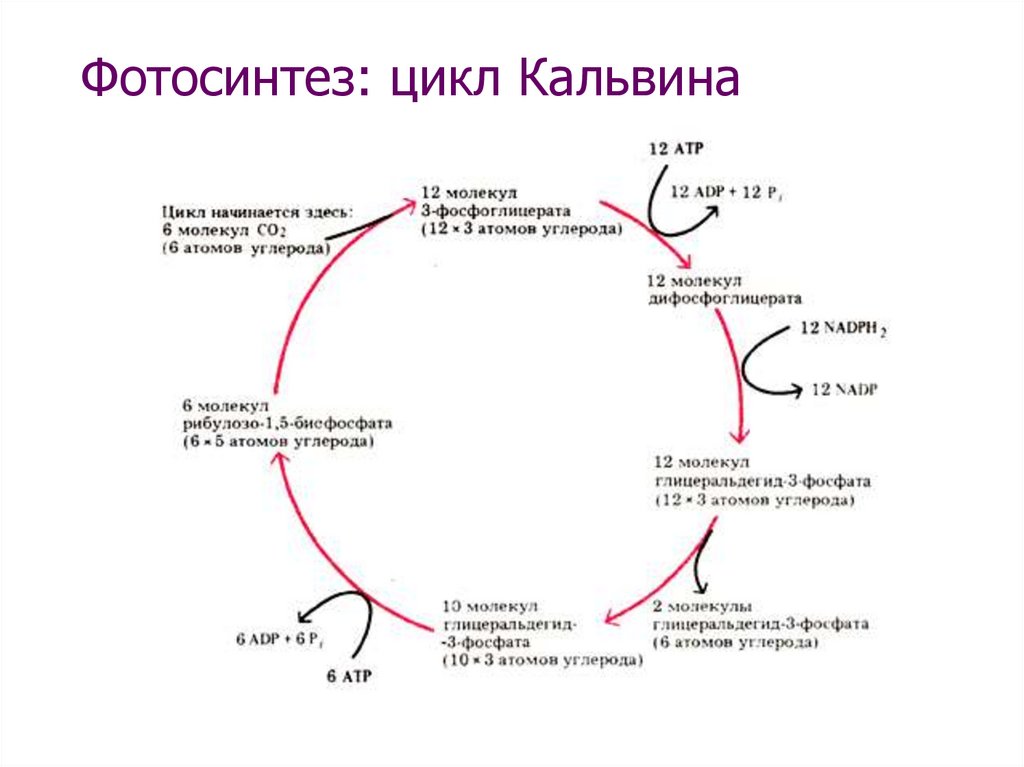 Мы использовали те же параметры, что и в предыдущей работе, и не выполняли никаких дальнейших подгонок параметров (полный список параметров представлен в таблицах S1 – S5 в Приложении S1). Мы отслеживали эволюцию нескольких критических параметров, чтобы оценить физиологическую достоверность наших результатов вычислений, включая pH просвета (при умеренном освещении около 6), скорость RuBisCO (в порядке величины измеренных значений) и окислительно-восстановительное состояние пула PQ. , используемый в качестве оценки общего окислительно-восстановительного состояния.Более того, систематический анализ стационарного состояния модели при различных условиях освещения приводит к вероятным концентрациям промежуточных продуктов и потоков CBB цикла, как сообщается в литературе (Pettersson and Ryde-Pettersson 1988).
Мы использовали те же параметры, что и в предыдущей работе, и не выполняли никаких дальнейших подгонок параметров (полный список параметров представлен в таблицах S1 – S5 в Приложении S1). Мы отслеживали эволюцию нескольких критических параметров, чтобы оценить физиологическую достоверность наших результатов вычислений, включая pH просвета (при умеренном освещении около 6), скорость RuBisCO (в порядке величины измеренных значений) и окислительно-восстановительное состояние пула PQ. , используемый в качестве оценки общего окислительно-восстановительного состояния.Более того, систематический анализ стационарного состояния модели при различных условиях освещения приводит к вероятным концентрациям промежуточных продуктов и потоков CBB цикла, как сообщается в литературе (Pettersson and Ryde-Pettersson 1988).
Результаты и обсуждение
Мы использовали нашу объединенную модель фотосинтеза и фиксации углерода для проведения систематического анализа спроса и предложения связанной системы. Во-первых, мы интегрировали систему для различных постоянных интенсивностей света, пока она не достигла устойчивого состояния.Примеры представлены на Рис. S1 в Приложении S1. Мы наблюдали разумные стационарные значения промежуточных соединений и потоков для большинства интенсивностей света. Однако при очень низкой интенсивности света (ниже 5 мкмоль м -2 с -1 ) фосфорилированные промежуточные соединения цикла CBB упали до нуля, и АТФ достиг максимальной концентрации, равной общему пулу аденозинфосфатов. В зависимости от начальных условий достигалось либо нефункционирующее состояние, характеризуемое нулевой скоростью фиксации углерода, либо функциональное состояние, характеризующееся положительным стационарным потоком.Это наблюдение бистабильности стало отправной точкой нашего анализа тесной взаимосвязи спроса и предложения.
Во-первых, мы интегрировали систему для различных постоянных интенсивностей света, пока она не достигла устойчивого состояния.Примеры представлены на Рис. S1 в Приложении S1. Мы наблюдали разумные стационарные значения промежуточных соединений и потоков для большинства интенсивностей света. Однако при очень низкой интенсивности света (ниже 5 мкмоль м -2 с -1 ) фосфорилированные промежуточные соединения цикла CBB упали до нуля, и АТФ достиг максимальной концентрации, равной общему пулу аденозинфосфатов. В зависимости от начальных условий достигалось либо нефункционирующее состояние, характеризуемое нулевой скоростью фиксации углерода, либо функциональное состояние, характеризующееся положительным стационарным потоком.Это наблюдение бистабильности стало отправной точкой нашего анализа тесной взаимосвязи спроса и предложения.
Чтобы проанализировать это поведение более подробно, мы выполнили моделирование динамики времени, в котором свет динамически переключался с постоянного достаточного света (между 20 и 200 мкмоль м -2 с -1 ) на «темный». фаза ‘продолжительностью 200 с с интенсивностью света 5 мкмоль м −2 с −1 , обратно в яркий свет, и наблюдали динамику переменных модели.На рис. 2 мы отображаем динамику внутренней концентрации ортофосфата, суммы всех трех скоростей экспорта триозофосфатного транспортера (TPT) и скорости RuBisCO (сверху вниз, соответственно) во время такого моделирования свет – темнота – свет.
фаза ‘продолжительностью 200 с с интенсивностью света 5 мкмоль м −2 с −1 , обратно в яркий свет, и наблюдали динамику переменных модели.На рис. 2 мы отображаем динамику внутренней концентрации ортофосфата, суммы всех трех скоростей экспорта триозофосфатного транспортера (TPT) и скорости RuBisCO (сверху вниз, соответственно) во время такого моделирования свет – темнота – свет.
Моделирование переходов свет – темнота – свет для различной интенсивности света от 20 до 200 мкмоль м −2 с −1 . Показана динамика внутренней концентрации ортофосфата, экспорта триозофосфатного транспортера (ТФТ) и скорости связывания углерода.Смоделированные временные интервалы показаны от 200 с, когда система достигла стационарного состояния. От 300 до 500 с (серая область) внешний свет был установлен на 5 мкмоль м -2 с -1 . На рисунке показано, что при низкой интенсивности света цикл CBB не может возобновиться во втором периоде освещения.
В соответствии с моделированием в установившемся режиме, более высокая интенсивность света приводит к более высокому общему потоку во время начальной фазы света. Более высокие потоки фиксации и экспорта углерода сопровождаются более низкими концентрациями ортофзофатов, что отражает более высокие уровни промежуточных продуктов цикла CBB.В темной фазе приближается к нефункциональному состоянию с нулевым потоком углерода. В то время как ставки снижаются, ортофосфат увеличивается, отражая истощение промежуточных пулов CBB. Во второй световой фазе только смоделированные переходы к интенсивности света 150 и 200 мкмоль м -2 с -1 могли восстановить функциональное состояние при выбранных условиях. Для более низких интенсивностей света очевидно, что промежуточный пул CBB был истощен до уровня, при котором повторное освещение не может восстановить активность цикла CBB.Очевидно, такое поведение не согласуется с повседневными наблюдениями в природе (листья растений восстанавливаются после темных периодов также при низкой интенсивности света). Тем не менее, модель полезна для получения новых идей. Во-первых, это показывает, что существует критический порог промежуточных концентраций. Если уровни упадут ниже этого порога, цикл не может быть повторно активирован. Во-вторых, он объясняет механизмы, приводящие к промежуточному истощению. В условиях низкой освещенности недостаточный запас энергии приводит к снижению активности АТФ и НАДФН-зависимых реакций в цикле фиксации углерода, что приводит к снижению скорости регенерации рибулозо-1,5-бисфосфата из рибулозо-5-фосфата (Ru5P).При этом остаются активными обратимые (АТФ-независимые) реакции. Поскольку триозофосфаты являются продуктами обратимых реакций, они продолжают обмениваться посредством реакций экспорта TPT со свободным фосфатом, что приводит к истощению промежуточных продуктов цикла CBB и сопутствующему увеличению пула ортофосфатов. Это также демонстрирует, что даже деактивация ключевых ферментов CBB, регулируемых светом, в темноте не предотвратит коллапс цикла, потому что продолжающаяся активность обратимых реакций и триозофосфатного транслокатора по-прежнему будет приводить к истощению промежуточных продуктов цикла (рис.
Тем не менее, модель полезна для получения новых идей. Во-первых, это показывает, что существует критический порог промежуточных концентраций. Если уровни упадут ниже этого порога, цикл не может быть повторно активирован. Во-вторых, он объясняет механизмы, приводящие к промежуточному истощению. В условиях низкой освещенности недостаточный запас энергии приводит к снижению активности АТФ и НАДФН-зависимых реакций в цикле фиксации углерода, что приводит к снижению скорости регенерации рибулозо-1,5-бисфосфата из рибулозо-5-фосфата (Ru5P).При этом остаются активными обратимые (АТФ-независимые) реакции. Поскольку триозофосфаты являются продуктами обратимых реакций, они продолжают обмениваться посредством реакций экспорта TPT со свободным фосфатом, что приводит к истощению промежуточных продуктов цикла CBB и сопутствующему увеличению пула ортофосфатов. Это также демонстрирует, что даже деактивация ключевых ферментов CBB, регулируемых светом, в темноте не предотвратит коллапс цикла, потому что продолжающаяся активность обратимых реакций и триозофосфатного транслокатора по-прежнему будет приводить к истощению промежуточных продуктов цикла (рис. S2 в Приложении S1).
S2 в Приложении S1).
Понятно, что в модели отсутствуют важные механизмы, предотвращающие такой функциональный сбой. В частности, нас интересует, как может быть реализован режим ожидания, в котором промежуточные уровни поддерживаются выше критического порога, и в то же время ресурсы, необходимые для этого, сводятся к минимуму. Возможная стратегия предотвращения коллапса цикла углеродной фиксации — пополнение запасов важных промежуточных продуктов. Известно, что одним из биохимических процессов на заводах по производству Ru5P является окислительная фаза PPP, в которой одна молекула глюкозо-6-фосфата окисляется и декарбоксилируется до Ru5P, производя при этом НАДФН и CO 2 (Kruger and Von Schaewen 2003). .Чтобы оценить критические промежуточные уровни, необходимые для предотвращения коллапса цикла фиксации углерода, мы выполнили моделирование при достаточном освещении (500 мкмоль м -2 с -1 ) с различными начальными условиями: начальные концентрации всего углерода промежуточные соединения фиксации установлены на ноль, за исключением Ru5P. Смоделированная концентрация Ru5P, изображенная на рис. 3, демонстрирует характерную динамику. В первые секунды промежуточные соединения цикла CBB уравновешиваются быстрыми обратимыми реакциями.Если уравновешенная концентрация Ru5P остается выше критического порога примерно 2,5 мкМ, цикл достигает функционального состояния, если она падает ниже, он разрушается. Интересно, что пороговая концентрация практически не зависит от интенсивности света (рис. S3 в приложении S1).
Смоделированная концентрация Ru5P, изображенная на рис. 3, демонстрирует характерную динамику. В первые секунды промежуточные соединения цикла CBB уравновешиваются быстрыми обратимыми реакциями.Если уравновешенная концентрация Ru5P остается выше критического порога примерно 2,5 мкМ, цикл достигает функционального состояния, если она падает ниже, он разрушается. Интересно, что пороговая концентрация практически не зависит от интенсивности света (рис. S3 в приложении S1).
Моделирование при интенсивности света 500 мкмоль м −2 с −1 для различных начальных концентраций Ru5P в диапазоне от 0,35 до 0,5 мМ. Содержание Ru5P отображается через 10 с, когда система приблизительно уравновешена.Пунктирная линия показывает критическую концентрацию для достаточной циклической активности после уравновешивания. На рисунке показано, что исходные концентрации Ru5P ниже 0,44 мМ приводят к потере содержания Ru5P.
Для моделирования простого механизма, реализующего режим ожидания, который поддерживает достаточное количество промежуточных уровней цикла CBB, мы ввели тривиальную концептуальную реакцию обмена неорганического фосфата на Ru5P. На рис. 4 показаны смоделированные устойчивые значения относительных концентраций стромального АТФ, концентраций Ru5P и рН просвета в условиях недостаточного освещения (5 мкмоль м -2 с -1 ) в зависимости от притока Ru5P.Опять же, можно наблюдать четкое пороговое поведение. Если приток Ru5P превышает приблизительно 4 мкМ с -1 , не только промежуточные соединения CBB принимают ненулевые концентрации, но также и pH просвета достигает реалистичных и нелетальных уровней.
На рис. 4 показаны смоделированные устойчивые значения относительных концентраций стромального АТФ, концентраций Ru5P и рН просвета в условиях недостаточного освещения (5 мкмоль м -2 с -1 ) в зависимости от притока Ru5P.Опять же, можно наблюдать четкое пороговое поведение. Если приток Ru5P превышает приблизительно 4 мкМ с -1 , не только промежуточные соединения CBB принимают ненулевые концентрации, но также и pH просвета достигает реалистичных и нелетальных уровней.
Моделирование устойчивого состояния при низкой интенсивности света 5 мкмоль · м −2 с −1 и систематическом увеличении притока Ru5P с 0 до 0,08 мМ · с −1 . На рисунке показаны нормализованное содержание АТФ, концентрация Ru5P и pH в просвете.
Как и ожидалось, увеличенный приток Ru5P приводит к увеличению стационарных концентраций Ru5P, что сопровождается увеличением потока через RuBisCO и экспортера TPT (рис. S4 в Приложении S1), что указывает на более высокий резервный поток и, следовательно, более высокие требования. ресурсов для поддержания этого режима.
S4 в Приложении S1), что указывает на более высокий резервный поток и, следовательно, более высокие требования. ресурсов для поддержания этого режима.
Эти результаты предполагают, что постоянный поток, обеспечивающий Ru5P в темноте со скоростью чуть выше критического порога 4 мкМ с -1 , должен поддерживать промежуточные уровни CBB на достаточно высоком уровне, в то же время минимизируя требуемые инвестиции.Действительно, при постоянной подаче Ru5P с 5 мкМ / с -1 система может быть перезапущена и достигнет функционального стационарного состояния после продолжительного периода темноты (рис. S5 в приложении S1). На один углерод эта скорость соответствует 25–30 мкМ углерода / с, в зависимости от того, импортируются ли пентозы напрямую или происходят из гексоз. Сравнивая это со стационарной фиксацией углерода в свете 0,1–1 мМ с −1 (для интенсивностей света от 20 до 200 мкмоль м −2 с −1 , рис.2 и рис. S1 в Приложении S1) показывает, что пополнение запасов в этих условиях потребует значительную долю ранее связанного углерода. Этот расчет демонстрирует важность подавления цикла CBB в темноте для положительного баланса фиксации углерода в течение дневного / ночного цикла. Действительно, известно, что ключевые ферменты в цикле фиксации углерода регулируются pH и окислительно-восстановительным состоянием стромы хлоропластов. Например, активность RuBisCO регулируется уровнями протонов и ионами магния (Tapia et al.2000, Андерссон 2008). Фруктозо-1,6-бисфосфатаза, седухептулозо-1,7-бисфосфатаза (SBPase) и фосфорибулокиназа контролируются окислительно-восстановительным состоянием через систему тиоредоксин-ферредоксин, а также pH (Chiadmi et al. 1999, Raines et al. 2000). , Рейнс 2003). Кроме того, Hendriks et al. показали светозависимость АДФ-глюкозопирофосфорилазы (Hendriks et al. 2003), которая является частью сосредоточенной реакции v Starch в нашей модели. Все эти механизмы приведут к значительному сокращению необходимого резервного потока цикла CBB, но они еще не включены в нашу простую объединенную модель.
S1 в Приложении S1) показывает, что пополнение запасов в этих условиях потребует значительную долю ранее связанного углерода. Этот расчет демонстрирует важность подавления цикла CBB в темноте для положительного баланса фиксации углерода в течение дневного / ночного цикла. Действительно, известно, что ключевые ферменты в цикле фиксации углерода регулируются pH и окислительно-восстановительным состоянием стромы хлоропластов. Например, активность RuBisCO регулируется уровнями протонов и ионами магния (Tapia et al.2000, Андерссон 2008). Фруктозо-1,6-бисфосфатаза, седухептулозо-1,7-бисфосфатаза (SBPase) и фосфорибулокиназа контролируются окислительно-восстановительным состоянием через систему тиоредоксин-ферредоксин, а также pH (Chiadmi et al. 1999, Raines et al. 2000). , Рейнс 2003). Кроме того, Hendriks et al. показали светозависимость АДФ-глюкозопирофосфорилазы (Hendriks et al. 2003), которая является частью сосредоточенной реакции v Starch в нашей модели. Все эти механизмы приведут к значительному сокращению необходимого резервного потока цикла CBB, но они еще не включены в нашу простую объединенную модель.
В исходной формулировке нашей модели без постоянной подачи Ru5P или светозависимой регуляции ферментов CBB низкая интенсивность света приводит к быстрому коллапсу цикла. Однако при достаточном освещении уровни АТФ очень высоки, а уровни фиксации углерода уже насыщены в условиях умеренного освещения (Рис. 2 и Рис. S1 в Приложении S1). Эти данные указывают на то, что наборы параметров для ферментов фиксации углерода и световых реакций, полученные из соответствующих оригинальных публикаций, не могут быть надлежащим образом адаптированы при использовании в объединенной, взаимодействующей системе.Это неудивительно, учитывая, что они происходят из совершенно разных систем и условий. Однако мы хотим подчеркнуть здесь, что известно, что модели системной биологии включают «небрежный» спектр чувствительности параметров, но все же обеспечивают надежные прогнозы (Gutenkunst et al. 2007).
Чтобы систематически исследовать поведение спроса и предложения связанной системы в различных условиях освещения, мы вводим «коэффициент регулирования» f CBB цикла CBB, с помощью которого все V max -значения светорегулируемые ферменты (см. выше) умножаются.Это позволяет систематически изменять потребность в энергии путем моделирования ускоренной или замедленной активности связывания углерода. Выполнение этого изменения при различных условиях освещения дает представление о синхронизации уровней производства и потребления АТФ и НАДФН и, таким образом, позволяет более глубокий анализ регуляции спроса и предложения фотосинтеза (Brandes et al. 1996, Chiadmi et al. 1999, Raines и др. 2000). Для следующего анализа устойчивого состояния концептуальная реакция притока Ru5P не включена.
выше) умножаются.Это позволяет систематически изменять потребность в энергии путем моделирования ускоренной или замедленной активности связывания углерода. Выполнение этого изменения при различных условиях освещения дает представление о синхронизации уровней производства и потребления АТФ и НАДФН и, таким образом, позволяет более глубокий анализ регуляции спроса и предложения фотосинтеза (Brandes et al. 1996, Chiadmi et al. 1999, Raines и др. 2000). Для следующего анализа устойчивого состояния концептуальная реакция притока Ru5P не включена.
На рис. 5 показаны стационарные значения ключевых переменных модели для различных значений силы света и факторов регулирования. В соответствии с наблюдениями, представленными выше, очень низкая интенсивность света приводит к коллапсу цикла, концентрации АТФ (фиг. 5A) максимальны (нулевой АДФ), экспорт триозофосфата (фиг. 5B) и выработка крахмала (фиг. 5C) ) равны нулю, а pH просвета (рис. 5D) очень низок (около 4). Последнее легко объяснить тем фактом, что градиент pH, создаваемый при слабом освещении, не может быть уменьшен АТФазой, у которой отсутствует субстрат АДФ. Далее становится ясно, что коэффициент регулирования f CBB = 1, соответствующий исходным параметрам, далек от оптимального. Отношение АТФ: АДФ остается очень высоким, а скорости экспорта ТРТ и производства крахмала значительно ниже оптимальных, независимо от интенсивности света. Постоянный pH просвета дополнительно показывает, что параметры не отрегулированы идеально. Не только при очень слабом освещении, но также и в условиях умеренного и сильного освещения (выше 300 мкмоль · м -2 с -1 ) просвет очень кислый, что указывает на несоответствие в процессах производства и потребления.Увеличение коэффициента регулирования до значений f CBB ≈ 4 приводит к резкому улучшению производительности системы. Отношение АТФ: АДФ предполагает реалистичные и здоровые значения около единицы, экспорт триозофосфата примерно удваивается, а производство крахмала увеличивается на один порядок по сравнению с исходными значениями параметров. При этом pH просвета остается умеренным (pH 5,8, как было предложено Kramer et al.
Далее становится ясно, что коэффициент регулирования f CBB = 1, соответствующий исходным параметрам, далек от оптимального. Отношение АТФ: АДФ остается очень высоким, а скорости экспорта ТРТ и производства крахмала значительно ниже оптимальных, независимо от интенсивности света. Постоянный pH просвета дополнительно показывает, что параметры не отрегулированы идеально. Не только при очень слабом освещении, но также и в условиях умеренного и сильного освещения (выше 300 мкмоль · м -2 с -1 ) просвет очень кислый, что указывает на несоответствие в процессах производства и потребления.Увеличение коэффициента регулирования до значений f CBB ≈ 4 приводит к резкому улучшению производительности системы. Отношение АТФ: АДФ предполагает реалистичные и здоровые значения около единицы, экспорт триозофосфата примерно удваивается, а производство крахмала увеличивается на один порядок по сравнению с исходными значениями параметров. При этом pH просвета остается умеренным (pH 5,8, как было предложено Kramer et al.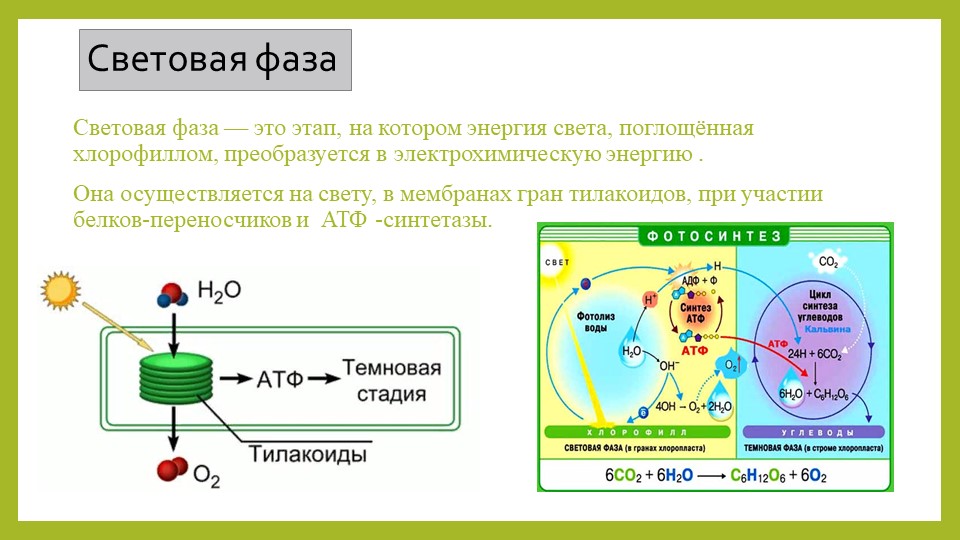 1999). Преимущество математического моделирования состоит в том, что можно также предсказать поведение системных переменных, которое нелегко получить экспериментально.На Рис. S6 в Приложении S1 мы в качестве примера изображаем окисленный ферредоксин, окисленный PQ, относительные уровни НАДФ + и виолаксантина.
1999). Преимущество математического моделирования состоит в том, что можно также предсказать поведение системных переменных, которое нелегко получить экспериментально.На Рис. S6 в Приложении S1 мы в качестве примера изображаем окисленный ферредоксин, окисленный PQ, относительные уровни НАДФ + и виолаксантина.
Анализ стационарного состояния объединенной модели фотосинтеза при различной интенсивности света (ось x) и скорости фиксации углерода (ось y). На оси z (A) отображается относительное содержание АТФ, (B) экспортный поток TPT, (C) скорость продуцирования крахмала и (D) люменальный pH.
Количественный анализ поведения спроса и предложения системы может быть выполнен путем расчета коэффициентов управления потоком (Касер и Бернс, 1973, Генрих и Рапопорт, 1974).Чтобы исследовать относительный общий контроль потока реакций спроса и предложения, мы сначала разделим набор всех реакций в модели (R) на два неперекрывающихся набора S и D. S представляет набор предложения, содержащий все реакции PETC, а D представляет собой набор реакций по запросу, включающий все реакции цикла CBB. Мы определяем общий контроль реакций предложения ( C Supply ) и спроса ( C Demand ) как сумму абсолютных значений всех контрольных коэффициентов реакций из S и D, соответственно, на устойчивом уровне. поток состояний через реакцию RuBisCO, (1)
(2)
где обозначает нормированный контрольный коэффициент реакции k на установившуюся скорость фиксации углерода.На рис. 6 показан нормализованный общий контроль реакций спроса C Спрос / ( C Спрос + C Предложение ) в зависимости от различной интенсивности света и факторов регулирования фиксации углерода. Низкая интенсивность света и быстрые реакции фиксации углерода переносят общий контроль потока на реакции подачи. Это легко объяснить, потому что в этих условиях (низкая освещенность и быстрые ферменты CBB) энергия и окислительно-восстановительное обеспечение за счет световых реакций являются ограничивающим фактором.
S представляет набор предложения, содержащий все реакции PETC, а D представляет собой набор реакций по запросу, включающий все реакции цикла CBB. Мы определяем общий контроль реакций предложения ( C Supply ) и спроса ( C Demand ) как сумму абсолютных значений всех контрольных коэффициентов реакций из S и D, соответственно, на устойчивом уровне. поток состояний через реакцию RuBisCO, (1)
(2)
где обозначает нормированный контрольный коэффициент реакции k на установившуюся скорость фиксации углерода.На рис. 6 показан нормализованный общий контроль реакций спроса C Спрос / ( C Спрос + C Предложение ) в зависимости от различной интенсивности света и факторов регулирования фиксации углерода. Низкая интенсивность света и быстрые реакции фиксации углерода переносят общий контроль потока на реакции подачи. Это легко объяснить, потому что в этих условиях (низкая освещенность и быстрые ферменты CBB) энергия и окислительно-восстановительное обеспечение за счет световых реакций являются ограничивающим фактором. Интересно, что PSII и PSI вносят наибольший вклад в общий контроль потока на стороне подачи (Рис. S7 в Приложении S1). И наоборот, высокая интенсивность света и медленные реакции связывания углерода смещают общий контроль потока в сторону спроса, потому что в этих условиях система энергетически насыщена, а узким местом является цикл CBB, потребляющий энергию и окислительно-восстановительные эквиваленты. Примечательно, что именно реакция SBPase демонстрирует самый высокий общий контроль потока (Рис. S8 в Приложении S1), в то время как RuBisCO имеет лишь незначительный контроль.
Интересно, что PSII и PSI вносят наибольший вклад в общий контроль потока на стороне подачи (Рис. S7 в Приложении S1). И наоборот, высокая интенсивность света и медленные реакции связывания углерода смещают общий контроль потока в сторону спроса, потому что в этих условиях система энергетически насыщена, а узким местом является цикл CBB, потребляющий энергию и окислительно-восстановительные эквиваленты. Примечательно, что именно реакция SBPase демонстрирует самый высокий общий контроль потока (Рис. S8 в Приложении S1), в то время как RuBisCO имеет лишь незначительный контроль.Нормализованный общий контроль реакций спроса ( C Требование ) при различной интенсивности света (ось x) и активности цикла CBB (ось y). Результаты показывают, как контроль переходит от реакции спроса в условиях высокой освещенности, но низкой активности CBB, к предложению в условиях низкой освещенности, но более быстрому циклу CBB.
Выводы
Слияние математических моделей — задача в высшей степени нетривиальная. Даже если две отдельные модели дают правдоподобные результаты, нет никакой гарантии, что это также верно после математического комбинирования этих моделей. Помимо чисто технических деталей, таких как преобразование концентраций в соответствующие единицы, существует ряд проблем, которые затрудняют объединение моделей. Обычно отдельные модели разрабатываются с учетом совершенно разных научных вопросов и поэтому могут отображать совершенно разные степени детализации вовлеченных процессов. Более того, параметризация часто выполняется для разных организмов, тканей или условий.Что наиболее важно, увеличение размера системы за счет интеграции двух или более моделей может привести к новым возникающим свойствам, которые не наблюдались в отдельных моделях.
Даже если две отдельные модели дают правдоподобные результаты, нет никакой гарантии, что это также верно после математического комбинирования этих моделей. Помимо чисто технических деталей, таких как преобразование концентраций в соответствующие единицы, существует ряд проблем, которые затрудняют объединение моделей. Обычно отдельные модели разрабатываются с учетом совершенно разных научных вопросов и поэтому могут отображать совершенно разные степени детализации вовлеченных процессов. Более того, параметризация часто выполняется для разных организмов, тканей или условий.Что наиболее важно, увеличение размера системы за счет интеграции двух или более моделей может привести к новым возникающим свойствам, которые не наблюдались в отдельных моделях.
В этой работе мы успешно объединили модель PETC, поставляющую ATP и NADPH, с моделью цикла CBB, потребляющего ATP и NADPH. Успешному слиянию в значительной степени способствовало обеспечение сопоставимого уровня упрощения двух отдельных моделей (PETC описывается 9 ODE, а цикл CBB — 15 ODE). Наша объединенная модель представляет собой систему спроса и предложения и, как таковая, демонстрирует системные свойства, которых не было в каждой из отдельных моделей. Связывание процессов спроса и предложения в одну функциональную модель позволило нам использовать анализ метаболического контроля для систематического исследования регуляторной зависимости между циклом PETC и CBB. Моделируя переходы свет-темнота-свет, мы могли бы обосновать важность окислительного PPP в обеспечении субстратов как механизма для работы цикла CBB в режиме ожидания.Одновременно мы показываем, что регулирование активности цикла CBB при очень низкой освещенности имеет решающее значение, чтобы избежать чрезмерных вложений в режим ожидания. Более того, модель демонстрирует, что регулирование, адаптирующееся к разной интенсивности света, важно для уравновешивания предложения PETC со спросом ниже по течению. Используя анализ метаболического контроля (MCA), мы количественно оценили контрольное распределение спроса и предложения в системе для различных условий освещения и для различной активности цикла CBB.
Наша объединенная модель представляет собой систему спроса и предложения и, как таковая, демонстрирует системные свойства, которых не было в каждой из отдельных моделей. Связывание процессов спроса и предложения в одну функциональную модель позволило нам использовать анализ метаболического контроля для систематического исследования регуляторной зависимости между циклом PETC и CBB. Моделируя переходы свет-темнота-свет, мы могли бы обосновать важность окислительного PPP в обеспечении субстратов как механизма для работы цикла CBB в режиме ожидания.Одновременно мы показываем, что регулирование активности цикла CBB при очень низкой освещенности имеет решающее значение, чтобы избежать чрезмерных вложений в режим ожидания. Более того, модель демонстрирует, что регулирование, адаптирующееся к разной интенсивности света, важно для уравновешивания предложения PETC со спросом ниже по течению. Используя анализ метаболического контроля (MCA), мы количественно оценили контрольное распределение спроса и предложения в системе для различных условий освещения и для различной активности цикла CBB.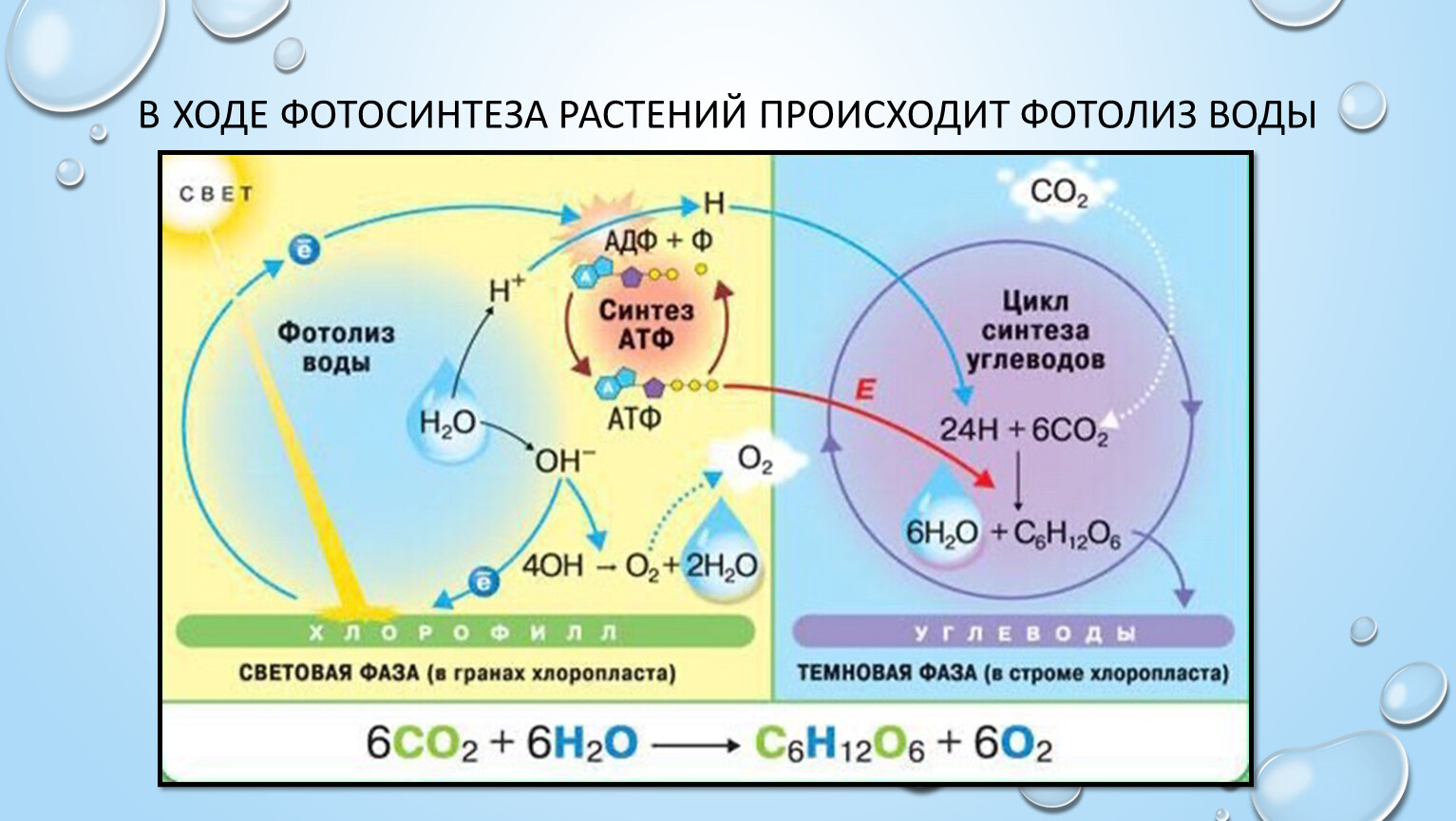 Вводя регулирующий фактор, соответствующий активности ферментов цикла CBB, мы демонстрируем, что система требует более высокого количества света, чтобы получить насыщение и более быструю фиксацию углерода. Наш анализ MCA показал, что реакции подачи демонстрируют высокий общий контроль потока при ограничении света. И наоборот, реакции спроса управляют потоком в светонасыщенных условиях. Среди реакций предложения активность PSII и PSI демонстрирует самый высокий общий контроль потока, в то время как среди реакций спроса SBPase поддерживает самый высокий общий контроль потока (рис. S7 и S8 в Приложении S1).Интересно, что часто рассматриваемый фермент «узкое место» RuBisCO демонстрирует лишь незначительный общий контроль потока. Это наблюдение можно объяснить тем, что модель предполагает условия насыщенного CO 2 .
Вводя регулирующий фактор, соответствующий активности ферментов цикла CBB, мы демонстрируем, что система требует более высокого количества света, чтобы получить насыщение и более быструю фиксацию углерода. Наш анализ MCA показал, что реакции подачи демонстрируют высокий общий контроль потока при ограничении света. И наоборот, реакции спроса управляют потоком в светонасыщенных условиях. Среди реакций предложения активность PSII и PSI демонстрирует самый высокий общий контроль потока, в то время как среди реакций спроса SBPase поддерживает самый высокий общий контроль потока (рис. S7 и S8 в Приложении S1).Интересно, что часто рассматриваемый фермент «узкое место» RuBisCO демонстрирует лишь незначительный общий контроль потока. Это наблюдение можно объяснить тем, что модель предполагает условия насыщенного CO 2 .
Наша модель находится в свободном доступе как программное обеспечение с открытым исходным кодом, и мы гарантируем, что представленные здесь результаты можно легко воспроизвести. Мы предполагаем, что благодаря сбалансированной простоте и ясной модульной структуре он послужит платформой для будущего развития.Результаты нашей модели были получены для конкретных экспериментальных значений содержания хлорофилла и отношения поверхности к объему стромы и просвета хлоропласта. Однако эти значения сильно зависят от условий роста и различаются для разных видов растений. Четкая структура модели и документированный код позволяют легко изменять параметры модели для альтернативных экспериментально определенных значений. Потребуются только относительно незначительные модификации структуры модели, чтобы использовать ее для дальнейшего анализа взаимосвязи между PETC и другими подпроцессами.Например, описывая крахмал как динамическую переменную и обеспечивая упрощенное представление окислительного PPP, можно улучшить наше понимание светозависимого оборота крахмала (Stitt and Zeeman 2012) и рационализировать пополнение запасов пентоз из гексоз в хлоропласте. окислительным PPP (Neuhaus and Emes 2000, Kruger and Von Schaewen 2003) и исследовать роль альтернативных шунтов (Preiser et al.
Мы предполагаем, что благодаря сбалансированной простоте и ясной модульной структуре он послужит платформой для будущего развития.Результаты нашей модели были получены для конкретных экспериментальных значений содержания хлорофилла и отношения поверхности к объему стромы и просвета хлоропласта. Однако эти значения сильно зависят от условий роста и различаются для разных видов растений. Четкая структура модели и документированный код позволяют легко изменять параметры модели для альтернативных экспериментально определенных значений. Потребуются только относительно незначительные модификации структуры модели, чтобы использовать ее для дальнейшего анализа взаимосвязи между PETC и другими подпроцессами.Например, описывая крахмал как динамическую переменную и обеспечивая упрощенное представление окислительного PPP, можно улучшить наше понимание светозависимого оборота крахмала (Stitt and Zeeman 2012) и рационализировать пополнение запасов пентоз из гексоз в хлоропласте. окислительным PPP (Neuhaus and Emes 2000, Kruger and Von Schaewen 2003) и исследовать роль альтернативных шунтов (Preiser et al. 2018). В принципе, также просто моделировать концентрации ненасыщенного диоксида углерода, соответствующим образом изменяя уравнение скорости RuBisCO (например,г. Witzel et al. 2010). Однако в этих условиях нельзя больше пренебрегать фотодыханием. Поэтому для реалистичного моделирования таких сценариев в модель следует включить упрощенное представление светодыхательного пути. С таким расширением модели можно было бы дополнительно исследовать энергетический баланс (Игамбердиев и др., 2001) и распределение контроля потока между PETC, циклом CBB и реакциями фотодыхания. Другое модельное предположение состоит в том, что весь АТФ, продуцируемый световыми реакциями, потребляется циклом CBB.Однако это, конечно, только приближение. В условиях сильного стресса или у различных организмов, таких как растения C4 или водоросли, усваивающие азот, это приближение, безусловно, неоправданно. Наша реализация модели в среде базовых моделей (Ebenhöh et al. 2018) предназначена для облегчения внесения изменений интуитивно понятным способом.
2018). В принципе, также просто моделировать концентрации ненасыщенного диоксида углерода, соответствующим образом изменяя уравнение скорости RuBisCO (например,г. Witzel et al. 2010). Однако в этих условиях нельзя больше пренебрегать фотодыханием. Поэтому для реалистичного моделирования таких сценариев в модель следует включить упрощенное представление светодыхательного пути. С таким расширением модели можно было бы дополнительно исследовать энергетический баланс (Игамбердиев и др., 2001) и распределение контроля потока между PETC, циклом CBB и реакциями фотодыхания. Другое модельное предположение состоит в том, что весь АТФ, продуцируемый световыми реакциями, потребляется циклом CBB.Однако это, конечно, только приближение. В условиях сильного стресса или у различных организмов, таких как растения C4 или водоросли, усваивающие азот, это приближение, безусловно, неоправданно. Наша реализация модели в среде базовых моделей (Ebenhöh et al. 2018) предназначена для облегчения внесения изменений интуитивно понятным способом.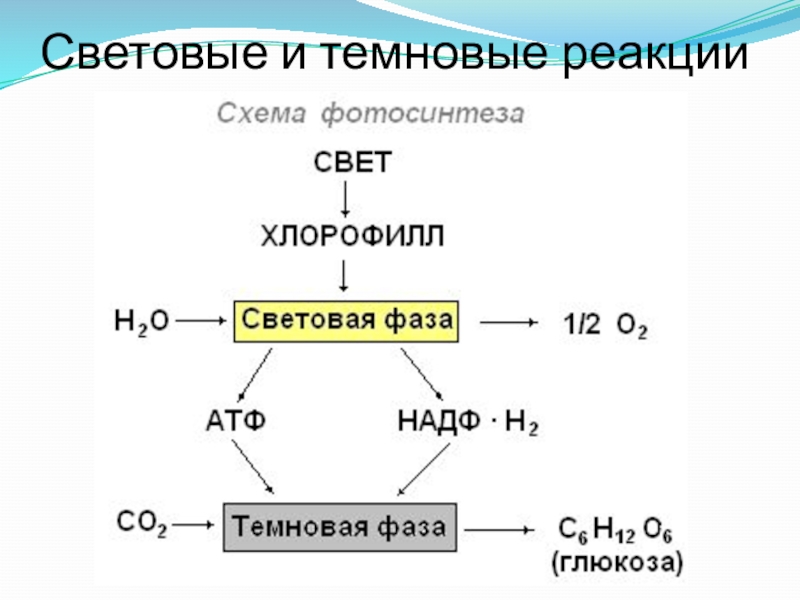 Следовательно, добавление дополнительных процессов потребления АТФ технически просто, что позволяет теоретически исследовать, как такой дополнительный спрос будет влиять на поведение фотосинтетической системы спроса и предложения.Задача здесь будет заключаться в получении реалистичных скоростных уравнений, которые описывают зависимость скорости дополнительного потребления АТФ от концентрации АТФ и, возможно, других переменных системы.
Следовательно, добавление дополнительных процессов потребления АТФ технически просто, что позволяет теоретически исследовать, как такой дополнительный спрос будет влиять на поведение фотосинтетической системы спроса и предложения.Задача здесь будет заключаться в получении реалистичных скоростных уравнений, которые описывают зависимость скорости дополнительного потребления АТФ от концентрации АТФ и, возможно, других переменных системы.
Процесс интеграции двух моделей, описанный здесь, демонстрирует силу теоретических подходов. Связывание двух процессов приводит к новым свойствам (здесь балансирование спроса и предложения), которые можно исследовать, чтобы получить новое фундаментальное понимание. Объединенная модель может объяснить важность системных свойств и, таким образом, объяснить, почему существуют определенные механизмы.В частности, ни одна из отдельных моделей не могла объяснить значимость режима ожидания или роль адаптивного регулирования в максимизации эффективности и, таким образом, объяснить функциональную важность окислительного PPP или окислительно-восстановительной и pH-чувствительности ключевых ферментов CBB в организме человека.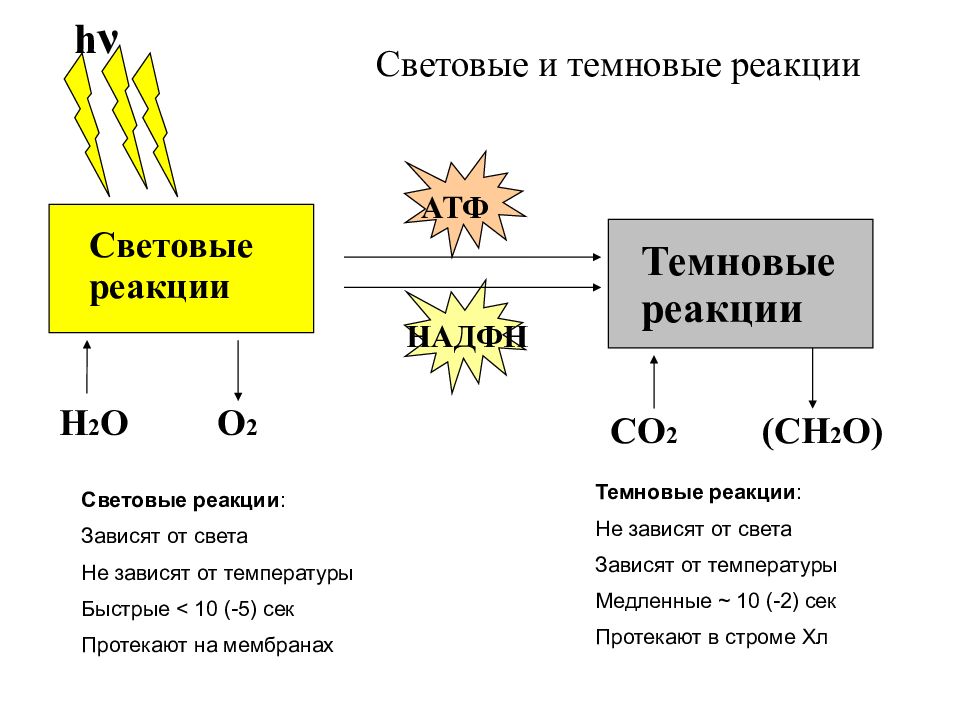 динамическая среда.
динамическая среда.
Вклад авторов
A.M. объединил модели и предоставил все математические описания. Н.П.С. выполнил вычислительный анализ и подготовил первый проект результатов.Все авторы принимали участие в интерпретации результатов и подготовке рукописи.
Благодарности
Это исследование финансировалось Deutsche Forschungsgemeinschaft (DFG) в рамках стратегии совершенства Германии EXC 2048/1, идентификатор проекта: 3
111.Это мероприятие прошло экспертную оценку.
Это мероприятие прошло экспертную оценку, в ходе которой представленные мероприятия сравниваются с набором критериев. В коллекцию были добавлены мероприятия, соответствующие этим критериям или отредактированные для соответствия этим критериям. Чтобы узнать больше о критериях обзора, см. [Http: // вкус.merlot.org/evaluationcriteria.html]. Более подробную информацию о процессе экспертной оценки можно найти на [http://taste.merlot.org/peerreviewprocess.html].
- Найдите место внутри листа, где происходят темные реакции фотосинтеза.
- Узнайте, каким образом диоксид углерода первоначально соединяется с 3-фосфоглицериновой кислотой с образованием накопленных углеводов.
- Укажите важность фермента рибулозобифосфаткарбоксилазы / оксигеназы и его вклад в этапы цикла Кальвина.
- Поймите, как темные реакции способствуют накоплению энергии в виде фиксированных углеводов.
- Используйте настоящий лист двудольных растений или нарисуйте его изображение на листе бумаги и разрежьте его пополам. Объясните, что световая и темная реакции фотосинтеза происходят внутри специализированных клеток, которые находятся в пределах края листа и пересекают внутреннюю часть.
- Нарисуйте край листа, на котором показаны несколько слоев клеток внутри, включая верхний эпидермис, паренхиму палисадной паренхимы, губчатую паренхиму, среднюю жилку с сосудистой тканью и нижний эпидермис см. Http://www.merlot.org/merlot/ viewMaterial.htm? id = 281356 для обзора того, где происходят световые реакции в листе, а затем см. http://www.merlot.org/merlot/viewMaterial.htm?id=481172 для получения подробной информации о темных реакциях.
- Укажите место фотосинтетических реакций в палисаде и губчатой паренхиме и нарисуйте одну клетку, изобразив несколько хлоропластов в цитоплазме этой клетки.Объясните, что реакции фотосинтеза происходят в хлоропластах.
- Изобразите хлоропласт, показывая строму и тилакоиды. Объясните, что темные реакции фотосинтеза происходят внутри стромы http://www.merlot.org/merlot/viewMaterial.htm?id=481172. Некоторые участники могут лучше понять, что хлоропласт «подобен» тарелке со стопкой блинов — блины представляют тилакоиды, а сироп — строму.
- Объясните, что углекислый газ проникает через устьичный аппарат и диффундирует в клетки паренхимы, где он может участвовать в реакциях цикла Кальвина.
- Укажите, что фермент рибулозобисфосфаткарбоксилаза / оксигеназа (RUBISCO) катализирует объединение диоксида углерода с рибулозобисфосфаткарбоксилазой / оксигеназой (RUBISCO) с образованием двух молекул 3-фосфоглицериновой кислоты.
- Укажите, что фотосинтезирующие организмы (как водные, так и наземные) многочисленны на Земле и что этого фермента очень много в растениях, что делает его самым распространенным ферментом на Земле.
- Покажите шаги и попросите участников нарисовать общие шаги цикла Кальвина, см. Http: // www.merlot.org/merlot/viewMaterial.htm?id=79769, а для получения более подробной информации об отдельных этапах и задействованных молекулярных структурах см. http://www.merlot.org/merlot/viewMaterial.htm?id=481167.
- Объясните, что фермент RUBISCO не всегда связывает углекислый газ, и кислород может конкурировать с углекислым газом, что приводит к процессу, называемому фотодыханием. См. Ссылку в последнем разделе на http://www.merlot.org/merlot/viewMaterial.htm?id=80033.
- Кратко объясните, как определенные растения, называемые растениями C-4 (в отличие от растений C-3), имеют фермент фосфоенолпируват (PEP) карбоксилазу, и этот фермент имеет более высокое сродство к диоксиду углерода, что является одной из основных причин, почему Установки C-4 могут быть более эффективными в сухом жарком климате http: // www.merlot.org/merlot/viewMaterial.htm?id=444380.
Влияние фазы света и темноты, растения-хозяина, температуры и их взаимодействия на скорость хищничества у насекомых-хищников | Экологическая энтомология
Абстрактные
Скорость хищничества в час Macrolophus pygmaeus Rambur (Hemiptera: Miridae) в светлой и темной фазах была исследована в зависимости от растения-хозяина, фотопериода, температуры и стадии жизни хищника. Особей каждой стадии нимфы плюс взрослые особи обоих полов из M. pygmaeus по отдельности помещали в чашки Петри на лист баклажана или растения перца, зараженные нимфами Myzus persicae (Sulzer) (Homoptera: Aphididae). Эксперименты проводились при трех фотопериодах (8:16, 12:12 и 16: 8 ч [L: D]) и температурах (20, 25 и 30 ° C) на растениях баклажанов и перца. Как правило, уровень хищничества был значительно выше в темноте, чем в светлой фазе, особенно в случае более крупных возрастов и взрослых особей.Взаимодействие между факторами показало, что этот хищник предпочитает питаться ночью намного выше на перце, чем на баклажане, и эта разница более заметна при 30 ° C. Обсуждается важность этих результатов для понимания поведения при добывании пищи и того, как аспекты этого поведения влияют на потенциал хищника в области биологического контроля.
Особей каждой стадии нимфы плюс взрослые особи обоих полов из M. pygmaeus по отдельности помещали в чашки Петри на лист баклажана или растения перца, зараженные нимфами Myzus persicae (Sulzer) (Homoptera: Aphididae). Эксперименты проводились при трех фотопериодах (8:16, 12:12 и 16: 8 ч [L: D]) и температурах (20, 25 и 30 ° C) на растениях баклажанов и перца. Как правило, уровень хищничества был значительно выше в темноте, чем в светлой фазе, особенно в случае более крупных возрастов и взрослых особей.Взаимодействие между факторами показало, что этот хищник предпочитает питаться ночью намного выше на перце, чем на баклажане, и эта разница более заметна при 30 ° C. Обсуждается важность этих результатов для понимания поведения при добывании пищи и того, как аспекты этого поведения влияют на потенциал хищника в области биологического контроля.
введение
ПОНИМАНИЕ ОБРАЗОВАНИЯ ПОВЕДЕНИЯ ИГРАЕТ решающую роль в эффективном и надлежащем использовании агентов биологической борьбы (DeBach and Rosen 1991). Воздействие насекомых-хищников на популяции травоядных в значительной степени зависит от характеристик растений-хозяев, которые влияют на их поведение в поисках пищи. Эти эффекты в основном связаны либо с архитектурой растений, такой как плотность трихом (Belcher and Thurston 1982) и скользкими листьями (Kareiva and Sahakian 1990, Grevstad and Klepetka 1992), либо с изменением качества добычи (Price et al. 1980, Giles et al. 2002 г.). У хищных Hemiptera также было зарегистрировано неблагоприятное влияние волосков на листьях на их продуктивность и активность поиска добычи (Coll and Ridgway 1995, Pfannenstiel and Yeargan 1998, De Clercq et al.2000). Поскольку эти клопы могут использовать сок растений (Naranjo and Gibson 1996, Coll 1998), растение-хозяин влияет на скорость их хищничества не только как поисковый субстрат, но и как источник питательных веществ, который может изменить их потребность в добыче (Coll and Ridgway 1995). . Свет также влияет на уровень хищничества, потому что большинство хищников имеют определенные предпочтения в питании в свете или темноте (Nakamuta 1987, Braman and Yeargan 1989, Harmon et al.
Воздействие насекомых-хищников на популяции травоядных в значительной степени зависит от характеристик растений-хозяев, которые влияют на их поведение в поисках пищи. Эти эффекты в основном связаны либо с архитектурой растений, такой как плотность трихом (Belcher and Thurston 1982) и скользкими листьями (Kareiva and Sahakian 1990, Grevstad and Klepetka 1992), либо с изменением качества добычи (Price et al. 1980, Giles et al. 2002 г.). У хищных Hemiptera также было зарегистрировано неблагоприятное влияние волосков на листьях на их продуктивность и активность поиска добычи (Coll and Ridgway 1995, Pfannenstiel and Yeargan 1998, De Clercq et al.2000). Поскольку эти клопы могут использовать сок растений (Naranjo and Gibson 1996, Coll 1998), растение-хозяин влияет на скорость их хищничества не только как поисковый субстрат, но и как источник питательных веществ, который может изменить их потребность в добыче (Coll and Ridgway 1995). . Свет также влияет на уровень хищничества, потому что большинство хищников имеют определенные предпочтения в питании в свете или темноте (Nakamuta 1987, Braman and Yeargan 1989, Harmon et al. 1998, Pfannenstiel and Yeargan 2002).
1998, Pfannenstiel and Yeargan 2002).
На уровень хищничества в полевых условиях влияет одновременное влияние таких факторов, как растительный субстрат, условия освещения, температура и их взаимодействия.Хотя определение влияния каждого фактора может быть начальной целью исследования, взаимодействия могут выявить пластичность поискового поведения, которая подразумевает возможную адаптацию хищника к неблагоприятным условиям.
Виды рода Macrolophus Fieber (Hemiptera: Miridae) широко используются в качестве средств биологической борьбы с насекомыми-вредителями, такими как белокрылки и тля на овощных культурах (Albajes and Alomar 1999). Macrolophus pygmaeus Рамбур является основным средством биологической борьбы с тлей на посевах томатов в центральной Греции (Perdikis and Lykouressis 1996, Lykouressis et al.1999-2000 гг.) И обычен для растений баклажанов и перца (Lykouressis et al. 2000). Этот хищник успешно развивается на овощах с добычей или без нее (Perdikis and Lykouressis 1999, 2000, Lykouressis et al.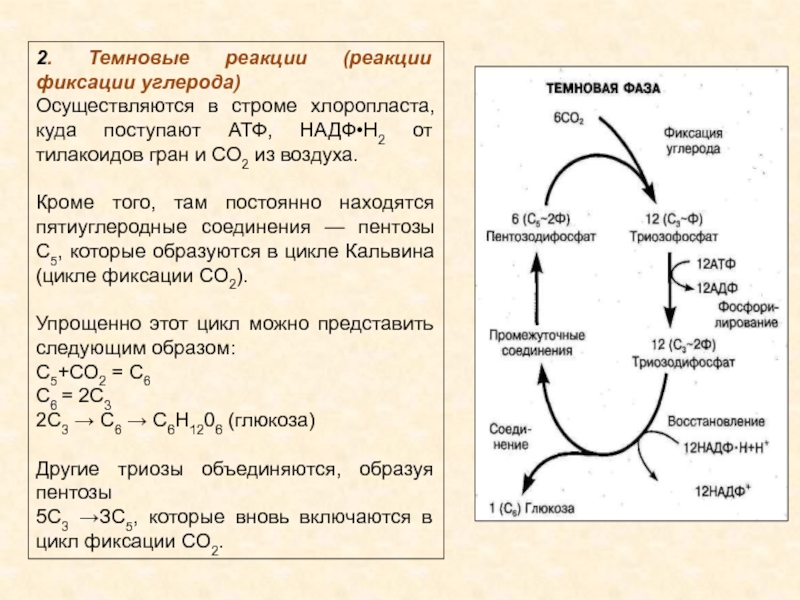 2001) и может хорошо развиваться при относительно низких температурах (Perdikis and Lykouressis 2002). Perdikis et al. (1999) оценили влияние растения-хозяина, фотопериода и температуры на 24-часовую скорость хищничества нимф M. pygmaeus и взрослых особей. В этом исследовании уровень хищничества оценивался на баклажанах и растениях перца, которые отличаются питанием от хищников, причем баклажаны в большей степени способствуют развитию нимф, чем растения перца при отсутствии добычи (Perdikis and Lykouressis 1999).Тля Myzus persicae (Sulzer) использовалась в качестве добычи, поскольку эта тля в равной степени подходит для развития нимф на обоих растениях (Perdikis and Lykouressis 1999). Взрослые особи и нимфы хищника уничтожили больше тлей при 30, чем при 25 и 20 ° C, причем самки и нимфы пятой стадии были самыми прожорливыми стадиями жизни при всех температурах. Однако различия в скорости хищничества в светлых и темных условиях могут объяснить значительное влияние фотопериода на растения перца, но не на баклажаны (Perdikis et al.
2001) и может хорошо развиваться при относительно низких температурах (Perdikis and Lykouressis 2002). Perdikis et al. (1999) оценили влияние растения-хозяина, фотопериода и температуры на 24-часовую скорость хищничества нимф M. pygmaeus и взрослых особей. В этом исследовании уровень хищничества оценивался на баклажанах и растениях перца, которые отличаются питанием от хищников, причем баклажаны в большей степени способствуют развитию нимф, чем растения перца при отсутствии добычи (Perdikis and Lykouressis 1999).Тля Myzus persicae (Sulzer) использовалась в качестве добычи, поскольку эта тля в равной степени подходит для развития нимф на обоих растениях (Perdikis and Lykouressis 1999). Взрослые особи и нимфы хищника уничтожили больше тлей при 30, чем при 25 и 20 ° C, причем самки и нимфы пятой стадии были самыми прожорливыми стадиями жизни при всех температурах. Однако различия в скорости хищничества в светлых и темных условиях могут объяснить значительное влияние фотопериода на растения перца, но не на баклажаны (Perdikis et al.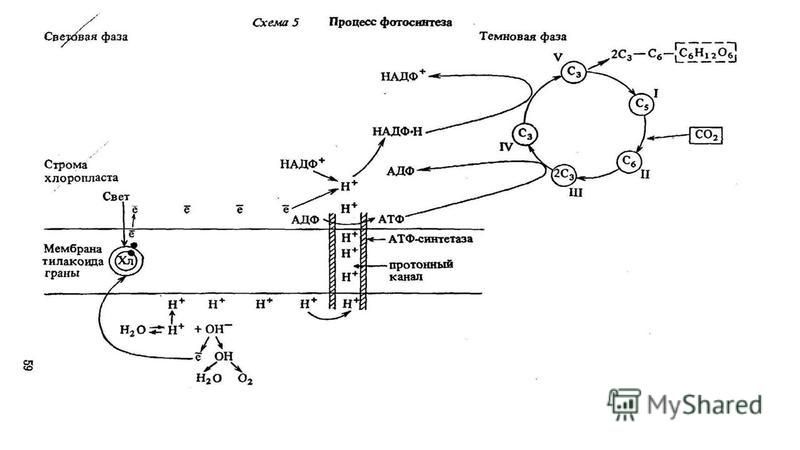 1999). Кроме того, такое исследование может выявить взаимодействие биотических и абиотических факторов со светом, что может способствовать нашему пониманию его пищевого поведения.
1999). Кроме того, такое исследование может выявить взаимодействие биотических и абиотических факторов со светом, что может способствовать нашему пониманию его пищевого поведения.
Целью этого исследования было дальнейшее изучение влияния света и его возможных взаимодействий с биотическими (виды растений и стадия жизни) и абиотическими факторами (фотопериод и температура) на уровень хищничества M. pygmaeus с использованием полученных данных. из Perdikis et al. (1999). В частности, это исследование проводилось для определения (1) влияния продолжительности световой фазы на предпочтение кормления хищников
и (2) наличия взаимосвязи между предпочтением кормления в темноте и другими факторами, такими как тип растения, фотопериод. , температура и жизненный этап.
Материалы и методы
Macrolophus pygmaeus был выращен в лаборатории от особей, собранных с обрабатываемого урожая томатов в Беотии, центральная Греция. Культуры поддерживали на горшечных баклажанах (сорт Bonica), зараженных M. persicae , в клетках с деревянными каркасами (80 на 80 на 70 см). Их содержали в теплице при температуре 22,5 ± 2,5 ° C (стандартное отклонение) при естественном дневном свете.
Культуры поддерживали на горшечных баклажанах (сорт Bonica), зараженных M. persicae , в клетках с деревянными каркасами (80 на 80 на 70 см). Их содержали в теплице при температуре 22,5 ± 2,5 ° C (стандартное отклонение) при естественном дневном свете.
Перед каждым экспериментом испытуемых насекомых (нимфы и взрослые особи) кондиционировали в течение не менее 7 дней на конкретном испытуемом растении-хозяине в соответствующих экспериментальных условиях фотопериода и температуры.
Влияние продолжительности темной и светлой фаз на скорость хищничества M. pygmaeus было изучено путем помещения предварительно кондиционированных насекомых (нимфы всех стадий, самцов и самок) по отдельности в чашку Петри диаметром 9 см и глубиной 1 см. с отверстием диаметром 3 см в его верхней части, покрытым тонким муслином для обеспечения достаточной вентиляции. Дно каждой чашки было покрыто слоем ваты, смоченной водой, на которую помещали лист соответствующего растения-хозяина.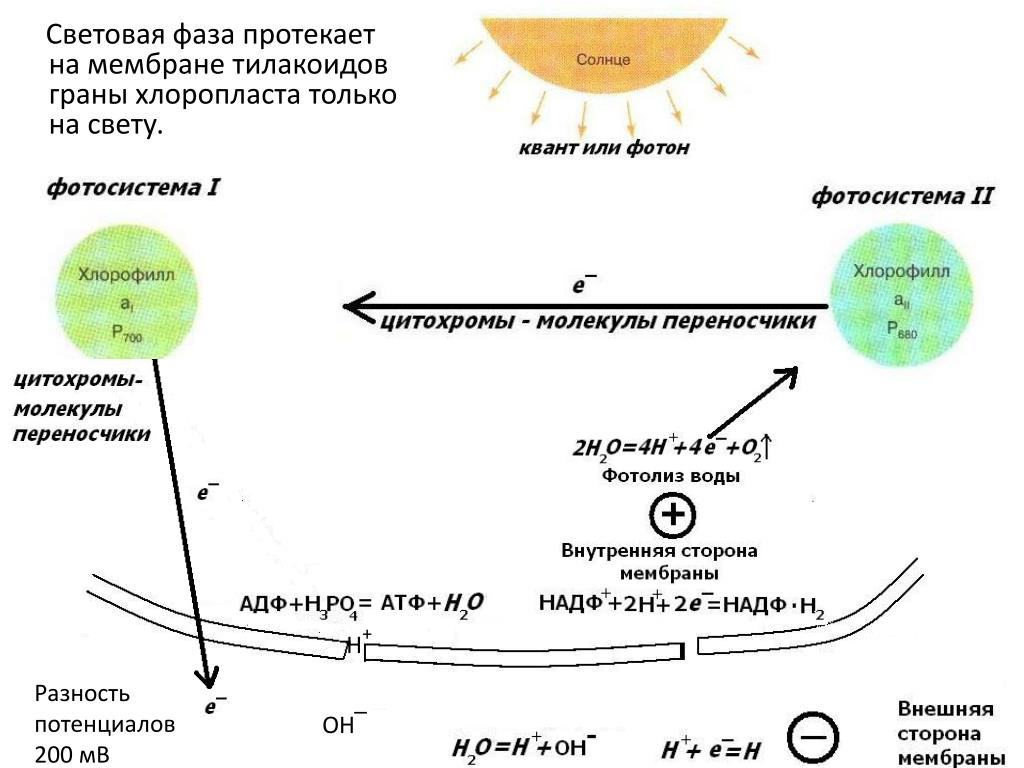 В этих экспериментах были протестированы баклажаны (сорт Bonica) и растения перца (сорт Vidi).Десять особей M. persicae первой, второй и третьей возрастов каждой помещали на лист каждой чашки Петри.
В этих экспериментах были протестированы баклажаны (сорт Bonica) и растения перца (сорт Vidi).Десять особей M. persicae первой, второй и третьей возрастов каждой помещали на лист каждой чашки Петри.
Эксперименты проводились в камерах для выращивания, поддерживаемых при относительной влажности 65 ± 5% и температуре 20, 25 и 30 ° C. Уровень хищничества M. pygmaeus исследовали в 8:16, 12:12 и 16: 8 (Д: Д) ч при трех температурах на обоих растениях. В каждой обработке использовали ≈20 человек (повторения). Половина реплик (чашки Петри с тлей и хищниками) была помещена в камеру для выращивания в начале светлой фазы, а половина — в начале темной фазы для каждого фотопериода.
Скорость хищничества оценивалась путем двойного измерения количества съеденных тлей, при этом первое измерение производилось
при смене светлой или темной фазы (8, 12 и 16 ч от начала каждого эксперимента), а первое измерение —
. второй, когда цикл свет: темнота завершился, т. е. через 24 ч после начала каждого эксперимента. При первом измерении трупы тли удаляли из каждой чашки Петри и заменяли живыми тлями того же возраста. В любом тесте данные отбрасывались, когда хищник менял нимфальную стадию.Большинство из вышеупомянутых экспериментальных процедур также было описано в предыдущей работе Perdikis et al. (1999).
е. через 24 ч после начала каждого эксперимента. При первом измерении трупы тли удаляли из каждой чашки Петри и заменяли живыми тлями того же возраста. В любом тесте данные отбрасывались, когда хищник менял нимфальную стадию.Большинство из вышеупомянутых экспериментальных процедур также было описано в предыдущей работе Perdikis et al. (1999).
В этом исследовании оценивали предпочтение M. pygmaeus питанию в светлой или темной фазе. Для этой цели, основываясь на результатах 24-часовой скорости хищничества M. pygmaeus (Perdikis et al. 1999), была рассчитана скорость хищничества в час в светлой или темной фазе для всех стадий нимфы и взрослых особей. Данные анализировали с использованием пятифакторного дисперсионного анализа (ANOVA) со следующими факторами: виды растений, фотопериод, температура, продолжительность жизни (каждая нимфальная стадия, мужская или женская) и светлая фаза (светлая или темная).Перед анализом данные были преобразованы в квадратный корень.
Когда был обнаружен значительный эффект, для выявления значимых различий между средними значениями использовали тест Тьюки-Крамера (HSD) для выявления значимых различий ( P <0,05). Данные были проанализированы с помощью статистического пакета JMP (SAS Institute 2001).
Результаты
Уровень хищничества M. pygmaeus значительно зависел от светлой фазы (таблица 1), будучи намного выше в темноте (рис.Было зарегистрировано значимое трехстороннее взаимодействие между температурой, стадией жизни и световыми условиями (таблица 1; рис. 1), что в основном было вызвано гораздо более высокой скоростью хищничества более крупных возрастов и взрослых особей в темноте, чем на свету. фаза,
Таблица 1. Пятифакторный дисперсионный анализвлияния растения-хозяина, фотопериода, температуры, стадии развития хищника и фазы свет-темнота на частоту хищничества M. pygmaeus в час на M. persicae
Таблица 1. Пятифакторный ANOVA влияния растения-хозяина, фотопериода, температуры, стадии развития хищника и фазы свет-темнота на скорость хищничества M. pygmaeus на M. persicae
pygmaeus на M. persicae
Рис. 1.
Скорость хищничества Mea ± SE (количество тлей в час) нимф и взрослых особей M. pygmaeus на M. persicae во время светлой или темной фазы при различных температурах. Средние значения каждой стадии жизни, за которыми следует одна и та же буква, не имели значимых различий при разных температурах (тест Tukey-Kramer HSD, P <0,05).
Рис. 1.
Mea ± SE Скорость хищничества (количество тлей в час) нимф и взрослых особей M. pygmaeus на M.persicae во время светлой или темной фазы при разных температурах. Средние значения каждой стадии жизни, за которыми следует одна и та же буква, не имели значимых различий при разных температурах (тест Tukey-Kramer HSD, P <0,05).
особенно при 30 ° C.
Для баклажанов значительные различия в скорости хищничества между светлой и темной фазами при световом периоде 8:16 ч (Д: Д) были обнаружены у самок при 25 ° C и у нимф пятого возраста и самок при 30 °. С (рис. 2). При фотопериоде 12:12 ч (L: D) значимые различия были обнаружены у пятых возрастов и самок при 25 ° C, четвертом и пятом возрастах, а также у самок при 30 ° C. Наконец, при фотопериоде 16: 8 ч (L: D) различия были зарегистрированы в четвертом и пятом возрастах и у самок при 30 ° C.
Наконец, при фотопериоде 16: 8 ч (L: D) различия были зарегистрированы в четвертом и пятом возрастах и у самок при 30 ° C.
Рис. 2.
Скорость хищничества (потребление тли в час) (среднее ± стандартная ошибка) нимф и взрослых особей M. pygmaeus на M. persicae во время светлой и темной фазы при различных температурах и фотопериодах 8:16 (a), 12 : 12 (b) и 16: 8 (c) h (L: D) на баклажанах. Слева данные для 20 ° C; посередине данные для 25 ° C; справа, данные для 30 ° C. * Значительная разница в уровне хищничества во время светлой или темной фазы (тест Tukey-Kramer HSD, P <0.05).
Рис. 2.
Скорость хищничества (количество тлей в час) (среднее ± стандартная ошибка) нимф и взрослых особей M. pygmaeus на M. persicae во время светлой и темной фазы при разных температурах и фотопериодах 8:16 (a), 12:12 (b) и 16: 8 (c) h (L: D) на баклажанах. Слева данные для 20 ° C; посередине данные для 25 ° C; справа, данные для 30 ° C. * Значительная разница в скорости хищничества во время светлой или темной фазы (тест Tukey-Kramer HSD, P <0,05).
Для растений перца при световом периоде 8:16 ч (L: D) значительно более высокая скорость хищничества в темноте, чем на свету, была обнаружена в пятых возрастах при 20 ° C, у самок при 25 ° C и в третий, четвертый и пятый возрасты плюс самцы и самки при 30 ° C (рис.3). В течение фотопериода 12:12 ч (Д: Д) значимые различия были зарегистрированы у самок при 20 ° C, у пятых возрастов и у самок при 25 ° C, а также у самцов и самок третьего, четвертого и пятого возрастов. при 30 ° С (рис. 3). Наконец, при фотопериоде 16: 8 ч (L: D) уровень хищничества был значительно выше в темноте, чем в светлой фазе для самцов и самок при 25 ° C и для четвертого и пятого возрастов, а также самцов и самок на 30 ° С.
Рис. 3.
Скорость хищничества (количество тлей в час) (среднее ± стандартная ошибка) у нимф и взрослых особей M.pygmaeus на M. persicae во время светлой и темной фазы при разных температурах и фотопериодах 8:16 (a), 12:12 (b) и 16: 8 (c) h (L: D) на растениях перца. * Значительная разница в скорости хищничества во время светлой или темной фазы (тест Tukey-Kramer HSD, P <0,05).
Рис. 3.
Скорость хищничества (количество тлей в час) (среднее ± стандартная ошибка) нимф и взрослых особей M. pygmaeus на M. persicae во время светлой и темной фазы при различных температурах и фотопериодах 8:16 (a), 12:12 (b) и 16: 8 (c) h (L: D) на перца.* Значительная разница в скорости хищничества во время светлой или темной фазы (тест Tukey-Kramer HSD, P <0,05).
Статистический анализ также выявил одно значимое четырехстороннее взаимодействие видов растений, фотопериода, температуры и фазы света
на уровень хищничества M. pygmaeus (Таблица 1). Анализ этого взаимодействия показывает, что (1) в темной фазе уровень хищничества растений перца был намного выше, чем
на баклажанах, особенно при 30 ° C (рис.4), и (2) гораздо более высокий рост хищничества был зарегистрирован с 25 до 30 ° C в темноте, чем на свету при световых периодах 8:16 ч (Д: Д) и 12:12 ч (Д: Д). чем 16: 8 ч (Д: Д) (рис. 5).
Рис. 4.
Скорость хищничества (количество тлей в час) хищника M. pygmaeus на M. persicae на баклажане и перце.
растения при разных фотопериодах и температурах в темную фазу. Означает, что в каждом из них должны быть одинаковые заглавные буквы.
фотопериода и одинаковыми строчными буквами на каждом растении-хозяине при каждой температуре существенно не различаются (тест Tukey-Kramer HSD, P <0.05).
pygmaeus на M. persicae на баклажане и перце.
растения при разных фотопериодах и температурах в темную фазу. Означает, что в каждом из них должны быть одинаковые заглавные буквы.
фотопериода и одинаковыми строчными буквами на каждом растении-хозяине при каждой температуре существенно не различаются (тест Tukey-Kramer HSD, P <0.05).
Рис. 4.
Скорость хищничества (тлей в час) хищника M. pygmaeus на M. persicae на баклажане и перце. растения при разных фотопериодах и температурах в темную фазу. Означает, что в каждом из них должны быть одинаковые заглавные буквы. фотопериода и одинаковыми строчными буквами на каждом растении-хозяине при каждой температуре существенно не различаются (тест Tukey-Kramer HSD, P <0,05).
Рис. 5.
Средняя ± SE скорость хищничества (количество тлей в час) хищника M.pygmaeus на M. persicae при разных фотопериодах и температурах в светлой и темной фазах растений перца. Значения, за которыми следуют одни и те же заглавные буквы при каждой температуре и одни и те же маленькие буквы в светлой или темной фазе в пределах каждого фотопериода, существенно не различаются (тест Tukey-Kramer HSD, P <0,05).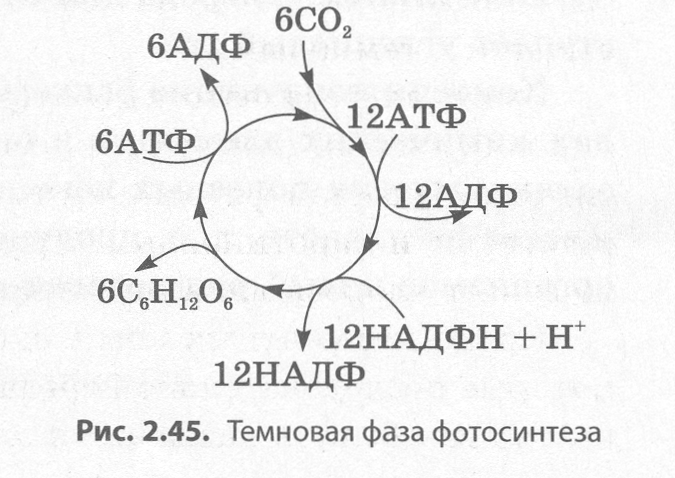
Рис. 5.
Средняя ± SE скорость хищничества (количество тлей в час) хищника M. pygmaeus на M. persicae при различных фотопериодах и температурах во время светлой и темной фаз растений перца.Значения, за которыми следуют одни и те же заглавные буквы при каждой температуре и одни и те же маленькие буквы в светлой или темной фазе в пределах каждого фотопериода, существенно не различаются (тест Tukey-Kramer HSD, P <0,05).
Обсуждение
Результаты по скорости хищничества M. pygmaeus в час при разных фотопериодах ясно показывают, что он предпочитает кормить больше в темноте, чем на светлой фазе (Таблица 1; Рис. 1-3). О слабом предпочтении хищника кормиться в темноте сообщалось только для растений перца в работе Perdikis et al.(1999), из-за более высокой 24-часовой скорости хищничества при фотопериодах 12:12 ч (Д: Д) и 8:16 ч (Д: Д), чем 16: 8 ч (Д: Д). Однако, как заявили авторы, это было признаком того, что хищник больше питается в темноте в эти фотопериоды (с длинной темной фазой). Мы также заметили, что хищник активен ночью. Однако результаты этого исследования показывают, что M. pygmaeus имеет более высокий уровень хищничества в темноте, чем на свету, на всех растениях-хозяевах и при всех фотопериодах и температурах.
Мы также заметили, что хищник активен ночью. Однако результаты этого исследования показывают, что M. pygmaeus имеет более высокий уровень хищничества в темноте, чем на свету, на всех растениях-хозяевах и при всех фотопериодах и температурах.
Предпочтение M. pygmaeus питаться в темноте было более значительным для более крупных возрастов и взрослых особей (рис. 2 и 3). Это, скорее всего, является следствием более высокой степени их хищничества по сравнению с более молодыми нимфами, как сообщалось Perdikis et al. (1999).
Склонность M. pygmaeus к более интенсивному питанию в темноте предполагает, что обонятельные сигналы могут быть важны при нахождении добычи на небольшом расстоянии. Вероятно, зрение играет довольно ограниченную роль в этом процессе, как было обнаружено у других хищных насекомых (Freund and Olmstead 2000).
Уровень хищничества M. pygmaeus в темноте зависел от растения-хозяина, и он был выше у растений перца, чем у баклажанов (рис. 4). Возможно, это связано с более высокими потребностями хищников в питании растений перца, чем баклажанов, где первые менее подходят для развития нимф, чем вторые, в отсутствие добычи (Perdikis and Lykouressis 1999). Кроме того, поверхность листьев баклажана гораздо более волосатая (5,53 ± 0,41 и 9,25 ± 0,49 волос / мм 2 на верхней и нижней поверхности соответственно), чем листья растений перца (0.05 ± 0,03 и 0,15 ± 0,07 волосков / мм ( 2 () на верхней и нижней поверхности соответственно) может увеличить количество времени, которое требуется хищнику, ищущему корм, чтобы найти свою добычу или справиться с ней (De Clercq et al. 2000). Таким образом, на листьях баклажана хищник может быть вынужден продолжить поиск в легкой фазе, что приведет к более высокому уровню хищничества в легкой фазе на баклажане, чем на перце.
4). Возможно, это связано с более высокими потребностями хищников в питании растений перца, чем баклажанов, где первые менее подходят для развития нимф, чем вторые, в отсутствие добычи (Perdikis and Lykouressis 1999). Кроме того, поверхность листьев баклажана гораздо более волосатая (5,53 ± 0,41 и 9,25 ± 0,49 волос / мм 2 на верхней и нижней поверхности соответственно), чем листья растений перца (0.05 ± 0,03 и 0,15 ± 0,07 волосков / мм ( 2 () на верхней и нижней поверхности соответственно) может увеличить количество времени, которое требуется хищнику, ищущему корм, чтобы найти свою добычу или справиться с ней (De Clercq et al. 2000). Таким образом, на листьях баклажана хищник может быть вынужден продолжить поиск в легкой фазе, что приведет к более высокому уровню хищничества в легкой фазе на баклажане, чем на перце.
Интересно, что разница в скорости хищничества M. pygmaeus в темной фазе между растениями перца и баклажанами становится больше при 30 ° C, чем при двух более низких температурах (рис.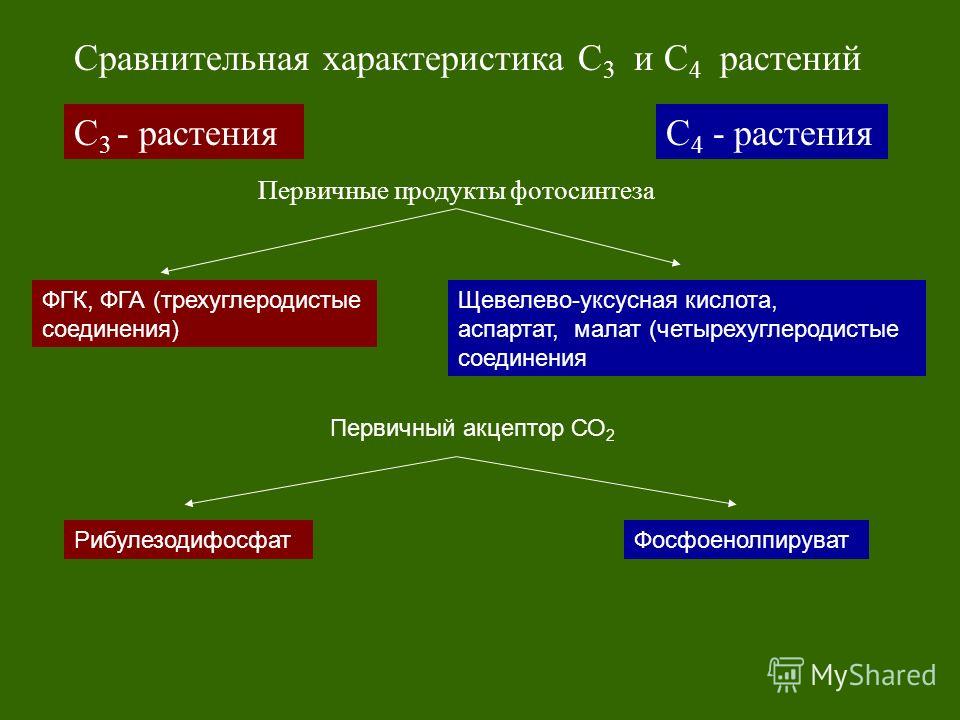 4). Кроме того, при содержании растений перца в течение долгих ночей (16 и 12 часов) контраст между скоростью хищничества при 30 ° C по сравнению с двумя другими температурами был намного больше, чем при коротких ночах (8 часов; рис. 5). Эта разница в скорости питания может быть результатом неблагоприятных температурных и влажностных условий на листьях безволосых растений перца при высоких температурах и особенно при длительных периодах освещения, поскольку характеристики листьев и условия окружающей среды влияют на микроклиматические условия на поверхности листьев (Willmer 1986).Во враждебной микросреде хищник, возможно, отказывается от поиска и предпочитает более интенсивный поиск в темноте. Подобное изменение пищевого поведения было зарегистрировано Pfannenstiel и Yeargan (2002) для хищника Colleomegilla maculata (DeGeer) (Coleoptera: Coccinellidae). , который, хотя и активен в течение дня, в теплые дни продолжает питаться до полуночи. Наконец,
4). Кроме того, при содержании растений перца в течение долгих ночей (16 и 12 часов) контраст между скоростью хищничества при 30 ° C по сравнению с двумя другими температурами был намного больше, чем при коротких ночах (8 часов; рис. 5). Эта разница в скорости питания может быть результатом неблагоприятных температурных и влажностных условий на листьях безволосых растений перца при высоких температурах и особенно при длительных периодах освещения, поскольку характеристики листьев и условия окружающей среды влияют на микроклиматические условия на поверхности листьев (Willmer 1986).Во враждебной микросреде хищник, возможно, отказывается от поиска и предпочитает более интенсивный поиск в темноте. Подобное изменение пищевого поведения было зарегистрировано Pfannenstiel и Yeargan (2002) для хищника Colleomegilla maculata (DeGeer) (Coleoptera: Coccinellidae). , который, хотя и активен в течение дня, в теплые дни продолжает питаться до полуночи. Наконец,
наиболее важным фактором, приводящим к этому результату, может быть то, что повышенные потребности в питании M. pygmeus , питающийся соком листьев растения перца, а не более питательными листьями баклажана (Perdikis and Lykouressis 1999), усиливается при 30 ° C. В этом случае должно произойти значительное увеличение скорости хищничества растений перца, особенно при этой температуре.
pygmeus , питающийся соком листьев растения перца, а не более питательными листьями баклажана (Perdikis and Lykouressis 1999), усиливается при 30 ° C. В этом случае должно произойти значительное увеличение скорости хищничества растений перца, особенно при этой температуре.
Знание условий, в которых хищник предпочитает кормиться, важно для поиска наиболее подходящего использования в биологическом контроле, а также важно при массовом выращивании (например, Jones et al.1977). Наши результаты показывают, что M. pygmaeus предпочтительно следует выпускать ближе к вечеру, потому что его более высокая скорость хищничества в ночное время может способствовать его укоренению. Кроме того, растения перца могут считаться более подходящими растениями-хозяевами, чем баклажаны, для индукции более высокого уровня хищничества. by M. pygmaeus , когда температура относительно высока и темная фаза затягивается.
Следовательно, на уровень хищничества у хищных насекомых может влиять растение-хозяин и внутри каждого растения-хозяина различные комбинации света и температуры.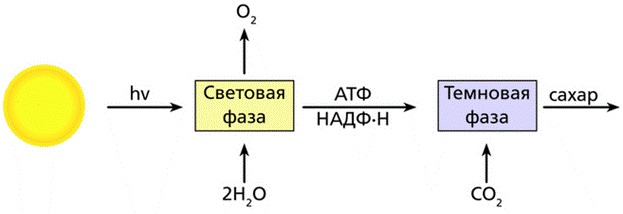 Следовательно, следует оценивать как влияние отдельных факторов, так и их взаимодействие, чтобы уточнить влияние «общей среды», в которой хищник добывает корм, на скорость своего хищничества. Изменение микроклиматических условий в пределах растительного покрова в течение дня может привести к эмиграции от менее подходящего растения-хозяина к более подходящему. Таким образом, потенциал хищника может быть увеличен при смешанном культивировании не только из-за большей доступности типов пищи (добыча, сок растений или пыльца) и убежищ, но и за счет предоставления ему возможности выбрать наиболее подходящее растение-хозяин для кормодобывания в определенных условиях. условия окружающей среды.Однако на продуктивность многоядного хищника могут влиять дополнительные факторы, влияющие на условия освещения, такие как альтернативная добыча, распределение добычи или поисковое поведение на растении, что требует дальнейшего изучения.
Следовательно, следует оценивать как влияние отдельных факторов, так и их взаимодействие, чтобы уточнить влияние «общей среды», в которой хищник добывает корм, на скорость своего хищничества. Изменение микроклиматических условий в пределах растительного покрова в течение дня может привести к эмиграции от менее подходящего растения-хозяина к более подходящему. Таким образом, потенциал хищника может быть увеличен при смешанном культивировании не только из-за большей доступности типов пищи (добыча, сок растений или пыльца) и убежищ, но и за счет предоставления ему возможности выбрать наиболее подходящее растение-хозяин для кормодобывания в определенных условиях. условия окружающей среды.Однако на продуктивность многоядного хищника могут влиять дополнительные факторы, влияющие на условия освещения, такие как альтернативная добыча, распределение добычи или поисковое поведение на растении, что требует дальнейшего изучения.
Это исследование показывает, что M. pygmaeus подвергается хищничеству больше в темноте, чем на свету. Кроме того, как биотические (тип растения), так и абиотические факторы (легкая фаза
и температура) взаимодействуют в своем влиянии на пищевые предпочтения хищника.Результаты предсказывают, что смешанные культуры могут обеспечить более высокое экологическое разнообразие, позволяя хищнику преодолевать возможные неблагоприятные воздействия микроклиматических условий. В конечном счете, это исследование демонстрирует более полное знание факторов, влияющих на уровень хищничества M. pygmaeus , с важными последствиями при его использовании для биологической борьбы.
В заключение, в этом исследовании было показано, что абиотические и биотические факторы, влияющие на скорость хищничества, взаимодействуют и могут влиять на поиск пищи хищниками и, следовательно, на скорость хищничества.Следовательно, следует поощрять такие исследования, поскольку они играют ключевую роль в определении наиболее подходящих комбинаций, которые будут использоваться для лучшего биологического контроля над насекомыми-вредителями.
Цитированные источники
.
Текущее и возможное использование многоядных хищников
.Комплексная борьба с болезнями вредителей в тепличных культурах. R Albajes, M Lodovica Gullino, J. C. van Lenteren, Y Elad, ed. Дордрехт, Нидерланды, Kluwer Academic Publishers
.1999
,265
—275
..
Торможение движения личинок конвергентной божьей коровки трихомами листьев табака
.Environ. Энтомол
.1982
,11
:91
—94
..
Распространение трех видов набисов (Hemiptera: Nabidae) внутри растений и влияние N
.roseipennis в популяциях зеленого клеверного червя на сое.Environ. Энтомол
.1989
,18
:240
—244
..
Обитание и питание растениями у хищных Heteroptera
.Хищные гетероптеры: их экология и использование в биологической борьбе. М. Колл, Дж. Р. Руберсон, изд. Лэнхэм, доктор медицины, Энтомологическое общество Америки
.1998
, 89-130..
Функциональные и числовые реакции Orius insidiosus (Heteroptera: Anthocoridae) на добычу в различных овощных культурах
.Ann. Энтомол. Soc. Am
.1995
,88
:732
—738
..
Биологический контроль со стороны естественных врагов
.Кембридж, Великобритания
,Cambridge University Press
,1991
..
Влияние растения-хозяина на функциональную реакцию хищника Podisus nigrispinus (Heteroptera: Pentatomidae)
.Biol. Контроль
.2000
,18
:65
—70
..
Роль зрения и обоняния усиков в среде обитания и местонахождении добычи у трех хищных гетероптероптероптеропрылых
.Environ. Энтомол
.2000
,29
:721
—732
..
Растения-хозяева влияют на приспособленность хищников через питательную ценность добычи травоядных: исследование системы растение-тля-божья коровка
.БиоКонтроль
.2002
,47
:1
—21
..
Влияние архитектуры растений на продуктивность кормления стаи божьих коровок, питающихся тлей
.Oecologia (Berl.)
.1992
,92
:399
—404
..
Роль зрения и цвета в кормлении в непосредственной близости от четырех видов кокцинеллид
.Oecologia (Berl.)
.1998
,115
:287
—292
..
Diel Периодичность кормления, спаривания и яйцекладки взрослых особей Chrysopa carnea
.Ann. Энтомол. Soc. Am
.1977
,70
:60
—62
..
Тритрофические эффекты простой архитектурной мутации у растений гороха
.Природа (Лондон)
.1990
,345
:433
—434
..
Ch, Chalkia Ch
.A. Воздействие естественных врагов на популяции тли при переработке томатов в центральной Греции. Энтомол. Hellenica
.1999-2000
,13
:135
—142
..
Многоядные мириды в Греции: растения-хозяева и изобилие ловушек, установленных на некоторых культурах
.Boll. Лаборатория. Энтомол. Agr. Филиппо Сильвестри
.2000
,56
:57
—68
..
Ч, Михалаки М
.P. Развитие нимф и выживаемость Macrolophus pygmaeus Rambur (Hemiptera: Miridae) на двух разновидностях баклажанов в зависимости от температуры и наличия / отсутствия добычи. Биол. Контроль
.2001
,20
:222
—227
..
Diel Ритмичность поисковой активности и ее преобладание над голоданием у божьей коровки Coccinella septempunctata
.Physiol. Энтомол
.1987
,12
:91
—98
..
Фитофагия хищных Heteroptera: влияние на жизненный цикл и динамику популяций
.Зоофитофаг Heteroptera: значение для жизненного цикла и комплексная борьба с вредителями. О Аломар, Р. Виденманн, изд.Лэнхэм, доктор медицины, Энтомологическое общество Америки
.1996
, 57-93..
Популяции тли и их естественные враги на свежих помидорах с рынка в центральной Греции
.Бык. IOBC / WPRS
.1996
,19
:33
—37
..
Ch, Lykouressis D
.P. Развитие и гибель нимфальных стадий хищного клопа Macrolophus pygmaeus при содержании при разных температурах и на разных растениях-хозяевах.Бык. IOBC / WPR
.1999
,22
:137
—144
..
Влияние различных диет, растений-хозяев и температуры на развитие и выживаемость Macrolophus pygmaeus Rambur (Hemiptera: Miridae)
.Biol. Контроль
.2000
,17
:55
—60
..
Ch, Lykouressis D
.P. Температурные потребности развития многоядного хищника Macrolophus pygmaeus (Hemiptera: Miridae).Environ. Энтомол
.2002
,31
:661
—667
..
Ch, Lykouressis D
.P, Economou L. P. Влияние температуры, фотопериода и типа растений на скорость хищничества Macrolophus pygmaeus Rambur на Myzus persicae. Биоконтроль
.1999
,44
:281
—289
..
Предпочтение к яйцекладке и распределение яиц в отобранных полевых и овощных культурах Nabis roseipennis (Hemiptera: Nabidae)
.J. Entomol. Sci
.1998
,33
:82
—89
..
Идентификация и образцы активности хищников, атакующих яйца Helicoverpa zea (Lepidoptera: Noctuidae) в сое и сладкой кукурузе
.Environ. Энтомол
.2002
,31
:232
—241
..
Взаимодействие между тремя трофическими уровнями: влияние растений на взаимодействия между насекомыми-травоядными и естественными врагами
.Annu. Rev. Ecol. Syst
.1980
,11
:41
—63
..Статистика запуска JMP. Руководство по статистике и анализу данных, версия 4.0.2. Кэри, Северная Каролина, Институт SAS
,2000
..
Микроклиматическое воздействие на насекомых на поверхности растений. Насекомые и поверхность растений
.B Можжевельник, T.R.E Southwood, ed
.Лондон, Великобритания
,Эдвард Арнольд
.1986
, 65-80.© 2004 Энтомологическое общество Америки
Темные реакции фотосинтеза
Эта страница создана Джимом Бидлаком, Университет Центральной Оклахомы, на основе оригинальной деятельности Бьёрна Виднеса, Норвежский центр научного образования, Като Тандберг, Университет Осло, Венче Эрлиен, Норвежский центр научного образования, Грэм Кент, Грант-колледж, Джойс Диван, Политехнический институт Ренсселера, Джон Кирк, Science Graphics, Родни Бойер, John Wiley & Sons Publishers, Inc., Майк Тайри, Технологический институт Вирджинии, и Джон Уайтмарш и Говинджи, Университет Иллинойса в Урбана-Шампейн.
Профиль автораЭта страница впервые обнародована: 11 августа 2010 г.
Этот материал был первоначально разработан Мерло
в рамках сотрудничества с Педагогическая служба SERC.
Сводка
Рисунки и визуализации используются, чтобы помочь участникам представить себе место и шаги, участвующие в темных реакциях фотосинтеза.
Цели обучения
Контекст использования
Эта стратегия обучения темновым реакциям фотосинтеза предусматривает одно- или двухчасовую презентацию с рисунками и визуализацией того, как углекислый газ «фиксируется» циклом Кальвина для облегчения накопления энергии в форме углеводов.
Описание и учебные материалы
Вспомогательные файлы:
Учебные заметки и советы
Эта стратегия обучения предлагает более практический подход к темным реакциям фотосинтеза, который помогает учащимся визуализировать, как углекислый газ попадает в лист и преобразуется в запасенную энергию. Обычно студентам требуется две лекции, чтобы полностью понять, когда и как возникают эти реакции. С помощью рисунков и визуализаций клеток листа и происходящих реакций учащиеся получают более практическое представление о том, как происходят эти процессы.Прежде чем приступить к этой теме, участники должны иметь некоторое представление о морфологии растений и клеточной биологии. Обычно есть хорошее понимание того, где происходят реакции, но немного сложнее понять конкретные шаги. Анимации и визуализации этих тем (см. Ссылки и ресурсы ниже), перемежающиеся во время обсуждения, помогают участникам продолжать активно участвовать в процессе обучения.
Оценка
Участники могут быть проверены на понимание этого учебного материала с помощью экзаменов с несколькими вариантами ответов, коротких ответов или сочинений.Несколько примеров вопросов включены в Рабочую таблицу, озаглавленную «Вопросы — Темные реакции фотосинтеза».
Ссылки и ресурсы
Описание MERLOT и ссылка на «Растения C3, C4 и CAM», где представлена информация о фотодыхании и альтернативных путях у растений C4. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=444380
.Описание MERLOT и ссылка на «Цикл Кальвина (фотосинтез)», который представляет собой сайт, на котором представлена анимированная трехступенчатая версия темных реакций фотосинтеза.См. Http://www.merlot.org/merlot/viewMaterial.htm?id=79769
.Описание MERLOT и ссылка на «Цикл Кальвина — фотосинтетические реакции углерода», в котором содержатся подробные сведения о каждом из этапов цикла Кальвина, молекулярные структуры и информация об участвующих ферментах. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=481172
.Описание MERLOT и ссылка на «Темные реакции фотосинтеза», где представлена анимация цикла Кальвина, а также детали задействованных молекулярных структур.См. Http://www.merlot.org/merlot/viewMaterial.htm?id=481167
.Описание MERLOT и ссылка на «Интерактивное анимированное руководство по фотосинтезу», которое включает обзор световых и темных реакций фотосинтеза, а также фотодыхания. См. Http://www.merlot.org/merlot/viewMaterial.htm?id=80033
.Описание MERLOT и ссылка на «Видео о фотосинтезе», которое предоставляет отличный обзор и руководство о том, где происходит фотосинтез в листе. См. Http: //www.

