Температура кипения жидкостей при атмосферном давлении. Таблица. Температура кипения этилового спирта и других жидкостей.
|
ЖИДКОСТИ Температуры кипения — Энциклопедия по машиностроению XXL
Более выгодны и удобны по сравнению с воздушными паровые компрессорные холодильные установки, позволяющие в области насыщенного пара осуществить изотермические отвод и подвод теплоты, отбираемой у охлаждающей среды, и приблизить холодильный цикл к обратному циклу Карно.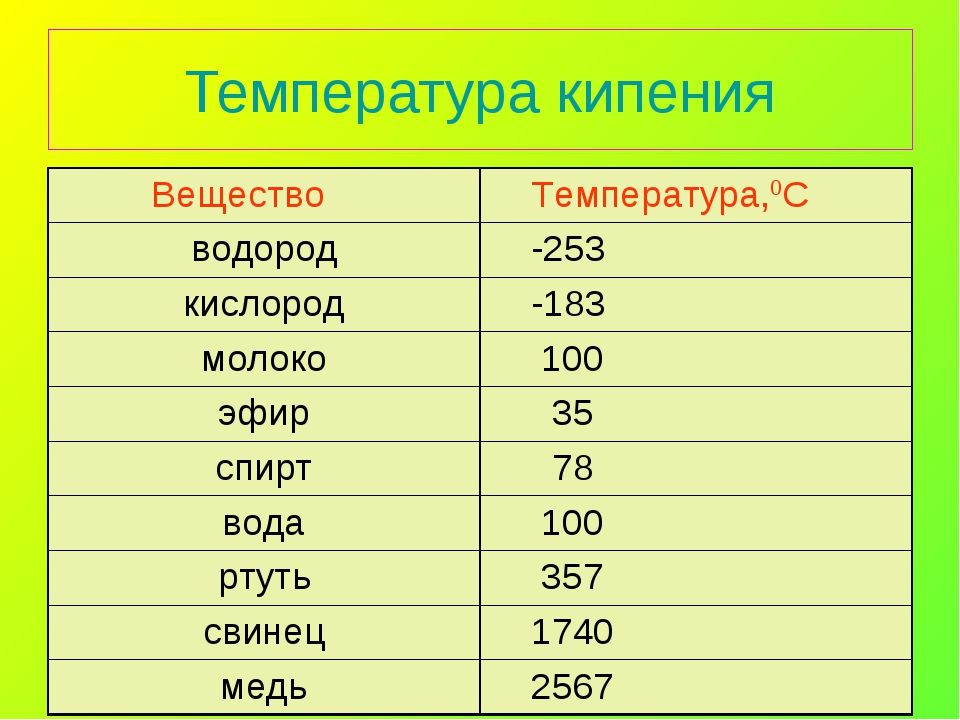
Метод измерения температуры кипения применим для относительно чистых химических соединений и редко используется для сложных жидкостей. Температура кипения может быть определена путем нагревания продукта и последующей дистилляции и конденсации или путем экстраполирования данных по давлению насыщенных паров. Чаще определяют пределы выкипания жидкостей, а не температуру кипения. [c.118]
Термостат (рис. 32) состоит из корпуса, гофрированного латунного цилиндра, штока и двойного клапана. Внутри гофрированного латунного цилиндра налита жидкость, температура кипения которой 70—75° С. Когда двигатель не прогрет, клапан термостата закрыт (рис. 32, а) и циркуляция происходит по малому кольцу водяной насос — рубашка охлаждения — термостат — насос.
Ориентировочный интервал рабочих Жидкость Температура кипения при Фактор переноса Л -10- , кВт/м Материалы [c.436]
В лабораторной практике применяют водяные, песчаные и воздушные электрические бани. Максимальная температура нагрева электрических водяных бань 100° С включая их в сеть через реостат, можно регулировать температуру нагрева. Электрические песочные бани применяют для нагревания веществ до 400° С. Нагревающей средой служит песок, предварительно очищенный прокаливанием в вытяжном шкафу. Преимуществом этих бань является то, что они дают относительно постоянную температуру нагревания. Воздушные бани применяют для нагревания жидкостей, температура кипения которых выше 100° С. Максимальная температура нагрева на таких банях 250° С.
Вода, обладающая значительной теплоемкостью, равной 4,186 кДж/(кг °С), является наиболее распространенной охлаждающей жидкостью. Температура кипения воды, при нормальных условиях равная 100°С, умень-
[c.62]
Температура кипения воды, при нормальных условиях равная 100°С, умень-
[c.62]
В качестве охлаждающих жидкостей, замерзающих при низкой температуре, обычно используют водные растворы этиленгликоля, представляющего собой жидкость, температура кипения которой равна 198°С, а температура плавления 11,5°С Теплоемкость этиленгликоля составляет 2,93 кДж/(кг-°С). Будучи добавленным к воде, этиленгликоль образует смесь, имеющую температуру замерзания ниже температуры замерзания воды. В зависимости от его содержания температура замерзания смеси этиленгликоль— вода изменяется в пределах от О до —75°С. Наибольшее распространение для охлаждения автомобильных двигателей внутреннего сгорания получили жидкости с температурой замерзания —40 и -65 °С. [c.64]
Температура кипения жидкости зависит от давления и природы жидкости. Для данной жидкости температура кипения является функцией только давления или каждому давлению соответствует строго определенная температура насыщенного пара, равная температуре кипения.
 [c.215]
[c.215]Температура кипения. Это важнейший показатель, определяющий предельно допустимую рабочую температуру гидропривода тормозов. Для большей части современных тормозных жидкостей температура кипения в процессе эксплуатации снижается из-за их высокой гигроскопичности. К этому приводит попадание воды, главным образом за счет конденсации из воздуха. Поэтому наряду с температурой кипения сухой тормозной жидкости определяют температуру кипения увлажненной жидкости, содержащей 3,5 % воды.
Термостат (рис. 25) состоит из корпуса, гофрированного латунного цилиндра, штока и двойного клапана. Внутрь гофрированного латунного цилиндра налита жидкость, температура кипения которой 70…75°С. Когда двигатель не прогрет, клапан термостата закрыт (см. рис. 25, а), и циркуляция происходит по малому кольцу водяной насос — полость охлаждения — термостат— перепускной шланг — насос. [c.42]
Испарение жидкости. Температуры кипения и конденсации жидкости являются функцией давления причем чем ниже давление, тем ниже температура кипения. В качестве хладагентов часто используют вещества, которые при высоком давлении и при
[c.105]
В качестве хладагентов часто используют вещества, которые при высоком давлении и при
[c.105]
Бурный процесс парообразования, сопровождающийся возникновением пузырьков пара по всему объему жидкости, называется кипением. Кипение жидкости происходит при постоянном давлении и при соответствующей ему постоянной температуре, которая называется температурой кипения или насыщения и обозначается 4- Для всех жидкостей температура кипения повышается с увеличением давления, зависимость между ними находится из опыта и в общем случае выражается уравнением н=/(р). Для различных жидкостей и воды имеется большое количество эмпирических уравнений, позволяющих приближенно установить зависимость tn=f p). В качестве примера для воды можно привести уравнение Руша, которое имеет вид [c.102]
Как уже было сказано, опытами установлено, что каждому давлению соответствует определенная температура кипения данной жидкости, а следовательно, и ее насыщенного пара, причем для всех жидкостей температура кипения возрастает с повышением давления.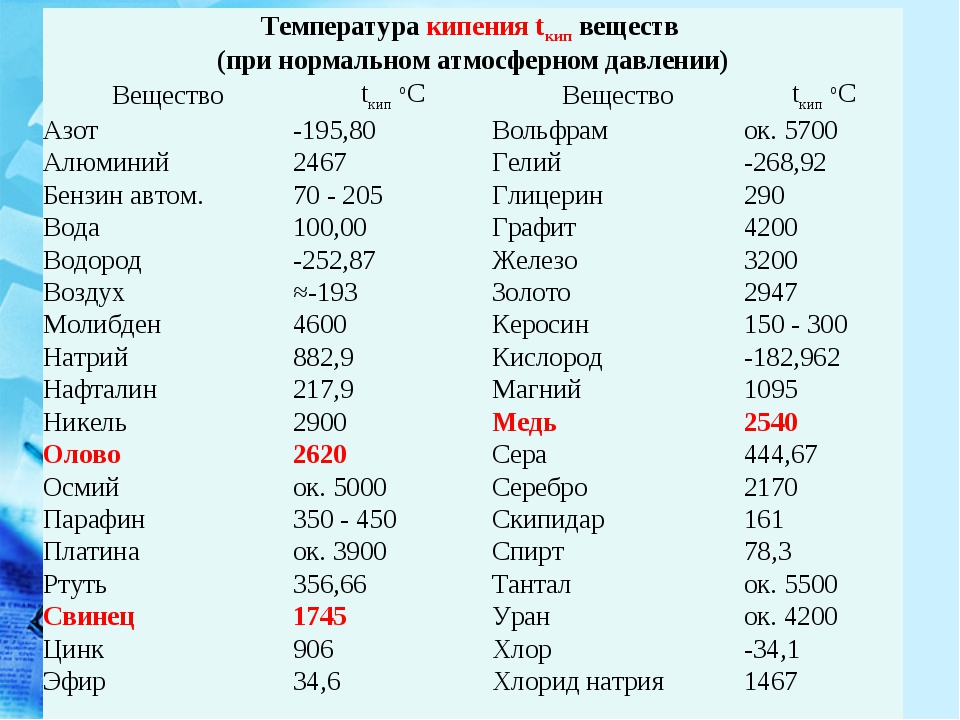
Жидкость Температура кипения, °С Теплота испарения, кал Жидкость Температура кипения, Теплота испарения. кал [c.21]
Регулятор температуры прямого действия РПД (фиг. 30-25). Термобаллон регулятора заполнен жидкостью, температура кипения которой немного ниже заданного значения регулируемой температуры. При изменении последней изменяется давление насыщенных паров рабочей жидкости, что приводит к соответствующему перемеще нию регулирующего органа. Регулятор статический перемещение регулирующего органа от одного крайнего положения до другого происходит при изменении регулируемой температуры на 10° С. Приспособлений для изменения передаточного коэффициента регулятор [c.530]
Начальное состояние воды, находящейся под давлением р и имеющей температуру О °С, изобразится на диаграмме точкой ао. При подводе теплоты к воде ее температура постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению.
Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму /, каждая точка которой соответствует состоянию 1 кг воды при О °С и давлении р, нижнюю пограничную кривую II, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую УУ/, дающую зависимость удельного объема сухого насыщенного пара от давления.
Пример 9. Смесь углеводородов, содержащая 0,30 молей изобутана, 0,50 молей гексана и 0,20 молей нормального октана, приведена в равновесие при 250 °F (121,1 °С) и 100 фунт/дюйм-(7,03 кГ/см ).
 Определить число молей жидкости и число молей пара при этих условиях, а также температуру кипения и температуру конденсации при давлении системы.
[c.290]
Определить число молей жидкости и число молей пара при этих условиях, а также температуру кипения и температуру конденсации при давлении системы.
[c.290]Первый этап относительно медленного охлаждения называется стадией пленочного кипения, второй этап быстрого охлаждения — стадией пузырчатого кипения. Когда температура поверхности металла ниже температуры кипения жидкости (при охлаждении в воде — ниже 100°С), жидкость кипеть уже не будет, и охлаждение замедлится. Этот третий этап охлаждения носит название стадии конвективного теплообмена. [c.291]
Замедленное охлаждение называют стадией пленочного кипения-, ускоренное охлаждение — стадией пузырчатого кипения. Однако когда температура поверхности металла достигает точки ниже температуры кипения жидкости, охлаждение замедляется. Это — стадия конвективного теплообмена. [c.125]
Критическое состояние вещества впервые было открыто Д. И. Менделеевым в 1861 г. Критическую температуру Д. И. Менделеев назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т. е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром).
[c.44]
И. Менделеев назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т. е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром).
[c.44]
Д. И. Менделеев дал следующее определение Абсолютной температурой кипения я называю такую температуру, при которой частицы жидкости теряют свое сцепление (поднятие в капиллярной трубке равно нулю, скрытое тепло равно нулю) и при которой жидкость, несмотря ни на какое давление и объем вся превращается в пар- . Многочисленные опыты с реальными газами полностью подтвердили существование критической точки, в которой исчезает различие между газообразной и жидкой фазами. [c.44]
Пограничные кривые делят диаграмму натри части влево от АК располагается область жидкости, между кривыми АК и КВ область влажного пара, вправо от КВ и вверх от точки К — область перегретого пара. В области жидкости процесс нагрева 1 кг воды от температуры 0° С до температуры кипения происходит по изобаре АаА , которая практически сливается с нижней пограничной кривой.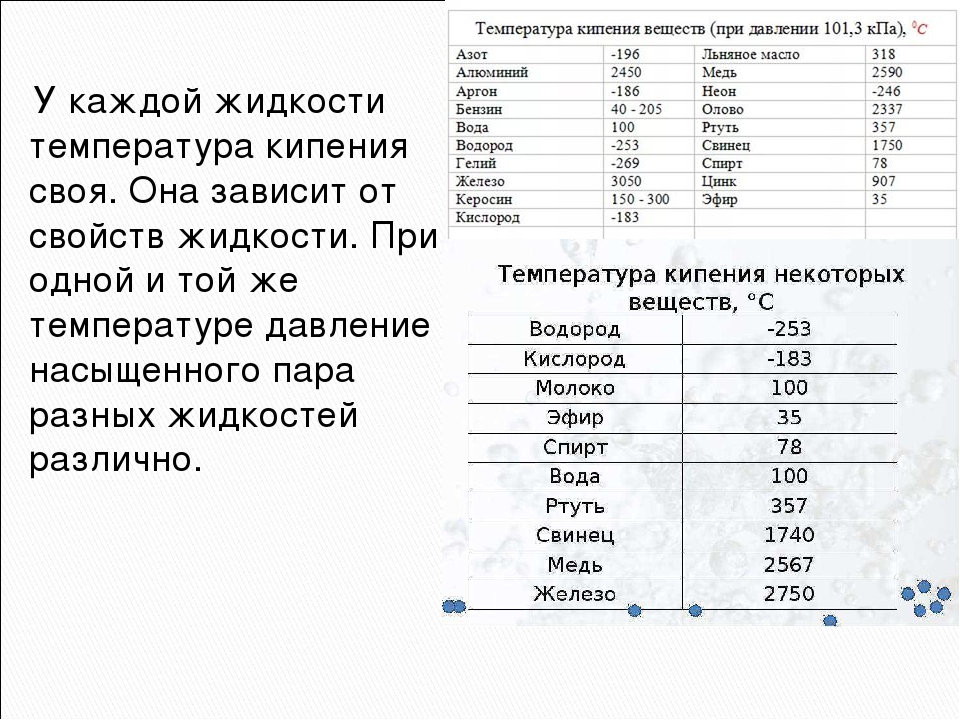 [c.185]
[c.185]
На рис. 19-4 изображен идеальный цикл Ренкина в pv-ma-грамме. Точка 4 характеризует состояние кипящей воды в котле при давлении pi. Линия 4-5 изображает процесс парообразования в котле затем пар подсушивается в перегревателе — процесс 5-6, 6-1 — процесс перегрева пара в перегревателе при давлении pi. Полученный пар по адиабате 1-2 расширяется в цилиндре парового двигателя до давления р2 в конденсаторе. В процессе 2-2 пар полностью конденсируется до состояния кипящей жидкости np>i давлении р2, отдавая теплоту парообразования охлаждающей воде. Процесс сжатия воды 2 -3 осуществляется в насосе получающееся при этом повышение температуры воды ничтожно мало, и им в исследованиях при давлениях до 30—40 бар пренебрегают. Линия 3-4 изображает изменение объема воды при нагревании от температуры в конденсаторе до температуры кипения. Работа насоса изображается заштрихованной площадью 032 7. Энтальпия пара при выходе из перегревателя в точке 1 равна h и в Ts-диаграмме (рис.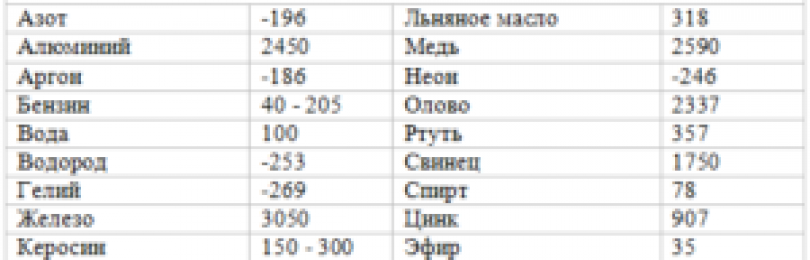 19-5) изображается пл. 92 34617109. Энтальпия пара при входе в конденсатор в точке 2 равна jg и в Ts-диаграмме изображается пл. 92 27109. Энтальпия воды при выходе из конденсатора в точке 2
[c.298]
19-5) изображается пл. 92 34617109. Энтальпия пара при входе в конденсатор в точке 2 равна jg и в Ts-диаграмме изображается пл. 92 27109. Энтальпия воды при выходе из конденсатора в точке 2
[c.298]
Эффектианссть теоретического цикла воздушной холодильной установки могла бы быть выше, если бы процессы отбора теплоты из охлаждаемого объема и отдачи теплоты воздухом в охладителе проводить не по изобарам, а по изотермам. Такую перестройку цикла удается осуществить, если в качестве холодильного агента использовать влажный пар жидкости, температура кипения которой при атмосферном давлении ниже 0°С. В этом случае хладоагент используется в двух фазах — [c.222]
Регулятор температуры состоит из герметичной термосистемы и регулируро-щего клапана. Термометрическая система, в свою очередь, состоит из приемника, капилляра и силь-фона. Система заполнена летучей жидкостью, температура кипения которой несколько ниже наименьшей температуры регулирования для данного типа РПД.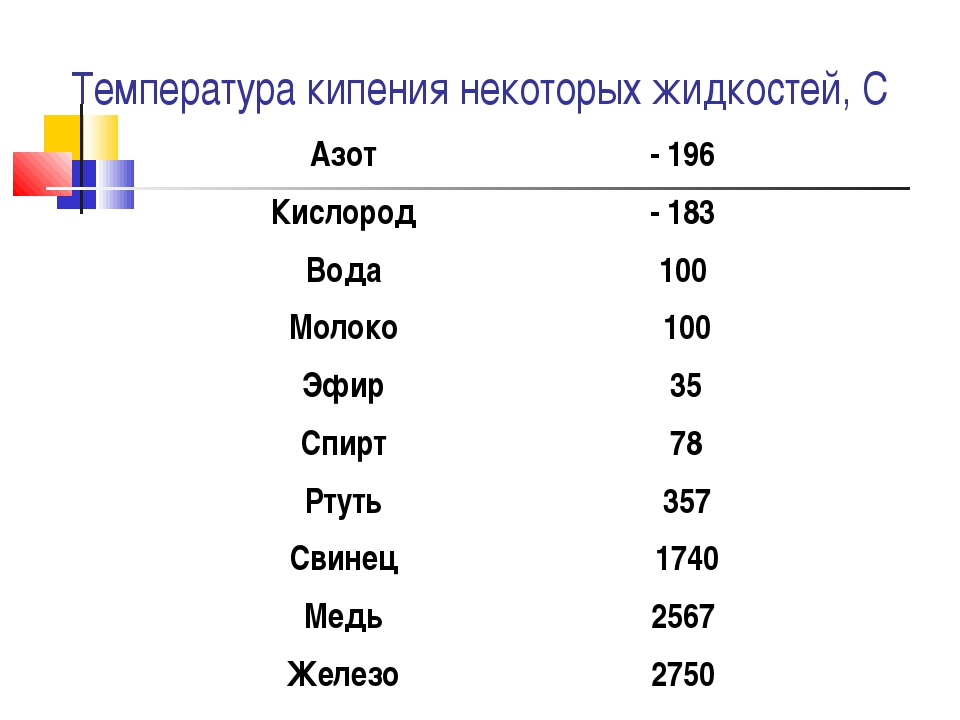 [c.73]
[c.73]
Сероуглерод (двусернистый углерод, S2). Бесцветная прозрачная жидкость температура кипения 46,26 С, плавления—минус 112,1 С. Хорошо растворяет жиры, масла, смолы, каучук, серу, фосфор, йод, смешивается с эфиром, спиртом, хлороформом с водой не смешивается. Ядовит, пожаро- и взрывооиа-сен. [c.309]
Бром технический Вг (молекулярная масса 159,808) — темно-красно-бурая тяжелая (плотностью 3,119 г/см ) легко летучая едкая с ре.зким. запахом жидкость. Температура кипения 58,8° С, температура плавления — 7,4° С, растворимость в воде 3,5%. Бром выпускается двух марок (ГОСТ 454—76) с содержанием основного вещества 99,9 (марка А) и 99,5% (марка Б). [c.421]
Гданьскому стеклодуву Фаренгейту человечество обязано началом серийного производства термометров и выбором в качестве рабочей жидкости ртути (1714 г.). В шкале Фаренгейта уже достаточно определенно воспроизведены три фиксированные точки. Температура тела здорового человека принималась равной 12 градусам промежуточная температура таяния чистого льда, согласно измерениям, оказалась равной 4 градусам. Градусы Фаренгейта получились вначале неудобно большими. Для более тонких отсчетов Фаренгейт трижды последовательно делил их пополам, что привело к восьмикратному уменьшению единицы. При этом температура таяния льда стала равной 32 градусам, а температура тела человека — 96 градусам. Температура таяни.я льда в те времена предполагалась ненадежной, поскольку уже были известны случаи переохлаждения жидкостей. Температура кипения воды была вначале величиной производной и равной 212 градусам. Фаренгейт провел изыскания надежных фиксированных точек шкалы и установил, что температура смеси льда с водой стабильна при значительной вариации внешних условий, а температура кипения воды зависит от барометрического давления. Шкала Фаренгейта получила широкое распространение. В 1736 г. точки замерзания и кипения воды при фиксированном барометрическом давлении были приняты в качестве основных для всех шкал.
[c.11]
Градусы Фаренгейта получились вначале неудобно большими. Для более тонких отсчетов Фаренгейт трижды последовательно делил их пополам, что привело к восьмикратному уменьшению единицы. При этом температура таяния льда стала равной 32 градусам, а температура тела человека — 96 градусам. Температура таяни.я льда в те времена предполагалась ненадежной, поскольку уже были известны случаи переохлаждения жидкостей. Температура кипения воды была вначале величиной производной и равной 212 градусам. Фаренгейт провел изыскания надежных фиксированных точек шкалы и установил, что температура смеси льда с водой стабильна при значительной вариации внешних условий, а температура кипения воды зависит от барометрического давления. Шкала Фаренгейта получила широкое распространение. В 1736 г. точки замерзания и кипения воды при фиксированном барометрическом давлении были приняты в качестве основных для всех шкал.
[c.11]
Схема абсорбционной холодильной установки дана на рис.
 1.92. Рассмотрим работу установки с наиболее часто применяемой водоаммиачной смесью. В генератор 1 поступает концентрированный водоаммиачный раствор. За счет теплоты, отдаваемой обогревающим телом, движущимся внутри змеевика, из этой бинарной смеси жидкостей испаряется главным образом та жидкость, температура кипения которой ниже, т. е. в данном случае аммиак. Образовавшиеся пары определенного давления р проходят из генератора в конденсатор 2, где, охлаждаемые водой, конденсируются при постоянном давлении. Жидкость после конденсатора проходит дроссельный вентиль 3, в котором давление ее падает до и поступает в испаритель 4. Отбирая здесь тепло от рассола, циркулирующего между испарителем и охлаждае-
[c.138]
1.92. Рассмотрим работу установки с наиболее часто применяемой водоаммиачной смесью. В генератор 1 поступает концентрированный водоаммиачный раствор. За счет теплоты, отдаваемой обогревающим телом, движущимся внутри змеевика, из этой бинарной смеси жидкостей испаряется главным образом та жидкость, температура кипения которой ниже, т. е. в данном случае аммиак. Образовавшиеся пары определенного давления р проходят из генератора в конденсатор 2, где, охлаждаемые водой, конденсируются при постоянном давлении. Жидкость после конденсатора проходит дроссельный вентиль 3, в котором давление ее падает до и поступает в испаритель 4. Отбирая здесь тепло от рассола, циркулирующего между испарителем и охлаждае-
[c.138]НОСТЬЮ. Эти приборы используются для регулирования температуры в пределах от 30 до 110°, а точность регулирования (чувствительность прибора) находится в пределах 5°. Измерительным элементом в терморегуляторе типа РПДТ служит система, состоящая из термопатрона, капилляра и сильфона. Термопатрон, помещенный в ванну, заполнен жидкостью, температура кипения которой несколько ниже значения регулируемой температуры. При иовыщении температуры возрастает давление насыщенных паров жидкости, заполняющих систему, вследствие чего сильфов растягивается и, преодолевая противодействие пружины, прикрывает связанный с ним плунжер клапана. При этом поступление пара уменьшается и температура снижается. При дальнейшем снижении температуры в ванне уменьщается давление паров в системе, пружина преодолевает З силие, развиваемое сильфоном, клапан открывается и пар поступает вновь. Настройка прибора на заданную температуру производится путем различной затяжки пружины при помощи гайки. Клапаны регуляторов имеют диаметры проходов 1 1,5 фиг. 48, Установка для автоматиче-и 2 дюйма и рассчитаны на условное давление до 16 кг/см .
[c.59]
Термопатрон, помещенный в ванну, заполнен жидкостью, температура кипения которой несколько ниже значения регулируемой температуры. При иовыщении температуры возрастает давление насыщенных паров жидкости, заполняющих систему, вследствие чего сильфов растягивается и, преодолевая противодействие пружины, прикрывает связанный с ним плунжер клапана. При этом поступление пара уменьшается и температура снижается. При дальнейшем снижении температуры в ванне уменьщается давление паров в системе, пружина преодолевает З силие, развиваемое сильфоном, клапан открывается и пар поступает вновь. Настройка прибора на заданную температуру производится путем различной затяжки пружины при помощи гайки. Клапаны регуляторов имеют диаметры проходов 1 1,5 фиг. 48, Установка для автоматиче-и 2 дюйма и рассчитаны на условное давление до 16 кг/см .
[c.59]
Понижение давления при П. может быть осуществлено двумя путями или непосредственно—путем создания вакуума насосом или эжектором или же косвенно—П. с водяным паром. Второй путь по самому существу своему м. б. применяем лишь для несмешивающихся с водой жидкостей, напр, при П. нефтяных и каменноугольных погонов, эфирных масел, скипидара, высших жирных к-т и т. п. Степень понижения давления при П. с острым паром и количество потребного для этого пара м. б. подсчитаны по вышеприведенной ф-ле Ванклина, причем практич. цифры расхода пара всегда несколько выше, нежели вычисленные по приведенной ф-ле, в силу неполноты насыщения водяных паров парами перегоняемой жидкости. Температура кипения смеси двух несмешивающихся жидкостей в случае насыщенного состояния их паров всегда ниже, нежели
[c.61]
с водяным паром. Второй путь по самому существу своему м. б. применяем лишь для несмешивающихся с водой жидкостей, напр, при П. нефтяных и каменноугольных погонов, эфирных масел, скипидара, высших жирных к-т и т. п. Степень понижения давления при П. с острым паром и количество потребного для этого пара м. б. подсчитаны по вышеприведенной ф-ле Ванклина, причем практич. цифры расхода пара всегда несколько выше, нежели вычисленные по приведенной ф-ле, в силу неполноты насыщения водяных паров парами перегоняемой жидкости. Температура кипения смеси двух несмешивающихся жидкостей в случае насыщенного состояния их паров всегда ниже, нежели
[c.61]
DOT 3 , DOT 4 , DOT 5 — маркировки родом из США. DOT — это американский департамент транспорта Departament of Transport, а цифры 3,4, 5 — номера допусков, которые регламентируют характеристики тормозных жидкостей (температуру кипения, застывания и др.). Необходимость внедрения маркировок обусловлена особенностью работы жидкостей данного типа. Главное требование — тормозная жидкость должна быть несжимаемой независимо от создаваемого давления (оно может дости-
[c.130]
Главное требование — тормозная жидкость должна быть несжимаемой независимо от создаваемого давления (оно может дости-
[c.130]
Фреон 114В2 (тетрафтордибромэтан) представляет собой нейтральную бесцветную жидкость. Температура кипения 46 С, температура замерзания —112° С [c.221]
Стабилизации температуры достигают при помощи регул -рующих клапанов с пневматическим мембранным приводом, т-крывающих или за крывающих доступ пара или воды для н-ва и охлаждения электролита. Выпускаемые промышленное. ю регуляторы температуры прямого действия типа РПД в качестге чувствительного элемента имеют герметически замкнутую термометрическую систему с рабочей жидкостью, температура кипения которой ниже наименьшей температуры регулирования, а в качестве исполнительного механизма — специальный клапан для регулирования расхода пара или горячей воды. [c.501]
В кипятильнике при pK = onst происходит выпаривание из раствора компонента за счет подводимой от горячего источника теплоты Ц. Пар направляется в конденсатор, где, отдавая теплоту охлаждающей среде (воде), конденсируется также при p = onst. При этом образуется жидкость с высокой концентрацией аммиака. В регулирующем вентиле РВ2 давление этого легкокипящего компонента снижается до давления в абсорбере (ра»к) при этом уменьшается и температура кипения. С этими параметрами жидкость поступает в испаритель и, отбирая теплоту переходит в пар. Пар направляется в абсорбер, где поглощается раствором выделяющаяся при этом теплота отводится охлаждающей водой. Чтобы не было изменения концентрации растворов в кипятильнике и абсорбере а( а> к) вследствие выпаривания компонента в первом и поглощения во втором, часть обогащенного легкокипящим компонентом раствора из абсорбера перекачивается насосом в кипятильник, а из последнего часть обедненного раствора через дроссель FBI направляется в абсорбер.
[c.201]
Пар направляется в конденсатор, где, отдавая теплоту охлаждающей среде (воде), конденсируется также при p = onst. При этом образуется жидкость с высокой концентрацией аммиака. В регулирующем вентиле РВ2 давление этого легкокипящего компонента снижается до давления в абсорбере (ра»к) при этом уменьшается и температура кипения. С этими параметрами жидкость поступает в испаритель и, отбирая теплоту переходит в пар. Пар направляется в абсорбер, где поглощается раствором выделяющаяся при этом теплота отводится охлаждающей водой. Чтобы не было изменения концентрации растворов в кипятильнике и абсорбере а( а> к) вследствие выпаривания компонента в первом и поглощения во втором, часть обогащенного легкокипящим компонентом раствора из абсорбера перекачивается насосом в кипятильник, а из последнего часть обедненного раствора через дроссель FBI направляется в абсорбер.
[c.201]
Полиизобутилепами называются продукты различного молекулярного веса, получаемые полимеризацией изобутилена в присутствии различных катализаторов.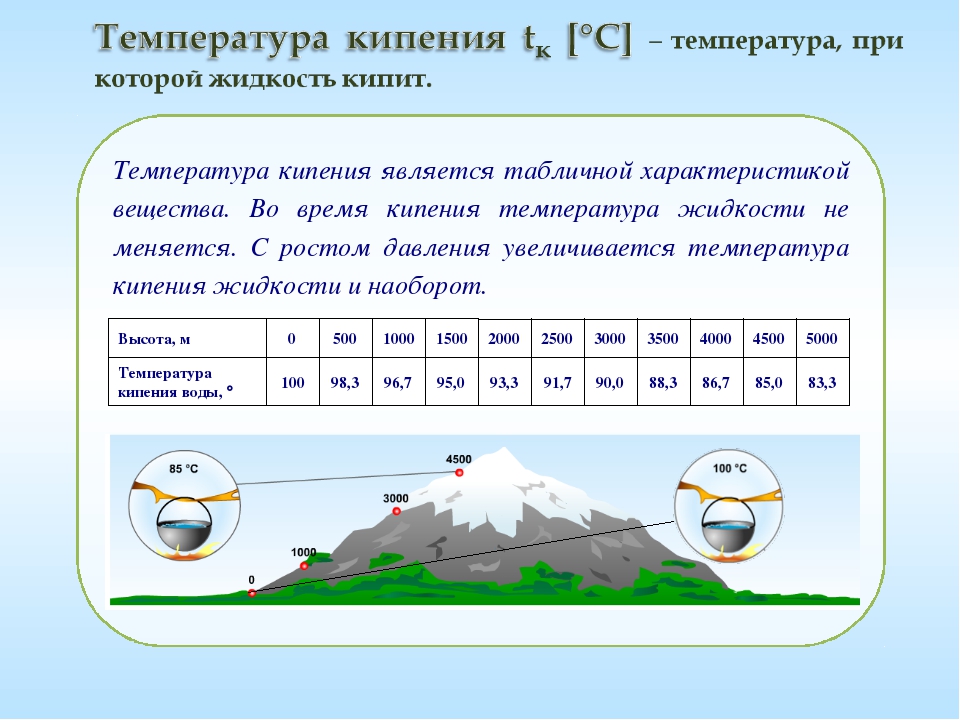 Процесс полимеризации протекает при —80°С. Мономер — изобутилен СН2С(СНз)2 при комнатной температуре н атмосферном давлении — горючий газ с температурой кипения — 7° С. Полиизобутилен низкого молекулярного веса представляет собой жидкость. С увеличением молекулярного веса он становится вначале смолоподобным, а затем каучукоподобпы.м.
[c.433]
Процесс полимеризации протекает при —80°С. Мономер — изобутилен СН2С(СНз)2 при комнатной температуре н атмосферном давлении — горючий газ с температурой кипения — 7° С. Полиизобутилен низкого молекулярного веса представляет собой жидкость. С увеличением молекулярного веса он становится вначале смолоподобным, а затем каучукоподобпы.м.
[c.433]
При дальнейшем подводе теплоты к воде, нагретой до температуры кипения при данном давлении, начнется превращение ее в пар. В процессе парообразования температура будет оставаться постоянной до тех пор, пока не превратится в пар последняя капля жидкости. В этом конечном состоянии получается сухой н 1сыщен-ный пар. [c.178]
В паровых котлах над поверхностью испарения получается только влажный,пар с большей или меньшей степенью сухости. Влажный пар определяется давлением р или температурой и степенью сухости х. Температура влажного пара равна температуре кипения жидкости при данном давлении. Удельный объем влажного пара определяется как объем смеси, состояш,ей из сухого пара и воды
[c. 179]
179]
Почему температура кипения жидкости зависит от внешнего давления?
Чтобы понять почему это происходит нужно понять как происходит кипение. Пусть сосуд с жидкостью стоит на открытом огне. Жидкость в единицу времени получает Q1 джоулей теплоты, но и отдаёт в окружающую среду Q2 джоулей. Если Q1 > Q2, то происходит увеличение температуры жидкости, или одним словом, нагревание. Как жидкость отдаёт тепло? Двумя способами: через стенки сосуда и испаряясь. Первый способ нас мало интересует, а вот испарение может происходить по разному. До начала кипения испарение происходит только с поверхности, а при кипении пузырьки насыщенного пара образуются по всему объёму, всплывают и лопаются. При кипении Q2 резко возрастает и быстро достигает Q1. По этому при кипении температура жидкости в среднем остаётся постоянной. Кипение, таким образом, это точка баланса между подводимым и отводимым теплом. Можно сделать огонь под сосудом чуть сильнее или слабее, в результате изменится интенсивность кипения, но температура жидкости останется прежней.
Чтобы пузырёк пара вырос и всплыл под действием архимедовой силы, нужно, чтобы давление в нём превзошло давление в жидкости (а это атмосферное + давление столба жидкости, меньшее к поверхности и бо́льшее у дна. Давление насыщенного пара зависит именно от температуры (это объясняется в термодинамике).
При нормальном атмосферном давлении (760мм.рт.ст) пузырьки пара в воде начинают всплывать и доплывать до поверхности при температуре, которую и стали для ровного счёта считать 100°С (замерзание и кипение воды были выбраны реперными точками для шкалы Цельсия).
Если атмосферное давление выше нормы, то нагревать воду до всплывания пузырьков придётся дольше и до более высокой температуры. И наоборот, если меньше, то пузырьки сорвутся раньше, при меньшей температуре. Вот и всё объяснение.
Логично предположить, что может существовать такое давление, при котором жидкая фаза будет вообще невозможна. Например, тихим солнечным днём положенный на поверхности Марса водяной лёд сразу будет испаряться. Нет жидкой фазы — нет и кипения.
Нет жидкой фазы — нет и кипения.
Обучение LIQUI MOLY
Надо ли говорить, что от состояния и работоспособности тормозной системы зависит жизнь водителя и его пассажиров? Качество тормозной жидкости, ее свойства имеют первостепенное значение. Американский стандарт DOT делит современные тормозные жидкости на три основные группы, отличающиеся между собой по двум ключевым параметрам: вязкости и температуре кипения. Вязкость не должна быть чрезмерной, так как от нее зависит быстрота срабатывания тормозной системы и точность дозирования тормозного усилия. Температура кипения имеет две разновидности: температура кипения чистой жидкости и температура кипения увлажненной, с содержанием воды около 3% (то есть после 1-2 лет интенсивной эксплуатации). Существующая сегодня тенденция к снижению вязкости автомобильных рабочих жидкостей не обошла тормозные жидкости стороной. Так разработана маловязкая жидкость DOT 4 Class 6, рассчитанная на совместную работу с быстродействующими системами стабилизации автомобилей премиальных классов (BMW, Audi и подобных).
Современные тормозные жидкости делаются только на основе синтетических компонентов: полигликолей, полигликольэтеров и борных солей органических кислот.
Используемые синтетические основы являются гигроскопичными, то есть активно поглощают влагу из воздуха, соответственно, снижая температуру кипения и коррозионную стойкость.
Чтобы оценить качество тормозной жидкости, необходимо знать фактические температуры кипения в увлажненном и чистом виде. И тот и другой параметры, как правило, указываются на этикетке. Особое место занимает активность тормозной жидкости по отношению к резиновым и прочим синтетическим материалам, из которых изготавливаются компоненты тормозных систем. Жидкости по стандарту DOT 3 обладают наибольшей активностью к эластомерам, поэтому на старых автомобилях стоит применять более современные и, одновременно, более нейтральные по отношению к резине жидкости DOT 4 и DOT 5.1.
Не путать DOT 5.1 с очень редко встречающейся на серийной технике DOT 5 (жидкость на силиконовой основе с чрезвычайно высокой ценой). DOT 5, несмотря на похожее обозначение, не смешиваются и несовместимы между собой в отличие от DOT 3, DOT 4 и DOT 5.1.
DOT 5, несмотря на похожее обозначение, не смешиваются и несовместимы между собой в отличие от DOT 3, DOT 4 и DOT 5.1.
Тормозная жидкость Bremsenflussigkeit DOT 4
Синтетическая маловязкая тормозная жидкость на основе гликольэтеров и эфиров борной кислоты. Содержит ингибиторы коррозии и антиоксиданты. Обеспечивает прокачку по тормозной системе, быстродействие антиблокировочных тормозных систем и систем стабилизации движения. Имеет стандартный срок службы.
Допуски и соответствия:
SAE J 1703, J 1704
ISO 4925
CUNA NC 956-01
FMVSS 571.116
DOT 4
Тормозная жидкость Bremsenflussigkeit SL6 DOT 4
Синтетическая маловязкая тормозная жидкость на основе гликольэтеров и эфиров борной кислоты. Содержит ингибиторы коррозии и антиоксиданты. DOT 4 SL6 тормозная жидкость была специально разработана, чтобы продлить срок службы компонентов, входящих в системы гидравлических тормозов и систем сцепления автотранспортных средств. Обеспечивает идеальную прокачку по тормозной системе, максимальное быстродействие антиблокировочных тормозных систем и систем стабилизации движения. Имеет увеличенный срок службы. Использование Bremsflussigkeit SL6 DOT 4 обеспечивает необходимое быстродействие ESP / DSC, ABS и ASR.
Обеспечивает идеальную прокачку по тормозной системе, максимальное быстродействие антиблокировочных тормозных систем и систем стабилизации движения. Имеет увеличенный срок службы. Использование Bremsflussigkeit SL6 DOT 4 обеспечивает необходимое быстродействие ESP / DSC, ABS и ASR.
Допуски и соответствия:
SAE J 1703/ J 1704
ISO 4925 Class 6 FMVSS116DOT3/DOT4
TL 766-Z
VW50114
BMW QV 34 001
GM Europa (Opel, Saab, Vauxhall) GMW 3356.
Тормозная жидкость Brake Fluid DOT 5.1
Синтетическая тормозная жидкость на основе гликольэтеров, алкиленполигликоленов и полигликольэфиров. Содержит ингибиторы, предотвращающие коррозию металлических элементов тормозной системы и существенно уменьшающие процесс окисления в высокотемпературных условиях. Разработана специально с целью увеличения сроков эксплуатации конструкционных элементов гидравлики тормозных систем и систем сцеплений автомобилей. Особенно хорошо приспособлена для использования в тормозных системах с ABS. Обеспечивает надёжную смазку всех подвижных компонентов тормозной системы. Смешиваема и совместима с высококачественными синтетическими тормозными жидкостями (кроме силиконовых). Обеспечивает необходимое быстродействие ABS и работу в теплонапряженных тормозных системах, в том числе спортивного назначения.
Обеспечивает надёжную смазку всех подвижных компонентов тормозной системы. Смешиваема и совместима с высококачественными синтетическими тормозными жидкостями (кроме силиконовых). Обеспечивает необходимое быстродействие ABS и работу в теплонапряженных тормозных системах, в том числе спортивного назначения.
Допуски и соответствия:
SAE J 1703, J 1704
ISO 4 925
CUNA NC 956-01
FMVSS 5 71. 116
Спортивная тормозная жидкость Brake Fluid Race
Brake Fluid Race синтетическая тормозная жидкость. Содержит ингибиторы, предотвращающие коррозию металлических деталей тормозных механизмов и уменьшающие окисление при высоких температурах. При старении продукта не образуются кислотные продукты. Liqui Moly Brake Fluid Race специально разработана, чтобы увеличить срок службы компонентов гидравлических тормозов и систем сцепления спортивных автомобилей и мотоциклов, Liqui Moly Brake Fluid Race имеет высокую влажную и сухую точку кипения, таким образом, обеспечивая безопасное торможение даже после длительного периода эксплуатации. Особый компонент помогает предотвращать формирование паровых пузырей. Liqui Moly Brake Fluid Race идеальна для использования в тормозных системах с ABS. Соответствует стандарту DOT4. Смешивается со всеми стандартными тормозными жидкостями на синтетической основе. Очень высокая температура кипения во влажном и сухом состоянии (более 320°С).
Особый компонент помогает предотвращать формирование паровых пузырей. Liqui Moly Brake Fluid Race идеальна для использования в тормозных системах с ABS. Соответствует стандарту DOT4. Смешивается со всеми стандартными тормозными жидкостями на синтетической основе. Очень высокая температура кипения во влажном и сухом состоянии (более 320°С).
Допуски и соответствия:
FMVSS 116 DOT 4 ISO Class 4
SAE J 1703 и 1704
Без регистрации вы можете ознакомиться с материалом,но для прохождения тестирования вам необходимо авторизоваться
Кипение жидкостей. Зависимость температуры кипения от давления | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Если жидкость получает теплоту, то она будет нагреваться и через некоторое время начнет кипеть. По наблюдениям этот процесс сопровождается образованием в объеме жидкости пузырьков насыщенного пара. С повышением температуры их количество на стенках сосуда возрастает, а размеры увеличиваются. При определенной температуре давление пара в пузырьках становится равным давлению в жидкости, и они под действием силы Архимеда начинают всплывать. Когда такой пузырек достигает поверхности жидкости, он лопается и выбрасывает пар наружу.
При определенной температуре давление пара в пузырьках становится равным давлению в жидкости, и они под действием силы Архимеда начинают всплывать. Когда такой пузырек достигает поверхности жидкости, он лопается и выбрасывает пар наружу.
Кипение — это внутреннее парообразование, которое происходит во всем объеме жидкости при температуре, когда давление насыщенного пара равно давлению в жидкости.
Установлено, что при кипении температура жидкости остается постоянной — при достижении температуры кипения все предоставленное количество теплоты идет на парообразование. Если жидкость не получает теплоту, кипение прекратится, поскольку не будет поступать энергия для внутреннего парообразования.
Кипение осуществляется при температуре, когда давление насыщенного пара в пузырьках равно давлению в жидкости.
Рис. 3.3. Зависимость температуры кипения воды от давления 3.3. Зависимость температуры кипения воды от давления |
Каждое вещество имеет собственную температуру кипения. Очевидно, что ее значение определяется давлением насыщенного пара при данной температуре, поскольку кипение наступает тогда, когда давление насыщенного пара уравнивается с давлением в жидкости. Поэтому температура кипения жидкостей зависит от внешнего давления — чем оно выше, тем выше должна быть температура кипения, и наоборот. Графически зависимость температуры кипения воды от давления изображена на рис. 3.3.
Это подтверждается на практике. Так, в паровых котлах, где давление может превышать 1,5 • 106 Па (15 атм), вода не кипит даже при 200 °C; на высокогорье, где давление намного меньше, чем нормальное атмосферное, температура кипения воды будет ниже 100 °C. Например, на вершине Говерлы (2062 м) вода будет кипеть при 90 °C, а на Эвересте (8848 м) температура кипения воды будет менее 70 °C.
При нормальном давлении жидкий аммиак кипит при -33 °C, вода — при 100 °C, ртуть — при 357 °C.
Это свойство жидкостей широко используют в разных технологических процессах. Например, в процессе нефтепереработки для разъединения нефтепродуктов — бензина, мазута и масел, имеющих разную температуру кипения; при сахароварении (благодаря пониженному давлению сироп кипит при низкой температуре, и поэтому сахар не пригорает). Материал с сайта http://worldofschool.ru
Чтобы вычислить количество теплоты, необходимой для кипения, следует учитывать: а) теплоту нагревания жидкости до температуры кипения Q1; б) теплоту парообразования Q2: Q = Q1 + Q2.
Таким образом, все жидкости имеют постоянную температуру кипения, которая зависит от рода вещества и внешнего давления. Чтобы кипение продолжалось, необходимо жидкость нагреть до температуры кипения и продолжать нагревать ее, предоставляя количество теплоты, необходимое для парообразования:
Чтобы кипение продолжалось, необходимо жидкость нагреть до температуры кипения и продолжать нагревать ее, предоставляя количество теплоты, необходимое для парообразования:
Q = cmΔt + rm.
На этой странице материал по темам:Как рассчитать температуру кипения в зависимости от давления
Формула зависимости температуры от давления r410 для excel
Температура кипения воды и аммиака
Температура. кипения. воды на высокогорье
Зависимость температуры кипения spirta от давления.
Чем отличается кипение от испарения?
При каких условиях происходит кипение?
От чего зависит температура кипения? Где используют это свойство жидкостей?
Будет ли кипеть вода в стакане, который находится в кастрюле с кипятком? А спирт?
Кипение — урок.
 Физика, 8 класс.
Физика, 8 класс.Вы уже изучили такой вид парообразования как испарение.
Рассмотрим второй способ образования пара — кипение.
Кипение — это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и по всему объёму.
Рассмотрим пример — кипение воды.
В воде растворены молекулы воздуха (газов). При нагревании этот растворённый газ выделяется в виде воздушных пузырьков на дне и стенках сосуда (рис. 1).
Рис. 1. Изображение кипения
С повышением температуры жидкости внутри этих пузырьков испаряется вода, они увеличиваются в размерах. Достигнув определённого размера, пузырьки отрываются от поверхности.
Если вода прогрета недостаточно, то пузырьки пара в холодных слоях схлопываются. А если температура достаточная, то они достигают поверхности воздуха или жидкости и лопаются, выпуская пар. В этот момент слышен шум, предшествующий обычно кипению. При определённой температуре вода закипает (рис. 2).
2).
Рис. 2. Изображение модели кипения
Температуру, при которой жидкость кипит, называют температурой кипения.
Обрати внимание!
Во время кипения температура жидкости не изменяется, так как вся энергия расходуется на парообразование.
Температура кипения жидкости зависит от двух факторов:
- от рода жидкости;
- от внешнего давления.
Для каждого вещества существует своя температура кипения.
| Вещество | Температура кипения (при норм. атм. давлении), °С |
| воздух | \(-193\) |
| кислород | \(-183\) |
| эфир | \(35\) |
| спирт | \(78\) |
| вода | \(100\) |
| ртуть | \(357\) |
| свинец | \(1740\) |
| медь | \(2567\) |
При уменьшении давления воздушным пузырькам легче всплывать, кипение происходит при меньшей температуре. Именно поэтому высоко в горах (на высотах \(6000\) — \(8000\) м) не варят суп или мясо, а пользуются готовыми консервами, т.к. температура кипения воды меньше \(100\)°С.
Именно поэтому высоко в горах (на высотах \(6000\) — \(8000\) м) не варят суп или мясо, а пользуются готовыми консервами, т.к. температура кипения воды меньше \(100\)°С.
Различные жидкости одной и той же массы требуют разное количество теплоты для их обращения в пар при температуре кипения.
Q=L ·m, где
\(Q\) — количество теплоты, необходимое для обращения вещества в пар;
\(m\) — масса вещества;
\(L\) — удельная теплота.
Удельная теплота парообразования (L) — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры.
Источники:
Рис. 1. Автор: Monoklon — собственная работа, CC BY 4.0, https://commons.wikimedia.org/w/index.php?curid=97966488.
Рис. 2. By Spiel496 (talk) — Own work by the original uploader using Inkscape., Public Domain, https://commons.wikimedia.org/w/index.php?curid=56968271.
Кипение жидкостей в физике — формулы и определение с примерами
Содержание:
Кипение жидкостей:
Вы уже знаете, что испарение жидкости без притока теплоты при любой температуре приводит к ее охлаждению. А как будет идти испарение, если жидкости непрерывно передавать энергию (теплоту)?
А как будет идти испарение, если жидкости непрерывно передавать энергию (теплоту)?
Проведем опыт. Поставим на электроплитку стакан с водой (рис. 68, а). По термометру будем следить за изменением температуры воды в стакане. Температура воды сначала растет. На дне стакана появляется множество маленьких пузырьков. Их размеры постепенно увеличиваются, так как вода испаряется внутрь пузырьков и давление пара в пузырьках при нагревании повышается. Пузырьки отрываются ото дна и стенок и движутся вверх. А что дальше? Если давление пара внутри пузырька больше, чем над жидкостью, то у поверхности он разрывается, и пар выходит наружу. При этом температура воды близка к 100 °C и практически не меняется. А все большее число пузырьков поднимается и лопается у поверхности, выбрасывая пар в атмосферу. Вода кипит (рис. 68, б).
Что такое кипение
Кипение — это процесс парообразования, идущий при постоянной температуре но всему объему жидкости. Действительно, любой пузырек можно рассматривать как сосуд с паром внутри жидкости (рис. 69). С поверхности его стенок идет испарение и обратный процесс — возврат молекул в жидкость, т. е. конденсация.
69). С поверхности его стенок идет испарение и обратный процесс — возврат молекул в жидкость, т. е. конденсация.
При кипении температура жидкости не меняется. По ведь энергия (от нагретой плитки) жидкостью поглощается. На что же она расходуется? Энергия, полученная жидкостью, идет на превращение ее в пар (газ), т. е. на преодоление сил притяжения между молекулами жидкости.
При обратном процессе — переходе пара в жидкость (рис. 70), или конденсации, это же количество энергии выделяется.
Температура, при которой происходит кипение жидкости, называется температурой кипения.
Температура кипения у разных жидкостей неодинакова. Это и понятно, ведь энергия взаимодействия их молекул тоже разная.
В таблице 4 приведены температуры кипения жидкостей при нормальном атмосферном давлении.
А случайно ли мы, говоря о температуре кипения жидкости, указываем давление? Нет, не случайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
Подтвердим это опытом. Нальем в колбу теплой воды, температура которой t = 50—60 °C. Закроем колбу пробкой, подсоединенной к откачивающему насосу (рис. 71). Откачаем газ из колбы. Вода закипит, хотя ее температура меньше 100 °C. Ио это не значит, что в такой воде можно сварить яйцо. Яйцо варится не потому, что вода кипит, а потому, что она горячая.
А если в специальных условиях создать высокое давление над поверхностью воды, то в ней можно будет расплавить олово, но вода так и не будет кипеть. Объясните почему.
Зависимость температуры кипения от внешнего давления используется в практических целях. Например, для стерилизации медицинских инструментов их помещают в герметически закрытые камеры-автоклавы (рис. 72), вода в которых кипит при температуре значительно выше 100 °C. В быту используются кастрюли-скороварки (рис. 73), в которых температура кипения воды может повышаться до 120 °C. Поэтому пища в скороварках готовится гораздо быстрее, чем в обычных кастрюлях.
Поэтому пища в скороварках готовится гораздо быстрее, чем в обычных кастрюлях.
Вернемся к парообразованию. Чтобы превратить в пар 1 кг жидкости при температуре кипения, необходимо передать ей определенное количество теплоты. А если масса жидкости будет 2 кг? Значит, теплоты понадобится в 2 раза больше. А при превращении в пар m кг жидкости количество теплоты увеличится в m раз, т. е. количество теплоты, необходимое для парообразования, прямо пропорционально массе жидкости:
В этой формуле коэффициент L называется удельной теплотой парообразования:
Как следует из формулы, единицей удельной теплоты парообразования в СИ является 1 джоуль на килограмм
Удельная теплота парообразования есть физическая величина, численно равная количеству теплоты, поглощенному 1 кг жидкости при переходе ее в пар при температуре кипения.
Таблица 4. Температура кипения и удельная теплота парообразования некоторых жидкостей (при нормальном атмосферном давлении)
Удельная теплота парообразования различных жидкостей дана в таблице 4. Что значит для воды? А это значит, что 1 кг воды при температуре 100 °C должен поглотить энергии (теплоты), чтобы перейти в газ (пар) с этой же температурой.
Что значит для воды? А это значит, что 1 кг воды при температуре 100 °C должен поглотить энергии (теплоты), чтобы перейти в газ (пар) с этой же температурой.
Можно сказать и иначе: — это количество теплоты, которое выделится при конденсации 1 кг пара при температуре кипения (100 °C).
Главные выводы:
- Превращение жидкости в газ (пар) при постоянной температуре во всем объеме жидкости называют кипением.
- Температура кипения зависит от рода жидкости и внешнего давления.
- Чем выше давление над поверхностью жидкости, тем выше температура кипения.
- При кипении жидкость поглощает энергию, при конденсации пара выделяется равное количество энергии.
- Количество поглощенной при кипении тепловой энергии зависит от рода жидкости и ее массы.
На рисунке 74 представлен график зависимости количества теплоты, идущего на парообразование некоторой жидкости, от ее массы. Какую массу олова можно расплавить, используя теплоту конденсации пара данной жидкости массой = 0,01 кг, взятого при температуре кипения? Температура олова t = 32 °C.
Какую массу олова можно расплавить, используя теплоту конденсации пара данной жидкости массой = 0,01 кг, взятого при температуре кипения? Температура олова t = 32 °C.
Дано:
Решение
Из графика найдем модуль количества теплоты, которое выделится при конденсации пара массой = 0,01 кг:
Для нагревания до температуры плавления и плавления массы m олова необходимо количество теплоты
Откуда
Тогда
Ответ: m = 0,2 кг.
Жидкости и газы – температуры кипения
Температура кипения вещества – это температура, при которой оно изменяет состояние из жидкого в газообразное во всем объеме жидкости. При температуре кипения молекулы в любом месте жидкости могут испаряться.
Температура кипения определяется как температура, при которой давление насыщенного пара жидкости равно атмосферному давлению.
Температура кипения при атмосферном давлении (14.7 PSIA, 1 бар абсолютный) для некоторых общих жидкостей и газов можно найти из таблицы ниже:
| Продукт | кипения в атмосферном давлении ( O C) | ||
|---|---|---|---|
| Acetaldehyde CH 3 CHO | 20. 8 8 | 20.8 | |
| Ангидрид уксусных кислот (CH 3 COO) 2 O | 139 | ||
| Acetone CH 3 Coch 3 | 56.08 | ||
| Acentonitrile 81,6 | |||
| Ацетилен -84 | |||
| акролеина 52,3 | |||
| акрилонитрил 77,2 | |||
| спирт — этиловый (зерно, этанол) С 2 H 5 О | 79 | ||
| Алкоголь — Аллил | 97.2 | ||
| Алкоголь — Бутил-N | 117 | ||
| Алкоголь — изобутил | 107.8 | ||
| Алкоголь — метил (спирт метиловой, алкоголь из дерева, дерево нафта или древесины) CH 3 OH | 64.7 | ||
| алкоголь — пропил | 97,5 | ||
| Allylamine | 54 | ||
| аммиак | -35. 5 5 | ||
| 184.1 | |||
| анизол | 153.6 | ||
| Argon | |||
| Benzaldehyde | 178.7 | ||
| бензол (бензол) C 6 H 6 | 80031 | 80014 | |
| 191.1 | |||
| Тормозная жидкая точка 3 (сухой — влажные точки кипения) (мокрые включает в себя гигроскопическую влагу) | 205 — 140 | ||
| Тормозная жидкость DOT 4 (сухой — влажные точки кипения) | 230 — 155 | ||
| тормозной жидкости DOT 5 (сухие — влажные точки кипения) | 260 — 180 | ||
| тормозной жидкость Точка 5.1 (сухой — влажные точки кипения) | 270 — 190 | ||
| 58.8 | |||
| Bromobenzene | 156. 0 0 | ||
| 1,2-бутадиен | 10.9 | ||
| N-бутана | -0.59 | ||
| 1-butene | -6.25 | -6.25 | -629 |
| Butanal | 74,8 | ||
| 1-бутанол | 117.6 | ||
| 2-бутанон | 79.6 | ||
| Масляная кислота п | 162,5 | ||
| Камфора | 204,0 | ||
| карболовой кислоты (фенола) | 182,2 | ||
| сероуглерода | 47,8 | ||
| Диоксид углерода СО 2 (сублиманы) | -78.59 | ||
| Дисульфид углерода CS 2 | 462 | ||
| Угарный монооксид углерода | -192 | ||
| Уголовный тетрахлорид углерода (тетрахлорэтан) CCL 4 | 76.7 | ||
| Хлор -34,4 | |||
| хлорбензол 131,7 | |||
| Хлороформ (Трихлорметан) | 62,2 | ||
| Циклогексан 80,7 | |||
| Циклогексанона 155,4 | |||
| Циклопентановых | 49. 3 3 | ||
| н — Декан | 174 | ||
| Дихлорметан — см. метиленхлорид | |||
| Диметилсульфат | 186 | ||
| диметилсульфид | 37,3 | ||
| диизопропиловый эфир | 68,4 | ||
| 2,2 — диметилпентан | 79,2 | ||
| 1,4-диоксане | 101,2 | ||
| даутерму 258 | |||
| Этан -88,78 | |||
| Эфир 34,6 | |||
| Глицерин 290 | |||
| этан С 2 Н | 6-88 | ||
| Этанол | 78.24 | ||
| этиламин | 16,6 | ||
| Этилацетат СН 3 COOC 2 Н 3 | 77,2 | ||
| этилбензола | 136 | ||
| этилбромидЭлюент С 2 Н 3 BR | 38,4 | 38. 4 4 | |
| -10329 | -103,7 | ||
| 1314 | |||
| Этиленгликоль | 197 | ||
| 3 — Ethynpentane | 935 | ||
| Фтор -187 | |||
| Формальдегид -19,1 | |||
| Муравьиная кислота | 101,0 | ||
| Трихлорфторметан хладагент R-11 | 23,8 | ||
| Дихлордифторметан хладагент R-12 | -29,8 | ||
| Хлордифторметана хладагент R-22 | |||
| 2,3 — диметилбутан | 58 | ||
| диизобутиловый 109 | |||
| фурфурола 161.5 | |||
| Fyrfuryl спирта | 168 | ||
| Бензин 38 — 204 | |||
| Глицерин 290 | |||
| гликоль 197 | |||
| Гелий -269 | |||
| н -HEPTANE | 98,4 | 98,4 | |
| N-Hexane | 68,7 | 68,7 | |
| Гексалимин | 132 | ||
| Гидроген | -253 | ||
| Гидрохлорная кислота | -817 | ||
| плавиковой кислоты | 18,9 | ||
| Хлорид водорода | -81,7 | ||
| Сероводород | |||
| Йод 184,3 | |||
| Изопропиловый Alchol | 80,3 | ||
| Гидропероксид изопропилбензола | 153 | ||
| Изобутан | -11,72 | ||
| Изобутен | -6. 9 9 | ||
| изооктан | 99,2 | ||
| изопентан | 27,8 | ||
| изопрен | 34,1 | ||
| изопропилбензола | 152 | ||
| Реактивное топливо | 163 | ||
| Керосин (парафин) | 150 — 300 | ||
| Linseed Oil | 287 | 287 | |
| Mercury | 356.9 | ||
| Metane | -161.5 | ||
| Метанол (метиловый спирт, древесный спирт) | 64,5 | ||
| метилацетата | 57,2 | ||
| метилбромида | 3,3 | ||
| Metyl Хлорид | -23,9 | ||
| Метиленхлорид (CH 2 CL 2 , Дихлорметан) | 39,8 | 39,8 | |
| метиламин | -64 | -614 | |
| метиловый эфир (C 2 H 6 o) | -25 | ||
| метилциклогексан | 101 | ||
| Метилциклопентан | 71. 8 8 | ||
| метилиодид | 42,6 | ||
| 2 — метилгексан | 90,1 | ||
| 3 — метилгексан | 91,8 | ||
| 2 — метилпентан | 60,3 | ||
| 3 — метилпентан | 63,3 | ||
| Нафта | 100 — 160 | ||
| Нафталин (нафталин) | 217,9 | ||
| неопентан | 9,5 | ||
| Азотная кислота | 120 | ||
| нитробензол | 210,9 | ||
| п — нонан | 150,7 | ||
| Азотная кислота | 120 | ||
| Азот | |||
| п — Октан | |||
| Оливковое масло | 300 | ||
| Кислород -183 | |||
| паральдегидом 124 | |||
| н — пентан | 36 | ||
| 1 — пентен | 30 | ||
| надуксусной кислоты | 110 | ||
| Бензин | 95 | ||
| Петролеум | 210 | ||
| петролейный эфир | 35 — 60 | ||
| Фенол | 182 | Фосген | 8. 3 3 |
| Фосфорная кислота 213 | |||
| пропаналя 48 | |||
| Пропан -42,04 | |||
| пропен -47,72 | |||
| 2-пропанол | 82,2 | ||
| пропионовая кислота | 141 | ||
| Пропиламин 47,2 | |||
| Пропилен -47,7 | |||
| Пропиленгликоль | 187 | ||
| насыщенным раствором соли 108 | |||
| Стирол 145 | |||
| Сера | 444.6 | ||
| Серная кислота 330 | |||
| Сера дихлорид | 59,6 | ||
| Диоксид серы хлорид | |||
| сульфурил 69,4 | |||
| Тар 300 | |||
| толуол | 110,6 | ||
| Триптан | 80,9 | ||
| триэтаноламин | 350 | ||
| Скипидар | 160 | ||
| воды | 100 | ||
| Вода, море | 100 . 7 7 | ||
| O-Xylole | 144.4 | 1444 | |
| M-Xylene | 139.1 | 139.1 | |
| P-Xylole | 138.3 | 138.3 |
кипение — жидкость, давление, температура и вода
Температура кипения жидкого вещества — это температура , при которой давление паров жидкости равняется внешнему давлению на жидкость. В жидкости образуются пузырьки пара, которые поднимаются на поверхность и лопаются, вызывая вскипание жидкости.
При комнатной температуре в замкнутой системе существует равновесие между жидкостью и ее паровой фазой. Например, если оставить открытым стакан с водой , вода в конце концов испарится, хотя на это может уйти несколько дней. С другой стороны, если стекло остается закрытым, при снятии крышки на дне крышки остается большое количество воды. Молекулы жидкости в стекле переходят в паровую фазу, но когда они сталкиваются с холодной поверхностью крышки, они снова конденсируются в жидкую форму и снова падают в жидкость. Когда скорость движения молекул в газовую фазу из жидкости равна скорости движения молекул в жидкую фазу из газовой фазы, две фазы находятся в равновесии.
Когда скорость движения молекул в газовую фазу из жидкости равна скорости движения молекул в жидкую фазу из газовой фазы, две фазы находятся в равновесии.
При повышении температуры большее количество молекул имеет достаточно энергии для перехода в газовую фазу. Если бы стакан оставался открытым, вода испарялась бы быстрее. Если бы стакан оставался закрытым, новое равновесие установилось бы быстрее. По мере повышения температуры в газовую фазу поступает больше молекул, и давление паров жидкости увеличивается.
В какой-то момент времени по мере повышения температуры давление паров жидкости увеличится до точки, где оно сравняется с внешним или атмосферным давлением . В этот момент в жидкости начинают образовываться и подниматься пузырьки, и говорят, что она кипит. До этой температуры пузыри не могут образовываться, потому что внешнее давление больше, чем давление в пузыре, и он схлопывается. Температура, при которой внешнее давление и давление пара равны, называется нормальной температурой кипения. Для воды эта температура составляет 212°F (100°C). Как правило, жидкость с высоким давлением паров и низкой нормальной температурой кипения называется летучей. Такие жидкости обычно имеют резкий запах. Жидкости с низким давлением паров и высокими нормальными точками кипения нелетучи и практически не имеют запаха.
Для воды эта температура составляет 212°F (100°C). Как правило, жидкость с высоким давлением паров и низкой нормальной температурой кипения называется летучей. Такие жидкости обычно имеют резкий запах. Жидкости с низким давлением паров и высокими нормальными точками кипения нелетучи и практически не имеют запаха.
Если внешнее давление меньше одной атмосферы, жидкости будут кипеть при более низких температурах, чем их обычные точки кипения. На больших высотах атмосферное давление намного ниже одной атмосферы.На вершине Эвереста, где атмосферное давление составляет около 5 фунтов на квадратный дюйм (260 мм ртутного столба), точка кипения воды составляет всего 160°F (71°C). На таких больших высотах часто необходимо следовать особым инструкциям по приготовлению и запеканию, так как температура воды недостаточно высока для приготовления пищи. И наоборот, если атмосферное давление больше одной атмосферы, жидкости будут кипеть при более высоких температурах, чем их обычные точки кипения. Мы можем использовать это в своих интересах. В скороварке повышаем давление, чтобы оно было больше одной атмосферы.В результате вода закипает при более высокой температуре, а пища готовится быстрее. Мы также можем повысить температуру кипения жидкости, добавив в нее нелетучее растворенное вещество. Например, добавление соли в воду повышает ее температуру кипения.
Мы можем использовать это в своих интересах. В скороварке повышаем давление, чтобы оно было больше одной атмосферы.В результате вода закипает при более высокой температуре, а пища готовится быстрее. Мы также можем повысить температуру кипения жидкости, добавив в нее нелетучее растворенное вещество. Например, добавление соли в воду повышает ее температуру кипения.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Температура кипения
Температура кипения
8 th Профессор естественных наук Шай
Эксперимент с температурой кипения
Раздел 3. 4 стр. 46
4 стр. 46
Введение
Мы изучали плотность и
замораживание-плавление
указать подробно как характеристика свойств
иметь значение.
Другой
таким идентифицирующим свойством является температура кипения
вещество.
То
температура кипения вещества – это температура, при которой
изменения
из
из жидкости в газ (кипение) или наоборот из газа в жидкость
(конденсация).Так же, как изменение состояния от твердого до
жидкость
требует
тепла, так же как переход от жидкости к газу.
Однако теплота , а не , меняет
температура
в
вещество. Вместо этого тепло используется исключительно для кипячения
в
вещество
что по большей части остается при постоянной температуре
на протяжении
кипячение
процесс. Когда все вещество закипит, тепло
снова поднимает
в
температура уже газообразного вещества.
Когда все вещество закипит, тепло
снова поднимает
в
температура уже газообразного вещества.
Температура кипения воды хорошо известно ты; это 212 градусов по Фаренгейту и 100 по Цельсию.
В этом эксперименте вы измерить температуры кипения двух неизвестных жидкостей. (Если вы действительно забота, тайна жидкости – вода и изопропиловый спирт).Две жидкости имеют разные температуры кипения, обе намного выше комнатной температуры. В номер температура, оба вещества являются жидкостями.
Процедура
я дам тебе 10 или 20 мл
воды
или алкоголь. Напомним, что характерными свойствами являются
независимый
принадлежащий
количество измеряемого вещества.Вы будете измерять
в
кипячение
точки вашего вещества и построить график температуры
против времени.
- Сборка приспособления на стр. 46 вашей книги. Убедитесь, что термометр сидя посреди воды и не касаясь нижняя часть трубка. Будет образец для смотреть в класс.
- Зажмите пробирку зажимом жидкости над теплораспределяющим экраном.
- Не забудьте добавить несколько чипсов фарфор на дно пробирки. Этот помогает поддерживать равномерную температуру и предотвращать неравномерное кипение.
- Попроси меня зажечь твою горелку.
- Каждые 30 секунд читать температура жидкости.
- График температуры жидкость против времени.
- Подождите и продолжайте измерять каждые 30 секунд, пока вещество не будет кипеть в течение 5 минут.
Рабочий лист
Время (минуты) Температура жидкости
0
. 5
5
1
1,5
2.0
2,5
3.0
3,5
4.0
4,5
5.0
5,5
6.0
7.0
7,5
8.0
8,5
9.0
9,5
10,0
… продолжайте по мере необходимости. Нарисуйте график на графике
бумага
при условии.
Запишите температуру кипения вашей жидкости как
указано
ваш
график с точностью до десятых долей градуса Цельсия. Рука в
ваш
график мне.
Характеристики твердого, жидкого и газообразного состояний
В разделах 1.3 и 2.5A3,
мы отметили, что физические свойства того или иного вещества определяют его
состояние при комнатной температуре. Если и его нормальная температура плавления, и его нормальное кипение
ниже комнатной температуры (20°C), вещество представляет собой газ при нормальных условиях.
условия. Нормальная температура плавления кислорода составляет -218°C; нормальное кипячение
точка -189°С. Кислород – это газ при комнатной температуре. Если нормальное плавление
точка вещества ниже комнатной температуры, вещество находится в жидком состоянии при
комнатная температура. Бензол плавится при 6°С и кипит при 80°С; это жидкость
при комнатной температуре.Если и нормальная температура плавления, и нормальная температура кипения
точки выше комнатной температуры, вещество твердое. хлорид натрия
плавится при 801°С и кипит при 1413°С. Хлорид натрия представляет собой твердое вещество под
нормальные условия. Рисунок 9.1 иллюстрирует взаимосвязь между физическим
состояние и нормальные температуры плавления и кипения.
Если и его нормальная температура плавления, и его нормальное кипение
ниже комнатной температуры (20°C), вещество представляет собой газ при нормальных условиях.
условия. Нормальная температура плавления кислорода составляет -218°C; нормальное кипячение
точка -189°С. Кислород – это газ при комнатной температуре. Если нормальное плавление
точка вещества ниже комнатной температуры, вещество находится в жидком состоянии при
комнатная температура. Бензол плавится при 6°С и кипит при 80°С; это жидкость
при комнатной температуре.Если и нормальная температура плавления, и нормальная температура кипения
точки выше комнатной температуры, вещество твердое. хлорид натрия
плавится при 801°С и кипит при 1413°С. Хлорид натрия представляет собой твердое вещество под
нормальные условия. Рисунок 9.1 иллюстрирует взаимосвязь между физическим
состояние и нормальные температуры плавления и кипения.
РИСУНОК 9.1 Физическое состояние относительно нормальных температур плавления и кипения. Обратите внимание, что твердые тела плавятся и кипят при температуре выше комнатной, жидкости плавятся и кипят при температуре ниже комнатной, а газы плавятся и кипят при температуре ниже комнатной. Обратите внимание, что твердые тела плавятся и кипят при температуре выше комнатной, жидкости плавятся и кипят при температуре ниже комнатной, а газы плавятся и кипят при температуре ниже комнатной. |
А. Форма и объем
Твердое тело имеет фиксированную форму и объем, которые не меняются в зависимости от формы его сосуда. Подумайте о камне и о том, как его размер и форма остаются неизменными, независимо от того, куда вы его поместите. Жидкость имеет постоянный объем, но ее форма соответствует форме сосуда. Рассмотрим образец молока. Его объем остается неизменным, кладете ли вы его в блюдце для питья кота или в стакане для себя; ясно, что его форма меняется, чтобы соответствовать форме контейнера.Газ меняет свою форму и объем, чтобы соответствовать форме и объему своего сосуда. Рассмотрим образец воздуха. Он наполнит пустую комнату, воздушный шар, шину или резиновый плот. Его форма и объем соответствуют форме и объему сосуда, в который он помещен.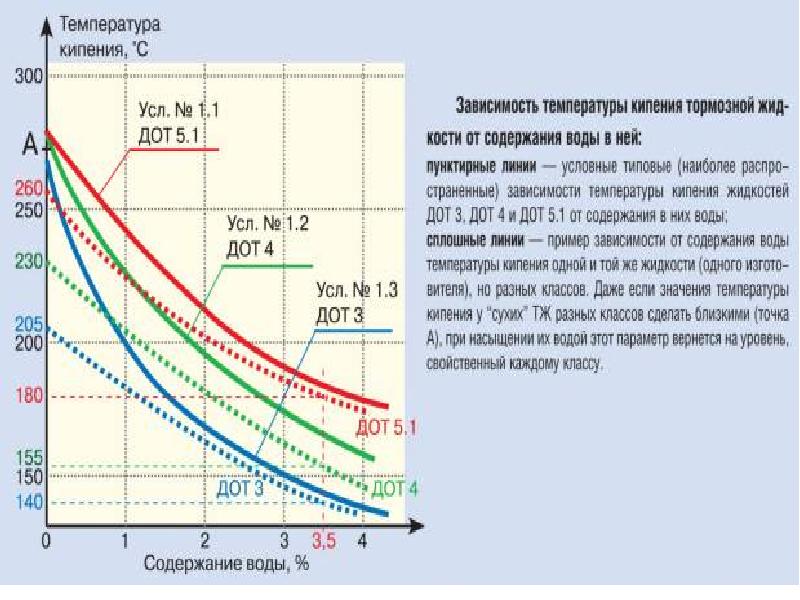 Рисунок 9.2 иллюстрирует эти моменты.
Рисунок 9.2 иллюстрирует эти моменты.
| РИСУНОК 9.2 Постоянство объема, формы и массы в трех состояниях вещества: (а) твердом, (б) жидком, (в) газообразном. |
Б.Плотность
Плотность жидкостей и твердых веществ измеряется в граммах на миллилитр и граммах на кубический сантиметр соответственно и очень мало меняется при изменении температуры образца. Газы имеют гораздо более низкую плотность, настолько низкую, что плотность газа измеряется в граммах на литр, а не в граммах на миллилитр. Плотность газа значительно меняется при изменении температуры газа. В таблице 9.1 показаны плотности трех обычных веществ, по одному в каждом из трех физических состояний, при двух различных температурах.
| Плотность при 20°C | Плотность при 100°C | |
|---|---|---|
| твердый: хлорид натрия | 2,16 г/см 3 | 2,16 г/см 3 |
| жидкость: вода | 0. 998 г/мл 998 г/мл | 0,958 г/мл |
| газ: кислород | 1,33 г/л | 1,05 г/л |
С. Сжимаемость
Объем твердого тела или жидкости не сильно меняется под давлением. Ты
нельзя изменить объем кирпича, сжимая его, и вы не можете сжать один
литр жидкости в 0,5-литровую бутыль.Объем газа сильно меняется
справиться с давлением; вы можете втиснуть 1,0-литровый баллон в 0,5-литровое пространство.
D. Выводы о межмолекулярной структуре
Постоянство формы и объема твердого тела предполагает, что его частицы (атомы,
ионы или молекулы) удерживаются вместе довольно жесткими связями. Переменная форма
и постоянный объем жидкости предполагают наличие некоторой связи между ее
частиц, но эти связи не являются жесткими и, вероятно, менее прочными, чем
те, что в твердом теле.Тот факт, что газ не имеет ни постоянной формы, ни постоянной
объем предполагает, что нет никаких связей и только очень небольшие силы взаимодействия
между частицами газа. Разнообразие сжимаемости предполагает другие
гипотезы. Если твердые тела и жидкости не могут быть сжаты, частицы которых
они составлены должны быть очень близко друг к другу. Высокая сжимаемость
газа означает, что частицы газа находятся очень далеко друг от друга
пространства между ними.Эта последняя гипотеза подтверждается разницей между
плотности твердых и жидких тел и плотности газов. Один мл
твердое тело или жидкость всегда имеют гораздо большую массу, чем один миллилитр газа.
Разнообразие сжимаемости предполагает другие
гипотезы. Если твердые тела и жидкости не могут быть сжаты, частицы которых
они составлены должны быть очень близко друг к другу. Высокая сжимаемость
газа означает, что частицы газа находятся очень далеко друг от друга
пространства между ними.Эта последняя гипотеза подтверждается разницей между
плотности твердых и жидких тел и плотности газов. Один мл
твердое тело или жидкость всегда имеют гораздо большую массу, чем один миллилитр газа.
Определение температуры кипения капиллярным методом — Концепция | Лаборатория: Химия
Определение температуры кипения
Подобно температуре плавления, точка кипения является физическим свойством. Если образец представляет собой чистое соединение, то для определения идентичности соединения можно использовать температуру кипения.В конечном счете, экспериментальное определение точной температуры кипения является сложной задачей. Как и точки плавления, экспериментальные точки кипения указаны в виде диапазона и отличаются на несколько градусов от фактического литературного значения.
Давление пара
Чтобы понять, почему растворитель кипит, что характеризуется знакомым нам бурлением раствора, важно понять динамику между жидкой и газообразной фазами. Рассмотрим чистое жидкое соединение в герметичном контейнере.У части молекул на поверхности жидкости будет достаточно энергии, чтобы преодолеть межмолекулярные силы и перейти в газовую фазу. Однако молекулы в газовой фазе также могут терять энергию и снова конденсироваться в жидкость. Следовательно, в этой системе есть два конкурирующих процесса: испарение и конденсация.
Когда скорость испарения равна скорости конденсации, система достигла состояния равновесия. Это означает, что на каждую молекулу, попадающую в газовую фазу, другая молекула конденсируется в жидкую фазу, и нет чистого прироста или потери количества жидкости или газа в контейнере.После установления равновесия давление пара над жидкостью называется давлением пара. Склонность жидкости к испарению называется летучестью. Более летучая жидкость имеет более высокое давление пара, а менее летучая жидкость имеет более низкое давление пара.
Более летучая жидкость имеет более высокое давление пара, а менее летучая жидкость имеет более низкое давление пара.
Давление паров зависит от температуры. Если вы повысите температуру раствора, у большего количества молекул будет достаточно энергии, чтобы покинуть жидкую фазу, и, таким образом, давление пара увеличится. В конечном счете, если приложить достаточно тепла, молекулы, которые не находятся на границе раздела между жидкостью и газом, перейдут в газовую фазу и сформируют знакомые пузырьки, которые мы ассоциируем с кипением.
Температура кипения жидкости достигается, когда общее давление паров жидкости эквивалентно атмосферному давлению. Температура, при которой это происходит, называется температурой кипения. На большей высоте и, следовательно, при более низком атмосферном давлении жидкость будет кипеть при более низкой температуре, поскольку для повышения давления пара до атмосферного требуется меньше тепла. Кроме того, летучесть или способность растворителя испаряться также влияет на давление паров. Растворители с высокой летучестью имеют более высокое давление паров, чем растворители с более низкой летучестью.
Растворители с высокой летучестью имеют более высокое давление паров, чем растворители с более низкой летучестью.
Факторы, влияющие на температуру кипения
Сходство между точками плавления и точками кипения означает, что те же самые факторы, которые влияют на температуру плавления соединения, будут влиять и на температуру кипения. Следовательно, сила и типы межмолекулярных сил, которые обнаруживаются внутри жидкого соединения, будут влиять на температуру кипения. Напомним, что существует три типа молекулярных сил: водородные связи, диполь-дипольные взаимодействия и лондонские дисперсионные силы.Каждый из них имеет разную силу притяжения и требует разного количества энергии для преодоления. Соединения, которые могут связываться водородом, будут иметь более высокие точки кипения, чем соединения, которые могут взаимодействовать только через лондонские дисперсионные силы. Дополнительное рассмотрение точек кипения связано с давлением паров и летучестью соединения.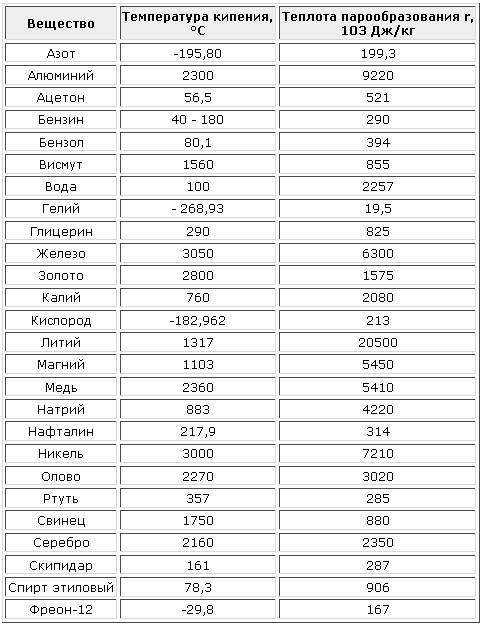 Как правило, чем летучее соединение, тем ниже его температура кипения.
Как правило, чем летучее соединение, тем ниже его температура кипения.
Капиллярный метод определения температуры кипения
Простой метод определения температуры кипения органического соединения заключается в использовании капиллярного метода.В этой установке пустая стеклянная капиллярная трубка переворачивается в емкость с чистым соединением в жидкой фазе. По мере нагревания жидкости давление паров образца увеличивается, и в стеклянную капиллярную трубку начинают поступать газообразные пары. Это вытесняет воздух, захваченный внутри, и приводит к появлению пузырьков на дне капиллярной трубки. В этот момент жидкости дают остыть. Как только давление паров образца станет таким же, как атмосферное давление внутри стеклянной капиллярной трубки, жидкость начнет поступать в трубку.Температура раствора, при которой происходит это явление, является температурой кипения жидкого соединения.
Давление паров – обзор
2.5.2 Индуцированное паром
Поскольку давление паров твердых веществ обычно очень низкое, этот раздел больше применим к сольватам и гидратам и в меньшей степени относится к сокристаллам. Термодинамика сольватов ясно показывает, что они стабильны в подмножестве условий, когда давление паров растворителя в окружающей среде выше некоторых критических значений.В этих условиях несольватированные кристаллические формы метастабильны, и существуют движущие силы для их превращения в сольватные формы. С другой стороны, в условиях, когда давление паров ниже этого критического значения, сольваты метастабильны, и существуют движущие силы для превращения сольватов в несольватированные формы.
Термодинамика сольватов ясно показывает, что они стабильны в подмножестве условий, когда давление паров растворителя в окружающей среде выше некоторых критических значений.В этих условиях несольватированные кристаллические формы метастабильны, и существуют движущие силы для их превращения в сольватные формы. С другой стороны, в условиях, когда давление паров ниже этого критического значения, сольваты метастабильны, и существуют движущие силы для превращения сольватов в несольватированные формы.
Термодинамика также показывает, что активность растворителей связана с температурой. То же давление паров приводит к более низкой активности при более высоких температурах.Таким образом, здесь применимо явление десольватации, обсуждавшееся в разделе 2.5.1. Однако отличие заключается в явлении сольватации/гидратации, когда несольватированные формы подвергаются воздействию высокого давления паров растворителя. Поскольку при разработке фармацевтики воздействие только паров органических растворителей встречается довольно редко, обсуждение здесь будет сосредоточено на роли водяного пара и образования гидратов.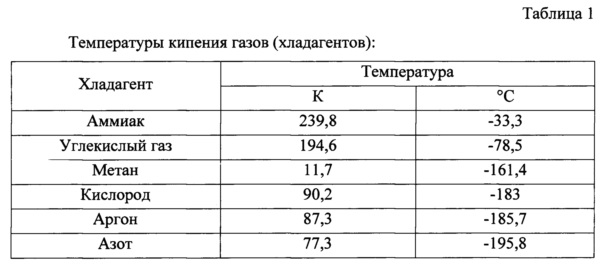
ОВ может значительно варьироваться от места к месту и от сезона к сезону. Поэтому поведение ангидритов и гидратов при фазовом переходе представляет особый интерес для фармацевтических разработок.Кинетический аспект обезвоживания также широко изучался. С термодинамической точки зрения, когда относительная влажность окружающей среды ближе к RH c , движущая сила обезвоживания ниже. Следовательно, скорость обезвоживания должна снизиться. Это действительно наблюдается экспериментально при дегидратации тригидрата амоксициллина. 96 Скорость изотермической дегидратации измеряли в диапазоне давлений водяного пара при 68°C. Дегидратация привела к плохо кристаллической фазе, и кинетическая модель, контролируемая фазовой границей, при всех изученных условиях лучше всего описывала скорости.Когда константы скорости наносятся на график в зависимости от давления водяного пара, независимо от размера используемых образцов, получаются прямые линии, и обе экстраполируются к общей точке пересечения (в пределах экспериментальной ошибки) на оси x (рис. 2.10). Этот перехват соответствует RH c .
2.10). Этот перехват соответствует RH c .
Рисунок 2.10. График зависимости константы скорости дегидратации тригидрата амоксициллина от давления водяного пара. 96
Однако в случае дигидрата карбамазепина константа скорости не следовала той же тенденции (рис.2.11). 97 При обезвоживании гидрата при все более высоком давлении водяного пара скорости сначала уменьшаются, достигают минимума, увеличиваются и проходят через максимум и, наконец, снова уменьшаются. Это явление известно как эффект Смита-Топли . 98–100 Наблюдается при дегидратации многих других гидратов. 101–107 Причиной такого «необычного» поведения является наличие различных продуктов дегидратации при низком и высоком давлении водяного пара.При чрезвычайно низком давлении водяного пара обезвоженная фаза является аморфной. Вода дегидратации должна диффундировать через аморфную матрицу снаружи каждой частицы гидрата. Однако небольшое увеличение давления водяного пара приводит к переходу аморфной обезвоженной фазы в кристаллическую фазу, что создает каналы для выхода воды и способствует обезвоживанию.
