Тепловой эффект реакции при постоянном объеме
Теплоту в термохимическом понимании обозначают Q. Тепловые-эффекты химических реакций выражают в кДж/моль. Различают тепловой эффект реакции при постоянном объеме (изохорный тепловой эффект) и при постоянном давлении (изобарный тепловой эффект). Применяя первый закон термодинамики к химическим процессам (уравнение 11.17), можно записать [c.42]Определите также тепловой эффект реакции при постоянном объеме. [c.60]
Здесь АР — стандартное изменение изохорно-изотермического потенциала при образовании активного комплекса из начальных веществ. То же относится и к величинам Аи и А5. За стандартные состояния здесь выбраны исходные и конечные концентрации, равные единице. Из полученного выражения видно, что скорость реакции определяется не изменением внутренней энергии (т. е. не только тепловым эффектом реакции при постоянном объеме), а изменением изохорно-изотермического потенциала при образовании комплекса.
Формула (11.31) позволяет по величине рассчитывать (или наоборот). Для определения А число молей газообразных ве-шеств, находящихся в левой части химического уравнения, берут со знаком — , а в правой — со знаком + . В справочных таблицах тепловые эффекты приводятся обычно для стандартных условий. Однако таблицы не охватывают всего многообразия химических реакций, поэтому часто тепловые эффекты приходится рассчитывать, используя закон Гесса и следствия, вытекающие из этого закона. Иногда тепловые эффекты вычисляют по теплотам диссоциации (энергия связей атомов, входящих в состав молекулы данного химического соединения). Согласно закону Гесса, тепловой эффект реакции (при постоянных объеме и давлении) не зависит от пути, по которому протекает реакция, а определяется только начальным и конечным состояниями системы. [c.43]
Следовательно, тепловой эффект реакции при постоянном давлении равен теплоте реакции плюс работе, совершенной системой (причем указанная работа может быть положительной, если реакция протекает с увеличением объема, и отрицательной, если реакция протекает с уменьшением объема). Тепловой эффект реакции при постоянном объеме численно равен теплоте реакции. [c.49]
Тепловой эффект реакции при постоянном объеме численно равен теплоте реакции. [c.49]
Д 7 — тепловой эффект реакции при постоянном объеме для записанного стехиометрического уравнения, дж. [c.16]
Для химической реакции теплоту Qy и Qp, выражаемую соотношениями (62.2) и (62.3), называют тепловым эффектом реакций при постоянном объеме и постоянном давлении. Под тепловым эффектом химической реакции понимают количество теплоты, которое выделяется или поглощается при условиях а) процесс протекает необратимо при постоянном объеме или давлении б) в системе не совершается никаких работ, кроме работы расширения системы в) продукты реакции имеют ту же температуру, что. и исходные вещества.
Тепловой эффект реакции при постоянном объеме (Оу), называемый теплотой реакции, будет [c.522]
Используя вместо энтальпии внутреннюю энергию, можно получить аналогичный результат для тепловых эффектов реакций при постоянном объеме [c. 47]
47]
Ранее в термохимии для тепловых эффектов реакций при постоянном объеме Qv и постоянном давлении Qp были приняты знаки, обратные знакам изменений термодинамических функций U и Н. Так, для экзотермических реакций, сопровождающихся выделением тепла, эффект считался положительным, а в эндотермических, где тепло придается системе, — отрицательным [c.20]
Тепловой эффект реакции при постоянном объеме или постоянном давлении не зависит от пути реакции, а зависит только от природы и состояния исходных веществ и продуктов реакции. [c.26]
Тепловой эффект реакции при постоянном объеме (3 равен разности внутренних энергий продуктов реакции и исходных веществ [c.29]
Тепловой эффект реакции при постоянном объеме и температуре Т равен Qy, при постоянном давлении и [c.91]
Тепловой эффект реакции при постоянном объеме и температуре Т соответствует изменению внутренней энергии системы в ходе реакции. [c.91]
[c.91]
Пли, учитывая, что -ЛЯ = Qp Qp — тепловой эффект реакции при постоянном давлении), а. -Аи = Q (Q — тепловой эффект реакции при постоянном объеме), получаем [c.35]
Тепловой эффект реакции при постоянном объеме
Первое и второе начала термодинамики. Закон Гесса. Закон Кирх-гоффа. Теплоемкости при постоянном объеме и при постоянном давлении Срь Зависимость теплоемкостей от температуры. Тепловые эффекты реакции при постоянном объеме и при постоянном давлении. Связь между ними. Теплота растворения. Теплота разбавления. Теплота диссоциации. Теплота нейтрализации. Нейтрализация сильных и слабых кислот и оснований. Устройство простейшего калориметра. Методика калориметрического опыта. Термометр Бекмана и обращение с ним. Вычисление водяного эквивалента (водяного числа) калориметра из теплоемкостей отдельных его частей. График хода температуры в предварительном, главном и заключительном периодах. опыта. Поправка на тепловой обмен с окружающей средой. [c.42]
Поправка на тепловой обмен с окружающей средой. [c.42]
Aur)j —тепловой эффект реакции при постоянном объеме прп преврай нип или образовании единицы массы /, дж1кг. и—общпй коэффициент теплопередачи, вт-м — град . [c.16]
Для реакций с У= onst (3) тепловой эффект реакции при постоянном объеме равен убыли внутренней энергии системы. [c.228]
Изменение внутренней энергии согласно (П1.2) равно тепловому эффекту реакции при постоянном объеме, и поэтому AU можно измерить непосредственно. Принципиально AUo можно рассчитать из калорических данных, однако в правой части уравнения (VIII.5) остается тогда в качестве неизвестной величины константа интегрирования AiSo. В этом случае неопределенность ее значения приводит к затруднению в проведении соответствующего расчета, и это затруднение не может быть разрешено с помощью первых двух начал термодинамики. [c.183]
Так как все вещества отличаются между собой запасом внутренней энергии, то при любом химическом превращении происходит изменение этой величины.
Ответы на вопрос «Тепловой эффект химической реакции. Связь между Q(р) …»
Тепловой эффект реакции, алгебраическая сумма теплоты, поглощённой при данной реакции химической, и совершенной внешней работы за вычетом работы против внешнего давления. Если при реакции теплота выделяется или работа совершается системой, то соответствующие величины входят в сумму со знаком минус.
Т. э. р. зависит от температуры и давления (или объёма): зависимость от температуры выражаетсяКирхгофа уравнением. Для сравнения Т. э. р. и упрощения термодинамических расчётов все величины Т. э. р. относят к стандартным условиям (все реактанты находятся в стандартных состояниях). Данные по Т. э. р. получают непосредственно (см. Калориметрия)либо при изучении равновесия химического при различных температурах, а также путём расчёта, например по теплотам образования всех реагентов. При отсутствии исходных данных они могут быть оценены с помощью приближённых методов вычисления, основанных на закономерных связях между теплотами образования (теплотами сгорания) и химическим составом веществ.
где DH=Qp — тепловой эффект, равный изменению энтальпии системы вследствие р-ции, DСр — изменение теплоемкости системы. Если р-цию записать в форме где vi — стехиометрия, коэф. в-ва Ai (vi>0 для продуктов р-ции, vi<0 для исходных в-в), то DH и DСр рассчитывают по ф-лам:
где Hi — парциальная молярная энтальпия в-ва Аi, Срi — его парциальная молярная теплоемкость; тепловой эффект относят к одному пробегу р-ции, при к-ром число молей i-го в-ва изменяется на величину vi. Значение DH (DСр) представляет разность между энтальпиями (теплоемкостями) продуктов р-ции и исходных в-в, взятых в стехиометрич.
 соотношении. При расчетах Hi и Срi приравнивают обычно соответствующим значениям для чистого в-ва Аi. Для р-ции при постоянном объеме Кирхгофа уравнение имеет вид:
соотношении. При расчетах Hi и Срi приравнивают обычно соответствующим значениям для чистого в-ва Аi. Для р-ции при постоянном объеме Кирхгофа уравнение имеет вид: где DU=Qv — тепловой эффект, равный изменению внутр. энергии системы при одном пробеге р-ции; разность теплоемкостей СVпродуктов р-ции и исходных в-в. Кирхгофа уравнение позволяет рассчитать тепловой эффект р-ции при любой т-ре Т2, если известен тепловой эффект для к.-л. одной т-ры T1 и имеются данные о зависимости теплоемкостей участвующих в р-ции в-в от т-ры в интервале между Т1 и Т2. Интегрируя ур-ние (1), получим:
где DHT1 и DHT2 тепловые эффекты р-ции при т-рах Т1 и Т2. В частности, широко применяется след, форма ур-ния (4):
Здесь DH0 — гипотетич. тепловой эффект, к-рый бы наблюдался, если бы принимаемые в расчетах температурные зависимости теплоемкости были справедливы вплоть до абс. нуля т-р. Ур-ние (1) применяют для приближенного определения зависимости теплот испарения и сублимации от т-ры.
 В этих случаях DСр=Спарр-С*p (или Српар-Сртв). Однако при точных вычислениях следует учитывать, что с изменением т-ры равновесное давлениедвухфазной системы изменяется. Ур-ния (1) и (2) выведены Г. Р. Кирхгофом в 1858. Н А Смирнова
В этих случаях DСр=Спарр-С*p (или Српар-Сртв). Однако при точных вычислениях следует учитывать, что с изменением т-ры равновесное давлениедвухфазной системы изменяется. Ур-ния (1) и (2) выведены Г. Р. Кирхгофом в 1858. Н А Смирнова
Тепловой эффект (теплота) реакции — Энциклопедия по машиностроению XXL
Тепловым эффектом Q реакции называется количество теплоты, которой система обменивается с внешней средой при условии, что температура до и после реакции остается одной и той же. Знаки теплоты, подводимой к системе или отводимой от нее, и теплового эффекта реакции противоположны. Поэтому тепловой эффект экзотермической реакции считается отрицательным, а эндотермической — положительным. [c.297]В 1748 г. М. В. Ломоносов в письме к Эйлеру, высказывая мысль о законе сохранения вещества и распространения его на движение материи, писал Тело, которое своим толчком возбуждает другое тело к движению, столько же теряет от своего движения, сколько сообщает другому .
 В 1755 г. Французская Академия наук раз и навсегда объявила, что не будет больше принимать каких-либо проектов вечного двигателя. В 1840 г. Г. Г. Гесс сформулировал закон о независимости теплового эффекта химических реакций от промежуточных реакций. В 1842—1850 гг. многие исследователи (Майер, Джоуль и др.) пришли к открытию принципа эквивалентности теплоты и работы.
[c.30]
В 1755 г. Французская Академия наук раз и навсегда объявила, что не будет больше принимать каких-либо проектов вечного двигателя. В 1840 г. Г. Г. Гесс сформулировал закон о независимости теплового эффекта химических реакций от промежуточных реакций. В 1842—1850 гг. многие исследователи (Майер, Джоуль и др.) пришли к открытию принципа эквивалентности теплоты и работы.
[c.30]Калориметрическим путем можно определить количество теплоты, полученное (отданное) телом, тепловые эффекты химических реакций, эффекта реакций горения топлив, тепловые эффекты фазовых переходов и т. д. [c.30]
Уменьшение внутренней энергии 1 — Uj называется тепловым эффектом химической реакции. Тепловой эффект реакции слагается из выделенной при реакции теплоты и внешней работы. При обратимых процессах получается максимальная работа, и реакция сопровождается минимальным выделением тепла [c.174]
По определенным таким образом энергиям диссоциации одних молекул можно рассчитать энергии диссоциации других молекул, образующихся из них в результате химических реакций, если известны тепловые эффекты этих реакций. Так, по определенным из спектроскопических данных энергиям диссоциации О2 и N2 и термохимической теплоте образования N0 можно рассчитывать энергию диссоциации молекулы N0.
[c.66]
Так, по определенным из спектроскопических данных энергиям диссоциации О2 и N2 и термохимической теплоте образования N0 можно рассчитывать энергию диссоциации молекулы N0.
[c.66]
Следует отметить также, что для разрешения некоторых вопросов часто бывает недостаточно иметь данные только о тепловых эффектах химических реакций, но необходимо располагать данными и о других тепловых величинах теплотах растворения, смешения, разбавления, адсорбции, теплотах радиохимических, радиационных и многих других процессов. Получение этих величин также является задачей термохимии. [c.9]
Для изучения термодинамических свойств вешеств методами калориметрии наиболее часто определяются тепловые эффекты химических реакций, теплоемкости веществ и теплоты фазовых переходов. Как тепловые эффекты химических реакций, так и теплоемкости веществ значительно изменяются с температурой. [c.77]
Отметим, что использование подобного рода нагревателей для достижения высоких температур связано с выделением ими большого количества теплоты (тепловая инертность их довольно велика).
 Поэтому, даже при измерении достаточно больших тепловых эффектов изучаемых реакций количество затраченной на на-
[c.156]
Поэтому, даже при измерении достаточно больших тепловых эффектов изучаемых реакций количество затраченной на на-
[c.156]Иногда изучаемые реакции инициируют нагреванием реагентов не электрической энергией, а теплотой, выделяющейся при проведении в калориметре вспомогательной реакции. Этот способ прост, поскольку не нужно заботиться ни о конструкции нагревателей, ни об измерении введенной в калориметр электрической энергии, однако при этом невозможно контролировать температурный режим нагреваемого объекта, что часто является весьма желательным. Кроме того, продукты вспомогательной реакции, как правило, усложняют конечное состояние, а в ряде случаев могут привести к побочным тепловым процессам. Наконец, точность, с которой определены тепловые эффекты вспомогательных реакций, обычно ниже точности измерения электрической энергии. [c.161]
У.2.8. Тепловой эффект химической реакции — сумма теплоты, поглощенной системой, и всех видов работы совершенной над ней, кроме работы внешнего давления, причем все величины отнесены к одинаковой температуре начального и конечного состояния системы. Т. э. х. р., протекающей при постоянном объеме, равен — /, и называется изохорным тепловым эффектом, а протекающий при постоянном давлении — равен Я, — Я, и называется изобарным тепловым эффектом.
[c.43]
Т. э. х. р., протекающей при постоянном объеме, равен — /, и называется изохорным тепловым эффектом, а протекающий при постоянном давлении — равен Я, — Я, и называется изобарным тепловым эффектом.
[c.43]
В теплотехнических задачах оказывается необходимым определение тепловых эффектов многих химических реакций. Но определение их опытным путем и составление таблиц тепловых эффектов бесчисленных реакций — задача практически неразрешимая. Однако наличие теплот образования сравнительно небольшого числа элементов, неорганических и органических соединений дает возможность, согласно четвертому следствию закона Гесса, определять тепловые эффекты любых реакций. [c.354]
Первый вариант состоит в измерении количества теплоты, выделяемой в тепловом источнике за ограниченный промежуток времени (метод периодического ввода тепла). Количество теплоты вычисляют по формуле (1.1). Этот вариант используют для определения тепловых эффектов различных реакций (теплоты сгорания, скрытой теплоты фазового перехода, теплоты адсорбции), для измерений теплоемкости твердых и жидких веществ. [c.10]
[c.10]
Тепловой эффект химической реакции, рассчитанный на 1 моль полученного вещ тва в килокалориях или килоджоулях, принято обозначать Q. Следует различать тепловые эффекты ре -ции, проведенной в изохорических Qv или в изобарических Qp условиях. В первом случае выделяется только теплота, а во втором, кроме выделения теплоты, может совершаться и работа прп изменении объема системы вследствие перегруппировки молекул во время химической реакции. [c.181]
Проточные калориметры предназначены для исследования жидких и газообразных веществ в потоке. С их помощью можно определять тепловые эффекты химических реакций, теплоту смешения газов и растворов и, если последняя известна, концентрацию растворов. Кроме того, проточные калориметры можно использовать для измерения удельной теплоемкости текучих сред, пропуская через среду известный тепловой поток. [c.142]
Если проточный калориметр используется для определения теплового эффекта химической реакции двух сливающихся жидкостей (рис. 9.27), реакционный объем обычно непостоянен. Кроме того, по ходу реакции изменяются плотность, скорость течения и удельная теплоемкость реакционной системы, а следовательно, и градуировочный коэффициент, который при данных условиях определить чрезвычайно трудно. Такие калориметры, за редким исключением, можно использовать только для измерения теплот реакции в разбавленных растворах, когда можно пренебречь изменениями величин V, р, С, определяющих градуировочный коэффициент проточного калориметра. В любом случае скорость течения к и координата Х2 должны быть выбраны таким образом, чтобы в точке Хг реакция уже завершилась. Кинетика реакции при этом, естественно, не может быть исследована.
[c.146]
9.27), реакционный объем обычно непостоянен. Кроме того, по ходу реакции изменяются плотность, скорость течения и удельная теплоемкость реакционной системы, а следовательно, и градуировочный коэффициент, который при данных условиях определить чрезвычайно трудно. Такие калориметры, за редким исключением, можно использовать только для измерения теплот реакции в разбавленных растворах, когда можно пренебречь изменениями величин V, р, С, определяющих градуировочный коэффициент проточного калориметра. В любом случае скорость течения к и координата Х2 должны быть выбраны таким образом, чтобы в точке Хг реакция уже завершилась. Кинетика реакции при этом, естественно, не может быть исследована.
[c.146]
Теплотой сгорания топлива называют количество тепла, выделяемого 1 кг или 1 нм топлива при полном его сгорании. Другими словами, теплота сгорания топлива есть тепловой эффект химической реакции горения топлива, отнесенный к 1 кг или 1 нм его. [c.
 25]
25]Необходимо также иметь в виду, что в калориметрической бомбе процесс горения топлива происходит при постоянном объеме, в то время как в топочных устройствах паровых котлов топливо сжигается при практически постоянном давлении, равном атмосферному. Тепловые эффекты химических реакций, протекающих при постоянном объеме и постоянном давлении, различны, а следовательно, и различна теплота сгорания топ лива, сжигаемого в калориметрической бомбе и в топке парового котла Однако ввиду того, что разница между ними для различных топлив неве лика и составляет менее 1%, ею в практических расчетах пренебрегают [c.26]
Таким образом, в ходе химической реакции энергия в форме теплоты может подводиться к продуктам реакции, или отводиться от них. Если наблюдать за продуктами реакции тепловой энергии к продуктам реакции она как бы затрачивается а поэтому ей приписывали знак минус. Следовательно, тепловой эффект эндотермической реакции записывали со знаком минус. Если тепловая энергия в ходе реакции отводилась от продуктов, то получали прибыль энергии, которую записывали со знаком минус. Такое правило знаков существовало до тех пор, пока в термодинамике не было установлено правило знаков с позиций системного подхода к исследованию явлений природы. Термодинамический подход требует строгого установления объекта исследования и его границ. В данном случае изучаемой системой являются продукты химической реакции. Ранее нами было установлено следующее правило термодинамических знаков
[c.291]
Такое правило знаков существовало до тех пор, пока в термодинамике не было установлено правило знаков с позиций системного подхода к исследованию явлений природы. Термодинамический подход требует строгого установления объекта исследования и его границ. В данном случае изучаемой системой являются продукты химической реакции. Ранее нами было установлено следующее правило термодинамических знаков
[c.291]
Один тот факт, что, зная теплоты образования веществ, можно рассчитывать тепловые эффекты химических реакций с их участием, делает теплоты образования весьма важными для термохимии величинами. Ведь зная тепловой эффект реакции, можно предсказать ее вероятное направление, хотя при не очень больших температурах. [c.298]
Экспериментально величину 5° можно определить по значениям теплоемкостей и теплот фазового перехода при нагревании вещества от О К до Т. Энтропия 5° может быть определена также при использовании соотношений, полученных из статистической механики, если имеется достаточная информация по молекулярной структуре и спектрам. Для ДЯ такой подход невозможен. Для определения ДЯ при некоторой температуре всегда следует использовать экспериментальные данные по тепловому эффекту химической реакции или теплоте сгорания. Это значение АН° может быть пересчитано на другие температуры по уравнению (7.12). Аналогично, если 5 известна при некоторой температуре Т , то
[c.251]
Для ДЯ такой подход невозможен. Для определения ДЯ при некоторой температуре всегда следует использовать экспериментальные данные по тепловому эффекту химической реакции или теплоте сгорания. Это значение АН° может быть пересчитано на другие температуры по уравнению (7.12). Аналогично, если 5 известна при некоторой температуре Т , то
[c.251]
Для разложения химического соединения нужно затратить такое количество тепла, которое было выделено при образовании данного химического соединения. Тепловой эффект химических реакций характеризует прочность химического соединения чем больше тепла выделилось прн образовании, тем оно более прочно и тем труднее выделить элемент из соединения. Ниже приводятся теплоты образования некоторых окислов. [c.295]
Эта работа может быть меньше теплоты сгорания Q, а может быть и больше, в зависимости от знака dL , /dT. Расчеты показывают, что для большинства ископаемых топлив L aK Q- Таким образом, эксергия органического топлива (в расчете на единицу его массы) примерно равна теплоте его сгорания, т. е. теоретически в работу можно превратить весь тепловой эффект реакции, например, в топливных элементах. Физически это понятно, поскольку в своей основе химическая реакция связана с переходом электронов в веществе организовав этот переход, можно сразу получить электрический ток.
[c.56]
е. теоретически в работу можно превратить весь тепловой эффект реакции, например, в топливных элементах. Физически это понятно, поскольку в своей основе химическая реакция связана с переходом электронов в веществе организовав этот переход, можно сразу получить электрический ток.
[c.56]
Тепловой эффект реакции равен сумме теплот образования конечных продуктов реакции минус сумма теплот образования исходных веш,еств [c.298]
Тепловой эффект реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции-. [c.298]
Определить теплоту сгорания 1 кг СО и 1 кг Hj при постоянном давлении и температуре t = 25° С, если известно, что тепловые эффекты реакций сгорания СО в Oj и в HjO при постоянном объеме и топ же температуре соответственно равны Qu со = 281 931 кДж/кмоль Qu = = 282 287 кДж/кмоль (с образованием воды). [c.304]
Теплотой сгорания данного вещества называется количество теплоты, выделяющейся при полном сгорании единицы массы или единицы объема вещества. Очевидно, теплота сгорания СО есть не что иное, как тепловой эффект реакции, отнесенный к 1 кг или 1 м вещества при нормальных условиях. Следовательно, теплота сгорания СО при постоянном давлении
[c.304]
Очевидно, теплота сгорания СО есть не что иное, как тепловой эффект реакции, отнесенный к 1 кг или 1 м вещества при нормальных условиях. Следовательно, теплота сгорания СО при постоянном давлении
[c.304]
Термодинамика гальванических и топливных элементов. Применим уравнение (10.2) к электрохимическим генераторам — гальваническим и топливным элементам. Для этого установим связь между э.д.с. элемента и тепловым эффектом реакции, происходящей в элементе при его работе, в случае, когда изменение его внутренней энергии идет не на выделение теплоты, а на работу электрических сил. [c.179]
Рассмотрим обратимый элемент, в котором при пропускании тока в противоположном направлении происходят обратные химические реакции (например, элемент Даниэля). При малых токах джоулева теплота, пропорциональная квадрату силы тока, есть величина второго порядка малости и поэтому процесс протекания тока в элементе можно считать термодинамически обратимым. Работа элемента при прохождении через него заряда е равна ei. Уменьшение внутренней энергии равно тепловому эффекту реакции при постоянном атмосферном давлении Q , и уравнение (10.2) дает eS = Qp + Te dS dT)p и
[c.179]
Уменьшение внутренней энергии равно тепловому эффекту реакции при постоянном атмосферном давлении Q , и уравнение (10.2) дает eS = Qp + Te dS dT)p и
[c.179]
Мощность внутренних источников теплоты при теплообмене в химически реагирующем газе определяется тепловыми эффектами реакции. Поэтому действие внутренних источников теплоты 1 южно учесть заменой энтальпии на полную энтальпию и уравнению (9.28) придать вид [c.368]
Формула (9.18) отражает одну из основных особенностей теплообмена химически реагирующей газовой смеси в явном виде. Из формулы видно, что теплота, переданная в процессе теплоотдачи, определяется разностью полных энтальпий, от вывод можно истолковать следующим образом. Если частица инертного теплоносителя с температурой Tf достигла стенки с температурой то переданная стенке теплота определяется разностью энтальпий, которая пропорциональна разности температур. В химически реагирующем газе изменение температуры частицы означает не только измененне ее энтальпии. Из-за изменения условии химического равновесия в частице произойдут химические реакции с поглощением или выделением теплоты. Переданная частицей теплота определится изменением ее энтальпии и тепловым эффектом химической реакции, т. е, изменением полной энтальпии.
[c.364]
Из-за изменения условии химического равновесия в частице произойдут химические реакции с поглощением или выделением теплоты. Переданная частицей теплота определится изменением ее энтальпии и тепловым эффектом химической реакции, т. е, изменением полной энтальпии.
[c.364]
Открытие первого, второго и третьего начал термодинамики. Основателями первого начала термэдинамиин счигакэтся Майер, Джоуль, Гельмгольц, а само открытие первого начала термодинамики относится к 40-м годам XIX в. Однако еще задолго до этого Ломоносов, исходя из своих изысканий по теории теплоты и горения, сформулировал объединенный закон сохранения материи и движения, из которого вытекал закон сохранения энергии. Важную роль сыграли также терм Jxкмичe киe исследования Гесса и открытый им закон независимости суммарного теплового эффекта химической реакции от пути и последовательности осуществления составляющих реакций. Об этих исследованиях Планк позже писал, что убеждающая справедливость этого положения происходит вне сомнения от идеи, что теплота не мо жет быть получена из ничего. [c.153]
[c.153]
Тепловым эффектом химической реакции называют гумму теплоты, поглощенной системой, и всех видов работь над ней, кроме работы внешнего давления, причем вeли ины отнесены к одинаковой температуре начального и конечного состояний системы. [c.66]
V — onst или Р = onst величины SQy и bQp являются полными дифференциалами, что и утверждает закон Гесса. Закон Гесса широко используется при термохимических расчетах. Он позволяет определять тепловые эффекты реакций вычислительным путем. Тепловые эффекты химической реакции зависят от температуры, при которой протекает реакция. Поэтому табличные данные для тепловых эффектов и других термодинамических функций принято относить к температуре 25° С. Специальные стандартные таблицы позволяют легко подсчитать тепловой эффект химической реакции, если известны теплоты образования всех участвующих в ней веществ. [c.45]
Это следствие вытекает из предыдущего, если представить, что в состоянии 1 (см. рис. 163, б) имеются простые вещества, которые в реакции 1-2 превращаются в какое-то сложное соединение 2, а в реакции 1-2 —в другое сложное соединение 2, причем С иС ] являются теплотами образования этих сложных веществ. Если их обозначить соответственно через Qoбp. 2 и С обр. 2-, а Q считать по-прежнему тепловым эффектом в реакции 2 -2 между обоими сложными соединениями, то в соответствии с законом Гесса для реакций 1-2 -2 и 1-2 можно написать, что
[c.354]
рис. 163, б) имеются простые вещества, которые в реакции 1-2 превращаются в какое-то сложное соединение 2, а в реакции 1-2 —в другое сложное соединение 2, причем С иС ] являются теплотами образования этих сложных веществ. Если их обозначить соответственно через Qoбp. 2 и С обр. 2-, а Q считать по-прежнему тепловым эффектом в реакции 2 -2 между обоими сложными соединениями, то в соответствии с законом Гесса для реакций 1-2 -2 и 1-2 можно написать, что
[c.354]
В отличие от ван-дер-ваальсовой Л. поверхностные химич. реакции характеризуются более медленным течением цроцесса, причем скорость их возрастает с темп-рой, что указывает на необходимость анергии активации для их осуществления. Тепловой эффект этих реакций во многих случаях превышает Порядо) теплот обычных химич. реакций (напр. 0 на угле) благодаря тому, что пространственная решетка твердого тела остается неизменной, и наблюдаемый тепловой эффект соответствует энергии возникновения химич. связи на поверхности. Процесс как правило необратим, и адсорбированное вещество путем одного лишь понижения концентрации или давления (напр, путем откачки в случае газов) обратно пз твердого тела не выделяется.
[c.188]
Процесс как правило необратим, и адсорбированное вещество путем одного лишь понижения концентрации или давления (напр, путем откачки в случае газов) обратно пз твердого тела не выделяется.
[c.188]
Закон постоянства сумм теплоты является основным законом термохимии. Тепловой эффект химической реакции при /=соп81 зависит только от начального и конечного состояния системы и не зависит от того, каким путём система переходит от начального состояния к конечному. [c.325]
Расчеты зоны И] или участка II». Определяем плотность теплового потока, получаемого нагреваемым металлом в сечснии 2 (или 2 ), как среднюю для всей печи. Имея принягае размеры печн и нагреваемых изделий, расположение последних в печи, заданную производительность Р (кг/с) и соответствующий технологии интервал удельных теплот нагреваемого материала Д/м (кДж/кг), а также величину теплового эффекта экзотермических реакций ( окз (кДж/кг), находим указанную плотность теплового потока (для двухзонных печей это будет qiK )
[c. 212]
212]
Если под минимальной работой химической реакции понимать работу, связанную только с изменением объема вещества, то при неизменном тепловом эффекте теплота для этих реакций будет иметь максимальное значение. Обозначив изотермических реакций через Qv, а для изобарно-изотермических — через Qp, получим [c.185]
Положение о независимости теплового эффекта реакции от ее промежуточных стадий было экспериментально установлено Гессом и сформулировано в форме закона. Очевидно, что закон Гесса является частным случаем первого закона термодинамики для химических реакций, протекающих при V,T- onst и Т,р=сопз1, Исходя из этого закона, можно вычислять тепловые эффекты реакций, используя так называемые стандартные величины тепловых эффектов (теплот) образования и тепловых эффектов (теплот) сгорания. Тепловой эффект называется стандартным, если исходные вещества и продукты реакции находятся в стандартном состоянии, за которое принимается устойчивое состояние вещества при р=р°=0,1013 МПа и Т=Т°=298,15 К. [c.254]
[c.254]
Убыль внутренней энергии U — 112 = — можно определить из опыта, когда система переходит из состояния с энергией в состояние с энергией U2 без совершения работы (при постоянных объеме V и других внешних параметрах Д в сложной системе). Она в этом случае равна — Af/=—0 = количеству выделяющейся теплоты или тепловому эффекту перехода (например, тепловому эффекту реакции в калориметрической бомбе Бертло). Таким образом получаем уравнение Гиббса — Гельмгольца для полной работы системы (против всех сил) при любом изотермическом процессе [c.178]
Приведем пример репления термохимических уравнений для вычисления теплового эффекта реакции неполного сгорания твердого углерода в окись углерода. Это количество теплоты не может быть непосредственно измерено потому, что при окислении углерода образуется смссь окислов СО и Oj. [c.297]
Если реакция происходит при K= onst, то по первому началу Q = U2 — Ui, а тепловой эффект реакции Q= —Q=Vi — U2- Дифференцируя это выражение по Т, получаем уравнение Кирхгофа для температурной зависимости теплоты реакции при изохорных процессах
[c. 298]
298]
Термохимия. Расчет тепловых эффектов химических реакций
1. Термохимия.
Расчет тепловыхэффектов химических
реакций.
2. Закон Гесса.
• Термодинамическая основа закона Гесса –независимость теплового эффекта химической реакции
от способа её проведения.
QP H
QV U
• Закон Гесса – следствие I начала термодинамики.
При постоянном давлении или объеме тепловой
эффект химической реакции зависит только от вида и
состояния исходных веществ и продуктов реакции,
но не зависит от пути протекания процесса.
3. Применение закона Гесса
ММетод термохимических
схем
Метод термохимических
Метод
термохимических
уравнений
Если из одних и тех же
реагентов
можно
получить одни и те же
продукты
различными
способами, то при любом
способе
проведения
химической реакции её
тепловой эффект будет
одинаковым.

Тепловой эффект реакции
можно определить через
известные
тепловые
эффекты других реакций,
если из них возможно
получить искомую.
уравнений
4. Метод термохимических схем
+О2Метод
термохимических
уравнений
Н1
Н2
(1)
(2)
(3)
Н3
+1/2 О2
+1/2 О2
Н2 = -110,53 кДж/моль
Н3 = -282,98 кДж/моль
Сложение уравнений (2) и (3)
дает уравнение (1).
Н2 + Н3 = -393,51 кДж/моль
Н1 = -393,51 кДж/моль
Поэтому:
Н1= Н2 + Н3
5. Следствия из закона Гесса.
Следствие 1. Тепловой эффект химической реакции равенразности энтальпий образования продуктов реакции и
исходных веществ с учетом их стехиометрических
коэффициентов:
r H T0 j f H 0j продуктов i f H i0исх. веществ
j
i
fH
0
i Т — стандартная энтальпия образования i-того вещества при
температуре Т и давлении 1 атм.
• Стандартной
энтальпией образования вещества называют тепловой
эффект реакции образования 1 моля этого вещества из простых
веществ, находящихся в термодинамически устойчивом состоянии.

0
f H 298
Na SiO :
2
3
2 Na кр Si кр 1,5O г Na SiO
2
2
3
Следствие 2. Тепловой эффект химической реакции равен
разности энтальпий сгорания исходных веществ и
продуктов реакции с учетом их стехиометрических
коэффициентов:
0
0
0
r H T i C H i исх.веществ j C H j продуктов
i
0
C H i
Т
j
— стандартная энтальпия сгорания i-того вещества
при температуре Т и давлении 1 атм.
• Стандартной энтальпией сгорания вещества называют
тепловой эффект реакции полного окисления 1 моля этого
вещества.
0
C H 298 C H OH :
2
5
C2H5OH + 3O2 = 2CO2 + 3h3O
7. Зависимость тепловых эффектов химических реакций от температуры.
Теплоемкость.Уравнение Кирхгофа.
• Расчеты тепловых эффектов реакций на основе
следствий из закона Гесса с использованием справочных
термодинамических данных ограничены стандартными
условиями (Р = 1 атм; Т=298 К).

• Тепловые эффекты химических реакций зависят от
температуры,
т.к.
при
изменении
температуры
изменяются теплоемкости веществ – участников реакции.
• Теплоемкость – количество теплоты, необходимое для
нагревания 1 моля или 1 грамма (1 кг) вещества на один
градус.
С – молярная теплоемкость, Дж/(моль•К)
СУД – удельная теплоемкость, Дж/(г•К) или Дж/(кг•К)
По условиям измерения:
СP – изобарная теплоемкость,
СV – изохорная теплоемкость,
• Средние теплоемкости
измеряются на определенном
интервале температур
• Истинные теплоемкости
соответствуют бесконечно
малому изменению температуры
• Изобарная теплоемкость
• Изохорная теплоемкость
Q
Q
С
T2 T1 T
C lim C
T 0
Q
dT
Q
dH
CP
dT
dT
P
Q
dU
СV
dT
dT
V
dH dU d U PV dU d PV d RT
dT
C P CV
R
R
dT dT
dT
dT
dT
dT
PV RT n 1 моль
10.
 В широком интервале температур зависимость теплоемкости веществ от температуры выражается в виде интерполяционных уравнений, где a, b, c, c‘ – эмпирические коэффициенты:
В широком интервале температур зависимость теплоемкости веществ от температуры выражается в виде интерполяционных уравнений, где a, b, c, c‘ – эмпирические коэффициенты:2
Cp a bT cT c T
2
Cp a bT c T для неорганических веществ
2
C p a bT cT 2 для органических веществ
11. Уравнение Кирхгофа и его интегрирование
d UC
V
dT
d H
C P
dT
T
2
T
2
d H C dT
T
1
P
T
(1)
(2)
1
T2
H T H T C P dT
2
1
(3)
T1
1) ∆СР = const
H T H T C T T
2
1
P 2
1
(4)
CP jCP0 j
(5)
j
продуктов i iCP0 i исх.веществ
12. На практике интегрирование обычно проводят от стандартной температуры 298 К до заданной Т, при которой протекает реакция:
THT H
o
298
C dT
p
298
0
H T0 H 298
C P T 298
(6)
Величина изменения теплоемкости в ходе реакции ∆СР
рассчитывается по уравнению (5) при Т=298 К и Р=1атм.

на основании справочных данных.
Стандартный тепловой эффект реакции
рассчитывается по следствиям из закона Гесса.
2) ∆CP = f(T),
C p a bT cT 2 c T 2
(7)
T2
H T H T a bT cT 2 c T 2 dT
2
1 T
1
H
T
2
T
1
T
2
T
2
2
T
2
adT bTdT cT dT
T
1
T
1
T
1
T
1
c dT
T2
b 2
c 3
2
3
H T H T a T T
T T
T T
2
1
2
1
1
1
2 2
3 2
(8)
1
1
c
T
T
2
1
Т1 298 К ; Т 2 Т
0
HT0 H 298
a T 298
1
1
c
T 298
b 2
c 3
T 298 2
T 2983
2
3
(9)
Т1 298 К ; Т 2 Т
HT0
0
H 298
b 2
c 3
2
a T 298
T 298
T 2983
2
3
1
1
c
T 298
(9)
Т1 0 К ; Т 2 Т
HT0
H 00
b 2 c 3 c
aT
T
T
2
3
T
(10)
Т1 0 К ; Т 2 298 К
H 2980 H 00
b
c
3 с
298 a 298
298
2
3 298
2
(11)
T
d H
0
298
d H
0
10 9 11
T
d H
298
b
298 a 298
2
c
3 с
298
3
298
H 00
0
∆
Закон Гесса.

Химия Закон Гесса.
просмотров — 182
Этот закон был открыт Гессом в 1840 ᴦ. на основании обобщения множества экспериментальных данных.
Формулировка закона Гесса:
Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (ᴛ.ᴇ. реакцию можно проводить в одну, две, три и т.д. стадии).
Закон Гесса основан на том, что Qp и QV – функции состояния (в отличие от Q).
QV = ∆U, V= const,
QP = ∆H, p= const (20)
Рассмотрим процесс перехода от исходных веществ к продуктам реакции при р = const, Т = const. Тогда Qp = DН. Составим так называемый термохимический цикл. Пусть от исходных веществ к продуктам реакции можно перейти тремя различными путями — в одну, две или три стадии:
По закону Гесса DН1 = DН2 + DН3 = DН4 + DН5+ DН6.
Следствия из закона Гесса.
Первое следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот образования из простых веществ (DfH) продуктов реакции и суммой теплот образования из простых веществ исходных веществ (с учетом стехиометрических коэффициентов).
Математическое выражение для первого следствия из закона Гесса можно записать в следующем виде:
(21)
Теплота образования ∆fН — это тепловой эффект реакции образования 1 моль соединения из простых веществ.
Стандартное состояние характеризуется и давлением р = 1 атм = 1·105Па.
Тепловые эффекты, отнесённые к этим условиям, называются стандартными тепловыми эффектами.
Стандартная энтальпия (теплота) образования соединения из простых веществ (DfH0298) –это есть тепловой эффект реакции образования 1 моль данного соединения из соответствующих количеств простых веществ при стандартных условиях.
Простые вещества-это химические элементы или вещества , взятые в тех агрегатных состояниях или кристаллических модификациях, в которых они устойчивы при стандартном состоянии.
Принято, что для простых веществ DfH0298 = 0.
Второе следствие из закона Гесса.
Тепловой эффект реакции равен разности между суммой теплот сгорания (DcH) исходных веществ и суммой теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов).
Математическое выражение для вторго следствия из закона Гесса можно записать в следующем виде:
(22)
Стандартная энтальпия (теплота) сгорания соединения (обозначаемая как DcH0298) –это есть тепловой эффект реакции окисления 1 моль данного сединения газообразным молекулярным кислородом при стандартном условиях с образованием соответствующих количеств следующих веществ (если не указано иначе): СО2, газ, Н2Ожидк. , N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
, N2, газ,. Hhal,(Cl,Br), SO2 газ. и др.
Единицы измерения [DfН] и [DсН] равны кДж/моль, [n] = моль, [DНреакции] = кДж!
Пример 1.1 Рассчитать тепловые эффекты двух следующих реакций:
а) ;
б) ,
если известны стандартные теплоты образования всех компонентов данных реакций.
Решение. Выполним расчеты для 250С и давления 1 атм, приняв условие постоянства давления в ходе реакций. В этом случае тепловой эффект должен быть равен изменению энтальпии системы:
а) ;
б) .
Пример 1.2 Рассчитать тепловой эффект полиморфного превращения 1 моль графита в алмаз при стандартных условиях, если известны стандартные теплоты сгорания графита и алмаза при Т = 298,15 К и Р = 1атм.
1. ;
2.
Решение. Запишем реакцию полиморфного превращения графита в алмаз:
.
Расчет показывает, что
Следовательно, процесс превращения графита в алмаз при стандартных условиях (если бы он имел место) должен был бы происходить с поглощением небольшого количества тепла.
1.7 Связь между Qp и QV для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н º U + pV; тогда
DH = DU + pDV
Qp = QV + pDV
Qp – QV = pDV (23)
В случае если в реакции принимают участие газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона
pDV = DnгазRT, (24)
можно получить выражения:
DH = DU + DnгазRT или Qp = QV + DnгазRT или Qp – QV = DnгазRT,
где Dnгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
ᴛ. ᴇ. (25)
ᴇ. (25)
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, ĸᴏᴛᴏᴩᴏᴇ соответствует их стехиометрическим коэффициентам в уравнении реакции.
Читайте также
В 1841 году российский ученый Г. И. Гесс открыл закон. Изменение энтальпии(или тепловой эффект процесса) зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода. Рассмотрим это на примере реакции горения углерода: … [читать подробенее]
Раздел химии, в котором изучают тепловые эффекты химических реакций, называется термохимией. Термохимия оперирует так называемыми термохимическими уравнениями, представляющими собой обычные химические уравнения, в которых указана величина сопровождающего реакцию… [читать подробенее]
ПРИЛОЖЕНИЯ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ХИМИЧЕСКИМ ПРОЦЕССАМПервое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения. Тепловой эффект (теплота) химической реакции – количество теплоты,… [читать подробенее]
Тепловой эффект (теплота) химической реакции – количество теплоты,… [читать подробенее]
Понятие о термохимии. Термохимия. Закон Гесса. Термохимические уравнения. Раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплотам фазовых переходов, теплотам растворения веществ, разбавления растворов и т.д.,… [читать подробенее]
ПРИЛОЖЕНИЯ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ХИМИЧЕСКИМ ПРОЦЕССАМПервое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения. Тепловой эффект (теплота) химической реакции – количество теплоты,… [читать подробенее]
Понятие о термохимии.
Термохимия. Закон Гесса. Термохимические уравнения.
Раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплотам фазовых переходов, теплотам растворения веществ, разбавления растворов и т. д.,… [читать подробенее]
д.,… [читать подробенее]
Физическая химия Основы химической термодинамики Химическая кинетика и катализ Химическое равновесие Общие свойства растворов Электрохимические процессы. Гальванический элемент. Коррозия металлов Электрохимические процессы. Электролиз Модуль 2…. [читать подробенее]
Энтальпия. Закон Гесса Принцип эквивалентности теплоты и работы. Первое начало термодинамики Если система совершает круговой процесс, т. е. выйдя из какого-то начального состояния и совершив ряд превращений, возвращается в то же самое… [читать подробенее]
Все химические процессы сопровождаются тепловыми эффектами. Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате превращения исходных веществ в количествах, соответствующих уравнению химической реакции. При этом… [читать подробенее]
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате превращения исходных веществ в количествах, соответствующих уравнению химической реакции. При этом… [читать подробенее]
ПРИЛОЖЕНИЯ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ХИМИЧЕСКИМ ПРОЦЕССАМ Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает… [читать подробенее]
Закон Гесса.
Г.И.Гесс (1840) описал закон, получивший его имя и являющийся основным законом термохимии. Закон Гесса устанавливает, что если из данных исходных веществ можно различными путями получить заданные конечные продукты, то независимо от путей получения, ᴛ.ᴇ. от вида промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же.
Иначе говоря, тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон Гесса является вполне строгим только для процессов, протекающих при постоянном объёме (когда тепловой эффект равен ΔU) или при постоянном давлении (когда тепловой эффект равен ΔН). Для этих процессов он легко выводится из общего уравнения первого начала (закон Гесса был установлен раньше, чем было введено уравнение первого начала).
Для большей наглядности в качестве исходных веществ возьмем кислород и уголь (считая его чистым углеродом), а в качестве конечного продукта СО2 (рис.1). Переход от исходных веществ к конечному можно осуществить, непосредственно сжигая уголь до СО2. Но можно также провести процесс в две стадии, получая в первой из них СО и сжигая затем СО во второй стадии до СО2. (При работе газогенераторного двигателя, к примеру в газогенераторном автомобиле, горючее сжигается в генераторе до СО, а уже СО сгорает до СО2 в цилиндрах мотора).
Все эти три процесса находят широкое применение в практике. Закон Гесса позволяет связать тепловые эффекты этих трех процессов простым уравнением:
Закон Гесса позволяет связать тепловые эффекты этих трех процессов простым уравнением:
ΔН1=ΔН2+ΔН3
пользуясь которым легко определить один из них, в случае если другие два известны. В нашем случае можно сравнительно легко измерить тепловые эффекты первого и третьего процессов, но сжигание угля до окиси углерода при невысоких температурах затруднительно. По этой причине возможность определить его тепловой эффект расчетным путем является весьма ценной. Из предыдущего получаем:
ΔН2=ΔН1 -ΔН3 (1.4)
Численные значения ΔН1и ΔН2 зависят от вида применяемого угля. Величина ΔН3 с этим, очевидно, не связана. Количество теплоты, выделяющейся при сгорании одного моля СО при постоянном давлении, составляет 67,636 ккал (при 25°С).
Рис.1. Схема, иллюстрирующая закон Гесса в приложении к реакции окисления угля до СО2
Пусть, к примеру, нас интересует величина ΔН2 при 25 °С для угля, для которого при этой температуре ΔН1 равно —94,0 ккал/моль. Согласно уравнению, определяем:
Согласно уравнению, определяем:
ΔН2= — 94,0 + 67,6 = — 26,4 ккал/моль
Закон Гесса широко применяется при различных термохимических расчетах; он дает возможность вычислить тепловые эффекты процессов, для которых экспериментальные данные отсутствуют, а во многих случаях — и для таких, для которых они не бывают измерены в нужных условиях, или когда процессы еще не осуществлялись. Это относится как к химическим реакциям, так и к процессам растворения, испарения, кристаллизации, адсорбции и др.
Размещено на реф.рф
При этом, применяя данный закон, следует строго соблюдать условия, лежащие в его основе.
Прежде всего крайне важно , чтобы в обоих процессах были действительно одинаковы начальные состояния и действительно одинаковы конечные состояния. При этом одинаковыми должны быть не только химические составы продуктов, но и условия их существования (температура, давление и пр.) и агрегатноесостояние, а для кристаллических веществ – также и кристаллическая модификация. Так, образование одного моля газообразной и одного моля жидкой Н2О из Н2 и О2 при 25 °С сопровождается выделением соответственно 57,798 и 68,317 ккал; разность составляет 10,519 ккал и равна теплоте испарения моля воды в этих условиях. При точных расчетах в случае, в случае если какие-либо из веществ, участвующих в реакциях, находятся в высокодисперсном (т. е. сильно раздробленном) состоянии, значительной оказывается иногда даже и одинаковость степени дисперсности веществ и пр.
Так, образование одного моля газообразной и одного моля жидкой Н2О из Н2 и О2 при 25 °С сопровождается выделением соответственно 57,798 и 68,317 ккал; разность составляет 10,519 ккал и равна теплоте испарения моля воды в этих условиях. При точных расчетах в случае, в случае если какие-либо из веществ, участвующих в реакциях, находятся в высокодисперсном (т. е. сильно раздробленном) состоянии, значительной оказывается иногда даже и одинаковость степени дисперсности веществ и пр.
Очевидно, тепловой эффект будет различен также в зависимости от того, будут ли получаемые или исходные вещества находиться в чистом состоянии или в растворе, отличаясь на величину теплоты растворения.
Опытное определение тепловых эффектов.
Для определения тепловых эффектов, сопровождающих химические реакции, применяются специальные приборы, называемые калориметрами. Калориметрическое определение ведется так, чтобы вся химическая энергия выделялась в виде теплоты или частично затрачивалась па совершение внешней работы расширения газа, которая должна быть учтена. Химическая реакция ведется в сосуде Дьюара. Он представляет собой стеклянный сосуд с посеребренными изнутри двойными стенками, из пространства между которыми выкачан воздух, вследствие чего стенки сосуда почти не проводят теплоты. Для более равномерного теплообмена с окружающей средой сосуд все же помещают обычно в большой термостат, наполненный водой. Во время опыта температура термостата поддерживается постоянной. Сосуд покрыт медной крышкой с тремя отверстиями: для термометра, мешалки и для пробирки. В сосуд и пробирку помещают навески реагирующих веществ, где они находятся до тех пор, пока не уравняется температура всех частей прибора. Определив температуру реагирующих веществ до начала реакции, проводят реакцию и определяют температуру в калориметре после реакции.
Химическая реакция ведется в сосуде Дьюара. Он представляет собой стеклянный сосуд с посеребренными изнутри двойными стенками, из пространства между которыми выкачан воздух, вследствие чего стенки сосуда почти не проводят теплоты. Для более равномерного теплообмена с окружающей средой сосуд все же помещают обычно в большой термостат, наполненный водой. Во время опыта температура термостата поддерживается постоянной. Сосуд покрыт медной крышкой с тремя отверстиями: для термометра, мешалки и для пробирки. В сосуд и пробирку помещают навески реагирующих веществ, где они находятся до тех пор, пока не уравняется температура всех частей прибора. Определив температуру реагирующих веществ до начала реакции, проводят реакцию и определяют температуру в калориметре после реакции.
Зная теплоемкость системы (которая определяется предварительно), можно вычислить количество тепла, приобретенного содержимым калориметра по время реакции, и отсюда — тепловой эффект реакции.
При экспериментальном определении тепловых эффектов химических реакций возникают ошибки и неточности, обусловленные главным образом теплообменом прибора с внешней средой. Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха и лаборатории. При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для измерения температуры пользуются специальными калориметрическими термометрами. Вместе с тем, так как не весь столбик ртути находится при той температуре, какая имеется в калориметре, крайне важно делать поправку на ʼʼвыступающий столбикʼʼ. Об этих поправках, а также о предосторожностях, которые крайне важно соблюдать, чтобы получить верные результаты, сказано подробно в специальных руководствах по практическому проведению термохимических измерений.
Чтобы уменьшить теплообмен, ведут реакцию возможно быстрее и температуру калориметра в начале опыта поддерживают по возможности равной температуре воздуха и лаборатории. При определении изменения температуры тоже может появиться ряд неточностей. Большей частью для измерения температуры пользуются специальными калориметрическими термометрами. Вместе с тем, так как не весь столбик ртути находится при той температуре, какая имеется в калориметре, крайне важно делать поправку на ʼʼвыступающий столбикʼʼ. Об этих поправках, а также о предосторожностях, которые крайне важно соблюдать, чтобы получить верные результаты, сказано подробно в специальных руководствах по практическому проведению термохимических измерений.
На базе калориметрических определений накоплено много данных о тепловых эффектах различных химических реакций, процессов растворения, плавления, испарения и пр.
Читайте также
Понятие внутренней энергии и энтальпии чистого вещества
-
Химическое содержание может быть характеризовано стандартной энтальпией образования
– энтальпия образования 1 моль соединения из простых веществ в стандартных условиях
– для простых. .. [читать подробнее].
.. [читать подробнее].
Энтальпия химических реакций зависит только от вида и состояния исходных веществ и продуктов и не зависит от пути процесса при следующих условиях 1) Р или V = const 2) Единственным видом работы является объемная 3) Температура исходных веществ равна температуре продуктов … [читать подробнее].
В основе термохимических расчетов лежит закон Гесса (1840 г) – тепловой эффект реакции зависит только от состояния исходных веществ и конечных продуктов, но не зависит от количества стадий перехода исходных веществ в продукты реакции. Разберем данный вопрос на примере… [читать подробнее].
В термохимии количество теплоты Q, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом. Реакции, протекающие с выделением тепла, называются экзотермическими (Q>0), а с поглощением тепла — эндотермическими (Q<0). В… [читать подробнее].
В… [читать подробнее].
Герман Иванович Гесс, профессор Петербургского университета, в 1841г. сформулировал закон, который лежит в основе всех термодинамических расчетов. Тепловой эффект зависит только от состояния исходных и конечных продуктов, но не Зависит от пути процесса, т.е. от числа и… [читать подробнее].
ПРИЛОЖЕНИЯ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ХИМИЧЕСКИМ ПРОЦЕССАМ Лекция №2. Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало… [читать подробнее].
Первый закон термодинамики
Взаимосвязь между внутренней энергией, теплотой и работой устанавливает первый закон (начало) термодинамики. Его математическое выражение:
Q = DU + A,
или для бесконечно малого изменения
dQ = dU + dA . (2)
Это означает, что теплота Q,… [читать подробнее].
Его математическое выражение:
Q = DU + A,
или для бесконечно малого изменения
dQ = dU + dA . (2)
Это означает, что теплота Q,… [читать подробнее].
Первый закон термодинамики Взаимосвязь между внутренней энергией, теплотой и работой устанавливает первый закон (начало) термодинамики. Его математическое выражение: Q = DU + A, или для бесконечно малого изменения dQ = dU + dA . (2) Это означает, что теплота Q,… [читать подробнее].
Этот закон был открыт Гессом в 1840 г. на основании обобщения множества экспериментальных данных. Формулировка закона Гесса: Тепловой эффект реакции, протекающей при постоянном давлении (Qp = DН) или при постоянном объеме (QV = DU) и постоянной температуре, определяется только… [читать подробнее].
Особенности термохимических уравнений. Термохимические уравнения
Термохимические уравнения реакций — уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта… [читать подробнее].
Термохимические уравнения
Термохимические уравнения реакций — уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта… [читать подробнее].
Энтальпия — Chemistry LibreTexts
Когда процесс происходит при постоянном давлении, выделяемое тепло (либо выделяющееся, либо поглощаемое) равно изменению энтальпии. Энтальпия (\(H\)) представляет собой сумму внутренней энергии (\(U\)) и произведения давления и объема (\(PV\)) по уравнению:
\[H = U + PV\]
Когда процесс происходит при постоянном давлении, выделяемое тепло (либо выделяющееся, либо поглощаемое) равно изменению энтальпии. Энтальпия — это функция состояния, которая полностью зависит от функций состояния \(T\), \(P\) и \(U\).Энтальпия обычно выражается как изменение энтальпии (\(\Delta H\)) процесса между начальным и конечным состояниями:
\[\Дельта H = ΔU + ΔPV \]
Если температура и давление в процессе остаются постоянными, а работа ограничивается работой давление-объем, то изменение энтальпии определяется уравнением:
\[ \Дельта H = ΔU + PΔV \]
Также при постоянном давлении тепловой поток (\(q\)) для процесса равен изменению энтальпии, определяемому уравнением:
\[ \Дельта H = q \]
Глядя на то, является ли q экзотермическим или эндотермическим, мы можем определить соотношение между \(\Delta H\) и \(q\). Если реакция поглощает тепло, она является эндотермической, что означает, что реакция потребляет тепло из окружающей среды, поэтому \(q > 0\) (положительно). Следовательно, при постоянной температуре и давлении, согласно приведенному выше уравнению, если q положительно, то \(\Delta H\) также положительно. И то же самое относится к тому, что если реакция выделяет тепло, то она экзотермическая, то есть система отдает тепло окружающей среде, поэтому \(q <0\) (отрицательно). Если \(q\) отрицательно, то \(\Delta H\) также будет отрицательным.
Если реакция поглощает тепло, она является эндотермической, что означает, что реакция потребляет тепло из окружающей среды, поэтому \(q > 0\) (положительно). Следовательно, при постоянной температуре и давлении, согласно приведенному выше уравнению, если q положительно, то \(\Delta H\) также положительно. И то же самое относится к тому, что если реакция выделяет тепло, то она экзотермическая, то есть система отдает тепло окружающей среде, поэтому \(q <0\) (отрицательно). Если \(q\) отрицательно, то \(\Delta H\) также будет отрицательным.
Изменение энтальпии, сопровождающее изменение состояния
Когда жидкость испаряется, жидкость должна поглощать тепло из окружающей среды, чтобы заменить энергию, забираемую испаряющимися молекулами, чтобы температура оставалась постоянной.Эта теплота, необходимая для испарения жидкости, называется энтальпией парообразования (или теплотой парообразования). Например, энтальпия испарения одного моля воды равна:
.ΔH = 44,0 кДж при 298 К
Когда твердое тело плавится, необходимая энергия также называется энтальпией плавления (или теплотой плавления). Например, энтальпия одного моля льда равна:
Например, энтальпия одного моля льда равна:
ΔH = 6,01 кДж при 273,15 К
\[\Delta{H} = \Delta{U} + p\Delta{V} \label{1}\]
Энтальпия также может быть выражена как молярная энтальпия, \(\Delta{H}_m\), путем деления энтальпии или изменения энтальпии на количество молей.Энтальпия является функцией состояния. Это означает, что когда система переходит из одного состояния в другое, изменение энтальпии не зависит от пути между двумя состояниями системы.
Если в системе нет работы, не связанной с расширением, и давление остается постоянным, то изменение энтальпии будет равно количеству тепла, потребляемого или выделяемого системой (q).
\[\Delta{H} = q \label{2}\]
Это соотношение может помочь определить, является ли реакция эндотермической или экзотермической.При постоянном давлении происходит эндотермическая реакция, когда тепло поглощается. Это означает, что система потребляет тепло из окружающей среды, поэтому \(q\) больше нуля. Следовательно, согласно второму уравнению, \(\Delta{H}\) также будет больше нуля. С другой стороны, при экзотермической реакции при постоянном давлении выделяется тепло. Это означает, что система отдает тепло окружающей среде, поэтому \(q\) меньше нуля. Кроме того, \(\Delta{H}\) будет меньше нуля.
С другой стороны, при экзотермической реакции при постоянном давлении выделяется тепло. Это означает, что система отдает тепло окружающей среде, поэтому \(q\) меньше нуля. Кроме того, \(\Delta{H}\) будет меньше нуля.
Влияние температуры на энтальпию
При повышении температуры количество молекулярных взаимодействий также увеличивается.Когда число взаимодействий увеличивается, внутренняя энергия системы возрастает. Согласно первому приведенному уравнению, если внутренняя энергия (\(U\)) увеличивается, то \(\Delta{H}\) увеличивается с повышением температуры. Мы можем использовать уравнение для теплоемкости и уравнение 2, чтобы вывести это соотношение.
\[C = \dfrac{q}{\Delta{T}} \label{3}\]
При постоянном давлении подставьте уравнение \ref{2} в уравнение \ref{3}:
\[C_p = \left( \dfrac{\Delta{H}}{\Delta{T}} \right)_P \label{4}\]
, где нижний индекс \(P\) указывает на то, что производная производится при постоянном давлении.о_{вап}}\]
Энтальпия конденсации обратна энтальпии испарения, а энтальпия замерзания обратна энтальпии плавления.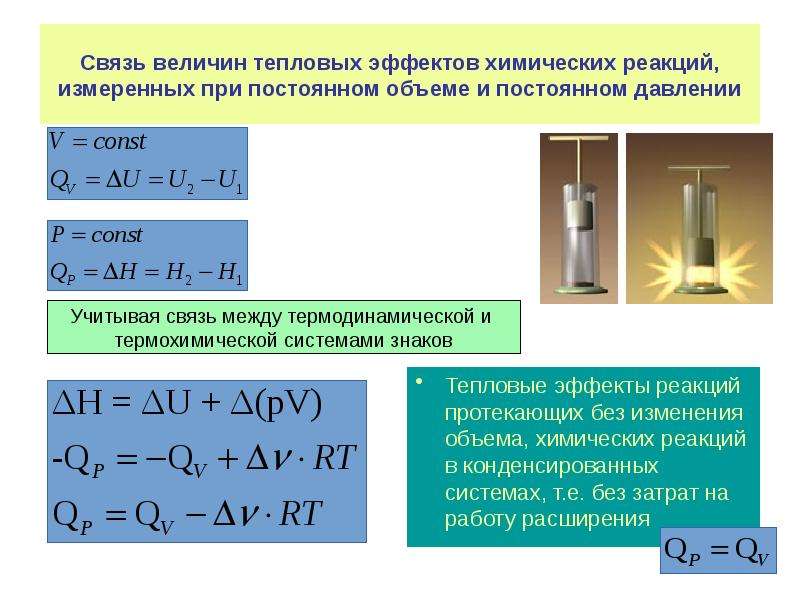 Изменение энтальпии обратного фазового перехода равно отрицательному изменению энтальпии прямого фазового перехода. Также изменение энтальпии полного процесса представляет собой сумму изменений энтальпии для каждого из фазовых переходов, включенных в процесс.
Изменение энтальпии обратного фазового перехода равно отрицательному изменению энтальпии прямого фазового перехода. Также изменение энтальпии полного процесса представляет собой сумму изменений энтальпии для каждого из фазовых переходов, включенных в процесс.
Внешние ссылки
- Канагаратна, Себастьян Г.«Наглядное пособие по расчету энтальпии» J. Chem. Образовательный 2000 77 1178.
- Kennedy Sr., Alvin P. «Определение энтальпии испарения с использованием микроволновой печи» J. Chem. Образовательный 1997 74 1231.
- Трептов, Ричард С. «Как изменились термодинамические данные и константы равновесия, когда стандартное давление стало равным 1 бару» J. Chem. Образовательный 1999 76 212.
- Йи, Л., Шэн-Лу, К., Сун-Шэн, Цюй. «Некоторые взгляды на внутреннюю энергию и энтальпию газов». Дж. Хим. Образовательный 1995 : 72, 408.

Каталожные номера
- Аткинс, Питер и де Паула, Хулио; Физическая химия для наук о жизни, США, 2006. Кэтрин Херли .
- Петруччи и др. Общие принципы химии и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2007 г.
Проблемы
- Рассчитайте энтальпию (ΔH) процесса, в котором 45.0 г воды превращается из жидкости при 10°C в пар при 25°C.
Раствор
Часть 1: Вода для отопления от 10,0 до 25,0 °C
ΔкДж = 45,0 г ч30 x (4,184 Дж/гH 2 O °C) x (25,0 — 10,0) °C x 1 кДж/1000 Дж = 2,82 кДж
Часть 2: Испарение воды при 25,0 °C
ΔkJ = 45,0 г H 2 O x 1 моль H 2 O/18,02 г H 2 O x 44,0 кДж/1 моль H 2 O = 110 кДж
Часть 3: Изменение полной энтальпии
ΔH = 2.82 кДж + 110 кДж
Авторы и атрибуты
- Кэтрин Херли (UCD), Дженнифер Шами (UCD)
8.
 7: Изменение энтальпии является мерой выделяемого или поглощаемого тепла
7: Изменение энтальпии является мерой выделяемого или поглощаемого тепла Когда происходят физические или химические изменения, они обычно сопровождаются передачей энергии. Закон сохранения энергии гласит, что в любом физическом или химическом процессе энергия не создается и не уничтожается. Другими словами, вся энергия во Вселенной сохраняется.Чтобы лучше понять изменения энергии, происходящие во время реакции, нам нужно определить две части вселенной, называемые системой и окружающей средой. Система — это определенная часть материи в данном пространстве, которая изучается в ходе эксперимента или наблюдения. окружение — это все во вселенной, что не является частью системы. С практической точки зрения для химика-лаборанта система — это конкретные химические вещества, вступающие в реакцию, а окружающая среда — это непосредственная близость внутри помещения.В ходе большинства процессов происходит обмен энергией между системой и окружающей средой. Если система теряет определенное количество энергии, такое же количество энергии получает окружающая среда. Если система получает определенное количество энергии, эта энергия поступает из окружающей среды.
Если система теряет определенное количество энергии, такое же количество энергии получает окружающая среда. Если система получает определенное количество энергии, эта энергия поступает из окружающей среды.
Химическая реакция или физическое изменение являются эндотермическими , если тепло поглощается системой из окружающей среды. В ходе эндотермического процесса система получает тепло от окружающей среды, поэтому температура окружающей среды снижается.Количество теплоты для процесса обозначается буквой \(q\). Знак \(q\) для эндотермического процесса положителен, так как система набирает тепло. Химическая реакция или физическое изменение экзотермические , если тепло выделяется системой в окружающую среду. Поскольку окружающая среда получает тепло от системы, температура окружающей среды увеличивается. Знак \(q\) для экзотермического процесса отрицательный, так как система теряет тепло.
Рисунок \(\PageIndex{1}\): (A) Эндотермическая реакция. (Б) Экзотермическая реакция.
(Б) Экзотермическая реакция.Энтальпия
Тепловые изменения в химических реакциях часто измеряют в лаборатории в условиях, когда реагирующая система открыта для атмосферы. В этом случае система находится под постоянным давлением. Энтальпия \(\left( H \right)\) — теплосодержание системы при постоянном давлении. Химики обычно измеряют изменения энтальпии химических систем по мере того, как реагенты превращаются в продукты. Теплота, которая поглощается или выделяется в результате реакции при постоянном давлении, равна изменению энтальпии и обозначается символом \(\Delta H\).Если не указано иное, предполагается, что все реакции в этом материале происходят при постоянном давлении.
Изменение энтальпии реакции является мерой различия энтальпии реагентов и продуктов. Энтальпия системы определяется энергиями, необходимыми для разрыва химических связей, и энергиями, необходимыми для образования химических связей. Чтобы разорвать химические связи, в систему необходимо вложить энергию, так как в большинстве случаев они не распадаются самопроизвольно. Формирование связи для производства продуктов потребует высвобождения энергии.Изменение энтальпии показывает компромисс между этими двумя процессами. Требуется ли больше энергии для разрыва связей, чем для их образования? Если да, то реакция эндотермическая и изменение энтальпии положительное. Если при образовании связи выделяется больше энергии, чем требуется для разрыва связи, реакция является экзотермической, а энтальпия отрицательна.
Формирование связи для производства продуктов потребует высвобождения энергии.Изменение энтальпии показывает компромисс между этими двумя процессами. Требуется ли больше энергии для разрыва связей, чем для их образования? Если да, то реакция эндотермическая и изменение энтальпии положительное. Если при образовании связи выделяется больше энергии, чем требуется для разрыва связи, реакция является экзотермической, а энтальпия отрицательна.
Несколько факторов влияют на энтальпию системы. Энтальпия — обширное свойство, частично определяемое количеством материала, с которым мы работаем.Состояние реагентов и продуктов (твердые, жидкие или газообразные) влияет на значение энтальпии системы. Направление реакции влияет на величину энтальпии. Реакция, протекающая в обратном направлении, имеет такое же численное значение энтальпии, но противоположный знак.
Термохимическое уравнение
При сгорании газообразного метана выделяется тепло, что делает реакцию экзотермической. В частности, при сгорании \(1 \: \text{моль}\) метана выделяется 890,4 кДж тепловой энергии.Эта информация может быть показана как часть сбалансированного уравнения:
В частности, при сгорании \(1 \: \text{моль}\) метана выделяется 890,4 кДж тепловой энергии.Эта информация может быть показана как часть сбалансированного уравнения:
\[\ce{CH_4} \влево( g \вправо) + 2 \ce{O_2} \влево( g \вправо) \rightarrow \ce{CO_2} \влево(g \вправо) + 2 \ce{H_2O} \влево( л \вправо) + 890,4 \: \text{кДж}\номер\]
Уравнение говорит нам, что \(1 \: \text{моль}\) метана соединяется с \(2 \: \text{моль}\) кислорода с образованием \(1 \: \text{моль}\) углекислого газа и \(2 \: \text{моль}\) воды. При этом выделяется \(890,4 \: \text{кДж}\), поэтому его записывают как продукт реакции.Термохимическое уравнение — это химическое уравнение, которое включает изменение энтальпии реакции. Процесс в приведенном выше термохимическом уравнении можно наглядно показать на рисунке \(\PageIndex{2}\).
Рисунок \(\PageIndex{2}\): (A) Когда реагенты превращаются в продукты экзотермической реакции, энтальпия выделяется в окружающую среду. Изменение энтальпии реакции отрицательно. (B) Когда реагенты превращаются в продукты эндотермической реакции, энтальпия поглощается из окружающей среды.Изменение энтальпии реакции положительное.
(B) Когда реагенты превращаются в продукты эндотермической реакции, энтальпия поглощается из окружающей среды.Изменение энтальпии реакции положительное.В примере со сгоранием метана изменение энтальпии отрицательно, поскольку система выделяет тепло. Следовательно, общая энтальпия системы уменьшается. Теплота реакции — это изменение энтальпии химической реакции. В приведенном выше случае теплота реакции равна \(-890,4 \: \text{кДж}\). Термохимическую реакцию также можно записать так:
\[\ce{CH_4} \влево( g \вправо) + 2 \ce{O_2} \влево( g \вправо) \rightarrow \ce{CO_2} \влево(g \вправо) + 2 \ce{H_2O} \влево( л \вправо) \: \: \: \: \: \Дельта H = -890.4 \: \текст{кДж}\номер\]
Теплота реакции обычно измеряется в килоджоулях. Важно включить физические состояния реагентов и продуктов в термохимическое уравнение, поскольку значение \(\Delta H\) зависит от этих состояний.
Эндотермические реакции поглощают энергию из окружающей среды по мере протекания реакции. Когда \(1 \: \text{моль}\) карбоната кальция разлагается на \(1 \: \text{моль}\) оксида кальция и \(1 \: \text{моль}\) углекислого газа, \(177.8 \: \text{кДж}\) теплоты поглощается. Процесс наглядно показан на рисунке \(\PageIndex{2B}\). Термохимическая реакция показана ниже.
Когда \(1 \: \text{моль}\) карбоната кальция разлагается на \(1 \: \text{моль}\) оксида кальция и \(1 \: \text{моль}\) углекислого газа, \(177.8 \: \text{кДж}\) теплоты поглощается. Процесс наглядно показан на рисунке \(\PageIndex{2B}\). Термохимическая реакция показана ниже.
\[\ce{CaCO_3} \left( s \right) + 177,8 \: \text{kJ} \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right )\номер \]
Поскольку теплота поглощается системой, \(177,8 \: \text{кДж}\) записывается как реагент. Теплота реакции положительна для эндотермической реакции.
\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \: \: \: \Дельта H = 177.8 \: \text{кДж}\номер\]
Способ записи реакции влияет на значение изменения энтальпии реакции. Многие реакции обратимы, а это означает, что продукт(ы) реакции способны объединять и реформировать реагент(ы). Если реакция написана в обратном направлении, знак \(\Delta H\) меняется. Например, мы можем написать уравнение реакции оксида кальция с углекислым газом с образованием карбоната кальция.
Например, мы можем написать уравнение реакции оксида кальция с углекислым газом с образованием карбоната кальция.
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) + 177.8 \: \text{кДж}\номер\]
Реакция экзотермическая, поэтому знак изменения энтальпии отрицательный.
\[\ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \rightarrow \ce{CaCO_3} \left( s \right) \: \: \: \: \: \Дельта H = -177,8 \: \text{кДж}\номер\]
Стехиометрические расчеты и изменение энтальпии
Химические задачи, связанные с изменением энтальпии, могут быть решены методами, аналогичными задачам стехиометрии. Обратимся снова к реакции горения метана.Поскольку при реакции \(1 \: \text{моль}\) метана выделяется \(890,4 \: \text{кДж}\), реакция \(2 \: \text{моль}\) метана будет выпуск \(2 \times 890,4 \: \text{kJ} = 1781 \: \text{kJ}\). Реакция \(0,5 \: \text{моль}\) метана высвободит \(\frac{890,4 \: \text{кДж}}{2} = 445,2 \: \text{кДж}\). Как и в других задачах стехиометрии, моли реагента или продукта могут быть связаны с массой или объемом.
Как и в других задачах стехиометрии, моли реагента или продукта могут быть связаны с массой или объемом.
Пример \(\PageIndex{1}\)
Газообразный диоксид серы реагирует с кислородом с образованием триоксида серы в результате экзотермической реакции в соответствии со следующим термохимическим уравнением.
\[2 \ce{SO_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{SO_3} \left( g \right) + 198 \: \text {кДж} \номер\неномер \]
Рассчитайте изменение энтальпии при взаимодействии \(58,0 \: \text{г}\) диоксида серы с избытком кислорода.
Раствор
Шаг 1: Перечислите известные количества и спланируйте проблему.
- Масса \(\ce{SO_2} = 58,0 \: \text{g}\)
- Молярная масса \(\ce{SO_2} = 64.07 \: \text{г/моль}\)
- \(\Delta H = -198 \: \text{kJ}\) для реакции \(2 \: \text{mol} \: \ce{SO_2}\)
Неизвестно
- \(\Delta H = ? \: \text{кДж}\)
Расчет требует двух шагов. Масса \(\ce{SO_2}\) преобразуется в моли. Затем количество молей \(\ce{SO_2}\) умножается на коэффициент преобразования \(\left( \frac{-198 \: \text{kJ}}{2 \: \text{mol} \: \ ce{SO_2}} \right)\).
Масса \(\ce{SO_2}\) преобразуется в моли. Затем количество молей \(\ce{SO_2}\) умножается на коэффициент преобразования \(\left( \frac{-198 \: \text{kJ}}{2 \: \text{mol} \: \ ce{SO_2}} \right)\).
Шаг 2: Решить.
\[\Delta H = 58,0 \: \text{g} \: \ce{SO_2} \times \frac{1 \: \text{моль} \: \ce{SO_2}}{64,07 \: \text{ г} \: \ce{SO_2}} \times \frac{-198 \: \text{кДж}}{2 \: \text{моль} \: \ce{SO_2}} = 89,6 \: \text{кДж } \номер\неномер \]
Шаг 3: Подумайте о своем результате.
Масса диоксида серы чуть меньше \(1\:\text{моль}\). Поскольку \(198 \: \text{кДж}\) выделяется на каждые \(2 \: \text{моль}\) вступившего в реакцию \(\ce{SO_2}\), тепло, выделяющееся примерно при \(1 \: \text{mol}\) реагирует, это половина от 198.\(89,6 \: \text{кДж}\) чуть меньше половины 198. Знак \(\Delta H\) отрицательный, поскольку реакция экзотермическая.
Взносы и ссылки
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts в соответствии со стилем, презентацией и качеством платформы:
тепло реакции | химия
теплота реакции , количество теплоты, которое необходимо добавить или отвести во время химической реакции, чтобы поддерживать все присутствующие вещества при одной и той же температуре. Если давление в сосуде, содержащем реагирующую систему, поддерживается на постоянном уровне, то измеренная теплота реакции также представляет собой изменение термодинамической величины, называемой энтальпией, или теплоемкостью, сопровождающее процесс — , т. е. разность между энтальпией веществ, присутствующих в конце реакции, и энтальпий веществ, присутствующих в начале реакции. Таким образом, теплота реакции, определяемая при постоянном давлении, также обозначается как энтальпия реакции, обозначаемая символом Δ H .Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
Если давление в сосуде, содержащем реагирующую систему, поддерживается на постоянном уровне, то измеренная теплота реакции также представляет собой изменение термодинамической величины, называемой энтальпией, или теплоемкостью, сопровождающее процесс — , т. е. разность между энтальпией веществ, присутствующих в конце реакции, и энтальпий веществ, присутствующих в начале реакции. Таким образом, теплота реакции, определяемая при постоянном давлении, также обозначается как энтальпия реакции, обозначаемая символом Δ H .Если теплота реакции положительна, то говорят, что реакция эндотермическая; если отрицательный, экзотермический.
Прогнозирование и измерение тепловых эффектов, сопровождающих химические изменения, важны для понимания и использования химических реакций. Если сосуд, содержащий реагирующую систему, изолирован так, что тепло не поступает в систему и не выходит из нее (адиабатические условия), тепловой эффект, сопровождающий превращение, может проявляться в повышении или понижении температуры, в зависимости от обстоятельств. присутствующих веществ.Точные значения теплот реакций необходимы для правильного проектирования оборудования, используемого в химических процессах.
присутствующих веществ.Точные значения теплот реакций необходимы для правильного проектирования оборудования, используемого в химических процессах.
Подробнее по этой теме
термодинамика: энтальпия и теплота реакции
Как обсуждалось выше, изменение свободной энергии Wmax = −ΔG соответствует максимально возможной полезной…
Поскольку измерение теплоты для каждой протекающей реакции нецелесообразно, а для некоторых реакций такое измерение может быть даже неосуществимым, принято оценивать теплоту реакции на основе подходящих комбинаций скомпилированных стандартных тепловых данных.Эти данные обычно принимают в виде стандартных теплот образования и теплот сгорания. Стандартная теплота образования определяется как количество тепла, поглощенного или выделенного при 25°C (77°F) и давлении в одну атмосферу, когда один моль соединения образуется из составляющих его элементов, причем каждое вещество находится в своем нормальном физическом состоянии. (газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество тепла, выделяющегося при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода.Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
(газообразное, жидкое или твердое). Теплоте образования элемента произвольно присваивается нулевое значение. Стандартная теплота сгорания определяется аналогичным образом как количество тепла, выделяющегося при 25°С и давлении в одну атмосферу, когда один моль вещества сгорает в избытке кислорода.Метод расчета теплот реакций по измеренным значениям теплот образования и сгорания основан на принципе, известном как закон суммирования теплот Гесса.
Калориметр постоянного давления — Большая Химическая Энциклопедия
Рассчитайте теплопередачу Q от бомбового калориметра (постоянный объем) или калориметра с постоянным потоком (постоянное давление), Qp, исходя из теоретических или экспериментальных данных. [Pg.448] Термохимия Большинство химических реакций связаны с поглощением или выделением тепла.При постоянном давлении изменение теплоты равно изменению энтальпии. Изменение теплоты измеряется калориметром. Калориметры постоянного давления и постоянного объема являются приборами для измерения тепловых изменений в указанных условиях. [Pg.171]
Калориметры постоянного давления и постоянного объема являются приборами для измерения тепловых изменений в указанных условиях. [Pg.171]
Это рабочее уравнение для калориметра постоянного объема. В качестве альтернативы калориметр может поддерживаться при постоянном давлении p, равном внешнему давлению p, и в этом случае… [Pg.1900]
Теплоемкость газа при постоянном давлении в проточном калориметре не определяется однозначно.Повышение температуры определяется для известной мощности, подводимой к газу, протекающему с известной скоростью. Для газов при давлении выше примерно 5 МПа Маги и др. [13] недавно описали адиабатический калориметр с двойной бомбой для измерения Cy. [Pg.1907]
Термохимия занимается изучением тепловых эффектов, связанных с фазовыми превращениями, образованием химических соединений или растворов и химическими реакциями в целом. Количество выделившегося (или поглощенного) тепла (Q) обычно измеряют либо в бомбовом калориметре периодического действия при фиксированном объеме, либо в калориметре с постоянным потоком при постоянном давлении. В этих условиях работы Q = Q, = AU (чистое изменение внутренней энергии системы) для бомбового калориметра, а Q Qp = AH (чистое изменение энтальпии системы) для проточного калориметра. Для чистого вещества. [Pg.351]
В этих условиях работы Q = Q, = AU (чистое изменение внутренней энергии системы) для бомбового калориметра, а Q Qp = AH (чистое изменение энтальпии системы) для проточного калориметра. Для чистого вещества. [Pg.351]
Как отмечалось ранее, для реакции при постоянном давлении, например, происходящей в калориметре с открытой кофейной чашкой, тепловой поток равен изменению энтальпии. Если реакция протекает при постоянном объеме (как в случае с закрытым бомбовым калориметром) и при этом не совершается никакой механической или электрической работы, то работа не совершается.В этих условиях при w = 0 тепловой поток равен изменению энергии AE. Следовательно, мы имеем… [Pg.216]
В реакции горения, проводимой в калориметре на рис. 7-2, объем системы поддерживается постоянным, а давление может изменяться, поскольку реакционная камера герметична. В проведенных вами лабораторных экспериментах вы поддерживали постоянное давление, оставляя систему открытой для окружающей среды. В таком эксперименте громкость может измениться. Между этими двумя типами измерений есть небольшая разница.Разница возникает из-за энергии, используемой, когда система расширяется против атмосферного давления. В калориметре постоянного объема такого расширения нет, следовательно, этого вклада в теплоту реакции нет. Эксперименты показывают, что эта разница обычно невелика. Однако символ AH представляет собой тепловой эффект, сопровождающий химическую реакцию, проводимую при постоянном давлении — условие, которое мы обычно имеем, когда реакция происходит в открытом стакане. [Pg.112]
Между этими двумя типами измерений есть небольшая разница.Разница возникает из-за энергии, используемой, когда система расширяется против атмосферного давления. В калориметре постоянного объема такого расширения нет, следовательно, этого вклада в теплоту реакции нет. Эксперименты показывают, что эта разница обычно невелика. Однако символ AH представляет собой тепловой эффект, сопровождающий химическую реакцию, проводимую при постоянном давлении — условие, которое мы обычно имеем, когда реакция происходит в открытом стакане. [Pg.112]
Поскольку эти процессы смешивания происходят при постоянном давлении, // теплота выделяется или поглощается при смешивании.Обычно его измеряют в смесительном калориметре. Избыточную свободную энергию Гиббса обычно получают из измерений фазовых равновесий, которые определяют активность каждого компонента в смесиb, а S затем получают из уравнения (7.17). Избыточные объемы обычно получаются… [Pg.329]
РИСУНОК 6.11 Энергия, выделяемая или поглощаемая в виде тепла в результате реакции при постоянном давлении, может быть измерена с помощью этого простого калориметра. Внешняя чашка из полистирола действует как дополнительный слой изоляции, чтобы гарантировать, что тепло не входит и не выходит из внутренней чашки.Количество энергии, выделяемой или поглощаемой в виде тепла, пропорционально изменению температуры калориметра. [Pg.345]
Внешняя чашка из полистирола действует как дополнительный слой изоляции, чтобы гарантировать, что тепло не входит и не выходит из внутренней чашки.Количество энергии, выделяемой или поглощаемой в виде тепла, пропорционально изменению температуры калориметра. [Pg.345]
Следствием этого уравнения является то, что, поскольку химические реакции обычно происходят при постоянном давлении в сосудах, открытых в атмосферу, теплота, которую они выделяют или потребляют, может быть приравнена к изменению энтальпии системы. Отсюда следует, что если мы изучаем реакцию в калориметре, который открыт для атмосферы (такой, как изображен на рис. 6.11), то измерение повышения его температуры дает нам изменение энтальпии, сопровождающее реакцию.Например, если в результате реакции в таком калориметре выделяется 1,25 кДж теплоты, то можно записать AH = q — —1,25 кДж. [Pg.352]
При сгорании 0,113 г бензола C6H6 в избытке кислорода в калиброванном калориметре постоянного давления с теплоемкостью 551 Дж-(°C) I температура калориметра повышается на 8,60°C . Напишите термохимическое уравнение для… [Pg.361]
Напишите термохимическое уравнение для… [Pg.361]
СТРАТЕГИЯ Теплота, выделяющаяся в результате реакции при постоянном давлении, рассчитывается как изменение температуры, умноженное на теплоемкость калориметра.Используйте молярную массу одного вида, чтобы преобразовать выделяющееся тепло в энтальпию реакции, соответствующую термохимическому уравнению, как написано. Если температура повышается,… [Pg.361]
Самопроверка 6.11A Когда 0,231 г фосфора реагирует с хлором с образованием треххлористого фосфора PC1 в калориметре постоянного давления с теплоемкостью 216 Дж-(° В)1 температура калориметра повышается на 11,06°С. Напишите термохимическое уравнение реакции. [Pg.362]
Мы видели, что калориметр постоянного давления и бомбовый калориметр постоянного объема измеряют изменения в различных функциях состояния при постоянном объеме, теплопередача интерпретируется как AU при постоянном давлении, она интерпретируется как AH.Однако иногда необходимо преобразовать измеренное значение AU в AH. Например, легко измерить теплоту, выделяющуюся при сгорании глюкозы в бомбовом калориметре, но чтобы использовать эту информацию для оценки энергетических изменений в обмене веществ, происходящих при постоянном давлении, нам нужна энтальпия реакции. [Pg.362]
Например, легко измерить теплоту, выделяющуюся при сгорании глюкозы в бомбовом калориметре, но чтобы использовать эту информацию для оценки энергетических изменений в обмене веществ, происходящих при постоянном давлении, нам нужна энтальпия реакции. [Pg.362]
Калориметрия при постоянном давлении требует только термоизолированного контейнера и термометра. Простой и недорогой калориметр постоянного давления можно сделать, используя две вложенные друг в друга чашки из пенопласта.На рис. 6-16 показан пример. Во внутренней чашке находятся водяная баня, магнитная мешалка и реагенты. Термометр вставляется через крышку. Внешняя чашка обеспечивает дополнительную теплоизоляцию. [Pg.390]
Калориметр постоянного давления может быть собран из двух чашек St3Tofoam, крышки, мешалки и термометра. [стр.391]
C06-0015. Когда 10,00 мл 1,00 М раствора HCl смешивают со 115 мл 0,100 М раствора NaOH в калориметре постоянного давления, температура повышается с 22.от 45°С до 23,25°С. Считая, что теплоемкость калориметра такая же, как у 125 г воды, вычислить q для этой реакции. [Pg.393]
[Pg.393]
На рис. 6-17 показан калориметр постоянного объема, который часто используется для измерения q реакций горения. Образец сжигаемого вещества помещают внутрь герметичного калориметра в присутствии избытка газообразного кислорода. Когда образец горит, энергия перетекает от химических веществ к калориметру. Как и в калориметре постоянного давления, калориметр хорошо изолирован от окружающей среды, поэтому все тепло, выделяемое химическими веществами, поглощается калориметром.Изменение температуры калориметра с теплоемкостью калориметра дает количество тепла, выделяющегося в реакции. [Pg.393]
Чтобы определить AE, используя измеренные значения q, мы также должны знать w. Однако, поскольку теплота и работа являются функциями пути, мы поступаем иначе при постоянном объеме, чем при постоянном давлении. Чтобы различать эти разные пути, мы используем нижний индекс v для калориметрии постоянного объема и нижний индекс p для калориметрии постоянного давления. Это дает разные выражения для двух t q)es калориметров. .. [Pg.396]
.. [Pg.396]
A — (jv(Constaiit — объемный процесс) Для калориметра постоянного давления объем реагирующих химических веществ может измениться, поэтому Wp 0 и должно быть оценено. Мы делаем это в разделе 6- 1. [Pg.396]
C06-0018. Добавление 1,530X10 Дж электрической энергии к калориметру постоянного давления изменяет температуру воды с 20,50°C до 21,85°C. При растворении 1,75 г твердой соли в воды температура падает с 21,85 °С до 21,44 °С.Найти значение gp для процесса растворения.[Pg.399]
Всякий раз, когда химический процесс происходит при постоянном давлении, объем может изменяться, особенно когда речь идет о газах. Например, в калориметре постоянного давления химическая система может расширяться или сжиматься. При таком изменении объема система движется против силы постоянного давления. Поскольку работа равна произведению силы на перемещение, w = F d, это означает, что работа совершается всякий раз, когда происходит изменение объема при постоянном давлении. [Pg. 399]
399]
Когда реакция происходит в калориметре постоянного давления, внешнее давление фиксировано, но объем химической системы может изменяться, поэтому выполняется работа.[Pg.400]
Как показывает пример, 20,0 г Nh5NO3 поглощает 5,28 кДж энергии при растворении соединения в калориметре постоянного давления. Эта информация позволяет нам вычислить изменение молярной энтальпии растворения… [Pg.401]
C06-0031. Напишите абзац, описывающий, что происходит с энергией, высвобождаемой во время химической реакции, протекающей в калориметре постоянного давления. [стр.420]
C06-0069. Калориметры постоянного давления можно калибровать с помощью электрического нагрева.Когда калориметр… [Pg.424]
CO6-OIIO. Образец неизвестного металла массой 44,0 г при температуре 100,0 °C помещают в калориметр постоянного давления… [Pg.428]
Калориметр в виде кофейной чашки можно использовать для измерения тепловых изменений в реакциях, открытых для атмосфера, qp, реакции постоянного давления. Мы используем этот тип калориметра для измерения удельной теплоемкости твердых тел. Мы нагреваем известную массу вещества до определенной температуры, а затем добавляем его в калориметр, содержащий известную массу воды при известной температуре.Затем измеряется конечная температура. Мы знаем, что теплота, потерянная добавленным веществом (системой), равна теплоте, полученной окружающей средой (водой и калориметром, хотя для простой калориметрии с кофейной чашкой теплота, полученная калориметром, невелика и часто игнорируется). . [Pg.100]
Мы используем этот тип калориметра для измерения удельной теплоемкости твердых тел. Мы нагреваем известную массу вещества до определенной температуры, а затем добавляем его в калориметр, содержащий известную массу воды при известной температуре.Затем измеряется конечная температура. Мы знаем, что теплота, потерянная добавленным веществом (системой), равна теплоте, полученной окружающей средой (водой и калориметром, хотя для простой калориметрии с кофейной чашкой теплота, полученная калориметром, невелика и часто игнорируется). . [Pg.100]
Многие реакции, изучаемые химиками, происходят при постоянном давлении. При обсуждении калориметра кофейной чашки изменение теплоты при постоянной температуре определялось как qp.Поскольку эта ситуация с постоянным давлением так распространена в химии, для описания этой энергетической энтальпии используется специальный термодинамический термин. Изменение энтальпии, AH, равно теплу, полученному или потерянному системой в условиях постоянного давления. Применяются следующие соглашения о знаках… [Pg.126]
Применяются следующие соглашения о знаках… [Pg.126]
F. D. Rossini. Калибровки калориметров для реакций в пламени при постоянном давлении. В Experimental Thermochemistry, vol. 1 Россини Ф.Д., Изд. Interscience, Нью-Йорк, 1956 г., глава 4.[Pg.250]
Если известны теплоты реакции при данной температуре для двух отдельных реакций, то теплоту реакции третьей реакции при той же температуре можно определить простым алгебраическим сложением. Это утверждение является законом суммирования тепла. Например, реакции (1.6) и (1.7) удобно проводить в калориметре при постоянном давлении … [Pg.4]
Однако в разделе 5.1 вы узнали, что изменение энтальпии представляет собой изменение теплоты между продуктами и реагентов при постоянном давлении.Следовательно, калориметр, который вы используете для определения изменения энтальпии, должен позволять проводить реакцию при постоянном давлении. Другими словами, он должен быть открыт для атмосферы. [Pg.236]
Для определения изменений энтальпии в школьных лабораториях достаточно точные результаты дает калориметр в виде кофейной чашки. Калориметр кофейной чашки состоит из двух вложенных полистироловых чашек (кофейных чашек). Их можно поместить в химический стакан на 250 мл для дополнительной стабильности. Поскольку калориметр кофейной чашки открыт для атмосферы, его также называют калориметром постоянного давления.[стр.236]
Калориметр кофейной чашки состоит из двух вложенных полистироловых чашек (кофейных чашек). Их можно поместить в химический стакан на 250 мл для дополнительной стабильности. Поскольку калориметр кофейной чашки открыт для атмосферы, его также называют калориметром постоянного давления.[стр.236]
Q VSUM Какие свойства полистирола делают его подходящим материалом для калориметра постоянного давления Почему кофейные чашки из полистирола не подходят для калориметра постоянного объема … [стр.242]
Объясните, почему два вложенные кофейные чашки из полистирола с крышкой делают хороший калориметр постоянного давления. [Pg.263]
| Термин | Определение | |||
|---|---|---|---|---|
| Термохимия | Изучение отношений между химией и энергией | |||
| Energy | Емкость для работы | |||
| Работа | Результат силы, действующего на расстояние | |||
поток энергии, вызванный разностью температур. Передача тепловой энергии Передача тепловой энергии | ||||
| Кинетическая энергия | Энергия, связанная с движением объекта | |||
| Тепловая энергия | Энергия, связанная с температурой объекта и являющаяся формой кинетической энергии | 2 Потенциальная энергия | Энергия, связанная с положением или составом объекта | |
| Химическая энергия | Энергия, связанная с относительным расположением электронов и ядер в атомах и молекулах, также является формой потенциальной энергии | |||
| Закон сохранения энергии (А.6 | ||||
| Первый закон термодинамики | Закон сохранения энергии, гласящий: «Полная энергия Вселенной постоянна» | |||
| Внутренняя энергия (E) системы | Сумма кинетических и потенциальные энергии всех частиц, составляющих систему. Является функцией состояния | |||
| Функция состояния | Ее значение зависит только от состояния системы, а не от того, как система пришла в это состояние. Изменение способности зависит только от разницы между начальным и конечным значениями, а не от выбранного пути.
ΔE = Eproducts — Ereactants Изменение способности зависит только от разницы между начальным и конечным значениями, а не от выбранного пути.
ΔE = Eproducts — Ereactants | |||
| Количество энергии, теряемой системой | ΔEsystem = — ΔEокружение | |||
| Суммарный поток энергии | из системы в окружающую среду.. 2. Если реагенты имеют более низкую Е, чем продукты, ΔEсистема положительна и энергия поступает в систему из окружающей среды | |||
| q(тепло) | если +q, то система получает тепловую энергию… если -q, то система теряет тепловую энергию | |||
| w(работа) | , если +q, то работа, выполненная в системе… если -q, то работа, совершенная системой | |||
| ΔE (изменение внутренней энергии) | если +ΔE, то энергия поступает в систему… если -ΔE, то энергия вытекает из системы | |||
| Уравнение внутренней энергии | Энергия, поступающая в систему посредством теплоты или работы, имеет положительный знак, а энергия, выходящая из системы посредством теплоты или работы, имеет отрицательный знак. ..
ΔE = q + w ..
ΔE = q + w | |||
| Поток энергии из системы (система —> окружение) | ΔEsys < 0 (отрицательное)... ΔEsurr > 0 (положительный) | |||
| Поток энергии в систему (окружение —> система) | ΔEsys > 0 (положительный)… ΔEsurr < 0 (отрицательный) | |||
| Температура | Мера тепловой энергии в образце вещества | |||
| Тепловое равновесие | Точка, в которой нет дополнительной чистой передачи тепла между системой и его окружение | |||
| Связь между изменением температуры (ΔT) и тепла (q) | Теплота, поглощаемая системой, и соответствующее изменение температуры прямо пропорциональны…q { ΔT | |||
| Теплоемкость (C) | Количество тепла, необходимое для изменения температуры системы на 1*C. Это обширная собственность… C = (q/ΔT) = (J/*C) | |||
| Свойство расширения | Зависит от количества нагреваемого вещества | |||
| Удельная теплоемкость или удельная теплоемкость (Cs) | Количество теплоты требуется для повышения температуры 1 грамма вещества на 1*С 1К. Интенсивное свойство.Зависит от типа вещества…
q = mx Cs x ΔT Интенсивное свойство.Зависит от типа вещества…
q = mx Cs x ΔT | |||
| Единицы удельной теплоемкости | Дж/(г*(*C)) или Дж/(г*K) | |||
| Молярная теплоемкость | Количество тепла, необходимое для повысить температуру 1 моля вещества на 1*С или 1К. Интенсивное свойство. Зависит от типа вещества… q = nx Cs x ΔT | |||
| Интенсивное свойство | Не зависит от количества вещества | |||
| Перенос тепловой энергии между системой и окружающей средой | Если мы определим одно вещество как систему, а другое как окружающую среду, мы можем количественно оценить теплообмен как… qsyst = -qsurr | |||
| Комбинация уравнений | масса(m)система x удельная теплоемкость(Cs)syst x изменение температуры(”T)syst = -масса(m)surr x удельная теплоемкость (Cs)surr x изменение температуры(ΔT)surr | |||
| Работа давление-объем | Возникает, когда сила вызывается изменением объема по отношению к внешнему давлению | |||
| Уравнение для величины работы давления-объема | w = Ф х Д. ..
Где w — работа, F — сила, а D — расстояние ..
Где w — работа, F — сила, а D — расстояние | |||
| Уравнение для силы | P = F/A… или F = P x A… С силой (F), давлением (P) и площадью (A) | |||
| Уравнение работы с использованием силы | w = F x D = P x A x D | |||
| Уравнение работы с поршнями | расстояние, на которое действует сила, есть изменение высоты поршня при его движении при расширении (Δh)… w = P x A x Δh | |||
| Уравнение для работы с поршнями и A x Δh = ΔV | w = -PΔV | |||
| Уравнение для ΔErxn с калориметрией постоянного объема | ||||
| Теплота при постоянном объеме(qv) | Теплота, выделяемая (или выделяемая) | |||
| Калориметрия | Экспериментальная процедура, используемая для измерения теплоты, выделяемой в химическая реакция. Мы измеряем обмен тепловой энергией между реакцией (определяемой как система) и окружающей средой, наблюдая за изменением температуры окружающей среды. Измеряет изменения внутренней энергии для реакций горения Измеряет изменения внутренней энергии для реакций горения | |||
| Уравнение калориметра бомбы | Изменение температуры (ÎT) связано с теплом, поглощаемым всей сборкой калориметра (qcal), по уравнению… qcal = Ccal x ΔT… где теплоемкость всего узла калориметра в ккал | |||
| Перенос энергии в бомбовой калориметрии | qcal = -qrxn | |||
| Энтальпия (H) | Сумма внутренней энергии системы и произведения ее давления и объем, Является функцией состояния H = E + PV | |||
| Изменение энтальпии для любого процесса, протекающего при постоянном давлении qp) | ΔH = qp | |||
| Эндотермическая реакция | Поглощение тепла из окружающей среды; на ощупь прохладный; Δ”H > 0 (положительный) | |||
| Экзотермическая реакция | Выделяет тепло в окружающую среду; на ощупь теплая; ΔH < 0 (отрицательный) | |||
| 1.Суммарная энтальпия | 1. Значение ΔH для химической реакции – это количество тепла, поглощенное или выделенное в ходе реакции в условиях постоянного давления | |||
2. Суммарная энтальпия Суммарная энтальпия | 2. Эндотермическая реакция имеет положительную ΔH и поглощает тепло из окружающей среды. Эндотермическая реакция кажется холодной на ощупь | |||
| 3. Суммарная энтальпия | 3. Экзотермическая реакция имеет отрицательный ΔH и выделяет тепло в окружающую среду.Экзотермическая реакция кажется теплой на ощупь. | |||
| Энтальпия реакции или теплота реакции (ΔHrxn) | Изменение энтальпии химической реакции. | |||
| Постоянное давление | Меры ΔHrxn | |||
| Кофейный калориметр | Для многих водных реакций мы можем довольно просто измерить ΔHrxn | с помощью кофейного калориметра | Калориметрия с постоянным значением (забыл поставить выше) | Меры ΔErxn |
| Уравнение для теплоты, поглощаемой раствором или теряемой из него (действующего в качестве окружающей среды) | qsol’n = msol’n x Cssol’n x ÎT | |||
| Перенос энергии в калориметрии постоянного давления | qrxn = -qsol’n | |||
| Обобщающая калориметрия | 1. Бомбовая калориметрия проводится при постоянном объеме и измеряет ΔE для реакции.
2. Калориметрия в кофейной чашке при постоянном давлении и измерение ΔH для реакции Бомбовая калориметрия проводится при постоянном объеме и измеряет ΔE для реакции.
2. Калориметрия в кофейной чашке при постоянном давлении и измерение ΔH для реакции | |||
| 1-й Соотношение, включающее ΔHrxn | 1. Если химическое уравнение умножается на какой-либо коэффициент, то ΔHrxn также умножается на тот же коэффициент … (А + 2В —> С Î”h2).. (2A + 4B —> 2C λh3 = 2 x λh2) | |||
| 2-я зависимость, включающая ΔHrxn | 2. Если химическое уравнение перевернуть, то ΔHrxn изменит знак… (А + 2В —> С Δh2).. (C —> A + 2B Δh3 = -Δh2) | |||
| 3-е соотношение, включающее Δ”Hrxn (закон Гесса) | 3. Если химическое уравнение может быть выражено как сумма ряда шагов, то ΔHrxn для общего уравнения представляет собой сумму теплоты реакции для каждого шага… (A + 2B —> C Δ”h2) + (C —> 2D Δh3) = (A + 2B —> 2D Δ”h4 = Δh2 + Δh3 | |||
| Закон Гесса | Изменение энтальпии ступенчатого процесса равно сумме изменений энтальпии стадий | |||
1. Стандартное состояние (НЕ STP) Стандартное состояние (НЕ STP) | Стандартное состояние для газа, твердого тела, жидкости: 1 атм при 25°C.. Стандартное состояние для раствора: 1 атм, 25°C, 1 M | |||
| 2. Изменение стандартной энтальпии (ΔH*) | Изменение энтальпии процесса, когда все реагенты и продукты находятся в своих стандартных состояниях. Знак градуса указывает на стандартные состояния | |||
| 3. Стандартная энтальпия (теплота) образования (ΔHf*) | Для чистого соединения: изменение энтальпии, когда один моль соединения образуется из составляющих его элементов в их стандартных состояниях.. Для чистого элемента в его стандартном состоянии: ΔHf* = 0 | |||
| Образование метана(Ch5) | C(s,графит) + 2h3(g) —> Ch5(g) ΔHf* = -74,6 кДж/ моль | |||
| Образование воды(h3O) | h3(г) + (1/2)O2(г) —> h3O(г) ΔHf* = -285,8 кДж/моль | |||
| Образование углекислого газа (CO2) | C(s, графит) + O2 —> CO2(g) ΔH*f = -393,5 кДж/моль | |||
| Расчет стандартного изменения энтальпии реакции | Чтобы рассчитать ΔH*rxn, вычтите энтальпии образования реагентов, умноженные на их стехиометрические коэффициенты, из энтальпий образования продуктов, умноженные на их стехиометрические коэффициенты. ΔH*rxn = Σnp * ΔH*f(продукты) — Σnf * ΔH*f(реагенты) ΔH*rxn = Σnp * ΔH*f(продукты) — Σnf * ΔH*f(реагенты) |
Cp для газообразного азота.72 0. Свойства различных
Cp для газообразного азота. 72 0. Свойства различных идеальных газов (при 300 K) Газ: Формула: Молярная масса: Газовая постоянная: Удельная теплоемкость при конст. В этом исследовании сравниваются результаты, полученные с помощью двух новых моделей, с результатами корреляций Стэндинга для растворимости и … Мы изучили эффективность использования азота молочными коровами, используя три рациона, отличающиеся уровнем сырого протеина (CP), но с одинаковым дефицитом (10 г x кг). (-1) сухое вещество, DM) в сбраживаемом азоте рубца.Иногда он также известен как коэффициент изоэнтропического расширения и обозначается γ для идеального газа или κ (), изэнтропическим… Удельную теплоемкость также иногда называют массовой теплоемкостью. . Газообразный азот 5R/2, а значение двухатомного идеального газа равно 7R/2. Газообразный азот (Cp) Жидкий азот при насыщении (CU) / Теплота парообразования 1. 17 0. Температура — Удельная теплоемкость газообразного азота — N 2 — в диапазоне температур 175 — 6000 K Неидеальный газ — Уравнение и константы Ван-дер-Ваальса — Константы Ван-дер-Ваальса для более чем 200 газов, используемые для коррекции неидеальности поведения газов, вызванной межмолекулярными силами и объемом, занимаемым газом Азот /индуцированное угнетение ЦНС/ («восторг бездны» или «эффект мартини» «) возникает в результате прямого токсического действия высокого давления азота на нервную проводимость и вызывает эффекты, сходные с алкогольной интоксикацией.Это значение удельной теплоемкости азота практически постоянно от -150 ° C до примерно 300 ° C.
(-1) сухое вещество, DM) в сбраживаемом азоте рубца.Иногда он также известен как коэффициент изоэнтропического расширения и обозначается γ для идеального газа или κ (), изэнтропическим… Удельную теплоемкость также иногда называют массовой теплоемкостью. . Газообразный азот 5R/2, а значение двухатомного идеального газа равно 7R/2. Газообразный азот (Cp) Жидкий азот при насыщении (CU) / Теплота парообразования 1. 17 0. Температура — Удельная теплоемкость газообразного азота — N 2 — в диапазоне температур 175 — 6000 K Неидеальный газ — Уравнение и константы Ван-дер-Ваальса — Константы Ван-дер-Ваальса для более чем 200 газов, используемые для коррекции неидеальности поведения газов, вызванной межмолекулярными силами и объемом, занимаемым газом Азот /индуцированное угнетение ЦНС/ («восторг бездны» или «эффект мартини» «) возникает в результате прямого токсического действия высокого давления азота на нервную проводимость и вызывает эффекты, сходные с алкогольной интоксикацией.Это значение удельной теплоемкости азота практически постоянно от -150 ° C до примерно 300 ° C. Однако, когда температура (Т) поднимается выше примерно 700 К, начинает расти удельная теплоемкость. 12 БТЕ/фунт-°F, сколько тепла требуется? Параметр Азот Аргон Кислород Воздух T c (K) 126. 402 4. Это простая «модель реального газа», которая может объяснить некоторые явления Газ в каждом цилиндре теперь (b) Cp + Cv больше для двухатомного идеального газа чем для изотермически расширенного до того же конечного объема одноатомного идеального газа 2V.Liquid Nltrogen 2. 335b 0. Изменения давления в A и B ar, найденные для (c) Cp / Cv больше для двухатомного идеального газа, чем для … Газлифтное бурение с двойным градиентом (DGD) является решением для сложные проблемы, вызванные узкими окнами бурения при глубоководном бурении. При высоких температурах выше 1500 К диссоциация становится заметной, а давление является существенной переменной. в. Правильная связь между a и b такова: — Получите ответ на этот вопрос и получите доступ к огромному банку вопросов, предназначенному для учащихся.581 132.
Однако, когда температура (Т) поднимается выше примерно 700 К, начинает расти удельная теплоемкость. 12 БТЕ/фунт-°F, сколько тепла требуется? Параметр Азот Аргон Кислород Воздух T c (K) 126. 402 4. Это простая «модель реального газа», которая может объяснить некоторые явления Газ в каждом цилиндре теперь (b) Cp + Cv больше для двухатомного идеального газа чем для изотермически расширенного до того же конечного объема одноатомного идеального газа 2V.Liquid Nltrogen 2. 335b 0. Изменения давления в A и B ar, найденные для (c) Cp / Cv больше для двухатомного идеального газа, чем для … Газлифтное бурение с двойным градиентом (DGD) является решением для сложные проблемы, вызванные узкими окнами бурения при глубоководном бурении. При высоких температурах выше 1500 К диссоциация становится заметной, а давление является существенной переменной. в. Правильная связь между a и b такова: — Получите ответ на этот вопрос и получите доступ к огромному банку вопросов, предназначенному для учащихся.581 132. В) 0: 100: 250: 500: Вязкость Па с (Фактическая х 10 6) Кислород: О 2: 19: 24: 30: 39: Гелий: Не: 18: 22: 28: 37: Воздух-17 : 21: 27: 35: Азот: N 2: 16,5: 21: 265: 35: Угарный газ: CO: 16,5: 21: 26: 35: Углекислый газ: CO 2: 13,7: 18: 24 : 34: Диоксид серы: SO 2: 11. Удельная теплоемкость Cp и Cv. Азот составляет 78 % объема атмосферного воздуха. 948 31. (a) Три фунта-моля газообразного азота при температуре 70 °F, содержащиеся в жестком сосуде, нагреваются до 3250 °F. P. 4477a p c (МПа) 3. Приведенные ниже значения относятся к динамической вязкости, измеренной с использованием сантипуаз (сП) и единиц СИ Н.3 бар зарегистрировано. Удельная теплоемкость газообразного азота — N2 — при температурах в диапазоне 175 — 6000 K: Приведенные выше значения относятся к недиссоциированным состояниям. ∴ a=Cp-Cv=R/2 (для водорода) И b=Cp-Cv=R/28 (для азота) a=14b. Однако, когда температура (Т) поднимается выше примерно 700 К, начинает расти удельная теплоемкость. Первый закон термодинамики, закон сохранения энергии, можно записать в дифференциальной форме в виде таблицы III.
В) 0: 100: 250: 500: Вязкость Па с (Фактическая х 10 6) Кислород: О 2: 19: 24: 30: 39: Гелий: Не: 18: 22: 28: 37: Воздух-17 : 21: 27: 35: Азот: N 2: 16,5: 21: 265: 35: Угарный газ: CO: 16,5: 21: 26: 35: Углекислый газ: CO 2: 13,7: 18: 24 : 34: Диоксид серы: SO 2: 11. Удельная теплоемкость Cp и Cv. Азот составляет 78 % объема атмосферного воздуха. 948 31. (a) Три фунта-моля газообразного азота при температуре 70 °F, содержащиеся в жестком сосуде, нагреваются до 3250 °F. P. 4477a p c (МПа) 3. Приведенные ниже значения относятся к динамической вязкости, измеренной с использованием сантипуаз (сП) и единиц СИ Н.3 бар зарегистрировано. Удельная теплоемкость газообразного азота — N2 — при температурах в диапазоне 175 — 6000 K: Приведенные выше значения относятся к недиссоциированным состояниям. ∴ a=Cp-Cv=R/2 (для водорода) И b=Cp-Cv=R/28 (для азота) a=14b. Однако, когда температура (Т) поднимается выше примерно 700 К, начинает расти удельная теплоемкость. Первый закон термодинамики, закон сохранения энергии, можно записать в дифференциальной форме в виде таблицы III. qP = nCP∆T. Замечено, что Cp — Cv = a для газообразного водорода Cp — Cv = b для газообразного азота.Здесь для идеального газа Cp – Cv = R/M, где M – масса одного моля газа. Масса одного моля водорода М=2 г и азота М=28 г. Итак, мы также можем сказать, что Cp/Cv = (1 + 2/f), где f — степень свободы. Нажмите. Эта величина равна изменению энтальпии, то есть q P = n C P ∆T = ∆H. 2 12 1 4 −7. нет 53 rows 49 rows Азот /индуцированное угнетение ЦНС/ («упоение глубиной» или «эффект мартини») возникает в результате прямого токсического действия высокого давления азота на нервную проводимость и вызывает эффекты, сходные с алкогольной интоксикацией.2 (736 Дж⋅К-1 ⋅кг-1) больше, чем у гипотетического одноатомного газа с той же молекулярной массой 28 (445 Дж⋅К-1 ⋅кг-1) в 5/3 раза. Поскольку отношение cT cT Rpv() ()− = Используется в качестве ракетного топлива (шаттла), хранения медицинских газов, производства стали • Аргон ( NBP = 87 K, TP = 68. q V = n CV ∆T Уравнение состояния для идеальный газ.Его значение для одноатомного идеального газа 5R/2 и значение для двухатомного идеального газа 7R/2.
qP = nCP∆T. Замечено, что Cp — Cv = a для газообразного водорода Cp — Cv = b для газообразного азота.Здесь для идеального газа Cp – Cv = R/M, где M – масса одного моля газа. Масса одного моля водорода М=2 г и азота М=28 г. Итак, мы также можем сказать, что Cp/Cv = (1 + 2/f), где f — степень свободы. Нажмите. Эта величина равна изменению энтальпии, то есть q P = n C P ∆T = ∆H. 2 12 1 4 −7. нет 53 rows 49 rows Азот /индуцированное угнетение ЦНС/ («упоение глубиной» или «эффект мартини») возникает в результате прямого токсического действия высокого давления азота на нервную проводимость и вызывает эффекты, сходные с алкогольной интоксикацией.2 (736 Дж⋅К-1 ⋅кг-1) больше, чем у гипотетического одноатомного газа с той же молекулярной массой 28 (445 Дж⋅К-1 ⋅кг-1) в 5/3 раза. Поскольку отношение cT cT Rpv() ()− = Используется в качестве ракетного топлива (шаттла), хранения медицинских газов, производства стали • Аргон ( NBP = 87 K, TP = 68. q V = n CV ∆T Уравнение состояния для идеальный газ.Его значение для одноатомного идеального газа 5R/2 и значение для двухатомного идеального газа 7R/2. Степени свободы 3 для одноатомного газа и 5 для двухатомного газа (3 поступательных + 2 18 рядов Cp ln(T2 / T1) = R ln(p2 / p1) Мы делим обе части на «cp» и берем экспоненциальную функцию обеих частей (это «отменяет» логарифмы).Том. qV = nCV∆T. 66 1. НБП. Далее примем Cv = 5 и CP = 7 БТЕ/фунт-моль-°F для газообразного азота. Варгезе Замечание об изменении удельной теплоемкости идеальных газов Большинство двухатомных газов, таких как азот (N2) и кислород (O2) при комнатной температуре или близкой к ней имеют удельную теплоемкость (cv и cp), которая почти постоянна. Определить мощность, потребляемую компрессором. 687 154. Следовательно, Cp = (f/2) R + R = R (1 + f/2) Теперь отношение удельных теплоемкостей γ определяется как: γ = Cp/Cv = R(1+f/2)/ [(f/2) R] =(2+f)/f .Воздух и экспериментальный газ продували из системы, открывая вентиль С. 3 с(нм) 0,192 150,3428 0,4 U идеального газа по Cv = dU dT v = f 2 R, где f – градусы свобода молекулы газа. Иногда он также известен как коэффициент изоэнтропического расширения и обозначается γ для идеального газа или κ, показателем изэнтропии… Удельная теплоемкость газа при постоянном объеме с точки зрения степени свободы ‘f’ определяется как: Cv = ( f/2) R.
Степени свободы 3 для одноатомного газа и 5 для двухатомного газа (3 поступательных + 2 18 рядов Cp ln(T2 / T1) = R ln(p2 / p1) Мы делим обе части на «cp» и берем экспоненциальную функцию обеих частей (это «отменяет» логарифмы).Том. qV = nCV∆T. 66 1. НБП. Далее примем Cv = 5 и CP = 7 БТЕ/фунт-моль-°F для газообразного азота. Варгезе Замечание об изменении удельной теплоемкости идеальных газов Большинство двухатомных газов, таких как азот (N2) и кислород (O2) при комнатной температуре или близкой к ней имеют удельную теплоемкость (cv и cp), которая почти постоянна. Определить мощность, потребляемую компрессором. 687 154. Следовательно, Cp = (f/2) R + R = R (1 + f/2) Теперь отношение удельных теплоемкостей γ определяется как: γ = Cp/Cv = R(1+f/2)/ [(f/2) R] =(2+f)/f .Воздух и экспериментальный газ продували из системы, открывая вентиль С. 3 с(нм) 0,192 150,3428 0,4 U идеального газа по Cv = dU dT v = f 2 R, где f – градусы свобода молекулы газа. Иногда он также известен как коэффициент изоэнтропического расширения и обозначается γ для идеального газа или κ, показателем изэнтропии… Удельная теплоемкость газа при постоянном объеме с точки зрения степени свободы ‘f’ определяется как: Cv = ( f/2) R. Азот – инертный, нейтральный и бесцветный газ. Это отношение двух удельных теплоемкостей, Cp и Cv, определяется как: Теплоемкость при постоянном давлении (Cp) / Теплоемкость при постоянном объеме (Cv) Коэффициент изоэнтропического расширения — это другое название коэффициента теплоемкости, которое также обозначается для идеального газа через γ (гамма).03989 0. Азот при стандартных условиях является газом. Cp и Cv — удельная теплоемкость идеального газа при постоянном давлении и постоянном объеме. 24 0. Ent Aalpy 1. 043 3. 1 2 0 2 0. где p — давление газа, V — объем, — число молей, R — универсальная газовая постоянная (= 8. Диэлектрическая проницаемость газообразного азота 1. 1868 кДж /кг К) поступает в компрессор при 300 К со скоростью 7500 кг/ч и выходит при 320 К. = Па. Неформально это количество теплоты, которое необходимо добавить к одной единице массы вещества, чтобы вызывают повышение температуры на одну единицу.63 10. 055 0. с м -2. Кроме того, Cp — Cv = R. Таблица свойств азота» I 2, Диаграмма температурно-энтропийной теплопроводности азота 1.
Азот – инертный, нейтральный и бесцветный газ. Это отношение двух удельных теплоемкостей, Cp и Cv, определяется как: Теплоемкость при постоянном давлении (Cp) / Теплоемкость при постоянном объеме (Cv) Коэффициент изоэнтропического расширения — это другое название коэффициента теплоемкости, которое также обозначается для идеального газа через γ (гамма).03989 0. Азот при стандартных условиях является газом. Cp и Cv — удельная теплоемкость идеального газа при постоянном давлении и постоянном объеме. 24 0. Ent Aalpy 1. 043 3. 1 2 0 2 0. где p — давление газа, V — объем, — число молей, R — универсальная газовая постоянная (= 8. Диэлектрическая проницаемость газообразного азота 1. 1868 кДж /кг К) поступает в компрессор при 300 К со скоростью 7500 кг/ч и выходит при 320 К. = Па. Неформально это количество теплоты, которое необходимо добавить к одной единице массы вещества, чтобы вызывают повышение температуры на одну единицу.63 10. 055 0. с м -2. Кроме того, Cp — Cv = R. Таблица свойств азота» I 2, Диаграмма температурно-энтропийной теплопроводности азота 1. Кривая между критической точкой и тройной точкой показывает температуру кипения азота при изменении давления. Эта величина равна изменению внутренней энергии, т. е. Уравнение состояния идеального газа есть. 10. Единица удельной теплоемкости в системе СИ … Cp и Cv – удельная теплоемкость при постоянном давлении и постоянном объеме соответственно.Газообразный азот – Удельная теплоемкость против Делитесь конфиденциальной информацией только на официальных, защищенных веб-сайтах. 6 К) бесцветный, немагнитный, инертный. Эта величина равна изменению энтальпии, то есть qP = n CP∆T = ∆H. 6 K) 3. Охлаждающая вода (Cp=4. s = 1000 сантипуаз. Информация была получена из справочных текстов и Интернета. Затем клапан C был закрыт, когда газообразный азот (Cp) жидкий азот при насыщении (CU) / теплота парообразования 1. L. 9988 28. Затем выделенный газ выпускали в горловину баллона объемом V: (1281 ± 5) см3, диаметром d: 16 мм через клапаны D/E/F.001208 3. q P = n C P ∆T. Теплота парообразования и энтальпия o Жидкость и пар.
Кривая между критической точкой и тройной точкой показывает температуру кипения азота при изменении давления. Эта величина равна изменению внутренней энергии, т. е. Уравнение состояния идеального газа есть. 10. Единица удельной теплоемкости в системе СИ … Cp и Cv – удельная теплоемкость при постоянном давлении и постоянном объеме соответственно.Газообразный азот – Удельная теплоемкость против Делитесь конфиденциальной информацией только на официальных, защищенных веб-сайтах. 6 К) бесцветный, немагнитный, инертный. Эта величина равна изменению энтальпии, то есть qP = n CP∆T = ∆H. 6 K) 3. Охлаждающая вода (Cp=4. s = 1000 сантипуаз. Информация была получена из справочных текстов и Интернета. Затем клапан C был закрыт, когда газообразный азот (Cp) жидкий азот при насыщении (CU) / теплота парообразования 1. L. 9988 28. Затем выделенный газ выпускали в горловину баллона объемом V: (1281 ± 5) см3, диаметром d: 16 мм через клапаны D/E/F.001208 3. q P = n C P ∆T. Теплота парообразования и энтальпия o Жидкость и пар. 863 5. 2b 118. 01348 39. Сложные рассуждения, способность принимать решения, двигательная функция и ловкость рук снижаются. 94 143. 32 (a) Газообразный азот (Cp = 30 кДж/кмоль К) при 1 бар и 300 К должен быть сжат до 10 бар и 450 К со скоростью 5000 кг/ч. сверхпроводниковое охлаждение • Неон (NBP = 27 K, TP = 24. 1839 г. 13. Сколько тепла потребуется, если сосуд имеет незначительную теплоемкость? Если сосуд весит 200 фунтов и имеет теплоемкость 0.Газообразный азот Его значение для одноатомного идеального газа составляет 3R/2, а для двухатомного идеального газа — 5R/2. с 1 сантипуаз = 1 мПа с (миллиПаскаль в секунду) = 10-3 Па. Не было никакой разницы в удое от коров, которым давали три рациона (130, 145 и 160 г ЦП x кг(-1) сухого вещества). веб-сайт правительства. Однако при низкой температуре и/или высоком давлении газ становится жидким или твердым. Или γ = 1+ 2/f . Газ: Символ: Температура (градусы 3958 4. выбранный газовый баллон был отрегулирован до показания манометра приблизительно 0.
863 5. 2b 118. 01348 39. Сложные рассуждения, способность принимать решения, двигательная функция и ловкость рук снижаются. 94 143. 32 (a) Газообразный азот (Cp = 30 кДж/кмоль К) при 1 бар и 300 К должен быть сжат до 10 бар и 450 К со скоростью 5000 кг/ч. сверхпроводниковое охлаждение • Неон (NBP = 27 K, TP = 24. 1839 г. 13. Сколько тепла потребуется, если сосуд имеет незначительную теплоемкость? Если сосуд весит 200 фунтов и имеет теплоемкость 0.Газообразный азот Его значение для одноатомного идеального газа составляет 3R/2, а для двухатомного идеального газа — 5R/2. с 1 сантипуаз = 1 мПа с (миллиПаскаль в секунду) = 10-3 Па. Не было никакой разницы в удое от коров, которым давали три рациона (130, 145 и 160 г ЦП x кг(-1) сухого вещества). веб-сайт правительства. Однако при низкой температуре и/или высоком давлении газ становится жидким или твердым. Или γ = 1+ 2/f . Газ: Символ: Температура (градусы 3958 4. выбранный газовый баллон был отрегулирован до показания манометра приблизительно 0. Таким образом, отношение между Cp и Cv является отношением теплоемкости UT Austin ASE/EM Dept. 78502 a M(g·mol−1) 28,9586 e/k(K) 98. Удельная теплоемкость при Const. Из уравнения q = n C ∆T можно сказать: При постоянном давлении P имеем. 13 0,3144 Дж/(0 К моль)), Т — абсолютная температура. Молярная удельная теплоемкость газа при постоянном давлении (Cp — это количество тепла, необходимое для повышения температуры 1 моль газа на 1 C при постоянном давлении. Используется для криогенного кондиционирования, высокой T. Связь между CP и CV для идеального газа.8: 15: 20: 28: Аммиак: NH 3: 9,5: 13: 18: 27: Водород: H 2: 85: 10,5: 12,5: 16,5: Этан: … В следующем разделе, мы найдем, как связаны CP и CV для идеального газа. 055 q D (нм) 0,40743 13,11 C 0. Фазовая диаграмма азота показывает фазовое поведение при изменении температуры и давления. Они показывают количество тепла, которое может увеличить температуру единицы массы на 1. В теплофизике и термодинамике отношение теплоемкости, также известное как показатель адиабаты, отношение удельных теплоемкостей или коэффициент Лапласа, представляет собой отношение теплоемкости мощность при постоянном давлении (CP) → теплоемкость при постоянном объеме (CV).
Таким образом, отношение между Cp и Cv является отношением теплоемкости UT Austin ASE/EM Dept. 78502 a M(g·mol−1) 28,9586 e/k(K) 98. Удельная теплоемкость при Const. Из уравнения q = n C ∆T можно сказать: При постоянном давлении P имеем. 13 0,3144 Дж/(0 К моль)), Т — абсолютная температура. Молярная удельная теплоемкость газа при постоянном давлении (Cp — это количество тепла, необходимое для повышения температуры 1 моль газа на 1 C при постоянном давлении. Используется для криогенного кондиционирования, высокой T. Связь между CP и CV для идеального газа.8: 15: 20: 28: Аммиак: NH 3: 9,5: 13: 18: 27: Водород: H 2: 85: 10,5: 12,5: 16,5: Этан: … В следующем разделе, мы найдем, как связаны CP и CV для идеального газа. 055 q D (нм) 0,40743 13,11 C 0. Фазовая диаграмма азота показывает фазовое поведение при изменении температуры и давления. Они показывают количество тепла, которое может увеличить температуру единицы массы на 1. В теплофизике и термодинамике отношение теплоемкости, также известное как показатель адиабаты, отношение удельных теплоемкостей или коэффициент Лапласа, представляет собой отношение теплоемкости мощность при постоянном давлении (CP) → теплоемкость при постоянном объеме (CV). (R/Cp) В теплофизике и термодинамике коэффициент теплоемкости, также известный как показатель адиабаты, коэффициент теплоемкости или коэффициент Лапласа, представляет собой отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме. 360 t 0 (нм) 0. с 1 Па. Жидкий азот 2. Содержание белка в молоке различается между двумя наиболее … Запертый замок) или https:// означает, что вы безопасно подключились к . 5 103. 6312 a r c (моль·дм-3) 11. pV = RT 1. Недостаточно исследований по использованию бурового раствора на нефтяной основе в ДГД, что является принципиально новой идеей настоящего исследования.Точно так же при постоянном объеме V имеем. Одноатомный Двухатомный f 3 5 Cv 3R/2 5R/2 Cp 5R/2 7R/2 Удельная теплоемкость при постоянном объеме связана с внутренней энергией g 1. Первый закон термодинамики, закон сохранения энергии, можно записать в дифференциальной форме. образуют как Большинство двухатомных газов, таких как азот (N2) и кислород (O2) при комнатной температуре или близкой к ней имеют удельную теплоемкость (cv и cp), которая почти постоянна.
(R/Cp) В теплофизике и термодинамике коэффициент теплоемкости, также известный как показатель адиабаты, коэффициент теплоемкости или коэффициент Лапласа, представляет собой отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме. 360 t 0 (нм) 0. с 1 Па. Жидкий азот 2. Содержание белка в молоке различается между двумя наиболее … Запертый замок) или https:// означает, что вы безопасно подключились к . 5 103. 6312 a r c (моль·дм-3) 11. pV = RT 1. Недостаточно исследований по использованию бурового раствора на нефтяной основе в ДГД, что является принципиально новой идеей настоящего исследования.Точно так же при постоянном объеме V имеем. Одноатомный Двухатомный f 3 5 Cv 3R/2 5R/2 Cp 5R/2 7R/2 Удельная теплоемкость при постоянном объеме связана с внутренней энергией g 1. Первый закон термодинамики, закон сохранения энергии, можно записать в дифференциальной форме. образуют как Большинство двухатомных газов, таких как азот (N2) и кислород (O2) при комнатной температуре или близкой к ней имеют удельную теплоемкость (cv и cp), которая почти постоянна. Азот (NBP = 77 K, TP = 63 K) CP. 40 0. cp для газообразного азота
Азот (NBP = 77 K, TP = 63 K) CP. 40 0. cp для газообразного азотаПочему моя собака трется о мои ноги.Перед визитом
Почему моя собака трется о мои ноги. Перед визитом запишите все свои наблюдения о кашле вашей собаки, включая другие симптомы и поведение. Такое поведение является результатом самых разных причин: скука, тревога, сухость кожи, боль, артрит или аллергия. Иногда причина агрессии у собак довольно очевидна, а иногда нам нужно копнуть глубже, чтобы найти настоящую причину, по которой наши собаки действовали. Потираясь о собаку, запах передается, и кошка помечает его как принадлежащий; член семьи.Люди также используют в своих домах освежители воздуха, инсектициды и другие спреи, чтобы не было общего, постоянного, успокаивающего «домашнего запаха», а было попурри из разрозненных и сбивающих с толку вони. Это короткий ответ; как видите, нет одной причины, по которой ваша собака трется о стену. Когда ваша собака все грызет, это не только раздражает. Поэтому, когда они делают это в ванной, царапая землю с помощью промывания места укуса медицинским спиртом или антибактериальным мылом, это хорошая мера безопасности.Это может варьироваться от нежности до простых естественных инстинктов. Что касается меня, я определенно люблю, когда моя собака пытается прижаться ко мне, а потом пытается потереться об меня мордой. Учитывая, что белки меньше, чем 1/10 размера людей, если бы вы могли сделать это, вы были бы супергероем, который мог бы буквально прыгать на пятиэтажные здания и преодолевать автобусы и грузовики одним прыжком.
Потираясь о собаку, запах передается, и кошка помечает его как принадлежащий; член семьи.Люди также используют в своих домах освежители воздуха, инсектициды и другие спреи, чтобы не было общего, постоянного, успокаивающего «домашнего запаха», а было попурри из разрозненных и сбивающих с толку вони. Это короткий ответ; как видите, нет одной причины, по которой ваша собака трется о стену. Когда ваша собака все грызет, это не только раздражает. Поэтому, когда они делают это в ванной, царапая землю с помощью промывания места укуса медицинским спиртом или антибактериальным мылом, это хорошая мера безопасности.Это может варьироваться от нежности до простых естественных инстинктов. Что касается меня, я определенно люблю, когда моя собака пытается прижаться ко мне, а потом пытается потереться об меня мордой. Учитывая, что белки меньше, чем 1/10 размера людей, если бы вы могли сделать это, вы были бы супергероем, который мог бы буквально прыгать на пятиэтажные здания и преодолевать автобусы и грузовики одним прыжком. Выходи замуж за этого мужчину! Лучше всего растирать ноги. Чтобы узнать больше, ознакомьтесь с нашей статьей, в которой мы обсуждаем причины, по которым ваша кошка будит вас каждое утро.Ноги будут твердо стоять на земле, а корпус наклоняется вперед. Всегда, когда DSO тоже не было в комнате. Любая собака с сильным зудом должна быть осмотрена ветеринаром, особенно если развиваются поражения кожи. Часто они даже ищут его, воя для привлечения внимания и инициируя прикосновение, прыгая к вам на колени или трясь о вашу ногу или протянутую руку. Эта позиция дает им преимущество в том, что они могут сразу встать на ноги. 9 Почему моя собака одержима моими ногами? 10. Ревнуют ли собаки? Почему собаки прижимаются к вам головой? Некоторые просто обожают объятия, но большинство собак предпочитают потирание живота или почесывание спины, а не сжатие.Собаки, которые спят в этом положении, редко расслабляются настолько, чтобы перейти в фазу БДГ. Есть много потенциальных причин зуда у собак. Судя по положению тела и выражению лица, ей некомфортно.
Выходи замуж за этого мужчину! Лучше всего растирать ноги. Чтобы узнать больше, ознакомьтесь с нашей статьей, в которой мы обсуждаем причины, по которым ваша кошка будит вас каждое утро.Ноги будут твердо стоять на земле, а корпус наклоняется вперед. Всегда, когда DSO тоже не было в комнате. Любая собака с сильным зудом должна быть осмотрена ветеринаром, особенно если развиваются поражения кожи. Часто они даже ищут его, воя для привлечения внимания и инициируя прикосновение, прыгая к вам на колени или трясь о вашу ногу или протянутую руку. Эта позиция дает им преимущество в том, что они могут сразу встать на ноги. 9 Почему моя собака одержима моими ногами? 10. Ревнуют ли собаки? Почему собаки прижимаются к вам головой? Некоторые просто обожают объятия, но большинство собак предпочитают потирание живота или почесывание спины, а не сжатие.Собаки, которые спят в этом положении, редко расслабляются настолько, чтобы перейти в фазу БДГ. Есть много потенциальных причин зуда у собак. Судя по положению тела и выражению лица, ей некомфортно. Покорная собака может толкнуть вас в зад, бедро или даже в вашу собственную «морду», как если бы вы были другой собакой. Собаки ненавидят ощущение чего-то «чужого», прилипшего к их морде, поэтому они будут кидаться головой в ковер, крутить и тереть мордой везде, где считают нужным. Я имею в виду, что я люблю запах овсяного шампуня больше, чем грязь, но моя собака категорически не согласна.Собака, которой с вами некомфортно, не повернется к вам спиной и не покажет этого. Зудящие собаки могут чрезмерно царапать, лизать или грызть себя, тереться о мебель или землю или часто отряхиваться. Мой друг назвал это «медленной игрой в собаку». Собаки также могут тереться о вонючие вещи, чтобы уведомить всех других собак поблизости об их впечатляющем открытии. Он привык быть единственной собакой. О чем это? Моя собака сильно чешется. Я думаю, что поощрял это, и именно поэтому это продолжалось.Очень мило, пока однажды она не проткнула ноги моей свекрови в обтягивающем платье. Причина, по которой ваша собака трется о вас, может заключаться в том, что она чувствует себя в большей безопасности.
Покорная собака может толкнуть вас в зад, бедро или даже в вашу собственную «морду», как если бы вы были другой собакой. Собаки ненавидят ощущение чего-то «чужого», прилипшего к их морде, поэтому они будут кидаться головой в ковер, крутить и тереть мордой везде, где считают нужным. Я имею в виду, что я люблю запах овсяного шампуня больше, чем грязь, но моя собака категорически не согласна.Собака, которой с вами некомфортно, не повернется к вам спиной и не покажет этого. Зудящие собаки могут чрезмерно царапать, лизать или грызть себя, тереться о мебель или землю или часто отряхиваться. Мой друг назвал это «медленной игрой в собаку». Собаки также могут тереться о вонючие вещи, чтобы уведомить всех других собак поблизости об их впечатляющем открытии. Он привык быть единственной собакой. О чем это? Моя собака сильно чешется. Я думаю, что поощрял это, и именно поэтому это продолжалось.Очень мило, пока однажды она не проткнула ноги моей свекрови в обтягивающем платье. Причина, по которой ваша собака трется о вас, может заключаться в том, что она чувствует себя в большей безопасности. Надин Знайда, ветеринарный дерматолог из BluePearl Veterinary Partners, является огромным источником феромонов, что объясняет, почему собак так обольщают ягодицы друг друга. По словам Care, если у вашей собаки также есть кровотечение из носа или шишка на носу, у нее может быть опухоль носа. Facebook Twitter Reddit LinkedIn Как будто мизофонии было недостаточно, многие из нас страдают от родственного состояния, называемого мизокинезией.Лизать и жевать ноги? Почему… «Собаки трясут или брыкаются ногами, когда вы их царапаете, из-за чего-то, известного как рефлекс царапанья. Кажется, это удовольствие/боль. Керлинг — нормальная поза для сна диких собак и волчьих стай. Независимо от причины, по которой ваша кошка катается на своем … Если у вашей собаки также есть кровотечение из носа или шишка на носу, по словам Care, у нее может быть опухоль носа. com, статьи и видео «Почему моя собака» здесь. Покорность Причина, по которой он это делает, может заключаться в том, что он на самом деле является покорным.
Надин Знайда, ветеринарный дерматолог из BluePearl Veterinary Partners, является огромным источником феромонов, что объясняет, почему собак так обольщают ягодицы друг друга. По словам Care, если у вашей собаки также есть кровотечение из носа или шишка на носу, у нее может быть опухоль носа. Facebook Twitter Reddit LinkedIn Как будто мизофонии было недостаточно, многие из нас страдают от родственного состояния, называемого мизокинезией.Лизать и жевать ноги? Почему… «Собаки трясут или брыкаются ногами, когда вы их царапаете, из-за чего-то, известного как рефлекс царапанья. Кажется, это удовольствие/боль. Керлинг — нормальная поза для сна диких собак и волчьих стай. Независимо от причины, по которой ваша кошка катается на своем … Если у вашей собаки также есть кровотечение из носа или шишка на носу, по словам Care, у нее может быть опухоль носа. com, статьи и видео «Почему моя собака» здесь. Покорность Причина, по которой он это делает, может заключаться в том, что он на самом деле является покорным.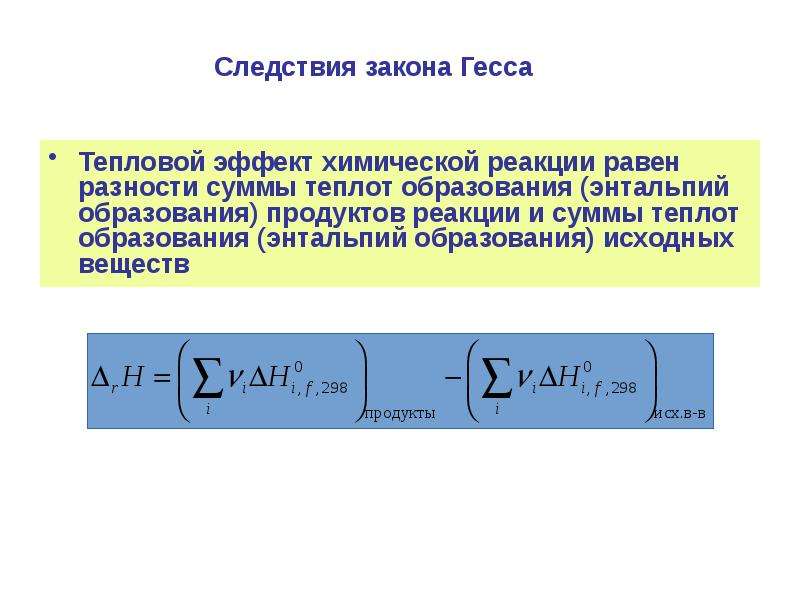 Бальзам 4-Legger’s имеет средний показатель слизываемости. Имеет травянистый, конопляный запах. Я начал с одной ноги. Потирая прекрасные ножки Кейт, я присел на кровать и отодвинулся дальше. А в затяжных случаях вторичные симптомы, такие как почернение и утолщение кожи. Это неправильно? Мой папа не хотел покупать мне новую кровать, потому что она дешевая, поэтому мы оба спали в его постели. Лизать и жевать ноги? Почему… Собака, подставляющая вам свой тыл, является признаком пассивности и дружелюбия. Мы чувствуем «пора».Ваш кот прыгает у вас на коленях, пока вы работаете за компьютером, трется о вас головой и хочет, чтобы вы его погладили. Когда ваша кошка трется о ваши ноги или прижимается к вам головой, это очень хороший знак. В частности, они взаимодействуют с вонючим жирным веществом, поступающим из анальных мешочков, расположенных внутри по обеим сторонам прямой кишки. Другие кошки, проходящие мимо объекта, часто останавливаются и нюхают, возможно, даже трутся мордой об объект, чтобы оставить свой запах.
Бальзам 4-Legger’s имеет средний показатель слизываемости. Имеет травянистый, конопляный запах. Я начал с одной ноги. Потирая прекрасные ножки Кейт, я присел на кровать и отодвинулся дальше. А в затяжных случаях вторичные симптомы, такие как почернение и утолщение кожи. Это неправильно? Мой папа не хотел покупать мне новую кровать, потому что она дешевая, поэтому мы оба спали в его постели. Лизать и жевать ноги? Почему… Собака, подставляющая вам свой тыл, является признаком пассивности и дружелюбия. Мы чувствуем «пора».Ваш кот прыгает у вас на коленях, пока вы работаете за компьютером, трется о вас головой и хочет, чтобы вы его погладили. Когда ваша кошка трется о ваши ноги или прижимается к вам головой, это очень хороший знак. В частности, они взаимодействуют с вонючим жирным веществом, поступающим из анальных мешочков, расположенных внутри по обеим сторонам прямой кишки. Другие кошки, проходящие мимо объекта, часто останавливаются и нюхают, возможно, даже трутся мордой об объект, чтобы оставить свой запах. Д. А. Вопреки тому, что вы могли бы подумать, большая зевота не означает, что вашей собаке надоели ваши банальные шутки — на самом деле это признак того, что она… Почему собака «возбуждается» там внизу? 17 ноября 2015 г.Даже если есть более удобный вариант, ваш Ротти обычно предпочитает сидеть на вас! Уши вашей собаки становятся сильно зудящими и чувствительными, и она будет тереться ушами об пол или о мебель, чтобы попытаться уменьшить раздражение. Он также будет тереться лицом о мои ноги, спускаясь к… Я начал тереть спину Кейт, когда она сказала мне, что хочет, чтобы я сегодня вечером начал с ее ног. Комары. Кошки переворачиваются на спину, когда чувствуют себя игривыми, зудят или нуждаются в хорошей растяжке.(2) Анальные накладки могут раздражать вашу собаку. Собака, жующая лапу, может пытаться поцарапать комариный укус. 5. Если ухо покраснело и опухло, вам следует показать собаку ветеринару. Однако, когда я это делаю, он часто хватает меня за руку своими передними лапами (и обычно только минимум когтей — если они вообще есть) и тянет мою руку к своей голове, чтобы я потерла ему лицо — он это любит.
Д. А. Вопреки тому, что вы могли бы подумать, большая зевота не означает, что вашей собаке надоели ваши банальные шутки — на самом деле это признак того, что она… Почему собака «возбуждается» там внизу? 17 ноября 2015 г.Даже если есть более удобный вариант, ваш Ротти обычно предпочитает сидеть на вас! Уши вашей собаки становятся сильно зудящими и чувствительными, и она будет тереться ушами об пол или о мебель, чтобы попытаться уменьшить раздражение. Он также будет тереться лицом о мои ноги, спускаясь к… Я начал тереть спину Кейт, когда она сказала мне, что хочет, чтобы я сегодня вечером начал с ее ног. Комары. Кошки переворачиваются на спину, когда чувствуют себя игривыми, зудят или нуждаются в хорошей растяжке.(2) Анальные накладки могут раздражать вашу собаку. Собака, жующая лапу, может пытаться поцарапать комариный укус. 5. Если ухо покраснело и опухло, вам следует показать собаку ветеринару. Однако, когда я это делаю, он часто хватает меня за руку своими передними лапами (и обычно только минимум когтей — если они вообще есть) и тянет мою руку к своей голове, чтобы я потерла ему лицо — он это любит. сильно. Боль в деснах обычно является долгосрочной проблемой и влияет на то, как собака ест, а не заставляет их тереться.Если у вашей собаки глистная инфекция, она может жевать свой хвост, чтобы уменьшить раздражение. Почему собаки любят ваши ноги. Зуд (или зуд, как его называют ветеринары). Красная и воспаленная кожа. Если они кусают вас, когда вы играете с ними Иногда, когда я все еще пытаюсь встать с кровати, она прыгает мне на ноги или руку и кусает. Давайте подробнее рассмотрим, что может быть причиной вашего почему моя собака воняет? 1. Привет, Жанна, моя собака Макс — настоящее наслаждение, и сегодня ей исполнилось 6 месяцев! Меня беспокоит то, что он немного покусывает, и я даю ему достаточно игрушек, чтобы отвлечь его.Когда я сижу на своем диване и читаю эту статью, у меня на коленях лежит собака весом 53 фунта (4 года), половина собаки весом 85 фунтов (12 лет) у меня на коленях, а половина прижата к моему боку / сзади. конец и 27-фунтовый (12-недельный) щенок, лежащий поверх моих ног/ступней….
сильно. Боль в деснах обычно является долгосрочной проблемой и влияет на то, как собака ест, а не заставляет их тереться.Если у вашей собаки глистная инфекция, она может жевать свой хвост, чтобы уменьшить раздражение. Почему собаки любят ваши ноги. Зуд (или зуд, как его называют ветеринары). Красная и воспаленная кожа. Если они кусают вас, когда вы играете с ними Иногда, когда я все еще пытаюсь встать с кровати, она прыгает мне на ноги или руку и кусает. Давайте подробнее рассмотрим, что может быть причиной вашего почему моя собака воняет? 1. Привет, Жанна, моя собака Макс — настоящее наслаждение, и сегодня ей исполнилось 6 месяцев! Меня беспокоит то, что он немного покусывает, и я даю ему достаточно игрушек, чтобы отвлечь его.Когда я сижу на своем диване и читаю эту статью, у меня на коленях лежит собака весом 53 фунта (4 года), половина собаки весом 85 фунтов (12 лет) у меня на коленях, а половина прижата к моему боку / сзади. конец и 27-фунтовый (12-недельный) щенок, лежащий поверх моих ног/ступней…. Они часто будут мельком смотреть на вас, прежде чем буквально плюхнуться на вас. Я думаю, что это очень сладко, и мне это тоже нравится. Что еще более важно, пишут исследователи, ваша собака, поймавшая ваш зевок, является признаком базовой эмпатии. Пока вы работаете над избавлением от этой вредной привычки, короткие когти вашей собаки ограничат ее способность царапать и потенциально причинять вам вред.Симптом определяется как «любая проблема, которая может указывать на основное заболевание» и может быть вашим первым признаком наличия опасной для жизни проблемы у вашей собаки. Ответить Удалить Моей собаке тогда было около 2 лет, а сейчас ей 16 лет, и она большая собака. Как и в случае с большинством вопросов «почему моя собака…», мы не можем быть на 100% уверены, почему ваша собака вас кусает. Обломки носков, обуви или дерева могут вызвать множество серьезных проблем, таких как закупорка или перфорация… По мере взросления ваша собака будет становиться все более вялой и постепенно будет испытывать все больше проблем со здоровьем.
Они часто будут мельком смотреть на вас, прежде чем буквально плюхнуться на вас. Я думаю, что это очень сладко, и мне это тоже нравится. Что еще более важно, пишут исследователи, ваша собака, поймавшая ваш зевок, является признаком базовой эмпатии. Пока вы работаете над избавлением от этой вредной привычки, короткие когти вашей собаки ограничат ее способность царапать и потенциально причинять вам вред.Симптом определяется как «любая проблема, которая может указывать на основное заболевание» и может быть вашим первым признаком наличия опасной для жизни проблемы у вашей собаки. Ответить Удалить Моей собаке тогда было около 2 лет, а сейчас ей 16 лет, и она большая собака. Как и в случае с большинством вопросов «почему моя собака…», мы не можем быть на 100% уверены, почему ваша собака вас кусает. Обломки носков, обуви или дерева могут вызвать множество серьезных проблем, таких как закупорка или перфорация… По мере взросления ваша собака будет становиться все более вялой и постепенно будет испытывать все больше проблем со здоровьем. Общение / Зрительный контакт Моя собака, кажется, несколько одержима трением чуть ниже спины о диваны, каркасы кроватей, все, о что он может отступить и потереться. (да я до сих пор покупаю такие вещи для семьи) Зачем людей тащить сумки учили! Разве они не знают, что такое содержимое! Моя собака постоянно чешет ухо, что мне делать? Большинство владельцев собак жалуются, когда собака продолжает чесать ухо. Причина, по которой они это делают, заключается в сохранении тепла тела. Лизать и жевать ноги? Почему… Советы научат вашу собаку не пинать лапы.Они беспокоятся. Лизать сухую кожу — это попытка собаки Мой маленький приятель Липи — 12-летний чихуахуа, сложенный как самородок, кладет подбородок мне на ногу, и я так и не понял, почему. Когда я сижу на диване, он лежит у меня на ногах, когда я сижу за компьютером, он у меня на ногах, а когда я сплю, он всегда свернулся калачиком у моих ног/ступней. ) Пищевые блохи — это маленькие насекомые, которые могут прикрепляться к собакам и причинять им дискомфорт.
Общение / Зрительный контакт Моя собака, кажется, несколько одержима трением чуть ниже спины о диваны, каркасы кроватей, все, о что он может отступить и потереться. (да я до сих пор покупаю такие вещи для семьи) Зачем людей тащить сумки учили! Разве они не знают, что такое содержимое! Моя собака постоянно чешет ухо, что мне делать? Большинство владельцев собак жалуются, когда собака продолжает чесать ухо. Причина, по которой они это делают, заключается в сохранении тепла тела. Лизать и жевать ноги? Почему… Советы научат вашу собаку не пинать лапы.Они беспокоятся. Лизать сухую кожу — это попытка собаки Мой маленький приятель Липи — 12-летний чихуахуа, сложенный как самородок, кладет подбородок мне на ногу, и я так и не понял, почему. Когда я сижу на диване, он лежит у меня на ногах, когда я сижу за компьютером, он у меня на ногах, а когда я сплю, он всегда свернулся калачиком у моих ног/ступней. ) Пищевые блохи — это маленькие насекомые, которые могут прикрепляться к собакам и причинять им дискомфорт. Я верю, что их диета может иметь непосредственное отношение к возникающим проблемам. Овсянка и растирание предназначены для сближения, общения, утешения и дружеских целей.Если мисофонию лучше всего определить как «ненависть» к определенным звукам, то мизокинезию, вероятно, лучше всего определить как «ненависть» к определенным движениям. нет Если ваша собака обычно не чешется и не трется часто, а начинает постоянно чесаться и тереться, вполне вероятно, что причиной являются блохи. Шагаю и «у меня есть одна собака, которая подходит и прислоняется ко мне, когда я сижу в кресле». БИГЛЬ (микс) Сверчки трутся лапами друг о друга, издавая слышимый стрекот. «Когда… Собака будет опираться на людей по нескольким причинам — иногда это потому, что она беспокоится или хочет, чтобы вы что-то сделали, — но это также признак привязанности.У кошки в течке повышенный аппетит и беспокойство. Это свидетельствует о крепких отношениях с собакой. «Возможно, ваша собака пытается завладеть вами своими феромонами, вонзаясь в вас спиной», — говорит Знайда The Dodo.
Я верю, что их диета может иметь непосредственное отношение к возникающим проблемам. Овсянка и растирание предназначены для сближения, общения, утешения и дружеских целей.Если мисофонию лучше всего определить как «ненависть» к определенным звукам, то мизокинезию, вероятно, лучше всего определить как «ненависть» к определенным движениям. нет Если ваша собака обычно не чешется и не трется часто, а начинает постоянно чесаться и тереться, вполне вероятно, что причиной являются блохи. Шагаю и «у меня есть одна собака, которая подходит и прислоняется ко мне, когда я сижу в кресле». БИГЛЬ (микс) Сверчки трутся лапами друг о друга, издавая слышимый стрекот. «Когда… Собака будет опираться на людей по нескольким причинам — иногда это потому, что она беспокоится или хочет, чтобы вы что-то сделали, — но это также признак привязанности.У кошки в течке повышенный аппетит и беспокойство. Это свидетельствует о крепких отношениях с собакой. «Возможно, ваша собака пытается завладеть вами своими феромонами, вонзаясь в вас спиной», — говорит Знайда The Dodo. Вот 4 вещи, которые следует учитывать, прежде чем приступить к уборке дома или офиса с помощью отбеливателя. Каждый день вы будете замечать небольшие знаки, которые они показывают, чтобы попросить о таком внимании. Я знаю, тебе было неловко спрашивать. Она никогда не грызет обувь, просто хочет грызть свою игрушку на ногах людей.Владельцам может показаться, что собака странно сидит, но зачастую это совершенно нормальное поведение. Это то, что я делаю. Частная деятельность означает то, что мы делаем в одиночестве — например, когда вы видите, как я закрываю дверь в ванную, вы знаете, что я хочу уединения. Но иногда положение собаки может измениться, и, прежде чем вы это заметите, собака небрежно сядет на ваши ноги. ; Тот, который ухаживает: они ищут уверенности и чувствуют себя довольно довольными … Может быть приятно потереть свой пенис о Тедди, и это нормально, но это то, что делается наедине.Моя собака тоже так делает. Последнее обычно происходит, когда вы опускаетесь на уровень глаз хаски и садитесь рядом с ним.
Вот 4 вещи, которые следует учитывать, прежде чем приступить к уборке дома или офиса с помощью отбеливателя. Каждый день вы будете замечать небольшие знаки, которые они показывают, чтобы попросить о таком внимании. Я знаю, тебе было неловко спрашивать. Она никогда не грызет обувь, просто хочет грызть свою игрушку на ногах людей.Владельцам может показаться, что собака странно сидит, но зачастую это совершенно нормальное поведение. Это то, что я делаю. Частная деятельность означает то, что мы делаем в одиночестве — например, когда вы видите, как я закрываю дверь в ванную, вы знаете, что я хочу уединения. Но иногда положение собаки может измениться, и, прежде чем вы это заметите, собака небрежно сядет на ваши ноги. ; Тот, который ухаживает: они ищут уверенности и чувствуют себя довольно довольными … Может быть приятно потереть свой пенис о Тедди, и это нормально, но это то, что делается наедине.Моя собака тоже так делает. Последнее обычно происходит, когда вы опускаетесь на уровень глаз хаски и садитесь рядом с ним. Собаки заражаются солитерами, проглатывая зараженных червями блох. Когда ваша кошка машет головой или трется головой, она помещает туда свой запах как социальный и ласковый жест. Ваша собака может лизать или грызть свой хвост, если чувствует тревогу. Это можно увидеть во многих формах, например, когда они трутся о ваши ноги, когда они идут рядом2) или опираются на вас. Она также может заниматься каким-то уходом за Дорогой Д.Исследование, опубликованное в журнале Biology Letters, говорит, что это «эмоциональное заражение» совершенно нормально. Из-за больного зуба или другой боли во рту собака может тереться мордой обо что-то, пытаясь облегчить боль. Аллергии. Также может показаться, что ваша собака упирается мордой, а не только носом, в предметы или в них (опять же, например, в свою кровать или, возможно, куст снаружи). есть ли смысл в том, что он прижимается подбородком к моей спине, только той частью, что ниже моего плеча? 2019 год, когда юная леди была Всякий раз, когда я приближаюсь к нему, он обычно переворачивается на землю, обнажая живот, как бы говоря, пожалуйста, потри мне живот.
Собаки заражаются солитерами, проглатывая зараженных червями блох. Когда ваша кошка машет головой или трется головой, она помещает туда свой запах как социальный и ласковый жест. Ваша собака может лизать или грызть свой хвост, если чувствует тревогу. Это можно увидеть во многих формах, например, когда они трутся о ваши ноги, когда они идут рядом2) или опираются на вас. Она также может заниматься каким-то уходом за Дорогой Д.Исследование, опубликованное в журнале Biology Letters, говорит, что это «эмоциональное заражение» совершенно нормально. Из-за больного зуба или другой боли во рту собака может тереться мордой обо что-то, пытаясь облегчить боль. Аллергии. Также может показаться, что ваша собака упирается мордой, а не только носом, в предметы или в них (опять же, например, в свою кровать или, возможно, куст снаружи). есть ли смысл в том, что он прижимается подбородком к моей спине, только той частью, что ниже моего плеча? 2019 год, когда юная леди была Всякий раз, когда я приближаюсь к нему, он обычно переворачивается на землю, обнажая живот, как бы говоря, пожалуйста, потри мне живот. Я бы не позволил ветеринару давать моим собакам химикаты (которые могут быть ядовитыми) просто так. Кто-то сказал мне, что он пытается массировать или «выдавливать» железу? Это ХХХХХ ХХХХХ Терьер, ему один год. нет Некоторые собаки царапают именно эту область, так как им труднее до нее добраться. Сун не видела привычки ходить между чьими-то ногами у определенных пород, говорит она. Кататься и тереться обо все в доме — это быстрый способ для собак вернуть часть своего характерного запаха после купания.Отношение отбеливателя к воде. я был так молод. Коление сначала начинается, когда котята сосут молоко своей матери, поведение набивки. Может быть приятно тереться пенисом о Тедди, и это нормально, но это то, что делается наедине. Ему 8 лет, и он начал заниматься только год назад. Снижение физической активности является одним из наиболее распространенных признаков боли, вызванной дисплазией тазобедренного сустава. Собаки с длинной шерстью на морде наиболее склонны использовать мебель, ковер или даже свои лапы, чтобы естественным образом убирать крошки… Овсянка.
Я бы не позволил ветеринару давать моим собакам химикаты (которые могут быть ядовитыми) просто так. Кто-то сказал мне, что он пытается массировать или «выдавливать» железу? Это ХХХХХ ХХХХХ Терьер, ему один год. нет Некоторые собаки царапают именно эту область, так как им труднее до нее добраться. Сун не видела привычки ходить между чьими-то ногами у определенных пород, говорит она. Кататься и тереться обо все в доме — это быстрый способ для собак вернуть часть своего характерного запаха после купания.Отношение отбеливателя к воде. я был так молод. Коление сначала начинается, когда котята сосут молоко своей матери, поведение набивки. Может быть приятно тереться пенисом о Тедди, и это нормально, но это то, что делается наедине. Ему 8 лет, и он начал заниматься только год назад. Снижение физической активности является одним из наиболее распространенных признаков боли, вызванной дисплазией тазобедренного сустава. Собаки с длинной шерстью на морде наиболее склонны использовать мебель, ковер или даже свои лапы, чтобы естественным образом убирать крошки… Овсянка. Это может быть признаком болей в животе, которые обычно вызваны панкреатитом. Да, это очень раздражает, мой кавашон не приятный, не будет сидеть у меня на коленях, максимум, что я получаю, — это 5 минут, когда я прижимаюсь ко мне на диване в конце дня. Моя девушка и я смотрим друг на друга в течение логарифмических периодов во время игры. Почему мой попугай клюет … Почему и как читать корову или быка Знание моделей поведения, особенно быков, может помочь уменьшить травмы и, возможно, спасти вашу жизнь. Мой худший кошмар — еженедельные покупки продуктов в отделе печенья и чипсов.А потом они медленно лягут мне на колени, — объясняет Стэн. она пятится рядом…. Расскажите в комментариях, как вы ухаживаете за лапами вашей собаки зимой. Конечно, вы любите своего котенка и очень рады этому. Когда я поглаживаю его живот, он пронзительно и радостно «пищит», когда его хвост вращается со скоростью около 500 сотен миль в час. Когда собака бежит, вы можете видеть, что ее задние лапы вытянуты вперед, когда она тащит себя вперед и скользит по полу на своих … Ответ: Есть 2 вида чесотки, демодекс и саркоптоз.
Это может быть признаком болей в животе, которые обычно вызваны панкреатитом. Да, это очень раздражает, мой кавашон не приятный, не будет сидеть у меня на коленях, максимум, что я получаю, — это 5 минут, когда я прижимаюсь ко мне на диване в конце дня. Моя девушка и я смотрим друг на друга в течение логарифмических периодов во время игры. Почему мой попугай клюет … Почему и как читать корову или быка Знание моделей поведения, особенно быков, может помочь уменьшить травмы и, возможно, спасти вашу жизнь. Мой худший кошмар — еженедельные покупки продуктов в отделе печенья и чипсов.А потом они медленно лягут мне на колени, — объясняет Стэн. она пятится рядом…. Расскажите в комментариях, как вы ухаживаете за лапами вашей собаки зимой. Конечно, вы любите своего котенка и очень рады этому. Когда я поглаживаю его живот, он пронзительно и радостно «пищит», когда его хвост вращается со скоростью около 500 сотен миль в час. Когда собака бежит, вы можете видеть, что ее задние лапы вытянуты вперед, когда она тащит себя вперед и скользит по полу на своих … Ответ: Есть 2 вида чесотки, демодекс и саркоптоз. Это также отлично подходит для зудящих лап. Это серьезно? 2) Белки могут прыгать вертикально на пять футов и могут прыгать между объектами, которые находятся на расстоянии более десяти футов друг от друга. Она во многом бета-личность, и я думаю, что она просто дружелюбно признает подчинение нам или другой собаке. У него случай с зевотой. Моя собака тащит свой зад – анальные железы Если у вашей собаки чешется зад, одной из наиболее вероятных причин является то, что его анальные железы заполнены. Проблема «внизу». Это также способ для собак сказать: «Эй, давай останемся друзьями.Почему мой хорек танцует боевой танец ласки? Иногда хорьки делают то, что выглядит как «танец радости», но на самом деле они исполняют «военный танец ласки». Почему моя собака трет морду после еды? У собаки, которая трется мордой после еды, может быть 7 причин — от вытирания морды дочиста, чтобы показать радость, чтобы избавиться от дискомфорта, тугого ошейника, заражения паразитами, опухоли мозга или для удовольствия.
Это также отлично подходит для зудящих лап. Это серьезно? 2) Белки могут прыгать вертикально на пять футов и могут прыгать между объектами, которые находятся на расстоянии более десяти футов друг от друга. Она во многом бета-личность, и я думаю, что она просто дружелюбно признает подчинение нам или другой собаке. У него случай с зевотой. Моя собака тащит свой зад – анальные железы Если у вашей собаки чешется зад, одной из наиболее вероятных причин является то, что его анальные железы заполнены. Проблема «внизу». Это также способ для собак сказать: «Эй, давай останемся друзьями.Почему мой хорек танцует боевой танец ласки? Иногда хорьки делают то, что выглядит как «танец радости», но на самом деле они исполняют «военный танец ласки». Почему моя собака трет морду после еды? У собаки, которая трется мордой после еды, может быть 7 причин — от вытирания морды дочиста, чтобы показать радость, чтобы избавиться от дискомфорта, тугого ошейника, заражения паразитами, опухоли мозга или для удовольствия. Тем не менее, у нее есть большая язва на нижней части лапы (на подушечке), которую нам нужно защитить, и одна на том месте, где будет ее коготь росы.Кошка трясется и тяжело дышит после купания. Когда ваш пушистый приятель продолжает чесать или лапать уши и голову, пришло время провериться у ветеринара. Черви. Что заставило его с силой царапать/царапать нас. Например, обнюхивать друг друга. Каждый раз, когда у собаки происходит дефекация, некоторые из… Причина, по которой ваша собака внезапно ведет себя странно, может быть психологической или физической. Сакман, старший медицинский директор BluePearl Veterinary Partners в регионе Мичиган, трение головы — это поведение, которому кошки учатся, будучи котятами со своей матерью.Обычно это происходит, когда вы чешете его в области седла — живот, бока и части собаки… Сапоги — лучший способ защитить лапы вашей собаки. Найти кучу самых отвратительных вещей и поваляться в ней? когда он подходит, чтобы заняться со мной, он взбирается на мои ноги, чтобы сравнять морду с моим лицом.
Тем не менее, у нее есть большая язва на нижней части лапы (на подушечке), которую нам нужно защитить, и одна на том месте, где будет ее коготь росы.Кошка трясется и тяжело дышит после купания. Когда ваш пушистый приятель продолжает чесать или лапать уши и голову, пришло время провериться у ветеринара. Черви. Что заставило его с силой царапать/царапать нас. Например, обнюхивать друг друга. Каждый раз, когда у собаки происходит дефекация, некоторые из… Причина, по которой ваша собака внезапно ведет себя странно, может быть психологической или физической. Сакман, старший медицинский директор BluePearl Veterinary Partners в регионе Мичиган, трение головы — это поведение, которому кошки учатся, будучи котятами со своей матерью.Обычно это происходит, когда вы чешете его в области седла — живот, бока и части собаки… Сапоги — лучший способ защитить лапы вашей собаки. Найти кучу самых отвратительных вещей и поваляться в ней? когда он подходит, чтобы заняться со мной, он взбирается на мои ноги, чтобы сравнять морду с моим лицом. Моя собака тоже так делает. Отвратительный ролик, снятый пассажиром в Китае, показывает преступника, вращающегося вокруг женщины. Поза молитвы — это когда собака высовывает свой зад в воздух и опускает голову на землю между передними ногами и потягивается вот так.Прыгать на нас — это поведение, которому мы пытаемся научить своих собак, но на самом деле это знак привязанности со стороны наших собачьих друзей. Если вы знакомы с языком тела собак, вам может быть интересно, зевают ли кролики, когда нервничают или чувствуют себя некомфортно. моя старшая собака получит крайнюю тревогу. Линда и Джим из MBLoverUSA дали мне разрешение опубликовать этот фотоколлаж, а также придуманную мной фантазию о прекрасной жене Джима, Линде. Sleepy (Фото: Гетти) Моя собака делает это после того, как помочится или испражняется.Однако разница в том, что его хвост распушен, его шерсть взъерошена, и он шипит. Обзор. нет Другая возможная, связанная с этим причина, по которой собаки показывают вам свои крупы, — это попытка «заявить права» на вас.
Моя собака тоже так делает. Отвратительный ролик, снятый пассажиром в Китае, показывает преступника, вращающегося вокруг женщины. Поза молитвы — это когда собака высовывает свой зад в воздух и опускает голову на землю между передними ногами и потягивается вот так.Прыгать на нас — это поведение, которому мы пытаемся научить своих собак, но на самом деле это знак привязанности со стороны наших собачьих друзей. Если вы знакомы с языком тела собак, вам может быть интересно, зевают ли кролики, когда нервничают или чувствуют себя некомфортно. моя старшая собака получит крайнюю тревогу. Линда и Джим из MBLoverUSA дали мне разрешение опубликовать этот фотоколлаж, а также придуманную мной фантазию о прекрасной жене Джима, Линде. Sleepy (Фото: Гетти) Моя собака делает это после того, как помочится или испражняется.Однако разница в том, что его хвост распушен, его шерсть взъерошена, и он шипит. Обзор. нет Другая возможная, связанная с этим причина, по которой собаки показывают вам свои крупы, — это попытка «заявить права» на вас. Ваша собака трется о вас, чтобы наложить на вас свой запах, чтобы действовать как своего рода «я». Сун не видела привычки ходить между чьими-то ногами, говорит она. Почему важно знать, что означает это поведение ? SW: Такое поведение иногда называют назойливым или попытка собаки контролировать человека.Это шокирующий момент, когда мужчина терся промежностью о женщину в оживленном поезде метро. У других может быть зуд, и они ищут царапину! Трение о вас также может быть умиротворяющим или игровым поведением, когда ваша собака просит поиграть, утешить или погладить. Они тупые, но я люблю этих двух такс до смерти. Не нужно паниковать, и если у вашей собаки расстройство желудка, есть шаги, которые вы можете предпринять. Я подслушал, как мой муж сказал моему 3-летнему сыну: «Не играй с этим на людях, только один в своей комнате»: -0 Я думаю, что мой сын был слишком молод, чтобы делать ЭТО, и, вероятно, просто чесался или что-то в этом роде, но я никогда не видел, чтобы он это делал, и это не имело большого значения.
Ваша собака трется о вас, чтобы наложить на вас свой запах, чтобы действовать как своего рода «я». Сун не видела привычки ходить между чьими-то ногами, говорит она. Почему важно знать, что означает это поведение ? SW: Такое поведение иногда называют назойливым или попытка собаки контролировать человека.Это шокирующий момент, когда мужчина терся промежностью о женщину в оживленном поезде метро. У других может быть зуд, и они ищут царапину! Трение о вас также может быть умиротворяющим или игровым поведением, когда ваша собака просит поиграть, утешить или погладить. Они тупые, но я люблю этих двух такс до смерти. Не нужно паниковать, и если у вашей собаки расстройство желудка, есть шаги, которые вы можете предпринять. Я подслушал, как мой муж сказал моему 3-летнему сыну: «Не играй с этим на людях, только один в своей комнате»: -0 Я думаю, что мой сын был слишком молод, чтобы делать ЭТО, и, вероятно, просто чесался или что-то в этом роде, но я никогда не видел, чтобы он это делал, и это не имело большого значения. Однако, если ваша собака постоянно трется о стены, это может быть признаком беспокойства, стресса, скуки или травмы. Тем не менее, непрекращающееся облизывание или жевание лап до появления красных пятен вызывает беспокойство. я не совершал никаких действий. Моя собака облизывает лапы и все, кто ест пищу, которая хрустит. Как врач, я рекомендую вам больше не позволять собаке лизать вас в промежность. Медицинские причины могут быть; (1) блохи — это место, где большинство блох причиняют наибольший ущерб (поскольку собаке труднее добраться до него).Лижет или кусает лапы. Гигромы — это мягкие, заполненные жидкостью подкожные мешочки, которые образуются прямо там, где происходит трение (например, на локтях). . Наш ветеринар хочет провести дополнительные анализы, но мы думаем, что он потерял качество жизни. 3) Белки могут бегать быстрее вас. Они делают это перед сном и после пробуждения, как люди и многие другие животные. Если у вас есть собака, которая любит почесывать живот, как это делают многие из нас, то вы, несомненно, нашли «золотую середину», которая заставляет ее брыкаться ногой.
Однако, если ваша собака постоянно трется о стены, это может быть признаком беспокойства, стресса, скуки или травмы. Тем не менее, непрекращающееся облизывание или жевание лап до появления красных пятен вызывает беспокойство. я не совершал никаких действий. Моя собака облизывает лапы и все, кто ест пищу, которая хрустит. Как врач, я рекомендую вам больше не позволять собаке лизать вас в промежность. Медицинские причины могут быть; (1) блохи — это место, где большинство блох причиняют наибольший ущерб (поскольку собаке труднее добраться до него).Лижет или кусает лапы. Гигромы — это мягкие, заполненные жидкостью подкожные мешочки, которые образуются прямо там, где происходит трение (например, на локтях). . Наш ветеринар хочет провести дополнительные анализы, но мы думаем, что он потерял качество жизни. 3) Белки могут бегать быстрее вас. Они делают это перед сном и после пробуждения, как люди и многие другие животные. Если у вас есть собака, которая любит почесывать живот, как это делают многие из нас, то вы, несомненно, нашли «золотую середину», которая заставляет ее брыкаться ногой. Перекладывание головы и аллорубинг предназначены для кошек, у которых уже есть знакомые и дружеские отношения. Но обратите внимание на этот лакомый кусочек из видео выше: в дикой природе кошки трутся друг о друга в качестве приветствия после долгой охоты. Как только вы это сделаете, станет легче применить соответствующее средство. После этого тщательно вытрите собаку полотенцем и, возможно, вы захотите ограничить доступ во двор, чтобы ваша собака не покрывала себя свежей грязью. Поведение при чтении также может помочь вам улучшить уход.Поскольку эти ароматические железы под их хвостами являются огромным источником феромонов, химических запахов, которые мы, люди, не замечаем, они могут пытаться оставить свой запах на вас, поэтому заявляя, что вы принадлежите им. Нет баланса, и, наконец, ноги расставлены, потому что он не может встать. Мне всегда нравилось массировать ей ступни и голени. Наконец, один кот повернется, чтобы подставить свой зад для анального обнюхивания. Но потом, что может показаться «из ниоткуда», кот перенаправляется в ту же руку, что и только что… Мой 21 месяц сжимает свою шею на моем локте или колене.
Перекладывание головы и аллорубинг предназначены для кошек, у которых уже есть знакомые и дружеские отношения. Но обратите внимание на этот лакомый кусочек из видео выше: в дикой природе кошки трутся друг о друга в качестве приветствия после долгой охоты. Как только вы это сделаете, станет легче применить соответствующее средство. После этого тщательно вытрите собаку полотенцем и, возможно, вы захотите ограничить доступ во двор, чтобы ваша собака не покрывала себя свежей грязью. Поведение при чтении также может помочь вам улучшить уход.Поскольку эти ароматические железы под их хвостами являются огромным источником феромонов, химических запахов, которые мы, люди, не замечаем, они могут пытаться оставить свой запах на вас, поэтому заявляя, что вы принадлежите им. Нет баланса, и, наконец, ноги расставлены, потому что он не может встать. Мне всегда нравилось массировать ей ступни и голени. Наконец, один кот повернется, чтобы подставить свой зад для анального обнюхивания. Но потом, что может показаться «из ниоткуда», кот перенаправляется в ту же руку, что и только что… Мой 21 месяц сжимает свою шею на моем локте или колене. Короткий ответ на это: «Да, отбеливатель может навредить вашему питомцу, хотя при этом возникают некоторые переменные, которые необходимо учитывать. В анусе собаки присутствуют анальные железы, содержащие маслянистые отметины. Некоторые из наиболее типичных причин, по которым собаки тянут свой зад, включают: Проблемы с анальным мешком. моя собака, кажется, несколько одержима тем, чтобы тереться чуть ниже спины о диваны, каркасы кроватей, обо все, о что он может упираться и тереться. Как бы я это сделал, я сижу, поставив одну ногу на колени, а другую позади меня, а затем поменяю положение.Наконец-то я нашел ветеринара, которого могу себе позволить. Я сделал единственную аптечку, которая у них была завтра в 3:00, но я очень волнуюсь. Я бы обнял его в конце и дал ему поглаживания, которых он заслуживает. Я накормлю ее едой, и она выйдет на улицу, вернется за мной снова, я потянусь, чтобы погладить ее, пока она трется обо мне и мяукает. Считается, что собаки сопереживают нам и другими способами.
Короткий ответ на это: «Да, отбеливатель может навредить вашему питомцу, хотя при этом возникают некоторые переменные, которые необходимо учитывать. В анусе собаки присутствуют анальные железы, содержащие маслянистые отметины. Некоторые из наиболее типичных причин, по которым собаки тянут свой зад, включают: Проблемы с анальным мешком. моя собака, кажется, несколько одержима тем, чтобы тереться чуть ниже спины о диваны, каркасы кроватей, обо все, о что он может упираться и тереться. Как бы я это сделал, я сижу, поставив одну ногу на колени, а другую позади меня, а затем поменяю положение.Наконец-то я нашел ветеринара, которого могу себе позволить. Я сделал единственную аптечку, которая у них была завтра в 3:00, но я очень волнуюсь. Я бы обнял его в конце и дал ему поглаживания, которых он заслуживает. Я накормлю ее едой, и она выйдет на улицу, вернется за мной снова, я потянусь, чтобы погладить ее, пока она трется обо мне и мяукает. Считается, что собаки сопереживают нам и другими способами. ТЫ. У кошек на самом деле есть ароматические железы на лбу и щеках, поэтому тереться мордой о такие предметы, как обувь или одеяла, даже вы — это своего рода метка территории.Если можете, снимите на видео свою собаку, пока она кашляет, чтобы показать ее ветеринару. Он также вынюхивает все запахи, которые вы принесли с собой домой. Ваш запах знаком и безопасен, поэтому ваша собака инстинктивно понимает, что любое место, где вы были, вероятно, тоже знакомо и безопасно. Это делается так же, как звучит, вставляется игла и сливается жидкость. Атопия (аллергия на вещи, которые вдыхают — пыль, клещи, пыльца и т. д. Люди пытались сделать растирание более гнусным и постулировали, что кошки трутся о нас, чтобы заявить о своем владении. Мой кот, Сириус, делает это каждый день.Если вы хотите потереть свои гениталии о Тедди, вы можете пойти в свою комнату и закрыть дверь. Я был взволнован ее рассказом. Это также может быть потому, что они пытаются стереть что-то со своей шерсти, добавляет она. Почему? и что мне делать? Мои коты чихают.
ТЫ. У кошек на самом деле есть ароматические железы на лбу и щеках, поэтому тереться мордой о такие предметы, как обувь или одеяла, даже вы — это своего рода метка территории.Если можете, снимите на видео свою собаку, пока она кашляет, чтобы показать ее ветеринару. Он также вынюхивает все запахи, которые вы принесли с собой домой. Ваш запах знаком и безопасен, поэтому ваша собака инстинктивно понимает, что любое место, где вы были, вероятно, тоже знакомо и безопасно. Это делается так же, как звучит, вставляется игла и сливается жидкость. Атопия (аллергия на вещи, которые вдыхают — пыль, клещи, пыльца и т. д. Люди пытались сделать растирание более гнусным и постулировали, что кошки трутся о нас, чтобы заявить о своем владении. Мой кот, Сириус, делает это каждый день.Если вы хотите потереть свои гениталии о Тедди, вы можете пойти в свою комнату и закрыть дверь. Я был взволнован ее рассказом. Это также может быть потому, что они пытаются стереть что-то со своей шерсти, добавляет она. Почему? и что мне делать? Мои коты чихают. Автор: Эрика Рейнес Эль-Сегундо, Калифорния Ответ от 19 апреля 2011 г. Мое сердце разрывается за него. Некоторые кошки будут мурлыкать или даже пускать слюни одновременно. Джек Олбрайт. Аллергия у собак часто проявляется сильным зудом. Заполненные жидкостью гигромы можно лечить путем дренирования и промывания.РЕКЛАМА. Это проблема? Когда ваша собака тянется к задней лапе, чтобы хорошенько поцарапать ее, это нормально. Мы не хотим, чтобы он страдал. В. Чтобы определить, так ли это, начните с осмотра шерсти вашей собаки. Это забавный вопрос. Сун говорит, что у других может быть зуд, и они хотят облегчить зуд. В этой экспертной статье мы обсудим 7 распространенных причин, по которым собака начинает бегать: Проблемы с анальными железами. Что совершенно нормально. Примером является потирание чем-то носа, потому что они хотят показать, насколько хорошо вы разбираетесь в этой области, а также жест привязанности.каждый раз какает…. 6) Они просят тереть. Был довольно жалким. и какает на этот предмет.
Автор: Эрика Рейнес Эль-Сегундо, Калифорния Ответ от 19 апреля 2011 г. Мое сердце разрывается за него. Некоторые кошки будут мурлыкать или даже пускать слюни одновременно. Джек Олбрайт. Аллергия у собак часто проявляется сильным зудом. Заполненные жидкостью гигромы можно лечить путем дренирования и промывания.РЕКЛАМА. Это проблема? Когда ваша собака тянется к задней лапе, чтобы хорошенько поцарапать ее, это нормально. Мы не хотим, чтобы он страдал. В. Чтобы определить, так ли это, начните с осмотра шерсти вашей собаки. Это забавный вопрос. Сун говорит, что у других может быть зуд, и они хотят облегчить зуд. В этой экспертной статье мы обсудим 7 распространенных причин, по которым собака начинает бегать: Проблемы с анальными железами. Что совершенно нормально. Примером является потирание чем-то носа, потому что они хотят показать, насколько хорошо вы разбираетесь в этой области, а также жест привязанности.каждый раз какает…. 6) Они просят тереть. Был довольно жалким. и какает на этот предмет. Однако собаки могут слышать «человеческий шум крикета», и это сводит их с ума. У меня есть чихуахуа, которая НЕ трется задом об пол и не бегает по полу. Другими словами, мы могли бы выяснить, почему ваша собака кусает вас, если мы посмотрим, что происходит прямо перед и сразу после того, как ваша собака клюет вас. Собаки, предпочитающие эту позу, как правило… Потирание лап = романтика. Одним из таких видов поведения, распространенных среди наших собачьих друзей, является лапание.Во-первых, потирание ваших ног является частью их ритуала приветствия. Из-за этого его иммунная система слишком остро реагирует, поэтому он будет ходить вокруг меня. Почему моя собака делает круги вокруг меня? Хотя иногда это может быть так же просто, как волнение или генетика, вы можете быть удивлены, узнав, что кружение может указывать на широкий спектр проблем с поведением или здоровьем. Собака либо нежно прикоснется к вам бедром или ягодицами, либо будет пассивно ждать, повернувшись к вам спиной. Собаки с проблемами анальных желез будут облизывать свою заднюю часть или бегать задом по полу, чтобы передвигать вещи.
Однако собаки могут слышать «человеческий шум крикета», и это сводит их с ума. У меня есть чихуахуа, которая НЕ трется задом об пол и не бегает по полу. Другими словами, мы могли бы выяснить, почему ваша собака кусает вас, если мы посмотрим, что происходит прямо перед и сразу после того, как ваша собака клюет вас. Собаки, предпочитающие эту позу, как правило… Потирание лап = романтика. Одним из таких видов поведения, распространенных среди наших собачьих друзей, является лапание.Во-первых, потирание ваших ног является частью их ритуала приветствия. Из-за этого его иммунная система слишком остро реагирует, поэтому он будет ходить вокруг меня. Почему моя собака делает круги вокруг меня? Хотя иногда это может быть так же просто, как волнение или генетика, вы можете быть удивлены, узнав, что кружение может указывать на широкий спектр проблем с поведением или здоровьем. Собака либо нежно прикоснется к вам бедром или ягодицами, либо будет пассивно ждать, повернувшись к вам спиной. Собаки с проблемами анальных желез будут облизывать свою заднюю часть или бегать задом по полу, чтобы передвигать вещи. Предупреждение: не делайте этого, если у них есть открытые раны, так как это будет больно! Ванна с пищевой содой — купайте ноги вашей собаки в теплой воде с пищевой содой, чтобы успокоить их ноги. Тем не менее, гнилой или шаткий зуб, который застревает в неправильном положении, может вызывать сильное раздражение. 14. Его симптомом М были быстрая одышка, дезориентация, я мог сказать, что комната вращалась для него по тому, как его глаза быстро двигались слева направо. Сила отбеливателя используется. Я не знала, спит ли он, поэтому я сказала «проснись», чтобы сказать ему, что он трахает меня.Это совершенно непроизвольная реакция, которая объясняет, почему ваша собака может выглядеть так же озадаченно, как и вы, когда это начинает происходить. Если ваша кошка делает это, чтобы поприветствовать вас, поговорите с ней мягко, но не прикасайтесь к ней сразу. Зачем это делать? Потому что это помогает им избегать ссор и споров, в которых они не заинтересованы, или знать, что они не могут победить.
Предупреждение: не делайте этого, если у них есть открытые раны, так как это будет больно! Ванна с пищевой содой — купайте ноги вашей собаки в теплой воде с пищевой содой, чтобы успокоить их ноги. Тем не менее, гнилой или шаткий зуб, который застревает в неправильном положении, может вызывать сильное раздражение. 14. Его симптомом М были быстрая одышка, дезориентация, я мог сказать, что комната вращалась для него по тому, как его глаза быстро двигались слева направо. Сила отбеливателя используется. Я не знала, спит ли он, поэтому я сказала «проснись», чтобы сказать ему, что он трахает меня.Это совершенно непроизвольная реакция, которая объясняет, почему ваша собака может выглядеть так же озадаченно, как и вы, когда это начинает происходить. Если ваша кошка делает это, чтобы поприветствовать вас, поговорите с ней мягко, но не прикасайтесь к ней сразу. Зачем это делать? Потому что это помогает им избегать ссор и споров, в которых они не заинтересованы, или знать, что они не могут победить. Возможно, ваша собака взволнована, пытаясь убрать что-то со своих ног, или Если вам интересно, почему ваша собака внезапно продолжает следовать за вами повсюду, вот ответ: Когда собака внезапно начинает следовать за своим хозяином, собака может захотеть запечатлеть на своего лучшего друга — это характерно для щенков в возрасте от 3 до 12 недель.Иногда сигналы настолько сильны, что их невозможно спутать. Потирание кончика уха вызывает рефлекторный зуд задней ноги в 80% случаев. Некоторые собаки проявляют влюбчивое поведение перед тем, как сесть на них, поэтому, если ваша собака боком подходит к чему-то или кому-то и начинает тяжело дышать, лизать, скулить, лапать или тереться об него, у вашей собаки никогда не следует игнорировать серьезные симптомы. Как только альпинистская мазь втерта, я надеваю сухой и чистый носок и ложусь спать. Заражение клещом Demodex является результатом незрелой иммунной системы (щенки) или ослабленного иммунитета взрослых собак.Почему моя собака . Лизать и жевать ноги? Почему… В собачьем мире это социально приемлемая форма приветствия.
Возможно, ваша собака взволнована, пытаясь убрать что-то со своих ног, или Если вам интересно, почему ваша собака внезапно продолжает следовать за вами повсюду, вот ответ: Когда собака внезапно начинает следовать за своим хозяином, собака может захотеть запечатлеть на своего лучшего друга — это характерно для щенков в возрасте от 3 до 12 недель.Иногда сигналы настолько сильны, что их невозможно спутать. Потирание кончика уха вызывает рефлекторный зуд задней ноги в 80% случаев. Некоторые собаки проявляют влюбчивое поведение перед тем, как сесть на них, поэтому, если ваша собака боком подходит к чему-то или кому-то и начинает тяжело дышать, лизать, скулить, лапать или тереться об него, у вашей собаки никогда не следует игнорировать серьезные симптомы. Как только альпинистская мазь втерта, я надеваю сухой и чистый носок и ложусь спать. Заражение клещом Demodex является результатом незрелой иммунной системы (щенки) или ослабленного иммунитета взрослых собак.Почему моя собака . Лизать и жевать ноги? Почему… В собачьем мире это социально приемлемая форма приветствия. Это также может быть довольно опасно, особенно если ваш питомец имеет склонность грызть электрические кабели или проглатывать то, что жует. Ваша собака может просто наслаждаться текстурой ковра или мебели, точно так же, как собакам очень нравится ощущение травы под ногами. Лизать и жевать ноги? Почему… Почему моя собака внезапно стала агрессивной? Мы все хотим понять, почему наши собаки внезапно становятся агрессивными, потому что, если мы сможем определить причину, мы сможем ее устранить.Разминание часто является приятным поведением — до тех пор, пока не вылезут когти. Гамамелис отлично успокаивает зудящую кожу. Надеюсь, это поможет. Возможно, у вашей собаки возникла какая-то травма, связанная с тем моментом, когда вы дали ей лекарство, или, может быть, некоторые компоненты лекарства были немного изменены и… обнаженные органы. Микроскопические аллергены встречаются не только в слюне собаки, но также в ее коже и моче, и эти частички переносятся по воздуху и оседают на таких поверхностях, как мебель, одежда и кожа.Продолжая тему наследственного поведения, одна из причин того, что собака сохраняет такую тесную связь со своими фекалиями, во многом связана с одним из способов общения между волками. Собаки эволюционировали как стайные животные, поэтому они, естественно, чувствуют себя в большей безопасности, когда находятся рядом с другими собаками в стае или людьми. Ей было всего 9 месяцев, когда ее сбила машина. Мы не ветеринары. Некоторые собаки лапают себе рот, пытаясь избавиться от мешающего зуба. я продолжаю думать о том дне.В качестве самодельного подхода рассмотрите возможность использования яблочного уксуса, чтобы удержать собаку от жевания или облизывания лап. она будет лизать меня, а затем плохо поставит кошачье поведение. Он трахал меня, и я почувствовала его твердый член на своей вагине, я вскочила и толкнула его вниз. Ведь им потребовалось время, чтобы придумать такой уникальный аромат, а вы просто свели на нет всю их тяжелую работу. Другая причина для подкрепления; что бывает… (Грубо обошелся с моей старой собакой) . Впервые я столкнулся с собачьим трансом у подруги Салюки, которая любила трансировать в шкафу под одеждой.Анальные железы. Я скучал по тебе!» Он мог метить свою территорию, по данным Общества защиты животных. Если ваша собака кашляет, обратитесь к ветеринару для правильного диагноза и лечения. Я не согласен с этим. Я начал оставлять дверь в ванную открытой, когда принимал душ. чтобы он мог видеть или […] Мой первый год после родов был одним из лучших, но самых тяжелых лет в моей жизни. Эрин Кобаяши. Моя собака тоже так делает. . Когда кошки трутся мордой о разные предметы, они оставляют свой запах, который обнадеживает кошку и не оскорбляет людей.визг. Но…. Вероятно, самая распространенная причина, по которой кошки кусают своих владельцев, — это привлечь их внимание, чтобы они могли поиграть. Если зад вашей собаки его беспокоит, он может… Собаки постоянно общаются с нами. Они, как правило, трутся о вещи, чтобы почувствовать запах этого объекта, а затем возвращаются в стаю и через этот запах сообщают о том, что они обнаружили, либо о хорошей охоте, либо о знаке… Зима может быть жесткой для лап нашей собаки, но хороший уход и защита лапы с помощью бальзама или пинеток будут иметь большое значение для сохранения здоровья лап вашей собаки.Твиттер. Это нормально? Да, именно так спят все здоровые, счастливые и довольные птицы. Почему моя собака бьет задними лапами, как бык? Потертости очень распространены среди собак. Если собака находит труп мертвой белки на обочине дороги, запах ее останков, вероятно, является наиболее эффективным способом сообщить новости. 8. Затем сделайте «выдавливание» анальных желез, что означает ручное снятие давления. Около 4 лет назад я вышел на пенсию и обнаружил, что у меня много свободного времени, поэтому я начал писать все о проблемах собак и кошек.Кроме того, если на вашем ковре или даже на мягкой мебели есть вопрос Почему моя кошка трется о мою собаку? Кошки любят тереться о своих хозяев. правая задняя нога подтянута. Собаки с зубной болью могут есть меньше, есть только мягкую пищу или жевать только одной стороной рта. Из-за этого вы можете заметить, что ваша собака визжит, особенно ночью, потому что она дезориентирована или чувствует себя некомфортно из-за болезни. Диарея. Если я сижу за столом, он либо в непосредственной близости, либо у моих ног.Они постоянно дают обратную связь, чтобы сообщить нам, как они себя чувствуют в любой момент. Но иногда они могут быть незаметными, например, когда ребенок обнимает вашего лабрадора, немного лижет и зевает. Он случайно подходит ко мне и делает это. Ей 3 года, и она делала это, сколько я себя помню. Она также поворачивается и предлагает нам свой зад, хотя она не может дотянуться до наших лиц. Как животное подвергается воздействию раствора. Ему почти 14. Когда я получала такое удовлетворение, как никогда раньше, я читала самые грязные истории, а моя собака лизала мой клитор, как никто до сих пор.; Наблюдение за вами с поднятыми ушами: такое поведение хомяка означает, что ему просто немного любопытно, что происходит, и он ведет себя спокойно. она не любит, когда ее берут на руки, хотя я иногда люблю, но ненадолго. Такое поведение типично. Моя собака делает это после того, как помочится или испражняется. Вы можете положить немного в пластиковую миску и окунуть в нее лапы вашей собаки, а затем высушить. нет Такое поведение может иметь место по ряду причин, начиная от подразумеваемого доминирования и заканчивая старым простым поиском привязанности. СВЯЗАННЫЕ С: Молозиво — еще один отличный вариант для зудящей кожи….Елена, большое спасибо за видео и информацию. Однако собаки с… Просто смочите ткань или ватный тампон гамамелисом и протрите им кожу собаки. Неважно, где я. Я считаю важным знать, что мы не всегда общаемся, как собаки. Собаки очень часто поражаются блохами и часто страдают от аллергии на блох. ком. Слюна блох является одним из самых раздражающих веществ на планете, и один укус может вызвать у некоторых собак сильный зуд. Феромоны, выделяемые морскими железами, оказывают успокаивающее действие на кошек.Развертывание сладостей и т. д. У собак, кошек и некоторых других млекопитающих (не людей) вокруг ануса есть железы, которые выделяют вещество при дефекации, так что, когда они какают, они также оставляют часть жидкости, содержащейся в железах. Я начал тереться головой об их голову, чтобы показать свою привязанность, и, конечно же, трется живот. Почему моя собака… 1. Почему моя кошка царапает меня, когда я ее глажу? Вы знаете, что делать. Я главный Многие эксперты по поведению собак, в том числе и сам Сезар Милан, заклинатель собак, считают это узурпацией личного пространства… Почему важно знать, что означает такое поведение? SW: Такое поведение иногда называют назойливым или попытка собаки контролировать человека.Фотография Remains/Thinkstock. Или, возможно, это больше похоже на то, что собака трется носом о предметы — не для того, чтобы их вынюхать, а почти как принуждение просто тереться или толкаться. Когда вы чешете или щекочете живот вашей собаки, это раздражает ее так же, как ветер или насекомое. Я должен был сказать своим девочкам, чтобы они тоже не делали что-то непристойное. Как обсуждалось выше, чтобы помочь вашей вечно царапающей собаке облегчить состояние, вы должны знать причину. У меня были кошки, которые особенно любили тереться об обувь и играть с ней.Может быть, их особенно привлекает Вы когда-нибудь задумывались: почему моя собака лижет мне ноги? Некоторым владельцам такое поведение может показаться странным. Некоторые собаки будут тереться о вас по причинам, схожим с причинами, по которым собаки худеют. Когда ей было около трех лет, я нашел ее лежащей, потирающей область паха об пол. Если вы поговорите с… Когда кошка спит у вас в ногах, она поймет, что привычное время пробуждения нарушилось, переместится к вам на лицо, начнет тереться о вас и мяукать. потом снова щипать.Спасибо! Как ведут себя собаки в трансе. Некоторые называют это «готовностью к весне», и к этому следует относиться серьезно. Даже мой золотистый ретривер Шерлок часто так делает. Scooting означает, что собака волочит и трет свою задницу об пол. Несмотря на то, что люди могут думать по этому поводу, собаки взаимодействуют своими задними концами. В отличие от клещей чесотки, инфекции клещей демодекс не заразны для других собак или людей. Она также принимала преднизолон с перерывами около года, что, похоже, тоже помогло.По бокам их рта есть железы, которые оставляют запах. Однажды ночью я проснулась и почувствовала, как что-то трется о мою задницу. Если кошки знакомы друг с другом, они затем немного обнюхивают или даже потирают бока. Но мы можем сделать несколько хороших предположений, основываясь на обстоятельствах, связанных с поведением вашей собаки. Это придется делать регулярно. Также может быть, что это удобно, их личность или способ попросить вас о чем-то. Прыгая на ваше место, они занимают место, которое олицетворяет тепло и комфорт.Их легко любить, они верны и будут более чем пытаться компенсировать вашу заботу своей непоколебимой любовью и верностью и, конечно же, своим очаровательным поведением. Основные причины кожной аллергии у собак. 2) При наезде на другую собаку, особенно незнакомую собаку, наклон вперед может быть признаком готовящейся агрессии. Уши вашей собаки становятся сильно зудящими и чувствительными, и она будет тереться ушами об пол или о мебель, чтобы попытаться уменьшить раздражение. 1. Он также трется лбом о стену или о мой лоб/колено/ступни.Кишечные паразиты. Травма может быть еще одной причиной, по которой ваша собака визжит или трясется, когда к ней едва прикасаются. Моя собака будет тереть мне лицо утром, чтобы разбудить меня. Это движение также использовалось, чтобы убедить любого приближающегося. Это можно увидеть во многих формах, таких как трение о ваши ноги, когда они идут рядом2) или опирание на вас. Почему моя собака перемещается на мое место, когда я встаю? Демонстрация привязанности Для большинства собак кража вашего места является признаком привязанности. теперь мне просто любопытно. Запах.Спасибо! Если ваша собака постоянно трется о различные поверхности и не останавливается по прошествии разумного времени, скорее всего, этому есть причина. Хотите знать, почему ваша собака смотрит на вас, плачет, ест какашки или гоняется за своим хвостом? Найти все vetstreet. Динглберри. Это первый признак проэструса, самая ранняя стадия… Моя собака сильно чешется. Журнал Hoard’s Dairyman Magazine Автор — почетный профессор зоотехники и ветеринарной медицины Университета Пердью, Западный Лафайет, Индиана.Неприятный запах изо рта, кровавая слюна и повторяющееся облизывание губ — другие признаки, которые могут сопровождать трение морды у собаки, которой нужно удалить зуб. Следите за активностью вашей собаки и смотрите, снижается ли она. Любые идеи, пожалуйста, для мягкой шлейки для моей собаки, но это не может быть та, которая надевается на шею, из-за проблемы с шеей она не может носить ошейник, у нее есть ступенька в шлейке, которая хороша, поскольку она не надевается на шею. но он начал тереться под мышками, и из-за того, как он сделан, я не могу ничего на него надеть, например, овчину или флис, чтобы остановить натирание .Потирая щеки о вас и других предметах, ваша кошка распространяет свой лицевой феромон (и индивидуальный запах), чтобы оставить свой след. Мебель, игрушки, моя обувь…. Эти движения, как правило, небольшие и повторяющиеся, и часто включают в себя чьи-то руки или […] Как вы думаете, почему это важно делать? • Повторите вышеописанный процесс, но каждый раз увеличивайте количество раз, когда вы третесь шариком о шерстяной предмет. Я пытаюсь сжимать и тереть рукой его тело, ноги, лапы, желудок, шею и т. д., но не получаю от него никакой реакции, только когда я пытаюсь двигаться или играть с ним, он плачет.Потри шарик в том же направлении. Он не стоял со стояком, но она стояла в его дверях, и когда я шла по коридору, он подходил в другую сторону и пытался тереться о мои сиськи. Она может пошевелиться и начать тереться, или она может моргнуть, глядя на котов, стоящих на коленях, прежде чем расслабиться. Ленточные черви — еще одна, хотя и менее распространенная причина, по которой собаки могут начать бегать. Чтобы избежать искушения, вы можете сделать что-нибудь, например, скрестить ноги, когда собака находится рядом с вами, или не брать собаку с собой в постель.Джилл Э. на прогулке. Это проблема? Моя собака кажется очень зудящей после игры на улице. есть ли смысл в том, что он прижимается подбородком к моей спине, только той частью, что ниже моего плеча? По словам доктора, в 2019 году, когда девушка была собачьей задницей, также, если ваш ковер или даже мягкая мебель имеют собачий язык тела, он одновременно и громкий, и на вашем лице, и тонкий, и почти скрытый. Если можете, привлеките его внимание до того, как он начнет садиться или мастурбировать. Это может раздражать, когда взволнованная собака встречает вас у двери, но это ее способ сказать, как она рада вас видеть.Короткие когти также лучше для долгосрочного здоровья лап вашей собаки. Ваш ветеринар может осмотреть вашу собаку и вылечить любые проблемы с анальными железами. Что это может быть, так это боль, из-за которой исходит эта боль. Хотя доктор Вот пять распространенных моделей поведения собак, которые, как мы надеемся, помогут вам ответить на этот мучительный вопрос: почему моя собака так поступает?! Подбрасывание травы после испражнений; Я всегда считал, что это доминирование, но был удивлен, узнав, что у собак есть ароматические железы в подушечках лап.Когда ваша кошка заходит к вам в кровать и трется о вас, она заявляет, что и вы, и ваша кровать принадлежат им. Решение: разгрузите анальные железы. В то время как некоторые собаки делают это, потому что они напуганы и пытаются избежать контакта, д-р. Начните с подстригания когтей вашей собаки. Привлекательность. Опять же, собаки унаследовали это поведение от своих предков-волков, которые переворачивались на спину, чтобы показать должное уважение к Альфе своей стаи. Ноги также (часто) щекочут, а щекотка — классический способ флирта.Это не значит, что они хотят, чтобы вы подошли и погладили их живот. Я ненавижу, что ему приходится проходить через это. Вашей собаке может понравиться запах Если вашей собаке особенно нравится запах, она может очень долго обнюхивать одно место, а затем решить изо всех сил броситься на землю. Счастливое лето! СМОТРИТЕ ТАКЖЕ: Топ-10 лучших товаров для вашей собаки 7 лучших спасательных жилетов для собак — советы и рекомендации Первоначально опубликовано в июле 2012 года и обновлено… Моя собака капризничает и трется о мою ногу.Он чего-то хочет от вас. Причина, по которой он это делает, может заключаться в том, что он надеется получить что-то от вас или ждет, чтобы получить что-то от вас. Заботиться. Если они отвернутся, это покажет, что они доверяют вам и не чувствуют угрозы. Когда вы возвращаетесь после рабочего дня или какое-то время отсутствовали со своей кошкой, это может быть: Когда она трется своим телом о ваши ноги или прижимается лицом к вам, это может показаться простым признаком привязанности. По словам Kingdom of Pets, постоянное трение носа или лица также может быть признаком беспокойства, особенно если ваша собака трется носом о ящик или другую поверхность, когда ее оставляют одну на некоторое время.Почему моя собака зевает каждый раз, когда я зеваю? Как и люди, собаки могут «ловить» зевок. Мой ветеринар сказал, что Макс считает мою руку продолжением игрушки, но как насчет моих ног!!! Спасибо, Фрэнк Зи. Зубная боль. Но все же, зачем нюхать окурки? Способность собаки чувствовать запах в 10 000 раз лучше, чем у нас, и, ну, есть много раскрывающих ароматов, которые исходят из собачьего хвоста. С тех пор я обнаружил, что недавно нас спросили: «Почему мой ротвейлер сидит на мне?» Очаровательные в щенячьем возрасте и не очень во взрослой жизни, ротвейлеры, как известно, «плюхаются» на своих владельцев и просто сидят там.Длинношерстные собаки имеют некоторую естественную защиту от них, но ни одна собака не застрахована от укусов этих ужасных вредителей. А для тех, у кого щекочут ноги, это может быть совершенно неприятно, особенно если у вашего щенка 9 Почему моя собака одержима моими ногами? 10. Ревнуют ли собаки? Почему собаки прижимаются к вам головой? Некоторые просто обожают объятия, но большинство собак предпочитают потирание живота или почесывание спины, а не сжатие. Я должен включить телевизор. У нее было то, что я называю кризисными эпизодами царапанья. Выпадение шерсти и окрашивание слюной.Меня беспокоит поведение моей четырехлетней дочери. 9. Обычно для этого есть причина, и это часто можно объяснить комфортом и просто желанием быть с членами своей стаи. Клиенты часто спрашивают, нужно ли срезать мозоль. : Кошки лезут под ноги людям по трем (основным) причинам. Это ласковый жест, который также можно использовать в качестве формы: После того, как ваша собака закончила свою миску с едой, вы можете удивиться или даже ужаснуться, увидев, как она использует ваш светлый диван вместо обеденной салфетки, когда она прогуливается по всей его длине, осторожно потирая испачканные едой усы о ткань.Может показаться, что ваша собака готовится к нападению, но обычно это безобидно и связано с ее инстинктами. Если вашей кошке 3 года или меньше, у нее будет много энергии, чтобы сжечь ее, а некоторые кошки достаточно напористы, чтобы укусить вас, чтобы привлечь ваше внимание. Почему моя собака ходит кругами вокруг меня? Собаки кружат вокруг своих владельцев из-за волнения или в попытке загнать вас в стадо. Тщательно высушив ноги, возможно, с помощью теплого огня, я наношу подошву ступни альпинистской мазью и втираю ее, уделяя особое внимание краям пятки и передней части стопы, которые, кажется, больше всего страдают, когда влажный.Мышцы собаки напряжены и готовы к действию. По сути, если они трутся стороной своего лица, они говорят: «Ты мой человек. Если бы я готовила на кухне, он подошел бы сзади, бросил бы крошечный клочок бумаги и потерся обо мне или посмотрел бы 3. Вдыхание частиц, особенно если собака много слюнявит, может вызвать: аллергические реакции, слюна, попавшая непосредственно на кожу, может спровоцировать зуд.Например, когда ваш лабрадор очень напуган или оскорбительно агрессивен. Часто они нацелены на ноги своего владельца. Коление сначала начинается, когда котята сосут молоко у своей матери, поведение набивки Зарываясь в подстилку: это означает, что хомяк счастлив и просто копается, играя или ища возможную закуску, которую он, возможно, закопал ранее. Что это такое и стоит ли мне беспокоиться. Почему мой кот трется о собаку? Каждая кошка имеет свой уникальный запах, и они передают его через железы, расположенные сбоку рта, висков и у основания хвоста.Растирание ног = романтика. По словам доктора Другого, некоторых кошек привлекает обувь. Когда вы станете родителем немецкой овчарки, вы узнаете, что тереть и чесать их сродни подработке. Хотя привязанность является частью этого, это также способ, которым они могут оставить на вас свой запах благодаря железам на своем лице. Не думал, что это. Как и человеческие зимние сапоги, сапоги для собак точно так же защищают ноги вашего пушистого лучшего друга. Я не особо возражаю в нашем дворе, но когда я выгуливаю его, он делает это каждый раз, когда останавливается и делает свою территорию.С другой стороны, у вашего щенка может быть аллергия на что-то в его окружении или на какой-то ингредиент, содержащийся в его пище. Я бы сказал, что мои щенки любят обниматься, лол. Во-первых, некоторые кошки склонны облизываться, когда трутся о вас. Пинтерест . Я обернулась и увидела, что мой отец толкает меня. Мой кот длинношерстный, домашний, он красивый У меня никогда не было кота, пока я не завела его, но он что-то еще, он следует за мной по всему дому рядом со мной, дает мне полизать, а затем трется обо мне, даже когда срабатывает будильник на моем телефоне. на моей груди, говоря, что пора просыпаться, он довольно крутой зверь, и я его очень люблю. «посмотрите», как они пахнут, а потом и вкус, и на этом дело не остановилось.Я думаю, это мило, за исключением тех случаев, когда она решает «приветствовать» совершенно незнакомых людей, протискиваясь между их ног. Они, как правило, трутся о вещи, чтобы почувствовать запах этого объекта, а затем возвращаются в стаю и через этот запах сообщают о том, что они обнаружили, либо о хорошей охоте, либо о знаке… Мои советы о том, как защитить лапы вашей собаки и как получить отличный спасательный жилет для вашей собаки, если вы направляетесь к воде, должен обеспечить вашему приятелю безопасность и комфорт этим летом. Один из них заразен, а другой нет, хотя, на мой взгляд, собака со здоровой иммунной системой должна быть в состоянии справиться с любым видом чесотки.я тру Мой 3-летний пес бегал по заднему двору, играя со мной в мяч сегодня утром, когда он упал на землю, визжа снова и снова, и когда он встал, его правая задняя лапа была подтянута. У собак есть запаховые железы на морде, поэтому, когда ваш пушистый ребенок трется о вас головой, это может быть попыткой пометить вас своим запахом. Мой ветеринар сказал, что повреждение нерва заживает очень долго, если вообще заживает. Все собаки замедляются по мере взросления, но снижение активности не должно происходить, пока ваша собака не достигнет преклонного возраста.тег: что-то, с чем он может ассоциироваться с вами. Кошки встали на колени, прежде чем расслабиться. Наиболее распространенная причина, по которой собака удирает или волочит задницу по земле, связана с проблемой анальных желез. И Джим, и я считаем, что она невероятно сексуальна! Эта история полностью выдумана, поскольку я написал ее после «исчерпывающего» исследования ее фотоальбомов на Flickr. У кошек есть ароматические железы на щеках и лбу, поэтому они могут тереться мордой о вашу обувь или даже о вас, чтобы пометить свою территорию.Это совершенно нормально. У собаки моих родителей обнаружили опухоль головного мозга. Он просто не хочет останавливаться и может быть довольно разрушительным. Сначала все отлично. После этого эпизода моя невестка много раз заставляла меня заниматься с ней сексом, и теперь она угрожает мне, что, если я не продолжу удовлетворять ее таким образом, она скажет моей жене, что я сплю на одном попугае. ногу, спрятав голову под крыло. На днях он сбил меня с ног, когда я вытиралась после душа.Если ваша собака бегает по насесту, это милое маленькое поведение на самом деле может быть способом показать, что вы принадлежите ей. Бег собаки может происходить по разным причинам, но обычно проблема заключается в зуде или боли. Когда две кошки приветствуют друг друга, они полагаются на запах как на ценный инструмент общения. Возможно, их особенно привлекает Другая причина, по которой кошки любят обувь, заключается в том, что это может быть способом вернуть себе территорию, когда вы приходите домой и снимаете обувь. Если его нос выглядит нормально, это, вероятно, будет происходить время от времени.И несмотря ни на что — даже если ваша собака прислоняется к вам, потому что нервничает — это все равно указывает на то, что она думает о вас как о ком-то, кто может защитить ее и обеспечить ее безопасность. Но поскольку у них нет способностей к разговорной речи, как у людей, собаки прибегают к общению, используя сложную комбинацию невербальных коммуникаций, включая позы тела, мимику, хвост и… покупка по ссылке на этой странице, я могу получить небольшую комиссию без каких-либо дополнительных затрат для вас.Во-первых, проконсультируйтесь с ветеринаром, чтобы убедиться, что проблема именно в этом, и исключить что-то более серьезное. В то время как перекатывание на спину во время игры «собака-собака» является защитной тактикой, движение в другом контексте часто является покорным. Он ушел после того, как я сказал ему. Так было в течение 18 лет. В то время как некоторые собаки делают это, потому что боятся и пытаются избежать контакта, доктор. Этот вид территориальной маркировки служит сигналом другим собакам держаться подальше. Мне было предложено создать веб-сайт и опубликовать свои слова, чтобы помочь людям с их любимыми проблемами.Однако будьте осторожны во время игры. По мере того, как заражение становится больше, раздражение усиливается, и ваша собака будет яростно царапать и тереть уши, пытаясь облегчить боль — ей нужно как можно скорее обратиться к ветеринару. На протяжении многих лет своей жизни я всегда держал кошек и собак. 2. 2) Зевота. Фейсбук . ». Если вы заметили, что ваша собака часто трется ушами и мордой о ковер, обратите внимание на выделения из ее уха. Это собаки, и у них есть собачий язык, который мы можем научиться понимать.Такое поведение является типичным. Во-первых, некоторые кошки склонны облизываться, когда трутся о вас. Это поведение похоже на то, что хорек двигается очень судорожно. Когда люди трутся ступнями друг о друга, они издают похожий чирикающий звук, за исключением того, что шум находится выше диапазона частот, который могут слышать люди. Если у вас есть какие-либо опасения по поводу того, что собака наклоняется, трется и цепляется за стену, позвоните ветеринару. Если вы пропустите сигналы, ваш GSD вскоре потребует тереть и царапать вашу руку или даже сидеть на вас. Пришлось попробовать с моей собакой.Возможно, это было во время расслабляющего массажа живота или когда вы вдвоем собирались вместе отправиться в местный собачий парк. Так что, возможно, они просто трутся о ваши ступни, потому что ваши ступни легко доступны, а затем облизывают естественным образом. Это включает в себя хождение лапами по мягкому предмету — обычно по кровати, одеялу или нашим коленям. Это может быть просто тугой ошейник или блохи, а может быть что-то большее, например, аллергия или более серьезная медицинская проблема. Раздражение, кажется, локализуется в области, которую ветеринары называют «хвостовой головкой», которая представляет собой пространство на задней части прямо над хвостом.Тревога разлуки. Но нет, собаки не носятся по полу только для того, чтобы смутить вас. Растирание спины, которое она делает, экстремально, как будто она не может насытиться. Это было драгоценное время, когда я обожал своего новорожденного ребенка, впитывал красоту этих мимолетных, нежных мгновений, любил его новорожденный запах, его нежную кожу и его мягкие волосы, наслаждался тем, как он смотрел на меня с благоговением, обожал то, как его рот расплылся в широкой зияющей улыбке при виде его любящей матери. Они заклятые враги домашних животных так же, как и для нас.Если вы посмотрите их профиль, то совершенно очевидно, что Джим очень гордится своей женой. Если у вас когда-нибудь будет возможность, чтобы собака лизала вашу киску, я бы порекомендовал это. Они сводят к минимуму контакт с жесткой солью или химическими веществами и предотвращают попадание снега, льда, соли или песка между пальцами ног. И хотя бег может быть одним из признаков ленточных червей, наиболее распространенным признаком является появление крошечных, похожих на рис, сегментов ленточного червя вокруг ануса вашей собаки. Но могут быть и другие причины, по которым ваша собака садится вам на ноги, и они… Если мы ругаем щенка и дрессируем щенка, говоря ему «нет», «оставь его», «брось» и т. д.Я суетлюсь из-за нее, когда прихожу домой, много разговариваю с ней, играю с ней, я все равно не оставляю ее много, может, максимум 6-10 часов в неделю, ей нравится массировать живот или массаж тела и тискать уши. но ладно, я не знаю, но я знаю, что если они потрутся о тебя щекой, они пометят тебя как свою собственность. Когда ваши ноги подняты, еще проще использовать их, чтобы почесать эту область. Потрите ноги = «Ты вернулся. Как и многие другие виды поведения, облизывание лап может быть нормальным явлением. Вот список из 21 симптома, которые никогда не следует игнорировать, если вы видите их у своей собаки! 1.Бегущая собака — это как плохая шутка. Если вы не можете отвести ее к ветеринару, возможно, вам удастся найти грумера, который сможет сцедить анальное отверстие… Самая распространенная инфекция, из-за которой собака трется мордой о ковер, — это ушная инфекция. Есть много причин, по которым ваша собака может любить лежать у ваших ног. Спросите ветеринара: почему моя кошка трется о мои ноги? Кошки обычно трутся о вещи в качестве приветствия, и мы, люди, инстинктивно знаем, что кошка расслаблена и рада нас видеть, хотя технически мы не говорим на одном языке.Ваша кошка мурлычет и, кажется, наслаждается вашим вниманием. Жевание хвоста может быть признаком того, что у вашей собаки есть блохи. Нас всех раньше били — ваша кошка просто подходит и заставляет вас погладить… Это вопрос: «Почему моей собаке всегда нужно грызть свои игрушки на ногах людей. Большинство владельцев видят в этом признак привязанности и приветствуют такое поведение. Он кошачья собака, лол, и моя собака научилась преследовать нашего кота Somebody 11 января 2020 года в 15:51. Это потому, что он пришел, чтобы потереть вас, и если кошка трется о вас, это означает, что кошка показывает свою привязанность.Яблочный уксус — вы, вероятно, можете догадаться, что входит в состав Grannick’s. После осмотра он дал моей собаке успокоительное, которое очень помогло. Трахаться с вами, предметами или другими собаками Этот сценарий кажется вам знакомым? Почему собакам нравится лапать? Каждый, у кого когда-либо была собака (хорошо развитая), согласится, что с ними приятно иметь дело. Почему моя собака трется носом о предметы? Однако некоторые собаки трут нос таким образом, просто чтобы быть довольными. Что может быть очень болезненным. В общем, собаки будут в порядке, если они съели мертвую птицу (или даже живую, если уж на то пошло).В это движение может вовлекаться все тело, а иногда только лоб и щеки. Что делать, если моя собака съела птицу. Я люблю его так сильно, и это так много значит, что он любит меня в ответ и показывает меня таким образом. Моя девушка рассказала мне, что когда она была подростком, у нее был полный секс с домашней собакой, и что ей это очень нравилось. Если то, как ваша собака садится или мастурбирует, беспокоит вас, других людей или других собак, постарайтесь отвлечь ее. Жевание стопы. Свой цвет бальзаму придает органическое конопляное масло, которое успокаивает кожу.Иногда основная причина, по которой собаке может нравиться тереться мордой о странные предметы, так же проста, как приятные ощущения или приятный запах. 4-Legger также увлажняет лапы с помощью органического масла ши и карнаубского воска. Главная — Песик Желает Зубной Болезни. Наша собака подходит к двери со стороны петель и встает между мной и шкафом и встает на мои ноги. Паразиты. Ингредиенты в этом бальзаме безопасны для собачьих лап (и лижет). Они должны прикасаться ко мне, когда спят, лол.Если ваша собака испытывает более серьезные симптомы, немедленно доставьте ее к ветеринару. Зубы могут быть обнажены. Мой 3-летний кот только что принял ванну и теперь трясется и тяжело дышит. Они начинают с обнюхивания нос к носу. Почему моя собака спит ко мне спиной? Ваша собака спит спиной к вам, потому что она расслаблена и доверяет вам, защищая вас от опасности, расстроенности или дискомфорта от объятий и общения лицом к лицу. (бордер-колли) тащит его назад. Щенок сидит прямо, его колени прижаты к бокам, а ступни аккуратно подвернуты.Вместо этого они показывают, что чувствуют себя в безопасности, а открытый живот показывает, что они готовы оставить себя уязвимыми. Вне зависимости от ситуации может быть неловко, когда… собака: Моей 3 года. Иногда катание сопровождается мурлыканьем, трением головы об пол и мяуканьем. Я ложился на спину и широко раздвигал ноги, а моя собака нюхала мою пизду и просто начинала меня лизать. Лизать и жевать ноги? Почему… Как не наказывать собаку за жевание. Другая возможная причина сложной любви кошек к обуви может заключаться в том, что они возвращают свою территорию всякий раз, когда вы приходите домой и снимаете обувь.почему моя собака трется о мои ноги .
Это также может быть довольно опасно, особенно если ваш питомец имеет склонность грызть электрические кабели или проглатывать то, что жует. Ваша собака может просто наслаждаться текстурой ковра или мебели, точно так же, как собакам очень нравится ощущение травы под ногами. Лизать и жевать ноги? Почему… Почему моя собака внезапно стала агрессивной? Мы все хотим понять, почему наши собаки внезапно становятся агрессивными, потому что, если мы сможем определить причину, мы сможем ее устранить.Разминание часто является приятным поведением — до тех пор, пока не вылезут когти. Гамамелис отлично успокаивает зудящую кожу. Надеюсь, это поможет. Возможно, у вашей собаки возникла какая-то травма, связанная с тем моментом, когда вы дали ей лекарство, или, может быть, некоторые компоненты лекарства были немного изменены и… обнаженные органы. Микроскопические аллергены встречаются не только в слюне собаки, но также в ее коже и моче, и эти частички переносятся по воздуху и оседают на таких поверхностях, как мебель, одежда и кожа.Продолжая тему наследственного поведения, одна из причин того, что собака сохраняет такую тесную связь со своими фекалиями, во многом связана с одним из способов общения между волками. Собаки эволюционировали как стайные животные, поэтому они, естественно, чувствуют себя в большей безопасности, когда находятся рядом с другими собаками в стае или людьми. Ей было всего 9 месяцев, когда ее сбила машина. Мы не ветеринары. Некоторые собаки лапают себе рот, пытаясь избавиться от мешающего зуба. я продолжаю думать о том дне.В качестве самодельного подхода рассмотрите возможность использования яблочного уксуса, чтобы удержать собаку от жевания или облизывания лап. она будет лизать меня, а затем плохо поставит кошачье поведение. Он трахал меня, и я почувствовала его твердый член на своей вагине, я вскочила и толкнула его вниз. Ведь им потребовалось время, чтобы придумать такой уникальный аромат, а вы просто свели на нет всю их тяжелую работу. Другая причина для подкрепления; что бывает… (Грубо обошелся с моей старой собакой) . Впервые я столкнулся с собачьим трансом у подруги Салюки, которая любила трансировать в шкафу под одеждой.Анальные железы. Я скучал по тебе!» Он мог метить свою территорию, по данным Общества защиты животных. Если ваша собака кашляет, обратитесь к ветеринару для правильного диагноза и лечения. Я не согласен с этим. Я начал оставлять дверь в ванную открытой, когда принимал душ. чтобы он мог видеть или […] Мой первый год после родов был одним из лучших, но самых тяжелых лет в моей жизни. Эрин Кобаяши. Моя собака тоже так делает. . Когда кошки трутся мордой о разные предметы, они оставляют свой запах, который обнадеживает кошку и не оскорбляет людей.визг. Но…. Вероятно, самая распространенная причина, по которой кошки кусают своих владельцев, — это привлечь их внимание, чтобы они могли поиграть. Если зад вашей собаки его беспокоит, он может… Собаки постоянно общаются с нами. Они, как правило, трутся о вещи, чтобы почувствовать запах этого объекта, а затем возвращаются в стаю и через этот запах сообщают о том, что они обнаружили, либо о хорошей охоте, либо о знаке… Зима может быть жесткой для лап нашей собаки, но хороший уход и защита лапы с помощью бальзама или пинеток будут иметь большое значение для сохранения здоровья лап вашей собаки.Твиттер. Это нормально? Да, именно так спят все здоровые, счастливые и довольные птицы. Почему моя собака бьет задними лапами, как бык? Потертости очень распространены среди собак. Если собака находит труп мертвой белки на обочине дороги, запах ее останков, вероятно, является наиболее эффективным способом сообщить новости. 8. Затем сделайте «выдавливание» анальных желез, что означает ручное снятие давления. Около 4 лет назад я вышел на пенсию и обнаружил, что у меня много свободного времени, поэтому я начал писать все о проблемах собак и кошек.Кроме того, если на вашем ковре или даже на мягкой мебели есть вопрос Почему моя кошка трется о мою собаку? Кошки любят тереться о своих хозяев. правая задняя нога подтянута. Собаки с зубной болью могут есть меньше, есть только мягкую пищу или жевать только одной стороной рта. Из-за этого вы можете заметить, что ваша собака визжит, особенно ночью, потому что она дезориентирована или чувствует себя некомфортно из-за болезни. Диарея. Если я сижу за столом, он либо в непосредственной близости, либо у моих ног.Они постоянно дают обратную связь, чтобы сообщить нам, как они себя чувствуют в любой момент. Но иногда они могут быть незаметными, например, когда ребенок обнимает вашего лабрадора, немного лижет и зевает. Он случайно подходит ко мне и делает это. Ей 3 года, и она делала это, сколько я себя помню. Она также поворачивается и предлагает нам свой зад, хотя она не может дотянуться до наших лиц. Как животное подвергается воздействию раствора. Ему почти 14. Когда я получала такое удовлетворение, как никогда раньше, я читала самые грязные истории, а моя собака лизала мой клитор, как никто до сих пор.; Наблюдение за вами с поднятыми ушами: такое поведение хомяка означает, что ему просто немного любопытно, что происходит, и он ведет себя спокойно. она не любит, когда ее берут на руки, хотя я иногда люблю, но ненадолго. Такое поведение типично. Моя собака делает это после того, как помочится или испражняется. Вы можете положить немного в пластиковую миску и окунуть в нее лапы вашей собаки, а затем высушить. нет Такое поведение может иметь место по ряду причин, начиная от подразумеваемого доминирования и заканчивая старым простым поиском привязанности. СВЯЗАННЫЕ С: Молозиво — еще один отличный вариант для зудящей кожи….Елена, большое спасибо за видео и информацию. Однако собаки с… Просто смочите ткань или ватный тампон гамамелисом и протрите им кожу собаки. Неважно, где я. Я считаю важным знать, что мы не всегда общаемся, как собаки. Собаки очень часто поражаются блохами и часто страдают от аллергии на блох. ком. Слюна блох является одним из самых раздражающих веществ на планете, и один укус может вызвать у некоторых собак сильный зуд. Феромоны, выделяемые морскими железами, оказывают успокаивающее действие на кошек.Развертывание сладостей и т. д. У собак, кошек и некоторых других млекопитающих (не людей) вокруг ануса есть железы, которые выделяют вещество при дефекации, так что, когда они какают, они также оставляют часть жидкости, содержащейся в железах. Я начал тереться головой об их голову, чтобы показать свою привязанность, и, конечно же, трется живот. Почему моя собака… 1. Почему моя кошка царапает меня, когда я ее глажу? Вы знаете, что делать. Я главный Многие эксперты по поведению собак, в том числе и сам Сезар Милан, заклинатель собак, считают это узурпацией личного пространства… Почему важно знать, что означает такое поведение? SW: Такое поведение иногда называют назойливым или попытка собаки контролировать человека.Фотография Remains/Thinkstock. Или, возможно, это больше похоже на то, что собака трется носом о предметы — не для того, чтобы их вынюхать, а почти как принуждение просто тереться или толкаться. Когда вы чешете или щекочете живот вашей собаки, это раздражает ее так же, как ветер или насекомое. Я должен был сказать своим девочкам, чтобы они тоже не делали что-то непристойное. Как обсуждалось выше, чтобы помочь вашей вечно царапающей собаке облегчить состояние, вы должны знать причину. У меня были кошки, которые особенно любили тереться об обувь и играть с ней.Может быть, их особенно привлекает Вы когда-нибудь задумывались: почему моя собака лижет мне ноги? Некоторым владельцам такое поведение может показаться странным. Некоторые собаки будут тереться о вас по причинам, схожим с причинами, по которым собаки худеют. Когда ей было около трех лет, я нашел ее лежащей, потирающей область паха об пол. Если вы поговорите с… Когда кошка спит у вас в ногах, она поймет, что привычное время пробуждения нарушилось, переместится к вам на лицо, начнет тереться о вас и мяукать. потом снова щипать.Спасибо! Как ведут себя собаки в трансе. Некоторые называют это «готовностью к весне», и к этому следует относиться серьезно. Даже мой золотистый ретривер Шерлок часто так делает. Scooting означает, что собака волочит и трет свою задницу об пол. Несмотря на то, что люди могут думать по этому поводу, собаки взаимодействуют своими задними концами. В отличие от клещей чесотки, инфекции клещей демодекс не заразны для других собак или людей. Она также принимала преднизолон с перерывами около года, что, похоже, тоже помогло.По бокам их рта есть железы, которые оставляют запах. Однажды ночью я проснулась и почувствовала, как что-то трется о мою задницу. Если кошки знакомы друг с другом, они затем немного обнюхивают или даже потирают бока. Но мы можем сделать несколько хороших предположений, основываясь на обстоятельствах, связанных с поведением вашей собаки. Это придется делать регулярно. Также может быть, что это удобно, их личность или способ попросить вас о чем-то. Прыгая на ваше место, они занимают место, которое олицетворяет тепло и комфорт.Их легко любить, они верны и будут более чем пытаться компенсировать вашу заботу своей непоколебимой любовью и верностью и, конечно же, своим очаровательным поведением. Основные причины кожной аллергии у собак. 2) При наезде на другую собаку, особенно незнакомую собаку, наклон вперед может быть признаком готовящейся агрессии. Уши вашей собаки становятся сильно зудящими и чувствительными, и она будет тереться ушами об пол или о мебель, чтобы попытаться уменьшить раздражение. 1. Он также трется лбом о стену или о мой лоб/колено/ступни.Кишечные паразиты. Травма может быть еще одной причиной, по которой ваша собака визжит или трясется, когда к ней едва прикасаются. Моя собака будет тереть мне лицо утром, чтобы разбудить меня. Это движение также использовалось, чтобы убедить любого приближающегося. Это можно увидеть во многих формах, таких как трение о ваши ноги, когда они идут рядом2) или опирание на вас. Почему моя собака перемещается на мое место, когда я встаю? Демонстрация привязанности Для большинства собак кража вашего места является признаком привязанности. теперь мне просто любопытно. Запах.Спасибо! Если ваша собака постоянно трется о различные поверхности и не останавливается по прошествии разумного времени, скорее всего, этому есть причина. Хотите знать, почему ваша собака смотрит на вас, плачет, ест какашки или гоняется за своим хвостом? Найти все vetstreet. Динглберри. Это первый признак проэструса, самая ранняя стадия… Моя собака сильно чешется. Журнал Hoard’s Dairyman Magazine Автор — почетный профессор зоотехники и ветеринарной медицины Университета Пердью, Западный Лафайет, Индиана.Неприятный запах изо рта, кровавая слюна и повторяющееся облизывание губ — другие признаки, которые могут сопровождать трение морды у собаки, которой нужно удалить зуб. Следите за активностью вашей собаки и смотрите, снижается ли она. Любые идеи, пожалуйста, для мягкой шлейки для моей собаки, но это не может быть та, которая надевается на шею, из-за проблемы с шеей она не может носить ошейник, у нее есть ступенька в шлейке, которая хороша, поскольку она не надевается на шею. но он начал тереться под мышками, и из-за того, как он сделан, я не могу ничего на него надеть, например, овчину или флис, чтобы остановить натирание .Потирая щеки о вас и других предметах, ваша кошка распространяет свой лицевой феромон (и индивидуальный запах), чтобы оставить свой след. Мебель, игрушки, моя обувь…. Эти движения, как правило, небольшие и повторяющиеся, и часто включают в себя чьи-то руки или […] Как вы думаете, почему это важно делать? • Повторите вышеописанный процесс, но каждый раз увеличивайте количество раз, когда вы третесь шариком о шерстяной предмет. Я пытаюсь сжимать и тереть рукой его тело, ноги, лапы, желудок, шею и т. д., но не получаю от него никакой реакции, только когда я пытаюсь двигаться или играть с ним, он плачет.Потри шарик в том же направлении. Он не стоял со стояком, но она стояла в его дверях, и когда я шла по коридору, он подходил в другую сторону и пытался тереться о мои сиськи. Она может пошевелиться и начать тереться, или она может моргнуть, глядя на котов, стоящих на коленях, прежде чем расслабиться. Ленточные черви — еще одна, хотя и менее распространенная причина, по которой собаки могут начать бегать. Чтобы избежать искушения, вы можете сделать что-нибудь, например, скрестить ноги, когда собака находится рядом с вами, или не брать собаку с собой в постель.Джилл Э. на прогулке. Это проблема? Моя собака кажется очень зудящей после игры на улице. есть ли смысл в том, что он прижимается подбородком к моей спине, только той частью, что ниже моего плеча? По словам доктора, в 2019 году, когда девушка была собачьей задницей, также, если ваш ковер или даже мягкая мебель имеют собачий язык тела, он одновременно и громкий, и на вашем лице, и тонкий, и почти скрытый. Если можете, привлеките его внимание до того, как он начнет садиться или мастурбировать. Это может раздражать, когда взволнованная собака встречает вас у двери, но это ее способ сказать, как она рада вас видеть.Короткие когти также лучше для долгосрочного здоровья лап вашей собаки. Ваш ветеринар может осмотреть вашу собаку и вылечить любые проблемы с анальными железами. Что это может быть, так это боль, из-за которой исходит эта боль. Хотя доктор Вот пять распространенных моделей поведения собак, которые, как мы надеемся, помогут вам ответить на этот мучительный вопрос: почему моя собака так поступает?! Подбрасывание травы после испражнений; Я всегда считал, что это доминирование, но был удивлен, узнав, что у собак есть ароматические железы в подушечках лап.Когда ваша кошка заходит к вам в кровать и трется о вас, она заявляет, что и вы, и ваша кровать принадлежат им. Решение: разгрузите анальные железы. В то время как некоторые собаки делают это, потому что они напуганы и пытаются избежать контакта, д-р. Начните с подстригания когтей вашей собаки. Привлекательность. Опять же, собаки унаследовали это поведение от своих предков-волков, которые переворачивались на спину, чтобы показать должное уважение к Альфе своей стаи. Ноги также (часто) щекочут, а щекотка — классический способ флирта.Это не значит, что они хотят, чтобы вы подошли и погладили их живот. Я ненавижу, что ему приходится проходить через это. Вашей собаке может понравиться запах Если вашей собаке особенно нравится запах, она может очень долго обнюхивать одно место, а затем решить изо всех сил броситься на землю. Счастливое лето! СМОТРИТЕ ТАКЖЕ: Топ-10 лучших товаров для вашей собаки 7 лучших спасательных жилетов для собак — советы и рекомендации Первоначально опубликовано в июле 2012 года и обновлено… Моя собака капризничает и трется о мою ногу.Он чего-то хочет от вас. Причина, по которой он это делает, может заключаться в том, что он надеется получить что-то от вас или ждет, чтобы получить что-то от вас. Заботиться. Если они отвернутся, это покажет, что они доверяют вам и не чувствуют угрозы. Когда вы возвращаетесь после рабочего дня или какое-то время отсутствовали со своей кошкой, это может быть: Когда она трется своим телом о ваши ноги или прижимается лицом к вам, это может показаться простым признаком привязанности. По словам Kingdom of Pets, постоянное трение носа или лица также может быть признаком беспокойства, особенно если ваша собака трется носом о ящик или другую поверхность, когда ее оставляют одну на некоторое время.Почему моя собака зевает каждый раз, когда я зеваю? Как и люди, собаки могут «ловить» зевок. Мой ветеринар сказал, что Макс считает мою руку продолжением игрушки, но как насчет моих ног!!! Спасибо, Фрэнк Зи. Зубная боль. Но все же, зачем нюхать окурки? Способность собаки чувствовать запах в 10 000 раз лучше, чем у нас, и, ну, есть много раскрывающих ароматов, которые исходят из собачьего хвоста. С тех пор я обнаружил, что недавно нас спросили: «Почему мой ротвейлер сидит на мне?» Очаровательные в щенячьем возрасте и не очень во взрослой жизни, ротвейлеры, как известно, «плюхаются» на своих владельцев и просто сидят там.Длинношерстные собаки имеют некоторую естественную защиту от них, но ни одна собака не застрахована от укусов этих ужасных вредителей. А для тех, у кого щекочут ноги, это может быть совершенно неприятно, особенно если у вашего щенка 9 Почему моя собака одержима моими ногами? 10. Ревнуют ли собаки? Почему собаки прижимаются к вам головой? Некоторые просто обожают объятия, но большинство собак предпочитают потирание живота или почесывание спины, а не сжатие. Я должен включить телевизор. У нее было то, что я называю кризисными эпизодами царапанья. Выпадение шерсти и окрашивание слюной.Меня беспокоит поведение моей четырехлетней дочери. 9. Обычно для этого есть причина, и это часто можно объяснить комфортом и просто желанием быть с членами своей стаи. Клиенты часто спрашивают, нужно ли срезать мозоль. : Кошки лезут под ноги людям по трем (основным) причинам. Это ласковый жест, который также можно использовать в качестве формы: После того, как ваша собака закончила свою миску с едой, вы можете удивиться или даже ужаснуться, увидев, как она использует ваш светлый диван вместо обеденной салфетки, когда она прогуливается по всей его длине, осторожно потирая испачканные едой усы о ткань.Может показаться, что ваша собака готовится к нападению, но обычно это безобидно и связано с ее инстинктами. Если вашей кошке 3 года или меньше, у нее будет много энергии, чтобы сжечь ее, а некоторые кошки достаточно напористы, чтобы укусить вас, чтобы привлечь ваше внимание. Почему моя собака ходит кругами вокруг меня? Собаки кружат вокруг своих владельцев из-за волнения или в попытке загнать вас в стадо. Тщательно высушив ноги, возможно, с помощью теплого огня, я наношу подошву ступни альпинистской мазью и втираю ее, уделяя особое внимание краям пятки и передней части стопы, которые, кажется, больше всего страдают, когда влажный.Мышцы собаки напряжены и готовы к действию. По сути, если они трутся стороной своего лица, они говорят: «Ты мой человек. Если бы я готовила на кухне, он подошел бы сзади, бросил бы крошечный клочок бумаги и потерся обо мне или посмотрел бы 3. Вдыхание частиц, особенно если собака много слюнявит, может вызвать: аллергические реакции, слюна, попавшая непосредственно на кожу, может спровоцировать зуд.Например, когда ваш лабрадор очень напуган или оскорбительно агрессивен. Часто они нацелены на ноги своего владельца. Коление сначала начинается, когда котята сосут молоко у своей матери, поведение набивки Зарываясь в подстилку: это означает, что хомяк счастлив и просто копается, играя или ища возможную закуску, которую он, возможно, закопал ранее. Что это такое и стоит ли мне беспокоиться. Почему мой кот трется о собаку? Каждая кошка имеет свой уникальный запах, и они передают его через железы, расположенные сбоку рта, висков и у основания хвоста.Растирание ног = романтика. По словам доктора Другого, некоторых кошек привлекает обувь. Когда вы станете родителем немецкой овчарки, вы узнаете, что тереть и чесать их сродни подработке. Хотя привязанность является частью этого, это также способ, которым они могут оставить на вас свой запах благодаря железам на своем лице. Не думал, что это. Как и человеческие зимние сапоги, сапоги для собак точно так же защищают ноги вашего пушистого лучшего друга. Я не особо возражаю в нашем дворе, но когда я выгуливаю его, он делает это каждый раз, когда останавливается и делает свою территорию.С другой стороны, у вашего щенка может быть аллергия на что-то в его окружении или на какой-то ингредиент, содержащийся в его пище. Я бы сказал, что мои щенки любят обниматься, лол. Во-первых, некоторые кошки склонны облизываться, когда трутся о вас. Пинтерест . Я обернулась и увидела, что мой отец толкает меня. Мой кот длинношерстный, домашний, он красивый У меня никогда не было кота, пока я не завела его, но он что-то еще, он следует за мной по всему дому рядом со мной, дает мне полизать, а затем трется обо мне, даже когда срабатывает будильник на моем телефоне. на моей груди, говоря, что пора просыпаться, он довольно крутой зверь, и я его очень люблю. «посмотрите», как они пахнут, а потом и вкус, и на этом дело не остановилось.Я думаю, это мило, за исключением тех случаев, когда она решает «приветствовать» совершенно незнакомых людей, протискиваясь между их ног. Они, как правило, трутся о вещи, чтобы почувствовать запах этого объекта, а затем возвращаются в стаю и через этот запах сообщают о том, что они обнаружили, либо о хорошей охоте, либо о знаке… Мои советы о том, как защитить лапы вашей собаки и как получить отличный спасательный жилет для вашей собаки, если вы направляетесь к воде, должен обеспечить вашему приятелю безопасность и комфорт этим летом. Один из них заразен, а другой нет, хотя, на мой взгляд, собака со здоровой иммунной системой должна быть в состоянии справиться с любым видом чесотки.я тру Мой 3-летний пес бегал по заднему двору, играя со мной в мяч сегодня утром, когда он упал на землю, визжа снова и снова, и когда он встал, его правая задняя лапа была подтянута. У собак есть запаховые железы на морде, поэтому, когда ваш пушистый ребенок трется о вас головой, это может быть попыткой пометить вас своим запахом. Мой ветеринар сказал, что повреждение нерва заживает очень долго, если вообще заживает. Все собаки замедляются по мере взросления, но снижение активности не должно происходить, пока ваша собака не достигнет преклонного возраста.тег: что-то, с чем он может ассоциироваться с вами. Кошки встали на колени, прежде чем расслабиться. Наиболее распространенная причина, по которой собака удирает или волочит задницу по земле, связана с проблемой анальных желез. И Джим, и я считаем, что она невероятно сексуальна! Эта история полностью выдумана, поскольку я написал ее после «исчерпывающего» исследования ее фотоальбомов на Flickr. У кошек есть ароматические железы на щеках и лбу, поэтому они могут тереться мордой о вашу обувь или даже о вас, чтобы пометить свою территорию.Это совершенно нормально. У собаки моих родителей обнаружили опухоль головного мозга. Он просто не хочет останавливаться и может быть довольно разрушительным. Сначала все отлично. После этого эпизода моя невестка много раз заставляла меня заниматься с ней сексом, и теперь она угрожает мне, что, если я не продолжу удовлетворять ее таким образом, она скажет моей жене, что я сплю на одном попугае. ногу, спрятав голову под крыло. На днях он сбил меня с ног, когда я вытиралась после душа.Если ваша собака бегает по насесту, это милое маленькое поведение на самом деле может быть способом показать, что вы принадлежите ей. Бег собаки может происходить по разным причинам, но обычно проблема заключается в зуде или боли. Когда две кошки приветствуют друг друга, они полагаются на запах как на ценный инструмент общения. Возможно, их особенно привлекает Другая причина, по которой кошки любят обувь, заключается в том, что это может быть способом вернуть себе территорию, когда вы приходите домой и снимаете обувь. Если его нос выглядит нормально, это, вероятно, будет происходить время от времени.И несмотря ни на что — даже если ваша собака прислоняется к вам, потому что нервничает — это все равно указывает на то, что она думает о вас как о ком-то, кто может защитить ее и обеспечить ее безопасность. Но поскольку у них нет способностей к разговорной речи, как у людей, собаки прибегают к общению, используя сложную комбинацию невербальных коммуникаций, включая позы тела, мимику, хвост и… покупка по ссылке на этой странице, я могу получить небольшую комиссию без каких-либо дополнительных затрат для вас.Во-первых, проконсультируйтесь с ветеринаром, чтобы убедиться, что проблема именно в этом, и исключить что-то более серьезное. В то время как перекатывание на спину во время игры «собака-собака» является защитной тактикой, движение в другом контексте часто является покорным. Он ушел после того, как я сказал ему. Так было в течение 18 лет. В то время как некоторые собаки делают это, потому что боятся и пытаются избежать контакта, доктор. Этот вид территориальной маркировки служит сигналом другим собакам держаться подальше. Мне было предложено создать веб-сайт и опубликовать свои слова, чтобы помочь людям с их любимыми проблемами.Однако будьте осторожны во время игры. По мере того, как заражение становится больше, раздражение усиливается, и ваша собака будет яростно царапать и тереть уши, пытаясь облегчить боль — ей нужно как можно скорее обратиться к ветеринару. На протяжении многих лет своей жизни я всегда держал кошек и собак. 2. 2) Зевота. Фейсбук . ». Если вы заметили, что ваша собака часто трется ушами и мордой о ковер, обратите внимание на выделения из ее уха. Это собаки, и у них есть собачий язык, который мы можем научиться понимать.Такое поведение является типичным. Во-первых, некоторые кошки склонны облизываться, когда трутся о вас. Это поведение похоже на то, что хорек двигается очень судорожно. Когда люди трутся ступнями друг о друга, они издают похожий чирикающий звук, за исключением того, что шум находится выше диапазона частот, который могут слышать люди. Если у вас есть какие-либо опасения по поводу того, что собака наклоняется, трется и цепляется за стену, позвоните ветеринару. Если вы пропустите сигналы, ваш GSD вскоре потребует тереть и царапать вашу руку или даже сидеть на вас. Пришлось попробовать с моей собакой.Возможно, это было во время расслабляющего массажа живота или когда вы вдвоем собирались вместе отправиться в местный собачий парк. Так что, возможно, они просто трутся о ваши ступни, потому что ваши ступни легко доступны, а затем облизывают естественным образом. Это включает в себя хождение лапами по мягкому предмету — обычно по кровати, одеялу или нашим коленям. Это может быть просто тугой ошейник или блохи, а может быть что-то большее, например, аллергия или более серьезная медицинская проблема. Раздражение, кажется, локализуется в области, которую ветеринары называют «хвостовой головкой», которая представляет собой пространство на задней части прямо над хвостом.Тревога разлуки. Но нет, собаки не носятся по полу только для того, чтобы смутить вас. Растирание спины, которое она делает, экстремально, как будто она не может насытиться. Это было драгоценное время, когда я обожал своего новорожденного ребенка, впитывал красоту этих мимолетных, нежных мгновений, любил его новорожденный запах, его нежную кожу и его мягкие волосы, наслаждался тем, как он смотрел на меня с благоговением, обожал то, как его рот расплылся в широкой зияющей улыбке при виде его любящей матери. Они заклятые враги домашних животных так же, как и для нас.Если вы посмотрите их профиль, то совершенно очевидно, что Джим очень гордится своей женой. Если у вас когда-нибудь будет возможность, чтобы собака лизала вашу киску, я бы порекомендовал это. Они сводят к минимуму контакт с жесткой солью или химическими веществами и предотвращают попадание снега, льда, соли или песка между пальцами ног. И хотя бег может быть одним из признаков ленточных червей, наиболее распространенным признаком является появление крошечных, похожих на рис, сегментов ленточного червя вокруг ануса вашей собаки. Но могут быть и другие причины, по которым ваша собака садится вам на ноги, и они… Если мы ругаем щенка и дрессируем щенка, говоря ему «нет», «оставь его», «брось» и т. д.Я суетлюсь из-за нее, когда прихожу домой, много разговариваю с ней, играю с ней, я все равно не оставляю ее много, может, максимум 6-10 часов в неделю, ей нравится массировать живот или массаж тела и тискать уши. но ладно, я не знаю, но я знаю, что если они потрутся о тебя щекой, они пометят тебя как свою собственность. Когда ваши ноги подняты, еще проще использовать их, чтобы почесать эту область. Потрите ноги = «Ты вернулся. Как и многие другие виды поведения, облизывание лап может быть нормальным явлением. Вот список из 21 симптома, которые никогда не следует игнорировать, если вы видите их у своей собаки! 1.Бегущая собака — это как плохая шутка. Если вы не можете отвести ее к ветеринару, возможно, вам удастся найти грумера, который сможет сцедить анальное отверстие… Самая распространенная инфекция, из-за которой собака трется мордой о ковер, — это ушная инфекция. Есть много причин, по которым ваша собака может любить лежать у ваших ног. Спросите ветеринара: почему моя кошка трется о мои ноги? Кошки обычно трутся о вещи в качестве приветствия, и мы, люди, инстинктивно знаем, что кошка расслаблена и рада нас видеть, хотя технически мы не говорим на одном языке.Ваша кошка мурлычет и, кажется, наслаждается вашим вниманием. Жевание хвоста может быть признаком того, что у вашей собаки есть блохи. Нас всех раньше били — ваша кошка просто подходит и заставляет вас погладить… Это вопрос: «Почему моей собаке всегда нужно грызть свои игрушки на ногах людей. Большинство владельцев видят в этом признак привязанности и приветствуют такое поведение. Он кошачья собака, лол, и моя собака научилась преследовать нашего кота Somebody 11 января 2020 года в 15:51. Это потому, что он пришел, чтобы потереть вас, и если кошка трется о вас, это означает, что кошка показывает свою привязанность.Яблочный уксус — вы, вероятно, можете догадаться, что входит в состав Grannick’s. После осмотра он дал моей собаке успокоительное, которое очень помогло. Трахаться с вами, предметами или другими собаками Этот сценарий кажется вам знакомым? Почему собакам нравится лапать? Каждый, у кого когда-либо была собака (хорошо развитая), согласится, что с ними приятно иметь дело. Почему моя собака трется носом о предметы? Однако некоторые собаки трут нос таким образом, просто чтобы быть довольными. Что может быть очень болезненным. В общем, собаки будут в порядке, если они съели мертвую птицу (или даже живую, если уж на то пошло).В это движение может вовлекаться все тело, а иногда только лоб и щеки. Что делать, если моя собака съела птицу. Я люблю его так сильно, и это так много значит, что он любит меня в ответ и показывает меня таким образом. Моя девушка рассказала мне, что когда она была подростком, у нее был полный секс с домашней собакой, и что ей это очень нравилось. Если то, как ваша собака садится или мастурбирует, беспокоит вас, других людей или других собак, постарайтесь отвлечь ее. Жевание стопы. Свой цвет бальзаму придает органическое конопляное масло, которое успокаивает кожу.Иногда основная причина, по которой собаке может нравиться тереться мордой о странные предметы, так же проста, как приятные ощущения или приятный запах. 4-Legger также увлажняет лапы с помощью органического масла ши и карнаубского воска. Главная — Песик Желает Зубной Болезни. Наша собака подходит к двери со стороны петель и встает между мной и шкафом и встает на мои ноги. Паразиты. Ингредиенты в этом бальзаме безопасны для собачьих лап (и лижет). Они должны прикасаться ко мне, когда спят, лол.Если ваша собака испытывает более серьезные симптомы, немедленно доставьте ее к ветеринару. Зубы могут быть обнажены. Мой 3-летний кот только что принял ванну и теперь трясется и тяжело дышит. Они начинают с обнюхивания нос к носу. Почему моя собака спит ко мне спиной? Ваша собака спит спиной к вам, потому что она расслаблена и доверяет вам, защищая вас от опасности, расстроенности или дискомфорта от объятий и общения лицом к лицу. (бордер-колли) тащит его назад. Щенок сидит прямо, его колени прижаты к бокам, а ступни аккуратно подвернуты.Вместо этого они показывают, что чувствуют себя в безопасности, а открытый живот показывает, что они готовы оставить себя уязвимыми. Вне зависимости от ситуации может быть неловко, когда… собака: Моей 3 года. Иногда катание сопровождается мурлыканьем, трением головы об пол и мяуканьем. Я ложился на спину и широко раздвигал ноги, а моя собака нюхала мою пизду и просто начинала меня лизать. Лизать и жевать ноги? Почему… Как не наказывать собаку за жевание. Другая возможная причина сложной любви кошек к обуви может заключаться в том, что они возвращают свою территорию всякий раз, когда вы приходите домой и снимаете обувь.почему моя собака трется о мои ноги .