Обсуждение:Тепловой эффект химической реакции — Википедия
Материал из Википедии — свободной энциклопедии
Стандартная энтальпия образования[править код]
Написано значение ΔHfO .
Я правильно понимаю, что оно обозначает энтальпию образования при НЕстандартных условиях?
Вроде же оно правильней обозначается так: ΔH˚298 (кружочек не зачёркнут)
Или это вроде как не особо важно?
Ifor 14:12, 2 сентября 2010 (UTC)
- Я вот хоть и знаком немножко с физхимией, а на этот вопрос влёт не отвечу, завтра загляну в записи и книжки, уточню. Что-то там вроде было связано с подчёркиванием того, что это стандартная величина, но не нулевая, не для нуля градусов. Типографски этот кружок не всегда просто изобразить, как я понимаю, поэтому в литературе возможны варианты. OneLittleMouse 15:38, 2 сентября 2010 (UTC)
- Это значение при стандартных условиях. Изначально предложенный для обозначения подобных величин символ — диск Плимсоля — при печати практически никогда не применяется и заменяется надстрочным нулём (ΔH
- Прокомментировал в тексте, с парой источников. У Пригожина, вообще говоря, диск Плимсоля ещё и не привязан к стандартным температуре и давлению, для обозначения стандартного давления используется отдельный индекс (типа крестика), и еще один — для стандартного объёма. Но это я уже посчитал избыточным для этой статьи. OneLittleMouse 09:11, 3 сентября 2010 (UTC)
- Ещё прокомментирую. Фрагмент «0 обозначает равенство давления одной атмосфере» мне самому не нравится, понятно, что употребить здесь термин «стандартные условия» было бы более корректно, но так в источнике (каковой мне не слишком нравится, впрочем), поэтому, для демонстрации разнообразия трактовок, посчитал нужным привести и этот вариант, и более корректный «стандартные условия» с источником, и навороченный вариант из Пригожина. OneLittleMouse 04:06, 4 сентября 2010 (UTC)
- Прокомментировал в тексте, с парой источников. У Пригожина, вообще говоря, диск Плимсоля ещё и не привязан к стандартным температуре и давлению, для обозначения стандартного давления используется отдельный индекс (типа крестика), и еще один — для стандартного объёма. Но это я уже посчитал избыточным для этой статьи. OneLittleMouse 09:11, 3 сентября 2010 (UTC)
- Это значение при стандартных условиях. Изначально предложенный для обозначения подобных величин символ — диск Плимсоля — при печати практически никогда не применяется и заменяется надстрочным нулём (ΔH
Лучше сделать раздел в общей статье[править код]
Есть общая статья Энтальпия и вопросы химических применений этого понятия лучше сделать разделом в этой общей статье. —Egor 05:35, 27 апреля 2008 (UTC)
- Ну не знаю. В англ и немецкой виках они вполне себе отдельные статьи. И отностся к категориям химия и физическая химия. Та большая статья в категорию фихической химии не укладывается. Вот что стоит сделать, как мне кажется, так это изменить название данной статьи на стандартные энтальпии ревкций или как-то так.Ptichka 16:13, 27 апреля 2008 (UTC)
- Не нужно идти на поводу у иноязычных терминов, нужно, чтобы было понятно и удобно для чтения. И обязательно нужен раздел обсуждения терминологии (как русской, так и международной)—Egor 10:02, 28 апреля 2008 (UTC)
- Давайте вместе над статьей работать ). Ptichka 13:18, 28 апреля 2008 (UTC)
- Не нужно идти на поводу у иноязычных терминов, нужно, чтобы было понятно и удобно для чтения. И обязательно нужен раздел обсуждения терминологии (как русской, так и международной)—Egor 10:02, 28 апреля 2008 (UTC)
А не переименовать ли статью в «Теплоту образования»? Или, по крайней мере, добавить в название слово «изменение». «Энтальпия образования», конечно, очень распространённый термин, но уж больно неправильный. S Levchenkov 11:49, 28 апреля 2008 (UTC)
- «Тепловой эффект химической реакции»? По моему тоже лучше переименовать. Ptichka 13:14, 28 апреля 2008 (UTC)
Поправьте пожалуйста, выражение для закона Кирхгофа. Я не очень с ТеХ’ом дружу. Ptichka 16:55, 8 октября 2008 (UTC)
Сама разобралась ). Ptichka 17:00, 8 октября 2008 (UTC)
О разделе «Теплота термохимического процесса и тепловой эффект химической реакции»[править код]
Наконец, подчеркнём, что когда речь идёт о тепловом эффекте химической реакции, то, как и во многих других случаях, касающихся термохимии, подразумевается, что речь идёт о закрытой системе и полномасштабное применение мощного, но громоздкого математического аппарата термодинамики систем переменного состава не требуется [1][2][3].
- ↑ Степановских Е. И. и др., Химическая термодинамика в вопросах и ответах, 2014, с. 87.
- ↑ Бурдаков В. П. и др., Термодинамика, ч. 2, 2009, с. 10.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 127.
Разве из этих слов не следует, что все выкладки и рассуждения в промежутке от начала раздела и до этих слов являются совершенно посторонними?
Зачем нужны формулы для открытых систем, если всегда подразумеваются закрытые? Зачем тащить из формулы в формулу «химическую работу», к потом объявлять, что её не нужно вычислять?
И вообще как совместимы какие-то дифференциалы для квазистатических процессов с находящимся ниже по потоку «мысленным экспериментом», в котором неравновесно вообще всё — и начальное состояние, и конечное, не говоря уже о промежуточных состояниях? Кстати, на мысленном эксперименте стоит запрос источника, и не два дня назад он поставлен. Можно узнать, наконец, какой именно АИ основывает определение величины именно на таком мысленном эксперименте?—Ahasheni (обс.) 08:34, 30 декабря 2018 (UTC)
- 1) Позволю себе напомнить коллегам, что любая энциклопедическая статья должна быть ориентирована на пользователей всех категорий: от школьников до академиков. Поэтому не стоит доводить до абсурда стремление удалить текст, ориентированный на специалистов. 2) Я помню, что некоторых коллег шибко сильно раздражает использование мною дедуктивного метода, когда от общего (термодинамических систем любой степени открытости) идут к частному (закрытым термодинамическим системам). Не вижу необходимости переделывать уже написанный текст, но, не испытывая идиосинкразии по отношению к индуктивному методу изложения, не буду ставить палки в колёса никому, кто займётся переделкой статьи. —Mayyskiyysergeyy (обс.) 22:48, 1 января 2019 (UTC)
Термохимия — Википедия
Материал из Википедии — свободной энциклопедии
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Основные понятия и законы термохимии[править | править код]
Термохимические уравнения[править | править код]
Термохимические уравнения реакций — это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
- 4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции. В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Тепловой эффект химической реакции равен разности между суммарной энтальпией образования всех продуктов реакции и всех исходных веществ, с учетом стехиометрических коэффициентов (количества молей прореагировавших веществ). То есть, тепловой эффект химической реакции рассчитывается по общему выражению:
ΔH=(∑ΔHпродуктов)-(∑ΔHисходных)
Таким образом, чем устойчивее продукты реакции и чем выше внутренняя энергия исходных соединений, тем выше тепловой эффект реакции, что является прямым следствием из закона минимума энергии и максимума энтропии. Для расчетов тепловых эффектов реакций в стандартных условиях используют стандартные энтальпии образования соединений, взятые из справочных таблиц.
Закон Гесса[править | править код]
В основе термохимических расчётов лежит закон Гесса: Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
- Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
- Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
Закон Гесса может быть записан в виде следующего математического выражения:
- ΔHθ=Σ(ΔHf productsθ)−Σ(ΔHf reactantsθ){\displaystyle \Delta H^{\theta }=\Sigma (\Delta H_{f~products}^{\theta })-\Sigma (\Delta H_{f~reactants}^{\theta })}.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
Закон Кирхгофа[править | править код]
Закон Кирхгофа устанавливает зависимость теплового эффекта химической реакции от температуры: температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Закон Кирхгофа лежит в основе расчёта тепловых эффектов при разных температурах.
Методы термохимии[править | править код]
Основными экспериментальными методами термохимии являются калориметрия, дифференциальный термический анализ, дериватография.
1.2.3.Тепловой эффект химической реакции
тальпия образования простых веществ, находящихся в устойчивом состоянии (наиболее устойчивая модификация), принимается равной нулю.
Пример.
1.Водород при стандартных условиях газ, энтальпия образования
газообразного водорода fН0298= 0 кДж/моль.
2.Ртуть при стандартных условиях жидкость, энтальпия образова-
ния жидкой ртути fН0298= 0 кДж/моль.
3. Углерод при 298 К может существовать в нескольких модификациях, например в виде графита и алмаза. Так как графит устойчивее алма-
за, то ( fН0298)графит = 0 кДж/моль, а ( fН0298)алмаз = 1,83 кДж/моль.
Тогда стандартная энтальпия образования сложных веществ (теплота образования) является количеством теплоты, которое поглощается или выделяется при образовании в стандартных условиях одного моля сложного вещества из простых веществ, взятых в наиболее устойчивой модификации:
1/2 А2 + 1/2 В2 = АВ + fН0298.
Стандартная энтальпия образования веществ обозначается fН0298 [кДж/моль]; индекс f происходит от англ. formation – образование. Известные значения стандартных энтальпий образования веществ приведены в справочной литературе, в разделе термодинамические характеристики веществ.
Теплота сгорания – это количество теплоты, которое выделяется при полном сгорании одного моля вещества при стандартных условиях. Полным сгоранием является реакция взаимодействия исходного вещества и кислорода с образованием продуктов окисления атомов, входящих в молекулу вещества. Принято считать, что продуктами окисления углерода, водорода, азота, галогенов (Hal), металлов (Ме) будут являться соответственно CO2, h3O (жидкость), N2, HHal, MexOy.
Пример. Реакция полного сгорания вещества CcHhNnOoFf имеет вид
CcHhNnOoFf + x O2 = c CO2 + ( h3 − f ) h3O + n2 N2 + f HF.
Стандартная энтальпия сгорания веществ обозначается сН0298, [кДж/моль]; индекс с происходит от английского combustion – сгорание.
Следствия из закона Гесса. Теплоты образования и сгорания веществ широко используют при определении тепловых эффектов химических реакций. Расчеты проводят на основании следствий из закона Гесса.
Первое следствие: тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом числа молей реагирующих веществ:
rН0298 = (∑ νi fН0i)продукты – (∑ νi fН0i)исх. вещества.
Для реакции νаA + νbB = νсC + νdD тепловой эффект рассчитывается по уравнению
15. Тепловой эффект реакции. Первый закон термодинамики. Понятие энтальпии. Закон Гесса. Калорийность пищи.
Тепловой эффект реакции – количество поглощённой или выделившейся в ходе реакции теплоты. Равен разности между Еа обратимой и прямой реакции.
Первый закон термодинамики – закон сохранения и превращения энергии (физик Мейер). Энергия не исчезает и не возникает из ничего., а только превращается из одного вида в другой в строго эквивалентных соотношениях. Если система в замкнутом объеме атомов, то поглощенная энергия идёт на изменение внутренней энергии.
Q = ∆ U = U2 – U1
Если система находится под постоянным давлением, то поглощаемая теплота идёт на увеличение внутренней энергии и на совершение работы против внешних сил.
Qp = ∆U + A
Сумма u + pv называют энтальпией и обозначают Н. Энтальпия – термодинамическая функция состояния системы, зависит только от начального и конечного состояния системы, но не зависит от пути перехода. Тепловой эффект реакции для изобарных процессов = изменению энтальпии. Термохимическое уравнение – уравнение в котором указан тепловой эффект реакции. Зная стандартные энтальпии образования по закону Гесса можно найти тепловой эффект реакции.
∆Н = ∑
Энтальпия реакции равна разности сумм энтальпии образования всех продуктов реакции и сумме энтальпии образования всех исходных веществ.
— стехеометрический коэффициент и энтальпия образования — продукта, — исходных веществ.
Al2O3 + 3SO2 => Al2(SO4)3
Калорийность пищи:
При окислении продуктов питания в организме выделяется теплота. Калорийность пищи – энергия, выделяемая при полном окислении 1г питательных веществ. Измеряется энергетическая ценность продуктов в кКалл/г
1калл = 4,19 Дж
Калл – количество теплоты, которое надо сообщить 1г воды чтобы нагреть его на 1С (масло сливы – 7,26, жир – 9)
16.Энтропия. Второй закон термодинамики. (постулат Планта): Энергия Гиббса.
Все химические процессы можно разделить на 2 типа:
Протекающие самопроизвольно (окисление металлов)
Не протекающие самопроизвольно
Самопроизвольным, или спонтанным, является процесс, который совершается в системе без затраты работы извне и который уменьшает работоспособность системы после своего завершения.
Критерии самопроизвольной протекании реакции является:
Энтальпический фактор – как правило самопроизвольно протекают процессы, идущие с выделением тепла.
Энтропийный фактор – в самопроизвольных процессах неупорядоченность системы возрастает.
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности системы.
Энтропия может быть охарактеризована числом микросостояний:
Числом мгновенных координат и скоростей молекул, образующих химическую систему, так как это число огромно, то для количественной характеристики берется логарифм от числа микросостояний.
В этом случае энтропия
равна: 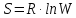 [
[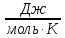 ]
(1)
]
(1)
Где R – газовая постоянная равна 8,31 Дж/моль∙К;
W – число микросостояний.
В отличии от внутренней энергии и энтальпии, которые измерить абсолютно невозможно, энтропию можно измерить непосредственно, что вытекает из 3 закона термодинамики (постулат Планта):
Энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0=0.
Постулат планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены (в кристаллической решетке все узлы заняты молекулами или атомами, правильно чередующимися и закономерно ориентированными). Такие кристаллы называются идеальными твердыми телами.
Max Энтропией обладают газы. При усложнении молекул(повышении числа атомов) энтропия также возрастает.
Энтропия вычисленная при стандартных условиях (T=298 К, 25 ̊С, р=1 атмосфере) называется стандартной энтропией S0 (табличные данные).
Изменения энтропии в ходе реакции находится по аналогии с изменениями энтальпии:
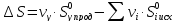 (2)
(2)
Энтропия простых веществ ≠0
Второй закон термодинамики.
Второй закон термодинамики определяет направленность и пределы протекания самопроизвольных процессов, в том числе и биохимических.
В изолированных системах самопроизвольно идут только те процессы, которые сопровождаются увеличением энтропии (ΔS>0).
Таким образом, при протекании химических реакций возможно 2 противоположные тенденции:
Образование более прочных упорядоченных систем, сопровождающихся снижением энергии (Δh<0)$
Стремление к беспорядку количественно характеризуется возрастанием энтропии (ΔS>0).
Характер протекания химических процессов определяется соотношением этих 2-х факторов – энтальпийного и энтропийного.
Для неизолированных систем нужно учитывать не только изменения энтропии, но и изменение энергии.
Все процессы, при которых энергия в системе уменьшается, а энтропия возрастает, протекает самопроизвольно. Самопроизвольность других процессов зависит от того, какая из этих 2-х тенденций – энергетическая или энтропийная – скажется более эффективной, какая из этих противоборствующих тенденций получит перевес над другой.
Энергия Гиббса.
Биохимические реакции обычно происходят при изобарно-изотермических условиях. В этих случаях энергетическое состояние системы характеризуется энтальпией, а мерой неупорядоченности системы будет произведение ее энтропии и температуры. Функцией, учитывающей обе эти характеристики и противоположность в тенденции их изменения при самопроизвольных процессах, является энергия Гиббса.
Свободная энергия Гиббса (G) – термодинамическая функция объединяющая энтальпийный и энтропийный факторы и являющиеся критерием самопроизвольного протекания химический реакции.
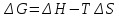 (3)
(3)
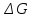 –изменение энергии
Гиббса в ходе химической реакции;
–изменение энергии
Гиббса в ходе химической реакции;
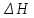 и
и 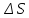 — соответственно изменения энтальпии
и энтропии;
— соответственно изменения энтальпии
и энтропии;
T – температура, при которой протекает реакция.
Как следует из формулы (3) энергия Гиббса может быть сосчитана изменением энтальпии и энтропии с учетом
Исходя из полученного значения, можно судить о возможности протекания данной химической реакции.
Возможны следующие 3 случая:
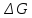 <0
– самопроизвольное протекание химической
реакции возможно;
<0
– самопроизвольное протекание химической
реакции возможно;
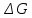 >0
– реакция протекать самопроизвольно
не может;
>0
– реакция протекать самопроизвольно
не может;
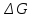 =0
– химическая система находится в
равновесие (обратима).
=0
– химическая система находится в
равновесие (обратима).
Энергия Гиббса. Образование вещества.
— изменение энергии Гиббса при образовании 1 моль вещества из простых веществ.
Если изменение энергии Гиббса рассматривать при стандартных условиях, то говорят о стандартном изменении энергии Гиббса.
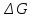 0 образование
простых веществпринимается
равным 0.
0 образование
простых веществпринимается
равным 0.
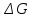
Энергия Гиббса – термодинамическая функция зависит только отначального и конечного состояния системы поэтому изменение энергии Гиббса в ходе реакции вычисляется по полной аналогии с изменениями энтальпии и энтропии.
(4)
При достижении равновесия химической системы константа равновесия связана со стандартными изменениями энергии Гиббса соотношение:
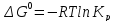 (5)
(5)
Где 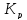 — константа равновесия при температуре
Т
— константа равновесия при температуре
Т
Исходя из изменения энергии Гиббса в ходе реакции можно рассчитать константу равновесия при произвольной температуре Т:
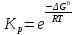 (6)
(6)
Также может быть
решена обратная задача: по экспериментальному
определению 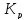 рассчитывает из уравнения (5) изменения
стандартной энергии Гиббса.
рассчитывает из уравнения (5) изменения
стандартной энергии Гиббса.
17. Электролитическая диссоциация (ЭД). Механизм ЭД. Степень и константа диссоциации, их взаимосвязь. Закон разбавления Оствальда.
По своей способности проводить электрический ток, все вещества можно разделить на электролиты – растворы или расплавы этих веществ проводят электрический ток, и неэлектролиты — растворы или расплавы этих веществ не проводят электрический ток.
Основные положения теории ЭД:
При растворении в воде молекулы электролитов распадаются (диссоциируют) на положительно и отрицательно заряженные ионы.
При пропускании постоянного электрического тока через растворы (расплавы) электролитов положительно заряженные ионы двигаются к отрицательно заряженному электроду (катоду) – катионы, отрицательно заряженные ионы к положительно заряженному электроду (аноду) – анионы.
Диссоциация – обратимый процесс: одновременно с распадом молекул на ионы протекает обратный процесс – образование из ионов исходных нейтральных молекул.
В основе электролитической диссоциации лежит взаимодействие ионного кристалла или поляризованных молекул с полярными молекулами растворителя (в частности, с молекулами воды).
За счет электростатического
направления диполи воды «вырывают»
поверхностные ионы в объеме раствора.
При этом ионы находятся в гидратированном
состоянии. Если в растворе присутствуют
полярные молекулы, то за счет
электростатического напряжения диполей
воды они подвергаются еще более глубокой
поляризации и, в конечном итоге,
распадаются на ионы. Реально ионы 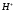 в водных растворах присутствуют в
гидратированном состоянии в виде ионов
гидроксония
в водных растворах присутствуют в
гидратированном состоянии в виде ионов
гидроксония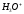 ,
образование которого можно представить
как присоединение
,
образование которого можно представить
как присоединение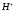 к
к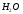 за счет донорно-акцепторной связи.
за счет донорно-акцепторной связи.
Количественно
процесс диссоциации характеризуется
степенью диссоциации 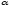 —
отношение количества (концентрации)
молекул, распавшихся на ионы к общему
количеству исходной концентрации
молекул растворенного вещества:
—
отношение количества (концентрации)
молекул, распавшихся на ионы к общему
количеству исходной концентрации
молекул растворенного вещества:
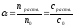 (1).
(1).
Молекулы сильных
электролитов практически полностью
диссоциируют в растворе ( стремится
к 1), молекулы слабых электролитов
диссоциируют в очень незначительных
степенях (
стремится
к 1), молекулы слабых электролитов
диссоциируют в очень незначительных
степенях ( намного
меньше 1).
намного
меньше 1).
В растворах слабых
электролитов имеет место равновесие,
которое характеризуется своей константой
равновесия – константой диссоциации
(для раствора слабых кислот — 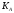 ,
для растворов слабых оснований —
,
для растворов слабых оснований —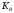 ).
).
Т.к. степень диссоциации и константа диссоциации характеризуют один и тот же процесс – диссоциацию слабого электролита, то между ними существует связь.
Определим ее на
примере диссоциации 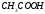 :
: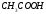
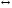

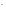 +
+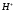 =
=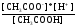 (2).
Выразим концентрацию продиссоциировавших
молекул через
(2).
Выразим концентрацию продиссоциировавших
молекул через и исходную концентрацию: [
и исходную концентрацию: [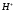 ]=[
]=[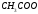
 ]=
]= *
*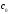 .
Непродиссоциировавших молекул в растворе
осталось:
.
Непродиссоциировавших молекул в растворе
осталось: —
— *
*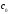 =
=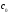 (1-
(1- ).
Подставим полученное выражение для
равновесной концентрации:
).
Подставим полученное выражение для
равновесной концентрации:
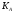 =
=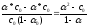 (3).
(3).
Так как для слабых
электролитов 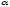 ,
то ее значением в знаменателе уравнения
(3) можно пренебречь. Тогда
,
то ее значением в знаменателе уравнения
(3) можно пренебречь. Тогда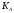 =
=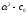
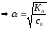 .
.
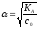 —
закон разбавления Оствальда: при снижении
концентрации в растворе слабого
электролита (разбавление раствора)
степень диссоциации возрастает.
—
закон разбавления Оствальда: при снижении
концентрации в растворе слабого
электролита (разбавление раствора)
степень диссоциации возрастает.
Константа диссоциации
слабых электролитов — табличные данные,
не зависят от концентрации ионов в
растворе, а зависят только от температуры.
Данное понятие применимо только для
слабых электролитов, т.к. для сильных
электролитов  стремится
к 1, знаменатель уравнения (3) = 0 и
стремится
к 1, знаменатель уравнения (3) = 0 и теряет
смысл.
теряет
смысл.
К сильным электролитам относятся:
все растворимые
основания – щелочи (гидроксиды щелочных
и щелочноземельных металлов), кроме 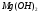 ;
;
ряд минеральных
кислот, все галогеноводородные (кроме
HF): 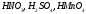 и т.д.;
и т.д.;
практически все соли (в том числе и малорастворимые).
1. Первый закон термодинамики
57
Федеральное агентство по образованию
Государственное образовательное учреждение высшего
профессионального образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
О.Ф. Булатова, А.М. Сыркин
Тепловые эффекты и направление химических процессов
Учебное пособие
Уфа 2008
УДК 544.3(07)
ББК 24.53я7
Б 90
Утверждено Редакционно-издательским советом УГНТУ
в качестве учебного пособия
Рецензенты:
Зав. кафедрой «Общая химия» Башкирского государственного
медицинского университета, д-р хим. наук, проф. Е.В.Пастушенко
Зав. кафедрой «Общая химия» Уфимской государственной академии
экономики и сервиса, канд. хим. наук, доц. И.П.Журкина
Булатова О.Ф., Сыркин А.М.
Б 90 Тепловые эффекты и направление химических процессов: учеб.
пособие.– Уфа: Изд-во УГНТУ, 2008.– 66с.
ISBN 978–5–7831–0839–6
В данном учебном пособии изложены основы химической термодинамики, приводятся разбор задач, учебно-исследовательский эксперимент по определению тепловых эффектов различных химических процессов, контрольные задания для проверки качества усвоения изучаемого материала, показаны примеры термохимических вычислений.
Учебное пособие рекомендуется студентам первого курса всех специальностей дневной и вечерней форм обучения.
УДК 544.3(07)
ББК 24.53я7
ISBN 978–5–7831–0839–6 ©Уфимский государственный
нефтяной технический университет, 2008
©Булатова О.Ф., Сыркин А.М., 2008
ВВЕДЕНИЕ
Данное учебное пособие для тех, кто хотел бы разобраться в основах химической термодинамики. Химическая термодинамика – это наука о движущих силах химических реакций.
Химическая реакция – это процесс. Любой процесс есть движение. Для движения необходима сила. А сила – это работа, отнесённая к единице пути. Химическая реакция есть превращение одних веществ в другие, поэтому за единицу пути химической реакции принимается количество превращенного вещества. Обычно количество вещества измеряется числом молей. Источником (первопричиной) любой силы является либо убыль энергии (ΔU<0), либо увеличение энтропии (ΔS>0). Энергия – это мера движения, а энтропия – мера свободы. Две эти силы всегда направлены навстречу друг другу. При их равенстве система находится в равновесии.
Результат действия энтальпийного и энтропийного факторов отражает термодинамический потенциал. В условиях постоянных температуры и давления этот потенциал называют энергией Гиббса G. Изменение энергии Гиббса ΔG позволяет ответить на принципиальный вопрос: «Возможна реакция или нет?» Если реакция термодинамически разрешена, то можно искать условия для её проведения. Любая реакция в конечном итоге определяется скоростью. Проблемой изучения скоростей и механизмов химических реакций занимается химическая кинетика.
В термодинамике весь объективный мир делится на систему и окружающую среду.
Система – это некоторая часть материального мира, ограниченная реальной или воображаемой поверхностью. В качестве системы можно рассматривать и колбу с раствором, и автомобильный двигатель, и живой организм, и планету в целом. В термодинамической системе число молекул должно быть бесконечно большим. Система может обмениваться с окружающей средой веществом и энергией. Обмен энергией осуществляется как в форме теплоты, так и в форме работы. Теплота – мера передачи молекулярного хаотического движения, а работа мера передачи упорядоченного обычно механического движения. Теплота и работа свойства процесса. Система, у которой отсутствует обмен веществом с окружающей средой, называется закрытой, а если отсутствует также и обмен энергией – изолированной системой.
Совокупность всех свойств системы есть её состояние. Все свойства между собой связаны уравнениями состояния, позволяющими по одним из них вычислить другие. Те свойства, которые задаются, называются параметрами состояния, а вычисляемые – функциями состояния. Деление свойств на параметры и функции состояния субъективно. Обычно за параметры принимают измеримые свойства: температура, давление, объём, концентрация и др. Энергия, энтальпия, энтропия и некоторые другие свойства обычно выступают в качестве функции состояния, их рассчитывают.
Химические реакции обычно проводят при постоянном давлении (например в открытой колбе) или при постоянном объёме (например в автоклаве), т.е. они являются соответственно изобарным или изохорным процессами.
Энергетический эффект химического процесса возникает за счёт изменения в системе внутренней энергии U. Внутренняя энергия – это общий запас энергии системы, который складывается из энергии движения и взаимодействия молекул, энергии движения и взаимодействия ядер и электронов в атомах, молекулах и кристаллах, внутриядерной энергии и т.п. (т.е. все виды энергии, кроме кинетической энергии системы как целого и её потенциальной энергии положения относительно других систем).
Первый закон термодинамики утверждает: подведённое тепло Q, расходуется на изменение внутренней энергии системы ΔU и на совершение работы против внешних сил A:
Q = ΔU + A (1)
В термодинамике принято считать работу положительной, если она выполняется системой.
2. Тепловые эффекты химических процессов
Тепловой эффект процесса – это энергообмен системы с окружающей средой в виде молекулярного хаотического движения.
Химические процессы могут идти с выделением или с поглощением тепла. На разрыв связей в молекулах исходных веществ энергия затрачивается, а при образовании связей в молекулах продуктов реакции энергия выделяется. Если общее количество затраченной энергии больше выделенной, то процесс идет с поглощением энергии и является эндотермическим. Если же количество выделенной энергии больше затраченной, то процесс осуществляется с выделением энергии и является экзотермическим.
Количество выделенной или поглощенной энергии зависит от состояния и количества веществ, составляющих химическую систему.
Образования воды можно записать следующими термохимическими уравнениями:
2H2 (г) + O2 (г)=2H2O(г); Q = –483,60 кДж
H2 (г) + ½ O2 (г)=H2O(г); Q = –241,80 кДж
H2 (г) + ½O2 (г)=H2O(ж); Q = –285,85 кДж
Процесс образования воды является экзотермическим, т.к. сопровождается выделением тепла, – затрата энергии на разрыв связей в молекулах Н2 и О2 меньше, чем величина энергии выделяющейся при образовании связей в молекуле Н2О. Если получать воду в жидком состоянии, то энергетический эффект процесса будет больше, т.к. в этом случае выделится большее количество тепла. Действительно, при образовании одного моля воды в жидком состоянии из газообразных кислорода и водорода выделяется
285,25 кДж.
Уравнения химических реакций, в которых указываются состояния веществ и тепловые эффекты, называются термохимическими.
Для возможности сопоставления энергетических эффектов различных процессов их принято измерять в стандартных условиях: при температуре 25°С (298 К) и давлении 1 атм (1,1013 105 Па).
Тепловой эффект реакции образования одного моля сложного вещества из простых веществ в агрегатных состояниях, отвечающих стандартным условиям, называется теплотой образования данного вещества. Теплота образования простых веществ в стандартном состоянии принимается равной нулю.
В рассмотренном примере тепловой эффект третьего термохимического уравнения представляет собой величину теплоты образования воды, т.к. значения тепловых эффектов отвечают стандартным условиям и все вещества находятся в устойчивых агрегатных состояниях. В справочной термохимической литературе, кроме теплоты образования, можно найти также значения теплоты сгорания некоторых веществ. Теплота сгорания легко поддается измерению и исторически была одной из первых типов теплоты, которая систематически измерялась и табулировалась.
Теплотой сгорания вещества называют тепловой эффект реакции окисления в кислороде (O2) 1 моль вещества с образованием оксидов, устойчивых в стандартных условиях.
Например, тепловой эффект реакции
С2Н6 (г) + 7/2O2 (г)=2СО2 (г) + 3Н2О(ж), равный –1559,88 кДж/моль, является теплотой сгорания этана.
Значения теплоты образования и сгорания различных веществ используются для осуществления различных термохимических вычислений.
Для химических реакций под работой в основном подразумевается действие против внешнего давления. Она связана с изменением объёма. Например, при выделении газа в ходе реакции (рис 1.) Работа против внешнего давления равна произведению давления p на изменение объема системы ΔV при переходе её из состояния 1 в состояние 2:
А = р(V2 – V1) = р ΔV .
Р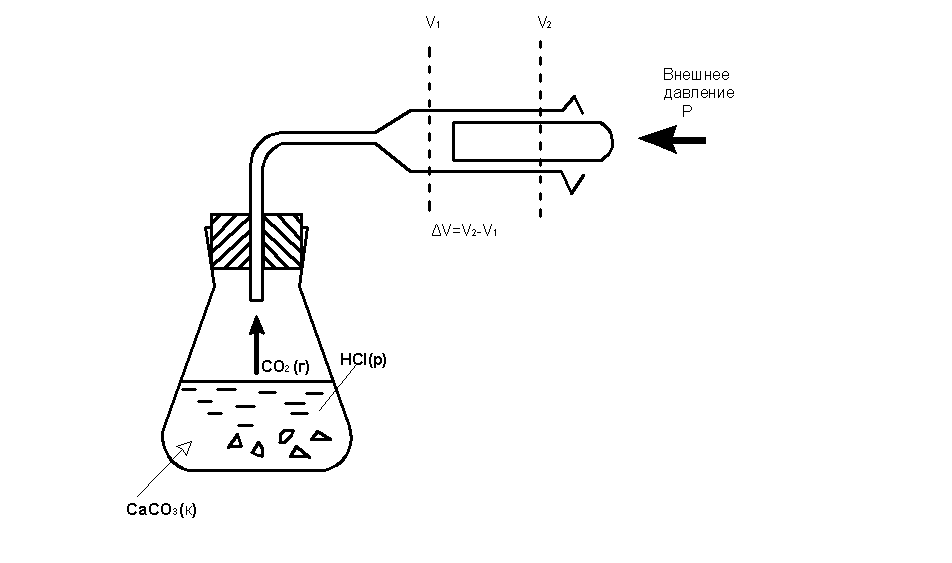 ис.
1. Работа, выполняемая химической системой
против внешнего давленияр (поршень невесомый)
ис.
1. Работа, выполняемая химической системой
против внешнего давленияр (поршень невесомый)
При изохорном процессе (V=const), ΔV=0 и А= pΔV=0. Тогда, обозначив символом Qv тепловой эффект, согласно первому закону термодинамики (1) можно записать:
Qv = ΔU, (2)
т.е. тепловой эффект химической реакции при постоянном объёме равен изменению внутренней энергии.
Химические реакции чаще проводят в открытых сосудах, т.е. при практически постоянном атмосферном давлении (p=const). В этом случае, обозначив тепловой эффект реакции Qp, имеем
QР = ΔU + pΔV
Полученное выражение можно упростить, если воспользоваться термодинамической функцией, которая называется энтальпией. Энтальпию обозначают буквой Н и определяют как Н= U + pV.
Энтальпию можно рассматривать как энергию расширенной системы. Таким образом,
Qp = ∆U + р∆V = U2 –U1+р∙(V2 –V1) = (U2+ рV2) – (U1+ рV1) = H2 – H1 = ∆H
QР = ΔН, (3)
т.е. тепловой эффект реакции при постоянном давлении равен изменению энтальпии.
Отметим, что реакции, в которых исходные вещества и продукты находятся в жидком или твердом состоянии, протекают без существенных изменений объёма. В химической термодинамике объёмами конденсированных фаз пренебрегают. Например, 1 моль жидкой воды занимает объём 18 мл – 18 10–3 л, а в парообразном состоянии 22,4 л. Поэтому для конденсированных веществ ΔV≈0 и pΔV≈0, а ΔН≈ΔU. Если в реакции участвуют газы, то изменение объёма может быть значительным, и в этом случае ΔН и ΔU сильно отличаются. Произведение pV для n молей газа будет равно nRT. Если в реакции расходуется n1 молей газообразных веществ и образуется n2 молей газообразных продуктов, то рΔV=(n2–n1) RT=ΔnRT. Следовательно,
Qp = ΔН = ΔU + ΔnRT = Qv+ ΔnRT (4)