Классификация органических веществ
Будьте внимательны! У Вас есть 10 минут на прохождение теста. Система оценивания — 5 балльная. Разбалловка теста — 3,4,5 баллов, в зависимости от сложности вопроса. Порядок заданий и вариантов ответов в тесте случайный. С допущенными ошибками и верными ответами можно будет ознакомиться после прохождения теста. Удачи!Список вопросов теста
Вопрос 1
Укажите формулы углеводородов:
Варианты ответов
Вопрос 2
Варианты ответов
- ― COOH
- ― CHO
- ― OH
― NH2
Вопрос 3
Какие функциональные группы присутствуют в аминокислотах?
Варианты ответов
― CHO
― COOH
― NH2
― ОН
Вопрос 4
Установите соответствие между формулой соединения и его классификационной характеристикой:Варианты ответов
- алифатическое
- карбоциклическое
- гетероциклическое
- насыщенное
Вопрос 5
Варианты ответов
Вопрос 6
Этанол — это:
Варианты ответов
- монофункциональное соединение
- полифункциональное соединение
- ароматическое соединение
- гетероциклическое соединение
Вопрос 7
Варианты ответов
- монофункциональное соединение
- полифункциональное соединение
- гетерофункциональное соединение
- карбоциклическое соединение
Вопрос 8
Установите соответствие между функциональной группой и её названием:
Варианты ответов
- ― OH
― NH2
― NO2
― CHO
― COOH
Вопрос 9
Скелет данной молекулы является:
Варианты ответов
- неразветвлённым
- разветвлённым
- ациклическим
- гетероатомным
Вопрос 10
Варианты ответов
- углеводородом
- кислородсодержащим соединением
- скелет его молекулы — углеродный
- скелет его молекулы — гетероатомный
Рекомендации к СУРС
%PDF-1. 5
%
1 0 obj
>
/Metadata 2 0 R
/Outlines 3 0 R
/PageLayout /OneColumn
/Pages 4 0 R
/StructTreeRoot 5 0 R
/Type /Catalog
>>
endobj
6 0 obj /Keywords ()
/ModDate (D:20160112162136+03’00’)
/Producer (Adobe PDF Library 10.0)
/SourceModified (D:20160112132118)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2016-01-12T16:21:36+03:002016-01-12T16:21:28+03:002016-01-12T16:21:36+03:00Acrobat PDFMaker 10.1 для Worduuid:196a2dff-6488-42d1-aa42-2fa5f7adeb57uuid:fb22120d-9f36-4159-a7b4-ee37f5913ddb
5
%
1 0 obj
>
/Metadata 2 0 R
/Outlines 3 0 R
/PageLayout /OneColumn
/Pages 4 0 R
/StructTreeRoot 5 0 R
/Type /Catalog
>>
endobj
6 0 obj /Keywords ()
/ModDate (D:20160112162136+03’00’)
/Producer (Adobe PDF Library 10.0)
/SourceModified (D:20160112132118)
/Subject ()
/Title
>>
endobj
2 0 obj
>
stream
2016-01-12T16:21:36+03:002016-01-12T16:21:28+03:002016-01-12T16:21:36+03:00Acrobat PDFMaker 10.1 для Worduuid:196a2dff-6488-42d1-aa42-2fa5f7adeb57uuid:fb22120d-9f36-4159-a7b4-ee37f5913ddb
^a82+ڇ!3|0?Tlbxrl>hIa*;]C`GhgXD6&SIwX:k!t@|e,~tFsyWa4&4FLL䖟4Λ! ]֡u;**CMֱ7Ϧa*_G»p;m9pO[YC;W$Wv`̃۾Aᆜܛ;Ù4UثƓpI( n|IΪs`T0jE9; ԯ}+#cP4’B+Uh&JnT6SZ:1; _G:n~ށȅn=轕|]H\wb9
Строение органических веществ — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Атомы углерода отличаются от атомов других элементов тем, что способны образовывать устойчивые химические связи друг с другом. Они могут связываться в цепи разной длины. Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Между атомами углерода могут образовываться одинарные, двойные и тройные связи.
Молекулы органических веществ состоят обычно из атомов неметаллов, поэтому в них присутствуют ковалентные связи. Число ковалентных связей, которые образует атом, определяет его валентность.
В основе органической химии лежит теория химического строения органических веществ А. М. Бутлерова. Её основные положения:
М. Бутлерова. Её основные положения:
Атомы в молекулах органических веществ соединены в определённом порядке в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен, кислород — двухвалентен, а водород и галогены — одновалентны.
В молекуле метилового спирта атом углерода соединён ковалентными связями с четырьмя другими атомами, атом кислорода — с двумя, а каждый атом водорода образует одну ковалентную связь.
Свойства веществ зависят не только от состава молекул, но и от порядка соединения атомов в них,
т. е. от химического строения.
Рассмотрим второе положение на примере вещества, имеющего состав: C2h5Cl2.
Состав веществ одинаковый, а порядок соединения атомов в них разный. В молекуле первого вещества атомы хлора соединены с разными атомами углерода, а в молекуле второго — с одним. Свойства веществ отличаются. Так, температура кипения первого вещества — \(–96,7\) °С, а второго — \(–42,0\) °С.
При составлении структурных формул органических веществ сначала записывают символы углерода, связывая их между собой; затем с учётом четырёхвалентности атома углерода записывают символы других элементов.
Структурная формула углеводорода, состоящего из трёх атомов углерода и восьми атомов водорода, строится следующим образом:
Ациклический углеводород – обзор
1 Введение
Химическая теория графов применяет этот раздел математики к моделированию молекул с целью изучения их различных физических свойств. Граф G = ( V , E ) состоит из набора V вершин (или узлов) и набора E неупорядоченных пар различных элементов V , которые являются ребрами. В химии атомы молекулы представлены вершинами, а химические связи представлены ребрами.Полученный граф часто называют химическим графом . При изучении алканов, имеющих химическую формулу C n H 2 n +2 , атомы водорода удаляются из графика, что приводит к тому, что известно как обедненный водородом молекулярный график или углерод. дерево . Поскольку каждый углерод имеет четыре связи, а каждый водород имеет одну связь, информация о молекуле не теряется при удалении атомов водорода. Полученный график на самом деле легче изучать, поскольку геометрическая структура алкана более очевидна.Например, 2,2,4-триметилпентан представлен на рис. 1. Химическая диаграмма 2,2,4-триметилпентана представлена на рис. 2.
Полученный график на самом деле легче изучать, поскольку геометрическая структура алкана более очевидна.Например, 2,2,4-триметилпентан представлен на рис. 1. Химическая диаграмма 2,2,4-триметилпентана представлена на рис. 2.
Рис. 1. Изображение 2,2, Молекула 4-триметилпентана.
Рис. 2. Химическая диаграмма 2,2,4-триметилпентана.
Вершина набор графа на рис. 2 — V = { A , B , C , D , E , F , G , H } , а набор ребер этого графа задается как E=ab,bc,cd,de,bf,bg,dh.Степень вершины v — это количество ребер, прикрепленных к вершине v , и обозначается deg( v ). В молекулярном соединении это число связей, которое имеет атом, и определяется как валентность атома. На рис. 2 deg( a )= deg( f )=deg( g )=deg(h )=deg( e )=1, deg( b )=4 , град( c )=2 и град( d )=3.
Учитывая график G с вершинами U , V ∈ V ( G ), мы определяем U — V Путь Как последовательность краев из г из формы UV 1 , V 1 V 2 , V 2 V 3 , …, V N v , где каждая вершина v i ∈ V ( G ) для 1 ≤ i ≤ n различна.Длина заданного пути u – v равна n , количеству ребер в пути. Кратчайший путь из вершины u в v — это путь, для которого n , количество ребер в пути, минимально. Путь из вершины g в h на рис. 2 задается как gb , bc , cd , dh и имеет длину четыре. Это также кратчайший путь от g до h , поскольку это единственный путь g – h . Учитывая, что 2,2,4-триметилпентан является ациклическим углеводородом, его химический граф не содержит циклов. Цикл в графе — это путь, который начинается и заканчивается в одной вершине. Поскольку граф 2,2,4-триметилпентана не содержит циклов, путь между любой парой вершин графа всегда будет кратчайшим путем между двумя вершинами.
Учитывая, что 2,2,4-триметилпентан является ациклическим углеводородом, его химический граф не содержит циклов. Цикл в графе — это путь, который начинается и заканчивается в одной вершине. Поскольку граф 2,2,4-триметилпентана не содержит циклов, путь между любой парой вершин графа всегда будет кратчайшим путем между двумя вершинами.
В теории графов вершины традиционно обозначаются буквами, чтобы не путать метку вершины со степенью вершины.Однако, когда изучаемые соединения представляют собой алканы (известные также как ациклические насыщенные углеводороды, парафины и метановые ряды), «прямую» цепь углеводорода традиционно обозначают цифрами от 1 до и , а все разветвленные атомы углерода — цифрами. метки n + 1, n + 2 и т. д. по необходимости на химическом графике. Например, химическая диаграмма 2,2,4-триметилпентана будет выглядеть так, как показано на рис. 3. С этого момента в этой главе все химические диаграммы алканов будут обозначены таким образом.
Рис. 3. 2,2,4-Триметилпентан с традиционной маркировкой.
Граф называется связным , если существует путь между каждой парой вершин в графе. В противном случае граф называется несвязным . Если граф связный, расстояние d ( u , v ) от u до v является длиной кратчайшего пути от u до v . Расстояние матрицы графика G , имеющих N вершин N × N N × N , чьи I — J -й вход составляет D ( I , j ) и обозначается D ( G ).Например, матрица расстояний для 2,2,4-триметилпентана имеет вид
D(G)=0123422410123113210122223210133143210442212340242123420443212440
. кратчайшие пути между любыми двумя парами атомов углерода. Матрица смещения , A ( г ), меченого графа г , имеющих N вершин N × N N × N , записи, чьи записи даны на
AIJ = 1if VerticsianDjare.
Например, матрица соседних для 2,2,4-триметилпентана дана
A (G) = 010000001010010101010000001010010101010000000010101000010000000000000101000010000000000000000000010000010000000000000000000100000100000000000000000000010000010000000000000000000000010000000100000000000000000000000100000000000000000000000000000001Число , соответствующее графа G , представляет собой (возможно, пустое) множество независимых ребер графа G . k — , соответствующее , — это паросочетание, которое имеет ровно k ребер. Обозначим через a k число k -сопоставлений, полином простого паросочетания графа с p вершин задается формулой ∑k=0p/2akωp−k. Мы продемонстрируем, как вычислить простой полином соответствия 2,2-диметилбутана, используя химический граф этой молекулы, показанный на рис.4.
Рис. 4. 2,2-Диметилбутан.
Существует только один способ выбрать нулевые ребра для паросочетания ( a 0 = 1), как показано на рис.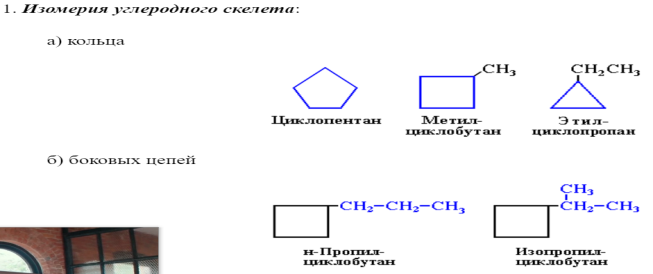 5. Существует пять способов образования 1-сочетания, поскольку граф 2,2-диметилбутана имеет пять ребер ( a 1 = 5). Эти 1-соответствия показаны на рис. 6. На рис. 7 показаны три возможных 2-соответствия 2,2-диметилбутана. выбор двух ребер не будет независимым ( a 2 = 3).Для k ≥ 3 нет k -паросочетаний, так как любой выбор из 3, 4, 5 и т. д. ребер не будет независимым. Используя значения a k , как объяснялось ранее в формуле для формулы простого сопоставления, полином простого сопоставления для 2,2-диметилбутана равен ω 6 + 5 ω
5. Существует пять способов образования 1-сочетания, поскольку граф 2,2-диметилбутана имеет пять ребер ( a 1 = 5). Эти 1-соответствия показаны на рис. 6. На рис. 7 показаны три возможных 2-соответствия 2,2-диметилбутана. выбор двух ребер не будет независимым ( a 2 = 3).Для k ≥ 3 нет k -паросочетаний, так как любой выбор из 3, 4, 5 и т. д. ребер не будет независимым. Используя значения a k , как объяснялось ранее в формуле для формулы простого сопоставления, полином простого сопоставления для 2,2-диметилбутана равен ω 6 + 5 ω
0 + 3 ω 4 .
Рис. 5. 0-Соответствие для 2,2-диметилбутана.
Рис. 6. 1-Сочетания для 2,2-диметилбутана.
Рис. 7. 2-Сочетания для 2,2-диметилбутана.
Глава 7 – Алканы и галогенированные углеводороды – Химия
Глава 7: Алканы и галогенированные углеводороды Этот текст опубликован в соответствии с лицензией Creative Commons, для ссылки и адаптации нажмите здесь.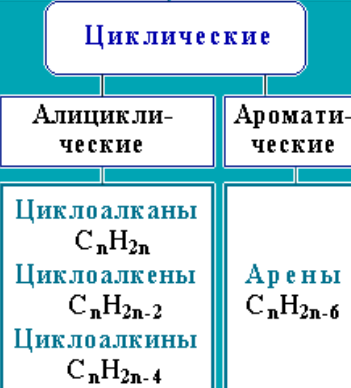
 7 Каталожные номера
7 Каталожные номера
Вступительное эссе
Углеводороды — простейшие органические соединения, но они обладают интересными физиологическими эффектами. Эти эффекты зависят от размера молекул углеводородов и от того, где они применяются в организме. Алканы с низкой молекулярной массой, содержащие от 1 до примерно 10 атомов углерода, представляют собой газы или легкие жидкости, которые действуют как анестетики. Вдыхание («вдыхание») этих углеводородов в бензине или аэрозольных пропеллентах из-за их опьяняющего эффекта является серьезной проблемой для здоровья, которая может привести к повреждению печени, почек или головного мозга или к немедленной смерти от удушья при исключении кислорода.Канистры с пропаном и бутаном под давлением, оба из которых предназначены для использования в качестве топлива, используются в качестве ингалянтов.
Рисунок 7.1. Ряд продуктов на основе нефти, которыми можно злоупотреблять в качестве ингалянтов . Фото: Lance Cpl. Мэтью К. Хакер
Фото: Lance Cpl. Мэтью К. Хакер
Проглатывание жидких алканов мало вредит желудку. Однако в легких они вызывают «химическую» пневмонию, растворяя жироподобные молекулы клеточных мембран в крошечных воздушных мешочках (альвеолах).Легкие перестают выталкивать жидкости, как при пневмонии, вызванной бактериями или вирусами. Людей, которые проглатывают бензин или другие жидкие смеси алканов, нельзя вызывать рвоту, так как это увеличивает вероятность попадания алканов в легкие. (Не существует противоядия для домашнего лечения отравления бензином; позвоните в токсикологический центр.)
Жидкие алканы, содержащие примерно 5–16 атомов углерода на молекулу, смывают естественные кожные масла и вызывают высыхание и растрескивание кожи, в то время как более тяжелые жидкие алканы (содержащие примерно 17 или более атомов углерода на молекулу) действуют как смягчающие средства (смягчители кожи).В качестве защитной пленки можно применять такие смеси алканов, как минеральное масло и вазелин. Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
Вода и водные растворы, такие как моча, не растворяют такую пленку, что объясняет, почему вазелин защищает нежную кожу ребенка от опрелостей.
В этой главе мы будем исследовать алканы, соединения, содержащие только два элемента, углерод и водород, и имеющие только одинарные связи. Мы также будем исследовать алканы, в структуру которых входят галогены. Напомним, что галогены являются элементами семейства 7A в периодической таблице и содержат репрезентативные элементы, такие как хлор, фтор, йод и бром.Существует несколько других видов углеводородов, отличающихся типами связи между атомами углерода и свойствами, возникающими в результате этой связи. В главе 8 мы рассмотрим углеводороды с двойными связями, с тройными связями и с особым типом связи, называемым ароматичностью . Затем в главе 9 мы изучим некоторые соединения, которые считаются производными от углеводородов путем замены одного или нескольких атомов водорода кислородсодержащей группой. Глава 10 посвящена органическим кислотам и основаниям.
7.1 Распознавание органических структур Цель обучения
- Уметь узнавать состав и свойства, характерные для органических и неорганических соединений.
Ученые 18 и начала 19 веков изучали соединения, полученные из растений и животных, и обозначили их как органические , потому что они были выделены из «организованных» (живых) систем.Соединения, выделенные из неживых систем, таких как горные породы и руды, атмосфера и океаны, были обозначены как неорганические . Многие годы ученые считали, что органические соединения могут образовываться только живыми организмами, потому что они обладают жизненной силой, присущей только живым системам. Теория жизненной силы начала приходить в упадок в 1828 году, когда немецкий химик Фридрих Вёлер синтезировал мочевину из неорганических исходных материалов. Он провел реакцию с цианатом серебра (AgOCN) и хлоридом аммония (NH 4 Cl), рассчитывая получить цианат аммония (NH 4 OCN).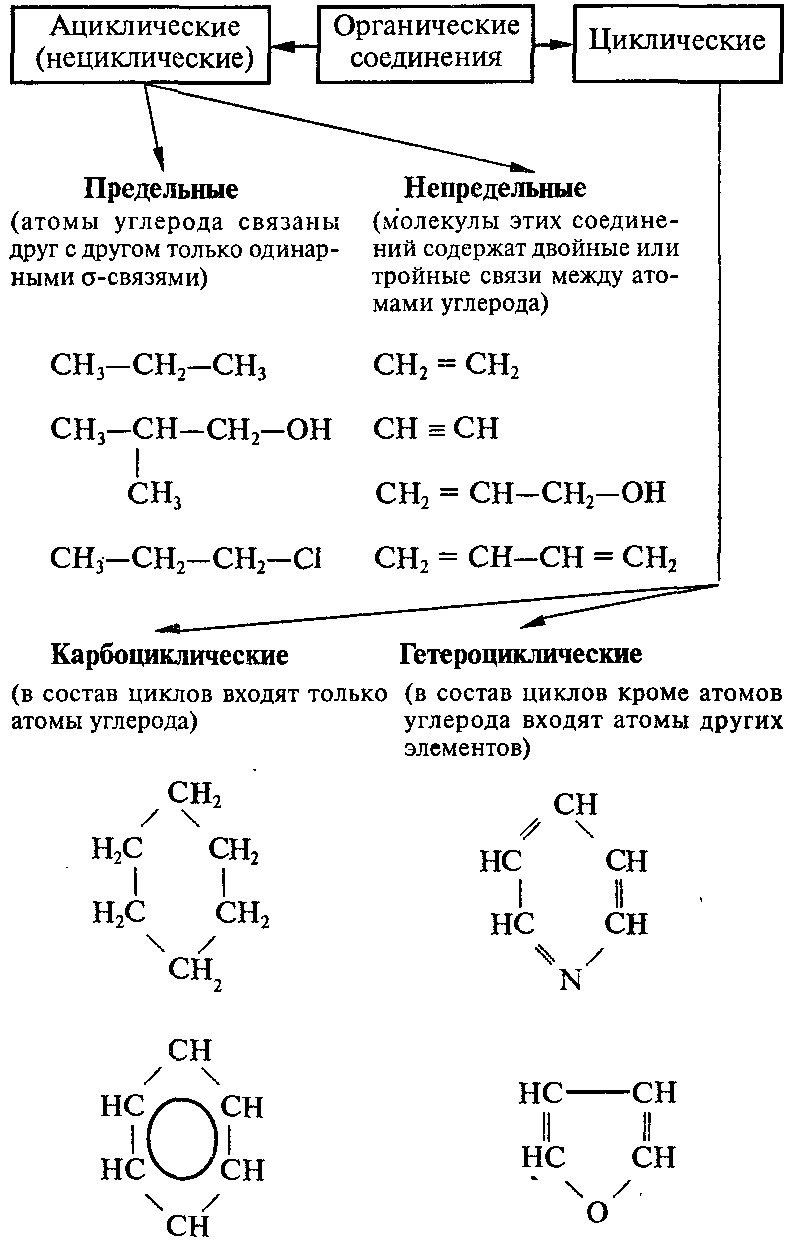 То, что он ожидал, описывается следующим уравнением.
То, что он ожидал, описывается следующим уравнением.
AgOCN + NH 4 Cl → AgCl + NH 4 OCN
Вместо этого он обнаружил, что продукт представляет собой мочевину (NH 2 CONH 2 ), хорошо известное органическое вещество, которое легко выделяют из мочи. Этот результат привел к серии экспериментов, в которых большое разнообразие органических соединений было получено из неорганических исходных материалов. Теория жизненной силы постепенно ушла в прошлое, когда химики узнали, что они могут создавать многие органические соединения в лаборатории.
Сегодня органическая химия реклассифицирована как изучение соединений, содержащих углерод, а неорганическая химия является изучением химии всех других элементов. Может показаться странным, что мы делим химию на две ветви — одну, которая рассматривает соединения только одного элемента, и другую, которая охватывает более 100 остальных элементов. Однако такое деление представляется более разумным, если учесть, что из десятков миллионов охарактеризованных соединений подавляющее большинство составляют соединения углерода.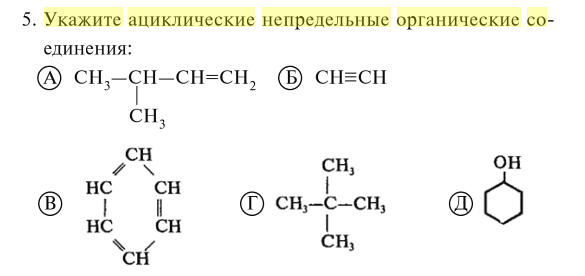
Слово органический имеет разные значения. Органические удобрения, такие как коровий навоз, являются органическими в первоначальном смысле; он получен из живых организмов. Органические продукты – это продукты, выращенные без синтетических пестицидов или удобрений. Органическая химия – это химия соединений углерода. Углерод уникален среди других элементов тем, что его атомы могут образовывать устойчивые ковалентные связи друг с другом и с атомами других элементов во множестве вариаций.Образовавшиеся молекулы могут содержать от одного до миллионов атомов углерода.
Органические соединения, как и неорганические соединения, подчиняются всем законам природы. Часто нет четкого различия в химических или физических свойствах органических и неорганических молекул. Тем не менее, полезно сравнить типичных членов каждого класса, как в Таблице 7.1 (помните, однако, что в каждой категории в этой таблице есть исключения). Чтобы дополнительно проиллюстрировать типичные различия между органическими и неорганическими соединениями, Таблица 7.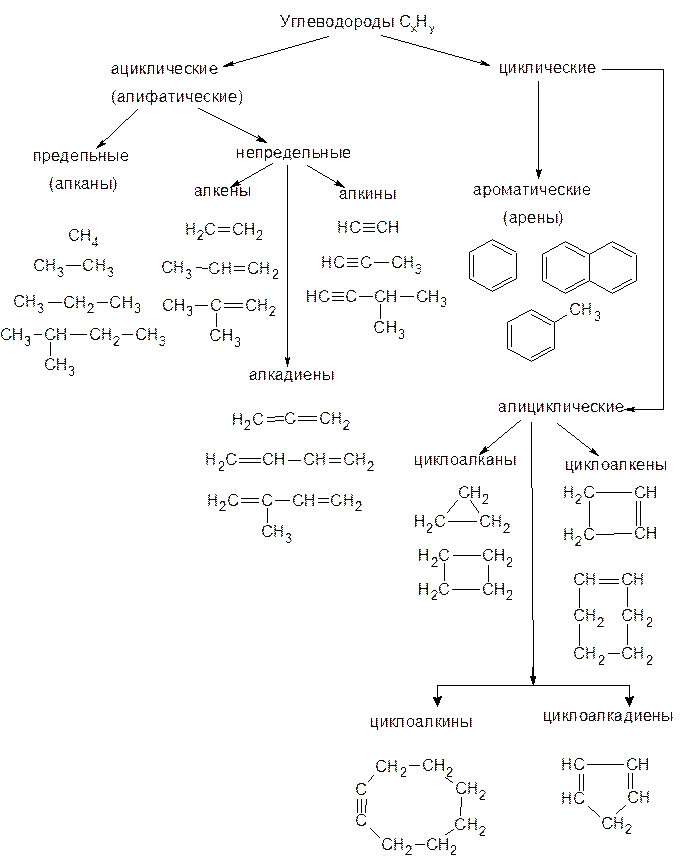 1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1.
1 также перечислены свойства неорганического соединения хлорида натрия (поваренная поваренная соль, NaCl) и органического соединения гексана (C 6 H 14 ), растворителя, который используется для извлечения соевого масла из соевых бобов (среди прочего). Многие соединения можно классифицировать как органические или неорганические по наличию или отсутствию некоторых типичных свойств, как показано в таблице 7.1.
Таблица 7.1 Общие контрастные свойства и примеры органических и неорганических соединений
Упражнения по обзору концепции: нажмите, чтобы ответить на вопросы
Вынос ключей- Органическая химия изучает соединения углерода, почти все из которых также содержат атомы водорода.
Классифицируйте каждое соединение как органическое или неорганическое.

- С 6 Н 10
- CoCl 2
- С 12 Н 22 О 11
Классифицируйте каждое соединение как органическое или неорганическое.
- CH 3 NH 2
- NaNH 2
- Cu(NH 3 ) 6 Cl 2
Какой член каждой пары имеет более высокую температуру плавления?
- CH 3 ОН и NaOH
- CH 3 Cl и KCl
Какой член каждой пары имеет более высокую температуру плавления?
- C 2 H 6 и CoCl 2
- CH 4 и LiH
- органический
- неорганический
- органический
(наверх)
7.
 2 Введение в алканы
2 Введение в алканы Алканы представляют собой органические соединения, полностью состоящие из атомов углерода и водорода с одинарной связью и лишенные каких-либо других функциональных групп. Алканы имеют общую формулу C n H 2n +2 и могут быть подразделены на следующие три группы: линейные алканы с прямой цепью, разветвленные алканы и циклоалканы (рис. 7.2). Алканы также являются насыщенными углеводородами, , то есть все атомы углерода «насыщены» атомами водорода и не содержат двойных или тройных связей углерод-углерод.Алканы — это простейшие и наименее реакционноспособные виды углеводородов, содержащие только углерод и водород. Они очень важны с коммерческой точки зрения, так как являются основным компонентом бензина и смазочных масел и широко используются в органической химии; хотя роль чистых алканов (например, гексанов) отводится в основном растворителям. Отличительной чертой алкана, отличающей его от других соединений, которые также содержат исключительно углерод и водород, является отсутствие ненасыщенности. Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии. Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Другими словами, он не содержит двойных или тройных связей, которые очень реакционноспособны в органической химии. Хотя они не полностью лишены реакционной способности, отсутствие у них реакционной способности в большинстве лабораторных условий делает их относительно неинтересными, хотя и очень важными компонентами органической химии. Как вы узнаете позже, энергия, заключенная в связи углерод-углерод и связь углерод-водород, довольно высока, и их быстрое окисление производит большое количество тепла, обычно в форме огня.
Рисунок 7.2. Примеры алканов
Алканы с прямой цепью
Алканы с прямой цепью, метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) представляют собой начало ряда соединений, в которых любые два члены в последовательности отличаются одним атомом углерода и двумя атомами водорода, а именно единицей CH 2 (рис. 7.3)
Рис 7. 3 Три простейших алкана
3 Три простейших алкана
Первые 10 членов этого ряда приведены в таблице 7.2. Обратите внимание, что по мере увеличения длины углеродной цепи количество возможных различных структурных изомеров также увеличивается.
Таблица 7.2 Первые 10 алканов с прямой цепью
Начиная с пропана (C 3 H 8) и далее, вы заметите, что единственная разница между углеводородами с более длинной цепью заключается в добавлении СН 2 звеньев по мере продвижения вверх по ряду (рис.7.4). Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом и может быть определено математически. Члены такого ряда называются гомологами . В органической химии свойства гомологов изменяются закономерным и предсказуемым образом. Таким образом, принцип гомологии дает организацию органической химии почти так же, как таблица Менделеева дает организацию неорганической химии. Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Вместо сбивающего с толку множества отдельных соединений углерода мы можем изучить несколько членов гомологического ряда и вывести из них некоторые свойства других соединений этого ряда.
Рисунок 7.4 Члены гомологичного ряда
Обратите внимание, что на рис. 7.4 каждая последующая формула включает на один атом углерода и два атома водорода больше, чем предыдущая формула. Принцип гомологии позволяет записать общую формулу алканов: С n H 2 n + 2 .Используя эту формулу, мы можем написать молекулярную формулу любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Упражнения по обзору концепцииВ гомологическом ряду алканов, какова молекулярная формула члена чуть выше C 8 H 18 ?
Используйте общую формулу алканов, чтобы написать молекулярную формулу алкана с 12 атомами углерода.

Алканы с разветвленной цепью
Мы можем записать структуру бутана (C 4 H 10 ), связав четыре атома углерода в ряд,
–С–С–С–С–
, а затем добавление достаточного количества атомов водорода, чтобы дать каждому атому углерода четыре связи:
Соединение бутана имеет такую структуру, но есть и другой способ соединения 4 атомов углерода и 10 атомов водорода. Поместите 3 атома углерода в ряд, а затем разветвите четвертый от среднего атома углерода:
Теперь мы добавим столько атомов водорода, чтобы дать каждому углероду четыре связи.
Существует углеводород, который соответствует этой структуре, а это означает, что два разных соединения имеют одинаковую молекулярную формулу (C 4 H 10 ), но разное расположение атомов в пространстве. Напомним, что соединения, имеющие одинаковую молекулярную формулу, но разное расположение в пространстве, называются структурными изомерами .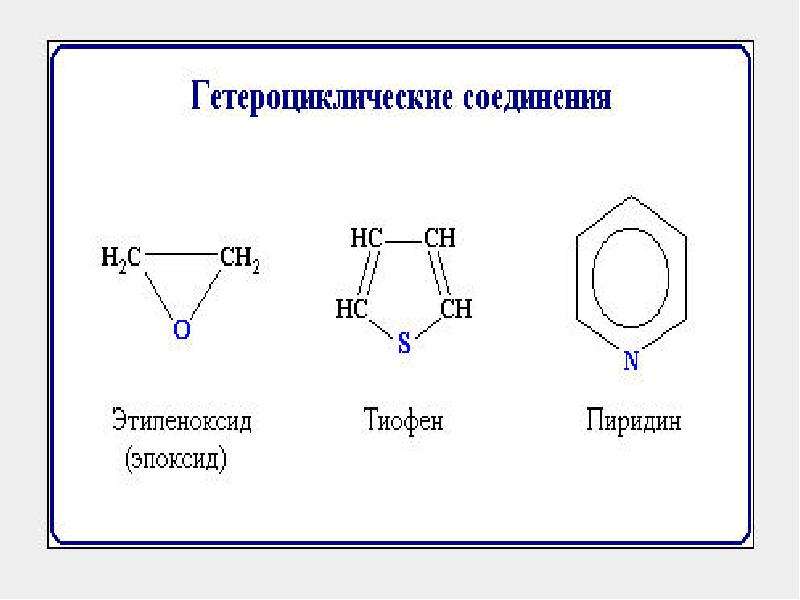 Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Структурные изомеры обладают разными химическими и физическими свойствами. На рис. 7.5 показана модель шара и стержня для бутана с прямой цепью и разветвленного изомера изобутана.
Рисунок 7.5 Бутан и изобутан. Шарико-стержневые модели этих двух соединений показывают, что они являются изомерами; оба имеют молекулярную формулу C 4 H 10 .
Обратите внимание, что C 4 H 10 изображен с изогнутой цепью на Рисунке 7.5. Четырехуглеродная цепь может быть изогнута по-разному, поскольку группы могут свободно вращаться вокруг связей С-С. Однако это вращение не меняет идентичности соединения.Важно понимать, что изгиб цепи , а не меняет идентичность соединения; все следующие представляют одно и то же соединение:
Формула изобутана показывает непрерывную цепь только из трех атомов углерода, причем четвертый присоединен как ответвление от среднего атома углерода непрерывной цепи.
В отличие от C 4 H 10 , соединения метана (CH 4 ), этана (C 2 H 6 ) и пропана (C 3 H
2 8) не существуют в доизомерных изомерах формы, потому что есть только один способ расположить атомы в каждой формуле так, чтобы каждый атом углерода имел четыре связи.
Примечание
Непрерывную (неразветвленную) цепь атомов углерода часто называют прямой цепью , хотя тетраэдрическое расположение каждого атома углерода придает ей зигзагообразную форму. Алканы с прямой цепью иногда называют нормальными алканами , а их именам дают префикс n -. Например, бутан называется n -бутан.
Упражнения по обзору концепцииМожет ли в алканах быть двухуглеродная ветвь от второго атома углерода четырехуглеродной цепи? Объяснять.
Студента просят написать структурные формулы двух различных углеводородов, имеющих молекулярную формулу C 5 H 12 . Она пишет одну формулу со всеми пятью атомами углерода в горизонтальной линии, а другую с четырьмя атомами углерода в линии, с группой CH 3 , идущей вниз от первого присоединенного к третьему атому углерода. Представляют ли эти структурные формулы разные молекулярные формулы? Объясните, почему да или почему нет.

Нет; ответвление составило бы самую длинную непрерывную цепь из пяти атомов углерода.
Нет; обе представляют собой пятиуглеродные непрерывные цепи.
- Алканы с четырьмя и более атомами углерода могут существовать в изомерных формах.
Кратко укажите важные различия между алканом с прямой цепью и алканом с разветвленной цепью.
Нарисуйте структурные изомеры следующих алканов.
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
CH 3 CH 2 CH 2 CH 3 и
CH 3 CH 2 CH 2 CH 2 CH 3 и
Алканы с прямой цепью и алканы с разветвленной цепью имеют разные свойства, а также разную структуру.

Напишите сокращенную структурную формулу для каждой структурной формулы.
Сокращенная структурная формула изогексана может быть записана как (CH 3 ) 2 CHCH 2 CH 2 CH 3 . Нарисуйте формулу угла линии для изогексана.
Нарисуйте формулу линии-угла для соединения CH 3 CH 2 CH(CH 3 )CH 2 CH 2 CH 3 .
Назовите структурную формулу соединения, представленного этой формулой угла линии:
(наверх)
Циклоалканы
Циклоалканы очень важны для компонентов продуктов питания, фармацевтических препаратов и многого другого.
 Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.Источник: Википедия
Для образования некоторых циклоалканов угол между связями должен отклоняться от этого идеального угла, эффект, известный как угловая деформация .Кроме того, некоторые атомы водорода могут приблизиться друг к другу ближе, чем это желательно (затмить себя), эффект, называемый деформацией кручения . Эти дестабилизирующие эффекты, угловая деформация и деформация при кручении вместе известны как кольцевая деформация .
 Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.Рисунок 7.6. Репрезентативные циклоалкановые структуры. Указаны средние валентные углы и энергия деформации.
Для вашего здоровья: циклопропан в качестве анестетикаЦиклопропан с температурой кипения -33°C представляет собой газ при комнатной температуре.
(наверх) Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Классификация углеродных связейАтомы углерода, участвующие в химических связях внутри молекулы, можно классифицировать на основе количества образующихся углерод-углеродных связей.
- первичный атом углерода : один соседний атом углерода
- вторичный атом углерода : два соседа углерода
- третичный атом углерода : три соседа углерода
- четвертичный атом углерода : четыре соседа углерода
Число соседей углерода, которое имеет атом углерода, может помочь определить реакционную способность этого положения углерода. Таким образом, важно уметь распознавать, является ли атом углерода первичным, вторичным, третичным или четвертичным по своей структуре (рис.
 7.7).
7.7).Рисунок 7.7. Классификация атомов углерода на первичные, вторичные, третичные и четвертичные. В приведенных выше молекулах центральный углерод оценивается по количеству атомов углерода, которые связаны непосредственно с центральным углеродом. Первичный углерод связан с одним углеродом, вторичный углерод связан с двумя атомами углерода, третичный углерод связан с тремя атомами углерода, а четвертичный углерод связан с четырьмя атомами углерода.
В любой данной молекуле каждый атом углерода может быть классифицирован (рис.7.8).
Рисунок 7.8. Классификация атомов углерода в молекуле
(наверх)
7.3 Свойства алкановАлканы — это простейшее семейство углеводородов — соединений, содержащих только углерод и водород только с углерод-водородными связями и углерод-углеродными одинарными связями. Алканы не очень реакционноспособны и обладают небольшой биологической активностью; все алканы бесцветны и не имеют запаха.
 Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.
Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.В таблице 7.3 описаны некоторые свойства некоторых из первых 10 алканов с прямой цепью. Почти все алканы имеют плотность менее 1,0 г/мл и, следовательно, менее плотны, чем вода (плотность H 2 O равна 1.00 г/мл при 20°C).
Таблица 7.3 Физические свойства некоторых алканов
Взгляд поближе: плотность газа и пожароопасностьТаблица 7.3 показывает, что первые четыре члена ряда алканов являются газами при обычных температурах. Природный газ состоит в основном из метана, который имеет плотность около 0,67 г/л. Плотность воздуха составляет около 1,29 г/л. Поскольку плотность природного газа меньше плотности воздуха, он поднимается вверх.
(наверх) Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Температуры плавления и кипенияКак температуры плавления, так и температуры кипения алканов характеризуют межмолекулярные силы, возникающие между молекулами. Разница электроотрицательностей между углеродом и водородом (2,1 – 1,9 = 0,2) невелика; поэтому связь C-H неполярна, а это означает, что единственными притяжениями между одной молекулой и ее соседями будут лондонские дисперсионные силы.
 Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые переходы). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые переходы). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .Рисунок 7.9. Температуры плавления и кипения алканов с прямой цепью
Адаптировано из: Techstepp
Что касается изомеров, чем более разветвлена цепь, тем ниже температура кипения. Лондонские дисперсионные силы меньше для более коротких молекул и действуют только на очень коротких расстояниях между одной молекулой и ее соседями.
 Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
(наверх) РастворимостьАлканы (как нормальные, так и циклоалканы) практически нерастворимы в воде, но растворяются в органических растворителях. Жидкие алканы являются хорошими растворителями для многих других ковалентных соединений.При растворении молекулярного вещества в воде должно происходить следующее:
- нарушение межмолекулярных сил внутри вещества. В случае алканов это лондонские дисперсионные силы.
- разрыв межмолекулярных сил в воде, чтобы вещество могло поместиться между молекулами воды.
 В воде основным межмолекулярным притяжением являются водородные связи.
В воде основным межмолекулярным притяжением являются водородные связи.
Для устранения любого из этих притяжений требуется энергия, хотя количество энергии, необходимое для разрушения лондонских дисперсионных сил в соединении, таком как метан, относительно незначительно; это не относится к водородным связям в воде.Напомним, что водородные связи намного прочнее.
Проще говоря, вещество растворяется, если при образовании новых связей между веществом и водой высвобождается достаточно энергии, чтобы компенсировать энергию, необходимую для разрушения первоначальных притяжений. Единственным новым притяжением между алканом и молекулами воды являются лондонские дисперсионные силы. Эти силы не выделяют достаточного количества энергии, чтобы компенсировать энергию, необходимую для разрыва водородных связей в воде.Следовательно, алкан не растворяется, как показано на рисунке 7.10.
Рисунок 7.10. Углеводороды с длинной цепью нерастворимы в воде.
Растворимость в органических растворителях Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.
Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.В большинстве органических растворителей основными силами притяжения между молекулами растворителя являются лондонские дисперсионные силы. Следовательно, когда алкан растворяется в органическом растворителе, лондонские дисперсионные силы разрушаются и заменяются новыми лондонскими дисперсионными силами между смесью. Два процесса более или менее энергетически компенсируют друг друга; таким образом, нет никаких препятствий для растворимости.
(наверх)
Свойства алканов и опасность для окружающей среды: подробный обзорИз-за растворимости и плотности алканов разливы нефти в океан или другие водоемы могут иметь разрушительные последствия для окружающей среды.
 Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.
Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.Рисунок 7.11 Разливы нефти. Сырая нефть покрывает поверхность воды в Мексиканском заливе после того, как нефтяная платформа Deepwater Horizon затонула в результате взрыва. Утечка произошла на милю ниже поверхности, что затрудняет оценку размера разлива. Один литр нефти может создать пятно размером 2,5 га (6,3 акра). Этот и подобные разливы служат напоминанием о том, что углеводороды и вода не смешиваются.
Источник: Фото предоставлено NASA Goddard / MODIS Rapid Response Team.
Упражнения по обзору концепции
Угадайте, не обращаясь к таблице, что имеет более высокую температуру кипения — гексан или додекан. Объяснять.
Если к 100 мл воды в стакане добавить 25 мл гексана, что из следующего вы ожидаете? Объяснять.
- Гексан растворяется в воде.
- Гексан не растворялся в воде и всплывал на поверхность.
- Гексан не растворяется в воде и оседает на дно контейнера.
додекан из-за его большей молекулярной массы
б; гексан нерастворим в воде и менее плотен, чем вода.
- Алканы представляют собой неполярные соединения с низкой температурой кипения и нерастворимы в воде.
Не обращаясь к таблице или другому справочнику, предскажите, какой член каждой пары имеет более высокую температуру кипения.

- пентан или бутан
- гептан или нонан
Для какого члена каждой пары гексан является хорошим растворителем?
- пентан или вода
- хлорид натрия или соевое масло
(наверх) 7.4 Химическая активность алкановАлканы содержат прочные углерод-углеродные одинарные связи и прочные углерод-водородные связи. Обе эти связи неполярны. Следовательно, нет части молекулы, которая несет значительное количество положительного или отрицательного заряда, необходимого для притяжения к ней других ионных и полярных молекул. Поэтому алканы обычно не реагируют с ионными соединениями, такими как большинство лабораторных кислот, оснований, окислителей или восстановителей.Рассмотрим бутан в качестве примера:
Ни положительные, ни отрицательные ионы не притягиваются к неполярной молекуле. На самом деле алканы вступают в так мало реакций, что их иногда называют парафинами , от латинского parum affinis , что означает «малое сродство».

В результате алканы обладают очень низкой реакционной способностью и подвергаются только трем основным типам реакций, включая следующие:
- Реакции горения – сжечь их – уничтожить всю молекулу;
- Реакции галогенирования (типа замещения) – реагируют с некоторыми галогенами, разрывая углерод-водородные связи;
- Реакции крекинга – используют тепло и/или катализатор для крекинга алканов, разрывая углерод-углеродные связи.
Реакции горенияГорение соединений углерода, особенно углеводородов, было самым важным источником тепловой энергии для человеческих цивилизаций на протяжении всей истории человечества. Практическое значение этой реакции нельзя отрицать, но массовые и неконтролируемые химические изменения, происходящие при горении, затрудняют вывод механизмов. Используя в качестве примера горение пропана, мы видим из следующего уравнения, что каждая ковалентная связь в реагентах была разорвана, и в продуктах образовался совершенно новый набор ковалентных связей.
 Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.CH 3 CH 2 CH 3 + 5O 2 → 3CO 2 + 4H 2 O + нагрева
Обратите внимание, что в приведенной выше реакции соединения с левой стороны стрелки называются субстратами или реагентами , а соединения с правой стороны стрелки являются продуктами реакции.Энергия, чаще всего выделяющаяся в виде тепла, может быть либо субстратом, либо продуктом реакции, в зависимости от участвующих соединений. Также обратите внимание, что ни один из атомов не теряется в данных химических уравнениях. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Таким образом, уравнение должно быть сбалансированным и иметь такое же количество атомов в левой части уравнения, как и в правой.
 Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.Химические связи также обладают потенциальной энергией. Если вы думаете о природе связи, она удерживается вместе энергией притяжения. Для разрыва связей на стороне реагента в уравнении требуется энергия, в то время как образование связей на стороне продукта высвобождает энергию.Если энергия, выделяемая при образовании связи, выше, чем энергия, необходимая для диссоциации связи, в результате реакции будет выделяться энергия. Эта энергия обычно измеряется как теплота реакции, которая называется энтальпией .
В отношении этой реакции важны два момента:
- Поскольку все ковалентные связи в молекулах реагентов разорваны, количество теплоты, выделяющейся в этой реакции, связано с прочностью этих связей (и, конечно, с прочностью связей, образующихся в продуктах).
 Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения).
Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения). - Также важна стехиометрия реагентов. Если подается недостаточно кислорода, некоторые из продуктов будут состоять из менее окисленного газообразного монооксида углерода (СО).
Например, если бы присутствовало только 4 моля кислорода, при сгорании одного моля пропана образовался бы только 1 моль двуокиси углерода и 2 моля моноксида углерода.
CH 3 CH 2 CH 3 + 4O 2 → CO 2 + 2CO + 4H 2 O + тепло
Бонд ЭнерджисАтомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем те, которыми они обладают как отдельные атомы. Количество энергии, равное разности энергий связанных атомов и энергий разъединенных атомов, выделяется обычно в виде тепла.
 То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию. Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, образующие другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
2H 2 O → 2H 2 + O 2
Для разрыва связи всегда требуется энергия, известная как энергия связи .Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы. Его можно использовать для определения наиболее подходящей точечной структуры Льюиса при наличии нескольких точечных структур Льюиса.
Основные выводы:- Для разрыва связи всегда требуется энергия.
- Энергия всегда высвобождается при создании связи.

Хотя каждая молекула имеет свою характеристическую энергию связи, возможны некоторые обобщения.Например, хотя точное значение энергии связи С–Н зависит от конкретной молекулы, все связи С–Н имеют энергию связи примерно одинакового значения, поскольку все они являются связями С–Н. Чтобы разорвать 1 моль связи С-Н, требуется примерно 100 ккал энергии, поэтому мы говорим об энергии связи связи С-Н, равной примерно 100 ккал/моль. Связь C – C имеет приблизительную энергию связи 80 ккал / моль, а C = C имеет энергию связи около 145 ккал / моль. Мы можем рассчитать более общую энергию связи, найдя среднее значение энергии связи конкретной связи в разных молекулах, чтобы получить среднюю энергию связи.В таблице 7.2 приведен список средних энергий связи для обычных органических связей. Помните, что энергия может быть выражена в ккал или кДж и что коэффициент преобразования между ними составляет: 4,184 кДж = 1 ккал
.Таблица 7.  4: Средняя энергия связи (кДж/моль)
4: Средняя энергия связи (кДж/моль) Одинарные облигации Множественные облигации H—H 432
Н-Н 391
Я—Я 149
С = С 614
В—Ж 565
Н—Н 160
I—Кл 208
С ≡ С 839
H—Cl 427
Н—Ф 272
И—Бр 175
О = О 495
H—Br 363
N—Cl 200
С = О* 745
H—I 295
Н—Бр 243
Ш-В 347
С ≡ О 1072
№ 201
С-Ф 327
Н = О 607
С—Н 413
О—Н 467
S—Cl 253
Н = Н 418
К—К 347
О—О 146
С—Бр 218
Н ≡ Н 941
C—N 305
О—Ф 190
С—С 266
С ≡ N 891
С—О 358
О—Cl 203
С = Н 615
C—F 485
О—Я 234
Si—Si 340
C—Cl 339
Si—H 393
C—Br 276
Ф—Ф 154
Si-C 360
С—Я 240
F—Кл 253
Si-O 452
К—С 259
Ф—Бр 237
Кл—Кл 239
Кл—Бр 218
Бр—Бр 193
*C = O in (CO 2 ) = 799
Когда связь прочная, энергия связи выше, поскольку для ее разрыва требуется больше энергии.
 Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Разрыв и формирование связиКогда происходит химическая реакция, атомы реагентов перестраивают свои химические связи, образуя продукты. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах.Поэтому, когда происходят химические реакции, всегда будет сопровождать изменение энергии . Изменение энергии реакции или теплоты реакции называется энтальпией . Он представлен математическим символом ΔH и рассчитывается как разница между энергией, необходимой для разрыва связей реагентов, и энергией, высвобождаемой при образовании связей в продуктах.
ΔH = энергия реагентов – энергия продуктов
Рис. 7.12: Энтальпия реакции.
 (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
(верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.В некоторых реакциях энергия образующихся продуктов ниже энергии реагентов. Таким образом, в ходе реакции избыточная энергия, выделяемая при образовании продукта, будет выделяться в окружающую среду.Такие реакции являются экзотермическими и могут быть представлены диаграммой уровней энергии на рисунке 7.12 (вверху). В большинстве случаев энергия выделяется в виде тепла (хотя в некоторых реакциях энергия выделяется в виде света). В химических реакциях, где продукты имеют более высокую энергию, чем реагенты, реагенты должны поглощать энергию из окружающей среды, чтобы иметь возможность реагировать. Эти реакции являются эндотермическими и могут быть представлены диаграммами энергетических уровней, подобными рис.
 7.12 (ниже).
7.12 (ниже).Экзотермические и эндотермические реакции можно рассматривать как имеющие энергию либо как «продукт» реакции, либо как «реагент» соответственно.Экзотермические реакции высвобождают энергию, поэтому энергия является продуктом. Эндотермические реакции требуют энергии, поэтому энергия является реагентом.
Экзотермические реакции будут иметь отрицательную общую энтальпию, а эндотермические реакции будут иметь положительную общую энтальпию.
ΔH = энергия реагентов – энергия продуктов
Энергия реакции может рассматриваться стехиометрически в рамках реакции точно так же, как любое из соединений в реакции.При сгорании метана CH 4 каждый сожженный моль выделяет 824 кДж энергии. Таким образом, легко подсчитать, сколько энергии высвобождается при сгорании любого количества CH 4 . Мы также можем легко подсчитать, сколько CO 2 образуется на каждый моль сгоревшего CH 4 , поскольку на каждый моль сгоревшего CH 4 производится один моль CO 2 .
(наверх)
Полное сгорание (при достаточном количестве кислорода) любого углеводорода дает углекислого газа (CO 2 ) и воды (H 2 O) .Очень важно, чтобы вы могли написать правильно сбалансированные уравнения для этих реакций, потому что они часто возникают как часть термохимических расчетов. Некоторые легче, чем другие. Например, алканы с четным числом атомов углерода немного тверже, чем с нечетным!
Пример 1: сжигание пропана
Например, с пропаном (C 3 H 8 ) вы можете сбалансировать углерод и водород, записывая уравнение.Ваш первый черновик будет:
C 3 H 8 + ?O 2 → 3CO 2 + 4H 2 O
Подсчет кислорода приводит непосредственно к окончательной версии:
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
Пример 2: сжигание бутана
С бутаном (C 4 H 10 ) вы можете снова сбалансировать углерод и водород, записывая уравнение.

C 4 H 10 + ?O 2 → 4CO 2 + 5H 2 O
Подсчет кислорода приводит к небольшой проблеме — 13 справа. Наличие нечетного количества кислорода на стороне продукта делает невозможным балансирование с четным числом на стороне реагента. В подобных случаях начните пытаться сбалансировать уравнение, изменив кофактор перед алканом на 2. Затем сбалансируйте углерод и водороды на стороне продукта.В этом случае число кислорода должно стать положительным, и теперь вы сможете сбалансировать уравнение.
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
Углеводороды труднее воспламеняются по мере того, как молекулы становятся больше. Это связано с тем, что более крупные молекулы не так легко испаряются — реакция идет намного лучше, если кислород и углеводород хорошо перемешаны в виде газов. Если жидкость не очень летучая, только те молекулы, которые находятся на поверхности, могут реагировать с кислородом.
 Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.При полном сгорании все углеводороды будут гореть синим пламенем. Однако сгорание имеет тенденцию быть менее полным по мере увеличения числа атомов углерода в молекулах. Это означает, что чем крупнее углеводород, тем больше вероятность того, что вы получите желтое дымное пламя.
Неполное сгораниеНеполное сгорание (при недостатке кислорода) может привести к образованию углерода или монооксида углерода.Проще говоря, водород в углеводороде получает первый шанс на образование воды в продукте, а углерод получает все, что осталось! Когда образуется только углерод, присутствие светящихся частиц углерода в пламени окрашивает его в желтый цвет, а в дыме часто виден черный углерод. Если некоторое количество кислорода может взаимодействовать с углеродом, но недостаточно для образования двуокиси углерода (CO 2 ), тогда образуется окись углерода (CO) в виде бесцветного ядовитого газа.

Почему угарный газ ядовит: Кислород переносится кровью гемоглобином, белком, содержащимся в красных кровяных тельцах.Углекислый газ также связывается с гемоглобином. Гемоглобин переносит кислород из легких в каждую клетку вашего тела, где он выделяет кислород, собирает углекислый газ и переносит его обратно в легкие. Затем гемоглобин заменяет углекислый газ на кислород в воздухе, которым вы дышите. Когда вы выдыхаете, вы выделяете углекислый газ. Угарный газ также может связываться с гемоглобином. Разница в том, что монооксид углерода связывается необратимо (или очень сильно), что делает эту конкретную молекулу гемоглобина бесполезной для переноса кислорода.Если вы вдохнете достаточно угарного газа, вы умрете от внутреннего удушья!
Теплота сгоранияТеплота сгорания, ΔH c , определяется как полная энергия, выделяемая в виде тепла, когда вещество подвергается полному сгоранию с кислородом при наборе стандартных условий. Он рассчитывается так же, как и энтальпия, однако он специфичен для набора стандартных условий.
. Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:БТЕ/фунт = (кДж/кг)*2,326
Теплота сгорания, ΔHc, значения общих источников топлива и связанные с ними выбросы CO2 указаны в таблице 7.5
Таблица 7.5 Профиль теплоты сгорания и выбросов CO2 для обычных видов топливаАдаптировано из: EPA – (2014) и Википедии – Теплота сгорания
Нефть (от греческого: петра: «камень» + олеум : «нефть») — это природная жидкость от желтого до черного цвета, встречающаяся в геологических формациях под поверхностью Земли, которая обычно перерабатывается в различные типы.
 топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).Компоненты нефти разделяют по размеру с помощью метода, называемого фракционной перегонкой. Полученные образцы включают бензин с алканами длиной от пяти до десяти атомов углерода и керосин со смесью алканов длиной от десяти до семнадцати атомов углерода.
Для обсуждения: Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.Подсчитано, что в зимние месяцы в Орегоне для обогрева среднего хорошо изолированного дома требуется около 40 БТЕ в час на квадратный фут.
 Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
(наверх)
Реакции галогенирования (тип замещения)В присутствии тепла или света алканы могут реагировать с галогенами с образованием алкилгалогенидов (или галогеналканов). Этот тип реакции называется реакцией замещения , поскольку атом галогена занимает место (или замещает) один из атомов водорода в структуре алкана. Следует отметить, что не все галогены одинаково реагируют с алканами.
- Реакция между алканами и фтором: Эта реакция взрывоопасна даже на холоде и в темноте, и вы скорее получите углерод и фтористый водород, чем желаемую реакцию замещения.
 Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
CH 4 + F 2 → CH 3 F + HF
Но реакция идет так быстро, что вот результат:
CH 4 + 2F 2 → C + 4HF
- Реакция между алканами и йодом: Йод никак не реагирует с алканами – по крайней мере, в нормальных лабораторных условиях.Так что эта реакция тоже бесполезна.
- Реакции между алканами и хлором или бромом: В темноте реакции не происходит, но при наличии света и тепла реакция приведет к образованию желаемых алкилгалогенидов. Таким образом, мы сосредоточим наше обсуждение на реакциях галогенирования с хлором и бромом.
В присутствии пламени реакции подобны реакции с фтором – образуется смесь углерода и галогеноводорода.
 Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.В реакции замещения атом водорода в метане заменяется атомом хлора. Это может происходить несколько раз, пока не будут заменены все атомы водорода.В конечном счете, чем дольше протекает реакция, тем больше атомов водорода в алкане заменяется. Таким образом, вы получите смесь хлорметана (CH 3 Cl), дихлорметана (CH 2 Cl 2 ), трихлорметана (CHCl 3 ) и тетрахлорметана (CCl 4 ).
Исходная смесь бесцветного газа (CH 4 ) и зеленого газа (Cl 2 ) должна производить пары хлористого водорода (HCl) и туман органических жидкостей (смесь хлорированного метана).
 Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.Эта реакция замещения является примером радикальной реакции, когда за один раз переносится только один электрон. Тепло или свет инициируют реакцию, разрывая связь между двумя атомами Cl в ионе хлорида. Это образует два радикала . Радикал – это атом, молекула или ион с неспаренными валентными электронами.Таким образом, они очень нестабильны и реактивны. На приведенной ниже диаграмме показана первая стадия реакции галогенирования. Это называется посвящением .
Инициирующая реакцияКак только радикал инициируется, он атакует алкан, в данном случае метан (CH 4 ), и создает новый углеродный радикал. Эта стадия реакции называется размножением , поскольку один вид радикала создает или размножает другой радикал.
Реакция распространения
Заключительной стадией радикальной реакции является реакция обрыва , которая гасит присутствующие радикальные частицы. Для реакции метан-хлор это образование хлорметана (CH 3 Cl).
Реакция завершенияТаким образом, радикальные реакции протекают в три стадии:
- Инициирование — , при котором образуются радикалы, как правило, под действием тепла, света или другого каталитического процесса.
- Размножение — , когда один вид радикалов взаимодействует с другой молекулой с образованием другого вида радикалов.
- Прекращение – , когда два вида радикалов взаимодействуют и гасят радикальную реакцию, образуя стабильный продукт.
Как видно из примера с метаном, если вы галогенируете более крупные алканы, вы снова получите смесь продуктов замещения, но стоит просто кратко взглянуть на то, что происходит, если замещается только один из атомов водорода (монозамещение) — просто чтобы показать что все не так просто, как кажется! Например, с пропаном можно получить один из двух изомеров:
.
Если бы случай был единственным фактором, вы бы ожидали получить в три раза больше изомера с хлором на конце.Есть 6 атомов водорода, которые могут быть заменены на концевых атомах углерода, по сравнению только с двумя в середине. На самом деле вы получаете примерно одинаковое количество каждого из двух изомеров. Если вы используете бром вместо хлора, большая часть продукта образуется там, где бром присоединен к центральному атому углерода. Почему это происходит?
Это связано со стабильностью промежуточного углеродного радикала, который образуется во время реакции. Углерод, который имеет больше углеродных соседей, будет легче терять водород и образовывать промежуточный углеродный радикал.Соседние атомы углерода, будучи больше, чем соседние атомы водорода, могут помочь стабилизировать образование углеродного радикала. Таким образом, в реакции галогенирования третичные углероды будут наиболее реакционноспособными, за ними следуют вторичные углероды и, наконец, первичные углероды.
 Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Реакции галогенирования с циклоалканамиРеакции циклоалканов, как правило, такие же, как и у алканов, с атомами водорода в циклической кольцевой структуре, замененными атомом галогена.Например, в присутствии УФ-излучения циклопропан будет вступать в реакцию замещения с хлором или бромом точно так же, как нециклический алкан.
Однако небольшие кольцевые структуры, особенно циклопропан, также обладают способностью реагировать в темноте. В отсутствие УФ-света циклопропан может вступать в реакции присоединения, в которых цикл разрывается. Например, с бромом циклопропан дает следующее линейное соединение.
Это все еще может происходить в присутствии УФ-излучения, но вы также получите смесь реакций замещения.Кольцо сломано, потому что циклопропан сильно страдает от деформации кольца.
Упражнения по обзору концепции Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.
Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.Почему алканы иногда называют парафинами?
Какой галоген наиболее легко реагирует с алканами? Что реагирует наименее легко?
Алканы не реагируют со многими обычными химическими веществами.Иногда их называют парафинами, от латинского parum affinis , что означает «мало родства».
наиболее легко: F 2 ; наименее охотно: I 2
Большое количество интересных и часто полезных соединений имеют один или несколько атомов галогена на молекулу. Например, метан (СН 4 ) может реагировать с хлором (Cl 2 ), заменяя один, два, три или все четыре атома водорода на атомы Cl.
Таблица 7.6: Некоторые галогенированные углеводороды Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.
Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.
Для вашего здоровья: галогенированные углеводородыКогда-то широко использовавшиеся в потребительских товарах, многие хлорированные углеводороды считаются канцерогенами (веществами, вызывающими рак), а также известно, что они вызывают серьезные повреждения печени. Примером может служить четыреххлористый углерод (CCl 4 ), который когда-то использовался в качестве растворителя для химической чистки и в огнетушителях, но больше не рекомендуется ни для того, ни для другого.Даже в небольших количествах его пары могут вызвать серьезное заболевание при длительном воздействии. Кроме того, он реагирует с водой при высоких температурах с образованием смертоносного газа фосгена (COCl 2 ), что делает использование CCl 4 в огнетушителях особенно опасным.

Этилхлорид, напротив, используется в качестве наружного местного анестетика. При распылении на кожу он быстро испаряется, охлаждая участок настолько, что он становится нечувствительным к боли. Его также можно использовать в качестве экстренного общего анестетика.
Бромсодержащие соединения широко используются в огнетушителях и в качестве антипиренов для одежды и других материалов. Поскольку они также токсичны и оказывают неблагоприятное воздействие на окружающую среду, ученые занимаются разработкой более безопасных заменителей для них, как и для многих других галогенсодержащих соединений.
Для вашего здоровья: хлорфторуглероды и озоновый слойАлканы, замещенные атомами фтора (F) и хлора (Cl), использовались в качестве диспергирующих газов в аэрозольных баллончиках, в качестве пенообразователей для пластмасс и в качестве хладагентов.Два наиболее известных из этих хлорфторуглеродов (ХФУ) перечислены в таблице 7.
 6.
6.Хлорфторуглероды способствуют возникновению парникового эффекта в нижних слоях атмосферы. Они также диффундируют в стратосферу, где разрушаются ультрафиолетовым (УФ) излучением с высвобождением атомов Cl. Они, в свою очередь, разрушают молекулы озона (O 3 ), которые защищают Землю от вредного ультрафиолетового излучения. Действия во всем мире привели к сокращению использования ХФУ и родственных соединений. ХФУ и другие хлор- или бромсодержащие озоноразрушающие соединения заменяются более безопасными веществами.Одной из альтернатив являются гидрофторуглероды (ГФУ), такие как CH 2 FCF 3 , которые не содержат Cl или Br для образования радикалов. Другим примером являются гидрохлорфторуглероды (ГХФУ), такие как CHCl 2 CF 3 . Молекулы ГХФУ легче разрушаются в тропосфере, и меньше озоноразрушающих молекул достигает стратосферы.
Рисунок 7.13. Истощение озонового слоя в верхних слоях атмосферы.
 Озон в верхних слоях атмосферы защищает поверхность Земли от солнечного УФ-излучения, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и фиолетовые области в центре) представляют собой большие области значительного истощения озонового слоя. Они встречаются в основном над Антарктидой с конца августа по начало октября и заполняются примерно в середине ноября. Истощение озонового слоя также было отмечено в арктических регионах. Самая большая из когда-либо наблюдаемых озоновых дыр образовалась 24 сентября 2006 года.
Озон в верхних слоях атмосферы защищает поверхность Земли от солнечного УФ-излучения, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и фиолетовые области в центре) представляют собой большие области значительного истощения озонового слоя. Они встречаются в основном над Антарктидой с конца августа по начало октября и заполняются примерно в середине ноября. Истощение озонового слоя также было отмечено в арктических регионах. Самая большая из когда-либо наблюдаемых озоновых дыр образовалась 24 сентября 2006 года.
Крекинг-алканыЧто трещит? Крекинг — это название, данное разбиению больших молекул углеводородов на более мелкие и более полезные фрагменты.Это достигается за счет использования высоких катализатора высокого давления и температуры или более низких температур и давлений в присутствии катализатора .
 Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.
Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.Источником больших молекул углеводородов часто является фракция нафты или фракция газойля, образующаяся при фракционной перегонке сырой нефти (нефти).Эти фракции получают в процессе дистилляции в виде жидкостей, но перед крекингом повторно испаряют в газообразную фазу. В взломщике не происходит ни одной уникальной реакции. Молекулы углеводородов распадаются довольно случайным образом, образуя смеси более мелких углеводородов, некоторые из которых имеют двойные углерод-углеродные связи. Одной из возможных реакций с участием углеводорода C 15 H 32 может быть:
C 15 H 32 → 2C 2 H 4 + C 3 H 6 + C 8 902 3 H 190
Или, более ясно показывая, что происходит с различными атомами и связями:
Это только один из способов распада данной конкретной молекулы.
 Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для производства пластмасс или других органических химикатов. Октан является одной из молекул, обнаруженных в бензине (бензине).
Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для производства пластмасс или других органических химикатов. Октан является одной из молекул, обнаруженных в бензине (бензине).
Взгляд поближе: Алкановая основа свойств других соединенийПонимание физических свойств алканов важно, поскольку нефть и природный газ, а также многие продукты, получаемые из них — бензин, газ в баллонах, растворители, пластмассы и т. д. — состоят в основном из алканов.Это понимание важно еще и потому, что оно является основой для описания свойств других семейств органических и биологических соединений. Например, большая часть структур липидов состоит из неполярных алкильных групп. Липиды включают пищевые жиры и жироподобные соединения, называемые фосфолипидами и сфинголипидами, которые служат структурными компонентами живых тканей.
 Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.Эта характеристика необходима для избирательной проницаемости клеточных мембран.
Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.Эта характеристика необходима для избирательной проницаемости клеточных мембран.Рисунок 7.13 Сравнение липидов и алканов. Трипальмитин (а), типичная молекула жира, имеет длинные углеводородные цепи, типичные для большинства липидов. Сравните эти цепи с гексадеканом (б), алканом с 16 атомами углерода.
(наверх)
7.5 Краткое содержание главыЧтобы убедиться, что вы поняли материал этой главы, вы должны просмотреть значения следующих выделенных жирным шрифтом терминов в резюме и спросить себя, как они относятся к темам этой главы.
Органическая химия — химия соединений углерода, а неорганическая химия — химия всех остальных элементов. Атомы углерода могут образовывать прочные ковалентные связи с другими атомами углерода и с атомами других элементов, и это свойство позволяет образовывать десятки миллионов органических соединений.
 Углеводороды содержат только атомы водорода и углерода.
Углеводороды содержат только атомы водорода и углерода.Углеводороды, в которых каждый атом углерода связан с четырьмя другими атомами, называются алканами или насыщенными углеводородами .Они имеют общую формулу C n H 2 n + 2 . Любой данный алкан отличается от следующего в ряду на единицу CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором, называется гомологическим рядом .
Атомы углерода в алканах могут образовывать прямые или разветвленные цепи. Два или более соединений, имеющих одинаковую молекулярную формулу, но разные структурные формулы, являются изомерами друг друга.Для трех самых маленьких алканов нет изомерных форм; начиная с C 4 H 10 все остальные алканы имеют изомерные формы.
Циклоалканы представляют собой углеводороды, молекулы которых представляют собой замкнутые кольца, а не прямые или разветвленные цепи.
 Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.Напомним, что структурная формула показывает все атомы углерода и водорода и то, как они связаны друг с другом. Сокращенная структурная формула показывает атомы водорода рядом с атомами углерода, к которым они присоединены.Формула угла линии — это формула, в которой атомы углерода подразумеваются в углах и концах линий. Подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать каждому атому углерода четыре связи
Физические свойства алканов отражают тот факт, что молекулы алканов неполярны. Алканы нерастворимы в воде и менее плотны, чем вода.
Алканы обычно не вступают в реакцию с лабораторными кислотами, основаниями, окислителями и восстановителями.Они горят (проходят реакции горения ).
Алканы реагируют с галогенами, замещая атомы водорода одним или несколькими атомами галогена с образованием галогенированных углеводородов.
 Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена.
Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена.Более крупные алканы можно разбить на более мелкие алканы и алкены с помощью высокой температуры или катализаторов.Эти реакции называются реакциями крекинга .
(наверх)
7.6 Упражнения в конце главыВы нашли банку без этикетки, содержащую твердое вещество, плавящееся при 48°C. Он легко воспламеняется и легко горит. Вещество нерастворимо в воде и плавает на поверхности. Является ли вещество органическим или неорганическим?
В чем опасность проглатывания жидкого алкана?
- Различают более легкие и тяжелые жидкие алканы с точки зрения их воздействия на кожу.
Ниже приведена линейная формула алкана.
 Нарисуйте сжатую структуру.
Нарисуйте сжатую структуру.Напишите уравнения полного сгорания каждого соединения.
- бутан, C 4 H 10 (обычная жидкость для зажигалок)
- октан, C 8 H 18 (типичный углеводород в бензине).
Плотность образца бензина 0,690 г/мл. На основе полного сгорания октана рассчитайте количество в граммах двуокиси углерода (CO 2 ) и воды (H 2 O), образующихся на галлон (3.78 л) бензина при использовании в автомобиле.
Нарисуйте структуры четырех из девяти изомерных гексанов (C 7 H 16 ).
Укажите, представляют ли структуры в каждом наборе одно и то же соединение или изомеры.
Рассмотрите приведенные здесь формулы линейного угла и ответьте на вопросы.
- Какая пара формул представляет изомеры? Нарисуйте каждую структуру.

- Какая формула представляет алкилгалогенид? Напишите его сокращенную структурную формулу.
- Какая формула представляет собой циклический алкан?
- Это молекулярная формула соединения, представленного (i)?
- Какая пара формул представляет изомеры? Нарисуйте каждую структуру.
(наверх) 7.7 Каталожные номераТекст для этой главы был адаптирован из ресурсов Creative Commons, перечисленных ниже, если в тексте не указано иное.
- Органическая химия (2016) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.libretexts.org/Core/Organic_Chemistry .
- Ингалант. (2017, 12 февраля). В Википедии , Свободной энциклопедии . Получено 01:21, 13 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Inhalant&oldid=765135147 .
- Аноним. (2012) Введение в химию: общая, органическая и биологическая (V1.
 0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html .
0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html . - Физическая и теоретическая химия (2017) Libretexts, UC Дэвис, Лицензия: Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License. Доступно по адресу: https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies.
- Нефть. (2017, 14 февраля). В Википедии , Свободной энциклопедии . Получено 06:29, 16 февраля 2017 г., с https://en.wikipedia.org/w/index.php?title=Petroleum&oldid=765440823 .
- Болл, Д.В., Хилл, Дж.В., и Скотт, Р.Дж. (2016) КАРТА: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
Правило А-2.
 Насыщенные соединения с разветвленной цепью и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ) Правило A-2. Насыщенные соединения с разветвленной цепью и одновалентные радикалы (аЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ)
Насыщенные соединения с разветвленной цепью и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ) Правило A-2. Насыщенные соединения с разветвленной цепью и одновалентные радикалы (аЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ)Перенесите возможности именования IUPAC на свой рабочий стол!
ACD/Name (Chemist Version) предлагает стандартизированный набор функций для быстрого и простого создания имен IUPAC и структур из имен. Это упрощенная версия нашего популярного программного обеспечения ACD/Name.
Ознакомьтесь с полным описанием и ценами в нашем интернет-магазине.
Ациклические углеводороды
Правило A-2. Насыщенные соединения с разветвленной цепью и одновалентные радикалы
2.1 — Насыщенный разветвленный ациклический углеводород называют путем добавления префикса обозначения боковых цепей к названию самой длинной цепи, присутствующей в формула.
Следующие названия сохраняются только для незамещенных углеводородов:Пример к правилу A-2.1
2.Изобутан Изопентан Неопентан Изогексан  2 — Самая длинная цепь пронумерована от одного конца до другого арабскими цифрами, причем направление выбрано таким образом, чтобы сторонам давали наименьшие возможные номера
цепи. Когда ряды локантов, содержащих одинаковое количество терминов, сравниваются почленно, тот ряд является «самым низким», который содержит наименьшее число в случае первого различия. Этот
принцип применяется независимо от природы заместителей.
2 — Самая длинная цепь пронумерована от одного конца до другого арабскими цифрами, причем направление выбрано таким образом, чтобы сторонам давали наименьшие возможные номера
цепи. Когда ряды локантов, содержащих одинаковое количество терминов, сравниваются почленно, тот ряд является «самым низким», который содержит наименьшее число в случае первого различия. Этот
принцип применяется независимо от природы заместителей.
2.25 — Одновалентные разветвленные радикалы, полученные из алканов, называются путем добавления обозначения боковых цепей к названию неразветвленного алкильного радикала, обладающего максимально возможной длиной цепь, начинающаяся с атома углерода со свободной валентностью, при этом указанный атом имеет номер 1.Примеры к правилу A-2.2
Следующие названия могут использоваться только для незамещенных радикалов: 2.Примеры к правилу A-2.25
1-метилпентил 2-метилпентил 5-метилгексил  3 — При наличии двух или более боковых цепей разной природы они указываются в алфавитном порядке.
3 — При наличии двух или более боковых цепей разной природы они указываются в алфавитном порядке.Алфавитный порядок определяется следующим образом:
(i) Названия простых корней сначала располагаются в алфавитном порядке, а затем вставляются умножающие префиксы.
(ii) Считается, что название сложного радикала начинается с первой буквы его полного названия.Примеры к правилу A-2.3(i)
этил указан перед метилом,
, таким образом, 4-этил-3,3-диметилгептан
(iii) В тех случаях, когда названия сложных корней состоят из одинаковых слов, приоритет для цитирования отдается тому радикалу, который содержит младший локант в первой цитируемой точке разница в корне.Примеры к правилу A-2.3(ii)
диметилпентил (как полный один заместитель) обозначен буквой «d» в алфавитном порядке
, таким образом, 7-(1,2-диметилпентил)-5-этилтридекан
2.4 — Если две или более боковых цепей находятся в эквивалентных позициях, меньший номер присваивается той, которая указана первой в названии.Примеры к правилу A-2.3(iii)
2,5 — Наличие одинаковых незамещенных радикалов обозначается соответствующим умножающим префиксом ди-, три-, тетра-, пента-, гекса-, гепта-, окта-, нона-, дека-, ундека, и т. д.Примеры: к правилу A-2.4
Наличие одинаковых радикалов, каждый из которых замещен одинаковым образом, может быть обозначен соответствующим умножающим префиксом бис-, трис-, тетракис-, пентакис-, и т. д. Полное выражение обозначающие такую боковую цепь, могут быть заключены в круглые скобки, или атомы углерода в боковых цепях могут быть обозначены числами со штрихами.Пример к правилу A-2.5(a)

2.6 — Если цепи одинаковой длины конкурируют за выбор в качестве основной цепи в насыщенном разветвленном ациклическом углеводороде, то выбор идет последовательно до:Примеры к правилу A-2.5(b)
(a) Использование круглых скобок и нештрихованных чисел:
5,5-Бис(1,1-диметилпропил)-2-метилдекан
(б) Использование простых чисел:
5,5-бис-1′,1′-диметилпропил-2-метилдекан
(a) Использование круглых скобок и нештрихованных чисел:
7-(1,1-Диметилбутил)-7-(1,1-диметилпентил)тридекан
(б) Использование простых чисел:
7-1′,1′-Диметилбутил-7-1″,1″-диметилпентилтридекан
а) Цепь с наибольшим числом боковых цепей.
(b) Цепь, боковые цепи которой имеют локанты с наименьшими номерами.Пример к правилу A-2.6(a)
в) Цепь с наибольшим числом атомов углерода в меньших боковых цепях.Пример к правилу A-2.
 6(b)
6(b)
(d) Цепь с наименее разветвленными боковыми цепями.Пример к правилу A-2.6(c)
Пример к правилу A-2.6(d)
- Следующий:
- Ненасыщенные соединения и одновалентные радикалы
Двухвалентные и многовалентные радикалы
Это HTML-воспроизведение разделов A, B и C «Синей книги» ИЮПАК максимально приближено к опубликованная версия [см. Номенклатура органической химии, разделы A, B, C, D, E, F и H , Pergamon Press, Oxford, 1979.Copyright 1979 IUPAC.] Если вам нужно процитировать эти правила, укажите эту ссылку в качестве источника.Опубликовано с разрешения IUPAC компанией Advanced Chemistry Development, Inc. , www.acdlabs.
 com, +1(416)368-3435 тел., +1(416)368-5596 факс. Для комментариев или предложений обращайтесь по адресу webmaster@acdlabs.com
com, +1(416)368-3435 тел., +1(416)368-5596 факс. Для комментариев или предложений обращайтесь по адресу webmaster@acdlabs.com7.3: Расчет степени ненасыщенности
Цели
После завершения этого раздела вы сможете
- определяют степень ненасыщенности органического соединения по его молекулярной формуле и, следовательно, определяют количество двойных связей, тройных связей и колец, присутствующих в соединении.
- нарисуйте все возможные изомеры, которые соответствуют данной молекулярной формуле, содержащей только углерод (максимум до шести атомов) и водород.
- нарисуйте определенное количество изомеров, которые соответствуют заданной молекулярной формуле, содержащей углерод, водород и, возможно, другие элементы, такие как кислород, азот и галогены.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенные ниже ключевые термины.
- степень ненасыщенности
- насыщенный
- ненасыщенный
Есть много способов определить структуру неизвестной органической молекулы.
 Хотя ядерный магнитный резонанс (ЯМР) и инфракрасное излучение (ИК) являются основными способами определения молекулярной структуры, расчет степени ненасыщенности является полезной информацией, поскольку он легко дает информацию о молекулярной структуре.
Хотя ядерный магнитный резонанс (ЯМР) и инфракрасное излучение (ИК) являются основными способами определения молекулярной структуры, расчет степени ненасыщенности является полезной информацией, поскольку он легко дает информацию о молекулярной структуре.Насыщенные и ненасыщенные молекулы
Поскольку алканы имеют максимально возможное число атомов Н согласно правилам ковалентных связей, алканы также называют насыщенными углеводородами . Наличие двойной связи приводит к тому, что алкены содержат меньше атомов водорода, чем алкан с таким же числом атомов углерода.Точно так же соединения, содержащие тройные углерод-углеродные связи (R-C≡C-R), называемые алкинами (, обсуждается в главе 9, ), также содержат меньше водорода, чем соответствующий алкан. В совокупности соединения, содержащие меньше атомов водорода, чем алкан с таким же числом атомов углерода, называются ненасыщенными углеводородами . Соотношение между числом атомов углерода (n) и атомами водорода в молекулярной формуле алканов, алкенов и алкинов указано ниже.

Например, трехуглеродный алкан пропан имеет молекулярную формулу C 3 H 8. В то время как ненасыщенные соединения пропен (C 3 H 6 ) и пропин (C 3 H 4 ) содержат меньше атомов водорода. Также важно отметить, что циклоалканы с одним кольцом имеют общую молекулярную формулу C n H 2n , как и алкены. Поскольку они также содержат меньше максимально возможного количества атомов водорода, циклические соединения также считаются ненасыщенными.
Определение степени ненасыщенности
Считается, что каждое кольцо или пи-связь в соединении представляют одну степень ненасыщенности.Способность определять степень ненасыщенности в данном соединении является важным навыком. Каждое из следующих соединений является изомером C 5 H 7 и содержит две степени ненасыщенности.
Упражнение \(\PageIndex{1}\)
Сколько степеней ненасыщенности имеют следующие соединения?
a), b) CH 3 CH=CHCH 3, c), d), e) 3-хлор-5-октин, f)
- Ответить
а) 0
б) 1
в) 1
г) 2)
д) 2
е) 2
Расчет степени ненасыщенности (DoU)
Как отмечалось выше, каждая степень ненасыщенности приводит к потере двух атомов водорода в молекулярной формуле соединения по сравнению с алканом с таким же числом атомов углерода.
 Понимание этой взаимосвязи позволяет рассчитать степень ненасыщенности соединения по его молекулярной формуле. Сначала вычисляется максимально возможное количество атомов водорода для данного соединения (2C + 2) , а затем фактическое количество атомов водорода, присутствующих в соединении (H) , вычитается . Если эту разницу разделить на 2, то ответ будет равен степени ненасыщенности соединения.
Понимание этой взаимосвязи позволяет рассчитать степень ненасыщенности соединения по его молекулярной формуле. Сначала вычисляется максимально возможное количество атомов водорода для данного соединения (2C + 2) , а затем фактическое количество атомов водорода, присутствующих в соединении (H) , вычитается . Если эту разницу разделить на 2, то ответ будет равен степени ненасыщенности соединения.Для соединения, которое содержит только углерод и водород:
ДоУ = (2С + 2) — Ч/2
Например, для молекулярной формулы C 3 H 4 количество фактических атомов водорода, необходимых для насыщения соединения, составляет 8 [2C+2=(2×3)+2=8] .Поскольку соединение имеет только 4 атома водорода в своей молекулярной формуле, оно должно получить еще 4 атома водорода, чтобы стать полностью насыщенным (8-4 = 4) . Степень ненасыщенности равна половине количества атомов водорода, необходимого для полного насыщения молекулы.
 Это соединение имеет 2 степени ненасыщенности (4/2 = 2) .
Это соединение имеет 2 степени ненасыщенности (4/2 = 2) .DoU соединений, содержащих элементы, отличные от углерода и водорода, также можно рассчитать аналогичным образом.Однако на формулу, используемую для расчета DoU, могут влиять различные элементы.
Для соединения, которое содержит элементы, отличные от углерода и водорода:
\[ DoU= \dfrac{2C+2+N-X-H}{2} \tag{7.2.1}\]
- \(C\) число атомов углерода
- \(N\) число атомов азота
- \(X\) — число галогенов (F, Cl, Br, I)
- \(H\) число атомов водорода
Галоген (X) заменяет водород в соединении, поскольку оба образуют одну одинарную связь.Поэтому формула DoU вычитает количество галогенов (X), присутствующих в соединении. Например, 1,1-дихлорэтен (C 2 H 2 Cl 2 ) имеет на два атома водорода меньше, чем этилен (C 2 H 4 ), но оба они имеют одну степень ненасыщенности.

Кислород и сера не включены в формулу DoU, поскольку эти элементы не влияют на насыщение. Включение спирта или серы в соединение не изменяет количество атомов водорода для достижения насыщения.Как видно из спиртов, количество атомов водорода в циклогексаноле (C 6 H 12 O) соответствует количеству атомов водорода в циклогексане (C 6 H 12 ), и оба они имеют одну степень ненасыщенности.
Когда в соединении присутствует азот, для достижения насыщения требуется еще один водород. Поэтому добавляем количество азотов (N). Пропиламин (C 3 H 9 N) имеет на один водород больше по сравнению с пропаном (C 3 H 8 ), оба из которых являются насыщенными соединениями с 0 DoU.
Со степенью ненасыщенности приходит информация о возможном количестве колец и кратных связей в данном соединении. Помните, что степень ненасыщенности дает только сумму пи-связей и/или колец.

- Одна степень ненасыщенности эквивалентна 1 кольцу или 1 двойной связи (1 \( \pi \) связи).
- Две степени ненасыщенности эквивалентны 2 двойным связям, 1 кольцу и 1 двойной связи, 2 кольцам или 1 тройной связи (2 \( \pi \) связи).
Пример 7.2.1: Бензол
Какова степень ненасыщенности бензола?
Раствор
Молекулярная формула бензола C 6 H 6 . Таким образом,
DoU= 4, где C=6, N=0, X=0 и H=6. 1 DoB может равняться 1 кольцу или 1 двойной связи. Это соответствует бензолу, содержащему 1 кольцо и 3 двойные связи.
Однако при заданной молекулярной формуле C 6 H 6 бензол является лишь одной из многих возможных структур (изомеров).Все следующие структуры имеют DoB 4 и имеют ту же молекулярную формулу, что и бензол.
Ссылки
- Фоллхардт, К.П.К. и Шор, Н. (2007). Органическая химия (5 -е изд.
 ). Нью-Йорк: WH Freeman. (473-474)
). Нью-Йорк: WH Freeman. (473-474) - Шор, Н. (2007). Учебное пособие и руководство по решениям для органической химии (5 th Ed.). Нью-Йорк: WH Фримен. (201)
Упражнение \(\PageIndex{1}\)
Являются ли следующие молекулы насыщенными или ненасыщенными:
(а.) (б.) (в.) (г.) C 10 H 6 N 4
- Ответить
(a.) un насыщенный (E , хотя кольца содержат только одинарные связи, кольца считаются ненасыщенными.)
(б.) ненасыщенный
(к.) насыщенный
(г.) ненасыщенный
Проблемы
- Следующие молекулы являются насыщенными или ненасыщенными:
- (б.) (в) (г) C 10 H 6 N 4
- Используя молекулы из 1.
 , укажите степени ненасыщенности для каждой.
, укажите степени ненасыщенности для каждой. - Рассчитайте степени ненасыщенности для следующих молекулярных формул:
H
- (a.) C 9 H 20 (b.) C 7 H 8 (c.) C 5 H 2 C 9 7 9.002 9 НЕТ 4
- Используя молекулярные формулы из 3, являются молекулы ненасыщенными или насыщенными.
- Используя молекулярные формулы из 3, если молекулы насыщены, сколько колец/двойных связей/тройных связей прогнозируется?
- 5.
(a.) 0 (Помните, что насыщенная молекула содержит только одинарные связи)
(b.) Молекула может содержать любую из этих комбинаций (i) 4 двойные связи (ii) 4 кольца (iii) 2 двойные связи+2 кольца (iv) 1 двойная связь+3 кольца (v) 3 двойные связи+1 кольцо (vi) 1 тройная связь+2 кольца (vii) 2 тройные связи (viii) 1 тройная связь+1 двойная связь+1 кольцо (ix) 1 тройная связь+2 двойные связи
(г.
 ) ( i) 1 тройная связь (ii) 1 кольцо+1 двойная связь (iii) 2 кольца (iv) 2 двойные связи
) ( i) 1 тройная связь (ii) 1 кольцо+1 двойная связь (iii) 2 кольца (iv) 2 двойные связи (d.) (i) 3 тройные связи (ii) 2 тройные связи+2 двойные связи (iii) 2 тройные связи+1 двойная связь+1 кольцо (iv)… (Как видите, степень ненасыщенности дает только сумму двойных связей, тройных связей и/или колец. Таким образом, формула может давать множество возможных структур для данной молекулярной формулы.)
Ответы
1.
(a.) un насыщенный (E , хотя кольца содержат только одинарные связи, кольца считаются ненасыщенными.)
(б.) ненасыщенный
(к.) насыщенный
(г.) ненасыщенный
2. Если дана молекулярная структура, самый простой способ решения — подсчитать количество двойных связей, тройных связей и/или колец. Однако вы также можете определить молекулярную формулу и определить степень ненасыщенности, используя формулу.

(а) 2
(b.) 2 (одна двойная связь и двойная связь из карбонила)
(к.) 0
(г.) 10
3. Используйте формулу для решения
(а) 0
(б) 4
(к.) 2
(г.) 6
4.
(а) насыщенный
(р.) ненасыщенный
(к.) ненасыщенный
Авторы и авторство
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.
 Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.

ПРАВИЛА НОМЕНКЛАТУРЫ ИЮПАК-НАЗВАНИЕ ИЮПАК-ОРГАНИЧЕСКАЯ ХИМИЯ
В прежние дни общепринятые названия органических соединений в основном производились от источника происхождения и их свойства. Однако химики-органики осознали необходимость систематического наименования органических соединений, поскольку со временем синтезируется большое количество органических соединений. Это приводит к созданию системы номенклатуры «Международный союз теоретической и прикладной химии, IUPAC» .
Система номенклатуры ИЮПАК представляет собой набор логических правил, которые в основном направлены на то, чтобы дать недвусмысленное название органическому соединению. С помощью этой системы можно систематизировать Название IUPAC для органического соединения, просто взглянув на его структуру, и также можно записать структуру органического соединения, следуя названию IUPAC для этого соединения.
На этой странице я дал логическое введение в номенклатуру IUPAC.
 А
используется краткий и унифицированный подход, чтобы помочь в присвоении имен IUPAC почти всем типам
соединений. Это не исчерпывающая ссылка на номенклатуру IUPAC. тем не мение
этого более чем достаточно для всех студентов на различных уровнях их
кривая обучения.
А
используется краткий и унифицированный подход, чтобы помочь в присвоении имен IUPAC почти всем типам
соединений. Это не исчерпывающая ссылка на номенклатуру IUPAC. тем не мение
этого более чем достаточно для всех студентов на различных уровнях их
кривая обучения.Систематическое название органического соединения ИЮПАК состоит из четырех частей.
- Корневое слово
- Суффикс(ы) Префикс(ы)
- и
- инфикс
Суффикс снова делится на первичный и вторичный.Следовательно, полное систематическое название IUPAC может быть представлено как:
.* «Корень слова» и «Суффикс 1 o » вместе известен как базовое имя .
* Префикс(ы), инфикс и суффикс 2 o могут требоваться или не требоваться всегда.
1) Корневое слово:Корень слова имени ИЮПАК указывает количество атомов углерода в самой длинной непрерывной углеродной цепи, также известной как родительская цепочка выбирается по набору правил.
 То
Корни слов, используемые для обозначения разной длины углеродной цепи (до 20), показаны ниже.
То
Корни слов, используемые для обозначения разной длины углеродной цепи (до 20), показаны ниже.Число атомов углерода в исходной цепи Корневое слово 1 Мет 2 Эт. 3 Опора 4 Но 5 Пент 6 Шестигранник 7 Гепт 8 окт. 
9 Нет 10 Декабрь 11 Ундец 12 Додек 13 Тридек 14 Тетрадек 15 Пентадек 16 Шестнадцатеричный 17 Гептадек 18 Октадек 19 Нонадек 20 Икос
2) Суффикс:Он снова делится на два типа.

i) Основной суффикс:- Первичный суффикс и
- Дополнительный суффикс
Используется для обозначения степени насыщения или ненасыщенности в основной цепи. Добавляется сразу после корень слова имени ИЮПАК.
Тип углеродной цепи Основной суффикс Насыщенный (все связи C-C) -ан Ненасыщенный: один C=C -ен Ненасыщенный: два C=C -диен Ненасыщенный: один C≡C -инэ Ненасыщенный: два C≡C -дийне Ненасыщенные: один C=C и один C≡C -энинэ
ii) Дополнительный суффикс:Используется для обозначения основной функциональной группы в органическом соединении и добавляется сразу после суффикса 1 или .
 во имя ИЮПАК.
во имя ИЮПАК.Примечание: Если в соединении есть две или более функциональные группы, функциональная группа с более высоким приоритетом должна быть выбрана в качестве основной функциональной группы, которая должна быть обозначена вторичным суффиксом. Остальные функциональные группы с более низким приоритетом рассматриваются как заместители и обозначаются префиксами.
Суффиксы, а также префиксы, используемые для некоторых важных функциональных групп, показаны в следующей таблице в порядке убывания их приоритета.
Также обратите внимание, что другой суффикс используется, когда атом углерода функциональной группы не является частью основной цепи.
Наименование функциональной группы Представительство Суффикс
Когда углерод функциональной группы является частью исходной цепиСуффикс
Когда углерод функциональной группы НЕ является частью исходной цепиПрефикс карбоновая кислота -COOH -овая кислота -карбоновая кислота карбокси- ангидрид кислоты -oic ангидрид — ангидрид карбоновой кислоты — Эстер -КООР алкил-оат алкил-карбоксилат алкоксикарбонил- Галогенангидрид -КОКС -оилгалогенид -карбонилгалогенид галогенкарбонил- Амид кислоты -КОНХ 2 -амид -карбоксамид карбамоил- Нитрил -CN -нитрил -карбонитрил циано- Альдегид -ЧО -ал -карбальдегид оксо- Кетон -СО- -один — оксо- Алкоголь -ОН -ол — гидрокси Тиол -Ш -тиол — меркапто Амин -НХ 2 -амин — амино- Имине =НХ -имине — имино- Алкен С=С -ен — — Алкин С≡С -инэ — — Примечание.
3) Префикс: Это не полный справочник.
Это не полный справочник.Префикс используется для обозначения боковых цепей, заместителей и низкоприоритетных функциональных групп (которые рассматриваются как заместители). То префикс может предшествовать корню слова или инфиксу имени ИЮПАК.
Префиксы, используемые для некоторых общих боковых цепей и заместителей, показаны ниже. (префиксы функциональных групп уже указаны)
Боковая цепь или заместитель Префикс -СН 3 метил- -CH 2 CH 3 (или) -C 2 H 5 этил- -CH 2 CH 2 CH 3 пропил- изопропил- -CH 2 CH 2 CH 2 CH 3 бутил втор-бутил
(или)
(1-метил)пропилизобутил
(или)
(2-метил)пропилтрет-бутил
(или)
(1,1-диметил)этил-Х гало- -ИЛИ алкокси- -НО 2 — нитро Помните, что алкильные группы наряду с галогеном, нитро и алкокси имеют такое же предпочтение.
3) Инфикс: Они имеют более низкий приоритет, чем двойные и тройные связи.
Они имеют более низкий приоритет, чем двойные и тройные связи.Инфиксы, такие как cyclo, спиро, бицикло добавляются между префиксом(ами) и корнем слова в ИЮПАК. имя для обозначения природа родительской цепи.
* Инфикс «Cyclo» используется для обозначения циклического характера родительская цепь.
* Инфикс «Спиро» используется для обозначения соединения спиро.
* Инфикс «Бицикло» используется для обозначения бициклической природы родительская цепь.
Инфиксы иногда называют первичными префиксами.
1) Первым шагом при присвоении названия IUPAC органическому соединению является выбор исходной цепи и назначение корень слова.
2) Затем к корневому слову необходимо добавить соответствующий первичный суффикс(ы), чтобы указать насыщенность или ненасыщенность.
3) Если молекула содержит функциональную группу или группы, необходимо добавить дополнительный суффикс для обозначения основной функциональной группы.
 Это необязательно и необязательно, если молекула содержит функциональную группу или .
Это необязательно и необязательно, если молекула содержит функциональную группу или .4) Ставить перед корневым словом инфикс «цикло», если родительская цепочка циклический; или с инфиксом «спиро», если это спиросоединение; или с инфикс «бицикло», если соединение является бициклическим.
5) Наконец, добавьте префикс(ы) к названию IUPAC, если в исходной цепи есть боковые цепи или заместители.
напр. Название IUPAC следующего соединения (3-метилбутан-2-ол) получено в соответствии с указанными этапами. ниже.
Ступень-1 Сколько атомов углерода в родительском цепь? 4 Корневое слово = «но» Ступень-2 Насыщенный или ненасыщенный? Насыщенный 1 o суффикс = «ане» Ступень-3 Есть ли функциональная группа? Да.  На 2-й улице есть алкогольная группа.
углерод.
На 2-й улице есть алкогольная группа.
углерод.2 или суффикс = «2-ол» Ступень-4 Имеются ли боковые цепи или заместители? Да. На 3-м углероде есть метильная группа. 2 o префикс = «3-метил» Теперь добавьте их, чтобы составить название IUPAC соединения.
Вы узнаете, как выбрать родительскую цепочку?; как сосчитать атомы углерода и дать местонахождение функциональным группам, боковым цепям? и т.д., в следующий раздел.
ПРАВИЛА НОМЕНКЛАТУРЫ ИЮПАК
Следующие правила номенклатуры ИЮПАК полезны при присвоении органическому соединению систематического названия ИЮПАК.
1) Выбор родительского цепь:Первым шагом в названии органического соединения является выбор исходной цепи и присвоение корень слова на основе числа атомов углерода в нем.

Исходная цепь в органической молекуле представляет собой самую длинную непрерывную углеродную цепь, содержащую как можно больше функциональных групп, двойных связей, тройных связей, боковых цепей и заместителей.
Примеры:
i) В следующей молекуле самая длинная цепь имеет 6 атомов углерода. Следовательно корень слова «hex-«. Обратите внимание, что родительская цепь может быть не прямой.
ii) Корень для следующей молекулы — «гепт-», поскольку самая длинная цепь содержит 7 атомов углерода.
Не думайте, что этильные группы (-C 2 H 5 ) являются боковыми цепями, а самая длинная цепь содержит 5 атомов углерода.
Заштрихованная часть показывает самую длинную цепь, содержащую 7 атомов углерода. Также посмотрите на альтернативный способ записи этой молекулы, в котором этильные группы расширены до -CH 2 CH 3 .

iii) В следующей молекуле имеются три цепи одинаковой длины (7 атомов углерода).
Однако цепь с большим количеством заместителей (с 3 заместителями, как показано на следующей диаграмме) должна быть принята в качестве исходной цепи.Таким образом, «гепт» появляется как корень слова в названии IUPAC этого соединения.
iv) Двойные связи и тройные связи имеют больший приоритет, чем алкильные боковые цепи и некоторые другие заместители, такие как галоген, нитро, алкокси и т.д. или тройная связь должна быть выбрана в качестве исходной цепи независимо от другой цепи, содержащей большее количество заместителей.
Имеются две цепи с 6 атомами углерода. Но цепь с двойной связью, как показано на диаграмме (II), должна быть выбрана в качестве исходной цепи.

Примечание. Двойная связь имеет больший приоритет, чем тройная.
v) Однако в качестве исходной цепи должна быть выбрана самая длинная цепь, независимо от того, содержит она кратные связи или нет.
напр. В следующей молекуле самая длинная цепь (заштрихована) не содержит двойной связи. Ее следует выбрать в качестве исходной цепи, поскольку она содержит больше атомов углерода (7), чем содержащая двойную связь (всего 6 атомов углерода).
vi) Цепь с основной функциональной группой должна быть выбрана в качестве исходной цепи, даже если она содержит меньше атомов углерода, чем любая другая цепь без основной функциональной группы.
Функциональная группа имеет приоритет над всеми вышеуказанными правилами, поскольку она имеет больший приоритет, чем двойные связи, тройные связи, боковые цепи и другие заместители.

Помните, что функциональная группа является главной.
Цепь (заштрихованная) с 6 атомами углерода, которая включает функциональную группу -ОН, должна быть выбрана в качестве исходной цепи независимо от наличия другой цепи с 7 атомами углерода, не содержащей функциональной группы.
Есть и другие ситуации, которые будут решать родительскую цепочку. Они будут рассмотрены в соответствующих разделах.
2) Нумерация родителя цепь:i) Положения двойных или тройных связей, или заместителей, или боковых цепей, или функциональных групп в исходной цепи должны быть указаны соответствующими номерами (или местами). Локанты присваиваются им путем нумерации атомов углерода в исходной цепи.
Несмотря на то, что возможны две разные серии локантов путем нумерации углеродной цепи с обеих сторон, правильная серия выбирается в соответствии с правилом первой точки различия, как указано ниже.

Примечание. В номенклатуре iupac номер, указывающий на положение заместитель называется «локант».
Правило первой точки разности:Когда ряды локантов, содержащие одинаковое количество терминов, сравниваются почленно, предпочтение отдается ряду, который содержит наименьшее число в случае первого различия.
Например, в следующей молекуле нумерация может быть выполнена с любой стороны цепи, чтобы получить два набора локантов.Однако выбрано число 2,7,8, поскольку оно имеет наименьшее число, т. е. 2, в первом случае различия по сравнению с другим набором: 3,4,9.
На самом деле так называемое «Правило наименьшей суммы» является частным случаем вышеупомянутого «Правила первой точки разности». Хотя это выглядит просто, правило наименьших сумм справедливо только для цепей с двумя заместителями, что является особым случаем. Однако использование правила наименьших сумм не рекомендуется, когда имеется более двух заместителей, поскольку это может нарушить фактическое правило первой точки разности.

Поэтому при определении позиций мы всегда должны использовать только «правило первой точки разности».
ii) Если две или более боковых цепей находятся в эквивалентных позициях, той, которая должна быть присвоена с меньшим номером, будет та, которая указана первой в названии.
В случае простых корней группа, которая должна быть процитирована первой в названии, определяется по алфавитному порядку первой буквы в случае простых корней.При выборе алфавитного порядка не следует принимать во внимание такие префиксы, как ди, три, тетра.
В следующей молекуле 4-этил-5-метилоктана метильная и этильная группы находятся в эквивалентных положениях. Однако этильная группа стоит первой в алфавитном порядке. Поэтому оно должно быть написано первым в имени и ему должно быть присвоено наименьшее число.
Примечание. Группы: втор-бутил и трет-бутил расположены в алфавитном порядке под «б».
 Однако изобутильная и изопропильная группы расположены в алфавитном порядке под
«i», а не под «b» или «p».
Однако изобутильная и изопропильная группы расположены в алфавитном порядке под
«i», а не под «b» или «p».iii) Однако, если две или более группы равны , а не на эквивалентных позициях, группа, которая идет первой в алфавитном порядке, может не получить наименьшее число.
напр. В следующей молекуле, 5-этил-2-метилгептане, метильная и этильная группы не находятся в эквивалентных положениях. Метильная группа получает наименьшее число по правилу первой точки разности.
Но обратите внимание, что этильная группа пишется первой в названии.
iv) Множественные связи (двойные или тройные связи) имеют более высокий приоритет по сравнению с алкильными, или галогеновыми, или нитро-, или алкоксигруппами, и поэтому им должны присваиваться меньшие номера.
напр. В следующем углеводороде, 6-метилгепт-3-ене, двойной связи присвоен меньший номер, и она обозначена основным суффиксом 3-ен.
 Положение метильной группы обозначено локантом, 6.
Положение метильной группы обозначено локантом, 6.v) Двойная связь предпочтительнее тройной связи, поскольку она должна быть указана первой в названии.
Следовательно, двойной связи следует присваивать меньший номер всякий раз, когда и двойная, и тройная связи находятся в эквивалентных положениях в исходной цепи.
напр. В следующем углеводороде, гепт-2-ен-5-ине, и двойная, и тройная связи находятся в эквивалентных положениях.Но положение двойной связи показано 2-еном. Подсчет атомов углерода ведется с левой стороны молекулы.
vi) Однако, если двойные и тройные связи не находятся в эквивалентных позициях, то позиции определяются по правилу первой точки разности.
напр. В следующем углеводороде, гепт-4-ен-2-ине, двойные и тройные связи не находятся в эквивалентных положениях.Тройная связь получает меньший номер.

Еще раз обратите внимание, что 4-ен пишется первым.
vii) Тем не менее, основной функциональной группе должен быть присвоен наименьший номер, даже если это нарушает правило первой точки различия. Он также имеет больший приоритет, чем множественные облигации.
Например, в следующей органической молекуле, 6-метилокт-7-ен-4-оле, группа -ОН получает меньший номер (т.д., 4) нумерацией атомов углерода справа налево.
3) Грамматика, которой необходимо следовать при письме IUPAC имя:i) Название IUPAC должно быть написано одним словом. Однако есть и исключения.
ii) Номера разделены запятыми.
iii) Цифры и буквы разделяются дефисами.
iv) Если имеется два или более простых заместителя одного типа, они должны иметь префикс ди, три, тетра, пента и т. д.
напр. Количество метильных групп указано ди и три в следующих случаях.
v) Если сами боковые цепи содержат такие термины, как ди, три, тетра и т. д., префиксы умножения, такие как бис, трис, тетракис и т. д., должен быть использован.
напр. Две 1,2-диметилпропильные группы обозначены префиксом «бис», как показано ниже.
vi) Если присутствуют две или более боковые цепи разной природы, они указываются в алфавитном порядке.
* В случае простых корней они располагаются в алфавитном порядке по первой букве имени простого корня без префиксов умножения.
напр. В следующей молекуле этильная группа записывается первой, поскольку буква «е» предшествует букве «м» метила в алфавитном порядке. Не следует сравнивать «е» в слове «этил» и «д» в слове «диметил»
* Однако считается, что название сложного радикала начинается с первой буквы его полного названия.
напр. В следующем случае «диметилбутил» рассматривается как полный одиночный заместитель и в алфавитном порядке обозначается буквой «d».
IUPAC Номенклатура циклических соединения
i) T Название ИЮПАК алициклического соединения начинается с префикса «цикло».
напр.
ii) Циклы старше ацикликов.
Следовательно, когда циклическое ядро присоединено к нециклической цепи, его всегда называют производным циклического углеводорода, независимо от длины нециклической цепи.Это очень новая рекомендация IUPAC.
Однако в соответствии с конвенцией 1979 г.: «углеводород, содержащий маленькое циклическое ядро, присоединенное к длинной цепи, обычно называют производным ациклического углеводорода; а углеводород, содержащий небольшую группу, присоединенную к большому циклическому ядру, обычно называют производным циклического углеводорода». Большинство учебников и учителей до сих пор следуют этому соглашению.
Э.г. В следующих примерах старая система IUPAC предлагает другое название, когда ациклическая цепь содержит большее количество атомов углерода, чем в циклической системе.
iii) Когда два неароматических кольца (алициклические) соединены друг с другом, соединение рассматривается как производное большего кольца. Корень слова происходит от большего кольца. В то время как меньшее кольцо обозначено префикс.
напр. Следующее соединение считается производным циклогексана. Меньшее кольцо обозначено префиксом: циклопентил.
iv) Однако, если два алициклических кольца одинакового размера соединены с каждым другие, они называются x,x’-би(циклоалкил). Где x и x’ указывают локанты даны атомам углерода, через которые кольца соединены.х относится к локанту углерода в первом кольце, а x ‘представляет локант углерода во втором кольце.
напр. Следующее соединение названо 1,1′-би(циклопентил), так как два циклопентановых кольца соединены друг с другом через их 1 и 1′ углероды.
напр. В следующем соединении к каждому присоединены два циклопентановых кольца. разное.Отсюда и название 1,1′-би(циклопентил)
.v) Ароматические кольца имеют большее преимущество перед неароматическими кольцами, когда размеры обоих колец одинаковы.
напр. Корень слова — бензол в следующем соединении.
Однако более крупное кольцо имеет более высокий приоритет, независимо от его природы (будь то он ароматный или нет).
напр. В фенилциклогептане циклогептан представляет собой неароматическое кольцо. больше. Следовательно, это соединение названо производным циклогептана.
vi) Тем не менее, функциональная группа всегда правит. Это определит корень слова Название ИЮПАК, если оно присутствует в соединении.
напр. В первом соединении, как показано ниже, ациклическая цепь считается исходной цепью, поскольку на ней есть функциональная группа -ОН.Циклопентановая часть рассматривается как заместитель.
Во втором соединении также бензольное кольцо считается заместителем, так как оно не содержит функциональной группы.
Найдите больше примеров названий циклических соединений iupac.
Название IUPAC соединений с многофункциональными группы
При наличии более одной функциональной группы основная функциональная группа обозначается цифрой 2 o суффикс в названии IUPAC, тогда как остальные функциональные группы рассматриваются как заместители и обозначаются соответствующими префиксами.
Например. В следующем органическом соединении, 5-гидроксигексановой кислоте, обе группы -OH и -COOH функциональные группы. Но группа -COOH имеет больший приоритет, чем группа -OH. Следовательно, она считается основной функциональной группой и обозначается второстепенной. суффикс «ойевая кислота». Принимая во внимание, что группа -ОН считается заместителем и обозначается префиксом «гидрокси».
Перейти на следующую страницу — больше Примеры ИЮПАК.
Номенклатура спиросоединений ИЮПАК
Спиросоединения содержат два циклических кольца, которые имеют один общий атом углерода, называемый спироатомом.
В названии спиросоединения ИЮПАК есть инфикс «спиро», за которым следует квадрат. скобки, внутри которых число атомов в меньшем кольце, за которым следует показано количество атомов в большем кольце, за исключением самого спироатома.Эти числа разделены точкой (точкой).
Корень слова основан на общем количестве скелетных атомов углерода в два цикла, включая спироатом. Не включать углероды боковых цепей и заместители над кольцами при подсчете этого количества.
напр. В следующем спиросоединении один атом углерода является общим для 5 одночленные и шестичленные кольца.Название IUPAC — спиро[4.5]декан. Заметь спироуглерод не учитывается при указании цифр в квадратная скобка.
Нумерация ведется от скелетного углерода малого кольца и продолжается до спироуглерода. Затем скелетные углероды в большем кольце пронумерованы.
напр.В следующем спиросоединении метильная группа занимает место, 7. Это связано с тем, что нумерация скелета спиро делается первой и нет необходимости, чтобы метильная группа всегда получала наименьший номер.
Дополнительные примеры спиросоединений IUPAC на следующей странице.
бициклосоединения содержат два конденсированных кольца с двумя соединяющими общими атомами углерода известный как угольный мостик.углеродная цепь или ковалентная связь, соединяющая эти головки мостиков, считается мостиком. Есть три мостика в простом бициклическом соединении.
Название бициклического соединения в ИЮПАК имеет инфикс «бицикло». за которыми следуют квадратные скобки, показывающие числа, разделенные точками (точками). Они указывают количество атомов в мостиках. При подсчете количества атомы в мосту, головка моста углероды не учитываются.Эти числа расположены в порядке убывания т. е. от большего моста к меньшему.
Корень слова указывает на общее количество скелетных атомов углерода в двух кольцах. Не включайте атомы углерода в боковые цепи или заместители в кольцах, пока достигнув корня слова имени ИЮПАК.
напр. В следующем бициклосоединении есть три мостика с 2, 2 и 1 атом углерода, соединяющий два углеродных мостика в головке.Отсюда и название бицикло[2.2.1]гептан.
Нумерация ведется, начиная с одного из карбона головки моста и продолжается через самый длинный мост, пока не будет достигнут другой мост. Затем скелетные атомы углерода следующего более длинного моста пронумерованы. Этот процесс продолжается пока самый короткий мост не будет окончательно пронумерован.
напр. В следующем бициклосоединении метильная группа считается быть на 7 месте.
Перейти к другим примерам номенклатуры бициклосоединений iupac.
Μαριάννα Μπελεφάντη – Διαδικτυακή Δημοσιογραφία
Όλοι γνωρίζουμε για τον εγωισμό που εκδηλώνεται, στις ερωτικές σχέσεις και το πώς ένα ζευγάρι μπορεί ακόμα και να χωρίσει οριστικά λόγω αυτού. Σκέφτηκε κανείς όμως, για τον εγωισμό που υπάρχει ανάμεσα στους φίλους; Το πόσες Φιλίες εχχς φαλλεί εχχιή χαρρε ηι ή καρρά ηη η κρηηηηη η ηυκψηηηη η κηηηηηηηηηηηηηηηηηηηηηηηηηηηη σηη η κηηηηηηηη ηηηηη η Σττλλει εκκννος / η πρώτος / η να πάμε για καφέ.» ή «έχει να με πάρει τόσο καιρό τηλέφωνο γιατί να πάρω εγώ;» Και δεν μιλάμε για φιλίες πέντε ημερών, αλλά για εκείνες που έχουν αναμνήσεις χρόνων.
είμαι Σχεδόν σίΓορρη άάΠογγ ρη ή άάΠοι Στιγμή της ζωήή Σου, τκκνε αυττς, τκς ψεις, τπις σκκψεες, όπΩς τις χΩ άάάάε κααι εΓώ. Και αυτό λέγεται ξεκάθαρα εγωισμός. Κάθεσαι μόνος σπίτι σου, έχοντας διάθεση να βγεις ή να μιλήσεις σε κάποιον και το μόνο που σε κρατάει είναι, ότι απλά δεν σου έχει τεθεί πρόταση ήδη. Και εννοείται πως για χίλιους δυο λόγους, δεν πρόκειται να προτείνεις εσώ ο ίδιος κάος κάος κάοςΕίτε γιατί την τελευταία φορά που βρεθήκατε εσύ ήσουν αυτός που πρότεινες, είτε γιατί ξαφνικά βρήκε άλλες παρέες και νομίζεις πως σε ξέχασε, άρα σιγά μην προσπαθήσεις εσύ να βγείτε, είτε γιατί έχετε καιρό να μιλήσετε επομένως αυτός / η πρέπει να κάνει το πρώτο βήμα. Και πόσοι ακόμη χαζοί λόγοι που σε κάνουν να απομακρύνεσαι όλο και περισσότφερο σλουό τοουό τοουο
Πέρα από αυτόν τα «θα αυυτν» τα θα μπορούσαμε να χαρακτηρίσουμε εαωισμόόσΣοσΣοσε εΓΩισμόόσ ,ΣοσΣοσσε ε καασ, ,ννν πάάε και ενννΣ πυοεε καίζεεννΣ πυο ς τΣακζζεύύή σήος τΣακωζύΣ ή τιΣ Παρεξηγήσεις.Εκεί να δεις γλέντια! Από μια απλή παρεξήγηση χάνονται φιλίες χρόνων, αφού οι άνθρωποι ξεχνούν τα συναισθήματα που έχουν ο ένας για τον άλλο, ή μάλλον καλύτερα, επιλέγουν να προσποιηθούν ότι δεν υπάρχουν, αφήνοντας πίσω την λογική και βλέποντας μόνο τις δικές τους απόψεις. Και η συγγνώμη σαφώς, άγνωστη λέξη για έναν εγωιστή, ακόμα και αν φταίει. Το ίδιο συμβαίνει και με τους τσακωμούς. Το αποτέλεσμα; Αυτττ Που πάποτε Στήήήιααα καε αήήήήύύαα κααι αγαπΣύΣαν ο οναΣ τονΣαάν ο οναΣ τον άιΛάάά καώή δνν νά κααή Συνανοι.
Αλήθεια, πόσο στενάχωρο είναι τόσες όμορφες στιγμές, τόσα γέλια, τόσες τρέλες και τόσες στιγμές συμπαράστασης να χάνονται για έναν εγωισμό; Πώώ Γίνεται να αήήήνε ααττ τήνουμε αυτν τήήήήμ αυτν τοήήήε δττον τοήή δάίοο τοε άάάει να χχάμε τιά εε νεεχχ τώώοεεεύύύύύύύύύύύύύύύύύύύύύύύύύύύύύύύύύάάάά ε ναούύάάάε Το να προσπαθείς να κρατήσεις τους φίλους που θεωρείς σημαντικούς στην ζωή σου δεν είναι ούτε υποτιμητικό ούτε ντροπή. Το αντίθετο μάλιστα, είναι δείγμα ωριμότητας και δυναμισμού.Δεν σου λέω ότι δεν θα υπάρξουν στιγμές που θα θέλεις να «σκοτώσεις» τον φίλο σου από τα νεύρα σου, αλλά κάνεις δεν είπε ότι οι ανθρώπινες σχέσεις είναι εύκολες και ρόδινες. Όπως κανείς επίσης δεν είπε, ότι μπορείς να ζήσεις ευτυχισμένος χωρίς αυτές.




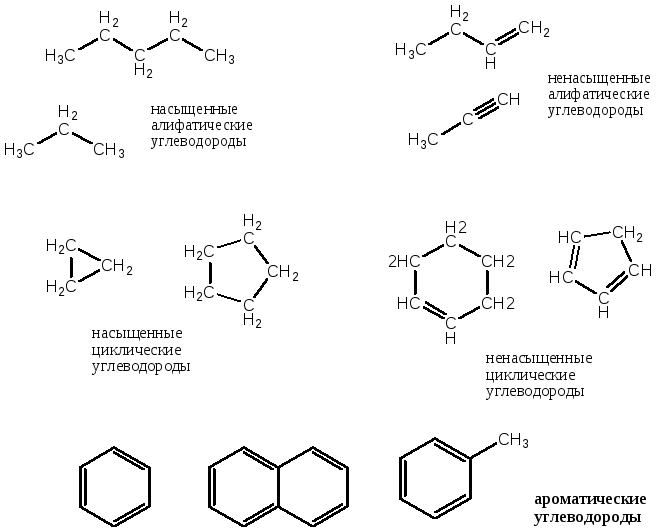 Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°.
Однако, чтобы использовать циклоалканы в таких приложениях, мы должны знать эффекты, функции, свойства и структуру циклоалканов. Циклоалканы представляют собой алканы в форме кольца; следовательно, префикс цикло- используется для обозначения этих алканов. Стабильные циклоалканы не могут быть образованы с углеродными цепями любой длины. Напомним, что в алканах углерод принимает тетраэдрическую геометрию, в которой углы между связями составляют 109,5°. Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов.
Циклоалканы меньшего размера, циклопропан и циклобутан, имеют особенно высокие деформации кольца, потому что их валентные углы существенно отклоняются от 109,5 °, а их атомы водорода затмевают друг друга. Таким образом, обе эти кольцевые конформации крайне неблагоприятны и нестабильны.Циклопентан представляет собой более стабильную молекулу с небольшой деформацией кольца, в то время как циклогексан может принимать идеальную геометрию циклоалкана, в которой все углы составляют идеальные 109,5 °, и ни один водород не затмевается; у него вообще нет кольцевой деформации. Циклоалканы большего размера, чем циклогексан, имеют кольцевую деформацию и не так часто встречаются в органической химии. На рис. 7.6 приведены примеры структур циклоалканов. Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях.
Это также мощный, быстродействующий анестетик с небольшим количеством нежелательных побочных эффектов в организме. Однако в хирургии он больше не используется, так как образует с воздухом взрывоопасные смеси практически при любых концентрациях. 7.7).
7.7). Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.
Поскольку алканы обладают относительно предсказуемыми физическими свойствами и подвергаются относительно небольшому количеству химических реакций, кроме горения, они служат основой для сравнения свойств многих других семейств органических соединений. Сначала рассмотрим их физические свойства.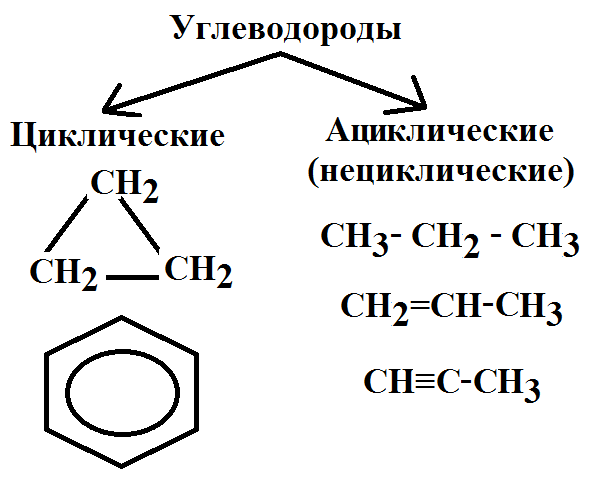 Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа.
Когда утечка природного газа обнаружена и перекрыта в помещении, газ можно удалить, открыв верхнее окно. С другой стороны, баллонный газ может быть либо пропаном (плотность 1,88 г/л), либо бутанами (смесь бутана и изобутана, плотность около 2,5 г/л). Оба вещества намного тяжелее воздуха (плотность 1,2 г/л). Если баллонный газ попадает в здание, он скапливается у пола. Это представляет гораздо более серьезную опасность возгорания, чем утечка природного газа, потому что из комнаты труднее избавиться от более тяжелого газа. Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые переходы). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .
Эти силы будут очень малы для такой молекулы, как метан, но будут увеличиваться по мере увеличения размера молекул. Следовательно, температуры плавления и кипения алканов увеличиваются с увеличением размера молекул из-за увеличения лондоновских дисперсионных сил. (т. е. межмолекулярные силы сильнее в более крупных углеводородах, поэтому требуется больше энергии, чтобы вызвать фазовые переходы). На рис. 7.9 показаны тренды температуры плавления и кипения первых 16 углеводородов. Обратите внимание, что первые четыре алкана являются газами при комнатной температуре, а твердые вещества не начинают появляться примерно до C 17 H 36 .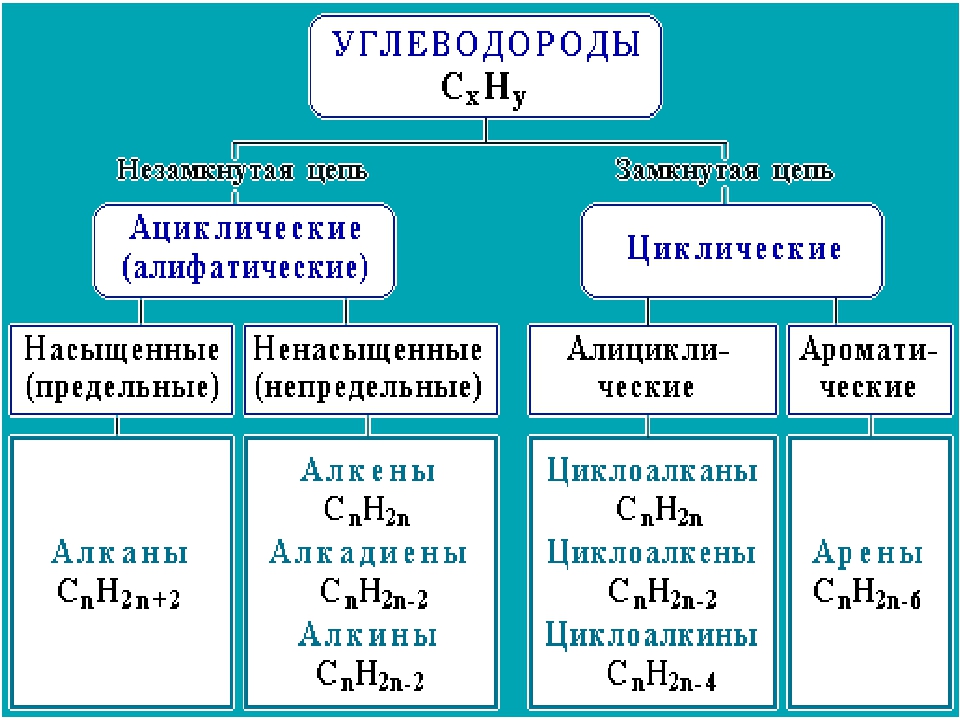 Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.
Коротким громоздким молекулам (со значительным количеством разветвлений) труднее располагаться близко друг к другу (компактно) по сравнению с длинными тонкими молекулами.Циклоалканы похожи на алканы по своим общим физическим свойствам, но имеют более высокие температуры кипения, температуры плавления и плотности, чем алканы. Это связано с более сильными лондонскими силами, потому что форма кольца обеспечивает большую площадь контакта.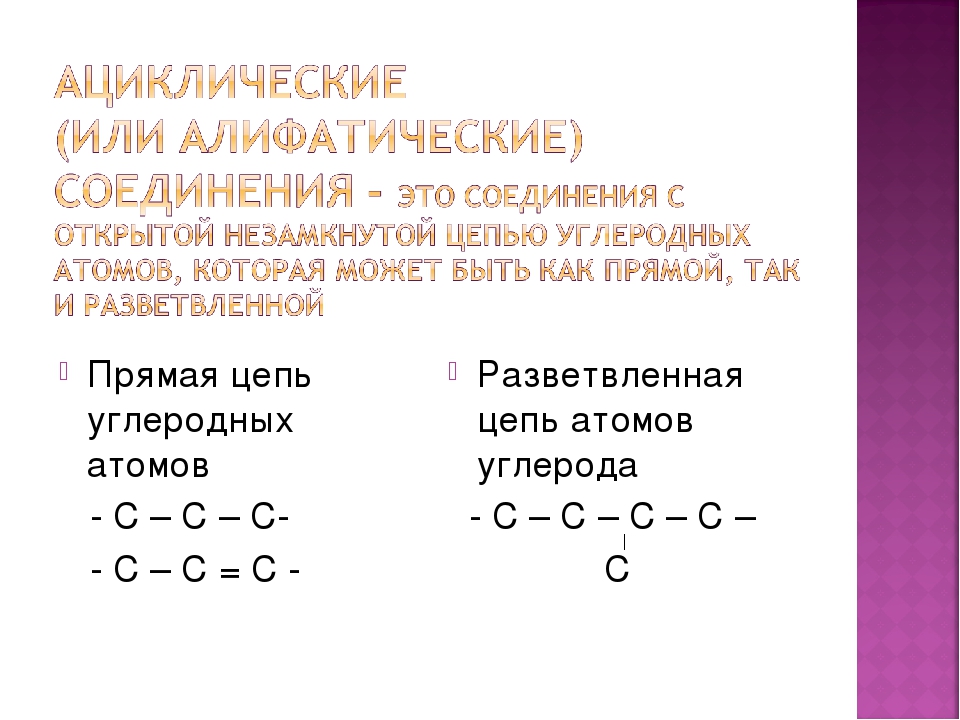 В воде основным межмолекулярным притяжением являются водородные связи.
В воде основным межмолекулярным притяжением являются водородные связи.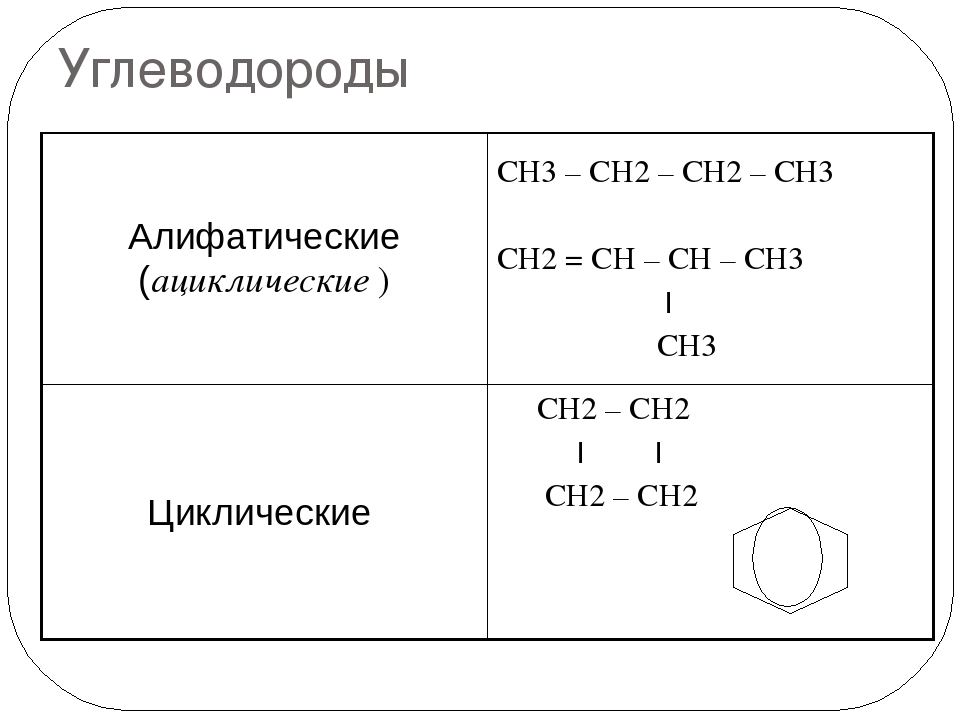 Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя.
Ни насыщенные, ни ненасыщенные углеводороды в этом подсолнечном масле не обладают достаточно сильными межмолекулярными силами, чтобы разрушить водородные связи между молекулами воды. Таким образом, масло не растворяется в воде и образует пузырьки масла на поверхности раздела вода/нефть.В этом случае нефть менее плотна, чем вода, и будет плавать поверх водного слоя. Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.
Нефть не может растворяться или смешиваться с водой, и поскольку она менее плотная, чем вода, она плавает на поверхности воды, создавая нефтяное пятно, как показано на рис. 7.11. Поскольку нефтяное пятно остается на поверхности воды, от нефтяных пятен больше всего страдают организмы, обитающие на поверхности океана или вблизи береговой линии, включая морских выдр и морских птиц.Химические компоненты масла токсичны при приеме внутрь, вдыхании, раздражении кожи и глаз.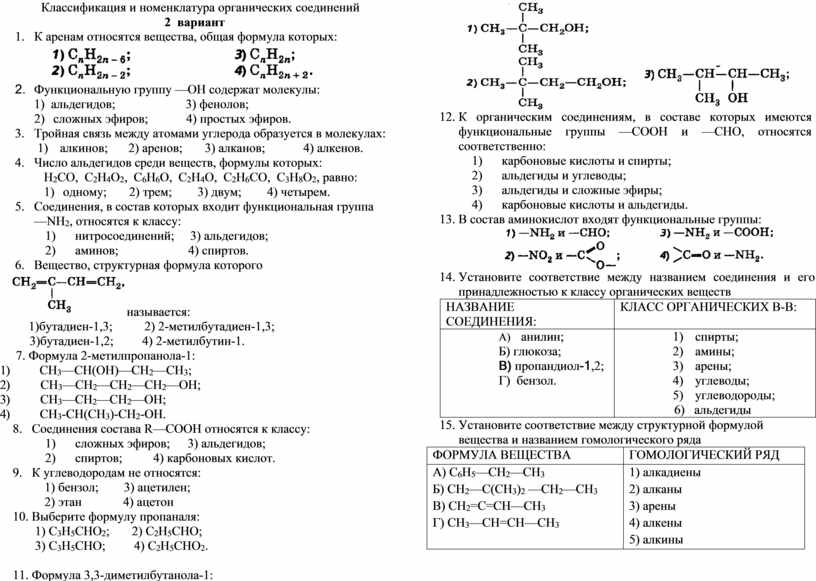


 Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.
Никакая другая обычная реакция не вызывает столь глубоких и всеобъемлющих изменений, а механизм горения настолько сложен, что химики только начинают изучать и понимать некоторые его элементарные особенности.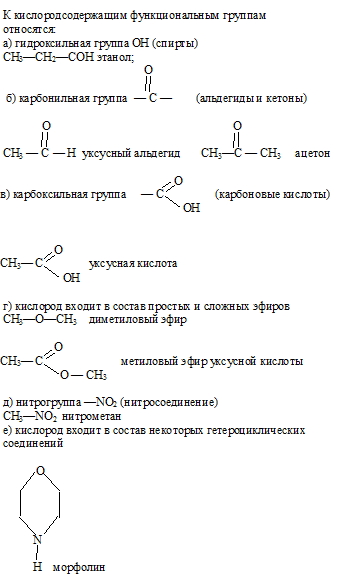 Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.
Напомним, что коэффициенты уравнения определяют, сколько молей соединения присутствует, и что если коэффициент не показан, по умолчанию он равен единице.Например, приведенное выше уравнение будет читаться так: 1 моль пропана (CH 3 CH 2 CH 3 ) реагирует с 5 молями кислорода (O 2 ) с образованием 3 молей углекислого газа (CO 2 ) и 4 моля воды (H 2 O) и выделяется тепло.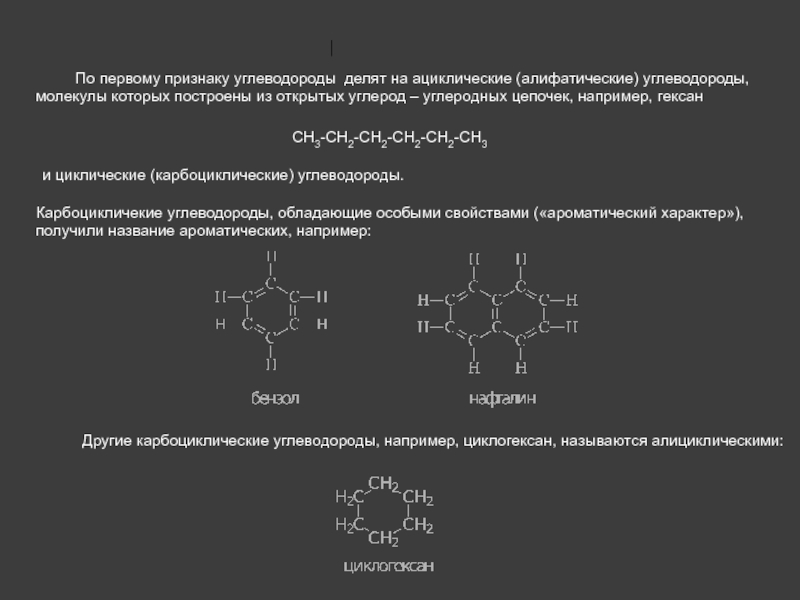 Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения).
Эти теплоты можно оценить с помощью энергий диссоциации/образования связи (энергия, необходимая для разрыва связи на стороне реагента уравнения, и энергия, выделяемая при образовании связи на стороне продукта уравнения). То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
То есть связанные атомы имеют более низкую энергию, чем отдельные атомы как отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию. 
 4: Средняя энергия связи (кДж/моль)
4: Средняя энергия связи (кДж/моль)  Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи.
Это коррелирует с порядком связи и длиной связи. Когда порядок связи выше, длина связи короче, и чем короче длина связи, тем больше энергия связи из-за увеличения электрического притяжения. Как правило, чем короче длина связи, тем больше энергия связи. (верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты.
(верхняя реакция) Экзотермические реакции. При экзотермической химической реакции энергия выделяется по мере того, как реагенты превращаются в продукты. (нижняя реакция) Эндотермические реакции. Для эндотермической химической реакции энергия поглощается по мере того, как реагенты превращаются в продукты. 7.12 (ниже).
7.12 (ниже).

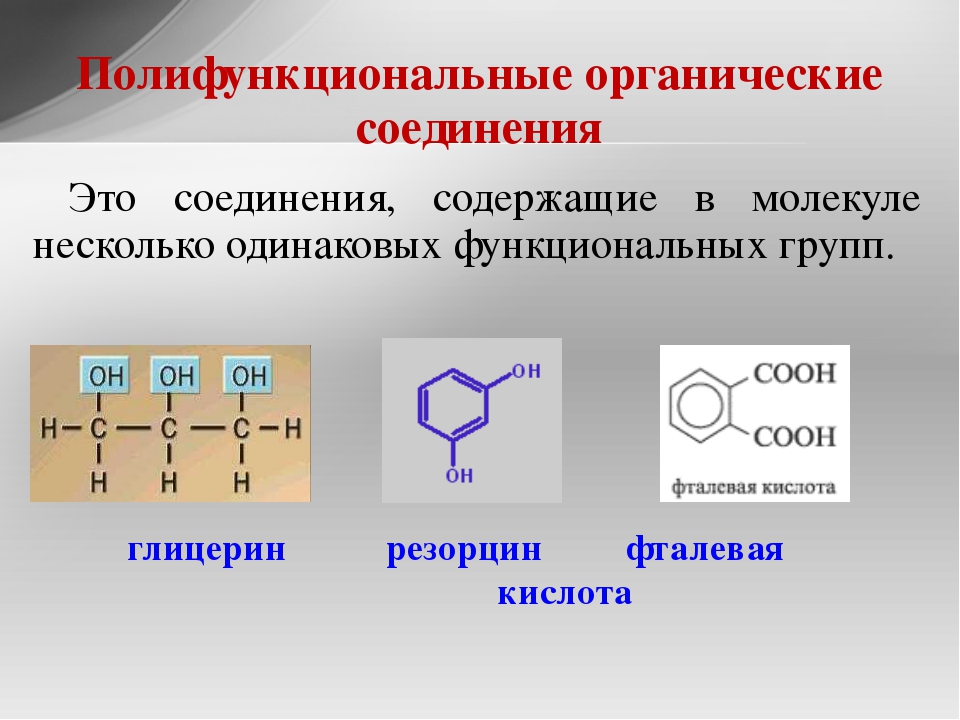 Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
Молекулы большего размера имеют большее притяжение Ван-дер-Ваальса, что затрудняет их отрыв от своих соседей и превращение в газ.
 Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы:
Теплота сгорания является полезной величиной, поскольку это постоянная величина для типа сжигаемого материала, и ее можно использовать для сравнения эффективности и полезности различных источников топлива, наиболее часто используемых в обществе (нефть, бензин, природный газ, дизельное топливо, уголь). , древесина, водород, этанол и т. д.).В Соединенных Штатах показатели нагрева обычно указываются в британских тепловых единицах (БТЕ) на фунт материала. Обычное преобразование в метрические единицы: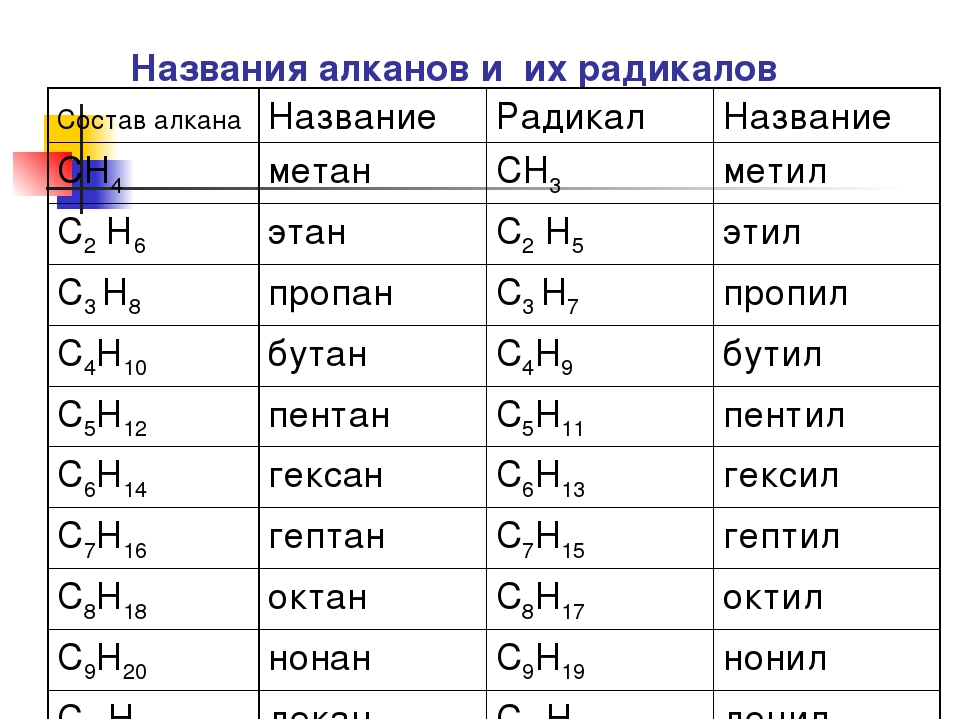 топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).
топлива.Он состоит в основном из алканов, циклоалканов и алкенов различной длины и некоторых дополнительных второстепенных органических соединений. Алканы с пятью или более атомами углерода являются жидкостями и встречаются в качестве обычных компонентов нефти (также называемой сырой нефтью ). Многие циклоалканы также содержатся в нефтепродуктах, включая бензин, керосин, дизельное топливо, моторное масло и многие другие тяжелые масла. С другой стороны, природный газ состоит преимущественно из метана (CH 4 ), но также содержит этан (C 2 H 6 ), пропан (C 3 H 8 ) и бутан ( C 4 H 10 ).Природный газ также содержит следовые количества азота, двуокиси углерода (CO 2 ) и сероводорода (H 2 S).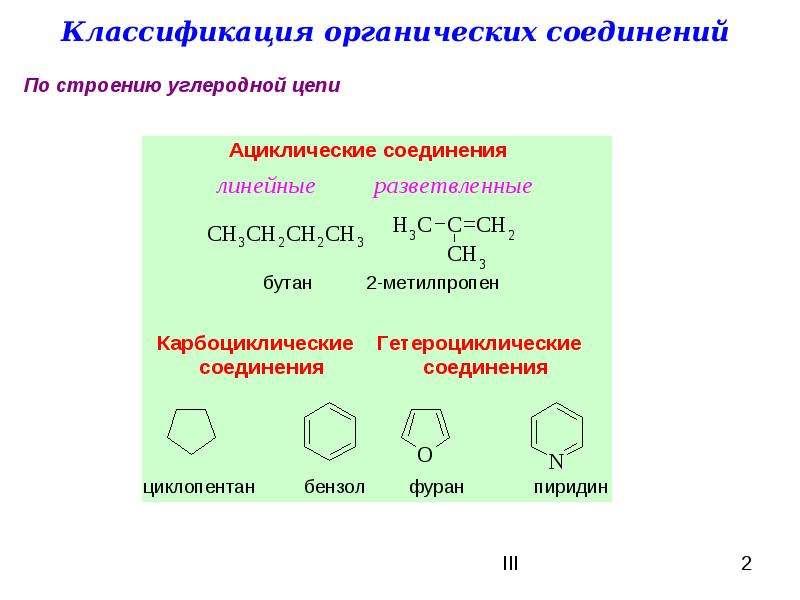 Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель.
Алканы с более длинными углеродными цепями встречаются в дизельном топливе, мазуте, вазелине, парафине, моторных маслах, а самая большая длина цепи используется в асфальте.Подсчитано, что в мире ежедневно используется около 95 миллионов баррелей нефти! По оценкам Агентства по охране окружающей среды, каждый баррель нефти производит 0,43 метрических тонны CO 2 . Обратите внимание, что метрическая тонна эквивалентна 1000 кг. Это означает, что 40 850 000 метрических тонн CO 2 или 40 850 000 000 кг CO 2 ежедневно выбрасываются в атмосферу только в результате потребления нефти! Это почти 15 миллиардов метрических тонн CO 2 в год! Этот расчет включает только потребление сырой нефти, а не других распространенных источников топлива, таких как природный газ, уголь, древесина и возобновляемые источники энергии, такие как этанол и биодизель. Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц?
Если бы вы владели домом площадью 2000 квадратных футов, сколько БТЕ вам потребовалось бы для обогрева собственного дома в течение 1 месяца? (примерно 31 день в месяце). Если бы у вас был выбор обогрева дома природным газом, углем (лигнитом) или дровами, сколько кг каждого из этих видов топлива потребовалось бы для обогрева вашего дома в течение одного месяца? Сколько CO2 будет производиться каждым топливом каждый зимний месяц? Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид:
Для химиков-органиков это не представляет особого интереса, так как реакция может быть очень опасной и не дает желаемого продукта. Например, желаемым продуктом будет алкилфторид: Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.
Интенсивность реакции значительно падает по мере перехода от фтора к хлору и к брому. Интересные реакции происходят в присутствии ультрафиолетового света (подойдет солнечный свет). Это фотохимические реакции, которые происходят при комнатной температуре. Рассмотрим реакции с хлором, хотя реакции с бромом аналогичны, но развиваются медленнее.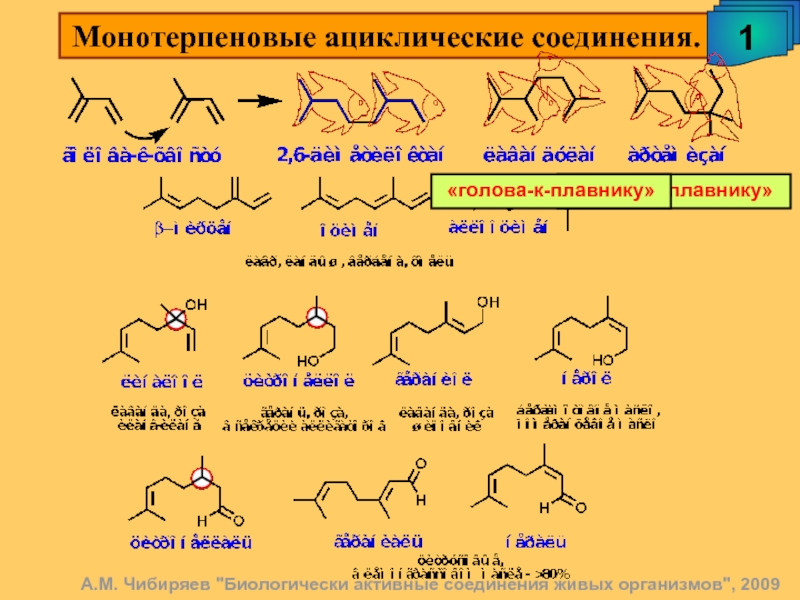 Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.
Все органические продукты являются жидкими при комнатной температуре, за исключением хлорметана (CH 3 Cl), который представляет собой газ.

 Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.
Четвертичные углероды нереакционноспособны, так как у них нет доступных атомов водорода, которые могут быть заменены галогеном.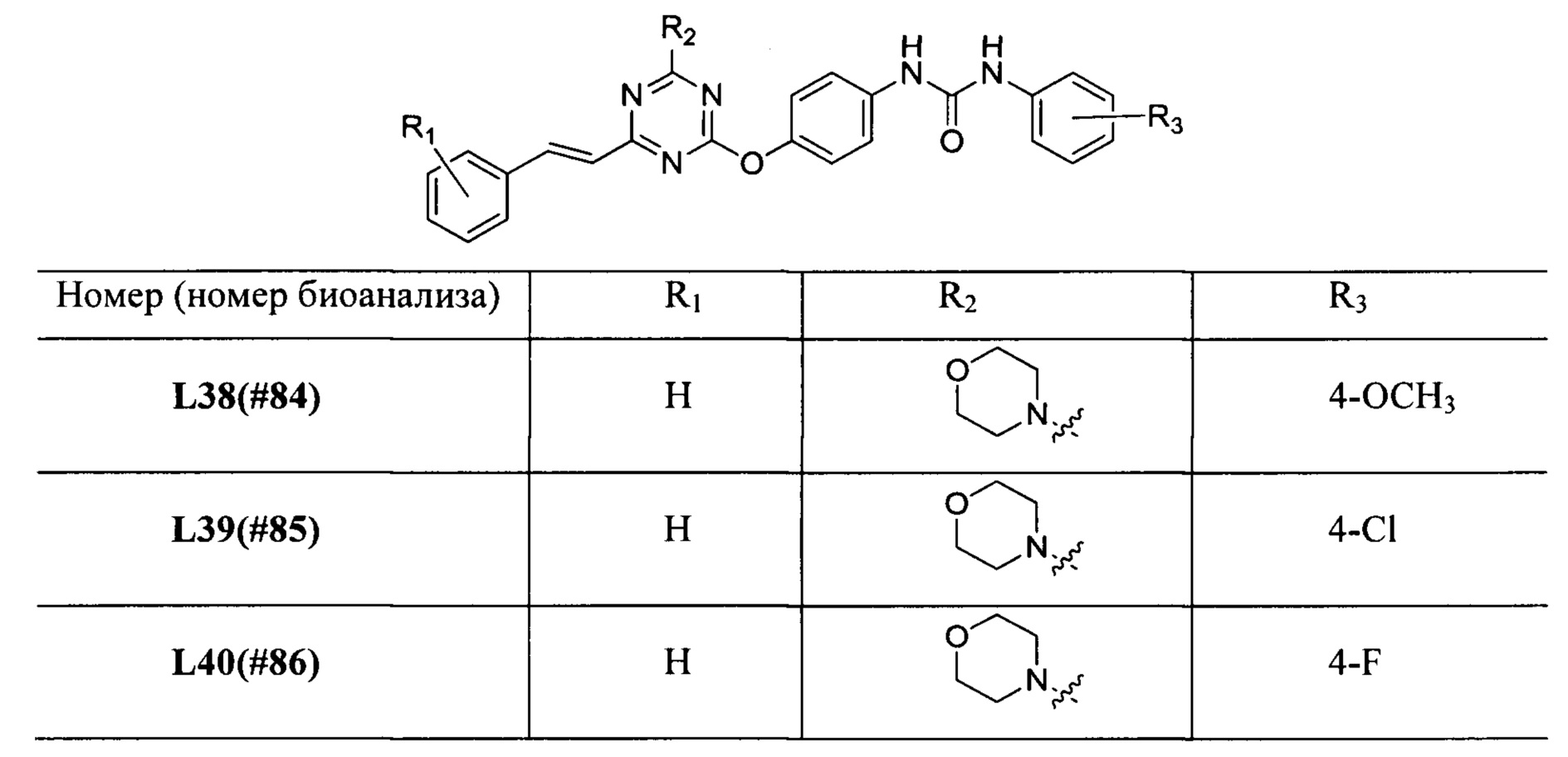 Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.
Напомним, что валентные углы в кольце составляют 60°, а не обычное значение около 109,5°, когда углерод образует четыре одинарные связи.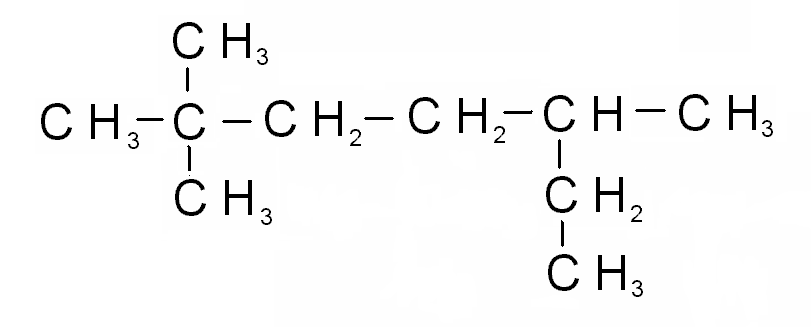 Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.
Несколько галогенированных продуктов, полученных из метана и этана (CH 3 CH 3 ), перечислены в таблице 7.6 вместе с некоторыми из их применений.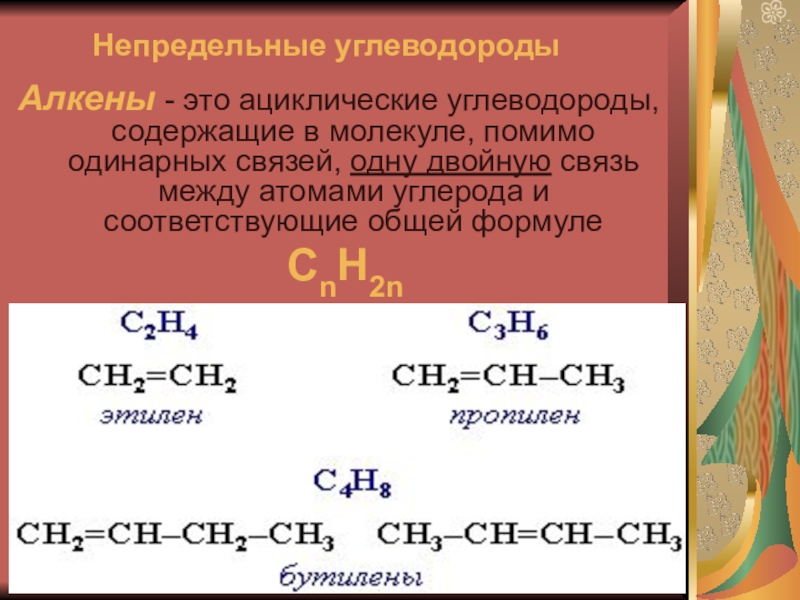
 6.
6. Озон в верхних слоях атмосферы защищает поверхность Земли от солнечного УФ-излучения, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и фиолетовые области в центре) представляют собой большие области значительного истощения озонового слоя. Они встречаются в основном над Антарктидой с конца августа по начало октября и заполняются примерно в середине ноября. Истощение озонового слоя также было отмечено в арктических регионах. Самая большая из когда-либо наблюдаемых озоновых дыр образовалась 24 сентября 2006 года.
Озон в верхних слоях атмосферы защищает поверхность Земли от солнечного УФ-излучения, которое может вызывать рак кожи у людей, а также вредно для других животных и некоторых растений.Озоновые «дыры» в верхних слоях атмосферы (серые, розовые и фиолетовые области в центре) представляют собой большие области значительного истощения озонового слоя. Они встречаются в основном над Антарктидой с конца августа по начало октября и заполняются примерно в середине ноября. Истощение озонового слоя также было отмечено в арктических регионах. Самая большая из когда-либо наблюдаемых озоновых дыр образовалась 24 сентября 2006 года. Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений.
Катализатор — это вещество, которое увеличивает скорость химической реакции, не претерпевая при этом каких-либо необратимых химических изменений. Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для производства пластмасс или других органических химикатов. Октан является одной из молекул, обнаруженных в бензине (бензине).
Обратите внимание, что помимо образования более мелких алканов в результате реакции крекинга также могут образовываться алкены с двойными связями. В этом случае алкены — этен (C 2 H 4 ) и пропен (C 3 H 6 ) — являются важными материалами для производства пластмасс или других органических химикатов. Октан является одной из молекул, обнаруженных в бензине (бензине). Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.Эта характеристика необходима для избирательной проницаемости клеточных мембран.
Эти соединения имеют как полярные, так и неполярные группы, что позволяет им ликвидировать разрыв между водорастворимыми и водонерастворимыми фазами.Эта характеристика необходима для избирательной проницаемости клеточных мембран. Углеводороды содержат только атомы водорода и углерода.
Углеводороды содержат только атомы водорода и углерода.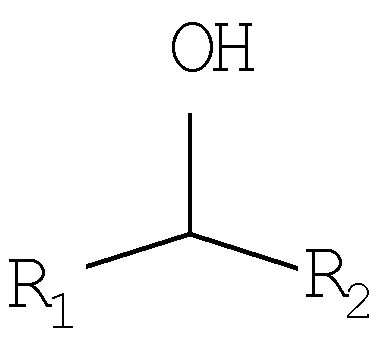 Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.
Циклический углеводород представляет собой углеводород с кольцом из атомов углерода.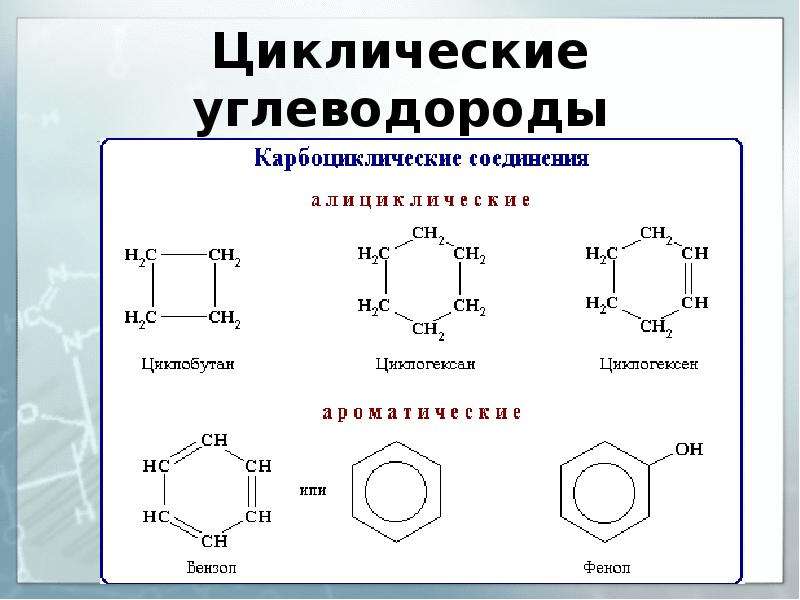 Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена.
Эта реакция называется галогенированием . Алкилгалогенид (галогеналкан) представляет собой соединение, полученное в результате замены атома водорода алкана атомом галогена. Нарисуйте сжатую структуру.
Нарисуйте сжатую структуру.
 0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
0). Опубликовано Creative Commons by-nc-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html Насыщенные соединения с разветвленной цепью и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ) Правило A-2. Насыщенные соединения с разветвленной цепью и одновалентные радикалы (аЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ)
Насыщенные соединения с разветвленной цепью и одновалентные радикалы (АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ) Правило A-2. Насыщенные соединения с разветвленной цепью и одновалентные радикалы (аЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ) 2 — Самая длинная цепь пронумерована от одного конца до другого арабскими цифрами, причем направление выбрано таким образом, чтобы сторонам давали наименьшие возможные номера
цепи. Когда ряды локантов, содержащих одинаковое количество терминов, сравниваются почленно, тот ряд является «самым низким», который содержит наименьшее число в случае первого различия. Этот
принцип применяется независимо от природы заместителей.
2 — Самая длинная цепь пронумерована от одного конца до другого арабскими цифрами, причем направление выбрано таким образом, чтобы сторонам давали наименьшие возможные номера
цепи. Когда ряды локантов, содержащих одинаковое количество терминов, сравниваются почленно, тот ряд является «самым низким», который содержит наименьшее число в случае первого различия. Этот
принцип применяется независимо от природы заместителей. 3 — При наличии двух или более боковых цепей разной природы они указываются в алфавитном порядке.
3 — При наличии двух или более боковых цепей разной природы они указываются в алфавитном порядке.

 6(b)
6(b)  com, +1(416)368-3435 тел., +1(416)368-5596 факс. Для комментариев или предложений обращайтесь по адресу webmaster@acdlabs.com
com, +1(416)368-3435 тел., +1(416)368-5596 факс. Для комментариев или предложений обращайтесь по адресу webmaster@acdlabs.com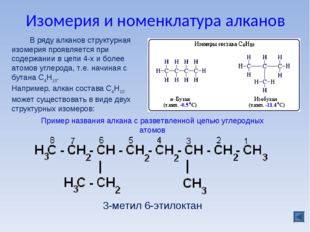 Хотя ядерный магнитный резонанс (ЯМР) и инфракрасное излучение (ИК) являются основными способами определения молекулярной структуры, расчет степени ненасыщенности является полезной информацией, поскольку он легко дает информацию о молекулярной структуре.
Хотя ядерный магнитный резонанс (ЯМР) и инфракрасное излучение (ИК) являются основными способами определения молекулярной структуры, расчет степени ненасыщенности является полезной информацией, поскольку он легко дает информацию о молекулярной структуре.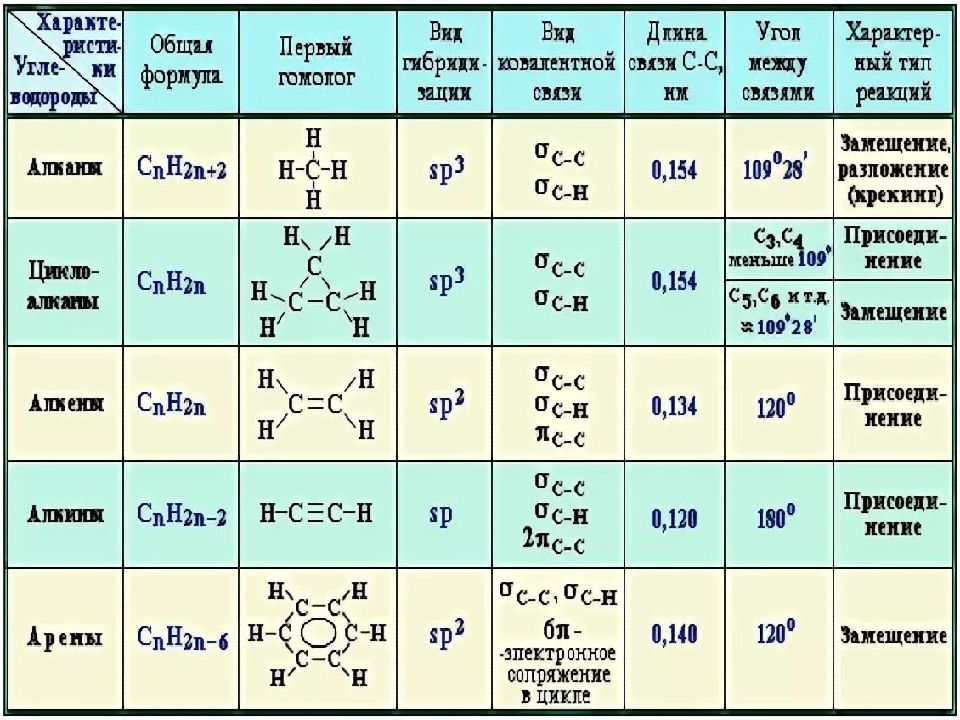
 Понимание этой взаимосвязи позволяет рассчитать степень ненасыщенности соединения по его молекулярной формуле. Сначала вычисляется максимально возможное количество атомов водорода для данного соединения (2C + 2) , а затем фактическое количество атомов водорода, присутствующих в соединении (H) , вычитается . Если эту разницу разделить на 2, то ответ будет равен степени ненасыщенности соединения.
Понимание этой взаимосвязи позволяет рассчитать степень ненасыщенности соединения по его молекулярной формуле. Сначала вычисляется максимально возможное количество атомов водорода для данного соединения (2C + 2) , а затем фактическое количество атомов водорода, присутствующих в соединении (H) , вычитается . Если эту разницу разделить на 2, то ответ будет равен степени ненасыщенности соединения.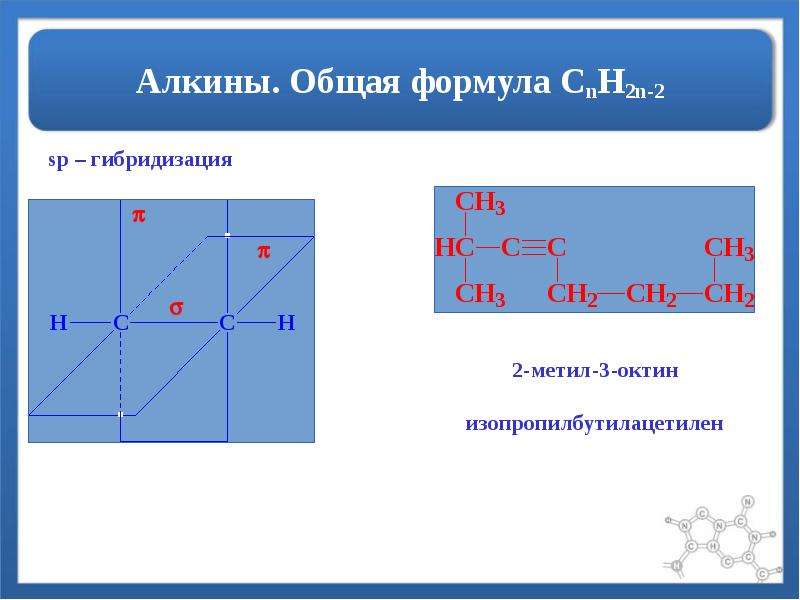 Это соединение имеет 2 степени ненасыщенности (4/2 = 2) .
Это соединение имеет 2 степени ненасыщенности (4/2 = 2) .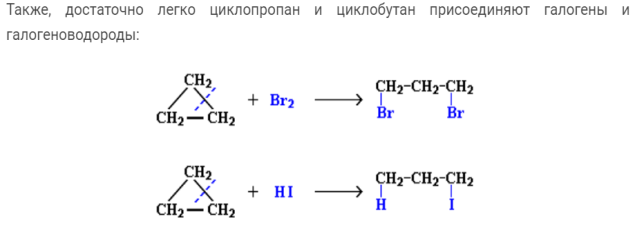

 ). Нью-Йорк: WH Freeman. (473-474)
). Нью-Йорк: WH Freeman. (473-474) , укажите степени ненасыщенности для каждой.
, укажите степени ненасыщенности для каждой. ) ( i) 1 тройная связь (ii) 1 кольцо+1 двойная связь (iii) 2 кольца (iv) 2 двойные связи
) ( i) 1 тройная связь (ii) 1 кольцо+1 двойная связь (iii) 2 кольца (iv) 2 двойные связи 
 Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:

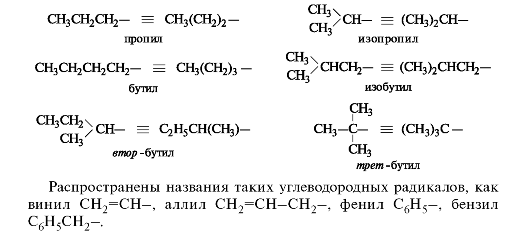 А
используется краткий и унифицированный подход, чтобы помочь в присвоении имен IUPAC почти всем типам
соединений. Это не исчерпывающая ссылка на номенклатуру IUPAC. тем не мение
этого более чем достаточно для всех студентов на различных уровнях их
кривая обучения.
А
используется краткий и унифицированный подход, чтобы помочь в присвоении имен IUPAC почти всем типам
соединений. Это не исчерпывающая ссылка на номенклатуру IUPAC. тем не мение
этого более чем достаточно для всех студентов на различных уровнях их
кривая обучения. То
Корни слов, используемые для обозначения разной длины углеродной цепи (до 20), показаны ниже.
То
Корни слов, используемые для обозначения разной длины углеродной цепи (до 20), показаны ниже.

 во имя ИЮПАК.
во имя ИЮПАК. Это не полный справочник.
Это не полный справочник. Они имеют более низкий приоритет, чем двойные и тройные связи.
Они имеют более низкий приоритет, чем двойные и тройные связи.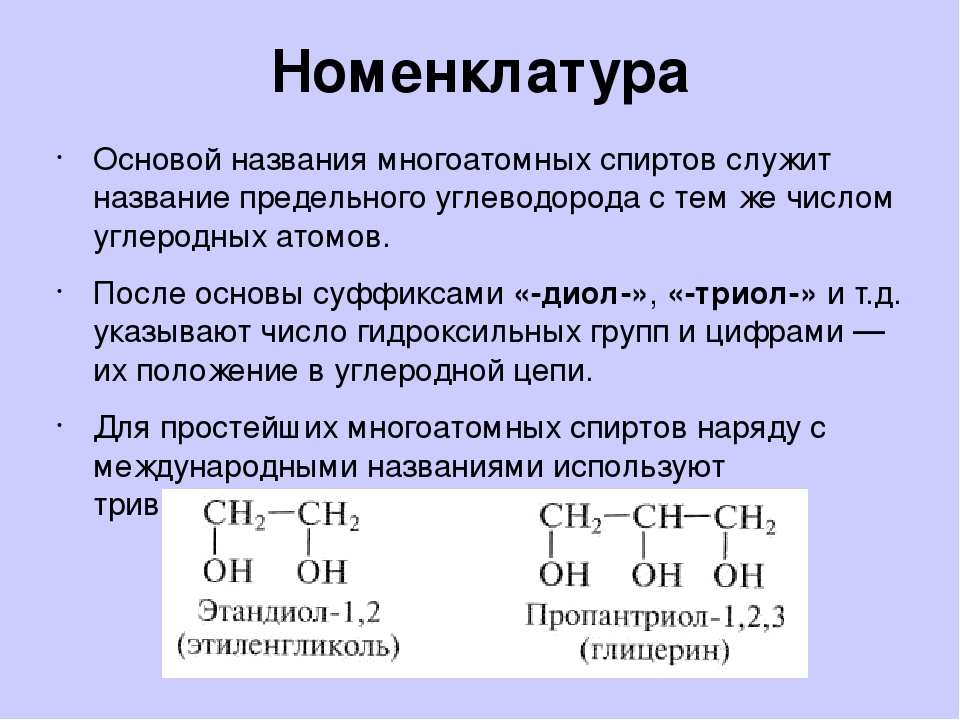 Это необязательно и необязательно, если молекула содержит функциональную группу или .
Это необязательно и необязательно, если молекула содержит функциональную группу или . На 2-й улице есть алкогольная группа.
углерод.
На 2-й улице есть алкогольная группа.
углерод.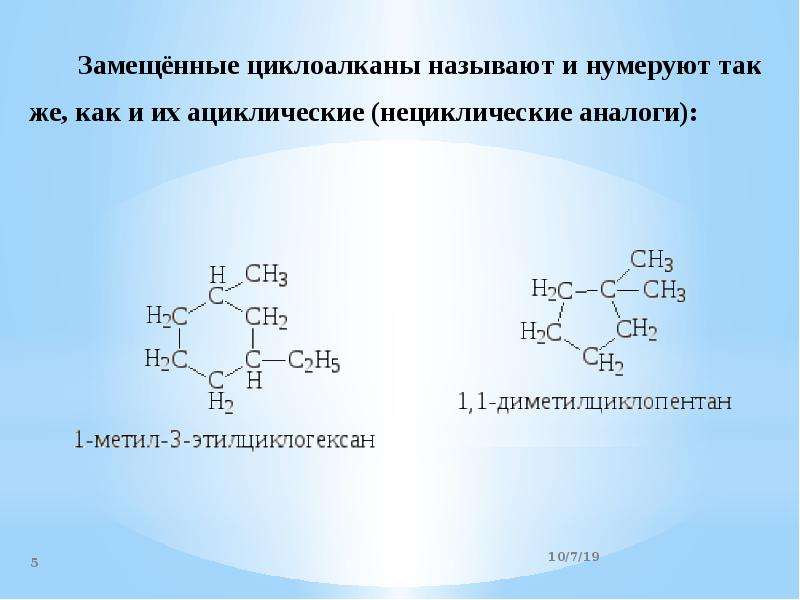
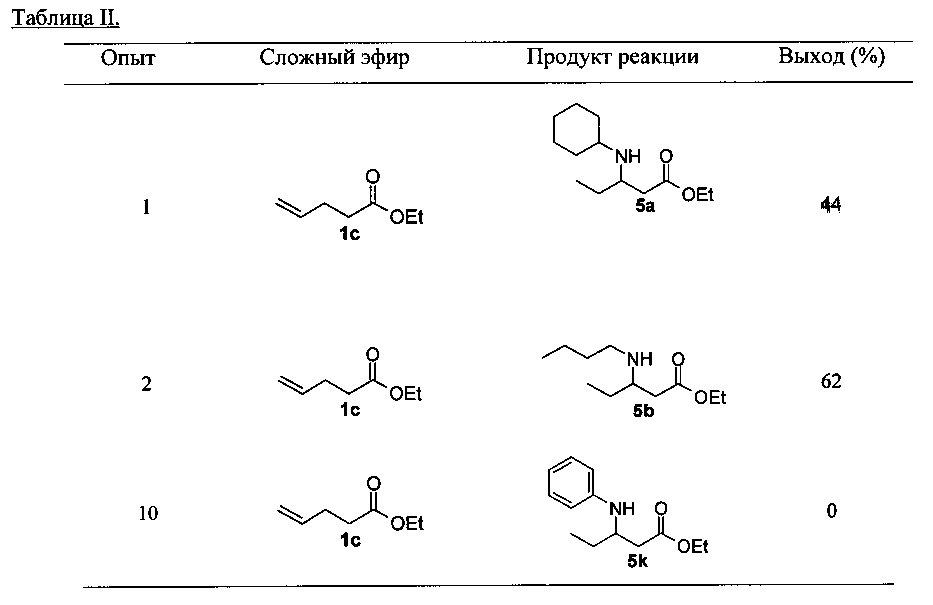


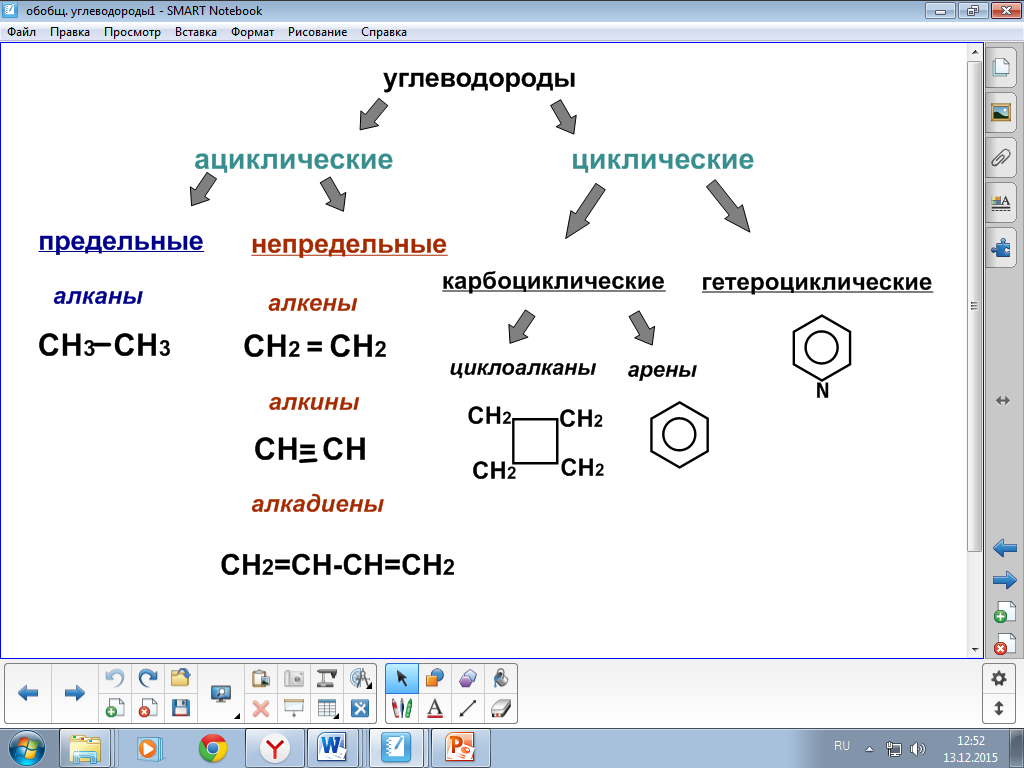
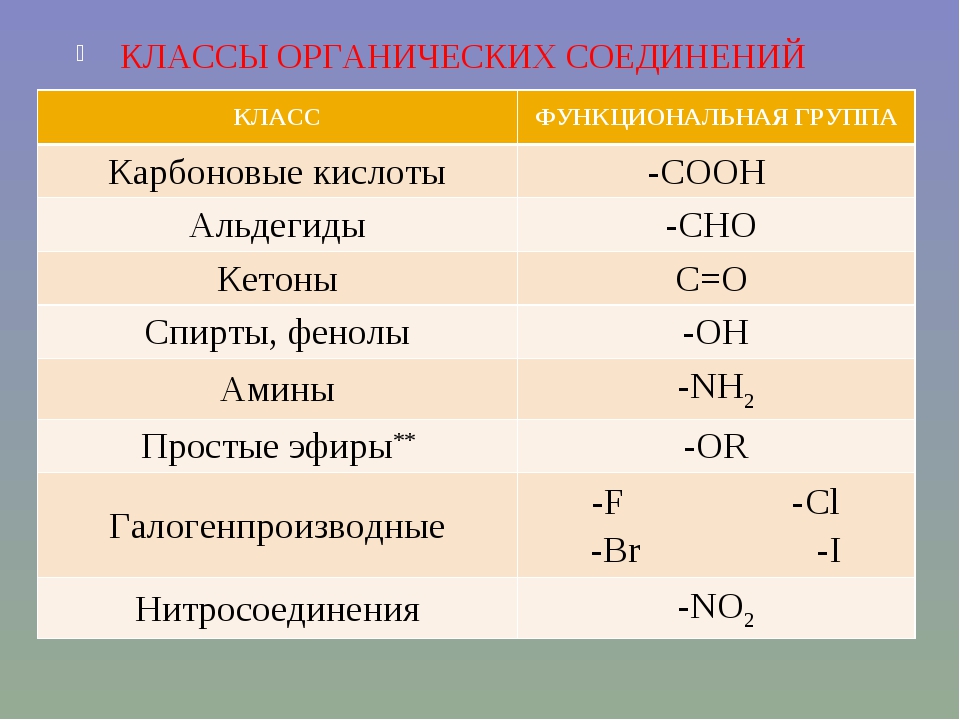 Однако изобутильная и изопропильная группы расположены в алфавитном порядке под
«i», а не под «b» или «p».
Однако изобутильная и изопропильная группы расположены в алфавитном порядке под
«i», а не под «b» или «p».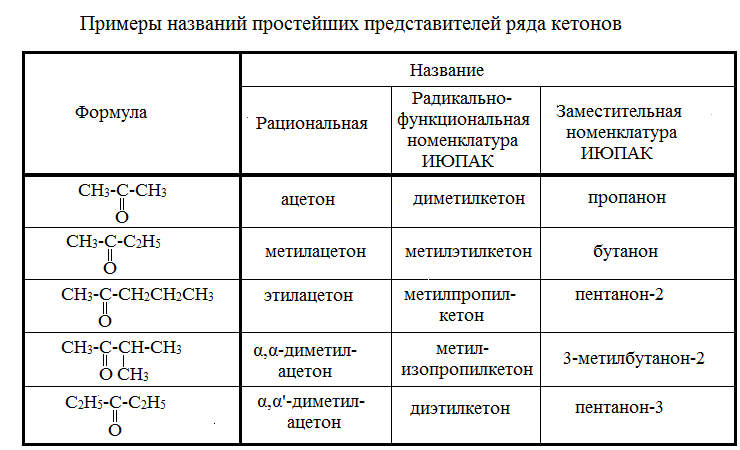 Положение метильной группы обозначено локантом, 6.
Положение метильной группы обозначено локантом, 6.