ТЕСТ ПО ОРГАНИЧЕСКОЙ ХИМИИ НА ТЕМУ «Предельные углеводороды»(10 класс)
Тест Предельные у/в
частьА
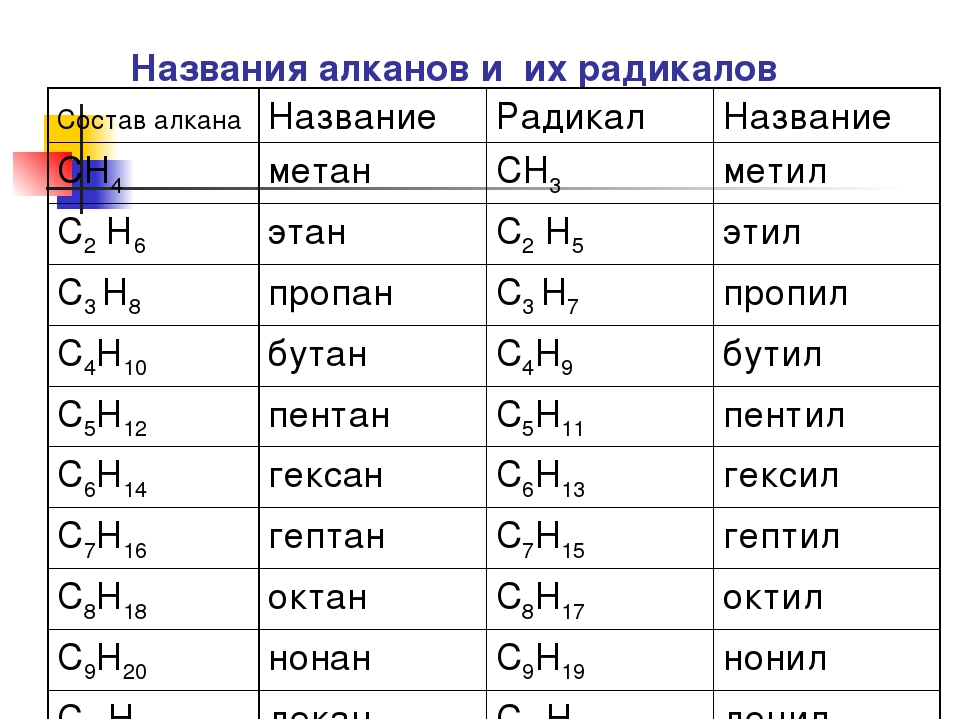
Укажите название углеводорода С3 Н8
а) этан б) пропан в) метан г) бутан
2.Укажите формулу бутана
а) С4Н10 б)С2 Н6 в) С3Н8 г) СН4
3.Укажите название радикала –СН3
а)бутил б) метан в) этил г)метил
4.Укажите формулу радикала этила
а)-С2Н6 б)-С3Н7 в) –С2Н5 г)-с4н9
5.Укажите, какое суждение является правильным:
а) изомеры – вещества, имеющие одинаковый состав, но разное химическое строение и поэтому разные свойства
б)гомологи- вещества- , отличающиеся по своему составу на гомологическую разность – СН2, но имеющие сходное строение и близкие свойства
а) верно только А б) верно только Б в) верны оба суждения г)оба суждения неверны
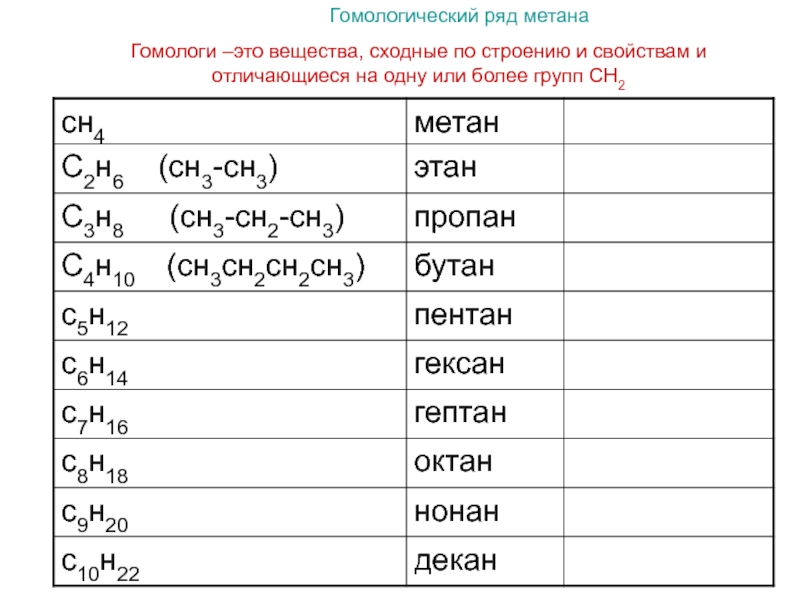
6. Укажите общую формулу гомологического ряда метана
Укажите общую формулу гомологического ряда метана
а)СnH2n+2 ,б )CnH2n в) CnH 2n-2 г)CnH2n-6
7.Углеводород, относящийся к предельным углеводородам,- это:
а)С6Н8 б) С5 Н10 в) С7 Н14 г) С8 Н 18
8.Определите число атомов водорода в молекуле гомолога метана, если там имеется 11 атомов углерода.
а) 26 б) 24 в) 22 г) 28
Часть В
Установите соответствие между названием предельного углеводорода и его формулой .Ответ дайте в виде последовательности цифр , соответствующих буквам по алфавиту
Название углеводорода Формула углеводорода
а) этан 1)СН
4б) пентан 2) С3Н8
в) метан 3) С5Н12
г) бутан 4) С2Н6
д) пропан 5) С4Н10
2. Установите соответствие между атомами водорода в молекулах гомологов метана и числом атомов углерода в этих молекулах. Ответ дайте в виде последовательности цифр , соответствующих буквам по алфавиту.
Установите соответствие между атомами водорода в молекулах гомологов метана и числом атомов углерода в этих молекулах. Ответ дайте в виде последовательности цифр , соответствующих буквам по алфавиту.
число атомов Н число атомов С
а)16 1) 11
б)22 2) 7
в)24 3) 5
г)18 4)10
д)12 5)8
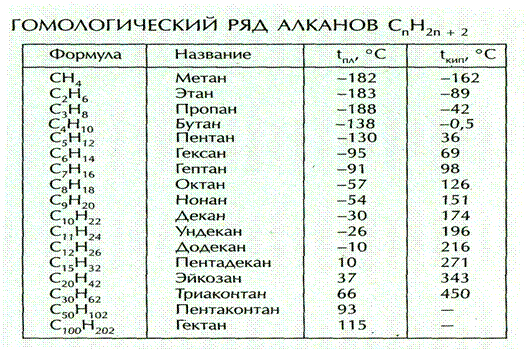
Гомологический ряд общая формула. Гомологические ряды
Спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность . Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула С n H 2n+2): метан CH 4 , этан C 2 H 6 , пропан С 3 H 8 и т. д.; гомологической разностью этого ряда является метиленовое звено -СН 2 -.
Энциклопедичный YouTube
1 / 3
1.1. Алканы: Строение, номенклатура, изомерия. Подготовка к ЕГЭ по химии
Химия. Органическая химия: Гомологический ряд алкенов. Центр онлайн-обучения «Фоксфорд»
Органическая химия: Гомологический ряд алкенов. Центр онлайн-обучения «Фоксфорд»
№ 9. Органическая химия. Тема 6. Алканы. Часть 1. Гомологический ряд алканов
Субтитры
Гомология и структура соединений
В основе понятия гомологии в органической химии лежит фундаментальное положение о том, что химические и физические свойства вещества определяются структурой его молекул: эти свойства определяются как функциональными группами соединения (гидроксил спиртов , карбоксильная группа карбоновых кислот , арильная группа ароматических соединений и т. п.), так и его углеродным скелетом.
Сам комплекс химических свойств и, соответственно, принадлежность соединения к определённому классу, определяется именно функциональными группами (так, наличие карбоксильной группы определяет проявление соединением кислотных свойств и его принадлежность к классу карбоновых кислот), но на степень проявления химических свойств (например, реакционная способность и константа диссоциации) или физические свойства (температуры кипения и плавления , показатель преломления и т.
В случае подобия углеродных скелетов соединений, то есть отсутствия изомерии , формулу гомологичных соединений можно записать как X-(СН 2) n -Y , соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений (например, H-(СН 2) n -COOH — алифатические карбоновые кислоты). Таким образом, соединения-гомологи принадлежат к одному классу соединений, и свойства ближайших гомологов наиболее близки.
В гомологических рядах наблюдается закономерное изменение свойств от младших членов ряда к старшим, однако такая закономерность может нарушаться, в первую очередь, в начале ряда, из-за образования водородных связей при наличии функциональных групп, способных к их образованию (см. Рис. 2, температуры плавления).
В данной статье читатель найдет информацию о гомологичных соединениях, узнает, что они собой представляют. Будут рассмотрены общие свойства, формула веществ и их наименования, характеристика. К тому же затронуто будет не только химическое понимание гомологов, но и биологическое.
К тому же затронуто будет не только химическое понимание гомологов, но и биологическое.
Что такое гомологический ряд
Гомологический ряд — это химические соединения, имеющие аналогичный структурный тип, но различающиеся по количеству повторения элементарных единиц вещества. Различие структурных компонентов, а именно одинаковых единиц, и называется гомологической разностью. Гомологами называют вещества, которые находятся в одном и том же гомологическом ряду.
Примером гомологов могут служить спирты, алканы, алкины, кетоны. Если рассматривать гомологичный ряд на примере алканов — простейших представителей (характерная формула: C n H 2 n+2), то видим сходства в структуре ряда представителей данного рода веществ: метан Ch5, этан C2H6, пропан C3H8 и так далее; метиленовые звенья Ch3 являются гомологической разностью в ряде этих веществ.
Общие представления о структуре и гомологии соединений
Представление о гомологии веществ в органической химии базируется на понимании того, что как физические, так и химические качественные характеристики веществ могут определяться молекулярной структурой. Свойства гомологических соединений могут зависеть от строения углеродного скелета и функциональной группы определенного соединения.
Свойства гомологических соединений могут зависеть от строения углеродного скелета и функциональной группы определенного соединения.
Определить химические свойства и, следовательно, принадлежность гомолога к конкретному классу возможно по его функциональной группе. В качестве примера можно обратить внимание на карбоксильную группу, которая отвечает за проявление кислых свойств и принадлежность вещества к карбоновым кислотам. Однако определить уровень проявления химических или физически качеств можно, изучая не только функциональную группу, но и углеродный молекулярный скелет.
Существуют соединения, в которых углеродные скелеты схожи, иными словами, изомерия в них отсутствует. Такие гомологи записываются следующим образом: X — (CH 2) n — Y. Количество метиленовых n-звеньевых единиц является гомологичным и относится к классу соединений одного вида. Подобные виды гомологов являются ближайшими.
Гомологический ряд веществ носит некоторые общие закономерности изменения свойств от младших представителей к старшим. Подобное явление способно нарушаться, что связано с образованием водородной связи при наличии группы, которая может их образовывать.
Подобное явление способно нарушаться, что связано с образованием водородной связи при наличии группы, которая может их образовывать.
Гомология альдегидов
Альдегиды — ряд соединений органического типа, содержащих в себе альдегидную группу — COH. В веществах данного типа карбоксильная группа взаимосвязана с водородным атомом и одной радикальной группой.
Гомологический ряд альдегидов имеет общую формулу R-COH. Одним из элементарных представителей является формальдегид (H-COH), в нем альдегидная группа связана с H. В других, предельных представителях данного ряда соединений водородный атом заменяется на алкин. Общая формула: C n C 2 n+1 -COH.
Альдегиды рассматриваются в качестве веществ, которые произошли в результате замены в парафиновом углеводородном атоме H на группу альдегидную группу. Для таких химических соединений изомерия и гомология является аналогичной другим производным предельных однозамещенных углеводородов.
Наименование альдегидов составляется в зависимости от названия кислоты с таким же количеством углеродных атомов в молекуле, например: Ch4-CHO — уксусный альдегид, Ch4Ch3-CHO — пропионовый альдегид, (Ch4)2CH-CHO — изомасляный альдегид и т.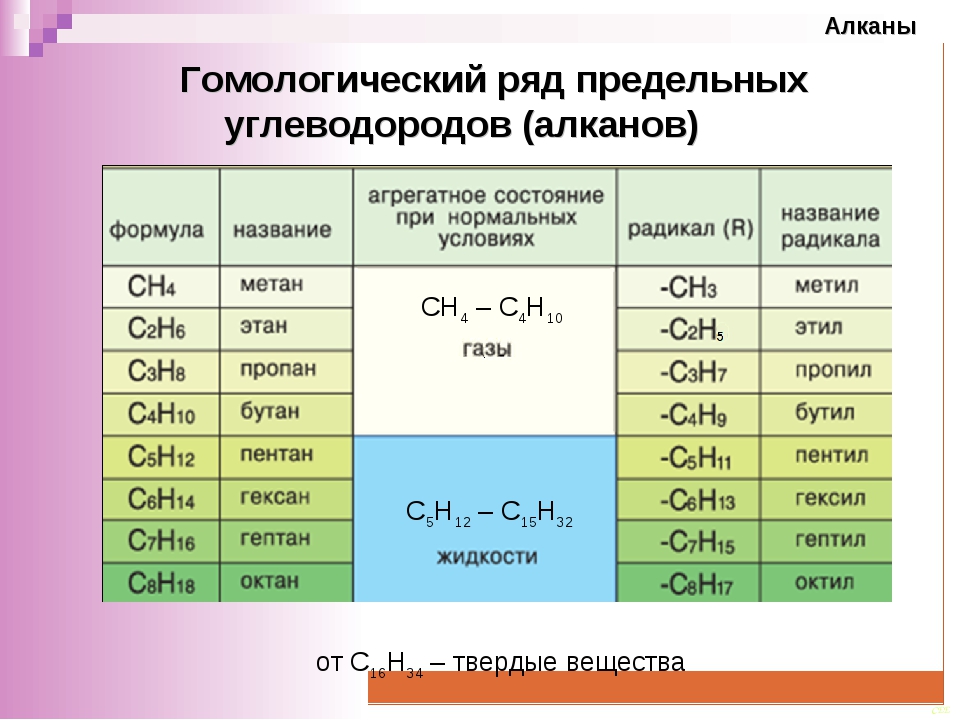 д.
д.
Гомология алкинов
Алкины — это углеводородные химические соединения, несущие в себе тройные связи между атомами C. Они образовывают ряд гомологов с характерной формулой C n H 2 n-2 . Общая особенность положения углеродного атома при тройном количестве связей — состояние sp-гибридизации.
Гомологический ряд алкинов: этин (C2h3), пропин (C3h5), бутин (C4H6), пентин (C5H8), гексин (C6h20), гептин (C7h22), октин (C8h24), нонин (C9h26), децин (C10h28).
Физические свойства алкинов определяются аналогичным образом с алкенами. Например, температура кипения и плавления постепенно возрастает с увеличением длины главенствующей цепи углерода и молекулярной массой. К химическим свойствам можно отнести реакции галогенирования, гидрогалогенирования, гидратацию, полимеризацию. Для алкинов также характерны реакции замещения.
Гомология в биологии
Гомологический ряд используется в биологии, однако носит несколько иной характер. Н. И. Вавилов открыл закон, в соответствии с которым происхождение видов и даже родов растений, сходных между собой, влечет протекание изменчивости по параллельным путям. Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.
Роды и виды, характеризующиеся генетически аналогичными наследственными изменениями, могут послужить способом определения изменений в проявлении признаков для иных, родственных видов. Как и в химической таблице Д. И. Менделеева, гомологический закон делает возможным определение и предсказание существования неизвестных таксономических единиц растений с селективными особенностями, носящими ценный характер. Этот закон был сформулирован благодаря изучению параллелизмов, проявляющихся в наследственной изменчивости поколений.
Заключение
Гомологический ряд веществ, характеризующихся общей формульной структурой, но отличающихся гомологической разностью, позволил человеку увеличить химический потенциал веществ, открывать и получать множество новых соединений, используемых во всех сферах жизнедеятельности. Лучше понять фундаментальное явление о том, что физические и химические качественные характеристики могут определяться молекулярной структурой соединения.
Общая формула гомологического ряда алканов СnН2n+2. Гомологические ряды могут быть построены для всех классов органических соединений. Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой. Для рассмотренного гомологического ряда предельных углеводородов такой формулой будет СnН2n+2 , где n — число атомов углерода. ГОМОЛОГИЧЕСКИЕ РЯДЫ — органические соединения, родственные по химическому составу (напр. спирты).
Гомологические ряды могут быть построены для всех классов органических соединений. Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой. Для рассмотренного гомологического ряда предельных углеводородов такой формулой будет СnН2n+2 , где n — число атомов углерода. ГОМОЛОГИЧЕСКИЕ РЯДЫ — органические соединения, родственные по химическому составу (напр. спирты).
Ch4 — Ch4, этилен Ch3 = Ch3, ацетилен CH ≡ CH. Генетические ряды — группы органических. Ch3 (т. н. гомологическая разность) в молекуле. Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. Группы СН2 называется гомологической разностью.
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические. Функциональные группы – это группы атомов, которые определяют химические свойства данного класса соединений.
Функциональные группы – это группы атомов, которые определяют химические свойства данного класса соединений.
Смотреть что такое «Гомологические ряды» в других словарях:
Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называется алкилож, общая формула алкилов СnН2n+1. В обеих формулах атомы С кольца и не участвующие в реакции атомы Н опускаются (для краткости). На примере одной пары изомеров укажите, в чем сходство и различие этих соединений.
Так, температуры кипения соседних членов в середине Г. р. (для соединений с неразветвлённой цепью) различаются приблизительно на 20-25 °С (у высших членов Г. р. эта величина постепенно уменьшается). Известный пример АЛКАНЫ углеводородной группы. Таким образом, соединения-гомологи принадлежат к одному классу соединений, и свойства ближайших гомологов наиболее близки.
Урок 4. Ковалентные связи органических соединений
Соединения, сходные по химическим свойствам, состав которых отличается друг от друга на группу СН2, называются гомологами. Суффикс -ан является характерным для названия всех алканов. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами.
Суффикс -ан является характерным для названия всех алканов. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами.
Длины связей и валентные углы в молекулах CCl4 и C2H6
Классификация органических соединений. Карбоциклические соединения подразделяются: 1) на алициклические (предельные и непредельные), похожие по свойствам на алифатические; 2) ароматические – содержат бензольные кольца.
Наличие этих групп позволяет разделить типы органических соединений на классы и облегчить их изучение. В полиалкенах с сопряженными (чередующимися) двойными связями происходит делокализация π-электронов. Соединения с двойными связями легко полимеризуются. Алкины (ацетиленовые углеводороды) содержат тройную связь. Общая формула алкина с одной тройной связью Cnh3n–2.
5 атомов) и получают основу названия (5 – пентан). Таким образом, в нашем примере алкан должен быть назван 2,3-диметилпентан. В приведенной выше реакции продуктом будет 2-иодпропан СН3СН(I)СН3. По правилу Марковникова протекает и реакция гидратации, т. е. реакция присоединения воды в присутствии серной кислоты.
По правилу Марковникова протекает и реакция гидратации, т. е. реакция присоединения воды в присутствии серной кислоты.
Полиметилбутадиеновый каучук – это полимер, существующий в природе (натуральный каучук), а полибутадиеновый каучук получен искусственно (С. В. Лебедев, 1932 г.) и называется синтетическим каучуком. В алкинах атомные орбитали углерода у тройной связи имеют sp-гибридизацию (линейное строение).
Алканы (парафины) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарной связью (предельные углеводороды). ГОМОЛОГИЧЕСКИЕ РЯДЫ — ГОМОЛОГИЧЕСКИЕ РЯДЫ, группы органических соединений с одинаковой хим. функцией, но отличающихся друг от друга одной или несколькими метиленовыми (СН2) группировками. СН2-. Группа -СН2- называется гомологической разностью.
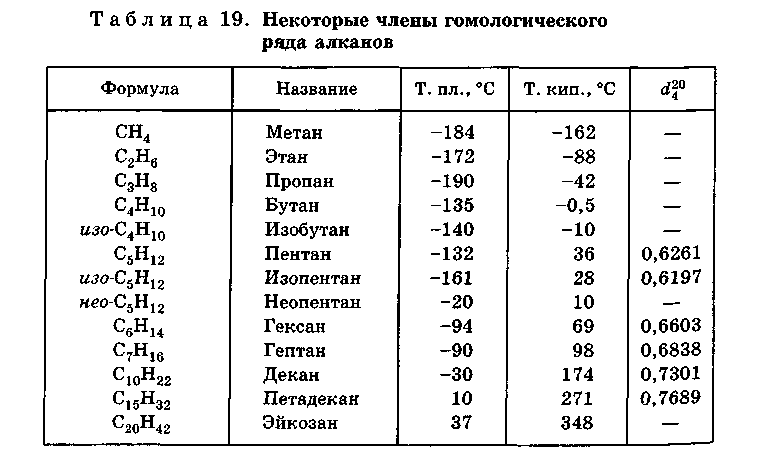
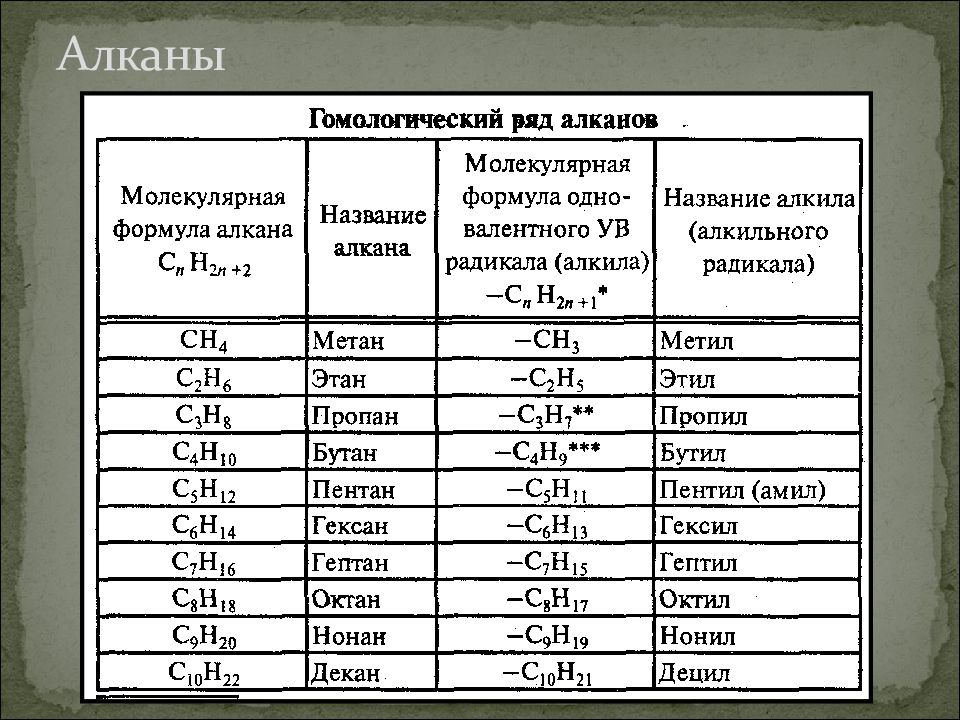
Алканы — класс углеводородов с общей формулой C n H 2n+2 . Родственные соединения, отличающиеся на одну метиленовую группу -CH 2 -, образуют гомологический ряд алканов. Самым простым веществом ряда является метан с одним атомом углерода (CH 4).
Самым простым веществом ряда является метан с одним атомом углерода (CH 4).
Гомологи
Родственные соединения — гомологи — схожи химическими, но различны физическими свойствам. В зависимости от количества атомов углерода выделяют газообразные, жидкие, твёрдые алканы. Первые четыре представителя — газы, гомологи с 5-15 атомами углерода — горючие жидкости. Высшими алканами называют воски и твёрдые вещества с 16-390 атомами углерода.
Рис. 1. Горение метана.
Названия алканов отличаются суффиксом -ан после греческого обозначения числительного:
- ун- или ген- — один;
- до- — два;
- три- — три;
- тетра- — четыре;
- пент- — пять;
- гекс- — шесть;
- гепт- — семь;
- окт- — восемь;
- нон- — девять;
- дек- — десять.
Названия первых четырёх гомологов закрепились исторически. Каждое десятое название «переходит» к следующим девяти веществам, сохраняя числительные приставки и классовый суффикс. В таблице гомологического ряда алканов описаны первые 20 гомологов.
В таблице гомологического ряда алканов описаны первые 20 гомологов.
Название | Формула | Физические свойства |
Газы. Горят синим пламенем, выделяя большое количество тепла | ||
Горючие маслянистые жидкости. Содержатся в нефти. Используются для получения жидкого топлива — бензина, керосина, мазута | ||
Тридекан | ||
Тетрадекан | ||
Пентадекан | ||
Гексадекан | Воски и твёрдые вещества. | |
Гептадекан | ||
Октадекан | ||
Нанадекан | ||
Температуры плавления и кипения алканов повышаются с увеличением количества атомов углерода и, соответственно, молекулярной массы. При этом всем алканам свойственна плотность меньше единицы. Алканы плавают на поверхности воды и растворяются только в органических растворителях.
Изомеры
Алканы — нециклические насыщенные углеводороды. Молекулы представляют собой длинные или разветвлённые углеродные цепи. Гомологичные алканы могут образовывать изомеры. Чем больше атомов углерода, тем больше вариантов изомеров. Первые три алкана (метан, этан, пропан) изомеров не образуют. Бутан, пентан, гексан имеют только структурные изомеры. У бутана их два: н-бутан и изобутан. Пентан образует н-пентан, изопентан, неопентан. Гексан имеет пять изомеров: н-гексан, изогексан, 3-метилпентан, диизопропил, неогексан.
Гомологи от гептана и выше помимо структурных изомеров образуют стереоизомеры или пространственные изомеры, отличающиеся положением атомов в пространстве. Две молекулы идентичны по строению и структуре, но выглядят как предмет и его зеркальное отражение.
Рис. 2. Стереоизомеры.
Длинные названия изомеров составляются по международной номенклатуре ИЮПАК. Словесное обозначение состоит из трёх частей:
- цифр и приставки, обозначающих количество присоединённых групп;
- названия групп;
- названия главной (самой длинной) цепи.
Например, название изомера гептана 2,3-диметилпентан, указывает, что молекула состоит из пяти атомов углерода (пентана) и двух метильных групп, присоединённых ко второму и третьему атомам углерода.
Для отображения строения изомеров используются структурные формулы. Метильная группа -CH 3 записывается либо через черту вверх или вниз от атома углерода, либо в скобочках после группы -CH 2 в углеродной цепи. Например, H 3 C-CH 2 -CH(CH 2 CH 3)-CH 2 -CH 3 .
Например, H 3 C-CH 2 -CH(CH 2 CH 3)-CH 2 -CH 3 .
Рис. 3. Структурная формула.
Количество изомеров для каждого алкана можно рассчитать математически. Поэтому многие изомеры существуют только в теории. Предполагается, что гектан (C 100 H 202) может иметь 592 107 ∙ 10 34 изомеров, а это далеко не последний алкан в гомологическом ряду.
Что мы узнали?
Алканы образованы гомологическим рядом метана с общей формулой C n H 2n+2 . Каждый последующий гомолог отличается от предыдущего на одну группу CH 2 . С возрастанием атомов углерода в гомологическом ряду меняется физическое состояние веществ. Высшими алканами считаются соединения, содержащие более 15 атомов углерода. Это твёрдые вещества. Жидкости содержат 5-15 атомов углерода, газы — 1-4. Начиная с четвёртого гомолога, все алканы образуют структурные изомеры. Помимо этого алканы от гептана и выше могут образовывать стереоизомеры.
Тест по теме
Оценка доклада
Средняя оценка: 4. 2
. Всего получено оценок: 121.
2
. Всего получено оценок: 121.
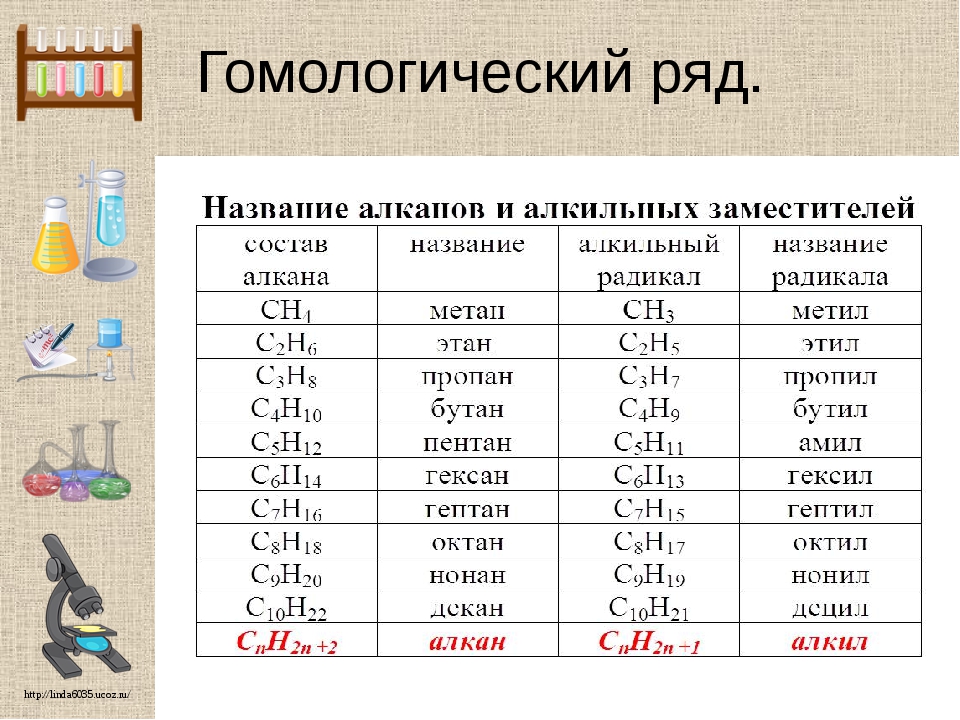
Предельные углеводороды. Свойства предельных углеводородов. Гомологический ряд углеводородов
Предельные углеводородыПредельные углеводороды — их название говорит за себя! Это сложные химические вещества, молекулы которых состоят из атомов водорода и атомов углерода.
Предельные углеводороды образуют гомологический ряд углеводородов, каждое химическое вещество в таком ряду отличается от предыдущего в химическом строении на одно и тоже количество атомов водорода и углерода.
Гомологический ряд углеводородов
- CH4 — метан
- C2H6 — этан
- C3H8 — пропан
- C4H10 — бутан
- C5H12 — пентан
- C6H14 — гексан
- C7H16 — гептан
- C8H18 — октан
- C9H20 — нонан
- C10H22 — декан .
 ..
..
Гомологический ряд углеводородов характеризуется общей формулой, по которой можно определить формулу любого вещества данного ряда. Для предельных углеводородов — эта формула
CnH2n+2
C увеличением молекулярной массы вещества (увеличивается количество атомов углерода и водорода в молекуле) происходит увеличение температуры кипения этого вещества. Поэтому следует отметить, что вещества с CH4 по C4H10 — газы, с C5H12 по C15H32 — жидкости, далее — это твёрдые вещества!
Предельные углеводороды имеют ещё несколько названий — насыщенные углеводороды или парафины.
Предельные углеводороды образуют изомеры — вещества, которые имеют одинаковое число атомов одних и тех же элементов, но разное пространственное строение. Например, группа CH3 (или метил), может соединяться не с первым, а со вторым или третьим атомом водорода.
Изомеры характерны для предельных углеводородов, начиная с C4H10 — бутана.
Слева — формула газа — бутан, справа — тот же бутан, только в форме изомера.
Если от предельного углеводорода отсоединить один атом водорода — то образуется очень активное химическое вещество, которое, практически, не существует в свободном состоянии, мгновенно вступает в реакцию.
В химическом отношении при комнатной температуре все алканы инертные (то есть не вступают в химические реакции). Но при повышении температур — проявляют достаточную химическую активность.
Свойства предельных углеводородов
— реакция замещения: (реакция галогенирования)
— реакция нитрования:
— реакция дегидрогенизации (отщепление водорода):
— реакция горения
— реакция крекинга (расщепление большой молекулы на более мелкие молекулы)
Тема №12631 Задания для подготовки к работе по химии 4 типа заданий (Часть 2)
Тема №12631
261. Составьте уравнение химической реакции между кислородом и магнием. В ответе
Составьте уравнение химической реакции между кислородом и магнием. В ответе
укажите коэффициент возле формулы продукта реакции.
262. Определите массу углекислого газа полученного прокаливанием 100 г известняка,
если известно, что в результате реакции получено 56 г оксида кальция.
263. Напишите общую формулу членов гомологического ряда, к которому принадлежит
бутен-1.
t°
264. Определите и напишите уравнение реакции обмена:
2NaCl + F2 = 2NaF +Cl2
NaOH + HNO3 = NaNO3 + h3O
2K + S = K2S
2Na +Cl2 = 2NaCl
265. При взаимодействии 56 л оксида серы (IV) и 48 л кислорода, определите, какой объем
газа останется не израсходованным (н.у.).
266. Напишите название вещества, имеющего структурную формулу:
267. Определите число атомов кислорода в озоне количеством вещества 0,3 моль.
268. Укажите, как необходимо изменить концентрацию исходных веществ и температуру
для того, чтобы сместить вправо равновесие реакции
N2 (Г) + О2 (Г) ⇄2NO (Г) – Q
269. Укажите, во сколько раз увеличится скорость реакции, если повысить температуру от
Укажите, во сколько раз увеличится скорость реакции, если повысить температуру от
10°С до 50°С, учитывая, что при повышении температуры на каждые 10°С скорость
реакции возрастает в 2 раза.
270. Определите вещество Х и напишите в ответе его название.
СН2=СН2 + НОН
+H
Х
271. Укажите тип гибридизации атомов углерода в молекулах насыщенных
углеводородов.
272. В результате реакции, термохимическое уравнение которой
2С2Н2 (Г) + 5O2 (Г) 4СO2 (Г) + 2Н2O (Г) + 2610 кДж
выделилось 6525 кДж теплоты. Определите объем сгоревшего ацетилена.
273. В каком из предложенных нуклидов: 56Fe,
126I,
58Co,
12C, содержится одинаковое число
протонов и нейтронов?
274. Определите число общих электронных пар между атомами фтора в молекуле F2.
275. Среди предложенных формул: HPO3, HBr, h3SO3, h3CO3, укажите бескислородную
кислоту.
276. Чему равно число ковалентных связей, которое может образовать невозбужденный
атом фосфора за счет неспаренных электронов?
277. Какую массу соли и воды надо взять для приготовления 300 г раствора с массовой
Какую массу соли и воды надо взять для приготовления 300 г раствора с массовой
долей NaCl 15%?
278. Составьте уравнение химической реакции между кислородом и угарным газом. В
ответе укажите коэффициент возле формулы продукта реакции.
279. 10 г кальция вступило в реакцию с 4 г кислорода. Определите массу полученного
оксида кальция.
280. Укажите общую формулу членов гомологического ряда, к которому принадлежит
C10h32.
281. Определите и напишите в ответе уравнение реакции соединения, в результате
которой образуется нерастворимое вещество:
S + O2 = SO2
CO2 +CaO =CaCO3
P2O5 + 3h3O = 2h4PO4
4P + 5O2 = 2P2O5
282. Определить объем ацетилена (при н.у.), который образуется при термическом
крекинге 280 л метана.
283. Напишите название вещества, имеющего структурную формулу:
284. Определите массу 4 моль Mg3N2.
285. Укажите, как повлияет снижение температуры на содержание NO2 равновесной
системе
2NO2 (Г) ⇄N2O4 (Г) + Q
286. Начальная скорость реакции при 40°С составляет 0,54 моль/л∙мин. Вычислите
Начальная скорость реакции при 40°С составляет 0,54 моль/л∙мин. Вычислите
скорость этой реакции при температуре 10°С, если при повышении температуры на
каждые 10°С скорость химической реакции возрастает в 3 раза.
287. Определите вещество Х и запишите в ответе его название.
HC≡CH + h3O
2+ Hg
X
288. Напишите уравнение диссоциации нитрата магния в водном растворе.
289. Вычислите количество теплоты, которое выделится при каталитическом окислении
44,8 л аммиака по термохимическому уравнению реакции
4Nh4 + 5O2 (Г) 4NO (Г) + 6h3O (Ж) + 1169 кДж
290. Определите число частиц (нейтронов) в ядре атома нуклида ванадия 51V.
291. Из предложенных HCl, HF, HI, HBr, укажите вещество, в котором химическая связь
наименее полярная.
292. Среди предложенных формул: NaCl, AgNO3, BaSO4, Mg(NO3)2, определите
нерастворимую соль.
293. Укажите тип кристаллической решетки для веществ, которые являются одними из
самых твердых.
294. Какую массу сульфата натрия и воды надо взять для приготовления раствора массой
241 г с массовой долей Na2SO4 9%?
295. Составьте уравнение химической реакции между оксидом лития и водой. В ответе
Составьте уравнение химической реакции между оксидом лития и водой. В ответе
укажите коэффициент возле формулы продукта реакции.
296. При взаимодействии 10 г кальция с хлором образовалось 27,75 г продукта реакции.
Какая масса хлора прореагировала?
297. Укажите вещество, которое образуется в результате тримеризации ацетилена.
298. Определите и напишите в ответе уравнение реакции разложения, в результате
которой образуется газообразное вещество:
Zn + 2HCl = ZnCl2 + h3
2NaCl + h3SO4 = Na2SO4 + 2HCl
2KClO3 = 2KCl + 3O2
Ca(OH)2 + 2HCl = CaCl2 + 2h3O
299. Определите объем хлороводорода (при н.у.), который можно получить из 120 л хлора.
300. Составьте структурную формулу 3,4-диметилпентена-1.
301. Определите объем 3 моль аммиака при н.у.
302. На основании принципа Ле-Шателье определите, в каком направлении сместится
равновесие в следующей системе при повышении давления:
C3H8 (Г) + 5O2 (Г) ⇄ 3CO2 (Г) + 4h3O (Г)
303. Определите, как изменится скорость некоторой реакции при понижении температуры
от 10°С до 0°С, если известно, что при повышении температуры на каждые 10°С
скорость реакции возрастает в 3 раза.
304. Определите вещество Х и запишите в ответе его название.
СН2=СН−СН3 + НСl Х
305. Укажите максимальное количество электронов на d-подуровне.
306. Определите количество теплоты, которое поглотится при окислении 96 г серы по
термохимическому уравнению реакции
S (Т) + 2СО2 (Г) = SO2 (Г) + 2СО – 269 кДж
307. Среди предложенных: B, Li, Be, F, укажите химический элемент, у которого
наибольший атомный радиус.
308. Какая из предложенных молекул: Н2, N2, F2, О2 имеет наиболее прочную химическую
связь в молекуле?
309. Среди предложенных формул: h3SO4, h3S, HBr, HPO3 определите двухосновную
бескислородную кислоту.
310. Укажите формулу вещества из предложенных: S, h3SO4, h3S, SO2, в которой сера
проявляет минимальную степень окисления.
311. Определите массу раствора, который образуется при растворении в 90 г воды 10 г
кухонной соли.
312. Составьте уравнение химической реакции взаимодействия воды и натрия. В ответе
укажите коэффициент, стоящий перед формулой газообразного продукта реакции.
313. Сожгли 3,1 г фосфора, при этом образовался оксид фосфора (V) массой 7,1 г. Какая
масса кислорода прореагировала?
314. Укажите общую формулу гомологического ряда, к которому принадлежит
бутадиен 1,3.
315. Определите и запишите в ответе реакцию, которая не является окислительно-
восстановительной:
Fe2O3 + 3CO = 2Fe + 3CO2
P2O5 + 5C = 5CO + 2P
CuO +CO =Cu +CO2
BaO +CO2 =BaCO3
316. Определите объем углекислого газа (при н.у.), который образуется при сгорании
метана в 40 л кислорода.
317. Изобразите структурную формулу 3-метил-4-этилгексина-1.
318. Определите число атомов водорода в сероводороде количеством вещества 5 моль.
319. В какую сторону сместится химическое равновесие в реакции, уравнение которой
2CO + O2 ⇄ 2CO2 + Q,
в случае повышения температуры.
320. При 150°С некоторая реакция заканчивается за 16 минут. Принимая, что при
повышении температуры на 10°С скорость реакции возрастает в 2 раза, определите,
через какое время закончится эта реакция, если проводить ее при 170°С.
321. Определите вещество Х и запишите в ответе его название, если известно, что
вещества взаимодействуют в соотношении 1:1.
СН≡С−СН3 + HBr X
322. Напишите название фракции, которая выделяется при перегонке нефти и содержит
углеводороды от С5Н12 до С11Н24.
323. В соответствии с термохимическим уравнением реакции
СН4 (Г) + 2О2 (Г) = СО2 (Г) + 2Н2О (Г) + 880 кДж
определите количество теплоты, выделившееся при окислении 89,6 л метана.
Часть 2
2.1. Задания содержат семь вариантов ответов, среди которых три
правильных. Выберите правильные ответы и внесите их в бланк ответа в виде
отметки «Х».
1. Глюкозу характеризует:
А) нерастворимость в воде
Б) формула С5Н10О5
В) подвергается брожению
Г) образование глицерида при взаимодействии с фосфорной кислотой
Д) взаимодействие с гидроксидом меди (II) с образованием раствора синего цвета
Е) образование сорбита при взаимодействии с водородом
Ж) ароматические свойства
2. В водном растворе с выпадением осадка протекает реакция
В водном растворе с выпадением осадка протекает реакция
А) хлорид алюминия + гидроксид калия
Б) карбонат натрия + сульфат калия
B) сульфит калия + соляная кислота
Г) сульфат калия + гидроксид натрия
Д) карбонат калия + гидроксид кальция
Е) сульфат натрия + хлорид бария
Ж) хлорид натрия + сульфат алюминия
3. Укажите формулы солей, в водном растворе которых рН > 7
А) NaNO3
Б) Na2SO3
В) ZnCl2
Г) KСl
Д) Na3РO4
Е) Na2SO4
Ж) NaСН3СОО
4. Укажите вещества гомологического ряда аренов
А) метанол
Б) толуол
В) бензол
Г) гексанол
Д) пропанол
Е) стирол
Ж) циклогексанол
5. Выберите из перечня веществ те, при электролизе водного раствора которых на
катоде выделяется металл:
А) нитрат ртути (II)
Б) хлорид меди (II)
B) фторид натрия
Г) сульфат никеля
Д) гидроксид лития
Е) сульфид натрия
Ж) карбонат натрия
6. К характеристикам метиламина относятся:
А) проявляет основные свойства
Б) имеет окраску
В) является газообразным веществом
Г) не взаимодействует с водой
Д) реагирует с этиламином
Е) является более сильным основанием, чем аммиак
Ж) относится к классу аренов
7. В водном растворе с образованием воды протекает реакция
В водном растворе с образованием воды протекает реакция
А) хлорид натрия + гидроксид кальция
Б) азотная кислота + карбонат калия
B) гидроксид кальция + соляная кислота
Г) сульфат калия + гидроксид натрия
Д) гидроксид натрия + азотная кислота
Е) сульфат натрия + хлорид бария
Ж) сульфат алюминия + хлорид натрия
8. Укажите формулы солей, в водном растворе которых рН среды имеет значение
меньше 7
А) K2S
Б) АlСl3
В) KСl
Г) K2SO3
Д) Fe(NO3)3
Е) Na3РO4
Ж) ZnBr2
9. Укажите вещества гомологического ряда этиленовых углеводородов
А) пропан
Б) пропен
В) ацетон
Г) гексен
Д) этен
Е) бутадиен
Ж) полиэтилен
10. При электролизе водного раствора, какой соли на катоде и аноде будут
выделяться газообразные вещества?
А) AgNO3
Б) KNO3
B) CuCl2
Г) ZnCl2
Д) SnCl2
Е) Na2SO4
Ж) K2СО3
11. Какие утверждения о свойствах белков верны:
А) при добавлении белка к свежеприготовленному гидроксиду меди (II) появляется
желтое окрашивание
Б) попадание на белок азотной кислоты вызывает появление желтого окрашивания
В) при добавлении к щелочному раствору белка ацетата свинца (II) образуется
осадок черного цвета
Г) появление фиолетового окрашивания при проведении биуретовой пробы
свидетельствует о наличии пептидных связей
Д) пиридин – катализатор белковой природы, ускоряющий биохимические процессы
в организме
Е) первичная структура белка не разрушается даже при нагревании до 300°С
Ж) белки – мономеры для построения более сложных молекул
12. С раствором азотной кислоты реагируют
С раствором азотной кислоты реагируют
А) оксид кремния (IV)
Б) карбонат аммония
B) хлорид бария
Г) медь
Д) ацетат натрия
Е) оксид углерода (IV)
Ж) азот
13. Укажите формулы солей, добавление которых к раствору KСl приведет к
уменьшению значения рН среды
А) (Nh5)2S
Б) Nh5NO3
В) Al(NO3)3
Г) ZnCl2
Д) NaCl
Е) K3РO4
Ж) KNO3
14. Укажите моносахариды
А) глюкоза
Б) сахароза
В) целлюлоза
Г) крахмал
Д) фруктоза
Е) рибоза
Ж) глицерин
15. Выберите правильные утверждения. Во время электролиза водного раствора
сульфата меди (II)…
А) на аноде восстанавливается медь
Б) на аноде выделяется кислород
В) на катоде выделяется водород
Г) в растворе образуется гидроксид меди (II)
Д) на катоде окисляется кислород
Е) на катоде восстанавливается медь
Ж) в растворе накапливается серная кислота
16. Из перечисленных характеристик к метиламину относятся:
А) не имеет запаха
Б) реагирует с этаном
В) горит на воздухе
Г) является донором электронной пары
Д) изменяет окраску лакмуса на синюю
Е) проявляет амфотерные свойства
Ж) является углеводородом
17. С разбавленным раствором серной кислоты реагируют
С разбавленным раствором серной кислоты реагируют
А) гидроксид алюминия
Б) угарный газ
B) метан
Г) оксид цинка
Д) медь
Е) карбонат магния
Ж) сера
18. Укажите соли, водные растворы которых окрашиваются фенолфталеином
А) ортофосфат натрия
Б) силикат кальция
В) хлорид натрия
Г) сульфит калия
Д) хлорид железа (III)
Е) фторид калия
Ж) нитрат аммония
19. Укажите названия веществ гомологического ряда ацетиленовых углеводородов
А) гексин
Б) ацетилен
В) пропилен
Г) этиленгликоль
Д) пропин
Е) метаналь
Ж) фенол
20. Укажите, при электролизе водных растворов каких солей образуется водород
А) AgNO3
Б) Hg(NO3)2
B) СaCl2
Г) CuSO4
Д) NaNO3
Е) BaBr2
Ж) HgSO4
21. Метилпропиламин взаимодействует с
А) бутаном
Б) бромоводородной кислотой
В) кислородом
Г) гидроксидом натрия
Д) бензолом
Е) водой
Ж) гелием
22. Ортофосфорная кислота реагирует с
А) сульфатом натрия
Б) гидроксидом бария
B) сульфатом калия
Г) аммиаком
Д) гидрофосфатом аммония
Е) оксидом кремния
Ж) углекислым газом
23. Укажите вещества, добавление водных растворов которых к водному раствору
Укажите вещества, добавление водных растворов которых к водному раствору
нитрата железа (III) приводит к ослаблению гидролиза
А) нитрат калия
Б) хлорид железа (II)
В) азотная кислота
Г) хлороводород
Д) нитрат меди (II)
Е) гидроксид калия
Ж) серная кислота
24. Укажите полисахариды
А) сахароза
Б) гликоген
В) галактоза
Г) мальтоза
Д) целлюлоза
Е) крахмал
Ж) полиэтилен
25. Укажите правильные утверждения. При электролизе:
А) на аноде катионы принимают электроны и восстанавливаются
Б) на катоде анионы отдают электроны и окисляются
B) на катоде катионы принимают электроны и восстанавливаются
Г) протекает окислительно-восстановительная реакция
Д) на аноде анионы принимают электроны и восстанавливаются
Е) на катоде анионы принимают электроны и восстанавливаются
Ж) на аноде анионы отдают электроны и окисляются
26. Глюкоза взаимодействует с
А) карбонатом магния
Б) гидроксидом меди (II)
В) водородом
Г) сульфатом калия
Д) аммиачным раствором оксида серебра (I)
Е) водой
Ж) ацетоном
27. Выберите реагенты, которые необходимо использовать, чтобы реакция прошла
Выберите реагенты, которые необходимо использовать, чтобы реакция прошла
согласно схеме: Ba2+ + SO4
2−
= BaSO4
А) BaCl2 + NaOH
Б) FeCl3 + Ba(OH)2
B) Ba(NO3)2 + h3SO4
Г) BaSO4 + HCl
Д) BaCl2 + K2SO4
Е) Ba(NO3)2 + Li2SO4
Ж) BaSO4 + h3О
28. Для усиления гидролиза сульфида калия к раствору необходимо добавить
А) K2SO4
Б) KОН
В) h3S
Г) NaOH
Д) НСl
Е) KHS
Ж) K2SiO3
29. Укажите вещества гомологического ряда метана
А) ацетат натрия
Б) пентан
В) бензол
Г) октан
Д) 2-метилбутан
Е) метаналь
Ж) метанол
30. Выберите правильное утверждение. Во время электролиза расплава хлорида
натрия
А) на аноде восстанавливается натрий
Б) на катоде окисляются группы ОН-
В) на катоде восстанавливается натрий
Г) на аноде анионы отдают электроны, и образуется водород
Д) на катоде окисляются ионы Na+
Е) на аноде выделяется газообразный хлор
Ж) на электродах образуются натрий и хлор
31. Из приведенных характеристик к диметиламину относятся:
Из приведенных характеристик к диметиламину относятся:
А) имеет специфический запах
Б) относится к третичным аминам
В) при комнатной температуре находится в жидком состоянии
Г) содержит один атом азота с неподеленной электронной парой
Д) реагирует с кислотами
Е) является более слабым основанием, чем аммиак
Ж) негорюч
32. В водном растворе возможна реакция
А) сульфат железа (II) + гидроксид калия
Б) нитрат аммония + соляная кислота
B) дигидрофосфат калия + гидроксид натрия
Г) сульфат алюминия + нитрат бария
Д) карбонат натрия + карбонат лития
Е) нитрат калия + сульфат натрия
Ж) гидроксид натрия + гидроксид калия
33. Укажите соли, подвергающиеся полному и необратимому гидролизу
А) силикат натрия
Б) сульфид калия
В) хлорид бария
Г) карбонат алюминия
Д) сульфид железа (III)
Е) сульфид алюминия
Ж) сульфат алюминия
34. Укажите углеводороды гомологического ряда алканов
А) 3-метилоктан
Б) пентан
В) этилен
Г) ацетилен
Д) пропан
Е) пропен
Ж) изопрен
35. Выделение кислорода происходит при электролизе водного раствора соли
Выделение кислорода происходит при электролизе водного раствора соли
А) MgСl2
Б) CuSO4
B) NaBr
Г) FeBr2
Д) K3PO4
Е) ZnBr2
Ж) NaNO3
36. Какие утверждения о свойствах белков верны:
А) первичная структура белков определяется последовательностью остатков α-
аминокислот
Б) при денатурации белков их первичная структура не разрушается
В) в состав полипептидной цепи входят как остатки -аминокислот, так и другие
группировки
Г) при проведении биуретовой пробы появляется черное окрашивание
Д) при попадании азотной кислоты на белки появляется желтое окрашивание
Е) стабильность первичной структуры белков определяется существованием
водородных связей между соседними витками цепи
Ж) реагируют с алканами
37. В водном растворе с выделением газообразного продукта протекает реакция
А) хлорид алюминия + гидроксид калия
Б) нитрат натрия + сульфит калия
B) сульфид калия + соляная кислота
Г) хлорид аммония + гидроксид натрия
Д) соляная кислота + водный раствор аммиака
Е) сульфат натрия + серная кислота
Ж) карбонат кальция + азотная кислота
38. Одинаковую реакцию среды имеют растворы карбоната натрия и
Одинаковую реакцию среды имеют растворы карбоната натрия и
А) нитрата меди (II)
Б) хлорида натрия
В) нитрата кальция
Г) сульфида калия
Д) сульфида алюминия
Е) селенита калия
Ж) сульфита калия
39. Укажите вещества гомологического ряда предельных одноатомных спиртов
А) пентанол
Б) глицерин
В) фенол
Г) этанол
Д) пропанол
Е) глюкоза
Ж) фенол
40. Выберите правильные утверждения. Во время электролиза расплава хлорида
меди (II)…
А) на аноде окисляется хлор
Б) анод покрывается медью
В) на катоде выделяется хлор
Г) на катоде восстанавливаются катионы Cu2+ и выделяется медь
Д) на аноде окисляется медь
Е) на аноде выделяется газообразный хлор
Ж) хлорид-ионы на аноде окисляются до простого вещества
41. Из приведенных характеристик к анилину относятся:
А) неподеленная электронная пара атома азота находится в сопряжении с
ароматической -системой
Б) хорошо растворим в воде
В) взаимодействует с бромной водой с образованием 1,3,5-триброманилина
Г) взаимодействует с бромной водой с образованием 2,4,6-триброманилина
Д) сильное основание, изменяет окраску фенолфталеина
Е) может быть получен из нитробензола по реакции Зинина
Ж) не окисляется сильными окислителями
42. В водном растворе с образованием воды протекает реакция
В водном растворе с образованием воды протекает реакция
А) сернистая кислота + гидроксид калия
Б) азотная кислота + ортофосфат калия
B) гидроксид натрия + соляная кислота
Г) сульфат калия + гидроксид алюминия
Д) гидрокарбонат бария + азотная кислота
Е) сульфат натрия + хлорид бария
Ж) силикат натрия + соляная кислота
43. Щелочную реакцию среды имеет раствор каждой из двух солей
А) KCl и Na2S
Б) K2SiO3 и Na2CO3
В) FeCl2 и NН4Cl
Г) CuSO4 и Na2SO4
Д) ZnCl2 и CrCl3
Е) K2SO3 и K2SеO3
Ж) Na3PO4 и K2CO3
44. Укажите названия веществ гомологического ряда этиленовых углеводородов
А) пропен
Б) пентен
В) пропин
Г) метан
Д) этен
Е) бутадиен-1,3
Ж) этин
45. Выберите ряд веществ, которые получают в промышленности электролизом
водных растворов
А) Cu, NaOH, Cl2
Б) KОН, Mg(OH)2, Cl2, F2
B) F2, KОН, Cl2, NaOH
Г) Cl2, NaOH, KОН, Н2
Д) Fe, SO2, N2
Е) KOH, Cl2, h3, O2
Ж) Сl2, І2, KОН, NaOH
46. Анилин взаимодействует с
Анилин взаимодействует с
А) соляной кислотой
Б) водным раствором аммиака
В) серной кислотой
Г) гидроксидом натрия
Д) бромной водой
Е) хлоридом натрия
Ж) метаном
47. В водном растворе возможны реакции между следующими реагентами
А) нитрат железа (III) + хлорид калия
Б) сульфат магния + нитрат калия
B) сульфат калия + соляная кислота
Г) сульфат железа (III) + гидроксид натрия
Д) карбонат калия + азотная кислота
Е) нитрат серебра + хлорид натрия
Ж) сульфат калия + нитрат бария
48. Одинаковую реакцию среды имеют растворы хлорида меди (II) и
А) хлорида натрия
Б) ацетата кальция
В) хлорида калия
Г) нитрата цинка
Д) бромида цинка
Е) бромида аммония
Ж) бромида бария
49. Укажите моносахариды
А) глюкоза
Б) сахароза
В) целлюлоза
Г) крахмал
Д) фруктоза
Е) дезоксирибоза
Ж) гликоген
50. Не получают из природных веществ методом электролиза расплава
А) кальций
Б) калий
B) ртуть
Г) натрий
Д) золото
Е) железо
Ж) алюминий
51. Для крахмала и целлюлозы верны следующие утверждения:
Для крахмала и целлюлозы верны следующие утверждения:
А) имеют общую формулу (С6Н10О5)n
Б) имеют одинаковую степень полимеризации
В) используются для получения искусственных волокон
Г) вступают в реакцию «серебряного зеркала»
Д) подвергаются гидролизу
Е) используются для промышленного получения спирта
Ж) являются продуктами питания человека
52. Карбонат калия будет реагировать в водном растворе с
А) гидроксидом бария
Б) сульфатом натрия
B) хлоридом бария
Г) иодидом магния
Д) нитратом рубидия
Е) бромидом аммония
Ж) гидроксидом калия
53. Укажите вещества, подвергающиеся гидролизу
А) фторид калия
Б) этилэтаноат
В) хлорид калия
Г) бромид калия
Д) иодид калия
Е) сульфат калия
Ж) карбид кальция
54. Укажите жиры
А) глицерид олеиновой кислоты
Б) динитроглицерин
В) глицерат меди (II)
Г) глицерофосфат
Д) глицерид пальмитиновой кислоты
Е) глицерид уксусной кислоты
Ж) глицерид стеариновой кислоты
55. Укажите соли, при электролизе водных растворов которых можно получить
Укажите соли, при электролизе водных растворов которых можно получить
водород на катоде и кислород на инертном аноде
А) K2SO4, Na3PO4, KNO3
Б) CuCl2, NaCl, BaCl2
B) NiSO4, NaNO3, K3PO4
Г) Cu(NO3)2, K2CO3, FeSO4
Д) Ba(NO3)2, Na2SO4, ZnCl2
Е) K2СО3, NaNO3, Na2SO4
Ж) Ca(NO3)2, Mg(NO3)2, K2СО3
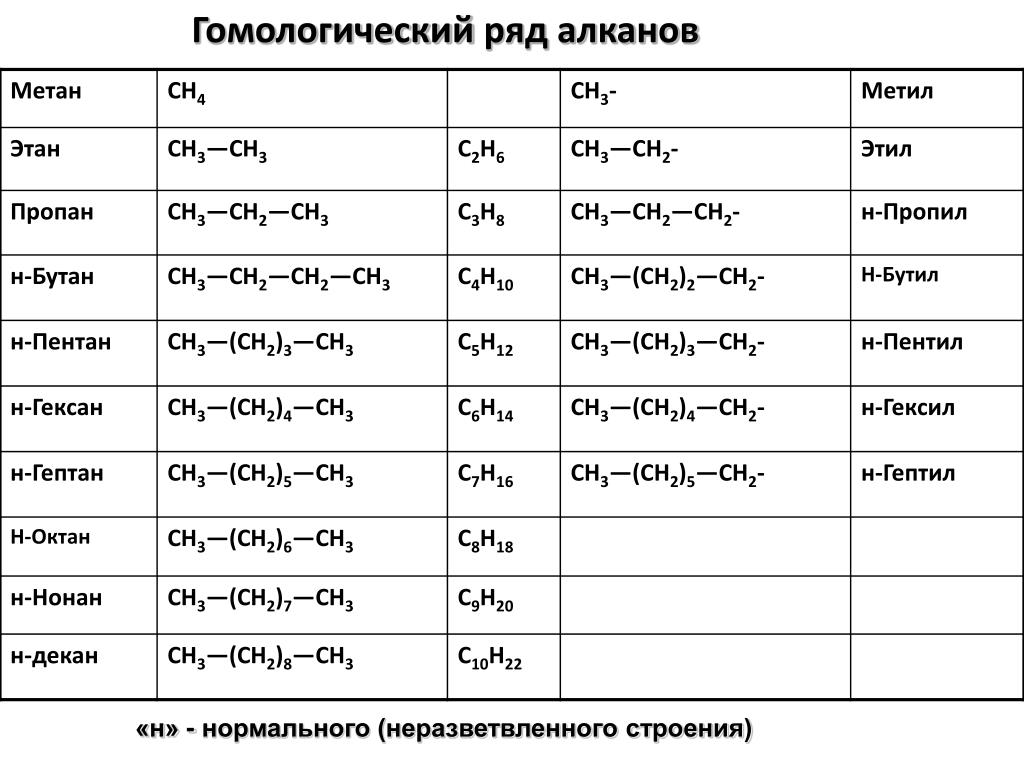
Строение алканов — урок. Химия, 8–9 класс.
Насыщенные углеводороды — соединения углерода с водородом, в молекулах которых все связи одинарные.
Такие углеводороды содержат максимально возможное число атомов водорода, поэтому их ещё называют предельными. Международное название насыщенных углеводородов — алканы.
Наиболее простое строение среди алканов имеет метан. Его формула — Ch5. Структурная формула метана:
Если от молекулы метана отнять один атом водорода, то образуется радикал метил —Ch4.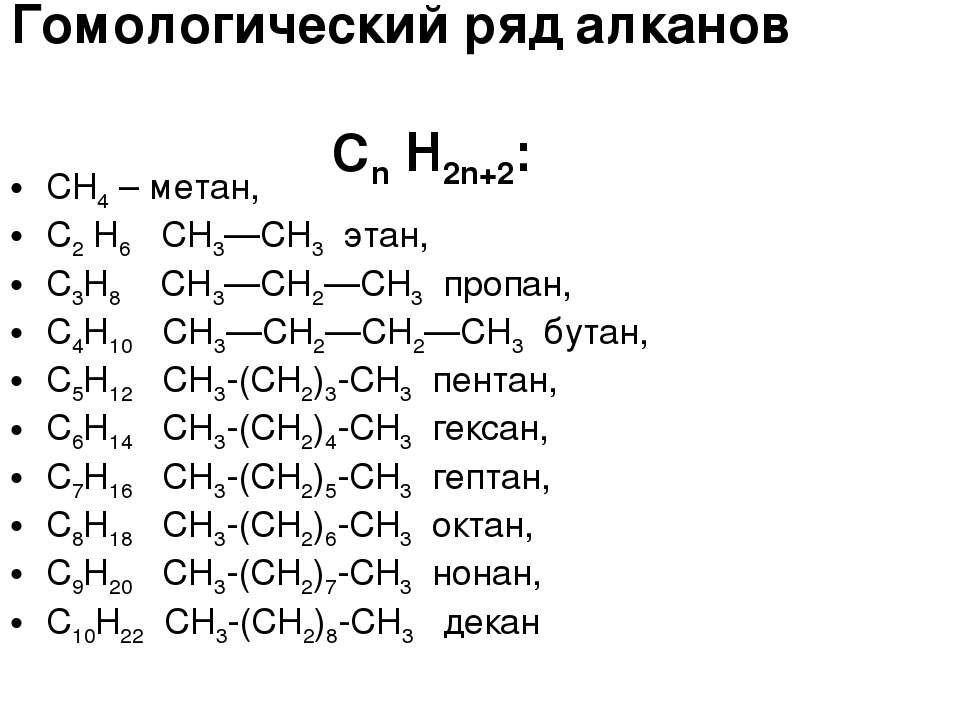
Этан имеет состав C2H6 и строение Ch4—Ch4. Его структурную формулу можно изобразить следующим образом:
Этану соответствует радикал этил —C2H5.
Пропан: C3H8, Ch4—Ch3—Ch4,
Из молекулы пропана образуется радикал пропил —C3H7.
Бутан: C4h20, Ch4—Ch3—Ch3—Ch4,
Радикал бутил —C4H9.
Соседние углеводороды отличаются друг от друга на группу атомов —Ch3—, называемую гомологической разностью.
Такие вещества являются гомологами, а ряд гомологов — гомологическим рядом.
Для алканов состав любого члена гомологического ряда можно вывести из общей формулы Cnh3n+2, где n — число атомов углерода в молекуле.
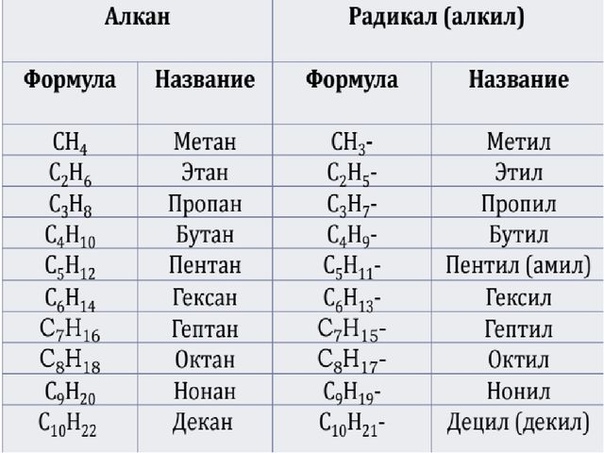
Составим формулы следующих гомологов метана и радикалов, которые они образуют:
C5h22 пентан C5h21− пентил (амил)
C6h24 гексан C6h23− гексил
C7h26 гептан C7h25− гептил
C8h28 октан C8h27− октил
C9h30 нонан C9h29− нонил
C10h32 декан C10h31− децил
Структурные формулы показывают порядок соединения атомов, но не совсем правильно отражают строение молекул алканов. Молекулы алканов объёмные.
Молекулы алканов объёмные.
Установлено, что молекула метана имеет тетраэдрическое строение: атом углерода находится в центре тетраэдра, а атомы водорода — в вершинах тетраэдра.
Углы между всеми связями одинаковые и равны \(109\)°.
| Рис. \(1\). Молекула метана | Рис. \(2\). Модель молекулы |
В молекулах гомологов метана все связи тоже располагаются под углом \(109\)°, поэтому атомы углерода располагаются зигзагообразно.
Рис. \(3\). Модель молекулы пентана
В молекулах алканов, начиная с бутана, атомы углерода могут образовывать боковые ответвления. Один и тот же состав может иметь не одно вещество, а несколько. Такие вещества — изомеры.
Ch4—Ch3—Ch3—Ch4
Бутан
\(2\)-метилпропан
Для составления названий изомеров используются специальные правила — международная номенклатура.
Цифра в начале названия показывает, у какого по счёту атома углерода находится боковой радикал, затем записывают название радикала, а потом — название цепи.
Источники:
Рис. 1. Молекула метана
https://upload.wikimedia.org/wikipedia/commons/thumb/4/4b/Methane-3D-space-filling.svg/1024px-Methane-3D-space-filling.svg.png
Рис. 2. Модель молекулы метана
https://upload.wikimedia.org/wikipedia/commons/thumb/9/92/Methane-2D-stereo.svg/1024px-Methane-2D-stereo.svg.png
Рис. 3. Модель молекулы пентана
https://upload.wikimedia.org/wikipedia/commons/5/5f/Pentane-3D-space-filling.png
Предельные углеводороды. Тест 19 — презентация онлайн
Тест 19.Предельные
углеводороды
Часть А (задания с выбором ответа)
А1. Укажите название углеводорода C3H8.
2)пропан
верно
3)
ошибка
метан
4)
бутан
ошибка
верно
1)C
4h20
ошибка
2) C2H6
ошибка
3) C3H8
ошибка
4)
Ch5
ошибка
1)бутил
2)
ошибка
метан
ошибка
3) этил
верно
4)
метил
3)верно
C2H5
4)
C4H9
ошибка
ошибка
1) этан
А2.
 Укажите формулу бутана.
Укажите формулу бутана.А3. Укажите название радикала Ch4.
А4. Укажите формулу радикала этила.
1) C2H6
ошибка
2) C3H7
ошибка
А5. Укажите, какое суждение является правильным: А) изомеры вещества, имеющие
одинаковый состав, но разное строение и потому разные свойства; Б) гомологи — вещества,
отличающиеся по своему составу на гомологическую разность -Ch3, но имеющие сходное
строение и близкие свойства.
4) оба суждения
1) верно
только А
2) верно
только Б
3) верны верно
оба суждения
ошибка
ошибка
ошибканеверны
А6. Укажите общую формулу гомологического ряда метана.
1)верно
Cnh3n+2
2)
Cnh3n
ошибка
3) Cnh3n-2
ошибка
4)ошибка
Cnh3n-6
А7. Углеводород, относящийся к предельным углеводородам, это
1)ошибка
C6H8
2)
C5h20
ошибка
3) C7h24
ошибка
4) C8h28
верно
3) C6h20
ошибка
4)
C6h22
ошибка
А8.
 Укажите вещество, являющееся гомологом метана.
Укажите вещество, являющееся гомологом метана.1)ошибка
C6H8
2)верно
C6h24
А9. Определите число атомов водорода в молекуле гомолога метана, если там имеется
11 атомов углерода.
1) 26
ошибка
2) 24
верно
3) 22
ошибка
4) 20
ошибка
А10. Определите число атомов углерода
28 атомов водорода.
1) 15
ошибка
в молекуле гомолога метана, если там имеется
2) 14
ошибка
3) 13
верно
4) 12
ошибка
А11. Реакции, в ходе которых от молекулы вещества отщепляется водород,
называются реакциями
2) дегалогенирования
3)дегидрогалогенирования
1) дегидратации
4) дегидрирования
ошибка
ошибка
верно
ошибка
А12. Составьте уравнение горения предельного углеводорода Cnh3n+2 .
Определите коэффициент перед кислородом, считая, что перед молекулой углеводорода
стоит коэффициент, равный единице.
1) ошибка
(1,5n 0,5)
2) (1,5n
+ 0,5)
верно
3) ошибка
(2,0n + 0,5)
4)
(1,5n)
ошибка
А13.
 При термическом разложении метана получено 100 л (н.у.) водорода. Определите
При термическом разложении метана получено 100 л (н.у.) водорода. Определитемассу полученной при этом сажи.
1) верно
26,8 г.
2) 36,8 г.
ошибка
3)
42,4 г.
ошибка
4) 53,6 г.
ошибка
А14. При каталитическом дегидрировании пропана C3H8 получили пропилен C3H6 и 10 г
водорода. Определите массу полученного пропилена.
1) 190 г
ошибка
2)
200 г
ошибка
3)верно
210 г
4)
220 г
ошибка
А15. При сгорании метана образовалось 54 г воды. Определите объем (н.у.) израсходованного
на сгорание метана воздуха, полагая, что объемная доля кислорода в воздухе равна 0,21.
1) 290 л
ошибка
2) 300 л
ошибка
3) 310 л
ошибка
4)
320 л
верно
Часть В (задания с кратким ответом)
В1. Установите соответствие между названием предельного углеводорода и его формулой.
Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
НАЗВАНИЕ УГЛЕВОДОРОДА
ФОРМУЛА УГЛЕВОДОРОДА
А) этан
1) Ch5
Б) пентан
2) C3H8
В) метан
3) C5h22
Г) бутан
4) C2H6
ответ
Д) пропан
5) C4h20
43152
В2.
 Установите соответствие между формулой радикала и его названием. Ответ дайте в
Установите соответствие между формулой радикала и его названием. Ответ дайте ввиде последовательности цифр, соответствующих буквам по алфавиту.
ФОРМУЛА РАДИКАЛА
НАЗВАНИЕ РАДИКАЛА
А) -C4H9
1) амил
Б) — C3H7
2) пропил
В) — Ch4
3) метил
Г) — C2H5
4) бутил
Д) — C5h21
5) этил
ответ
42351
В3. Установите соответствие между числом атомов водорода в молекулах гомологов метана и
числом атомов углерода в этих же молекулах. Ответ дайте в виде последовательности цифр,
соответствующих буквам по алфавиту.
ЧИСЛО АТОМОВ Н
ЧИСЛО АТОМОВ С
А) 16
1) 11
Б) 22
2) 7
В) 24
3) 5
Г) 18
4) 10
Д) 12
5) 8
ответ
24153
В4. Среди перечисленных алканов укажите предельные углеводороды, являющиеся газами при
н.у.: 1) пентан, 2) бутан,
3) пропан, 4) гексан, 5) гептан, 6) этан, 7) октан, 8) метан. Ответ
дайте в виде последовательности цифр в порядке их возрастания.

ответ
2368
В5. Установите соответствие между формулой углеводорода и коэффициентом перед молекулой
кислорода в уравнении реакции горения этого углеводорода, полагая, что коэффициент перед
молекулой углеводорода равен единице. Ответ дайте в виде последовательности цифр,
соответствующих буквам по алфавиту.
АЛКАН
КОЭФФИЦИЕНТ ПЕРЕД О2
А) C9h30
1) 11
Б) C5h22
2) 5
В) C7Н16
3) 14
Г) C3H8
4) 8
ответ
3412
12.2: Структура и названия алканов
- Последнее обновление
- Сохранить как PDF
- Ключевые вынос
Цели обучения
- Для идентификации и наименования простых (с прямой цепью) алканов по формулам и написания формул для алканов с прямой цепью с указанием их названий.

Мы начинаем изучение органической химии с углеводородов, простейших органических соединений, которые состоят только из атомов углерода и водорода. Как мы уже отметили, существует несколько различных видов углеводородов. Их различают типы связи между атомами углерода и свойства, возникающие в результате этой связи. Углеводороды, имеющие только одинарные связи углерод-углерод (C – C) и существующие как непрерывная цепочка атомов углерода, также связанных с атомами водорода, называются алканами (или насыщенными углеводородами). Насыщенный , в данном случае, означает, что каждый атом углерода связан с четырьмя другими атомами (водородом или углеродом) — наиболее вероятным; в молекулах нет двойных или тройных связей.
Слово насыщенный имеет то же значение для углеводородов, что и для пищевых жиров и масел: молекула не имеет двойных связей углерод-углерод (C = C).
Ранее мы ввели три простейших алкана — метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ), и они снова показаны на рисунке \ ( \ PageIndex {1} \).
Показанные плоские изображения не точно отображают валентные углы или геометрию молекулы. Метан имеет тетраэдрическую форму, которую химики часто изображают с клиньями, указывающими на связи, идущие к вам, и пунктирными линиями, обозначающими связи, отходящие от вас. Обычная сплошная линия обозначает связь в плоскости страницы. Напомним, что теория VSEPR правильно предсказывает тетраэдрическую форму молекулы метана (рисунок \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \): Тетраэдрическая молекула метанаМетан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются началом ряда соединений, в которых любые два члена в последовательности различаются на один атом углерода и два атома водорода, а именно на звено CH 2 . Первые 10 членов этой серии приведены в таблице \ (\ PageIndex {1} \).
| Имя | Молекулярная формула (C n H 2n + 2 ) | Концентрированная структурная формула | Количество возможных изомеров |
|---|---|---|---|
| метан | СН 4 | Канал 4 | – |
| этан | С 2 В 6 | Канал 3 Канал 3 | – |
| пропан | С 3 В 8 | Канал 3 Канал 2 Канал 3 | – |
| бутан | С 4 В 10 | Канал 3 Канал 2 Канал 2 Канал 3 | 2 |
| пентан | С 5 В 12 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 | 3 |
| гексан | С 6 В 14 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 | 5 |
| гептан | С 7 В 16 | Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 Канал 2 Канал 3 | 9 |
| октановое число | С 8 В 18 | канал 3 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 3 | 18 |
| нонан | С 9 В 20 | канал 3 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 3 | 35 |
| декан | С 10 В 22 | канал 3 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 2 канал 3 | 75 |
Рассмотрим ряд на рисунке \ (\ PageIndex {3} \). Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по серии добавляется блок CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом. Члены такой серии, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии обеспечивает организацию органической химии во многом так же, как периодическая таблица Менделеева обеспечивает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и на их основе вывести некоторые свойства других соединений в этом ряду.
Последовательность начинается с C 3 H 8 , и на каждом шаге вверх по серии добавляется блок CH 2 . Любое семейство соединений, в котором соседние члены отличаются друг от друга определенным фактором (здесь группа CH 2 ), называется гомологическим рядом. Члены такой серии, называемые гомологами , обладают свойствами, которые изменяются регулярным и предсказуемым образом. Принцип гомологии обеспечивает организацию органической химии во многом так же, как периодическая таблица Менделеева обеспечивает организацию неорганической химии.Вместо ошеломляющего множества отдельных углеродных соединений мы можем изучить несколько членов гомологического ряда и на их основе вывести некоторые свойства других соединений в этом ряду.
Принцип гомологии позволяет нам написать общую формулу для алканов: C n H 2 n + 2 .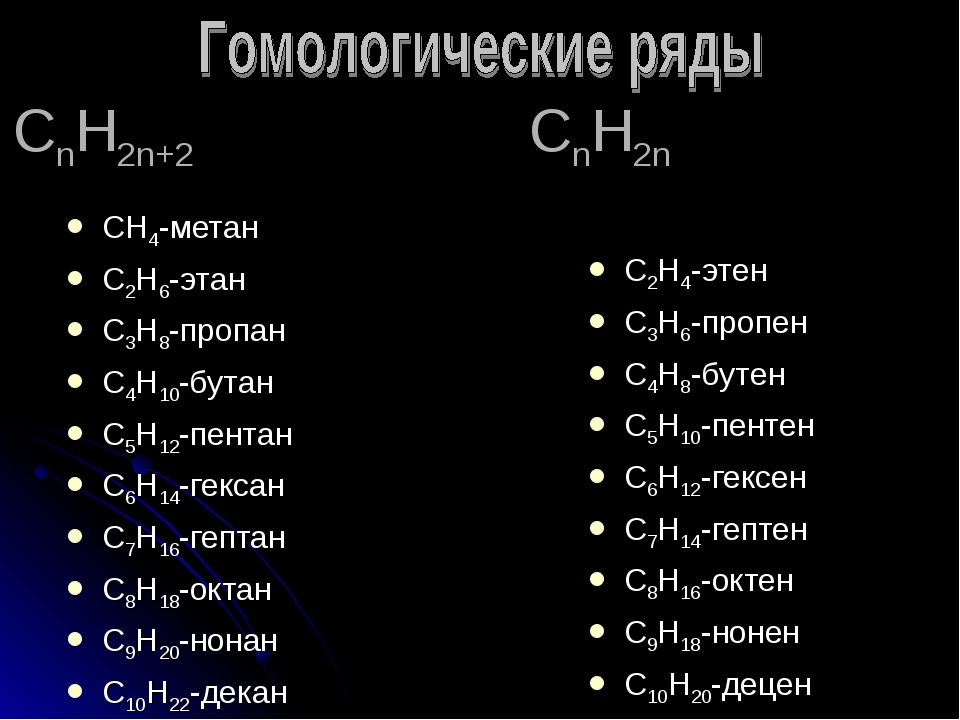 Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Используя эту формулу, мы можем написать молекулярную формулу для любого алкана с заданным числом атомов углерода. Например, алкан с восемью атомами углерода имеет молекулярную формулу C 8 H (2 × 8) + 2 = C 8 H 18 .
Key Takeaway
- Простые алканы существуют в виде гомологического ряда, в котором соседние члены различаются единицей CH 2 .
Объяснитель уроков: гомологичные серии | Nagwa
В этом пояснителе мы узнаем, как идентифицировать гомологичную группу органических химикаты.
Все органические соединения принадлежат к определенным семействам соединений. Семья, которая группа соединений зависит от структуры и свойств тех соединения.
Исследуем следующий ряд соединений в таблице, которые взяты из семейство алканов, чтобы увидеть, в чем их сходства и различия.
Метан имеет один атом углерода и четыре атома водорода. Его формула
Ch5. Следующее соединение в этой семейной серии —
этан, у которого есть еще один атом углерода и еще два атома водорода.Формула этана — Ch36. Итак, если взять метан
и добавить один атом C
и два
Атомы H, получаем этан
Ch36. Метан и этан отличаются только на
Блок Ch3.
Его формула
Ch5. Следующее соединение в этой семейной серии —
этан, у которого есть еще один атом углерода и еще два атома водорода.Формула этана — Ch36. Итак, если взять метан
и добавить один атом C
и два
Атомы H, получаем этан
Ch36. Метан и этан отличаются только на
Блок Ch3.
Если мы теперь сравним этан и следующее соединение в семействе алканов, пропан, получаем тот же результат. Этан имеет два углерода атомы и шесть атомов водорода атомы. Его формула — Ch36. Следующее соединение в алкане семейная серия — пропан. Пропан имеет еще один углерод атом и еще два водорода атомы.Формула пропана — Ch48.
Итак, переходя от этана к пропану, мы, по сути, добавили один Атом углерода и два атома Н.
Обратите внимание, что каждое последующее соединение отличается от предыдущего только на
Блок Ch3. Другими словами, каждое соединение — это
то же, что и предыдущее соединение, за исключением того, что у него есть дополнительный
Блок Ch3. Это узор из этой серии или
группа соединений. Мы говорим, что метан, этан и пропан являются гомологами.
Это узор из этой серии или
группа соединений. Мы говорим, что метан, этан и пропан являются гомологами.
Определение: Гомологи
Гомологи — это соединения, которые отличаются друг от друга повторяющийся блок.
Мы называем всю эту группу линейных алканов гомологичным рядом алканов. Гомологический ряд — это семейство соединений, которые имеют одну и ту же функциональную группу, аналогичные химические свойства и та же общая формула. Конкретная формула каждое соединение в серии будет отличаться от следующего простым структурным Блок.
Определение: гомологическая серия
Гомологическая серия — это семейство соединений, которые имеют одну и ту же функциональную группу и, таким образом, аналогичные химические свойства и одна и та же общая формула, причем каждый соединение в ряду, отличающееся от следующего простой структурной единицей.
Все соединения в гомологическом ряду алканов имеют одну и ту же общую формулу
CH +, где 𝑛
равно 1, 2, 3 и т. д.
д.
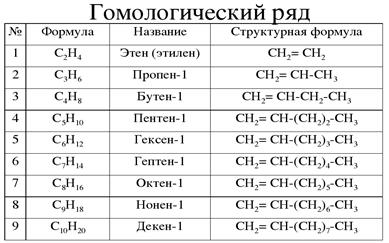
Посмотрим еще одну гомологичную серию. В таблице ниже представлена информация для гомологический ряд алкенов. У всех алкенов одинаковы Функциональная группа СС.
Этен имеет два атома углерода и четыре атома водорода. атомы. Его формула Ch34. Следующее соединение в гомологе алкена серия пропеновая. Пропен имеет еще один углерод атом и еще два водорода атомы и его формула — Ch46.Чтобы получить пропен, мы добавляем к этену структурную единицу Ch3. в таким же образом, чтобы получить бут-1-ен, мы добавляем Ch3 структурная единица на пропен. К настоящему времени вы могли заметить, что каждое соединение в алкене гомологический ряд отличается от предыдущего соединения простым Блок Ch3. Но общая формула — это не то же, что и для алканов. Общая формула гомологического ряда алкенов: CH.
Пример 1: Идентификация молекул, принадлежащих к одной и той же гомологической серии
Почему все три указанные ниже молекулы принадлежат к одной и той же гомологической серии?
CCHHHHCCHCHHHHCHHCCHHHHCHH
- Все они ненасыщенные.

- Отношение атомов водорода к атомам углерода 2∶1.
- У них увеличивается количество атомов углерода.
- Все они углеводороды.
- Все они содержат одну и ту же функциональную группу.
Ответ
Три вышеуказанные молекулы — это этен, пропен и бут-1-ен. Все они принадлежат
к гомологическому ряду алкенов. Все они ненасыщенные, с прямой цепью.
углеводороды с той же функциональной группой (CC). Единственная разница — длина углеродной цепи.Потому что у каждого из них есть
разное количество атомов углерода, у них также разное количество водорода
атомы. Таким образом, у них другая молекулярная формула. Этен
Ch34, пропен — Ch46,
а бут-1-ен — Ch58. Потому что они принадлежат к
один и тот же гомологический ряд, все они также имеют одну и ту же общую формулу:
CH. Гомологическая серия — это семья
соединений с одинаковой функциональной группой и, следовательно, схожими химическими свойствами
и той же общей формулы, причем каждое соединение в серии отличается от следующего
простой структурной единицей.
Все варианты ответов применимы к этим трем соединениям. Все верно утверждения, которые мы можем использовать для описания этих соединений. Однако все они ненасыщенность не обязательно делает эти соединения частью одного и того же гомологический ряд. Многие соединения являются ненасыщенными, но не обязательно часть одного гомологического ряда. Например, этин (Ch32) и октен оба ненасыщенные, но находятся в разных гомологических сериях.Ethyne относится к группе алкинов, и октен относится к алкеновому ряду. Итак, мы можем исключить вариант ответа А.
Два или более соединений, имеющих CH∶ соотношение 1∶2, являются углеводородами или имеют увеличивающееся количество углерода также не обязательно означает, что соединения находятся в одном гомологичном ряд.
Например, рассмотрим отображаемую формулу этенола:
COHHCHH
И рассмотрим формулу бут-1-ена:
CCHHCHCHHHHH
И этенол, и бут-1-ен имеют одинаковое соотношение атомов углерода и водорода. (1∶2) и все большее количество атомов углерода, но находятся в
разные серии.Таким образом, мы можем исключить варианты ответа B и C.
(1∶2) и все большее количество атомов углерода, но находятся в
разные серии.Таким образом, мы можем исключить варианты ответа B и C.
Теперь рассмотрим отображаемую формулу метана:
CHHHH
И учтем формулу бензола:
CCCHHHHHH
Метан и бензол являются углеводородами, но не входят в состав такой же ряд. Таким образом, мы можем исключить вариант ответа D.
Увеличение числа атомов углерода не обязательно означает соединения принадлежат к одному гомологическому ряду. Например, метан, этен, и пропин имеют увеличивающееся количество атомов углерода, но они не входят в состав из той же гомологической серии.Таким образом, мы можем исключить вариант ответа C.
Наиболее правильный ответ — E. Все они содержат один и тот же функционал. группа.
Пример 2: Определение формулы следующего соединения в гомологичном ряду
Какова формула следующего алкена в следующем гомологичном ряду? серии: Ч34, Ч46, Ch58?
- CH614
- Ch510
- CH510
- CH612
- CH512
Ответ
В вопросе даны три соединения: Ch34
(этен), Ch46 (пропен) и
Ch58 (бутен). Нам говорят, что они все в
гомологический ряд алкенов. Все алкены имеют одну и ту же общую формулу:
CH. Состав, который придет
после бутена в этом ряду будет на один атом углерода больше, чем у бутена. Будет
имеют пять атомов углерода. Итак, мы можем определить формулу следующего алкена по формуле
заменяя 5 на в общей формуле
CH.
Нам говорят, что они все в
гомологический ряд алкенов. Все алкены имеют одну и ту же общую формулу:
CH. Состав, который придет
после бутена в этом ряду будет на один атом углерода больше, чем у бутена. Будет
имеют пять атомов углерода. Итак, мы можем определить формулу следующего алкена по формуле
заменяя 5 на в общей формуле
CH.
Следовательно, подставляя 𝑛 = 5, получаем СН52 (5).
При умножении получаем CH510.
Итак, правильный ответ — C: CH510.
Все соединения относятся к определенной гомологической серии. Мы не будем исследовать все эти семейства соединений — их много. В таблице ниже показаны некоторые информация о гомологическом ряду алканов, алкенов, простых спиртов, и простые карбоновые кислоты.
9 0065| Гомологическая серия | Функциональная группа | Общая формула | Примеры | |
|---|---|---|---|---|
| Название | Формула | |||
| Алканы | — | CH + | ||
| Метан | Метан | |||
| Этан | Ch36 | |||
| Пропан | Ch48 | |||
| Бутан | Ch510 | |||
| Алкены | CC | CH | ||
| Ethene | Chpen | Ch46 | ||
| Бутен | Ch58 | |||
| Спирты | OH | CHOH (+) | ||
| Метанол | CHOh4 | |||
| Этанол | CHOh35 | CHOh47 | ||
| Бутанол | CHOh59 | |||
| Карбоновые кислоты | COOH | CHCOOH (+) | ||
| Метановая кислота | HCOOH | |||
| Этановая кислота | CHCOOh4 | |||
| Пропановая кислота | Пропановая кислота | |||
| CHCOOh47 | ||||
Пример 3: Понимание того, почему разные соединения не принадлежат к одному и тому же Гомологическая серия
Почему этан является членом гомологического ряда алканов, а метанол? не является?
- Этан имеет меньшую молекулярную массу.

- Этан получают из сырой нефти.
- Этан содержит ту же функциональную группу, что и другие алканы.
- У этана два атома углерода, а у метанола только один.
- Этан — газ, а метанол — жидкость.
Ответ
Все алканы имеют общую формулу CH +. Когда соединения относятся к один и тот же гомологический ряд, они имеют одну и ту же функциональную группу, одну и ту же общую формула и одинаковые или очень похожие химические свойства.
Молекулярная формула этана — Ch36, и его общая формула CH +. Итак, этан — это алкан.
Формула метанола: CHOh4, и его общая формула CHOH (+). Метанол содержит гидроксильную группу ОН, а вот этан — нет.
Этан и метанол не имеют одинаковой общей формулы, потому что они не
содержат ту же функциональную группу. Итак, правильный ответ: C. Этан содержит
та же функциональная группа, что и другие алканы.
Мы можем предсказать формулу гомологического ряда, относящегося к гомологическому ряду, который мы знакомы с. Например, все алкены имеют одну и ту же общую формулу CH. Если все соединения в этом монозамещены хлором, тогда все они будут иметь этот новый общий формула CHCl–. Номер атомы водорода уменьшаются на 1, и поэтому индекс для водорода больше не 2𝑛; он становится 2𝑛 − 1. Кроме того, Cl добавлен в формулу.
Пример 4: Определение общей формулы для галоалканов, содержащих один галоген Атом
Что из следующего является общей формулой галогеналканов, которые содержат один атом галогена?
- CHX +
- CHX +
- CHX–
- CHX
- CHX–
Ответ
Все алканы имеют одинаковые общая формула: CH +.
Если один из атомов водорода в алкане заменить на галоген
(X), то общая формула для
соединение больше не будет
CH +. Вместо этого число
атомов водорода уменьшится на 1, поэтому индекс числа
атомов водорода изменится с «2𝑛 + 2» на
«2𝑛 + 1». Общая формула станет
CH +.
Вместо этого число
атомов водорода уменьшится на 1, поэтому индекс числа
атомов водорода изменится с «2𝑛 + 2» на
«2𝑛 + 1». Общая формула станет
CH +.
Мы должны не забыть добавить X к представляют собой один атом галогена.Итак, общая формула галогеналкана с один атом галогена будет CHX +.
Эта формула соответствует ответу A: CHX +.
Помимо одинаковой общей формулы, все соединения в пределах гомологического ряда
имеют одинаковые или похожие химические свойства. Это потому, что все соединения в
гомологические серии имеют одну и ту же функциональную группу. Например, все алканы
полностью насыщенный, только с атомами углерода и водорода и без функциональных групп.Таким образом, алканы реагируют аналогичным образом. Другими словами, у них похожие
химические свойства. Точно так же все алкены имеют 1 углерод-углеродную двойную связь,
CC, и поэтому алкены имеют тенденцию реагировать таким же образом
как друг друга. Спирты одного гомологического ряда претерпевают одни и те же реакции.
поскольку они имеют одну и ту же функциональную группу, а именно гидроксил,
ОН, группа. Соединения в карбоновой кислоте
гомологические серии имеют схожие химические свойства друг с другом, потому что они
у всех есть группа COOH и так далее.
Спирты одного гомологического ряда претерпевают одни и те же реакции.
поскольку они имеют одну и ту же функциональную группу, а именно гидроксил,
ОН, группа. Соединения в карбоновой кислоте
гомологические серии имеют схожие химические свойства друг с другом, потому что они
у всех есть группа COOH и так далее.
Давайте рассмотрим два кратких примера.
Алканы реагируют с галогенами в присутствии УФ-света с замещением реакции. Уравнение ниже показывает, как основной продукт реакции между этан и газообразный хлор — это этан, монозамещенный атомом хлора:
Другие алканы будут реагировать аналогичным образом.
Однако алкены вступают в реакции присоединения с галогенами. Следующее уравнение показывает, как алкены по-разному реагируют на алканы.У них есть CC-связь, которая открывается для присоединения двух атомов галоген:
Алкены имеют тенденцию реагировать одинаково, потому что они имеют одну и ту же функциональную группу
и принадлежат к одному гомологическому ряду.
Физические свойства, однако, не одинаковы для соединений одного и того же гомологические ряды, но они имеют тенденцию различаться в соответствии с заметными тенденциями. Например, алканы с прямой цепью имеют постоянно увеличивающуюся температуру кипения. с увеличением длины цепи (количества атомов углерода).График ниже показывает этот тренд.
Алканы являются ковалентными молекулами и имеют слабые силы Ван-дер-Ваальса между их молекулы. Для алканов с короткой длиной цепи требуется небольшая энергия. требуется для преодоления межмолекулярного притяжения, что приводит к очень низкому кипению точка. Чем длиннее становится длина цепи (тем больше атомов углерода в цепи), однако чем сильнее становятся силы притяжения Ван-дер-Ваальса и тем выше точка кипения.
Вязкость, то есть сопротивление потоку, является еще одним примером физического
свойство, которое постепенно изменяется в пределах гомологического ряда.График ниже
показывает тенденцию изменения вязкости
(в МПа⋅с) по сравнению с
число атомов углерода в цепи для гомологического ряда алканов. Для
линейные алканы на
25∘C, тем больше углерода
атомов, тем более вязкая жидкость. Другими словами, чем дольше
углеродная цепочка, чем толще алкановая жидкость и тем медленнее она течет. Алканы с длинной цепью очень вязкие. Они сопротивляются потоку. Они текут очень медленно
потому что они толстые и «липкие».”
Для
линейные алканы на
25∘C, тем больше углерода
атомов, тем более вязкая жидкость. Другими словами, чем дольше
углеродная цепочка, чем толще алкановая жидкость и тем медленнее она течет. Алканы с длинной цепью очень вязкие. Они сопротивляются потоку. Они текут очень медленно
потому что они толстые и «липкие».”
Воспламеняемость также медленно изменяется в гомологической серии. Воспламеняемость имеет тенденцию к уменьшаются с увеличением числа атомов углерода. Другими словами, чем больше, тем молекула, тем она менее горючая. Кроме того, поскольку атомов углерода больше, сгорание будет неполным с более крупными молекулами, что даст более дымное пламя когда соединение горит.
Пример 5: Прогнозирование тенденции воспламеняемости для гомологического ряда алканов
В части гомологического ряда алканов, от метана до гексана, что происходит с воспламеняемостью при увеличении числа атомов углерода?
- Уменьшается, затем увеличивается.

- Уменьшается.
- Остается прежним.
- Увеличивается.
- Увеличивается, затем уменьшается.
Ответ
Мы переходим от метана (который имеет один атом углерода) к гексану (который имеет шесть атомов углерода) в гомологическом ряду алканов, поэтому количество атомов углерода увеличивается. По мере того, как молекулы становятся больше, соединения становятся менее воспламеняется и горит более дымным пламенем. Итак, от метана к гексану в алканового ряда воспламеняемость уменьшается по мере увеличения количества атомов углерода увеличивается.Правильный ответ — Б; он уменьшается.
Мы видели, что количество атомов углерода в цепи или размер молекула, влияет на физические свойства. И последний пример. Поскольку молекулярная увеличивается масса алкана, увеличивается плотность. В таблице показан этот общий тенденция.
| Алкан | Плотность
(г / мл)
при 20∘C
и 1 атм. | Физическое состояние алкана при 20∘C и 1 атм |
|---|---|---|
| Метан | 0.000668 | Газ |
| Этан | 0,00127 | Газ |
| Пропан | 0,00187 | Газ |
| Бутан | 0,00249 | Газ |
| Пентан | Пентан | |
| Гексан | 0,659 | Жидкость |
| Октан | 0,703 | Жидкость |
| Декан | 0.730 | Жидкость |
Чем длиннее углеродная цепочка, тем выше плотность. Также есть внезапное увеличение плотности при переходе от бутана к пентану как состояние алкана переходит с газа в жидкость.
Ключевые моменты
- Гомологи — это соединения, которые отличаются друг от друга повторяющейся единицей.
- Гомологический ряд — это семейство соединений, имеющих одну и ту же функциональную группу.
 и, таким образом, аналогичные химические свойства и одна и та же общая формула, причем каждый
соединение в ряду, отличающееся от следующего простой структурной единицей.
и, таким образом, аналогичные химические свойства и одна и та же общая формула, причем каждый
соединение в ряду, отличающееся от следующего простой структурной единицей. - Некоторые общие формулы:
- CH + для алканов,
- CH для алкенов,
- CHOH (+) для спиртов,
- CHCOOH (+) для карбоновых кислоты.
- Физические свойства не одинаковы для соединений одного гомологического ряда, но они имеют тенденцию различаться в зависимости от заметных тенденций.
Nature’s Chemistry — Homologous series — National 5 Chemistry Revision
Углеводороды и гомологическая серия
Гомологическая серия — это семейство углеводородов со схожими химическими свойствами, которые имеют одну и ту же общую формулу.
Мы рассмотрим три ряда углеводородов: алканы, алкены и циклоалканы.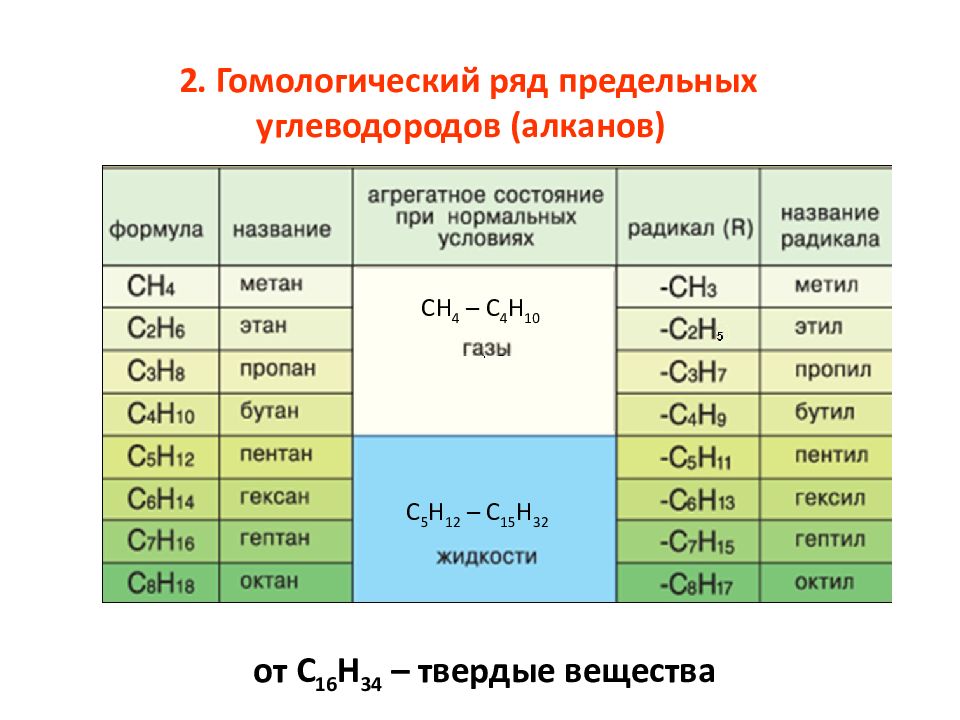 Углеводороды — это соединения, которые содержат только водород и углерод.
Углеводороды — это соединения, которые содержат только водород и углерод.
Алканы
Первый гомологический ряд — это алканы. Их имена заканчиваются на — и .
Алканы имеют множество применений:
- метан — (природный газ) приготовление пищи, нагревание
- пропан — используется в газовых баллонах для барбекю и т. Д. октан
- — используется в бензине для автомобилей
Общая формула алканов: \ ({C_n} {H_ {2n + 2}} \).Они не растворимы в воде.
214qtqt0w8k.0.0.0.1:0.1.0.$0.$2.$8″> Необходимо выучить названия, молекулярную формулу и структурную формулу первых восьми алканов. Использование мнемоники может облегчить изучение имен.
$2.$9.$1.$4″>1333| Метан | CH 4 | Monsters | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Этан | C 1.0.$0.$2.$9.$1.$1.$1.$1″> 2 H 6 | Eat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пропан | C H 9 Ученики | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бутан | C 4 H 10 | Но | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Пентан | C 5 H 12 | Предпочтительно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гексан | 14 | Волосатый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гептан | C 7 H 214qtqt0w8k.0.0.0.1:0.1.0.$0.$2.$9.$1.$6.$1.$3″> 16 | Haggis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Октан | C 8 H 18 | Время от времени | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
группа и свойства алканов.Алканы: молекулярные и структурные формулыАлканы: молекулярные и структурные формулы Алканы представляют собой ряд соединений, состоящих из атомов углерода и водорода с одинарными ковалентными связями. Простейший алкан, метан, имеет один атом углерода и молекулярную формулу CH 4 .Поскольку это соединение содержит только одинарные ковалентные связи, его структурная формула В более длинных молекулах алканов дополнительные атомы углерода связаны друг с другом одинарными ковалентными связями. Каждый атом углерода также присоединен к достаточному количеству атомов водорода, чтобы образовать вокруг себя в общей сложности четыре одиночные ковалентные связи. Таким образом, октан, восьмиуглеродный алкан, имеет молекулярную формулу C 8 H 18 и структурную формулу Алкильные группы. Когда заместитель, такой как галоген или гидроксигруппа, связывается с молекулой алкана, одна из углерод-водородных связей молекулы превращается в связь углерод-заместитель. Алкан с водородом, удаленным от одной связи, называется алкильной группой. Алкильные группы часто обозначаются буквой R , так же как галогены часто обозначаются буквой X. Реакция метан-хлор может быть обобщена как Часто химики-органики используют эти типы представлений для обсуждения обобщенных реакций. Изомеры. Алкильные группы могут существовать в более чем одной изомерной форме. Например, пропан алкан имеет два изомера алкила. Эти изомеры отличаются друг от друга типом углерода, который потерял водород с образованием алкильной группы. Атомы углерода классифицируются как первичные (1 °), вторичные (2 °) или третичные (3 °), в зависимости от числа атомов углерода, к которым они присоединены. На приведенной выше диаграмме изомеров пропана группа слева является первичной (1 °) пропильной группой, а группа справа — вторичной (2 °) пропильной группой. Бутилы (алканы с четырьмя атомами углерода) имеют три изомерные группы. Структуры и названия этих групп Знакомство с алканамиЗнакомство с алканамиВведение в АлканыДжеймс Ричард Фромм Углеводороды — простые органические соединения, содержащие только углерод. и водород.Если атомы углерода связаны в цепочки, соединения называются алифатические соединения; если атомы связаны кольцами, соединения называют алициклическими. Цепные соединения или алифатические соединения могут быть дополнительно классифицированы на основе
отдельные углерод-углеродные связи. Цепные соединения, в которых все углерод-углеродные связи являются только простыми одинарными связями, являются
позвонил по номеру АЛКАНЫ . Эти соединения также называют насыщенными углеводородов, потому что каждая связь углерод-углерод является одинарной связью, а валентность
атом углерода, следовательно, является насыщенным. Никакие атомы больше не могут быть связаны с атомами в
соединение, не разбивая соединение на два или более фрагментов. Если это
содержит одну или несколько связей, которые могут реагировать с водородом, это называется ненасыщенной углеводород.Практически все остальные органические соединения можно назвать производными.
этих простых углеводородов. Простейшим алканом является газ метан , молекулярная формула которого CH 4 .
Метан существует в форме тетраэдра, но часто он представлен в виде уплощенной формы.
структура, как и большинство органических соединений. Плоские конструкции для трех простейших
алканы представлены на рисунке ниже. Во многих случаях конструкции могут быть
упрощается без потери информации за счет исключения всех одинарных облигаций и написания буквы
обозначение элемента близко к буквенному обозначению элемента, к которому он прикреплен. Структура этана может быть получена из структуры метана путем замещения -CH 3 группа, называемая метильной группой , для одного из атомов водорода метана.
Структура пропана может быть получена либо замещением метильной группы на
этан или замещением этильной группы метаном; любой метод дает одно и то же
продукт, пропан . Таким же образом структура следующего члена группы
ряд, бутан , может быть получен замещением метильной группы на
пропан. Алканы над пропаном названы по количеству атомов углерода (по-гречески) с окончание -ан добавлено. Если алкан не имеет прямой цепи, то самая длинная прямая цепь в нем используется как основа названия, а более короткие боковые цепи считаются заместителями; таким образом, такие названия, как метилпропан и метилбутан, являются полученный. Позиционные изомеры алканов Известны два четырехуглеродных алкана, которые имеют существенно разные химические и химические свойства.
физические свойства. Их структуры H 3 CCH 2 CH 2 CH 3 и H 3 CCH (CH 3 ) 2 . Поэтому они и были названы нормальными.
бутан , часто сокращенно н-бутан, и изобутан . Две формы бутана описаны как два позиционных изомеров бутан, потому что они различаются только положением группы заместителя.В
пентаны имеют три позиционных изомера: H 3 CCH 2 CH 2 CH 2 CH 3 , нормальный пентан или н-пентан ; H 3 CCH 2 CH 2 (CH 3 ) 2 , изопентан ; и H 3 CC (CH 3 ) 3 , неопентан . Таблица: Структурные формулы первых десяти алканов с непрерывной цепью
 Имена старших членов этой серии состоят из числового члена, за которым следует « -ан ». Примеры этих имен приведены в таблице ниже. Общее название насыщенных алифатических ( ациклических ) углеводородов ( разветвленных или неразветвленный ) представляет собой « алкан ». Примеры названий: (n = общее количество атомов углерода)
Каждое соединение отличается от следующего кратным -CH 2 — ( метилен
группа ). Серия соединений, структуры которых отличаются друг от друга определенной структурной единица (, например -CH 2 — в случае алканов ) называется гомологичной Серии . Можно написать общую формулу для всех членов гомологичного такие как алканы.Для алканов формула C n H 2n + 2 , где n — количество атомов углерода в соединении. Есть общие тенденции в физических и химических свойствах в пределах гомологичных семейств. которые можно использовать для изучения этих семей в целом. Например, как молекулярный масса соединения в семействе увеличивается, температура кипения увеличивается. Это может быть видно из приведенной выше таблицы, в которой перечислены первые десять членов семейства алканов. Интересно отметить, что первые четыре алкана, которые все существуют в парах
состояние при нормальных атмосферных условиях, являются основными ингредиентами природного газа. Если один атом водорода и связанный с ним электрон удален из углеводорода молекулы Остался радикал :
названы путем замены конца -yl на нормальный -ane окончание родительского соединения. Для удобства наименования органических соединений атомы углерода в структурной формуле: заданные номера позиций. В неразветвленной цепной молекуле нумерация углерода атомы могут начинаться с любого конца цепочки:
Не все алканы имеют неразветвленные цепи атомов углерода.Сложные алканы названы используя самых длинных цепочек из атомов углерода в качестве основы для названия соединения. г. РОДИТЕЛЬСКАЯ ЦЕПЬ не обязательно входит в прямую линию . Это соединение
имеет пентан (C 5 H 12 ) в качестве родительской цепи, так как самая длинная цепь
содержит пять атомов углерода.  это
не часть родительской цепи, а скорее присоединяется как боковая ветвь. это
не часть родительской цепи, а скорее присоединяется как боковая ветвь.
Относительно легко увидеть, что если не следовать установленным правилам, предыдущая структура могла быть ошибочно названа 4-этил-4-метилгексаном. ОДИН ДОЛЖЕН НАЧАТЬ НУМЕРАЦИЮ УГЛЕРОДА В РОДИТЕЛЬСКОЙ ЦЕПИ С ТОЧЕГО КОНЦА БЛИЖАЙШЕГО ДО ПРИСОЕДИНЕННОГО РАДИКАЛЬНЫЙ .Вы могли задаться вопросом, почему структура не была названа 3-метил-3-этилгексан. Дело в том, что и 3-этил-3-метилгексан, и 3-метил-3-этилгексан верны. Допускается выбрать одно из двух правил.
Первое из перечисленных правил является общепринятым методом представления прикрепленных радикалы и функциональные группы. Какой бы метод ни был выбран, важно последовательный. Если есть два или более одинаковых радикала, удобно использовать префиксы ( ди-, три-, тетра-, пента- и т. д. ) вместо записи каждой группы по отдельности. Запятая ставится между номерами позиций заместителей, которые похожи.
Материнская цепь представляет собой пентан с пятью углеродными цепями.Углероды родителя
цепь должна быть пронумерована, начиная слева, потому что радикалы ( метил ) являются
расположен ближе всего к этому концу. Два одинаковых радикала расположены на втором
и третьи атомы углерода родительской цепи, таким образом, обозначение 2,3-.
Как отмечалось в разделе 10.1, наличие двух или более веществ с одним и тем же
молекулярная формула (C 4 H 10 в данном случае ), но разные
расположение атомов и связей называется ISOMERISM .
Поскольку существует только одна форма метилпропана, метилбутана и диметилпропана,
не обязательно указывать номера позиций при написании их имени. Гексан (C 6 H 14 ), следующий член семейства алканов, имеет пять изомеров, а гептан (C 7 H 16 ) — девять. Изомеры названы в соответствии с самой длинной цепочкой, а не по общему количеству атомов углерода в молекуле. Таким образом, изомеры гептана составляют:
Количество изомеров резко возрастает с увеличением количества атомов углерода в исходной цепь, как указано октаном с восемнадцатью (18), нонаном с тридцатью пятью (35) и деканом с семьюдесятью пятью (75). Таблица: Фракции, полученные из сырой нефти
Все алканы горючие, продукт горения — двуокись углерода (CO 2 )
и вода (H 2 O). Предыдущая тема: Линейная комбинация атомных орбиталей Следующая тема: Циклоалканы Схема возврата к курсу Авторские права 1997 Джеймс Р.Фромм — отредактировано в мае 1998 г. УГЛЕВОДОРОДОВУГЛЕВОДОРОДОВУГЛЕВОДОРОДЫ Это молекулы, которые содержат только углерод и водород и включают алканов, алкенов, алкинов и ароматических соединений. АЛКАНЫ Ссылка: McMurry Ch 2, George et al. Структура и соединение
Рассмотрим метан, CH 4 Все связи C-H имеют одинаковую длину (154 мкм), прочность (412 кДж · моль -1 ) и химически эквивалентны. Гибридизация дает четыре идентичных sp 3 орбиталей, которые образуют тетраэдрическую форму, чтобы минимизировать отталкивание между орбиталями. Номенклатура Название органической молекулы состоит из нескольких частей: Стержень указывает количество атомов углерода в самой длинной цепи, содержащей функциональную группу. Правил:
Конституционные изомеры Алканы с «прямой цепью» образуют гомологический ряд, отличающийся группой CH 2 . например
В этих случаях возможна только одна формула, однако для C 4 H 10 есть две возможности:
По мере увеличения числа атомов углерода число структурных изомеров быстро увеличивается. C 5 H 12 имеет 3 структурных изомера C 6 H 14 имеет 5 структурных изомеров C 10 H 22 имеет 75 конституциональных изомеров C 20 H 42 имеет 366319 конституционных изомеров Конформационные изомеры Алканы можно нарисовать разными способами, которые отличаются вращением вокруг связи C-C.Это конформационных изомеров или конформеров . Конформеры обычно не могут быть изолированы друг от друга, поскольку взаимное преобразование одного конформера в другое происходит быстро. Конформационные изомеры являются частью класса изомеров, называемых стереоизомерами, которые обладают одинаковыми связями, но различаются положением атомов в пространстве. Пример: этан Циклоалканы
Получение алканов
Реакция
C 8 H 18 + 12 O 2 ® 8 CO 2 + 9 H 2 O DH = -5512 кДж моль -1 Изомеры и стереохимия Вопросы по алканам Вернуться к списку Изомер — обзор | Темы ScienceDirect29. 2.5.2 Физические и химические свойства 2.5.2 Физические и химические свойстваФизические свойства, указанные для различных катионных комплексов [Mn (CO) 6 — n (L) n ] + , не являются исключительными. Эти комплексы обычно кристаллические, белого или бледно окрашенного (обычно желтого цвета). Большая часть доступной информации была представлена для характеристики; неудивительно, что это в основном ограничивается данными ИК и ЯМР, а также данными о проводимости. Структурные данные рентгеновской дифракции доступны только для двух из этих комплексов, изомеров цис, — и транс, — [Mn (CO) 2 {PPh (OMe) 2 } 4 ] PF 6 . 164 Оба комплекса имеют приблизительную октаэдрическую координацию относительно металла с небольшими отклонениями, приписываемыми стерическим эффектам. Длины связей марганец – фосфор в пределах точности идентичны. Длины связей марганец-углерод различаются, хотя и не в значительной степени; значение для изомера транс составляет 1,84 (2) Å, что примерно на 0,06 Å больше, чем значения, измеренные для изомера цис . Существенные химические свойства этих катионных комплексов включают подверженность нуклеофильным реакциям, окислительно-восстановительную химию, а также образование и взаимопревращение изомеров. В этом обсуждении можно обойтись без темы замены лиганда, поскольку она рассматривалась как синтетический путь. Окислительно-восстановительный химический состав этих катионных комплексов недостаточно изучен. За исключением значительных электрохимических исследований комплексов, содержащих изоцианидные лиганды, [Mn (CO) 6 — n (CNR) n ] + (рассмотрено в разделе 29.9.2), информация в этой области ограничена несколькими примерами. Первым катионным комплексом марганца, который оказался окисляемым, является транс — [Mn (CO) 2 (dppe) 2 ] ClO 4 . 165 Как и ожидалось, окисление вызвало увеличение ν (CO) с 1897 до 1975 см -1 . Окисление цис — [Mn (CO) 2 (L) 4 ] PF 6 [L = PPh (OMe) 2 ] 140 по NOPF 6 имеет было показано, что дает транс — [Mn (CO) 2 (L) 4 ] (PF 6 ) 2 . Восстановление этой темно-синей разновидности марганца (II) гидразином дает транс — [Mn (CO) 2 (L) 4 ] PF 6 . Аналогичная картина поведения наблюдалась с цис — [Mn (CO) 2 (L) 2 (MeCN) 2 ] PF 6 и [Mn (CO) 2 (L) 3 (MeCN)] PF 6 ; при окислении NOPF 6 эти комплексы дают транс — [Mn (CO) 2 (L) 2 (MeCN) 2 ] (PF 6 ) 2 и мер , транс — [Mn (CO) 2 — (L) 3 (MeCN)] (PF 6 ) 2 соответственно. Изомеры катионных комплексов [Mn (CO) 3 (L) 3 ] + и [Mn (CO) 2 (L) 4 ] + были обнаружены недавно. Лицевые изомеры [Mn (CO) 3 (L) 3 ] ClO 4 были исходными продуктами, когда различные лиганды (L = PEt 3 , PBu 3 , PPhEt 2 , PPh 2) Et, PPh 2 Me, PPh 2 OEt) заменяли ацетон в [Mn (CO) 3 (ацетон) 3 ] ClO 4 .Когда эти реакции проводились в течение более длительного времени или когда изомеры fac нагревали в CHCl 3 , образовывались изомеры mer . Точно так же кипячение раствора цис в этаноле или бутаноле — [Mn (CO) 2 (L) 4 ] ClO 4 [L = PPh (OMe) 2 , PPh (OEt) 2 ] , P (OMe) 3 , P (OEt) 3 ] преобразовали эти частицы в равновесную смесь цис- и транс-изомеров , из которых можно было отделить транс-изомеров .
Восприимчивость катионные комплексы к нуклеофильным реагентам можно подробно описать. Комплекс [Mn (CO) 6 ] + быстро реагирует с водой. 167 Этой реакции способствует основание, и предполагается, что она происходит при атаке OH — на координированный карбонил.Недавние исследования с H 2 18 O показывают, что замена 18 O на 16 O происходит быстрее, чем образование гидрида. Обмен 18 O в H 2 18 O с карбонильными атомами кислорода в замещенных частицах [Mn (CO) 5 (L)] + или [Mn (CO) 4 (L) 2 ] + (L = фосфины) происходит с более низкой скоростью. 168 Для этих соединений необходимо добавление основания, такого как SH — или Et 3 N, для превращения катионного комплекса в гидрид (уравнение 43). Бензиловый реагент Гриньяра реагирует с комплексами [Mn (CO) 5 (L)] + (L = CO, PPhMe 2 ) с образованием цис -Mn (COCH 2 Ph ) (CO) 4 (L) комплексов. 169 Было обнаружено, что дальнейшая реакция Mn (COCH 2 Ph) (CO) 5 с этим нуклеофилом дает цис — [Mn (COCH 2 Ph) 2 (CO) 4 ] — . Реакции между Mn 2 (CO) 10 или MnX (CO) 5 и аминами с образованием карбамоильных комплексов, Mn (CONHR) (CO) 4 (RNH 2 ) (R = H, алкил группы). 41,133 Было высказано предположение, что первоначально образуются катионные комплексы [Mn (CO) 5 (RNH 2 )] + , но эти частицы далее реагируют с амином. Последняя стадия реакции представляет собой нуклеофильную атаку амина по координированному карбонилу. Дальнейшая работа доказала, что такие реакции действительно происходят и предположительно носят общий характер. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Используются для изготовления вазелина, парафина
Используются для изготовления вазелина, парафина ..
..



 и, таким образом, аналогичные химические свойства и одна и та же общая формула, причем каждый
соединение в ряду, отличающееся от следующего простой структурной единицей.
и, таким образом, аналогичные химические свойства и одна и та же общая формула, причем каждый
соединение в ряду, отличающееся от следующего простой структурной единицей.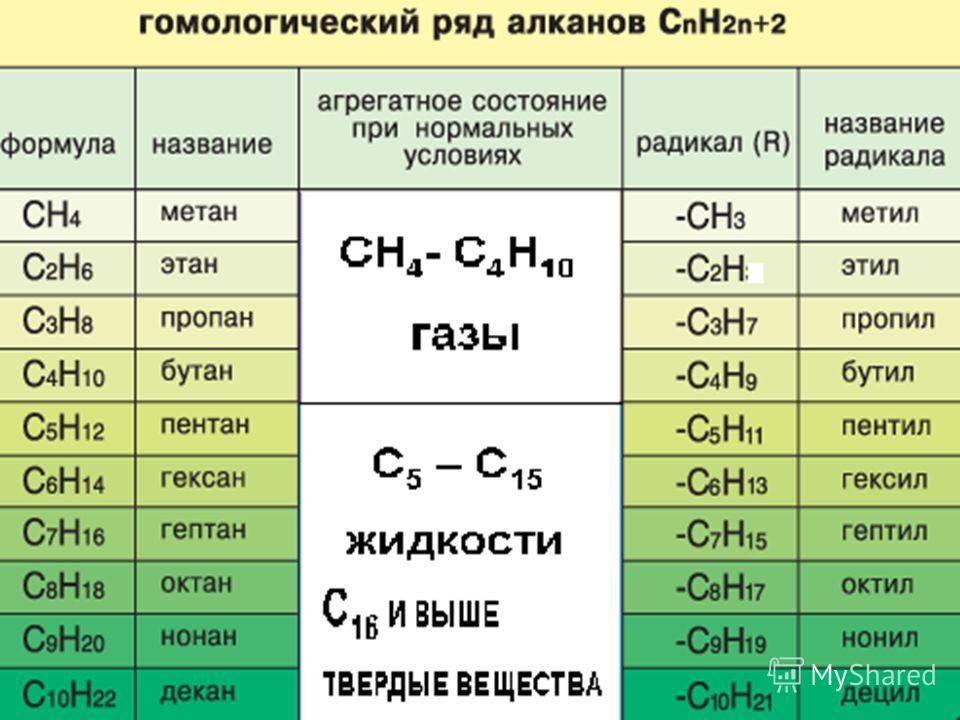 Эта группа соединений включает гомологический ряд с общей молекулярной формулой C n H 2 n +2 , где равно любому целому числу.
Эта группа соединений включает гомологический ряд с общей молекулярной формулой C n H 2 n +2 , где равно любому целому числу. Например, когда метан реагирует с хлором, образуется новое соединение, называемое хлорметаном (или хлористым метилом). Это новое соединение содержит группу CH 3 , связанную с атомом хлора.
Например, когда метан реагирует с хлором, образуется новое соединение, называемое хлорметаном (или хлористым метилом). Это новое соединение содержит группу CH 3 , связанную с атомом хлора. Первичный углерод непосредственно присоединен только к одному другому атому углерода. Вторичный и третичный атомы углерода присоединены к двум и трем другим атомам углерода соответственно.
Первичный углерод непосредственно присоединен только к одному другому атому углерода. Вторичный и третичный атомы углерода присоединены к двум и трем другим атомам углерода соответственно. Каждый атом углерода может образовывать четыре связи с
другие атомы, таким образом, достигается конфигурация благородного газа (8 внешних электронов). Каждый
атом водорода образует одну связь, производящую 2 внешних электрона, наиболее стабильное состояние для
водород.
Каждый атом углерода может образовывать четыре связи с
другие атомы, таким образом, достигается конфигурация благородного газа (8 внешних электронов). Каждый
атом водорода образует одну связь, производящую 2 внешних электрона, наиболее стабильное состояние для
водород. Алканы с длинными углеродными цепями часто
в химической промышленности называют парафинами. Самый простой алкан — метан с
формула CH 4 . Второй алкан — этан с формулой C 2 H 6 .
Общая формула алканов: C n H 2n + 2 .
Алканы с длинными углеродными цепями часто
в химической промышленности называют парафинами. Самый простой алкан — метан с
формула CH 4 . Второй алкан — этан с формулой C 2 H 6 .
Общая формула алканов: C n H 2n + 2 . Таким образом, представление метана как CH 4 , этана как H 3 CCH 3 (а не как C 2 H 6 ), а пропан как H 3 CCH 2 CH 3 (а не как C 3 H 8 ) является представлением структуры, а также
молекулярный состав. Для многих простых органических соединений такие представления
подходят для обсуждения и идентификации. Когда они неадекватны,
все химики-органики прибегают к более тщательно прорисованным структурам, которые передают
нужная информация.
Таким образом, представление метана как CH 4 , этана как H 3 CCH 3 (а не как C 2 H 6 ), а пропан как H 3 CCH 2 CH 3 (а не как C 3 H 8 ) является представлением структуры, а также
молекулярный состав. Для многих простых органических соединений такие представления
подходят для обсуждения и идентификации. Когда они неадекватны,
все химики-органики прибегают к более тщательно прорисованным структурам, которые передают
нужная информация. Таким образом, можно неограниченно расширять алкановый ряд соединений.
метод. Названия соединений и их группы заместителей приведены в
Таблица ниже. Для даже более длинных цепей имя — это просто номер (по-гречески
префикс).
Таким образом, можно неограниченно расширять алкановый ряд соединений.
метод. Названия соединений и их группы заместителей приведены в
Таблица ниже. Для даже более длинных цепей имя — это просто номер (по-гречески
префикс). В
прямолинейная форма считается «нормальной» формой. В качестве альтернативы они
может быть назван с использованием систематического метода ИЮПАК как 1-метилпропан и 2-метилпропан,
или даже как бутан и 2-метилпропан.Методом IUPAC названа самая длинная прямая
углеродная цепь обычным способом, а затем нумеруются атомы углерода; расположение заместителя
группа дается числом ее углерода. Метод IUPAC всегда используется для большего
сложные молекулы, но многие из более простых по-прежнему используют несистематические названия, называемые тривиальных имен , потому что они менее громоздки в использовании.
В
прямолинейная форма считается «нормальной» формой. В качестве альтернативы они
может быть назван с использованием систематического метода ИЮПАК как 1-метилпропан и 2-метилпропан,
или даже как бутан и 2-метилпропан.Методом IUPAC названа самая длинная прямая
углеродная цепь обычным способом, а затем нумеруются атомы углерода; расположение заместителя
группа дается числом ее углерода. Метод IUPAC всегда используется для большего
сложные молекулы, но многие из более простых по-прежнему используют несистематические названия, называемые тривиальных имен , потому что они менее громоздки в использовании. Эта старая номенклатура все еще используется для различения нормальных или n-соединений, которые
имеют прямые цепи от изо-соединений, которые разветвляются у углерода рядом с концом
углерод, но новые соединения теперь называются с использованием системы ИЮПАК.Систематическая
Названиями трех позиционных изомеров пентана будут пентан, 2-метилбутан и
2,2-диметилпропан. Обратите внимание, что появление двух заместителей на одном и том же углероде
не вызывает проблем; одно и то же место просто указывается дважды.
Эта старая номенклатура все еще используется для различения нормальных или n-соединений, которые
имеют прямые цепи от изо-соединений, которые разветвляются у углерода рядом с концом
углерод, но новые соединения теперь называются с использованием системы ИЮПАК.Систематическая
Названиями трех позиционных изомеров пентана будут пентан, 2-метилбутан и
2,2-диметилпропан. Обратите внимание, что появление двух заместителей на одном и том же углероде
не вызывает проблем; одно и то же место просто указывается дважды.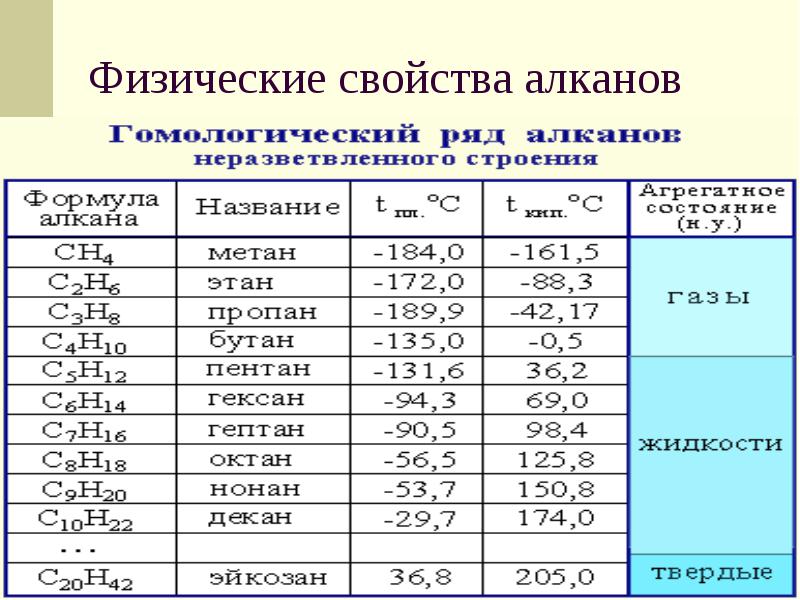 0
0 5
5 По сути, мы строим серию соединений, удаляя
атом водорода от одного из атомов углерода и добавление — CH 2 — к цепи и
затем замена водорода.
По сути, мы строим серию соединений, удаляя
атом водорода от одного из атомов углерода и добавление — CH 2 — к цепи и
затем замена водорода.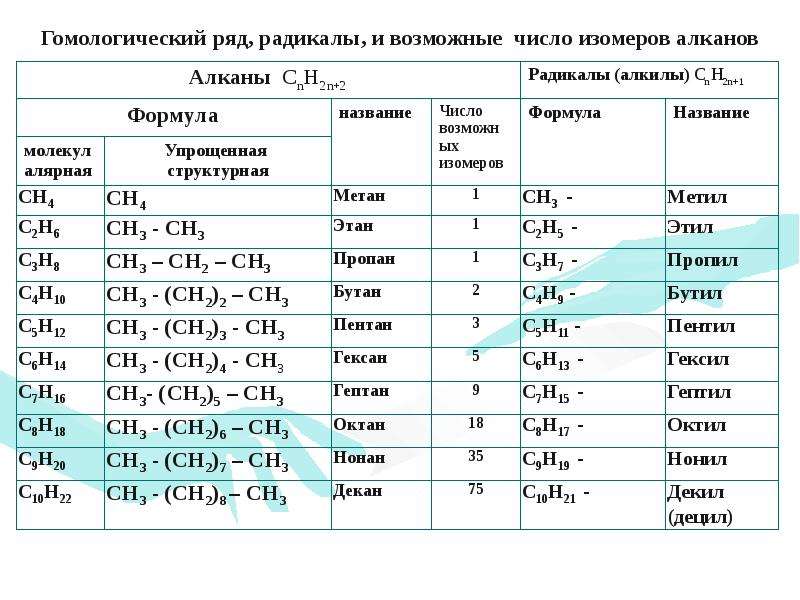 Члены семейства алканов используют префикс греческого (, иногда латинского ).
для числа атомов углерода, а характеристическое окончание -ан для идентификации
и описать их положение и структуру в соответствующей семье.
Члены семейства алканов используют префикс греческого (, иногда латинского ).
для числа атомов углерода, а характеристическое окончание -ан для идентификации
и описать их положение и структуру в соответствующей семье.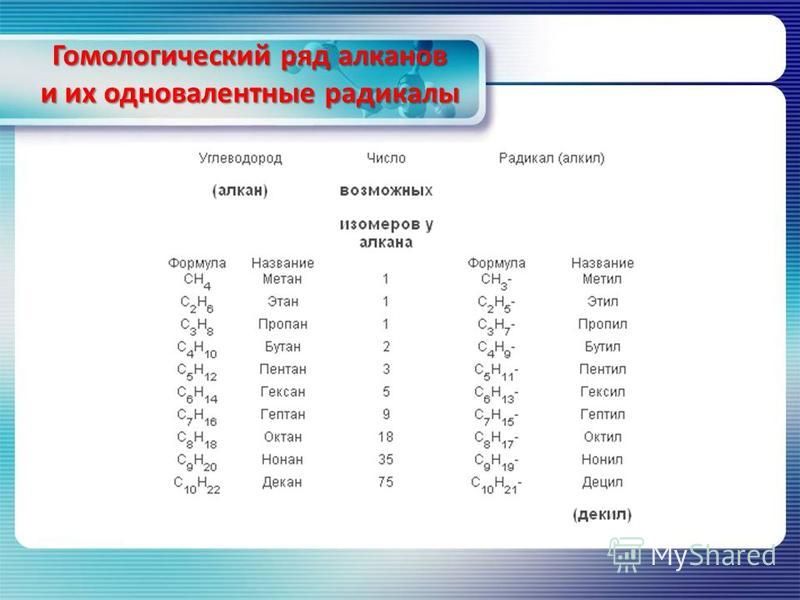
 Атомам углерода самой длинной цепи даны позиции
числа, начинающиеся с одного конца родительской цепочки. CH 3 — группа, которая
присоединенная к основной цепи, называется боковой цепью или заместителем . В
боковая цепь названа радикалом. Указываем цифрой положение углеродного
атом родительской цепи, к которой присоединена боковая цепь (радикал , ).
Таким образом, название 3-метилпентан для вышеуказанного насыщенного алкана. Исходное соединение
представляет собой пентан, радикал представляет собой метил, который присоединен к атому углерода номер 3 исходного
цепь.Название пишется через дефис между заместителями ( радикал ).
номер должности и наименование. Корень и родитель записываются одним словом.
Нумерация атомов углерода родительской цепи начинается с конца, что дает
номера младших позиций в корень.
Атомам углерода самой длинной цепи даны позиции
числа, начинающиеся с одного конца родительской цепочки. CH 3 — группа, которая
присоединенная к основной цепи, называется боковой цепью или заместителем . В
боковая цепь названа радикалом. Указываем цифрой положение углеродного
атом родительской цепи, к которой присоединена боковая цепь (радикал , ).
Таким образом, название 3-метилпентан для вышеуказанного насыщенного алкана. Исходное соединение
представляет собой пентан, радикал представляет собой метил, который присоединен к атому углерода номер 3 исходного
цепь.Название пишется через дефис между заместителями ( радикал ).
номер должности и наименование. Корень и родитель записываются одним словом.
Нумерация атомов углерода родительской цепи начинается с конца, что дает
номера младших позиций в корень.
 Потому что есть
два одинаковых радикала префикс di- используется для обозначения числа
настоящее время. Снова обратите внимание на наличие запятой и дефиса .
Для таких структур, как метан (CH 4 ), этан (CH 3 -CH 3 ),
и пропан (CH 3 -CH 2 -CH 3 ) только одна структурная схема
нужно нарисовать.Однако существует альтернативная структура для бутана.
Потому что есть
два одинаковых радикала префикс di- используется для обозначения числа
настоящее время. Снова обратите внимание на наличие запятой и дефиса .
Для таких структур, как метан (CH 4 ), этан (CH 3 -CH 3 ),
и пропан (CH 3 -CH 2 -CH 3 ) только одна структурная схема
нужно нарисовать.Однако существует альтернативная структура для бутана. Две структуры бутана, представленные на диаграмме выше, называются изомерами бутана.
Большинство органических соединений имеют изомеры, но нет известного способа точно предсказать, как
многие изомеры могут образовывать большинство соединений. Пентан (C 5 H 12 ), следующий
член семейства алканов, имеет три изомера:
Две структуры бутана, представленные на диаграмме выше, называются изомерами бутана.
Большинство органических соединений имеют изомеры, но нет известного способа точно предсказать, как
многие изомеры могут образовывать большинство соединений. Пентан (C 5 H 12 ), следующий
член семейства алканов, имеет три изомера:
 Метан, этан, пропан и бутан в помещении газообразны.
температура и все вместе обозначаются как природный газ . Углеводороды
неполярны, что позволяет силам Ван-дер-Ваальса действовать между ними. Короткие алканы имеют
слабые силы Ван дер Вальса. С увеличением количества атомов углерода силы Ван-дер-Ваальса
увеличивать. По мере того, как молекулярные цепочки становятся длиннее, молекулы становятся жидкими и
в итоге твердый.
Метан, этан, пропан и бутан в помещении газообразны.
температура и все вместе обозначаются как природный газ . Углеводороды
неполярны, что позволяет силам Ван-дер-Ваальса действовать между ними. Короткие алканы имеют
слабые силы Ван дер Вальса. С увеличением количества атомов углерода силы Ван-дер-Ваальса
увеличивать. По мере того, как молекулярные цепочки становятся длиннее, молекулы становятся жидкими и
в итоге твердый. Ch 1.1
Ch 1.1 Окончание указывает на природу присутствующей функциональной группы. Заместители обозначены префиксами, а число используется для однозначного определения местоположения любого заместителя или функциональной группы в молекуле.
Окончание указывает на природу присутствующей функциональной группы. Заместители обозначены префиксами, а число используется для однозначного определения местоположения любого заместителя или функциональной группы в молекуле. Они имеют общую формулу C n H 2n + 2
Они имеют общую формулу C n H 2n + 2 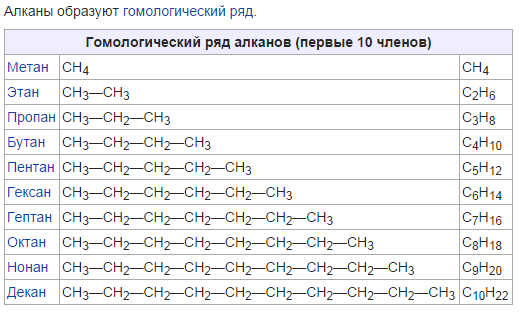 Например, соединение формулы C 4 H 8 O может быть кетоном, альдегидом, спиртом или эфиром.
Например, соединение формулы C 4 H 8 O может быть кетоном, альдегидом, спиртом или эфиром.
 Это различие соответствует большему эффекту транс карбонила по сравнению с эффектом фосфина.
Это различие соответствует большему эффекту транс карбонила по сравнению с эффектом фосфина.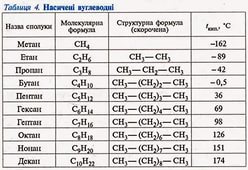 Более позднее электрохимическое исследование [Mn (CO) 2 (dppe) 2 ] ClO 4 показало одноэлектронное окисление при 1,07 В ( против Ag |, |, | AgCl). 166
Более позднее электрохимическое исследование [Mn (CO) 2 (dppe) 2 ] ClO 4 показало одноэлектронное окисление при 1,07 В ( против Ag |, |, | AgCl). 166  127 Восстановление этих солей марганца (II) гидразином дает транс — [Mn (CO) 2 (L) 2 (MeCN) 2 [PF 6 и мер , транс — [Mn (CO) 2 (L) 3 (MeCN)] PF 6 .
127 Восстановление этих солей марганца (II) гидразином дает транс — [Mn (CO) 2 (L) 2 (MeCN) 2 [PF 6 и мер , транс — [Mn (CO) 2 (L) 3 (MeCN)] PF 6 . 139 ИК-данные были использованы для определения геометрии этих продуктов. В качестве иллюстрации ниже приведены значения ν (CO), измеренные для нескольких соединений:
139 ИК-данные были использованы для определения геометрии этих продуктов. В качестве иллюстрации ниже приведены значения ν (CO), измеренные для нескольких соединений: Реакции с кислородом (OH — , H 2 O, OR — ), серой (HS — ), азотом (RNH 2 , NH 3 , NR 2 — , N 3 — , N 2 H 4 ) и нуклеофилы углерода.
Реакции с кислородом (OH — , H 2 O, OR — ), серой (HS — ), азотом (RNH 2 , NH 3 , NR 2 — , N 3 — , N 2 H 4 ) и нуклеофилы углерода.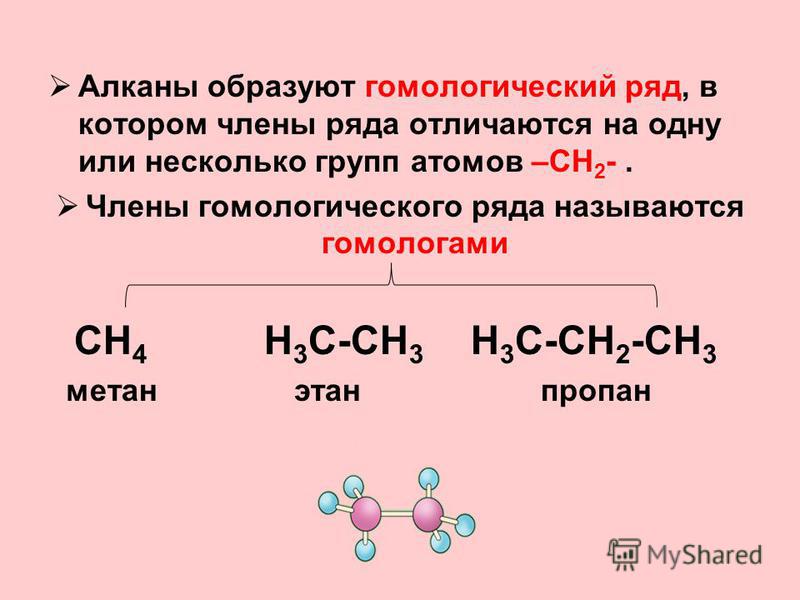
 Behrens et al. 170 провели реакции [Mn (CO) 6 ] + , [Mn (CO) 5 (L)] + и [Mn (CO) 4 (L) 2 ] + (L = PPh 3 , PEt 3 ; L 2 = phen, bipy) с NH 3 , которые в каждом случае дают карбамоильные производные марганца.Стабильны только продукты из Mn (CONH 2 ) (CO) 3 (L) 2 ; два комплекса Mn (CONH 2 ) (CO) 4 (L) разлагаются даже при -70 ° C в результате разложения амида типа Хофмана с образованием MnH (CO) 5 и NH 4 OCN. Анджеличи и Бринк 171 показали, что [Mn (CO) 4 (L) 2 ] + (L = PPh 3 , PPh 2 Me, PPhMe 2 ) реагируют с первичными аминами. , RNH 2 (R = Cy, Bu n , Pr i , Bu s ) таким же образом, давая Mn (CONHR) (CO) 3 (L) 2 .
Behrens et al. 170 провели реакции [Mn (CO) 6 ] + , [Mn (CO) 5 (L)] + и [Mn (CO) 4 (L) 2 ] + (L = PPh 3 , PEt 3 ; L 2 = phen, bipy) с NH 3 , которые в каждом случае дают карбамоильные производные марганца.Стабильны только продукты из Mn (CONH 2 ) (CO) 3 (L) 2 ; два комплекса Mn (CONH 2 ) (CO) 4 (L) разлагаются даже при -70 ° C в результате разложения амида типа Хофмана с образованием MnH (CO) 5 и NH 4 OCN. Анджеличи и Бринк 171 показали, что [Mn (CO) 4 (L) 2 ] + (L = PPh 3 , PPh 2 Me, PPhMe 2 ) реагируют с первичными аминами. , RNH 2 (R = Cy, Bu n , Pr i , Bu s ) таким же образом, давая Mn (CONHR) (CO) 3 (L) 2 .