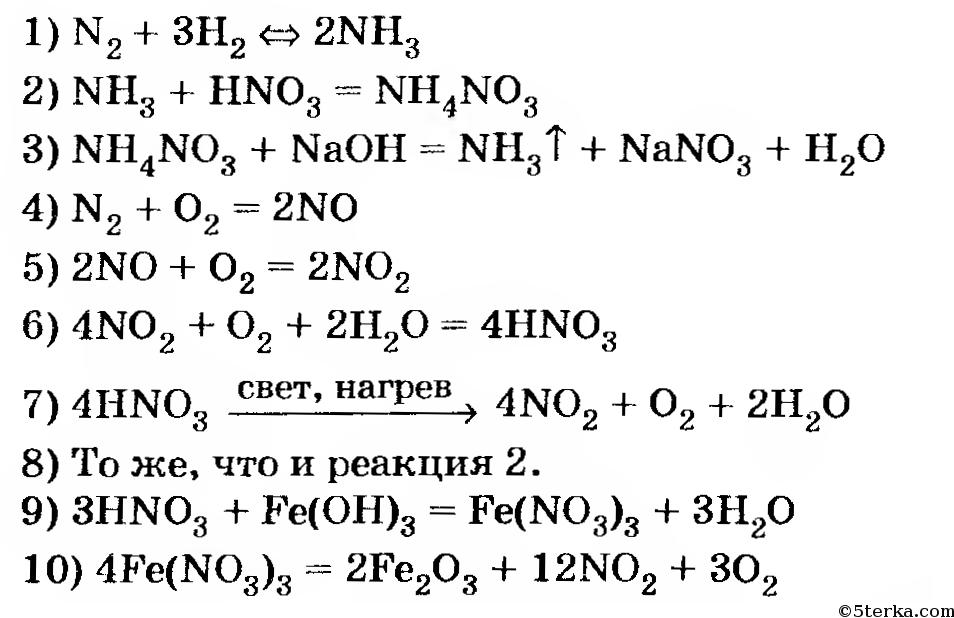Разработка урока химии ,8 классс
Тема : Ионные уравнения реакций.
Цель: показать суть химических реакций, протекающих в растворах.
Планируемые УУД: Предметные: Формулируют и воспроизводят понятия «Электролиты – не электролиты» «Электролитическая диссоциация», «Ионные реакции», «Условия необратимости реакций».Проводят опыты, наблюдают, описывают наблюдения. Регулятивные: Преобразуют практическую задачу в познавательную. Планируют собственную деятельность. Осуществляют контроль и оценку своих действий. Познавательные: Проводят наблюдение, анализ, выдвигают предположения (моделируют процессы) и осуществляют их экспериментальную проверку. Коммуникативные: Обмениваются знаниями для принятия эффективных решений. Личностные: Проявляют устойчивый интерес к поиску решения проблемы. Методы урока: По характеру познавательной деятельности: объяснительно –иллюстративный, проблемно – поисковый. По виду источника знаний: словесно – наглядный По форме совместной деятельности учителя и уч — ся: рассказ, беседа, эксперимент Контроль результатов обучения: а) самоконтроль б) взаимоконтроль в) компьютерный контроль Оборудование: ПК, медиапроектор,
Тип урока: урок открытия новых знаний.
Основные понятия темы: реакции ионного обмена, ионные реакции, ионные уравнения, молекулярные уравнения реакций, полные и сокращённые ионные уравнения реакций, реакции нейтрализации Методы обучения: технология проблемного обучения. Оборудование и реактивы: Растворы кислот, серной и соляной Карбонат натрия, сульфат натрия, хлорид меди(2) Штативы с пробирками.
Ход урока
I. Организационный момент. Здравствуйте, ребята! Я рада вас приветствовать сегодня на уроке. Улыбнитесь друг друга ,а я улыбаюсь Вам. Я вижу все настроены на урок и получение новых знаний, настроение у всех хорошее. Эпиграфом нашего урока будут следующие слова (слайд) Три пути ведут к знанию: путь размышления – самый благородный, путь подражания – самый легкий, и путь опыта – это самый горький.
2.Какие вещества называются неэлектролитами? Какие вещества к ним относятся? 3то такое электролитическая диссоциация?
4.Что такое ионы?
5.Какие вы знаете ионы?
6.Распределить ионы К+, CO32– , Al3+, OH– , Cl– , H+, PO43– , Mg2+, SO42–, Nh5+, S2– КАТИОНЫ АНИОНЫ Закончите уравнения реакций,расставьте коэффициенты ,укажите тип реакций: (У доски -1 человек, остальные на листе самоконтроля) (слайд) СаСО3 + HCl = CaCl2 + h3O + CO2 ↑ CaCl2 + h4PO4 = Ca3(PO4)2 ↓+ ……….. h3SO4 + NaOH = ………….+……………….. Дополните нужными словами:(слайд) Схема на доске (кружочки на магнитах)- суть реакции обмена, составляет один желающий. Схема на листочке (шарики из пластилина, подсказка)-составляют две пары слабых учащихся, проверяют сильные учащиеся с предыдущей парты. Реакция обмена – это реакция в результате которой два …………… вещества …………………. своими составными ………… .
III. Целеполагание и мотивация.
— Понятия “реакции обмена”, “ионы” мы уже знаем, а как их вместе применить? Определите ключевое понятие сегодняшнего урока, (“реакции ионного обмена”). Тема нашего урока: « Ионные уравнения реакций». Запишите тему урока Формулировка целей и задач урока: (используя упражнение «Посмотрите через левое плечо»). Учитель предлагает учащимся встать, посмотреть через левое плечо, подумать, что каждый из них увидел; а теперь снова посмотрите через левое плечо как можно дальше. Вопрос учащимся: когда вы смогли увидеть больше, в первый или во второй раз? Учащиеся отвечают, во второй раз. Это потому, что у вас была такая цель. Давайте вместе сформулируем цель нашего урока, учитывая то, что тема немного нам знакома.
IV. Изучение нового материала.
1) Вступительное слово На предыдущих уроках мы выяснили, что свойства растворов электролитов зависят от свойств ионов. Но химия изучает отношение веществ друг к другу. Что будем наблюдать, если смешать растворы электролитов? (Опыт с шариком- смешиваем кислоту и карбонат натрия)-шарик надулся. Почему?(образовался газ) В каких случаях произошли химические реакции? — По каким признакам вы определили, что произошла химическая реакция? — К какому типу реакций относятся реакции, проведенные в опыте? — Какие частицы находятся в растворах электролитов? Между тем, реакции обмена между электролитами в водных растворах мы раньше изображали молекулярными уравнениями, не учитывая, что в этих реакциях участвуют не молекулы электролита, а ионы, на которые он диссоциирован. — Существуют ли какие-нибудь закономерности в протекании таких реакций? Чтобы получить ответ на этот вопрос, запишем уравнения этих реакций не только в молекулярном, но и в ионном виде (полное и сокращенное ионное уравнения). Для этого посмотрим на алгоритм составления этих уравнений СОСТАВЛЕНИЕ ИОННЫХ УРАВНЕНИЙ Учитель на доске составляет полное и сокращенное ионное уравнение для первого опыта, комментируя записи, учащиеся сопоставляют запись на доске с алгоритмом (у каждого на столе)
Правила: 1. Простые вещества, оксиды, а также нерастворимые кислоты, основания и соли не диссоциируют.
2. Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой части уравнения должна быть равна сумме электрических зарядов ионов в правой части. Алгоритм составления ионных реакций
Алгоритм составления ионных реакций
1.Записываем молекулярное уравнение, расставляем коэффициенты.
2.С помощью таблицы растворимости определяем растворимость каждого вещества.
3. Составляем полное ионное уравнение реакции. 4.Составляем сокращенное ионное уравнение реакции (найти одинаковые ионы и сократить их слева и справа). Итак: В растворе электролиты распадаются на ионы и между ними могут протекать химические реакции, которые называются ионными реакциями. Уравнения этих реакций называются ионными уравнениями. РИО (реакции ионного обмена) – это реакции, протекающие между электролитами.
Вывод 1. :РИО идут до конца , если выделяется газ. СОЗДАНИЕ проблемной ситуации а) на доске запись CuCl2+2NaOH=Cu(OH)²↓+2NaCl Учитель напоминает, что реакция протекает в растворе, где вещества находятся в виде ионов и предлагает написать представленное уравнение в ионном виде. Запись на доске: Cu(2+)+2Cl(-)+2Na(+)+2OH(-)=Cu(OH)²+2Na(+)+2Cl(-)-полное ионное Учитель – посмотрите на обе части уравнения. Что мы видим?
Ученики – одинаковые ионы. Учитель – что наблюдаете при поведении реакции? Ученики – выпадение осадка. Учитель – а какое вещество выпадает в осадок? Ученики – с помощью таблицы растворимости –гидроксид меди 2 Учитель – значит – вещество нерастворимое. А когда в результате реакции выпадает осадок, что можно сказать о такой реакции?
Ученики – реакция необратима Предлагается сделать верную запись реакции и учащиеся самостоятельно должны записать уравнение реакции: Учитель поясняет, что написанное уравнение называется полным ионным. определим одинаковые ионы, то есть ионы, не участвующие в реакции (они находятся в правой и левой части уравнения в одинаковом количестве ).
Формулы этих ионов можно вычеркнуть, другими словами, привести подобные члены в левой и правой частях уравнения («сократить») Затем предлагается сравнить обе части уравнения и сделать вывод – какие частицы участвовали в реакции, и записать соответствующее уравнение реакции: Cu(2+)+2OH(-)=Cu(OH)²- Учитель – это сокращенное ионное уравнение. * Сокращённое ионное уравнение отражает сущность реакции ионного обмена. Вывод2.: образование осадка. Учитель – вспомните признаки химических реакций; как вы думаете, в каких случаях реакция ионного обмена может быть необратима? Запись на доске: NaOH + HCl = NaCl + h3O ГИПОТЕЗА образование воды ПРОВЕРКА ГИПОТЕЗ — написать уравнение реакции в молекулярном и ионном видах и сделать выводы. Вывод 3.образование воды-мдв. РИО между кислотой и щелочью с образованием соли и воды называется НЕЙТРАЛИЗАЦИЕЙ.
* Сокращённое ионное уравнение отражает сущность реакции ионного обмена. Вывод2.: образование осадка. Учитель – вспомните признаки химических реакций; как вы думаете, в каких случаях реакция ионного обмена может быть необратима? Запись на доске: NaOH + HCl = NaCl + h3O ГИПОТЕЗА образование воды ПРОВЕРКА ГИПОТЕЗ — написать уравнение реакции в молекулярном и ионном видах и сделать выводы. Вывод 3.образование воды-мдв. РИО между кислотой и щелочью с образованием соли и воды называется НЕЙТРАЛИЗАЦИЕЙ.
V.Релаксация(слайд)
При сливании некоторых растворов электролитов реакции протекают, а в других случаях – нет. Как вы думаете почему? Попробуем разобраться с помощью эксперимента. Na2SO4 + СuCl2 — ……+…… Вспомним правила ТБ по работе с химическими веществами.
В XIX веке жил знаменитый ученый-химик Карл Либих. Его коллега (тоже химик) Карл Фогт вспоминает один такой случай… как-то входит Либих, а у него в руке склянка с притертой пробкой. Он подходит к Фогту и говорит: «Ну-ка, обнажите свою руку», — и влажной пробкой прикасается к руке Фогта и спрашивает: «Жжет, не правда ли?» Я только что получил муравьиную кислоту. Правильно ли поступил Карл Либих? Конечно же нет. У Фогта после этого долго болела рука и остался шрам. А вы знаете, как надо обращаться с реактивами? Учащийся проводит опыт, соблюдая технику безопасности (учитель делает акцент на правилах по ТБ.) Проведение опыта.(один у доски). Результат: ничего не произошло.
Реакция обратима. Выводы: Если выделит ГАЗ — Это раз; И получится ВОДА¬ — Это два; А ещё нерастворимый Осаждается продукт… «Есть ОСАДОК», — говорим мы… Это третий важный пункт, Химик «правила обмена» Не забудет никогда: В результате – непременно Будет ГА3 или ВОДА, Выпадет ОСАДОК – Вот тогда порядок!!! VII. Первичное закрепление нового материала (тест) -взаимопроверка • 1. Реакции ионного обмена – это реакции: А. Разложения. В. Обмена Б. Замещения. Д. Соединения • 2. Укажите уравнение реакции ионного обмена: А.
Именно в наш «информационный» век стало возможным понять, как же именно сохранить произведения искусства для потомков. Химическими исследованиями, которые применяются при реставрации картин это Капельный метод. В основе которого лежат ионные реакции.
Ребята мы сегодня занимались небольшим научным исследованием. Исследовали и выяснили, что ионные реакции идут до конца в трех случаях. .. остальные являются обратимыми . Также ознакомились с новым типом реакций обмена- нейтрализация. Кластер Молодцы ребята вы смогли превратить наш урок в научную лабораторию. Мы прошли с вами все этапы научного познания всего лишь на одном уроке. VI. Рефлексвно-оценочный (3 мин).
Я предлагаю вам оценить свою работу с помощью колеса самооценки. Возьмите его пожалуйста. На колесе самооценки есть 6 критериев по которым вы должны оценить себя. От 0 до 10 б., в течении 1 минуты оцените работу по данным критериям. Вам понятно как выполнять оценивание Что вы можете сказать по критерию Работа ума и получения новых знаний? Почему? Спасибо! Замечательно. Как вы оценили свою деятельность по критерию гармония отношений с одноклассниками Как вы оценили, себя по критерию у нас все получилось!
VII. Домашнее задание § 37,на листе Презентация по теме: «Реакции ионного обмена в природе и жизни человека»
Предложите решение следующей задачи: Задача 1. В сточных водах гальванического цеха химического завода обнаружены катионы Fe3+, Fe2+, Ni2+ и анионы Cl-, SO42-. Как с помощью реакций ионного обмена можно очистить эти стоки?
В сточных водах гальванического цеха химического завода обнаружены катионы Fe3+, Fe2+, Ni2+ и анионы Cl-, SO42-. Как с помощью реакций ионного обмена можно очистить эти стоки?
Спасибо вам за сотрудничество. Успехов вам в дальнейшем изучении химии! Желаю вам в этой жизни накапливать только позитивную энергию и дарить ее окружающим во всем в учебе , в общении, в познании нашего мира. Спасибо вам большое.
Метод полуреакций — Составление уравнений окислительно-восстановительных реакций — Окислительно-восстановительные реакции. Электролиз — Теоретические основы химии
9 января 2007
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:Н2S – 2е– = S + 2H+
Это первая полуреакция – процесс окисления восстановителя Н2S.Обесцвечивание раствора связано с переходом иона MnO4– (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4– → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Поэтому процесс перехода записываем так:MnO4– + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:MnO4– + 8Н+ + 5e–= Mn2+ + 4Н2О
Это вторая полуреакция – процесс восстановления окислителя, т.е. перманганат–ионаДля составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4– + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону – анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
Таким образом, составление уравнений окислительно–восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов а есть ионы
Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов а есть ионы
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно–восстановительных реакций, протекающих в водных растворах.
Реакции ионного обмена и условия их осуществления
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
- Na2CO3 + h3SO4 → Na2SO4 + CO2↑ + h3O
- 2Na(+) + CO3(2-) + 2H(+) + SO4(2-) → 2Na(+) + SO4(2-) + CO2↑ + h3O
- 2H(+) + CO3(2-) → CO2↑ + h3O
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
Диссоциации не подвергаются:
- оксиды
- газообразные вещества
- вода
Реакция ионного обмена идет до конца, если образуется газ, осадок или вода:
- Na2CO3 + 2HCl → CO2↑ + 2NaCl + h3O
- 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
- NaOH + HCl → NaCl + h3O
Полезные ссылки
Источник материала
Реакции ионного обмена (видео)
Калькулятор расчета уравнения Аррениуса онлайн
В мире все находится в постоянном движении. В результате постоянно происходит столкновение и взаимодействие мельчайших частиц. Однако, по утверждению Аррениуса, не все столкнувшиеся молекулы вступают в химическое взаимодействие. Столкновения станут эффективны, если молекулы имеют достаточную энергию. Минимальная энергия молекулы, способная при столкновении привести к химическому взаимодействию, является энергией активации. Сообщив неактивным частицам энергию, их можно сделать активными. Процесс получил название активация, дополнительная энергия — энергией активации. Энергия активации — энергия, необходимая одному моль молекул вещества, пребывающего в стандартном состоянии, чтобы они стали активными. Измеряется в Дж/моль. Для каждой химической реакции есть собственное значение Еa. При увеличении температуры растет число активных частиц, соответственно, возрастает константа скорости реакции. Ученым Я.Г. Вант-Гоффом было эмпирически установлено, что с повышением температуры на каждые 10 градусов в 2-4 раза возрастает константа скорости элементарной химической реакции. Температурный коэффициент константы скорости реакции γ показывает, во сколько раз увеличивается константа скорости реакции при росте температуры на 10 градусов. Однако, при очень высоких и низких температурах скорость химической реакции уже не зависит от температуры, а температурный коэффициент γ будет равен единице.
Для каждой химической реакции есть собственное значение Еa. При увеличении температуры растет число активных частиц, соответственно, возрастает константа скорости реакции. Ученым Я.Г. Вант-Гоффом было эмпирически установлено, что с повышением температуры на каждые 10 градусов в 2-4 раза возрастает константа скорости элементарной химической реакции. Температурный коэффициент константы скорости реакции γ показывает, во сколько раз увеличивается константа скорости реакции при росте температуры на 10 градусов. Однако, при очень высоких и низких температурах скорость химической реакции уже не зависит от температуры, а температурный коэффициент γ будет равен единице.
В 1889 г. Аррениусом было предложено уравнение зависимости константы скорости элементарной химической реакции от температуры:
К = A·10(-Ea/kT)
В данном уравнении: A обозначает предэкспоненциальный множитель, Ea — энергия активации, k — постоянная Больцмана, T — абсолютная температура. Вместо постоянной Больцмана (k) берется газовая постоянная R, если энергия активации берется не на одну частицу, на 1 моль частиц (в кДж/моль).
Скорость реакции при постоянной температуре зависит от Ea. При увеличении Ea уменьшается количество активных молекул, реакция замедляется. Чем меньше Ea, скорость реакции возрастает. При Ea равном нулю происходит мгновенная химическая реакция. Если Ea = 50–100 кДж моль–1, при изменении температуры реакции на 10 градусов скорость изменится в 2-4 раза.
С помощью онлайн калькулятора можно быстро и правильно определить константу (k) скорости реакции, применив уравнение Аррениуса и указав температуру (Т), энергию активации (Еa), частоту столкновений (А).
Уравнение Аррениуса онлайн
Химия
- Подробности
Просмотров: 14107
8 класс
Готовимся к контрольной работе по теме
«Основные классы неорганических соединений»
Написать уравнения реакций с помощью которых можно осуществить превращения:
Zn → ZnO → ZnCl2 →Zn(OH)2 → ZnO → Zn
1) 2Zn + O2 = 2ZnO реакция соединения
2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
4) Zn(OH)2 = ZnO + H2O реакция разложения
ZnO + H2 = Zn + H2O реакция замещения
Ca → Ca(OH)2 → CaSO4 → BaSO4
1) Ca + 2H2O = Ca(OH)2 + H2↑ реакция замещения
2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакцияобмена
3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2 реакцияобмена
S → SO2 → SO3 → H2SO4→ Na2SO4
1) S + O2 = SO2 реакция соединения
2) 2SO2 + O2 = 2SO3 реакция соединения
3) SO3 + H2O = H2SO4 реакция соединения
4) Na2O + H2SO4 = Na2SO4 + H2O реакцияобмена
C → CO2 → CaCO3 → CO2 → CaCO3 → Ca(NO3)2
1) C + O2 = CO2 реакция соединения
2) CO2 + Ca(OH)2 =CaCO3 + H2O реакция обмена или
CO2 + CaO =CaCO3 реакция соединения
3) CaСO3 + 2HСl = CaCl2 + H2O + CO2↑ реакция обмена
4) см. реакцию №2
реакцию №2
5) CaСO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑ реакция обмена
Как работать с цепочками превращений.
Цепочки превращений являются важным механизмом проверки знаний и умений, умению применять их на практике, способствуют развитию логического мышления учащихся.
Разберемся с выполнением подобных заданий на конкретном примере:
Mg → MgO → MgCl2 → Mg(OH)2 → MgO → Mg
Итак, первое задание – исходя из магния, получить оксид магния. Анализируя предложенные вещества, видим, что необходимо металл превратить в оксид металла. Различие между двумя веществами в наличии у оксида магния кислорода. Вспомним свойства металлов. Металлы взаимодействуют с неметаллами, в том числе, и с кислородом. Осталось записать уравнение химической реакции и расставить коэффициенты:
2Mg + O2 = 2MgO
Второе задание – исходя из оксида магния, получить хлорид магния. Анализируем: имеем оксид магния, получаем соль – хлорид магния. Из оксида необходимо получить соль. Вспомним свойства оксидов. Основные оксиды взаимодействуют с кислотами с образованием соли и воды. Хлор входит в состав соляной кислоты, значить записываем уравнение реакции между оксидом магния и соляной кислотой и расставляем коэффициенты:
MgO + 2HCl = MgCl2 + H2O
Третье задание – исходя из хлорида магния, получить гидроксид магния. Анализируем: имеем соль, необходимо получить основание. Вспоминаем свойства солей. Соли взаимодействуют с растворимыми основаниями (щелочами) с образованием нового основания и новой соли. Записываем уравнение реакции:
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Четвертое задание – исходя из гидроксида магния, получить оксид магния. Анализируем: имеем основание, необходимо получить основный оксид. Вспоминаем свойства оснований. Нерастворимые основания при нагревании разлагаются на основный оксид и воду. Записываем уравнение химической реакции термического разложения гидроксида магния:
Записываем уравнение химической реакции термического разложения гидроксида магния:
Mg(OH)2 = MgO + H2O
Пятое задание – исходя из оксида магния, получить чистый металл магний. Анализируем: имеем основный оксид, необходимо получить металл. Вспоминаем свойства основных оксидов. Из оксида металла можно получить чистый металл несколькими способами с помощью восстановителей (C, CO, H2, более активный металл, электролиз). Записываем уравнение химической реакции восстановления металла из его оксида:
MgO + H2 = Mg + H2O
Всё! Задание выполнено!
Вы убедились в том, что если хорошо знаешь свойство классов неорганических веществ, выполнить задания цепочек превращений не представляет труда. Ну а если не знаешь, можно воспользоваться следующей шпаргалкой.
Свойства классов неорганических веществ.
(шпаргалка)
Основные оксиды:
1. Взаимодействуют с кислотными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с более активными металлами с образованием нового оксида и металла.
Пример: СuO + Mg = Cu + MgO
3. Взаимодействуют с восстановителями (С, CO, H2) с образованием чистого металла и нового оксида.
Пример: Fe2O3 + 3H2 = 2Fe + 3H2O
4. Взаимодействуют с кислотами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
5. Взаимодействуют с водой (оксиды щелочных и щелочноземельных металлов) с образованием щелочей.
Пример: Na2O + H2O = 2NaOH
Кислотные оксиды:
1. Взаимодействуют с основными оксидами с образованием соли.
Пример: CaO + CO2 = CaCO3
2. Взаимодействуют с основаниями с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
3. Взаимодействуют с солями, образованными более слабой кислотой с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Основания:
1. Взаимодействуют с кислотными оксидами с образованием соли и воды.
Пример: CO2 + 2NaOH = Na2CO3 + H2O
2. Щелочи взаимодействуют с солями с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3. Взаимодействуют с кислотами с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
Кислоты:
1. Взаимодействуют с металлами, стоящими в ряду активности перед водородом с образованием соли и водорода.
Пример: Zn + 2HCl = ZnCl2 + H2↑
2. Взаимодействуют с основными оксидами с образованием соли и воды.
Пример: CaO + 2HCl = CaCl2 + H2O
3. Взаимодействуют с основаниями с образованием соли и воды.
Пример: NaOH + HCl = NaCl + H2O
4. Взаимодействуют с солями с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
Соли:
1. Взаимодействуют с солями с образованием новых солей.
Пример: BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2. Взаимодействуют с металлами, если в ряду активности металл стоит перед металлом входящим в состав соли с образованием новой соли и металла.
Пример: CuCl2 + Mg = Cu + MgCl2
3. Взаимодействуют с кислотами с образованием новой соли и новой кислоты.
Пример: HCl + AgNO3 = AgCl↓ + HNO3
4. Взаимодействуют со щелочами с образованием нового основания и новой соли.
Взаимодействуют со щелочами с образованием нового основания и новой соли.
Пример: 2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
5. Взаимодействуют с кислотными оксидами, если оксид образует более сильную кислоту с образованием новой соли и нового оксида.
Пример: SO3 + Na2SiO3 = Na2SO4 + SiO2
Выполнить задания:
Осуществите цепочки превращений:
а Sr →SrO → Sr(OH)2,
б Р → Р2О5 → Н3РО4.
Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот и солей и дайте им названия:
1.К2ОАl(OH)3 HNO3 HCl BaO BaSO4 AlPO4 CO2 H3PО4 Fe(OH)2 Ag Cl NaNO3 Al2O3
2. Дана схема превращений. Составьте уравнения реакций.
Cu ® CuO ® CuCl2 → Cu(OH)2 Укажите тип реакций.
3. С какими из перечисленных веществ будет реагировать соляная кислота: HCl, CaO, CO2, H2O, Mg, Ba(OH)2. Напишите уравнения осуществимых реакций.
4. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, фосфата кальция, сульфата цинка, сульфида железа (II), хлорида меди (II), силиката калия, сульфита натрия, бромида алюминия, иодида калия, гидрокарбоната магния, дигидрофосфата калия.
Домашнее задание.
9АБВГД
| Железо. Нахождение в природе. Свойства железа. |
* 43 у 1-5 с 135 задача 102 с 136 |
| Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 44 у 6-11 з 3-4 с 136 |
91
|
Железо. Оксиды, гидроксиды и соли железа (II) и железа (Ш). |
* 43 у 1-5 с 135 з 102 с 136 * 44 у 6-11 з 3-4 с 136 |
|
Понятие о металлургии. Способы получения металлов. Проблемы безотходных производств в металлургии и охрана окружающей среды. Сплавы. Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей |
* 45 у 1-4 з 1-3 с 147, * 46- *47 у 5-14 з 4-6с147 |
10АБ
|
Одноосновные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Реакция этерификации. Получение карбоновых кислот и применение. Краткие сведения о непредельных карбоновых кислотах. Генетическая связь карбоновых кислот с другими классами органических соединений |
**27 -29 у 1-4, 11- 18 с 117-118 З 1 с118 |
111
|
Окислительно–восстановительные реакции |
* 11, записи в тетради |
12АБ
| Металлы побочных подгрупп (Б — групп) периодической системы химических элементов |
** 22 – 27 У 1- 12 с 118 з 1-4 с 118 |
| Оксиды и гидроксиды металлов |
*29 у 16-18 с 118 З 6 с 118 |
Сплавы металлов. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. Решение расчётных задач. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. |
* 28 у 13- 15 с 118 |
121
|
Генетическая связь неорганических и органических веществ |
* 33 у с 143 |
Задание С1 на ЕГЭ по химии. Особенности, советы, рекомендации.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Часть С на ЕГЭ по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Часто абитуриенты считают, что уж это задание не требует особой подготовки. Однако оно содержит подводные камни, которые мешают получить за него полный балл. Давайте разберёмся, на что обратить внимание.
Теоретические сведения.
Перманганат калия как окислитель.
Дихромат и хромат как окислители.
Повышение степеней окисления хрома и марганца.
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).

| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит (реакция идёт при кипячении) | и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода | и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода | и |
Диспропорционирование оксида азота (IV) и солей.
Ты нашел то, что искал? Поделись с друзьями!
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю. Задание 1: Расставьте степени окисления в веществах: - Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0. - Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда. Пример:
В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием? - Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции:
Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции: - Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться. Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк? Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше: Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до . Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель. Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель.
 Тогда второй будет восстановителем. Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
Тогда второй будет восстановителем. Задание 11: Кто из этих галогенов окислитель, а кто восстановитель? - Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
- Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях: Задание 14: Допишите и уравняйте: Задание 15: Допишите и уравняйте: - Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот. Пример: в реакции свободный хлор часто теряется.
 Получается, что электроны к марганцу прилетели из космоса…
Получается, что электроны к марганцу прилетели из космоса… - Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .Задание 5:
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:Задание 7:
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц. )
)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Примеры составления реакций ионного обмена
1. Если врезультате реакции выделяется малодиссоциирующее (мд) вещество – вода.
а) Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Сокращённое ионное уравнение реакции:
H+ + OH– = H2O
б) Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca2+ + 2NO3— + H2O
Сокращённое ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Mg(OH)2 (н) + H2SO4 (р) = MgSO4(р) + 2H2O (мд)
Полное ионное уравнение реакции:
Mg(OH)2 + 2H+ + SO42- = Mg2+ + SO42- + 2H2O
Сокращённое ионное уравнение реакции:
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
2. Если врезультате реакции выделяется нерастворимое в воде вещество.
Если врезультате реакции выделяется нерастворимое в воде вещество.
а) Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH)2↓
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2↓
Сокращённое ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2↓
б) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl—
Сокращённое ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
3. Если врезультате реакции выделяется газообразное вещество.
а) Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑.
Сокращённое ионное уравнение реакции:
S2– + 2H+ = H2S↑
б) Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3— = 2Na+ + CO2↑ + H2O + 2NO3—
Сокращённое ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до
конца свидетельствуют два признака: выделение воды и газа – оксида
углерода(IV).
Онлайн-калькулятор: Калькулятор химических реакций
Этот онлайн-калькулятор балансирует уравнения химических реакций. Есть несколько методов уравновешивания химических уравнений:
- Метод проверки или метод «пробного и удачного»
- Алгебраический метод
- Метод, предложенный Аркесио Гарсия
- Метод изменения окислительного числа
- Ионно-электронный метод, или метод полуреакции
Последние два используются для окислительно-восстановительных реакций.
В этом балансировщике химических уравнений используется алгебраический метод, который обычно довольно сложен для ручных вычислений, однако он идеально подходит для компьютерной программы.
Алгебраический метод основан на Законе сохранения массы — материю нельзя ни создать, ни разрушить. Следовательно, количество атомов каждого типа на каждой стороне химического уравнения должно быть одинаковым. Уравновешивание химических уравнений — это процесс сохранения материи. Итак, вам просто нужно создать набор алгебраических уравнений, выражающих количество атомов каждого элемента, участвующего в реакции, и решить его.Таким образом, этот метод можно использовать для любых химических реакций (включая окислительно-восстановительные реакции).
Позвольте мне проиллюстрировать этот метод на примере.
Рассмотрим реакцию:
Начнем с введения неизвестных коэффициентов:
Затем мы запишем уравнения баланса для каждого элемента в терминах неизвестных:
Для Fe:
Для Cl:
Для Na:
Для P:
Для O:
Они образуют систему линейных уравнений:
Здесь у нас есть пять уравнений для четырех неизвестных, однако последнее зависит от четвертого, поэтому его можно опустить.
Теперь мы можем переписать эту систему в матричном виде:
Эта система может быть решена с помощью метода исключения Гаусса. Конечно, нельзя было ожидать, что количество неизвестных всегда будет равно количеству уравнений. Однако метод исключения Гаусса фактически может найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, который реализует метод исключения Гаусса — / 6200 / — в форме, пригодной для химических реакций.Короче говоря, он просто сохраняет все дроби и в конце переходит к целому решению.
Однако метод исключения Гаусса фактически может найти решение для любого количества уравнений и неизвестных. Я создал специальный калькулятор, который реализует метод исключения Гаусса — / 6200 / — в форме, пригодной для химических реакций.Короче говоря, он просто сохраняет все дроби и в конце переходит к целому решению.
Таким образом, представленный ниже калькулятор просто анализирует химическую реакцию, создает систему линейных уравнений и передает ее в вышеупомянутый калькулятор исключения Гаусса. Возвращенное решение затем используется для отображения сбалансированного уравнения.
Примечание: Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа, как в периодической таблице.Сравните: Co — кобальт и CO — окись углерода. Таким образом, Na3PO4 — правильная форма, na3po4 — неправильная форма.
Калькулятор химических реакций
content_copy Ссылка сохранить Сохранить extension Widget
Сбалансированные химические уравнения — Введение в химические реакции — OCR Gateway — GCSE Chemistry (Single Science) Revision — OCR Gateway
Сбалансированное уравнение моделирует химическую реакцию с использованием формул реагентов и продуктов.Он показывает количество единиц каждого задействованного вещества.
Балансировка уравнения
Если вы просто напишете уравнение, заменив имена формулами, оно может не сбалансироваться. Число атомов каждого элемента слева должно быть таким же, как и справа.
Чтобы сбалансировать несбалансированное уравнение, вам нужно добавить числа слева от одной или нескольких формул. Вот один из способов выяснить, как это сделать для реакции между азотом и водородом.
В сбалансированных уравнениях отображаются только формулы, но не названия. Уравновешивающее число умножает все атомы в веществе рядом с ним.
Символы состояния
Сбалансированные уравнения часто включают символы состояния в скобках после каждой формулы. Они показывают физическое состояние этого вещества.
| Обозначение состояния | 0.0.0.1:0.1.0.$0.$1.$8.$1.$0.$1″> Значение |
|---|---|
| (с) | Твердое вещество |
| (л) | Жидкость |
| (г) | Газ |
| Водный раствор |
Водный раствор образуется при растворении вещества в воде.
Государственные символы полезны, потому что они показывают, на что похоже вещество. Например:
- H 2 O (l) — жидкая вода, но H 2 O (g) — пар
- HCl (g) — газообразный хлористый водород, но HCl (водный) — соляная кислота
Металлический натрий реагирует с водой с образованием раствора гидроксида натрия и газообразного водорода.Напишите сбалансированное уравнение реакции, включая государственные символы.
2Na (s) + 2H 2 O (l) → 2NaOH (вод.) + H 2 (g) или
Na (s) + H 2 O ( л) → NaOH (водн.) + ½H 2 (г)
Реакции | Ресурсы Wyzant
Что такое химическая реакция?
Химическая реакция — это изменение материала из начальной массы. к полученному веществу.Признак химической реакции сделан ли новый материал или материалы, а также исчезновение массы, которая изменилась, чтобы создать новую. Этот не означает , что были изготовлены новые элементы. Чтобы чтобы создать новые элементы, должно измениться ядерное содержимое. Есть большая разница в количестве энергии в обычные химические реакции по сравнению с ядерными реакциями. Энергия перестройки ядер атомов меняется на новые. элементов огромен по сравнению с меньшими энергиями химические изменения.Алхимики в своих попытках изменить меньше дорогие металлы к золоту, не имели фундаментальных понимание того, что они пытались сделать, чтобы оценить различия.
Химическое уравнение — это способ описать, что происходит в
химическая реакция, фактическое изменение материала. Химическая
уравнения записываются с символами материалов, которые включают
элементы, ионные или ковалентные соединения, водные растворы,
ионы или частицы. Справа есть стрелка,
указывает действие реакции.Материалы слева
стрелки реагенты или материалы, которые
собираюсь отреагировать. Материалы справа от стрелки — это товаров , или
материалы, которые были произведены в результате реакции. Закон Сохранение массы утверждает, что в химической реакции нет
масса теряется или набирается. Закон сохранения массы применяется
к отдельным типам атома. Можно сказать, что для любого
элемент, нет потери или увеличения этого элемента в химическом
реакция.Есть такие вещи, как обратимые реакции,
реакции, в которых продукты снова собираются, чтобы стать оригинальными
продукты. Обратимые реакции обозначены символом химического
уравнения двойной стрелкой, но стандарт остается
назовите материалы слева реагенты и материалы
справа продукты.
Химическая
уравнения записываются с символами материалов, которые включают
элементы, ионные или ковалентные соединения, водные растворы,
ионы или частицы. Справа есть стрелка,
указывает действие реакции.Материалы слева
стрелки реагенты или материалы, которые
собираюсь отреагировать. Материалы справа от стрелки — это товаров , или
материалы, которые были произведены в результате реакции. Закон Сохранение массы утверждает, что в химической реакции нет
масса теряется или набирается. Закон сохранения массы применяется
к отдельным типам атома. Можно сказать, что для любого
элемент, нет потери или увеличения этого элемента в химическом
реакция.Есть такие вещи, как обратимые реакции,
реакции, в которых продукты снова собираются, чтобы стать оригинальными
продукты. Обратимые реакции обозначены символом химического
уравнения двойной стрелкой, но стандарт остается
назовите материалы слева реагенты и материалы
справа продукты.
Онлайн-калькулятор балансировки окислительно-восстановительных реакций
Реакция, в которой восстановитель теряет электроны при окислении, а окислитель приобретает электроны при восстановлении, называется окислительно-восстановительной реакцией.С помощью этого калькулятора можно уравновесить несбалансированную окислительно-восстановительную реакцию.
Калькулятор балансировки окислительно-восстановительных реакций
Окислительно-восстановительная реакция — это химическая реакция, в которой окисление и восстановление происходят одновременно, а вещество, которое приобретает электроны, называется окислителем.
См. Следующую таблицу, в которой указаны степени окисления.
Таблица общих ионов
Положительные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| Литий | Ли + | Магний | мг 2+ | Алюминий | Al 3+ |
| Натрий | На + | Кальций | Ca 2+ | Утюг III | Fe 3+ |
| Калий | К + | Стронций | Sr 2+ | Хром | Cr 3+ |
| Серебро | Ag + | Барий | Ba 2+ | ||
| Гидроний | H 3 O + | Медь II | Cu 2+ | ||
| Водород | H + | Свинец II | Пб 2+ | ||
| Аммоний | NH 4 + | Цинк | Zn 2+ | ||
| Медь I | Cu + | Марганец II | млн 2+ | ||
| Меркурий I | рт. Ст. + Ст. + | Утюг II | Fe 2+ | ||
| Олово II | Sn 2+ | ||||
Отрицательные ионы
| Валентность 1 | Валентность 2 | Валентность 3 | |||
|---|---|---|---|---|---|
| фторид | Ф — | Оксид | O 2- | Фосфат | PO 4 3- |
| Хлорид | Класс — | Сульфид | S 2- | ||
| Бромид | Br — | Карбонат | CO 3 2- | ||
| йодид | I — | Сульфат | СО 4 2- | ||
| Гидроксид | ОН — | Сульфит | СО 3 2- | ||
| Нитрат | НЕТ 3 — | Дихромат | Cr 2 O 7 2- | ||
| Бикарбонат | HCO 3 — | Хромат | CrO 4 2- | ||
| бисульфат | HSO 3 — | Оксалат | С 2 О 4 2- | ||
| Нитрит | НЕТ 2 — | Тиосульфат | S 2 O 3 2- | ||
| Хлорат | ClO 3 — | Тетратионат | S 4 O 6 2- | ||
| Перманганат | MnO 4 — | одноатомный фосфат | HPO 4 2- | ||
| Гипохлорит | OCl — | ||||
| Дигидрофосфат | H 2 PO 4 — | ||||
Пример: 1
Сбалансировать данную окислительно-восстановительную реакцию:
H 2 + + O 2 2- -> H 2 O
Принимая во внимание приведенное выше уравнение, у нас есть 2 водорода (H) с общим зарядом +1 [см. Заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на L.H.S и 2 водорода (H) с общим зарядом +2 и только 1 кислород (O) с общим зарядом -2 на R.H.S. Следовательно, из-за неравного количества зарядов молекул кислорода химическое уравнение считается несбалансированным.
Заряды элементов в таблице выше] и 2 кислорода (O) с общим зарядом -2 на L.H.S и 2 водорода (H) с общим зарядом +2 и только 1 кислород (O) с общим зарядом -2 на R.H.S. Следовательно, из-за неравного количества зарядов молекул кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение, используя метод половинной реакции с пошаговой процедурой.
Гивен,
H +1 2 + O -2 2 -> H +1 2 O -2
Чтобы сбалансировать несбалансированные заряды молекул кислорода, мы добавляем 2 перед произведением на R.H.S.
Получаем,
H +1 2 + O -2 2 -> (2) H +1 2 O -2
Теперь у нас есть 2 кислорода с общим зарядом -2 и 4 атома водорода с общим зарядом +4 на R.H.S.
Чтобы сбалансировать то же самое, мы добавляем еще 2 перед Hydrogen на L.H.S
(2) H +1 2 + O -2 2 -> (2) H +1 2 O -2
Теперь уравнение уравновешено с 4 атомами водорода (H) с общим зарядом +4 и 4 атомами кислорода с общим зарядом -4 с обеих сторон.
Пример: 2
Cr +3 + Cl -1 = Cr +3 + Cl -1 2
Принимая во внимание приведенное выше уравнение, у нас есть 1 хром (Cr) с общим зарядом +3 [см. Заряды элементов в приведенной выше таблице] и 1 хлорид (Cl) с общим зарядом -1 на LHS и 1 хром ( Cr) с общим зарядом +3 и только 2 хлорида (Cl) с общим зарядом -1 на правой стороне Следовательно, при неравном количестве зарядов молекулы кислорода химическое уравнение считается несбалансированным.
Как уравновесить несбалансированное химическое уравнение?
Давайте узнаем здесь, как сбалансировать вышеприведенное несбалансированное уравнение с помощью пошаговой процедуры.
Дано:
Cr +3 + Cl -1 = Cr +3 + Cl -1 2
Чтобы сбалансировать несбалансированные заряды молекул хлорида, мы добавляем 2 перед хлоридом на L.H.S.
Получаем,
Cr +3 + (2) Cl -1 = Cr +3 + Cl -1 2
Теперь уравнение уравновешено с 2 хлоридами (Cl) с общим зарядом -2 и 3 хромами с общим зарядом +3 с обеих сторон.
Вот как сбалансированы окислительно-восстановительные уравнения.
Наука путем моделирования — ChemReaX
ChemReaX ™ — это бесплатное веб-приложение для моделирования и моделирования основных химических реакций . Программа предназначена для студентов-химиков и их учителей на уровне бакалавриата и старшей школы (AP / IB). Платформа моделирования ChemReaX позволяет легко создавать сложные виртуальные лаборатории на курсах общей химии и физической химии.
ChemReaX можно использовать для экспериментов с химической термодинамикой , реакционным равновесием, кинетикой, кислотно-основным титрованием и . Он включает термодинамические свойства для более чем 1200 химических веществ, что позволяет пользователям создавать практически неограниченное количество химических реакций. Или пользователи могут выбирать из более чем 80 предопределенных реакций. ChemReaX моделирует данную реакцию от начальных условий до конечного состояния равновесия и точно моделирует влияние концентраций, температуры и давления.Он поставляется с подробным руководством пользователя, учебными пособиями и несколькими готовыми к использованию виртуальными лабораторными упражнениями.
ChemReax внесен в список Национальная научная цифровая библиотека , Базы данных MERLOT, EdSurge и LearnPlatform в качестве онлайн-инструмента для обучения химии, а также доступны через LibreTexts проект учебника в открытом доступе.
Особенности:
- Позволяет пользователям создавать виртуальные неограниченное разнообразие химических реакций с использованием более 1200 видов во внутреннем базы данных и автоматически проверяет правильность формул и / или автоматически уравновешивает уравнения.Он также содержит более 80 предопределенных реакций, которые можно быстро выбрать по 10 различным категориям.
- Имитирует заданную реакцию от начальные условия до тех пор, пока он не достигнет окончательного состояния равновесия с использованием алгоритма моделирования, управляемого событиями, и точно генерирует конечные концентрации всех компонентов реакции на основе начальных концентраций (или парциальных давлений) и температуры.
- Оценивает влияние давления изменяется в состоянии равновесия и производит окончательные композиции с отрегулированным давлением продукты и реактивы.
- Моделирует кинетику реакции с использованием модели скорости реакции (с параметрами, определяемыми пользователем) на основе алгоритма моделирования, управляемого временем, и отображает состав реагента / продукта графически как функцию времени.
- Имитирует кислотно-щелочной
титрования с использованием
та же основная технология моделирования, используемая для общих реакций.

- Ставит мощное моделирование и симуляцию способность в руках студентов и учителей-химиков. Это не инструмент анимации, но настоящий инструмент моделирования — аналогично инструментам, используемым в промышленности — это может помочь в серьезном научном исследовании и исследовании и дать возможность исследовательского / экспериментального подхода к изучению химии.
- Обеспечивает крупнейшая бесплатная онлайн-база данных химических термодинамических свойств в виде функция температуры.
Доступ и использование инструмента:
- ChemReaX — это веб-сервер и хостинг в облаке . На компьютер пользователя устанавливать нечего, подойдет любой веб-браузер. для доступа к инструменту.Инструмент доступен на сайте chemreax.com.
- Учебные статьи доступны для демонстрации того, как ChemReaX можно использовать как виртуальную химическую лабораторию по общей химии и физике. Курсы химии по программам бакалавриата и старшей школы AP / IB: Chemreax.com/Tutorials.aspx. Темы охватывали включают: реакционное равновесие, энтропию, химическую кинетику, кислотно-основное титрование, и моделирование твердых тел / жидкостей / растворенных веществ в химической термодинамике.
- Виртуальная химическая лаборатория на основе ChemReaX упражнения и задания легко создавать. Несколько готовых к использованию виртуальных лабораторных упражнений доступны на сайте chemreax.com/Exercises.aspx. Обсуждаемые темы включают: ограничивающие реагенты, принцип Ле Шателье, химическую кинетику, фазовый переход, растворимость и осаждение, а также кислотно-основное титрование.

Публикации по теме:
Словарь терминов по химическим реакциям, обзорный лист
Изучите главу 11, изучите химию с помощью бесплатных интерактивных карточек.Выбирайте из 500 различных наборов карточек по химии в главе 11 в Quizlet.
Дополнительная практика для типов химических уравнений — Словесные уравнения 6.1_TypesChemEqs_WordEqns.pdf Вторник, 9 мая Блок A — youtube — классификация химических реакций (Девитт) Перейти к сводной таблице и примечаниям (практика) WB pg 105-106 Блок B — Перейти WB pg 99-101 и 105-106 Lab 6-1B WB Pg 107-108 6.2 PPT — СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.ppt Химическая реакция охлаждается, а окружающая среда становится теплее.Энергия на стороне продукта. C8h28 O2 —— gt CO2 h3O энергия; 73 Эндотермические реакции. Поглощенная энергия gt Высвобожденная энергия; Химическая реакция нагревается, а окружающая среда — холоднее. Энергия находится на стороне реагента. Бывший. Фотосинтез; 74 Обзор химической реакции
Практика английского языка Загружаемые рабочие листы по грамматике и словарю в формате PDF. Этот веб-сайт предоставляет вам бесплатные загружаемые практические материалы для студентов и преподавателей. Все рабочие листы в формате PDF, их можно просматривать и распечатывать на всех устройствах.
Начать изучать словарь «Химические реакции». Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. Всего 220,84 руб. / Мес. Словарь терминов по химическим реакциям. Просмотреть рабочий лист. Цель: все основные части химической реакции охватываются этим рабочим листом. Студенты будут определять реагенты, продукты, индексы и коэффициенты. Включена информация о состоянии вещества, которая указывает, является ли каждое вещество твердым, жидким, газообразным или водным раствором.
Глава 2 Химия жизни Обзор основных понятий Класс Дата Обзор раздела 2-4 Завершение В предоставленных строках заполните следующие предложения. 1. Химические реакции этой энергии часто происходят спонтанно. 2. Во время химической реакции химические связи образуются. 3. Биологические катализаторы или ферменты действуют, снижая уровень, необходимый для реакции. 4.
1. Химические реакции этой энергии часто происходят спонтанно. 2. Во время химической реакции химические связи образуются. 3. Биологические катализаторы или ферменты действуют, снижая уровень, необходимый для реакции. 4.
27 февраля 2009 г. · Словарь по биомам — опубликовано … зашифрованные слова в качестве обзора; Рабочий лист по физическим и химическим изменениям … концентрация может влиять на скорость химических реакций.Типы химических реакций Заметки в эскизе Этот ресурс с заметками на одной странице — отличное дополнение к любой интерактивной записной книжке! Студенты смогут различать 5 основных типов химических реакций; синтез, разложение, однократное замещение, двойное замещение и горение. Многим студентам нравится творческий дизайн …
Задачи Объясните, как химические реакции влияют на химические связи. Опишите, как изменения энергии влияют на то, насколько легко будет происходить химическая реакция. Объясните, почему ферменты важны для живых существ.Краткое содержание урока Химические реакции Все, что происходит в организме, основано на химических реакциях. Рабочий лист химических реакций и ферментов …
Это руководство знакомит с основами химических реакций. Другие разделы включают материю, элементы, периодическую таблицу и биохимию. Когда вы пытаетесь понять химические реакции, представьте, что вы работаете с атомами. Представьте, что строительные блоки лежат прямо перед вами на столе. Студенты узнают о материальном балансе, фундаментальной концепции химической инженерии.Они используют стехиометрию для прогнозирования массы углекислого газа, который улетучивается после реакции измеренных количеств бикарбоната натрия с разбавленной уксусной кислотой. Затем ученики производят реакции химических веществ в небольшом реакторе, сделанном из пластиковой бутылки с водой и воздушного шара.
Электронная библиотека Химические реакции Ферменты Рабочий лист Answersenergy. Химические реакции, высвобождающие энергию, часто происходят сами по себе. Химические реакции, которые поглощают энергию, требуют источника энергии. Энергия, необходимая для начала реакции, называется энергией активации.Ферменты Фермент — это белок, который действует как биологический катализатор. A …
Химические реакции, которые поглощают энергию, требуют источника энергии. Энергия, необходимая для начала реакции, называется энергией активации.Ферменты Фермент — это белок, который действует как биологический катализатор. A …
30 апреля 2019 г. · Рабочий лист балансировки химических реакций 1 Отличные 12 лучших типов из рабочего листа химии типов химических реакций, источник: givebacksocialfund.com. Органические реакции также очень легко изучить, потому что есть только три элемента, которые делают до соединения: кислород, азот и вода. Химия Химические уравнения и реакции. Реакция горения происходит, когда вещество быстро реагирует с кислородом (O 2).Например, на рисунке ниже уголь комбинируется с обзорами. Редактировать обзор Было ли это полезно? Удалить Голосовать Да Нет. Отправить обзор Пропустить обзор Отменить.
Мгновенное форматирование химических уравнений с помощью ChemFormatter — Genius Lab Gear
Методы: химические реакции, написание журнальной статьи
Направление (а): Химия, биохимия
Прислал: Genius Lab Gear Staff
Лаборатория Взлом:
Химик и программист создали совершенно бесплатный и удобный плагин для Microsoft Word под названием ChemFormatter, чтобы мгновенно отформатировать ваши химические уравнения с указанием индексов стехиометрии, надстрочных индексов заряда и других труднодоступных символов!
Я использовал этот составитель химических уравнений для написания всех моих диссертаций и статей в журналах, и он экономит массу времени от утомительного редактирования формул.Только будьте осторожны, так как он может непреднамеренно отформатировать некоторые торговые наименования, содержащие числа, потому что он считает их химическими формулами.
Вам нужно будет загрузить его с хоста SourceForge, установить и следовать инструкциям ниже. Мы не изобретали это, мы просто нашли это в Интернете и хотели поделиться им со всеми вами! Благодарим Ujihara Kzauya за создание этого замечательного инструмента!
 Нахождение в природе. Свойства железа.
Нахождение в природе. Свойства железа. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции:
Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции: Тогда второй будет восстановителем. Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
Тогда второй будет восстановителем. Задание 11: Кто из этих галогенов окислитель, а кто восстановитель? Получается, что электроны к марганцу прилетели из космоса…
Получается, что электроны к марганцу прилетели из космоса…