Химический калькулятор
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
=3260°C23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,074d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t° пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Уравнения химических реакций
Цикл занятий “Уравнения химических реакций” (программа 15 ч , 10 занятий) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-11-х классов, которые хотят улучшить свои знания основ химии.
Почему у многих школьников возникают проблемы с изучением химии? Химия — это не просто наука с яркими и эффектными экспериментами, но и та область, в которой используются свои символы, формулы и обозначения. По своей сути, химия — тот же иностранный язык со своими терминами и законами. В результате химических реакций происходят именно те процессы, которые так часто описываются в учебниках. Именно поэтому уравнения химических реакций — одна из основ химии.
В течение цикла занятий “Уравнения химических реакций” мы узнаем, как правильно записать химические реакции в уравнениях и как выполнять последующие действия с ними. Полученные знания и навыки помогут систематизировать школьные знания и справляться с химическими уравнениями в заданиях различной сложности, а также сэкономят Ваши средства и время, потраченные на репетиторов.
Полученные знания и навыки помогут систематизировать школьные знания и справляться с химическими уравнениями в заданиях различной сложности, а также сэкономят Ваши средства и время, потраченные на репетиторов.
Автор программы: Мартыньш Гулбис — руководитель “Laboratorium zinātnes skola”.
Цель программы: ученики способны самостоятельно составлять и записывать уравнения химических реакций различной сложности.
Темы занятий:
- Влияние атомной структуры на степень окисления.
- Индексы и составление молекулярных формул.
- Закон сохранения массы в уравнении реакции.
- Классификация веществ.
- Типы реакций.
- Таблица растворимости.
- Взаимодействие веществ и цепочки превращений.
- Количество вещества в уравнениях реакций.
- Задачи с уравнениями реакций.
- Закрепление знаний и тестирование.
Наша цель, чтобы в результате данных занятий участники приобрели следующие навыки и умения:
- Подсчитывать атомы элементов в соединениях и уравнениях реакций
- Находить коэффициенты в уравнениях реакции и самостоятельно проверять полученный результат
- Верно подбирать вещества для получения конкретной реакции и продукта
- Определять степень окисления элементов и писать химические формулы
- Определять классы веществ и типы реакций
- Использовать таблицу растворимости для составления уравнения реакции
- Выстраивать цепочки из уравнений реакций
- Использовать уравнения реакции для дальнейших вычислений
ЗАПИСАТЬСЯ
ОПЛАТА И ДРУГАЯ ВАЖНАЯ ИНФОРМАЦИЯ
Занятия будут проходить 1 раз в неделю, 10 раз.
Длительность одного занятия — 1,5 часа.
Количество участников: до 16 учеников
Взять с собой: тетрадь для записей, ручка, калькулятор.
Занятия будут проходить удаленно через платформу Google Classroom
В программу включены теория, демонстрации и практические задания разного уровня сложности: начиная с основ и вплоть до заданий “с орешком”. Именно поэтому абсолютно каждый участник программы, несмотря на уровень своей подготовки, получит новые знания и навыки. На каждом занятии присутствуют педагог и 1 или 2 ассистента, чтобы уделить внимание каждому ученику и сделать обучение еще более эффективным. В конце каждого занятия ребята проходят тест по пройденному материалу, а в конце курса их ожидает проверочная работа на все пройденные темы.
Цена: 99 Eur за всю программу (10 занятий) при оплате всей суммы сразу, 118 Eur при оплате 2 частями (5 занятий + 5 занятий).
Оплатить занятия необходимо до начала первого занятия по Счету, который будет вам выставлен и выслан после заполнения заявки — анкеты.
ЗАПИСАТЬСЯ
ДАТЫ БЛИЖАЙШИХ КУРСОВ
ДРУГИЕ КУРСЫ:
РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ / ФИЗИКЕ
Онлайн курсы
Цикл занятий “Развивай навыки решения задач по химии” (программа 12.5 ч , 5 занятий)
Достаточно часто решение задач по химии доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по химии освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящие формулы и путь решения.
Для кого: 8-11 классы
Занятия будут проходить 1 раз в неделю, 5 раз
Длительность одного занятия: 150 минут
Цена: 75 Eur за всю программу (5 раз), 20 Eur за отдельное занятие
УЗНАТЬ ПОДРОБНЕЕ ОБ ЭТОМ КУРСЕ
ЗАПИСАТЬСЯ
Цикл занятий “Развивай навыки решения задач по физике” (программа 12.5 ч , 5 занятий)
Достаточно часто решение задач по физике доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.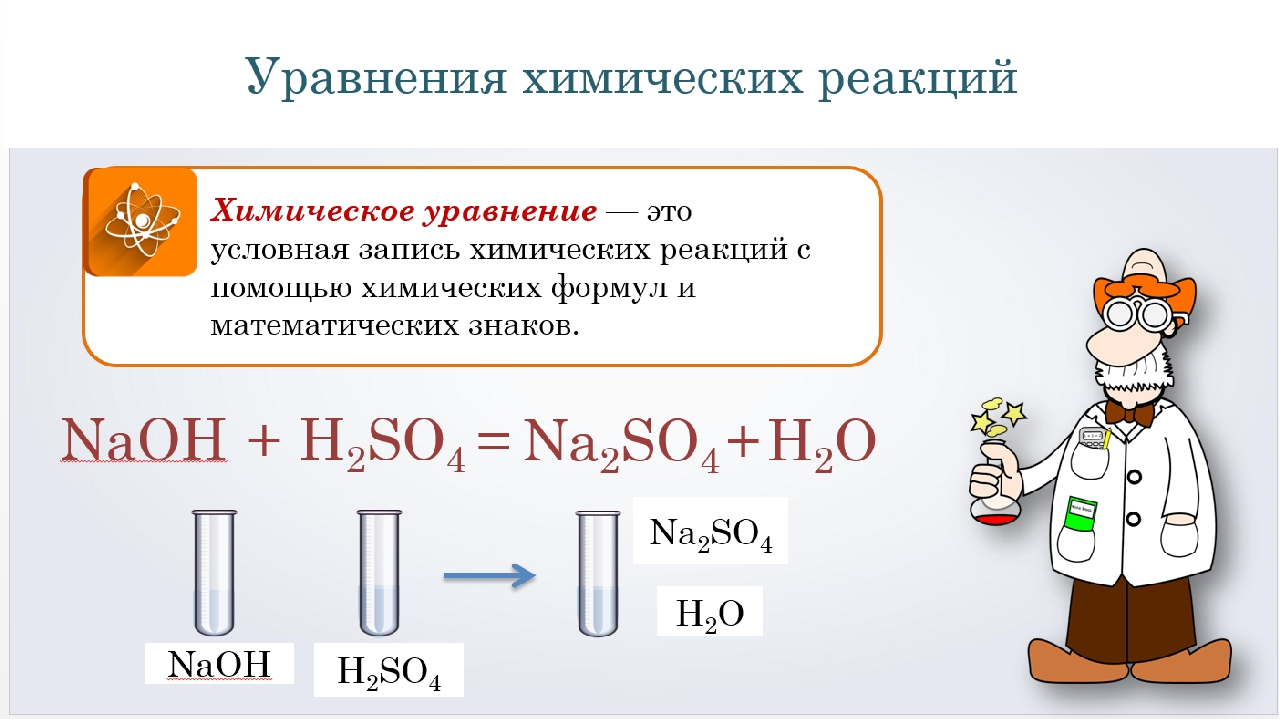
Для кого: 8-11 классы
Занятия будут проходить 1 раз в неделю, 5 раз
Длительность одного занятия: 150 минут
Цена: 75 Eur за всю программу (5 раз), 20 Eur за отдельное занятие
УЗНАТЬ ПОДРОБНЕЕ ОБ ЭТОМ КУРСЕ
ЗАПИСАТЬСЯ
Цикл занятий “Уравнения химических реакций” (программа 15 ч , 10 занятий)
Почему у многих школьников возникают проблемы с изучением химии? Химия — это не просто наука с яркими и эффектными экспериментами, но и та область, в которой используются свои символы, формулы и обозначения. По своей сути, химия — тот же иностранный язык со своими терминами и законами. В результате химических реакций происходят именно те процессы, которые так часто описываются в учебниках. Именно поэтому уравнения химических реакций — одна из основ химии.
В течение цикла занятий “Уравнения химический реакций” мы узнаем, как правильно фиксировать химические реакции в уравнениях и как выполнять последующие действия с ними. Полученные знания и навыки помогут систематизировать школьные знания и справляться с химическими уравнениями в заданиях различной сложности, а также сэкономят Ваши средства и время, потраченные на репетиторов.
Полученные знания и навыки помогут систематизировать школьные знания и справляться с химическими уравнениями в заданиях различной сложности, а также сэкономят Ваши средства и время, потраченные на репетиторов.
Для кого: 8-11 классы
Занятия будут проходить 1 раз в неделю, 10 раз
Длительность одного занятия: 90 минут
Цена: 99 Eur за всю программу (10 занятий) при оплате всей суммы сразу, 118 Eur при оплате 2 частями (5 занятий + 5 занятий).
УЗНАТЬ ПОДРОБНЕЕ ОБ ЭТОМ КУРСЕ
ЗАПИСАТЬСЯ
Составить ионные уравнения реакции онлайн. Как уравнивать химические уравнения? Химическая реакция замещения
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять»
2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
3) Изредка возникают ситуации, когда формулы реагентов и продуктов записаны абсолютно верно, но коэффициенты все равно не расставляются. Такое может возникать в тех случаях, если коэффициенты в уравнении могут быть расставлены двумя или более способами. Наиболее вероятно возникновение такой проблемы с реакциями окисления органических веществ при которых рвется углеродный скелет. В таком случае попробуйте заменить неизменяемые фрагменты органических молекул на какой-нибудь произвольный символ, например радикал фенил C 6 H 5 можно обозначить как Ph или X. Например, следующее уравнение:
C 6 H 5 CH 2 CH 3 + KMnO 4 + H 2 SO 4 → C 6 H 5 COOH + CO 2 + K 2 SO 4 + MnSO 4 + H 2 O
не будет сбалансировано, так как возможна разная расстановка коэффициентов. Однако, введя обозначение C 6 H 5 = Ph, расстановка коэффициентов происходит корректно:
5PhCH 2 CH 3 + 12KMnO 4 + 18H 2 SO 4 → 5PhCOOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
Примечание
В уравнении допускается для разделения формул реагентов от формул продуктов использовать как знак равенства (=), так и стрелку (→), а также случайная запись отдельных букв символов химических элементов не латиницей, а кириллицей в случае их идентичного написания, как, например, символов C, H, O, P.
Окислительно-восстановительные реакции — это процесс «перетекания» электронов от одних атомов к другим. В результате происходит окисление или восстановление химических элементов, входящих в состав реагентов.
Основные понятия
Ключевой термин при рассмотрении окислительно-восстановительных реакций — это степень окисления, которая представляет собой условный заряд атома и количество перераспределяемых электронов. Окисление — процесс потери электронов, при котором увеличивается заряд атома. Восстановление, наоборот, представляет собой процесс присоединения электронов, при котором степень окисления уменьшается. Соответственно, окислитель принимает новые электроны, а восстановитель — теряет их, при этом такие реакции всегда происходят одновременно.
Определение степени окисления
Вычисление данного параметра — одна из самых популярных задач в школьном курсе химии. Поиск зарядов атомов может быть как элементарным вопросом, так и задачей, требующей скрупулезных расчетов: все зависит от сложности химической реакции и количества составляющих соединений. Хотелось бы, чтобы степени окисления указывались в периодической таблице и были всегда под рукой, однако этот параметр приходится либо запоминать, либо вычислять для конкретной реакции. Итак, существует два однозначных свойства:
Хотелось бы, чтобы степени окисления указывались в периодической таблице и были всегда под рукой, однако этот параметр приходится либо запоминать, либо вычислять для конкретной реакции. Итак, существует два однозначных свойства:
- Сумма зарядов сложного соединения всегда равна нулю. Это значит, что часть атомов будет иметь положительную степень, а часть — отрицательную.
- Степень окисления элементарных соединений всегда равна нулю. Простыми называются соединения, которые состоят из атомов одного элемента, то есть железо Fe2, кислород O2 или октасера S8.
Существуют химические элементы, электрический заряд которых однозначен в любых соединениях. К таким относятся:
- -1 — F;
- -2 — О;
- +1 — H, Li, Ag, Na, K;
- +2 — Ba, Ca, Mg, Zn;
- +3 — Al.
Несмотря на однозначность, существуют некоторые исключения. Фтор F -уникальный элемент, степень окисления которого всегда составляет -1. Благодаря этому свойству многие элементы изменяют свой заряд в паре с фтором. Например, кислород в соединении с фтором имеет заряд +1 (O 2 F 2) или +2 (ОF2). Кроме того, кислород меняет свою степень в перекисных соединениях (в перекиси водорода h302 заряд равен -1). И, естественно, кислород имеет нулевую степень в своем простом соединении O2.
Например, кислород в соединении с фтором имеет заряд +1 (O 2 F 2) или +2 (ОF2). Кроме того, кислород меняет свою степень в перекисных соединениях (в перекиси водорода h302 заряд равен -1). И, естественно, кислород имеет нулевую степень в своем простом соединении O2.
При рассмотрении окислительно-восстановительных реакций важно учитывать вещества, которые состоят из ионов. Атомы ионных химических элементов имеют степень окисления, равную заряду иона. Например, в соединении гидрида натрия NaH по идее водород имеет степень +1, однако ион натрия также имеет заряд +1. Так как соединение должно быть электрически нейтральным, то атом водорода принимает заряд -1. Отдельно в этой ситуации стоят ионы металлов, так как атомы таких элементов ионизируются на разные величины. К примеру, железо F ионизируется и на +2, и на +3 в зависимости от состава химического вещества.
Пример определения степеней окисления
Для простых соединений, которые включают в себя атомы с однозначным зарядом, распределение степеней окисления не составляет труда. Например, для воды h3O атом кислорода имеет заряд -2, а атом водорода +1, что в сумме дает нейтральный нуль. В более сложных соединениях встречаются атомы, которые могут иметь разный заряд и для определения степеней окисления приходится использовать метод исключения. Рассмотрим пример.
Например, для воды h3O атом кислорода имеет заряд -2, а атом водорода +1, что в сумме дает нейтральный нуль. В более сложных соединениях встречаются атомы, которые могут иметь разный заряд и для определения степеней окисления приходится использовать метод исключения. Рассмотрим пример.
Сульфат натрия Na 2 SO 4 имеет в своем составе атом серы, заряд которого может принимать значения -2, +4 или +6. Какое значение выбрать? Первым делом определяем, что ион натрия имеет заряд +1. Кислород в подавляющем большинстве случаев имеет заряд –2. Составляем простое уравнение:
1 × 2 + S + (–2) × 4 = 0
Таким образом, заряд серы в сульфате натрия равен +6.
Расстановка коэффициентов по схеме реакции
Теперь, когда вы знаете, как определять заряды атомов, вы можете расставлять коэффициенты в окислительно-восстановительных реакциях для их балансировки. Стандартное задание по химии: подобрать коэффициенты реакции при помощи метода электронного баланса. В этих заданиях вам нет нужды определять, какие вещества образуются на выходе реакции, так как результат уже известен. Например, определите пропорции в простой реакции:
Например, определите пропорции в простой реакции:
Na + O2 → Na 2 O
Итак, определим заряд атомов. Так как натрий и кислород в левой части уравнения — простые вещества, то их заряд равен нулю. В оксиде натрия Na2O кислород имеет заряд -2, а натрий +1. Мы видим, что в левой части уравнения натрий имеет нулевой заряд, а в правой – положительный +1. То же самое с кислородом, который изменил степень окисления с нуля до -2. Запишем это «химическим» языком, указав в скобках заряды элементов:
Na(0) – 1e = Na(+1)
O(0) + 2e = O(–2)
Для балансировки реакции требуется уравновесить кислород и добавить коэффициент 2 к оксиду натрия. Получим реакцию:
Na + O2 → 2Na2O
Теперь у нас дисбаланс по натрию, уравновесим его при помощи коэффициента 4:
4Na + O2 → 2Na2O
Теперь количество атомов элементов совпадают с обеих сторон уравнения, следовательно, реакция сбалансирована. Все это мы проделали вручную, и это было несложно, так как реакция сама по себе элементарна. Но что делать, если требуется сбалансировать реакцию вида K 2 Cr 2 O 7 + KI + H 2 SO 4 → Cr 2 (SO 4)3 + I2 + H 2 O + K 2 SO 4 ? Ответ прост: используйте калькулятор.
Но что делать, если требуется сбалансировать реакцию вида K 2 Cr 2 O 7 + KI + H 2 SO 4 → Cr 2 (SO 4)3 + I2 + H 2 O + K 2 SO 4 ? Ответ прост: используйте калькулятор.
Калькулятор балансирования окислительно-восстановительных реакций
Наша программа позволяет автоматически расставить коэффициенты для самых распространенных химических реакций. Для этого вам необходимо вписать в поле программы реакцию или выбрать ее из раскрывающегося списка. Для решения выше представленной окислительно-восстановительной реакции вам достаточно выбрать ее из списка и нажать на кнопку «Рассчитать». Калькулятор мгновенно выдаст результат:
K 2 Cr 2 O 7 + 6KI + 7H 2 SO 4 → Cr 2 (SO 4)3 + 3I2 + 7H 2 O + 4K 2 SO 4
Использование калькулятора поможет вам быстро сбалансировать наиболее сложные химические реакции.
Заключение
Умение балансировать реакции необходимо всем школьникам и студентам, которые мечтают связать свою жизнь с химией. В целом расчеты выполняются по строго определенным правилам, для понимания которых достаточно элементарных знаний по химии и алгебре: помнить, что сумма степеней окисления атомов соединения всегда равна нулю и уметь решать линейные уравнения.
Для того, чтобы научится уравнивать химические уравнения, сначала нужно выделять главные моменты и использовать правильный алгоритм.
Ключевые моменты
Выстроить логику процесса несложно. Для этого выделим следующие этапы:
- Определение типа реагентов (все реагенты органические, все реагенты неорганические, органические и неорганические реагенты в одной реакции)
- Определение типа химической реакции (реакция с изменением степеней окисления компонентов или нет)
- Выделение проверочного атома или группы атомов
Примеры
- Все компоненты неорганические, без изменения степени окисления, проверочным атомом будет кислород – О (его не затронули никакие взаимодействия:
NaОН + НCl = NaCl + h3O
Посчитаем количество атомов каждого элементов правой и левой части и убедимся, что здесь не требуется расстановка коэффициентов (по умолчанию отсутствие коэффициента – это коэффициент равный 1)
NaOH + h3SO4 = Na2 SO4 + h3O
В данном случае, в правой части уравнения мы видим 2 атома натрия, значит в левой части уравнения нам нужно подставить коэффициент 2 перед соединением, содержащим натрий:
2 NaOH + h3SO4 = Na2 SO4 + h3O
Проверяем по кислороду — О: в левой части 2О из NaОН и 4 из сульфат иона SO4, а в правой 4 из SO4 и 1 в воде. Добавляем 2 перед водой:
Добавляем 2 перед водой:
2 NaOH + h3SO4 = Na2 SO4 +2 h3O
- Все компоненты органические, без изменения степени окисления:
НООС-СOOH + Ch4OH = Ch4OOC-COOCh4 + h3O (реакция возможна при определенных условиях)
В данном случае мы видим, что в правой части 2 группы атомов Ch4, а в левой только одна. Добавляем в левую часть коэффициент 2 перед Ch4OH, проверяем по кислороду и добавляем 2 перед водой
НООС-СOOH + 2Ch4OH = Ch4OOC-COOCh4 + 2h3O
- Органический и неорганические компоненты без изменения степеней окисления:
Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
В данной реакции проверочный атом необязателен. В левой части 1 молекула метиламина Ch4Nh3, а в правой 2. Значит нужен коэффициент 2 перед метиламином.
2Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
- Органический компонент, неорганический, изменение степени окисления.
СuO + C2H5OH = Cu + Ch4COOH + Н2O
В данном случае необходимо составить электронный баланс, а формулы органических веществ лучше преобразовать в брутто. Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
CuO + C2H6O = Cu + C2h5O2
2С +2 — 2е = 2С0
C3H8 + O2 = CO2 + h3O
Здесь O не может быть проверочным, так как сам меняет степень окисления. Проверяем по Н.
О2 0 + 2*2 е = 2O-2 (речь идет о кислороде из CO2)
3С (-8/3) — 20е = 3С +4 (в органических окислительно-восстановительных реакциях используют условные дробные степени окисления)
Из электронного баланса видно, что для окисления углерода требуется в 5 раз больше кислорода. Ставим 5 перед O2, также из электронного баланса м должны поставить 3 перед С из СО2, проверим по Н, и поставим 4 перед водой
C3H8 + 5O2 = 3CO2 + 4h3O
- Неорганические соединения, изменение степеней окисления.
Na2SO3 + KMnO4 + h3SO4 = Na2SO4 + K2SO4 + Н2О + MnO2
Проверочными будут водороды в воде и кислотные остатки SO4 2- из серной кислоты.
S+4 (из SO3 2-) – 2e = S +6(из Na2SO4)
Mn+7 + 3e = Mn+4
Таким образом нужно поставить 3 перед Na2SO3 и Na2SO4, 2 перед КМnO4 и MNO2.
3Na2SO3 + 2KMnO4 + h3SO4 = 3Na2SO4 + K2SO4 + Н2О +2MnO2
You have to enable Java in your browser.
Здесь вы можете рисовать химические формулы онлайн, написать реакцию и многое другое. Изменения, сделанные вами на этой странице нигде не сохраняются, поэтому вам нужно экспортировать полученную химическую структуру (реакцию) в один из форматов: SMILES, MOL, SVG и другие (кнопка во втором ряду, под «i»)
Marvin JS
Тут также вы можете создать химическую формулу, написать реакцию и многое другое, в том числе радикалы, заряды и так далее. Этот редактор поддерживает больше форматов, которые можно сразу же скачать, после того, как вы нарисовали. Он умеет импортировать из других форматов файлов.
Помните, что изменения, сделанные вами на этой странице нигде не сохраняются, поэтому вам нужно экспортировать полученную химическую структуру (реакцию) в один из форматов химических структур или картинок (нажимать на дискетку)
PubChem
В этом on-line редакторе химических формул, также можно рисовать химические формулы. Интерфейс у него достаточно древний и может не всем подойдёт, зато экспортировать он умеет во многие форматы. В любом случае, химики не избалованы красивыми интерфейсами приложений:)
Интерфейс у него достаточно древний и может не всем подойдёт, зато экспортировать он умеет во многие форматы. В любом случае, химики не избалованы красивыми интерфейсами приложений:)
Напоминание, сделанные вами на этой странице нигде не сохраняются, поэтому вам нужно экспортировать полученную химическую структуру (реакцию) в один из форматов химических структур или картинок (есть кнопка «Export»)
ОПРЕДЕЛЕНИЕ
Химическими реакция называют превращения веществ, в которых происходит изменение их состава и (или) строения.
Наиболее часто под химическими реакциями понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы,
число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения,
а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ
целочисленных стехиометрических коэффициентов.
Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ
целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой химической реакции будет выглядеть следующим образом:
Например:
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3) 2
SO 3 + H 2 O = H 2 SO 4
2Mg + O 2 = 2MgO.
2FеСl 2 + Сl 2 = 2FеСl 3
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения . В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
Например:
CaCO 3 CaO + CO 2 (1)
2H 2 O =2H 2 + O 2 (2)
CuSO 4 × 5H 2 O = CuSO 4 + 5H 2 O (3)
Cu(OH) 2 = CuO + H 2 O (4)
H 2 SiO 3 = SiO 2 + H 2 O (5)
2SO 3 =2SO 2 + O 2 (6)
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 +4H 2 O (7)
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов,
кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к
ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
С 18 H 38 = С 9 H 18 + С 9 H 20 (8)
C 4 H 10 = C 4 H 6 + 2H 2 (9)
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение химической реакции замещения будет выглядеть следующим образом:
Например:
2Аl + Fe 2 O 3 = 2Fе + Аl 2 О 3 (1)
Zn + 2НСl = ZnСl 2 + Н 2 (2)
2КВr + Сl 2 = 2КСl + Вr 2 (3)
2КСlO 3 + l 2 = 2KlO 3 + Сl 2 (4)
СаСО 3 + SiO 2 = СаSiO 3 + СО 2 (5)
Са 3 (РО 4) 2 + ЗSiO 2 = ЗСаSiO 3 + Р 2 О 5 (6)
СН 4 + Сl 2 = СН 3 Сl + НСl (7)
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Примеры реакций разложения, в которых не происходит изменения
степеней окисления немногочисленны (5, 6).
Реакциями обмена называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
АВ + СD = АD + СВ
Например:
CuO + 2HCl = CuCl 2 + H 2 O (1)
NaOH + HCl = NaCl + H 2 O (2)
NаНСО 3 + НСl = NаСl + Н 2 О + СО 2 (3)
AgNО 3 + КВr = АgВr ↓ + КNО 3 (4)
СrСl 3 + ЗNаОН = Сr(ОН) 3 ↓+ ЗNаСl (5)
Реакции обмена не являются окислительно-восстановительными. Частный случай этих реакций обмена -реакции нейтрализации (реакции взаимодействия кислот со
щелочами) (2). Реакции обмена протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного вещества (3), осадка
(4, 5) или малодиссоциирующего соединения, чаще всего воды (1, 2).
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO 2 = 2MgO + C (1)
Mg 0 – 2e = Mg 2+ (восстановитель)
С 4+ + 4e = C 0 (окислитель)
FeS 2 + 8HNO 3 (конц) = Fe(NO 3) 3 + 5NO + 2H 2 SO 4 + 2H 2 O (2)
Fe 2+ -e = Fe 3+ (восстановитель)
N 5+ +3e = N 2+ (окислитель)
AgNO 3 +HCl = AgCl ↓ + HNO 3 (3)
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ↓ + H 2 O (4)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и
эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
Если в
уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
N 2 + 3H 2 = 2NH 3 +46,2 кДж (1)
2Mg + O 2 = 2MgO + 602, 5 кДж (2)
N 2 + O 2 = 2NO – 90,4 кДж (3)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
А + В ↔ АВ
Например:
СН 3 СООН + С 2 Н 5 ОН↔ Н 3 СООС 2 Н 5 + Н 2 О
Примерами необратимых реакций может служить следующие реакции:
2КСlО 3 → 2КСl + ЗО 2
С 6 Н 12 О 6 + 6О 2 → 6СО 2 + 6Н 2 О
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего
соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание некоторых реакций вообще невозможно без присутствия катализатора:
2H 2 O 2 = 2H 2 O + O 2 (катализатор MnO 2)
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF 2 + H 2 O, где Ме – металл.
Примеры решения задач
ПРИМЕР 1
Кинетика и макрокинетика физико-химических процессов
Для уровней подготовки:
Бакалавриат
Общая трудоемкость курса, акад. ч.: 72
ч.: 72
Лекции, акад.ч.: 16
Практические занятия, акад.ч.: 16
Самостоятельная работа, акад.ч.: 40
Вид итогового контроля: Зачет с оценкой
Цели курса:- Приобретение практических навыков построения кинетических моделей сложных гетерогенно-каталитических реакций; моделей зерна катализатора, использования аналитических и численных методов решения уравнений математических моделей, методов оценки кинетических и макрокинетических параметров моделей и проверки их адекватности экспериментальным данным.
- формирование опыта и навыков построения кинетических моделей сложных многомаршрутных химических реакций;
- формирование опыта и навыков анализа процессов массо-, теплопереноса в зерне гетерогенного катализатора,
- построение моделей зерна катализатора для гранул различных форм, расчета факторов эффективности работы зерна катализатора для различных реакций и реагентов;
- освоение основных методов оценки неизвестных кинетических и макрокинетических параметров моделей и проверки их адекватности экспериментальным данным;
- освоение численных методов решения уравнений математических моделей;
- проведение практических работ с применением современных средств вычислительной техники.

Базовые знания:
Программа курса предполагает, что обучающиеся имеют теоретическую и практическую подготовку в области математики, вычислительной математики, общей и неорганической химии, органической химии.
Содержание курса:
1. Теоретические основы. Статика и кинетика химически реагирующих систем. Построение кинетических моделей сложных многомаршрутных химических реакций.
1.1. Стехиометрический анализ реагирующей химической системы.
Значение и роль кинетических исследований при моделировании промышленного каталитического процесса. Определение механизма многостадийной химической реакции. Стехиометрический анализ реагирующей химической системы. Структурная и стехиометрическая матрицы. Закон действующих масс. Принцип детального равновесия. Константы равновесия элементарных реакций, константы скоростей прямой и обратной элементарной реакции, их зависимость от термодинамических переменных. Независимые химические реакции. Стехиометрическое правило Гиббса. Базисные решения основной стехиометрической системы уравнений. Методика расчета независимых реакций.
Константы равновесия элементарных реакций, константы скоростей прямой и обратной элементарной реакции, их зависимость от термодинамических переменных. Независимые химические реакции. Стехиометрическое правило Гиббса. Базисные решения основной стехиометрической системы уравнений. Методика расчета независимых реакций.
1.2. Меры завершенности реакций. Прямая и обратная задача химического равновесия.
Определение меры завершенности (глубины протекания) химической реакции. Векторные концентрационные и молярные меры завершенности химических реакций. Прямая и обратная задача химического равновесия. Использование независимых химических реакций при расчете равновесных составов сложных реагирующих химических систем. Принципы выбора оптимальной совокупности независимых реакций.
1.3. Химические варианты и инварианты. Основная система кинетических уравнений.
Химические инварианты, определение и свойства. Оценка общего числа химических инвариантов. Построение уравнений химических инвариантов по структурной или стехиометрической матрице. Основная система кинетических уравнений, ее свойства. Матричное представление.
Построение уравнений химических инвариантов по структурной или стехиометрической матрице. Основная система кинетических уравнений, ее свойства. Матричное представление.
1.4. Адсорбция газов на поверхностях твердых катализаторов.
Импульсные методы изучения в нестационарных режимах процессов адсорбции реагентов на различных адсорбентах или каталитических реакций на гетерогенных катализаторах. Кинетические модели многокомпонентной адсорбции на однородных поверхностях. Матричное представление. Экспериментальные и математические методы определения типа динамических моделей адсорбции, изотерм адсорбции, оценка их констант – констант скоростей адсорбции, констант адсорбционно-десорбционного равновесия, коэффициентов диффузии, коэффициентов массоотдачи для реагентов, констант моделей пористой структуры адсорбентов.
1.5. Метод Боденштейна для построения кинетических моделей гетерогенно-каталитических реакций со сложным механизмом протекания.
Химическая кинетика сложных каталитических реакций. Нестационарная, квазистационарная и стационарная области протекания химических реакций. Принцип квазистационарности Боденштейна — Семенова. Боденштейновские и небоденштейновские вещества. Построение уравнений химических инвариантов для боденштейновских и небоденштейновских веществ. Медленные и квазиравновесные стадии механизма химической реакции. Кинетические модели многостадийных химических реакций и их основные свойства.
Нестационарная, квазистационарная и стационарная области протекания химических реакций. Принцип квазистационарности Боденштейна — Семенова. Боденштейновские и небоденштейновские вещества. Построение уравнений химических инвариантов для боденштейновских и небоденштейновских веществ. Медленные и квазиравновесные стадии механизма химической реакции. Кинетические модели многостадийных химических реакций и их основные свойства.
1.6. Метод Хориути для построения кинетических моделей гетерогенно-каталитических реакций со сложным механизмом протекания.
Стехиометрические числа, маршруты реакций, стехиометрические матрицы итоговых уравнений маршрутов. Правило Хориути. Определение максимального числа линейно независимых векторов стехиометрических чисел Хориути. Расчет вектора скоростей итоговых реакций по маршрутам, выведенных по методу Хориути.
2. Планирование эксперимента для оценки параметров кинетических моделей
2.1. Статические и непрерывные планы эксперимента.
2.2. Методы оценки параметров кинетических моделей, стартовый и прецизионный эксперимент.
Структурная и параметрическая идентификация кинетических моделей. Оценка параметров одно- и многооткликовых линейно- и нелинейно-параметризованных моделей при равноточных и неравноточных наблюдениях методом наименьших квадратов и максимального правдоподобия. Дисперсионно-ковариационная матрица оценок параметров, оценка значений откликов, дисперсионно-ковариационная матрица оценок значений откликов. Планирование стартового и прецизионного эксперимента с использованием различных критериев оптимальности.
2.3. Численные методы решения уравнений кинетических моделей.
Алгоритмы и численные методы решения уравнений кинетических моделей (явный и полунеявный методы Рунге-Кутта, метод ортогональных коллокаций).
2.4 Проверка адекватности кинетических моделей.
Методы Бартлетта и Хагао проверки адекватности многоотклитковых кинетических моделей физико-химических процессов экспериментальным данным.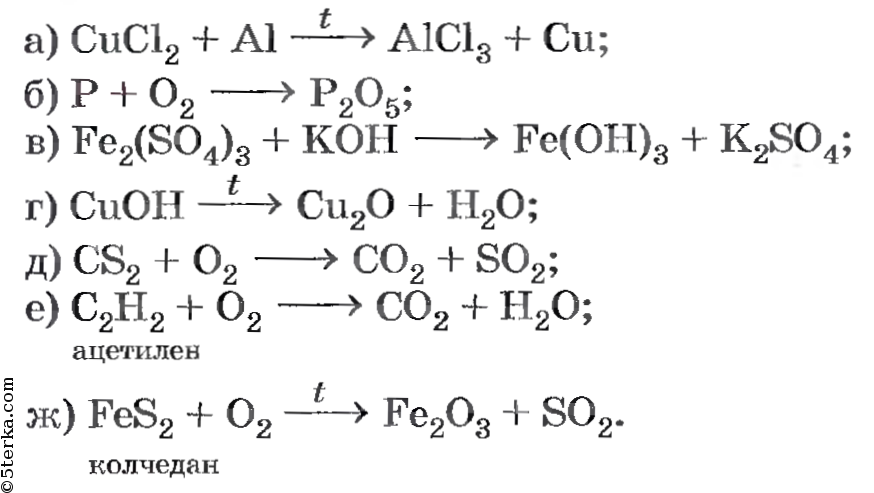
2.5. Планирование дискриминирующего эксперимента, дискриминация кинетических моделей.
Общие подходы к дискриминации кинетических моделей физико-химических процессов. Количественные критерии дискриминации моделей — -критерий, энтропийный критерий Кульбака, обобщенный критерий отношения вероятностей. Их основные достоинства и недостатки. Cтратегия эффективного экспериментирования при дискриминации конкурирующих моделей.
3. Методы моделирования физико-химических процессов в зерне катализатора.
3.1. Экспериментальные методы определения областей протекания реакций в системах газ — твердое.
Области протекания гетерогенно-каталитических процессов (кинетическая, внутридиффузионная, внешнедиффузионная) и экспериментальные способы их определения.
3.2. Процессы переноса массы и тепла в зерне катализатора и в пограничном слое.
Потоки реагентов в зерне катализатора. Молекулярная диффузия, кнудсеновская и поверхностная диффузия. Зависимость коэффициентов молекулярной диффузии от термодинамических переменных. Пуазейлевский поток. Зависимость коэффициентов пуазейлевской диффузии от термодинамических переменных. Стефановский поток. Процессы переноса тепла в зерне катализатора. Нестационарные и стационарные режимы работы зерна.
Зависимость коэффициентов молекулярной диффузии от термодинамических переменных. Пуазейлевский поток. Зависимость коэффициентов пуазейлевской диффузии от термодинамических переменных. Стефановский поток. Процессы переноса тепла в зерне катализатора. Нестационарные и стационарные режимы работы зерна.
3.3. Математические модели гранул катализаторов различной формы – квазигомогенные, капиллярные, глобулярные, бидисперсные.
Квазигомогенная модель зерна катализатора для гранул различной формы. Граничные условия Дирихле и Неймана. Капиллярные, глобулярные, бидисперсные модели зерна катализатора. Их преимущества и недостатки.
3.4. Уравнения диффузионной стехиометрии для изотермических и неизотермических процессов. Основные способы интенсификации работы зерна катализатора.
Уравнения диффузионной стехиометрии для изотермических и неизотермических процессов. Единственность и множественность стационарных состояний работы зерна. Основные способы интенсификации работы зерна катализатора.
3.5. Неявные конечно-разностные схемы для решения уравнений моделей зерна катализатора.
Анализ и моделирование процесса в зерне катализатора. Неявные конечно-разностные схемы для решения уравнений модели зерна катализатора. Метод ортогональных коллокаций.
3.6. Оценка факторов эффективности работы зерна катализатора.
Оценка внешнего и внутреннего факторов эффективности работы зерна катализатора для реагентов и итоговых реакций по маршрутам. Уравнения инвариантов для расчета факторов эффективности для неключевых веществ и независимых реакций.
Открытое образование — Физическая химия. Кинетика
- 10 недели
- 4 зачётных единицы
Настоящая учебная дисциплина дает пользователям знания в области основных законов и понятий кинетики, знакомит с основными экспериментальными и теоретическими подходами к описанию кинетических процессов, позволяет освоить практические навыки использования физико-химических основ в нанотехнологиях и наноэлектронике. Курс разработан НИТУ «МИСиС»
Курс разработан НИТУ «МИСиС»
О курсе
Курс знакомит пользователей с основными кинетическими методами для анализа химических и фазовых превращений в макроскопических системах. На основе полученных знаний они осваивают возможность составлять кинетические модели процессов в многокомпонентных, многофазных системах и решать соответствующие задачи аналитическими и численными методами, распознавать особенности кинетики гетерогенных процессов, определять лимитирующие стадии.
Формат
Еженедельные занятия будут включать в себя просмотр тематических видео лекций и выполнение индивидуальных тестовых и расчетных заданий.
Требования
Курс лекций подходит для широкого круга слушателей с базовой подготовкой по математике в пределах курсов «Интегральное и дифференциальное исчисление», включая раздел о решениях дифференциальных уравнений. Для эффективного усвоения курса обязательно знакомство с курсами «Химическая термодинамика», «Химия» и «Физика».
Для эффективного усвоения курса обязательно знакомство с курсами «Химическая термодинамика», «Химия» и «Физика».
Программа курса
Раздел 1 Формальная химическая кинетика.
Кинетика; химическая кинетика, скорость реакции
Кинетическое уравнение и порядок реакции
Порядок реакции; время полупревращения
Методы определения порядка реакции
Раздел 2 Кинетика вблизи равновесия. Зависимость скорости реакции от температуры
Кинетика и равновесие
Зависимость скорости реакции от температуры
Теория переходного состояния (теория абсолютных
скоростей реакций)
Раздел 3 Кинетика сложных реакций
Кинетика параллельных и последовательных реакций
Автокаталитические реакции в открытых системах
Цепные реакции
Раздел 4 Диффузия.
Диффузия – общее описание
2-ое уравнение диффузии, основные решения
Основные результаты экспериментальных исследований диффузии в твердых телах
Раздел 5 Механизмы диффузии в твердых телах
Модель случайных блужданий
Механизмы диффузии в кристаллах
Диффузия в многофазных системах
Раздел 6 Кинетика гетерогенных процессов
- Общие понятия гетерогенной кинетики
- Процессы последовательного и параллельного массопереноса
- Процессы последовательного и параллельного массопереноса и химической реакции
Раздел 7 Поверхностные явления
- Поверхности раздела фаз, их характеристики
- Теория Лангмюра
- Эффективная поверхность. Полимолекулярная адсорбция
- Адсорбция в растворах
Раздел 8 Кинетика фазовых превращений
- Фазовые переходы 1-го рода
- Критический размер зародышей
- Скорость зарождения центров и линейная скорость роста
- Гетерогенное образование зародышей.
 Уравнение Аврами.
Уравнение Аврами.
Раздел 9 Фазовые превращения второго рода. Теория электролитов.
- Фазовые превращения 2-го рода
- Теория электролитов. Положения теории Аррениуса
- Теория электролитов. Определение степени диссоциации
- Теория электролитов.Степень диссоциации.Числа переноса
Раздел 10 Электродные процессы. Общее заключение
- Электрохимия окислительно- восстановительных процессов
- Термодинамика электродных процессов
- Типы электродов
Результаты обучения
В результате обучения студент способен:
- Применять методы формальной кинетики при анализе химических превращений веществ;
- вычислять скорости химических реакций по экспериментальным данным и выполнять расчеты параметров кинетического уравнения;
- вычислять энергию активации для химических реакций и находить температурную зависимость скорости химической реакции;
- использовать законы диффузии для анализа процессов массопереноса вещества;
- владеть методами описания гетерогенных химических реакций и определять лимитирующую стадию процесса;
- владеть методами описания твердофазных химических реакций.

Формируемые компетенции
22.03.01 Материаловедение и технологии материалов), (11.03.04 Электроника и наноэлектроника), (28.03.01. Нанотехнологии и микросистемная техника)
Знать теоретические основы организации и планирования физических исследований, ОПК-1;
Знать основы химической кинетики, катализа и электрохимии, ОПК-1;
Уметь применять основы химической кинетики, катализа и электрохимии при описании полученных экспериментальных результатов, ОПК-1;
Курсы подготовки к ЕГЭ по химии онлайн и в классе / Maximum
Maximum Education Москва Контакты:Адрес: Подсосенский переулок, д. 23, стр. 2, этаж 3, пом. 1, метро Курская Москва,
Телефон:8 800 775 53 81, Факс:8 800 775 53 81, Электронная почта: Maximum Education Санкт-Петербург Контакты:Адрес: улица Рубинштейна 13, Бизнес Центр «Агат», 4-й этаж Санкт-Петербург,
Телефон:8 (812) 385-52-55 , Факс:8 (812) 385-52-55 , Электронная почта: Maximum Education Бердск Контакты: Адрес:
ул.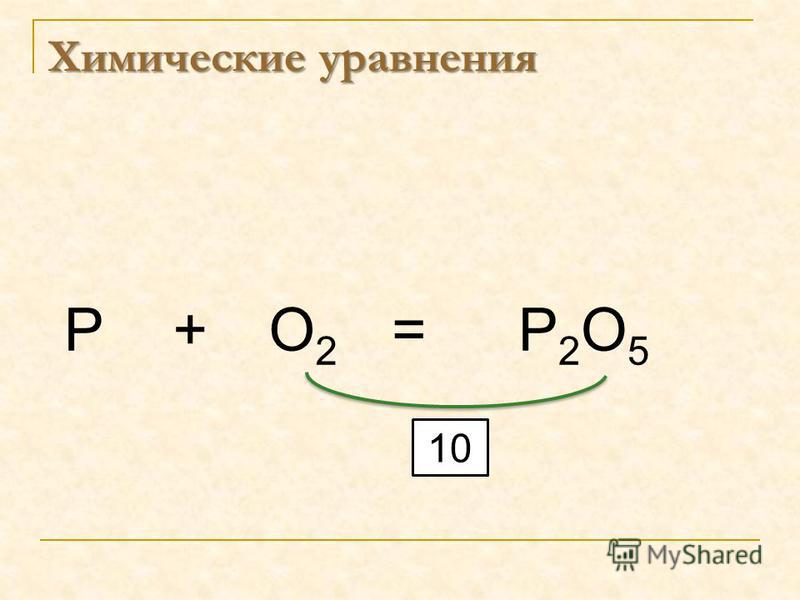 Первомайская д.19 оф.2 Бердск,
Первомайская д.19 оф.2 Бердск,
Адрес: пр. Красного знамени, д.34 Владивосток ,
Телефон:8 (423) 290-90-99, Факс:8 (423) 290-90-99, Электронная почта: Maximum Education Владикавказ Контакты:Адрес: пр.Коста, 15, оф.1-8 Владикавказ,
Телефон:8 (926) 265-17-16, Факс:8 (926) 265-17-16, Электронная почта: Maximum Education Владимир Контакты:Адрес: Октябрьский пр-кт, д. 7 (ДЦ «Типография», вход номер 4, 4 этаж, башня), офис 417. Владимир,
Телефон:8 (4922) 600-007, Факс:8 (4922) 600-007, Электронная почта: Maximum Education Волгоград Контакты:Адрес: ул. Ткачева, 7 Волгоград,
Телефон:8 (8442) 60-10-97, Факс:8 (8442) 60-10-97, Электронная почта: Maximum Education Воронеж Контакты: Адрес:
ул. Карла Маркса 70А Воронеж,
Карла Маркса 70А Воронеж,
Адрес: ул. Г. Н. Трошева, д. 7 Грозный,
Телефон:8 (928) 948-20-00, Факс:8 (928) 948-20-00, Электронная почта: Maximum Education Екатеринбург Контакты:Адрес: Ул. Чернышевского, д. 16, эт. 2, метро Площадь 1905 года Екатеринбург,
Телефон:8 (343) 288-58-19, Факс:8 (343) 288-58-19, Электронная почта: Maximum Education Иркутск Контакты:Адрес: Степана Разина 27, оф. 205 Иркутск,
Телефон:8 (3952) 500-131, Факс:8 (3952) 500-131, Электронная почта: Maximum Education Калуга Контакты:Адрес: Бизнес-Центр «Московский», ул.Суворова, 121 Калуга,
Телефон:+7 (484) 220-71-76, Факс:+7 (484) 220-71-76, Электронная почта: kaluga@maximumtest. ruMaximum Education Краснодар
Контакты:
ruMaximum Education Краснодар
Контакты:Адрес: ул. Кожевенная, д. 56 Краснодар,
Телефон:8 (861) 205-34-45, Факс:8 (861) 205-34-45, Электронная почта: Maximum Education Красноярск Контакты:Адрес: ул. Парижской Коммуны, д. 33, оф. 302 Красноярск,
Телефон:8 (391) 269-90-33, Факс:8 (391) 269-90-33, Электронная почта: Maximum Education Махачкала Контакты:Адрес: ул. Леваневского 3, 3й этаж. Махачкала,
Телефон:+7 (928) 599-63-33, Факс:+7 (928) 599-63-33, Электронная почта: Maximum Education Мурманск Контакты:Адрес: ул. Полярные Зори, дом 1, этаж 4 Мурманск,
Телефон:78-77-14, Факс:78-77-14, Электронная почта: Maximum Education Мытищи Контакты: Адрес:
Олимпийский пр-кт, вл.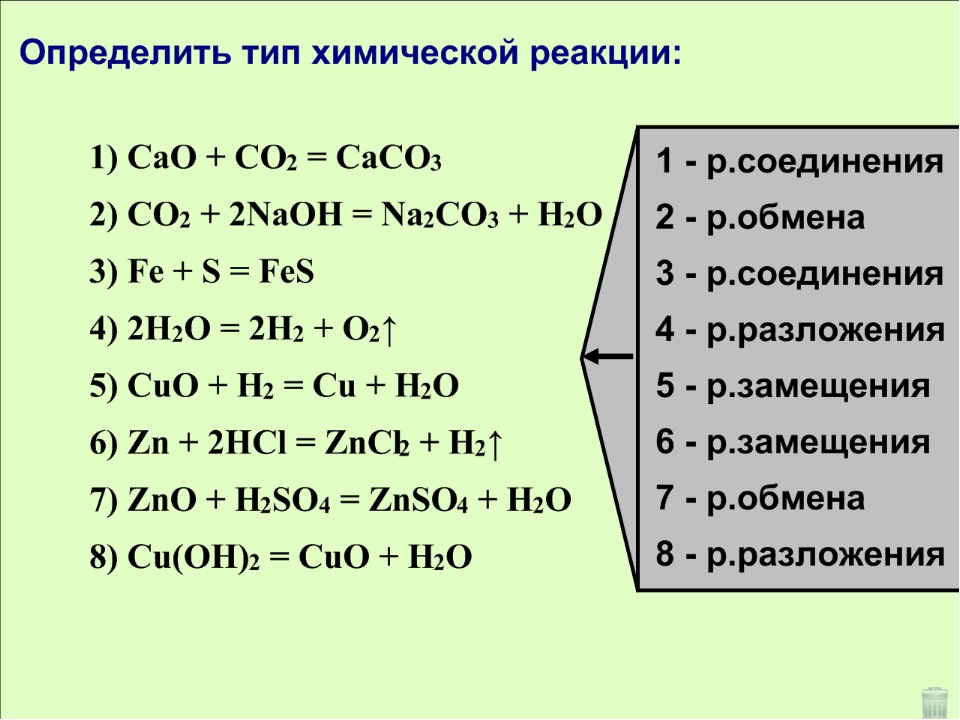 13, стр.1. БЦ «Фрегат». Мытищи,
13, стр.1. БЦ «Фрегат». Мытищи,
Адрес: ул. Московская, 33 Назрань,
Телефон:+7 (928) 918-05-65, Факс:+7 (928) 918-05-65, Электронная почта: Maximum Education Нижний Новгород Контакты:Адрес: м.Горьковская, ул. Костина, д. 3, эт. 4 Нижний Новгород,
Телефон:8 (831) 260-12-47, Факс:8 (831) 260-12-47, Электронная почта: Maximum Education Новосибирск Контакты:Адрес: м. Площадь Ленина. Ул. Максима Горького 75 Новосибирск,
Телефон:8 (383) 383-26-21, Факс:8 (383) 383-26-21, Электронная почта: Maximum Education Одинцово Контакты:Адрес: Можайское шоссе, д. 71 Одинцово,
Телефон:8 (499) 322-44-36, Факс:8 (499) 322-44-36, Электронная почта: Maximum Education Оренбург Контакты: Адрес:
ул. 8 Марта 49 (ТЦ Панорама), офис 204 Оренбург,
8 Марта 49 (ТЦ Панорама), офис 204 Оренбург,
Адрес: ул. Советская, 72, 4ый этаж Пермь,
Телефон:8 (342) 207-10-15, Факс:8 (342) 207-10-15, Электронная почта: Maximum Education Подольск Контакты:Адрес: Г. Подольск, ул. К.Готвальда, 6В, 2эт, 19 павильон Подольск,
Телефон:8(916) 055-96-65, Факс:8(916) 055-96-65, Электронная почта: Maximum Education Ростов-на-Дону Контакты:Адрес: ул. Пушкинская, д. 144 Ростов-на-Дону,
Телефон:8 (863) 320-02-15, Факс:8 (863) 320-02-15, Электронная почта: Maximum Education Салехард Контакты:Адрес: undefined Салехард,
Телефон:8 (482) 273-44-18, Факс:8 (482) 273-44-18, Электронная почта: Maximum Education Сочи Контакты: Адрес:
ул. Советская, д. 42, 2 этаж, офис 205 Сочи,
Советская, д. 42, 2 этаж, офис 205 Сочи,
Адрес: ул. Маяковского, дом 9/1 Сургут,
Телефон:8 (3462) 550-812, Факс:8 (3462) 550-812, Электронная почта: Maximum Education Тверь Контакты:Адрес: ул. Советская 36 Тверь,
Телефон:8 (482) 273-44-18, Факс:8 (482) 273-44-18, Электронная почта: Maximum Education Тольятти Контакты:Адрес: ул. Фрунзе, 8, офис 1010 (10 этаж) Тольятти,
Телефон:8 (927) 768-95-89, Факс:8 (927) 768-95-89, Электронная почта: Maximum Education Томск Контакты:Адрес: ул. Проспект Фрунзе, 103, оф. 605 Томск,
Телефон:8 (3822) 908 910, Факс:8 (3822) 908 910, Электронная почта: Maximum Education Тула Контакты: Адрес:
ул. Софьи Перовской 4, 2 этаж оф. 22,23 Тула,
Софьи Перовской 4, 2 этаж оф. 22,23 Тула,
Адрес: ул. Гончарова, 5 Ульяновск,
Телефон:8 (8422) 50-57-50, Факс:8 (8422) 50-57-50, Электронная почта: Maximum Education Ярославль Контакты:Адрес: Октябрьский переулок, дом 3 Ярославль,
Телефон:8 (4852) 208-996, Факс:8 (4852) 208-996, Электронная почта:Программа охватывает все темы ЕГЭ от простых к сложным, включая их повторение в течение года, поэтому каждый ученик получит свой максимально возможный балл.
Смотри вебинары, тренируйся, читай теорию, отслеживай прогресс — в онлайн модуле! Тебе не придется искать информацию в интернете или копить распечатки.
Держи связь с преподавателем в социальных сетях, а не только на уроках. Обсуждай прогресс и задавай вопросы на личных беседах — преподаватель всегда ответит и поможет.
80+баллов по химии ученики MAXIMUM получают в 1,5 раза чаще, чем в среднем по России
Запишитесь на консультацию
Это бесплатно и ни к чему вас не обязывает. Мы вам сразу перезвоним, и вы сможете уточнить все детали у нашего консультанта
Что вы получите на курсе
подготовки к ЕГЭ?
Только темы, необходимые для ЕГЭ, в простом и понятном формате — ничего лишнего!
На уроках мы будем работать только с актуальными заданиями в формате ЕГЭ
Мы научим тебя отвечать на любой вопрос так, чтобы получить за него максимум баллов
Поделимся с тобой секретными алгоритмами и методами решения заданий ЕГЭ
Мы проведем для тебя симуляции ЕГЭ и специальные мастер-классы, чтобы ты чувствовал себя уверенно
Гарантируем поступление нашим ученикам
Что вы могли не знать о ЕГЭ по химии
- ЕГЭ по химии включает в себя 4 блока: теоретически основы в химии, неорганическая химия, органическая химия и методы познания в химии.

- Для решения ЕГЭ необходимо уметь писать уравнения химических реакций.
- Самое ценное задание (№ 33) требует продемонстрировать знание реакций и механизмы их протекания (за верное решение можно получить 5 первичных баллов).
Учитесь с нами в удобном формате
Нужна помощь в выборе курса?
Оставьте номер телефона, и мы перезвоним в течение 24 часов,
чтобы ответить на все вопросы
Результаты наших учеников в 2019 году
Посмотри, что происходило в чатах групп в день публикации результатов ЕГЭ
Образовательная лицензия
В MAXIMUM занятия с преподавателем проходят в любом удобном для
ученика формате:
В классе или онлайн, мини-группе или один на
один. На курсе ученик узнает теорию и формат экзамена, осваивает
лайфхаки и оптимальные методы
На курсе ученик узнает теорию и формат экзамена, осваивает
лайфхаки и оптимальные методы
Курсы MAXIMUM по другим предметам
Занимайтесь онлайн или в классе
Оставьте заявку на консультацию
Система балансировки химического уравненияOnline — EndMemo
| H | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | He | ||||||
| Li | Be | ( | ) | В | С | 0067″> н. | O | ф. | Ne | ||||||||
| Na | Мг | Al | Si | П | ю. | Cl | Ar | ||||||||||
| К | Ca | сбн | Ti | В | кр | млн | Fe | 933195″> Co | Ni | Cu | Zn | Ga | Ge | Как | SE | руб. | кр |
| руб. | Sr | Zr | Пн | Тс | Ру | Pd | Ag | кд | 818″> В | Sn | сб | Te | Xe | ||||
| CS | Ba | Лас | Hf | Ta | Вт | Re | Ос | Ir | Пт | Au | рт. | тл | Пб | Bi | Po | при | рн |
| Пт | Ra | СК | Rf | Дб | Sg | Bh | HS | тонн | Ds | Rg | Cn | ||||||
| Лас | «> La | CE | Nd | вечера | см | Eu | Gd | Тб | Dy | Ho | Er | тм | Yb | Лю | |||
| AC | переменного тока | Чт | Па | U | Np | Pu | Am | см | Bk | Cf | Es | FM | мкр. | Нет | л. | ||
Балансир по химическому уравнению
Этот балансировщик химических уравнений может помочь вам сбалансировать несбалансированное уравнение.
Этот балансир также может помочь вам проверить, сбалансировано ли уравнение, таким образом, вы можете редактировать уравнение и проверять его баланс.
Балансир чувствителен к регистру.
Ниже приведены некоторые примеры формата ввода уравнения:
1. h3 + O2 = h3O
2. 2h3 + O2 = 2h3O
3. CaCl2 + 2AgNO3 = Ca (NO3) 2 + 2AgCl
Калькулятор балансировки химических уравнений | Онлайн-балансировщик
Что такое химическое уравнение?
Химическое уравнение показывает общее химическое превращение реагентов в продукты.Реагенты — это то, с чего вы начинаете, а продукты — это то, что образуется. Есть два способа написания химических уравнений — словесное уравнение и символьное уравнение.
$$ \ text {NaOH} \; \; + \; \; \ text {HCl} \; \ rightarrow \; $$
$$ \ text {NaCl} \; \; + \; \; H_2O $$
Гидроксид натрия (NaOH)
Соляная кислота (HCl)
Хлорид натрия (NaCl)
Вода (H 2 O)
Как записывается химическое уравнение?
При написании химического уравнения реагенты находятся слева перед стрелкой, а продукты — справа.Стрелка —> показывает, что реакция необратима. Он показывает направление реакции. Знак плюс указывает, что на каждой стороне уравнения присутствует более одного реагента или продукта.
Словесное уравнение дает хорошее резюме, а символьное уравнение дает более подробную информацию. Он показывает больше информации и позволяет нам увидеть, сколько атомов и молекул участвует в каждой реакции.
Для изучения молекул используйте наш калькулятор из граммов в моли.Или, если вы хотите узнать долю молей, попробуйте Калькулятор молей.
Введение в калькулятор балансировки химических уравнений
Калькулятор химических уравнений балансировки работает разумно, так как есть искусственный интеллект. Калькулятор уравновешивающих уравнений выполняет функцию уравновешивания данного уравнения, вычисляя коэффициенты.
Используется алгоритм исключения Гаусса-Джордана, но с небольшими изменениями.Калькулятор химических уравнений балансировки бесплатный и простой в использовании.
Как работает калькулятор балансировки химических уравнений?
Если мы смешаем железо (Fe) с двумя молекулами кислорода (O 2 ) вместе, вы получите соединение (Fe 2 O 3 ) и то, что обычно называют ржавчиной. Это хороший пример того, что происходит, когда вы оставляете велосипед под дождем.
Велосипед в основном состоит из стали. Сталь чиста на 95%, но железо смешивается с дождем, который представляет собой просто воду, а вода содержит кислород. Итак, железо и кислород соединяются вместе, и вы получаете это раздражающее коричневое вещество на вашем велосипеде, которое представляет собой Fe 2 O 3 , и вы знаете его как ржавчину.
Итак, железо и кислород соединяются вместе, и вы получаете это раздражающее коричневое вещество на вашем велосипеде, которое представляет собой Fe 2 O 3 , и вы знаете его как ржавчину.
$$ \ text {Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Чтобы сбалансировать это уравнение, нам нужно иметь такое же количество железа в левой части, что и в правой части. Таким образом, в левой части находится один атом железа, а в правой части — два атома железа. Чтобы сделать их равными, добавьте количество двух молекул в левой части.
$$ \ text {2Fe} \; \; + \; \; O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
А теперь сделаем то же самое с кислородом. С левой стороны у нас есть два атома кислорода, но с правой стороны у нас есть три атома кислорода. Нам нужно сделать это равным. Итак, в левой части нанесены два атома кислорода с половиной молекул.
$$ \ text {2Fe} \; \; + \; \; 1.5O_2 \; \; \ rightarrow \; \; Fe_2O_3 $$
Теперь у нас есть то же точное количество железа и кислорода в левой части, что и в правой части. Но мы возвращаемся с проблемой, потому что никогда не бывает половины молекулы.
Но мы возвращаемся с проблемой, потому что никогда не бывает половины молекулы.
Но мы заметили, что здесь у нас есть полторы молекулы кислорода. Так как же нам избавиться от этой половины молекулы? Ответ на этот вопрос — умножить обе части на два.
Теперь у нас есть сбалансированное химическое уравнение. Калькулятор баланса химических реакций также работает по тому же принципу. Чтобы узнать период полураспада, попробуйте Half Life Calculator, чтобы вы могли практиковаться во время выполнения.
Как использовать калькулятор балансировки химического уравнения?
Наш калькулятор уравнений баланса бесплатный и простой в использовании.С помощью нашего калькулятора химической реакции вы легко сможете сбалансировать любое уравнение. Просто введите свое несбалансированное уравнение в заданном месте и нажмите «Баланс». Избегайте ненужных пробелов.
У нас есть периодическая таблица, помещенная в наш калькулятор химических уравнений, просто нажмите на значения и нажмите кнопку «Баланс» нашего калькулятора химического балансира, чтобы получить необходимые результаты.
Мы надеемся, что вам понравился наш калькулятор балансировки химических уравнений. Помимо нашего калькулятора балансировки химических уравнений, у нас также есть другие онлайн-калькуляторы, связанные с химией.
Если вы хотите рассчитать теоретическую доходность по ее формуле, просто воспользуйтесь нашим калькулятором теоретической доходности. Или, если вы хотите узнать, что такое процентная доходность и как ее рассчитать, попробуйте калькулятор процентной доходности.
Пожалуйста, поделитесь с нами своими ценными отзывами, чтобы мы могли постоянно улучшаться.
Как сбалансировать химические уравнения: 3 простых шага
Химическое уравнение говорит вам, что происходит во время химической реакции. Сбалансированное химическое уравнение содержит правильное количество реагентов и продуктов, удовлетворяющих Закону сохранения массы.
В этой статье мы поговорим о том, что такое химическое уравнение, как сбалансировать химические уравнения, и дадим вам несколько примеров, которые помогут вам в практике балансирования химических уравнений.
Что такое химическое уравнение?
Проще говоря, химическое уравнение сообщает вам, что происходит в химической реакции . Вот как выглядит химическое уравнение:
Fe + O2 → Fe2O3
В левой части уравнения находятся реагенты. Это материалы, с которыми вы начинаете химическую реакцию.
В правой части уравнения находятся произведения. Продукты — это вещества, образованные в результате химической реакции.
Для того, чтобы химическая реакция была правильной, она должна удовлетворять так называемому Закону сохранения массы, , который гласит, что масса не может быть создана или разрушена во время химической реакции. Это означает, что каждая сторона химического уравнения должна иметь одинаковое количество массы, потому что количество массы нельзя изменить.
Если в вашем химическом уравнении массы в левой и правой частях уравнения разные, вам необходимо сбалансировать химическое уравнение.
Как сбалансировать химические уравнения — объяснение и пример
Уравновешивание химических уравнений означает, что вы пишете химическое уравнение правильно, чтобы на каждой стороне стрелки было одинаковое количество массы.
В этом разделе мы собираемся объяснить, как сбалансировать химическое уравнение на примере реальной жизни, химическом уравнении, которое возникает, когда железо ржавеет:
Fe + O 2 → Fe 2 O 3
# 1: Определите продукты и реагенты
Первым шагом в балансировании химического уравнения является определение ваших реагентов и ваших продуктов. Помните, ваши реагенты находятся в левой части уравнения. Товары находятся на правой стороне.
Для этого уравнения нашими реагентами являются Fe и O 2 . Наши продукты — Fe 2 и O3.
# 2: Запишите количество атомов
Затем вам нужно определить, сколько атомов каждого элемента присутствует на каждой стороне уравнения. Вы можете сделать это, просмотрев индексы или коэффициенты. Если нет нижнего индекса или коэффициента, то у вас есть только один атом чего-то.
Вы можете сделать это, просмотрев индексы или коэффициенты. Если нет нижнего индекса или коэффициента, то у вас есть только один атом чего-то.
Fe + O 2 → Fe 2 O 3
Со стороны реагента у нас есть один атом железа и два атома кислорода.
Со стороны продукта у нас есть два атома железа и три атома кислорода.
Когда вы записываете количество продуктов, вы можете видеть, что уравнение не сбалансировано, потому что есть разные количества каждого атома на стороне реагента и на стороне продукта.
Это означает, что нам нужно добавить коэффициенты, чтобы сбалансировать это уравнение.
# 3: добавить коэффициенты
Ранее я упоминал, что есть два способа определить, сколько атомов определенного элемента существует в химическом уравнении: глядя на индексы и глядя на коэффициенты.
Когда вы уравновешиваете химическое уравнение, вы меняете коэффициенты. Вы никогда не меняете индексы.
Коэффициент — это множитель целого числа. Чтобы сбалансировать химическое уравнение, вы складываете эти целые числовые множители (коэффициенты), чтобы убедиться, что на каждой стороне стрелки находится одинаковое количество атомов.
Вот что важно помнить о коэффициентах: они применяются к каждой части продукта. Например, возьмите химическое уравнение воды: h3O. Если вы добавили коэффициент, чтобы получилось 2H 2 O, то коэффициент будет кратным для всех присутствующих элементов. Итак, 2H 2 O означает, что у вас есть четыре атома водорода и два атома кислорода. Вы не просто умножаете против первого присутствующего элемента.
Итак, в нашем химическом уравнении (Fe + O 2 → Fe 2 O 3 ) любой коэффициент, который вы добавляете к продукту, должен отражаться в реагентах.
Давайте посмотрим, как сбалансировать это химическое уравнение.
Со стороны продукта у нас есть два атома железа и три атома кислорода. Давайте сначала займемся железом.
Давайте сначала займемся железом.
При первом взгляде на это химическое уравнение вы можете подумать, что работает что-то вроде этого:
2Fe + O 2 → Fe 2 O 3
Хотя это уравновешивает атомы железа (оставляя по два с каждой стороны), кислород все еще не сбалансирован. Это означает, что нам нужно продолжать поиски.
Если взять в первую очередь железо, мы знаем, что будем работать с кратным двум, поскольку на стороне продукта присутствуют два атома железа.
Зная, что использовать два в качестве коэффициента не получится, давайте попробуем следующее кратное двум: четыре.
4Fe + O 2 → 2Fe 2 O 3
Это создает баланс для железа, имея по четыре атома на каждой стороне уравнения. Кислород еще не совсем сбалансирован, но на стороне продукта у нас есть шесть атомов кислорода.Шесть кратно двум, поэтому мы можем работать с этим на стороне реагента, где присутствуют два атома кислорода.
Это означает, что мы можем записать наше сбалансированное химическое уравнение следующим образом:
4Fe + 3O 2 → 3Fe 2 O 3
3 Великие Источники Балансировки Химических Уравнений Практика
Есть много мест, где вы можете практиковать балансирование химических уравнений онлайн.
Вот несколько мест с практическими задачами, которые вы можете использовать:
Уравновешивание химических уравнений: основные выводы
Балансировка химических уравнений кажется сложной, но на самом деле это не так уж сложно!
Ваша главная цель при балансировании химических уравнений — убедиться, что на каждой стороне стрелки химического уравнения присутствует одинаковое количество реагентов и продуктов.
Что дальше?
Пишете исследовательскую работу для школы, но не знаете, о чем писать? В нашем справочнике по темам исследовательских работ есть более 100 тем в десяти категориях, так что вы можете быть уверены, что найдете идеальную тему для вас.
Хотите узнать о самых быстрых и простых способах преобразования между градусами Фаренгейта и Цельсия? Мы вас прикрыли! Ознакомьтесь с нашим руководством по лучшим способам преобразования Цельсия в Фаренгейта (или наоборот).
Вы изучаете облака в своем классе естественных наук? Получите помощь в определении различных типов облаков с помощью нашего экспертного руководства.
Уравновешивание химических уравнений с помощью алгебры
В последней из моей серии статей о балансировании химических уравнений мы рассмотрим алгебраический метод, который полезен для уравновешивания самых сложных уравнений
Хотя сочетание алгебры и уравновешивающих химических уравнений может показаться ужасающим, это не так плохо, как кажется.Часть алгебры довольно проста, нет ничего сложнее, чем одновременные уравнения, с которыми вы столкнетесь на математике уровня GCSE, если это так.
При этом этот математический подход подходит только для математически мыслящих студентов A Level или IB . Если вы его изучите, это может быть очень быстрый способ сбалансировать сложные уравнения, которые трудно сбалансировать при проверке, но нет формального требования для изучения этого метода , и вам никогда не нужно использовать его для балансировки химического уравнения на экзамене A Level или IB Diploma.
Если вы его изучите, это может быть очень быстрый способ сбалансировать сложные уравнения, которые трудно сбалансировать при проверке, но нет формального требования для изучения этого метода , и вам никогда не нужно использовать его для балансировки химического уравнения на экзамене A Level или IB Diploma.
Существует два алгебраических метода: нормальный алгебраический метод и упрощенная версия, которая является лучшим способом взломать самые сложные уравнения. Давайте сначала посмотрим на алгебраический метод.
Алгебраический метод уравновешивания химических уравнений
Стратегия алгебраического уравновешивания химических уравнений выглядит следующим образом:
- Напишите разные буквенные коэффициенты перед каждым составным в уравнении
- Напишите алгебраические выражения или правила для каждого элемента, которые уравнивают его атомы на левой и правой сторонах.
- Подставьте и упростите, чтобы получить правило, которое приравнивает только два буквенных коэффициента, которые вы можете решить
- Подставьте значения в другие правила, чтобы получить коэффициенты балансировки
В этом нет никакого смысла, я уверен без примера, поэтому вот уравнение для баланса с использованием этой стратегии:
_KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + _H 2 O
Первое, что мы делаем, это присваиваем каждому соединению буквенный коэффициент:
a KMnO 4 + b HCl → c MnCl 2 + d KCl + e Cl 2 + f H 2 O
Затем, применяя закон сохранения массы, который говорит нам, что общее количество атомов каждого элемента должно быть одинаковым с обеих сторон, напишите алгебраические правила для каждого элемента.
K: a = d
Mn: a = c
O: 4 a = f
H: b = 2 f
Cl: b = 2 c + d + 2 e
Чтобы объяснить логику этого на примере Cl, мы знаем, что количество атомов хлора должно быть одинаковым с обеих сторон уравнения. Со стороны реагентов у нас будет всего b атомов хлора.Что касается продукта, MnCl 2 содержит два атома хлора, поэтому, если его коэффициент равен c , он должен содержать 2c атомов хлора, в то время как KCl содержит d атомов хлора и так далее, суммируя общее количество атомы хлора на правой стороне.
Здесь слишком много неизвестных, но мы можем заменить правила для K и Mn на правило для Cl, чтобы избавиться от c и d :
b = 2 a + a + 2 e
b = 3 a + 2 e
Мы также можем избавиться от b , используя правило для H:
2 f = 3 a + 2 e
И, наконец, избавьтесь от f , используя правило для O:
2 (4 a ) = 3 a + 2 e
8 a = 3 a + 2 e
5 a = 3 a , следовательно, a = 5 и b = 3
Найдя теперь два коэффициента, подставив в правила для Cl и O и используя тот факт, что a = c = d = 2, решает для b и f :
b = 2 c + d + 2 e
b = 3 a + 2 e
b = 3 x 2 + 2 x 5
∴ b = 16
4 a = f
∴ f = 8
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
В том маловероятном случае, если это обнаружится в экзаменационной работе как вопрос о балансировке, вы обычно используете метод балансировки окислительно-восстановительного потенциала, но я думаю, вы согласитесь, что этот метод быстрее.
Обратите внимание, что когда вы используете алгебраический метод, вы можете выполнить различные замены, чтобы исключить неизвестные. Это прекрасно, нет правильного или неправильного подхода.
Простой алгебраический метод уравновешивания химических уравнений
Теперь, если в приведенном выше примере вы думали: « держитесь, если a = c = d, зачем вообще вводить c и d? Почему бы не упростить все это? », вы были бы правы, и здесь на помощь приходит упрощенный алгебраический метод.Этот метод делает именно это — он использует логику, чтобы уменьшить количество неизвестных, которые вам нужно решить.
Это лучший из известных мне методов балансировки чрезвычайно сложных уравнений, а также очень быстрый метод балансировки жестких окислительно-восстановительных уравнений, если вы освоите его. Обратной стороной является то, что этот метод требует немного интуиции. Под этим я подразумеваю, что некоторые уравнения требуют, чтобы вы применили определенную балансировку по принципам проверки, чтобы упростить алгебраические выражения, которые вам в конечном итоге придется решать.
Процедура использования простого алгебраического метода приведена ниже, но, честно говоря, она будет выглядеть как gobbledegook, и единственный способ разобраться в этом — проработать множество практических вопросов, которые, к счастью, я предоставил.
- Укажите элемент (ы), появляющийся только один раз на левой и правой сторонах уравнения.
- Если элемент (элементы) уже сбалансирован, укажите тот же буквенный коэффициент перед его составными частями
- Если элемент (ы) не сбалансирован, укажите буквенный коэффициент перед соединением, содержащим большее количество его атомов, затем уравновесите элемент с другой стороны уравнения, используя тот же буквенный коэффициент (с применением Сохранения массы)
- Поместите буквенные коэффициенты перед остальными составными частями.
- Минимизируйте необходимое количество букв, применяя принцип сохранения массы и логику, чтобы коэффициенты, представляющие элемент с одной стороны, выражались в терминах существующих коэффициентов, представляющих элемент с другой стороны.
 Идея состоит в том, чтобы уменьшить количество неизвестных.
Идея состоит в том, чтобы уменьшить количество неизвестных. - Стремитесь использовать не менее двух буквенных коэффициентов .
- Напишите алгебраическое правило для оставшихся элементов, которое уравнивает их с каждой стороны уравнения, замените и упростите, чтобы получить решения для каждого буквенного коэффициента.
- По возможности используйте принцип сохранения заряда, так как это может значительно уменьшить количество неизвестных (пример приведен ниже)
Чтобы показать, как это работает, воспользуемся тем же уравнением, что и выше:
_KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + _H 2 O
На этот раз мы начнем с того, что заметим, что кислород появляется только один раз с каждой стороны. Применяя приведенные выше правила, мы будем использовать тот же буквенный коэффициент перед KMnO 4 и H 2 O, поместив a перед KMnO 4 и 4a перед H 2 O , поскольку логически число перед H 2 O должно быть в четыре раза больше числа перед KMnO 4 , чтобы уравновесить кислород:
a KMnO 4 + _HCl → _MnCl 2 + _KCl + _Cl 2 + 4a H 2 O
Калий и марганец также появляются только по одному разу с каждой стороны, как и водород. Используя то, что я назвал правилом «принудительных коэффициентов» в этом блоге о балансировании химических уравнений, мы знаем, что коэффициент перед KCl и MnCl 2 также должен быть a :
Используя то, что я назвал правилом «принудительных коэффициентов» в этом блоге о балансировании химических уравнений, мы знаем, что коэффициент перед KCl и MnCl 2 также должен быть a :
a KMnO 4 + _HCl → a MnCl 2 + a KCl + _Cl 2 + 4a H 2 O
Для водорода коэффициент перед HCl должен быть в два раза больше коэффициента перед H 2 O, что составляет 8a :
a KMnO 4 + 8a HCl → a MnCl 2 + a KCl + _Cl 2 + 4a H 2 O
Остается только хлор, и мы дадим ему коэффициент b :
a KMnO 4 + 8a HCl → a MnCl 2 + a KCl + b Cl 2 + 4a H 2 O 9030
Теперь можно написать алгебраическое правило для хлора:
8 a = 2 a + a + 2 b
5 a = 2 b , что дает a = 2 и b = 5
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
Вот еще один пример, на этот раз тот, где мы можем использовать принцип сохранения заряда, чтобы легко его решить:
_IO 3 + _I — + _H + → _I 2 + _H 2 O
Первый шаг — отметить, что кислород появляется один раз на каждой стороне уравнения, поэтому, следуя приведенным выше рекомендациям, мы начнем с того, что поставим буквенный коэффициент a перед IO 3 и 3a перед H 2 O:
a IO 3 + _I — + _H + → _I 2 + 3a H 2 O
Водород также появляется по одному разу с каждой стороны уравнения, и если в H 2 O есть 3a , то на LHS должно быть 6a H + ионов:
a IO 3 + _I — + 6a H + → _I 2 + 3a H 2 O
Остается йод. Если мы поставим b перед I 2 на правой стороне, то общее количество атомов йода на правой стороне будет 2b , а общее количество атомов йода на левой стороне (с применением принципа сохранения массы) должно быть 2b -a ( a — количество атомов, присутствующих в IO 3 ):
Если мы поставим b перед I 2 на правой стороне, то общее количество атомов йода на правой стороне будет 2b , а общее количество атомов йода на левой стороне (с применением принципа сохранения массы) должно быть 2b -a ( a — количество атомов, присутствующих в IO 3 ):
a IO 3 + 2b-a I — + 6a H + → b I 2 + 3a H 2 O
Вот здесь-то и приходит на помощь сохранение заряда.У RHS нет нетто-заряда, что означает, что у LHS также не должно быть нетто-заряда. Это означает, что коэффициент перед I — и H + должен быть равен, поэтому мы можем написать выражение, представляющее это:
2b-a = 6a
2b = 7a , следовательно, a = 2 и b = 7
Подстановка этих значений дает сбалансированное уравнение:
2 IO 3 + 12 I — + 12 H + → 7 I 2 + 6 H 2 O
Chemical Reactions & Equations (Онлайн и дистанционное обучение)
Готовы ввести химические реакции и / или уравнения? Нужно быстро проверить предыдущие знания студентов? Разбудите их интерес, показав им 3-минутное онлайн-видео о, казалось бы, волшебном превращении, а затем используйте готовые раздаточные материалы (для отдельных лиц, пар или групп), чтобы проверить их мышление и выявить любые неправильные представления. Это занятие вызовет некоторое обсуждение химии!
Это занятие вызовет некоторое обсуждение химии!
Это также является отличным средством для формирующего оценивания, чтобы увидеть, «понимают» ли ваши ученики важные идеи, лежащие в основе химических уравнений и реакций. Используйте его как инструмент, чтобы весело и увлекательно проверить их понимание, пока они учатся дома.
Этот файл содержит PDF-файлы (раздаточный материал для учащихся с необходимой ссылкой и ключом учителя).
*************************
Связанные ресурсы для дистанционного обучения
Снова в школу Наука Белл Ringers Sample | Google Classroom
Урок по коронавирусу для студентов дома
Ежедневный пакет эндокринных разрушителей
БЕСПЛАТНОЕ развлечение, интересные вопросы для чтения научных новостей
Исследовательский проект по элементу Безумный Шляпник | Дистанционное обучение
**************************
Наслаждайтесь! Чтобы получать обновления о моих ресурсах, новых модулях / проектах и, конечно, о бесплатных услугах, «подпишитесь» в магазине Brilliant Dust на сайте Teachers Pay Teachers здесь.
Я преподаватель естественных наук с опытом лабораторных исследований, страстью к классной комнате, а теперь обучаю своих маленьких ученых на дому. Спасибо за ознакомление с моими ресурсами!
Важные условия использования
Этот ресурс был создан для использования только в одном классе (как учитель, вы можете использовать его в своих классах). Множественные лицензии доступны со скидкой. Пожалуйста, не размещайте этот ресурс в Интернете (за исключением платформ, защищенных паролем, предоставляющих цифровой доступ только вашим студентам).Спасибо за уважение к авторству учителя!
Несоблюдение является нарушением авторских прав и Закона о защите авторских прав в цифровую эпоху (DMCA). Авторские права 2020 Brilliant Dust. Все права защищены автором.
(PDF) Автоматически классифицированные задачи химического уравнения в онлайн-оценках с доски
World Journal of Chemical Education 92
() () () ()
22
3s g 3s g
3FeCl 3H S Fe S + 6HCl. + →
+ →
Стехиометрический коэффициент Fe2S3 Вопрос 1a равен 1,
оставив ячейку без переменной, также подразумевается 1, но
Blackboard Fill in Multiple Blanks не принимает пробелы,
переменная должна быть записана в пусто (ячейка), поэтому,
, мы должны предоставить значение 1, как в вопросе 1b
(коэффициент Al4C3), или не предоставить ячейку, как в
вопрос 1a (коэффициент Fe2S3), рисунок 1.
ii. Завершение и уравновешивание одного продукта
При написании продукта комбинационных реакций,
соединения должны быть представлены их правильными химическими формулами
, которые записаны на основе валентностей
(т.е. объединяющие способности взаимодействующих элементов
или заряды их ионов). [7] Например, в вопросе 2a
алюминий имеет валентность +3, а кислород
валентность +2, поэтому формула оксида алюминия — Al2O3.
Одним из ограничений Blackboard является неспособность испытуемых
записывать количество атомов в форме подстрочного индекса
.
Кроме реакций, продукты должны быть записаны в их молекулярных формулах
(соединения записываются путем объединения
атомов одного и того же элемента). Например,
молекулярная формула этанола — C2H6O. Тем не менее,
Химик часто записывает сжатую молекулярную формулу как
Ch4Ch3OH (или в более сокращенном виде C2H5OH).
Такое представление говорит нам, как связаны атомы в молекулах
. [8] Другие возможные ответы
, предоставленные экзаменатором на эти вопросы:
HOCh3Ch4, Ch4Ch3-OH, HO-Ch3Ch4, Ch4-Ch3-OH,
Ch3 (OH) Ch4, C2H5 –OH и т. Д. Чтобы избежать трудностей, ответ
должен быть простым и кратким, 5 однако простая молекулярная формула
(C2H6O) — лучший вариант
(рис. 2).
iii.Завершение и балансировка двух продуктов
Проблема, которая может возникнуть при завершении и
балансировки двух продуктов, заключается в том, чтобы решить, какой из продуктов
будет записан первым, эта проблема может быть решена, если
состояния продуктов различаются, что имеет место в случае
большинство реакций. Следовательно, продукт, который должен быть написан первым, должен быть написан
Следовательно, продукт, который должен быть написан первым, должен быть написан
государством. В вопросе 3, CO2
будет первым, прежде чем вода, из-за состояния CO2 (г)
был помещен в первую ячейку, рисунок 3.Здесь тоже присутствует ограничение на ввод нижнего индекса
.
iv. Преобразование словесных вопросов в химические уравнения
В вопросе 4 реагентами являются Ca (OH) 2 и HNO3, оба состояния реагентов
— водные (водные), проблема в том, какие из
реагенты должны быть записаны первыми, выход из них
, чтобы дать оба ответа (переменные, Ca (OH) 2 и HNO3)
для обоих черных, так как очень маловероятно, что испытуемый запишет
кислота или основание в обеих ячейках, рисунок 4.Ограничение нижнего индекса
также является проблемой в этом типе вопросов.
v. Классификация химических реакций
Несколько общих типов химических реакций могут происходить
в зависимости от того, что происходит при переходе от реагентов к продуктам
. [9] Реакции горения могут быть легко идентифицированы
[9] Реакции горения могут быть легко идентифицированы
по присутствию O2 на стороне реагента, CO2
и h3O на стороне продукта, Вопрос 5a.
Переменные, которые могут быть предоставлены для Вопроса 5b экспертом
, — это комбинация, синтез или сложение.Более активный элемент
замещает другой менее активный элемент в соединении
, следовательно, ответы, предоставленные экзаменатором на
Вопрос 5c, могут быть заменой, однократной заменой, смещением
или замещением (реакции), Рисунок 5.
Рисунок 2.
Рисунок 3.
Рисунок 4.
Как ввести химические уравнения в MS Word?
Для получения поддержки Office 365 при вводе уравнения в MS Word ознакомьтесь с этим пошаговым руководством:
https: // support.office.com/en-us/article/write-an-equation-or-formula-1d01cabc-ceb1-458d-bc70-7f9737722702
Если вы используете локальную версию MS Word на своем компьютере, вы можете попробовать один из следующих вариантов:
Вариант 1:
Если у вас установлен шрифт Lucida Sans Unicode (проверьте список шрифтов в Word), вам повезло.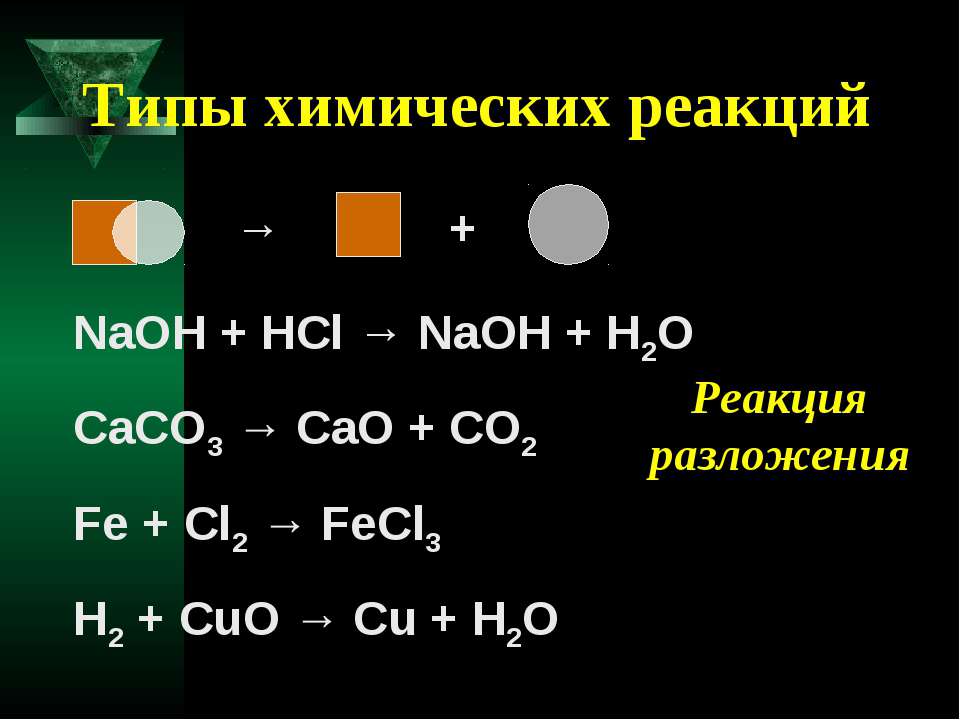
Если вы хотите вставить символ, щелкните меню «Вставка» и выберите «Символ». В поле шрифта выберите Lucida Sans Unicode. Вы увидите очень богатый выбор специальных символов, доступных для использования в математических операторах.Вот некоторые из них, которые могут быть полезны.
⇌ символ равновесия код 21CC
¯ заряд аниона 00AF
° градус символ 00b0
℃ градусов Цельсия 2103
√ корень 221A
→ стрелка реакции 2192
Шаг ∆ 2206
≈ примерно равно 2248
Вот еще более простой способ получить символ равновесия.Поместив курсор в точку вставки, где должен появиться символ, введите 21cc, затем одновременно нажмите клавиши ALT и X. Если у вас есть шрифт Lucida Sans Unicode, он напечатает символ равновесия, не переходя в меню вставки символа. Этот метод будет работать с любым из вышеперечисленных символов, заменяя соответствующий код перед нажатием ALT + X.
Вариант 2:
Для MS Word 2007/2010/2013: используйте функцию формул, предназначенную для математики, но нормально работающую для химии.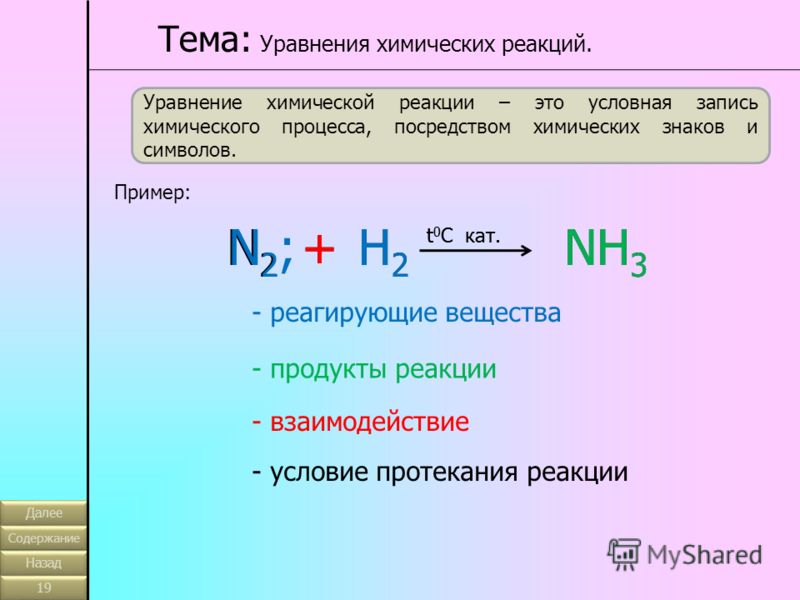

 Уравнение Аврами.
Уравнение Аврами.

 Идея состоит в том, чтобы уменьшить количество неизвестных.
Идея состоит в том, чтобы уменьшить количество неизвестных.