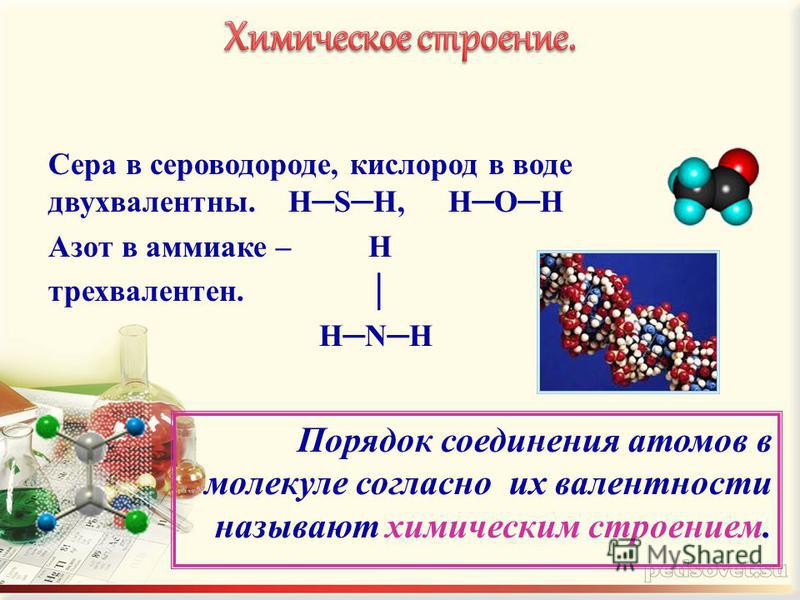
Валентность азота (N), формулы и примеры
Общие сведения о валентности азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Валентность азота в соединениях
Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14). В атоме азота есть два энергетических уровня, на которых находятся 7 электронов (рис.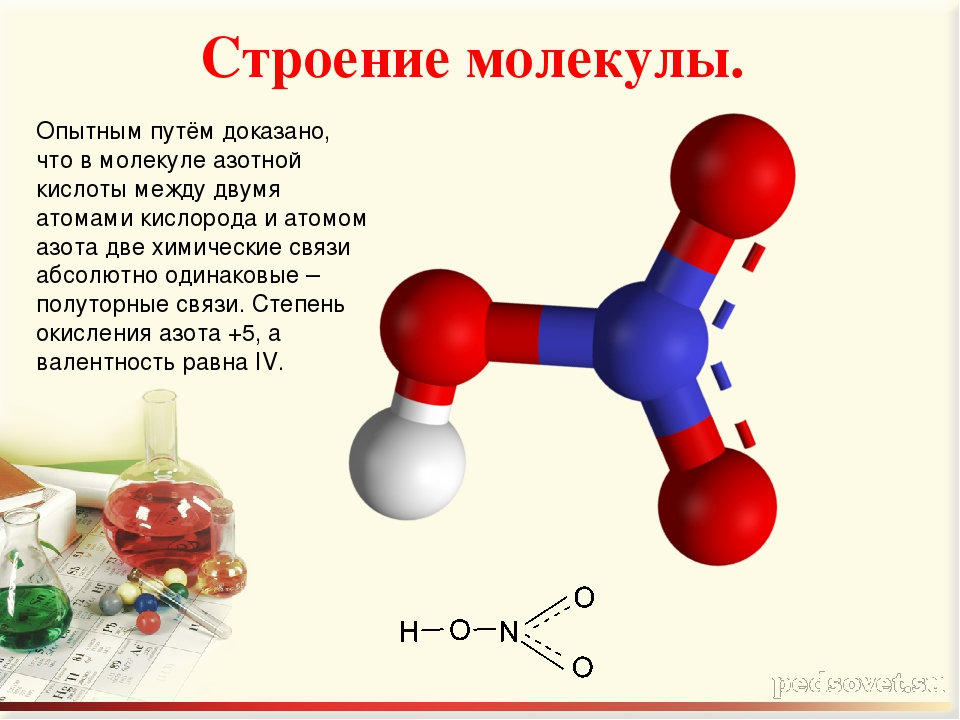
Рис. 1. Строения атома азота.
Электронная формула атома азота в основном состоянии имеет следующий вид:
1s22s22p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех неспаренных электронов свидетельствует о том, что азот может проявлять валентность III в своих соединения (NIII2O3, NIIIH3, HNIIIO2).
Известно, что помимо трех ковалентных связей, образуемых по обменному типу, азот способен образовывать ещё одну (т.е. в сумме четыре) по донорно-акцепторому механизму за счет наличия неподеленной пары электронов, находящейся на 2s-подуровне. Это означает, что азот также может проявлять в своих соединениях валентность IV (NIVO2).
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у азота нет.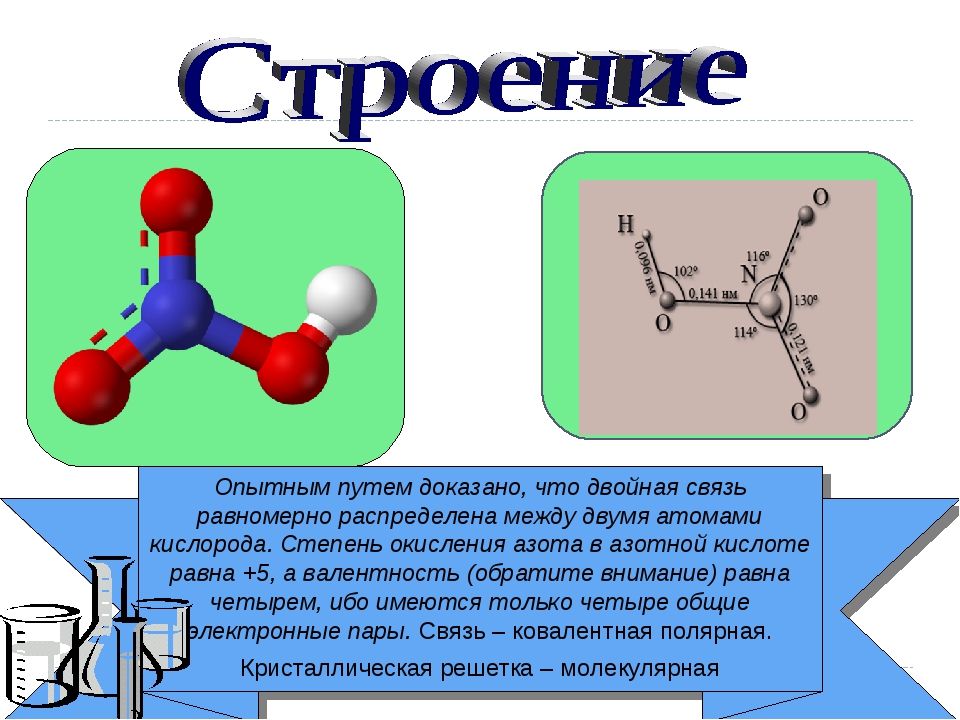
Ранее считалось, что высшая валентность азота равна V – соответствует номеру группы, в которой этот элемент расположен (NV2O5, HNVO3). Однако, квантово-механические исследования показали, что такая валентность для азота не характерна (рис. 2). Степень окисления +5 у азота есть, а валентности равной V – нет.
Рис. 2. Структурные формулы азотной кислоты и оксида азота (V).
Также для азота характерно проявление валентностей I (NI2O) и II (NO).
Примеры решения задач
Валентность — азот — Большая Энциклопедия Нефти и Газа, статья, страница 3
Валентность — азот
Cтраница 3
Известны следующие формы оксидов азота, соответствующие всем валентностям азота от единицы до пяти [173]: N2O, NO, NjOs, NO2, N2O4 и N2O5; все эти оксиды могут входить в состав обезвреживаемых нитрозных газов. [31]
Однако вы уже располагаете достаточными знаниями, чтобы установить валентность азота в этом соединении просто на основании рассмотрения приведенной выше его структурной формулы. [32]
[32]
При обсуждении производства азотной кислоты из аммиака мы упоминали наиболее важные валентности азота, которые он проявляет в своих соединениях. Какие валентности имеет азот в своих соединениях. [33]
По методическим соображениям все соединения, в которых три валентности азота насыщены только водородом, уалеродсодер-жащпмп остатками пли азотом, отнесены к одной группе. В пределах этой грушгы сначала будут описаны соединения, не содержащие в молекуле кратной свяли между атомами углерода it азота, потом остальные. Ко второй группе относятся соединения, в которых у атома углерода или атома азота, образующих свн л С — N, находится атом кислорода. В этой группе сначала будут рассмотрены соединения с кислородом, стоящим у азота, затем соединения с кислородом, стоящим у углерода. Последнюю группу образуют производные азотистоводо родной кислоты. Кроме этих простейших типов, имеются также более сложные типы соединений, которые не удаетсн спстематизиромать.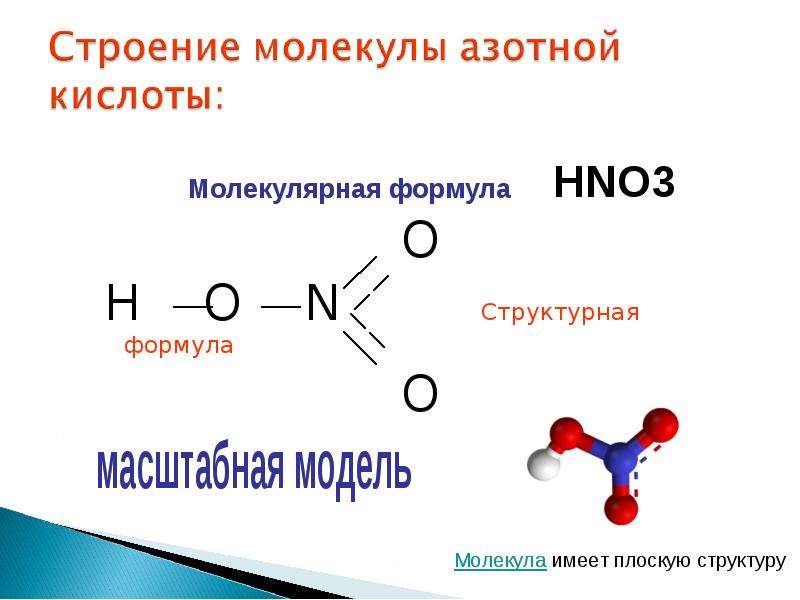
По методическим соображениям все соединения, в которых три валентности азота насыщены только водородом, углеродсодермсащими остатками или азотом, отнесены к одной группе. [35]
В соединениях, где азот образует двойную связь, третья
Каждый атом азота здесь пятивалентен, согласно старым представлениям о валентности азота в аммонийных солях. [37]
В соединениях, где азот образует двойную связь, третья валентность азота оказывается под углом к плоскости двойной связи.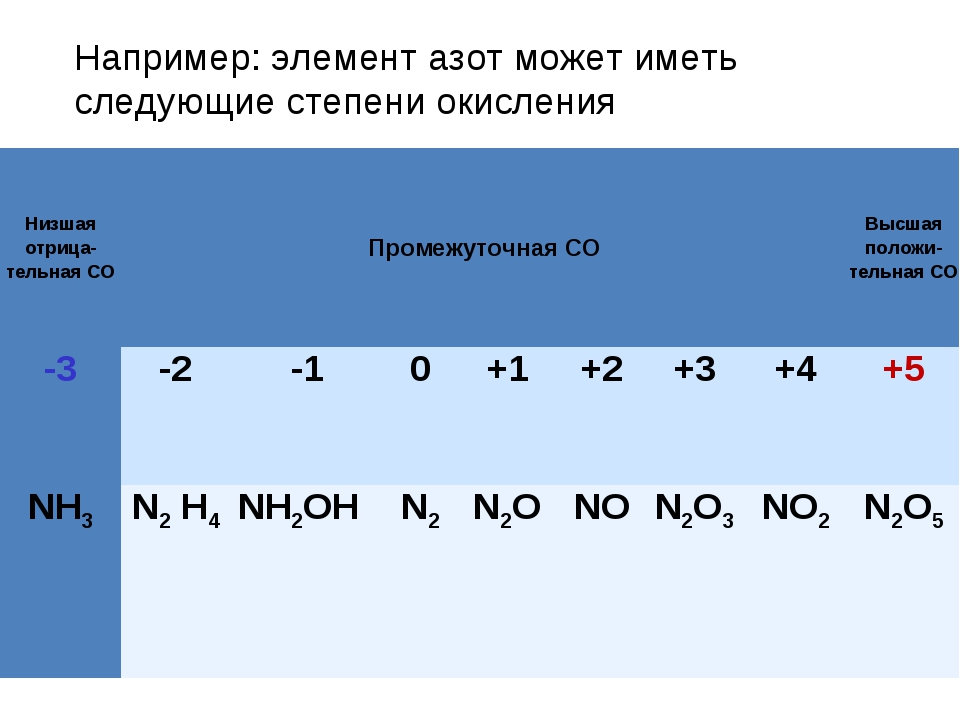 Геометрически картина совершенно такая же, как в этиленовых соединениях, лишь один заместитель отсутствует; вместо него стоит свободная электронная пара.
[38]
Геометрически картина совершенно такая же, как в этиленовых соединениях, лишь один заместитель отсутствует; вместо него стоит свободная электронная пара.
[38]
Четвертое электронное облако соответствует паре электронов, обусловливающей возможность повышения валентности азота и являющейся причиной основности аммиака. [39]
В атоме азота в соответствии с правилом Хунда имеется три одиночных р-электрона, поэтому валентность азота равна трем. Следует отметить, что азот не проявляет валентность, равную пяти. Для этого потребовалось бы переведение электронов на новый ( третий) электронный слой, а это сопряжено с такой затратой энергии, которая не может быть компенсирована энергией какой-либо химической связи азота с другим атомом. Строение молекулы азотной кислоты, в которой степень окисления азота 5, рассмотрено ниже ( см. стр.
[40]
стр.
[40]
В соответствии с правилом Гунда в атоме азота имеется три неспаренных электрона, поэтому валентность азота равна трем. Перевод электронов в третий слой сопряжен с большой затратой энергии, которая не компенсируется энергией какой-либо химической связи азота с другим атомом. Поэтому азот не проявляет валентность, равную пяти. [41]
Страницы: 1 2 3
Валентность азота
Валентность азота.
Валентность азота:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность азота равна I, II, III, IV, но не V! Азот не может быть пятивалентным! Даже в азотной кислоте и своем высшем оксиде атом азота образует только четыре ковалентные связи, являясь четырехвалентным. Азот проявляет переменную валентность.
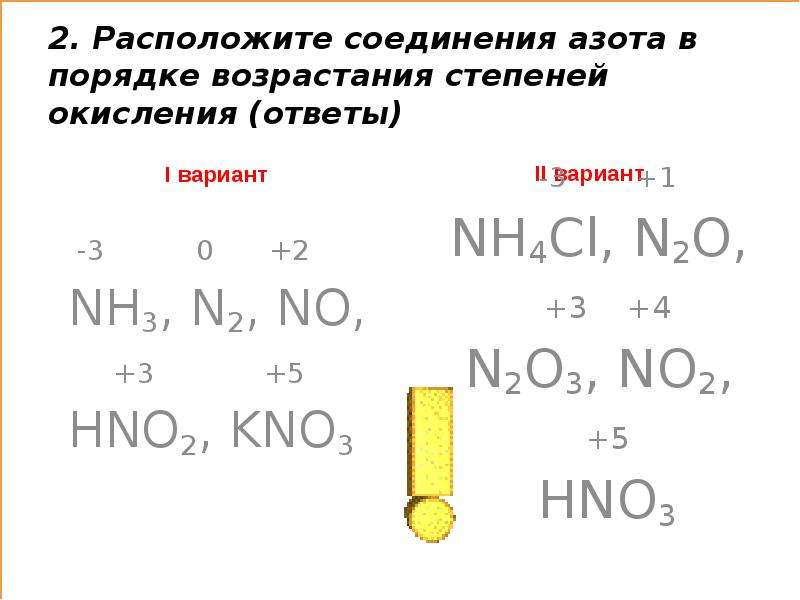
| Валентность азота в соединениях | |
| I | N2O |
| II | NO |
| III | Na3N, NH3, N2O3 |
| IV | HNO3, N2O5, NO2 |
Все свойства атома азота
youtube.com/embed/Pmz3hi9Bm0Q?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности 517
Валентность. Степень окисления химических элементов
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Правила определения валентности элементов в соединениях
- Валентность водорода принимают за I (единицу).

- Кислород в своих соединениях всегда проявляет валентность II.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – № группы.
- Валентность может быть постоянной или переменной.
- Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы).
Валентность элементов не имеет знака.
У металлов, находящихся в главных подгруппах, валентность равна номеру группы.
У неметаллов в основном проявляются две валентности: высшая и низшая.
Пример
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II.
Фосфор (P) проявляет валентности V и III.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2.
- h3 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Элементы с постоянной степенью окисления
Степень окисления = +№ группы
I группа главная подгруппа степень окисления +1.
II группа главная подгруппа степень окисления +2.
III группа главная подгруппа (бор, алюминий) степень окисления равна +3.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si(+4)h5(-), B2(+3)H6(-), B(+3)h4(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na(+)H(-), Ca(+2)h3(-).

- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например h3(+)O2(-), Na(2+)O(2-), Ba(+2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2(+)F2(-), O(+2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = +№ группы.

- Низшая степень окисления = +№ группы – 8.
- Промежуточная степень окисления = +№ группы – 2.
Пример
Фосфор (P)
- Высшая степень окисления = +5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = +3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Примеры определения степеней окисления в сложных веществах
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Решение
В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Решение
Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6.
Отсюда х = +6.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Решение
Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
11 класс.
 Химия. Азот.Фосфор. — АзотКомментарии преподавателя
Химия. Азот.Фосфор. — АзотКомментарии преподавателя1. Электронное строение атома азота
Химический элемент азот расположен во втором периоде 5 группы, главной подгруппы. Электронная конфигурация атома азота – 1s22s22p3. На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена. См. Рис. 1. Поэтому азот не может быть 5-ти валентным. Максимальная валентность азота в соединениях равна 4. При этом 3 связи образуются по обменному механизму, а одна – по донорно-акцепторному. Азот проявляет степени окисления от -3 до +5.
Рис. 1
Примеры веществ с различной степенью окисления см. рис. 2.
Рис. 2
2. Азот – простое вещество
Для азота нехарактерна аллотропия. Он образует одно простое вещество, N2. Это молекулярное вещество, с ковалентной неполярной связью. Связь образована при помощи трёх общих электронных пар, тройная связь – одна сигма и 2 пи-связи. Тройная связь очень прочная. Это обуславливает низкую реакционно способность молекулярного азота.
Тройная связь очень прочная. Это обуславливает низкую реакционно способность молекулярного азота.
Физические свойства
Азот – это газ без цвета и запаха, плохо растворим в воде, немного легче воздуха. Азот вступает в реакцию с некоторыми веществами, но условия проведения реакций очень жесткие (высокие температура и давление, использование катализатора). В обычных условиях азот взаимодействует только с литием, образуя нитрид лития.
6Li + N2 = 2Li3N, гидролизом которого можно получить аммиак.
Li3N + h3O = 3LiOH + Nh4↑ (аммиак)
Под действием электрического разряда азот способен окисляться
N2+O2 ⇄ 2NO
N2+h3 ⇄ 2Nh4 (t=5000С, Р= 1000 атм, катализатор Fe).
Получение азота
В промышленности азот получают перегонкой жидкого воздуха. Так как жидкий азот имеет tкип.= -1960С, то его используют в качестве охлаждающего средства для различных целей.
В лаборатории азот получают из нитрита аммония.
Nh5NO2 N2↑+ 2h3O
Азот применяется для создания инертной атмосферы в некоторых реакциях.
3. Получение и свойства аммиака
В молекуле аммиака атом азота находится в sp3-гибридизации. При помощи гибридных орбиталей образуется связь с атомами водорода. См. рис. 3.Четвертая гибридная орбиталь занята неподеленной парой. Поскольку понятие пространственной конфигурации молекул учитывает распределение атомов в пространстве и не учитывает распределение неподелённых электронных пар, то пространственная конфигурация молекулы азота – это тригональная пирамида с валентным углом 1070. Он отличается от тетраэдрического угла 1090. Это происходит вследствие отталкивания электронов, связывающих электронные пары, от неподеленной электронной пары атома азота.
Рис. 3
Физические свойства
Аммиак – это бесцветный газ, обладающий резким запахом. Он легче воздуха и очень хорошо растворим в воде. В одном объеме воды может раствориться до 700 объёмов аммиака. Разбавленный водный раствор аммиака с концентрацией от 3% до 10% называется нашатырным спиртом. Не путайте с нашатырем. Нашатырь – это хлорид аммония Nh5Cl. Концентрированный раствор аммиака с концентрацией от 18% до 20% называют аммиачной водой. Аммиак можно применять в качестве хладагента в холодильных установках.
Не путайте с нашатырем. Нашатырь – это хлорид аммония Nh5Cl. Концентрированный раствор аммиака с концентрацией от 18% до 20% называют аммиачной водой. Аммиак можно применять в качестве хладагента в холодильных установках.
Получение аммиака
В промышленности аммиак получают из азота и водорода. (Синтез Габера – Боша)
N2+h3 ⇄ 2Nh4 + Q (t=5000С, Р = 1000 атм, катализатор Fe).
Сырьем является азот, полученный перегонкой жидкого воздуха и водород, который получают разложением природного газа.
В лаборатории аммиак получают из солей аммония.
Nh5NO3 + NaOH Nh4↑ + h3O + NaNO3. Эта реакция является качественной на ион аммония. Её признак – это появление запаха аммиака.
Химические свойства аммиака
Аммиак обладает только восстановительными свойствами, т. к. азот находится в своей низшей степени окисления -3.
1. Горение аммиака
4Nh4+3O2 = 2N2+6 h3O
2. Каталитическое окисление аммиака
4Nh4+5O2NO+6h3O
3. Восстановление металлов из их оксидов
Восстановление металлов из их оксидов
3CuO +2Nh4 3CO + N2 +3h3O
4. Проявляет основные свойства. Водные растворы аммиака имеют щелочную реакцию. Взаимодействует с кислотами.
Поскольку в молекуле аммиака есть неподелённая электронная пара, он может образовывать связь по донорно-акцепторному механизму. Благодаря этому аммиак способен реагировать с кислотами, образуя соли аммония.
Nh4+ HCl = Nh5Cl (хлорид аммония)
2Nh4 + h3SO4 = (Nh5)2SO4 (сульфат аммония)
Nh4 + h3SO4 = Nh5HSO4 (гидросульфат аммония)
Соли аммония
Особенность солей аммония в том, что они легко разлагаются при нагревании.
Nh5Cl Nh4↑+ HCl
(Nh5)2CO3Nh4↑+ CO2↑+h3O
Nh5NO3N2O↑+ h3O
4. Получение и химические свойства азотной кислоты
В азотной кислоте степень окисления азота равна N+5 — . HN+5O3
При обычных условиях азотная кислота – это бесцветная жидкость, в полтора раза тяжелее воды.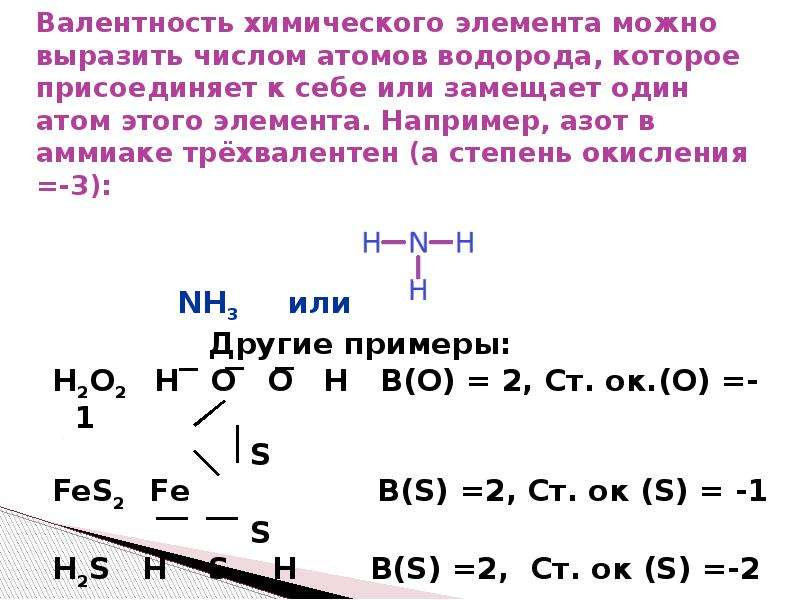 Это сильная одноосновная кислота, которая проявляет типичные для кислот свойства.
Это сильная одноосновная кислота, которая проявляет типичные для кислот свойства.
Окислительные свойства азотной кислоты
Азотная кислота является очень сильным окислителем за счет азота N+5.
1. При взаимодействии азотной кислоты с металлами образуется нитрат металла, продукт восстановления азота и вода. В качестве продуктов восстановления могут быть оксиды азота (N2O, NO, NO2), азот N2, нитрат аммония Nh5NO3. Глубина восстановления азота в таких реакциях зависит от концентрации кислоты, от активности металла, от температуры. Понижение температуры способствует более глубокому восстановлению азота. Водород в реакциях кислоты с металлами не выделяется потому, что азотная кислота проявляет свои окислительные свойства не за счет Н+, а за счет N+5.
С азотной кислотой любой концентрации не реагируют благородные металлы, а с концентрированной ( не реагируют алюминий, хром и железо из-за пассивации.
Схема взаимодействия азотной кислоты с металлами. См. Рис. 4.
См. Рис. 4.
Рис. 4
Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑+ 2h3O
3Cu + 8HNO3(разб) = 3Cu (NO3)2 + 2NO↑+ 4h3O
2. Азотная кислота взаимодействует с неметаллами, способными проявлять восстановительные свойства.
С + 4HNO3 =CO2+ 4NO2+ 2h3O
3P + 5HNO3 + 2h3O =3h4PO4+ 5NO
При долгом хранении, на свету или при нагревании азотная кислота может разлагаться.
4HNO3= 4NO2+ 2h3O + О2
Получение азотной кислоты
В лаборатории азотную кислоту получают нагреванием кристаллических нитратов калия или натрия с концентрированной серной кислотой.
2KNO3 + h3SO4 (конц.) K2SO4 + 2HNO3↑
Промышленное получение азотной кислоты.
Сырьем для получения азотной кислоты является азот.
I стадия: N2+h3 ⇄ 2Nh4 + Q (t = 5000С, Р = 1000 атм, катализатор Fe).
II стадия: 4Nh4+5O2NO+6 h3O
III стадия: 2NO +О2⇄2 NO2
IV стадия 4NO2+ 2h3O + О2 ⇄ 4HNO3
Азотная кислота является одной из важнейших неорганических кислот, её используют для получения удобрений, при нитровании органических соединений. Продуктами нитрования может быть нитробензол. Продуктом восстановления нитробензола является анилин, из которого получают красители. При нитровании органических соединений получают тринитрофенол, тринитротолуол или тринитроглицерин. Это взрывчатые вещества.
Продуктами нитрования может быть нитробензол. Продуктом восстановления нитробензола является анилин, из которого получают красители. При нитровании органических соединений получают тринитрофенол, тринитротолуол или тринитроглицерин. Это взрывчатые вещества.
Нитраты
Нитраты – это соли азотной кислоты. Они обладают ионным типом кристаллической решетки. Это твердые кристаллические вещества, хорошо растворимы в воде, температура плавления у нитратов сравнительно низкая. Они могут быть окрашены, но только за счет катионов соответствующего металла. Важной особенностью химических свойств нитратов является их способность разлагаться при нагревании.
Разложение нитратов
— Нитраты щелочных и щелочноземельных металлов (кроме Li) разлагаются по схеме:
Me+n(NO3)n Me+n(NO2)n+ O2↑
— Нитраты металлов, расположенных в ряду напряжений от Mg до Cu, и нитрат Li разлагаются по схеме:
Me+n(NO3)n Me+nO + NO2↑+ O2↑
— Нитраты металлов, расположенных в ряду напряжений правее Cu, разлагаются по схеме:
Me+n(NO3)n Me + NO2↑+ O2↑
— Разложение нитрата аммония
Nh5NO3N2O↑+ h3O
Горение черного пороха
При обычных условиях нитратный анион в нитратах, в отличие от азотной кислоты, не обладает ярко-выраженными окислительными свойствами. Но при нагревании или в расплавленном состоянии он их способен проявлять.
Но при нагревании или в расплавленном состоянии он их способен проявлять.
KNO3+ 3C + S N2↑ + 3CO2↑+ K2S
5. Закись азота, царская водка
Закись азота – веселящий газ
Веселящим газом называется закись азота N2O.
Nh5NO3N2O↑+ h3O
Исследованием этого вещества ученые занимаются давно. Его получают при разложении нитрата аммония. Разложение начинается при 1700С и сопровождается выделением тепла, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, т. к. при температурах более 3000С нитрат аммония разлагается со взрывом. При вдыхании N2O сначала наблюдается беспричинная веселость, и поэтому его назвали «веселящий газ», затем пропадает болевая чувствительность, а при вдыхании очень больших объемов начинаются галлюцинации. Закись азота в небольших количествах стали использовать в качестве обезболивающего. Он не оказывает вредного влияния на организм.
Царская водка
Смесь 3-х объемов концентрированной соляной кислоты и 1-го объема концентрированной азотной кислоты называется царской водкой. Она обладает окислительными свойствами ещё более сильными, чем концентрированная азотная кислота. Такая смесь способна растворять платину и «короля металлов» – золото.
Она обладает окислительными свойствами ещё более сильными, чем концентрированная азотная кислота. Такая смесь способна растворять платину и «короля металлов» – золото.
HNO3 + 3HCl + Au = AuCl3 + 2h3O + NO
Подведение итога урока
На уроке вы познакомились с темой «Азот». Получили представление об азоте как простом веществе, аммиаке, азотной кислоте и нитратах. Были рассмотрены химические и физические свойства этих веществ, строение их молекул, реакции с другими веществами. Перечислены способы получения этих веществ лабораторным и промышленным путем, их применение в различных отраслях. Рассмотрели свойства и применение закиси азота и царской водки (соединение из трех частей соляной кислоты и одной части азотной).
источник видео — http://www.youtube.com/watch?t=810&v=sW7rQzXh0O4
http://www.youtube.com/watch?t=88&v=zwr7aGa7FKU
http://www.youtube.com/watch?t=6&v=94rw6X7gMyI
http://www. youtube.com/watch?t=792&v=R8zi1bqYT1Y
youtube.com/watch?t=792&v=R8zi1bqYT1Y
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
http://orgchem.ru/chem5/index5.htm
источник презентации — http://ppt4web.ru/khimija/azot.html
http://www.youtube.com/watch?t=75&v=05AYIk-G97M — заставка
Азот — урок. Химия, 8–9 класс.
Химический элемент
Азот — химический элемент № \(7\). Он расположен в VА группе Периодической системы химических элементов.
N7+7)2e)5e
На внешнем слое атома азота содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом азоту характерна степень окисления \(–3\), а при взаимодействии с более электроотрицательными кислородом и фтором он проявляет положительные степени окисления от \(+1\) до \(+5\).
Азот в виде простого вещества содержится в воздухе. Его объёмная доля составляет \(78\) %. В земной коре соединения азота встречаются редко. Известно месторождение нитрата натрия NaNO3 (чилийская селитра).
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Простое вещество
Молекулы простого вещества состоят из двух атомов, связанных прочной тройной связью:
N:::N…., N≡N.
При обычных условиях азот — бесцветный газ без запаха и вкуса, малорастворимый в воде.
Не ядовит.
Азот химически малоактивен из-за прочной тройной связи и в химические реакции вступает только при высоких температурах.
При комнатной температуре он реагирует только с литием с образованием нитрида лития:
6Li0+N20=2Li+13N−3.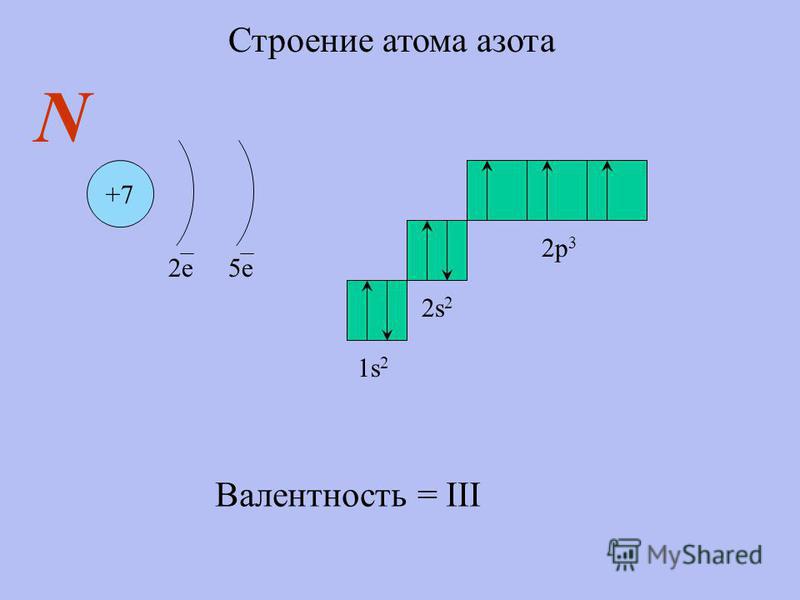
При нагревании образует нитриды и с некоторыми другими металлами:
3Ca+N2=tCa3N2.
С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора. В реакции образуется аммиак:
N20+3h30⇄t,p,k2N−3h4+1.
В реакциях с металлами и водородом азот проявляет окислительные свойства.
Восстановительные свойства азота проявляются в реакции с кислородом:
N20+O20⇄t2N+2O−2.
Реакция возможна только при очень высокой температуре (\(3000\) °С) и частично протекает в атмосфере во время грозы. Образуется оксид азота(\(II\)).
Применение и получение
Большое количество азота используется для получения аммиака и азотных удобрений.
Применяется он для создания инертной среды при проведении химических реакций. Жидкий азот находит применение в медицине, используется для охлаждения в химических и физических исследованиях.
Чистый азот получают из воздуха.
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи.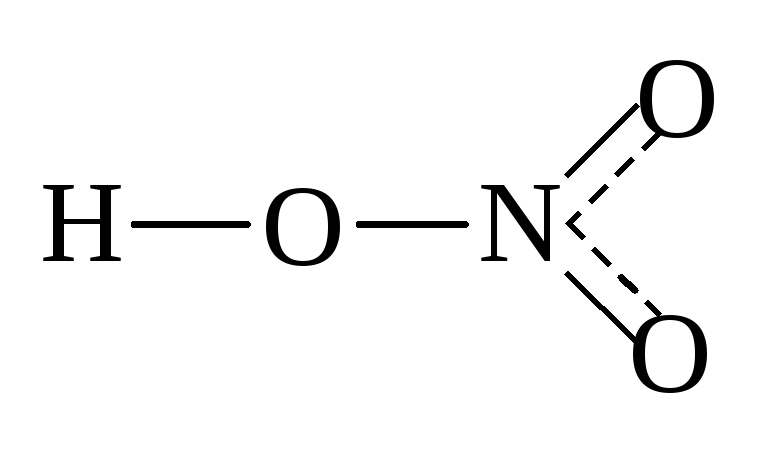 Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т. д.
д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.

- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8.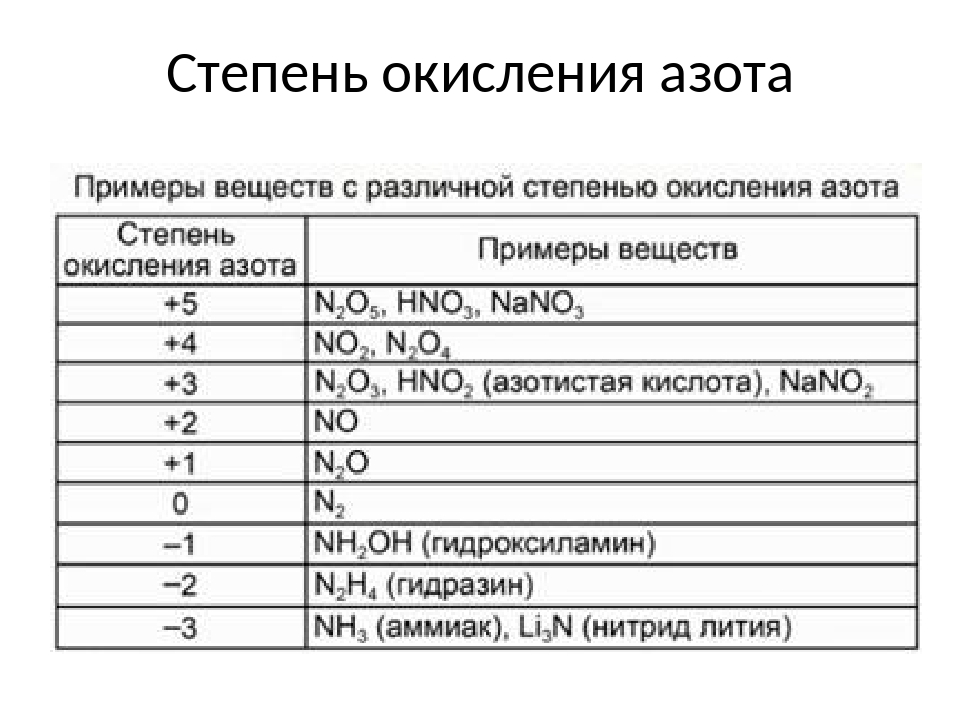 Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химия азота и фосфора
Химия Азот и фосфор
Химия азота
В химическом составе азота преобладает легкость, с которой
атомы азота образуют двойные и тройные связи. Нейтральный азот
Атом содержит пять валентных электронов: 2 с 2 2 p 3 .
Следовательно, атом азота может достигать октета валентности.
электронов, разделив три пары электронов с другим
атом азота.
Нейтральный азот
Атом содержит пять валентных электронов: 2 с 2 2 p 3 .
Следовательно, атом азота может достигать октета валентности.
электронов, разделив три пары электронов с другим
атом азота.
Поскольку ковалентный радиус атома азота относительно маленькие (всего 0,070 нм), атомы азота подходят достаточно близко друг к другу образовывать очень прочные связи. Энтальпия диссоциации связи для тройная связь азот-азот составляет 946 кДж / моль, что почти вдвое больше большой, как для двойной связи O = O.
Прочность тройной связи азот-азот составляет N 2 молекула очень инертная. N 2 настолько инертен, что литий один из немногих элементов, с которыми он реагирует в комнате температура.
| 6 Li ( с ) | + | N 2 ( г ) | 2 Li 3 Н ( с ) |
Несмотря на то, что молекула N 2 является
инертные, соединения, содержащие азот, существуют практически
каждый элемент периодической таблицы, кроме элементов группы VIIIA
(Он, Не, Ар и т. Д.).Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным, чем
температура повышается. При высоких температурах азот реагирует с
водород с образованием аммиака и кислородом с образованием оксида азота.
Д.).Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным, чем
температура повышается. При высоких температурах азот реагирует с
водород с образованием аммиака и кислородом с образованием оксида азота.
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) | |
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) |
Во-вторых, ряд катализаторов, встречающихся в природе, преодолевают инертность N 2 при низких температурах.
Синтез Аммиак
Трудно представить живую систему, которая не
содержат азот, который является важным компонентом
белки, нуклеиновые кислоты, витамины и гормоны, которые делают жизнь
возможный. Животные забирают необходимый им азот из растений
или других животных в их рационе. Растения должны собирать свои
азота из почвы или абсорбировать его как N 2 из
Атмосфера.Концентрация азота в почве достаточно высока.
маленький, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«исправить» N 2 крайне важно.
Животные забирают необходимый им азот из растений
или других животных в их рационе. Растения должны собирать свои
азота из почвы или абсорбировать его как N 2 из
Атмосфера.Концентрация азота в почве достаточно высока.
маленький, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«исправить» N 2 крайне важно.
Хотя 200 миллионов тонн NH 3 производит азотфиксации каждый год, растения сами по себе не могут уменьшить N 2 к NH 3 . Эта реакция осуществляется сине-зеленые водоросли и бактерии, связанные с определенными растения.Наиболее понятный пример азотфиксации включает: бактерии ризобий, обнаруженные в корневых клубеньках бобовых, таких как клевер, горох и фасоль. Эти бактерии содержат нитрогеназу. фермент, который способен замечательно восстанавливать N 2 из атмосферы в NH 3 при комнатной температуре.
Аммиак сначала производят в промышленных масштабах. Разработан между 1909 и 1913 годами Фрицем Габером. В Haber
процесс , смесь N 2 и H 2 пропускают газ при давлении от 200 до 300 атм и от 400 до 600 o C
катализатор из мелкодисперсного металлического железа.
Разработан между 1909 и 1913 годами Фрицем Габером. В Haber
процесс , смесь N 2 и H 2 пропускают газ при давлении от 200 до 300 атм и от 400 до 600 o C
катализатор из мелкодисперсного металлического железа.
| Fe | |||||
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) |
Почти 20 миллионов тонн NH 3 производится в Соединенные Штаты каждый год этим процессом.Около 80% этого стоит более 2 миллиардов долларов используется для производства удобрений для растений, которые не может исправить азот из атмосферы. Исходя из веса, аммиак — второй по важности промышленный химикат в Соединенные Штаты. (Только серная кислота производится в больших количества.)
Две трети аммиака, используемого для производства удобрений, перерабатывается. в твердые вещества, такие как нитрат аммония, NH 4 NO 3 ; фосфат аммония, (NH 4 ) 3 PO 4 ; сульфат аммония, (NH 4 ) 2 SO 4 ; а также мочевина, H 2 NCONH 2 .Другая треть применяется непосредственно в почву как безводный (буквально, «без воды») аммиак. Аммиак — это газ в комнате температура. С ним можно обращаться как с жидкостью при растворении в вода с образованием водного раствора. В качестве альтернативы это может быть охлаждается до температуры ниже -33 o C, в этом случае газ конденсируется с образованием безводной жидкости NH 3 ( л ).
Синтез Азотная кислота
NH 3 , произведенный по технологии Габера, не используется как удобрение, сжигается в кислороде для производства азота окись.
| 4 NH 3 ( г ) | + | 5 О 2 ( г ) | 4 НЕТ ( г ) | + | 6 H 2 O ( г ) |
Оксид азота или оксид азота, как раньше было известно, является бесцветный газ, который быстро реагирует с кислородом с образованием азота диоксид, темно-коричневый газ.
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) |
Двуокись азота растворяется в воде с образованием азотной кислоты и НЕТ, который можно уловить и переработать.
| 3 НЕТ 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) | + | НЕТ ( г ) |
Таким образом, с помощью трехэтапного процесса, разработанного Фридрихом Оствальдом в 1908 г. аммиак можно превратить в азотную кислоту.
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НЕТ ( г ) | + | 6 H 2 O ( г ) | |
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НЕТ 2 ( г ) | |||
| 3 НЕТ 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) | + | НЕТ ( г ) |
Процесс Габера для синтеза аммиака в сочетании с процесс Оствальда для преобразования превращение аммиака в азотную кислоту произвело революцию в индустрии взрывчатых веществ.Нитраты были важным взрывчатым веществом со времен брата Роджера. Бэкон смешал серу, селитру и порошкообразный уголь, чтобы получить порох 1245.
| 16 KNO 3 ( с ) | + | S 8 ( S ) | + | 24 C ( с ) | 8 К 2 S ( с ) | + | 24 CO 2 ( г ) | + | 8 Н 2 ( г ) | H o = -571.9 кДж / моль N 2 |
До того, как был разработан процесс Оствальда, единственный источник нитраты для использования во взрывчатых веществах — это природные минералы такие как селитра, которая представляет собой смесь NaNO 3 и KNO 3 . Как только надежный запас азотной кислоты стал доступен из Оствальда, ряд нитратов может быть использован в качестве взрывчатые вещества. Объединение NH 3 из процесса Габера с HNO 3 из процесса Оствальда, например, дает аммиачная селитра, которая является одновременно отличным удобрением и дешевое и надежное взрывчатое вещество, обычно используемое в порохе.
| 2 NH 4 НЕТ 3 ( с ) | 2 Н 2 ( г ) | + | O 2 ( г ) | + | 4 H 2 O ( г ) |
Разрушающая сила аммиачной селитры составляет видно на фотографиях федерального здания им. Альфреда П. Мурры. в Оклахома-Сити, который был разрушен бомбой, сделанной из аммиачная селитра 19 апреля 1995 г.
Средний Номера окисления
Азотная кислота (HNO 3 ) и аммиак (NH 3 ) представляют собой максимальное (+5) и минимальное (-3) степени окисления для азот. Азот также образует соединения при каждом окислении. число между этими крайними значениями (см. таблицу ниже).
Общие числа окисления азота
| Окисление Число | Примеры | |
| -3 | NH 3 , NH 4 + , NH 2 — , Mg 3 N 2 | |
| -2 | N 2 H 4 | |
| -1 | NH 2 OH | |
| -1/3 | NaN 3 , HN 3 | |
| 0 | N 2 | |
| +1 | N 2 O | |
| +2 | НЕТ, N 2 O 2 | |
| +3 | HNO 2 , NO 2 — , N 2 O 3 , НЕТ + | |
| +4 | НЕТ 2 , N 2 O 4 | |
| +5 | HNO 3 , NO 3 — , N 2 O 5 |
отрицательный Число окисления азота кроме -3
Примерно в то время, когда Хабер разработал процесс изготовления аммиак и Оствальд разработали процесс преобразования аммиака в азотную кислоту, Рашиг разработал процесс, в котором ион гипохлорита (OCl — ) для окисления аммиака с образованием гидразин, N 2 H 4 .
| 2 NH 3 ( водн. ) | + | OCl — ( водн. ) | N 2 H 4 ( водн. ) | + | Класс — ( водн. ) | + | H 2 O ( л ) |
Эту реакцию можно понять, отметив, что OCl — ион — двухэлектронный окислитель.Потеря пары электронов и пары ионов H + соседними NH 3 молекулы образуют пару высокореакционных NH 2 молекулы, которые будут объединяться, чтобы сформировать молекулу гидразина как показано на рисунке ниже.
Гидразин — бесцветная жидкость со слабым запахом аммиака. которые могут быть собраны, когда этот раствор нагревается до N 2 H 4 отгоняется из реакционной колбы.Многие физические Свойства гидразина аналогичны свойствам воды.
| H 2 O | N 2 H 4 | |||
| Плотность | 1.000 г / см 3 | 1.008 г / см 3 | ||
| Точка плавления | 0,00 или С | 1,54 o С | ||
| Температура кипения | 100 o C | 113,8 o С |
Существует значительная разница между химическим свойства этих соединений, однако.Гидразин горит при воспламеняется на воздухе с образованием газообразного азота, водяного пара и большого количества количество энергии.
| N 2 H 4 ( л ) | + | O 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) | H o = -534.3 кДж / моль N 2 H 4 |
В основном гидразин используется в качестве ракетного топлива. это уступает только жидкому водороду по количеству килограмм тяги на килограмм сожженного топлива. Гидразин имеет ряд преимуществ перед жидким H 2 , тем не мение. Его можно хранить при комнатной температуре, тогда как жидкий водород необходимо хранить при температуре ниже -253 o C. Гидразин также более плотный, чем жидкий H 2 и поэтому требуется меньше места для хранения.
Чистый гидразин редко используется в качестве ракетного топлива, поскольку он замерзает при температурах, встречающихся в верхних слоях атмосферы. Гидразин смешивают с N, N -диметилгидразином, (CH 3 ) 2 NNH 2 , образовывать раствор, который остается жидким при низких температурах. Смеси гидразина и N, N -диметилгидразина были использовались для заправки ракет Titan II, которые несли Project Gemini космический аппарат, а также реакция производных гидразина с N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют космический шаттл для маневра в космосе.
Продукт сгорания гидразина необычный. Когда соединения углерода горят, углерод окисляется до CO 2 . При горении соединений серы образуется SO 2 . Когда гидразин сжигается, продукт реакции N 2 из-за необычайно прочной тройной связи азот-азот в молекула N 2 .
| N 2 H 4 ( л ) | + | O 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) |
Гидразин реагирует с азотистой кислотой (HNO 2 ) с образованием азид водорода, HN 3 , в котором атом азота формально имеет степень окисления — 1 / 3 .
| N 2 H 4 ( водн. ) | + | HNO 2 ( водн. ) | HN 3 ( водн. ) | + | 2 H 2 O ( л ) |
Чистый азид водорода — чрезвычайно опасное вещество. Четный с разбавленными растворами следует обращаться осторожно из-за риска взрывов.Азид водорода лучше всего описать как резонансный гибрид структур Льюиса, показанный на рисунке ниже. В соответствующий азид-ион, N 3 — , является линейным молекула, которая представляет собой резонансный гибрид трех структур Льюиса.
| HN 3 | |
| N 3 — |
Положительно Числа окисления азота: галогениды азота
Фтор, кислород и хлор — единственные элементы. электроотрицательный, чем азот.В результате положительное окисление количества азота находятся в соединениях, которые содержат один или больше этих элементов.
Теоретически N 2 может реагировать с F 2 на образуют соединение с формулой NF 3 . На практике N 2 слишком инертен, чтобы проходить эту реакцию при комнатной температуре. NF 3 получается реакцией аммиака с F 2 в присутствии катализатор на основе металлической меди.
| Cu | ||||||
| NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 HF ( г ) |
HF, образующийся в этой реакции, соединяется с аммиаком с образованием фторид аммония.Общая стехиометрия реакции составляет поэтому написано так.
| Cu | ||||||
| 4 NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 NH 4 F ( с ) |
Структура Льюиса NF 3 аналогична структуре Льюиса. Структура Льюиса NH 3 , и две молекулы имеют похожие формы.
Аммиак реагирует с хлором с образованием NCl 3 , который на первый взгляд кажется тесно связанным с NF 3 . Но между этими соединениями есть существенная разница. NF 3 практически инертен при комнатной температуре, тогда как NCl 3 это чувствительная к ударам, взрывоопасная жидкость, которая разлагается до форма N 2 и Cl 2 .
| 2 NCl 3 ( л ) | N 2 ( г ) | + | 3 Класс 2 ( г ) |
Аммиак реагирует с йодом с образованием твердого вещества, представляющего собой комплекс. между NI 3 и NH 3 .Этот материал является предмет популярной, но опасной демонстрации, в которой свежеприготовленные образцы НИ 3 в аммиаке заливают на фильтровальную бумагу, которой дают высохнуть на подставке для колец. После аммиак испаряется, NH 3 / NI 3 кристаллы касаются пером, прикрепленным к метровой палочке, в результате взрыва этого чувствительного к удару твердого тела, которое разлагается с образованием смеси N 2 и I 2 .
| 2 NI 3 ( с ) | N 2 ( г ) | + | 3 I 2 ( г ) |
Положительно Числа окисления азота: оксиды азота
Структуры Льюиса для семи оксидов азота с окислением числа от +1 до +5 приведены в Таблица ниже.
Все эти соединения имеют две общие черты: они содержат N = O двойные связи, и они менее стабильны, чем их элементы в газовой фазы, как показано данными об энтальпии образования в Таблица ниже.
Данные по энтальпии образования оксидов азота
| Соединение | H o f (кДж / моль) | |
| N 2 O ( г ) | 82.05 | |
| НЕТ ( г ) | 90,25 | |
| НЕТ 2 ( г ) | 33,18 | |
| N 2 O 3 ( г ) | 83,72 | |
| N 2 O 4 ( г ) | 9.16 | |
| N 2 O 5 ( г ) | 11,35 |
Оксид диазота, N 2 O, также известный как закись азота, может быть получена осторожным разложением аммония нитрат.
| 170 до 200 o C | ||||
| NH 4 НЕТ 3 ( с ) | N 2 O ( г ) | + | 2 H 2 O ( г ) |
Закись азота — бесцветный газ со сладким запахом, наиболее известный нехимики как «веселящий газ».»Еще в 1800 г. Хамфри Дэви отметил, что N 2 O, вдыхаемый в относительно в небольших количествах, часто вызывает состояние явного опьянения сопровождается судорожным смехом или плачем. Когда принято в больших дозах закись азота обеспечивает быстрое и эффективное облегчение от боли. Таким образом, N 2 O был использован в качестве первого анестетик. Поскольку для анестезии необходимы большие дозы, и продолжительное воздействие газа может быть фатальным, N 2 O is используется сегодня только для относительно коротких операций.
Закись азота имеет несколько других интересных свойств. Первый, хорошо растворяется в сливках; по этой причине он используется как пропеллент в дозаторах для взбитых сливок. Во-вторых, хотя это так не гореть сам по себе, это лучше, чем воздух при поддержке возгорание других предметов. Это можно объяснить, отметив, что N 2 O может разлагаться с образованием атмосферы, которая одна треть O 2 по объему, тогда как нормальный воздух составляет только 21% кислород по объему.
| 2 Н 2 O ( г ) | 2 Н 2 ( г ) | + | O 2 ( г ) |
Уже много лет окончания — ous и — ic использовались для различения самого низкого и самого высокого в паре степени окисления. N 2 O — закись азота, поскольку степень окисления азота +1.NO оксид азота потому что степень окисления азота +2.
Огромные количества оксида азота или оксида азота генерируется каждый год реакцией между N 2 и O 2 в атмосфере, катализируемая ударом молния, проходящая через атмосферу или горячие стены двигатель внутреннего сгорания.
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) |
Одна из причин понижения степени сжатия автомобильных двигателей в последние годы является снижение температуры реакции горения, тем самым уменьшая количество NO выбрасывается в атмосферу.
NO можно получить в лаборатории путем реакции металлической меди. с разбавленной азотной кислотой .
| 3 Cu ( с ) | + | 8 HNO 3 ( водн. ) | 3 Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ ( г ) | + | 4 H 2 O ( л ) |
Молекула NO содержит нечетное количество валентных электронов.В результате невозможно написать структуру Льюиса для этого молекула, в которой все электроны спарены (см. таблицу оксидов азота). Когда НЕТ газа При охлаждении пары молекул NO соединяются в обратимой реакции образуют димер (от греч. «два частей «), с формулой N 2 O 2 , в в котором все валентные электроны спарены, как показано в таблице оксидов азота.
NO быстро реагирует с O 2 с образованием диоксида азота (когда-то известный как перекись азота), который представляет собой темно-коричневый газ при температуре комнатная температура.
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НЕТ 2 ( г ) |
NO 2 можно приготовить в лаборатории путем нагревания. определенные нитраты металлов до их разложения.
| 2 Pb (NO 3 ) 2 ( с ) | 2 PbO ( с ) | + | 4 НЕТ 2 ( г ) | + | O 2 ( г ) |
Его также можно получить путем реакции металлической меди с концентрацией азотная кислота,
| Cu ( с ) | + | 4 HNO 3 ( водн. ) | Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ 2 ( г ) | + | 2 H 2 O ( л ) |
NO 2 также имеет нечетное количество электронов и следовательно, содержит по крайней мере один неспаренный электрон в своей льюисовской конструкции.NO 2 димеризуется при низких температурах с образованием N 2 O 4 молекул, в которых все электроны являются парными, как показано в таблице оксидов азот.
Смеси NO и NO 2 при охлаждении объединяются с образованием триоксид диазота, N 2 O 3 , который является синим жидкость. Образование голубой жидкости при НЕТ или НЕТ 2 охлаждается поэтому подразумевает наличие хотя бы небольшого часть другого оксида, потому что N 2 O 2 и N 2 O 4 оба бесцветны.
Путем осторожного удаления воды из концентрированной азотной кислоты при низкие температуры с дегидратирующим агентом мы можем образовать диазот пятиокись.
| 4 HNO 3 ( водн. ) | + | P 4 O 10 ( с ) | 2 N 2 O 5 ( с ) | + | 4 HPO 3 ( с ) |
N 2 O 5 — бесцветное твердое вещество, которое разлагается на свету или при нагревании до комнатной температуры.Как мог и следовало ожидать, N 2 O 5 растворяется в воде до образуют азотную кислоту.
| N 2 O 5 ( с ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) |
Химия Фосфор
Фосфор — первый элемент, открытие которого можно проследить одному человеку.В 1669 году в поисках пути к конвертировать серебро в золото, Hennig Brand получил белый восковой твердое вещество, которое светилось в темноте и спонтанно вспыхнуло пламенем при контакте с воздухом. Бренд создал это вещество путем испарения воды из мочи и позволяя черному остатку разлагаться на несколько месяцев. Затем он смешал этот остаток с песком, нагрел это смесь в присутствии минимального количества воздуха и собрана под вода летучие продукты, которые вышли из реакции колба.
Фосфор образует ряд соединений, являющихся прямыми аналогами азотсодержащих соединений. Однако тот факт, что элементарный азот практически инертен при комнатной температуре, тогда как элементарный фосфор может самопроизвольно загореться при контакте с воздухом показывает, что есть различия между эти элементы тоже. Фосфор часто образует соединения с те же степени окисления, что и аналогичные соединения азота, но с разными формулами, как показано в таблице ниже.
Соединения азота и фосфора с Те же числа окисления, но разные формулы
| Число окисления | Соединение азота | Фосфорное соединение | ||
| 0 | N 2 | п. 4 | ||
| +3 | HNO 2 (азотистая кислота) | H 3 PO 3 (фосфористая кислота) | ||
| +3 | N 2 O 3 | П 4 О 6 | ||
| +5 | HNO 3 (азотная кислота) | H 3 PO 4 (фосфорная кислота) | ||
| +5 | NaNO 3 (нитрат натрия) | Na 3 PO 4 (фосфат натрия) | ||
| +5 | N 2 O 5 | П 4 О 10 |
Те же факторы, которые объясняют разницу между серой и кислород можно использовать для объяснения различий между фосфор и азот.
1. Тройные связи азот-азот намного прочнее, чем тройные связи фосфор-фосфор.
2. Одинарные связи P-P прочнее одинарных связей N-N.
3. Фосфор ( EN = 2,19) намного меньше электроотрицательна, чем азот ( EN = 3,04).
4. Фосфор может расширять свою валентную оболочку, удерживая более восемь электронов, но не азот.
Эффект Различия в прочности одиночной и тройной связи
Отношение радиусов атомов фосфора и азота равно такое же, как отношение радиусов атомов серы и кислорода, в пределах экспериментальная ошибка.
В результате тройные связи фосфор-фосфор значительно слабее, чем тройные связи азот-азот, по той же причине что двойные связи S = S слабее, чем двойные связи O = O фосфора атомы слишком велики, чтобы подходить достаточно близко друг к другу, чтобы образовать прочные облигации.
Каждый атом в молекуле N 2 завершает свой октет валентных электронов, разделяя три пары электронов с один соседний атом. Поскольку фосфор не образует прочных кратные связи с собой, элементарный фосфор состоит из тетраэдрические P 4 молекул, в которых каждый атом образует одинарные связи с тремя соседними атомами, как показано на рисунке ниже.
Фосфор — белое твердое вещество с восковым оттенком, которое плавится при 44,1 o C и закипает при 287 o C. производится путем восстановления фосфата кальция углеродом в присутствии кремнезем (песок) при очень высоких температурах.
| 2 Ca 3 (PO 4 ) 2 ( с ) | + | 6 SiO 2 ( с ) | + | 10 C ( с ) | 6 CaSiO 3 ( с ) | + | П 4 ( с ) | + | 10 CO ( г ) |
Белый фосфор хранится под водой, потому что элемент самопроизвольно воспламеняется в присутствии кислорода при температура лишь немного выше комнатной.Хотя фосфор нерастворим в воде, хорошо растворяется в углероде дисульфид. Решения P 4 в CS 2 являются достаточно стабильный. Как только CS 2 испарится, однако фосфор воспламеняется.
Валентный угол P-P-P в тетраэдрической молекуле P 4 составляет всего 60 o . Этот очень маленький угол дает значительное количество штамма в молекуле P 4 , что можно уменьшить, разорвав одну из связей P-P.Таким образом, фосфор образует другие аллотропы, открывая P 4 тетраэдр. Когда белый фосфор нагревается до 300 o C, одна связь внутри каждого тетраэдра P 4 разорвана, и P 4 молекулы соединяются вместе, образуя полимер (от греческого pol — «многие» и meros , «части») со структурой, показанной на рисунке ниже. Этот аллотроп фосфора темно-красный, и его присутствие в небольшие следы часто придают белому фосфору светло-желтый цвет.Красный фосфор более плотный (2,16 г / см 3 ), чем белый фосфор (1,82 г / см 3 ) и гораздо менее реакционноспособен при нормальные температуры.
Эффект Различия в сильных сторонах двойных облигаций P = X и N = X
Размер атома фосфора также влияет на его способность образовывать двойные связи с другими элементами, такими как кислород, азот, и сера.В результате фосфор имеет тенденцию образовывать соединения, которые содержат две одинарные связи P-O, где азот образует N = O двойная связь. Азот образует нитрат, NO 3 — , ион, например, у которого степень окисления +5. Когда фосфор образует ион с такой же степенью окисления, это фосфат, PO 4 3-, ион, как показано на рисунок ниже.
Аналогичным образом азот образует азотную кислоту HNO 3 , которая содержит двойную связь N = O, тогда как фосфор образует фосфорную кислота, H 3 PO 4 , содержащая одиночный P-O облигации, как показано на рисунке ниже.
Эффект Различия в электроотрицательности фосфора и азота.
Разница между электроотрицательностями фосфора и азот ( EN = 0,85) такой же, как разница между электроотрицательностями серы и кислорода ( EN = 0,86), в пределах ошибки эксперимента. Потому что меньше электроотрицательный, фосфор более склонен, чем азот, к показывают положительную степень окисления.Наиболее важное окисление числа для фосфора -3, +3 и +5 (см. таблицу ниже).
Общее число окисления фосфора
| Окисление Число | Примеры | |
| -3 | Ca 3 P 2 , PH 3 | |
| +3 | PF 3 , P 4 O 10 , H 3 PO 3 | |
| +5 | PF 5 , P 4 O 10 , H 3 PO 4 , ПО 4 3- |
Поскольку он более электроотрицателен, чем большинство металлов, фосфор реагирует с металлами при повышенных температурах с образованием фосфиды, у которых степень окисления -3.
| 6 Ca ( с ) | П 4 ( с ) | 2 Ca 3 P 2 ( с ) |
Эти фосфиды металлов реагируют с водой с образованием ядовитый, высокореактивный, бесцветный газ, известный как фосфин (PH 3 ), который имеет самый отвратительный запах, с которым столкнулись авторы.
| Ca 3 P 2 ( с ) | + | 6 H 2 O ( л ) | 2 PH 3 ( г ) | + | 3 Ca 2+ ( водн. ) | + | 6 ОН — ( водн. ) |
Образцы фосфорного аналога аммиака РН 3 , часто загрязнены следами P 2 H 4 , фосфорный аналог гидразина.Как будто токсичность и запах PH 3 было недостаточно, смеси PH 3 и P 2 H 4 самопроизвольно загорелся в наличие кислорода.
Соединения (например, Ca 3 P 2 и PH 3 ) в которых фосфор имеет отрицательную степень окисления, далеко превосходит количество соединений, в которых степень окисления фосфор положительный. Фосфор горит в О 2 до производят P 4 O 10 в реакции, которая выделяет необычайное количество энергии в виде тепла и света.
| P 4 ( с ) | + | 5 О 2 ( г ) | P 4 O 10 ( с ) | H o = -2985 кДж / моль P 4 |
Когда фосфор горит в присутствии ограниченного количества O 2 , Произведено П 4 О 6 .
| P 4 ( с ) | + | 3 O 2 ( г ) | P 4 O 6 ( с ) | H o = -1640 кДж / моль P 4 |
P 4 O 6 состоит из тетраэдра, в котором атом кислорода вставлен в каждую связь P-P в P 4 молекула (см. рисунок ниже).P 4 O 10 имеет аналогичная структура, с дополнительным атомом кислорода, связанным с каждым четырех атомов фосфора.
P 4 O 6 и P 4 O 10 реагировать с водой с образованием фосфористой кислоты, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 соответственно.
| P 4 O 6 ( с ) | + | 6 H 2 O ( л ) | 4 H 3 PO 3 ( водн. ) | |
| P 4 O 10 ( с ) | + | 6 H 2 O ( л ) | 4 H 3 PO 4 ( водн. ) |
P 4 O 10 имеет такое высокое сродство к воде что он обычно используется как обезвоживающий агент.Фосфор кислота, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 , являются примерами большого класса оксикислот фосфора. Льюис структуры для некоторых из этих оксикислот и связанных с ними оксианионов приведены в таблице ниже.
Эффект Различия в способности фосфора и азота расширяться Их валентная оболочка
Реакция между аммиаком и фтором останавливается при NF 3 поскольку азот использует 2 s , 2 p x , 2 p y и 2 p z орбиталей для удержания валентных электронов.Следовательно, атомы азота могут иметь максимум восемь валентностей. электроны. Фосфор, однако, имеет пустое 3 d атомных атомов. орбитали, которые можно использовать для расширения валентной оболочки, чтобы удерживать 10 или больше электронов. Таким образом, фосфор может реагировать с фтором с образованием образуют как PF 3 , так и PF 5 . Фосфор может даже образуют ион ПФ 6 — , в котором 12 валентные электроны на центральном атоме, как показано на рисунке ниже.
по неорганической химии — Почему максимальная ковалентность азота равна 4?
Напомним, что ковалентность — это количество общих электронных пар, образованных атомом этого элемента. Максимальная ковалентность азота действительно составляет 4 доллара. И нет, , а не разбивает свою единственную пару.
Приведу простой пример. Взгляните на структуру Льюиса иона аммония:
.( источник )
Обратите внимание, что октет азота завершен, как только он связывается с тремя атомами $ \ ce {H} $ (иначе образует аммиак).Четвертая ковалентная связь на самом деле представляет собой ковалентную связь с координатами , образованную, когда неподеленная пара этого атома азота передается протону.
Это также максимальная ковалентность для атома азота, поскольку у него больше нет неспаренных электронов, которые можно было бы спарить с другими атомами, чтобы образовать больше ковалентных связей.
Домашнее задание: Теперь вы можете определить максимальную ковалентность старшего брата азота, кислорода?
Осторожно: впереди дополнительные вещи , это поможет тем, у кого знания выше уровня средней школы.Если у вас уровень средней школы или ниже, вернитесь домой и поиграйте со своей кошкой.
После размышлений: Валентность — бесполезный термин, который не поможет вам заниматься какой-либо химией. В разных источниках это определяется по-разному (два определения в Википедии). Это просто помогает заполнить школьные учебники большим количеством страниц, но становится неуместным с введением более подходящих терминов, таких как координационное число, которое на самом деле кое-что говорит вам о структуре молекулы. Хотя «валентность» может быть полезна на начальном курсе для начинающих при схватывании, у этой точки зрения есть ограничения.
Вот пример такого противоречия. Вы можете ожидать, что элементы периода 3 $ и выше будут демонстрировать более высокую ковалентность. Один из таких примеров — фосфор. Хотя он принадлежит к той же группе, что и азот, он может образовывать соединения типа $ \ ce {PCl5} $, (по-видимому) вместо этого увеличивая свою максимальную ковалентность до $ 5 $. Причины этого обычно приписываются гипервалентности / октетному расширению, но это неправильных и устаревших концепций , которые были вытеснены более новыми концепциями. Фактически, $ \ ce {P} $ по-прежнему имеет ковалентность , равную четыре в $ \ ce {PCl5} $, поскольку существует только четыре общих пары электронов (несвязывающие электроны не учитываются).Это подтверждает идею о том, что координационные числа — лучший и более полезный термин, чем валентность. ($ \ ce {P} $ теперь имеет координационное число $ 5 $ в $ \ ce {PCl5} $)
Формальных зарядов в органической химии
Прежде чем перейти к Формальным зарядам , давайте вспомним валентность элементов в органической химии. Валентность — это склонность элементов к созданию определенного количества облигаций.
Взгляните на эти молекулы и попытайтесь найти схему связи для каждого элемента:
Мы замечаем, что углерод имеет четыре связи в каждой молекуле, кислород имеет два , азот — три галогена и вместе с водородом , как правило, имеют только одну связь .Таким образом, это валентность тех атомов, которые, говоря простыми словами, представляют собой число связей , которые данный элемент образует чаще всего .
Это не означает, например, что углерод никогда не может иметь менее четырех связей или кислород никогда не будет связываться более чем с двумя атомами. Однако валентность указывает на количество связей, которые любит образовывать каждый элемент. Ниже приведена диаграмма, показывающая валентность углерода, азота, кислорода, галогенов и водорода.
Запомните эти числа! Они очень помогут вам сэкономить время при рисовании правильных органических структур и определении того, является ли структура Льюиса неправильной / неполной.
Формальные заряды — это количественные и качественные показатели того, насколько данный элемент отклоняется от своей стандартной валентности. Например, атом углерода с тремя связями, скорее всего, будет заряжен положительно, поскольку обычно он имеет четыре связи, а поскольку связи состоят из электронов, их уменьшение указывает на слабый отрицательный заряд.
В более математическом определении формальный заряд — это разница между валентными электронами атома и тем, сколько электронов он «владеет» в этой конкретной структуре Льюиса.
Помните, что количество валентных электронов определяется просто согласно номеру группы атома. Следовательно, мы можем легко определить эту разницу.
Например, азот ниже формально имеет отрицательный заряд. Это потому, что он имеет пять валентных электронов, но владеет шестью — двумя неподеленными парами и одним электроном от каждой связи:
Обратите внимание, что неподеленные пары также учитываются при определении количества электронов в атоме.
Мы упоминали выше, что иногда структуры Льюиса могут быть неправильными или неполными . Это может быть потому, что атомы неправильно соединены или / и электроны не распределены так, как должны быть в соответствии с валентностью элементов.
Например, ниже представлена неполная структура Льюиса метоксида иона :
Мы только что упомянули, что эта структура является ионом, но где заряд — это углерод, водород, или кислород? А что такое заряд — положительный, отрицательный?
Теперь вы не хотите тратить целый день на определение формального платежа за структуру.Вместо этого сосредоточьтесь на элементах, которые не соответствуют своей валентности. В данном случае это кислород, так как он имеет только одну связь и три неподеленные пары вместо 2 × 2, как указано в таблице.
С другой стороны, заряд не может быть на углероде или водороде, потому что они оба соответствуют своей стандартной валентности. или кислород, но
Формальный заряд кислорода (и вообще) можно рассчитать по следующей формуле:
FC = V — (N + B)
Где:
V — количество валентных электронов
N — количество несвязывающих электронов
B — количество связей
Итак, формальный заряд кислорода будет
FC (O) = 6 — (6 + 1) = -1
Это также можно найти в таблице выше: кислород любит иметь две связи с двумя неподеленными парами электронов, и это когда он не имеет формального заряда.Имейте в виду, что в целом атомы не любят заряжаться.
Таким образом, если вам нужно идентифицировать и определить формальный заряд, ищите странный атом, такой как углерод с тремя связями, кислород, не имеющий двух связей и т. Д. Как только вы его заметите, используйте формулу для вычисления формального зарядите или, альтернативно, практикуйтесь, пока ваши глаза не станут естественными для ваших глаз видеть тенденцию к связям и зарядам в органических структурах.
В следующем посте мы поговорим об одиночных ремонтах и о том, как их определить на основе формального начисленного количества облигаций.
1.Укажите любые формальные платежи в структурах ниже:
Проверьте свои ответы
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединяясь к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению проблем, викторин с несколькими вариантами ответов, головоломок, и мощного набора из Краткое учебное пособие по органической химии 1 и 2 .
Solution
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединяясь к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению проблем, викторин с несколькими вариантами ответов, головоломок, и мощного набора из Краткое учебное пособие по органической химии 1 и 2 .
VALENCY — ОБЪЕДИНЕНИЕ МОЩНОСТИ ИЛИ ОБЪЕДИНЕНИЕ МОЩНОСТИ — Freakgenie
Каждый элемент обладает определенной способностью сочетаться с другими элементами.
Комбинирующая способность элемента называется его валентностью ».
Обычно водород имеет 1, кислород 2, азот 3 и углерод 4 валентности. Это будет зависеть от природы элемента.
Прочитать сначала —
Ионы — катионы и анионы
Общие простые и многоатомные ионы
Валентность по комбинации водорода —
Количество атомов водорода, которые объединяются с одним атомом элемента, называется объединяющим числом или валентностью элемента.
Например —
- Один атом водорода соединяется с одним атомом хлора с образованием хлористого водорода (HCl), и, таким образом, валентность атома хлора равна единице. Элементы с валентностью, равной единице, называются однолистными .
- Два атома водорода соединяются с одним атомом кислорода с образованием воды (H 2 O), и, таким образом, валентность атома кислорода равна двум. Элементы с валентностью два называются двухвалентными .
- Три атома водорода соединяются с одним атомом азота с образованием аммиака (NH 3 ), и, таким образом, валентность атома азота равна трем.Элементы с валентностью три называются трехвалентными .
- Четыре атома водорода соединяются с одним атомом углерода с образованием метана (CH 4 ), таким образом валентность атома углерода равна четырем. Элементы с валентностью четыре называются четырехвалентными .
- Некоторые элементы (благородные газы или инертные газы, например, гелий, неон, аргон и т. Д.) Обычно не соединяются с другими элементами и, следовательно, имеют нулевую валентность. Такие элементы известны как нулевой валент .
Валентность по валентным электронам —
Число электронов, присутствующих во внешней оболочке элемента, известно как валентных электронов .
Каждый элемент пытается получить стабильную электронную конфигурацию ближайшего благородного газа, теряя / получая или разделяя электроны.
Число электронов, необходимое для потери / получения или совместного использования, чтобы получить стабильную электронную конфигурацию ближайшего благородного газа, придает валентность элемента.
- Элементы из Li в B (период 2) и из Na в Al (период 3) могут легко потерять свои электроны.Здесь валентность равна количеству валентных электронов.
- Валентность металла = Число валентных электронов
- В C и Si четыре валентных электрона и еще четыре электрона необходимы для завершения октета. Поскольку для получения или потери четырех электронов требуется большое количество энергии, такие элементы предпочитают разделение четырех электронов. Таким образом, валентность этих элементов равна четырем.
- Начиная с N и P, за исключением благородных газов, эти элементы предпочитают приобретение электронов, поскольку они не могут потерять так много электронов из-за соображений энергии.Таким образом, валентность для таких элементов может быть определена как:
Валентность неметалла = 8 — количество валентных электронов - Благородные газы полностью заполнены октетом. Таким образом, они не образуют связи. Таким образом, валентность таких элементов равна нулю.
- У водорода на орбите только один валентный электрон. Следовательно, он показывает тенденцию либо отдавать свой электрон, либо делиться им. Следовательно, его валентность одна.
Иногда элемент имеет более одной валентности.Это означает, что элемент имеет переменных валентностей. Например, азот образует несколько оксидов — N 2 O, N 2 O 2 , N 2 O 3 , N 2 O 4 и N 2 O 5 . Если взять валентность кислорода 2, то валентность азота в этих оксидах будет 1,2,3,4 и 5 соответственно.
Не пропустите —
Задачи, основанные на законе сохранения массы
Закон определенных пропорций / Постоянный состав
Задачи, основанные на законе определенных пропорций или постоянного состава
Mole Concept — Значение и формулы
Задачи / Численные значения на основе Mole Concept
Валентность ионов —
- Заряд иона представляет валентность иона.Катион имеет положительный заряд, поэтому он имеет положительную валентность, а анион имеет отрицательный заряд, поэтому он имеет отрицательную валентность.
- Если ион имеет единичный заряд, его валентность равна 1, и этот ион называется одновалентным ионом . Одновалентный катион имеет валентность +1, а одновалентный анион — валентность -1.
- Моновалентный катион —
H + ион водорода
Na + ион натрия
K + ион калия
Ag + ион серебра
Cu + ион меди (I) или ион меди
Li + ион лития
Nh5 + ион аммония
Hg + ион ртути (I) или ион ртути - Моновалентный анион —
CN — цианид
OH — гидроксид
Cl — хлорид
F — фторид
Br — бромид
I — H иодид 9 гидрид
NO 2 — нитрит
NO 3 — нитрат
HCO 3 — гидрокарбонат (бикарбонат)
HSO 4 — гидросульфат (бисульфат)
HSO 3 — гидросульфит (бисульфит)
MnO 4 — перманганат
ClO 3 — хлорат
- Если у иона два заряда, его валентность равна 2, и этот ион называется двухвалентным ионом .Двухвалентный катион имеет валентность +2, а двухвалентный анион — валентность -2.
Двухвалентный катион —
Mg +2 ион магния
Ca +2 ион кальция
Ba +2 ион бария
Zn +2 ион цинка
Cu +2 меди (II) ион или ион меди
Fe +2 ион железа (II) или двухвалентного железа
Hg +2 ион ртути (II) или ион ртути
Двухвалентный анион —
O -2 оксид-ион
CO 3 -2 карбонат-ион
SO 3 -2 сульфит-ион
S -2 сульфид-ион
HPO 4 -2 гидрофосфат-ион
SO 4 -2 сульфат-ион - Если ион имеет заряд трех единиц, его валентность равна 3, и этот ион называется трехвалентным ионом .Трехвалентный катион имеет валентность +3, а трехвалентный анион — валентность -3.
Трехвалентный катион —
Al +3 Ион алюминия
Fe +3 Ион железа (III) или трехвалентного железа
Cr +3 Ион хрома
Трехвалентный анион —
N -3 нитрид-ион
PO 4 -3 фосфат-ион
P -3 фосфид-ион - Если у иона четыре единицы заряда, его валентность равна 4, и этот ион называется четырехвалентным ионом .Четырехвалентный катион имеет валентность +4, а четырехвалентный анион имеет валентность -4.
Четырехвалентный катион
Pb +4 ион свинца
Pt +4 ион платины
Четырехвалентный анион —
C — 4 16 карбид-ион
Подробнее —
Что такое материя? Каковы его характеристики?
Состояния Материи
Закон сохранения массы
Читать далее —
ХИМИЧЕСКИЕ ФОРМУЛЫ ПРОСТОГО СОЕДИНЕНИЯ
Как это:
Нравится Загрузка…
СвязанныеСтруктура Льюиса NO2, молекулярная геометрия, гибридизация, полярность и диаграмма MO
Кто не слышал о NO2, диоксиде азота?
Это одна из наиболее распространенных газообразных молекул красновато-коричневого оттенка. Его можно охладить и спрессовать до желтовато-коричневой жидкости для транспортировки и транспортировки.
NO2 — высокотоксичное ядовитое химическое соединение, является основным загрязнителем воздуха и относится к группе оксидов азота.
Это химическое вещество можно использовать для отбеливания и стерилизации.
Применяется в табачной промышленности и производстве взрывчатых веществ. NO2 действует как промежуточный продукт при производстве кислоты HNO3, а также как окислитель топлива в ракетах и космических зондах.
Ниже приведены лабораторные методы получения диоксида азота.
Структура Льюиса
Краткое введение
Внутри атома у нас есть положительно заряженное ядро, окруженное электронами в их оболочках, образующих отрицательно заряженное облако.
Электроны во внешней оболочке, определяющие валентность, известны как валентные электроны.
Структура Льюиса — это схематическое представление любой данной молекулы с помощью составляющих атомов, а также положения и расположения электронов для образования связей и неподеленных пар.
Это ограниченная теория о природе химической связи и электронной структуре, но обеспечивает простую точку зрения на образование любого молекулярного состава.
Давайте поговорим о построении структуры Льюиса для диоксида азота (NO2).
Структура Льюиса NO2
Молекула диоксида азота состоит из одного атома азота и двух атомов кислорода.
Давайте посмотрим на таблицу Менделеева.
Азот принадлежит к группе 15 (или группе 5) и имеет атомный номер 7, следовательно, имеет валентность 5. Кислород принадлежит к группе 16 (или группе 6) и имеет атомный номер 8, следовательно, валентность 6.
Общее число валентных электронов в NO2 = 5 + 6 * 2
= 17.
Теперь, чтобы выяснить, какой атом будет действовать как центральный, мы должны взглянуть на диаграмму электроотрицательности Полинга.
Азот является наименее электроотрицательным элементом между ними, поэтому центральным атомом будет азот.
Вот как мы поместили азот в центр, окруженный двумя атомами O.
Теперь, с помощью точечных структур, мы окружим атомы их валентными электронами.
Здесь мы следовали правилу октетов.
Правило октета
Знаете ли вы, что элементы, присутствующие в основных группах периодической таблицы, имеют тенденцию образовывать восьмиэлектронное расположение в своей валентной оболочке в соответствии с конфигурациями благородных газов?
Это известно как правило октетов и является важным понятием для наброска наиболее вероятной структуры Льюиса молекулы.
Посмотрите на диаграмму еще раз. Мы уже заставили два атома O достичь конфигурации Неона.
Итак, атом азота окружен всего пятью электронами, а общее количество валентных электронов уже израсходовано.
Чтобы атом азота имел конфигурацию, близкую к октету, мы собираемся сдвинуть два электрона с одного атома O и образовать двойную связь.
Поехали.
Азот теперь имеет 7 электронов и достиг почти октетной конфигурации.
Официальное обвинение
Давайте проверим формальное обвинение.
Официальный заряд O (в одинарной связи с N)
= 6 — 0,5 * 2 — 6 = 6 — 1 — 6 = -1.
Формальный заряд O (в двойной связи с N)
= 6-0.5 * 4-4 = 6-2-4 = 0.
Формальный заряд центрального атома азота
= 5 — 0,5 * 6 — 1 = 5 — 3 — 1 = 1.
Если теперь мы найдем сумму общих формальных сборов, мы получим чистый результат 0.
Следовательно, молекула нейтральна, и элементы присутствуют в своих наименее возможных формальных значениях заряда.
Следовательно, наиболее подходящей структурой Льюиса NO2 является:
Молекулярная геометрия
Давайте посмотрим на некоторые недостатки Lewis Structure:
- Он может предоставлять только двухмерное представление, но не трехмерное.
- Структура Льюиса может говорить только о расположении электронов, но не о том, как они разделены.
- Он может только идентифицировать тип образования связи, но не может подробно описать, как происходит образование связи.
Вот где появляется роль теории VSEPR:
Теория VSEPR
VSEPR расшифровывается как модель отталкивания электронных пар валентной оболочки.
Согласно этой теории, поскольку электроны несут одинаковые заряды («-»), они обязаны испытывать отталкивание, и эта сила отталкивания варьируется в зависимости от связанной и неподеленной пары электронов.
Итак, эту силу отталкивания необходимо минимизировать, чтобы сформировать стабильную или сбалансированную многоатомную молекулярную или ионную структуру.
Таким образом,VSEPR помогает в прогнозировании трехмерной молекулярной геометрии или формы молекулы вместе с валентными углами.
Какова молекулярная геометрия NO2?
В модели VSEPR используется нотация AXnEx.
A обозначает центральный атом, здесь азот (N).
X обозначает окружающие атомы, здесь мы имеем два атома O.
n обозначает количество атомов вокруг центрального элемента, мы имеем значение 2.
E обозначает несвязанные электроны (обычно неподеленную пару), x обозначает число.
Здесь, поскольку у нас есть только один неподеленный электрон, примем его равным 1.
У нас есть обозначение AX2E1.
График VSEPR:
Мы видим, что NO2 имеет изогнутую молекулярную геометрию и угол составляет около 120 градусов.
Но и здесь есть исключения.В NO2 у нас есть 2 пары связей и 1 неподеленный электрон.
Если мы посмотрим на нитрит-ион NO2-, у нас будет 2 пары связей и 1 неподеленная пара электронов.
Там у нас также есть изогнутая структура, но поскольку сила отталкивания имеет порядок LP-LP> LP-BP> BP-BP, порядок углов связи ниже
NO2 +> NO2> NO2- .
Следовательно, валентный угол NO2 составляет около 134 градусов. Длина связи составляет около 1,20 Å.
Гибридизация
Орбитальная гибридизация
Знаете ли вы, что электрон можно описать с помощью его волновой функции?
Нам известна концепция атомных орбиталей, математических функций вероятности, указывающих на присутствие электронов в любом региональном пространстве.
Когда волновые функции атомных орбиталей объединяются или образуют слияние, это приводит к гибридным орбиталям, и этот процесс известен как орбитальная гибридизация.
Гибридизация NO2
Одинарная связь в N-O имеет одну сигма-связь, а двойная связь N = O имеет одну сигма-связь и одну пи-связь. Пи-связь не участвует в гибридизации.
Итак, в NO2 17 валентных электронов, поэтому это нечетная электронная система. Для одноэлектронных частиц у нас есть следующее правило:
Если степень окисления центрального атома окажется положительной, то электрон будет участвовать в процессе гибридизации, но если степень окисления отрицательная, он не будет участвовать.
В диоксиде азота,
Стерический номер = 2 сигма + 1 одиночный электрон.
Центральный N менее электроотрицателен, чем О. Следовательно, заряд на N равен «+».
Итак, степень окисления положительная, и одиночный электрон примет участие в гибридизации.
стерическое no = 2 + 1 = 3. Следовательно, гибридизация NO2 — это sp2 .
Полярность NO2
Что такое полярность?
Полярность — важное химическое понятие.Каждая молекулярная композиция имеет свойство полярности, которое определяет, является ли указанная молекула полярной или неполярной. Это зависит от природы химической связи, которая влияет на форму и геометрию.
Двухатомная однородная молекула, состоящая из одинаковых атомов, всегда дает нулевой дипольный момент и, следовательно, неполярна.
Однако внутри гетерогенной многоатомной молекулы имеется несколько атомных элементов с различными значениями электроотрицательности. Это вызывает частичные заряды на атомах, которые, если их не нейтрализовать, приводят к полярным молекулам.
Также нерегулярность и асимметрия молекул с помощью неподеленных пар и связей вызывают полярность из-за неравномерного распределения зарядов.
Что делает NO2 полярной молекулой?
Азот имеет значение электроотрицательности 3,04, а кислород — 3,44.
Это означает, что между двумя атомными элементами существует разница в электроотрицательности. Хотя разница значительно меньше, мы имеем асимметричную изогнутую молекулярную структуру, которая индуцирует суммарный дипольный момент и в действительности делает NO2 полярной молекулой.
Для получения более подробной информации вам также следует однажды прочитать статью о полярности NO2.
Диаграмма молекулярных орбиталей
(МО)
Пояснение
Электроны могут иметь как частицу, так и волнообразную природу. Теория молекулярных орбиталей — это концепция квантовой механики, которая пытается объяснить химические связи внутри любой молекулы.
В этой теории мы узнаем, что валентные электроны могут быть разделены между всеми составляющими атомами, а атомные орбитали от разных атомов объединяются, образуя молекулярные орбитали (МО).
Здесь мы будем включать определенные термины, такие как антисвязывание, несвязывание и связывающие орбитали. Кроме того, у нас есть концепция HOMO (самая высокая занятая молекулярная орбиталь) и LUMO (самая низкая незанятая молекулярная орбиталь).
Схема МО для NO2
Давайте посмотрим на электронную конфигурацию обоих N&O.
N: 1s2 2s2 2p3
O: 1s2 2s2 2p4 (у нас есть два атома O в NO2)
Шесть электронов, присутствующих на 1s-орбитали, не участвуют в связывании, поэтому будут играть роль несвязывающих орбиталей.
Два электрона 1s2 в атоме азота принимают участие в σ2s МО. Атомы кислорода составляют 2 неподеленные пары каждый.
Оставшиеся электроны на p-орбиталях N и O образуют σ2px, 𝜋2py, 𝜋2pz и σ * 2s.
Заключение
NO2 — одна из самых распространенных гетероядерных двухатомных молекул. В этой статье мы подробно обсудили природу химической связи молекулы.
Мы надеемся, что вы прошли этапы формирования идеальной структуры Льюиса, использования обозначений теории VSEPR для расчета валентных углов и предсказания геометрии молекул, процесса гибридизации, полярности, а также концепции молекулярных орбиталей связи.
Наслаждайтесь!
Может ли азот образовывать двойные связи?
В химии азота преобладает легкость, с которой атомы азота образуют двойные и тройные связи. Нейтральный атом азота содержит пять валентных электронов: 2s2 2p3. Таким образом, атом азота может получить октет валентных электронов, разделив три пары электронов с другим атомом азота. … Двойная связь.
Может ли азот иметь две двойные связи?
NO2 нельзя нарисовать с двумя двойными связями и одной неподеленной парой на центральном атоме N, потому что это нарушает правило октетов.N не может превышать правило октетов, потому что у него нет пустых d-орбиталей, в отличие от многих элементов третьего периода, которые используют свои пустые d-орбитали для размещения большего количества электронов.
Сколько связей может образовывать азот?
три
Какие элементы могут образовывать двойные связи?
Двойные связи характерны для элементов углерода, азота и кислорода периода 2 и реже для элементов более высоких периодов. Металлы также могут участвовать в множественной связи в множественной связи металлического лиганда.
Может ли азот иметь более 3 связей?
Как известно, азот может образовывать 3 связи на основе правила октетов, поскольку он имеет 5 валентных электронов. Это означает, что для этого нужны 3 облигации.
Почему у no2 не может быть двух двойных связей?
Почему азот не образует 2 двойных связи? … Редко азот проявляет четырехвалентность и образует две двойные связи в резонансной структуре, например -N = N = N- НИТРЕН, Ch3 = N = N-ДИАЗОМЕТАН. Эти соединения более реакционноспособны и менее стабильны из-за менее стабильной структуры и легкого удаления наиболее стабильного N2.Молекула.
Может ли азот образовывать 4 связи?
Если вы посмотрите на изображение выше, вы увидите, что когда азот имеет положительный заряд (на один электрон меньше), он может образовывать четыре ковалентные связи. С одинарными, двойными или тройными связями. В этом отношении он похож на фосфор, потому что оба они имеют пять валентных электронов (четыре, когда они имеют положительный заряд).
Почему ковалентность азота равна 4?
Это будет 4 только потому, что N может вместить максимум 8 электронов в своей внешней оболочке.Когда три его 2p-электрона связываются с H, октет становится полностью заполненным. Таким образом, ни более ковалентные связи не могут быть образованы, ни неподеленная пара не может быть разорвана и, таким образом, может быть образована одна координационная связь.
Может ли азот образовывать 5 связей?
Причина, по которой фосфор может образовывать «пять связей», а азот только три или четыре, связана с размером двух атомов. Фосфор может вместить вокруг себя пять атомов фтора; азот не может.
Может ли азот образовывать 5 связей?
Азот не может образовать 5 связей, если не считать 4 ковалентных связи и 1 ионную «связь».Обычно атом азота образует 3 связи, но когда атом азота имеет положительный заряд, у него не хватает электрона, поэтому он может образовать дополнительную четвертую ковалентную связь.
Что сильнее одинарной или двойной связи?
Двойные связи прочнее одинарных, и для них характерно разделение четырех или шести электронов между атомами соответственно. … Двойная связь ограничена вращением, в то время как одинарная связь вращается свободно, поэтому двойная связь сильнее.
Какой элемент никогда не образует двойной связи?
Правило двойной связи гласит, что химические элементы с главным квантовым числом больше 2 для их валентных электронов (элементы с периодом 3 и ниже), как правило, не образуют кратных связей (например,грамм. двойные связи и тройные связи) с собой или с другими элементами.
Как узнать, когда использовать двойные связи?
С точки зрения приоритета, вы захотите использовать двойные связи, чтобы количество электронов соответствовало общему количеству, которое вы должны иметь. Затем возникает необходимость иметь нулевой формальный заряд для каждого атома.
Почему кислород не может образовывать тройную связь?
Кислород не может образовывать тройную связь, потому что даже в его гибридизированных атомных орбитальных формах он никогда не имеет двух доступных p-орбиталей, чтобы образовать тройную…
Почему азот тройная связь?
Азот имеет пять валентных электронов, поэтому для завершения своего октета ему нужны еще три валентных электрона.Атом азота может заполнить свой октет, разделив три электрона с другим атомом азота, образуя три ковалентные связи, так называемую тройную связь. … Фактически, тройная связь в азоте — одна из самых прочных из известных.
Почему азот никогда не может быть пятивалентным?
Азот не имеет вакантных d-орбиталей. Он не может расширить свой октет. Другими словами, он не может иметь более 8 валентных электронов. Следовательно, азот не может быть пятивалентным.
1.4 Представление структуры
Структуры Льюиса представляют валентные электроны атома точками. Используя структуры Льюиса, можно определить, обладают ли какие-либо атомы электронами с неподеленной парой или имеют формальный заряд. Например, вода и гидроксид-ион могут быть представлены структурами Льюиса, как показано ниже.
Валентные электроны, не используемые в связывании, называются несвязывающими электронами или электронами неподеленной пары. Положительный или отрицательный заряд, присвоенный атому, называется формальным зарядом; Молекула воды не имеет формального заряда, но атом кислорода в гидроксид-ионе имеет формальный заряд -1.
Азот имеет пять валентных электронов, и ниже показаны структуры Льюиса аммиака, иона аммония и аниона амида. Ион аммония имеет формальный заряд +1, а амид-анион имеет формальный заряд -1.
Углерод имеет четыре валентных электрона, и структуры Льюиса метана, метильного катиона, метильного аниона и метильного радикала показаны ниже.
Вид, содержащий положительно заряженный атом углерода, называется карбокатионом , а вид, содержащий отрицательно заряженный атом углерода, называется карбанионом .Вид, содержащий атом с одним неспаренным электроном, называется радикалом или свободным радикалом .
Водород имеет один валентный электрон, и каждый галоген (F, Cl, Br, I) имеет семь валентных электронов, поэтому следующие разновидности имеют указанные формальные заряды:
Пара общих электронов также может быть показана как линия между двумя атомами. Водород имеет одну ковалентную связь и не имеет неподеленной пары. Галогены имеют одну ковалентную связь и три неподеленные пары.Кислород воды имеет две ковалентные связи и две неподеленные пары. Азот аммиака имеет три ковалентные связи и одну неподеленную пару. У каждого атома есть полный октет, кроме водорода, который полностью заполнил внешнюю оболочку.
Структуры Кекуле представляют связывающие электроны в виде линий, а электроны неподеленной пары обычно полностью не учитываются, если только они не нужны для построения механизма химической реакции.
Иногда некоторые ковалентные связи в структуре соединения опускаются для упрощения.