Основания. Химические свойства и способы получения. Кислоты и основания Химические свойства оснований взаимодействие с кислотами
Основания представляют собой сложные соединения, включающие два основных структурных компонента:
- Гидроксогруппа (одна или несколько). Отсюда, кстати и второе название этих веществ — «гидроксиды».
- Атом металла или ион аммония (Nh5+).
Название оснований происходит из объединения наименований обоих его компонентов: например, гидроксид кальция, гидроксид меди, гидроксид серебра и т. д.
Единственным исключением из общего правила образования оснований следует считать когда гидроксогруппа присоединяется не к металлу, а к катиону аммония (Nh5+). Это вещество образуется в том случае, когда происходит растворение в воде аммиака.
Если говорить о свойствах оснований, то сразу следует отметить, что валентность гидроксогруппы равна единице, соответственно, количество этих групп в молекуле будет напрямую зависеть от того, какой валентностью обладают вступающие в реакцию металлы.
Химические свойства оснований проявляются в их реакциях с кислотами, солями, другими основаниями, а также в их действии на индикаторы. В частности, щелочи можно определить, если воздействовать их раствором на определенный индикатор. В этом случае он заметно поменяет свою окраску: например, из белой станет синей, а фенолфталеин — малиновым.
Химические свойства оснований, проявляясь в их взаимодействии с кислотами, приводят к знаменитым реакциям нейтрализации. Суть такой реакции в том, что атомы металла, присоединяясь к кислотному остатку, образуют соль, а гидроксогруппа и ион водорода, соединяясь, превращаются в воду. Реакцией нейтрализации эта реакция называется потому, что после нее не остается ни щелочи, ни кислоты.
Характерные химические свойства оснований проявляются и в их реакции с солями. При этом стоит отметить, что с растворимыми солями в реакцию вступают только щелочи.
Наконец, химические свойства оснований прекрасно проявляют себя во время термического воздействия на них — нагревания. Здесь, осуществляя те или иные опыты, стоит иметь в виду, что практически все основания, за исключением щелочей, при нагревании ведут себя крайне неустойчиво. Подавляющее их большинство почти мгновенно распадается на соответствующий оксид и воду. А если взять основания таких металлов, как серебро и ртуть, то в нормальных условиях они не могут быть получены, так как начинают распадаться уже при комнатной температуре.
Общие свойства оснований обусловлены наличием в их растворах иона ОН — , создающего в растворе щелочную среду (фенолфталеин окрашивается в малиновый цвет, метилоранж – в желтый, лакмус – в синий).
1. Химические свойства щелочей:
1) взаимодействие с кислотными оксидами:
2KOH+CO 2 ®K 2 CO 3 +H 2 O;
2) реакция с кислотами (реакция нейтрализации):
2NaOH+ H 2 SO 4 ®Na 2 SO 4 +2H 2 O;
3) взаимодействие с растворимыми солями (только в том случае, если при действии щелочи на растворимую соль выпадает осадок или выделяется газ):
2NaOH+ CuSO 4 ®Cu(OH) 2 ¯+Na 2 SO 4 ,
Ba(OH) 2 +Na 2 SO 4 ®BaSO 4 ¯+2NaOH, KOH(конц. )+NH 4 Cl(крист.)®NH 3 +KCl+H 2 O.
)+NH 4 Cl(крист.)®NH 3 +KCl+H 2 O.
2. Химические свойства нерастворимых оснований:
1) взаимодействие оснований с кислотами:
Fe(OH) 2 +H 2 SO 4 ®FeSO 4 +2H 2 O;
2) разложение при нагревании. Нерастворимые основания при нагревании разлагаются на основный оксид и воду:
Cu(OH) 2 ®CuO+H 2 O
Конец работы —
Эта тема принадлежит разделу:
Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры
Атомно молекулярные учения в химии атом молекула химический элемент моль простые сложные вещества примеры.. теоретическую основу современной химии составляет атомно молекулярное.. атомы мельчайшие химические частицы являющиеся пределом химического..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Получение оснований
1. Получение щелочей:
1) взаимодействие щелочных или щелочноземельных металлов или их оксидов с водой:
Сa+2h3O®Ca(OH)2+H
Получение щелочей:
1) взаимодействие щелочных или щелочноземельных металлов или их оксидов с водой:
Сa+2h3O®Ca(OH)2+H
Номенклатура кислот
Названия кислот производятся от того элемента, от которого образована кислота. При этом в названии бескислородных кислот обычно имеется окончание –водородная: HCl – хлороводородная, HBr – бромоводо
Химические свойства кислот
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н+, образующихся при диссоциации молекул кислоты, таким образом, кислоты – это доноры протонов: HxAn«xH+
Получение кислот
1) взаимодействие кислотных оксидов с водой:
SO3+h3O®h3SO4,
P2O5+3h3O®2h4PO4;
Химические свойства кислых солей
1) кислые соли содержат атомы водорода, способные принимать участие в реакции нейтрализации, поэтому они могут реагировать со щелочами, превращаясь в средние или другие кислые соли – с меньшим числ
Получение кислых солей
Кислую соль можно получить:
1) реакцией неполной нейтрализации многоосновной кислоты основанием:
2h3SO4+Cu(OH)2®Cu(HSO4)2+2H
Основные соли
Основными (гидроксосолями) называются соли, которые образуются в результате неполного замещения гидроксидных ионов основания анионами кислот.
Химические свойства основных солей
1) основные соли содержат гидроксогруппы, которые могут принимать участие в реакции нейтрализации, поэтому они могут реагировать с кислотами, превращаясь в средние соли или в основные соли с меньши
Получение основных солей
Основную соль можно получить:
1) реакцией неполной нейтрализации основания кислотой:
2Cu(OH)2+h3SO4®(CuOH)2SO4+2h3
Средние соли
Средними солями называюся продукты полного замещения Н+-ионов кислоты ионами металлов; они также могут рассматриваться как продукты полного замещения ОН-ионов основания аниона
Номенклатура средних солей
В русской номенклатуре (используемой в технологической практике) существует следующий порядок наименования средних солей: к корню названия кислородсодержащей кислоты прибавляют слово
Химические свойства средних солей
1) Почти все соли являются ионными соединениями, поэтому в расплаве и в водном растворе они диссоциируют на ионы (при пропускании тока через растворы или расплавы солей идет процесс электролиза).
Получение средних солей
Большая часть методов получения солей основана на взаимодействии веществ противоположной природы – металлов с неметаллами, кислотных оксидов с основными, оснований с кислотами (см. таблицу 2).
Строение атома
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Порядковый номер элемента в Периодической таблице элементов равен заряду ядра
Состав атомных ядер
Ядро состоит из протонов и нейтронов.
Количество протонов равно порядковому номеру элемента. Число нейтронов в ядре
равно разности между массовым числом изотопа и по
Электрон
Вокруг ядра вращаются электроны по определенным стационарныморбитам. Двигаясь по своей орбите, электрон не излучает и не поглощает электромагнитную энергию. Излучение или поглощение энергии происхо
Правило заполнения электронных уровней, подуровней элементов
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первог
Максимальное заполнение первых четырех энергетических уровней: для первог
Энергия ионизации, сродства к электрону, электроотрицательность
Энергия ионизации атома. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации I:
Э + I = Э+ + е-
Энергия ионизаци
Ковалентная связь
В большинстве случаев при образовании связи происходит обобществление электронов связываемых атомов. Такой тип химической связи называют ковалентной связью (приставка «ко-» в латинском яз
Сигма и пи связи
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна
Образование ковалентной связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и
Химическая связь и геометрия молекул. BI3, PI3
BI3, PI3
рисунок 3.1Сложение дипольных элементов в молекулах Nh4 и NF3
Полярная и неполярная связь
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании
Ионная связь
Ионная связь– это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования и
Степень окисления
Валентность 1. Валентность — способность атомов химических элементов образовывать определенное число химических связей. 2. Значения валентности изменяются от I до VII (редко VIII). Валент
Водородная связь
Помимо различных гетерополярных и го-меополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водоро
Кристаллические решётки
Итак, кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. При мысленном соединении этих точек линиями получаются простра
При мысленном соединении этих точек линиями получаются простра
Растворы
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода,
Электролитическая диссоциация
Растворы всех веществ можно разделить на две группы: электролиты-проводят электрический ток, неэлектролиты-проводниками не являются. Это деление является условным, потому что все
Механизм диссоциации
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ио
Ионное произведение воды
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Водородный показатель численно ра
Химическая реакция
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаютс
Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаютс
Методы расстановки коэффициентов в ОВР
Метод электронного баланса 1). Записываем уравнение химической реакции KI + KMnO4 → I2 + K2MnO4 2). Находим атомы, изме
Гидролиз
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции (pH) среды.
Суть
Скорость химических реакций
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 – С1) / (t2 — t
Факторы, влияющие на скорость химических реакций
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с
Энергия активации
Столкновение химических частиц приводит к химическому взаимодействию лишь в том случае, если сталкивающиеся частицы обладают энергией, превышающей некоторую определенную величину. Рассмотрим взаимо
Рассмотрим взаимо
Катализ катализатор
Многие реакции можно ускорить или замедлить путем введения некоторых веществ. Добавляемые вещества не участвуют в реакции и не расходуются в ходе ее протекания, но оказывают существенное влияние на
Химическое равновесие
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которы
Принцип Ле Шателье
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию кон
Факторы влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции
Увеличивают скорость
Уменьшают скорость
Наличие химически активных реагентов
Закон Гесса
Пользуясь табличными значениями
Тепловой эффект
В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв — с поглощением энергии, то х
Поскольку образование связи идет с выделением, а ее разрыв — с поглощением энергии, то х
Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH 4 +) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания , которые самопроизвольно разлагаются.
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na 2 O + H 2 O → 2NaOH
При этом оксид меди (II) с водой не реагирует :
CuO + H 2 O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно :
2K 0 + 2H 2 + O → 2K + OH + H 2 0
3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье .
Например , электролиз хлорида натрия:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
либо
щелочь + соль 1 = соль 2 ↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 ↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II) :
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода .
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH) 2 + CO 2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей . Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления , которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe +2 (OH) 2 + O 2 0 + 2H 2 O → 4Fe +3 (O -2 H) 3
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации
. Возможно и образование кислой соли , если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты . В избытке щёлочи образуется средняя соль и вода:
Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации
. Возможно и образование кислой соли , если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты . В избытке щёлочи образуется средняя соль и вода:
щёлочь (избыток) + кислота = средняя соль + вода
щёлочь + многоосновная кислота (избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты , фосфаты или гидрофосфаты .
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H 3 PO 4 → NaH 2 PO 4 + H 2 O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H 3 PO 4 → Na 2 HPO 4 + 2H 2 O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H 3 PO 4 → Na 3 PO 4 + 3H 2 O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH) 3 = NaAlO 2 + 2H 2 O
А в растворе образуется комплексная соль:
NaOH + Al(OH) 3 = Na
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли , в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь (избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид (избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO 2 = NaHCO 3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена .
Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена .
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например , гидроксид натрия взаимодействует с сульфатом меди в растворе :
Cu 2+ SO 4 2- + 2Na + OH — = Cu 2+ (OH) 2 — ↓ + Na 2 + SO 4 2-
Также щёлочи взаимодействуют с растворами солей аммония .
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
NH 4 + NO 3 — + K + OH — = K + NO 3 — + NH 3 + H 2 O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль!
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO 4 + 2KOH = Zn(OH) 2 ↓ + K 2 SO 4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид . А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO 4 + 4KOH = K 2 + K 2 SO 4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла (избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь (избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO 3 + KOH = K 2 SO 3 + H 2 O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO 3 мы разбиваем на уольную кислоту H 2 CO 3 и карбонат натрия Na 2 CO 3 . Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
Например, гидрокарбонта натрия NaHCO 3 мы разбиваем на уольную кислоту H 2 CO 3 и карбонат натрия Na 2 CO 3 . Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород , в расплаве — средняя соль и водород .
Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H 2 + O = 2Na + 3H 2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах . Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
Как правило, неметаллы диспропорционируют в щелочах . Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О 2 ≠
NaOH +N 2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl 2 0 = NaCl — + NaOCl + + H 2 O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl 2 0 = 5NaCl — + NaCl +5 O 3 + 3H 2 O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH +Si 0 + H 2 + O= NaCl — + Na 2 Si +4 O 3 + 2H 2 0
Фтор окисляет щёлочи:
2F 2 0 + 4NaO -2 H = O 2 0 + 4NaF — + 2H 2 O
Более подробно про эти реакции можно прочитать в статье .
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li 2 O + H 2 O
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH) 2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH 4 + (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH 3 + H 2 O = NH 4 OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH) 3 , Ca(OH) 2 , Fe(OH) 3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др. ). Однако большинство из них в воде не растворяются.
). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы . Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH) 2 = CuO + H 2 O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H + . Основания Аррениуса в водном растворе образуют
анионы OH — . Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад HCl на H + и Cl — .
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H 2 O, H 3 O + , CH 3 CO 2 H, H 2 SO 4 , HSO 4 − , HCl, CH 3 OH, NH 3
Часто используемые основания:
OH − , H 2 O, CH 3 CO 2 − , HSO 4 − , SO 4 2− , Cl −
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H + и анионы. Пример сильной кислоты — соляная кислота HCl:
Пример сильной кислоты — соляная кислота HCl:
HCl (р-р) + H 2 O (ж) → H 3 O + (р-р) + Cl — (р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO 3 , H 2 SO 4 , HClO 4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO 3 — азотная кислота
- HClO 4 — хлорная кислота
- H 2 SO 4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF (р-р) + h3O (ж) → h4O + (р-р) + F — (р-р) — в такой реакции более 90% кислоты не диссоциирует:
=Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H 3 PO 4 фосфорная
- H 2 SO 3 сернистая
- H 2 S сероводородная
- H 2 CO 3 угольная
- H 2 SiO 3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH (р-р) + H 2 O ↔ NH 4К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH) 2 гидроксид бария
- Ca(OH) 2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH — :
NH 3 (р-р) + H 2 O ↔ NH + 4 (р-р) + OH — (р-р)Большинство слабых оснований — это анионы:
F — (р-р) + H 2 O ↔ HF (р-р) + OH — (р-р)Список слабых оснований
- Mg(OH) 2 гидроксид магния
- Fe(OH) 2 гидроксид железа (II)
- Zn(OH) 2 гидроксид цинка
- NH 4 OH гидроксид аммония
- Fe(OH) 3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Пример:
H 3 O + + OH — ↔ 2H 2 OСлабое основание и слабая кислота
Общий вид реакции:
Слабое основание (р-р) + H 2 O ↔ Слабая кислота (р-р) + OH — (р-р)Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX (р-р) + OH — (р-р) ↔ H 2 O + X — (р-р)Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H 2 O + H 2 O ↔ H 3 O + (р-р) + OH — (р-р)
K c = / 2
Константа равновесия воды при t=25°: K c = 1.83⋅10 -6 , также имеет место следующее равенство: = 10 -14 , что называется константой диссоциации воды.Для чистой воды = = 10 -7 , откуда -lg = 7.0.
Данная величина (-lg) называется pH — потенциал водорода. Если pH 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H + и анионом отличным от O 2- . В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли , необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H + , ни OH — в воде.
Например, Cl — , NO — 3 , SO 2- 4 , Li + , Na + , K + .
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F — , CH 3 COO — , CO 2- 3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Статья на тему «Можно ли обойтись без изучения валентности?»
Овсянникова Татьяна Николаевна
учитель химии
МБОУ «Средняя общеобразовательная школа №84»
г.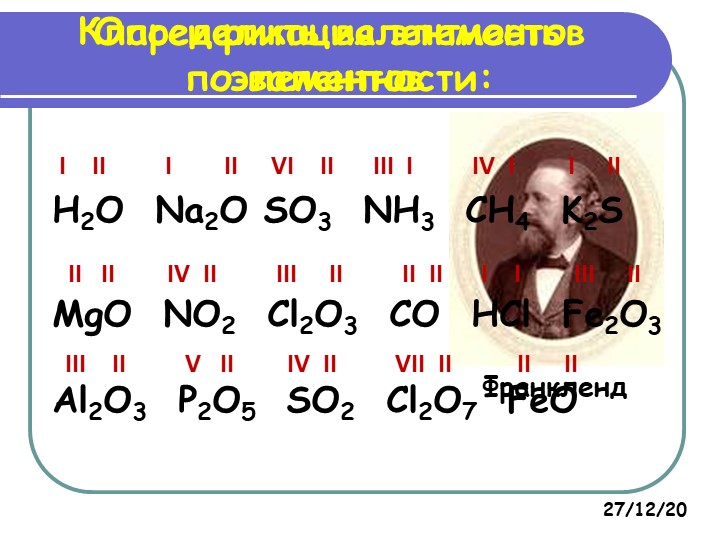 Кемерово, Кемеровская область
Кемерово, Кемеровская область
МОЖНО ЛИ ОБОЙТИСЬ БЕЗ ИЗУЧЕНИЯ ВАЛЕНТНОСТИ?
Аннотация
В данной статье речь идет об одном из важнейших свойств атомов химических элементов – валентности.
Статья подводит некоторые итоги изучения данного понятия на уроках химии в 8-11 классах средних общеобразовательных школ.
На основе многолетних практических выводов автор отстаивает идею о том, что в современной школе не имеет смысла отказываться от изучения понятия «валентность», заменяя ее другим немаловажным свойством атомов – степенью окисления. С целью улучшения качества химического образования школьников, для успешной подготовки к экзаменам, необходимо учить детей применять на практике понятие «валентность».
Многие авторы современных учебников химии для средней школы давно частично или полностью отказались от использования понятия «валентность» при подаче изучаемого материала не только в 8-9, но и в 10-11 классах. Возможно, считается, что отказ от изучения понятия о валентности и валентных возможностях атомов сокращает учебный материал и облегчает степень усвоения знаний школьниками, тем более, что на практике валентность легко заменяют понятием «степень окисления», а для подготовки к ЕГЭ по химии валентность тоже не нужна, ведь в заданиях контрольно-измерительных материалов о ней не упоминается. Так ли это на самом деле?
Возможно, считается, что отказ от изучения понятия о валентности и валентных возможностях атомов сокращает учебный материал и облегчает степень усвоения знаний школьниками, тем более, что на практике валентность легко заменяют понятием «степень окисления», а для подготовки к ЕГЭ по химии валентность тоже не нужна, ведь в заданиях контрольно-измерительных материалов о ней не упоминается. Так ли это на самом деле?
Я заметила, что от изучения валентности отказываются те авторы, у которых в учебниках порядок изложения материала следующий: сначала изучается теория строения атома, периодический закон и периодическая система Д.И. Менделеева, типы химической связи, электроотрицательность, кристаллические решетки и т.д. и только значительно позже речь заходит о составе простых и сложных веществ, химических формулах и уравнениях химических реакций. Сразу хочу сказать, что я не сторонница такой подачи учебного материала учащимся, начинающим изучать химию в 8 классе. Я считаю, что нелогично сначала объяснять ребенку сложнейшее внутреннее строение атома, вызывающее до сих пор массу споров и противоречий у ряда ученых, рассказывать о структуре периодической системы и открытии периодического закона в то время, как у него еще совершенно не сложилось в голове представление о самих веществах, атомах и молекулах, их образующих, химических элементах, их обозначении, массе, простейших свойствах, роли в природе и т. д. Мой практический опыт показывает, что изучать валентность и степень окисления надо сравнивая эти два важнейших свойства атомов. И начинать надо всё-таки с валентности, т.к. до изучения степени окисления ребёнку ещё необходимо «дорасти».
д. Мой практический опыт показывает, что изучать валентность и степень окисления надо сравнивая эти два важнейших свойства атомов. И начинать надо всё-таки с валентности, т.к. до изучения степени окисления ребёнку ещё необходимо «дорасти».
Понятие «валентность» ученик впервые встречает тогда, когда речь заходит о составлении химических формул бинарных соединений. Возможно, не каждый ребенок сразу осмысленно отложит в памяти, что валентность – это свойство атомов присоединять к себе определенное количество атомов других химических элементов, но зато четко усвоит, что для составления химических формул сложных веществ применять его необходимо. Тем более, после выполнения одного-двух упражнений на составление формул сложных веществ, подавляющее большинство детей уже легко запомнит, что валентность атомов бывает постоянная и переменная, что водород проявляет валентность один, а кислород – два. А дальше, для более чёткого и грамотного усвоения, я всегда предлагаю детям записать и запомнить элементы с постоянной валентностью
Валентность | Хим. |
I | H,Na,K,Li,F,Ag |
II | O,Be,Mg,Ba,Zn,Ca |
III | B,Al |
и, конечно, поясняю, как определить значение валентности элемента по положению в периодической системе. Здесь дети могут уже увидеть, что у большинства химических элементов валентность переменная, высшая (у элементов главных подгрупп) совпадает с номером группы, не бывает больше восьми и, в зависимости от положения элемента в группе, принимает чётные или нечётные значения. Позднее, ближе к концу учебного года, т.е. когда понятие о валентности атомов и не только, уже чётко уляжется у детей в головах, при изучении электронного строения атома они с помощью учителя уже легко смогут объяснить проявление той или иной валентности атомами в соединениях.
Научившись составлять формулы бинарных соединений по валентности, ребёнок может уже довольно легко освоить составление формул оксидов, кислот, солей и оснований при переходе к изучению основных классов неорганических соединений. К этому времени дети уже хорошо помнят не только валентность атомов водорода, но и постоянную валентность многих металлов, а здесь всего лишь надо запомнить, что валентность кислотных остатков равна числу атомов водорода в кислотах и что валентность гидроксогруппы всегда равна одному. Конечно, для составления формул солей и оснований можно пользоваться и степенями окисления элементов, но это для усвоения значительно сложнее: например, составить формулу сульфата алюминия:
6
Al23+(SO4)32-
Сложнее, во-первых, потому, что ребёнку надо помнить, что ионы металлов всегда проявляют положительные заряды и понимать, почему положительные. Во-вторых, надо помнить, что ионы кислотных остатков проявляют отрицательные заряды и с чем это связано.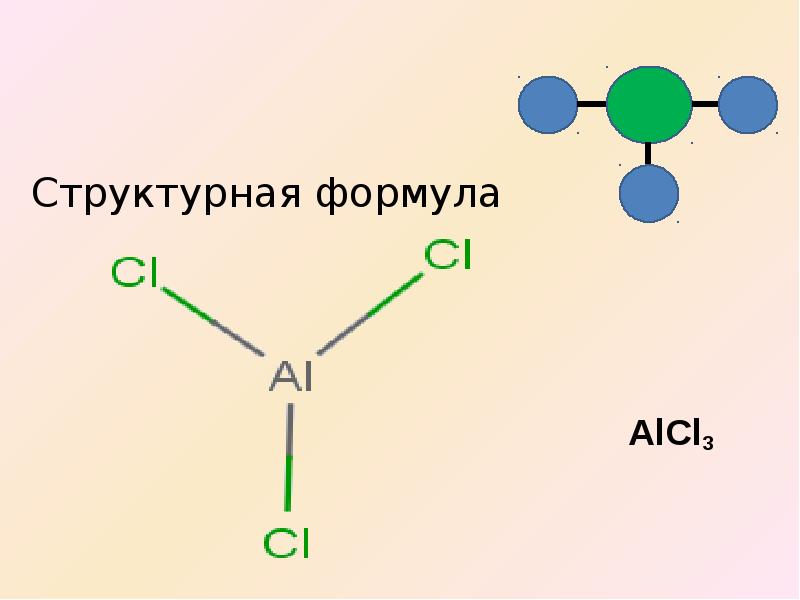 В третьих, ребёнка надо будет сначала научить вычислять суммарный заряд иона кислотного остатка по степеням окисления каждого элемента, и только потом объяснять, что заряд численно совпадает с количеством атомов водорода в кислоте, от которой образована соль. В-четвёртых, алгебраическая сумма зарядов ионов в сложном веществе должна быть равна нулю. Согласитесь, сплошная математика! А ведь далеко не всем детям она так легко даётся, не все учатся в физико-математических школах. Поэтому с уверенностью продолжаю утверждать, что формулы солей и оснований по валентности составлять значительно легче и быстрее.
В третьих, ребёнка надо будет сначала научить вычислять суммарный заряд иона кислотного остатка по степеням окисления каждого элемента, и только потом объяснять, что заряд численно совпадает с количеством атомов водорода в кислоте, от которой образована соль. В-четвёртых, алгебраическая сумма зарядов ионов в сложном веществе должна быть равна нулю. Согласитесь, сплошная математика! А ведь далеко не всем детям она так легко даётся, не все учатся в физико-математических школах. Поэтому с уверенностью продолжаю утверждать, что формулы солей и оснований по валентности составлять значительно легче и быстрее.
Научить детей грамотно называть сложные вещества – тоже немаловажная задача. Проявляемая элементом переменная валентность должна обязательно указываться в названии сложного вещества. Например, SO3 –оксид серы (VI) и SO2 – оксид серы (IV) дети могут просто называть «оксид серы», даже не задумываясь о том, что это совсем разные вещества из-за того, что сера проявляет в каждом из них разную валентность. И, главное, что здесь, в названиях веществ, указывается именно валентность, а не степень окисления химического элемента. Значение степени окисления принято указывать с помощью арабских цифр с добавлением перед цифрой знака «+» или «-», величину заряда иона указывают тоже с помощью арабских цифр, изображая знак «+» или «-» после цифры, и только валентность указывают римскими цифрами без каких-либо знаков. Поэтому, если мы не изучаем валентность, то как сможем объяснить детям, почему над знаком химического элемента в формуле пишем степень окисления +6, а в названии вещества указываем её же VI?
И, главное, что здесь, в названиях веществ, указывается именно валентность, а не степень окисления химического элемента. Значение степени окисления принято указывать с помощью арабских цифр с добавлением перед цифрой знака «+» или «-», величину заряда иона указывают тоже с помощью арабских цифр, изображая знак «+» или «-» после цифры, и только валентность указывают римскими цифрами без каких-либо знаков. Поэтому, если мы не изучаем валентность, то как сможем объяснить детям, почему над знаком химического элемента в формуле пишем степень окисления +6, а в названии вещества указываем её же VI?
Когда начнётся изучение темы «Электролитическая диссоциация», на базе имеющихся знаний учащихся о валентности атомов металлов, кислотных остатков, гидроксогрупп, легко будет запомнить, что заряды ионов этих же частиц численно равны их валентности, а запомнить надо только знак заряда иона.
При изучении строения атома важнейшее значение отводится электронам наружного (внешнего) энергетического уровня, которые всегда назывались валентными. Их число совпадает не только с номером группы, в которой расположен химический элемент А-подгруппы, но и с высшей валентностью данного элемента в соединениях. В ряде школьных учебников химии об этом сейчас не упоминается. Ну, а если ребёнок не знаком с понятием о валентных электронах, то как объяснить ему в дальнейшем смысл понятия «ковалентная связь»? Ведь само слово «ковалентная» происходит именно от слова «валентность» и дословно переводится как «со-валентная», т.е. образующаяся за счёт связывания валентных электронов.
Их число совпадает не только с номером группы, в которой расположен химический элемент А-подгруппы, но и с высшей валентностью данного элемента в соединениях. В ряде школьных учебников химии об этом сейчас не упоминается. Ну, а если ребёнок не знаком с понятием о валентных электронах, то как объяснить ему в дальнейшем смысл понятия «ковалентная связь»? Ведь само слово «ковалентная» происходит именно от слова «валентность» и дословно переводится как «со-валентная», т.е. образующаяся за счёт связывания валентных электронов.
А как мы будем обходиться без понятия «валентность» в курсе органической химии, когда во всех органических веществах углерод проявляет валентность IV, а степени окисления при этом самые разнообразные, от +4 до -4?
Итак, я твёрдо убеждена, что перед тем, как изучать степень окисления, ребёнок должен научиться применять понятие «валентность». А уже ближе к концу восьмого класса, после подробного изучения электронного строения атома, периодического закона, структуры периодической системы, типов химической связи, детей можно и нужно знакомить с понятием «степень окисления». Тогда уже ребёнок в состоянии понять и осмыслить, что валентность и степень окисления – это важнейшие свойства атомов металлов и неметаллов, значения которых легко можно объяснить на основе электронного строения атомов каждого химического элемента. Ребёнок увидит, что валентность и степень окисления почти всегда численно совпадают, что по значениям степеней окисления атомов также можно составлять формулы сложных веществ, но делать это будет уже гораздо легче. Считаю неверным впервые упоминать о валентности атомов после изучения степени окисления и только в 10 или 11 классе. Тогда уже изучение валентности точно не имеет смысла, а ребёнок так и не научился составлять формулы химических соединений.
Тогда уже ребёнок в состоянии понять и осмыслить, что валентность и степень окисления – это важнейшие свойства атомов металлов и неметаллов, значения которых легко можно объяснить на основе электронного строения атомов каждого химического элемента. Ребёнок увидит, что валентность и степень окисления почти всегда численно совпадают, что по значениям степеней окисления атомов также можно составлять формулы сложных веществ, но делать это будет уже гораздо легче. Считаю неверным впервые упоминать о валентности атомов после изучения степени окисления и только в 10 или 11 классе. Тогда уже изучение валентности точно не имеет смысла, а ребёнок так и не научился составлять формулы химических соединений.
Сравнивать понятия «валентность» и «степень окисления» я продолжаю вместе с детьми на протяжении всего изучения химии, с 8 по 11 класс. Тридцатилетний опыт работы показывает мне, что выпускнику 11 класса надо хорошо знать и понимать разницу между валентностью атомов, степенью окисления и зарядом иона, это одна из важнейших составляющих успеха при сдаче единого государственного экзамена по химии. Так что отказываться от изучения валентности в школьном курсе химии частично или полностью я не собираюсь.
Так что отказываться от изучения валентности в школьном курсе химии частично или полностью я не собираюсь.
План изучения темы 1 Состав названия и определение
План изучения темы: 1. Состав, названия и определение оснований. 2. Классификация оснований. 3. Физические свойства оснований. 4. Химические свойства оснований.
Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
Состав оснований: Назовите составные части оснований. Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью металла, образующего основание. Ме(ОН)х
Выберите формулы оснований. Назовите их. НСl, Na. OH, Na 2 O, Ca(OH)2, H 2 SO 4, P 2 O 5, Fe(OH)3, Mg. O, Cи(OH)2
Основания Na. OH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 – гидроксид меди (III) Найдите ошибку!
Классификация оснований Растворимые Нерастворимые (щелочи) Na. OH KOH Ba(OH)2 Li. OH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)3
OH KOH Ba(OH)2 Li. OH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)3
Таблица растворимости кислот, оснований, солей
По какому признаку основания разделены на группы? ? Na. OH KOH Li. OH Сs. OH ? Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 ? Al(OH)3 Fe(OH)3
Классификация оснований по числу гидроксогрупп. Основания Однокислотные Na. OH, KOH Двухкислотные Трехкислотные Pb(OH)2, Fe(OH)2 Al(OH)3
Физические свойства оснований КОН Агрегатное состояние: Все твердые вещества • Цвет кислот: Белого – КОН, Голубого — Cu(OH)2 Красно-бурого — Fe(OH)3 • Запах – ? • Вкус – ? (горький, солоноватый) • Растворимость в воде — ?
Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами, 4). солями.
Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами, 4). солями.
ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 1% раствором уксусной кислоты.
1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» — указатели Лакмус Метиловый оранжевый Фенолфталеин Na. OH
2. Щелочь + кислота : Ва(ОН)2 + 2 НСl = Ва. Сl 2 + 2 Н 2 О хлорид бария
Hydroxyl Ion – обзор
3.2.1.2 Электростатическое взаимодействие
Поверхности гидроокисей амфотерны и подвергаются кислотно-основным реакциям, при которых протоны и ионы гидроксила могут специфически адсорбироваться. По этой причине H + и OH — называются ионами, определяющими потенциал. Разделение заряда, происходящее на границе раздела двух фаз, называется двойным электрическим слоем, поскольку в идеале он состоит из двух областей с противоположным зарядом.
Разделение заряда, происходящее на границе раздела двух фаз, называется двойным электрическим слоем, поскольку в идеале он состоит из двух областей с противоположным зарядом.
Поверхностный заряд ( σ 0 ) компенсируется распределением ионов с зарядом, противоположным заряду поверхности (так называемые противоионы) и ионов с одинаковым зарядом (коионы). Поверхностный потенциал ( ψ ) экспоненциально затухает с расстоянием ( x ) в соответствии с уравнением Дебая – Хюккеля:
(3.3)ψx=ψ0exp−κx
, где 2
, где ρ ∞ I — это ионная концентрация ионов I в основном, E — электронный заряд, Z I — это валентность ионов, ɛ — диэлектрическая проницаемость среды (диэлектрическая проницаемость, 78.6 для воды при 25 °C), ε 0 — диэлектрическая проницаемость вакуума, k — постоянная Больцмана и T — абсолютная температура. Это уравнение определяет конденсатор, две пластины которого разделены расстоянием 1/ κ , которое известно как длина Дебая и дает толщину двойного слоя. Его величина зависит только от свойств среды, а не от свойств поверхности, таких как заряд и потенциал.
Это уравнение определяет конденсатор, две пластины которого разделены расстоянием 1/ κ , которое известно как длина Дебая и дает толщину двойного слоя. Его величина зависит только от свойств среды, а не от свойств поверхности, таких как заряд и потенциал.
Образование двойного слоя объясняется модификацией Штерна теории Гуи–Чепмена, предполагающей наличие монослоя противоионов, специфически адсорбированных на поверхности, и диффузного слоя, в котором концентрация противоионов уменьшается с увеличением расстояния разделения .Расстояние ближайшего приближения к поверхности составляет x 1 , а диффузная часть двойного слоя начинается с x 2 , так что для x > x 2 9014 , 9014 , силы ничтожны. Если поверхность частиц положительна, то негидратированные анионы контактируют с поверхностью, а плоскость, образованная центрами анионов, называется внутренней плоскостью Гельмгольца (ВГП). Катионы остаются гидратированными, а плоскость, пересекающая их центры, является внешней плоскостью Гельмгольца (ОНР). Распределение потенциала на границе раздела схематически представлено на рис. 3.1. За подробным анализом электростатического взаимодействия читатель может обратиться к учебникам по коллоидам, указанным в конце главы.
Распределение потенциала на границе раздела схематически представлено на рис. 3.1. За подробным анализом электростатического взаимодействия читатель может обратиться к учебникам по коллоидам, указанным в конце главы.
При движении частицы через жидкость Штерн и часть диффузного слоя перемещаются вместе с частицей. Потенциал в этой плоскости сдвига называется дзета-потенциалом ( ζ ) и указывает на градиент электрического потенциала, когда поверхностный потенциал постоянен.Изоэлектрическая точка определяется как значение рН, при котором дзета-потенциал равен нулю. В отсутствие специфической адсорбции изоэлектрическая точка и точка нуля заряда совпадают. Когда происходит специфическая адсорбция, изоэлектрическая точка смещается в сторону кислых значений pH при адсорбции анионов и в сторону основных значений pH при адсорбции катионов (Parks, De Bruyn, 1962; Hunter, 1981).
Отталкивающий электростатический потенциал между двумя частицами определяется выражением
(3. 5)VR=64πkTaρ∞γ2κ2exp−κx
5)VR=64πkTaρ∞γ2κ2exp−κx
, где
(3.5)6)γ=tanhzeψ04kT=expzeψ0/2kT−1expzeψ0/2kT+1
, что является основой модели Гуи–Чепмена. Для больших потенциалов γ → 1, тогда как для низких потенциалов замена th x ~ x сводит это уравнение к уравнению (3.3).
Стабильность суспензии широко оценивается по сочетанию различных взаимодействий. В самом общем случае устойчивость заряженных систем определяется теорией Держагина–Ландау–Фервея–Овербека (ДЛВО), где полный потенциал взаимодействия определяется суммой электростатического потенциала отталкивания и потенциала притяжения Лондона–Ван-дер-Ваальса. потенциал (Дерягин и Ландау, 1941; Вервей и Овербек, 1948):
(3.7)VT=64πkTρ∞γ2κ2exp-κx-Aa12x
Взаимодействие DLVO можно представить как функцию расстояния между двумя частицами, как показано на рисунке 3.2. Взаимодействие Ван-дер-Ваальса всегда отрицательно, а сочетание с электростатическим отталкиванием приводит к наличию глубокого минимума (называемого первичным минимумом) на очень коротких расстояниях, где частицы соприкасаются друг с другом, что приводит к так называемой коагуляции. На больших расстояниях существует максимальный барьер, соответствующий максимальной устойчивости системы.На еще больших расстояниях может быть вторичный минимум, в котором частицы флоккулируют. В этом случае частицы объединяются под действием промежуточного вещества (например, молекул жидкости или сжатого двойного слоя) так, что их можно легко повторно диспергировать. Напротив, коагулированные системы не подлежат повторному диспергированию. Важной особенностью является то, что энергия взаимодействия (и дзета-потенциал) суспензии сильно зависит от концентрации электролита (вообще любых ионов, образующихся в результате добавления дефлокулянта или присутствующих в виде примесей).
На больших расстояниях существует максимальный барьер, соответствующий максимальной устойчивости системы.На еще больших расстояниях может быть вторичный минимум, в котором частицы флоккулируют. В этом случае частицы объединяются под действием промежуточного вещества (например, молекул жидкости или сжатого двойного слоя) так, что их можно легко повторно диспергировать. Напротив, коагулированные системы не подлежат повторному диспергированию. Важной особенностью является то, что энергия взаимодействия (и дзета-потенциал) суспензии сильно зависит от концентрации электролита (вообще любых ионов, образующихся в результате добавления дефлокулянта или присутствующих в виде примесей).
Рисунок 3.2. Изменение потенциалов между частицами в зависимости от расстояния и концентрации электролита.
Когда присутствует более одного типа частиц, ситуация усложняется. Взаимодействия между разнородными частицами (по природе или по размеру) называют гетерокоагуляцией. Из теории ДЛФО для сферических частиц с κa > 10 и ψ 0 > 50 мВ потенциальная энергия отталкивания для двух частиц с радиусами a 1 и 4 1 и потенциалов ψ 1 и ψ 2 определяется уравнением, предложенным Hogg et al. (1966):
(1966):
(3.8)VR=2πɛɛ0a1a2a1+a22Ψ1Ψ2ln1+exp-κx1-exp-κx+Ψ12+Ψ22ln1-exp-κx
изоэлектрической точки, а значит, будет область рН с частицами противоположного знака, что приведет к гетерокоагуляции. Однако это может быть выгодно для смесей материалов с сильными различиями в форме или размере, чтобы получить структуры ядро-оболочка и покрыть более крупные частицы более мелкими за счет сильных электростатических сил.
Доступны модели и программное обеспечение для оценки коллоидной стабильности суспензий практически любого типа. Одной из таких программ является набор инструментов Hamaker 2, бесплатно предоставляемый EPFL (Лозанна, Швейцария). В Hamaker 2 большое внимание было уделено максимально гибкому графику. Графики потенциала и силы между разнородными частицами можно построить в 2D как функцию одной переменной или в 3D как функцию двух переменных. Все параметры моделей могут быть выбраны в качестве переменных построения графика, что делает его очень гибким, поскольку пользователь может добавить практически любой тип потенциала взаимодействия (Aschauer et al. , 2011).
, 2011).
Синтез гликоконъюгатов тимина с углеводным каркасом для организации поливалентности
Для конъюгации двух тиминовых и, в конечном итоге, двух гликотиминовых ветвей на гликозидном каркасе были выбраны 2- и 3-гидрокси функции маннозы. Эти две функциональные группы могут быть легко адресованы ортогонально к остальной части молекулы. Кроме того, вицинальные 2- и 3-гидроксигруппы -цис--ориентированы, и, таким образом, должно быть облегчено внутримолекулярное [2+2] фотоциклоприсоединение присоединенных фрагментов тимина.В качестве аномерной функциональной группы выбранного каркаса маннозида была выбрана Вос-защищенная аминогруппа, которая может быть получена из азидной функции. Таким образом, синтез целевого двухвалентного гликоконъюгата тимина начался с известного 2-азидоэтил α-D-маннозида ( 1 , схема 1) [11–13]. Кинетически контролируемая реакция маннозида 1 с 2-метоксипропеном дает 4,6-изопропилидензащищенное производное 2 с хорошим выходом, оставляя 2- и 3-гидроксигруппы свободными [14,15]. Последующая этерификация Вильямсона [16] пропаргилбромидом дала 2,3-ди- O -пропаргилманнозид 3 с высоким выходом. Пропаргилирование было выбрано для этой стадии, чтобы обеспечить конъюгацию с известным азидопропилированным производным тимина 6 [17-20] посредством клик-реакции, катализируемой медью (I) [21,22]. Ранее кислотолабильная изопропилиденовая защитная группа была удалена с использованием 10% TFA в дихлорметане, что привело к маннозиду 4 , а затем азидная функция в 4 была преобразована в восстановление Штаудингера [23] с одновременным Boc-защитой, что привело к маннозид 5 с высоким общим выходом.Вос-защита аминогруппы также облегчала процесс хроматографической очистки на последующих стадиях.
Последующая этерификация Вильямсона [16] пропаргилбромидом дала 2,3-ди- O -пропаргилманнозид 3 с высоким выходом. Пропаргилирование было выбрано для этой стадии, чтобы обеспечить конъюгацию с известным азидопропилированным производным тимина 6 [17-20] посредством клик-реакции, катализируемой медью (I) [21,22]. Ранее кислотолабильная изопропилиденовая защитная группа была удалена с использованием 10% TFA в дихлорметане, что привело к маннозиду 4 , а затем азидная функция в 4 была преобразована в восстановление Штаудингера [23] с одновременным Boc-защитой, что привело к маннозид 5 с высоким общим выходом.Вос-защита аминогруппы также облегчала процесс хроматографической очистки на последующих стадиях.
Схема 1: Синтез димерного тимина 7 на углеводном каркасе и внутримолекулярное фотоциклоприсоединение. Продукт облучения 8 представляет собой сложную изомерную смесь (детально не показана, ср.Вспомогательный информационный файл 1).
Продукт облучения 8 представляет собой сложную изомерную смесь (детально не показана, ср.Вспомогательный информационный файл 1).
Схема 1: Синтез димерного тимина 7 на углеводном каркасе и внутримолекулярное фотоциклоприсоединение. Я…
Маннозид 5 снабжен двумя пропаргильными ответвлениями, выступающими из β-поверхности углевода, тогда как Boc-защищенный аминоэтилагликон находится в α-положении и готов к возможной иммобилизации конечного гликоконъюгата тимина на поверхности или к конъюгации с другим многовалентное соединение.Для клик-реакции 5 с производным тимина 6 использовали сульфат меди и аскорбат натрия. Продукт конъюгации 7 был получен с выходом 71% и показал хорошую растворимость в воде.
Продукт конъюгации 7 был получен с выходом 71% и показал хорошую растворимость в воде.
Затем было протестировано фотоциклоприсоединение [2 + 2]. Для облучения двухвалентный тиминовый гликоконъюгат 7 разводили (максимальная концентрация 500 мкг/1 мл) в смеси воды и ацетона 1:1, чтобы способствовать внутримолекулярному фотоциклоприсоединению и избежать межмолекулярной реакции.В качестве триплетного сенсибилизатора в этом процессе требуется ацетон [5]. Облучение светом ≥ 290 нм проводили в течение 3 и 6 часов соответственно. После облучения растворители удаляли и продукт исследовали без какой-либо очистки или дальнейшего разделения. 1 H ЯМР-спектроскопический анализ показывает, что сигналы двух протонов тимина H-6 в 7 при 7,27 и 7,25 м.7 частей на миллион в 8 ). Кроме того, умножаются сигналы для двух триазолов H-11 (7,96 м. д.) и для аномерного каркаса H-1 (H-1 core ) при 4,92 м.д. Интересно, что хотя пик H-1 исходного вещества явно уменьшен, в продукте фотоциклоприсоединения [2 + 2] 8 наблюдается всего пять дублетов, слегка смещенных в слабое поле (рис. 2C, 5,0–5,3 м.д.). Эти сигналы соответствуют пяти различным изомерным продуктам фотоциклоприсоединения.
д.) и для аномерного каркаса H-1 (H-1 core ) при 4,92 м.д. Интересно, что хотя пик H-1 исходного вещества явно уменьшен, в продукте фотоциклоприсоединения [2 + 2] 8 наблюдается всего пять дублетов, слегка смещенных в слабое поле (рис. 2C, 5,0–5,3 м.д.). Эти сигналы соответствуют пяти различным изомерным продуктам фотоциклоприсоединения.
Рисунок 2: 1 Спектры ЯМР H (все в D 2 O, 500 МГц) маннозида 7 (A) и продукта облучения ( 8 ) после 3 часов облучения (B) и 6 часов облучения ( С).Прогресс фотоциклоприсоединения виден по изменению сигналов протонов триазола Н-11 и тимина Н-6 (слева в слабом поле) и аномерного Н-1 углеводного каркаса (≈4,9 м.д.). Аномерная область H-1 детализирована в каждом случае: после 6 часов облучения (С) видны пять новых сигналов (синие стрелки), соответствующие пяти различным изомерам продукта фотоциклоприсоединения 8 .
Рисунок 2: 1 H ЯМР-спектры (все в D 2 O, 500 МГц) маннозида 7 (A) и продукта облучения ( 8 ) после 3 …
Фотоциклоприсоединение [2 + 2] производных тимина широко обсуждалось в литературе [9,10,24,25], поскольку оно важно при повреждении ДНК (как циклореверсия при репарации ДНК) [26,27]. Соответственно, фотодимеризация может происходить по типу анти и син , приводя к региоизомерным продуктам (ср.Вспомогательный информационный файл 1). Оба региоизомера могут состоять из четырех различных стереоизомеров, двух изомеров цис и двух изомеров транс в соответствии с относительной стерической ориентацией метильных групп тимина. Можно предположить, что облучение 7 в разбавленном растворе способствует фотоциклоприсоединению син с образованием двух изомерных цис-син- и двух транс-син — [2 + 2] продуктов фотоциклоприсоединения. Кроме того, по-видимому, также образуется продукт против , поскольку в спектре ЯМР 1 Н-1 видны пять (а не четыре) сигналов Н-1.
Можно предположить, что облучение 7 в разбавленном растворе способствует фотоциклоприсоединению син с образованием двух изомерных цис-син- и двух транс-син — [2 + 2] продуктов фотоциклоприсоединения. Кроме того, по-видимому, также образуется продукт против , поскольку в спектре ЯМР 1 Н-1 видны пять (а не четыре) сигналов Н-1.
Фотоциклоприсоединение 7 также можно наблюдать с помощью УФ-видимой спектроскопии. При облучении поглощение при 270 нм полностью исчезает (см. Файл с дополнительной информацией 1). Масс-спектрометрический анализ позволяет исключить межмолекулярное фотоциклоприсоединение, поскольку соответствующие масс-пики не обнаружены (см. Файл вспомогательной информации 1).
На следующем этапе были нацелены на гликозилированные димеры тимина (см. Рисунок 1Б). Основываясь на нашей более ранней работе [5], мы сначала планировали использовать соответствующий бромалкилманнозид для N -алкилирования тимина N 3 [28]. На этом этапе DBU можно использовать в качестве ненуклеофильного основания [29], оставляя группу NHBoc нетронутой. Когда вместо этого используется гидрид натрия, NHBoc депротонируется в дополнение к тимину, и происходит нежелательное алкилирование NHBoc. Однако свободные гидроксильные функции также мешают реакции, и, следовательно, мы не нашли условий реакции для чистой тиминовой функционализации N 3 7 .Таким образом, ОН-защищенный аналог 7 был получен, исходя из 3 (схема 2). Восстановление Штаудингера азидной группы и Boc-защита в одном и том же реакторе дали 9 и последующую клик-реакцию с производным тимина 6 с получением изопропилиден-защищенного димерного гликоконъюгата тимина 10 с хорошим выходом. Это может быть алкилировано с использованием бромэтилманнозида 11 [11] в оптимизированной процедуре с использованием DBU и TBAI при комнатной температуре [5] в течение двух дней с получением защищенного производного гликотимина 12 с выходом 64%.
Рисунок 1Б). Основываясь на нашей более ранней работе [5], мы сначала планировали использовать соответствующий бромалкилманнозид для N -алкилирования тимина N 3 [28]. На этом этапе DBU можно использовать в качестве ненуклеофильного основания [29], оставляя группу NHBoc нетронутой. Когда вместо этого используется гидрид натрия, NHBoc депротонируется в дополнение к тимину, и происходит нежелательное алкилирование NHBoc. Однако свободные гидроксильные функции также мешают реакции, и, следовательно, мы не нашли условий реакции для чистой тиминовой функционализации N 3 7 .Таким образом, ОН-защищенный аналог 7 был получен, исходя из 3 (схема 2). Восстановление Штаудингера азидной группы и Boc-защита в одном и том же реакторе дали 9 и последующую клик-реакцию с производным тимина 6 с получением изопропилиден-защищенного димерного гликоконъюгата тимина 10 с хорошим выходом. Это может быть алкилировано с использованием бромэтилманнозида 11 [11] в оптимизированной процедуре с использованием DBU и TBAI при комнатной температуре [5] в течение двух дней с получением защищенного производного гликотимина 12 с выходом 64%. Ацетильные защитные группы отщепляли по методике Земплена [30]. Во время обработки кислотной ионообменной смолой неожиданно наблюдалось отщепление изопропилиденовой защитной группы, в то время как Вос-защита оставалась нетронутой. Таким образом, названный гликокластер 13 был получен в ходе одной стадии снятия защиты. Новый двухвалентный гликоконъюгат 13 показывает хорошую растворимость в воде и поэтому подходит для биологических испытаний.
Ацетильные защитные группы отщепляли по методике Земплена [30]. Во время обработки кислотной ионообменной смолой неожиданно наблюдалось отщепление изопропилиденовой защитной группы, в то время как Вос-защита оставалась нетронутой. Таким образом, названный гликокластер 13 был получен в ходе одной стадии снятия защиты. Новый двухвалентный гликоконъюгат 13 показывает хорошую растворимость в воде и поэтому подходит для биологических испытаний.
Схема 2: Синтез димерного гликотимина 13 на углеводных каркасах и внутримолекулярное фотоциклоприсоединение.Продукт облучения 14 представляет собой сложную изомерную смесь (подробно не показана, см. Файл вспомогательной информации 1).
Схема 2: Синтез димерного гликотимина 13 на углеводном каркасе и внутримолекулярное фотоциклоприсоединение. …
…
Для фотодимеризации 13 его облучали в течение 6 часов снова в разбавленном растворе с использованием смеси воды и ацетона 1:1.Как и наблюдалось при облучении 7 , пики протонов тимина Н-6, триазола Н-11 и аномерного Н-1 основного маннозида претерпели характерное изменение в спектре ЯМР 1 Н. (Рисунок 3). В этом случае в фотодимеризованном продукте 14 появляются четыре, а не пять (как в 8 ) новых дублетов для ядра H-1 (рис. 3B). Этот вывод согласуется с образованием двух цис-син- и двух транс-син -[2 + 2] продуктов фотоциклоприсоединения.Образование продуктов присоединения к , по-видимому, затруднено в этом случае, поскольку гликотиминовые ответвления в 13 и 14 стерически более затруднены, чем тиминовые ответвления в 7 и 8 . Опять же, УФ-видимая спектроскопия еще раз подчеркивает успех димеризации, поскольку максимум поглощения при 270 нм исчезает, а масс-спектрометрия подтверждает только внутримолекулярное фотоциклоприсоединение (см. Файл вспомогательной информации 1).
Опять же, УФ-видимая спектроскопия еще раз подчеркивает успех димеризации, поскольку максимум поглощения при 270 нм исчезает, а масс-спектрометрия подтверждает только внутримолекулярное фотоциклоприсоединение (см. Файл вспомогательной информации 1).
Рисунок 3: Спектры ЯМР 1 H (все в D 2 O, 500 МГц) маннозида 13 (A) и продукта облучения ( 14 ) после 6-часового облучения (B).На фотоциклоприсоединение указывают изменения сигналов протонов триазола Н-11 и тимина Н-6 (слева в слабом поле) и аномерного Н-1 углеводного каркаса (≈4,9 м.д.). Аномерная область H-1 детализирована в обоих случаях: видны четыре новых сигнала в 14 (B) (синие стрелки), соответствующие четырем различным изомерным продуктам фотоциклоприсоединения.
Рисунок 3: 1 Спектры ЯМР Н (все в D 2 O, 500 МГц) маннозида 13 (А) и продукта облучения ( 14 ) после …
2.3 Функциональные группы – органическая химия I
Функциональные группы являются наиболее реакционноспособными частями органических соединений и определяют основные свойства соединений. Краткое описание общих функциональных групп включено в Таблицу 2.2 . Хорошее знание функциональных групп является одним из основных навыков, необходимых для этого курса.Это требуется для того, чтобы учащиеся быстро определяли и называли функциональные группы, входящие в молекулы, а также понимали, интерпретировали и четко рисовали конкретную структуру каждой функциональной группы. Также требуется наименование IUPAC для соединений, содержащих пару функциональных групп.
Также требуется наименование IUPAC для соединений, содержащих пару функциональных групп.
Алкен и алкины представляют собой углеводородные функциональные группы; π-связь в кратных связях объясняет реакционную способность алкенов и алкинов.
Бензольные кольца (C 6 H 6 ) представляют собой особый тип углеводородов. Исторически сложилось так, что из-за особого аромата (сладкого запаха), который выделяют бензол и его производные, их называют ароматическими соединениями. Строение бензола можно представить как три двойные связи C=C, чередующиеся с одинарными связями, однако реальная структура бензола не имеет ничего общего с алкенами. Подробное обсуждение структуры бензола, который представляет собой большую систему сопряжения, и химических определений ароматичности/ароматичности будет темой органической химии II. Бензольные кольца могут быть показаны на любом из следующих структурных чертежей.
Бензольные кольца могут быть показаны на любом из следующих структурных чертежей.
Рисунок 2.3c Бензол
Когда галоген соединен с углеродом, группа называется алкилгалогенид ( или галогеналкан) . Галогенид можно разделить на первичный (1°), вторичный (2°) или третичный (3°) галогенид, в зависимости от того, к какой категории относится углерод, связанный с галогеном.
Рисунок 2.3d Хлорид на 2° углеродаСпирт — это функциональная группа, с которой вы, вероятно, знакомы.В органической химии термин «спирт» относится к соединению, содержащему группу ОН (гидрокси). В зависимости от положения группы ОН спирты также можно разделить на первичные (1°), вторичные (2°) и третичные (3°).
Рисунок 2.3e 1° спирт
Другой функциональной группой, содержащей атом кислорода в одинарных связях, является эфир . В эфире атом O соединяется с двумя углеродсодержащими группами R через две σ-связи C-O. Для соединений с эфиром в качестве единственной функциональной группы его обычно называют общим названием «алкилалкиловый эфир». Когда две алкильные группы одинаковы, их можно объединить как «диалкил».
Когда две алкильные группы одинаковы, их можно объединить как «диалкил».
Рисунок 2.3f диэтиловый эфир
Эфир также может иметь циклическую структуру. Может быть не так интуитивно распознать следующую структуру как эфир, и маркировка атома углерода будет полезна для идентификации.
Рисунок 2.3g Примеры циклического эфира
Обе группы нитрил и нитро содержат атом азота, и их может быть легко перепутать.Нитрил имеет тройную связь C≡N и, следовательно, может находиться только на конце структуры, тогда как нитро (NO 2 ) может находиться в любом положении углеродной цепи или кольца.
Амин является органическим производным аммиака, NH 3 . Когда атом(ы) водорода в NH 3 заменяется группами R, образуется амин. Амин может быть первичным (1°), вторичным (2°) или третичным (3°) в зависимости от того, сколько групп R связано с азотом. Амины также могут быть названы общепринятыми именами.
Рисунок 2.3h Первичный, вторичный и третичный амин
Для функциональных групп в части 2 и таблицы 2.2 все они имеют общую структурную единицу карбонильной группы C=O; различное строение «W» в общей формуле определяет характер функциональной группы. Обычно бывает сложнее идентифицировать и правильно нарисовать эти функциональные группы, потому что они в чем-то похожи. Необходимо больше практики.
Фигура 2.3i Общая структура функциональных групп, содержащих связь с=о
Альдегид и кетон сходны по своему строению и свойствам. Альдегид можно рассматривать как частный случай кетона, поскольку «H» можно рассматривать как , рассматривая как R с нулевым углеродом. Поскольку H должен быть связан с одной стороны группы C=O в альдегиде, альдегид может находиться только в конце структуры. Кетон, с другой стороны, должен быть в среднем положении, чтобы обе стороны групп C=O были связаны с группами R. Кетон также может иметь циклическую структуру.
Кетон также может иметь циклическую структуру.
Рисунок 2.3j Примеры кетона и циклического кетона
Последние четыре функциональные группы связаны между собой структурой и химическими свойствами. Когда группа ОН соединена с С=О, весь СООН называется функциональной группой карбоновой кислоты . Остальные три, сложный эфир , ангидрид и амид , все являются производными карбоновой кислоты, что означает, что они могут быть получены с использованием карбоновой кислоты в качестве исходного материала.Для этих трех функциональных групп важно помнить, что часть «W» должна рассматриваться вместе с C=O, и в целом она правильно определяет функциональную группу. Например, COOR представляет собой сложный эфир; это не может быть распознано как «кетон» плюс «эфир».
Рис. 2.3k Карбоновая кислота (COOH/CO2H), сложный эфир (COOR/CO2R), ангидрид и амид
Валентность — наука
Комбинирующая способность элемента называется его валентностью. Нажмите здесь, чтобы найти валентность первых 103 элементов таблицы Менделеева
Нажмите здесь, чтобы найти валентность первых 103 элементов таблицы Менделеева1+ | 2+ | 3+ | 1 | 2 | 3- | |
| h 1+ | мг 2+ | AL 3+ | F 1- | 1- O 2- Оксид | PO4 3- PoSphate | |
| Na 1+ | CA 2+ | Fe 3+ Ferric | CL 1- | S 2- Сульфид | 9 04446 | |
| LI 1+ | CU 2+ | BR 1- | CO 3 2- карбонат | |||
| K 1+ | Zn 2+ | OH 1- 4 2- 2-
| ||||
| AG 1+ | PB 2+ | 6 | NO 3 1-
| |||
| NH 4 1+ аммоний | Fe 2+ FE 2+ Fe | HCO 3 1- бикарбонат |
 Ознакомьтесь с валентностями различных радикалов.
Ознакомьтесь с валентностями различных радикалов.Перейти к Edmodo.com и войти в систему с ei1yt0, как код и попытка листа назвать некоторые радикалы и дать молекулярную формулу для некоторых соединений
| Valuction | Radialсимвол | Ион | |
| Моновалентная [1] | Гипохлорит ClO | ClO 1- | |
| Хлорит ClO 2 | ClO 2 | 1||
| хлорат | ClO 3 | ClO 3 | 1|
| перхлорат ClO 4 | ClO 4 | 1-||
| гипобромитом BrO | BrO 1- | ||
| Бромит | BrO 2 | BrO 2 1- | |
| Бромат BrO 3 | BrO 3 | 1||
| пербромат BrO 4 | BrO 4 | 1||
| гипоиодит IO | И. О. О. | 1||
| йодит IO 2 | И.О. 2 | 1||
| йодат IO 3 | И.О. 3 | 1||
| Периодатное | 4 IO | 4 IO | 1|
| Гидроксид ОН | ОН 1- | ||
| Нитриты NO 2 | NO 2 1- | ||
| Нитрат | НЕТ 3 | НЕТ 3 1- | HCO 3 9 HCO 3 1- 1- |
| HSO 3 1- | |||
| Bisulfate [Водород Сульфат] | HSO 4 | HSO 4 1- | | |
| Diгидроген фосфат | H 2 Po 4 H 2 PO 4 1- | ||
| Цианид CN | CN 1- | ||
| цианат CNO | CNO 1- | ||
| тиоцианат SCN | SCN 1- | ||
Перманганат Mno 4 4 | MNO 4 1- | | ||
| ацетат | C 2 H 3 O 2 | C 2 H 2 H 3 H 3 O 2 1- | |
| Divalent [2] | Peroxide 2 | 2 6O 2 2- | |
| карбонат | CO 3 3 2- | ||
| Sulfite | SO 3 6 3 3 2- | ||
| Сульфат | SO 4 | 4 2- | |
| Thiosulfate | |||
| S 2 O 3 O 3 O 3 O 3 O 3 2- 6 2- | |||
| Бифосфат [Водосфат] | HPO 4 | HPO 4 2- | |
| CRO 4 6 4 | CRO 4 2- | ||
| DichRomate | 9 0659 CR 2 O 7CR 2 O 7 2- | 2-||
| Oxalate 0 | C 2 O 4 O 4 46 C 2 O 4 2 — | ||
| Trualent [3] | Phosphite | Po 3 3 3- | 3-|
| Phosphate | Po 4 6 | PO 4 3- |
СВЯЗНО-ВАЛЕНТНЫЙ ПОДХОД К СТРУКТУРЕ, ХИМИЧЕСКОМУ И ПАРАГЕНЕЗУ ГИДРОКСИДНО-ГИДРАТНЫХ ОКСИСОЛЕВЫХ МИНЕРАЛОВ.
 I. ТЕОРИЯ | Канадский минералог
I. ТЕОРИЯ | Канадский минералог О разделении кристаллической структуры минерала на две части: (1) Структурная единица , Управление полиэдров и валентность анионных связей, и т. д. (2) le complexe interstitiel , unagement de cations à gros rayon et faible valence, d’anions simples, et de groupes (H 2 O), généralement à caractère cationique. Комплексы межузельных взаимодействий, соединяющие комплексы с молекулярными связями катион-анион и гидрогенными связями, несовместимы с прежней структурой.La décomposition d’unestructure est généralement régie par la force des liaisons les plus faibles qui lient les unitésstructures les unes aux autres. Интерстициальный комплекс является общим комплексом катионов и имеет характерный селон-сын , ацидит-де-Льюис , и имеет определенное сродство к электронам. Структурная единица, представляющая собой общий оксианионный комплекс, и прочее, характерное для , базисное по Льюису . L’interaction entre l’unitéstructurele et le complexe interstitiel peut se quantifier selon le principe de la соответствие валентностей де liaisons. Dans une série destructures ayant la meme unitéstructurele, il est évident que la coordinance moyenne des atomes d’oxygene dans l’unitéstructurele varie legerement d’une framework à l’autre, menant à un intervalle de baseité de Lewis pour cette unité структурные особенности. Ainsi, une Telle Unité Structurele Peut être Stable Sur Un intervalle de baselité de Lewis, c’est-à-dire, de pH. На Peut Ecreire La Формул D’un Complede Interstitiel De La Façon Suivante: { [ м ] M + A [ N ] M 2+ B [ L ] M 3+ C (H 2 O) D (H 2 O) E (OH) F (H 2 O) G } ( A + 2B + 3C — F ) + , выражение Dans Laquelle [ N ], [ M ] ET [ l ] экспериментальная координация, a, b et c представляет номер катионов одновалентных, двухвалентных и трехвалентных соединений, d est номбр де групп де (H 2 9010 10 10 10 10 10 10 10 10 10 10 014 О) e est le nombre de groupes de (H 2 O) состоит из двух катионов i Interstitiels ou un катион interstitiel et участник à une liaison hydrogène, f est le nombre de groupes (OH) interstitiels, et g представляют nombre de groupes (H 2 O) без катиона.
Dans une série destructures ayant la meme unitéstructurele, il est évident que la coordinance moyenne des atomes d’oxygene dans l’unitéstructurele varie legerement d’une framework à l’autre, menant à un intervalle de baseité de Lewis pour cette unité структурные особенности. Ainsi, une Telle Unité Structurele Peut être Stable Sur Un intervalle de baselité de Lewis, c’est-à-dire, de pH. На Peut Ecreire La Формул D’un Complede Interstitiel De La Façon Suivante: { [ м ] M + A [ N ] M 2+ B [ L ] M 3+ C (H 2 O) D (H 2 O) E (OH) F (H 2 O) G } ( A + 2B + 3C — F ) + , выражение Dans Laquelle [ N ], [ M ] ET [ l ] экспериментальная координация, a, b et c представляет номер катионов одновалентных, двухвалентных и трехвалентных соединений, d est номбр де групп де (H 2 9010 10 10 10 10 10 10 10 10 10 10 014 О) e est le nombre de groupes de (H 2 O) состоит из двух катионов i Interstitiels ou un катион interstitiel et участник à une liaison hydrogène, f est le nombre de groupes (OH) interstitiels, et g представляют nombre de groupes (H 2 O) без катиона. Имя группы (H 2 O) влияет на усиление кислотности межузельного комплекса Льюиса, а также на изменение кислотности интерстициального комплекса Льюиса, который в целом представляет графическое представление в функции номера группы de (H 2 O) трансформаторы. Où l’acidité de Lewis d’une complexe interstitial généralisé соответствует à l’intervalle en basicité de Lewis d’une unité структурный particulière, le principe de соответствие валентностей связи est satisfait, et unagencement stable est doncвозможный.Nous examinons une collection de minéraux boratés de ce point de vue. Или важные ограничения, касающиеся деталей интерстициальных комплексов, мема в кассах боратов и комплексов. Nous essions de comprendre ce qui control la collection des minéraux du groupe des oxysels комплексы, et nous croyons que notre démarche contribue à atteindre cet objectif.
Имя группы (H 2 O) влияет на усиление кислотности межузельного комплекса Льюиса, а также на изменение кислотности интерстициального комплекса Льюиса, который в целом представляет графическое представление в функции номера группы de (H 2 O) трансформаторы. Où l’acidité de Lewis d’une complexe interstitial généralisé соответствует à l’intervalle en basicité de Lewis d’une unité структурный particulière, le principe de соответствие валентностей связи est satisfait, et unagencement stable est doncвозможный.Nous examinons une collection de minéraux boratés de ce point de vue. Или важные ограничения, касающиеся деталей интерстициальных комплексов, мема в кассах боратов и комплексов. Nous essions de comprendre ce qui control la collection des minéraux du groupe des oxysels комплексы, et nous croyons que notre démarche contribue à atteindre cet objectif.
(Traduit par la Rédaction)
Свободные радикалы — Химия LibreTexts
В химии радикал (точнее, свободный радикал ) представляет собой атом, молекулу или ион, который имеет неспаренные валентные электроны или открытую валентность. электронной оболочке и, следовательно, может рассматриваться как имеющая одну или несколько «оборванных» ковалентных связей.
электронной оболочке и, следовательно, может рассматриваться как имеющая одну или несколько «оборванных» ковалентных связей.
За некоторыми исключениями, эти «висячие» связи делают свободные радикалы очень химически реактивными по отношению к другим веществам или даже к самим себе: их молекулы часто самопроизвольно димеризуются или полимеризуются, если они вступают в контакт друг с другом. Большинство радикалов достаточно стабильны только при очень низких концентрациях в инертных средах или в вакууме.
Ярким примером свободного радикала является гидроксильный радикал (HO•), молекула, которая на один атом водорода меньше молекулы воды и, таким образом, имеет одну связь, «подвешенную» к кислороду.Двумя другими примерами являются молекула карбена ( : Ch3), которая имеет две оборванные связи; и супероксидный анион (•O−2), молекула кислорода O2 с одним дополнительным электроном, которая имеет одну оборванную связь. Напротив, анион гидроксила (HO-), анион оксида (O2-) и катион карбения (CH+3) не являются радикалами, поскольку связи, которые могут казаться оборванными, на самом деле разрешаются путем добавления или удаления электронов. .
.
Свободные радикалы могут быть созданы различными способами, включая синтез с очень разбавленными или разреженными реагентами, реакции при очень низких температурах или расщепление более крупных молекул.На последнюю может повлиять любой процесс, который вкладывает достаточно энергии в исходную молекулу, например, ионизирующее излучение, тепло, электрические разряды, электролиз и химические реакции. Действительно, радикалы являются промежуточными стадиями во многих химических реакциях.
Свободные радикалы играют важную роль в горении, химии атмосферы, полимеризации, плазмохимии, биохимии и многих других химических процессах. В живых организмах свободные радикалы супероксид и оксид азота и продукты их реакции регулируют многие процессы, такие как контроль тонуса сосудов и, следовательно, артериального давления.Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут даже быть посредниками в процессе, получившем название окислительно-восстановительной передачи сигналов. Радикал может быть захвачен растворяющей клеткой или связан иным образом.
Радикал может быть захвачен растворяющей клеткой или связан иным образом.
До конца 20-го века слово «радикал» использовалось в химии для обозначения любой связанной группы атомов, такой как метильная группа или карбоксильная группа, независимо от того, была ли она частью более крупной молекулы или молекулой сама по себе. Затем квалификатор «свободный» был необходим для указания несвязанного случая.После недавних изменений номенклатуры часть более крупной молекулы теперь называется функциональной группой или заместителем, а «радикал» теперь означает «свободный». Однако старая номенклатура все еще может встречаться в литературе.
История
Первым идентифицированным органическим свободным радикалом был трифенилметильный радикал. Этот вид был открыт Моисеем Гомбергом в 1900 году в Мичиганском университете США. Исторически термин радикал в радикальной теории также использовался для связанных частей молекулы, особенно когда они остаются неизменными в реакциях. Теперь их называют функциональными группами. Например, метиловый спирт был описан как состоящий из метильного «радикала» и гидроксильного «радикала». Радикалы в современном химическом смысле также не являются радикалами, поскольку они постоянно связаны друг с другом и не имеют неспаренных реактивных электронов; однако их можно наблюдать как радикалы в масс-спектрометрии, когда они распадаются при облучении энергичными электронами.
Теперь их называют функциональными группами. Например, метиловый спирт был описан как состоящий из метильного «радикала» и гидроксильного «радикала». Радикалы в современном химическом смысле также не являются радикалами, поскольку они постоянно связаны друг с другом и не имеют неспаренных реактивных электронов; однако их можно наблюдать как радикалы в масс-спектрометрии, когда они распадаются при облучении энергичными электронами.
Изображение химических реакций
В химических уравнениях свободные радикалы часто обозначаются точкой, расположенной непосредственно справа от символа атома или молекулярной формулы следующим образом:
- Газообразный хлор может быть расщеплен ультрафиолетовым светом с образованием радикалов атомарного хлора .
Механизмы радикальных реакций используют однонаправленные стрелки для обозначения движения отдельных электронов:
Гомолитический разрыв разрывной связи показан стрелкой в виде «рыболовного крючка», чтобы отличить его от обычного движения двух электронов, изображенного стандартной фигурной стрелкой. Следует отметить, что второй электрон разрывающей связи также движется, чтобы соединиться с атакующим радикальным электроном; в данном случае это явно не указано.
Следует отметить, что второй электрон разрывающей связи также движется, чтобы соединиться с атакующим радикальным электроном; в данном случае это явно не указано.
Свободные радикалы также принимают участие в радикальном присоединении и радикальном замещении в качестве реакционноспособных промежуточных продуктов.Цепные реакции с участием свободных радикалов обычно можно разделить на три отдельных процесса. Это инициация , распространение и завершение .
- Инициирование реакций — это реакции, которые приводят к чистому увеличению количества свободных радикалов. Они могут включать образование свободных радикалов из стабильных частиц, как в приведенной выше реакции 1, или они могут включать реакции свободных радикалов со стабильными частицами с образованием большего количества свободных радикалов.
- Реакции размножения — это реакции с участием свободных радикалов, в которых общее количество свободных радикалов остается неизменным.

- Прекращение реакции — это реакции, приводящие к общему уменьшению количества свободных радикалов. Обычно два свободных радикала объединяются, образуя более стабильные соединения, например: 2Cl · → Cl 2
Формирование
Образование радикалов может включать гомолитический разрыв ковалентных связей, процесс, требующий значительного количества энергии.Например, расщепление H 2 на 2H · имеет Δ H ° +435 кДж/моль, а Cl 2 на 2Cl · имеет Δ H ° +243 кДж/моль. . Это известно как энергия диссоциации гомолитической связи и обычно обозначается аббревиатурой Δ H °. На энергию связи между двумя ковалентно связанными атомами влияет структура молекулы в целом, а не только идентичность двух атомов. Точно так же радикалы, для образования которых требуется больше энергии, менее стабильны, чем радикалы, для образования которых требуется меньше энергии. Гомолитический разрыв связи чаще всего происходит между двумя атомами с одинаковой электроотрицательностью. В органической химии это часто связь O-O в пероксидных соединениях или связи O-N. Иногда образование радикалов запрещено по спину, что представляет собой дополнительный барьер. Однако размножение является очень экзотермической реакцией. Точно так же, хотя ионы-радикалы существуют, большинство видов электрически нейтральны. Радикалы также могут образовываться при окислении или восстановлении атома или молекулы одним электроном. Примером может служить производство супероксида электрон-транспортной цепью.Ранние исследования металлоорганической химии, особенно соединений тетраалкилсвинца, проведенные Ф. А. Панетом и К. Ханфельдом в 1930-х годах, подтвердили гетеролитическое расщепление связей и механизм, основанный на радикалах.
Гомолитический разрыв связи чаще всего происходит между двумя атомами с одинаковой электроотрицательностью. В органической химии это часто связь O-O в пероксидных соединениях или связи O-N. Иногда образование радикалов запрещено по спину, что представляет собой дополнительный барьер. Однако размножение является очень экзотермической реакцией. Точно так же, хотя ионы-радикалы существуют, большинство видов электрически нейтральны. Радикалы также могут образовываться при окислении или восстановлении атома или молекулы одним электроном. Примером может служить производство супероксида электрон-транспортной цепью.Ранние исследования металлоорганической химии, особенно соединений тетраалкилсвинца, проведенные Ф. А. Панетом и К. Ханфельдом в 1930-х годах, подтвердили гетеролитическое расщепление связей и механизм, основанный на радикалах.
Стойкость и стабильность
Хотя радикалы обычно недолговечны из-за их реакционной способности, существуют долгоживущие радикалы. Они подразделяются на следующие категории:
Они подразделяются на следующие категории:
- Стабильные радикалы
Ярким примером стабильного радикала является молекулярный дикислород (O 2 ).Другим распространенным примером является оксид азота (NO). Органические радикалы могут быть долгоживущими, если они встречаются в сопряженной π-системе, такой как радикал, полученный из α-токоферола (витамин Е). Существуют также сотни примеров тиазильных радикалов, которые демонстрируют низкую реакционную способность и замечательную термодинамическую стабильность с очень ограниченной степенью стабилизации π-резонанса. [1] [2]
- Стойкие радикалы
Стойкие радикальные соединения — это соединения, долговечность которых обусловлена стерическим скоплением вокруг радикального центра, что физически затрудняет реакцию радикала с другой молекулой. [3] Их примеры включают трифенилметильный радикал Гомберга, соль Фреми (нитрозодисульфонат калия, (KSO 3 ) 2 NO·), нитроксиды (общая формула R 2 NO·), такие как TEMPO, TEMPOL, нитронилнитрокси и азефениленилы и радикалы, полученные из PTM (перхлорфенилметильный радикал) и TTM (трис(2,4,6-трихлорфенил)метильный радикал).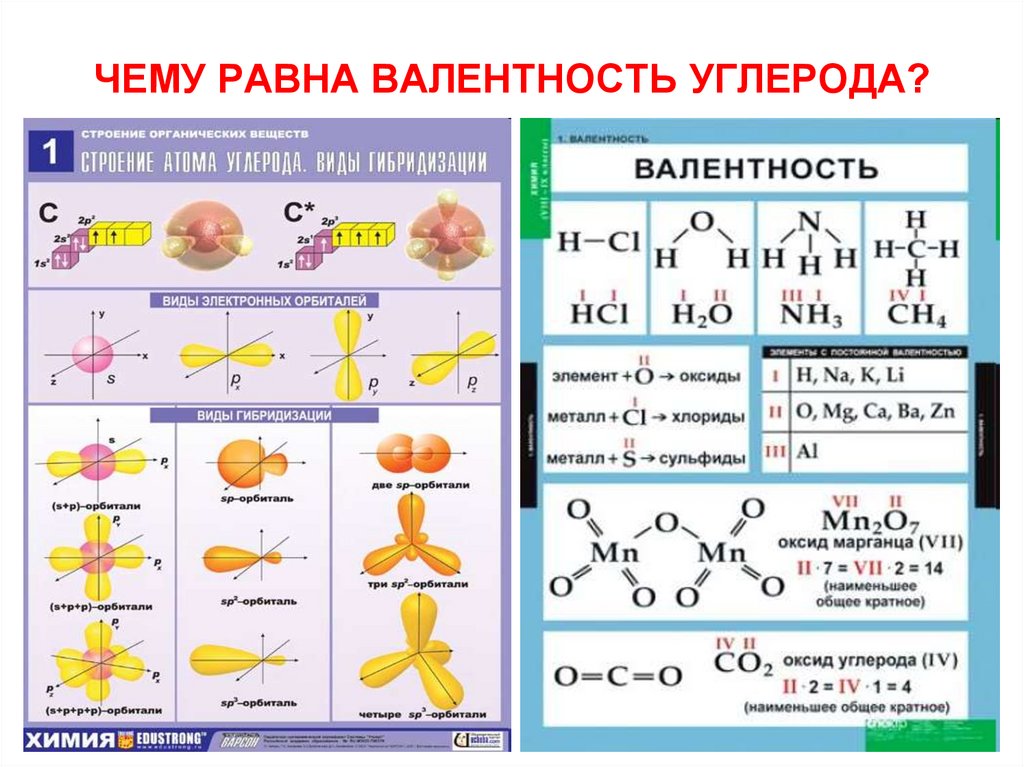 Стойкие радикалы образуются в большом количестве во время сгорания и «могут быть ответственны за окислительный стресс, приводящий к сердечно-легочным заболеваниям и, возможно, раку, который связывают с воздействием переносимых по воздуху мелких частиц.» [4]
Стойкие радикалы образуются в большом количестве во время сгорания и «могут быть ответственны за окислительный стресс, приводящий к сердечно-легочным заболеваниям и, возможно, раку, который связывают с воздействием переносимых по воздуху мелких частиц.» [4]
- Дирадикалы
Дирадикалы представляют собой молекулы, содержащие два радикальных центра. В молекуле может существовать несколько радикальных центров. Атмосферный кислород в природе существует в виде бирадикала в основном состоянии в виде триплетного кислорода. Низкая реакционная способность атмосферного кислорода обусловлена его бирадикальным состоянием. Нерадикальные состояния дикислорода на самом деле менее стабильны, чем бирадикал. Относительная стабильность бирадикала кислорода в первую очередь связана с запрещенным по спину характером триплет-синглетного перехода, необходимого для захвата им электронов, т.е.д., «окислять». Дирадикальное состояние кислорода также приводит к его парамагнитному характеру, о чем свидетельствует его притяжение к внешнему магниту. [5]
[5]
Реактивность
Промежуточные радикальные алкилы стабилизируются с помощью физических процессов, аналогичных карбокатионам: как правило, чем более замещен радикальный центр, тем он более стабилен. Это направляет их реакцию. Таким образом, образование третичного радикала (R 3 C·) предпочтительнее вторичного (R 2 HC·), которое предпочтительнее первичного (RH 2 C·).Точно так же радикалы рядом с функциональными группами, такими как карбонил, нитрил и простой эфир, более стабильны, чем третичные алкильные радикалы.
Радикалы атакуют двойные связи. Однако, в отличие от подобных ионов, такие радикальные реакции не так сильно управляются электростатическими взаимодействиями. Например, реакционная способность нуклеофильных ионов с α,β-ненасыщенными соединениями (C=C–C=O) обусловлена электроноакцепторным эффектом кислорода, что приводит к частичному положительному заряду карбонильного углерода. В ионном случае наблюдаются две реакции: атака карбонила при прямом присоединении к карбонилу или атака винила при сопряженном присоединении, и в любом случае заряд нуклеофила принимает кислород. Радикалы быстро присоединяются к двойной связи, и образующийся α-радикал карбонил относительно стабилен; он может соединяться с другой молекулой или окисляться. Тем не менее электрофильный/нейтрофильный характер радикалов был показан во множестве случаев. Одним из примеров является чередующаяся тенденция сополимеризации малеинового ангидрида (электрофильный) и стирола (слабо нуклеофильный).
Радикалы быстро присоединяются к двойной связи, и образующийся α-радикал карбонил относительно стабилен; он может соединяться с другой молекулой или окисляться. Тем не менее электрофильный/нейтрофильный характер радикалов был показан во множестве случаев. Одним из примеров является чередующаяся тенденция сополимеризации малеинового ангидрида (электрофильный) и стирола (слабо нуклеофильный).
Во внутримолекулярных реакциях можно добиться точного контроля, несмотря на чрезвычайную реакционную способность радикалов.Как правило, радикалы атакуют ближайший реактивный сайт с наибольшей готовностью. Поэтому при наличии выбора наблюдается предпочтение пятичленных колец: четырехчленные кольца слишком напряжены, а столкновения с атомами углерода, отстоящими на шесть и более атомов в цепи, нечасты.
Карбены и нитрены, которые являются бирадикалами, имеют характерный химический состав.
Горение
Спектр голубого пламени бутановой горелки, показывающий излучение полосы возбужденного молекулярного радикала и полосы Свана
Знакомой свободнорадикальной реакцией является горение. Молекула кислорода представляет собой стабильный бирадикал, лучше всего представленный как ·O-O·. Поскольку спины электронов параллельны, эта молекула стабильна. В то время как основное состояние кислорода представляет собой этот нереакционноспособный спин-неспаренный (триплетный) бирадикал, доступно чрезвычайно реактивное спин-спаренное (синглетное) состояние. Чтобы произошло горение, необходимо преодолеть энергетический барьер между ними. Этот барьер можно преодолеть с помощью тепла, требующего высоких температур. Триплет-синглетный переход также «запрещен». Это создает дополнительный барьер для реакции.Это также означает, что молекулярный кислород относительно неактивен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Молекула кислорода представляет собой стабильный бирадикал, лучше всего представленный как ·O-O·. Поскольку спины электронов параллельны, эта молекула стабильна. В то время как основное состояние кислорода представляет собой этот нереакционноспособный спин-неспаренный (триплетный) бирадикал, доступно чрезвычайно реактивное спин-спаренное (синглетное) состояние. Чтобы произошло горение, необходимо преодолеть энергетический барьер между ними. Этот барьер можно преодолеть с помощью тепла, требующего высоких температур. Триплет-синглетный переход также «запрещен». Это создает дополнительный барьер для реакции.Это также означает, что молекулярный кислород относительно неактивен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Горение состоит из различных радикальных цепных реакций, которые может инициировать синглетный радикал. Воспламеняемость данного материала сильно зависит от концентрации свободных радикалов, которая должна быть получена до того, как преобладают реакции инициирования и распространения, ведущие к горению материала. После того, как горючее вещество израсходовано, снова начинают преобладать реакции обрыва, и пламя гаснет.Как указано, стимулирование реакций распространения или прекращения изменяет воспламеняемость. Например, поскольку свинец сам по себе дезактивирует свободные радикалы в бензино-воздушной смеси, когда-то в бензин обычно добавляли тетраэтилсвинец. Это предотвращает неконтролируемое инициирование сгорания или несгоревших остатков (детонация двигателя) или преждевременное воспламенение (преждевременное зажигание).
После того, как горючее вещество израсходовано, снова начинают преобладать реакции обрыва, и пламя гаснет.Как указано, стимулирование реакций распространения или прекращения изменяет воспламеняемость. Например, поскольку свинец сам по себе дезактивирует свободные радикалы в бензино-воздушной смеси, когда-то в бензин обычно добавляли тетраэтилсвинец. Это предотвращает неконтролируемое инициирование сгорания или несгоревших остатков (детонация двигателя) или преждевременное воспламенение (преждевременное зажигание).
При сгорании углеводорода участвует большое количество различных кислородных радикалов. Первоначально образуются гидропероксильные радикалы (HOO·).Затем они вступают в дальнейшую реакцию с образованием органических гидропероксидов, которые распадаются на гидроксильные радикалы (HO·).
Полимеризация
Помимо горения, во многих реакциях полимеризации участвуют свободные радикалы. В результате путем радикальной полимеризации образуются многие пластмассы, эмали и другие полимеры. Например, олифы и алкидные краски затвердевают за счет радикального сшивания кислородом из атмосферы.
Например, олифы и алкидные краски затвердевают за счет радикального сшивания кислородом из атмосферы.
Недавние достижения в методах радикальной полимеризации, известные как живая радикальная полимеризация, включают:
- Обратимая передача цепи присоединения-фрагментации (ОПЦП)
- Радикальная полимеризация с переносом атома (ATRP)
- Полимеризация, опосредованная нитроксидом (NMP)
Эти методы позволяют получать полимеры с гораздо более узким распределением молекулярной массы.
Атмосферные радикалы
Наиболее распространенным радикалом в нижних слоях атмосферы является молекулярный кислород. Фотодиссоциация исходных молекул приводит к образованию других свободных радикалов. В нижних слоях атмосферы наиболее важными примерами образования свободных радикалов являются фотодиссоциация диоксида азота с образованием атома кислорода и оксида азота (см. уравнение 1 ниже), играющего ключевую роль в образовании смога, и фотодиссоциация озона с образованием дают возбужденный атом кислорода O (1D) (см.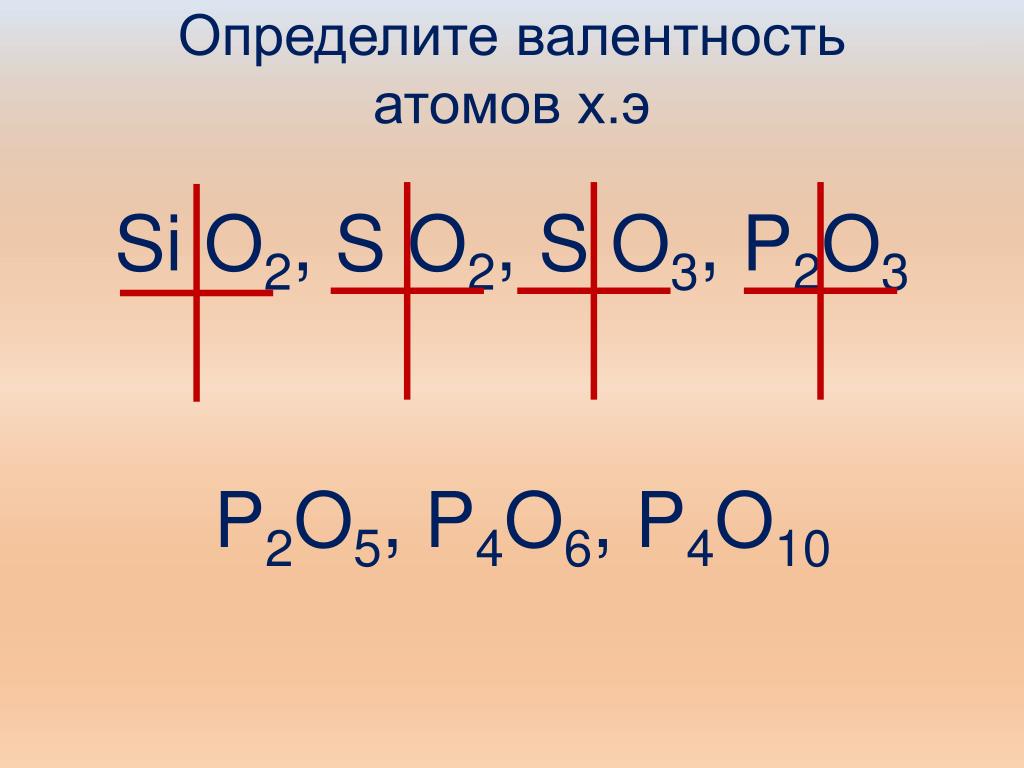 уравнение 2 ниже).Также показаны чистая и обратная реакции (ур. 3 и 4 соответственно).
уравнение 2 ниже).Также показаны чистая и обратная реакции (ур. 3 и 4 соответственно).
В верхних слоях атмосферы особенно важным источником радикалов является фотодиссоциация обычно нереакционноспособных хлорфторуглеродов (ХФУ) под воздействием солнечного ультрафиолетового излучения или в результате реакций с другими компонентами стратосферы (см. уравнение 1 ниже). В этих реакциях выделяется радикал хлора Cl•, который реагирует с озоном в каталитической цепной реакции, заканчивающейся истощением озона и регенерацией радикала хлора, что позволяет ему снова участвовать в реакции (см.2–4 ниже). Считается, что такие реакции являются основной причиной разрушения озонового слоя (общий результат показан в уравнении 5 ниже), поэтому использование хлорфторуглеродов в качестве хладагентов ограничено.
По биологии
Свободные радикалы играют важную роль в ряде биологических процессов. Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитирующими клетками, такими как гранулоциты и макрофаги.Исследователи также установили, что свободные радикалы участвуют в некоторых процессах клеточной передачи сигналов, [6] , известных как передача окислительно-восстановительных сигналов.
Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитирующими клетками, такими как гранулоциты и макрофаги.Исследователи также установили, что свободные радикалы участвуют в некоторых процессах клеточной передачи сигналов, [6] , известных как передача окислительно-восстановительных сигналов.
Двумя наиболее важными свободными радикалами с кислородным центром являются супероксид и гидроксильный радикал. Они образуются из молекулярного кислорода в восстановительных условиях. Однако из-за своей реакционной способности эти же свободные радикалы могут участвовать в нежелательных побочных реакциях, приводящих к повреждению клеток. Чрезмерное количество этих свободных радикалов может привести к повреждению и гибели клеток, что может способствовать развитию многих заболеваний, таких как рак, инсульт, инфаркт миокарда, диабет и серьезные расстройства. [7] Считается, что многие формы рака являются результатом реакций между свободными радикалами и ДНК, что может привести к мутациям, которые могут неблагоприятно повлиять на клеточный цикл и привести к злокачественным новообразованиям. [8] Некоторые симптомы старения, такие как атеросклероз, также связаны со свободным радикальным окислением холестерина до 7-кетохолестерола. [9] Кроме того, свободные радикалы способствуют повреждению печени, вызванному алкоголем, возможно, больше, чем сам алкоголь.Свободные радикалы, выделяемые сигаретным дымом, участвуют в инактивации альфа-1-антитрипсина в легких. Этот процесс способствует развитию эмфиземы легких.
[8] Некоторые симптомы старения, такие как атеросклероз, также связаны со свободным радикальным окислением холестерина до 7-кетохолестерола. [9] Кроме того, свободные радикалы способствуют повреждению печени, вызванному алкоголем, возможно, больше, чем сам алкоголь.Свободные радикалы, выделяемые сигаретным дымом, участвуют в инактивации альфа-1-антитрипсина в легких. Этот процесс способствует развитию эмфиземы легких.
Свободные радикалы также могут быть связаны с болезнью Паркинсона, старческой и лекарственной глухотой, шизофренией и болезнью Альцгеймера. [10] Классический свободнорадикальный синдром, гемохроматоз, связанный с болезнью накопления железа, обычно сочетается с комплексом симптомов, связанных со свободными радикалами, включая двигательные расстройства, психоз, аномалии пигментного меланина кожи, глухоту, артрит и сахарный диабет. .Свободнорадикальная теория старения предполагает, что свободные радикалы лежат в основе самого процесса старения. Точно так же процесс митогормезиса предполагает, что многократное воздействие свободных радикалов может увеличить продолжительность жизни.
Точно так же процесс митогормезиса предполагает, что многократное воздействие свободных радикалов может увеличить продолжительность жизни.
Поскольку свободные радикалы необходимы для жизни, в организме имеется ряд механизмов, позволяющих свести к минимуму повреждения, вызванные свободными радикалами, и восстанавливать возникающие повреждения, такие как ферменты супероксиддисмутаза, каталаза, глутатионпероксидаза и глутатионредуктаза. Кроме того, антиоксиданты играют ключевую роль в этих защитных механизмах.Часто это три витамина: витамин А, витамин С и витамин Е, а также полифенольные антиоксиданты. Кроме того, есть убедительные доказательства того, что билирубин и мочевая кислота могут действовать как антиоксиданты, помогая нейтрализовать определенные свободные радикалы. Билирубин образуется в результате распада содержимого эритроцитов, а мочевая кислота является продуктом распада пуринов. Однако слишком много билирубина может привести к желтухе, которая в конечном итоге может повредить центральную нервную систему, а слишком много мочевой кислоты вызывает подагру. [11]
[11]
Активные формы кислорода
Активные формы кислорода или АФК представляют собой такие виды, как супероксид, перекись водорода и гидроксильный радикал, которые связаны с повреждением клеток. АФК образуются как естественный побочный продукт нормального метаболизма кислорода и играют важную роль в передаче сигналов клетками.
Было обнаружено, чтоОксибензон образует свободные радикалы на солнце и, следовательно, также может быть связан с повреждением клеток. Это происходило только тогда, когда его смешивали с другими ингредиентами, обычно встречающимися в солнцезащитных кремах, такими как оксид титана и октилметоксициннамат. [12]
Свободное определение радикалов
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевой спин. Однако в областях, включая спектроскопию, химические реакции и астрохимию, определение немного отличается. Герхард Герцберг, получивший Нобелевскую премию за исследования электронной структуры и геометрии радикалов, предложил более свободное определение свободных радикалов: «любые переходные (химически нестабильные) разновидности (атом, молекула или ион)». [13] Суть его предположения состоит в том, что существует много химически нестабильных молекул с нулевым спином, таких как C 2 , C 3 , CH 2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это расплывчатое определение. [14]
[13] Суть его предположения состоит в том, что существует много химически нестабильных молекул с нулевым спином, таких как C 2 , C 3 , CH 2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это расплывчатое определение. [14]
Диагностика
Методы диагностики свободных радикалов включают:
- Широко используемым методом изучения свободных радикалов и других парамагнитных частиц является спектроскопия электронного парамагнитного резонанса (ЭПР).Это также называют спектроскопией электронного парамагнитного резонанса (ЭПР). Концептуально это связано с ядерным магнитным резонансом, хотя электроны резонируют с более высокочастотными полями при заданном фиксированном магнитном поле, чем большинство ядер.
- Ядерный магнитный резонанс с использованием явления, называемого CIDNP
- Химическая маркировка
- Химическая маркировка путем гашения свободными радикалами, напр.
 с оксидом азота (NO) или DPPH (2,2-дифенил-1-пикрилгидразил) с последующими спектроскопическими методами, такими как рентгеновская фотоэлектронная спектроскопия (XPS) или абсорбционная спектроскопия, соответственно.
с оксидом азота (NO) или DPPH (2,2-дифенил-1-пикрилгидразил) с последующими спектроскопическими методами, такими как рентгеновская фотоэлектронная спектроскопия (XPS) или абсорбционная спектроскопия, соответственно.
- Использование маркеров свободных радикалов
- Стабильные, специфические или неспецифические производные физиологических веществ можно измерять, например. продукты перекисного окисления липидов (изопростаны, TBARS), продукты окисления аминокислот (мета-тирозин, орто-тирозин, гидрокси-Leu, дитирозин и др.), продукты окисления пептидов (окисленный глутатион – GSSG)
- 2,2′-Азобис(2-амидинопропан) дигидрохлорид (AAPH) представляет собой химическое соединение, используемое для изучения химии окисления лекарств. [15] Это азосоединение, генерирующее свободные радикалы. Он приобретает известность как модельный окислитель в низкомолекулярных и белковых терапевтических средствах благодаря своей способности инициировать реакции окисления как по нуклеофильным, так и по свободнорадикальным механизмам.
 Окли, Ричард Т. Вербер, Джей; Ван, Ю. Джон; Миллиган, Майкл; Ли, Сяохуа; Джи, Джунян А. (2011). «Анализ разложения и гидролиза 2,2′-азобис (2-амидинопропана) дигидрохлорида в водных растворах». Journal of Pharmaceutical Sciences 100 (8): 3307–15. дои: 10.1002/jps.22578. PMID 21560126.
Окли, Ричард Т. Вербер, Джей; Ван, Ю. Джон; Миллиган, Майкл; Ли, Сяохуа; Джи, Джунян А. (2011). «Анализ разложения и гидролиза 2,2′-азобис (2-амидинопропана) дигидрохлорида в водных растворах». Journal of Pharmaceutical Sciences 100 (8): 3307–15. дои: 10.1002/jps.22578. PMID 21560126.структура Льюиса Ч4ОН, молекулярная геометрия и форма
Метанол или метиловый спирт — одно из соединений, которые используются для понимания молекулярной геометрии, связей и многого другого в органической химии.Это соединение имеет гидроксильную группу (ОН), присоединенную к метильной группе, поэтому оно и получило свое название «метиловый спирт». Чтобы вам было легче понять, предположим, что один атом водорода метана или Ch5 замещен гидроксильной группой, в результате чего метанол имеет химическую формулу Ch4OH .
Метиловый спирт представляет собой светлую бесцветную летучую жидкость со спиртовым запахом, похожим на этанол.
 Структуру молекулы легко понять, и этот пример также можно использовать для изучения более сложных структур в органической химии.Чтобы понять структуру и форму этого соединения, важно знать его валентные электроны и структуру Льюиса.
Структуру молекулы легко понять, и этот пример также можно использовать для изучения более сложных структур в органической химии.Чтобы понять структуру и форму этого соединения, важно знать его валентные электроны и структуру Льюиса.
Ch4OH Валентные электроныМетанол состоит из одного атома углерода, трех атомов водорода и одной гидроксильной группы. Чтобы узнать общее количество валентных электронов, мы должны знать валентные электроны всех атомов по отдельности:
У углерода четыре валентных электрона на внешней оболочке, следовательно, валентных электронов в углероде = 4.
Водород имеет только один валентный электрон, но поскольку в этом соединении три атома водорода, общее количество валентных электронов для водорода = 3*1= 3,
Кислород имеет шесть валентных электронов на внешней оболочке и нуждается в двух электронах, чтобы следовать правилу октетов; следовательно, его валентность равна 6,
.
Водород, присоединенный к кислороду в гидроксильной группе, имеет один валентный электрон; следовательно, его валентность равна 1,
.Общее число валентных электронов в Ch4OH = 4 + 3+6+1
= 14
Таким образом, общее число валентных электронов в Ch4OH (метанол) равно 14.
Правило октета
В химии все атомы имеют тенденцию становиться инертными, достигая электронной конфигурации благородного газа , который имеет восемь электронов на внешней оболочке. Следовательно, все атомы имеют тенденцию образовывать связи при достижении этой конфигурации и становятся стабильными. У этого правила есть некоторые исключения в химии, но в основном все элементы следуют этому правилу октета.
Ch4OH Структура ЛьюисаТочечная структура Льюиса — это графическое изображение молекулы, ее связи с другими атомами и расположения атомов в соединении.
 Это помогает узнать количество связанных электронов, неподеленных пар и молекулярную форму соединения. Валентные электроны помогают нарисовать эту структуру Льюиса, так как все электроны показаны точками, а прямые линии представляют связи, образованные между молекулами.
Это помогает узнать количество связанных электронов, неподеленных пар и молекулярную форму соединения. Валентные электроны помогают нарисовать эту структуру Льюиса, так как все электроны показаны точками, а прямые линии представляют связи, образованные между молекулами.Здесь в Ch4OH,
Всего в соединении 14 валентных электронов. У углерода стерическое число 4, так как он имеет четыре валентных электрона во внешней оболочке. В метаноле углерод является центральным атомом, а все остальные атомы расположены вокруг него.
Чтобы нарисовать структуру, вы можете разместить четыре электрона (в виде точек) вокруг центрального атома углерода во всех четырех направлениях. Теперь все атомы водорода имеют один валентный электрон, и все эти три атома образуют связь с углеродом, разделяя один электрон атома углерода. Чтобы изобразить эти связи, проведите прямые линии между тремя атомами водорода и центральным атомом углерода.
Гидроксильная группа (ОН) разделяет один валентный электрон с углеродом, и, таким образом, эта гидроксильная группа образует одну связь с углеродом, разделяя его валентный электрон.
Ch4OH Молекулярная геометрия Во внешней оболочке атома кислорода осталось четыре валентных электрона, поскольку он делит один из своих шести валентных электронов с водородом, а другой с атомом углерода. Тем не менее, у атома кислорода есть четыре валентных электрона, которые образуют вокруг него две неподеленные пары электронов. Таким образом, все валентные электроны атомов углерода теперь образовали связи, и на центральном атоме углерода нет неподеленных пар или несвязанных электронов, но кислород имеет две неподеленные пары электронов.
Во внешней оболочке атома кислорода осталось четыре валентных электрона, поскольку он делит один из своих шести валентных электронов с водородом, а другой с атомом углерода. Тем не менее, у атома кислорода есть четыре валентных электрона, которые образуют вокруг него две неподеленные пары электронов. Таким образом, все валентные электроны атомов углерода теперь образовали связи, и на центральном атоме углерода нет неподеленных пар или несвязанных электронов, но кислород имеет две неподеленные пары электронов.Теперь, когда мы знаем структуру Льюиса Ch4OH, легко изобразить молекулярную геометрию соединения.Рисуя структуру Льюиса для Ch4OH, вы заметите, что атом углерода будет иметь три связи с тремя атомами водорода и одну связь с гидроксильной группой .
Поскольку углерод имеет четыре валентных электрона, которые образуют связи с другими атомами, он демонстрирует sp3-гибридизацию.
Форма Ch4OHГибридизация центрального атома (Углерод) в Ch4OH есть sp3, что означает, что он должен образовывать тетраэдрическую форму, но он не образует точно эту форму.
 Форма метанола изогнута, потому что гидроксильная группа (ОН) содержит две неподеленные пары электронов, которые вызывают отталкивание между связанной парой электронов и несвязанной парой электронов в соединении. Эти силы отталкивания приводят к информации изогнутой конструкции.
Форма метанола изогнута, потому что гидроксильная группа (ОН) содержит две неподеленные пары электронов, которые вызывают отталкивание между связанной парой электронов и несвязанной парой электронов в соединении. Эти силы отталкивания приводят к информации изогнутой конструкции.Согласно некоторым теориям также считается, что Ch4OH имеет два геометрических центра, один для атома углерода, а другой для атома кислорода в гидроксильной группе. Центральные атомы углерода образуют четыре сигма-связи и не имеют неподеленных пар, что приводит к образованию тетраэдра.Одновременно атом кислорода образует две сигма-связи и две неподеленные пары электронов, что вызывает искривление валентного угла из-за сил отталкивания. Таким образом, кислород имеет изогнутую тетраэдрическую форму, что приводит к изогнутой форме метанола.
Заключительные замечания
Структуру метанола или Ch4OH сравнительно легко изучить, так как валентность центрального атома углерода полностью удовлетворена, а неподеленные пары на атоме углерода отсутствуют.



 Для чистой воды = = 10 -7 ,
откуда -lg = 7.0.
Для чистой воды = = 10 -7 ,
откуда -lg = 7.0. Например, Cl — , NO — 3 ,
SO 2- 4 , Li + , Na + , K + .
Например, Cl — , NO — 3 ,
SO 2- 4 , Li + , Na + , K + . элементы
элементы
 с оксидом азота (NO) или DPPH (2,2-дифенил-1-пикрилгидразил) с последующими спектроскопическими методами, такими как рентгеновская фотоэлектронная спектроскопия (XPS) или абсорбционная спектроскопия, соответственно.
с оксидом азота (NO) или DPPH (2,2-дифенил-1-пикрилгидразил) с последующими спектроскопическими методами, такими как рентгеновская фотоэлектронная спектроскопия (XPS) или абсорбционная спектроскопия, соответственно. Окли, Ричард Т. Вербер, Джей; Ван, Ю. Джон; Миллиган, Майкл; Ли, Сяохуа; Джи, Джунян А. (2011). «Анализ разложения и гидролиза 2,2′-азобис (2-амидинопропана) дигидрохлорида в водных растворах». Journal of Pharmaceutical Sciences 100 (8): 3307–15. дои: 10.1002/jps.22578. PMID 21560126.
Окли, Ричард Т. Вербер, Джей; Ван, Ю. Джон; Миллиган, Майкл; Ли, Сяохуа; Джи, Джунян А. (2011). «Анализ разложения и гидролиза 2,2′-азобис (2-амидинопропана) дигидрохлорида в водных растворах». Journal of Pharmaceutical Sciences 100 (8): 3307–15. дои: 10.1002/jps.22578. PMID 21560126. Структуру молекулы легко понять, и этот пример также можно использовать для изучения более сложных структур в органической химии.Чтобы понять структуру и форму этого соединения, важно знать его валентные электроны и структуру Льюиса.
Структуру молекулы легко понять, и этот пример также можно использовать для изучения более сложных структур в органической химии.Чтобы понять структуру и форму этого соединения, важно знать его валентные электроны и структуру Льюиса.
 Это помогает узнать количество связанных электронов, неподеленных пар и молекулярную форму соединения. Валентные электроны помогают нарисовать эту структуру Льюиса, так как все электроны показаны точками, а прямые линии представляют связи, образованные между молекулами.
Это помогает узнать количество связанных электронов, неподеленных пар и молекулярную форму соединения. Валентные электроны помогают нарисовать эту структуру Льюиса, так как все электроны показаны точками, а прямые линии представляют связи, образованные между молекулами. Во внешней оболочке атома кислорода осталось четыре валентных электрона, поскольку он делит один из своих шести валентных электронов с водородом, а другой с атомом углерода. Тем не менее, у атома кислорода есть четыре валентных электрона, которые образуют вокруг него две неподеленные пары электронов. Таким образом, все валентные электроны атомов углерода теперь образовали связи, и на центральном атоме углерода нет неподеленных пар или несвязанных электронов, но кислород имеет две неподеленные пары электронов.
Во внешней оболочке атома кислорода осталось четыре валентных электрона, поскольку он делит один из своих шести валентных электронов с водородом, а другой с атомом углерода. Тем не менее, у атома кислорода есть четыре валентных электрона, которые образуют вокруг него две неподеленные пары электронов. Таким образом, все валентные электроны атомов углерода теперь образовали связи, и на центральном атоме углерода нет неподеленных пар или несвязанных электронов, но кислород имеет две неподеленные пары электронов. Форма метанола изогнута, потому что гидроксильная группа (ОН) содержит две неподеленные пары электронов, которые вызывают отталкивание между связанной парой электронов и несвязанной парой электронов в соединении. Эти силы отталкивания приводят к информации изогнутой конструкции.
Форма метанола изогнута, потому что гидроксильная группа (ОН) содержит две неподеленные пары электронов, которые вызывают отталкивание между связанной парой электронов и несвязанной парой электронов в соединении. Эти силы отталкивания приводят к информации изогнутой конструкции.