Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо. Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
- Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева. Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла. Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль.
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.
- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.
- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние. Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO 2; определите валентность F в соединении C2H2F2.
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи. Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо. Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
- Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева. Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла. Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль. Такие связи названы в честь голландского физика Яна Дидерика Ван-дер-Ваальса. Экспериментально было определено, что молекулы, в которых внешние оболочки всех атомов заполнены (молекулы азота N2, хлора Cl2, аммиака NH3 , атомы инертных газов — He, Ne и т.д) также связываются друг с другом и образуют слабые межмолекулярные связи. Вандерваальсово взаимодействие состоит из трёх слабых электромагнитных взаимодействий:
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.
- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.
- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние. Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO2; определите валентность F в соединении C2H2F2.
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи. Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
Видеоурок по химии «Валентные возможности атомов. Степень окисления»
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
- дать понятия «валентность», «валентные электроны»;
- научить определять валентность атома в основном состоянии;
- закрепить знания о возбужденном состоянии атома и научить определять его валентные возможности;
- закрепить знание понятия «степень окисления», научить определять С.О. в бинарных соединениях и более сложного состава;
- убедиться в существенном различии понятий «степень окисления» и «валентность атома»;
- дать представление об атомах-донорах и атомах-акцепторах.
Скачать видеоурок «Валентные возможности атомов. Степень окисления»
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического у
План урока по химии на тему «Валентность, валентные возможности атомов»



 11 класс.
11 класс.
Тема: «Валентность, валентные возможности атомов».
Цель урока: Повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Технологическая схема урока в логике ТРКМ:
Вызов (пробуждение интереса к изучаемой теме, актуализация знаний по теме и определение направления дальнейшего изучения или целеполагание) – Тонкие и толстые вопросы;
Осмысление (знакомство с новой информацией) – Фишбоун, вопрос Коломбо;
Рефлексия (введение новых знания в систему имеющихся сведений по теме, выработка отношение к ней) – Вопрос, направляющий ход мышления, рефлексивные вопросы.
I Стадия вызова.
Учитель задает учащимся вопросы: тонкие вопросы, требующие ответа на уровне воспроизведения, и толстый вопрос, ответ на который требует размышления (смотри таблицу 1).
Таблица №1. Тонкие и толстые вопросы.
Тонкие вопросы
Толстые вопросы
1. Что такое валентность?
2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Ответы учащиеся записывают в тетради:
1. валентность — способность атомов к присоединению определенного числа других атомов.
2. степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов (электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам).
3. Высшая валентность х.э. – это число электронов на внешнем энергетическом уровне.
4. Низшая валентность – это число свободных мест на атомной орбитали внешнего уровня.
Ответ на толстый вопрос учитель предлагает найти вместе.
Учащиеся выдвигают свои версии ответа на этот вопрос.
II Стадия осмысления
Учитель на доске изображает «рыбный скелет», учащиеся переносят его себе в тетради (схема 1). В «голове» рыбы записывается вопрос. На первых «косточках», ближайших к голове, записываются понятия, которые нужно сравнить, на вторых – определения этих понятий. Однако понятие валентности рассматривается уже на более высоком уровне, с точки зрения образования ковалентных связей. На следующих «косточках» учитель записывает примеры веществ N2 и NaCl, учащимся предлагается определить валентности и степень окисления элементов данных соединениях. Затем учащиеся делают вывод о том, в чем состоит отличие рассмотренных понятий. Этот вывод записывается в «хвосте» рыбы.
Затем учитель формулирует следующее положение: «Мы обсудили, что валентность атома определяется числом неспаренных электронов. Но тогда, мне бы хотелось знать, чему равна валентность азота в катионе аммония NH4+».
Учащиеся с помощью учителя, путем последовательных рассуждений, выводят решение этой проблемы:
Атом N образует три ковалентные связи с атомами водорода:
2p
2s
H 1s H 1s H 1s
Образуется молекула аммиака.
Для образования катиона аммония необходимо присоединить к данной молекуле катион водорода (протон).
N 2p
2s
H 1s H 1s H 1s
H+ 1s
Такой механизм образования связи называется донорно-акцепторным.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
Исходя из решения данной проблемы, учащиеся вместе с учителем делают вывод, что Валентные возможности атомов определяются не только числом неспаренных электронов, но и числом неподеленных электронных пар, способных переходить на свободные орбитали атомов другого элемента.
Высшим пределом валентности является такое значение, которое равно числу возможных орбиталей (квантовых ячеек) на внешнем уровне атома.
III Стадия Рефлексии
Учащимся предлагается на основании электронной конфигурации атома (и ее графического отображения) определить валентные возможности атома.
Электронная конфигурация S – 3s23p4
3p
3s
2 свободных электрона дают возможность сере образовывать 2 ковалентные связи по обменному механизму. Сера в данном случае проявляет валентность 2.
Химический элемент S расположен в третьем периоде, значит на внешнем энергетическом уровне его имеется 3 энергетических подуровня – s, p и d. Серу можно перевести в возбужденное состояние распарив электроны на 3p-подуровне.
*
3p 3d
3s 3p
3s
Теперь на внешнем энергетическом уровне находится 4 неспаренных электрона. Которые могут участвовать в образовании 4 ковалентных связей по обменному механизму. Валентность серы равна 4.
Аналогично можно распарить электроны, расположенные на 3s-подуровне.
* 3d ** 3d
3p 3p
3s 3s
6 неспаренных электронов на внешнем энергетическом уровне способны образовывать 6 ковалентных связей. Сера в таких соединениях проявляет валентность равную 6.
Таким образом, валентность серы в соединениях может быть равной 2, 4 и 6. В простых веществах валентность серы равно 0.
После этого учитель задает учащимся следующие вопросы:
Что показалась трудным на уроке? что осталось непонятым? что бы вы хотели обсудить подробнее? какое впечатление осталось от урока?
Использование приемов ТРКМ на данном уроке позволило заинтересовать учащихся, пробудить их творческую активность
Схема 1. Схема для приема «Фишбоун»

Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Урок Конспект Дополнительные материалыВалентность
Наберите на клавиатуре следующую фразу:
Валентные возможности химических элементов
Найдите в представленном филворде химические элементы, валентность которых может быть равна I.
ПодсказкаОбратите внимание на то, что в предложенном филворде спрятано пять химических элементов.
Валентные возможности атомов, электроотрицательность
Разгадайте кроссворд на тему: «Валентные возможности атомов, электроотрицательность».
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Электроотрицательность химических элементов
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Валентные возможности химических элементов
Выполните задание.
ПодсказкаПовторите конспект по теме: «Валентность и валентные возможности атомов».
Электроотрицательность и типы химических связей
Используя шкалу электроотрицательности, соотнесите соединение и тип его химической связи:
ПодсказкаПовторите конспект по теме: «Валентность и валентные возможности атомов».
Степень окисления атомов в химических соединениях
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Степени окисления химических элементов
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Валентные возможности химических элементов
Из предложенных вариантов выберите валентность, которая не характерна для марганца.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Формула вещества
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Определение валентности элемента в соединении
Определите валентность марганца в соединении MnO(OH)2.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Электроотрицательность соединения
Выполните задание.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Химические элементы
Расположите химические элементы с представленными электронными формулами по возрастанию их электроотрицательности.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
1s22s22p63s23p64s23d104p65s14d10
Неизвестное вещество
В данном соединении один из элементов имеет электронную конфигурацию 1s22s22p63s23p3. При определенном соотношении с кислородом это соединение самовоспламеняется. Получить его можно взаимодействием исходного элемента со щелочью и водой. Вещество очень ядовито. Определите тип химической связи в данном соединении.
ПодсказкаПовторите видеоурок по теме: «Валентность и валентные возможности атомов».
Вопрос № 3. Валентность. Различные трактовки понятия валентность в современной химии. Валентные возможности атомов с позиции МВС. Постоянная и переменная валентность
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать опре-
деленное число атомов другого элемента. Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей. В представлении метода валентных связей численное значение валентности соответствует числу ковалентных связей, которые образует атом. Образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта — пару элект-ронов): Н∙ + ∙Н =Н:Н или Н∙ + ∙Н = Н – Н
Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, в образовании ковалентных связей могут принимать участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода:
В ряде случаев число непарных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом углерода в основном состоянии имеет два непарных электрона (2s22p2), а при возбуждении одного из 2s-электронов в 2p-состояние возникают четыре непарных электрона:
Вследствие этого атом углерода может соединяться, например, с четырьмя атомами фтора (2s22p5), имеющими по одному непарному электрону:
Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяемой при образовании связей.
Валентные возможности элементов. Имея в виду оба описанные выше механизма образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы 2-го периода, и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2р-.
Поскольку у бора и углерода имеются энергетически близкие свободные 2p-орбитали, при возбуждении эти элементы могут приобрести новые электронные конфигурации. В соответствии с числом непарных электронов атомыВ, С и Nмогут образовать соответственно три, четыре и три ковалентные связи, например с атомами водорода:
Атом бора имеет свободную орбиталь, поэтому в молекуле ВН3 дефицит электронов. В молекуле же Н3N при атоме азота имеется неподеленная (несвязывающая) электронная пара. Таким образом,молекула ВН3 может выступать как акцептор, а молекула Н3N, наоборот,— как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму.
Простейший донор электронной пары—гидрид-ион Н—. Присоединение отрицательного гидрид-иона к молекуле ВН3 приводит к образованию сложного (комплексного) иона ВН4— с отрицательным зарядом:
Простейший акцептор электронной пары — протон Н—; его присоединение к молекуле Н3N тоже приводит к образованию комплексного иона NH4+, но уже с положительным зарядом:
Из сопоставления структурных формул молекулы СН4 и комплексных ионов ВН4— и H3N4+ видно, что атомы бора, углерода и азота в этих соединениях четырехвалентны. Следует отметить, что в ионах ВН4— и H3N4+ все четыре связи равноценны и неразличимы, следовательно, в ионах заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей.
 Многие элементы в своих соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (таблица). Водород, натрий и калий во всех соединениях одновалентны, кислород, кальций и магний проявляют постоянную валентность равную двум (П). Медь, железо и некоторые другие элементы могут менять свою валентность. Их называют элементами с переменной валентностью. Она зависит от природы и условий взаимодействия элементов в соединении. Например, при сгорании угля на воздухе образуется диоксид углерода (СО2), а при недостаточном поступлении воздуха — монооксид углерода (СО). В первом соединении углерод четырехвалентен, а во втором — двухвалентен.
Многие элементы в своих соединениях проявляют постоянную валентность. Но есть элементы, обладающие переменной валентностью (таблица). Водород, натрий и калий во всех соединениях одновалентны, кислород, кальций и магний проявляют постоянную валентность равную двум (П). Медь, железо и некоторые другие элементы могут менять свою валентность. Их называют элементами с переменной валентностью. Она зависит от природы и условий взаимодействия элементов в соединении. Например, при сгорании угля на воздухе образуется диоксид углерода (СО2), а при недостаточном поступлении воздуха — монооксид углерода (СО). В первом соединении углерод четырехвалентен, а во втором — двухвалентен.
«Валентность и валентные возможности атомов химических элементов» (9 класс)
Тест на тему: «Валентность и валентные возможности атомов химических элементов»
(9класс)
1. Какова электронная конфигурация атома углерода в возбужденном состоянии и чему равна его валентность:
а) [He] 2s2 2p2 б) [He] 2s1 2p3 в) 1s22s12p3 г) 1s22s22p2
2. Какова электронная конфигурация атома хлора в VII –валентном состоянии:
а) [Ne] 3s1 3p33d3 б) [Ne] 3s2 3p5 в) 1s22s22p63s23p5 г) 1s22s22p63s13p33d3
3. Валентные возможности атома серы:
а) II, IV б) IV, VI в) II, IV, VI
4. Какую валентность проявляет фосфор в ортофосфорной кислоте и какова электронная конфигурация атома:
а) III и 1s22s22p63s23p3 б) V и [Ne] 3s1 3p3 3d1
в) V и 1s22s22p63s13p33d1 г) III и [Ne] 3s2 3p3
5. Валентные возможности атома брома:
а) I, III б) III, V в) I, III, V г) I, III, V, VII
6. Какую валентность проявляет сера в оксиде серы (IV) и какова электронная конфигурация атома:
а) 1s22s22p63s23p4 б) 1s22s22p63s23p33d1 в) [Ne] 3s2 3p33d1 г) [Ne] 3s2 3p4
7. Электронную конфигурацию [Ne] 3s2 3p33d2 имеет:
а) атом хлора в VI- валентном состоянии;
б) атом хлора в возбужденном состоянии;
в) атом хлора в III — валентном состоянии;
г) атом хлора в V- валентном состоянии.
8. Какую валентность проявляет железо в железной окалине и какова электронная конфигурация атома:
а) 1s22s22p63s23p63d64s2 б) [Ar] 4s2 3d6 в) [Ar] 4s1 3d6 4p1 г) 1s22s22p63s23p64s13d54p2
Валентных электронов — Характеристики и определение валентных электронов
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma класса 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 11
- Образцы документов CBSE чел для класса 12
- Классы
- CBSE Контрольный документ за предыдущий год
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- , класс
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к редакции класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке класса 9 CBSE
Дополнительные вопросы по математике для класса 10
- CBSE Class
- Дополнительные вопросы по науке, класс 10 по CBSE
- , класс 3
- , класс 4
- , класс 5
- , класс 6
- , класс 7
- , класс 8
- , класс 9 Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия Решения для биологии класса 11
- Решения NCERT для математики класса 11 9 0003 NCERT Solutions Class 11 Accountancy
- NCERT Solutions For Класс 12 по физике
- Решения NCERT для химии класса 12
- Решения NCERT для класса 12 по биологии
- Решения NCERT для класса 12 по математике
- Решения NCERT Класс 12 Бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- Решения NCERT, класс 12 Экономика
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для социальных наук класса 6
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7 Математика
- Решения NCERT для класса 7 Наука
- Решения NCERT для класса 7 по социальным наукам
- Решения NCERT для класса 7 Английский
- Решения NCERT для класса 8 Математика
- Решения NCERT для класса 8 Science
- Решения NCERT для социальных наук 8 класса
- Решение NCERT ns для класса 8 Английский
- Решения NCERT для социальных наук класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для Математика класса 9 Глава 2
- Решения NCERT для математики класса 9 Глава 3
- Решения NCERT для математики класса 9 Глава 4 Решения NCERT
- для математики класса 9 Глава 5
- Решения NCERT для математики класса 9 Глава 6
- Решения NCERT для Математика класса 9 Глава 7
- Решения NCERT для математики класса 9 Глава 8 Решения NCERT
- для математики класса 9 Глава 9 Решения NCERT
- для математики класса 9 Глава 10
- Решения NCERT для математики класса 9 Глава 11
- Решения NCERT для Математика класса 9 Глава 12
- Решения NCERT для математики класса 9 Глава 13 Решения
- NCERT для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для класса 9 Наука Глава 3
- Решения NCERT для Науки Класса 9 Глава 4
- Решения NCERT для Науки Класса 9 Глава 5
- Решения NCERT для Науки Класса 9 Глава 6
- Решения NCERT для Науки Класса 9 Глава 7
- Решения NCERT для Класса 9 Наука Глава 8
- Решения NCERT для Науки Класса 9 Глава 9
- Решения NCERT для Науки Класса 9 Глава 10
- Решения NCERT для Науки Класса 9 Глава 12
- Решения NCERT для Науки Класса 9 Глава 11
- Решения NCERT для Класса 9 Наука Глава 13
- Решения NCERT для класса 9 Наука Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10 Глава 2
- Решения NCERT для математики класса 10 Глава 3
- Решения NCERT для математики класса 10 Глава 4
- Решения NCERT для математики класса 10 Глава 5
- Решения NCERT для математики класса 10 Глава 6
- Решения NCERT для математики класса 10 Глава 7 Решения NCERT
- для математики класса 10 Глава 8
- Решения NCERT для математики класса 10 Глава 9 Решения NCERT
- для математики класса 10 Глава 10 Решения NCERT
- для математики класса 10 Глава 11
- Решения NCERT для класса 10 по математике Глава 12
1.3: Валентные электроны и открытые валентности
Валентный электрон — это электрон, который связан с атомом и может участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон, чтобы образовать общую пару. Наличие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.6 \)) химически инертен. Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, обладает высокой реакционной способностью, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов
Количество валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
Периодическая таблица химических элементов
| Группа периодической таблицы | Валентные электроны |
|---|---|
| Группа 1 (I) (щелочные металлы) | 1 |
| Группа 2 (II) (щелочноземельные металлы) | 2 |
| Группы 3-12 (переходные металлы) | 2 * (Оболочка 4s завершена и больше не может удерживать электроны) |
| Группа 13 (III) (группа бора) | 3 |
| Группа 14 (IV) (углеродная группа) | 4 |
| Группа 15 (V) (пниктогены) | 5 |
| Группа 16 (VI) (халькогены) | 6 |
| Группа 17 (VII) (галогены) | 7 |
| Группа 18 (VIII или 0) (благородные газы) | 8 ** |
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов.Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Концепция открытой валентности («валентность»)
Валентность (или валентность ) элемента является мерой его объединяющей способности с другими атомами, когда он образует химические соединения или молекулы. Концепция валентности была разработана во второй половине XIX века и успешно объяснила молекулярную структуру многих органических соединений.Поиски основных причин валентности привели к современным теориям химической связи, включая структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания пар электронов валентных оболочек (1958) и все продвинутые методы квантовой химии.
Объединяющая способность или сродство атома элемента определялась числом атомов водорода, с которыми он соединялся. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность два; а в хлористом водороде хлор имеет валентность 1.Хлор, поскольку он имеет валентность, равную единице, может замещать водород, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют связь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Валентность описывает только связность, она не описывает геометрию молекулярных соединений или то, что сейчас известно как ионные соединения или гигантские ковалентные структуры.Линия между атомами не представляет собой пару электронов, как на диаграммах Льюиса.
.Сколько валентных электронов в атоме хлора?
Наука
- Анатомия и физиология
- Астрономия
- Астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
- Органическая химия
- Физика
Математика
.Валентная зона — Energy Education
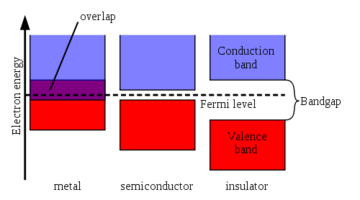 Рис. 1. [1] Диаграмма, показывающая валентную зону и зону проводимости изоляторов, металлов и полупроводников. Уровень Ферми — это название, данное электронной орбитали с наивысшей энергией при абсолютном нуле. [2]
Рис. 1. [1] Диаграмма, показывающая валентную зону и зону проводимости изоляторов, металлов и полупроводников. Уровень Ферми — это название, данное электронной орбитали с наивысшей энергией при абсолютном нуле. [2] Валентная зона — это зона электронных орбиталей, из которых электроны могут выпрыгивать, перемещаясь в зону проводимости при возбуждении. Валентная зона — это просто самая удаленная электронная орбиталь атома любого конкретного материала, которую электроны фактически занимают.Это тесно связано с идеей валентного электрона.
Разница в энергии между самым высоким занятым энергетическим состоянием валентной зоны и самым низким незанятым состоянием зоны проводимости называется запрещенной зоной и указывает на электрическую проводимость материала. [3] Большая запрещенная зона означает, что для возбуждения валентных электронов в зону проводимости требуется много энергии. И наоборот, когда валентная зона и зона проводимости перекрываются, как в металлах, электроны могут легко перепрыгивать между двумя зонами (см. Рисунок 1), что означает, что материал обладает высокой проводимостью. [4]
Разницу между проводниками, изоляторами и полупроводниками можно показать по величине их запрещенной зоны. [5] Изоляторы характеризуются большой шириной запрещенной зоны, поэтому для выведения электронов из валентной зоны и образования тока требуется недопустимо большое количество энергии. [6] Проводники имеют перекрытие между зоной проводимости и валентной зоной, поэтому валентные электроны в таких проводниках по существу свободны. [4] Полупроводники, с другой стороны, имеют небольшую запрещенную зону, которая позволяет значительной части валентных электронов материала перемещаться в зону проводимости с учетом определенного количества энергии.Это свойство дает им проводимость между проводниками и изоляторами, что является одной из причин, почему они идеально подходят для электрических цепей, поскольку не вызывают короткого замыкания, как проводник. [2] Эта запрещенная зона также позволяет полупроводникам преобразовывать свет в электричество в фотоэлектрических элементах и излучать свет в виде светодиодов, когда они превращены в диоды определенных типов. Оба эти процесса зависят от энергии, поглощаемой или выделяемой электронами, движущимися между зоной проводимости и валентной зоной.